Психологические особенности в пожилом и старческом возрасте
Психологические особенности в пожилом и старческом возрасте
Проблема старения и старости является объектом особой междисциплинарной отрасли знания – геронтологии. В центре внимания геронтологии находятся биологические, психологические и социологические аспекты старения.
Биологический подход к старению ориентирован прежде всего на обнаружение телесных причин и проявлений старения. Биологи рассматривают старение как закономерный процесс, протекающий в течение постнатальной жизни организма и сопровождающийся столь же закономерными изменениями на биохимическом, клеточном, тканевом, физиологическом и системных уровнях (В.В. Фролъкис, 1988; Е.Н. Хрисанфова, 1999).
В зарубежной геронтологии широкое распространение получили четыре основополагающих критерия старения, которые в 60-е годы XX в. были предложены известным геронтологом Б. Стрехлером:
старение, в отличие от болезни, представляет собой универсальный процесс, ему подвержены все без исключения члены популяции;
старение является прогрессирующим непрерывным процессом;
старение есть свойство любого живого организма;
старение сопровождается дегенеративными изменениями (в противовес изменениям организма при его развитии и взрослении).
Таким образом, старение человека представляет собой базовый универсальный биологический процесс, который, однако, реализуется в конкретных социокультурных условиях. Поэтому геронтология рассматривает старение как комплексное явление, включающее личностные, социальные и даже экономические аспекты жизни человека. Об этом свидетельствует также тот факт, что такие показатели, как продолжительность жизни и схемы периодизации, отмечающие начало старения и длительность его протекания, подвержены заметным изменениям.
Рекомендуемые файлы
К числу наиболее значимых, глобальных явлений, наблюдавшихся в XX веке, относится радикальное (почти в два раза) увеличение продолжительности жизни. С этим связано изменение взглядов на периодизацию старения.
В начале века немецкий физиолог М. Рубнер предложил возрастную классификацию, в которой начало старости устанавливалось в 50 лет, а почтенная старость начиналась с 70 лет. В 1905 г. известный американский медик В.Аслер утверждал, что 60 лет надо считать предельным возрастом, после чего старики становятся в тягость себе и обществу. В 1963 г. на Международном семинаре ВОЗ по проблемам геронтологии была принята классификация, выделяющая три хронологических периода в позднем онтогенезе человека: средний возраст (45-59 лет), пожилой возраст (60-74 года), старческий возраст (75 лет и старше). В отдельную категорию были выделены так называемые долгожители (90 лет и старше). В соответствии с последними данными, возраст 60-69 лет определяется как предстарческий, 70-79 лет – как старческий, 80-89 лет – как позднестарческий, 90-99 лет — как дряхлость (Крайг, 2000).
В 1963 г. на Международном семинаре ВОЗ по проблемам геронтологии была принята классификация, выделяющая три хронологических периода в позднем онтогенезе человека: средний возраст (45-59 лет), пожилой возраст (60-74 года), старческий возраст (75 лет и старше). В отдельную категорию были выделены так называемые долгожители (90 лет и старше). В соответствии с последними данными, возраст 60-69 лет определяется как предстарческий, 70-79 лет – как старческий, 80-89 лет – как позднестарческий, 90-99 лет — как дряхлость (Крайг, 2000).
Следует, однако, иметь в виду, что любая схема выделения и классификации инволюционного, или регрессивного, возраста достаточно условна, поскольку физиологи еще не располагают данными для исчерпывающей характеристики каждой из перечисленных выше стадий онтогенеза. Принято считать, что регрессивные изменения биохимических, морфологических и физиологических показателей статистически коррелируют с увеличением хронологического возраста. Наряду с этим, как и в детстве, при оценке старения необходимо различать понятия биологического и календарного/ хронологического возрастов. Однако оценка биологического возраста при старении является одной из дискуссионных проблем возрастной физиологии.
Однако оценка биологического возраста при старении является одной из дискуссионных проблем возрастной физиологии.
Определение биологического возраста требует точки отсчета, отталкиваясь от которой, можно количественно и качественно охарактеризовать психосоматический статус человека. В детстве биологический возраст определяют с помощью понятия статистической нормы, где точкой отсчета служат средние групповые или популяционные данные, характеризующие уровень развития структуры или функции в данной выборке в текущий момент времени. Подобный подход к оценке биологического возраста при старении весьма затруднителен, поскольку оно часто осложнено разнообразными заболеваниями и нет четкого представления о том, как должно протекать естественное старение, не осложненное болезнями.
Тем не менее, как указывал известный физиолог И.А. Аршавский, по биохимическим и физиологическим параметрам можно определить среднее значение максимальной степени неравновесности (потенциальной лабильности различных систем организма), характерное для физиологически здоровых людей в стационарном (взрослом) состоянии, и таким способом приобрести точку отсчета (И.
Проблема, однако, состоит в том, что при старении, как и в детстве, действует принцип гетерохронности. Он проявляется в том, что у человека не все органы и системы стареют одновременно и с одинаковой скоростью. Для большинства из них процессы старения начинаются задолго до наступления старости. Многие эффекты старения не обнаруживают себя до поздней взрослости не только потому, что процессы старения развиваются постепенно, но и потому, что наряду с процессами старения в организме параллельно протекают компенсаторные процессы витаукта
Кроме того, нельзя упускать из виду тот факт, что хотя старение – процесс закономерный и нормативный, оно имеет большой спектр индивидуальных различий. На этой стадии онтогенеза различия между календарным и биологическим возрастами могут быть выражены сильнее, чем в детстве. Индивидуальные особенности старения человека обусловливают существование различных вариантов старения. Клинико-физиологические показатели позволяют выделить несколько синдромов старости: гемодинамический (изменения в сердечно-сосудистой системе), нейрогенный (изменения в нервной системе), респираторный (изменения в дыхательной системе).
На этой стадии онтогенеза различия между календарным и биологическим возрастами могут быть выражены сильнее, чем в детстве. Индивидуальные особенности старения человека обусловливают существование различных вариантов старения. Клинико-физиологические показатели позволяют выделить несколько синдромов старости: гемодинамический (изменения в сердечно-сосудистой системе), нейрогенный (изменения в нервной системе), респираторный (изменения в дыхательной системе).
По темпам старения выделяют ускоренное, преждевременное (акселерированное) старение и замедленное, ретардированное, старение. Описано крайнее выражение ускоренного старения – прогерия, когда признаки старения проявляются даже у детей. Замедленное старение свойственно долгожителям (В.В. Фролъкис, 1988).
Старение организма в целом связывается прежде всего с нарушениями механизмов саморегуляции и процессов переработки информации на разных уровнях жизнедеятельности. Особое значение в механизмах старения на клеточном уровне имеет нарушение передачи информации в системе генетического аппарата клеток, на уровне целостного организма – в системе нейрогуморальной регуляции. Вследствие этого старение представляет собой тотальный процесс, охватывающий весь организм человека, и его проявления можно обнаружить во всех органах, системах и функциях.
Вследствие этого старение представляет собой тотальный процесс, охватывающий весь организм человека, и его проявления можно обнаружить во всех органах, системах и функциях.
Внешние телесные изменения при старении хорошо известны (седина, морщины и др.). Кроме того, изменения в структуре скелета приводят к уменьшению роста, который может снизиться на 3-5 см в связи со сжатием межпозвоночных дисков. Возникает остеопороз (деминерализация костей, выражающаяся в утрате ими кальция), в результате кости становятся хрупкими. Уменьшается мышечная масса, вследствие чего снижаются сила и выносливость. Кровеносные сосуды теряют эластичность, некоторые из них закупориваются, из-за этого ухудшается кровоснабжение организма со всеми вытекающими отсюда последствиями. Эффективность работы сердечно-сосудистой системы в целом снижается, ослабевает способность легких к осуществлению газообмена. В иммунной системе снижается выработка антител, и защитные силы организма ослабевают. В то же время регулярные физические упражнения, способствующие укреплению мышц, в пожилом возрасте улучшают соматический статус организма.
Систематическое изучение возрастной эволюции и инволюции сенсорно-перцептивных функций человека проводилось в 60-е годы в школе Б.Г.Ананьева. В этих исследованиях было установлено, что онтогенетические изменения сенсорной (для зрения, слуха) и пропреоцептивной чувствительности имеют общий характер. Чувствительность возрастает к периоду ранней юности, затем стабилизируется и, начиная с 50-60 лет, снижается. На фоне этой общей тенденции, однако, наблюдаются некоторые возрастные спады и подъемы. Другими словами, и на стадии позитивного развития, и в ходе инволюции изменение чувствительности осуществляется в соответствии с принципом гетерохронности.
Показательна в этом плане возрастная динамика цветочувствительности. За исключением общего оптимума, который наблюдается приблизительно в 30 лет, т. е. значительно позднее по сравнению с общей светочувствительностью и остротой зрения, все частные виды чувствительности к различным длинам волн изменяются по-разному. Начиная с 30 лет происходит значительное и неуклонное снижение чувствительности к крайним длинноволновым и коротковолновым цветам — красному и синему. В то же время чувствительность к желтому цвету не снижается даже после 50 лет. В отношении слуховой чувствительности установлено, что ее возрастающее снижение распространяется на высокочастотную часть звукового диапазона и начинается с 30 лет. Если в качестве эталона использовать пороги слышимости двадцатилетних, то оказывается, что потери чувствительности возрастают в следующем порядке: в 30 лет – на 10 дБ, в 40 лет – на 20 дБ, в 50 лет – на 30 дБ. Сходные тенденции наблюдаются и в других видах сенсорных модальностей.
В то же время чувствительность к желтому цвету не снижается даже после 50 лет. В отношении слуховой чувствительности установлено, что ее возрастающее снижение распространяется на высокочастотную часть звукового диапазона и начинается с 30 лет. Если в качестве эталона использовать пороги слышимости двадцатилетних, то оказывается, что потери чувствительности возрастают в следующем порядке: в 30 лет – на 10 дБ, в 40 лет – на 20 дБ, в 50 лет – на 30 дБ. Сходные тенденции наблюдаются и в других видах сенсорных модальностей.
Однако, как подчеркивал Ананьев, в случаях, когда профессия предъявляет повышенные требования к органам чувств (например, требования к зрительным функциям у летчиков), их функционирование даже в зрелом возрасте остается на высоком уровне. Любая сенсорная функция проявляет свой действительный потенциал лишь в том случае, если находится систематически в состоянии полезного для нее оптимального напряжения.
Возрастные изменения с неизбежностью затрагивают и мозг человека.
Прежде всего, возрастные изменения головного мозга человека характеризуются уменьшением его массы и объема. Масса мозга человека в возрасте от 60 до 75 лет снижется на 6%, причем неравномерно в различных отделах. Кора больших полушарий уменьшается на 4%, наибольшие изменения (на 12-15%) происходят в лобной доле. Отмечены половые различия степени атрофии мозга при старении. Масса головного мозга женщин примерно на 110-115 г меньше, чем у мужчин. Между 40 и 90 годами масса мозга уменьшается у мужчин на 2,85 г в год, а у женщин на 2,92 г (В. В. Фролькис, 1988).
Масса головного мозга женщин примерно на 110-115 г меньше, чем у мужчин. Между 40 и 90 годами масса мозга уменьшается у мужчин на 2,85 г в год, а у женщин на 2,92 г (В. В. Фролькис, 1988).
Большинство исследователей мозга человека указывают на преимущественную потерю нейронов в коре, гиппокампе и мозжечке. В большинстве подкорковых образований клеточный состав остается неизменным до глубокой старости. Иными словами, филогенетически более «новые» структуры мозга, связанные с познавательной функцией, в большей степени подвержены возрастной потере нейронов, чем филогенетически «старые» (ствол мозга).
Синаптические контакты, как известно, играют решающую роль в обеспечении межнейронного взаимодействия в нервных сетях, в силу своей пластичности они тесно связаны с памятью и научением. При старении уменьшается плотность числа синапсов. Однако утрата синапсов происходит не во всех отделах ЦНС в равной степени. Так, в лобной доле человека достоверно доказано уменьшение количества синапсов с возрастом, в то время как в височной доле возрастные изменения не наблюдаются.
Изменения в состоянии синапсов наблюдаются не только в коре, но и в подкорковых структурах. Например, возрастные нарушения пространственной памяти объясняются снижением специфичности, эффективности и пластичности синаптической передачи в гиппокампе. При старении уменьшается способность формирования новых синапсов. Редукция синаптической пластичности в старости может способствовать потере памяти, ухудшению двигательной активности и развитию других функциональных нарушений мозга. При этом ухудшаются межнейронные контакты в различных областях ЦНС, нейроны как бы подвергаются «деафферентации», в связи с чем нарушается их ответная реакция на сигналы внешней среды, нервные и гормональные стимулы, т.е. повреждаются синаптические механизмы деятельности мозга.
При старении существенно изменяется состояние медиаторных систем организма. Одним из наиболее характерных феноменов старения является дегенерация дофаминэргической системы мозга, последнее непосредственно связано с развитием в старческом возрасте таких заболеваний, как паркинсонизм. Нарушения в деятельности еще одной медиаторной системы мозга – холинэргической — играют одну из основных ролей в расстройствах памяти, восприятия и других познавательных процессов, возникающих при болезни Альцгеймера.
Нарушения в деятельности еще одной медиаторной системы мозга – холинэргической — играют одну из основных ролей в расстройствах памяти, восприятия и других познавательных процессов, возникающих при болезни Альцгеймера.
Особый интерес представляет проблема межполушарного взаимодействия при старении. Главная особенность церебральной асимметрии стареющего мозга состоит в том, что нарушается устойчивая совместная деятельность полушарий. Существуют некоторые разногласия в оценках темпов старения левого и правого полушарий. По одной из точек зрения, правое полушарие стареет раньше левого, по другой – процесс старения обоих полушарий характеризуется высокой синхронностью.
Н.К. Корсакова, обсуждая нейропсихологические аспекты старения мозга, обратилась к концепции Лурии о функциональных блоках мозга. По ее данным, нормальное физиологическое старение характеризуется на всех этапах позднего возраста в первую очередь изменениями в работе блока регуляции тонуса и бодрствования: в нем происходит сдвиг в сторону преобладания тормозных процессов. В связи с этим возникают такие характерные феномены, как общая замедленность при выполнении различных действий, сужение объема психической активности при одновременной реализации различных программ. Наряду с этим сохранность ранее закрепленных форм активности, связанных с функционированием блока переработки информации, создает благоприятные предпосылки для успешной реализации сложившихся стереотипов деятельности.
В связи с этим возникают такие характерные феномены, как общая замедленность при выполнении различных действий, сужение объема психической активности при одновременной реализации различных программ. Наряду с этим сохранность ранее закрепленных форм активности, связанных с функционированием блока переработки информации, создает благоприятные предпосылки для успешной реализации сложившихся стереотипов деятельности.
Теперь перейдем к обсуждению теории старения. Основной вопрос, который, так или иначе, ставится во всех существующих теориях старения, сводится к следующему: является ли этот процесс генетически запрограммированным и закономерно обусловленным эволюцией человека как вида или он представляет собой аналог механического износа технического устройства, заключающийся в постепенном накоплении мелких нарушений, которые приводят в конечном счете к «поломке» организма. Соответственно существующие теории старения подразделяются на две группы — теории программированного старения и теории изнашиваемости организма (так называемые стохастические теории).
Теории программированного старения исходят из того, что эволюция запрограммировала функционирование живого организма на период его активной жизнедеятельности, включающий период репродукции. Иначе говоря, в живой организм генетически заложена биологическая активность, распространяющаяся только на период его так называемой «биологической полезности». Быстрая деградация и гибель стареющего организма предопределены природой.
Применительно к человеку этот подход связан с распространенными в начале XX в. представлениями о том, что в каждый период жизни организма доминирует определенная эндокринная железа: в молодости — тимус, при половом созревании – эпифиз, в зрелости –половые железы, в старости – кора надпочечников. Старение рассматривается как результат смены деятельности различных желез и определенного их соотношения. Причины смены доминирования теория не объясняет.
Близка по смыслу к этому и теория «встроенных часов». Эта теория предполагает, что существует единый пейсмейкер («водитель ритма»), находящийся, возможно, в гипоталамусе и в гипофизе головного мозга. Он включается в результате того, что вскоре после наступления полового созревания гипофиз начинает выделять гормон, вызывающий начало процесса старения, который в дальнейшем будет протекать с определенной скоростью. Наличие «встроенных часов» подтверждается, в частности, существованием для каждого организма строго генетически обусловленной программы клеточного деления в онтогенезе. Возможно, что биологические часы также управляют иммунной системой человека, которая до 20 лет набирает силу, а затем постепенно ослабевает.
Он включается в результате того, что вскоре после наступления полового созревания гипофиз начинает выделять гормон, вызывающий начало процесса старения, который в дальнейшем будет протекать с определенной скоростью. Наличие «встроенных часов» подтверждается, в частности, существованием для каждого организма строго генетически обусловленной программы клеточного деления в онтогенезе. Возможно, что биологические часы также управляют иммунной системой человека, которая до 20 лет набирает силу, а затем постепенно ослабевает.
Наряду с этим существует теория, в соответствии с которой старение определяется запрограммированными действиями специфических генов. Другими словами, старение – это генетически запрограммированный процесс, результат закономерного, последовательного развертывания программы, заложенной в генетическом аппарате. Предполагается, в частности, что средняя продолжительность жизни определяется специфическими генами, которые содержатся в каждой клетке тела. Экспрессия этих генов происходит в заранее заданный момент времени, когда должна наступить смерть организма.
В соответствии со стохастическими теориями старение – это просто снижение способности клеток к самовосстановлению. Человеческий организм сравнивается с механизмом, изнашивающимся от постоянного использования. Причем к этому износу добавляется накапливание клеточных дисфункций и повреждений. Последнее приводит к тому, что состарившиеся клетки хуже избавляются от продуктов метаболизма, а это препятствует нормальному протеканию внутриклеточных процессов, нарушая и/или замедляя их.
Предполагается также, что старение вызывается существованием в организме остатков метаболизма кислорода, который необходим для жизнедеятельности каждой клетки. Это так называемые «свободные радикалы» – высокоактивные химические агенты, готовые вступить в химическую реакцию с другими внутриклеточными химическими соединениями и нарушить этим нормальное функционирование клетки. Обычно у клетки существуют восстановительные механизмы, уменьшающие ущерб, причиненный свободными радикалами. Однако после серьезного повреждения организма, например, в результате воздействия радиации или тяжелых заболеваний, вред, наносимый свободными радикалами, достаточно серьезен.
Хорошо известно также, что при старении снижается эффективность работы иммунной системы, следствием чего оказывается худшая сопротивляемость болезням. Более того, при ряде болезней, например таких, как ревматоидный артрит или некоторые заболевания почек, иммунные клетки нападают на здоровые клетки собственного организма.
Стохастические теории не могут, однако, объяснить ряд положений. Например, они не отвечают на вопрос, почему внутренняя «ремонтная мастерская» организма, какое-то время прекрасно справлявшаяся с устранением неполадок в нем, вдруг перестает работать.
Механизмом, определяющим устойчивость и продолжительность существования живой системы, является витаукт. Разрабатывая проблему старения, известный отечественный ученый В.В. Фролъкис выдвинул ряд положений:
изучение механизмов старения возможно только с позиций системного подхода;
старение является обязательным звеном возрастного развития, во многом определяющим его течение; именно поэтому понимание сущности старения возможно в рамках теоретической гипотезы, объясняющей механизмы возрастного развития;
при старении наряду с угасанием активности функций жизнеобеспечения и обмена веществ мобилизуются важные приспособительные механизмы – механизмы витаукта;
старение – результат нарушения механизмов саморегуляции на разных уровнях жизнедеятельности организма.
Развитие этих положений привело к выдвижению адаптационно-регуляторной теории возрастного развития.
Теорию В.В. Фролькиса можно рассматривать как промежуточную между генетическими и стохастическими теориями старения. Базируясь на понятии саморегуляции, эта теория объясняет механизмы возрастных изменений как процесс адаптационных, приспособительных возможностей организма. Этот процесс направлен на стабилизацию жизнеспособности организма, повышение надежности его функционирования, увеличение долгосрочности его существования.
В соответствии с адаптационно-регуляторной теорией старение генетически не запрограммировано, но генетически детерминировано, предопределено особенностями биологической организации жизнедеятельности, свойствами организма. Иными словами, генетически запрограммированы многие свойства организма, и уже от них зависит темп старения, продолжительность жизни.
Витаукт, подчеркивает Фролькис, – это не просто восстановление повреждений, возникших в процессе старения, не просто антистарение. Скорее, во многом старение является антивитауктом, разрушающим, расшатывающим механизмы исходной жизнеспособности организма. Не только в историческом, но и в индивидуальном развитии, не только в филогенезе, но и в онтогенезе, на самых ранних этапах становления организма, начиная с зиготы, возникает разрушительный процесс – старение. Это неизбежное повреждение ДНК, распад белков, нарушение мембран, гибель части клеток, действие свободных радикалов, токсических веществ, кислородного голодания и др. И если на этом этапе благодаря механизмам саморегуляции надежен процесс витаукта, вся система развивается, совершенствуется, растут ее адаптационные возможности.
Скорее, во многом старение является антивитауктом, разрушающим, расшатывающим механизмы исходной жизнеспособности организма. Не только в историческом, но и в индивидуальном развитии, не только в филогенезе, но и в онтогенезе, на самых ранних этапах становления организма, начиная с зиготы, возникает разрушительный процесс – старение. Это неизбежное повреждение ДНК, распад белков, нарушение мембран, гибель части клеток, действие свободных радикалов, токсических веществ, кислородного голодания и др. И если на этом этапе благодаря механизмам саморегуляции надежен процесс витаукта, вся система развивается, совершенствуется, растут ее адаптационные возможности.
До какого-то времени деструктивные процессы в ряде клеточных структур благодаря механизмам витаукта еще не приводят к старению организма в целом. В конечном итоге в определенном возрасте (прекращение роста, завершение онтогенеза) начинает прогрессировать процесс старения организма в целом со всеми вытекающими из этого последствиями. Итак, продолжительность жизни определяется единством и противоположностью двух процессов — старения и витаукта. Как подчеркивает Фролькис, геронтология будущего будет все больше внимания уделять изучению механизмов витаукта.
Итак, продолжительность жизни определяется единством и противоположностью двух процессов — старения и витаукта. Как подчеркивает Фролькис, геронтология будущего будет все больше внимания уделять изучению механизмов витаукта.
Явление витаукта создает благоприятные условия для полноценного функционирования психики людей пожилого возраста. Как отмечают некоторые исследователи, так называемый возраст инволюции вовсе не характеризуется линейным нарастанием аномальных процессов в психике. По данным Н.К. Корсаковой, в возрастном диапазоне от 50 до 85 лет наиболее выраженные нарушения нейродинамики характерны для начального и старшего этапа старения, после 80 лет. В возрасте от 65 до 75 лет не только наблюдается стабилизация высших психических функций, но, по ряду параметров, в частности по функции памяти, лица этого возраста демонстрируют достижения на уровне еще не старого человека.
Н.К. Корсакова вообще подчеркивает значение позитивных тенденций в психическом функционировании пожилого человека. Учитывая разнообразие способов преодоления нарушений в работе высших психических функций при нормальном старении, можно сказать, что оно представляет собой этап индивидуального развития, требующий смены стратегий и использования относительно новых форм опосредствования психической деятельности. Если рассматривать онтогенез как проявление новообразований в психике и поведении, отсутствовавших на предшествовавших этапах развития, то о старости можно говорить как об одном из этапов онтогенеза. Эмпирические данные показывают, что в старости интеллект в большей степени направляется на саморегуляцию психической активности, чем на познание мира.
Учитывая разнообразие способов преодоления нарушений в работе высших психических функций при нормальном старении, можно сказать, что оно представляет собой этап индивидуального развития, требующий смены стратегий и использования относительно новых форм опосредствования психической деятельности. Если рассматривать онтогенез как проявление новообразований в психике и поведении, отсутствовавших на предшествовавших этапах развития, то о старости можно говорить как об одном из этапов онтогенеза. Эмпирические данные показывают, что в старости интеллект в большей степени направляется на саморегуляцию психической активности, чем на познание мира.
Это соответствует современному взгляду на старение не только в отрицательном аспекте — как на угасание, но и в позитивном смысле – как на возможность формирования у человека способов сохранения себя как индивида и личности в общем континууме собственного жизненного пространства.
Старость – один из самых парадоксальных и противоречивых периодов жизни, связанный с тем, что «последние вопросы бытия» (М. М. Бахтин) встают перед человеком во весь рост, требуя разрешения неразрешимого – совместить возможности старого человека в понимании мира и его жизненный опыт с физической немощью и невозможностью активно воплотить в жизнь все понимаемое.
М. Бахтин) встают перед человеком во весь рост, требуя разрешения неразрешимого – совместить возможности старого человека в понимании мира и его жизненный опыт с физической немощью и невозможностью активно воплотить в жизнь все понимаемое.
Но в противовес пессимизму обыденных представлений о старости психологи говорят о таких своеобразных новообразованиях старческого возраста, как:
чувство принадлежности к группе или группам;
чувство, что «ты здесь дома» – личностный комфорт во взаимодействии с людьми;
чувство общности с другими людьми, переживание похожести на них;
вера в других – чувство, что в каждом человеке есть что-то хорошее;
мужество быть несовершенным – ощущение того, что ошибки делать естественно, что совсем не обязательно быть всегда и во всем «первым» и «правильным», «лучшим» и «непогрешимым»;
ощущение себя человеком – чувство, что ты часть человечества;
оптимизм – чувство, что мир можно сделать лучшим местом для жизни.
Природный потенциал регионов и проблемы его рационального использования — лекция, которая пользуется популярностью у тех, кто читал эту лекцию.
В то же время старение реально создает много психологических трудностей: ведь это годы «вынужденной праздности», часто проводимые в отрыве от работы с ощущением контраста «той» и «этой» жизни, который многими воспринимается как унизительный. Вынужденное безделье часто становится патогенным фактором в соматическом и психическом отношении, поэтому многие стараются остаться работоспособными, трудиться и приносить посильную пользу (хотя мнение, что все пенсионеры хотят продолжать трудиться, тоже неверное: статистика показывает, что это всего лишь одна треть всех людей пенсионного возраста).
Выделение периода старения и старости (геронтогенеза) связано с целым комплексом социально-экономических, биологических и психологических причин, поэтому период позднего онтогенеза изучается различными дисциплинами – биологией, нейрофизиологией, демографией, психологией и т. д. Общее постарение населения является современным демографическим феноменом: доля групп людей старше 60-65 лет составляет свыше 20% общей численности населения во многих странах мира (шестая или восьмая часть всей мировой популяции!).
д. Общее постарение населения является современным демографическим феноменом: доля групп людей старше 60-65 лет составляет свыше 20% общей численности населения во многих странах мира (шестая или восьмая часть всей мировой популяции!).
Средняя продолжительность жизни современного человека значительно выше, чем у его предков, и это означает, что пожилой и старческий возраст превращается в самостоятельный и достаточно продолжительный период жизни со своими социальными и психологическими особенностями. Эти демографические тенденции приводят также к усилению роли пожилых и старых людей в общественной, политической, культурной жизни общества и требуют анализа сущностных характеристик развития человека в этом периоде жизни. Геронтолог И. Давыдовский говорил, что опыт и мудрость всегда были функцией времени. Они остаются привилегией взрослых и пожилых. Для геронтологии как науки не так важно «прибавить годы к жизни»; важнее «прибавить жизнь к годам».
Процесс старения неоднороден. Традиционно выделяют три градации периода геронтогенеза: пожилой возраст (для мужчин – 60-74 года, для женщин – 55-4 года), старческий возраст (75-90 лет) и долгожители (90 лет и старше). Но современные исследования показывают, что в последние десятилетия процесс старения замедляется (человек 55-60 лет может совершенно не ощущать себя старым и по социальным функциям может находиться в когорте взрослых – зрелых – людей), да и само старение внутри указанных фаз не является однородным (кто-то устает от жизни уже к 50 годам, а кто-то и в 70 может быть полным сил и жизненных планов). Как говорил Б. Спиноза, никто не знает, «к чему способно тело».
Традиционно выделяют три градации периода геронтогенеза: пожилой возраст (для мужчин – 60-74 года, для женщин – 55-4 года), старческий возраст (75-90 лет) и долгожители (90 лет и старше). Но современные исследования показывают, что в последние десятилетия процесс старения замедляется (человек 55-60 лет может совершенно не ощущать себя старым и по социальным функциям может находиться в когорте взрослых – зрелых – людей), да и само старение внутри указанных фаз не является однородным (кто-то устает от жизни уже к 50 годам, а кто-то и в 70 может быть полным сил и жизненных планов). Как говорил Б. Спиноза, никто не знает, «к чему способно тело».
С физиологической и психологической точек зрения, старость менее жестко связана с хронологическим возрастом, чем любой более ранний период жизни (например, ранний, дошкольный или подростковый возраст) вплоть до 60-65 лет. Согласно наблюдениям Дж. Ботвиника и Л. Томпсона, если хронологический возраст – это фактор, на основе которого судят о том, кто стар, тогда все же люди пожилого возраста значительно более разнообразны по своим биологическим и поведенческим характеристикам, чем более молодые.
Сложность процесса старения выражается в усилении и специализации действия закона гетерохронии, в результате чего имеют место длительная сохранность и даже улучшение функционирования одних систем и ускоренная, происходящая разными темпами, инволюция других. Дольше всего сохраняются в организме те структуры (и функции), которые тесно связаны с осуществлением основного жизненного процесса в его наиболее общих проявлениях. Усиление противоречивости проявляется главным образом в разнонаправленности изменений, происходящих в отдельных функциональных системах индивидной организации. Хотя эволюционно-инволюционные процессы присущи всему онтогенезу в целом, именно в период старения разнонаправленность определяет специфику как психического, так и непсихического развития.
ФГБНУ НЦПЗ. ‹‹Болезнь Альцгеймера и старение: от нейробиологии к терапии››
АДАПТАЦИОННО-РЕГУЛЯТОРНАЯ КОНЦЕПЦИЯ
СТАРЕНИЯ И КОГНИТИВНЫЕ ПРОЦЕССЫ В НОРМЕ
И ПРИ ДЕМЕНЦИЯХ ПОЗДНЕГО ВОЗРАСТА
Н. К. Корсакова, В. Г. Постное Научный центр психического здоровья РАМН, Москва
К. Корсакова, В. Г. Постное Научный центр психического здоровья РАМН, Москва
Изучение когнитивных процессов при физиологическом старении и при деменциях позднего возраста (ДПВ), интенсивно осуществлявшееся в последнее десятилетие, позволило получить достаточно полную картину в отношении различных высших психических функций (ВПФ). Значимый вклад в это направление исследований внесло применение нейропсихологического подхода, рассматривающего когнитивные составляющие психики в связи с морфо-функциональными изменениями в работе нервной системы в норме и патологии [3].
Применение концепции А. Р. Лурии о трех блоках мозга в сочетании с комплексным синдромальным анализом основных составляющих познавательной деятельности позволило описать различные мозговые механизмы когнитивных изменений, сформировать представления о вариантах физиологического старения, определить нейропсихологические критерии деменций позднего возраста и дать характеристику синдромов когнитивных расстройств, характерных для различных форм ДПВ и стадий их развития, в качественном и количественном аспектах [1,2,5,6].
В результате сложилось представление о так называемой нейрокогнитивной дефицитарности при старении в норме и у больных ДПВ. Между тем, взгляд на старение исключительно как на возраст «утрат и потерь» является, в известном смысле, ограниченным. В нем недостаточно отражены неоднозначность и противоречивость изменений в когнитивной сфере психики в позднем возрасте. Последнее обстоятельство не только хорошо известно по жизненным наблюдениям, касающимся индивидуальных особенностей старения, но и находится в согласии со взглядами на движущие силы развития психики в онтогенезе.
Возникает необходимость обратиться к анализу когнитивной сферы в позитивном смысле, в аспекте понимания межфункциональных возрастных перестроек в познавательной деятельности, позволяющих человеку, несмотря на нейрокогнитивные ограничения, эффективно взаимодействовать с окружающим миром и с самим собой.
Разработка данной проблемы имеет значение для дальнейшего расширения представлений о познавательных процессах в позднем возрасте и, что не менее важно, для более содержательного понимания механизмов симптомообразования при различных формах ДПВ. Кроме того, соединение в нейропсихологическом подходе негативной и позитивной диагностики позволит с большей определенностью говорить о перспективах оказания психологической помощи психически здоровым стареющим людям, а также больным и их семьям. В качестве одной из серьезных предпосылок для анализа позитивных составляющих в структуре и динамике ВПФ на различных этапах старения является адаптационно-регуляторная концепция старения. [7]. Разработанная в контексте исследований по биологии старения, данная концепция позволяет наметить путь подхода к поставленной выше проблеме и на уровне психической деятельности. Старение рассматривается как закономерный и процессуальный этап развития индивида, подобный детству, юности и зрелости. Вместе с тем, характерным для этого периода жизни является ограничение адаптивных возможностей на различных уровнях обеспечения жизнедеятельности и поддержания гомеостазиса. Автором концепции убедительно показано, что наряду с явлениями угасания и даже подавления функций на различных уровнях возникают и становятся актуальными важные приспособительные механизмы.
Кроме того, соединение в нейропсихологическом подходе негативной и позитивной диагностики позволит с большей определенностью говорить о перспективах оказания психологической помощи психически здоровым стареющим людям, а также больным и их семьям. В качестве одной из серьезных предпосылок для анализа позитивных составляющих в структуре и динамике ВПФ на различных этапах старения является адаптационно-регуляторная концепция старения. [7]. Разработанная в контексте исследований по биологии старения, данная концепция позволяет наметить путь подхода к поставленной выше проблеме и на уровне психической деятельности. Старение рассматривается как закономерный и процессуальный этап развития индивида, подобный детству, юности и зрелости. Вместе с тем, характерным для этого периода жизни является ограничение адаптивных возможностей на различных уровнях обеспечения жизнедеятельности и поддержания гомеостазиса. Автором концепции убедительно показано, что наряду с явлениями угасания и даже подавления функций на различных уровнях возникают и становятся актуальными важные приспособительные механизмы.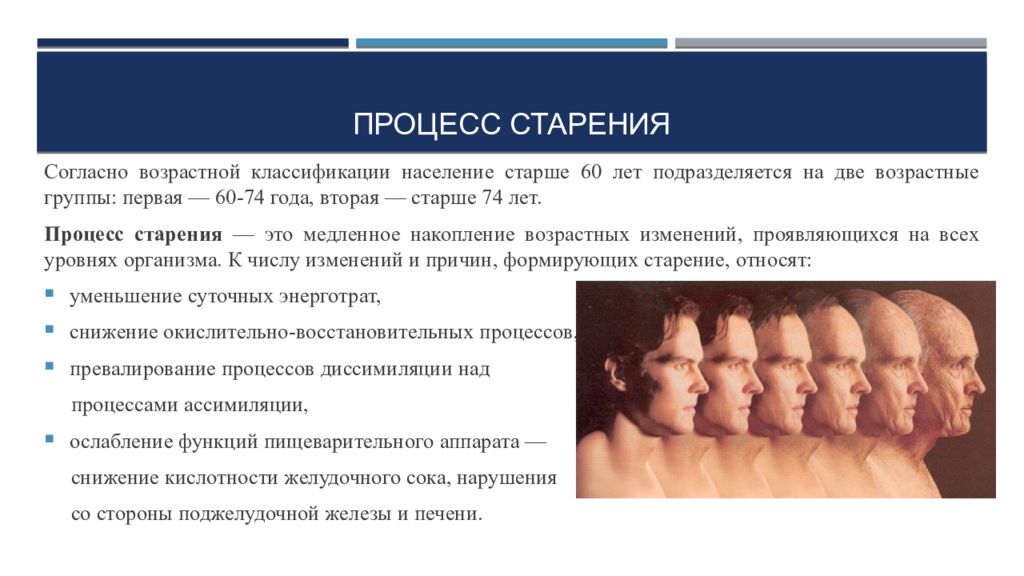 Можно предположить, что и в психической деятельности при снижении уровня надежности когнитивных процессов и ослаблении одних их звеньев следует говорить о мобилизации других, что, в свою очередь, предполагает установление новых межфункциональных взаимодействий и в структурах психики, и в работе мозга. Совершенно очевидно при этом, что указанные перестройки происходят в течение достаточно длительного периода и — по аналогии с более ранними этапами онтогенеза — характеризуются ГЕТЕРОХРОННОСТЬЮ (разное время возникновения ограничений), ГЕТЕРОТОПНОСТЬЮ («локализация» изменений в различных психических процессах и в обеспечивающих их мозговых структурах) и ГЕТЕРОДИНАМИЧНОСТЬЮ (различный темп формирования перестроек в отдельных составляющих когнитивной сферы [8].
Можно предположить, что и в психической деятельности при снижении уровня надежности когнитивных процессов и ослаблении одних их звеньев следует говорить о мобилизации других, что, в свою очередь, предполагает установление новых межфункциональных взаимодействий и в структурах психики, и в работе мозга. Совершенно очевидно при этом, что указанные перестройки происходят в течение достаточно длительного периода и — по аналогии с более ранними этапами онтогенеза — характеризуются ГЕТЕРОХРОННОСТЬЮ (разное время возникновения ограничений), ГЕТЕРОТОПНОСТЬЮ («локализация» изменений в различных психических процессах и в обеспечивающих их мозговых структурах) и ГЕТЕРОДИНАМИЧНОСТЬЮ (различный темп формирования перестроек в отдельных составляющих когнитивной сферы [8].
И, наконец, переструктурирование в когнитивной сфере невозможно без включения в психическую деятельность дополнительных и новых по отношению к предыдущим периодам жизни человека способов ауторегуляции (на основе прошлого опыта) процессов, отклоняющихся от требуемого режима работы.
Этап «вхождения» в возраст начала старения характеризуется появлением когнитивных ограничений, обусловленных изменением нейродинамических параметров психической активности и снижением ее энергетического обеспечения (дисфункция первого блока мозга по А. Р. Лурия). Это обнаруживается прежде всего в трудностях переключения и распределения внимания при параллельном выполнении нескольких действий и проявляется в виде сужения объема психической деятельности. Возникают ограничения в функционировании памяти в виде повышенной тормозимости следов при текущем запоминании, что, в свою очередь, снижает возможности обучения — феномен, отмечаемый практически во всех нейропсихологических и психофизиологических исследованиях. Вместе с тем, имеют место затруднения в переработке пространственных характеристик в задачах, требующих целостного, симультанного восприятия (дисфункция теменно-височно-затылочных отделов правого полушария мозга). Переживаемый при этом когнитивный диссонанс (не всегда отчетливо осознаваемый) требует действий, направленных на преодоление имеющихся ограничений в виде формирования особых стратегий регуляции психической активности. К ним относятся развернутый контроль за ранее неавтоматизированными операциями и действиями, включение в программу выполнения действий дополнительных способов и средств в виде наглядных опор, речевой регуляции во внутреннем плане и специальных способов преобразования информации при запоминании. Регуляция активности осуществляется за счет формирования определенных установок, позволяющих выбрать и реализовать направление деятельности в сторону наибольшей эффективности.
К ним относятся развернутый контроль за ранее неавтоматизированными операциями и действиями, включение в программу выполнения действий дополнительных способов и средств в виде наглядных опор, речевой регуляции во внутреннем плане и специальных способов преобразования информации при запоминании. Регуляция активности осуществляется за счет формирования определенных установок, позволяющих выбрать и реализовать направление деятельности в сторону наибольшей эффективности.
Исследование памяти у психически здоровых лиц показало, что в возрасте от 53 до 62 лет при увеличении объема запоминаемых слов снижается продуктивность их воспроизведения по сравнению с результатами испытуемых, относящихся к предыдущему возрастному десятилетию (45-55 лет). Вместе с тем, результаты «старшей» подгруппы отличались одной особенностью — полным отсутствием ошибок в припоминании. Опрос испытуемых показал, что в то время, как более молодые испытуемые традиционно ориентировались при запоминании и на объем стимульного материала, и на точность его воспроизведения, выполняя одновременно две установочных задачи, испытуемые более старшего возраста направляли свою деятельность на реализацию одной из двух установок — установки на точность. Такая стратегия запоминания приводила к более устойчивому и, в конечном счете, к более эффективному выполнению задания [4]. Данная иллюстрация показывает, что в деятельность запоминания вводятся новые регуляторные приемы, соответствующие оптимальному использованию энергетического обеспечения психической активности в одном фиксированном направлении.
Такая стратегия запоминания приводила к более устойчивому и, в конечном счете, к более эффективному выполнению задания [4]. Данная иллюстрация показывает, что в деятельность запоминания вводятся новые регуляторные приемы, соответствующие оптимальному использованию энергетического обеспечения психической активности в одном фиксированном направлении.
Выше говорилось о характерных для начального периода старения трудностях, связанных с недостаточностью симультанности в переработке информации. В наших наблюдениях этот вариант ограничений в психическом функционировании преодолевается путем поэтапного, пошагового выполнения заданий, то есть происходит изменение когнитивных стратегий от симультанной (целостной), реализуемой правым полушарием мозга, к сукцессивной (аналитической). Последняя осуществляется левым полушарием, которое в этом возрастном периоде функционирует более полноценно по сравнению с правым. В качестве примера можно привести данные самонаблюдения одной из наших испытуемых, которая отличалась прекрасной памятью на телефонные номера, припоминая их (как многие люди) целиком в виде одной целостной структуры. В возрасте около 60 лет она обнаружила, что для припоминания ранее хорошо известного ей номера необходимо извлекать его из памяти по частям, иногда с ошибочной перестановкой двузначных цифровых блоков.
В возрасте около 60 лет она обнаружила, что для припоминания ранее хорошо известного ей номера необходимо извлекать его из памяти по частям, иногда с ошибочной перестановкой двузначных цифровых блоков.
Приведенные примеры, во-первых, указывают на то, что поиск (и нахождение) способов регуляции, направленных на преодоление нейрокогнитивной недостаточности, в начале возраста старения может рассматриваться как новая форма психической активности, отдельный вид деятельности. Во-вторых, формирование и становление этого вида деятельности происходит в течение всего первого десятилетия возраста старения.
Принимая во внимание тот факт, что аналогичные перестройки в интер- и интрафункциональных взаимодействиях происходят на различных уровнях систем жизнеобеспечения [7], можно предположить следующее. Первое десятилетие возраста старения представляет собой сензитивный период жизни, кризис развития, аналогичный по уровню нагрузок на адаптивные и регуляторные процессы кризису подросткового возраста.
К концу этого этапа старения при условии его неотягощенности серьезными соматическими заболеваниями и психогенными негативными факторами (таковым, в частности, может быть хронический стресс) психическое функционирование гармонизируется с опорой на сформировавшиеся новые адаптивно-регуляторные способы и стратегии.
Данные о характере когнитивных ограничений, возникающих на начальной стадии старения, и о новых адаптивно-регуляторных видах психической деятельности позволяют конкретизировать основные параметры позднего онтогенеза. Гетерохронность и гетеротопность проявляются в наиболее выраженном ограничении психической активности, связанной с изменением уровня работы первого блока мозга. Относительно сохранный второй блок мозга (прежде всего
его структуры, относящиеся к левому полушарию) и полноценно функционирующие передние отделы мозга (третий блок) и межполушарные связи дают стареющему человеку возможность, опираясь соответственно на прошлый опыт и активизацию процессов саморегуляции психической деятельности, выработать и закрепить новые действия и структуры поведения, обеспечивающие возможность адаптивного психического функционирования.
Параметр гетеродинамичности при физиологическом старении проявляется в том, что перестройки в изменении способов и стратегий регуляции деятельности происходят неравномерно в отношении различных составляющих когнитивных ограничений. Наши данные показывают, что первоначально изменяются формы регуляции, связанные с преодолением патологической тормозимости следов текущего запоминания за счет приемов его опосредствования [4]. Позднее прорабатываются стратегии преодоления дефицитарности в симультанности переработки информации и в многоканальности психической активности [4]. Такая динамика указывает, скорее всего, на значимость процессов текущего запоминания в приспособительном поведении а также, вероятно, и на более медленный темп — по сравнению с мнестической деятельностью — нарастания ограничений в сфере симультанности.
Перестройки в интер- и интрапсихических взаимодействиях в конечном счете стабилизируются и обеспечивают переход на следующий этап старения, который характеризуется достаточной устойчивостью и сбалансированностью в психическом функционировании. Отсутствие на сегодняшний день лонгитюдных исследований не позволяет однозначно и точно определить время начала периода, обозначаемого в житейской психологии как «вторая молодость». Можно, однако, говорить о возрасте, близком к 63 — 65 годам жизни. Косвенным свидетельством в пользу такого предположения являются данные о биологии старения [7] и результаты сравнительного исследования запоминания у различных возрастных групп, где показано, что по ряду параметров памяти лица в возрасте от 62 до 78 лет имеют более высокие показатели, чем предыдущая возрастная группа [4]. Вместе с тем, хотелось бы отметить, что показатели памяти у лиц в возрасте от 53 до 60 лет во многом оказываются сходными с таковыми, полученными при обследовании лиц более позднего возраста (78-97 лет).
Отсутствие на сегодняшний день лонгитюдных исследований не позволяет однозначно и точно определить время начала периода, обозначаемого в житейской психологии как «вторая молодость». Можно, однако, говорить о возрасте, близком к 63 — 65 годам жизни. Косвенным свидетельством в пользу такого предположения являются данные о биологии старения [7] и результаты сравнительного исследования запоминания у различных возрастных групп, где показано, что по ряду параметров памяти лица в возрасте от 62 до 78 лет имеют более высокие показатели, чем предыдущая возрастная группа [4]. Вместе с тем, хотелось бы отметить, что показатели памяти у лиц в возрасте от 53 до 60 лет во многом оказываются сходными с таковыми, полученными при обследовании лиц более позднего возраста (78-97 лет).
Скорее всего, поздний возраст в силу нарастающих морфо-функциональных изменений в нервной системе и в других системах жизнеобеспечения должен рассматриваться, согласно В. В. Фролькису, как возраст, в котором компенсаторные механизмы исчерпываются. Можно добавить, что на уровне психической деятельности в глубокой старости ранее сформированные стратегии регуляции выступают как гиперкомпенсаторные и нередко не только не помогают, но и по критерию избыточности мешают выполнению действий. В частности, такой важный способ преодоления тормозимости следов, как опосредствование, на позднем этапе старения применяется даже при запоминании последовательности всего из трех-четырех слов. Нарастающее к этому возрасту сужение объема психической активности приводит к тому, что одновременное выполнение и действия опосредствования, и задачи запоминания создает взаимные помехи вследствие которых запоминание оказывается непродуктивным и неточным.
Можно добавить, что на уровне психической деятельности в глубокой старости ранее сформированные стратегии регуляции выступают как гиперкомпенсаторные и нередко не только не помогают, но и по критерию избыточности мешают выполнению действий. В частности, такой важный способ преодоления тормозимости следов, как опосредствование, на позднем этапе старения применяется даже при запоминании последовательности всего из трех-четырех слов. Нарастающее к этому возрасту сужение объема психической активности приводит к тому, что одновременное выполнение и действия опосредствования, и задачи запоминания создает взаимные помехи вследствие которых запоминание оказывается непродуктивным и неточным.
Предложенное рассмотрение нейрокогнитивной дефицитарности при физиологическом старении в свете адаптационно-регуляторной теории можно апплидировать к пониманию механизмов симптомообразования в мнестико-интеллектуальном снижении при ДПВ.
В целом патологическое старение, безусловно, характеризуется нарушением приспособительных механизмов при отсутствии возможностей формирования регуляторных (компенсаторных) стратегий. Это обусловлено прежде всего диффузностью морфо-функциональных расстройств в нервной системе. В связи с этим основные параметры позднего нормального онтогенеза (гетерохронность, гетеротопность и гетеродинамичность) искажаются и могут быть обозначены как «синхронность», «синтопичность» и «синдинамия». Нарушается возможность преодоления когнитивных ограничений, поскольку в состоянии патологического функционирования находятся те структуры мозга, которые в норме обеспечивают выбор, становление и закрепление регуляторных стратегий.
Это обусловлено прежде всего диффузностью морфо-функциональных расстройств в нервной системе. В связи с этим основные параметры позднего нормального онтогенеза (гетерохронность, гетеротопность и гетеродинамичность) искажаются и могут быть обозначены как «синхронность», «синтопичность» и «синдинамия». Нарушается возможность преодоления когнитивных ограничений, поскольку в состоянии патологического функционирования находятся те структуры мозга, которые в норме обеспечивают выбор, становление и закрепление регуляторных стратегий.
В этом контексте можно рассмотреть нарушения ВПФ при болезни Альцгеймера, сенильной деменции и деменциях сосудистой этиологии. Наиболее выраженным спектром прогрессирующих когнитивных расстройств характеризуется болезнь Альцгеймера. Несмотря на относительную сохранность функции лобных долей мозга, особенно на ранних стадиях течения болезни, расстройства в уровне функционирования первого блока мозга в сочетании с патологией блока приема, переработки и хранения информации не только в правом (как в норме), но и большей степени в левом полушарии мозга «закрывают» пути для выбора и становления компенсаторных стратегий. Нельзя исключить, что вместе с тем тяжесть когнитивных расстройств при болезни Альцгеймера обусловлена и ее относительно ранним началом. Оно приходится на первый этап старения, представляющий собой определенный кризис в индивидуальном развитии и характеризующийся закономерно происходящими перестройками и временной несформированностью стратегий преодоления когнитивной дефицитарности. В пользу последнего предположения свидетельствует характер нарушений ВПФ при сенильной деменции, которые не представлены в столь выраженной и развернутой форме, как при болезни Альцгеймера. Сложившиеся к началу этой формы деменции регуляторно-адаптационные механизмы закреплены в индивидуальном опыте и обеспечивают стабильное психическое функционирование. Максимальное снижение (по сравнению с другими когнитивными составляющими) процессов регуляции [6] не оказывает разрушительно-значимого влияния с учетом имеющихся рабочих возможностей первого и, в особенности, второго блоков мозга.
Нельзя исключить, что вместе с тем тяжесть когнитивных расстройств при болезни Альцгеймера обусловлена и ее относительно ранним началом. Оно приходится на первый этап старения, представляющий собой определенный кризис в индивидуальном развитии и характеризующийся закономерно происходящими перестройками и временной несформированностью стратегий преодоления когнитивной дефицитарности. В пользу последнего предположения свидетельствует характер нарушений ВПФ при сенильной деменции, которые не представлены в столь выраженной и развернутой форме, как при болезни Альцгеймера. Сложившиеся к началу этой формы деменции регуляторно-адаптационные механизмы закреплены в индивидуальном опыте и обеспечивают стабильное психическое функционирование. Максимальное снижение (по сравнению с другими когнитивными составляющими) процессов регуляции [6] не оказывает разрушительно-значимого влияния с учетом имеющихся рабочих возможностей первого и, в особенности, второго блоков мозга.
В случае ДПВ сосудистой этиологии следует отметить наибольшую выраженность когнитивных расстройств не при мультиинфарктных мелкоочаговых поражениях мозга, относящихся, как правило, к определенному сосудистому бассейну, а к тому варианту деменции, при котором имеет место массивное поражение белого вещества больших полушарий мозга. Данная патология приводит к нарушению связей между передними и задними, кортикальными и субкортикальными структурами, что нарушает возможность интегративной работы зон мозга, необходимой для перестроек в межфункциональном взаимодействии когнитивных процессов и формирования новых регуляторных стратегий.
Данная патология приводит к нарушению связей между передними и задними, кортикальными и субкортикальными структурами, что нарушает возможность интегративной работы зон мозга, необходимой для перестроек в межфункциональном взаимодействии когнитивных процессов и формирования новых регуляторных стратегий.
В последние годы в связи с задачами ранней диагностики ДПВ особым вниманием исследователей пользуется так называемая мягкая форма, нуждающаяся в дополнительных критериях, отделяющих ее от нормальных возрастных изменений. Можно предположить, что важным дифференциально-диагностическим признаком могут быть не столько негативные когнитивные симптомы, сколько органичное использование собственных или возможность включения в деятельность предлагаемых извне компенсаторно-регуляторных приемов и стратегий.
В заключение следует подчеркнуть, что привлечение основных положений биологической адаптационно-регуляторной концепции старения к анализу когнитивных процессов на уровне психологического подхода позволяет увидеть процесс старения в более широком, динамичном аспекте как особый этап онтогенеза, имеющий свою периодизацию, характеризующийся межфункциональными перестройками в психических функциях, нелинейностью когнитивных изменений и развитием новых способов регуляции психического функционирования.
Литература
1. Балашова Е. Ю. Нарушения пространственных функций при сосудистых и атрофических деменциях позднего возраста. Автореферат канд. дисс., М.,1995.
2. ЗагянскаяН. А., Зуева Ю. В., Корсакова Н. К. Нейропсихологический анализ вариантов нормального старения//Тезисы I Международной конференции памяти А. Р. Лурии, М., 1997, с. 37.
3. Каски Б., Нидерэхе Дж. Нейропсихологическая оценка сенильной деменции. Психологический журн., т. 19, № 2,1988.
4. Корсакова Н. К., Балашова Е. Ю. Опосредование как компонент саморегуляции психической деятельности в позднем возрасте//Вестник МГУ. Сер. 14, Психология, 1995, № 1, с. 18-23.
5. Корсакова Н. К., Дыбовская Н. Р., Рощина И. Ф., Гаврилова С. И. Учебно-методическое пособие по нейропсихологической диагностике деменции альцгеймеровского типа (болезнь Альцгеймера и сенильная деменция). М., НЦПЗРАМН, 1992.
6. Рощина И. Ф. Структура и динамика нейропсихологического синдрома при сенильной деменции. Автореферат канд. дисс. М., 1993.
Автореферат канд. дисс. М., 1993.
7. ФролькисВ. В. Природа старения. М., 1969.
8. Шахматов Н. Ф. Психическое старение. М., 1997.
Неизбежным старение делает физика, а не биология / Хабр
Привет, Хабр! Представляю вашему вниманию перевод статьи
Physics Makes Aging Inevitable, Not Biology. Автор
Peter Hoffmann.
Наномасштабная теплофизика гарантирует наше угасание, независимо от того, сколько болезней мы излечим
Внутренности каждой клетки нашего тела подобны перенаселенному городу заполненному путями, транспортом, библиотеками, фабриками, электростанциями и мусоропроводами. Рабочие этого города белковые машины, которые усваивают пищу, вывозят мусор или восстанавливают ДНК. Грузы перемещаются из одного места в другое с помощью молекулярных машин, передвигающихся на двух ножках по белковым канатам. Пока эти машины занимаются своим делом, окружающие тысячи молекул воды случайным образом врезаются в них миллионы раз в секунду. Это явление, которое физики эвфемистически называют «тепловым движением», и которое более уместно назвать чудовищным тепловым хаосом.
Это явление, которое физики эвфемистически называют «тепловым движением», и которое более уместно назвать чудовищным тепловым хаосом.
Вызывает недоумение, как эти молекулярные машины могут хорошо выполнять свою работу в таких невыносимых условиях. Частично ответ заключается в том, что белковые машины в клетках, подобно крошечным храповикам, превращают энергию случайной бомбардировки молекул воды в направленное движение, которое заставляет клетки работать. Превращают хаос в порядок.
Четыре года назад я опубликовал книгу под названием «Храповик жизни» в которой объясняется, как молекулярные машины создают порядок в наших клетках. Моей главной задачей было показать, как жизнь избегает погружения в хаос. К моему большому удивлению вскоре после публикации книги со мной связались исследователи изучающие биологическое старение. Сначала не увидел связи между темой книги и старением, так как ничего не знал о нем кроме того, что знал из наблюдений за старением своего тела.
Затем, из понимания важной роли теплового хаоса в работе молекулярных машин, возникло озарение, и я призвал исследователей старения подумать об этом, как о движущей силе старения. Тепловое движение может быть полезным в краткосрочном плане, как двигатель молекулярных машин, но может ли оно быть вредным в долгосрочной перспективе? Ведь при отсутствии внешних энергозатрат случайное тепловое движение стремится разрушить порядок.
Эта тенденция описывается вторым законом термодинамики, который утверждает, что все стареет и распадается: здания и дороги рушатся; корабли и рельсы ржавеют; горы смываются в море. Неживые структуры беспомощны против разрушающей силы теплового движения. Но жизнь другая: белковые машины постоянно восстанавливают и обновляют клетки.
В этом смысл противопоставления жизни, как биологической формы — физике, в битве со смертью. Так почему же живые существа умирают? Является ли старение окончательным триумфом физики над биологией? Или старение является частью самой биологии?
Если искать основополагающий документ для современного уровня исследования старения, то им может быть «Нерешенная проблема биологии» сэра Питера Медавара. Медавар, лауреат Нобелевской премии по биологии, а также остроумный и иногда язвительный автор эссе и книг. В своей книге Медавар выдвинул два противостоящих друг другу объяснения старения: с одной стороны ”врожденное старение», или старение как биологическая необходимость. С другой — теория “износа”, старение из-за “накопления последствий постоянных стрессов». Первое — это биология, второе — физика. Врожденное старение подразумевает, что старение и смерть продукты эволюции, выработанные с целью освобождения места новым поколениям.
Медавар, лауреат Нобелевской премии по биологии, а также остроумный и иногда язвительный автор эссе и книг. В своей книге Медавар выдвинул два противостоящих друг другу объяснения старения: с одной стороны ”врожденное старение», или старение как биологическая необходимость. С другой — теория “износа”, старение из-за “накопления последствий постоянных стрессов». Первое — это биология, второе — физика. Врожденное старение подразумевает, что старение и смерть продукты эволюции, выработанные с целью освобождения места новым поколениям.
Идея врожденного старения предполагает, что внутри нас есть главные часы, отсчитывающие время нашей жизни. Такие часы действительно имеются. Наиболее известными являются теломеры — маленькие фрагменты ДНК, которые укорачиваются каждый раз, когда клетка делится. Результаты изучения теломер противоречивые, неясно, является ли укорачивание теломер причиной или следствием старения. Теломеры не сокращаются на постоянную величину. Есть минимальная величина, которая приходится на каждое деление клетки, и более быстрое укорочение, если клетка каким-либо образом была повреждена. Многие исследователи считают, что укорочение теломер является больше признаком старения, нежели ее причиной.
Многие исследователи считают, что укорочение теломер является больше признаком старения, нежели ее причиной.
Жизнь противопоставляет биологию физике в смертельной битве
Сам Медавар выступал за теорию «изнашивания» — точку зрения физики на старение. Он заявил, что во-первых, трудно объяснить, как естественный отбор может действовать в старости, когда люди перестают занимаются воспроизводством потомства, а естественный отбор связан с темпами воспроизводства. Во-вторых, нет необходимости целенаправленно умертвлять пожилых людей, чтобы уменьшить их число. Случайность может сделать это самостоятельно.
Медавар утверждал, что биологические часы для старения не нужны. Чтобы проиллюстрировать почему, он привел пример не из биологии: пробирки в лаборатории. Предположим пробирки время от времени случайно ломаются, и их выбрасывают. Чтобы запас пробирок было постоянным, каждую неделю закупаются новые. Сколько будет старых и новых пробирок через несколько месяцев? Если предположить, что вероятность случайной поломки не зависит от возраста (разумное предположение), и построить график количества пробирок в зависимости от возраста каждой пробирки, мы получим спадающую экспоненциальную кривую, напоминающую детские горки. Смерть без старения. Компьютерная симуляция кривой выживания для случайно разбитых пробирок и ее экспоненциальная аппроксимация (красным цветом). Вертикальная ось — количество пробирок в каждой возрастной группе, горизонтальная — возраст пробирок в неделях.
Смерть без старения. Компьютерная симуляция кривой выживания для случайно разбитых пробирок и ее экспоненциальная аппроксимация (красным цветом). Вертикальная ось — количество пробирок в каждой возрастной группе, горизонтальная — возраст пробирок в неделях.
Хотя пробирки не стареют (старые пробирки ломаются не легче новых), постоянная вероятность поломки значительно уменьшает количество старых пробирок. Предположим, что люди, как и пробирки, с одинаковой вероятностью умирают в любом возрасте. Тогда число пожилых людей тоже будет небольшим. Вероятность сделает свое дело.
Беда в том, что кривые выживания, построенные для человеческих популяций, не похожи на кривую выживания пробирок Медавара. Они почти горизонтальные в начале, с небольшим количеством потерь в молодом возрасте (кроме новорожденных). Затем, начиная с некоторого возраста, кривая начинает резко спадать. Чтобы получить такую кривую в модель пробирок Медавара необходимо добавить еще одно предположение: с течением времени пробирки должны накапливать крошечные трещины, которые увеличивают вероятность их поломки.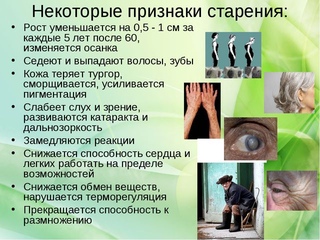 Другими словами они должны стареть. Если вероятность поломки увеличивается в геометрической прогрессии мы получим кривую описываемую законом Гомпертца — Мейкхайма. Этот закон хорошо описывает кривую выживания человека. Как и для пробирок закон включает постоянную и экспоненциально возрастающую вероятность поломки. Для людей экспоненциальный рост наблюдается, когда вероятность смерти начинает удваивается каждые семь лет, после достижения 30 лет.
Другими словами они должны стареть. Если вероятность поломки увеличивается в геометрической прогрессии мы получим кривую описываемую законом Гомпертца — Мейкхайма. Этот закон хорошо описывает кривую выживания человека. Как и для пробирок закон включает постоянную и экспоненциально возрастающую вероятность поломки. Для людей экспоненциальный рост наблюдается, когда вероятность смерти начинает удваивается каждые семь лет, после достижения 30 лет.
В чем причина этого экспоненциального роста? Тепловое движение — не единственный источник повреждений в наших клетках. Некоторые регулярные процессы, особенно метаболизм в наших митохондриях, не идеальны, и имеют тенденцию производить свободные радикалы — высокореактивные соединения, которые могут повредить ДНК. В совокупности, тепловой шум и образование свободных радикалов, создают фоновый риск повреждения клеток. Обычно повреждения восстанавливаются, если клетка не подлежит восстановлению, то она запускает процесс самоубийства — апоптоз, и стволовые клетки замещают их.
Ликвидация рака или болезни Альцгеймера улучшила бы жизнь, но это не сделало бы нас бессмертными или даже не позволило бы нам жить значительно дольше
Тем не менее, повреждения со временем накапливаются. ДНК может быть восстановлена только тогда, когда есть неповрежденная копия для копирования. Поврежденные белки разворачиваются и начинают слипаться, образуя
агрегаты. Защита клеток и механизм апоптоза нарушаются.
«Стареющие клетки»начинают накапливаться в органах, что приводит к
воспалению. Стволовые клетки не активируются, или истощаются. Митохондрии повреждаются уменьшая энергоснабжение, которое необходимо для работы молекулярных машин восстанавливающих ДНК. Это
порочный круг, который на техническом языке называется цепью положительной обратной связи. Математически наличие положительной обратной связи приводит к экспоненциальному увеличению риска, который может объяснить форму кривой выживания человека.
В научной литературе имеется много объяснений старения: агрегация белков, повреждение ДНК, воспаление, теломеры. Но это биологические реакции на первопричину, которой является накопление повреждений в результате термической и химической деградации. Чтобы доказать, что термические эффекты действительно вызывают старение необходимо произвести наблюдение за людьми, имеющих различные внутренние температуры. Это невозможно, но есть организмы, которые могут подвергаться воздействию разной температуры без немедленных последствий. В недавней статье в Nature команда Гарвардской Медицинской школы провела исследование температурную зависимость старения у круглого червя C. elegans, простого и хорошо изученного вида. Они обнаружили, что форма кривой выживания остается практически неизменной, но растягивается или сжимается в зависимости от изменения температуры. Особи жившие при более низкой температуре имели более растянутые кривые выживания, в то время как черви жившие при более высокой температуре имели более короткую продолжительность жизни.
Но это биологические реакции на первопричину, которой является накопление повреждений в результате термической и химической деградации. Чтобы доказать, что термические эффекты действительно вызывают старение необходимо произвести наблюдение за людьми, имеющих различные внутренние температуры. Это невозможно, но есть организмы, которые могут подвергаться воздействию разной температуры без немедленных последствий. В недавней статье в Nature команда Гарвардской Медицинской школы провела исследование температурную зависимость старения у круглого червя C. elegans, простого и хорошо изученного вида. Они обнаружили, что форма кривой выживания остается практически неизменной, но растягивается или сжимается в зависимости от изменения температуры. Особи жившие при более низкой температуре имели более растянутые кривые выживания, в то время как черви жившие при более высокой температуре имели более короткую продолжительность жизни.
Более того, коэффициент растяжения кривой выживания зависел от температуры по знакомой каждому ученому схеме: такой же зависимости скорости разрыва химических связей от температуры теплового движения.
Я увидел потенциальную связь между разрывом связей и старением человека даже в своей лаборатории. Когда впервые столкнулся с законом Гомперца-Мейкхайма, то он показался мне странно знакомым. В лаборатории с помощью атомно-силового микроскопа мы изучаем вероятность сохранения одиночных молекулярных связей. Этот микроскоп позволяет измерять слабые силы, действующие между двумя молекулами. В типичном эксперименте мы присоединяем один белок к плоской поверхности, а другой к концу небольшой пружинки. Позволяем двум белкам связываться друг с другом, затем медленно тянем за пружину, чтобы приложить усилие к молекулам. В конце концов, связь между двумя молекулами разрывается, и мы измеряем приложенное для этого усилие.
Это случайный процесс связанный с тепловым движением, каждый раз сила разрыва различная. Но график зависимости вероятности сохранения связи от величины прикладываемой силы выглядит так же, как график выживания человека с возрастом. Особенно большое сходство с результатами для C. elegans, которые предполагают возможную связь между разрывными связей белков и старением, а также между старением и тепловым движением.Общая смерть. Слева: график выживания для человека с аппроксимацией законом Гомпертца — Мейкхайма. Справа: график сохранения одиночных белковых связей в зависимости от приложенной силы. Математически форма двух кривых идентична.
elegans, которые предполагают возможную связь между разрывными связей белков и старением, а также между старением и тепловым движением.Общая смерть. Слева: график выживания для человека с аппроксимацией законом Гомпертца — Мейкхайма. Справа: график сохранения одиночных белковых связей в зависимости от приложенной силы. Математически форма двух кривых идентична.
В исследовательском сообществе по проблемам старения активно обсуждается вопрос о том, следует ли классифицировать старение, как болезнь. Многие исследователи, изучающие конкретные заболевания, клеточные системы или молекулярные компоненты хотели бы, чтобы их любимый предмет исследования облачился в мантию причины старения. Но само количество выдвигаемых причин опровергает такую возможность. Леонард Хейфлик, первооткрыватель клеточного старения, отметил в своей провокационно озаглавленной статье «Биологическое старение больше не является нерешенной проблемой», что «общим знаменателем, который лежит в основе всех современных теорий старения, является изменение молекулярной структуры, и следовательно, функции». Конечной причиной, по словам Хейфлика, «является растущая потеря молекулярной точности или увеличение молекулярных нарушений». Эта потеря точности и увеличение нарушений будут проявляться, по самой своей природе, случайным образом, и, следовательно, по-разному для разных людей. Но основная причина остается прежней.
Конечной причиной, по словам Хейфлика, «является растущая потеря молекулярной точности или увеличение молекулярных нарушений». Эта потеря точности и увеличение нарушений будут проявляться, по самой своей природе, случайным образом, и, следовательно, по-разному для разных людей. Но основная причина остается прежней.
Если такая интерпретация данных верна, то старение — это естественный процесс, который можно свести к наномасштабной теплофизике, а не к болезни. Вплоть до 1950-х годов большие успехи достигнутые в увеличении продолжительности жизни человека были почти полностью связаны с ликвидацией инфекционных заболеваний, постоянного фактора риска, который не особенно зависит от возраста. В результате резко увеличилась продолжительность жизни (средний возраст на момент смерти), но максимальная продолжительность жизни человека не изменилась. Экспоненциально растущий риск в конечном счете превосходит любое снижение постоянного риска. Заниматься постоянным риском полезно, но до определенного предела: постоянный риск является экологическим (несчастные случаи, инфекционные заболевания), большая часть экспоненциально растущего риска связана с внутренним износом. Ликвидация рака или болезни Альцгеймера улучшила бы жизнь, но это не сделало бы нас бессмертными или даже не позволило жить значительно дольше.
Ликвидация рака или болезни Альцгеймера улучшила бы жизнь, но это не сделало бы нас бессмертными или даже не позволило жить значительно дольше.
Это не значит, что мы ничего не можем сделать. Необходимы дополнительные исследования специфических молекулярных изменений в процессе старения. Это может показать нам есть ли ключевые молекулярные компоненты, которые первыми нарушаются, и приводит ли эти нарушения к последующему каскаду сбоев. Если такие ключевые компоненты имеются, то у нас будут четкие цели для вмешательств и восстановления, возможно с помощью нанотехнологий, исследований стволовых клеток или редактирования генов. Это стоит попробовать. Но мы должны четко понимать: нам никогда не одолеть законы физики.
Постскриптум автора перевода.1. Статья под таким провокационным заголовком вызвала острые дискуссии на нескольких интернет-площадках, и вынудили автор написать
откликна комментарии читателей. Счел целесообразным добавить перевод этого отклика (по тексту
поста в блоге) к статье.
Когда я опубликовал “Храповик жизни” 2 года назад, то был сосредоточен на том, как жизнь может создавать и поддерживать высокоупорядоченные системы в окружающем молекулярном хаосе – в частности, как молекулярные машины “извлекают порядок из хаоса”. К моему удивлению книга вызвала большой интерес в области исследований старения. Старение, как говорит Эд Лакатта, руководитель лаборатории кардиологии Института старения NIH, извлекает «хаос из порядка».
С учетом этого интереса меня пригласили написать статью для научного-популярного журнала Nautilus (который могу только рекомендовать). Моя статья о старении появилась вчера в интернете под провокационным (не выбранным мной) заголовком «Старение неизбежным делает физика, а не биология». Мой заголовок был «Старение: где физика встречается с биологией». Что, вероятно, более скучно, но менее провокационно.
Поскольку невозможно было развернуто написать по этому вопросу в 2000 слов в статье, поделюсь несколькими дополнительными мыслями об этом здесь, в моем блоге.
Для начала посмотрел комментарии к статье. Некоторые повторяющиеся темы в комментариях, что (1) человек открытая термодинамическая система, и следовательно, не подвержена увеличению энтропии (так как всегда можем понизить энтропию получая энергию из окружающей среды), (2) что наши клетки имеют восстановительные системы, которые могут устранять любые нарушения, которые могут произойти, и (3) есть “бессмертные” клетки и организмы, которые опровергают мое утверждение, что старение неизбежно.
(1) и (2) имеют практически одинаковый ответ:
Абсолютно верно, что человек открытая система. Это то, что я подробно описал в своей книге. Потребление низкоэнтропийной энергии (пищи и кислорода, прим. переводчика) является причиной того, что наша клеточная машинерия может наводить порядок в молекулярном хаосе. Однако молекулярный хаос присутствует всегда, молекулы в наших клетках повреждаются непрерывно. В отличие от других термодинамически открытых самоорганизующихся систем, таких как ураган, живые системы представляют собой жестко контролируемые системы, состоящие из сложно взаимосвязанных цепей обратной связи и контуров регулирования. Эти петли обратной связи полагаются на превосходно адаптированные и сконструированные молекулярные машины, неповрежденную ДНК для выполнения программы, а также своевременное и точное регулирование и сигнализацию. Эти системы взаимодействуют через иерархию молекул, органелл, клеток, межклеточных взаимодействий, тканей, органов и на уровне всего организма. У них много резервных, дублирующих и восстанавливающих систем.
Эти петли обратной связи полагаются на превосходно адаптированные и сконструированные молекулярные машины, неповрежденную ДНК для выполнения программы, а также своевременное и точное регулирование и сигнализацию. Эти системы взаимодействуют через иерархию молекул, органелл, клеток, межклеточных взаимодействий, тканей, органов и на уровне всего организма. У них много резервных, дублирующих и восстанавливающих систем.
Тем не менее, некоторые из этих систем подвергаются едва заметному повреждению. Энергоснабжение замедляется, нарушаются сигнальные цепи, расстраивается синхронизация контура обратной связи, поврежденные молекулы не выводятся из клеток и со временем накапливаются, молекулярные машины не выполняют функции или не активируются. Эта потеря функции может вызвать потерю функции в других системах, из-за взаимозависимости всех систем в организме. Это приводит к нарастающему каскаду отказов. Начало этого процесса — вопрос вероятности в огромном количестве клеток и функций. Вы можете попытаться предотвратить сбой одной системы, но есть много других, которые потерпят неудачу.
Системы восстановления в наших клетках превосходны — они позволяют нам жить до 80+ лет. Мы живем дольше любого млекопитающего сопоставимого размера и частоты сердечных сокращений. Можем ли мы жить еще дольше? В принципе, восстановительные системы можно было бы усовершенствовать, но их сложность отдаляет эту перспективу на многие годы. Поэтому мы всегда будем подвержены игре вероятностей, которую в итоге проиграем.
3) Некоторые читатели отмечают, что существуют ”бессмертные» организмы. Одна особенность, которую можно заметить у всех этих бессмертных организмах заключается в том, что все они очень просты, обычно одноклеточные или, по крайней мере, мало дифференцированные. Примерами являются бактерии, но и такие существа, как так называемые “бессмертные медузы”. Бессмертная медуза проходит стадию в которой она обращает процесс своего развития, возвращаясь от взрослой особи к личиночной стадии, которая затем может развиться в новую взрослую. Это, по-видимому, может продолжаться бесконечно, делая медуз «бессмертной». На первый взгляд это кажется удивительным. Однако, в некотором смысле, люди делают то же самое! Наши эмбриональные линии также «бессмертны». Но это отличается от старения сложной взрослой особи. По сравнению с поддержанием порядка на молекулярном и системном уровне в сложном организме в течение многих лет, поддержание ДНК в яйцеклетке является относительно легкой задачей. Тем не менее, даже там со временем происходит деградация. Это основная причина по которой мы размножаемся в основном в молодом возрасте, так как врожденные дефекты более распространены у стареющих матерей и отцов. Что касается медуз, как отдельных взрослых особей, они явно не бессмертны, так как они должны “умереть”, чтобы вернуться к личиночной стадии. Кроме того, вероятно не все медузы проделают эту трансформацию успешно, поэтому “бессмертие” находится на уровне популяции, а не на индивидуальном уровне. Но если это определение «бессмертия», то и люди бессмертны. Но мы обычно не используем такое определение!
На первый взгляд это кажется удивительным. Однако, в некотором смысле, люди делают то же самое! Наши эмбриональные линии также «бессмертны». Но это отличается от старения сложной взрослой особи. По сравнению с поддержанием порядка на молекулярном и системном уровне в сложном организме в течение многих лет, поддержание ДНК в яйцеклетке является относительно легкой задачей. Тем не менее, даже там со временем происходит деградация. Это основная причина по которой мы размножаемся в основном в молодом возрасте, так как врожденные дефекты более распространены у стареющих матерей и отцов. Что касается медуз, как отдельных взрослых особей, они явно не бессмертны, так как они должны “умереть”, чтобы вернуться к личиночной стадии. Кроме того, вероятно не все медузы проделают эту трансформацию успешно, поэтому “бессмертие” находится на уровне популяции, а не на индивидуальном уровне. Но если это определение «бессмертия», то и люди бессмертны. Но мы обычно не используем такое определение!
Регулярные (соматические) человеческие клетки также могут стать бессмертными, это называется раком. Рак и старение две стороны одной медали молекулярных нарушений. Если бы наши клетки не умирали в какой-то момент, молекулярные нарушения и повреждение ДНК непрерывно увеличивали бы вероятность того, что клетки станут раковыми. Плата за поддержание наших клеток в строю — это жесткая регуляция клеточного деления, роста и дифференциации. Плата за это жесткое регулирование, сталкивающегося с натиском теплового и химического повреждения — старение.
Рак и старение две стороны одной медали молекулярных нарушений. Если бы наши клетки не умирали в какой-то момент, молекулярные нарушения и повреждение ДНК непрерывно увеличивали бы вероятность того, что клетки станут раковыми. Плата за поддержание наших клеток в строю — это жесткая регуляция клеточного деления, роста и дифференциации. Плата за это жесткое регулирование, сталкивающегося с натиском теплового и химического повреждения — старение.
2. С накоплением повреждений в организме можно бороться разными методами, о чем на Хабре нам бодро сообщают в своих публикациях пользователи
Batinи
arielf🙂 Наиболее последовательный подход к борьбе с повреждениями на всех уровнях организма декларируется исследовательским фондом
SENS.
3. В статье делается упор на тепловое движение молекул и образование свободных радикалов, как базовых причин деструктивных изменений в организме, приводящих в конечном счете к его старению и смерти. Но мало уделяется внимания макроскопическим термодинамическим характеристикам этого процесса, в частности, связанным с основным обменом, как показателем уровня метаболизма, и его связью с другими характеристиками организмов такими, как масса, время роста, максимальная продолжительностью жизни и др. При благоприятном стечении обстоятельств планирую восполнить этот пробел, написав отдельную статью на эту тему.
При благоприятном стечении обстоятельств планирую восполнить этот пробел, написав отдельную статью на эту тему.
4. Статья ограниченная по объему, автор не вдается в детали, поэтому добавил ссылки для получения дополнительной информации по затрагиваемым темам. Работа клеточных молекулярных машин наглядно показана в фильме «Тайная жизнь клетки». Однако качество видео и звука оставляет желать лучшего.
Заболевания пожилого возраста. Справочник семейного доктора
Заболевания пожилого возраста
Особенности гериатрии
В процессе постарения населения, наблюдающегося в последние годы, происходят не только количественные изменения его возрастного состава – увеличение доли людей пожилого и старческого возраста, но и большие качественные изменения, в частности, улучшение состояния здоровья людей старших возрастных групп. Старость все чаще не ассоциируется с обязательной физической слабостью, болезнями, социально-экономической зависимостью. Активность, участие пожилых и старых людей в профессиональной, общественной жизни стали необходимыми для большинства людей, переступивших пенсионный возраст. В экономическом плане встал вопрос об увеличении возраста для достижения пенсионного периода, особенно у женщин. Пожилые и старые люди одного и того же возраста по состоянию их физического и психического здоровья представляют собой неоднородные группы. Несоответствие состояния стареющего организма возрастным нормам вызвало необходимость введения понятия «биологический возраст». Биологический возраст может не соответствовать календарному возрасту, в частности, он может «опережать» его в связи с преждевременным старением. И наоборот, нередки случаи, когда в возрасте, например, 70 лет состояние организма соответствует возрастным нормам 50—60-летнего человека. Определение биологического возраста и степени его несоответствия календарному имеет большое практическое значение в профилактике и лечении различных заболеваний, в решении вопросов рационального образа жизни и трудовой деятельности.
В экономическом плане встал вопрос об увеличении возраста для достижения пенсионного периода, особенно у женщин. Пожилые и старые люди одного и того же возраста по состоянию их физического и психического здоровья представляют собой неоднородные группы. Несоответствие состояния стареющего организма возрастным нормам вызвало необходимость введения понятия «биологический возраст». Биологический возраст может не соответствовать календарному возрасту, в частности, он может «опережать» его в связи с преждевременным старением. И наоборот, нередки случаи, когда в возрасте, например, 70 лет состояние организма соответствует возрастным нормам 50—60-летнего человека. Определение биологического возраста и степени его несоответствия календарному имеет большое практическое значение в профилактике и лечении различных заболеваний, в решении вопросов рационального образа жизни и трудовой деятельности.
В специальной литературе все чаще подчеркивается различие между хронологическим и биологическим возрастом, высказывается мнение о возможности деления людей одного и того же возраста на «молодых старых» и «старых старых», основываясь на состоянии здоровья и социальных показателях. По грубым подсчетам, в промышленно развитых странах «молодые старые» люди составляют 79–85 % от числа всех лиц в возрасте 60 лет и сохраняют способность не только к самообслуживанию, но и к трудовой деятельности, а «старые старые» составляют 15–20 %. Доля последних повышается в более старших возрастных группах, но даже многие из лиц в возрасте 80 лет и старше не имеют серьезных заболеваний, практически здоровы и поэтому могут быть отнесены к категории «молодые старые».
По грубым подсчетам, в промышленно развитых странах «молодые старые» люди составляют 79–85 % от числа всех лиц в возрасте 60 лет и сохраняют способность не только к самообслуживанию, но и к трудовой деятельности, а «старые старые» составляют 15–20 %. Доля последних повышается в более старших возрастных группах, но даже многие из лиц в возрасте 80 лет и старше не имеют серьезных заболеваний, практически здоровы и поэтому могут быть отнесены к категории «молодые старые».
Биологическое и физиологическое старение
Таким образом, старение как общебиологический процесс не может отождествляться с болезнью. Старение – закономерный биологический процесс, неизбежно развивающийся с возрастом, характеризующийся постепенным снижением приспособительных возможностей организма и увеличением вероятности смерти. Огромный диапазон приспособительных возможностей стареющего организма может на длительное время, а нередко до глубокой старости обеспечить достаточное сохранение функций, отодвинуть неизбежное – смерть.
Старость – заключительный этап жизнедеятельности организма, следствие процесса старения. Время наступления старости чрезвычайно условно, с увеличением продолжительности жизни представление о нем меняется. Старческим обычно принято считать возраст после 75 лет. Различают нормальное, или физиологическое и преждевременное старение. При физиологическом старении изменение основных физиологических систем организма происходит относительно плавно. Человек до глубокой старости сохраняет физическую и умственную активность, интерес к окружающему миру. Значительные приспособительные возможности организма могут в течение длительного времени обеспечивать достаточно высокую активность основных физиологических функций, т. е. практическое здоровье. Именно поэтому старение как общебиологический процесс не следует отождествлять с болезнью. Старость – неизбежный этап развития организма, болезнь – нарушение его жизнедеятельности, которое может возникнуть в любом возрастном периоде.
Обычно выраженные признаки физиологического старения – это изменения внешнего вида, психики, снижение работоспособности и другие, появляющиеся у человека с 60 лет (возраст с 60 до 75 лет условно считается пожилым). Однако фактически процесс старения начинается тогда, когда заканчивается рост и развитие организма. Так, уже в 30–35 лет происходит снижение уровня биологических процессов. Темп и характер старения в значительной мере определяют приспособительные возможности стареющего организма. Существенную роль в этом играет конституция человека, определяемая главным образом наследственностью. Генетически обусловленное старение достаточно убедительно подтверждается, например, тем, что долголетие, т. е. замедление процессов старения, передается в некоторых семьях из поколения в поколение. Прослеживается также определенная закономерность в самом характере старения, избирательно передающемся по наследству. Так, у представителей одной семьи наиболее заметные возрастные изменения могут проявиться, в первую очередь, в сердечно-сосудистой системе, у представителей другой семьи – в эндокринной и т. д. С генетическими особенностями связывают и более медленное старение у женщин (средняя продолжительность жизни женщин в развитых странах на 4—11 лет больше, чем у мужчин).
Однако фактически процесс старения начинается тогда, когда заканчивается рост и развитие организма. Так, уже в 30–35 лет происходит снижение уровня биологических процессов. Темп и характер старения в значительной мере определяют приспособительные возможности стареющего организма. Существенную роль в этом играет конституция человека, определяемая главным образом наследственностью. Генетически обусловленное старение достаточно убедительно подтверждается, например, тем, что долголетие, т. е. замедление процессов старения, передается в некоторых семьях из поколения в поколение. Прослеживается также определенная закономерность в самом характере старения, избирательно передающемся по наследству. Так, у представителей одной семьи наиболее заметные возрастные изменения могут проявиться, в первую очередь, в сердечно-сосудистой системе, у представителей другой семьи – в эндокринной и т. д. С генетическими особенностями связывают и более медленное старение у женщин (средняя продолжительность жизни женщин в развитых странах на 4—11 лет больше, чем у мужчин). Преждевременное старение в значительной мере обусловлено перенесенными ранее заболеваниями, неблагоприятными факторами окружающей среды, вредными привычками, в частности курением, злоупотреблением алкоголем и др. Нерациональное питание и вредные привычки снижают или извращают приспособительные возможности организма, способствуя тем самым развитию болезней, свойственных старческому возрасту. Следствием ускорения процесса старения является и преждевременная старость.
Преждевременное старение в значительной мере обусловлено перенесенными ранее заболеваниями, неблагоприятными факторами окружающей среды, вредными привычками, в частности курением, злоупотреблением алкоголем и др. Нерациональное питание и вредные привычки снижают или извращают приспособительные возможности организма, способствуя тем самым развитию болезней, свойственных старческому возрасту. Следствием ускорения процесса старения является и преждевременная старость.
Процесс физиологического старения начинается в разных тканях и органах неодновременно и протекает с различной интенсивностью. Старение заключается в постепенном снижении жизнеспособности организма: изменяется биосинтез белка, снижается активность окислительных ферментов, уменьшается количество митохондрий, нарушается функция клеточных мембран. В конечном итоге старение клеток приводит к их разрушению и гибели. Потеря клеток неодинакова в различных органах и тканях одного и того же организма. Темп старения клеток определяется также их отношением к той или иной функциональной системе.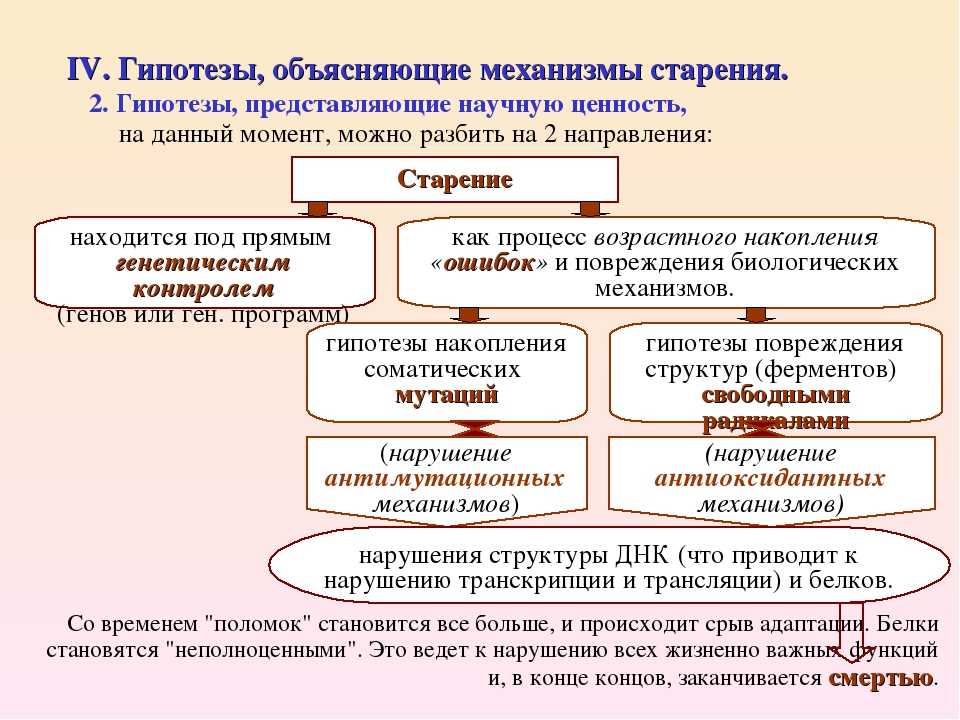 Так, в соединительной ткани изменения обнаруживаются во всех компонентах, функциональные возможности мышечных клеток с возрастом снижаются. Возрастные сдвиги, происходящие в результате старения клеток и тканей, обусловливают значительные изменения в регуляции функций органов и систем. Постепенно изменяются и сами функции, что, в свою очередь, приводит к структурным изменениям. Например, в процессе старения уменьшается масса головного мозга, извилины истончаются, соответственно, борозды расширяются. Однако, наряду с дистрофическими нарушениями в клетках головного мозга, происходят адаптационные изменения. Основные проявления старения человека связаны с возрастными изменениями функций центральной нервной системы. Раньше всего ослабляется подвижность процессов возбуждения и торможения. Нарушается деятельность анализаторов, ослабляется чувствительность обоняния, уменьшаются острота зрения и сила аккомодации глаза, постепенно понижается верхняя граница слуха.
Так, в соединительной ткани изменения обнаруживаются во всех компонентах, функциональные возможности мышечных клеток с возрастом снижаются. Возрастные сдвиги, происходящие в результате старения клеток и тканей, обусловливают значительные изменения в регуляции функций органов и систем. Постепенно изменяются и сами функции, что, в свою очередь, приводит к структурным изменениям. Например, в процессе старения уменьшается масса головного мозга, извилины истончаются, соответственно, борозды расширяются. Однако, наряду с дистрофическими нарушениями в клетках головного мозга, происходят адаптационные изменения. Основные проявления старения человека связаны с возрастными изменениями функций центральной нервной системы. Раньше всего ослабляется подвижность процессов возбуждения и торможения. Нарушается деятельность анализаторов, ослабляется чувствительность обоняния, уменьшаются острота зрения и сила аккомодации глаза, постепенно понижается верхняя граница слуха.
Ограничение адаптационных возможностей стареющего организма во многом определяется возрастными изменениями сердечно-сосудистой системы. В возрасте старше 60 лет уменьшается масса сердца. У пожилых и тем более старых людей снижается частота сердечных сокращений в состоянии покоя. При умеренных физических нагрузках обычно не происходит свойственного молодым людям учащения сердечного ритма, что, с одной стороны, предохраняет сердце от чрезмерного напряжения, а с другой – ограничивает кровоснабжение органов и систем организма. При резком учащении сердечных сокращений, связанном с большими физическими нагрузками, быстро наступает несоответствие между притоком крови к сердцу через коронарные сосуды и резким усилением обменных процессов в сердце, что приводит к недостаточности кровоснабжения сердечной мышцы.
В возрасте старше 60 лет уменьшается масса сердца. У пожилых и тем более старых людей снижается частота сердечных сокращений в состоянии покоя. При умеренных физических нагрузках обычно не происходит свойственного молодым людям учащения сердечного ритма, что, с одной стороны, предохраняет сердце от чрезмерного напряжения, а с другой – ограничивает кровоснабжение органов и систем организма. При резком учащении сердечных сокращений, связанном с большими физическими нагрузками, быстро наступает несоответствие между притоком крови к сердцу через коронарные сосуды и резким усилением обменных процессов в сердце, что приводит к недостаточности кровоснабжения сердечной мышцы.
В процессе старения развиваются атрофические и склеротические изменения в эндокринной системе. Аналогичные изменения происходят и в дыхательной системе: несколько увеличивается частота дыхания, уменьшается жизненная емкость легких и их максимальная вентиляция. Страдают функции пищеварительной и выделительной систем, костно-суставного аппарата, атрофируются скелетные мышцы.
Психологические аспекты старения
Период жизни людей, переступивших пенсионный рубеж, не всегда характеризуется успешной адаптацией. Легкая приспособляемость к новым условиям жизни обычно обусловлена преимущественно психологическими причинами. При старении отмечается снижение психической активности, при которой затрудняется восприятие, сужается его объем, ухудшается способность сосредоточения внимания и его переключения, наблюдается заострение характерологических особенностей, развивается эмоциональная неустойчивость. Нередко пожилой и тем более старый человек становится обидчивым, капризным, скупым, черствым и эгоистичным. Ему страшны любые жизненные перемены, снижается критичность в оценке своих возможностей, достоинств и прежних заслуг. Отсутствие самообладания делает человека раздражительным, вспыльчивым, агрессивным или, наоборот, слишком неуверенным в себе, подавленным и плаксивым. Общим является мнение о том, что в «третьем возрасте» состояние человека тесно связано с адаптацией в предшествующие периоды – в молодом и среднем возрасте; на него оказывают влияние перенесенные ранее заболевания, окружающая среда в широком ее понимании (труд, питание, быт, стрессовые ситуации и др. ).
).
Возрастная адаптация в старости осуществляется сугубо индивидуально, и можно только схематически представить шкалу, иллюстрирующую диапазон приспособительных возможностей в пожилом и старческом возрасте.
1. Приспособительная возможность полностью нарушена, человек не способен обучаться новому, не может работать в своем нынешнем положении, зависит от окружающих, нуждается в уходе.
2. Приспособительная возможность частично ограничена, уменьшается умственная работоспособность.
3. Способность к эффективному приспособлению на прежнем уровне, несмотря на снижение психофизических возможностей (пожилой человек может изменять свое поведение, компенсируя недостаточную умственную деятельность).
4. Пожилые люди не обнаруживают снижения уровня производительности, поскольку задачи не превышают их психических и биологических возможностей. Такой тип приспособления приводит к тому, что некоторые пожилые люди игнорируют негативные последствия старения.
5. Имеется гиперкомпенсация сниженных психофизических возможностей за счет осознания особенностей и степени выраженности возникающих в процессе старения недостатков и своевременного использования таких адекватных профилактических мер, как выполнение физических упражнений, диета, психофизиологический аутотренинг и др.
Имеется гиперкомпенсация сниженных психофизических возможностей за счет осознания особенностей и степени выраженности возникающих в процессе старения недостатков и своевременного использования таких адекватных профилактических мер, как выполнение физических упражнений, диета, психофизиологический аутотренинг и др.
6. Отмечается так называемая невротическая истерика, гиперкомпенсация, снижение психофизических возможностей, проявляющиеся в способе жизни или внешнем виде.
Знание особенностей психики людей пожилого и старческого возраста, понимание механизмов старения должны быть положены в основу подхода семейного врача при организации гериатрической помощи. Порой не столько соматическая патология, сколько неблагоприятные социальные факторы (смена стереотипов в трудовой деятельности) являются причиной того, что пожилой или старый человек чувствует себя больным. Поэтому особенно важно обращать внимание на психический статус пациентов старших возрастных групп. Любая стрессовая ситуация может вызвать у них ряд сдвигов, обусловливающих обострение латентно протекающих патологических процессов и развитие тяжелых состояний. Многие пожилые и старые люди нуждаются, в первую очередь, в устранении одиночества. Одиночество не обязательно сопровождается уединением, оно может ощущаться и в присутствии других людей. Одиночеством является сознание отсутствия общности с другими людьми, сознание того, что ты исключен из системы возможностей, объединяющих других людей. Особенно подвержены чувству одиночества люди, недавно потерявшие супруга и живущие не среди членов семьи.
Многие пожилые и старые люди нуждаются, в первую очередь, в устранении одиночества. Одиночество не обязательно сопровождается уединением, оно может ощущаться и в присутствии других людей. Одиночеством является сознание отсутствия общности с другими людьми, сознание того, что ты исключен из системы возможностей, объединяющих других людей. Особенно подвержены чувству одиночества люди, недавно потерявшие супруга и живущие не среди членов семьи.
Диапазон переживаний стареющего человека с изменением его биологических, социальных возможностей довольно широк, и старение по-разному воспринимается разными людьми. Для одних переход в старость осуществляется гладко, изменения, сопровождающие ее, воспринимаются спокойно. У других могут быть временные психологические сдвиги в ответ на специфические жизненные обстоятельства, но в конечном итоге вновь восстанавливается психологическое равновесие. Психическая симптоматика, требующая профессионального вмешательства, может развиться у людей, которых при наличии узкой адаптации к старости постигли тяжелые несчастья.
Нередко трудно провести четкую границу между часто встречающимися изменениями психики стариков, иногда с заострением отрицательных черт характера, и началом патологии психической сферы. Часто в обыденной жизни пожилой или старый человек, уже проявляющий симптомы сенильных патологических изменений психики, воспринимается окружающими отрицательно, как человек с тяжелым характером, с непонятными чудачествами, постоянно обвиняющий близких ему людей и соседей в попытках нанести ему вред, обокрасть и т. д. Многие семьи изменения в поведении родственника воспринимают как тяжелое проявление старости и считают, что с ними необходимо мириться. Они не всегда обращаются к психиатру своевременно, не желают помещать родственников в стационар для психических больных и стойко переносят изменения в поведении любимого человека. В ряде случаев психиатр осматривает больного на дому и назначает лечение в домашних условиях. Такое положение невозможно при функциональных старческих психозах, однако врачу следует учитывать, что в старческом возрасте увеличивается частота органических психозов, при которых госпитализация в психиатрическое отделение обязательна.
Старые люди по мере снижения их физических возможностей, ослабления психических реакций все чаще ощущают беспомощность при столкновении с жизненными обстоятельствами. Приходит время, когда они не могут справиться с повседневными заботами самостоятельно, становятся зависимыми от других. Это обстоятельство вызывает у многих старых людей чувство бессилия, неполноценности, покинутости, является причиной развития ряда симптомов и синдромов, которые при более выраженных формах требуют консультации психоневролога или психиатра и могут рассматриваться как функциональные нарушения психики. Часто эти нарушения временны и могут исчезнуть после устранения неблагоприятных факторов, о чем необходимо помнить медицинским и социальным работникам, оказывающим помощь старикам. У пожилых и старых людей может возникать ряд состояний, требующих психотерапевтической помощи.
Данный текст является ознакомительным фрагментом.
Продолжение на ЛитРесСтраница не найдена — Саянский медицинский колледж
Я, субъект персональных данных, в соответствии с Федеральным законом от 27 июля 2006 года № 152 «О персональных данных» предоставляю ОГБПОУ «Саянский медицинский колледж» (далее — Оператор), расположенному по адресу Иркутская обл. , г.Саянск, м/он Южный, 120, согласие на обработку персональных данных, указанных мной в форме веб-чата, обратной связи на сайте в сети «Интернет», владельцем которого является Оператор.
, г.Саянск, м/он Южный, 120, согласие на обработку персональных данных, указанных мной в форме веб-чата, обратной связи на сайте в сети «Интернет», владельцем которого является Оператор.
- Состав предоставляемых мной персональных данных является следующим: Имя, адрес электронной почты.
- Целями обработки моих персональных данных являются: обеспечение обмена короткими текстовыми сообщениями в режиме онлайн-диалога или обмена текстовыми сообщениями через электронную почту.
- Согласие предоставляется на совершение следующих действий (операций) с указанными в настоящем согласии персональными данными: сбор, систематизацию, накопление, хранение, уточнение (обновление, изменение), использование, передачу (предоставление, доступ), блокирование, удаление, уничтожение, осуществляемых как с использованием средств автоматизации (автоматизированная обработка), так и без использования таких средств (неавтоматизированная обработка).
- Я понимаю и соглашаюсь с тем, что предоставление Оператору какой-либо информации о себе, не являющейся контактной и не относящейся к целям настоящего согласия, а равно предоставление информации, относящейся к государственной, банковской и/или коммерческой тайне, информации о расовой и/или национальной принадлежности, политических взглядах, религиозных или философских убеждениях, состоянии здоровья, интимной жизни запрещено.

- В случае принятия мной решения о предоставлении Оператору какой-либо информации (каких-либо данных), я обязуюсь предоставлять исключительно достоверную и актуальную информацию и не вправе вводить Оператора в заблуждение в отношении своей личности, сообщать ложную или недостоверную информацию о себе.
- Я понимаю и соглашаюсь с тем, что Оператор не проверяет достоверность персональных данных, предоставляемых мной, и не имеет возможности оценивать мою дееспособность и исходит из того, что я предоставляю достоверные персональные данные и поддерживаю такие данные в актуальном состоянии.
- Согласие действует по достижении целей обработки или в случае утраты необходимости в достижении этих целей, если иное не предусмотрено федеральным законом.
- Согласие может быть отозвано мною в любое время на основании моего письменного заявления.
Процесс старения и возможные вмешательства для увеличения продолжительности жизни
Clin Interv Aging. 2007 сен; 2(3): 401–412.
Опубликовано в Интернете в сентябре 2007 г.
Маттео Тосато
1 Кафедра геронтологии, гериатрии и физиатрии; Католический университет Святого Сердца, Рим, Италия;
Валентина Замбони
1 Кафедра геронтологии, гериатрии и физиатрии; Католический университет Святого Сердца, Рим, Италия;
Алессандро Феррини
1 Кафедра геронтологии, гериатрии и физиатрии; Католический университет Святого Сердца, Рим, Италия;
Маттео Чезари
1 Кафедра геронтологии, гериатрии и физиатрии; Католический университет Святого Сердца, Рим, Италия;
2 Кафедра старения и гериатрических исследований, Медицинский колледж, Институт старения, Университет Флориды, Гейнсвилл, Флорида, США
1 Кафедра геронтологии, гериатрии и физиатрии; Католический университет Святого Сердца, Рим, Италия;
2 Департамент старения и гериатрических исследований, Медицинский колледж, Институт старения, Университет Флориды, Гейнсвилл, Флорида, США
Для переписки: Маттео Чезари, Департамент геронтологии, гериатрии и физиатрии; Католический университет Святого Сердца; Ларго Ф. Вито, 1; 00186 Рим, Италия, тел. +39 06 3015 4341, факс +39 06 3051-911, электронная почта
ti.ttacinu.mr@irasec_oettam Авторские права © 2007 Dove Medical Press Limited. Все права защищены. Эта статья цитировалась в других статьях PMC.
Вито, 1; 00186 Рим, Италия, тел. +39 06 3015 4341, факс +39 06 3051-911, электронная почта
ti.ttacinu.mr@irasec_oettam Авторские права © 2007 Dove Medical Press Limited. Все права защищены. Эта статья цитировалась в других статьях PMC.Abstract
Старение обычно определяется как накопление разнообразных вредных изменений, происходящих в клетках и тканях с возрастом, которые ответственны за повышенный риск заболевания и смерти. Все основные теории старения касаются конкретной причины старения, обеспечивая полезную и важную информацию для понимания физиологических изменений, связанных с возрастом.Однако их глобальный взгляд необходим при обсуждении процесса, который в некоторых своих аспектах все еще остается неясным. В этом контексте поиск единственной причины старения в последнее время уступил место взгляду на старение как на чрезвычайно сложный многофакторный процесс. Поэтому разные теории старения следует рассматривать не как взаимоисключающие, а как дополняющие друг друга в объяснении некоторых или всех особенностей нормального процесса старения. На сегодняшний день нет убедительных доказательств того, что введение существующих «омолаживающих» средств может замедлить старение или увеличить продолжительность жизни человека.Тем не менее, несколько исследований на животных моделях показали, что темпы старения и ожидаемая продолжительность жизни могут быть изменены. В настоящем обзоре представлен обзор наиболее общепринятых теорий старения, приводятся современные доказательства тех вмешательств, направленных на изменение процесса старения.
На сегодняшний день нет убедительных доказательств того, что введение существующих «омолаживающих» средств может замедлить старение или увеличить продолжительность жизни человека.Тем не менее, несколько исследований на животных моделях показали, что темпы старения и ожидаемая продолжительность жизни могут быть изменены. В настоящем обзоре представлен обзор наиболее общепринятых теорий старения, приводятся современные доказательства тех вмешательств, направленных на изменение процесса старения.
Ключевые слова: Старение, антивозрастная медицина, ограничение калорийности, окислительное повреждение, воспаление, физические упражнения для повышенного риска заболевания и смерти ( Harman 2003 ).Наблюдение, что большинство животных, живущих в естественной среде, редко стареют (поскольку умирают раньше от хищников, болезней, голода или засухи) ( Holliday 2006 ), предполагает, что старение — явление, уникальное для человеческого вида ( Hayflick 2000b). ). Другими словами, развитие знаний в области гигиены и биомедицины привело нас к открытию процесса старения, что телеологически не предназначалось для нас ( Hayflick 2000b ).Непосредственным следствием увеличения продолжительности жизни является увеличение числа пожилых людей в развитых странах, артефакт человеческой цивилизации ( Hayflick 1998 , 2000a ).
). Другими словами, развитие знаний в области гигиены и биомедицины привело нас к открытию процесса старения, что телеологически не предназначалось для нас ( Hayflick 2000b ).Непосредственным следствием увеличения продолжительности жизни является увеличение числа пожилых людей в развитых странах, артефакт человеческой цивилизации ( Hayflick 1998 , 2000a ).
Ожидаемая продолжительность жизни определяется как среднее общее количество лет, которые человек рассчитывает прожить. Иными словами, продолжительность жизни – это максимальное количество лет, которое может прожить человек. В то время как продолжительность жизни человека практически не изменилась за последние 100 000 лет и составила ~125 лет, ожидаемая продолжительность жизни заметно увеличилась (~27 лет за последнее столетие), особенно в западных странах ( Hayflick 2000b ).Увеличение продолжительности жизни в основном связано с элиминацией большинства инфекционных заболеваний, возникающих в молодости, улучшением гигиены, внедрением антибиотиков и вакцин.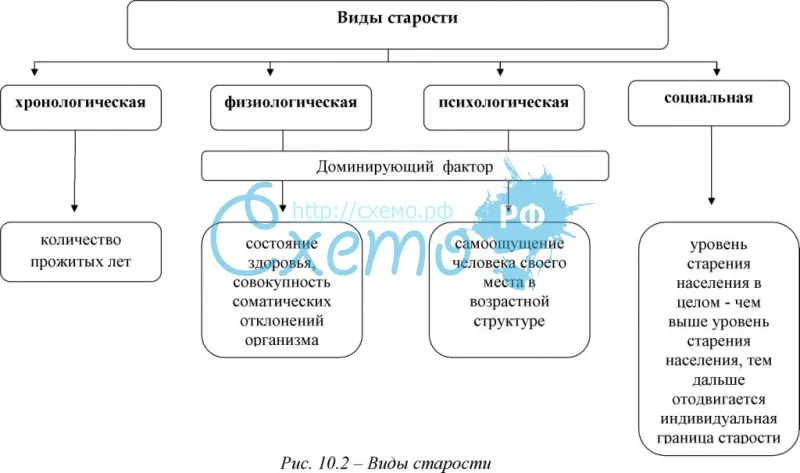
Перед рассмотрением предполагаемых биологических факторов, лежащих в основе процесса старения, важно подчеркнуть, что старение не является болезнью. Основываясь на этом предположении, Хейфлик оценивает, что потенциальное устранение основных причин смерти в пожилом возрасте (т. е. сердечно-сосудистых заболеваний, инсульта, рака) приведет только к увеличению продолжительности жизни человека на 15 лет (, Hayflick, 2000b, ).Следовательно, даже в этом гипотетическом состоянии мы не станем бессмертными, а сможем лишь испытать, как наступает смерть при отсутствии болезни. Поскольку старение отрицательно связано со способностью реагировать на стресс и положительно связано с гомеостатическим балансом и частотой патологий, смерть остается конечным последствием старения (, Kowald and Kirkwood, 1996, ).
Представление о том, что старение требует лечения, основано на убеждении, что стареть нежелательно.В последние десятилетия старение получило негативную окраску и стало синонимом ухудшения, приближающейся патологии и смерти. Если бы наше общество научилось ценить старость так же, как в настоящее время это делается для молодежи, то исследования, направленные на замедление, остановку или обращение вспять процесса старения, были бы столь же немыслимы, как и вмешательство в процессы развития молодежи. Вместо этого желательно и доказуемо достижимо во все времена жизни предотвращение или устранение патологии ( Hayflick 2004 ).
Если бы наше общество научилось ценить старость так же, как в настоящее время это делается для молодежи, то исследования, направленные на замедление, остановку или обращение вспять процесса старения, были бы столь же немыслимы, как и вмешательство в процессы развития молодежи. Вместо этого желательно и доказуемо достижимо во все времена жизни предотвращение или устранение патологии ( Hayflick 2004 ).
Основные теории старения (например, свободнорадикальная теория ( Harman 2003 ), иммунологическая теория ( Franceschi et al 2000a ), теория воспаления ( Chung et al 2001 ), митохондриальная теория ( Cadenas и Davies 2000 )) специфичны для конкретной причины старения, обеспечивая полезную и важную информацию для понимания физиологических изменений, происходящих при старении. Однако их глобальный взгляд необходим при обсуждении процесса, который до сих пор неясен в некоторых своих аспектах ( Holliday 2006 ).В этом контексте поиск единственной причины старения (например, одного гена или упадка системы организма) недавно был заменен взглядом на старение как на чрезвычайно сложный многофакторный процесс ( Kowald and Kirkwood 1996 Weinert and Timiras 2003 ). На самом деле весьма вероятно, что несколько процессов одновременно взаимодействуют и действуют на разных уровнях функциональной организации ( Franceschi et al 2000b ). Следовательно, различные теории старения не следует рассматривать как взаимоисключающие, а могут дополнять другие для объяснения некоторых или всех особенностей нормального процесса старения ( Weinert and Timiras 2003 ).
На самом деле весьма вероятно, что несколько процессов одновременно взаимодействуют и действуют на разных уровнях функциональной организации ( Franceschi et al 2000b ). Следовательно, различные теории старения не следует рассматривать как взаимоисключающие, а могут дополнять другие для объяснения некоторых или всех особенностей нормального процесса старения ( Weinert and Timiras 2003 ).
На протяжении всей истории люди всегда мечтали излечить старение и болезни в поисках «источника молодости». Эта мечта так и не стала реальностью из-за сложного понимания процесса старения. Любое вмешательство, способное отсрочить развитие возрастных изменений, не считающихся заболеваниями, обозначается термином «антивозрастная медицина» ( Butler et al 2002 ). На сегодняшний день мы не знаем ни одного вмешательства, которое замедлит, остановит или повернет вспять процесс старения у людей.Также сомнительно, что вмешательство в процесс старения было достигнуто в какой-либо другой форме жизни ввиду отсутствия общепринятого определения старения и прек-маркеров для измерения скорости его изменений ( Hayflick 2004 ). Тем не менее, несколько исследований на животных моделях показали, что темпы старения и ожидаемая продолжительность жизни могут быть изменены.
Тем не менее, несколько исследований на животных моделях показали, что темпы старения и ожидаемая продолжительность жизни могут быть изменены.
Эволюционная теория старения
Эволюционная теория указывает на старение как результат снижения силы естественного отбора.Эта теория была впервые широко сформулирована в сороковых годах в результате наблюдения за пациентами с болезнью Гентингтона, доминантной летальной мутацией ( Haldane 1941 ). Было отмечено, что даже при тщательном отборе субъектов, страдающих этим заболеванием, болезнь Гентингтона остается в популяции. Это отсутствие естественного отбора можно объяснить поздним возрастом начала заболевания (30–40 лет), что позволяет носителю размножаться до смерти.
Еще раньше, чем эти наблюдения, Дарвин объяснил, что естественный отбор происходит в организмах, умирающих в первую очередь от хищничества и опасностей окружающей среды и, следовательно, развивающих продолжительность жизни, оптимизированную для их собственной конкретной среды ( Weinert and Timiras 2003 ). Подтверждением этой гипотезы являются данные о том, что животные, живущие в защищенной среде (например, в зоопарке), живут дольше, потенциально достигая максимальной продолжительности жизни ( Holliday 2006 ). Например, эта теория была подтверждена Аустадом в естественной среде путем сравнения материковых опоссумов, подверженных хищничеству, с популяцией опоссумов, живущих на острове, свободном от хищников ( Austad 1993 ). Эволюционная теория предсказывает, что у охраняемых островных опоссумов была бы возможность увеличить продолжительность жизни, если бы это было полезно для их приспособленности.Действительно, островные опоссумы жили дольше и старели медленнее, чем их материковые собратья. Однако так называемая «теория старения одноразовой сомы» утверждает, что соматический организм эффективно поддерживается только для репродуктивного успеха; потом он одноразовый. Следовательно, соматическое поддержание (другими словами, долголетие) имеет свою цену. Равновесие между ресурсами, вложенными в долголетие, и ресурсами, вкладываемыми в репродуктивную способность, определяет продолжительность жизни (, Loison et al.
Подтверждением этой гипотезы являются данные о том, что животные, живущие в защищенной среде (например, в зоопарке), живут дольше, потенциально достигая максимальной продолжительности жизни ( Holliday 2006 ). Например, эта теория была подтверждена Аустадом в естественной среде путем сравнения материковых опоссумов, подверженных хищничеству, с популяцией опоссумов, живущих на острове, свободном от хищников ( Austad 1993 ). Эволюционная теория предсказывает, что у охраняемых островных опоссумов была бы возможность увеличить продолжительность жизни, если бы это было полезно для их приспособленности.Действительно, островные опоссумы жили дольше и старели медленнее, чем их материковые собратья. Однако так называемая «теория старения одноразовой сомы» утверждает, что соматический организм эффективно поддерживается только для репродуктивного успеха; потом он одноразовый. Следовательно, соматическое поддержание (другими словами, долголетие) имеет свою цену. Равновесие между ресурсами, вложенными в долголетие, и ресурсами, вкладываемыми в репродуктивную способность, определяет продолжительность жизни (, Loison et al. , 1999, ). Этот антагонизм между репродукцией и долголетием подтверждается экспериментами, в которых ограничение репродукции путем разрушения клеток зародышевой линии может увеличить продолжительность жизни как у Drosophila , так и у Caenorhabditis elegans .
, 1999, ). Этот антагонизм между репродукцией и долголетием подтверждается экспериментами, в которых ограничение репродукции путем разрушения клеток зародышевой линии может увеличить продолжительность жизни как у Drosophila , так и у Caenorhabditis elegans .
Свободнорадикальная теория старения
Для объяснения процесса старения было предложено более 300 теорий ( Medvedev 1990 ), но ни одна из них до сих пор не получила всеобщего признания геронтологов. Тем не менее, свободнорадикальная теория старения, по-видимому, получила самое широкое признание в качестве правдоподобного объяснения первичных химических реакций, лежащих в основе процесса старения ( De La Fuente 2002 ).
Свободнорадикальная теория старения была впервые сформулирована в 50-х годах Харманом, который выдвинул гипотезу единого общего процесса, модифицируемого генетическими факторами и факторами окружающей среды, при котором накопление эндогенных кислородных радикалов, генерируемых в клетках, может быть ответственным за старение и гибель клеток. все живые существа ( Harman 1957 ; Finkel and Holbrook 2000 ).Затем эта теория была пересмотрена в 1972 году ( Harman 1972 ), когда было установлено, что митохондрии ответственны за инициирование большинства свободнорадикальных реакций, связанных с процессом старения. Было также постулировано, что продолжительность жизни определяется скоростью повреждения митохондрий свободными радикалами.
все живые существа ( Harman 1957 ; Finkel and Holbrook 2000 ).Затем эта теория была пересмотрена в 1972 году ( Harman 1972 ), когда было установлено, что митохондрии ответственны за инициирование большинства свободнорадикальных реакций, связанных с процессом старения. Было также постулировано, что продолжительность жизни определяется скоростью повреждения митохондрий свободными радикалами.
Нарастающий возрастной окислительный стресс, по-видимому, является следствием дисбаланса между образованием свободных радикалов и антиоксидантной защитой с более высоким производством первых ( Sastre et al 2000 ).
Все организмы живут в среде, содержащей активные формы кислорода. Митохондриальное дыхание, основа производства энергии у всех эукариот, генерирует активные формы кислорода путем утечки промежуточных продуктов из цепи переноса электронов (, Финкель и Холбрук, 2000, ). Универсальная природа окислительных свободных радикалов и, возможно, свободнорадикальной теории старения подтверждается наличием супероксиддисмутазы во всех аэробных организмах, ответственной за удаление супероксидных анионов (, Финкель и Холбрук, 2000, ). Более того, клеточное окислительное повреждение носит неизбирательный характер. На самом деле было показано, что окислительные модификации происходят в молекулах ДНК, белков и липидов ( Weinert and Timiras 2003 ). В стареющих организмах были обнаружены повышенные уровни поврежденной окислителями ДНК и белка (, Beckman and Ames, 1998, , ; , , Shringarpure and Davies, 2002, ).
Более того, клеточное окислительное повреждение носит неизбирательный характер. На самом деле было показано, что окислительные модификации происходят в молекулах ДНК, белков и липидов ( Weinert and Timiras 2003 ). В стареющих организмах были обнаружены повышенные уровни поврежденной окислителями ДНК и белка (, Beckman and Ames, 1998, , ; , , Shringarpure and Davies, 2002, ).
Однако, даже если ясно, что возрастное накопление окислительного повреждения, еще не ясно, способствует ли этот процесс старению во всех организмах.Увеличение продолжительности жизни трансгенных мух, экспрессирующих супероксиддисмутазу, указывает на то, что ферментов, поглощающих свободные радикалы, достаточно для замедления старения у Drosophila ( Tower 2000 ). Кроме того, мухи, отобранные для увеличения продолжительности жизни, имеют повышенный уровень супероксиддисмутазы и повышенную устойчивость к окислительному стрессу ( Arking et al 2000 ). Также было продемонстрировано, что долгоживущие мутантные черви также устойчивы к окислительному стрессу и демонстрируют возрастное увеличение активности супероксиддисмутазы и каталазы ( Larsen 1993 ).Увеличение продолжительности жизни в моделях Caenorhabditis elegans с использованием синтетических молекул, имитирующих каталазу и/или супероксиддисмутазу, демонстрирует, что антиоксидантные соединения могут играть важную роль в замедлении старения ( Melov et al 2000 ).
Также было продемонстрировано, что долгоживущие мутантные черви также устойчивы к окислительному стрессу и демонстрируют возрастное увеличение активности супероксиддисмутазы и каталазы ( Larsen 1993 ).Увеличение продолжительности жизни в моделях Caenorhabditis elegans с использованием синтетических молекул, имитирующих каталазу и/или супероксиддисмутазу, демонстрирует, что антиоксидантные соединения могут играть важную роль в замедлении старения ( Melov et al 2000 ).
Свободнорадикальная теория старения делится на несколько гипотез, акцентирующих внимание на исключительной роли определенных органелл и типов поврежденных молекул в процессе старения ( Weinert and Timiras 2003 ). Например, было высказано предположение, что мутации в митохондриальной ДНК ускоряют повреждение свободными радикалами, вводя измененные компоненты фермента в цепь переноса электронов.Неправильный перенос электронов, следовательно, приводит к повышенной утечке свободных радикалов и, в конечном итоге, к увеличению количества мутаций митохондриальной ДНК и усилению производства оксидантов. Этот «порочный круг» мутаций и производства оксидантов может в конечном итоге привести к клеточной/органной недостаточности и старению ( Mandavilli et al 2002 ). Другая гипотеза утверждает, что свободные радикалы вызывают старение из-за накопления окисленных белков в клетках. Зависимое от возраста снижение способности к деградации окисленных белков может быть причиной накопления поврежденных, дисфункциональных молекул в клетке ( Shringarpure and Davies 2002 ).
Этот «порочный круг» мутаций и производства оксидантов может в конечном итоге привести к клеточной/органной недостаточности и старению ( Mandavilli et al 2002 ). Другая гипотеза утверждает, что свободные радикалы вызывают старение из-за накопления окисленных белков в клетках. Зависимое от возраста снижение способности к деградации окисленных белков может быть причиной накопления поврежденных, дисфункциональных молекул в клетке ( Shringarpure and Davies 2002 ).
Было высказано предположение, что окислительное повреждение может быть важным источником соматических мутаций на основе так называемой «теории старения соматических мутаций». Эта теория предполагает, что накопление генетических мутаций в соматических клетках представляет собой специфическую причину старения (, Beckman and Ames, 1998, ).
Идентификация свободнорадикальных реакций как стимуляторов процесса старения подразумевает, что вмешательства, направленные на их ограничение или торможение, должны быть способны снизить скорость формирования возрастных изменений с последующим снижением скорости старения и патогенеза заболевания ( Harman 2003 ). Был описан идеальный «золотой треугольник» окислительного баланса, в каждой вершине которого расположены оксиданты, антиоксиданты и биомолекулы ( Carmeli et al 2002 ). В нормальной ситуации между этими тремя элементами существует уравновешенное равновесие. Избыточное образование свободных радикалов может подавлять естественную клеточную антиоксидантную защиту, что приводит к перекисному окислению липидов и дальнейшему повреждению мышц ( Bowles et al 1991 ; Meydani et al 1993 ).
Был описан идеальный «золотой треугольник» окислительного баланса, в каждой вершине которого расположены оксиданты, антиоксиданты и биомолекулы ( Carmeli et al 2002 ). В нормальной ситуации между этими тремя элементами существует уравновешенное равновесие. Избыточное образование свободных радикалов может подавлять естественную клеточную антиоксидантную защиту, что приводит к перекисному окислению липидов и дальнейшему повреждению мышц ( Bowles et al 1991 ; Meydani et al 1993 ).
Даже несмотря на то, что антиоксидантные добавки привлекают все большее внимание и все чаще применяются в западных странах, подтверждающие данные по-прежнему скудны и неоднозначны. На самом деле, даже если некоторые эпидемиологические исследования показали, что пищевые добавки с витамином Е снижают риск рака и сердечно-сосудистых заболеваний, такие наблюдения не являются универсальными (, Батлер и др., 2002, ). Единственная возможность уменьшить окислительное повреждение за счет добавления антиоксидантов ограничена. McCall and Frei (1999) заявили, что «за исключением дополнительного витамина Е и, возможно, витамина С, которые способны значительно снизить окислительное повреждение липидов как у курильщиков, так и у некурящих, текущих данных недостаточно, чтобы сделать вывод о том, что антиоксидантные витаминные добавки существенно снижают окислительные поражения человека». Таким образом, продлевающий жизнь потенциал антиоксидантных добавок (в частности, витамина Е как наиболее изученного) остается неопределенным даже в исследованиях на животных ( Анисимов 2001 ).Единственный достоверный вывод о том, что фармакологический антиоксидант может увеличить продолжительность жизни, был сделан Меловым и его коллегами (2000) на животной модели, демонстрирующей, что EUK-134, соединение, обладающее как каталазной, так и супероксиддисмутазной активностью, значительно увеличивает продолжительность жизни нематод.
McCall and Frei (1999) заявили, что «за исключением дополнительного витамина Е и, возможно, витамина С, которые способны значительно снизить окислительное повреждение липидов как у курильщиков, так и у некурящих, текущих данных недостаточно, чтобы сделать вывод о том, что антиоксидантные витаминные добавки существенно снижают окислительные поражения человека». Таким образом, продлевающий жизнь потенциал антиоксидантных добавок (в частности, витамина Е как наиболее изученного) остается неопределенным даже в исследованиях на животных ( Анисимов 2001 ).Единственный достоверный вывод о том, что фармакологический антиоксидант может увеличить продолжительность жизни, был сделан Меловым и его коллегами (2000) на животной модели, демонстрирующей, что EUK-134, соединение, обладающее как каталазной, так и супероксиддисмутазной активностью, значительно увеличивает продолжительность жизни нематод.
Митохондриальная теория старения
Возрастное физиологическое снижение, по-видимому, связано с накоплением дефектов в нескольких метаболических путях. При поиске потенциальных кандидатов на прогрессирующее накопление повреждений в течение жизни представляется целесообразным исключить РНК, белки и другие клеточные макромолекулы с быстрым оборотом.По этой главной причине исследования механизмов старения всегда были сосредоточены на ДНК. В клетках млекопитающих митохондрии и ядро являются единственными органеллами, обладающими ДНК. Представляется очевидным, что физиологическая целостность клетки тесно связана с целостностью ее генома.
При поиске потенциальных кандидатов на прогрессирующее накопление повреждений в течение жизни представляется целесообразным исключить РНК, белки и другие клеточные макромолекулы с быстрым оборотом.По этой главной причине исследования механизмов старения всегда были сосредоточены на ДНК. В клетках млекопитающих митохондрии и ядро являются единственными органеллами, обладающими ДНК. Представляется очевидным, что физиологическая целостность клетки тесно связана с целостностью ее генома.
Даже если митохондриальная ДНК составляет всего 1-3% генетического материала в клетках животных, ее вклад в клеточную физиологию, по-видимому, намного больше, чем можно было бы ожидать, исходя только из ее размера. Митохондриальная ДНК, находящаяся в непосредственной близости от мест образования кислородных радикалов и незащищенная гистонами, связанными с ядерной ДНК, является чувствительной мишенью для атаки кислородных радикалов.На самом деле было подсчитано, что уровень окислительно окисленных оснований в митохондриальной ДНК в 10-20 раз выше, чем в ядерной ДНК ( Richter et al 1988 ; Ames 1989 ). Кроме того, митохондриальная ДНК кодирует полипептиды цепи переноса электронов, а также компоненты, необходимые для их синтеза. Следовательно, любые кодирующие мутации в митохондриальной ДНК будут влиять на всю цепь переноса электронов, потенциально изменяя как сборку, так и функцию продуктов многочисленных ядерных генов в комплексах цепи переноса электронов.Наконец, дефекты в цепи переноса электронов могут иметь плейотропные эффекты, поскольку влияют на всю клеточную энергетику ( Алексеев и др. 2004 ).
Кроме того, митохондриальная ДНК кодирует полипептиды цепи переноса электронов, а также компоненты, необходимые для их синтеза. Следовательно, любые кодирующие мутации в митохондриальной ДНК будут влиять на всю цепь переноса электронов, потенциально изменяя как сборку, так и функцию продуктов многочисленных ядерных генов в комплексах цепи переноса электронов.Наконец, дефекты в цепи переноса электронов могут иметь плейотропные эффекты, поскольку влияют на всю клеточную энергетику ( Алексеев и др. 2004 ).
Фрамингемское исследование долголетия ишемической болезни сердца показало, что продолжительность жизни более тесно связана с возрастом материнской смерти, чем с возрастом отцовской смерти, что позволяет предположить, что наследование митохондриальной ДНК может играть важную роль в определении продолжительности жизни ( Brand et al. 1992 ). Даже если этот вопрос все еще остается спорным ( Ross et al 2001 ), несколько исследований показывают, что долголетие связано со специфическими полиморфизмами митохондриальной ДНК ( Ivanova et al 1998 ; Tanaka et al 1998
1; и др.
 1999 ).
1999 ). Митохондриальная теория старения часто рассматривается как расширение и уточнение теории свободных радикалов ( Harman 1972 ; Miquel et al 1980 ). Мутации митохондриальной ДНК постепенно накапливаются в течение жизни и напрямую ответственны за измеримый дефицит активности клеточного окислительного фосфорилирования, что приводит к усиленному производству активных форм кислорода. Это последнее приводит к повышенной скорости повреждения митохондриальной ДНК и мутагенеза, запуская начало «порочного круга» экспоненциально нарастающего окислительного повреждения и дисфункции, что в конечном итоге приводит к смерти.Подтверждая первостепенное значение митохондрий в процессе старения и в определении продолжительности жизни, было задокументировано, что некоторые мутагенные химические вещества и липофильные канцерогены (например, полициклические ароматические углеводороды) имеют тенденцию преимущественно повреждать митохондриальную ДНК ( Wunderlich et al 1970 ; ). Allen and Coombs 1980 ; Niranjan et al. 1982 ; Rossi et al. 1988 ). Затем можно предположить, что пожизненное воздействие этих токсинов окружающей среды может привести к предпочтительному накоплению повреждений митохондриальной ДНК и ускорению старения.
Allen and Coombs 1980 ; Niranjan et al. 1982 ; Rossi et al. 1988 ). Затем можно предположить, что пожизненное воздействие этих токсинов окружающей среды может привести к предпочтительному накоплению повреждений митохондриальной ДНК и ускорению старения.
Супероксидный анион-радикал (или супероксид) и перекись водорода, соответственно продукты одновалентного и двухвалентного восстановления кислорода, образуются в ходе нормального аэробного метаболизма и представляют собой физиологические внутриклеточные метаболиты ( Cadenas and Davies 2000 ). Несколько реакций в биологических системах вносят вклад в стационарные концентрации супероксида и перекиси водорода, хотя митохондрии, по-видимому, являются наиболее важным источником в количественном отношении ( Cadenas and Davies 2000 ).
Несмотря на то, что легкое окислительное повреждение, такое как во время тренировки ( Davies et al 1982 ), может фактически быть стимулом для физиологического митохондриального биогенеза, более серьезное, более обширное или более продолжительное окислительное повреждение явно токсично ( Cadenas и Дэвис 2000 ).
Теория регуляции генов старения
Теория регуляции генов старения предполагает, что старение является результатом изменений, происходящих в экспрессии генов ( Kanungo 1975 ; Weinert and Timiras 2003 ).Хотя ясно, что экспрессия многих генов меняется с возрастом, маловероятно, что отбор мог действовать непосредственно на гены, которые способствуют старению ( Weinert and Timiras 2003 ). На сегодняшний день данные в этой области остаются противоречивыми, и старение следует более безопасно рассматривать как стохастический процесс, а не как запрограммированный механизм, непосредственно управляемый генами. Было продемонстрировано не менее 15 различных генетических манипуляций, вызывающих продление жизни у таких организмов, как дрожжи, плодовые мушки, нематоды и мыши (, Батлер и др., 2002, ).Однако до сих пор неизвестно, как белки, кодируемые этими генами, участвуют в регуляции долголетия. С другой стороны, другие исследования, проведенные с использованием животных моделей, показали, что гены, предположительно участвующие в старении, не способны обратить вспять или остановить неумолимое проявление молекулярного беспорядка, который является отличительной чертой старения ( Hayflick 2004 ).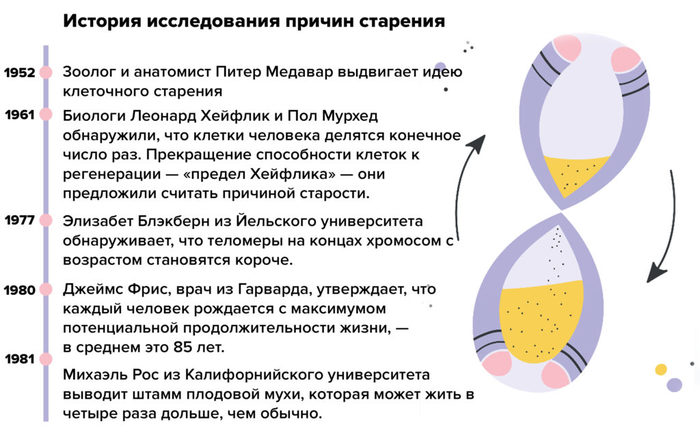
Возможно, геном необходим для управления биологическим развитием и поддержанием, но не является причиной старения животного.Поскольку гены не управляют процессом старения, понимание человеческого генома, даже сверх того, что известно сегодня, не даст понимания процесса, который является случайным и термодинамически обусловленным ( Hayflick 2004 ). Недавно был идентифицирован инсулиноподобный сигнальный путь, регулирующий продолжительность жизни червей, мух и мышей (, Татар и др., 2003, ). Увеличение продолжительности жизни происходит в результате активации консервативного фактора транскрипции в ответ на снижение инсулиноподобной передачи сигналов, что позволяет предположить, что экспрессия генов может регулировать продолжительность жизни.
Исследования столетних людей и их родственников выявили важный генетический аспект способности доживать до исключительного возраста. Идентификация локуса на хромосоме 4, который может содержать ген(ы), способствующий долголетию ( Puca et al 2001 ), недавно подтвердила теорию о генетическом компоненте исключительного долголетия.
Если будет подтверждено, что изменения в экспрессии генов могут модулировать процесс старения, будет сделан важный шаг вперед в понимании старения и будет создана отправная точка для разработки вмешательств, направленных на замедление старения.
Генные манипуляции, возможные на лабораторных животных, по-видимому, имеют ограниченный потенциал для прямого применения на людях, хотя они позволяют получить представление о важных биологических факторах при определении продолжительности жизни в модельных системах. Напротив, потенциал заместительной клеточной терапии в устранении некоторых неблагоприятных последствий старения представляется значительным. Старение сопровождается некоторой потерей функции ткани, что, по крайней мере, частично связано либо с возрастной потерей клеток из ткани, либо с увеличением доли дисфункциональных клеток.
Недавнее выделение почти тотипотентных клеток, таких как эмбриональные стволовые клетки человека, открывает широкий спектр потенциальных возможностей. Эти клетки экспрессируют теломеразу и, по-видимому, сохраняют бессмертный фенотип даже после длительного культивирования in vitro. Клетки и ткани, полученные из таких культур, могут обеспечить уникальное преимущество, заключающееся в том, что они обладают большой способностью к репликации и широким потенциалом дифференцировки.
Эти клетки экспрессируют теломеразу и, по-видимому, сохраняют бессмертный фенотип даже после длительного культивирования in vitro. Клетки и ткани, полученные из таких культур, могут обеспечить уникальное преимущество, заключающееся в том, что они обладают большой способностью к репликации и широким потенциалом дифференцировки.
Однако важно отметить, что огромные препятствия еще предстоит преодолеть.Клетки, полученные из установленных линий эмбриональных стволовых клеток человека, вероятно, не окажутся иммунологически совместимыми с большинством пациентов. Это может быть решено иммуносупрессивной терапией, генетической модификацией клеток для снижения иммуногенности или, возможно, созданием химерной иммунной системы у пациента для индукции толерантности. Недавнее открытие перепрограммирования клеток посредством переноса ядра предлагает путь к перепрограммированию клетки пациента, тем самым превращая ее в аутологичную эмбриональную стволовую клетку.Этика технологии эмбриональных стволовых клеток и использования переноса ядер в медицине в настоящее время является предметом интенсивных дискуссий. Наконец, еще предстоит увидеть, будет ли такая новая ткань (даже если бы она была аутологичной) адекватно васкуляризирована и впоследствии функционировала бы надлежащим образом у пациента.
Наконец, еще предстоит увидеть, будет ли такая новая ткань (даже если бы она была аутологичной) адекватно васкуляризирована и впоследствии функционировала бы надлежащим образом у пациента.
Теломерная теория старения
Теория клеточного старения была сформулирована в 1965 году, когда клеточное старение было описано как процесс, происходящий в нормальных клетках человека в культуре и характеризующийся ограниченным числом клеточных делений ( Hayflick 1965 ).Этот предел «репликативной способности» возникает после характерного числа клеточных делений и приводит к окончательной остановке клеток с измененной физиологией ( Campisi 2003 ).
Теломеры представляют собой специализированные последовательности ДНК, расположенные на концах эукариотических хромосом. У человека теломеры состоят из повторяющихся последовательностей TTAGGG, повторяющихся в тандеме до 15 килобаз при рождении ( Ahmed and Tollefsbol 2001 ). Теломеры синтезируются теломеразой, ферментом обратной транскриптазы рибонуклеопротеина, который поддерживает длину хромосом ( Lingner et al 1997 ). Последовательности теломер стабилизируют хромосомные концы, связываясь с белками, которые предотвращают их распознавание как двухцепочечные разрывы ферментами репарации ( de Lange 1992 ). Истощение хромосомных концов, вызванное потерей теломеразы, может привести к разрывам и последующей транслокации, слиянию или перестройке внутри этих участков ДНК ( de Lange 1992 ).
Последовательности теломер стабилизируют хромосомные концы, связываясь с белками, которые предотвращают их распознавание как двухцепочечные разрывы ферментами репарации ( de Lange 1992 ). Истощение хромосомных концов, вызванное потерей теломеразы, может привести к разрывам и последующей транслокации, слиянию или перестройке внутри этих участков ДНК ( de Lange 1992 ).
Фермент теломераза, который стабилизирует окончания хромосом путем добавления повторов теломер к концам хромосом с использованием специальной матрицы РНК ( Greider and Blackburn 1989 ; Artandi 2006 ), представляет значительный интерес для геронтологов.Считается, что его экспрессия необходима для иммортализации клеток ( Rhyu 1995 ), а его отсутствие может лежать в основе клеточного старения ( Harley et al 1990 ; Ahmed and Tollefsbol 2001 6; 9 Artandi). ). Бессмертные клетки в целом имеют стабильную длину теломер, а смертные клетки имеют теломеры, которые укорачиваются при каждом клеточном делении, что устанавливает связь между присутствием теломеразы, стабильностью хромосом и гибелью клеток. Фактически, специализированные бессмертные типы клеток (такие как стволовые клетки, зародышевые клетки и Т-лимфоциты) экспрессируют теломеразу и будут либо поддерживать длину теломер, либо замедлять их изнашивание. Кроме того, активность теломеразы активируется в 85-95% раковых клеток, в которых нет чистой потери средней длины теломер, что позволяет предположить, что стабильность теломер может быть необходима клеткам, чтобы избежать репликативного старения и пролиферировать бесконечно ( Shay and Wright 1996). ; Artandi 2006 ).
Фактически, специализированные бессмертные типы клеток (такие как стволовые клетки, зародышевые клетки и Т-лимфоциты) экспрессируют теломеразу и будут либо поддерживать длину теломер, либо замедлять их изнашивание. Кроме того, активность теломеразы активируется в 85-95% раковых клеток, в которых нет чистой потери средней длины теломер, что позволяет предположить, что стабильность теломер может быть необходима клеткам, чтобы избежать репликативного старения и пролиферировать бесконечно ( Shay and Wright 1996). ; Artandi 2006 ).
В активно делящихся дифференцированных клетках при каждом клеточном делении обязательно теряется небольшое количество ДНК на каждом конце хромосомы, что приводит к укорочению теломер и изменению структуры теломер, что в конечном итоге приводит к прекращению клеточной пролиферации ( Blackburn 2000 ; Weinert and Timiras 2003 ). Это прогрессивное укорочение теломер начинается вскоре после зачатия, когда клетки начинают широко дифференцироваться. Хотя в некоторых из этих клеток теломераза инактивирована до рождения, в других некоторая активность теломеразы может быть обнаружена после рождения (, Ulaner and Giudice, 1997, , ; , , Ahmed and Tollefsbol, 2001, ).Таким образом, укорочение теломер и потеря теломеразы в нормальных соматических клетках рассматриваются как потенциальные молекулярные часы, запускающие клеточное старение (, Harley et al., 1990, ), потерю пролиферативной способности и возрастные патологии ( Campisi, 1997, , ; Fossel 1998 ).
Хотя в некоторых из этих клеток теломераза инактивирована до рождения, в других некоторая активность теломеразы может быть обнаружена после рождения (, Ulaner and Giudice, 1997, , ; , , Ahmed and Tollefsbol, 2001, ).Таким образом, укорочение теломер и потеря теломеразы в нормальных соматических клетках рассматриваются как потенциальные молекулярные часы, запускающие клеточное старение (, Harley et al., 1990, ), потерю пролиферативной способности и возрастные патологии ( Campisi, 1997, , ; Fossel 1998 ).
Обнаружение того, что большинство клеток, экспрессирующих теломеразу, вместо того, чтобы подвергаться клеточному старению, сохраняют молодое состояние и неограниченно размножаются, открыло новые области исследований для потенциального «антивозрастного» вмешательства ( Bodnar et al 1998 ; Вазири и Бенчимол 1998 ).Клетки, снабженные экзогенным источником теломеразы, сохраняют молодость и неограниченно размножаются (, Bodnar et al. , 1998, ). Эти «омоложенные» клетки не только бессмертны, но и демонстрируют обратное старение (такие как повышенная ломкость и субэпидермальное образование пузырей) ( Funk et al 2000 ). Таким образом, биологические и потенциальные медицинские последствия экспрессии теломеразы кажутся весьма значительными.
, 1998, ). Эти «омоложенные» клетки не только бессмертны, но и демонстрируют обратное старение (такие как повышенная ломкость и субэпидермальное образование пузырей) ( Funk et al 2000 ). Таким образом, биологические и потенциальные медицинские последствия экспрессии теломеразы кажутся весьма значительными.
Подтверждая предполагаемую связь между теломерами и старением, было продемонстрировано, что некоторые дисфункции теломер связаны с преждевременным старением, характерным для прогерии.Например, белок ДНК-хеликаза, мутантный при синдроме Вернера, необходим для эффективной репликации и стабильности теломер. Следовательно, в более широком смысле, как это происходит при преждевременном старении, теломеры могут быть, по крайней мере частично, ответственны за нормальное старение человека ( Artandi 2006 ).
Теломеразная обратная транскриптаза человека (hTERT), активный компонент теломеразы, была идентифицирована и клонирована, а ее информационная РНК не обнаруживается в дифференцированных клетках, не экспрессирующих теломеразу, но присутствует в изобилии в недифференцированных клетках, экспрессирующих теломеразу ( Meyerson et al. 1997 ).Хотя посттранскрипционные механизмы могут модифицировать активность hTERT ( Liu et al 1999 ), экспрессия hTERT напрямую коррелирует с активностью теломеразы, и существенные доказательства указывают на то, что активность hTERT контролируется главным образом на уровне транскрипции ( Cong et al 1999 ; Wick et al 1999 ). Промотор теломеразы должен быть «включен» в клетках, которые могут пролиферировать бесконечно, но «выключен» в клетках с ограниченной пролиферативной продолжительностью жизни. К сожалению, до сих пор мало что известно о механизме переключения, который контролирует экспрессию теломеразы, что приводит к ее подавлению и последующей клеточной гибели в соматических клетках.
1997 ).Хотя посттранскрипционные механизмы могут модифицировать активность hTERT ( Liu et al 1999 ), экспрессия hTERT напрямую коррелирует с активностью теломеразы, и существенные доказательства указывают на то, что активность hTERT контролируется главным образом на уровне транскрипции ( Cong et al 1999 ; Wick et al 1999 ). Промотор теломеразы должен быть «включен» в клетках, которые могут пролиферировать бесконечно, но «выключен» в клетках с ограниченной пролиферативной продолжительностью жизни. К сожалению, до сих пор мало что известно о механизме переключения, который контролирует экспрессию теломеразы, что приводит к ее подавлению и последующей клеточной гибели в соматических клетках.
Более того, даже если исследования укорочения теломер и теломеразы покажут большие надежды в выяснении основных основ клеточного старения, пока неясно, как эти знания улучшат наше понимание старения человека. На самом деле возможно присутствие некоторых тканей, в которых пролиферативная недостаточность способствует ухудшению физиологии, связанной со старением, но эти ткани не были однозначно идентифицированы. Только до 70 % иммортализованных линий соматических клеток человека ( Bryan et al 1997 ) и около 90 % линий раковых клеток человека ( Shay and Gazdar 1997 ) продемонстрировали активность теломеразы in vitro, что позволяет предположить, что другие факторы, кроме теломеразы, активны. участвует в репликации и старении клеток.Более того, многие теломеразо-отрицательные иммортализованные клеточные линии могут сохранять свою длину теломер ( Bryan et al 1995 ). С другой стороны, гибриды теломераза-негативных и теломеразо-позитивных клеток не смогли стать иммортализованными, так что вполне вероятно, что одного фермента теломеразы недостаточно для предотвращения старения клеток ( Bryan et al 1995 ).
Только до 70 % иммортализованных линий соматических клеток человека ( Bryan et al 1997 ) и около 90 % линий раковых клеток человека ( Shay and Gazdar 1997 ) продемонстрировали активность теломеразы in vitro, что позволяет предположить, что другие факторы, кроме теломеразы, активны. участвует в репликации и старении клеток.Более того, многие теломеразо-отрицательные иммортализованные клеточные линии могут сохранять свою длину теломер ( Bryan et al 1995 ). С другой стороны, гибриды теломераза-негативных и теломеразо-позитивных клеток не смогли стать иммортализованными, так что вполне вероятно, что одного фермента теломеразы недостаточно для предотвращения старения клеток ( Bryan et al 1995 ).
Несмотря на то, что исследования показывают, что теломераза может быть непосредственно вовлечена в клеточное старение и имеет большие перспективы, наше понимание этих возрастных механизмов все еще находится в начале пути.Количество доступных в настоящее время доказательств того, что предотвращение укорочения теломер влияет на какой-либо аспект старения, все еще недостаточно.
Воспалительная гипотеза старения
Даже если вовлечение воспалительного процесса в несколько (суб)клинических состояний (например, атеросклероз, диабет, деменция) хорошо продемонстрировано, важность воспаления в процессе старения была признана лишь недавно ( McGeer and McGeer 1999 ; Chung et al 2001 ).Тем не менее, воспаление все чаще считается краеугольным камнем механизмов, лежащих в основе процесса старения, поэтому даже возникает неологизм «воспалительное старение» ( Franceschi et al 2000a ). Воспаление представляет собой сложную нормальную защитную реакцию хозяина на физиологические и нефизиологические стрессоры. Острые, как и хронические воспалительные реакции, состоят из последовательных фаз, контролируемых гуморальными и клеточными стимулами: 1) внутриклеточная активация; 2) провоспалительные клетки в тканях; 3) повышение проницаемости сосудов; 4) повреждение тканей и гибель клеток ( Huerre and Gounon 1996 ; Chung et al 2001 ).
Выдвинута гипотеза об индивидуальном пороге способности справляться со стрессом. Если возрастное воспаление (или воспалительное старение) выходит за пределы этого уровня, происходит переход между успешным и неуспешным старением. Эпидемиологические данные подтверждают гипотезу о том, что период жизни при неудачном старении (инвалидности) максимален у пожилых людей, а минимален у молодых людей и долгожителей ( Franceschi et al 2000a ).
Даже при обсуждении воспаления и его связи со старением важно подчеркнуть, как этот механизм связан с другими на основе различных теорий старения.На самом деле тесная связь между воспалением и окислительным повреждением хорошо известна в литературе ( Cesari et al 2005 ). Фактически, активные формы кислорода и реактивные формы азота в значительной степени вовлечены в воспалительные процессы. Перепроизводство или неконтролируемое высвобождение реактивных частиц является основным причинным фактором воспаления тканей.
Иммунная теория старения
В 1989 году Франчески предложил иммунную теорию старения, или сетевую теорию старения ( Franceschi 1989 ; Franceschi et al 2000a ), в которой предполагалось, что старение сеть клеточных и молекулярных защитных механизмов. Основные части этой сети состоят из ферментов репарации ДНК, активации поли(АДФ-рибозил)полимеразы, ферментативных и неферментативных антиоксидантных систем (например, супероксиддисмутазы, каталазы, глутатионпероксидазы), продукции белков теплового шока ( Franceschi 1989 ; Franceschi et al 2000b ). Эти механизмы служат для ограничения негативного воздействия различных физических, химических и биологических факторов стресса. Эффективность сети контролируется генетически и различается у разных видов и особей, что объясняет наблюдаемые различия в продолжительности жизни.
Основные части этой сети состоят из ферментов репарации ДНК, активации поли(АДФ-рибозил)полимеразы, ферментативных и неферментативных антиоксидантных систем (например, супероксиддисмутазы, каталазы, глутатионпероксидазы), продукции белков теплового шока ( Franceschi 1989 ; Franceschi et al 2000b ). Эти механизмы служат для ограничения негативного воздействия различных физических, химических и биологических факторов стресса. Эффективность сети контролируется генетически и различается у разных видов и особей, что объясняет наблюдаемые различия в продолжительности жизни.
В сетевой теории старения иммунная система представляет собой наиболее мощный механизм противостояния стрессорам ( Franceschi et al 2000a ). В частности, Франчески определил макрофаги как первичный модулятор порочного круга, существующего между врожденным иммунитетом, воспалением и стрессом. Активация макрофагов из-за хронического стресса может дать потенциальное объяснение субклиническому хроническому воспалительному статусу, характерному для пожилых людей, и, в то же время, возможную особенность процесса старения. На лимфоциты также влияет постоянный антигенный стресс, связанный с возрастом, что приводит к хронической стимуляции, ответственной за расширение клеток памяти, уменьшение (даже истощение) наивных клеток и сокращение репертуара Т-клеток.
На лимфоциты также влияет постоянный антигенный стресс, связанный с возрастом, что приводит к хронической стимуляции, ответственной за расширение клеток памяти, уменьшение (даже истощение) наивных клеток и сокращение репертуара Т-клеток.
В пользу этой гипотезы и важности иммунной системы в определении старения свидетельствует высокая заболеваемость опухолями и большая восприимчивость к инфекциям от патогенов у пожилых людей. Было высказано предположение, что пожилые люди, поддерживающие свои иммунные функции на исключительно высоком уровне, с большей вероятностью будут иметь большую продолжительность жизни ( Wayne et al 1990 ; Pawelek et al 1999 ).
Как отмечалось выше, теории старения часто перекрывают друг друга, предполагая взаимодействие различных систем и механизмов. В этом контексте следует рассматривать связь между функциями иммунных клеток (такими как функции, участвующие в цитотоксической активности и особенно в фагоцитах в отношении их микробицидной активности) и образованием активных форм кислорода. Избыточное количество активных форм кислорода, не противодействующее антиоксидантной защите, может стать потенциальным источником повреждения тканей ( De La Fuente 2002 ).Более того, антиоксиданты поддерживают целостность и функцию мембранных липидов, клеточных белков и нуклеиновых кислот и контролируют передачу сигнала экспрессии генов в иммунных клетках. Неудивительно, что клетки иммунной системы обычно содержат более высокие концентрации антиоксидантов, чем другие клетки ( Knight 2000 ), учитывая высокий процент полиненасыщенных жирных кислот в их плазматических мембранах. Таким образом, функции иммунных клеток находятся под сильным влиянием баланса антиоксидант/оксидант, и, следовательно, уровни антиоксидантов играют ключевую роль в поддержании иммунных клеток I) в восстановленной среде и II) в защите их от окислительного стресса, чтобы сохранить их адекватное функционирование ( Knight 2000 ).
Избыточное количество активных форм кислорода, не противодействующее антиоксидантной защите, может стать потенциальным источником повреждения тканей ( De La Fuente 2002 ).Более того, антиоксиданты поддерживают целостность и функцию мембранных липидов, клеточных белков и нуклеиновых кислот и контролируют передачу сигнала экспрессии генов в иммунных клетках. Неудивительно, что клетки иммунной системы обычно содержат более высокие концентрации антиоксидантов, чем другие клетки ( Knight 2000 ), учитывая высокий процент полиненасыщенных жирных кислот в их плазматических мембранах. Таким образом, функции иммунных клеток находятся под сильным влиянием баланса антиоксидант/оксидант, и, следовательно, уровни антиоксидантов играют ключевую роль в поддержании иммунных клеток I) в восстановленной среде и II) в защите их от окислительного стресса, чтобы сохранить их адекватное функционирование ( Knight 2000 ).
Нейроэндокринная теория старения
Общепризнано наличие двунаправленной связи между нервной и иммунной системами ( Besedovsky and Del Rey 1996 ).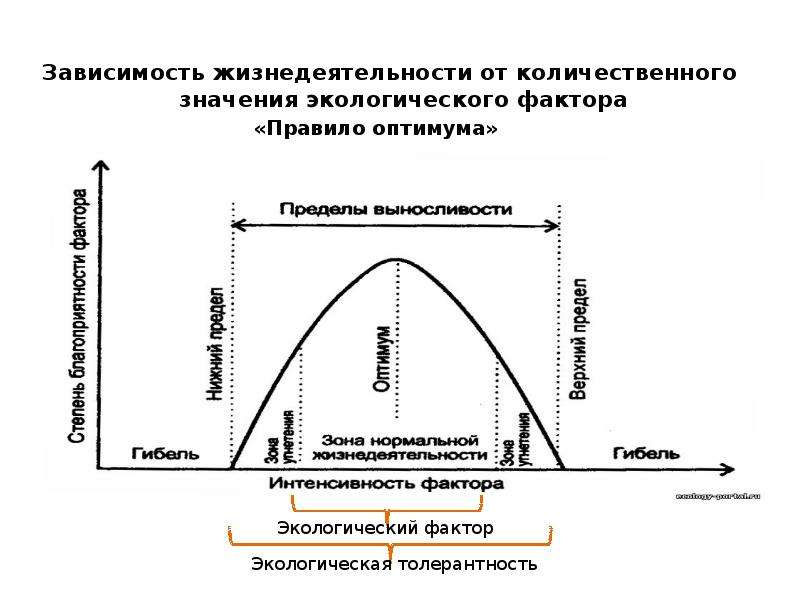 При старении происходит не только функциональное снижение иммунной и нервной систем, но также может стать очевидным нарушение связи между этими двумя регуляторными системами, что приводит к потере гомеостаза и повышению риска смерти ( Fabris 1991 ; De Ла Фуэнте 2002 ).
При старении происходит не только функциональное снижение иммунной и нервной систем, но также может стать очевидным нарушение связи между этими двумя регуляторными системами, что приводит к потере гомеостаза и повышению риска смерти ( Fabris 1991 ; De Ла Фуэнте 2002 ).
Нейроэндокринная теория предполагает, что старение связано с изменениями нервных и эндокринных функций, которые имеют решающее значение для: 1) координации и реакции различных систем на внешнюю среду; 2) программирование физиологических реакций на раздражители внешней среды; и 3) поддержание оптимального функционального состояния для размножения и выживания.
Эти изменения не только избирательно влияют на нейроны и гормоны, регулирующие такие эволюционно значимые функции, как размножение, рост и развитие, но также влияют на регуляцию выживания посредством адаптации к стрессу.Таким образом, продолжительность жизни, регулируемая «биологическими часами», будет проходить континуум последовательных стадий, управляемых нервными и эндокринными сигналами. Изменения биологических часов (например, сниженная чувствительность к стимулам, регулирующим часы, чрезмерная или недостаточная координация ответов) могут нарушить часы и соответствующие регулировки ( Finkel 1976 ; Timiras 1978 ; Weinert и Тимирас 2003 ).
Изменения биологических часов (например, сниженная чувствительность к стимулам, регулирующим часы, чрезмерная или недостаточная координация ответов) могут нарушить часы и соответствующие регулировки ( Finkel 1976 ; Timiras 1978 ; Weinert и Тимирас 2003 ).
Важный компонент этой теории указывает на то, что ось гипоталамо-гипофизарно-надпочечниковая (ГГН) является первичным регулятором, своего рода водителем ритма, сигнализирующим о начале и окончании каждого этапа жизни.Ось HPA контролирует физиологические приспособления, направленные на сохранение и поддержание внутреннего гомеостаза, несмотря на продолжающиеся изменения в окружающей среде ( Weinert and Timiras 2003 ). В течение жизни хроническое воздействие тяжелых и множественных физических, биологических или эмоциональных стрессоров может истощить или ослабить эту способность к адаптации и привести к так называемой «болезни адаптации» и смерти ( Selye 1976 ; Weinert and Timiras). 2003 ). В таком случае старение следует рассматривать как результат снижения способности переживать стресс, что еще раз указывает на тесную связь между стрессом и долголетием.
2003 ). В таком случае старение следует рассматривать как результат снижения способности переживать стресс, что еще раз указывает на тесную связь между стрессом и долголетием.
Интеграция ответов на стимулы окружающей среды, по-видимому, осуществляется гипоталамусом на основе информации, полученной в различных структурах головного мозга. Сам гипоталамус регулирует: 1) нервные функции (например, симпатические и парасимпатические висцеральные функции), 2) поведение (например, сексуальное и пищевое поведение, гнев, страх) и 3) эндокринные функции (например, выработку и секрецию гипофизиотропных гормонов, стимулирующих /ингибирование выброса гормона из гипофиза). В ответ на сигналы гипоталамуса гипофиз вырабатывает и секретирует несколько гормонов, регулирующих многие важные функции организма.Эта регуляция контролируется высвобождением гормонов (например, гормона роста, окситоцина, вазопрессина) или стимуляцией периферических эндокринных желез (например, коры надпочечников, щитовидной железы, половых желез).
Основными гормонами мозгового слоя надпочечников являются катеколамины адреналин и норэпинефрин, функционирующие как нейротрансмиттеры для симпатического отдела вегетативной нервной системы и быстро реагирующие на любой внешний или внутренний стресс посредством регулирования кровообращения и метаболизма ( Weinert and Timiras 2003 ).С возрастом снижение симпатической реактивности характеризуется: 1) меньшим количеством катехоламиновых рецепторов в периферических тканях-мишенях; 2) снижение белков теплового шока, повышающих стрессоустойчивость; и 3) снижение способности катехоламинов индуцировать белки теплового шока.
К гормонам коры надпочечников относятся глюкокортикоиды (отвечают за регуляцию липидного, белкового и углеводного обмена), минералкортикоиды (регулируют водно-электролитный баланс) и половые гормоны.Среди последних — дегидроэпиандростерон, уровень которого снижается с возрастом.
Заместительная терапия дегидроэпиандростероном рекомендуется для людей, несмотря на неубедительные результаты ( Daynes and Araneo 1992 ). Глюкокортикоиды, как и другие стероидные гормоны, регулируются положительной и отрицательной обратной связью между гормонами-мишенями и их центральным контролем со стороны гипофиза и гипоталамуса. С возрастом и в ответ на хронический стресс могут быть изменены не только механизмы обратной связи, но и сами глюкокортикоиды становятся токсичными для нервных клеток, тем самым нарушая контроль обратной связи и гормональную цикличность ( Sapolsky et al 1986 ; Sapolsky 1992 ; Weinert and Timiras 2003 ).
Глюкокортикоиды, как и другие стероидные гормоны, регулируются положительной и отрицательной обратной связью между гормонами-мишенями и их центральным контролем со стороны гипофиза и гипоталамуса. С возрастом и в ответ на хронический стресс могут быть изменены не только механизмы обратной связи, но и сами глюкокортикоиды становятся токсичными для нервных клеток, тем самым нарушая контроль обратной связи и гормональную цикличность ( Sapolsky et al 1986 ; Sapolsky 1992 ; Weinert and Timiras 2003 ).
Циркулирующие уровни гормона роста, тестостерона, эстрогена, дегидроэпиандростерона и других гормонов снижаются с возрастом. Хотя в клинических испытаниях было показано, что некоторые стратегии заместительной гормональной терапии изменяют некоторые физиологические атрибуты, связанные со старением, негативные побочные эффекты часто возникают при тех вмешательствах, которые, как было показано, приносят некоторую пользу, таких как гормон роста.
Хотя эпидемиологические данные в подавляющем большинстве случаев положительны в отношении некоторых преимуществ заместительной терапии эстрогенами для здоровья, недавнее исследование подняло вопрос о раке яичников после длительного использования.Было показано, что добавление мелатонина увеличивает среднюю продолжительность жизни мышей примерно на 5%, но это связано с увеличением частоты возникновения спонтанных опухолей.
Для того, чтобы адекватно справиться со снижением гормонов, происходящим с возрастом, крайне важно понимать сложный гормональный каскад, запутанное взаимодействие между сигналами, путями и системами производства и доставки.
Заместительная терапия эстрогенами представляет собой особый случай заместительной гормональной терапии и заслуживает особого внимания из-за ее долгой клинической истории и очевидного успеха в повышении качества жизни у женщин в постменопаузе.Эстроген особенно рекомендуется для профилактики остеопороза, но было высказано предположение, что он может снизить риск слабоумия и сердечно-сосудистых заболеваний. Было подсчитано, что благоприятные изменения липидов плазмы могут составлять примерно 25% кардиопротекторного эффекта эстрогенов.
Было подсчитано, что благоприятные изменения липидов плазмы могут составлять примерно 25% кардиопротекторного эффекта эстрогенов.
Вывод о том, что эстроген защищает женщин в постменопаузе от сердечно-сосудистых заболеваний, в настоящее время подвергается сомнению, в основном на основе экспериментов по изучению вторичной профилактики у женщин с уже существующими заболеваниями сердца.
Заместительная терапия эстрогенами была названа первой настоящей антивозрастной терапией. Однако пока не сообщалось о результатах рандомизированных исследований, сравнивающих эффекты этой терапии с плацебо, начиная с менопаузального перехода, у женщин без известной предшествующей ишемической болезни сердца или деменции.
Было продемонстрировано, что уровень циркулирующего гормона роста снижается с возрастом. Также было показано, что замена гормона роста у взрослых с заболеванием гипофиза и дефицитом гормона роста благотворно влияет на состав тела, уменьшая количество жира и увеличивая мышечную массу тела, мышечную силу и костную массу. Рудман и его коллеги исследовали, восстанавливают ли инъекции гормона роста пожилых мужчин мышечную массу, типичную для молодых мужчин. Они обнаружили, что уровни фактора роста инсулина (IGF)-1 действительно повышались и что безжировая масса тела увеличивалась, а жировая масса уменьшалась, что позволяет предположить, что инъекции гормона роста действительно обращали вспять изменения в составе тела, вызванные возрастом и ухудшением физической формы. Недавние данные, полученные на мышах, позволяют предположить, что перепроизводство ГР на протяжении всей жизни снижает продолжительность жизни мышей, тогда как недостаточное производство или неспособность реагировать на ГР увеличивают ее.У трансгенных мышей со сверхэкспрессией ГР наблюдаются тяжелые поражения почек и повышенная частота новообразований, а избыточная продукция ГР у взрослых людей приводит к состоянию, известному как акромегалия, которое характеризуется чрезмерным ростом определенных органов и тканей, а также преждевременной сердечной и легочной недостаточностью.
Рудман и его коллеги исследовали, восстанавливают ли инъекции гормона роста пожилых мужчин мышечную массу, типичную для молодых мужчин. Они обнаружили, что уровни фактора роста инсулина (IGF)-1 действительно повышались и что безжировая масса тела увеличивалась, а жировая масса уменьшалась, что позволяет предположить, что инъекции гормона роста действительно обращали вспять изменения в составе тела, вызванные возрастом и ухудшением физической формы. Недавние данные, полученные на мышах, позволяют предположить, что перепроизводство ГР на протяжении всей жизни снижает продолжительность жизни мышей, тогда как недостаточное производство или неспособность реагировать на ГР увеличивают ее.У трансгенных мышей со сверхэкспрессией ГР наблюдаются тяжелые поражения почек и повышенная частота новообразований, а избыточная продукция ГР у взрослых людей приводит к состоянию, известному как акромегалия, которое характеризуется чрезмерным ростом определенных органов и тканей, а также преждевременной сердечной и легочной недостаточностью.
Данные по нематодам и плодовым мушкам свидетельствуют о том, что снижение активности инсулиноподобного сигнального пути связано с увеличением продолжительности жизни, а не наоборот.Таким образом, необходимы дальнейшие исследования, прежде чем добавки ГР у людей, поощряемые многими «антивозрастными» клиницистами, можно будет считать либо безопасными, либо полезными для долгосрочного вмешательства.
Нейроэндокринно-иммунная теория старения
В иерархии мультисистемной регуляции на протяжении последовательных этапов жизни значительная роль принадлежит взаимодействию и интеграции нейроэндокринной и иммунной систем. Такое взаимодействие происходит через 1) присутствующие в иммунной системе нейропептиды и цитокины, опосредующие как внутрииммунную связь, так и между нейроэндокринной и иммунной системами, 2) несколько гормонов заднего (вазопрессин) и переднего (тиреотропный гормон, пролактин, адренокортикотропный гормон, гормон роста гормон) гипофиза и 3) реципрокное действие цитокинов на нейроэндокринные функции.
Помимо нейроэндокринных взаимодействий, иммунная система должна контролировать и устранять чужеродные организмы и вещества в организме хозяина, в то же время распознавая и, следовательно, защищая от разрушения свои молекулы. У большинства пожилых людей старение иммунитета характеризуется снижением устойчивости к инфекционным заболеваниям, снижением защиты от рака и повышенной неспособностью узнавать себя (что приводит к последующей аутоиммунной патологии) ( Franceschi et al 2000b ).Как нейроэндокринная, так и иммунная системы характеризуются высокой степенью пластичности и способны модифицировать свое функционирование в соответствии с потребностью. Пластичность наиболее эффективна в раннем возрасте, но сохраняется и в пожилом возрасте.
Для описания теоретических траекторий процесса старения Роу и Кан (1987) описали три кривые: первая характеризуется болезнью и инвалидностью; второй, известный как «обычное старение», характеризуется отсутствием явной патологии, но наличием некоторого снижения функции; и последнее, так называемое «успешное старение», с небольшими или отсутствующими физиологическими потерями и без патологии.Механизмы успешного старения основаны на: 1) сохранении нормальной функции и пластичности, 2) компенсаторных реакциях для восстановления нормальной функции, 3) вмешательствах для замещения нарушенных функций, 4) изменении исхода для здоровья путем модификации профилей риска, 5) профилактике заболеваний и 6) усиление социальных взаимодействий и поддержки ( Rowe and Kahn 1998 ). Было высказано предположение, что успешный пример этого «функционального ремоделирования» может быть опосредован нейроэндокринной и иммунной системами ( Mobbs et al 2001 ).
Ограничение калорийности
Отдельной главы в этом обзоре заслуживает ограничение калорийности, единственное негенетическое вмешательство, которое постоянно показывает замедление внутренней скорости старения у млекопитающих ( Dirks and Leeuwenburgh 2006 ). Это определяется снижением потребления калорий при сохранении основных потребностей в питательных веществах. Традиционно экспериментальные модели ограничения калорий на млекопитающих снижают потребление калорий примерно на 40% от диеты adlibitum на протяжении всей жизни животного.Это сокращение привело к увеличению максимальной продолжительности жизни на 30-40% ( Weindruch et al 1986 ).
Каким образом ограничение калорий может увеличить продолжительность жизни? Вполне вероятно, что это вмешательство может дать положительный эффект, действуя на различных уровнях функции и вовлекая ряд молекулярно-клеточных и системных изменений. Увеличивается не только продолжительность жизни, но также значительно усиливаются метаболические (например, повышенная чувствительность тканей к инсулину), нейроэндокринные и иммунные (например, повышенная защита от стресса, инфекций, рака) и коллагеновые реакции (например, уменьшение образования поперечных связей). ( Моббс и др. 2001 ).Примечательно, что такие функциональные изменения могут также модулироваться изменениями в профиле экспрессии генов. Ограничение калорий может способствовать долголетию за счет метаболического перепрограммирования с транскрипционным сдвигом (возможно, вызванным инсулином) в сторону 1) снижения энергетического метаболизма и 2) увеличения биосинтеза и оборота белков. Также было продемонстрировано, что ограничение калорийности заметно влияет на проявление патологических фенотипов у видов грызунов, отобранных в качестве моделей патологии человека ( Weinert and Timiras 2003 ).
Даже если краткосрочные эффекты у человека обнадеживают ( Walford et al 1999 ; Weyer et al 2000 ; Fontana et al 2004 ), долгосрочные исследования не вызывают удивления. в людях. Отсутствие данных человеческих моделей в основном связано с трудностями соблюдения этого строгого вмешательства и продолжительностью жизни человека.
Самые известные отчеты о влиянии ограничения калорий на здоровье человека были получены в ходе экспериментов «Биосфера-2».Биосфера 2 — замкнутое экологическое пространство, расположенное в пустынях Аризоны. В 1991 году восемь человек отправились в биосферу на двухлетний период для изучения последствий жизни в замкнутой системе. Из-за непредвиденных технических проблем доступ к еде был ограничен на протяжении всего исследования, так что фактическое потребление калорий участниками было примерно на 30% ниже ожидаемого. Физиологические и биохимические показатели оценивались в течение времени, проведенного в биосфере (т. е. пока члены экипажа испытывали ограничение калорийности), а также через 18 месяцев после выхода из биосферы и возвращения к обычному питанию.Физиологические изменения, с которыми столкнулись участники Биосферы 2, были аналогичны тем, которые были обнаружены у грызунов и нечеловеческих приматов с ограниченным потреблением калорий: снижение скорости метаболизма, температуры тела, систолического и диастолического артериального давления, а также снижение уровня глюкозы, инсулина и гормонов щитовидной железы в крови.
Показано, что окинавское население отличается пониженной заболеваемостью и смертностью, и на этом острове проживает самый большой процент долгожителей в мире.Было высказано предположение, что большая продолжительность жизни без инвалидности у этой группы населения может быть связана с диетой, основанной на овощах, злаках, сое, фруктах, рыбе и водорослях и характеризующейся низким потреблением калорий (примерно на 20% меньше, чем у остальная часть Японии и примерно на 40% меньше, чем в США). Примечательно, что эта диета очень похожа на меры по ограничению калорий, разработанные для экспериментов на животных моделях.
Несмотря на многочисленные данные, свидетельствующие о пользе для здоровья и снижении темпов старения за счет ограничения потребления калорий в моделях на животных млекопитающих, вполне вероятно, что эти положительные эффекты будут утрачены при переносе на человеческие модели ( Dirks and Leeuwenburgh 2006 ).Следовательно, прежние большие надежды на долгосрочное ограничение калорий у людей как на новый «фонтан молодости» недавно изменились.
Заключение
Утверждается, что более половины бюджета Национального института старения США тратится на борьбу с болезнью Альцгеймера ( Hayflick 2000a ). Тем не менее устранение этого клинического состояния окажет лишь минимальное влияние на ожидаемую продолжительность жизни и не поможет продвижению наших знаний в области фундаментальной биологии старения.Больше внимания следует уделить редко задаваемому вопросу: почему старые клетки более уязвимы для болезней, чем молодые? Ответ на этот вопрос не только расширит наши фундаментальные знания о старении, но и поможет лучше понять возрастные заболевания ( Hayflick 2000a ).
Был сделан ряд важных шагов вперед в понимании процесса старения, так что он больше не является неясной проблемой биологии ( Holliday 2006 ). Тем не менее, по-прежнему необходимы дальнейшие исследования и решение многочисленных проблем.В частности, важно выяснить, до какой степени и какой ценой можно ограничить или обратить вспять процесс старения. При поиске решения этих вопросов мы должны четко помнить, что Хейфлик написал в комментарии Nature : «Если главная цель наших биомедицинских исследований — установить причины смерти, то каждый пожилой человек становится свидетелем этих причин». успехи. Биогеронтологи обязаны подчеркнуть, что целью исследований старения является не увеличение продолжительности жизни человека вне зависимости от последствий, а увеличение активной продолжительности жизни, свободной от инвалидности и функциональной зависимости» ( Hayflick 2000b ).
Ссылки
- Ahmed A, Tollefsbol T. Теломеры и теломераза: значение фундаментальной науки для старения. J Am Geriatr Soc. 2001;49:1105–9. [PubMed] [Google Scholar]
- Алексеев М.Ф., Леду С.П., Уилсон Г.Л. Митохондриальная ДНК и старение. Clin Sci (Лондон) 2004; 107: 355–64. [PubMed] [Google Scholar]
- Allen JA, Coombs MM. Ковалентное связывание полициклических ароматических соединений с митохондриальной и ядерной ДНК. Природа. 1980; 287: 244–5. [PubMed] [Google Scholar]
- Эймс Б.Н.Эндогенное окислительное повреждение ДНК, старение и рак. Free Radic Res Commun. 1989; 7: 121–8. [PubMed] [Google Scholar]
- Анисимов В.Н. Увеличение продолжительности жизни и риск рака: мифы и реальность. Опыт Геронтол. 2001; 36: 1101–36. [PubMed] [Google Scholar]
- Arking R, Burde V, Graves K, et al. Прямая и обратная селекция на долголетие у дрозофилы характеризуется изменением экспрессии антиоксидантных генов и паттернов окислительного повреждения. Опыт Геронтол. 2000; 35: 167–85. [PubMed] [Google Scholar]
- Artandi SE.Теломеры, теломераза и болезни человека. N Engl J Med. 2006; 355:1195–7. [PubMed] [Google Scholar]
- Austad SN. Замедленное старение в островной популяции опоссумов. Джей Зул. 1993; 229: 695–708. [Google Scholar]
- Бекман К.Б., Эймс Б.Н. Свободнорадикальная теория старения созревает. Физиол Рез. 1998; 78: 547–81. [PubMed] [Google Scholar]
- Беседовский Х., Дель Рей А. Иммуно-нейро-эндокринные взаимодействия: факты и гипотезы. Endocrinol Rev. 1996; 17:64–102. [PubMed] [Google Scholar]
- Blackburn EH.Состояния теломер и клеточные судьбы. Природа. 2000;408:53–6. [PubMed] [Google Scholar]
- Bodnar AG, Ouellette M, Frolkis M, et al. Увеличение продолжительности жизни за счет введения теломеразы в клетки человека. Наука. 1998; 279: 349–52. [PubMed] [Google Scholar]
- Bowles D, Torgan C, Ebner S, et al. Влияние острых субмаксимальных упражнений на витамин Е в скелетных мышцах. Free Radic Res Commun. 1991; 14: 139–43. [PubMed] [Google Scholar]
- Brand FN, Kiely DK, Kannel WB и др. Семейные модели смертности от ишемической болезни сердца: Framingham Longevity Study.Дж. Клин Эпидемиол. 1992; 45: 169–74. [PubMed] [Google Scholar]
- Bryan TM, Englezou A, Dalla-Pozza L, et al. Доказательства альтернативного механизма поддержания длины теломер в опухолях человека и опухолевых клеточных линиях. Нат Мед. 1997;3:1271–4. [PubMed] [Google Scholar]
- Bryan TM, Englezou A, Gupta J, et al. Удлинение теломер в бессмертных клетках человека без обнаруживаемой теломеразной активности. EMBO J. 1995; 14:4240–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Butler RN, Fossel M, Harman SM, et al.Существует ли лекарство против старения? J Gerontol A Biol Sci Med Sci. 2002; 57А:В333–8. [PubMed] [Google Scholar]
- Cadenas E, Davies KJ. Генерация митохондриальных свободных радикалов, окислительный стресс и старение. Свободный Радик Биол Мед. 2000; 29: 222–30. [PubMed] [Google Scholar]
- Кампизи Дж. Биология репликативного старения. Евр Джей Рак. 1997; 33: 703–9. [PubMed] [Google Scholar]
- Кампизи Дж. Клеточное старение и гибель клеток. В: Тимирас П.С., редактор. Физиологические основы старения и гериатрия.3-е изд. CRC; Бока-Ратон, Флорида: 2003. стр. 47–59. [Google Scholar]
- Кармели Э., Коулман Р., Резник А.З. Биохимия стареющих мышц. Опыт Геронтол. 2002; 37: 477–89. [PubMed] [Google Scholar]
- Cesari M, Kritchevsky SB, Leeuwenburgh C, et al. Окислительное повреждение и активация тромбоцитов как новые предикторы нарушения двигательных функций и смертности у пожилых людей. Антиоксидный окислительно-восстановительный сигнал. 2005 г. в печати. [PubMed] [Google Scholar]
- Chung HY, Kim HJ, Kim JW и др. Воспалительная гипотеза старения – молекулярная модуляция ограничением калорий.Энн Н.Ю. Академия наук. 2001; 928: 327–35. [PubMed] [Google Scholar]
- Cong YS, Wen J, Bacchetti S. Каталитическая субъединица теломеразы человека hTERT: организация гена и характеристика промотора. Хум Мол Жене. 1999; 8: 137–42. [PubMed] [Google Scholar]
- Davies KJ, Quintanilha A, Brooks GA, et al. Свободные радикалы и повреждение тканей, вызванное физическими упражнениями. Biochem Biophys Res Comm. 1982; 107: 1292–9. [PubMed] [Google Scholar]
- Daynes RA, Araneo BA. Профилактика и коррекция некоторых возрастных изменений иммунологических реакций с помощью дополнительной терапии дегидроэпиандростерона сульфатом.Старение: иммунология и инфекционные заболевания. 1992; 3: 135–53. [Google Scholar]
- De Benedictis G, Rose G, Carrieri G, et al. Унаследованные варианты митохондриальной ДНК связаны с успешным старением и долголетием человека. FASEB J. 1999; 13:1532–6. [PubMed] [Google Scholar]
- Де Ла Фуэнте М. Влияние антиоксидантов на старение иммунной системы. Eur J Clin Nutr. 2002; 56:S5–S8. [PubMed] [Google Scholar]
- de Lange T. Теломеры человека прикреплены к ядерному матриксу. ЭМБО Дж.1992; 11: 717–24. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Dirks AJ, Leeuwenburgh C. Ограничение калорий у людей: потенциальные ловушки и проблемы со здоровьем. Механическая эпоха Дев. 2006; 127:1–7. [PubMed] [Google Scholar]
- Фабрис Н. Нейроэндокринно-иммунные взаимодействия: теоретический подход к старению. Арх Геронтол Гериатр. 1991; 12: 219–30. [PubMed] [Google Scholar]
- Finkel CE. Регуляция физиологических изменений при старении млекопитающих. Q Rev Biol. 1976; 51: 49–83. [PubMed] [Google Scholar]
- Finkel T, Holbrook NJ.Оксиданты, окислительный стресс и биология старения. Природа. 2000; 408: 239–47. [PubMed] [Google Scholar]
- Fontana L, Meyer TE, Klein S, et al. Длительное ограничение калорий очень эффективно для снижения риска атеросклероза у людей. Proc Natl Acad Sci. 2004; 101:6659–63. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Фоссель М. Теломераза и стареющая клетка: последствия для здоровья человека. ДЖАМА. 1998; 279:1732–5. [PubMed] [Google Scholar]
- Franceschi C.Пролиферация клеток и гибель клеток в процессе старения. Старение Clin Exp Res. 1989; 1: 3–13. [Google Scholar]
- Franceschi C, Bonafe M, Valensin S, et al. Воспалительное старение – эволюционный взгляд на иммуностарение. Энн Н.Ю. Академия наук. 2000а; 908: 244–54. [PubMed] [Google Scholar]
- Franceschi C, Valensin S, Bonafe M, et al. Сетевые и ремоделирующие теории старения: исторический фон и новые перспективы. Опыт Геронтол. 2000б; 35:879–96. [PubMed] [Google Scholar]
- Funk WD, Wang CK, Shelton DN, et al.Экспрессия теломеразы восстанавливает целостность дермы для состаренных in vitro фибробластов в модели реконструированной кожи. Разрешение ячейки опыта. 2000; 258: 270–8. [PubMed] [Google Scholar]
- Greider CW, Blackburn EH. Теломерная последовательность в РНК теломеразы Tetrahymena, необходимая для синтеза теломерных повторов. Природа. 1989; 337: 331–37. [PubMed] [Google Scholar]
- Haldane JBS. Новые пути в генетике. Аллен и Анвин; Лондон: 1941 г. [Google Scholar]
- Harley CB, Futcher AB, Greider CW.Теломеры укорачиваются при старении фибробластов человека. Природа. 1990; 345: 458–60. [PubMed] [Google Scholar]
- Харман Д. Старение: Теория, основанная на свободных радикалах и радиационной химии. Дж Геронтол. 1957; 2: 298–300. [PubMed] [Google Scholar]
- Харман Д. Биологические часы: митохондрии? J Am Geriatr Soc. 1972; 20: 145–147. [PubMed] [Google Scholar]
- Харман Д. Свободнорадикальная теория старения. Антиоксидный окислительно-восстановительный сигнал. 2003; 5: 557–61. [PubMed] [Google Scholar]
- Хейфлик Л.Ограниченное время жизни диплоидных клеток человека in vitro. Разрешение ячейки опыта. 1965; 37: 614–36. [PubMed] [Google Scholar]
- Хейфлик Л. Как и почему мы стареем. Опыт Геронтол. 1998; 33: 639–53. [PubMed] [Google Scholar]
- Хейфлик Л. Новые подходы к старости. Природа. 2000а; 403:365. [PubMed] [Google Scholar]
- Хейфлик Л. Будущее старения. Природа. 2000b; 408: 267–9. [PubMed] [Google Scholar]
- Хейфлик Л. «Противовозрастное лечение» — это оксюморон» J Gerontol A Biol Sci Med Sci.2004; 59А: 573-8. [PubMed] [Google Scholar]
- Холлидей Р. Старение больше не является нерешенной проблемой биологии. Энн Н.Ю. Академия наук. 2006; 1067:1–9. [PubMed] [Google Scholar]
- Huerre MR, Gounon P. Воспаление: закономерности и новые концепции. Рез Иммунол. 1996; 147: 417–34. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Иванова Р., Лепаж В., Чаррон Д. и др. Митохондриальный генотип, связанный с французскими долгожителями европеоидной расы. Геронтология. 1998;44:349. [PubMed] [Google Scholar]
- Kanungo MS.Модель старения. Дж Теор Биол. 1975; 53: 253–61. [PubMed] [Google Scholar]
- Knight JA. Обзор: Свободные радикалы, антиоксиданты и иммунная система. Энн Клин Lab Sci. 2000;30:145–58. [PubMed] [Google Scholar]
- Kowald A, Kirkwood TB. Сетевая теория старения: взаимодействие дефектных митохондрий, аберрантных белков, свободных радикалов и поглотителей в процессе старения. Мутат рез. 1996; 316: 209–36. [PubMed] [Google Scholar]
- Larsen PL. Старение и устойчивость к окислительному повреждению у Caenorhabditis elegans.Proc Natl Acad Sci. 1993; 90:8905–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Лингнер Дж., Хьюз Т.Р., Шевченко А. и др. Мотивы обратной транскриптазы в каталитической субъединице теломеразы. Наука. 1997; 276: 561–7. [PubMed] [Google Scholar]
- Liu K, Schoonmaker MM, Levine BL, et al. Конститутивная и регулируемая экспрессия теломеразной обратной транскриптазы (hTERT) в лимфоцитах человека. Proc Natl Acad Sci. 1999; 96: 5147–52. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Loison A, Festa-Bianchet M, Gaillard JM, et al.Возрастная выживаемость в пяти популяциях копытных: свидетельство старения. Экология. 1999; 80: 2539–54. [Google Scholar]
- Mandavilli BS, Santos JH, Van Houten B. Восстановление митохондриальной ДНК и старение. Мутат рез. 2002; 509: 127–51. [PubMed] [Google Scholar]
- McCall MR, Frei B. Могут ли витамины-антиоксиданты существенно уменьшить окислительное повреждение у людей? Свободный Радик Биол Мед. 1999; 26:1034–53. [PubMed] [Google Scholar]
- McGeer EG, McGeer PL. Воспаление головного мозга при болезни Альцгеймера и его терапевтические последствия.Курр Фарм Дез. 1999; 5:821–36. [PubMed] [Google Scholar]
- Медведев З.А. Попытка рациональной классификации теорий старения. Биол Rev. 1990; 65: 375–98. [PubMed] [Google Scholar]
- Melov S, Ravenscroft J, Malik S, et al. Увеличение продолжительности жизни с помощью миметиков супероксиддисмутазы/каталазы. Наука. 2000; 289:1567–9. [PubMed] [Google Scholar]
- Meydani M, Evans WJ, Handelman G, et al. Защитный эффект витамина Е на окислительное повреждение, вызванное физическими упражнениями, у молодых и пожилых людей.Am J Physiol. 1993; 264: R992–8. [PubMed] [Google Scholar]
- Meyerson M, Counter CM, Eaton EN, et al. hEST2, предполагаемый ген каталитической субъединицы теломеразы человека, активируется в опухолевых клетках и во время иммортализации. Клетка. 1997; 90: 785–95. [PubMed] [Google Scholar]
- Miquel J, Economos AC, Fleming J, et al. Роль митохондрий в старении клеток. Опыт Геронтол. 1980; 15: 575–91. [PubMed] [Google Scholar]
- Mobbs CV, Bray GA, Atkinson RL, et al. Нейроэндокринные и фармакологические манипуляции для оценки того, как ограничение калорий увеличивает продолжительность жизни.J Gerontol A Biol Sci Med Sci. 2001; 56:34–44. [PubMed] [Google Scholar]
- Ниранджан Б.Г., Бхат Н.К., Авадхани Н.Г. Преимущественная атака митохондриальной ДНК афлатоксином B1 во время гепатоканцерогенеза. Наука. 1982; 215:73–75. [PubMed] [Google Scholar]
- Pawelek G, Effros C, Caruso C, et al. Т-клетки и старение. Фронт биосай. 1999; 4: 216–69. [PubMed] [Google Scholar]
- Puca AA, Dalay MJ, Brewster SJ, et al. Полногеномное сканирование на предмет связи с исключительной продолжительностью жизни человека идентифицирует локус на хромосоме 4.Proc Natl Acad Sci. 2001; 98:10505–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Rhyu MS. Теломеры, теломераза и бессмертие. J Natl Cancer Inst. 1995; 87: 884–94. [PubMed] [Google Scholar]
- Richter C, Park JW, Ames BN. Нормальное окислительное повреждение митохондриальной и ядерной ДНК обширно. Proc Natl Acad Sci. 1988; 85: 6465–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Ross OA, McCormack R, Curran MD, et al. Полиморфизм митохондриальной ДНК: его роль в долголетии населения Ирландии.Опыт Геронтол. 2001; 36:1161–78. [PubMed] [Google Scholar]
- Rossi SC, Gorman N, Wetterhahn KE. Митохондриальное восстановление хромата канцерогена: образование хрома(V) Chem Res Toxicol. 1988; 1: 101–7. [PubMed] [Google Scholar]
- Rowe JW, Kahn RL. Старение человека: обычное и успешное. Наука. 1987; 237: 143–9. [PubMed] [Google Scholar]
- Rowe JW, Kahn RL. Успешное старение. Старение (Милан) 1998; 10: 142–4. [PubMed] [Google Scholar]
- Сапольский Р.М. Рудман Стресс, старение мозга и механизмы гибели нейронов.Массачусетский технологический институт Пресс; Кембридж, Массачусетс: 1992. [Google Scholar]
- Sapolsky RM, Krey LC, McEwen BS. Нейроэндокринология стресса и старения: гипотеза глюкокортикоидного каскада. Endocr Rev. 1986; 7: 284–301. [PubMed] [Google Scholar]
- Sastre J, Pallardo FV, Garcia de la Asuncion J, et al. Митохондрии, окислительный стресс и старение. Бесплатный Рад Res. 2000; 32:189–98. [PubMed] [Google Scholar]
- Selye H. Жизненный стресс. Макгроу-Хилл; Нью-Йорк: 1976. [Google Scholar]
- Shay JW, Gazdar AF.Теломераза в ранней диагностике рака. Джей Клин Патол. 1997; 50:106–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Shay JW, Wright WE. Теломеразная активность при раке человека. Curr Opin Oncol. 1996; 8: 66–71. [PubMed] [Google Scholar]
- Shringarpure R, Davies KJ. Обмен белков протеасомами при старении и заболеваниях. Свободный Радик Биол Мед. 2002; 32:1084–9. [PubMed] [Google Scholar]
- Танака М., Гонг Дж. С., Чжан Дж. и др. Митохондриальный генотип связан с долголетием.Ланцет. 1998; 351:185–6. [PubMed] [Google Scholar]
- Татар М., Бартке А., Антеби А. Эндокринная регуляция старения инсулиноподобными сигналами. Наука. 2003; 299:1346–51. [PubMed] [Google Scholar]
- Тимирас PS. Биологические взгляды на старение. Am Sci. 1978; 66: 605–13. [PubMed] [Google Scholar]
- Tower J. Трансгенные методы увеличения продолжительности жизни дрозофилы. Механическая эпоха Дев. 2000; 118:1–14. [PubMed] [Google Scholar]
- Уланер Г.А., Джудиче Л.С. Развитие регуляции активности теломеразы в тканях плода человека во время беременности.Мол Хум Репрод. 1997; 3: 769–73. [PubMed] [Google Scholar]
- Vaziri H, Benchimol S. Восстановление активности теломеразы в нормальных клетках человека приводит к удлинению теломер и увеличению продолжительности репликативной жизни. Карр Биол. 1998; 8: 279–82. [PubMed] [Google Scholar]
- Walford RL, Mock D, MacCallum T и др. Физиологические изменения у людей, подвергшихся строгому избирательному ограничению калорий в течение двух лет в биосфере 2: здоровье, старение и токсикологические перспективы. Токсикол науч. 1999; 52:61–5.[PubMed] [Google Scholar]
- Wayne SJ, Rhyne RL, Garry PJ и др. Клеточный иммунитет как предиктор заболеваемости и смертности у лиц старше 60 лет. J Gerontol. 1990;45:М45–8. [PubMed] [Google Scholar]
- Weindruch R, Walford RL, Fligiel S, et al. Замедление старения у мышей диетическими ограничениями: долголетие, рак, иммунитет и потребление энергии в течение жизни. Дж Нутр. 1986; 116: 641–54. [PubMed] [Google Scholar]
- Weinert BT, Timiras PS. Теории старения. J Appl Physiol.2003; 95: 1706–16. [PubMed] [Google Scholar]
- Weyer C, Walford RL, Harper IT и др. Энергетический обмен после 2-летнего ограничения энергии: эксперимент «Биосфера-2». Am J Clin Nutr. 2000;72:946–53. [PubMed] [Google Scholar]
- Вик М., Зубов Д., Хаген Г. Геномная организация и характеристика промотора гена, кодирующего ген обратной транскриптазы теломеразы человека (hTERT). 1999; 232: 97–106. [PubMed] [Google Scholar]
- Wunderlich V, Schutt M, Bottger M, et al. Преимущественное алкилирование митохондриальной дезоксирибонуклеиновой кислоты N-метил-N-нитрозомочевиной.Биохим Дж. 1970; 118:99–109. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Четыре фазы старения: за пределами честности Эриксона и отчаяния
Это стадия, через которую она проходит
Моя мать качала на меня головой и говорила: «Это стадия, через которую она проходит». Я полагаю, это было. Позиция моей матери заключалась в том, что лекарством от каждой стадии является следующая; Думаю, это сработало для нас обоих. Но что бы она сказала, если бы узнала, что мне почти 90 лет, а я все еще прохожу этапы? Ну, это то, что она предсказала, не так ли?
Многие из нас в возрасте, хотя мы ценим новаторскую работу психоаналитика Эрика Эриксона по определению стадий развития, нуждаются в помощи помимо «целостности против отчаяния», потому что 50 лет уже не старость, а концепция старения изменилась.Пожилым людям и их младшим членам семьи семейное путешествие может показаться более легким, если у них есть некоторые рекомендации относительно стадий развития и старости.
Здесь мы рассмотрим четыре стадии, определенные Джином Коэном, учеником Эриксона, в его книге 2006 года Зрелый разум: позитивная сила стареющего мозга . Хотя существует много полезных описаний старения, я выбрал описание Коэна, потому что его этапы легко понять и легко научить. Текущие исследования продолжают поддерживать его теории, и легко добавить новые исследования, особенно о мозге.Кроме того, я достаточно взрослый, чтобы пройти все четыре стадии, и они соответствуют моему опыту и моим наблюдениям за старением других людей.
Старость
Старость Эриксона, век мудрости, начался в 50 лет. В своей книге 1950 года « Детство и общество » Эриксон назвал восьмую стадию развития, старость, кризисом целостности и отчаяния, стадией генерализации чувственных модусов. с базовой силой мудрости.
Когда мне исполнилось 50 лет, я не испытал ни малейших пятнышек мудрости.Хотя я по-прежнему благодарен Эриксону за новаторскую работу, мне нужно было больше.
В моем старом словаре что-то говорится о старении как о постепенном изменении организма, увеличивающем риск смерти.
Действительно! «Риск» смерти? Я думал, что смерть — это данность. Часть нашего естественного жизненного процесса.
В настоящее время мы придерживаемся гериатрической позиции, согласно которой старение связано не с днями рождения, а с процессом развития и поддержания, и что успешное старение связано со всеми аспектами благополучия и высоким уровнем удовлетворенности жизнью.
Джин Коэн подхватил призыв Эриксона к своим ученикам продолжить работу над проблемой старения. Его книга « Зрелый разум » стала результатом. Коэн начинает с развенчания преобладающего упрямого мифа о том, что старение — это что-то негативное, болезнь, застой, развал, в котором доминирует неизбежный упадок тела и разума. Он призывает нас ожидать положительного роста с возрастом и принять научные открытия о том, что стареющий мозг может формировать новые воспоминания и выращивать новые клетки мозга. Он говорит,
Мы также узнали, что мозг старшего возраста может обрабатывать информацию совершенно иначе, чем мозг молодого возраста.Пожилые люди могут использовать оба полушария своего мозга для выполнения задач, для которых молодые люди используют только одно полушарие. Большое количество научных работ также подтвердило старую пословицу «используй или потеряешь».
Развитие интеллекта
Коэффициент и внутренний толчок
Коэн утверждает, что все мы наделены Внутренним Толчком, который подталкивает нас к нашему развитию в любом возрасте. Он отмечает, что на протяжении всей своей жизни люди всегда находятся на каком-то уровне развития своего интеллекта.Этот уровень является их Коэффициентом Интеллекта Развития. это
… степень проявления человеком своих уникальных неврологических, эмоциональных, интеллектуальных и психологических способностей. … Более конкретно, интеллект развития отражает созревающую синергию познания, эмоционального интеллекта, суждений, социальных навыков, жизненного опыта и сознания.
Коэн считает развитие интеллекта самым большим преимуществом стареющего мозга/разума.Назовите это мудростью. Хотя процесс старения связан с некоторой потерей памяти и некоторым замедлением мышления, Коэн напоминает нам о том, что во многих случаях снижение умственных способностей вызвано не днями рождения, а болезнями, психическими заболеваниями, депрессией, стрессом, нездоровым образом жизни и травмами.
Не по дням рождения? Когда я недавно потерял почти год крепкого здоровья, мне неоднократно говорили, что я должен был ожидать этого, потому что мне было за 70. Когда я потерял большую часть своего четвертого класса из-за невыявленной болезни, никто не сказал мне ожидать этого, потому что мне было 9 лет! Давайте остерегаемся обозначать провалы в памяти как «взрослые моменты».» Они могут быть не о днях рождения.
Четыре стадии зрелости Коэна
Фазы (стадии) Коэна более подвижны, чем фазы Эриксона; он отмечает, что люди могут испытывать их в порядке, отличном от представленного здесь, или они могут перекрываться.
Фаза I — переоценка среднего возраста (возраст от 30 до 60 лет)
Фаза I — это период поиска, а не кризиса. Это включает в себя поиск истины и смысла.
- Где я был?
- Где я сейчас?
- Куда я иду?
Люди в этой фазе обычно сталкиваются со своей смертностью.Хотя у некоторых это вызывает тревогу, Внутренний толчок обычно приводит к захватывающему новому взгляду на то, что мы хотим делать со своей жизнью. Это может означать, что нужно делать что-то другое или что-то совершенно новое. Люди среднего возраста часто становятся менее импульсивными, более вдумчивыми в своей работе, более открытыми к жизненным сложностям и более осведомленными о своих интуитивных чувствах. Между тем, мозг помогает Внутреннему толчку, расширяя мозолистое тело. Эта растущая интеграция обоих полушарий мозга приводит к большему балансу между аналитическим и интуитивным, что приводит к большей продуктивности и более сильному самоощущению.Это прекрасное время, чтобы начать новый проект или направление.
В свой 50-й день рождения я решил написать свою первую книгу. Я всегда считал себя медленным стартером, но, по словам Коэна, я был как раз вовремя.
Фаза II — Освобождение (возраст от конца 50-х до 70-х годов)
Фаза II — время экспериментов и инноваций. В загруженном мозгу новые нейроны растут в гиппокампе, где дендриты достигают наибольшей плотности с начала 50-х до конца 70-х годов. Внутренний толчок направлен на освобождение, а не на подчинение, на инновации и готовность идти на риск.Для многих выход на пенсию означает время заняться тем, чем они всегда хотели заниматься. Вопросы: если не сейчас, то когда? Почему нет? Что они могут сделать со мной?
Для меня это было восхитительное карьерное время, когда я изобретал новые способы преподавания и обдумывал теории.
Этап III — Подведение итогов (возраст от 60 до 80 лет)
Фаза III — это время пересмотра и решения, и она предвещает желание отплатить. Обзор жизни с осознанием ее смысла. Это время размещения фотографий в альбомах, написания воспоминаний.Возможно, богатству автобиографической деятельности способствует способность использовать одновременно левое и правое полушария мозга. Левая сторона в основном используется молодыми людьми. Коэн предполагает, что мозг «наслаждается» подведением итогов.
В свои 70 лет мой муж Дик понял, что его внуки не могут знать историю своего дедушки-иммигранта. Дик начал с нескольких страниц, а несколько лет спустя у него было 3 дюйма фактов, историй и картинок.
Исследование Коэна показывает, что 80% тех, кто находится на этапе подведения итогов, выполняют какую-либо волонтерскую работу. Общие вопросы: В чем смысл моей жизни? Как мне вернуть, сделать мир лучше? Есть ли неразрешенные конфликты, которые я могу исправить?
Фаза IV — Заключительная фаза, Encore (возраст с конца 70-х до конца жизни)
замечания Коэна,
Эта потребность оставаться жизненной может привести к новым проявлениям творчества и социальной активности, которые сделают этот период полным сюрпризов.
Опираясь на свои обширные исследования и исследования других, а также на интервью и опыт работы с людьми в Фазе IV, Коэн видит, что Внутренний толчок способствует размышлению и празднованию. Он отмечает, что эта фаза продолжает аспекты трех предыдущих фаз: перепроверки, освобождения и подведения итогов. Следовательно, название «бис» используется во французском смысле «продолжать». Хотя некоторые качества интеллектуального функционирования ухудшаются, постоянно создаются новые дендриты, синапсы и нейроны, особенно при адекватной физической и умственной стимуляции.Мало того, что обучение всегда возможно, но и глубина опыта придает дополнительное измерение мудрости качеству мышления. Коэн цитирует исследования, показывающие, что самые старые люди могут хорошо справляться с трудностями и имеют высокий уровень удовлетворенности и психологической устойчивости. Положительные эмоции и моральный дух поддерживаются дальнейшими изменениями в миндалевидном теле. Коэн заявляет:
Несколько других исследований подтвердили эти результаты — даже среди нездоровых взрослых. Вывод: люди лучше приспосабливаются к своим условиям по мере взросления.
Независимо от состояния здоровья пожилые люди обычно лучше подготовлены — как с точки зрения удовлетворенности жизнью, так и с точки зрения способности справляться — справляться с превратностями старения.
Для меня эта книга — да! Это так освобождает. Да, личное восприятие и способ мышления меняются. Они становятся шире и глубже. Да, эти старые социальные мифы о старении программируют нас на страх старости. Да, нам нужно выйти за их пределы и ожидать положительного роста.
Приглашение
Если вы считаете, что четырехступенчатая концепция Коэна может быть полезна в классе или при обучении отдельного человека или семьи, у меня есть две идеи, которыми я хочу поделиться.Во-первых, я нахожу обозначения фаз Коэна громоздкими, поэтому я называю их Поиском, Изюминкой, Смыслом и Смягчением. Во-вторых, если раздаточный материал «Четыре фазы развития взрослого человека» кажется вам полезным, смело используйте его. Я создаю короткие задания, в зависимости от интересов группы или отдельного человека, чтобы помочь людям изучить свои мысли и убеждения по поводу каждого этапа.
Пусть все мы, кто постарше, будем вдумчивыми, путешествуя по своим этапам и создавая собственное успешное старение.
Эволюция старения | Изучайте науку в Scitable
Ackermann, M. и др. . Старение у бактерии с асимметричным делением. Наука 300 , 1920–1920 (2003).Аккерманн, М. и др. . Об эволюционном происхождении старения. Aging Cell 6 , 235–244 (2007).
Austad, S.N. & Fischer, K.E. Старение, метаболизм и экология млекопитающих: данные по летучим мышам и сумчатым. Журнал геронтологии 46 , B47–B53 (1991).
Bailey, C. Titi Lucreti Cari De Rerum Natura .Том 3, Оксфорд, Великобритания: Clarendon Press, 1947.
Бланко, М. А. и Шерман, П. В. Максимальная продолжительность жизни химически защищенных и незащищенных рыб, рептилий и земноводных поддерживает эволюционные гипотезы старения. Механизмы старения и развития 126 , 794–803 (2005).
Брониковски А. М. и Флэтт Т. Старение и его демографические измерения. Природообразовательные знания 1 , 3 (2011).
Чарльзворт, Б. Эволюция возрастных популяций . Кембридж, Великобритания: Издательство Кембриджского университета, 1994.
Чарльзворт, Б. Фишер, Медавар, Гамильтон и эволюция старения. Генетика 156 , 927–931 (2000).
Charlesworth, B. Модели возрастных средних и генетических вариаций показателей смертности, предсказанные теорией старения с накоплением мутаций. Журнал теоретической биологии 210 , 47–65 (2001).
Финч, К.E. Долголетие, старение и геном . Чикаго, Иллинойс: University of Chicago Press, 1990.
Фишер, Р. А. Генетическая теория естественного отбора . Оксфорд, Великобритания: Clarendon Press, 1930.
Flatt, T. Стоимость выживания при размножении Drosophila . Экспериментальная геронтология , In Press (2011).
Флэтт, Т. и Промислоу, Д.Э.Л. Физиология: все еще размышляя над извечным вопросом. Наука 318 , 1255–1256 (2007).
Flatt, T. & Schmidt, P.S. Объединение эволюционной и молекулярной генетики старения. Biochimica et Biophysica Acta 1790 , 951–962 (2009).
Холдейн, JBS Новые пути в генетике . Лондон, Великобритания: Allen & Unwin, 1941.
Hamilton, WD. Формирование старения естественным отбором. Журнал теоретической биологии 12 , 12–45 (1966).
Хьюз, К. А. и Рейнольдс, Р. М. Эволюционные и механистические теории старения. Ежегодный обзор энтомологии 50 , 421–445 (2005).
Хьюз, К. А. и др. . Проверка эволюционных теорий старения. Труды Национальной академии наук Соединенных Штатов Америки 99 , 14286–14291 (2002).
Кирквуд Т.Б.Л. Эволюция старения. Природа 270 , 301–304 (1977).
Luckinbill, L. S. и др. . Селекция на замедленное старение у Drosophila melanogaster . Эволюция 38 , 996–1003 (1984).
Медавар, П. Б. Старость и естественная смерть. Modern Quarterly 1 , 30–56 (1946).
Медавар, П. Б. Нерешенная проблема биологии . London, UK: HK Lewis, 1952.
Moorad, JA & Promislow, D.E.L. Что генетическая изменчивость может рассказать нам об эволюции старения? Труды Королевского общества B: биологические науки 276 , 2271–2278 (2009).
Мурад, Дж. А. и Промислоу, Д. Э. Л. Эволюция: старение дерева? Current Biology 20 , R406–R408 (2010).
Партридж, Л. и Бартон, Н. Х. Оптимальность, мутация и эволюция старения. Природа 362 , 305–311 (1993).
Promislow, D.E.L. & Bronikowski, A. «Эволюционная генетика старения», в Evolutionary Genetics: Concepts and Case Studies , eds. CW Fox & JB Wolf (Oxford University Press, 2006) 464–481.
Rauschert, E. Кривые выживаемости. Знания о естественном образовании 1 , 18 (2010).
Роуз, М. Р. Лабораторная эволюция отложенного старения у Drosophila melanogaster . Эволюция 38 , 1004–1010 (1984).
Роуз, М. Р. Эволюционная биология старения . Нью-Йорк, штат Нью-Йорк: издательство Оксфордского университета, 1991.
Роуз, М. Р. и Чарльзворт, Б. Проверка эволюционных теорий старения. Природа 287 , 141–142 (1980).
Роуз, М. Р. и др. . Силы естественного отбора Гамильтона через сорок лет. Эволюция 61 , 1265–1276 (2007).
Шефферсон, Р. П. Почему истории жизни так разнообразны? Природообразовательные знания 1 , 1 (2010).
Stearns, S.C. Эволюция историй жизни . Оксфорд, Великобритания: Oxford University Press, 1992.
Stearns, SC и др. . Экспериментальная эволюция старения, роста и размножения плодовых мушек. Труды Национальной академии наук Соединенных Штатов Америки 97 , 3309–3313 (2000).
Стюарт, Э. Дж. и др. . Старение и смерть в организме, размножающемся морфологически симметричным делением. PLoS Biology 3 , 295–300 (2005).
Вайсманн, А. Очерки наследственности . Оксфорд, Великобритания: Clarendon Press, 1891.
Уильямс, Г. К. Плейотропия, естественный отбор и эволюция старения. Эволюция 11 , 398–411 (1957).
12.2: Жизненный цикл человека
- Последнее обновление
- Сохранить как PDF
- Изменения во время младенчества
- Изменения во время малыша
- Изменения в детстве
- Изменения во время полового созревания
- Изменения в позднем подростке
- . Изменения в позднем подростке
- на вынос
- 6
- Определите и определите различные этапы жизненного цикла человека.
- Объясните, как развивается человеческое тело от младенчества до раннего возраста.
- Беременность. Развитие зиготы в эмбрион, а затем в плод при подготовке к родам.
- Детство. Самая ранняя часть детства. Это период от рождения до годовалого возраста.
- Детские годы. Возникают в возрасте двух и трех лет и заканчиваются в раннем детстве.
- Детство. Действие происходит в возрасте от четырех до восьми лет.
- Половое созревание. Период от девяти до тринадцати лет, который является началом подросткового возраста.
- Старший подростковый возраст. Стадия, происходящая в возрасте от четырнадцати до восемнадцати лет.
- Совершеннолетие. Период от подросткового возраста до конца жизни и начинается в девятнадцать лет.
- Средний возраст. Период взрослой жизни, который длится с тридцати одного до пятидесяти лет.
- Старшие годы, или старость. Продлить с пятидесяти одного года до конца жизни.
- Готовясь к этой и следующей главам, спрогнозируйте, как, по вашему мнению, могут отличаться потребности в питательных веществах в начале жизни и в конце жизни. Затем, прочитав эту и следующую главы, обсудите, были ли ваши прогнозы правильными или нет.
- 1.
Finch CE. Эволюция продолжительности жизни человека и болезней старения: роль инфекции, воспаления и питания. Proc Natl Acad Sci U S A. 2010; 107 (дополнение 1): 1718–24.
Артикул пабмед Google Scholar
- 2.
Vaupel JW, Carey JR, Christensen K, Johnson TE, Yashin AI, Holm NV, et al. Биодемографические траектории долголетия. Наука. 1998;280(5365):855–60.
Артикул пабмед КАС Google Scholar
- 3.
Уилмот младший. Демография долголетия: прошлые, настоящие и будущие тенденции. Опыт Геронтол. 2000;35(9-10):1111–29.
Артикул пабмед КАС Google Scholar
- 4.
Оппен Дж., Вопель Дж.В. Нарушены пределы ожидаемой продолжительности жизни. Наука. 2002;296(5570):1029–31.
Артикул пабмед КАС Google Scholar
- 5.
Вопель Дж.В. Биодемография старения человека. Природа. 2010;464(7288):536–42.
Центральный пабмед Статья пабмед КАС Google Scholar
- 6.
Лопес-Отин С., Бласко М.А., Партридж Л., Серрано М., Кремер Г.Признаки старения. Клетка. 2013;153(6):1194–217.
Центральный пабмед Статья пабмед КАС Google Scholar
- 7.
Николи Т., Партридж Л. Старение как фактор риска заболеваний. Карр Биол. 2012;22(17):R741–R52.
Артикул пабмед КАС Google Scholar
- 8.
Кримминс Э.М. Продолжительность жизни и продолжительность здоровья: прошлое, настоящее и обещание. Геронтолог.2015;55(6):901–11.
Центральный пабмед Статья пабмед Google Scholar
- 9.
Salomon JA, Wang H, Freeman MK, Vos T, Flaxman AD, Lopez AD, et al. Ожидаемая продолжительность здоровой жизни в 187 странах, 1990–2010 гг.: систематический анализ для Глобального исследования бремени болезней, 2010 г. Lancet. 2012;380(9859):2144–62.
Артикул пабмед Google Scholar
- 10.
Хранилище данных Глобальной обсерватории здравоохранения.Ожидаемая продолжительность жизни и ожидаемая продолжительность здоровой жизни. Данные по регионам ВОЗ. http://apps.who.int/gho/data/view.main.SDG2016LEXREGv?lang=en. По состоянию на 18 июля 2018 г.
- 11.
Юнис А., Гольдкорн Р., Гольденберг И., Гева Д., Цур Б. и др. Нарушение уровня глюкозы натощак является основной детерминантой 20-летнего риска смертности, связанного с метаболическим синдромом, у пациентов без диабета со стабильной ишемической болезнью сердца. Ассоциация J Am Heart. 2017;6:e006609.
Центральный пабмед Статья пабмед Google Scholar
- 12.
Кароне Г., Костелло Д., Диес Гуардиа Н., Мурре Г., Пшивара Б., Саломяки А. Экономические последствия старения населения в государствах-членах ЕС25, Главное управление по экономическим и финансовым вопросам Европейская экономика, экономический рабочий документ №. 236.2005. https://doi.org/10.2139/ssrn.873872.
- 13.
Контис В., Беннет Дж. Э., Мазерс К. Д., Ли Г., Форман К., Эззати М. Ожидаемая продолжительность жизни в будущем в 35 промышленно развитых странах: прогнозы с помощью ансамбля байесовских моделей. Ланцет. 2017;389(10076):1323–35.
Центральный пабмед Статья пабмед Google Scholar
- 14.
Dong X, Milholland B, Vijg J. Доказательства ограничения продолжительности жизни человека. Природа. 2016;538(7624):257–9.
Артикул пабмед КАС Google Scholar
- 15.
Ленарт А., Вопель Дж.В. Сомнительные доказательства ограничения продолжительности жизни человека. Природа. 2017;546(7660):E13–E4.
Артикул пабмед КАС Google Scholar
- 16.
Барби Э., Лагона Ф., Марсили М., Вопель Д.В., Вахтер К.В. Плато человеческой смертности: демография пионеров долголетия. Наука. 2018; 360:1459–61.
Артикул пабмед КАС Google Scholar
- 17.
Tetzlaff J, Muschik D, Epping J, Eberhard S, Geyer S. Расширение или сжатие полиморбидности? 10-летнее развитие лет жизни, проведенных с мультиморбидностью, основанное на данных о страховых выплатах в Нижней Саксонии, Германия.Международный паб J Health. 2017;62(6):679–86.
Артикул Google Scholar
- 18.
Себастиани П., Перлз Т. Генетика экстремального долголетия: уроки исследования долгожителей Новой Англии. Фронт Жене. 2012;3:277. https://doi.org/10.3389/fgene.2012.00277.
Центральный пабмед Статья пабмед Google Scholar
- 19.
Чарльзворт Б., Чарльзворт Д. Элементы эволюционной генетики.Деревня Гринвуд: издательство Roberts and Company; 2010.
Google Scholar
- 20.
Роза МР. Эволюционная биология старения. Нью-Йорк и Оксфорд: Издательство Оксфордского университета; 1991.
Google Scholar
- 21.
Finch CE. Долголетие, старение и геном. Чикаго и Лондон: Издательство Чикагского университета; 1990.
Google Scholar
- 22.
Nussey DH, Froy H, Lemaitre JF, Gaillard JM, Austad SN. Старение в естественных популяциях животных: широко распространенные данные и их значение для биогеронтологии. Aging Res Rev. 2013;12(1):214–25.
Артикул пабмед Google Scholar
- 23.
Клаттон-Брок Т., Шелдон, Британская Колумбия. Особи и популяции: роль многолетних индивидуальных исследований животных в экологии и эволюционной биологии. Тенденции Экол Эвол. 2010; 25: 562–73.
Артикул пабмед Google Scholar
- 24.
Чарльзворт Б. Эволюционные механизмы старения. Генетика. 1993; 91:11–9.
Артикул пабмед КАС Google Scholar
- 25.
Баудиш А. Неизбежное старение? Берлин: Спрингер; 2008.
Google Scholar
- 26.
Munné-Bosch S. Старение: универсально или нет? Тенденции Растениевод.2015;20(11):713–20.
Артикул пабмед КАС Google Scholar
- 27.
Шефферсон Р.П., Джонс О.Р., Салгуэро-Гомес Р. Эволюция старения на древе жизни. Кембридж: Издательство Кембриджского университета; 2017.
Книга Google Scholar
- 28.
Чарльзворт Б. Фишер, Медавар, Гамильтон и эволюция старения. Генетика. 2000;156(3):927–31.
Центральный пабмед пабмед КАС Google Scholar
- 29.
Фишер Р.А. Генетическая теория естественного отбора. Оксфорд: Издательство Оксфордского университета; 1930.
Книга Google Scholar
- 30.
Холдейн JBS. Новые пути в генетике. Лондон: Аллен и Анвин; 1941.
Google Scholar
- 31.
Медавар ПБ. Старость и естественная смерть. Мод Кварт. 1946; 2: 30–49.
Google Scholar
- 32.
Медавар ПБ. Нерешенная проблема биологии. Лондон: Х.К. Льюис; 1952.
Google Scholar
- 33.
Williams GC. Плейотропия, естественный отбор и эволюция старения. Эволюция. 1957; 11: 398–411.
Артикул Google Scholar
- 34.
Hamilton WD. Формирование старения естественным отбором. Дж Теор Биол. 1966; 12(1):12–45.
Артикул пабмед КАС Google Scholar
- 35.
Индикаторы силы отбора Баудиша А. Гамильтона. Proc Natl Acad Sci U S A. 2005;102(23):8263–8.
Центральный пабмед Статья пабмед КАС Google Scholar
- 36.
Роуз М.Р., Раузер К.Л., Бенфорд Г., Матос М., Мюллер Л.Д. Силы естественного отбора Гамильтона через сорок лет. Эволюция. 2007;61(6):1265–76.
Артикул пабмед Google Scholar
- 37.
Чарлсворт Б. Эволюция популяций с возрастной структурой. 1-е изд. Кембридж: Издательство Кембриджского университета; 1980.
Google Scholar
- 38.
Charlesworth B. Эволюция населения с возрастной структурой. 2-е изд. Кембридж: Издательство Кембриджского университета; 1994.
Книга Google Scholar
- 39.
Партридж Л., Дилен Дж., Слэгбум ЧП. Решение глобальных проблем старения.Природа. 2018; в печати
- 40.
Kirkwood TBL. Эволюция старения. Природа. 1977; 270:301–4.
Артикул пабмед КАС Google Scholar
- 41.
Кирквуд ТБЛ. Одноразовая сома теория старения. В: Harrison DE, редактор. Генетические эффекты старения II. Колдуэлл: Телфорд Пресс; 1990. с. 9–19.
Google Scholar
- 42.
Абрамс П.А., Людвиг Д.Теория оптимальности, закон Гомперца и теория старения одноразовой сомы. Эволюция. 1995;49(6):1055–66.
Артикул пабмед Google Scholar
- 43.
Charlesworth B. Закономерности возрастных средних и генетических вариаций коэффициентов смертности, предсказанные теорией старения с накоплением мутаций. Дж Теор Биол. 2001; 210:47–65.
Артикул пабмед КАС Google Scholar
- 44.
Партридж Л, Бартон, Нью-Хэмпшир. Оптимальность, мутация и эволюция старения. Природа. 1993; 362: 305–11.
Артикул пабмед КАС Google Scholar
- 45.
Партридж Л., Бартон Н.Х. Эволюция старения — проверка теории на дрозофиле. Генетика. 1993;91(1-3):89–98.
Артикул пабмед КАС Google Scholar
- 46.
Партридж Л., Джемс Д. Механизмы старения: общественные или частные? Нат Рев Жене.2002; 3: 165–75.
Артикул пабмед КАС Google Scholar
- 47.
Флэтт Т., Шмидт П.С. Интеграция эволюционной и молекулярной генетики старения. Биохим Биофиз Акта. 2009; 1790(10):951–62.
Центральный пабмед Статья пабмед КАС Google Scholar
- 48.
Stearns SC, Partridge L. Генетика старения у Drosophila . В: Masoro E, Austad S, редакторы.Справочник по биологии старения. 5-е изд. Кембридж: Академическая пресса; 2001. с. 353–68.
- 49.
Хьюз К.А., Рейнольдс Р.М. Эволюционная и механистическая теории старения. Анну Рев Энтомол. 2005; 50: 421–45.
Артикул пабмед КАС Google Scholar
- 50.
Flatt T. Стоимость выживания при размножении Дрозофила . Опыт Геронтол. 2011;46(5):369–75.
Артикул пабмед Google Scholar
- 51.
Кеньон К. Пластичность старения: взгляды долгоживущих мутантов. Клетка. 2005;120(4):449–60.
Артикул пабмед КАС Google Scholar
- 52.
Гайяр Ж.М., Леметр Ж.Ф. Наследие Уильямса: критическая переоценка его девяти предсказаний об эволюции старения. Эволюция. 2017;71(12):2768–85.
Артикул пабмед Google Scholar
- 53.
Lemaitre JF, Berger V, Bonenfant C, Douhard M, Gamelon M, Plard F, et al. Компромиссы ранней и поздней жизни и эволюция старения в дикой природе. Proc R Soc Lond B. 2015;282(1806):20150209.
- 54.
Роуз М., Чарльзворт Б. Проверка эволюционных теорий старения. Природа. 1980; 287: 141–2.
Артикул пабмед КАС Google Scholar
- 55.
Роза МР. Лабораторная эволюция отсроченного старения у Drosophila melanogaster .Эволюция. 1984; 38 (5): 1004–10.
Артикул пабмед Google Scholar
- 56.
Партридж Л., Проуз Н., Пигнателли П. Другой набор ответов и коррелированных ответов на отбор по возрасту при размножении у Drosophila melanogaster . Proc R Soc Lond B. 1999;266:255–61.
Артикул КАС Google Scholar
- 57.
Sgro CM, Partridge L. Отсроченная волна гибели от размножения у Drosophila .Наука. 1999; 286:2521–4.
Артикул пабмед КАС Google Scholar
- 58.
Stearns SC, Ackermann M, Doebeli M, Kaiser M. Экспериментальная эволюция старения, роста и размножения плодовых мушек. Proc Natl Acad Sci U S A. 2000;97:3309–13.
Центральный пабмед Статья пабмед КАС Google Scholar
- 59.
Zwaan B, Bijlsma R, Hoekstra RF.Прямой отбор по продолжительности жизни у Drosophila melanogaster . Эволюция. 1995;49(4):649–59.
Артикул пабмед Google Scholar
- 60.
Партридж Л., Джемс Д., Уизерс Д.Дж. Секс и смерть: какая связь? Клетка. 2005;120(4):461.
Артикул пабмед КАС Google Scholar
- 61.
Clancy DJ, Gems D, Harshman LG, Oldham S, Stocker H, Hafen E, et al.Увеличение продолжительности жизни за счет потери CHICO, белка-субстрата инсулинового рецептора Drosophila . Наука. 2001; 292:104–6.
Артикул пабмед КАС Google Scholar
- 62.
Кеньон К. Законсервированная система регуляции старения. Клетка. 2001;105(2):165–8.
Артикул пабмед КАС Google Scholar
- 63.
Татар М., Копельман А., Эпштейн Д., Ту М.-П., Инь С.-М., Гарофало Р.С.Мутант дрозофилы , гомолог инсулинового рецептора, увеличивающий продолжительность жизни и нарушающий нейроэндокринную функцию. Наука. 2001; 292:107–10.
Артикул пабмед КАС Google Scholar
- 64.
Татар М., Бартке А., Антеби А. Эндокринная регуляция старения инсулиноподобными сигналами. Наука. 2003;299(5611):1346–51.
Артикул пабмед КАС Google Scholar
- 65.
Пааби AB, Шмидт PS. Анализ генетики долголетия у Drosophila melanogaster . Флай (Остин). 2009;3(1):29–38.
Артикул КАС Google Scholar
- 66.
Пааби А.Б., Бергланд А.О., Берман Э.Л., Шмидт П.С. Высоко плейотропный полиморфизм аминокислот в инсулиновом рецепторе Drosophila способствует адаптации на протяжении всей жизни. Эволюция. 2014;68(12):3395–409.
Центральный пабмед Статья пабмед Google Scholar
- 67.
Пааби AB, Шмидт PS. Функциональное значение аллельной изменчивости у метусала , гена старения у дрозофилы . ПЛОС Один. 2008;3(4):e1987.
Центральный пабмед Статья пабмед КАС Google Scholar
- 68.
Чарльзворт Б., Хьюз К.А. Возрастная депрессия инбридинга и компоненты генетической изменчивости в связи с эволюцией старения. Proc Natl Acad Sci U S A. 1996;93(12):6140–5.
Центральный пабмед Статья пабмед КАС Google Scholar
- 69.
Шоу Ф.Х., Промислоу Д.Э., Татар М., Хьюз К.А., Гейер С.Дж. К согласованию выводов о генетической изменчивости в старении Drosophila melanogaster . Генетика. 1999;152(2):553–66.
Центральный пабмед пабмед КАС Google Scholar
- 70.
Хьюз К.А., Алипаз Дж.А., Дрневич Дж.М., Рейнольдс Р.М.Проверка эволюционных теорий старения. Proc Natl Acad Sci U S A. 2002;99(22):14286–91.
Центральный пабмед Статья пабмед КАС Google Scholar
- 71.
Moorad JA, Promislow DE. Что генетическая изменчивость может рассказать нам об эволюции старения? Proc R Soc Lond B. 2009;276(1665):2271–8.
Артикул Google Scholar
- 72.
Rodríguez JA, Marigorta UM, Hughes DA, et al.Антагонистическая плейотропия и накопление мутаций влияют на старение и болезни человека. Нат Экол Эвол. 2017;1(3):55.
Артикул пабмед Google Scholar
- 73.
Райт А., Чарлсуорт Б., Рудан И., Карозерс А., Кэмпбелл Х. Полигенная основа позднего начала заболевания. Тенденции Жене. 2003;19(2):97–106.
Артикул пабмед КАС Google Scholar
- 74.
Чарльзворт Б. Эволюция старения: болезнь Альцгеймера и эволюция. Карр Биол. 1996;6(1):20–2.
Артикул пабмед КАС Google Scholar
- 75.
Campisi J. Старение, клеточное старение и рак. Annu Rev Physiol. 2013;75(1):685–705.
Артикул пабмед КАС Google Scholar
- 76.
Byars SG, Huang QQ, Gray L-A, Bakshi A, Ripatti S, Abraham G, et al.Генетические локусы, ассоциированные с болезнью коронарных артерий, свидетельствуют об отборе и антагонистической плейотропии. Генетика PLoS. 2017;13(6):e1006328.
Центральный пабмед Статья пабмед КАС Google Scholar
- 77.
Картер А.Дж., Нгуен А.К. Антагонистическая плейотропия как распространенный механизм поддержания аллелей полиморфных заболеваний. БМС Мед Жене. 2011;12(1):1–13.
Артикул КАС Google Scholar
- 78.
Wang X, Byars SG, Stearns SC. Генетические связи между пострепродуктивной продолжительностью жизни и размером семьи во Фрамингеме. Эвол Мед Паб Здоровье. 2013; 2013(1):241–53.
Артикул Google Scholar
- 79.
Kang H-J, Feng Z, Sun Y, Atwal G, Murphy ME, Rebbeck TR, et al. Однонуклеотидные полиморфизмы пути р53 регулируют фертильность у людей. Proc Natl Acad Sci U S A. 2009;106(24):9761–6.
Центральный пабмед Статья пабмед Google Scholar
- 80.
Smith KR, Hanson HA, Mineau GP, Buys SS. Влияние мутаций BRCA1 и BRCA2 на женскую фертильность. Proc R Soc Lond B. 2012;279(1732):1389–95.
Артикул КАС Google Scholar
- 81.
Moorad JA, Walling CA. Измерение отбора генов, которые способствуют долгой жизни в исторической человеческой популяции. Нат Экол Эвол. 2017; 1:1773–81.
Артикул пабмед Google Scholar
- 82.
Абрамс Пенсильвания. Способствует ли повышенная смертность развитию большего количества и быстрому старению? Эволюция. 1993;47(3):877–87.
Артикул пабмед Google Scholar
- 83.
Williams PD, Day T. Антагонистическая плейотропия, взаимодействие источников смертности и эволюционная теория старения. Эволюция. 2003;57(7):1478–88.
Артикул пабмед Google Scholar
- 84.
Caswell H. Внешняя смертность и эволюция старения. Тенденции Экол Эвол. 2007;22(4):173–4.
Артикул пабмед Google Scholar
- 85.
Gaillard J-M, Festa-Bianchet M, Yoccoz NG, Loison A, Toïgo C. Временные изменения в компонентах приспособленности и динамика популяций крупных травоядных. Annu Rev Ecol Syst. 2000; 31: 367–93.
Артикул Google Scholar
- 86.
Уильямс П.Д., Дэй Т., Флетчер К., Роу Л. Формирование старения в дикой природе. Тенденции Экол Эвол. 2006;21(8):458–63.
Артикул пабмед Google Scholar
- 87.
Резник Д.Н., Брайант М.Дж., Рофф Д., Галамбор К.К., Галамбор Д.Е. Влияние внешней смертности на эволюцию старения гуппи. Природа. 2004; 431 (7012): 1095–9.
Артикул пабмед КАС Google Scholar
- 88.
Чен Х, Маклаков АА. Увеличение продолжительности жизни происходит при высоких показателях смертности, зависящей от состояния. Карр Биол. 2012;22(22):2140–3.
Артикул пабмед КАС Google Scholar
- 89.
Kirkwood TBL, Martin GM, Partridge L. Эволюция, старение и здоровье в пожилом возрасте. В: Stearns SC, редактор. Эволюция здоровья и болезни. Оксфорд: Издательство Оксфордского университета; 1999. с. 219–30.
Google Scholar
- 90.
Burke MK, King EG, Shahrestani P, Rose MR, Long AD. Полногеномное ассоциативное исследование чрезвычайной продолжительности жизни у Drosophila melanogaster . Геном Биол Эвол. 2014;6(1):1–11.
Артикул пабмед Google Scholar
- 91.
Highfill CA, Reeves GA, Macdonald SJ. Генетический анализ изменчивости продолжительности жизни с использованием картирования популяции дрозофилы при расширенном интеркроссе с несколькими родителями. БМС Генет. 2016;17(1):113.
Центральный пабмед Статья пабмед КАС Google Scholar
- 92.
Иванов Д.К., Escott-Price V, Ziehm M, Magwire MM, Mackay TFC, Partridge L, et al. Долголетие GWAS с использованием генетической эталонной панели Drosophila . J Gerontol A Biol Sci Med Sci. 2015;70(12):1470–8.
Центральный пабмед Статья пабмед КАС Google Scholar
- 93.
Резник Д.Н. Генетическая основа старения: взгляд биолога-эволюциониста. Sci Aging Knowl Environment. 2005;2005(11):pe7.
Артикул Google Scholar
- 94.
McElwee JJ, Schuster E, Blanc E, Piper MD, Thomas JH, Patel DS, et al. Эволюционное сохранение регулируемых механизмов обеспечения долголетия. Геном биол. 2007;8(7):R132.
Центральный пабмед Статья пабмед КАС Google Scholar
- 95.
Smith ED, Tsuchiya M, Fox LA, Dang N, Hu D, Kerr EO, et al. Количественные доказательства законсервированных путей долголетия между расходящимися видами эукариот. Геном Res. 2008;18(4):564–70.
Центральный пабмед Статья пабмед КАС Google Scholar
- 96.
Кеньон CJ. Генетика старения. Природа. 2010;464(7288):504–12.
Артикул пабмед КАС Google Scholar
- 97.
Фонтана Л., Партридж Л., Лонго В.Д. Увеличение продолжительности здоровой жизни — от дрожжей до человека. Наука. 2010;328(5976):321–6.
Центральный пабмед Статья пабмед КАС Google Scholar
- 98.
Wyss-Coray T. Старение, нейродегенерация и омоложение мозга. Природа. 2016; 539:180.
Центральный пабмед Статья пабмед КАС Google Scholar
- 99.
Castellano JM, Mosher KI, Abbey RJ, McBride AA, James ML, Berdnik D, et al. Белки плазмы пуповины человека оживляют функцию гиппокампа у старых мышей. Природа. 2017; 544: 488–92.
Центральный пабмед Статья пабмед КАС Google Scholar
- 100.
Mair W, Dillin A. Старение и выживание: генетика увеличения продолжительности жизни за счет ограничения питания. Анну Рев Биохим. 2008; 77: 727–54.
Артикул пабмед КАС Google Scholar
- 101.
Фонтана Л., Партридж Л. Укрепление здоровья и долголетия с помощью диеты: от модельных организмов до человека. Клетка. 2015;161(1):106–18.
Центральный пабмед Статья пабмед КАС Google Scholar
- 102.
Андерсон Р.М., Ле Кутер Д.Г., де Кабо Р. Исследование ограничения калорийности: новые взгляды на биологию старения. J Gerontol A Biol Sci Med Sci. 2017;73(1):1–3.
Артикул пабмед Google Scholar
- 103.
Капахи П., Каберляйн М., Хансен М. Ограничения в питании и продолжительность жизни: уроки на моделях беспозвоночных. Aging Res Rev. 2017; 39:3–14.
Артикул пабмед Google Scholar
- 104.
Гарднер Э.М. Ограничение калорий снижает выживаемость старых мышей в ответ на первичную инфекцию гриппа. J Gerontol A Biol Sci Med Sci. 2005;60(6):688–94.
Артикул пабмед Google Scholar
- 105.
Colman RJ, Anderson RM, Johnson SC, Kastman EK, Kosmatka KJ, Beasley TM, et al. Ограничение калорийности задерживает начало заболевания и смертность у макак-резусов. Наука. 2009;325(5937):201–4.
Центральный пабмед Статья пабмед КАС Google Scholar
- 106.
Mattison JA, Roth GS, Beasley TM, Tilmont EM, Handy AM, Herbert RL, et al. Влияние ограничения калорийности на здоровье и выживаемость макак-резус из исследования NIA.Природа. 2012; 489:318–21.
Артикул пабмед КАС Google Scholar
- 107.
Colman RJ, Beasley TM, Kemnitz JW, Johnson SC, Weindruch R, Anderson RM. Ограничение калорийности снижает возрастную смертность и смертность от всех причин у макак-резусов. Нац коммун. 2014;5:3557.
Центральный пабмед Статья пабмед КАС Google Scholar
- 108.
Инграм Д.К., де Кабо Р.Ограничение калорий у грызунов: предостережения, которые следует учитывать. Aging Res Rev. 2017; 39:15–28.
Артикул пабмед ПабМед Центральный Google Scholar
- 109.
Grandison RC, Piper MDW, Partridge L. Аминокислотный дисбаланс объясняет увеличение продолжительности жизни диетическими ограничениями у Drosophila . Природа. 2009;462(7276):1061–5.
Центральный пабмед Статья пабмед КАС Google Scholar
- 110.
Левин М.Е., Суарес Хорхе А., Брандхорст С., Баласубраманиан П., Ченг К.В., Мадиа Ф. и др. Низкое потребление белка связано со значительным снижением IGF-1, рака и общей смертности в 65 лет и моложе, но не в старшем населении. Клеточный метаб. 2014;19(3):407–17.
Центральный пабмед Статья пабмед КАС Google Scholar
- 111.
Мирзаи Х., Суарес Х.А., Лонго В.Д. Ограничение белков и аминокислот, старение и болезни: от дрожжей до человека.Тенденции Эндокринол Метаб. 2014;25(11):558–66.
Центральный пабмед Статья пабмед КАС Google Scholar
- 112.
Солон-Бит Саманта М., МакМахон Эйслинг С., Баллард Дж. Уильям О., Руохонен К., Ву Линдси Э., Коггер Виктория С. и др. Соотношение макронутриентов, а не потребление калорий, диктует кардиометаболическое здоровье, старение и долголетие у мышей, которых кормили вволю. Клеточный метаб. 2014;19(3):418–30.
Центральный пабмед Статья пабмед КАС Google Scholar
- 113.
Симпсон С.Дж., Ле Кутер Д.Г., Раубенхаймер Д., Солон-Бит С.М., Куни Г.Дж., Коггер В.К. и др. Диетический белок, старение и геометрия питания. Aging Res Rev. 2017; 39: 78–86.
Артикул пабмед КАС Google Scholar
- 114.
Piper MDW, Soultoukis GA, Blanc E, Mesaros A, Herbert SL, Juricic P, et al. Соответствие баланса аминокислот в рационе экзому, транслируемому in silico, оптимизирует рост и размножение без ущерба для продолжительности жизни.Клеточный метаб. 2017;25(3):610–21.
Центральный пабмед Статья пабмед КАС Google Scholar
- 115.
Cummings NE, Williams EM, Kasza I, Konon EN, Schaid MD, Schmidt BA, et al. Восстановление метаболического здоровья за счет снижения потребления аминокислот с разветвленной цепью. Дж. Физиол. 2018;596(4):623–45.
Артикул пабмед КАС Google Scholar
- 116.
Mattson MP, Allison DB, Fontana L, Harvie M, Longo VD, Malaisse WJ, et al. Частота и время приема пищи в норме и при болезни. Proc Natl Acad Sci U S A. 2014;111(47):16647–53.
Центральный пабмед Статья пабмед КАС Google Scholar
- 117.
Brandhorst S, Choi In Y, Wei M, Cheng Chia W, Sedrakyan S, Navarrete G, et al. Периодическая диета, имитирующая голодание, способствует регенерации многих систем, улучшению когнитивных функций и сохранению здоровья.Клеточный метаб. 2015;22(1):86–99.
Центральный пабмед Статья пабмед КАС Google Scholar
- 118.
Лонго В.Д., Панда С. Голодание, циркадные ритмы и ограниченное по времени питание в здоровой жизни. Клеточный метаб. 2016;23(6):1048–59.
Центральный пабмед Статья пабмед КАС Google Scholar
- 119.
Мартинес-Лопес Н., Тарабра Э., Толедо М., Гарсия-Масия М., Саху С., Колетто Л. и др.Общесистемные преимущества голодания между приемами пищи с помощью аутофагии. Клеточный метаб. 2017;26(6):856–71.e5.
Артикул пабмед КАС Google Scholar
- 120.
Moatt JP, Nakagawa S, Lagisz M, Walling CA. Влияние диетических ограничений на воспроизводство: метааналитическая перспектива. БМС Эвол Биол. 2016;16(1):199.
Центральный пабмед Статья пабмед Google Scholar
- 121.
Шэнли Д.П., Кирквуд Т.Б. Ограничение калорий и старение: анализ истории жизни. Эволюция. 2000;54(3):740–50.
Артикул пабмед КАС Google Scholar
- 122.
Zajitschek F, Georgolopoulos G, Vourlou A, et al. Эволюция при диетических ограничениях отделяет выживание от плодовитости у самок Drosophila melanogaster . J Gerontol A Biol Sci Med Sci. 2018; в печати
- 123.
Страндин Т., Бабаян С.А., Forbes К.М.Рассмотрение влияния обеспечения пищей на иммунитет диких животных. Philos Trans R Soc Lond B. 2018;373(1745):20170088.
Артикул Google Scholar
- 124.
Бутин С. Эксперименты с пищевыми добавками наземных позвоночных: модели, проблемы и будущее. Джан Джей Зул. 1990; 68: 203–20.
Артикул Google Scholar
- 125.
Руффино Л., Сало П., Койвисто Э., Бэнкс П.Б., Корпимяки Э.Репродуктивные реакции птиц на экспериментальные пищевые добавки: метаанализ. Фронт Зоол. 2014;11:80.
Центральный пабмед Статья пабмед КАС Google Scholar
- 126.
Класс М, Хирш Д. Нестареющий вариант развития Caenorhabditis elegans . Природа. 1976; 260: 523–5.
Артикул пабмед КАС Google Scholar
- 127.
Класс МР. Метод выделения долгоживущих мутантов у нематоды Caenorhabditis elegans и первоначальные результаты. Механическое старение Dev. 1983;22(3-4):279–86.
Артикул пабмед КАС Google Scholar
- 128.
Джонсон Т.Е., Митчелл Д.Х., Клайн С., Кемаль Р., Фой Дж. Задержка развития останавливает старение нематоды Caenorhabditis elegans . Механическое старение Dev. 1984;28(1):23–40.
Артикул пабмед КАС Google Scholar
- 129.
Джонсон TE. Старение можно генетически разделить на составные процессы с использованием долгоживущих линий Caenorhabditis elegans . Proc Natl Acad Sci U S A. 1987;84(11):3777–81.
Центральный пабмед Статья пабмед КАС Google Scholar
- 130.
Фридман Д.Б., Джонсон Т.Е. Мутация в гене age-1 у Caenorhabditis elegans удлиняет жизнь и снижает плодовитость гермафродитов.Генетика. 1988;118(1):75–86.
Центральный пабмед пабмед КАС Google Scholar
- 131.
Джонсон Т.Е., Литгоу Г.Дж. Поиск генетической основы старения: идентификация геронтогенов у нематоды Caenorhabditis elegans . J Am Geriatr Soc. 1992;40(9):936–45.
Артикул пабмед КАС Google Scholar
- 132.
Кеньон С., Чанг Дж., Генш Э., Руднер А., Табтианг Р.Мутант C. elegans , который живет вдвое дольше, чем дикий тип. Природа. 1993;366(6454):461–4.
Артикул пабмед КАС Google Scholar
- 133.
Кеньон К. Первые долгоживущие мутанты: открытие пути инсулина/ИФР-1 для старения. Philos Trans R Soc Lond B. 2011; 366 (1561): 9–16.
Артикул КАС Google Scholar
- 134.
Моррис Дж., Тиссенбаум Х., Рувкун Г.Член семейства фосфатидилинозитол-3-ОН киназ, регулирующий продолжительность жизни и диапаузу у Caenorhabditis elegans . Природа. 1996; 382: 536–9.
Артикул пабмед КАС Google Scholar
- 135.
Kimura K, Tissenbaum H, Liu Y, Ruvkun G. daf-2, ген, подобный рецептору инсулина, который регулирует продолжительность жизни и диапаузу у Caenorhabditis elegans . Наука. 1997; 277: 942–6.
Артикул пабмед КАС Google Scholar
- 136.
Огг С., Паради С., Готтлиб С., Паттерсон Г., Ли Л., Тиссенбаум Х. и др. Транскрипционный фактор Fork head DAF-16 передает инсулиноподобные метаболические сигналы и сигналы долголетия у C. elegans . Природа. 1997; 389: 994–9.
Артикул пабмед КАС Google Scholar
- 137.
Lee S, Kennedy S, Tolonen A, Ruvkun G. Гены-мишени DAF-16, которые контролируют C. elegans продолжительность жизни и метаболизм. Наука. 2003; 300: 644–7.
Артикул пабмед КАС Google Scholar
- 138.
Лин К., Дорман Дж., Родан А., Кеньон К. daf-16: член семейства HNF-3/forkhead, который может удвоить продолжительность жизни Caenorhabditis elegans . Наука. 1997; 278:1319–22.
Артикул пабмед КАС Google Scholar
- 139.
Murphy C, McCarroll S, Bargmann C, Fraser A, Kamath R, Ahringer J, et al.Гены, которые действуют после DAF-16, влияют на продолжительность жизни Caenorhabditis elegans . Природа. 2003; 424: 277–84.
Артикул пабмед КАС Google Scholar
- 140.
Хванбо Д.С., Гершам Б., Ту М.П., Палмер М., Татар М. Дрозофила dFOXO контролирует продолжительность жизни и регулирует передачу сигналов инсулина в головном мозге и жировом теле. Природа. 2004;429(6991):562–6.
Артикул пабмед КАС Google Scholar
- 141.
Giannakou ME, Goss M, Junger MA, Hafen E, Leevers SJ, Partridge L. Долгоживущие Drosophila со сверхэкспрессией dFOXO в жировом теле взрослого человека. Наука. 2004;305(5682):361.
Артикул пабмед КАС Google Scholar
- 142.
Капахи П., Зид Б.М., Харпер Т., Кословер Д., Сапин В., Бензер С. Регулирование продолжительности жизни у дрозофилы путем модуляции генов в сигнальном пути TOR. Карр Биол. 2004;14(10):885–90.
Центральный пабмед Статья пабмед КАС Google Scholar
- 143.
Блюхер М., Кан Б.Б., Кан Ч.Р. Увеличение продолжительности жизни у мышей, у которых отсутствует рецептор инсулина в жировой ткани. Наука. 2003;299(5606):572–4.
Артикул пабмед КАС Google Scholar
- 144.
Selman C, Lingard S, Choudhury AI, Batterham RL, Claret M, Clements M, et al. Доказательства увеличения продолжительности жизни и замедления возрастных биомаркеров у мышей с нулевым субстратом инсулинового рецептора 1.FASEB J. 2008;22(3):807–18.
Артикул пабмед КАС Google Scholar
- 145.
Holzenberger M, Dupont J, Ducos B, Leneuve P, Géloen A, Even PC, et al. Рецептор IGF-1 регулирует продолжительность жизни и устойчивость к окислительному стрессу у мышей. Природа. 2003; 421:182–7.
Артикул пабмед КАС Google Scholar
- 146.
Тагучи А., Вартшоу Л.М., Уайт М.Ф.Мозговая передача сигналов IRS2 координирует продолжительность жизни и гомеостаз питательных веществ. Наука. 2007;317(5836):369–72.
Артикул пабмед КАС Google Scholar
- 147.
Flachsbart F, Caliebe A, Kleindorp R, Blanche H, von Eller-Eberstein H, Nikolaus S, et al. Связь вариации FOXO3A с продолжительностью жизни человека подтверждена у немецких долгожителей. Proc Natl Acad Sci U S A. 2009;106(8):2700–5.
Центральный пабмед Статья пабмед Google Scholar
- 148.
Willcox BJ, Donlon TA, He Q, Chen R, Grove JS, Yano K, et al. Генотип FOXO3A тесно связан с долголетием человека. Proc Natl Acad Sci U S A. 2008;105(37):13987–92.
Центральный пабмед Статья пабмед Google Scholar
- 149.
Suh Y, Atzmon G, Cho MO, Hwang D, Liu B, Leahy DJ, et al. Функционально значимые мутации рецептора инсулиноподобного фактора роста I у долгожителей. Proc Natl Acad Sci U S A. 2008;105(9):3438–42.
Центральный пабмед Статья пабмед Google Scholar
- 150.
Tazearslan C, Huang J, Barzilai N, Suh Y. Нарушение передачи сигналов IGF1R в клетках, экспрессирующих аллели человеческого IGF1R, связанные с долголетием. Стареющая клетка. 2011;10(3):551–4.
Центральный пабмед Статья пабмед КАС Google Scholar
- 151.
Passtoors WM, Beekman M, Deelen J, van der Breggen R, Maier AB, Guigas B, et al.Анализ экспрессии генов пути mTOR: связь с долголетием человека. Стареющая клетка. 2013;12(1):24–31.
Артикул пабмед КАС Google Scholar
- 152.
Flachsbart F, Dose J, Gentschew L, Geismann C, Caliebe A, Knecht C, et al. Идентификация и характеристика двух функциональных вариантов гена долголетия человека FOXO3. Нац коммун. 2017;8(1):2063.
Центральный пабмед Статья пабмед КАС Google Scholar
- 153.
Бьедов И., Тойвонен Дж. М., Керр Ф., Слэк С., Джейкобсон Дж., Фоли А. и др. Механизмы увеличения продолжительности жизни рапамицином плодовой мушки Drosophila melanogaster . Клеточный метаб. 2010;11(1):35–46.
Центральный пабмед Статья пабмед КАС Google Scholar
- 154.
Harrison DE, Strong R, Sharp ZD, Nelson JF, Astle CM, Flurkey K, et al. Рапамицин, вводимый в конце жизни, увеличивает продолжительность жизни генетически гетерогенных мышей.Природа. 2009; 460:392–5.
Центральный пабмед Статья пабмед КАС Google Scholar
- 155.
Миллер Р.А., Харрисон Д.Э., Астл К.М., Фернандес Э., Флурки К., Хан М. и другие. Опосредованное рапамицином увеличение продолжительности жизни у мышей зависит от дозы и пола и метаболически отличается от диетического ограничения. Стареющая клетка. 2014;13(3):468–77.
Центральный пабмед Статья пабмед КАС Google Scholar
- 156.
Johnson SC, Rabinovitch PS, Kaeberlein M. mTOR является ключевым модулятором старения и возрастных заболеваний. Природа. 2013; 493:338–45.
Центральный пабмед Статья пабмед КАС Google Scholar
- 157.
Кеннеди Б.К., Лэмминг Д.В. Механическая мишень рапамицина: главный проводник метаболизма и старения. Клеточный метаб. 2016;23(6):990–1003.
Центральный пабмед Статья пабмед КАС Google Scholar
- 158.
Swanson EM, Dantzer B. Инсулиноподобный фактор роста-1 связан с изменением жизненного цикла млекопитающих. Proc R Soc Lond B. 2014;281(1782):20132458.
Артикул КАС Google Scholar
- 159.
Данцер Б., Суонсон Э.М. Опосредование истории жизни позвоночных через инсулиноподобный фактор роста-1. Biol Rev. 2012;87(2):414–29.
Артикул пабмед Google Scholar
- 160.
Де Йонг Г., Бочдановиц З. Широтные клины в Drosophila melanogaster : размер тела, частоты аллозимов, частоты инверсий и путь передачи сигналов инсулина. Дж. Жене. 2003;82(3):207–23.
Артикул пабмед КАС Google Scholar
- 161.
Фабиан Д.К., Капун М., Нольте В., Кофлер Р., Шмидт П.С., Шлоттерер С. и др. Полногеномные закономерности широтной дифференциации среди популяций Drosophila melanogaster из Северной Америки.Мол Экол. 2012;21(19):4748–69.
Центральный пабмед Статья пабмед Google Scholar
- 162.
Капун М., Фабиан Д.К., Гуде Дж., Флэтт Т. Геномные доказательства адаптивных инверсионных клинов у Drosophila melanogaster . Мол Биол Эвол. 2016;33(5):1317–36.
Артикул пабмед КАС Google Scholar
- 163.
Flatt T, Amdam GV, Kirkwood TBL, Omholt SW.Эволюция жизненного цикла и полифеническая регуляция соматического поддержания и выживания. Q Rev Biol. 2013;88(3):185–218.
Артикул пабмед Google Scholar
- 164.
Пааби А.Б., Блэкет М.Дж., Хоффманн А.А., Шмидт П.С. Идентификация кандидата на адаптивный полиморфизм для дрозофилы в жизненном цикле параллельными независимыми клинами на двух континентах. Мол Экол. 2010;19(4):760–74.
Артикул пабмед КАС Google Scholar
- 165.
Полиция Стэнли, Нгома Э., О’Дей С., Кинг Э.Г. Генетический анализ пластичности, вызванной питанием, в передаче сигналов инсулина / инсулиноподобного фактора роста и средней продолжительности жизни в популяции дрозофил с несколькими родителями. Генетика. 2017;206(2):587–602.
Центральный пабмед Статья пабмед КАС Google Scholar
- 166.
Родригес М.А., Флэтт Т. Эндокринное разъединение компромисса между размножением и соматическим поддержанием у эусоциальных насекомых.Curr Opin Insect Sci. 2016; 16:1–8.
Артикул пабмед Google Scholar
- 167.
Амент С.А., Корона М., Поллок Х.С., Робинсон Г.Э. Передача сигналов инсулина участвует в регуляции разделения труда рабочих в семьях медоносных пчел. Proc Natl Acad Sci U S A. 2008;105(11):4226–31.
Центральный пабмед Статья пабмед Google Scholar
- 168.
Corona M, Velarde RA, Remolina S, Moran-Lauter A, Wang Y, Hughes KA, et al.Вителлогенин, ювенильный гормон, передача сигналов инсулина и долголетие маток медоносных пчел. Proc Natl Acad Sci U S A. 2007;104(17):7128–33.
Центральный пабмед Статья пабмед КАС Google Scholar
- 169.
Wang Y, Mutti NS, Ihle KE, Siegel A, Dolezal AG, Kaftanoglu O, et al. Понижающая регуляция гена IRS медоносной пчелы смещает поведение в сторону пищи, богатой белком. Генетика PLoS. 2010;6(4):e1000896.
Центральный пабмед Статья пабмед КАС Google Scholar
- 170.
Мутти Н.С., Ван Ю., Кафтаноглу О., Амдам Г.В. PTEN медоносной пчелы — описание, нокдаун развития и тканеспецифическая экспрессия сплайс-вариантов, коррелирующих с альтернативными социальными фенотипами. ПЛОС Один. 2011;6(7):e22195.
Центральный пабмед Статья пабмед КАС Google Scholar
- 171.
Wang Y, Azevedo SV, Hartfelder K, Amdam G. Инсулиноподобные пептиды (AmILP1 и AmILP2) по-разному влияют на развитие женской касты медоносной пчелы ( Apis mellifera ).J Эксперт Биол. 2013; 216:4347–57.
Центральный пабмед Статья пабмед КАС Google Scholar
- 172.
Патель А., Фондрк М.К., Кафтаноглу О., Эморе С., Хант Г., Фредерик К. и др. Создание королевы: путь TOR является ключевым игроком в развитии дифенической касты. ПЛОС Один. 2007;2(6):e509.
Центральный пабмед Статья пабмед КАС Google Scholar
- 173.
Libbrecht R, Corona M, Wende F, Azevedo DO, Serrão JE, Keller L. Взаимодействие между передачей сигналов инсулина, ювенильным гормоном и вителлогенином регулирует материнские эффекты на полифенизм у муравьев. Proc Natl Acad Sci U S A. 2013;110(27):11050–5.
Центральный пабмед Статья пабмед Google Scholar
- 174.
Кирквуд ТБЛ. Понимание странной науки о старении. Клетка. 2005;120(4):437–47.
Артикул пабмед КАС Google Scholar
- 175.
Флэтт Т., Хейланд А. Механизмы эволюции истории жизни — генетика и физиология черт истории жизни и компромиссы. Оксфорд: Издательство Оксфордского университета; 2011.
Книга Google Scholar
- 176.
Гейгер-Торнсберри Г.Л., Маккей Т.Ф. Локусы количественных признаков, влияющие на естественную изменчивость долголетия Drosophila . Механическое старение Dev. 2004;125(3):179–89.
Артикул пабмед КАС Google Scholar
- 177.
Flatt T. Оценка естественной изменчивости генов, влияющих на продолжительность жизни Drosophila . Механическое старение Dev. 2004;125(3):155–9.
Артикул пабмед КАС Google Scholar
- 178.
Ремолина С.К., Чанг П.Л., Лейпс Дж., Нуждин С.В., Хьюз К.А. Геномные основы старения и эволюции жизненного цикла Drosophila melanogaster. Эволюция. 2012;66(11):3390–403.
Центральный пабмед Статья пабмед Google Scholar
- 179.
Карнес М.Ю., Кэмпбелл Т., Хуанг В., Батлер Д.Г., Карбоне М.А., Дункан Л.Х. и другие. Геномная основа отсроченного старения у Drosophila melanogaster . ПЛОС Один. 2015;10(9):e0138569.
Центральный пабмед Статья пабмед КАС Google Scholar
- 180.
Minghui W, Qishan W, Zhen W, Qingping W, Xiangzhe Z, Yuchun P. Молекулярно-эволюционные модели сигнального пути инсулина/FOXO. Эвол Биоинформа.2013; 9:1–16.
Артикул Google Scholar
- 181.
Alvarez-Ponce D, Aguade M, Rozas J. Сравнительная геномика пути передачи сигнала инсулина/TOR у позвоночных: анализ селективного давления на уровне сети. Геном Биол Эвол. 2011;3:87–101.
Артикул пабмед КАС Google Scholar
- 182.
Garschall K, Flatt T. Взаимодействие между иммунитетом и старением у Drosophila .F1000рез. 2018;7:160.
Центральный пабмед Статья пабмед Google Scholar
- 183.
Санада Ф., Танияма Ю., Мурацу Дж., Оцу Р., Симидзу Х., Ракуги Х., Моришита Р. Источник хронического воспаления при старении. Front Cardiovasc Med. 2018;5:12.
Центральный пабмед Статья пабмед Google Scholar
- 184.
Бектас А., Шурман С.Х., Сен Р., Ферруччи Л. Старение, воспаление и окружающая среда.Опыт Геронтол. 2018;105:10–8.
Артикул пабмед КАС Google Scholar
- 185.
Комфорт А. Биология старения. Лондон: Рутле и Кеган Пол; 1956.
Книга Google Scholar
- 186.
Джонс О.Р., Шойерляйн А., Сальгеро-Гомес Р., Камарда К.Г., Шайбл Р., Каспер Б.Б. и др. Разнообразие старения на древе жизни. Природа. 2014; 505(7482):169–73.
Артикул пабмед КАС Google Scholar
- 187.
Baudisch A, Salguero-Gómez R, Jones OR, Wrycza T, Mbeau-Ache C, Franco M, et al. Темп и форма старения покрытосеменных растений. J Экол. 2013;101(3):596–06.
Артикул Google Scholar
- 188.
Garcia MB, Dahlgren JP, Ehrlén J. Нет признаков старения 300-летней горной травы. J Экол.2011;99(6):1424–30.
Артикул Google Scholar
- 189.
Шейбл Р., Шойерляйн А., Данько М.Ю., Гампе Дж., Мартинес Д.Е., Ваупель Дж.В. Постоянная смертность и рождаемость с возрастом у гидры . Proc Natl Acad Sci U S A. 2015;112(51):15701–6.
Центральный пабмед пабмед КАС Google Scholar
- 190.
Руби Дж. Г., Смит М., Баффенштейн Р. Смертность голых землекопов не соответствует законам Гомперца, поскольку не увеличивается с возрастом.жизнь. 2018;7:e31157.
Центральный пабмед Статья пабмед Google Scholar
- 191.
Леметр Ж-Ф, Гайар Ж-М. Репродуктивное старение: новые перспективы в дикой природе. Биол Rev. 2017; 92: 2182–99.
Артикул пабмед Google Scholar
- 192.
Finch CE, Austad SN. История и перспективы: симпозиум по организмам с медленным старением. Опыт Геронтол. 2001;36(4):593–7.
Артикул пабмед КАС Google Scholar
- 193.
Finch CE. Обновление о медленном старении и незначительном старении — мини-обзор. Геронтология. 2009;55(3):307–13.
Артикул пабмед Google Scholar
- 194.
Finch CE. Различия в старении и продолжительности жизни включают возможность незначительного старения. J Gerontol A Biol Sci Med Sci. 1998;53(4):B235–9.
Артикул пабмед КАС Google Scholar
- 195.
Vaupel JW, Baudisch A, Dolling M, Roach DA, Gampe J. Случай отрицательного старения. Теория народной биологии. 2004;65(4):339–51.
Артикул пабмед Google Scholar
- 196.
Salguero-Gómez R, Shefferson RP, Hutchings MJ. Растения не в счет… или нет? Новые взгляды на универсальность старения.J Экол. 2013;101(3):545–54.
Центральный пабмед Статья пабмед Google Scholar
- 197.
Peron G, Gimenez O, Charmantier A, Gaillard JM, Crochet PA. Возраст начала старения у птиц и млекопитающих предсказывается по продуктивности в раннем возрасте. Proc R Soc Lond B. 2010;277:2849–56.
Артикул Google Scholar
- 198.
Warner DA, Miller DAW, Bronikowski AM, Janzen FJ.Десятилетия полевых данных показывают, что черепахи стареют в дикой природе. Proc Natl Acad Sci U S A. 2016;113:6502–7.
Центральный пабмед Статья пабмед КАС Google Scholar
- 199.
Партридж Л., Бартон Н.Х. Об измерении скорости старения. Proc R Soc Lond B. 1996;263(1375):1365–71.
Артикул Google Scholar
- 200.
Петралия Р.С., Мэтсон М.П., Яо П.Дж.Старение и долголетие у простейших животных и стремление к бессмертию. Aging Res Rev. 2014; 16:66–82.
Артикул пабмед Google Scholar
- 201.
Bythell JC, Brown BE, Kirkwood TBL. Стареют ли рифовые кораллы? Биол Rev. 2017; 93 (2): 1192–02.
Артикул пабмед Google Scholar
- 202.
Ноден ЛД. Старение всего растения. В: Тиман К.В., Леопольд А.С., редакторы.Старение и старение растений. Кембридж: Академическая пресса; 1988. с. 391–439.
- 203.
Нельсон П., Мазел Дж. Межклеточная конкуренция и неизбежность многоклеточного старения. Proc Natl Acad Sci U S A. 2017;114(49):12982–7.
Центральный пабмед Статья пабмед КАС Google Scholar
- 204.
Белл Г. Секс и смерть простейших. Кембридж: Издательство Кембриджского университета; 1988.
Google Scholar
- 205.
Кирквуд ТБЛ. Бессмертие зародышевой линии против одноразовости сомы. В: Вудхед А.Д., Томпсон К.Х., редакторы. Эволюция долголетия у животных: сравнительный подход. Бостон: Springer США; 1987. с. 209–18.
Глава Google Scholar
- 206.
Джонс Д.Л. Старение и зародышевая линия: где встречаются смертность и бессмертие. Стволовые клетки, ред. 2007;3(3):192–200.
Артикул пабмед КАС Google Scholar
- 207.
Weissmann A. Die Continuität des Keimplasmas als Grundlage einer Theorie der Vererbung. Йена: Густав Фишер; 1885.
Google Scholar
- 208.
Акерманн М., Чао Л., Бергстром К.Т., Доебели М. Об эволюционном происхождении старения. Стареющая клетка. 2007;6(2):235–44.
Центральный пабмед Статья пабмед КАС Google Scholar
- 209.
Buffenstein R. Незначительное старение у самого долгоживущего грызуна, голого землекопа: взгляды на успешно стареющие виды.J Comp Physiol B. 2008;178(4):439–45.
Артикул пабмед Google Scholar
- 210.
Kim EB, Fang X, Fushan AA, Huang Z, Lobanov AV, Han L, et al. Секвенирование генома дает представление о физиологии и продолжительности жизни голого землекопа. Природа. 2011;479(7372):223–7.
Центральный пабмед Статья пабмед КАС Google Scholar
- 211.
Валенцано Д.Р., Абубакер А., Селуанов А., Горбунова В.Неканонические системы моделей старения и зачем они нам нужны. EMBO J. 2017;36(8):959–63.
Центральный пабмед Статья пабмед КАС Google Scholar
- 212.
Kim Y, Nam HG, Valenzano DR. Недолгоживущий африканский бирюзовый киллифиш: новая экспериментальная модель старения. Dis Model Mech. 2016;9(2):115–29.
Центральный пабмед Статья пабмед Google Scholar
- 213.
Валенсано Дарио Р., Бенаюн Беренис А., Сингх Парам П., Чжан Э., Эттер Пол Д., Ху С.-К. и др. Геном африканской бирюзовой киллифи дает представление об эволюции и генетической архитектуре продолжительности жизни. Клетка. 2015;163(6):1539–54.
Центральный пабмед Статья пабмед КАС Google Scholar
- 214.
Monaghan P, Charmantier A, Nussey DH, Ricklefs RE. Эволюционная экология старения. Функция Экол. 2008;22(3):371-8.
Артикул Google Scholar
- 215.
Wilkinson GS, South JM. История жизни, экология и долголетие летучих мышей. Стареющая клетка. 2002;1(2):124–31.
Артикул пабмед КАС Google Scholar
- 216.
Келлер Л., Женоуд М. Необычайная продолжительность жизни муравьев: проверка эволюционных теорий старения. Природа. 1997; 389: 958–60.
Артикул КАС Google Scholar
- 217.
Келлер Л., Джемилити С. Социальные насекомые как модель для изучения молекулярных основ старения. Опыт Геронтол. 2006; 41: 553–56.
Артикул пабмед КАС Google Scholar
- 218.
Kuhn JMM, Korb J. Редакционный обзор: общественные насекомые: старение и изменение соотношения плодовитости/долголетия с социальностью. Curr Opin Insect Sci. 2016;16:vii–x.
Артикул Google Scholar
- 219.
Хайнце Дж., Шремпф А. Старение и размножение общественных насекомых – мини-обзор. Геронтология. 2008; 54:160–7.
Артикул пабмед Google Scholar
- 220.
Schrempf A, Giehr J, Röhrl R, Steigleder S, Heinze J. Королевские дарвиновские демоны: вынужденные изменения в репродуктивных усилиях не влияют на продолжительность жизни муравьиных маток. Я Нат. 2017;189(4):436–42.
Артикул пабмед Google Scholar
- 221.
von Wyschetzki K, Rueppell O, Oettler J, Heinze J. Транскриптомные подписи отражают отсутствие компромисса между плодовитостью и долголетием у муравьиных маток. Мол Биол Эвол. 2015;32:3173–85.
Центральный пабмед пабмед КАС Google Scholar
- 222.
Хартманн А., Хайнце Дж. Откладывать яйца, жить дольше: разделение труда и продолжительность жизни у клональных видов муравьев. Эволюция. 2003; 57: 2424–9.
Артикул пабмед Google Scholar
- 223.
Крамер Б.Х., Шремпф А., Шойерляйн А., Хайнце Дж. Колонии муравьев не жертвуют воспроизводством ради содержания. ПЛОС Один. 2015;10:e0137969.
Центральный пабмед Статья пабмед КАС Google Scholar
- 224.
Блачер П., Хаггинс Т.Дж., Бурк АФГ. Эволюция старения, затраты на воспроизводство и компромисс между плодовитостью и долголетием у эусоциальных насекомых. Proc R Soc Lond B. 2017; 284:20170380.
Артикул Google Scholar
- 225.
Баффенштейн Р., Джарвис ЮМ. Голый землекоп — новый рекорд старейших ныне живущих грызунов. Sci Aging Knowl Environment. 2002;2002(21):pe7.
Артикул Google Scholar
- 226.
Kramer BH, van Doorn GS, Weissing FJ, Pen I. Различия в продолжительности жизни между кастами социальных насекомых: проблемы и возможности для эволюционных теорий старения. Curr Opin Insect Sci. 2016;16:76–80.
Артикул пабмед Google Scholar
- 227.
Kramer BH, Schaible R. Эволюция продолжительности жизни у социальных работников — теоретический подход к пониманию последствий внешней смертности в иерархической системе. ПЛОС Один. 2013;8:e61813.
Центральный пабмед Статья пабмед КАС Google Scholar
- 228.
Бурк АФГ. Родственный отбор и эволюционная теория старения. Annu Rev Ecol Evol Syst. 2007; 38: 103–28.
Артикул Google Scholar
- 229.
Мишо RE. Эволюция индивидуальности при переходе от одноклеточной жизни к многоклеточной. Proc Natl Acad Sci U S A. 2007;104:8613–8.
Центральный пабмед Статья пабмед КАС Google Scholar
- 230.
Неделку А., Мишод Р.Э. Молекулярные механизмы компромиссов в жизненном цикле и эволюция многоклеточной сложности у вольвокалевых зеленых водорослей. В: Flatt T, Heyland A, редакторы. Механизмы эволюции истории жизни — генетика и физиология черт истории жизни и компромиссы.Оксфорд: Издательство Оксфордского университета; 2011. с. 271–83.
- 231.
Рюффлер С., Хермиссон Дж., Вагнер Г.П. Эволюция функциональной специализации и разделения труда. Proc Natl Acad Sci U S A. 2012;109(6):1830–1.
Артикул Google Scholar
- 232.
Партридж Л. Измерение затрат на воспроизводство. Тенденции Экол Эвол. 1992;7(3):99–100.
Артикул пабмед КАС Google Scholar
- 233.
ван Нордвейк А., де Йонг Г. Приобретение и распределение ресурсов: их влияние на изменение тактики жизненного цикла. Я Нат. 1986;128(1):137–42.
Артикул Google Scholar
- 234.
Меткалф CJE. Невидимые компромиссы: Ван Нордвейк и де Йонг и эволюция истории жизни. Я Нат. 2016;187(4):iii–v.
Артикул пабмед Google Scholar
- 235.
Клепсател П., Галикова М., Майо Н., Риччи С., Шлоттерер С., Флэтт Т. Репродуктивная и пострепродуктивная история жизни выловленных в дикой природе Drosophila melanogaster в лабораторных условиях. Дж. Эвол Биол. 2013;26(7):1508–20.
Артикул пабмед КАС Google Scholar
- 236.
Charlesworth B. Модели оптимизации, количественная генетика и мутация. Эволюция. 1990; 44: 520–38.
Артикул пабмед Google Scholar
- 237.
Sundström J, Gulliksson G, Wirén M. Синергетические эффекты гипотензивных препаратов и статинов: систематический обзор и метаанализ. BMJ Evid Основанная Мед. 2018;23(2):64–9.
Артикул пабмед Google Scholar
- 238.
Blenis J. TOR, ворота к клеточному метаболизму, росту клеток и болезням. Клетка. 2017;171(1):10–3.
Артикул пабмед КАС Google Scholar
- 239.
Манник Дж. Б., Дель Джудис Г., Латтанзи М., Валианте Н. М., Престгаард Дж., Хуан Б., Лонетто М. А., Мэкер Х. Т., Коварик Дж., Карсон С. и др. Ингибирование mTOR улучшает иммунную функцию у пожилых людей. Sci Transl Med. 2014;6(268):268ra179.
Артикул пабмед КАС Google Scholar
- 240.
Барзилай Н., Крэндалл Дж.П., Кричевский С.Б., Эспеланд М.А. Метформин как средство борьбы со старением. Клеточный метаб. 2016;23(6):1060–5.
Центральный пабмед Статья пабмед КАС Google Scholar
- 241.
Johnson SC, Kaeberlein M. Рапамицин при старении и заболеваниях: максимальная эффективность при минимальных побочных эффектах. Онкотаргет. 2016;7(29):44876–8.
Центральный пабмед Статья пабмед Google Scholar
- 242.
Чайлдс Б.Г., Глушевич М., Бейкер Д.Дж., Лаберж Р.М., маркиз Д., Дананберг Дж., ван Дерсен Дж.М. Стареющие клетки: новая мишень для болезней старения. Nat Rev Drug Discov. 2017;16:718–35.
Центральный пабмед Статья пабмед КАС Google Scholar
- 243.
Чайлдс Б.Г., Дурик М., Бейкер Д.Дж., ван Дерсен Дж.М. Клеточное старение при старении и возрастных заболеваниях: от механизмов к терапии. Нат Мед. 2015;21:1424–35.
Центральный пабмед Статья пабмед КАС Google Scholar
- 244.
Рэндо Томас А., Чанг Ховард Ю. Старение, омоложение и эпигенетическое перепрограммирование: сброс часов старения. Клетка. 2012;148(1):46–57.
Центральный пабмед Статья пабмед КАС Google Scholar
- 245.
Кларк Р.И., Уокер Д.В. Роль микробиоты кишечника в ухудшении здоровья, связанном со старением: выводы из моделей беспозвоночных. Cell Mol Life Sci. 2018;75(1):93–101.
Артикул пабмед КАС Google Scholar
- 246.
Кунду П., Блахер Э., Элинав Э., Петтерссон С. Наш кишечный микробиом: развивающееся внутреннее «я». Клетка. 2017;171(7):1481–93.
Артикул пабмед КАС Google Scholar
- 247.
Schmidt TSB, Raes J, Bork P. Микробиом кишечника человека: от ассоциации к модуляции. Клетка. 2018;172(6):1198–215.
Артикул пабмед КАС Google Scholar
- 248.
Смит П., Виллемсен Д., Попкес М., Метге Ф., Гандива Э., Рейхард М., Валенцано Д.Р. Регуляция продолжительности жизни микробиотой кишечника у короткоживущих африканских бирюзовых киллифиш. жизнь. 2017;6:e27014.
Центральный пабмед пабмед Статья Google Scholar
- 249.
Навыки для развития
Согласно Американскому журналу клинического питания , продолжительность жизни человека или максимально возможная продолжительность жизни человека составляет 130 лет. Человеческие тела значительно меняются с течением времени, и пища является топливом для этих изменений. Людям всех возрастов нужны одни и те же основные питательные вещества — незаменимые аминокислоты, углеводы, незаменимые жирные кислоты и двадцать восемь витаминов и минералов — для поддержания жизни и здоровья.Однако количество необходимых питательных веществ различается. На протяжении всего жизненного цикла человека тело постоянно изменяется и проходит различные периоды, известные как стадии. Основные этапы жизненного цикла человека определяются следующим образом:
Изменения во время беременности
Рисунок 12.2.1: На этом ультразвуковом изображении показан четырехмесячный плод. Ультразвуковое изображение плода в утробе матери на 12-й неделе беременности (двумерное сканирование). Вольфганг Мородер .
В этой главе мы сосредоточимся на жизненном цикле человека от внутриутробного периода до раннего детства. Мы начинаем с беременности — марафона развития, который длится около сорока недель. Он начинается с первого триместра (с первой по двенадцатую неделю), продолжается во втором триместре (с тринадцатой по двадцать седьмую неделю) и заканчивается в третьем триместре (с двадцать восьмой недели до рождения). При зачатии сперматозоид оплодотворяет яйцеклетку, образуя зиготу. Зигота быстро делится на несколько клеток и в течение двух недель становится эмбрионом и имплантируется в стенку матки, где развивается в плод.Некоторые из основных происходящих изменений включают разветвление нервных клеток с образованием примитивных нервных путей через восемь недель. На двадцатой неделе врачи обычно проводят УЗИ, чтобы получить информацию о плоде и проверить наличие аномалий. К этому времени уже можно узнать пол малыша. В двадцать восемь недель будущий ребенок начинает добавлять жировые отложения, готовясь к жизни вне матки. На протяжении всего этого процесса выбор питания беременной женщины влияет не только на развитие плода, но и на ее собственное здоровье и будущее здоровье ее новорожденного.
Изменения в младенчестве
В младенчестве происходит ряд крупных физиологических изменений. Туловище растет быстрее, чем руки и ноги, а голова становится менее заметной по сравнению с конечностями. Органы и системы органов растут с большой скоростью. Также в этот период формируется бесчисленное количество новых синапсов, связывающих нейроны головного мозга. Две мягкие точки на черепе ребенка, известные как роднички, позволяют черепу приспосабливаться к быстрому росту мозга. Задний родничок закрывается первым, к восьминедельному возрасту.Передний родничок закрывается примерно через год, в среднем в восемнадцать месяцев. Вехи развития включают сидение без поддержки, обучение ходьбе, прорезывание зубов и вокализацию среди многих, многих других. Все эти изменения требуют адекватного питания для обеспечения развития с соответствующей скоростью.
Изменения в детском возрасте
Основные физиологические изменения продолжаются и в раннем возрасте. В отличие от младенческого возраста конечности растут значительно быстрее туловища, что придает телу более пропорциональный вид.К концу третьего года малыш становится выше и стройнее, чем младенец, с более прямой осанкой. По мере роста ребенка плотность кости увеличивается, и костная ткань постепенно заменяет хрящевую. Этот процесс, известный как окостенение, не завершается до полового созревания. Вехи развития включают бег, рисование, приучение к туалету и самостоятельное кормление. То, как малыш ведет себя, говорит, учится и ест, дает важные подсказки об его развитии.
Рис. 12.2.2: Когда дети взрослеют, их друзья могут оказывать сильное влияние на их выбор питания. (CC-BY-SA 2.0; USDA)
Изменения в детстве
Раннее детство охватывает период младенчества и ясельного возраста, от рождения до трехлетнего возраста. Оставшаяся часть детства — это период от четырех до восьми лет, когда дети идут в школу. На этом жизненном этапе происходит ряд критических физиологических и эмоциональных изменений.Например, конечности ребенка неуклонно удлиняются, тогда как рост других частей тела начинает замедляться. К десяти годам череп и мозг вырастают почти до размеров взрослого человека. Также происходят эмоциональные и психологические изменения. Отношения и мнения детей о еде углубляются. Они начинают получать информацию о предпочтениях в еде не только от членов семьи, но и от сверстников и более широкой культуры. Все эти факторы должны влиять на выбор питания, который родители делают для своих детей. В этот период жизни ребенка у родителей и других опекунов есть возможность укрепить хорошие привычки в еде и ввести в рацион новые продукты, не забывая при этом о предпочтениях ребенка.Родители также должны служить образцом для подражания для своих детей, которые часто будут подражать их поведению и привычкам в еде.
Изменения в период полового созревания
Начало полового созревания является началом подросткового возраста и мостом между детством и юностью. С медицинской точки зрения подростковый возраст определяется как период от одиннадцати до четырнадцати лет для девочек и от двенадцати до пятнадцати лет для мальчиков. В целях обсуждения влияния выбора питания в течение жизненного цикла в этом тексте будут следовать Руководству по питанию для американцев 2010 г. , которое делит подростковый возраст на два этапа: возраст от девяти до тринадцати лет, или половое созревание, и возраст от четырнадцати до восемнадцати лет. или поздний подростковый возраст.Сначала мы обсудим половое созревание. Некоторые из важных физиологических изменений, которые происходят на этом этапе, включают развитие первичных половых признаков или репродуктивных органов, а также начало менструации у женщин. Этот этап жизни также характеризуется появлением вторичных половых признаков, таких как рост волос на лице и теле, развитие молочных желез у девочек и огрубление голоса у мальчиков. Другие физические изменения включают быстрый рост и изменение пропорций тела.Все эти изменения, а также сопутствующие психические и эмоциональные изменения должны поддерживаться правильным питанием.
Изменения в позднем подростковом возрасте
Диетические рекомендации определяют следующую фазу жизненного цикла человека, поздний подростковый возраст, как период от четырнадцати до восемнадцати лет. После полового созревания скорость физического роста замедляется. Девочки перестают расти в возрасте около шестнадцати лет, в то время как мальчики продолжают расти в возрасте от восемнадцати до двадцати лет.Одно из психологических и эмоциональных изменений, которые происходят на этом жизненном этапе, включает стремление к независимости, поскольку подростки развивают свою индивидуальную идентичность отдельно от своей семьи. По мере того, как подростки принимают все больше и больше решений о своем питании, родители или другие лица, осуществляющие уход, и авторитетные лица должны направлять их к правильному выбору питательных веществ.
Ключевые выводы
Человеческое тело постоянно развивается и изменяется на протяжении всей жизни человека, а пища служит топливом для этих изменений.Основные этапы жизненного цикла человека включают беременность, младенчество, ранние годы, детство, половое созревание, старшую юность, взрослую жизнь, средний возраст и пожилые годы. Правильное питание и физические упражнения обеспечивают здоровье и хорошее самочувствие на каждом этапе жизненного цикла человека.
Начало обсуждения
Хронологический возраст – обзор
2.3 Хронология возраста
Подход, основанный на клиническом развитии, гораздо меньше фокусируется на хронологическом возрасте, чем большинство исследовательских подходов к развитию и психопатологии. К сожалению, стало довольно распространенным называть модель или исследование примером исследования «психологии развития», если в качестве значимой переменной используется возраст. Но хронологический возраст — это очень грубый показатель основных процессов биологического созревания, когнитивных способностей, отношений со сверстниками и семьей, а также понимания человеком самого себя.Возраст, конечно, играет роль в развитии большинства из этих областей, но зачастую в каждой из этих областей в пределах одной возрастной группы наблюдаются значительные различия в зрелости.
Существуют, конечно, и возрастные тенденции некоторых форм психопатологии. Например, уровень самоубийств резко возрастает в подростковом возрасте, как и другие расстройства, такие как депрессия, и проблемы с поведением. Шизофрения обычно является заболеванием, которое начинается в позднем подростковом или юношеском возрасте. Таким образом, возраст может служить простым способом организовать понимание многих лежащих в основе патогенных процессов.Однако простота этого подхода обманчива (см. Rutter 1989).
При психопатологическом развитии, как и при нормальном развитии, мы часто обнаруживаем, что хронологический возраст никоим образом не является гарантией того, что основные когнитивные и социально-когнитивные процессы имели место. Например, несмотря на утверждения в учебниках об обратном, многие подростки и взрослые никогда не достигают формально-операционного мышления (т. е. таблицы в типичном учебнике по психологии указывают подростковый возраст рядом с формальными операциями, как будто все подростки функционируют на этой когнитивной стадии).В то время как многие подростки достигли формально-операционального уровня мышления, другие продолжают функционировать на уровне конкретных операций и даже могут оставаться на этом уровне до конца жизни.
Следовательно, если использовать в качестве основного маркера развития хронологический возраст, то важные вариации, встречающиеся в каждой группе нормально развивающихся индивидуумов, получат недостаточное внимание. Для психолога, занимающегося клиническим развитием, это означает, что хронологический возраст необходимо дополнить специфическим для предметной области пониманием способностей человека в различных областях развития.
Но, хотя способности часто измеряются с точки зрения хронологического возраста, более сложные измерения развития, которые мы имеем, когда мы вступаем в двадцать первый век, призывают нас включить идею хронологического возраста в наше понимание прогрессивной адаптации и навыков. приобретение. При этом наше исследование обнаруживает существенные связи между развитием и психопатологией у подростков, где хронологический возраст играет лишь незначительную роль. Уровень социального когнитивного функционирования и форма внутренней репрезентации себя и объектов, а не возраст, часто связаны с конкретными нарушениями.
Заключительный этап развития человечества? Взгляд Эриксона на честность и старость
Арнетт, Дж. Дж. (2017). Концепции стадий жизни в истории и культурах: предложение для новой области, посвященной стадиям жизни коренных народов. Человеческое развитие 59 (5): 290–316.
Балтес, ПБ (1997). О незавершенной архитектуре онтогенеза человека: отбор, оптимизация и компенсация как основа теории развития. Американский психолог 52 (4): 366–380.
Балтес, П.Б. и Балтес, М.М. (1990). Психологические перспективы успешного старения: модель избирательной оптимизации с компенсацией. В П. Б. Балтес и М. М. Балтес (ред.), Успешное старение: взгляды поведенческих наук (стр. 1–34). Нью-Йорк: Издательство Кембриджского университета.
Бейерс, В. и Зайффге-Кренке, И. (2010). Предшествует ли идентичность близости? Проверка теории Эриксона о романтическом развитии взрослых людей 21 века.Журнал подростковых исследований 25 (3): 387–415.
Бойлин, В., Гордон, С.К. и Нерке, М.Ф. (1976). Воспоминания и целостность эго у пожилых мужчин в специализированных учреждениях. Геронтолог 16 (2): 118–124.
Брайли, Д. А. и Такер-Дроб, Э. М. (2014). Генетическая и экологическая преемственность в развитии личности: метаанализ. Психологический бюллетень 140 (5): 1303–1331.
Брайли, Д. А. и Такер-Дроб, Э.М. (2015). Сравнение генетики развития познания и личности на протяжении жизни. Журнал личности 85 (1): 51–64.
Коли, Дж. А. (2012). Демография старения. В AB Newman & JA Cauley (ред.), The Epidemiology of Aging (стр. 3–14). Дордрехт: Спрингер.
Чан, Т. М. и Накамура, Дж. (2016). Путь генеративности к смыслу жизни на пенсии: эго-целостность окупается за прошлые инвестиции в академическое наставничество.Работа, старение и выход на пенсию 2 (1): 24–37.
Чанг, С.О., Ким, Дж.Х., Конг, Э.С., Ким, К.Г., Ан, С.Ю. и Чо, Н.О. (2008). Изучение целостности эго у пожилых людей: исследование Q-методологии. Международный журнал сестринских исследований 45 (2): 246–256.
Цицерон, М. Т. (1923). Очерки о старости, о дружбе, о гадании. (Перевод WA Falconer). Кембридж: Издательство Гарвардского университета.
Коулз, Р. (1970). Эрик Х.Эриксон — рост его работы. Сувенирная пресса. Лондон.
Дарлинг-Фишер, К.С. и Лейди, Н.К. (1988). Измерение Эриксоновского развития у взрослых: Модифицированный опросник психосоциальных стадий Эриксона. Психологические отчеты 62 (3): 747–758.
Диксон, Дж. А. (1998). Порядок развития, типы шкал и сильный вывод. Психология развития 34 (1): 131–146.
Домино, Г. и Аффонсо, Д. Д. (1990).Личностная мера этапов жизни Эриксона: Инвентаризация психосоциального баланса. Журнал оценки личности 54 (3–4): 576–588.
Домино, Г. и Ханна, М. Т. (1989). Измерение эффективного функционирования пожилых людей: применение теории Эриксона. Журнал оценки личности 53 (2): 319–328.
Дуван, Э. (1997). Эрик Эриксон: Критические времена, критическая теория. Детская психиатрия и развитие человека 28(1): 15–21.
Дункель, К.С. и Харбке, К. (2017). Обзор показателей Эриксоновских стадий психосоциального развития: свидетельство общего фактора. Журнал развития взрослых 24 (1): 58–76.
Эриксон, Э. Х. (1958). Молодой человек Лютер: исследование психоанализа и истории. Нью-Йорк: WW Нортон и Ко
Эриксон, Э. Х. (1963). Детство и общество (2-е изд.) Harmondsworth: Penguin Books.
Эриксон, Э. Х. (1969). Правда Ганди: об истоках воинствующего ненасилия.Нью-Йорк: WW Нортон и Ко
Эриксон, Э. Х. (1975). История жизни и исторический момент: разнообразные презентации. Нью-Йорк: WW Нортон и Ко
Эриксон, Э. Х. (1982). Завершенный жизненный цикл: обзор. Нью-Йорк: WW Norton.
Эриксон, Э. Х. (1984). Размышления о последнем этапе – И первом. Психоаналитическое исследование ребенка 39: 155–165.
Эриксон, Э. Х., Эриксон, Дж.и Кивник, H.Q. (1986). Жизненно важное участие в старости. В.В. Нортон и Ко, Нью-Йорк.
Эриксон, Э. Х. (2006). В цикле поколений – Адрес. В Г. Юнкерс (ред.), Слишком поздно? Ключевые документы по психоанализу и старению (стр. 141–159). Лондон: Книги Карнака.
Эриксон, Дж. (1997). Девятый этап. В EH Erikson & JM Erikson (eds.), The Life Cycle Completed (Расширенная версия) (стр. 105–114). Нью-Йорк: WW Norton.
Фрейли, К.и Робертс, Б.В. (2004). Образцы преемственности: динамическая модель для концептуализации стабильности индивидуальных различий в психологических конструкциях на протяжении всей жизни. Психологический обзор 112: 60–74.
Фрейд, С. (1989). Новые вводные лекции по психоанализу. Нью-Йорк: WW Нортон.
Фрейд, С. (2006). За пределами принципа удовольствия. В А. Филлипсе (ред.), The Penguin Freud Reader (стр. 132–195). Лондон: Книги пингвинов.
Фридман, Л.Дж. (1999). Архитектор идентичности: биография Эрика Х. Эриксона. Лондон: Книги бесплатных ассоциаций.
Фридман, LJ (2004). Эрик Эриксон о генеративности: точка зрения биографа. В Э. де Сент-Обен, Д. П. МакАдамс и Т.-К. Ким (ред.), Генеративное общество: забота о будущих поколениях (стр. 257–264). Вашингтон, округ Колумбия: Американская психологическая ассоциация.
Гиллиган, К. (1982). другим голосом. Кембридж, Массачусетс: Издательство Гарвардского университета.
Gullette, MM (2011). Agewise: Борьба с новым эйджизмом в Америке. Издательство Чикагского университета, Чикаго.
Холл, Э. (1983). Разговор с Эриком Эриксоном. Психология сегодня 17 (6): 22–24.
Ханна, М.Т., Домино, Г., Фигередо, А.Дж. и Хендриксон, Р. (1996). Прогноз целостности эго у пожилых людей. Образовательные и психологические измерения 56 (6): 930–950.
Хирн, С., Солнье Г., Стрейер Дж., Гленхэм М., Купман Р. и Марсия Дж. Э. (2012). Между целостностью и отчаянием: К конструированию подтверждения восьмой стадии Эриксона. Журнал развития взрослых 19 (1): 1–20.
Хоар, CH (2000). Этическое я, духовное я: мудрость и честность в трудах Эрика Х. Эриксона. В М. Э. Миллер и С. Р. Кук-Гройтер (ред.), Творчество, духовность и трансцендентность: пути к целостности и мудрости в зрелом я (стр. 75–98).Стэмфорд: Cт. Издательство Аблекс.
Хоар, CH (2002). Эриксон о развитии во взрослом возрасте: новые идеи из неопубликованных статей. Оксфорд: Издательство Оксфордского университета.
Хор, К. (2013). Три недостающих измерения в современных исследованиях идентичности: бессознательное, негативные атрибуты и общество. Журнал теоретической и философской психологии 33 (1): 51–67.
Джеймс, Дж. Б. и Зарретт, Н. (2006). Целостность эго в жизни пожилых женщин.Журнал развития взрослых 13 (2): 61–75.
Ким, Х.К., Ли, Х.Дж., Джу, Ю.Дж. и Парк, С.М. (2009). Факторы, влияющие на целостность эго пожилых людей, живущих в одиночестве. Журнал корейского геронтологического ухода 11: 204–215.
Кивник, Х.К. и Уэллс, С.К. (2014). Неиспользованное богатство подвоя Эрика Х. Эриксона. Геронтолог 54 (1): 40–50.
Леви, Б. Р. (2003). Разум имеет значение: когнитивные и физические эффекты стереотипов старения.Журналы геронтологии, серия B: психологические и социальные науки 58 (4): P203–P211.
Лим, С.Ю. и Чанг, С.О. (2018). Субъективная система взглядов сотрудников дома престарелых на достижение резидентами целостности эго: исследование AQ-методологии. Японский журнал сестринского дела 15 (1): 17–30.
Логан, Р. Д. (1986). Реконцептуализация теории Эриксона: повторение экзистенциальных и инструментальных тем. Человеческое развитие 29(3): 125–136.
Маркстром, К.А., Сабино, В.М., Тернер, Б.Дж. и Берман, Р.К. (1997). Психосоциальный перечень сильных сторон эго: разработка и проверка новой эриксоновской меры. Журнал молодежи и подростков 26 (6): 705–732.
МакАдамс, Д. П. (2019). «Сначала мы придумали истории, потом они изменили нас»: эволюция нарративной идентичности. Эволюционные исследования образной культуры 3 (1): 1–18.
МакАдамс, Д. П.и Маклин, KC (2013). Нарративная идентичность. Текущие направления в психологической науке 22: 233–238.
Ньютон, Нью-Джерси и Стюарт, А.Дж. (2012). Развитие личности во взрослом возрасте. В SK Whitbourne & MJ Sliwinski (ред.), The Wiley-Blackwell Handbook of Adulthood and Aging (стр. 209–235). Чичестер, Великобритания: Wiley & Sons.
Новак, М. (1986). Биография после окончания метафизики: критика эпигенетической эволюции. Международный журнал старения и развития человека 22(3): 189–204.
Палс, Дж. Л. (2006). Обработка нарративной идентичности трудного жизненного опыта: пути развития личности и положительное самопреобразование во взрослой жизни. Журнал личности 74 (4): 1079–1110.
Плутарх. (1936). Должен ли старик заниматься общественными делами. В Моралии, том. X (стр. 73–153). [пер. Х. Н. Фаулер]. Кембридж, Массачусетс: Издательство Гарвардского университета.
Роазен, П. (1980). Америка Эрика Х. Эриксона: политические последствия психологии эго.Журнал истории поведенческих наук 16 (4): 333–341.
Роуленд, Д. Т. (2009). Глобальное старение населения: история и перспективы. В П. Уленберге (ред.), Международном справочнике по старению населения (стр. 37–65). Дордрехт: Спрингер.
Рифф, К.Д. и Хайнке, С.Г. (1983). Субъективная организация личности в зрелом и старческом возрасте. Журнал личности и социальной психологии 44 (4): 807–812.
Райландс, К.Дж. И Риквуд, ди-джей (2001). Эго-целостность против эго-отчаяния: влияние «принятия прошлого» на депрессию у пожилых женщин. Международный журнал старения и развития человека 53(1): 75–89.
Шоклич, А. и Бауманн, У. (2012). Генерация и старение: многообещающая тема будущих исследований? Журнал исследований старения 26 (3): 262–272.
Теш, С.А. (1986). Психосоциальное развитие и субъективное благополучие в возрастном разрезе взрослых.Международный журнал старения и развития человека 21(2): 109–120.
Торгес, К.М., Стюарт, А.Дж. и Дункан, Л.Е. (2008). Достижение целостности эго: развитие личности в позднем среднем возрасте. Журнал исследований личности 42 (4): 1004–1019.
Торгес, К.М., Стюарт, А.Дж. и Дункан, Л.Е. (2009). Оценка сложности жизни: оценка целостности повествовательного эго в позднем среднем возрасте. Журнал исследований личности 43 (1): 66–74.
Твенге, Дж. М. (2014). Поколение Я — пересмотрено и обновлено: почему сегодняшние молодые американцы более уверены в себе, напористы, наделены правами и более несчастны, чем когда-либо прежде. Нью-Йорк: Саймон и Шустер.
Вайян, Г. (2012). Триумфы опыта: люди исследования Гарвардского гранта. Кембридж, Массачусетс: Издательство Гарвардского университета.
Vaillant, G.E. & Milofsky, E. (1980). Естественная история мужского психологического здоровья: IX.Эмпирические доказательства модели жизненного цикла Эриксона. Американский журнал психиатрии 137: 1348–1359.
Ван Хиль, А. и Ванстенкисте, М. (2009). Амбиции сбылись? Влияние внутреннего и внешнего достижения цели на эго-целостность пожилых людей и отношение к смерти. Международный журнал старения и развития человека 68(1): 27–51.
Валаскай, М., Уитборн, С. и Нерке, М. (1983–1984). Построение и проверка интервью о статусе целостности эго.Международный журнал старения и развития человека 18(1): 61–72.
Вебстер, Дж. Д. (2003). Исследовательский анализ шкалы самооценки мудрости. Журнал развития взрослых 10 (1): 13–22.
Вестерхоф, Г. Дж. Болмейер, Э. Т. и МакАдамс, Д. П. (2017). Связь целостности эго и отчаяния с чертами личности и психическим здоровьем. Журналы геронтологии, серия B Психологические науки и социальные науки 72 (3): 400–407.
Винтер, Д.Г., Торгес, К.М., Стюарт, А.Дж., Хендерсон-Кинг, Д. и Хендерсон-Кинг, Э. (2006). Пути к третьему возрасту: изучение когорты «золотого века». Ежегодный обзор геронтологии и гериатрии 26: 103–129.
горизонтов эволюции старения | BMC Biology
- на вынос
- . Изменения в позднем подростке
- 5 Изменения во время беременности

