Здоровье: Наука и техника: Lenta.ru
Специалисты-онкологи Кардиффского университета сообщили о способности аспирина снижать риск смертности от онкологии и сокращать метастазы, пишет журнал eCancermedicalscience.
Эксперты провели анализ предыдущих исследований у пациентов с 18 различными видами рака, включая рак молочной железы, толстой кишки и предстательной железы, и заметили, что аспирин уменьшает распространение метастазов. Поэтому следует «серьезно подумать» об использовании аспирина наряду с другими методами лечения рака, уверены специалисты во главе с Питером Элвудом, почетным профессором Кардиффского университета, который изучал действие аспирина более 50 лет. «Достаточно доказательств, свидетельствующих о значительном снижении смертности у пациентов с раком, которые принимают аспирин, и эта польза, по-видимому, не ограничивается одним или несколькими видами рака», — сказал он.
Материалы по теме:
По словам профессора Элвуда, он был «поражен действием аспирина». В рассматриваемой учеными выборке из четверти миллиона пациентов от 20 до 25 процентов сообщили, что принимали аспирин. «В любое время после постановки диагноза рака примерно на 20 процентов больше пациентов, принимавших аспирин, были живы, по сравнению с пациентами, не принимавшими его», — сказал Элвуд.
В рассматриваемой учеными выборке из четверти миллиона пациентов от 20 до 25 процентов сообщили, что принимали аспирин. «В любое время после постановки диагноза рака примерно на 20 процентов больше пациентов, принимавших аспирин, были живы, по сравнению с пациентами, не принимавшими его», — сказал Элвуд.
Поскольку аспирин разжижает кровь, одним из его побочных эффектов при ежедневном применении может быть риск внутреннего кровотечения. Ученые выяснили, что не было никаких доказательств избыточных смертей, связанных с кровотечением у пациентов, принимавших препарат.
Профессор Элвуд добавил, что уже проведены новые клинические испытания для тестирования лечения аспирином нескольких видов рака. В дальнейшем испытания стоит проводить с исследованием действия аспирина на некоторые редкие разновидности рака.
Ранее актриса Оливия Уильямс, сыгравшая в картинах «Шестое чувство», «Воспитание чувств», «Академия Рашмор» и других, поделилась «странным» симптомом рака поджелудочной железы, который смогла побороть. Оливии потребовалось почти четыре года, чтобы узнать диагноз после появления первых симптомов в октябре 2014-го. Победив болезнь, актриса хочет повысить осведомленность людей о ее симптомах.
Оливии потребовалось почти четыре года, чтобы узнать диагноз после появления первых симптомов в октябре 2014-го. Победив болезнь, актриса хочет повысить осведомленность людей о ее симптомах.
Ученые нашли в овощах и фруктах основу для лекарств против рака
Ученые из России, Китая и Индии исследовали вещества, содержащиеся в овощах и фруктах, и их противораковые свойства.
Для анализа взяли три десятка соединений и с помощью компьютерного моделирования определили, какие группы веществ и как воздействуют на белки в клетках при профилактике и терапии опухолей. В будущем это поможет создать новые мощные препараты против онкологических заболеваний.
«Мы определили пул терапевтических мишеней, на которые впоследствии будут воздействовать препараты. К примеру, это антиапоптотические (предотвращают апоптоз — регулируемый процесс программируемой клеточной гибели) и проапоптотические (вызывают апоптоз) белки, протеинкиназы и другие. Но ключевой мишенью для лекарств является фосфатидилинозитол-3-киназа. Именно этот энзим влияет на мутации при раке, перестройку и амплификацию генов (один из механизмов активации онкогенов в процессе развития опухоли — прим.ред.)», — говорит ведущий научный сотрудник лаборатории органического синтеза УрФУ, профессор РАН Григорий Зырянов.
Именно этот энзим влияет на мутации при раке, перестройку и амплификацию генов (один из механизмов активации онкогенов в процессе развития опухоли — прим.ред.)», — говорит ведущий научный сотрудник лаборатории органического синтеза УрФУ, профессор РАН Григорий Зырянов.
Ученые назвали целей ряд веществ, которые обладают противораковыми свойствами. Эти соединения и ферменты содержатся в таких растениях, как брокколи, капуста, шпинат, цветная капуста, морковь, салат, огурцы, помидоры, лук-порей, брюква и репа.
Для терапии разных видов рака необходимы разные природные вещества или их комбинации. Например, ресвератрол, которого много в виноградной кожице, или птеростильбен из плодов черники подавляют метастазы стволовых клеток при раке груди. А индол-3-карбинол, содержащийся в капусте, защищает клетки при раке толстой кишки.
Восточная медицина полагает, что эффективные лекарства против онкозаболеваний можно получить из природных источников. Эту гипотезу проверила международная группа ученых: больные клетки, действительно, останавливают развитие под воздействием определенных комбинаций пищевых соединений. Было отобрано десять наиболее перспективных соединений для дальнейшего изучения.
Было отобрано десять наиболее перспективных соединений для дальнейшего изучения.
Подробнее об исследовании можно прочитать в журнале Scientific Reports, передает пресс-служба Уральского федерального университета.
Найдено растительное средство для лечения рака простаты
https://ria.ru/20210920/rak-1750980146.html
Найдено растительное средство для лечения рака простаты
Найдено растительное средство для лечения рака простаты — РИА Новости, 20.09.2021
Найдено растительное средство для лечения рака простаты
Ученые из Австралии и Китая установили, что соединение, содержащееся в цветах орхидеи, обладает лечебным действием против рака простаты. Результаты исследования РИА Новости, 20.09.2021
2021-09-20T14:50
2021-09-20T14:50
2021-09-20T14:50
наука
австралия
здоровье
рак
биология
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdnn21.img. ria.ru/images/07e5/09/14/1750979804_0:789:2048:1941_1920x0_80_0_0_0d8e622d1d591c0823614df71e5aba24.jpg
ria.ru/images/07e5/09/14/1750979804_0:789:2048:1941_1920x0_80_0_0_0d8e622d1d591c0823614df71e5aba24.jpg
МОСКВА, 20 сен — РИА Новости. Ученые из Австралии и Китая установили, что соединение, содержащееся в цветах орхидеи, обладает лечебным действием против рака простаты. Результаты исследования опубликованы в журнале Frontiers in Oncology.Рак простаты — вторая по распространенности форма рака в мире после рака легких и самая распространенная среди мужчин. Исследование, проведенное австралийскими учеными из Института Столетия Сиднейского университета вместе с китайскими коллегами, показало, что эрианин, природное соединение из группы бибензила, присутствующее в Dendrobium chrysotoxum, разновидности орхидеи, произрастающей в Юго-Восточной Азии, может стать новым эффективным средством для лечения рака простаты.Авторы обнаружили, что эрианин оказывает противоопухолевое действие как на ранней, андроген-зависимой, так и на поздней стадии развития рака предстательной железы.»На ранней стадии развития раковым клеткам простаты для роста необходимы андрогены — мужские половые гормоны, такие как тестостерон, — приводятся в пресс-релизе Института Столетия слова ведущего автора исследования доктора Янфэй Ци (Yanfei Qi), руководителя лаборатории липидно-клеточной биологии. — Андрогенная депривационная терапия, также известная как гормональная терапия, направлена на снижение уровня андрогенов и может помочь замедлить или ограничить рост рака. Когда рак простаты перестает реагировать на это лечение и продолжает расти, заболевание переходит на следующую стадию, известную как резистентность к кастрации».Авторы выяснили, что эрианин повышает уровень жирной кислоты, называемой церамидом C16, внутри раковых клеток, что ведет к разрушению эндоплазматического ретикулума клеток и их гибели. На поздних этапах развития опухоли, когда клетки рака уже перешли на стадию устойчивости к кастрации, одного эрианина оказалось недостаточно, но вместе с искусственным увеличением церамида C16 в клетках, вещество действовало весьма эффективно, что привело к массовой гибели раковых клеток.»Необходимо срочно найти новые методы лечения рака простаты, — говорит доктор Ци. — До двадцати процентов пациентов, получающих терапию по депривации андрогенов, прогрессируют до прогрессирующей стадии рака простаты в течение пяти лет».
— Андрогенная депривационная терапия, также известная как гормональная терапия, направлена на снижение уровня андрогенов и может помочь замедлить или ограничить рост рака. Когда рак простаты перестает реагировать на это лечение и продолжает расти, заболевание переходит на следующую стадию, известную как резистентность к кастрации».Авторы выяснили, что эрианин повышает уровень жирной кислоты, называемой церамидом C16, внутри раковых клеток, что ведет к разрушению эндоплазматического ретикулума клеток и их гибели. На поздних этапах развития опухоли, когда клетки рака уже перешли на стадию устойчивости к кастрации, одного эрианина оказалось недостаточно, но вместе с искусственным увеличением церамида C16 в клетках, вещество действовало весьма эффективно, что привело к массовой гибели раковых клеток.»Необходимо срочно найти новые методы лечения рака простаты, — говорит доктор Ци. — До двадцати процентов пациентов, получающих терапию по депривации андрогенов, прогрессируют до прогрессирующей стадии рака простаты в течение пяти лет». Исследователи считают, что эрианин может сыграть важную роль в разработке новых медицинских препаратов, которые способны бороться как с ранними, так и с поздними стадиями рака простаты, потенциально принося пользу многим пациентам и помогая спасать жизни.
Исследователи считают, что эрианин может сыграть важную роль в разработке новых медицинских препаратов, которые способны бороться как с ранними, так и с поздними стадиями рака простаты, потенциально принося пользу многим пациентам и помогая спасать жизни.
https://ria.ru/20210914/altsgeymer-1750056437.html
https://ria.ru/20210911/antibiotiki-1749508716.html
австралия
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2021
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdnn21. img.ria.ru/images/07e5/09/14/1750979804_0:597:2048:2133_1920x0_80_0_0_3d3d631db2d7e262efefc3bf0918fb96.jpg
img.ria.ru/images/07e5/09/14/1750979804_0:597:2048:2133_1920x0_80_0_0_3d3d631db2d7e262efefc3bf0918fb96.jpgРИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
австралия, здоровье, рак, биология
МОСКВА, 20 сен — РИА Новости. Ученые из Австралии и Китая установили, что соединение, содержащееся в цветах орхидеи, обладает лечебным действием против рака простаты. Результаты исследования опубликованы в журнале Frontiers in Oncology.Рак простаты — вторая по распространенности форма рака в мире после рака легких и самая распространенная среди мужчин. Исследование, проведенное австралийскими учеными из Института Столетия Сиднейского университета вместе с китайскими коллегами, показало, что эрианин, природное соединение из группы бибензила, присутствующее в Dendrobium chrysotoxum, разновидности орхидеи, произрастающей в Юго-Восточной Азии, может стать новым эффективным средством для лечения рака простаты.
Авторы обнаружили, что эрианин оказывает противоопухолевое действие как на ранней, андроген-зависимой, так и на поздней стадии развития рака предстательной железы.
«На ранней стадии развития раковым клеткам простаты для роста необходимы андрогены — мужские половые гормоны, такие как тестостерон, — приводятся в пресс-релизе Института Столетия слова ведущего автора исследования доктора Янфэй Ци (Yanfei Qi), руководителя лаборатории липидно-клеточной биологии. — Андрогенная депривационная терапия, также известная как гормональная терапия, направлена на снижение уровня андрогенов и может помочь замедлить или ограничить рост рака. Когда рак простаты перестает реагировать на это лечение и продолжает расти, заболевание переходит на следующую стадию, известную как резистентность к кастрации».
14 сентября 2021, 21:00НаукаУченые рассказали, как избежать болезни АльцгеймераАвторы выяснили, что эрианин повышает уровень жирной кислоты, называемой церамидом C16, внутри раковых клеток, что ведет к разрушению эндоплазматического ретикулума клеток и их гибели. На поздних этапах развития опухоли, когда клетки рака уже перешли на стадию устойчивости к кастрации, одного эрианина оказалось недостаточно, но вместе с искусственным увеличением церамида C16 в клетках, вещество действовало весьма эффективно, что привело к массовой гибели раковых клеток.
На поздних этапах развития опухоли, когда клетки рака уже перешли на стадию устойчивости к кастрации, одного эрианина оказалось недостаточно, но вместе с искусственным увеличением церамида C16 в клетках, вещество действовало весьма эффективно, что привело к массовой гибели раковых клеток.
«Необходимо срочно найти новые методы лечения рака простаты, — говорит доктор Ци. — До двадцати процентов пациентов, получающих терапию по депривации андрогенов, прогрессируют до прогрессирующей стадии рака простаты в течение пяти лет».
Исследователи считают, что эрианин может сыграть важную роль в разработке новых медицинских препаратов, которые способны бороться как с ранними, так и с поздними стадиями рака простаты, потенциально принося пользу многим пациентам и помогая спасать жизни.
11 сентября 2021, 08:00НаукаУченые открыли, когда одно из самых популярных лекарств ведет к ракуБорьба с раком — это «гонка вооружений»: как российские ученые ищут лекарства на дне океана
Владимир Катанаев — профессор трансляционной медицины Женевского университета (Швейцария), заведующий лабораторией природных соединений Школы биомедицины Дальневосточного федерального университета (Владивосток). Специалист в области изучения WNT-сигнальных путей, активация которых в организме взрослых становится одной из причин развития рака.
Специалист в области изучения WNT-сигнальных путей, активация которых в организме взрослых становится одной из причин развития рака.
— Как вы думаете, сможет ли человечество в ближайшей перспективе победить рак полностью?
— «Рак» — это обобщающее понятие для множества разных болезней. По большому счету, для каждой из них требуется свое собственное лекарство. Определенные формы рака уже можно считать побежденными, в том смысле, что мы научились либо их предотвращать, либо эффективно лечить. К первым относится, например, рак шейки матки, вызываемый вирусом папилломы человека, ко вторым — хронический миелоидный лейкоз. То есть мы видим определенный прогресс по ряду направлений, но говорить, что мы победили все формы рака, преждевременно. И, наверное, такого, к сожалению, никогда не произойдет.
Реклама на Forbes
— Почему?
— Во-первых, потому что с каждой из раковых болезней нужно бороться отдельно. Во-вторых, рак даже у одного и того же пациента до начала лечения и после его (рака) возвращения — это тоже, по сути, разные болезни. Рак очень динамичен, он эволюционирует, вырабатывая, с большей или меньшей эффективностью, резистентность к каждой новой терапии, которую мы ему «предлагаем». Поэтому борьба с раком у каждого конкретного пациента — это непрекращающаяся «гонка вооружений», победитель в которой не очевиден.
Рак очень динамичен, он эволюционирует, вырабатывая, с большей или меньшей эффективностью, резистентность к каждой новой терапии, которую мы ему «предлагаем». Поэтому борьба с раком у каждого конкретного пациента — это непрекращающаяся «гонка вооружений», победитель в которой не очевиден.
«Рак — это во многих случаях уже не приговор»: израильский онколог Полина Степенски — о своей работе
— Расскажите о ваших исследованиях. Как они связаны с онкологическими заболеваниями?
— В моих лабораториях в Женеве и в России мы изучаем в том числе внутриклеточные механизмы передачи сигнала при коммуникации клеток друг с другом. Коротко объясню, о чем речь.
Наш организм состоит из триллионов клеток, и им нужно координировать свою работу. Для этого клетки и ткани посылают друг другу химические сигналы. Большинство из этих сигналов не проникает внутрь клетки, а связывается с рецепторами-белками на ее поверхности. При этом запускается каскад реакций, в результате которых клетки могут расти, делиться, мигрировать или превращаться в клетки других типов.
Главный интерес у нас вызывает трижды негативный рак молочной железы — самая смертельная форма рака у женщин
Клетки становятся раковыми, если в них ошибочно запускается один из онкогенных сигнальных путей. В норме эти пути во взрослом возрасте не работают или работают ограниченно, поскольку их главная функция — регуляция процессов в ходе эмбрионального развития. Эмбриону нужно, чтобы его клетки быстро росли и делились, взрослому организму — в целом нет. Но иногда его клеткам «кажется» — например, из-за какой-то мутации в генах, — что они получили сигнал на активный рост и деление, и возникает опухоль.
Мы изучаем один из таких онкогенных сигнальных путей — WNT-каскад. Его активация приводит к раковому перерождению клеток кишечника, молочной железы, яичников, печени и некоторых других органов и тканей. Главный интерес на данный момент у нас вызывает так называемый трижды негативный рак молочной железы — самая смертельная форма рака у женщин.
— Какие перспективы ваши исследования открывают в лечении рака?
— Многие виды рака можно эффективно лечить, блокируя в клетках онкогенные сигнальные пути.
Однако не существует одобренных к применению лекарств, которые были бы ингибиторами WNT-сигнального пути. Почему? Дело в том, что он во взрослом состоянии «выключен» не во всех тканях: есть важные исключения. Например, костная ткань или эпителий кишечника, которым нужно постоянно обновляться. Кроветворение тоже зависит от контролируемой активации WNT-пути. Поэтому его грубая блокировка приводит к очень неприятным побочным эффектам, что подтвердили эксперименты не только на мышах. Один препарат-ингибитор WNT-пути, разработанный в США, дошел до первой фазы клинических испытаний, но провалился — у пациентов стал развиваться остеопороз (по-видимому, речь идет о двух экспериментальных препаратах, вантиктумабе и ипафрисепте, разработанных компанией OncoMed Pharmaceuticals.
Обмануть смерть: какое лечение позволило максимально продлить жизнь Стива Джобса
Моя команда ищет препарат, который эффективно подавлял бы именно тот вариант WNT-пути, что вызывает трижды негативный рак молочной железы, но при этом не блокировал бы — или почти не блокировал — другие варианты этого сигнального пути, нужные для нормальной работы организма. Такой препарат будет лечить опухоль, не вызывая побочных эффектов. Для этого мы нацеливаемся на один из десяти рецепторов, запускающих WNT-каскад. Он критически важен для раковых клеток, но в клетках здоровых тканей у него есть «дублеры». И мы уже нашли несколько веществ, способных его блокировать.
— Скоро ли можно будет приступить к клиническим испытаниям найденных вами препаратов?
— Один из них уже готов к началу клинических испытаний, и сейчас я пытаюсь решить ряд административных сложностей, чтобы это стало возможным. Речь об уже известном лекарстве, которое называется клофазимин и используется для лечения проказы (лепры) и некоторых форм туберкулеза.
Реклама на Forbes
Клофазмин — уже одобренное лекарство, хорошо известна его фармакокинетика, метаболизм, все побочные эффекты, дозировки. Известно, что его прием можно сочетать с химиотерапией. Такая практика, когда уже существующие лекарства применяют против новых болезней — она называется «репозиционирование», — позволяет значительно ускорить разработку новых методов лечения.
Другие препараты, которые мы разрабатываем с нуля, пока что не готовы к клиническим испытаниям. Они показали свою эффективность в экспериментах на лабораторных животных. Но прежде чем тестировать их на людях, нужно провести еще целый ряд исследований: детально изучить токсичность препарата, его фармакокинетику и так далее.
— Эти препараты будут работать только против того самого агрессивного рака молочной железы?
— Очень важный и хороший вопрос. Мы надеемся, что, во всяком случае, некоторые из разрабатываемых нами препаратов могут быть применены и к другим WNT-зависимым формам рака. Например, наши предварительные доклинические испытания того же клофазимина показали, что он эффективен также против ряда форм рака кишечника и примерно половины из исследованных нами форм гепатоцеллюлярной карциномы (рака печени). Но опять же, потребуются дополнительные исследования, чтобы утверждать что-то с уверенностью.
Мы надеемся, что, во всяком случае, некоторые из разрабатываемых нами препаратов могут быть применены и к другим WNT-зависимым формам рака. Например, наши предварительные доклинические испытания того же клофазимина показали, что он эффективен также против ряда форм рака кишечника и примерно половины из исследованных нами форм гепатоцеллюлярной карциномы (рака печени). Но опять же, потребуются дополнительные исследования, чтобы утверждать что-то с уверенностью.
— Как вы думаете, насколько быстро можно будет начать массовое применение клофазимина как антиракового препарата?
Реклама на Forbes
— Сложно сказать. Это зависит не только от нас как исследователей. В принципе, в тех странах, где клофазимин одобрен для лечения других болезней, он уже сейчас может назначаться лечащим онкологом пациентам с трижды негативной формой рака молочной железы. Такая практика называется применением лекарства off-label. Но клофазимин, в принципе, одобрен далеко не во всех странах. В России ситуация неопределенная: коллеги-клиницисты уже два месяца не могут ответить мне на вопрос, разрешен у нас клофазимин или нет.
В России ситуация неопределенная: коллеги-клиницисты уже два месяца не могут ответить мне на вопрос, разрешен у нас клофазимин или нет.
Зачем инвесторам вкладываться в разработку препарата, который затем будет находиться в публичном домене?
Мы с коллегами работаем над тем, чтобы клофазимин одобрили именно для лечения рака молочной железы трижды негативной формы, в мировом масштабе. Но для этого нужно одобрение от регуляторных органов разных стран, а для него, в свою очередь, — успешное прохождение препаратом клинических испытаний.
Вакцина от рака головного мозга: революционный прорыв или новый шаг в борьбе с болезнью
Одна из главных проблем — финансирование. Клинические испытания стоят недешево. А проблема с клофазимином заключается в том, что он известен уже несколько десятилетий, и практически все, что можно было про него предположить, уже публично заявлено. Поэтому получить такой патент на использование этого препарата для лечения рака молочной железы не получится: у нас просто нет права интеллектуальной собственности на данную идею, это публичный домен. А значит, мы не сможем привлечь под такие клинические испытания средства от инвесторов. Зачем им вкладываться в разработку препарата, который затем будет находиться в публичном домене? Поэтому сейчас мы ищем некоммерческий фонд, который профинансировал бы эти наши исследования.
А значит, мы не сможем привлечь под такие клинические испытания средства от инвесторов. Зачем им вкладываться в разработку препарата, который затем будет находиться в публичном домене? Поэтому сейчас мы ищем некоммерческий фонд, который профинансировал бы эти наши исследования.
— Бывали ли уже примеры успешного репозиционирования уже существующих лекарств для лечения раковых заболеваний?
Реклама на Forbes
— Да, конечно. Например, препарат иматиниб (гливек) был первоначально разработан для лечения хронического миелоидного лейкоза. Это довольно редкая форма рака, поэтому рынок для препарата был небольшим. Однако иматиниб спасло то, что он, как оказалось, может быть репозиционирован против гастроинтестинальных стромальных злокачественных опухолей, которые встречаются гораздо чаще. После того как это выяснилось, и препарат прошел новые клинические испытания, он стал очень успешно продаваться.
— Какие еще перспективные методы лечения рака, развивающиеся сейчас, вы можете выделить?
— Самым модным направлением сейчас является иммунотерапия.
Мировой океан — по сути, огромная фармакологическая сокровищница, которая требует исследования и разработки
Назову также фотодинамическую терапию. В основе этого метода лежит применение специальных веществ — фотосенсибилизаторов, которые при облучении светом с определенной длиной волны начинают выделять активные радикалы кислорода, убивающие клетки. Эти вещества вносятся в пораженную ткань и затем активируются лучом лазера. Данный метод, конечно, тоже не универсален: не в любой орган можно внести фотосенсибилизатор достаточно точно, и потом правильно его облучить. Но против некоторых типов рака кожи фотодинамическая терапия работает хорошо.
Данный метод, конечно, тоже не универсален: не в любой орган можно внести фотосенсибилизатор достаточно точно, и потом правильно его облучить. Но против некоторых типов рака кожи фотодинамическая терапия работает хорошо.
Пишет стихи, наводит порядок, становится человечным: что искусственный интеллект научился делать в 2020 году
Реклама на Forbes
Моя команда недавно выделила из тканей глубоководных иглокожих животных офиур вещество из класса порфиринов, которое убивает раковые клетки. Это вещество — интересный кандидат на роль природного фотосенсибилизатора для фотодинамической терапии. Чтобы понять, можно ли сделать из него лекарство, нужны дальнейшие исследования. Пока же мы опубликовали полученные нами первые результаты в Marine Drugs — журнале №1 в мире в области изучения природных соединений из морских источников как кандидатов в лекарственные препараты (рецензируемый научный журнал с импакт-фактором 4,07 и открытым доступом, выпускает швейцарское издательство MDPI. — Forbes Life).
— Forbes Life).
— Как в вашу лабораторию попало это глубоководное животное?
— Это еще один мой большой проект. Я пытаюсь продвигать то, что я называю национальной программой разработки лекарств из морских природных соединений. Организмы, обитающие в океанах, колоссально недоизучены, при этом они могут служить богатейшим источником новых лекарственных веществ для медицины, включая онкологию. Мировой океан — по сути, огромная фармакологическая сокровищница, которая требует исследования и разработки.
И у России в этом смысле есть огромное преимущество. Немногие страны на постоянной основе отправляют исследовательские суда в разные области Мирового океана и берут там образцы с разных глубин. Сейчас этим занимаются Китай, США, Евросоюз как целое, немного — Япония и Австралия. А в России такая океаническая экспедиционная активность есть и имеет большие традиции.
Мои лаборатории сейчас участвуют в этой активности. Мы посылаем своих сотрудников в комплексные экспедиции, которые организует Академия наук, собираем образцы с глубин и выделяем из них природные химические соединения, которые затем тестируем на активность против рака молочной железы и блокировку WNT-сигнального пути в раковых клетках. Здесь уже тоже получены интересные результаты с экстрактом тканей тех же офиур, сейчас мы пытаемся выделить из него действующее вещество, которое дает нужный эффект.
Здесь уже тоже получены интересные результаты с экстрактом тканей тех же офиур, сейчас мы пытаемся выделить из него действующее вещество, которое дает нужный эффект.
Реклама на Forbes
Вероятность успешного перехода на первую фазу клинических испытаний, по статистике, едва ли превышает 10%
— Не думали ли вы о запуске собственного стартапа, который монетизировал бы результаты ваших исследований?
— Да, в планах есть стартап на основе соединений, которые мы разрабатываем против WNT-пути. Я провел немало переговоров с потенциальными инвесторами, они уже принесли первые результаты. Больше пока ничего рассказать не могу.
— Биомедицинские стартапы сейчас считаются в США одними из самых перспективных, инвесторы охотно вкладывают в них деньги. Как вы думаете, оправдан ли такой ажиотаж?
— В Америке легче привлекать инвестиции в рискованные стартапы, а биомедицинские как раз относятся к их числу. Ведь что такое биомедицинский стартап? Этом малое предприятие, которое основано, скажем, на разработке одной молекулы или одного класса молекул, который показал эффективность в доклинических испытаниях. Цель основателей — дойти до клинических испытаний и успешно пройти первую фазу. После этого стартап можно уже продавать.
Цель основателей — дойти до клинических испытаний и успешно пройти первую фазу. После этого стартап можно уже продавать.
Но вероятность успешного перехода на первую фазу клинических испытаний, по статистике, едва ли превышает 10%. Соответственно, и успешных стартапов при таком грубом расчете не может быть больше 10%. А в реальности, я думаю, их еще меньше. Потому что разработка препаратов — сложный процесс, в котором есть и другие важные этапы.
Реклама на Forbes
Вакцины от коронавируса, лечение ВИЧ, лекарство от СМА: как женщины-ученые спасают мир от болезней
Рискуют и сами стартаперы. На этапе R&D получить финансирование достаточно легко, после завершения хотя бы второй фазы клинических испытаний — тоже. Но между этими двумя моментами лежит так называемая долина смерти, когда привлечь финансирование очень трудно. Немногие стартапы через эту долину проходят.
Конечно, есть успешные биотехнологические стартапы. Например, немецкий BioNTech, который помог Pfizer разработать вакцину от коронавируса на основе матричной РНК. Фактически они разработали инновационную технологию, которую купил фармгигант. Такие истории успеха есть, но их немного. Это не значит, что не нужно в этом направлении двигаться, и я собираюсь это делать. Но нужно осознавать риски.
Например, немецкий BioNTech, который помог Pfizer разработать вакцину от коронавируса на основе матричной РНК. Фактически они разработали инновационную технологию, которую купил фармгигант. Такие истории успеха есть, но их немного. Это не значит, что не нужно в этом направлении двигаться, и я собираюсь это делать. Но нужно осознавать риски.
Когда мы побеждаем одни смертельные болезни или откладываем их приход, вместо них появляются другие
— Как вы думаете, сможет ли биомедицина в обозримой перспективе сделать людей бессмертными или хотя бы существенно замедлить наше старение?
— Я думаю, бессмертия мы не достигнем. Старение — другая сложная тема. Практика показывает, что когда мы побеждаем одни смертельные болезни или откладываем их приход, вместо них появляются другие. После того как мы добились успехов в борьбе с сердечно-сосудистыми и теми же раковыми заболеваниями, на первый план у стареющего населения стали выходить нейродегенеративные. Вероятность того, что у человека в возрасте 100 лет разовьется болезнь Альцгеймера, приближается к 100%. Что с этим делать, пока непонятно.
Вероятность того, что у человека в возрасте 100 лет разовьется болезнь Альцгеймера, приближается к 100%. Что с этим делать, пока непонятно.
Реклама на Forbes
Я надеюсь, что мы в борьбе с болезнью Альцгеймера тоже будем продвигаться вперед. Но когда мы научимся откладывать ее приход, наверняка «всплывут» какие-то новые заболевания, связанные с возрастом. Поэтому то, что нам в ближайшие десятилетия удастся еще повысить продолжительность жизни — это бесспорно. Некоторые футурологи прогнозируют, что уже в этом веке мы будем жить по 120 лет — в чем я сомневаюсь, потому что не вижу к этому биологических оснований. Но бессмертия, я думаю, мы никогда не достигнем.
О старении, феминитивах и джедаях: лучшие новые книги от российских ученых
4 фото«Троянский конь» против рака: новое лекарство британских ученых
- Николай Воронин
- Корреспондент по вопросам науки
Автор фото, Getty Images
Ученые британского Института исследования рака разработали революционное лекарство, которое только что прошло клинические испытания и признано эффективным в борьбе с шестью видами опухоли.
Инновационная терапия работает по принципу «троянского коня»: разработчики «спрятали» лекарство, замаскировав токсичные молекулы безобидным антителом. Таким образом оно попадает напрямую в опухоль и разрушает ее изнутри.
Испытания проходили на пациентах с самыми распространенными и агрессивными формами рака уже на поздней стадии — после того как им не помогли другие виды лечения.
Наилучшие результаты лекарство показало в борьбе с раком шейки матки и мочевого пузыря: значительные улучшения были отмечены у четверти пациентов, которых ранее считали неизлечимыми. Опухоль либо сокращалась в размерах, либо полностью переставала расти — на срок от шести до девяти с половиной месяцев.
Кроме того, терапия оказалась эффективной в лечении рака легких, пищевода, матки и яичников, сообщают британские медики, однако не помогла при раке простаты.
Троянский конь
Лекарство, которое сами разработчики называют TV (сокращение от полного названия — tisotumab vedotin), вводится внутривенно и представляет собой гибрид химии и иммунотерапии.
Токсичное вещество закреплено на конце антитела, которое прикрепляется к белку CD142 — его особенно много на поверхности раковых клеток. В результате молекулу засасывает внутрь опухоли, где токсин освобождается и разрушает клетку изнутри.
Автор фото, Getty Images
У терапии есть побочные эффекты, но они вполне переносимы: наиболее распространенные из них — тошнота, повышенная усталость и кровотечения из носа.
В первом этапе клинических испытаний приняли участие почти 150 раковых больных из Бельгии, Великобритании, Дании, США и Швеции.
Однако результаты терапии оказались столь многообещающими, что еще до публикации статьи ученые начали второй этап, теперь уже с участием нескольких сотен неизлечимых пациентов.
По словам руководителя исследования, профессора Института исследования рака Джоана де Боно, лекарство может оказаться эффективным и в борьбе с раком кишечника, поджелудочной железы, гортани или головного мозга.
Автор фото, Getty Images
«Принципиальное новшество представляет сам принцип действия терапии, — объясняет он. — Лекарство проникает в раковые клетки, подобно Троянскому коню, и убивает их изнутри».
На вопрос, когда подобная терапия станет доступна рядовым пациентам, а не в рамках клинических исследований, профессор де Боно ответил: «Лет через пять. Может быть, и меньше».
Кто и как ищет лекарство от рака
Наука Анна Натитник Фото: pharmacy.unc.eduУсилия и ресурсы, направляемые на борьбу с онкологическими заболеваниями, колоссальны, как и достижения в этой области. Но почему же до сих пор нет таблетки от рака? На IV Всероссийском форуме «Наука будущего — наука молодых» на этот и другие вопросы, связанные с диагностикой и лечением онкологии, ответил один из ведущих мировых ученых в области доставки лекарств, доктор химических наук, профессор МГУ, директор Центра нанотехнологий для доставки лекарств и Института наномедицины Университета Северной Каролины Александр Кабанов.
HBR Россия: Хотя все говорят о прогрессе в терапии рака, согласно статистике, количество людей, умирающих от онкологических заболеваний, последнее десятилетие увеличивается. Чем это объясняется?
Александр Кабанов: Действительно, количество умирающих от рака увеличивается. Но нужно учитывать, что население планеты постоянно растет и стареет. Если статистические данные нормализовать по численности населения и по возрастным группам, учитывая увеличение продолжительности жизни, то окажется, что реальная смертность от онкологических заболеваний в мире снижается. Вероятность того, что человек практически с любым типом рака проживет пять лет после обнаружения заболевания, увеличилась по сравнению с 70-ми годами прошлого века.
Заболеваемость раком связана в том числе с возрастом?
Конечно: чем старее население, тем выше заболеваемость. Есть и детские раки, но чем старше становится человек, тем больше шансов, что у него разовьется тот или иной вид рака. С возрастом происходит дряхление клеток организма, накапливаются определенные повреждения, нарушения, воспаления. Это сложный процесс, и он может приводить к раку.
С возрастом происходит дряхление клеток организма, накапливаются определенные повреждения, нарушения, воспаления. Это сложный процесс, и он может приводить к раку.
Что еще, кроме старения, может провоцировать рак?
Факторов множество. В первую очередь, конечно, курение. Кроме этого — радиационное поражение, асбест, многие пестициды, которые используются, чтобы повысить урожайность. Например, в США в регионах, где развито сельское хозяйство, скажем в Небраске, риск возникновения ряда типов рака повышен у фермеров, применяющих гербициды. Ну и, конечно, существуют генетические факторы.
Можете ли вы вкратце обрисовать историю лекарственной борьбы с раком?
Первые химические соединения, использовавшиеся для лечения рака, — горчичные газы, которые применяли в качестве боевых отравляющих веществ. Они отравляли ДНК раковых клеток, но не слишком избирательно, поэтому убивали и нормальные ткани.
Формально точкой отсчета в области химиотерапии рака стало открытие антифолатов, сделанное Сидни Фарбером. Это было в 1950-х годах. Многие раковые клетки потребляют большое количество производных фолиевой кислоты, и в них повышен уровень фолатных рецепторов. Это особенно характерно для наиболее агрессивных видов рака. Фарбер предложил вещества, которые могут блокировать этот рецептор и метаболизм фолатов и убивать раковые клетки.
За следующие три десятилетия на рынок вывели доксорубицин — антибиотик, который встраивается в молекулы ДНК и приводит к их нарушению, а также много других лекарств на основе небольших органических молекул, действующих на разные мишени в раке. К сожалению, все эти химические соединения очень токсичны и опасны для здоровых клеток.
К 1997 году появились лекарства на основе антител. Антитела — это белковые молекулы, которые предназначены природой для того, чтобы очень точно узнавать определенные химические структуры. Они могут связываться с другими молекулами, в частности с рецепторами на поверхности раковой клетки, и мешать их работе. Или с кровеносными сосудами в раковой опухоли — и те перестанут расти и питать раковые клетки полезными веществами: раковые клетки будут умирать, а опухоль сокращаться. Сейчас среди основных лекарств примерно половина основана на антителах. Это прорывная технология.
Они могут связываться с другими молекулами, в частности с рецепторами на поверхности раковой клетки, и мешать их работе. Или с кровеносными сосудами в раковой опухоли — и те перестанут расти и питать раковые клетки полезными веществами: раковые клетки будут умирать, а опухоль сокращаться. Сейчас среди основных лекарств примерно половина основана на антителах. Это прорывная технология.
То есть с появлением антител проблема токсичности для здоровых клеток оказалась решена?
Стало казаться, что да: мы ушли от неспецифического воздействия (массового удара по всем ДНК с помощью горчичного газа) к вроде бы абсолютно специфическому узнаванию молекулярных мишеней с помощью антител. Действительно, у антител много преимуществ — но и масса проблем. Они тоже действуют на нецелевые клетки, приводя к побочным эффектам. Раковые опухоли могут вырабатывать устойчивость к антителам, и тогда антитела перестают действовать. Поэтому отказываться от небольших высокоактивных химиотерапевтических соединений при создании арсенала новых лекарств пока рано. Однако многие из этих соединений быстро расщепляются в организме, и продукты их расщепления становятся токсичными. Кроме того, они часто плохо растворимы. Из-за этого их очень непросто доставить туда, где находятся раковые клетки.
Однако многие из этих соединений быстро расщепляются в организме, и продукты их расщепления становятся токсичными. Кроме того, они часто плохо растворимы. Из-за этого их очень непросто доставить туда, где находятся раковые клетки.
Как решить эти проблемы?
Пытались изменить структуру молекул. Но поскольку молекулы маленькие, если изменить в них что-то одно, то поменяется и что-то другое. Так что если, например, сделать нерастворимую молекулу растворимой, она потеряет свою активность. Родилась идея — вместо того чтобы пытаться изменить молекулы, упаковать их в некий контейнер таким образом, чтобы они оказались изолированы от окружающей среды. И тогда на поверхности этого контейнера можно поместить то, что нам нужно: посадить туда полимеры, которые будут препятствовать узнаванию этого контейнера белками, выводящими его из организма. Контейнер будет бездействовать до тех пор, пока не подойдет к клетке, с которой должен взаимодействовать, а потом войдет в эту клетку и выпустит лекарство. Таким образом родилась идея направленной доставки лекарств.
Таким образом родилась идея направленной доставки лекарств.
Очевидно, что этот контейнер должен быть маленьким — меньше 100 нанометров. Сейчас выяснилось, что и это много, потому что опухоли, в которые он должен войти, часто бывают плотными и проникнуть в них может только очень маленькая частица. В общем, стали думать о наноматериалах. Так родилась наномедицина.
И все же, несмотря на все успехи фармакологии, панацеи от рака найти так и не удалось?
Рак — это не одно, а большое количество разных заболеваний, объединенных общими признаками. Даже рак одного органа может быть разным, протекать по-разному и нести разные риски. Так что и прогноз, и ход лечения разные. В этом смысле единой стратегии лечения рака не существует и не может существовать.
Хотя «таблетки» от рака нет, новые стратегии широкого действия уже просматриваются. Появляется больше лекарств, на которые будет отвечать все больше пациентов. И это существенный прогресс: если раньше на лекарство отвечало ноль процентов людей, а сейчас десять, а случаев заболевания 100 тыс., это означает, что вы спасли 10 тыс. людей, а если 40% — то 40 тыс. Так что эти проценты — борьба за чью-то жизнь.
И это существенный прогресс: если раньше на лекарство отвечало ноль процентов людей, а сейчас десять, а случаев заболевания 100 тыс., это означает, что вы спасли 10 тыс. людей, а если 40% — то 40 тыс. Так что эти проценты — борьба за чью-то жизнь.
Вы сказали, что раковые клетки мутируют и приобретают устойчивость к лекарствам. Не получится ли так, что борьба с раком бесконечна: находится новое лекарство — и рак учится ему противостоять?
Действительно, в ответ на химиотерапию раковые клетки мутируют. Например, рак может избавляться от рецептора, на который настроено лекарство, или начать вырабатывать клетки, в которых есть насосы, способные выкидывать молекулу с лекарством, или производить ферменты, которые быстро расщепляют лекарства. В итоге образуется рак, который фактически нельзя убить с помощью того или иного лекарства. Это происходит очень часто, поэтому надо постоянно придумывать новые методы борьбы.
Но сказать, что борьба с раком не приносит плодов, безусловно, нельзя. В лечении некоторых видов рака — рак простаты, метастатическая меланома, определенные типы рака груди — достигнут существенный прогресс. Но это заслуга не только химиотерапии. Важны и правильная диагностика, и вовремя проведенная хирургическая операция, и последующие уход и наблюдение. Все это помогает либо полностью победить рак, либо взять его под контроль. Так что я не могу сказать, что картина пессимистическая.
В лечении некоторых видов рака — рак простаты, метастатическая меланома, определенные типы рака груди — достигнут существенный прогресс. Но это заслуга не только химиотерапии. Важны и правильная диагностика, и вовремя проведенная хирургическая операция, и последующие уход и наблюдение. Все это помогает либо полностью победить рак, либо взять его под контроль. Так что я не могу сказать, что картина пессимистическая.
Можете ли вы привести цифры, подтверждающие ваши слова?
В США средняя пятилетняя выживаемость после постановки диагноза с 1970-х по 2007—2013 годы выросла с 50 до 67%. Приведу статистику по разным видам рака. Рак простаты — выживаемость выросла с 68 до 99%, рак щитовидки — с 92 до 98%, меланома — с 81 до 91%, а сейчас, думаю, стало еще больше. Рак груди — с 75 до 90%. Рак почек — с 50 до 74%. Лейкемия — с 34 до 60%. Миелома — с 24 до 49%. То есть по очень большому количеству раков идут крупные подвижки. Это происходит в результате того, что люди стали меньше курить, больше следить за своим здоровьем, врачи — лучше определять рак на тех стадиях, когда его можно лечить, а ученые разработали новые лекарственные препараты.
Существуют ли виды рака, которые невозможно или сложно вылечить?
Рак мозга, например. Пятилетняя выживаемость у больных раком мозга остается низкой — было 22%, стало 30%. Очень низкий пятилетний прогноз у панкреатического рака — было 2,5%, стало 8,2%. Рак печени — было 3%, стало 17—18%. Рак легких — было 13%, стало 18%. Рак пищевода — было 5%, стало 18%. Пока это очень низкие показатели.
Почему учитывается именно пятилетний прогноз?
Если человек прожил пять лет, шансы на то, что он проживет дольше, становятся очень большими.
С чем связано улучшение ранней диагностики рака?
С лучшим пониманием заболевания и внедрением определенных практик. Например, раньше женщины не делали маммографию, а теперь делают. Появились более тонкие молекулярные методы диагностики — можно увидеть рак с помощью антител или специальных молекул. Однако далеко не все ранние обнаружения приводят к увеличению продолжительности жизни. Можно найти в организме несколько раковых клеток, когда они не опасны, тут же побежать делать химиотерапию и, поскольку это отрава, умереть раньше времени. Я не клиницист, не врач, но как ученый могу сказать, что нужно слушать советы докторов. Иногда знать слишком много вредно, а иногда абсолютно необходимо.
Однако далеко не все ранние обнаружения приводят к увеличению продолжительности жизни. Можно найти в организме несколько раковых клеток, когда они не опасны, тут же побежать делать химиотерапию и, поскольку это отрава, умереть раньше времени. Я не клиницист, не врач, но как ученый могу сказать, что нужно слушать советы докторов. Иногда знать слишком много вредно, а иногда абсолютно необходимо.
советуем прочитать
Елизавета Серьгина / «Ведомости»
Мобуссен Майкл
Присцилла Кламан
Войдите на сайт, чтобы читать полную версию статьиИммунотерапия при онкологии — стоимость иммунотерапии рака в Москве и области | Онлайн-запись в Медскан
Иммунотерапия против рака не является чудодейственным
средством, потому что наши иммунные клетки не признают раковые клетки
непосредственно врагом. Во-первых, раковые клетки – это собственные клетки
организма. С другой стороны, многие виды рака разработали стратегии «сокрытия»
от иммунных клеток. Тем не менее, ученые все лучше понимают взаимодействие
между опухолями и иммунной системой и смогли разработать некоторые подходы к
борьбе с раком с помощью иммунотерапии.
Во-первых, раковые клетки – это собственные клетки
организма. С другой стороны, многие виды рака разработали стратегии «сокрытия»
от иммунных клеток. Тем не менее, ученые все лучше понимают взаимодействие
между опухолями и иммунной системой и смогли разработать некоторые подходы к
борьбе с раком с помощью иммунотерапии.
Как долго длится иммунотерапия и как она протекает, зависит от используемых методов лечения:
- Моноклональные антитела – это генетически изготовленные белковые тела, направленные против специфических поверхностных структур раковых клеток. Они повреждают эти антигены или блокируют их сигналы роста. В то же время они позволяют иммунным клеткам обнаруживать злокачественные, чтобы они могли быть уничтожены. Антитела в настоящее время используются для лечения рака молочной и лимфатической железы со значительным успехом.
- Ингибиторы контрольной точки
– относятся к моноклональным антителам. Но они связываются с рецепторами
Т-клеток и снимают блокаду Т-клеток опухолевыми клетками.
 Поэтому их также
называют тормозными. В результате Т-клетки обнаруживают злокачественные,
уничтожают их или, по крайней мере, останавливают их рост. При меланоме (раке кожи) и некоторых формах рака
легких с помощью ингибиторов контрольно-пропускной способности
удается достичь опухолевых образований различной степени прогрессирования.
Ингибиторы контрольной точки также используются при раке
почек и мочевого пузыря, а также опухолях в области
горла, носа и ушей.
Поэтому их также
называют тормозными. В результате Т-клетки обнаруживают злокачественные,
уничтожают их или, по крайней мере, останавливают их рост. При меланоме (раке кожи) и некоторых формах рака
легких с помощью ингибиторов контрольно-пропускной способности
удается достичь опухолевых образований различной степени прогрессирования.
Ингибиторы контрольной точки также используются при раке
почек и мочевого пузыря, а также опухолях в области
горла, носа и ушей. - CAR-T-клеточная терапия – Т-клетки, взятые у пациента, генетически снабжаются CAR-T-рецептором в специальной лаборатории. Они способны нарушать механизмы опухоли для остановки иммунной системы. Потому что рецептор помогает защитным клеткам распознавать злокачественные, чтобы они могли атаковать их. Этот метод особенно подходит для видов рака, которые развились из B-клеток. Например, некоторые острые лимфолейкозы, B-клеточная неходжкинская лимфома или множественная миелома.
Вакцины мембранных препаратов или дендритных
клеток (представляют опухолевый антиген особенно эффективным для обнаружения и
атаки других иммунных клеток) предназначены для запуска иммунной реакции,
направленной против рака, в организме. Тем не менее, предыдущие вакцины против
рака не подтвердили свою эффективность, не оправдав возложенные на них надежды.
Тем не менее, предыдущие вакцины против
рака не подтвердили свою эффективность, не оправдав возложенные на них надежды.
Тем не менее, исследования продолжаются – в настоящее время химия белка и молекулярная биология позволяют лучше характеризовать опухолевые антигены; они могут быть произведены в форме высокой чистоты, чтобы служить вакцинами. Вакцины планируется использоваться в будущем в качестве защиты от рецидива онкологических заболеваний после проведения хирургического вмешательства. В настоящее время вакцины находятся на этапе разработки.
Как проходит иммунотерапия и сколько длится
Моноклональные антитела обычно вводят в виде
внутривенных вливаний, реже подкожных (под кожу) инъекций. Введение ингибиторов
также осуществляется инфузией, которая – в зависимости от препарата и
переносимости – длится от одного до нескольких часов и повторяется через
регулярные промежутки времени. Для повышения эффективности терапии также может
потребоваться дополнительная комбинация из нескольких ингибиторов иммунной
контрольной точки. Это может занять несколько недель, прежде, чем лекарства
проявят свое действие.
Это может занять несколько недель, прежде, чем лекарства
проявят свое действие.
Аналогичным образом, при терапии CAR-T-клетками иммунные клетки, модифицированные в лаборатории, подаются инфузией. Одна такая Т-клетка может уничтожить 1000 опухолевых клеток.
Временные расстояния между инфузиями антител, а также длительность лечения зависят от введенного препарата и типа рака. Точная продолжительность по-прежнему является предметом исследования. Для иммунотерапии CAR-Т-клетками сначала необходимо получить достаточное количество Т-лимфоцитов пациента для их отделения из крови, которые затем отправляются в специальные лаборатории. Там происходит их генетическое изменение, т. е. оснащение CAR-T-рецептором (Chimeric Antigen Receptor) против определенных структур на опухолевых клетках.
Это означает, что в Т-клетки для борьбы с
раком вводится искусственно изготовленное ДНК со специальным планом. После
размножения подобным образом измененных клеток в пробирке, как только будет
достигнуто нужное количество (до 100 млн), их замораживают и отправляют в
лечебный центр, размораживают и вводят через инфузию.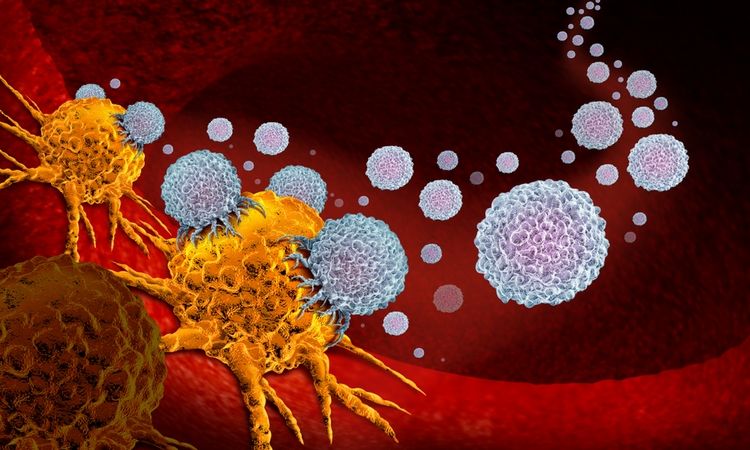 Таким образом, процедура
растягивается на несколько недель.
Таким образом, процедура
растягивается на несколько недель.
При каких видах рака эффективна иммунотерапия
Отдельные типы рака имеют несколько общих признаков. Например, тот, что они часто вытесняют здоровые ткани или находят соединение с кровяными или лимфатическими сосудами. Также онкологические образования могут образовывать метастазы (дочерние язвы) в других органах. Но рак не равен раку, даже если это опухоли одного и того же органа. Соответственно, по-разному может выглядеть и лечение.
С помощью хирургического вмешательства удаляются новообразования. Облучение должно уничтожить или, по крайней мере, уменьшить опухоль. Химиотерапия имеет цель убить раковые клетки. В идеале – все, даже метастазы. Более новый подход к лечению – лечить раковые заболевания иммунологическими методами. Принцип иммунотерапии рака таков: терапевтически использовать защитные реакции организма.
Есть виды опухолей, которые почти не реагируют
на иммунотерапию. И есть формы рака, в которых иммунная система, по-видимому,
играет более важную роль. К этой группе относятся, например, меланома,
почечно-клеточный рак и немелкоклеточный рак легких. Тем не менее, не все
пациенты с раком кожи, почек или легких одинаково хорошо реагируют на
иммунотерапию.
К этой группе относятся, например, меланома,
почечно-клеточный рак и немелкоклеточный рак легких. Тем не менее, не все
пациенты с раком кожи, почек или легких одинаково хорошо реагируют на
иммунотерапию.
Рак легкого
Независимо от стадии опухоли и формы рака легких, т. е. даже при мелкоклеточной опухоли, которая в основном обнаруживается только на очень продвинутой стадии, иммунотерапия значительно улучшает шансы на выживание. Назначается пембролизумаб, ниволумаб или атезолизумаб, преимущественно на ранних стадиях для достижения лучших результатов лечения и обеспечения более высокого качества жизни, как правило, в сочетании с обычными методами лечения рака или в одиночку.
Меланома
Рак кожи быстро дает метастазы, поэтому
используемые методы лечения становятся неэффективными. Иммунотерапия проводится
с помощью пембролизумаба, ниволумаба и ипилимумба. Эффективность лечения –
возросший процент регрессий и длительная отсрочка прогрессирования (от 2 до 3
лет).
Рак почки
Для лечения злокачественной опухоли почки назначают цитокины (интерферон-альфа и интерлейкин-2), которые представляют собой белки, активирующие иммунную систему для борьбы с раком. Вторая группа иммунопрепаратов – ингибиторы контрольных точек (ниволумаб), блокирующий белок, расположенный на поверхности Т-лимфоцитов.
Рак молочной железы
Моноклональные антитела назначаются при HER2-положительном, следовательно, быстро и неконтролируемо растущем раке молочной железы. Потому что их применение вместе с химиотерапией значительно улучшает прогноз. Предоперационная комбинированная терапия часто приводит к тому, что остаточная опухоль в груди не обнаруживается.
Рак мочевого пузыря
Иммунотерапия практически на 50% снижает
вероятность возникновения рецидива после проведения ТУР (трансуретральной
резекции). Эффект гораздо выше, чем при внутрипузырных инстилляциях
цитостатиков. Иммуноонкологические средства (атеролизумаб) широко используются
для лечения метастатической и распространенной карциномы мочевого пузыря.
Рак поджелудочной железы
При панкреатической карциноме назначается один препарат – пембролизумаб, эффективность которого уступает цитостатикам. Кейтруда полезна после прогрессирования при высокой агрессивности злокачественных клеток или в случае дефицита восстановительной способности – при репарации.
Рак простаты
При злокачественной опухоли предстательной железы назначают ипилимумаб (Ервой). Действующее вещество связывается с молекулой CTLA-4, активируя иммунную систему для борьбы с раком.
Иммунотерапия при раке простаты ненадолго останавливает прогрессирование болезни и рост опухоли. В 58% случаев ее размеры уменьшаются примерно на треть. Назначается преимущественно на поздней стадии болезни.
Рак яичников
Для борьбы со злокачественной опухолью
используют бевацизумаб (моноклональное антитело), блокирующее фактор роста
сосудистого эндотелия. На стадии разработки находятся такие методы
иммунотерапии, как онколитические вирусы, иммуноклеточные препараты и противораковые
вакцины.
Этапы терапии
Иммунотерапия при раке подразумевает введение специальных биологических средств, эффективность которых направлена на остановку роста злокачественного новообразования, а также на активацию защитных функций организма. Среди таких препаратов следует выделить цитокины, стимулирующие иммунные процессы, многоклеточные антитела, стимулирующие атаку на раковые клетки. Они комплексно воздействуют на проблему, перекрывая питание новообразования и останавливая его рост.
Иммунотерапия при раке эффективна только при наличии иммунного ответа, который заблокирован. Примерно в 70% случаев иммунный ответ не реализуется. На моделирование данной ситуации проводится множество исследований.
Для запуска цикла иммунного ответа в настоящее время воздействие осуществляется как минимум на два звена:
- Ипилимумаб (Анти-CTLA4). Эффективность направлена на блокировку рецептора на мембране Т-лимфоцитов,
выключающих активацию иммунной защиты.
 В человеческом организме все
сбалансировано, если иммунитет «слишком активен», то он начинает атаковать
здоровые клетки, провоцируя развитие аутоиммунных заболеваний. Ипилимумаб
останавливает блокировку иммунной системы, повышая количество T-лимфоцитов,
атакующих опухоль.
В человеческом организме все
сбалансировано, если иммунитет «слишком активен», то он начинает атаковать
здоровые клетки, провоцируя развитие аутоиммунных заболеваний. Ипилимумаб
останавливает блокировку иммунной системы, повышая количество T-лимфоцитов,
атакующих опухоль. - Ингибиторы контрольных точек. Речь идет о моноклональных антителах, блокирующих так называемые рецепторы клеточной гибели PD1, а также их лиганды. PD-L1 активируются рецепторы с помощью лиганда, находящегося на поверхности раковых клеток. Именно он запускает механизмы гибели клеток иммунитета. В норме данный механизм направлен на балансирование иммунной защиты, но опухолевые клетки используют его для самозащиты. Ингибиторы контрольных точек блокируют данный механизм, позволяя защитным функциям организма активироваться против раковых клеток.
В настоящее время иммунотерапия широко
используется для лечения метастатического рака кожи, немелкоклеточного рака
мочевого пузыря, легкого, шеи и головы, печени. Также лечение назначается при
лимфоме Ходжкина и карциноме Меркеля.
Также лечение назначается при
лимфоме Ходжкина и карциноме Меркеля.
Важно, чтобы иммунотерапию назначали врачи-онкологи, которые имеют должный опыт. Возможные осложнения должны быть выявлены на начальных этапах возникновения, что позволяет использовать короткий курс глюкокортикостероидов для предотвращения развития осложнений. В противном случае может возникнуть более серьезная ситуация, требующая проведения заместительной терапии.
О журнале : Anti-Cancer Drugs
Anti-Cancer Drugs сообщает о клинических и экспериментальных результатах, связанных с противораковыми препаратами, и приветствует вклад в разработку противораковых препаратов, доставку лекарств, фармакология, гормональные и биологические модальности и оценка химиотерапии. Журнал международного уровня, посвященный быстрой публикации инновационных исследований терапевтических средств против рака. Anti-Cancer Drugs направлен на стимулирование и отчетность об исследованиях как токсичных, так и нетоксичных противораковых агентов. Следовательно, тематика журнала будет охватывать как обычную цитотоксическую химиотерапию, так и методы гормонального или биологического ответа, такие как интерлейкины и иммунотерапия. Присланные статьи проходят предварительное рецензирование редактором. Некоторые статьи могут быть возвращены авторам без дальнейшего рассмотрения. Те, которые рассматриваются для публикации, будут подвергнуты дальнейшей оценке и рецензированию со стороны редакторов и тех, кто приглашен для этого из пула рецензентов.
Следовательно, тематика журнала будет охватывать как обычную цитотоксическую химиотерапию, так и методы гормонального или биологического ответа, такие как интерлейкины и иммунотерапия. Присланные статьи проходят предварительное рецензирование редактором. Некоторые статьи могут быть возвращены авторам без дальнейшего рассмотрения. Те, которые рассматриваются для публикации, будут подвергнуты дальнейшей оценке и рецензированию со стороны редакторов и тех, кто приглашен для этого из пула рецензентов.Контакты издательства и редакции
| Старший издатель Фил Дейли [email protected] Производственный редактор Реклама Разрешения Права на переводы и лицензирование Репринты и специальные проекты (У.S./Canada) Репринты и специальные проекты (за пределами США/Канады) Supplements Citi Building, 41st Floor 25 Canada Square Canary Wharf London E14 5LQ United Kingdom Tel: +44 (0)20 3197 6500 Факс: +44 (0)20 3197 6501 www.  lww.com lww.com | Главный редактор Профессор Пол Дент Факультет биохимии Университет Содружества Вирджинии VCU Massey Cancer Center 401 College Street Richmond VA 23298-0035 USA 900email Editorial Office Dr Jane ROberts VCU Massey Cancer Center Richmond VA, USA [email protected] |
противораковый препарат | фармакология | Britannica
противораковый препарат , также называемый противоопухолевым препаратом , любое лекарство, эффективное при лечении злокачественных или раковых заболеваний.Существует несколько основных классов противоопухолевых препаратов; к ним относятся алкилирующие агенты, антиметаболиты, натуральные продукты и гормоны. Кроме того, существует ряд препаратов, которые не относятся к этим классам, но демонстрируют противораковую активность и, таким образом, используются для лечения злокачественных заболеваний. Термин химиотерапия часто отождествляется с использованием противоопухолевых препаратов, хотя более точно он относится к использованию химических соединений для лечения болезней в целом.
Термин химиотерапия часто отождествляется с использованием противоопухолевых препаратов, хотя более точно он относится к использованию химических соединений для лечения болезней в целом.
Одним из первых препаратов, которые клинически использовались в современной медицине для лечения рака, был алкилирующий агент мехлорэтамин, азотистый иприт, который в 1940-х годах был признан эффективным при лечении лимфом.В 1956 году антиметаболит метотрексат стал первым лекарством для лечения солидной опухоли, а в следующем году был представлен 5-фторурацил в качестве первого из нового класса противоопухолевых соединений, известных как аналоги пиримидина. С тех пор было разработано и успешно используется множество противоопухолевых препаратов.
Подробнее по этой теме
Препарат: Противораковые препараты
Противораковые препараты — это агенты, демонстрирующие активность против злокачественных заболеваний. В их состав входят алкилирующие агенты, антиметаболиты, природные…
В их состав входят алкилирующие агенты, антиметаболиты, природные…
Решение использовать тот или иной противораковый препарат зависит от многих факторов, включая тип и локализацию рака, его тяжесть, возможность или необходимость применения хирургического вмешательства или лучевой терапии, а также побочные эффекты, связанные с препаратом. Большинство противоопухолевых препаратов вводят внутривенно; однако некоторые из них можно принимать перорально, а другие вводить внутримышечно или интратекально (в спинной мозг).
Лечение рака осложняется тем, что применяемые препараты воздействуют на клетки человека, даже на клетки, претерпевшие генетические изменения и делящиеся с быстрой и неконтролируемой скоростью. Однако некоторые противораковые препараты могут в некоторой степени различать клетки нормальных тканей и раковые клетки, и скорость пролиферации раковых клеток может фактически играть роль в кажущейся селективности агентов. Например, алкилирующие агенты, действующие на клетки на всех стадиях клеточного цикла, оказываются наиболее токсичными для клеток на стадии синтеза, или S, стадии, когда ДНК находится в процессе репликации, а неспаренные нуклеотиды (азотсодержащие единиц ДНК и РНК) наиболее подвержены алкилированию (присоединению алкильной группы). В конце 20-го и начале 21-го веков идентификация молекулярных особенностей, уникальных для раковых клеток, способствовала развитию таргетных методов лечения рака, которые обладают относительно высокой степенью специфичности в отношении раковых клеток.
В конце 20-го и начале 21-го веков идентификация молекулярных особенностей, уникальных для раковых клеток, способствовала развитию таргетных методов лечения рака, которые обладают относительно высокой степенью специфичности в отношении раковых клеток.
Специфичность противоопухолевых препаратов играет важную роль в снижении тяжести побочных эффектов, связанных с применением препаратов. Действительно, поскольку раковые клетки подобны нормальным человеческим клеткам, противораковые агенты обычно токсичны для нормальных клеток и могут вызывать многочисленные побочные эффекты, некоторые из которых опасны для жизни.Такие побочные эффекты включают выпадение волос, язвы во рту и на других слизистых оболочках, сердечные аномалии, токсичность костного мозга и сильную тошноту и рвоту. Токсичность костного мозга приводит к анемии, а также к снижению устойчивости к инфекционным агентам. Также может наступить стойкое бесплодие. Эти побочные эффекты могут потребовать уменьшения дозировки препарата или изменения режима приема препарата, чтобы сделать его переносимым пациентом.
В редких случаях длительное применение противоопухолевых препаратов может привести к развитию вторичного рака.Тип агента, первичный рак, для лечения которого он используется, и общая введенная кумулятивная доза влияют на степень канцерогенности (вызывания рака) противоракового препарата. Часто возникающие вторичные виды рака, связанные с терапией противоопухолевыми препаратами, включают миелодиспластический синдром и острые лейкозы, риск которых повышается, особенно при применении алкилирующих агентов и ингибиторов топоизомеразы (например, этопозида).
Побочные эффекты, связанные с противоопухолевыми препаратами, можно уменьшить за счет использования нескольких препаратов, что часто позволяет вводить более низкие дозы каждого препарата.Использование нескольких агентов может также снизить частоту возникновения клеточной резистентности, явления, которое позволяет опухолям избежать лечения и продолжать расти после периода ремиссии (отсутствие активности заболевания). Мультилекарственная терапия основана на предположении, что различные типы противоопухолевых препаратов проявляют свое действие в определенной части клеточного цикла (например, в фазе роста клеток, фазе клеточного деления, фазе покоя). Таким образом, одно лекарство может быть использовано для остановки роста раковых клеток на определенной фазе, а другое средство может действовать на другой фазе.В дополнение к использованию сложных схем, включающих несколько препаратов, химиотерапия рака часто сочетается с хирургическим вмешательством для уменьшения количества раковых клеток и с лучевой терапией для уничтожения большего количества клеток.
Таким образом, одно лекарство может быть использовано для остановки роста раковых клеток на определенной фазе, а другое средство может действовать на другой фазе.В дополнение к использованию сложных схем, включающих несколько препаратов, химиотерапия рака часто сочетается с хирургическим вмешательством для уменьшения количества раковых клеток и с лучевой терапией для уничтожения большего количества клеток.
Ивермектин, потенциальный противораковый препарат, полученный из противопаразитарного препарата
Pharmacol Res. 2021 янв; 163: 105207.
, A, B, B, 1 , C, C, 1 , A, D , A, D , A, B , A, B , A, , A, B , A, A, D и A, D, E, *Mingyang Tang
A Anhui Anhui Инфекции и иммунитета, Медицинский колледж Бэнбу, Бэнбу, провинция Аньхой 233030, Китай
b Клинический медицинский факультет, Медицинский колледж Бэнбу, Бэнбу, провинция Аньхой 233030, Китай
Сяодун Ху
c Кафедра гистологии и эмбриологии , Медицинский колледж Бэнбу, Бэнбу, провинция Аньхой 233030, Китай
Йи Ван
a Ключевая лаборатория инфекций и иммунитета Аньхой, Медицинский колледж Бэнбу, Бэнбу, провинция Аньхой 233030, Китай
d 3 Отдел микробиологии 9013 огия и паразитология, Медицинский колледж Бэнбу, Бэнбу, провинция Аньхой 233030, Китай
Синь Яо
a Аньхойская ключевая лаборатория инфекций и иммунитета, Медицинский колледж Бэнбу, Бэнбу, провинция Аньхой 233030, Китай
3 Департамент Микробиология и паразитология, Медицинский колледж Бэнбу, Бэнбу, провинция Аньхой 233030, КитайВэй Чжан
a Ключевая лаборатория инфекций и иммунитета Аньхой, Медицинский колледж Бэнбу, Бэнбу, провинция Аньхой 233030, Китай Медицинская клиника
b Медицинский колледж Бэнбу, Бэнбу, провинция Аньхой 233030, Китай
Ченьин Юй
a Аньхойская ключевая лаборатория инфекций и иммунитета, Медицинский колледж Бэнбу, Бэнбу, провинция Аньхой 233030, Китай
b al 9013 Медицинский колледж Бэнбу, Бэнбу, провинция Аньхой 233030, Китай
Fuying Cheng
a Anhui Key Lab ораторий инфекций и иммунитета, Медицинский колледж Бэнбу, Бэнбу, провинция Аньхой 233030, Китай
b Клинический медицинский факультет, Медицинский колледж Бэнбу, Бэнбу, провинция Аньхой 233030, Китай
Цзянъянь Ли
a 9013 Key Laboratory of Anhui Инфекция и иммунитет, Медицинский колледж Бэнбу, Бэнбу, провинция Аньхой 233030, Китай
d Кафедра микробиологии и паразитологии, Медицинский колледж Бэнбу, Бэнбу, провинция Аньхой 233030, Китай
Qiang Fang
a Лаборатория Anhui Key Инфекция и иммунитет, Медицинский колледж Бэнбу, Бэнбу, провинция Аньхой 233030, Китай
d Кафедра микробиологии и паразитологии, Медицинский колледж Бэнбу, Бэнбу, провинция Аньхой 233030, Китай
e Школа фундаментальных наук, Медицинский колледж Бэнбу , Бэнбу, провинция Аньхой 233030, Китай
a Аньхойская ключевая лаборатория инфекций и иммунитета , Медицинский колледж Бэнбу, Бэнбу, провинция Аньхой 233030, Китай
b Клинический медицинский факультет, Медицинский колледж Бэнбу, Бэнбу, провинция Аньхой 233030, Китай
c Кафедра гистологии и эмбриологии, Медицинский колледж Бэнбу, Бэнбу, Аньхой Провинция 233030, Китай
d Кафедра микробиологии и паразитологии Медицинского колледжа Бэнбу, Бэнбу, провинция Аньхой 233030, Китай
e Школа фундаментальных наук, Медицинский колледж Бэнбу, Бэнбу, провинция Аньхой 233032, Китай ⁎ Автор, ответственный за переписку: Аньхойская ключевая лаборатория инфекций и иммунитета, Медицинский колледж Бэнбу, Бэнбу, провинция Аньхой 233030, Китай.
1 Эти авторы внесли одинаковый вклад.
Поступила в редакцию 5 июня 2020 г .; Пересмотрено 11 сентября 2020 г .; Принято 11 сентября 2020 г.
Copyright © 2020 Elsevier Ltd. Все права защищены. С января 2020 года Elsevier создал ресурсный центр COVID-19 с бесплатной информацией на английском и китайском языках о новом коронавирусе COVID-19. Ресурсный центр COVID-19 размещен на Elsevier Connect, общедоступном новостном и информационном веб-сайте компании. Настоящим Elsevier разрешает сделать все свои исследования, связанные с COVID-19, которые доступны в ресурсном центре COVID-19, включая этот исследовательский контент, немедленно доступными в PubMed Central и других финансируемых государством репозиториях, таких как база данных COVID ВОЗ с правами на неограниченное повторное использование в исследованиях и анализы в любой форме и любыми средствами с указанием первоисточника.Эти разрешения предоставляются компанией Elsevier бесплатно до тех пор, пока ресурсный центр COVID-19 остается активным.
Graphical abstract
Ивермектин обладает мощным противоопухолевым действием, включая ингибирование пролиферации, метастазирования и ангиогенной активности в различных раковых клетках. Это может быть связано с регуляцией множественных сигнальных путей ивермектином через киназу PAK1. С другой стороны, ивермектин способствует запрограммированной гибели раковых клеток, включая апоптоз, аутофагию и пироптоз.Ивермектин индуцирует апоптоз, и аутофагия взаимно регулируется. Интересно, что ивермектин также может ингибировать опухолевые стволовые клетки и устранять множественную лекарственную устойчивость и оказывает оптимальный эффект при использовании в сочетании с другими химиотерапевтическими препаратами.
Сокращения: ASC, Ассоциированный с апоптозом пятнистый белок, содержащий CARD; ALCAR, ацетил-L-карнитин; CSCs, раковые стволовые клетки; DAMP, молекулярный паттерн, связанный с повреждением; EGFR, рецептор эпидермального фактора роста; ВЭБ, вирус Эпштейна-Барр; ЕМТ, Эпителиально-мезенхимальный переход; ГАМК, гамма-аминомасляная кислота; ГСДМД, Гасдермин Д; HBV, вирус гепатита В; ВГС, вирус гепатита С; HER2, рецептор 2 эпидермального фактора роста человека; HMGB1, белок группы box-1 высокой подвижности; HSP27, белок теплового шока 27; LD50, средняя летальная доза; ЛДГ, лактатдегидрогеназа; ИВМ, ивермектин; МЛУ, множественная лекарственная устойчивость; NAC, N-ацетил-L-цистеин; OCT-4, октамер-связывающий белок 4; PAK1, P-21-активируемые киназы 1; PAMP, патоген-ассоциированный молекулярный паттерн; PARP, поли(АДФ-рибоза)полимераза; P-gp, Р-гликопротеин; PRR, рецептор распознавания образов; АФК, активные формы кислорода; STAT3, преобразователь сигнала и активатор транскрипции 3; SID, SIN3-домен взаимодействия; siRNA, малая интерферирующая РНК; СОКС-2, СРИ-коробка 2; TNBC, трижды негативный рак молочной железы; YAP1, Yes-ассоциированный белок 1
Химические соединения, рассмотренные в этой статье: ивермектин (PubChem CID: 6321424), авермектин (PubChem CID: 6434889), селамектин (PubChem CID: 9578507), дорамектин (PubChem CID2: 09), моксидектин (PubChem CID:9832912)
Ключевые слова: ивермектин, рак, изменение положения препарата
Abstract
слепота, слоновость и чесотка. Сатоши Омура и Уильям К. Кэмпбелл получили Нобелевскую премию по физиологии и медицине 2015 года за открытие превосходной эффективности ивермектина против паразитарных заболеваний. Недавно сообщалось, что ивермектин ингибирует пролиферацию некоторых опухолевых клеток, регулируя несколько сигнальных путей. Это говорит о том, что ивермектин может быть противоопухолевым препаратом с большим потенциалом. Здесь мы рассмотрели связанные механизмы, с помощью которых ивермектин ингибировал развитие различных видов рака и способствовал запрограммированной гибели клеток, а также обсудили перспективы клинического применения ивермектина в качестве противоопухолевого препарата для терапии новообразований.
Сатоши Омура и Уильям К. Кэмпбелл получили Нобелевскую премию по физиологии и медицине 2015 года за открытие превосходной эффективности ивермектина против паразитарных заболеваний. Недавно сообщалось, что ивермектин ингибирует пролиферацию некоторых опухолевых клеток, регулируя несколько сигнальных путей. Это говорит о том, что ивермектин может быть противоопухолевым препаратом с большим потенциалом. Здесь мы рассмотрели связанные механизмы, с помощью которых ивермектин ингибировал развитие различных видов рака и способствовал запрограммированной гибели клеток, а также обсудили перспективы клинического применения ивермектина в качестве противоопухолевого препарата для терапии новообразований.
1. Введение
Ивермектин (ИВМ) представляет собой макролидный противопаразитарный препарат с 16-членным кольцом, полученным из авермектина, который состоит из 80% 22,23-дигидроавермектина-B1a и 20% 22,23-дигидроавермектина-B1b [1 ]. В дополнение к IVM современные члены семейства авермектинов включают селамектин, дорамектин и моксидектин [[2], [3], [4], [5]] (
).![]() IVM в настоящее время является наиболее успешным препаратом семейства авермектинов и был одобрен FDA для использования у людей в 1978 году [6]. Хорошо влияет на лечение таких паразитарных заболеваний, как речная слепота, слоновость, чесотка.Первооткрыватели IVM, японский ученый Сатоси Омура и ирландский ученый Уильям К. Кэмпбелл, получили Нобелевскую премию по физиологии и медицине в 2015 году [7,8]. IVM активирует глутамат-управляемые хлоридные каналы в паразите, вызывая приток большого количества ионов хлорида и гиперполяризацию нейронов, тем самым приводя к высвобождению гамма-аминомасляной кислоты (ГАМК) для разрушения нервов, а нервная передача мышечных клеток вызывает паралич. соматических мышц для уничтожения паразитов [9,10]. IVM также показал положительный эффект против других паразитарных заболеваний, таких как малярия [11,12], трипаносомоз [13], шистосомоз [14], трихинеллез [15] и лейшманиоз [16].
IVM в настоящее время является наиболее успешным препаратом семейства авермектинов и был одобрен FDA для использования у людей в 1978 году [6]. Хорошо влияет на лечение таких паразитарных заболеваний, как речная слепота, слоновость, чесотка.Первооткрыватели IVM, японский ученый Сатоси Омура и ирландский ученый Уильям К. Кэмпбелл, получили Нобелевскую премию по физиологии и медицине в 2015 году [7,8]. IVM активирует глутамат-управляемые хлоридные каналы в паразите, вызывая приток большого количества ионов хлорида и гиперполяризацию нейронов, тем самым приводя к высвобождению гамма-аминомасляной кислоты (ГАМК) для разрушения нервов, а нервная передача мышечных клеток вызывает паралич. соматических мышц для уничтожения паразитов [9,10]. IVM также показал положительный эффект против других паразитарных заболеваний, таких как малярия [11,12], трипаносомоз [13], шистосомоз [14], трихинеллез [15] и лейшманиоз [16].
Химическая структура ивермектина и других соединений семейства авермектинов в этом обзоре.
IVM не только оказывает сильное воздействие на паразитов, но также обладает потенциальным противовирусным действием. IVM может ингибировать репликацию флавивируса, воздействуя на геликазу NS3 [17]; он также блокирует ядерный транспорт вирусных белков, действуя на α/β-опосредованный ядерный транспорт, и проявляет противовирусную активность против вирусов ВИЧ-1 и денге [18]. Недавние исследования также показали, что он оказывает многообещающее ингибирующее действие на вирус SARS-CoV-2, вызвавший глобальную вспышку в 2020 году [19].Кроме того, IVM показывает потенциал для клинического применения при астме [20] и неврологических заболеваниях [21]. Недавно ученые обнаружили, что IVM обладает сильным противораковым эффектом.
С момента первого сообщения о том, что IVM может обратить опухоль с множественной лекарственной устойчивостью (MDR) в 1996 г. [22], несколько соответствующих исследований подчеркивали потенциальное использование IVM в качестве нового лечения рака
[[23], [24], [ 25], [26], [27]]. Несмотря на большое количество связанных исследований, до сих пор остаются нерешенными некоторые ключевые вопросы.Во-первых, неясен специфический механизм IVM-опосредованной цитотоксичности в опухолевых клетках; это может быть связано с влиянием IVM на различные сигнальные пути, но в целом это не очень ясно. Во-вторых, IVM, по-видимому, вызывает смешанную гибель опухолевых клеток, что также является спорным вопросом. Таким образом, в этом обзоре обобщены последние данные о противораковом действии IVM и обсужден механизм ингибирования опухолевой пролиферации и способ, которым IVM индуцирует запрограммированную опухолью гибель клеток, чтобы обеспечить теоретическую основу для использования IVM в качестве потенциального противоракового препарата.Поскольку стоимость исследований и разработки новых противоопухолевых препаратов продолжает расти, все большее значение приобретает репозиционирование лекарств. Репозиционирование лекарств относится к разработке новых показаний к применению, одобренных для клинического применения [28].
Несмотря на большое количество связанных исследований, до сих пор остаются нерешенными некоторые ключевые вопросы.Во-первых, неясен специфический механизм IVM-опосредованной цитотоксичности в опухолевых клетках; это может быть связано с влиянием IVM на различные сигнальные пути, но в целом это не очень ясно. Во-вторых, IVM, по-видимому, вызывает смешанную гибель опухолевых клеток, что также является спорным вопросом. Таким образом, в этом обзоре обобщены последние данные о противораковом действии IVM и обсужден механизм ингибирования опухолевой пролиферации и способ, которым IVM индуцирует запрограммированную опухолью гибель клеток, чтобы обеспечить теоретическую основу для использования IVM в качестве потенциального противоракового препарата.Поскольку стоимость исследований и разработки новых противоопухолевых препаратов продолжает расти, все большее значение приобретает репозиционирование лекарств. Репозиционирование лекарств относится к разработке новых показаний к применению, одобренных для клинического применения [28]. Для некоторых более старых препаратов, которые широко используются по их первоначальным показаниям и имеют клинические данные и информацию о безопасности, репозиционирование лекарств позволяет разрабатывать их по более дешевому и быстрому циклу и более эффективно использовать в клинической практике [29].Здесь мы систематически суммировали противораковый эффект и механизм IVM, что имеет большое значение для изменения положения IVM для лечения рака.
Для некоторых более старых препаратов, которые широко используются по их первоначальным показаниям и имеют клинические данные и информацию о безопасности, репозиционирование лекарств позволяет разрабатывать их по более дешевому и быстрому циклу и более эффективно использовать в клинической практике [29].Здесь мы систематически суммировали противораковый эффект и механизм IVM, что имеет большое значение для изменения положения IVM для лечения рака.
2. Роль ИВМ при различных видах рака
2.1. Рак молочной железы
Рак молочной железы представляет собой злокачественную опухоль, возникающую в результате генной мутации в эпителиальных клетках молочной железы, вызванной несколькими канцерогенами. Заболеваемость раком молочной железы увеличивается с каждым годом, и он стал одной из женских злокачественных опухолей с самой высокой заболеваемостью в мире.В среднем новый случай диагностируется каждые 18 секунд во всем мире [30,31]. После лечения IVM значительно снизилась пролиферация нескольких клеточных линий рака молочной железы, включая MCF-7, MDA-MB-231 и MCF-10. Механизм включал ингибирование IVM пути Akt/mTOR для индукции аутофагии, а p-21-активируемая киназа 1 (PAK1) была мишенью IVM при раке молочной железы [32]. Кроме того, исследование Диао показало, что IVM может ингибировать пролиферацию клеточных линий опухоли молочной железы собак CMT7364 и CIPp, блокируя клеточный цикл без усиления апоптоза, а механизм IVM может быть связан с ингибированием пути Wnt [33].
Механизм включал ингибирование IVM пути Akt/mTOR для индукции аутофагии, а p-21-активируемая киназа 1 (PAK1) была мишенью IVM при раке молочной железы [32]. Кроме того, исследование Диао показало, что IVM может ингибировать пролиферацию клеточных линий опухоли молочной железы собак CMT7364 и CIPp, блокируя клеточный цикл без усиления апоптоза, а механизм IVM может быть связан с ингибированием пути Wnt [33].
Тройной негативный рак молочной железы (TNBC) относится к раку, который является негативным для рецептора эстрогена, рецептора прогестерона и рецептора 2 эпидермального фактора роста человека (HER2) и является наиболее агрессивным подтипом рака молочной железы с наихудшим прогнозом. Кроме того, в настоящее время также нет клинически применимого терапевтического препарата [34,35]. Исследование лекарственного скрининга TNBC показало, что IVM можно использовать в качестве имитатора домена взаимодействия SIN3 (SID) для избирательного блокирования взаимодействия между SID и парной α-спиралью 2. Кроме того, IVM регулирует экспрессию гена E-кадгерина, связанного с эпителиальным мезенхимальным переходом (EMT), для восстановления чувствительности клеток TNBC к тамоксифену, что подразумевает возможность того, что IVM функционирует как эпигенетический регулятор при лечении рака [36]. .
Кроме того, IVM регулирует экспрессию гена E-кадгерина, связанного с эпителиальным мезенхимальным переходом (EMT), для восстановления чувствительности клеток TNBC к тамоксифену, что подразумевает возможность того, что IVM функционирует как эпигенетический регулятор при лечении рака [36]. .
Недавние исследования также показали, что IVM может способствовать гибели опухолевых клеток, регулируя микроокружение опухоли при раке молочной железы. При стимуляции микроокружения опухоли высоким уровнем аденозинтрифосфата (АТФ) вне опухолевых клеток IVM может усиливать опосредованное P2 × 4/P2 × 7/паннексин-1 высвобождение высокоподвижного белка группы box-1 (HMGB1). 37].Однако высвобождение большого количества HMGB1 во внеклеточную среду будет способствовать опосредованной иммунными клетками иммуногенной гибели и воспалительным реакциям, которые будут оказывать ингибирующее действие на рост опухолевых клеток. Поэтому мы считаем, что противоопухолевый эффект ИВМ не ограничивается цитотоксичностью, но также включает регуляцию микроокружения опухоли. IVM регулирует микроокружение опухоли и опосредует иммуногенную гибель клеток, что в будущем может стать новым направлением исследований противораковых механизмов.
IVM регулирует микроокружение опухоли и опосредует иммуногенную гибель клеток, что в будущем может стать новым направлением исследований противораковых механизмов.
2.2. Рак пищеварительной системы
Рак желудка является одной из самых распространенных злокачественных опухолей во всем мире. За последний год во всем мире было диагностировано более одного миллиона пациентов с раком желудка [38]. Исследование Nambara показало, что IVM может значительно ингибировать пролиферацию клеток рака желудка in vivo и in vitro и что ингибирующий эффект IVM зависит от экспрессии Yes-ассоциированного белка 1 (YAP1) [39]. Линии клеток рака желудка MKN1 и SH-10-TC имеют более высокую экспрессию YAP1, чем клетки MKN7 и MKN28, поэтому клетки MKN1 и SH-10-TC чувствительны к IVM, тогда как MKN7 и MKN28 не чувствительны к IVM.YAP1 играет онкогенную роль в онкогенезе, что указывает на возможность использования IVM в качестве ингибитора YAP1 для лечения рака [40].
В исследовании, посвященном скринингу ингибиторов пути Wnt, IVM ингибировал пролиферацию множественных видов рака, включая клеточные линии колоректального рака CC14, CC36, DLD1 и Ls174 T, и стимулировал апоптоз, блокируя путь Wnt [41]. После вмешательства с IVM экспрессия каспазы-3 в DLD1 и Ls174 Т-клетках увеличилась, что указывает на то, что IVM оказывает индуцирующее апоптоз действие и ингибирует экспрессию нижестоящих генов AXIN2, LGR5 и ASCL2 в пути Wnt/β-катенина. .Однако точная молекулярная мишень IVM, которая влияет на путь Wnt/β-catenin, еще предстоит изучить.
После вмешательства с IVM экспрессия каспазы-3 в DLD1 и Ls174 Т-клетках увеличилась, что указывает на то, что IVM оказывает индуцирующее апоптоз действие и ингибирует экспрессию нижестоящих генов AXIN2, LGR5 и ASCL2 в пути Wnt/β-катенина. .Однако точная молекулярная мишень IVM, которая влияет на путь Wnt/β-catenin, еще предстоит изучить.
Гепатоцеллюлярная карцинома является четвертой по значимости причиной смерти от рака во всем мире. Приблизительно 80% случаев рака печени вызваны инфекцией вируса гепатита В (ВГВ) и вируса гепатита С (ВГС) [42]. IVM может ингибировать развитие гепатоцеллюлярной карциномы, блокируя активность YAP1 при спонтанном раке печени Mob1b -/- мышей [43]. Холангиокарцинома представляет собой злокачественную опухоль, которая возникает в желчных протоках внутри и вне печени.Эксперимент Intuyod показал, что IVM ингибирует пролиферацию клеток холангиокарциномы KKU214 в зависимости от дозы и времени [44]. IVM останавливал клеточный цикл в S-фазе и способствовал апоптозу. Удивительно, но устойчивые к гемцитабину клетки KKU214 показали высокую чувствительность к IVM, что позволяет предположить, что IVM обладает потенциалом для лечения опухолей, устойчивых к обычным химиотерапевтическим препаратам.
Удивительно, но устойчивые к гемцитабину клетки KKU214 показали высокую чувствительность к IVM, что позволяет предположить, что IVM обладает потенциалом для лечения опухолей, устойчивых к обычным химиотерапевтическим препаратам.
2.3. Рак мочевыделительной системы
Почечно-клеточная карцинома — фатальная злокачественная опухоль мочевыделительной системы, происходящая из эпителиальных клеток почечных канальцев.Заболеваемость им увеличивается в среднем на 2% ежегодно во всем мире, а клинический эффект лечения неудовлетворителен [[45], [46], [47]]. Эксперименты подтвердили, что IVM может значительно ингибировать пролиферацию пяти клеточных линий почечно-клеточного рака, не влияя на пролиферацию нормальных клеток почки, и его механизм может быть связан с индукцией митохондриальной дисфункции [48]. IVM может значительно снизить потенциал митохондриальной мембраны и ингибировать митохондриальное дыхание и продукцию АТФ.Присутствие митохондриального топлива ацетил-L-карнитина (ALCAR) и антиоксиданта N-ацетил-L-цистеина (NAC) может обратить ингибирование, вызванное IVM. В экспериментах на животных результаты иммуногистохимии опухолевых тканей, обработанных IVM, показали, что экспрессия митохондриального маркера стресса HEL была значительно увеличена, и результаты соответствовали результатам экспериментов на клетках.
В экспериментах на животных результаты иммуногистохимии опухолевых тканей, обработанных IVM, показали, что экспрессия митохондриального маркера стресса HEL была значительно увеличена, и результаты соответствовали результатам экспериментов на клетках.
Рак предстательной железы представляет собой злокачественную опухоль, происходящую из эпителиальных клеток предстательной железы, и его заболеваемость уступает только раку легкого среди мужчин в западных странах [49].В эксперименте Наппи было обнаружено, что IVM может усиливать активность антиандрогенного препарата энзалутамида в клеточной линии рака предстательной железы LNCaP и обращать вспять устойчивость клеточной линии рака предстательной железы PC3 к доцетакселу [50]. Интересно, что IVM также восстанавливала чувствительность трижды негативного рака молочной железы к антиэстрогенному препарату тамоксифену [36], что также предполагает возможность использования IVM в эндокринной терапии. Кроме того, было обнаружено, что IVM оказывает хорошее ингибирующее действие на клеточную линию рака предстательной железы DU145 [51].
2.4. Гематологический рак
Лейкемия — тип злокачественного клонального заболевания, вызванного аномальными гемопоэтическими стволовыми клетками [52]. В эксперименте, предназначенном для скрининга потенциальных лекарств для лечения лейкемии, IVM преимущественно убивал лейкозные клетки в низких концентрациях, не затрагивая нормальные гемопоэтические клетки [51]. Механизм был связан с увеличением притока ионов хлорида в клетку с помощью IVM, что приводило к гиперполяризации плазматической мембраны и индукции продукции активных форм кислорода (АФК).Также было доказано, что ИВМ оказывает синергетическое действие с цитарабином и даунорубицином на лечение лейкемии. Эксперимент Wang показал, что IVM может избирательно индуцировать митохондриальную дисфункцию и окислительный стресс, заставляя клетки хронического миелоидного лейкоза K562 подвергаться усиленному каспазозависимому апоптозу по сравнению с нормальными клетками костного мозга [53]. Также было подтверждено, что IVM ингибирует рост опухоли дозозависимым образом, а дазатиниб обладает повышенной эффективностью.
2.5. Рак репродуктивной системы
Рак шейки матки является одним из наиболее распространенных гинекологических злокачественных новообразований, вызывая примерно 530 000 новых случаев и 270 000 случаев смерти во всем мире каждый год.Большинство случаев рака шейки матки вызвано инфекцией вирусом папилломы человека (ВПЧ) [54,55]. Было доказано, что IVM значительно ингибирует пролиферацию и миграцию клеток HeLa и способствует апоптозу [56]. После вмешательства с помощью IVM клеточный цикл клеток HeLa блокировался в фазе G1/S, и клетки демонстрировали типичные морфологические изменения, связанные с апоптозом.
Рак яичников является злокачественным раком, у которого отсутствуют ранние клинические симптомы и плохой терапевтический ответ. Пятилетняя выживаемость после постановки диагноза составляет примерно 47% [27,57].В исследовании Hashimoto было обнаружено, что IVM ингибирует пролиферацию различных клеточных линий рака яичников, и этот механизм был связан с ингибированием киназы PAK1 [58]. В исследованиях по скринингу потенциальных мишеней для лечения рака яичников с использованием библиотеки кшРНК и библиотеки CRISPR/Cas9 был обнаружен онкоген KPNB1. IVM может блокировать клеточный цикл и индуцировать клеточный апоптоз посредством KPNB1-зависимого механизма при раке яичников [59]. Интересно, что IVM и паклитаксел оказывают синергетическое действие на рак яичников, а комбинированное лечение в экспериментах in vivo почти полностью ингибирует рост опухоли.Кроме того, согласно отчету Zhang, IVM может повышать эффективность цисплатина для улучшения лечения эпителиального рака яичников, и этот механизм связан с ингибированием пути Akt/mTOR [60].
В исследованиях по скринингу потенциальных мишеней для лечения рака яичников с использованием библиотеки кшРНК и библиотеки CRISPR/Cas9 был обнаружен онкоген KPNB1. IVM может блокировать клеточный цикл и индуцировать клеточный апоптоз посредством KPNB1-зависимого механизма при раке яичников [59]. Интересно, что IVM и паклитаксел оказывают синергетическое действие на рак яичников, а комбинированное лечение в экспериментах in vivo почти полностью ингибирует рост опухоли.Кроме того, согласно отчету Zhang, IVM может повышать эффективность цисплатина для улучшения лечения эпителиального рака яичников, и этот механизм связан с ингибированием пути Akt/mTOR [60].
2.6. Глиома головного мозга
Глиома является наиболее распространенной опухолью головного мозга, и ежегодно примерно у 100 000 человек во всем мире диагностируется глиома. Глиобластома — самая смертоносная глиома со средним временем выживания всего 14–17 месяцев [61,62]. Эксперименты показали, что IVM ингибирует пролиферацию клеток глиобластомы человека U87 и T98 G дозозависимым образом и индуцирует апоптоз каспазозависимым образом [63]. Это было связано с индукцией митохондриальной дисфункции и окислительного стресса. Кроме того, IVM может индуцировать апоптоз эндотелиальных клеток микрососудов головного мозга человека и значительно ингибировать ангиогенез. Эти результаты показали, что IVM обладает потенциалом противодействия ангиогенезу опухоли и метастазированию опухоли. В другом исследовании IVM ингибировал пролиферацию клеток глиомы U251 и C6, ингибируя путь Akt/mTOR [64].
Это было связано с индукцией митохондриальной дисфункции и окислительного стресса. Кроме того, IVM может индуцировать апоптоз эндотелиальных клеток микрососудов головного мозга человека и значительно ингибировать ангиогенез. Эти результаты показали, что IVM обладает потенциалом противодействия ангиогенезу опухоли и метастазированию опухоли. В другом исследовании IVM ингибировал пролиферацию клеток глиомы U251 и C6, ингибируя путь Akt/mTOR [64].
В глиомах miR-21 может регулировать сигнальный путь Ras/MAPK и усиливать его влияние на пролиферацию и инвазию [65].Активность хеликазы DDX23 влияет на экспрессию miR-12 [66]. IVM может ингибировать сигнальный путь DDX23/miR-12, влияя на активность хеликазы DDX23, тем самым подавляя злокачественное биологическое поведение. Это указывает на то, что IVM может быть потенциальным ингибитором РНК-геликазы и новым средством для лечения опухолей. Однако здесь мы должны подчеркнуть, что, поскольку ИВМ не может эффективно преодолевать гематоэнцефалический барьер [67], перспектива использования ИВМ в лечении глиом не является оптимистичной.
2.7. Рак дыхательной системы
Рак носоглотки — злокачественная опухоль, происходящая из эпителиальных клеток слизистой оболочки носоглотки. Заболеваемость явно региональная и семейная, и инфекция, вызванная вирусом Эпштейна-Барр (ВЭБ), тесно связана [68]. В исследовании, посвященном скринингу препаратов для лечения рака носоглотки, IVM значительно ингибировал развитие карциномы носоглотки у голых мышей в дозах, не токсичных для нормальных тимоцитов [69]. Кроме того, IVM также оказывает цитотоксическое действие на различные раковые клетки носоглотки in vitro, и этот механизм связан со снижением активности киназы PAK1 для ингибирования пути MAPK.
Рак легкого имеет самую высокую заболеваемость и смертность среди онкологических заболеваний [70]. Нишио обнаружил, что IVM может значительно ингибировать пролиферацию клеток рака легкого h2299 путем ингибирования активности YAP1 [43]. Эксперимент Наппи также доказал, что IVM в сочетании с эрлотинибом обеспечивает синергетический эффект уничтожения путем регуляции активности EGFR и в клетках рака легкого HCC827 [50]. Кроме того, IVM может уменьшить метастазирование клеток рака легких путем ингибирования EMT.
Кроме того, IVM может уменьшить метастазирование клеток рака легких путем ингибирования EMT.
2.8. Меланома
Меланома — наиболее распространенная злокачественная опухоль кожи с высокой смертностью.Препараты, нацеленные на мутации BRAF, такие как вемурафениб, дабрафениб и моноклональные антитела к PD-1, включая пембролизумаб и ниволумаб, значительно улучшили прогноз меланомы [71,72]. Галлардо обрабатывал клетки меланомы с помощью IVM и обнаружил, что он может эффективно подавлять активность меланомы [73]. Интересно, что IVM также может проявлять активность в отношении клеток меланомы дикого типа BRAF, а его комбинация с дапафинибом может значительно повышать противоопухолевую активность. Кроме того, было подтверждено, что PAK1 является ключевой мишенью IVM, которая опосредует его антимеланомную активность, и IVM также может значительно уменьшить метастазирование меланомы в легкие в экспериментах на животных.Deng обнаружил, что IVM может активировать ядерную транслокацию TFE3 и вызывать зависимую от аутофагии гибель клеток путем дефосфорилирования TFE3 (Ser321) в клетках меланомы SK-MEL-28 [74]. Однако NAC обращал эффект IVM, что указывало на то, что IVM увеличивал TFE3-зависимую аутофагию через сигнальный путь ROS.
Однако NAC обращал эффект IVM, что указывало на то, что IVM увеличивал TFE3-зависимую аутофагию через сигнальный путь ROS.
3. IVM-индуцированная запрограммированная гибель опухолевых клеток и связанные с ней механизмы
3.1. Апоптоз
IVM индуцирует различные модели запрограммированной гибели клеток в разных опухолевых клетках ().Как показано в
, основной формой индуцированной IVM запрограммированной гибели клеток является апоптоз. Апоптоз — это запрограммированная гибель клеток, которая регулируется генами для поддержания стабильности клеток. Это может быть вызвано двумя путями активации: эндогенным эндоплазматическим ретикулумным стрессом / митохондриальным путем и экзогенным путем рецептора смерти [75,76]. Снижение митохондриального мембранного потенциала и выход цитохрома с из митохондрий в цитоплазму было обнаружено после вмешательства ИВМ в клетки Hela [56].Следовательно, мы делаем вывод, что IVM индуцирует апоптоз в основном через митохондриальный путь. Кроме того, наблюдались морфологические изменения, вызванные апоптозом, включая конденсацию хроматина, ядерную фрагментацию, фрагментацию ДНК и образование апоптотических телец. Наконец, IVM изменяет баланс между белками, связанными с апоптозом, повышая уровень белка Bax и снижая уровень антиапоптотического белка Bcl-2, тем самым активируя каспазу-9/-3 для индукции апоптоза [48, 53, 63] (48, 53, 63).
).
Кроме того, наблюдались морфологические изменения, вызванные апоптозом, включая конденсацию хроматина, ядерную фрагментацию, фрагментацию ДНК и образование апоптотических телец. Наконец, IVM изменяет баланс между белками, связанными с апоптозом, повышая уровень белка Bax и снижая уровень антиапоптотического белка Bcl-2, тем самым активируя каспазу-9/-3 для индукции апоптоза [48, 53, 63] (48, 53, 63).
).
Таблица 1
Резюме IVM способствует запрограммированной гибели клеток.
| Программируемая клеточная смерть | Линия опухоли | Ссылки |
|---|---|---|
| Apoptosis | ||
| SW-839, Caki-2, 786-O, A498, ACHN) Лейкемия (K562, первичная CD34 + клетка CML) Глиобластома (U87, T98 G) | [56][ 41][ 59][ 48][ 53][ 63] | |
| Аутофагия | Глиома (U251, C6)Рак молочной железы(MCF-7, MDA-MB-231)Меланома (SK-MEL-28) | [64] [ 32][ 74] |
| Пиротоз | Рак молочной железы (MDA-MB-231,4T1) | [37] |
Воздействие IVM на раковые клетки может вызывать образование АФК и снижение мембранного потенциала митохондрий. Более того, IVM может активировать Bax и подавлять Bcl-2, способствовать высвобождению цитохрома C в цитозоль и активировать сигнальный каскад каспаз-9/3. Наконец, активированный PARP и каспаза-3 запускают апоптоз.
Более того, IVM может активировать Bax и подавлять Bcl-2, способствовать высвобождению цитохрома C в цитозоль и активировать сигнальный каскад каспаз-9/3. Наконец, активированный PARP и каспаза-3 запускают апоптоз.
3.2. Аутофагия
Аутофагия — это лизосомно-зависимая форма запрограммированной гибели клеток. Он использует лизосомы для устранения лишних или поврежденных органелл в цитоплазме для поддержания гомеостаза.Для него характерны двухслойные или многослойные вакуолярные структуры, содержащие цитоплазматические компоненты, известные как аутофагосомы [77]. В последние годы многие исследования показали, что аутофагия является палкой о двух концах в развитии опухоли. С одной стороны, аутофагия может помочь опухолям адаптироваться к дефициту питательных веществ в микроокружении опухоли и в определенной степени защитить опухолевые клетки от повреждений, вызванных химиотерапией или лучевой терапией. С другой стороны, некоторые активаторы аутофагии могут повышать чувствительность опухолей к лучевой и химиотерапии, индуцируя аутофагию, а чрезмерная активация аутофагии также может приводить к гибели опухолевых клеток [[78], [79], [80], [81]. ].В целом, конкретное окружение опухолевых клеток будет определять, будет ли аутофагия усиливать или ингибировать развитие опухоли, и улучшение активности аутофагии также стало новым подходом в терапии рака. Запрограммированная гибель клеток, опосредованная аутофагией после вмешательства IVM, и усиление противораковой эффективности IVM за счет регуляции аутофагии являются интересными темами. Вмешательство с IVM в клеточные линии рака молочной железы MCF-7 и MDA-MB-231 значительно увеличило внутриклеточный поток аутофагии, и можно наблюдать экспрессию ключевых белков аутофагии, таких как LC3, Bclin1, Atg5, и образование аутофагосом [32].Однако после использования ингибиторов аутофагии хлорохина и вортманнина или нокдауна Bclin1 и Atg5 с помощью siRNA для ингибирования аутофагии противораковая активность IVM значительно снизилась. Это доказывает, что IVM оказывает противоопухолевое действие в основном через путь аутофагии. Кроме того, исследователи также использовали активатор Akt CA-Akt, чтобы доказать, что IVM в основном индуцирует аутофагию путем ингибирования фосфорилирования Akt и mTOR (19).
].В целом, конкретное окружение опухолевых клеток будет определять, будет ли аутофагия усиливать или ингибировать развитие опухоли, и улучшение активности аутофагии также стало новым подходом в терапии рака. Запрограммированная гибель клеток, опосредованная аутофагией после вмешательства IVM, и усиление противораковой эффективности IVM за счет регуляции аутофагии являются интересными темами. Вмешательство с IVM в клеточные линии рака молочной железы MCF-7 и MDA-MB-231 значительно увеличило внутриклеточный поток аутофагии, и можно наблюдать экспрессию ключевых белков аутофагии, таких как LC3, Bclin1, Atg5, и образование аутофагосом [32].Однако после использования ингибиторов аутофагии хлорохина и вортманнина или нокдауна Bclin1 и Atg5 с помощью siRNA для ингибирования аутофагии противораковая активность IVM значительно снизилась. Это доказывает, что IVM оказывает противоопухолевое действие в основном через путь аутофагии. Кроме того, исследователи также использовали активатор Akt CA-Akt, чтобы доказать, что IVM в основном индуцирует аутофагию путем ингибирования фосфорилирования Akt и mTOR (19). Феномен индуцированной IVM аутофагии также описан при глиоме и меланоме.
64,74].Все вышеперечисленные данные указывают на потенциал IVM как активатора аутофагии, чтобы вызвать зависимую от аутофагии гибель опухолевых клеток.
Феномен индуцированной IVM аутофагии также описан при глиоме и меланоме.
64,74].Все вышеперечисленные данные указывают на потенциал IVM как активатора аутофагии, чтобы вызвать зависимую от аутофагии гибель опухолевых клеток.
Механизмы IVM-индуцированной PAK1/Akt/mTOR-опосредованной аутофагии.
IVM способствует деградации PAK1 путем убиквитинирования/протеасомного пути, тем самым ингибируя сигнальный путь Akt/mTOR. Впоследствии инактивация передачи сигналов Akt/mTOR не может ингибировать образование комплекса Beclin-1, индуцируя, таким образом, образование аутофагосом. В целом, IVM может индуцировать аутофагию через путь PAK1/Akt/mTOR, подавляя рост раковых клеток независимо от апоптоза.(Ub: убиквитинирование, P: фосфорилирование)
3.3. Перекрестные помехи между индуцированным IVM апоптозом и аутофагией
Взаимосвязь между апоптозом и аутофагией очень сложна, и перекрестная связь между ними играет жизненно важную роль в развитии рака [82]. Очевидно, существующие результаты предполагают, что индуцированный IVM апоптоз и аутофагия также проявляют перекрестные помехи. Например, в клетках меланомы SK-MEL-28 было обнаружено, что IVM может способствовать как апоптозу, так и аутофагии [74].После использования ингибитора аутофагии бафиломицина A1 или siRNA для подавления Beclin1 апоптоз, вызванный IVM, значительно усилился, что свидетельствует о том, что усиленная аутофагия уменьшит апоптоз, вызванный IVM, и что аутофагия, вызванная IVM, может защитить опухолевые клетки от апоптоза. Однако в экспериментах с клетками рака молочной железы также было обнаружено, что IVM может вызывать аутофагию, а усиленная аутофагия может повышать противораковую активность IVM [37]. Последние исследования показывают, что в нормальных условиях аутофагия предотвращает индукцию апоптоза, а связанная с апоптозом активация фермента каспазы подавляет аутофагию.Однако в особых случаях аутофагия также может способствовать индукции апоптоза или некроза [83]. Короче говоря, взаимосвязь между IVM-индуцированным апоптозом и аутофагией включает сложный регуляторный механизм, и специфический молекулярный механизм нуждается в дальнейшем изучении.
Например, в клетках меланомы SK-MEL-28 было обнаружено, что IVM может способствовать как апоптозу, так и аутофагии [74].После использования ингибитора аутофагии бафиломицина A1 или siRNA для подавления Beclin1 апоптоз, вызванный IVM, значительно усилился, что свидетельствует о том, что усиленная аутофагия уменьшит апоптоз, вызванный IVM, и что аутофагия, вызванная IVM, может защитить опухолевые клетки от апоптоза. Однако в экспериментах с клетками рака молочной железы также было обнаружено, что IVM может вызывать аутофагию, а усиленная аутофагия может повышать противораковую активность IVM [37]. Последние исследования показывают, что в нормальных условиях аутофагия предотвращает индукцию апоптоза, а связанная с апоптозом активация фермента каспазы подавляет аутофагию.Однако в особых случаях аутофагия также может способствовать индукции апоптоза или некроза [83]. Короче говоря, взаимосвязь между IVM-индуцированным апоптозом и аутофагией включает сложный регуляторный механизм, и специфический молекулярный механизм нуждается в дальнейшем изучении. Мы считаем, что более глубокое изучение механизма может способствовать дальнейшему использованию IVM при лечении рака.
Мы считаем, что более глубокое изучение механизма может способствовать дальнейшему использованию IVM при лечении рака.
3.4. Пироптоз
Пироптоз — это тип воспалительной гибели клеток, вызванный инфламмасомами. Инфламмасома представляет собой мультимолекулярный комплекс, содержащий рецептор распознавания образов (PRR), связанный с апоптозом пятнистый белок, содержащий CARD (ASC), и прокаспазу-1.PRR может идентифицировать патоген-ассоциированные молекулярные паттерны (PAMP), которые являются структурно стабильными и эволюционно консервативными на поверхности патогенных микроорганизмов, а также связанные с повреждением молекулярные паттерны (DAMP), продуцируемые поврежденными клетками [84,85]. Инфламмасомы инициируют превращение прокаспазы-1 посредством саморасщепления в активированную каспазу-1. Активированная каспаза-1 может вызывать созревание и секрецию про-ИЛ-1β и про-ИЛ-18. Гасдермин D (GSDMD) является субстратом для активированной каспазы-1 и считается ключевым белком в осуществлении пироптоза [86,87]. В эксперименте Драганова было установлено, что выброс лактатдегидрогеназы (ЛДГ) и активированной каспазы-1 значительно увеличивался в клетках рака молочной железы после вмешательства ИВМ [37]. Кроме того, наблюдались характерные явления пироптоза, такие как набухание и разрыв клеток. Авторы предположили, что IVM может опосредовать возникновение пироптоза через путь P2 × 4/P2 × 7/NLRP3 (18), но нет конкретных доказательств, подтверждающих это предположение. Интересно, что в экспериментах по ишемии-реперфузии IVM усугубляла почечную ишемию через путь P2 × 7/NLRP3 и увеличивала высвобождение провоспалительных цитокинов в клетках проксимальных канальцев человека.
88].Хотя в настоящее время имеется мало доказательств того, что IVM вызывает пироптоз, важно изучить роль IVM в индукции пироптоза при других видах рака в будущих исследованиях и понять, что IVM может вызывать различные типы запрограммированной гибели клеток при разных типах рака.
В эксперименте Драганова было установлено, что выброс лактатдегидрогеназы (ЛДГ) и активированной каспазы-1 значительно увеличивался в клетках рака молочной железы после вмешательства ИВМ [37]. Кроме того, наблюдались характерные явления пироптоза, такие как набухание и разрыв клеток. Авторы предположили, что IVM может опосредовать возникновение пироптоза через путь P2 × 4/P2 × 7/NLRP3 (18), но нет конкретных доказательств, подтверждающих это предположение. Интересно, что в экспериментах по ишемии-реперфузии IVM усугубляла почечную ишемию через путь P2 × 7/NLRP3 и увеличивала высвобождение провоспалительных цитокинов в клетках проксимальных канальцев человека.
88].Хотя в настоящее время имеется мало доказательств того, что IVM вызывает пироптоз, важно изучить роль IVM в индукции пироптоза при других видах рака в будущих исследованиях и понять, что IVM может вызывать различные типы запрограммированной гибели клеток при разных типах рака.
Механизмы индуцированного IVM P2 × 4/P2 × 7/NLRP3-опосредованного пироптоза.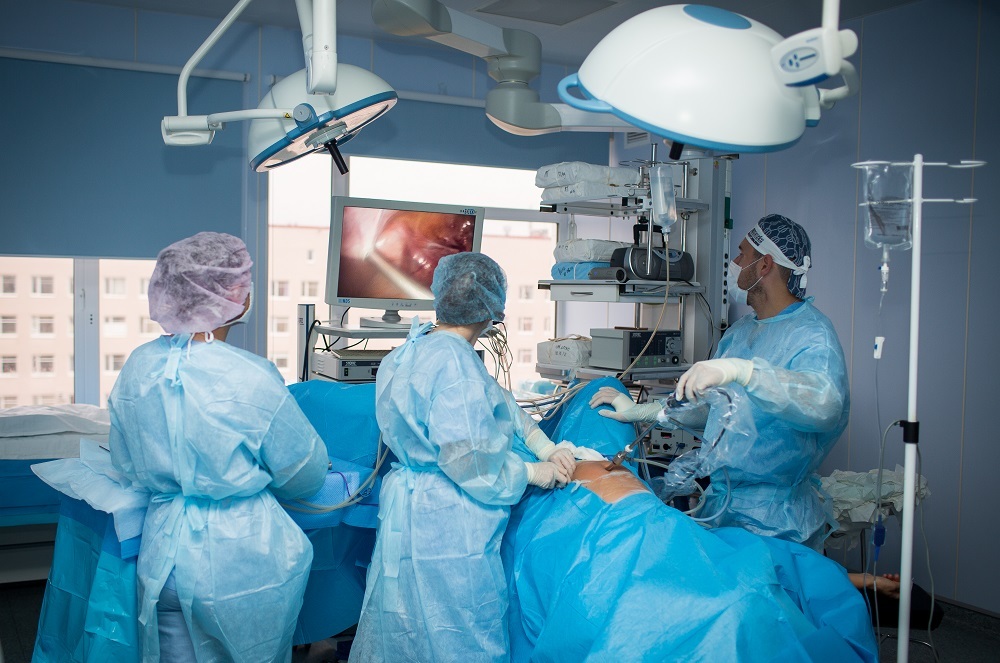
IVM может способствовать высвобождению АФК в раковых клетках с помощью рецепторов P2 × 4/P2 × 7. Клеточные АФК могут активировать инфламмасому NLRP3, включая сборку ASC, NLRP3 и прокаспазы-1.Впоследствии NLRP3 Inflammasome инициирует прокаспазу-1 для саморасщепления в зрелую каспазу-1. С одной стороны, активированная каспаза-1 индуцирует секрецию провоспалительных цитокинов IL-1β и IL-18. С другой стороны, каспаза-1, активируемая GSDMD, запускает пироптоз независимо от апоптоза.
4. Противораковый эффект IVM другими путями
4.1. Раковые стволовые клетки
Раковые стволовые клетки (РСК) представляют собой клеточную популяцию, сходную со стволовыми клетками, обладающую характеристиками самообновления и потенциала дифференцировки в опухолевой ткани [89,90].Хотя CSC сходны со стволовыми клетками с точки зрения функции, из-за отсутствия механизма регуляции отрицательной обратной связи для самообновления стволовых клеток их мощная способность к пролиферации и разнонаправленной дифференцировке не ограничена, что позволяет CSC поддерживать определенные активности во время химиотерапии и лучевой терапии. [[90], [91], [92]]. Когда внешняя среда является подходящей, CSC быстро размножаются, реактивируя образование и рост опухолей. Таким образом, ОСК были широко признаны основной причиной рецидива после лечения [93,94].Guadalupe оценила влияние IVM на CSC в клеточной линии рака молочной железы MDA-MB-231 [95]. Экспериментальные результаты показали, что IVM будет предпочтительно нацеливаться и ингибировать клеточные популяции, богатые CSC, по сравнению с другими клеточными популяциями в клетках MDA-MB-231. Более того, экспрессия гомеобоксного белка NANOG, октамер-связывающего белка 4 (OCT-4) и SRY-box 2 (SOX-2), тесно связанных со способностью стволовых клеток к самообновлению и дифференцировке в РСК, была снижена. также значительно ингибируется IVM.Это говорит о том, что IVM можно использовать в качестве потенциального ингибитора CSCs для лечения рака. Дальнейшие исследования показали, что IVM может ингибировать CSCs, регулируя ось PAK1-STAT3 [96].
[[90], [91], [92]]. Когда внешняя среда является подходящей, CSC быстро размножаются, реактивируя образование и рост опухолей. Таким образом, ОСК были широко признаны основной причиной рецидива после лечения [93,94].Guadalupe оценила влияние IVM на CSC в клеточной линии рака молочной железы MDA-MB-231 [95]. Экспериментальные результаты показали, что IVM будет предпочтительно нацеливаться и ингибировать клеточные популяции, богатые CSC, по сравнению с другими клеточными популяциями в клетках MDA-MB-231. Более того, экспрессия гомеобоксного белка NANOG, октамер-связывающего белка 4 (OCT-4) и SRY-box 2 (SOX-2), тесно связанных со способностью стволовых клеток к самообновлению и дифференцировке в РСК, была снижена. также значительно ингибируется IVM.Это говорит о том, что IVM можно использовать в качестве потенциального ингибитора CSCs для лечения рака. Дальнейшие исследования показали, что IVM может ингибировать CSCs, регулируя ось PAK1-STAT3 [96].
4.2. Реверсия мультирезистентности опухоли
МЛУ опухолевых клеток является основной причиной рецидивов и летальных исходов после химиотерапии [97]. АТФ-связывающий транспорт, опосредованный оттоком лекарств и гиперэкспрессией P-гликопротеина (P-gp), широко считается основными причинами опухолевой МЛУ [[98], [99], [100]].Несколько исследований подтвердили, что IVM может обратить вспять лекарственную устойчивость путем ингибирования P-gp и MDR-ассоциированных белков [[101], [102], [103]]. В экспериментах Didier, проверяющих влияние IVM на лимфоцитарную лейкемию, IVM можно было использовать в качестве ингибитора P-gp для воздействия на МЛУ [22]. В эксперименте Цзяна IVM обратил лекарственную устойчивость устойчивой к винкристину клеточной линии колоректального рака HCT-8, устойчивой к доксорубицину клеточной линии рака молочной железы MCF-7 и клеточной линии хронического миелогенного лейкоза K562 [104].IVM ингибирует активацию EGFR и нижестоящего сигнального пути ERK/Akt/NF-каппа B, чтобы снизить экспрессию P-gp. Ранее мы упоминали о роли IVM при резистентном к доцетакселу раке предстательной железы [50] и резистентной к гемцитабину холангиокарциноме [44].
АТФ-связывающий транспорт, опосредованный оттоком лекарств и гиперэкспрессией P-гликопротеина (P-gp), широко считается основными причинами опухолевой МЛУ [[98], [99], [100]].Несколько исследований подтвердили, что IVM может обратить вспять лекарственную устойчивость путем ингибирования P-gp и MDR-ассоциированных белков [[101], [102], [103]]. В экспериментах Didier, проверяющих влияние IVM на лимфоцитарную лейкемию, IVM можно было использовать в качестве ингибитора P-gp для воздействия на МЛУ [22]. В эксперименте Цзяна IVM обратил лекарственную устойчивость устойчивой к винкристину клеточной линии колоректального рака HCT-8, устойчивой к доксорубицину клеточной линии рака молочной железы MCF-7 и клеточной линии хронического миелогенного лейкоза K562 [104].IVM ингибирует активацию EGFR и нижестоящего сигнального пути ERK/Akt/NF-каппа B, чтобы снизить экспрессию P-gp. Ранее мы упоминали о роли IVM при резистентном к доцетакселу раке предстательной железы [50] и резистентной к гемцитабину холангиокарциноме [44].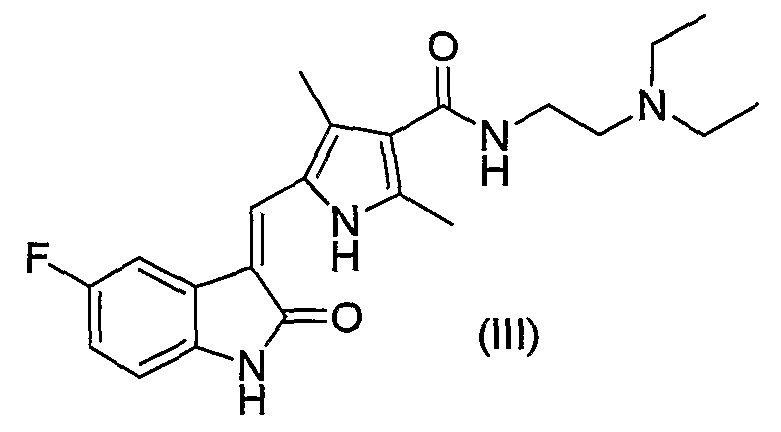 Эти результаты показали значимость применения IVM для лечения химиотерапевтических больных с МЛУ.
Эти результаты показали значимость применения IVM для лечения химиотерапевтических больных с МЛУ.
4.3. Расширенная таргетная терапия и комбинированное лечение
Таргетное лечение ключевых мутантных генов при раке, таких как EGFR при раке легкого и HER2 при раке молочной железы, может привести к мощным клиническим эффектам [105,106].HSP27 представляет собой молекулярный белок-шаперон, который в высокой степени экспрессируется при многих видах рака и связан с лекарственной устойчивостью и неблагоприятным прогнозом. Он рассматривается как новая мишень для терапии рака [107]. Недавние исследования показали, что IVM можно использовать в качестве ингибитора фосфорилирования HSP27 для повышения активности анти-EGFR-препаратов в опухолях, вызванных EGFR/HER2. Эксперимент показал, что IVM может значительно усилить ингибирующее действие эрлотиниба и цетуксимаба на рак легкого и колоректальный рак [50].Ранее мы упоминали, что IVM в сочетании с традиционными химиотерапевтическими препаратами, такими как цисплатин [60], паклитаксел [59], даунорубицин и цитарабин [51], или с таргетными препаратами, такими как дазатиниб [53] и дапафениб [73], обладает большим потенциалом в отношении рака. лечение. Комбинация препаратов может эффективно повысить эффективность, снизить токсичность или отсрочить лекарственную устойчивость. Поэтому комбинированная терапия является наиболее распространенным методом химиотерапии. IVM имеет множество различных механизмов действия при различных видах рака, и его потенциал для синергетических эффектов и повышенной эффективности в комбинированной терапии представлял для нас особый интерес.Мало того, что IVM не пересекается с другими методами лечения с точки зрения механизма действия, но тот факт, что IVM имеет несколько целей, предполагает, что вызвать устойчивость к IVM непросто. Таким образом, дальнейшее изучение и тестирование безопасных и эффективных комбинированных лекарственных средств необходимо для максимизации противоопухолевых эффектов IVM.
лечение. Комбинация препаратов может эффективно повысить эффективность, снизить токсичность или отсрочить лекарственную устойчивость. Поэтому комбинированная терапия является наиболее распространенным методом химиотерапии. IVM имеет множество различных механизмов действия при различных видах рака, и его потенциал для синергетических эффектов и повышенной эффективности в комбинированной терапии представлял для нас особый интерес.Мало того, что IVM не пересекается с другими методами лечения с точки зрения механизма действия, но тот факт, что IVM имеет несколько целей, предполагает, что вызвать устойчивость к IVM непросто. Таким образом, дальнейшее изучение и тестирование безопасных и эффективных комбинированных лекарственных средств необходимо для максимизации противоопухолевых эффектов IVM.
5. Молекулярные мишени и сигнальные пути, участвующие в противоопухолевом потенциале IVM
Как упоминалось выше, противораковый механизм IVM включает широкий спектр сигнальных путей, таких как Wnt/β-катенин, Akt/mTOR, MAPK и другие возможные мишени, такие как PAK1 и HSP27, а также другие механизмы действия (
). Мы обнаружили, что IVM ингибирует развитие опухолевых клеток PAK1-зависимым образом при большинстве видов рака. Следовательно, мы сосредоточились на обсуждении роли киназы PAK1 и взаимодействий между различными путями и PAK1, чтобы предоставить новые взгляды на механизм функции IVM.
Мы обнаружили, что IVM ингибирует развитие опухолевых клеток PAK1-зависимым образом при большинстве видов рака. Следовательно, мы сосредоточились на обсуждении роли киназы PAK1 и взаимодействий между различными путями и PAK1, чтобы предоставить новые взгляды на механизм функции IVM.
Таблица 2
Сводка антиканкера IVM
| Тип рака | Ссылки | |
|---|---|---|
| Ингибируют тропин Wnt | Рак молочной железы, колоректальный рак | [33,41] |
| ингибируют AKT / MOTOR PATHWAY | ||
| Ингибирует HSP27 | Рак предстательной железы, рак легкого Колоректальный рак | [50] |
| Вызывает митохондриальную дисфункцию | почечная клетка карцинома, глиомалекемия | |
| Colorectal Racce Cancerlekemia | ||
| [36] | ||
| Глиома | [66] | |
| [51] | ||
| [59 ] |
Являясь представителем семейства серин/треонинкиназ PAK, PAK1 выполняет множество биологических функций. такие как регуляция клеточной пролиферации и апоптоза, движение клеток, динамика и трансформация цитоскелета [108].Предыдущие исследования показали, что PAK1 расположен на пересечении множественных сигнальных путей, связанных с онкогенезом, и является ключевым регулятором раковых сигнальных сетей (4). Чрезмерная активация PAK1 участвует в формировании, развитии и инвазии различных видов рака.
109,110]. Нацеливание на PAK1 является новым и многообещающим методом лечения рака, и разработка ингибиторов PAK1 привлекла широкое внимание [111]. IVM является ингибитором PAK1 при различных опухолях и имеет хорошую безопасность по сравнению с другими ингибиторами PAK1, такими как IPA-3.При меланоме и карциноме носоглотки IVM ингибирует активность пролиферации клеток, ингибируя PAK1, чтобы снизить экспрессию MEK 1/2 и ERK1/2 [69,73]. После вмешательства IVM при раке молочной железы экспрессия PAK1 также значительно подавлялась, а использование siRNA для подавления экспрессии PAK1 в опухолевых клетках значительно снижало противораковую активность IVM.
такие как регуляция клеточной пролиферации и апоптоза, движение клеток, динамика и трансформация цитоскелета [108].Предыдущие исследования показали, что PAK1 расположен на пересечении множественных сигнальных путей, связанных с онкогенезом, и является ключевым регулятором раковых сигнальных сетей (4). Чрезмерная активация PAK1 участвует в формировании, развитии и инвазии различных видов рака.
109,110]. Нацеливание на PAK1 является новым и многообещающим методом лечения рака, и разработка ингибиторов PAK1 привлекла широкое внимание [111]. IVM является ингибитором PAK1 при различных опухолях и имеет хорошую безопасность по сравнению с другими ингибиторами PAK1, такими как IPA-3.При меланоме и карциноме носоглотки IVM ингибирует активность пролиферации клеток, ингибируя PAK1, чтобы снизить экспрессию MEK 1/2 и ERK1/2 [69,73]. После вмешательства IVM при раке молочной железы экспрессия PAK1 также значительно подавлялась, а использование siRNA для подавления экспрессии PAK1 в опухолевых клетках значительно снижало противораковую активность IVM. Интересно, что IVM может ингибировать экспрессию белка PAK1, но не влияет на экспрессию мРНК PAK1 [32].Ингибитор протеасом MG132 обращал вспять супрессивный эффект IVM, что указывало на то, что IVM в основном разрушал PAK1 посредством пути убиквитинирования протеасом. Мы уже упоминали, что IVM играет противораковую роль при различных опухолях, регулируя пути, тесно связанные с развитием рака. PAK1 находится на стыке этих путей. В целом, мы предполагаем, что IVM может регулировать Akt/mTOR, MAPK и другие пути, необходимые для пролиферации опухолевых клеток, путем ингибирования экспрессии PAK1, который играет противораковую роль в большинстве видов рака.
Интересно, что IVM может ингибировать экспрессию белка PAK1, но не влияет на экспрессию мРНК PAK1 [32].Ингибитор протеасом MG132 обращал вспять супрессивный эффект IVM, что указывало на то, что IVM в основном разрушал PAK1 посредством пути убиквитинирования протеасом. Мы уже упоминали, что IVM играет противораковую роль при различных опухолях, регулируя пути, тесно связанные с развитием рака. PAK1 находится на стыке этих путей. В целом, мы предполагаем, что IVM может регулировать Akt/mTOR, MAPK и другие пути, необходимые для пролиферации опухолевых клеток, путем ингибирования экспрессии PAK1, который играет противораковую роль в большинстве видов рака.
PAK1 перекрестно регулирует несколько сигнальных путей.
Активация RAS напрямую инициирует путь PAK1, MAPK и PI3K/Akt. PAK1 распределяет перекрестные помехи между путями PI3K и MAPK. PAK1 может индуцировать активацию MEK1/2 и ERK1/2 с помощью RAF и усиливать передачу сигналов PI3K/Akt с помощью PDK1. PAK1 также может активировать провоспалительные пути, облегчая ядерную активацию NF-каппа B. Кроме того, PAK1 способствует передаче сигналов Wnt/β-катенина, заставляя β-катенин накапливаться в цитоплазме и перемещаться в ядро.Более того, Akt может ингибировать перенос β-катенина в ядро.
Кроме того, PAK1 способствует передаче сигналов Wnt/β-катенина, заставляя β-катенин накапливаться в цитоплазме и перемещаться в ядро.Более того, Akt может ингибировать перенос β-катенина в ядро.
6. Обзор и перспективы
Злокачественные опухоли являются сегодня одним из самых серьезных заболеваний, угрожающих здоровью и социальному развитию человека, а химиотерапия является одним из важнейших методов лечения злокачественных опухолей. В последние годы в клинику поступило много новых химиотерапевтических препаратов, но опухолевые клетки склонны к лекарственной устойчивости и явным побочным реакциям на эти препараты. Поэтому разработка новых препаратов, способных преодолевать резистентность, повышать противоопухолевую активность и уменьшать побочные эффекты, является актуальной проблемой, требующей решения в химиотерапии.Репозиционирование лекарств — это кратчайший путь к ускорению разработки противоопухолевых препаратов.
Как упоминалось выше, противопаразитарное средство широкого спектра действия IVM, которое широко используется в области борьбы с паразитами, имеет много преимуществ, которые позволяют предположить, что его стоит разрабатывать в качестве потенциального нового противоопухолевого препарата.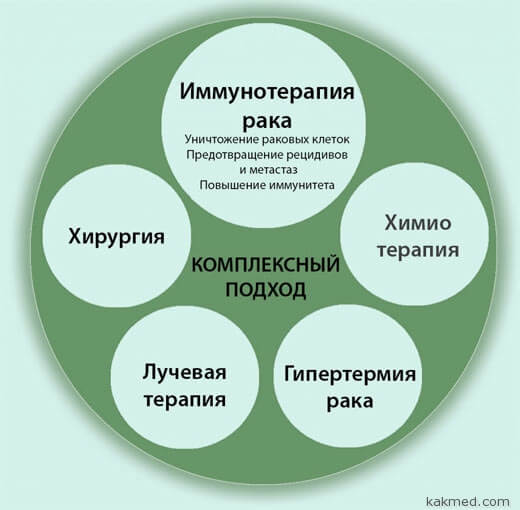 IVM избирательно ингибирует пролиферацию опухолей в дозе, которая не токсична для нормальных клеток и может обратить вспять МЛУ опухолей. Важно отметить, что IVM является признанным препаратом, используемым для лечения паразитарных заболеваний, таких как речная слепота и слоновость.Он широко используется у людей в течение многих лет, и его различные фармакологические свойства, включая долгосрочные и краткосрочные токсикологические эффекты и характеристики метаболизма лекарств, очень ясны. У здоровых добровольцев доза была увеличена до 2 мг/кг, и серьезных побочных реакций обнаружено не было, в то время как испытания на животных, таких как мыши, крысы и кролики, показали, что средняя летальная доза (LD50) IVM составляла 10-50 мг. /кг [112]. Кроме того, было доказано, что IVM демонстрирует хорошую проницаемость в опухолевых тканях [50].К сожалению, сообщений о клинических испытаниях IVM в качестве противоопухолевого препарата не поступало. Есть еще некоторые проблемы, которые необходимо изучить и решить, прежде чем ИВМ будет использоваться в клинике.
IVM избирательно ингибирует пролиферацию опухолей в дозе, которая не токсична для нормальных клеток и может обратить вспять МЛУ опухолей. Важно отметить, что IVM является признанным препаратом, используемым для лечения паразитарных заболеваний, таких как речная слепота и слоновость.Он широко используется у людей в течение многих лет, и его различные фармакологические свойства, включая долгосрочные и краткосрочные токсикологические эффекты и характеристики метаболизма лекарств, очень ясны. У здоровых добровольцев доза была увеличена до 2 мг/кг, и серьезных побочных реакций обнаружено не было, в то время как испытания на животных, таких как мыши, крысы и кролики, показали, что средняя летальная доза (LD50) IVM составляла 10-50 мг. /кг [112]. Кроме того, было доказано, что IVM демонстрирует хорошую проницаемость в опухолевых тканях [50].К сожалению, сообщений о клинических испытаниях IVM в качестве противоопухолевого препарата не поступало. Есть еще некоторые проблемы, которые необходимо изучить и решить, прежде чем ИВМ будет использоваться в клинике.
(1) Хотя большое количество результатов исследований указывает на то, что IVM влияет на несколько сигнальных путей в опухолевых клетках и ингибирует пролиферацию, IVM может вызывать противоопухолевую активность в опухолевых клетках через определенные мишени. Однако на сегодняшний день точной цели для действия IVM не найдено. (2) IVM регулирует микроокружение опухоли, ингибирует активность опухолевых стволовых клеток и снижает ангиогенез опухоли и метастазирование опухоли.Однако нет систематического и четкого вывода относительно родственного молекулярного механизма. Поэтому в будущих исследованиях необходимо продолжить изучение специфического механизма IVM, участвующего в регуляции микроокружения опухоли, ангиогенеза и ЭМП. (3) Становится все более очевидным, что IVM может индуцировать смешанный режим гибели клеток, включающий апоптоз, аутофагию и пироптоз, в зависимости от состояния клеток и типа рака. Выявление преобладающего или наиболее важного фактора гибели клеток при каждом типе рака и окружающей среде будет иметь решающее значение для определения эффективности лечения на основе IVM. (4) IVM может повышать чувствительность химиотерапевтических препаратов и снижать резистентность. Таким образом, IVM следует использовать в сочетании с другими препаратами для достижения наилучшего эффекта, в то время как конкретный план лечения, используемый для комбинации IVM с другими препаратами, еще предстоит изучить.
(4) IVM может повышать чувствительность химиотерапевтических препаратов и снижать резистентность. Таким образом, IVM следует использовать в сочетании с другими препаратами для достижения наилучшего эффекта, в то время как конкретный план лечения, используемый для комбинации IVM с другими препаратами, еще предстоит изучить.
Большая часть противораковых исследований, проведенных в отношении семейства авермектинов, до сих пор была сосредоточена на авермектине и IVM. Как сообщалось ранее, препараты семейства авермектинов, такие как селамектин [36, 41, 113] и дорамектин [114], также обладают противоопухолевым действием.С разработкой производных семейства авермектинов, которые являются более эффективными и менее токсичными, соответствующие исследования противоракового механизма производных по-прежнему имеют большое значение. Существующих исследований достаточно, чтобы продемонстрировать большой потенциал IVM и его перспективы в качестве нового многообещающего противоракового препарата после дополнительных исследований. Мы считаем, что в ближайшем будущем IVM можно будет развивать и внедрять в клиническую практику как часть новых методов лечения рака.
Мы считаем, что в ближайшем будущем IVM можно будет развивать и внедрять в клиническую практику как часть новых методов лечения рака.
Декларация о конкурирующих интересах
Авторы сообщают об отсутствии заявлений о заинтересованности.
Благодарности
Эта работа была поддержана Проектом группы научных исследований и инноваций колледжей и университетов провинции Аньхой (2016-40 гг.), Городским фондом естественных наук Бэнбу (2019-12 гг.), Ключевыми проектами научных исследований Медицинского колледжа Бэнбу ( BYKY2019009ZD) и Программа подготовки студентов Национального университета по инновациям и предпринимательству (201
Ссылки
1. Campbell W.C., Fisher M.H., Stapley E.O., Albers-Schonberg G., Jacob T.A. Ивермектин: новое мощное противопаразитарное средство.Наука. 1983;221(4613):823–828. doi: 10.1126/science.6308762. [PubMed] [CrossRef] [Google Scholar]2. Причард Р.К., Гири Т.Г. Перспективы применения моксидектина для борьбы с паразитическими нематодами в условиях развития резистентности к антигельминтным средствам. Int J Препараты от паразитов с лекарственной устойчивостью. 2019;10:69–83. doi: 10.1016/j.ijpddr.2019.06.002. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]3. Ашур Д.С. Ивермектин: от теории к клиническому применению. Противомикробные агенты Int J. 2019;54(2):134–142.doi: 10.1016/j.ijantimicag.2019.05.003. [PubMed] [CrossRef] [Google Scholar]4. Гуди А.С., Эванс Н.А., Гратион К.А., Бишоп Б.Ф., Гибсон С.П., Холдом К.С., Кэй Б., Уикс С.Р., Льюис Д., Уэзерли А.Дж. Дорамектин — мощный новый эндектоцид. Вет Паразитол. 1993;49(1):5–15. doi: 10.1016/0304-4017(93)-c. [PubMed] [CrossRef] [Google Scholar]5. Бишоп Б.Ф., Брюс С.И., Эванс Н.А., Гуди А.С., Гратион К.А., Гибсон С.П., Пейси М.С., Перри Д.А., Уолше Н.Д., Уитти М.Дж. Селамектин: новый эндектоцид широкого спектра действия для собак и кошек.Вет Паразитол. 2000;91(3-4):163–176. doi: 10.1016/s0304-4017(00)00289-2. [PubMed] [CrossRef] [Google Scholar]7. Крамп А. Ивермектин: загадочный многогранный «чудесный» препарат продолжает удивлять и превосходить ожидания.
Int J Препараты от паразитов с лекарственной устойчивостью. 2019;10:69–83. doi: 10.1016/j.ijpddr.2019.06.002. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]3. Ашур Д.С. Ивермектин: от теории к клиническому применению. Противомикробные агенты Int J. 2019;54(2):134–142.doi: 10.1016/j.ijantimicag.2019.05.003. [PubMed] [CrossRef] [Google Scholar]4. Гуди А.С., Эванс Н.А., Гратион К.А., Бишоп Б.Ф., Гибсон С.П., Холдом К.С., Кэй Б., Уикс С.Р., Льюис Д., Уэзерли А.Дж. Дорамектин — мощный новый эндектоцид. Вет Паразитол. 1993;49(1):5–15. doi: 10.1016/0304-4017(93)-c. [PubMed] [CrossRef] [Google Scholar]5. Бишоп Б.Ф., Брюс С.И., Эванс Н.А., Гуди А.С., Гратион К.А., Гибсон С.П., Пейси М.С., Перри Д.А., Уолше Н.Д., Уитти М.Дж. Селамектин: новый эндектоцид широкого спектра действия для собак и кошек.Вет Паразитол. 2000;91(3-4):163–176. doi: 10.1016/s0304-4017(00)00289-2. [PubMed] [CrossRef] [Google Scholar]7. Крамп А. Ивермектин: загадочный многогранный «чудесный» препарат продолжает удивлять и превосходить ожидания. J Antibiot (Токио) 2017;70(5):495–505. doi: 10.1038/ja.2017.11. [PubMed] [CrossRef] [Google Scholar]8. МакКерроу Дж. Х. Признание роли натуральных продуктов в качестве лекарств для лечения забытых тропических болезней Нобелевской премией 2015 года по физиологии и медицине. Nat Prod Rep. 2015;32(12):1610–1611.doi: 10.1039/c5npc. [PubMed] [CrossRef] [Google Scholar]9. Кейн Н.С., Хиршберг Б., Цянь С., Хант Д., Томас Б., Брошу Р., Людмерер С.В., Чжэн Ю., Смит М., Арена Дж.П., Коэн С.Дж., Шматц Д., Вармке Дж., Калли Д.Ф. Лекарственно-резистентные дрозофилы указывают на то, что управляемые глутаматом хлоридные каналы являются мишенями для антипаразитарных средств нодулиспоровой кислоты и ивермектина. Proc Natl Acad Sci U S A. 2000;97(25):13949–13954. doi: 10.1073/pnas.240464697. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]10. Фриц Л.C., Wang C.C., Gorio A. Авермектин B1a необратимо блокирует постсинаптические потенциалы в нервно-мышечном соединении омара, снижая сопротивление мышечной мембраны.
J Antibiot (Токио) 2017;70(5):495–505. doi: 10.1038/ja.2017.11. [PubMed] [CrossRef] [Google Scholar]8. МакКерроу Дж. Х. Признание роли натуральных продуктов в качестве лекарств для лечения забытых тропических болезней Нобелевской премией 2015 года по физиологии и медицине. Nat Prod Rep. 2015;32(12):1610–1611.doi: 10.1039/c5npc. [PubMed] [CrossRef] [Google Scholar]9. Кейн Н.С., Хиршберг Б., Цянь С., Хант Д., Томас Б., Брошу Р., Людмерер С.В., Чжэн Ю., Смит М., Арена Дж.П., Коэн С.Дж., Шматц Д., Вармке Дж., Калли Д.Ф. Лекарственно-резистентные дрозофилы указывают на то, что управляемые глутаматом хлоридные каналы являются мишенями для антипаразитарных средств нодулиспоровой кислоты и ивермектина. Proc Natl Acad Sci U S A. 2000;97(25):13949–13954. doi: 10.1073/pnas.240464697. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]10. Фриц Л.C., Wang C.C., Gorio A. Авермектин B1a необратимо блокирует постсинаптические потенциалы в нервно-мышечном соединении омара, снижая сопротивление мышечной мембраны. Proc Natl Acad Sci U S A. 1979;76(4):2062–2066. doi: 10.1073/pnas.76.4.2062. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]11. Смит М.Р., Очомо Э.О., Альджаюсси Г., Квамбай Т.К., Абонг’о Б.О., Чен Т., Бузема Т., Слейтер Х.К., Уотерхаус Д., Байо Н.М., Гимниг Д.Е., Сэмюэлс А.М., Десаи М.Р., Филлипс-Ховард П.А., Кариуки С.К., Ван Д., Уорд С.А., Тер Куиле Ф.О. Безопасность и противомоскитная эффективность высоких доз ивермектина при совместном введении с дигидроартемизинин-пиперакином у взрослых кенийцев с неосложненной малярией (IVERMAL): рандомизированное двойное слепое плацебо-контролируемое исследование. Ланцет Infect Dis. 2018;18(6):615–626. doi: 10.1016/s1473-3099(18)30163-4. [PubMed] [CrossRef] [Google Scholar] 12. Фой Б.Д., Алаут Х., Симэн Дж.А., Рао С., Магалхаес Т., Уэйд М., Парих С., Сома Д.Д., Санья А.Б., Фурнет Ф., Слейтер Х.К., Бугма Р., Драбо Ф., Диабате А., Кулидиати А.Г.В., Руамба Н., Дабире Р.К. Эффективность и риск вреда от повторных массовых назначений ивермектина для борьбы с малярией (RIMDAMAL): кластерное рандомизированное исследование.
Proc Natl Acad Sci U S A. 1979;76(4):2062–2066. doi: 10.1073/pnas.76.4.2062. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]11. Смит М.Р., Очомо Э.О., Альджаюсси Г., Квамбай Т.К., Абонг’о Б.О., Чен Т., Бузема Т., Слейтер Х.К., Уотерхаус Д., Байо Н.М., Гимниг Д.Е., Сэмюэлс А.М., Десаи М.Р., Филлипс-Ховард П.А., Кариуки С.К., Ван Д., Уорд С.А., Тер Куиле Ф.О. Безопасность и противомоскитная эффективность высоких доз ивермектина при совместном введении с дигидроартемизинин-пиперакином у взрослых кенийцев с неосложненной малярией (IVERMAL): рандомизированное двойное слепое плацебо-контролируемое исследование. Ланцет Infect Dis. 2018;18(6):615–626. doi: 10.1016/s1473-3099(18)30163-4. [PubMed] [CrossRef] [Google Scholar] 12. Фой Б.Д., Алаут Х., Симэн Дж.А., Рао С., Магалхаес Т., Уэйд М., Парих С., Сома Д.Д., Санья А.Б., Фурнет Ф., Слейтер Х.К., Бугма Р., Драбо Ф., Диабате А., Кулидиати А.Г.В., Руамба Н., Дабире Р.К. Эффективность и риск вреда от повторных массовых назначений ивермектина для борьбы с малярией (RIMDAMAL): кластерное рандомизированное исследование. Ланцет. 2019;393(10180):1517–1526. doi: 10.1016/s0140-6736(18)32321-3. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]13. Уденси У.К., Фагбенро-Бейиоку А.Ф. Влияние ивермектина на Trypanosoma brucei brucei у экспериментально инфицированных мышей. Дж. Вектор Борн Дис. 2012;49(3):143–150. [PubMed] [Google Scholar] 14.Кац Н., Араужо Н., Коэльо П.М.З., Морель С.М., Линде-Ариас А.Р., Ямада Т., Хоримацу Ю., Судзуки К., Сунадзука Т., Омура С. Эффективность ивермектина против биомфалярии, улитки-переносчика шистосомоза промежуточного хозяина. J Antibiot (Токио) 2017;70(5):680–684. doi: 10.1038/ja.2017.31. [PubMed] [CrossRef] [Google Scholar] 15. Б. М.М., Э.-С. А.А. Терапевтический потенциал мирры и ивермектина в отношении экспериментальной инфекции Trichinella Spiralis у мышей. Корейский журнал паразитологии. 2013;51(3):297–304. дои: 10.3347/kjp.2013.51.3.297. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]16. Ханафи Х.А., Сумлас Д.Э., Фряуфф Д.Дж., Эль-Хоссари С.С., Сингер Г.
Ланцет. 2019;393(10180):1517–1526. doi: 10.1016/s0140-6736(18)32321-3. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]13. Уденси У.К., Фагбенро-Бейиоку А.Ф. Влияние ивермектина на Trypanosoma brucei brucei у экспериментально инфицированных мышей. Дж. Вектор Борн Дис. 2012;49(3):143–150. [PubMed] [Google Scholar] 14.Кац Н., Араужо Н., Коэльо П.М.З., Морель С.М., Линде-Ариас А.Р., Ямада Т., Хоримацу Ю., Судзуки К., Сунадзука Т., Омура С. Эффективность ивермектина против биомфалярии, улитки-переносчика шистосомоза промежуточного хозяина. J Antibiot (Токио) 2017;70(5):680–684. doi: 10.1038/ja.2017.31. [PubMed] [CrossRef] [Google Scholar] 15. Б. М.М., Э.-С. А.А. Терапевтический потенциал мирры и ивермектина в отношении экспериментальной инфекции Trichinella Spiralis у мышей. Корейский журнал паразитологии. 2013;51(3):297–304. дои: 10.3347/kjp.2013.51.3.297. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]16. Ханафи Х.А., Сумлас Д.Э., Фряуфф Д.Дж., Эль-Хоссари С.С., Сингер Г. А., Осман С.Г., Ватани Н., Фурман Б.Д., Хоэль Д.Ф. Влияние ивермектина на кровососущих Phlebotomus papatasi и промастиготную стадию Leishmania major. Векторные зоонозные заболевания. 2011;11(1):43–52. doi: 10.1089/vbz.2009.0030. [PubMed] [CrossRef] [Google Scholar] 17. Мастранжело Э., Пеццулло М., Де Бурггрейв Т., Каптейн С., Пасторино Б., Даллмайер К., de Lamballerie X., Neyts J., Hanson AM, Frick D.N., Bolognesi M., Milani M. Ивермектин является мощным ингибитором репликации флавивируса, специально нацеленным на активность хеликазы NS3: новые перспективы для старого препарата. J Антимикробная химиотерапия. 2012;67(8):1884–1894. doi: 10.1093/jac/dks147. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]18. Вагстафф К.М., Сивакумаран Х., Хитон С.М., Харрич Д., Янс Д.А. Ивермектин является специфическим ингибитором импортина, опосредованного альфа/бета-импортином, способным ингибировать репликацию ВИЧ-1 и вируса денге.Биохим Дж. 2012;443(3):851–856. doi: 10.1042/bj20120150. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]19. Кэли Л., Дрюс Дж.Д., Каттон М.Г., Янс Д.А., Вагстафф К.М. Одобренный FDA препарат ивермектин ингибирует репликацию SARS-CoV-2 in vitro. Противовирусный рез. 2020:104787. doi: 10.1016/j.antiviral.2020.104787. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]20. Yan S., Ci X., Chen N., Chen C., Li X., Chu X., Li J., Deng X. Противовоспалительное действие ивермектина на мышиной модели аллергической астмы.Инфламм Рез. 2011;60(6):589–596. doi: 10.1007/s00011-011-0307-8. [PubMed] [CrossRef] [Google Scholar] 21. Франклин К.М., Асатрян Л., Яковец М.В., Труделл Дж.Р., Белл Р.Л., Дэвис Д.Л. Рецепторы P2X4 (P2X4R) представляют собой новую мишень для разработки лекарств для профилактики и/или лечения расстройств, связанных с употреблением алкоголя. Фронтальные нейроски. 2014; 8:176. doi: 10.3389/fnins.2014.00176. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]22. Didier A., Loor F. Производное абамектина ивермектин является мощным ингибитором p-гликопротеина.Противораковые препараты. 1996;7(7):745–751. doi: 10.1097/00001813-199609000-00005. [PubMed] [CrossRef] [Google Scholar] 23. Markowska A., Kaysiewicz J., Markowska J., Huczynski A. Доксициклин, салиномицин, монензин и ивермектин перепозиционированы как противораковые препараты. Bioorg Med Chem Lett. 2019;29(13):1549–1554. doi: 10.1016/j.bmcl.2019.04.045. [PubMed] [CrossRef] [Google Scholar] 24. Хуарес М., Школьник-Кабрера А., Дуэньяс-Гонсалес А. Многоцелевой препарат ивермектин: от противопаразитарного средства до нового лекарства от рака.Am J Рак Res. 2018;8(2):317–331. [Бесплатная статья PMC] [PubMed] [Google Scholar]25. Лю Дж., Чжан К., Ченг Л., Чжу Х., Сюй Т. Прогресс в понимании молекулярных механизмов, лежащих в основе противоопухолевых эффектов ивермектина. Препарат Des Devel Ther. 2020;14:285–296. doi: 10.2147/dddt.S237393. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]26. Антощак М., Марковска А., Марковска Ю., Хучински А. Старое вино в новых бутылках: перепрофилирование лекарств в онкологии. Евр Дж Фармакол. 2020;866:172784. дои: 10.1016/j.ejphar.2019.172784. [PubMed] [CrossRef] [Google Scholar] 27. Кобаяши Ю., Банно К., Кунитоми Х., Томинага Э., Аоки Д. Текущее состояние и перспективы ожидаемого изменения позиционирования лекарств в области рака яичников. J Гинекол Онкол. 2019;30(1):e10. doi: 10.3802/jgo.2019.30.e10. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]28. Йошида Г.Дж. Терапевтические стратегии изменения положения лекарств, нацеленные на аутофагию, чтобы вызвать гибель раковых клеток: от патофизиологии к лечению. J Гематол Онкол. 2017;10(1):67.doi: 10.1186/s13045-017-0436-9. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]29. Вурт Р., Теллунг С., Баджетто А., Маззанти М., Флорио Т., Барбьери Ф. Возможности перепозиционирования лекарств для лечения рака: новые молекулярные мишени для известных соединений. Наркотиков Дисков Сегодня. 2016;21(1):190–199. doi: 10.1016/j.drudis.2015.09.017. [PubMed] [CrossRef] [Google Scholar] 30. Харбек Н., Пено-Льорка Ф., Кортес Дж., Гнант М., Хуссами Н., Поортманс П., Радди К., Цанг Дж., Кардосо Ф. Рак молочной железы. Праймеры Nat Rev Dis.2019;5(1):66. doi: 10.1038/s41572-019-0111-2. [PubMed] [CrossRef] [Google Scholar] 31. Гинзбург О., Брей Ф., Коулман М.П., Вандерпуйе В., Эниу А., Кота С.Р., Саркер М., Хуонг Т.Т., Аллемани С., Дваладзе А., Гралоу Дж., Йейтс К., Тейлор С., Оомман Н., Кришнан С., Салливан Р., Комбе Д., Блас М.М., Пархам Г., Кассами Н., Контех Л. Глобальное бремя рака у женщин: большая проблема глобального здравоохранения. Ланцет. 2017;389(10071):847–860. doi: 10.1016/s0140-6736(16)31392-7. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]32.Dou Q., Chen HN, Wang K., Yuan K., Lei Y., Li K., Lan J., Chen Y., Huang Z., Xie N., Zhang L., Xiang R., Nice EC, Wei Y., Huang C. Ивермектин вызывает цитостатическую аутофагию, блокируя ось PAK1/Akt при раке молочной железы. Рак рез. 2016;76(15):4457–4469. doi: 10.1158/0008-5472.CAN-15-2887. [PubMed] [CrossRef] [Google Scholar] 33. Diao H., Cheng N., Zhao Y., Xu H., Dong H., Thamm D.H., Zhang D., Lin D. Ивермектин ингибирует рост опухоли молочной железы у собак, регулируя прогрессирование клеточного цикла и передачу сигналов WNT.BMC Vet Res. 2019;15(1):276. doi: 10.1186/s12917-019-2026-2. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]34. Диана А., Карлино Ф., Францезе Э., Ойкономиду О., Крискителло К., Де Вита Ф., Чардиелло Ф., Ордитура М. Ранний тройной негативный рак молочной железы: традиционное лечение и новые терапевтические ландшафты. Cancers (Базель) 2020; 12(4) doi: 10.3390/cancers12040819. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]35. Дипак К.Г.К., Вемпати Р., Нагараю Г.П., Дасари В.Р., Н.С., Рао Д.Н., Малла Р.Р. Микроокружение опухоли: проблемы и возможности в борьбе с метастазами тройного негативного рака молочной железы. Фармакол рез. 2020;153:104683. doi: 10.1016/j.phrs.2020.104683. [PubMed] [CrossRef] [Google Scholar] 36. Квон Ю.Дж., Петри К., Лейбович Б.А., Зенг Л., Мезей М., Хауэлл Л., Гил В., Христова Р., Бансал Н., Ян С., Шарма Р., Аризтия Э.В., Франкум Дж., Бро Р., Сбирков Ю., Эшворт А., Лорд С.Дж., Зелент А., Фариас Э., Чжоу М.М., Ваксман С. Избирательное ингибирование корепрессора SIN3 с помощью авермектинов как новая терапевтическая стратегия при тройном негативном раке молочной железы.Мол Рак Тер. 2015;14(8):1824–1836. doi: 10.1158/1535-7163.MCT-14-0980-T. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]37. Драганов Д., Гопалакришна-Пиллаи С., Чен Ю.Р., Цукерман Н., Меллер С., Ван С., Энн Д., Ли П.П. Модуляция чувствительности P2X4/P2X7/паннексина-1 к внеклеточному АТФ с помощью ивермектина вызывает неапоптотическую и воспалительную форму гибели раковых клеток. Научный доклад 2015; 5:16222. doi: 10.1038/srep16222. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]38. Тхань Хыонг П., Гуршаней С., Тхань Бинь Н., Гиа Фам А., Хоанг Нгуен Х., Тхань Нгуен Х., Фам-Те Х., Тран П.Т., Чыонг Ву К., Суан Зыонг Н., Пелуччи К., Ла Веккья С., Боффетта П., Нгуен Х.Д., Луу Х.Н. Новая роль циркулирующих опухолевых клеток при раке желудка. Cancers (Базель) 2020; 12(3) doi: 10.3390/cancers12030695. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]39. Намбара С., Масуда Т., Нишио М., Курамицу С., Тобо Т., Огава Ю., Ху К., Игучи Т., Курода Ю., Ито С., Эгучи Х., Сугимати К., Саеки Х. ., Oki E., Maehara Y., Suzuki A., Mimori K. Противоопухолевые эффекты противопаразитарного агента ивермектина посредством ингибирования экспрессии Yes-ассоциированного белка 1 при раке желудка. Онкотаргет. 2017;8(64):107666–107677. doi: 10.18632/oncotarget.22587. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]40. Zanconato F., Cordenonsi M., Piccolo S. YAP и TAZ: сигнальный узел микроокружения опухоли. Нат Рев Рак. 2019;19(8):454–464. doi: 10.1038/s41568-019-0168-y. [PubMed] [CrossRef] [Google Scholar]41.Мелотти А., Мас С., Куциак М., Лоренте-Тригос А., Борхес И., Руиз и Альтаба А. Лекарство от речной слепоты ивермектин и родственные макроциклические лактоны ингибируют реакции пути WNT-TCF при раке человека. EMBO Мол Мед. 2014;6(10):1263–1278. doi: 10.15252/emmm.201404084. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]42. Ян Дж.Д., Эно П., Горс Дж.Дж., Амаду А., Плимот А., Робертс Л.Р. Глобальный взгляд на гепатоцеллюлярную карциному: тенденции, риск, профилактика и лечение. Нат Рев Гастроэнтерол Гепатол.2019;16(10):589–604. doi: 10.1038/s41575-019-0186-y. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]43. Нишио М., Сугимати К., Гото Х., Ван Дж., Морикава Т., Миячи Ю., Такано Ю., Хикаса Х., Ито Т., Судзуки С.О., Курихара Х., Аишима С., Лиск А. , Sasaki T., Nakano T., Nishina H., Nishikawa Y., Sekido Y., Nakao K., Shin-Ya K., Mimori K., Suzuki A. Дисрегуляция передачи сигналов YAP1/TAZ и TGF-бета опосредует гепатокарциногенез в Mob1a/1b-дефицитные мыши. Proc Natl Acad Sci U S A. 2016;113(1):71–80.doi: 10.1073/pnas.1517188113. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]44. Интуйод К., Ханваджанавонг К., Пинлаор П., Пинлаор С. Противопаразитарное лекарственное средство ивермектин проявляет мощную противораковую активность против устойчивой к гемцитабину холангиокарциномы in vitro. Противораковый Рез. 2019;39(9):4837–4843. doi: 10.21873/anticanres.13669. [PubMed] [CrossRef] [Google Scholar]45. Ван Ю., Су Дж., Ван Ю., Фу Д., Идеозу Дж. Э., Гэн Х., Цуй К., Ван С., Чен Р., Ю Ю., Ню Ю., Юэ Д. Взаимодействие YBX1 с G3BP1 способствует метастазированию клеток почечно-клеточной карциномы через сигнальную ось YBX1/G3BP1-SPP1-NF-kappaB.J Exp Clin Cancer Res. 2019;38(1):386. doi: 10.1186/s13046-019-1347-0. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]46. Сюй В.Х., Ши С.Н., Сюй Ю., Ван Дж., Ван Х.К., Цао Д.Л., Ши Г.Х., Цюй Ю.Ю., Чжан Х.Л., Е Д.В. Прогностические последствия экспрессии аквапорина 9 при светлоклеточной почечно-клеточной карциноме. J Transl Med. 2019;17(1):363. doi: 10.1186/s12967-019-2113-y. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]47. Сигел Р.Л., Миллер К.Д., Джемал А. Статистика рака, 2019. CA Cancer J Clin.2019;69(1):7–34. doi: 10.3322/caac.21551. [PubMed] [CrossRef] [Google Scholar]48. Чжу М., Ли Ю., Чжоу З. Антибиотик ивермектин предпочтительно нацелен на рак почки, вызывая митохондриальную дисфункцию и окислительное повреждение. Коммуникации биохимических и биофизических исследований. 2017;492(3):373–378. doi: 10.1016/j.bbrc.2017.08.097. [PubMed] [CrossRef] [Google Scholar]50. Наппи Л., Агуда А.Х., Накузи Н.А., Лель-Гаролла Б., Беральди Э., Лаллус Н., Ти М., Мур С., Фазли Л., Баттсогт Д., Стиф С., Ban F., Nguyen NT, Saxena N., Dueva E., Zhang F., Yamazaki T., Zoubeidi A., Cherkasov A., Brayer GD, Gleave M. Ивермектин ингибирует HSP27 и усиливает эффективность нацеливания на онкогены в моделях опухолей. . Джей Клин Инвест. 2020;130(2):699–714. doi: 10.1172/jci130819. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]51. Шармин С., Скртич М., Сухай М.А., Хуррен Р., Гронда М., Ван Х., Фонсека С.Б., Сун Х., Вуд Т.Э., Уорд Р., Минден М.Д., Бати Р.А., Датти А., Врана Дж. , Келли С.О., Шиммер А.D. Противопаразитарное средство ивермектин индуцирует хлорид-зависимую гиперполяризацию мембран и гибель клеток в лейкозных клетках. Кровь. 2010;116(18):3593–3603. doi: 10.1182/blood-2010-01-262675. [PubMed] [CrossRef] [Google Scholar]52. Апперли Дж. Ф. Хронический миелоидный лейкоз. Ланцет. 2015;385(9976):1447–1459. doi: 10.1016/s0140-6736(13)62120-0. [PubMed] [CrossRef] [Google Scholar]53. Ван Дж., Сюй Ю., Ван Х., Ху Дж. Антибиотик ивермектин избирательно индуцирует апоптоз при хроническом миелоидном лейкозе, вызывая митохондриальную дисфункцию и окислительный стресс.Biochem Biophys Res Commun. 2018;497(1):241–247. doi: 10.1016/j.bbrc.2018.02.063. [PubMed] [CrossRef] [Google Scholar]54. Dong Z., Yu C., Rezhiya K., Gulijiahan A., Wang X. Понижающая регуляция миР-146a способствует онкогенезу стволовых клеток рака шейки матки через сигнальный путь VEGF/CDC42/PAK1. Artif Cells Nanomed Biotechnol. 2019;47(1):3711–3719. doi: 10.1080/216.2019.1664560. [PubMed] [CrossRef] [Google Scholar]55. Карнейро С.Р., да Силва Лима А.А., де Фатима Силва Сантос Г., де Оливейра К.С.B., Almeida M.C.V., da Conceicao Nascimento Pinheiro M. Связь между окислительным стрессом и физической активностью у женщин с плоскоклеточными интраэпителиальными поражениями в программе борьбы с раком шейки матки в бразильской Амазонии. Оксид Мед Селл Лонгев. 2019; 2019 doi: 10.1155/2019/8
А., Осман С.Г., Ватани Н., Фурман Б.Д., Хоэль Д.Ф. Влияние ивермектина на кровососущих Phlebotomus papatasi и промастиготную стадию Leishmania major. Векторные зоонозные заболевания. 2011;11(1):43–52. doi: 10.1089/vbz.2009.0030. [PubMed] [CrossRef] [Google Scholar] 17. Мастранжело Э., Пеццулло М., Де Бурггрейв Т., Каптейн С., Пасторино Б., Даллмайер К., de Lamballerie X., Neyts J., Hanson AM, Frick D.N., Bolognesi M., Milani M. Ивермектин является мощным ингибитором репликации флавивируса, специально нацеленным на активность хеликазы NS3: новые перспективы для старого препарата. J Антимикробная химиотерапия. 2012;67(8):1884–1894. doi: 10.1093/jac/dks147. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]18. Вагстафф К.М., Сивакумаран Х., Хитон С.М., Харрич Д., Янс Д.А. Ивермектин является специфическим ингибитором импортина, опосредованного альфа/бета-импортином, способным ингибировать репликацию ВИЧ-1 и вируса денге.Биохим Дж. 2012;443(3):851–856. doi: 10.1042/bj20120150. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]19. Кэли Л., Дрюс Дж.Д., Каттон М.Г., Янс Д.А., Вагстафф К.М. Одобренный FDA препарат ивермектин ингибирует репликацию SARS-CoV-2 in vitro. Противовирусный рез. 2020:104787. doi: 10.1016/j.antiviral.2020.104787. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]20. Yan S., Ci X., Chen N., Chen C., Li X., Chu X., Li J., Deng X. Противовоспалительное действие ивермектина на мышиной модели аллергической астмы.Инфламм Рез. 2011;60(6):589–596. doi: 10.1007/s00011-011-0307-8. [PubMed] [CrossRef] [Google Scholar] 21. Франклин К.М., Асатрян Л., Яковец М.В., Труделл Дж.Р., Белл Р.Л., Дэвис Д.Л. Рецепторы P2X4 (P2X4R) представляют собой новую мишень для разработки лекарств для профилактики и/или лечения расстройств, связанных с употреблением алкоголя. Фронтальные нейроски. 2014; 8:176. doi: 10.3389/fnins.2014.00176. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]22. Didier A., Loor F. Производное абамектина ивермектин является мощным ингибитором p-гликопротеина.Противораковые препараты. 1996;7(7):745–751. doi: 10.1097/00001813-199609000-00005. [PubMed] [CrossRef] [Google Scholar] 23. Markowska A., Kaysiewicz J., Markowska J., Huczynski A. Доксициклин, салиномицин, монензин и ивермектин перепозиционированы как противораковые препараты. Bioorg Med Chem Lett. 2019;29(13):1549–1554. doi: 10.1016/j.bmcl.2019.04.045. [PubMed] [CrossRef] [Google Scholar] 24. Хуарес М., Школьник-Кабрера А., Дуэньяс-Гонсалес А. Многоцелевой препарат ивермектин: от противопаразитарного средства до нового лекарства от рака.Am J Рак Res. 2018;8(2):317–331. [Бесплатная статья PMC] [PubMed] [Google Scholar]25. Лю Дж., Чжан К., Ченг Л., Чжу Х., Сюй Т. Прогресс в понимании молекулярных механизмов, лежащих в основе противоопухолевых эффектов ивермектина. Препарат Des Devel Ther. 2020;14:285–296. doi: 10.2147/dddt.S237393. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]26. Антощак М., Марковска А., Марковска Ю., Хучински А. Старое вино в новых бутылках: перепрофилирование лекарств в онкологии. Евр Дж Фармакол. 2020;866:172784. дои: 10.1016/j.ejphar.2019.172784. [PubMed] [CrossRef] [Google Scholar] 27. Кобаяши Ю., Банно К., Кунитоми Х., Томинага Э., Аоки Д. Текущее состояние и перспективы ожидаемого изменения позиционирования лекарств в области рака яичников. J Гинекол Онкол. 2019;30(1):e10. doi: 10.3802/jgo.2019.30.e10. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]28. Йошида Г.Дж. Терапевтические стратегии изменения положения лекарств, нацеленные на аутофагию, чтобы вызвать гибель раковых клеток: от патофизиологии к лечению. J Гематол Онкол. 2017;10(1):67.doi: 10.1186/s13045-017-0436-9. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]29. Вурт Р., Теллунг С., Баджетто А., Маззанти М., Флорио Т., Барбьери Ф. Возможности перепозиционирования лекарств для лечения рака: новые молекулярные мишени для известных соединений. Наркотиков Дисков Сегодня. 2016;21(1):190–199. doi: 10.1016/j.drudis.2015.09.017. [PubMed] [CrossRef] [Google Scholar] 30. Харбек Н., Пено-Льорка Ф., Кортес Дж., Гнант М., Хуссами Н., Поортманс П., Радди К., Цанг Дж., Кардосо Ф. Рак молочной железы. Праймеры Nat Rev Dis.2019;5(1):66. doi: 10.1038/s41572-019-0111-2. [PubMed] [CrossRef] [Google Scholar] 31. Гинзбург О., Брей Ф., Коулман М.П., Вандерпуйе В., Эниу А., Кота С.Р., Саркер М., Хуонг Т.Т., Аллемани С., Дваладзе А., Гралоу Дж., Йейтс К., Тейлор С., Оомман Н., Кришнан С., Салливан Р., Комбе Д., Блас М.М., Пархам Г., Кассами Н., Контех Л. Глобальное бремя рака у женщин: большая проблема глобального здравоохранения. Ланцет. 2017;389(10071):847–860. doi: 10.1016/s0140-6736(16)31392-7. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]32.Dou Q., Chen HN, Wang K., Yuan K., Lei Y., Li K., Lan J., Chen Y., Huang Z., Xie N., Zhang L., Xiang R., Nice EC, Wei Y., Huang C. Ивермектин вызывает цитостатическую аутофагию, блокируя ось PAK1/Akt при раке молочной железы. Рак рез. 2016;76(15):4457–4469. doi: 10.1158/0008-5472.CAN-15-2887. [PubMed] [CrossRef] [Google Scholar] 33. Diao H., Cheng N., Zhao Y., Xu H., Dong H., Thamm D.H., Zhang D., Lin D. Ивермектин ингибирует рост опухоли молочной железы у собак, регулируя прогрессирование клеточного цикла и передачу сигналов WNT.BMC Vet Res. 2019;15(1):276. doi: 10.1186/s12917-019-2026-2. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]34. Диана А., Карлино Ф., Францезе Э., Ойкономиду О., Крискителло К., Де Вита Ф., Чардиелло Ф., Ордитура М. Ранний тройной негативный рак молочной железы: традиционное лечение и новые терапевтические ландшафты. Cancers (Базель) 2020; 12(4) doi: 10.3390/cancers12040819. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]35. Дипак К.Г.К., Вемпати Р., Нагараю Г.П., Дасари В.Р., Н.С., Рао Д.Н., Малла Р.Р. Микроокружение опухоли: проблемы и возможности в борьбе с метастазами тройного негативного рака молочной железы. Фармакол рез. 2020;153:104683. doi: 10.1016/j.phrs.2020.104683. [PubMed] [CrossRef] [Google Scholar] 36. Квон Ю.Дж., Петри К., Лейбович Б.А., Зенг Л., Мезей М., Хауэлл Л., Гил В., Христова Р., Бансал Н., Ян С., Шарма Р., Аризтия Э.В., Франкум Дж., Бро Р., Сбирков Ю., Эшворт А., Лорд С.Дж., Зелент А., Фариас Э., Чжоу М.М., Ваксман С. Избирательное ингибирование корепрессора SIN3 с помощью авермектинов как новая терапевтическая стратегия при тройном негативном раке молочной железы.Мол Рак Тер. 2015;14(8):1824–1836. doi: 10.1158/1535-7163.MCT-14-0980-T. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]37. Драганов Д., Гопалакришна-Пиллаи С., Чен Ю.Р., Цукерман Н., Меллер С., Ван С., Энн Д., Ли П.П. Модуляция чувствительности P2X4/P2X7/паннексина-1 к внеклеточному АТФ с помощью ивермектина вызывает неапоптотическую и воспалительную форму гибели раковых клеток. Научный доклад 2015; 5:16222. doi: 10.1038/srep16222. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]38. Тхань Хыонг П., Гуршаней С., Тхань Бинь Н., Гиа Фам А., Хоанг Нгуен Х., Тхань Нгуен Х., Фам-Те Х., Тран П.Т., Чыонг Ву К., Суан Зыонг Н., Пелуччи К., Ла Веккья С., Боффетта П., Нгуен Х.Д., Луу Х.Н. Новая роль циркулирующих опухолевых клеток при раке желудка. Cancers (Базель) 2020; 12(3) doi: 10.3390/cancers12030695. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]39. Намбара С., Масуда Т., Нишио М., Курамицу С., Тобо Т., Огава Ю., Ху К., Игучи Т., Курода Ю., Ито С., Эгучи Х., Сугимати К., Саеки Х. ., Oki E., Maehara Y., Suzuki A., Mimori K. Противоопухолевые эффекты противопаразитарного агента ивермектина посредством ингибирования экспрессии Yes-ассоциированного белка 1 при раке желудка. Онкотаргет. 2017;8(64):107666–107677. doi: 10.18632/oncotarget.22587. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]40. Zanconato F., Cordenonsi M., Piccolo S. YAP и TAZ: сигнальный узел микроокружения опухоли. Нат Рев Рак. 2019;19(8):454–464. doi: 10.1038/s41568-019-0168-y. [PubMed] [CrossRef] [Google Scholar]41.Мелотти А., Мас С., Куциак М., Лоренте-Тригос А., Борхес И., Руиз и Альтаба А. Лекарство от речной слепоты ивермектин и родственные макроциклические лактоны ингибируют реакции пути WNT-TCF при раке человека. EMBO Мол Мед. 2014;6(10):1263–1278. doi: 10.15252/emmm.201404084. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]42. Ян Дж.Д., Эно П., Горс Дж.Дж., Амаду А., Плимот А., Робертс Л.Р. Глобальный взгляд на гепатоцеллюлярную карциному: тенденции, риск, профилактика и лечение. Нат Рев Гастроэнтерол Гепатол.2019;16(10):589–604. doi: 10.1038/s41575-019-0186-y. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]43. Нишио М., Сугимати К., Гото Х., Ван Дж., Морикава Т., Миячи Ю., Такано Ю., Хикаса Х., Ито Т., Судзуки С.О., Курихара Х., Аишима С., Лиск А. , Sasaki T., Nakano T., Nishina H., Nishikawa Y., Sekido Y., Nakao K., Shin-Ya K., Mimori K., Suzuki A. Дисрегуляция передачи сигналов YAP1/TAZ и TGF-бета опосредует гепатокарциногенез в Mob1a/1b-дефицитные мыши. Proc Natl Acad Sci U S A. 2016;113(1):71–80.doi: 10.1073/pnas.1517188113. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]44. Интуйод К., Ханваджанавонг К., Пинлаор П., Пинлаор С. Противопаразитарное лекарственное средство ивермектин проявляет мощную противораковую активность против устойчивой к гемцитабину холангиокарциномы in vitro. Противораковый Рез. 2019;39(9):4837–4843. doi: 10.21873/anticanres.13669. [PubMed] [CrossRef] [Google Scholar]45. Ван Ю., Су Дж., Ван Ю., Фу Д., Идеозу Дж. Э., Гэн Х., Цуй К., Ван С., Чен Р., Ю Ю., Ню Ю., Юэ Д. Взаимодействие YBX1 с G3BP1 способствует метастазированию клеток почечно-клеточной карциномы через сигнальную ось YBX1/G3BP1-SPP1-NF-kappaB.J Exp Clin Cancer Res. 2019;38(1):386. doi: 10.1186/s13046-019-1347-0. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]46. Сюй В.Х., Ши С.Н., Сюй Ю., Ван Дж., Ван Х.К., Цао Д.Л., Ши Г.Х., Цюй Ю.Ю., Чжан Х.Л., Е Д.В. Прогностические последствия экспрессии аквапорина 9 при светлоклеточной почечно-клеточной карциноме. J Transl Med. 2019;17(1):363. doi: 10.1186/s12967-019-2113-y. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]47. Сигел Р.Л., Миллер К.Д., Джемал А. Статистика рака, 2019. CA Cancer J Clin.2019;69(1):7–34. doi: 10.3322/caac.21551. [PubMed] [CrossRef] [Google Scholar]48. Чжу М., Ли Ю., Чжоу З. Антибиотик ивермектин предпочтительно нацелен на рак почки, вызывая митохондриальную дисфункцию и окислительное повреждение. Коммуникации биохимических и биофизических исследований. 2017;492(3):373–378. doi: 10.1016/j.bbrc.2017.08.097. [PubMed] [CrossRef] [Google Scholar]50. Наппи Л., Агуда А.Х., Накузи Н.А., Лель-Гаролла Б., Беральди Э., Лаллус Н., Ти М., Мур С., Фазли Л., Баттсогт Д., Стиф С., Ban F., Nguyen NT, Saxena N., Dueva E., Zhang F., Yamazaki T., Zoubeidi A., Cherkasov A., Brayer GD, Gleave M. Ивермектин ингибирует HSP27 и усиливает эффективность нацеливания на онкогены в моделях опухолей. . Джей Клин Инвест. 2020;130(2):699–714. doi: 10.1172/jci130819. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]51. Шармин С., Скртич М., Сухай М.А., Хуррен Р., Гронда М., Ван Х., Фонсека С.Б., Сун Х., Вуд Т.Э., Уорд Р., Минден М.Д., Бати Р.А., Датти А., Врана Дж. , Келли С.О., Шиммер А.D. Противопаразитарное средство ивермектин индуцирует хлорид-зависимую гиперполяризацию мембран и гибель клеток в лейкозных клетках. Кровь. 2010;116(18):3593–3603. doi: 10.1182/blood-2010-01-262675. [PubMed] [CrossRef] [Google Scholar]52. Апперли Дж. Ф. Хронический миелоидный лейкоз. Ланцет. 2015;385(9976):1447–1459. doi: 10.1016/s0140-6736(13)62120-0. [PubMed] [CrossRef] [Google Scholar]53. Ван Дж., Сюй Ю., Ван Х., Ху Дж. Антибиотик ивермектин избирательно индуцирует апоптоз при хроническом миелоидном лейкозе, вызывая митохондриальную дисфункцию и окислительный стресс.Biochem Biophys Res Commun. 2018;497(1):241–247. doi: 10.1016/j.bbrc.2018.02.063. [PubMed] [CrossRef] [Google Scholar]54. Dong Z., Yu C., Rezhiya K., Gulijiahan A., Wang X. Понижающая регуляция миР-146a способствует онкогенезу стволовых клеток рака шейки матки через сигнальный путь VEGF/CDC42/PAK1. Artif Cells Nanomed Biotechnol. 2019;47(1):3711–3719. doi: 10.1080/216.2019.1664560. [PubMed] [CrossRef] [Google Scholar]55. Карнейро С.Р., да Силва Лима А.А., де Фатима Силва Сантос Г., де Оливейра К.С.B., Almeida M.C.V., da Conceicao Nascimento Pinheiro M. Связь между окислительным стрессом и физической активностью у женщин с плоскоклеточными интраэпителиальными поражениями в программе борьбы с раком шейки матки в бразильской Амазонии. Оксид Мед Селл Лонгев. 2019; 2019 doi: 10.1155/2019/8- 2. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]56. Чжан П., Чжан Ю., Лю К., Лю Б., Сюй В., Гао Дж., Дин Л., Тао Л. Ивермектин вызывает остановку клеточного цикла и апоптоз клеток HeLa через митохондриальный путь.Селл Пролиф. 2019;52(2):e12543. doi: 10.1111/cpr.12543. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]57. Муфаррий С., Дандапани М., Артхофер Э., Гомес С., Шривастава А., Лопес-Асеведо М., Виллагра А., Чиаппинелли К.Б. Эпигенетическая терапия рака яичников: перспективы и успехи. Клин Эпигенетика. 2019;11(1):7. doi: 10.1186/s13148-018-0602-0. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]58. Хашимото Х., Мессерли С.М., Судо Т., Марута Х. Ивермектин инактивирует киназу PAK1 и блокирует PAK1-зависимый рост клеток рака яичников человека и опухолевых клеточных линий NF2.Препарат Дисков Тер. 2009;3(6):243–246. [PubMed] [Google Scholar]59. Кодама М., Кодама Т., Ньюберг Дж.Ю., Катаяма Х., Кобаяши М., Ханаш С.М., Йошихара К., Вэй З., Тьен Дж.С., Рангель Р., Хасимото К., Мабучи С., Савада К., Кимура T., Copeland NG, Jenkins NA Скрининг потери функции in vivo идентифицирует KPNB1 как новый лекарственный онкоген при эпителиальном раке яичников. Proc Natl Acad Sci U S A. 2017;114(35):E7301–E7310. doi: 10.1073/pnas.1705441114. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]60.Zhang X., Qin T., Zhu Z., Hong F., Xu Y., Zhang X., Xu X., Ma A. Ивермектин повышает эффективность цисплатина in vitro и in vivo при эпителиальном раке яичников путем подавления Akt/ Сигнализация mTOR. Am J Med Sci. 2020;359(2):123–129. doi: 10.1016/j.amjms.2019.11.001. [PubMed] [CrossRef] [Google Scholar] 61. Молинаро А.М., Тейлор Дж.В., Винке Дж.К., Ренш М.Р. Генетическая и молекулярная эпидемиология диффузной глиомы у взрослых. Нат Рев Нейрол. 2019;15(7):405–417. doi: 10.1038/s41582-019-0220-2. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]62.Вен П.Ю., Кесари С. Злокачественные глиомы у взрослых. N Engl J Med. 2008;359(5):492–507. doi: 10.1056/NEJMra0708126. [PubMed] [CrossRef] [Google Scholar]63. Liu Y., Fang S., Sun Q., Liu B. Противогельминтный препарат ивермектин ингибирует ангиогенез, рост и выживание глиобластомы, вызывая митохондриальную дисфункцию и окислительный стресс. Biochem Biophys Res Commun. 2016;480(3):415–421. doi: 10.1016/j.bbrc.2016.10.064. [PubMed] [CrossRef] [Google Scholar]64. Лю Дж., Лян Х., Чен С., Ван С., Цюй Ф., Wang H., Yang K., Wang Q., Zhao N., Meng J., Gao A. Ивермектин индуцирует опосредованную аутофагией гибель клеток через сигнальный путь AKT/mTOR в клетках глиомы. Biosci Rep. 2019; 39(12) doi: 10.1042/bsr20192489. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]65. Kwak HJ, Kim YJ, Chun KR, Woo YM, Park SJ, Jeong JA, Jo SH, Kim TH, Min HS, Chae JS, Choi EJ, Kim G., Shin SH, Gwak HS, Kim SK, Hong EK, Lee GK, Choi KH, Kim JH, Yoo H., Park JB, Lee SH Подавление Spry2 с помощью миР-21 вызывает злокачественные новообразования в глиомах человека.Онкоген. 2011;30(21):2433–2442. doi: 10.1038/onc.2010.620. [PubMed] [CrossRef] [Google Scholar]66. Yin J., Park G., Lee JE, Choi EY, Park JY, Kim TH, Park N., Jin X., Jung JE, Shin D., Hong JH, Kim H., Yoo H., Lee SH, Kim YJ, Пак JB, Ким JH DEAD-box РНК-хеликаза DDX23 модулирует злокачественность глиомы посредством повышения биогенеза миР-21. Головной мозг. 2015; 138 (часть 9): 2553–2570. doi: 10.1093/мозг/awv167. [PubMed] [CrossRef] [Google Scholar]67. Кирчик Л.Х., Дель Россо Дж.К., Лейтон А.М., Шаубер Дж.Более 25 лет клинического опыта применения ивермектина: обзор безопасности для растущего числа показаний. J Препараты Дерматол. 2016;15(3):325–332. [PubMed] [Google Scholar]68. Чен Ю.П., Чан А.Т.С., Ле К.Т., Бланшар П., Сунь Ю., Ма Дж. Рак носоглотки. Ланцет. 2019;394(10192):64–80. doi: 10.1016/s0140-6736(19)30956-0. [PubMed] [CrossRef] [Google Scholar]69. Галлардо Ф., Мариаме Б., Генс Р., Тилкин-Мариаме А.-Ф. Макроциклические лактоны ингибируют пролиферацию клеток карциномы носоглотки за счет ингибирования PAK1 и уменьшают рост опухоли in vivo.Дизайн лекарств, разработка и терапия. 2018;12:2805–2814. doi: 10.2147/dddt.S172538. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]70. Thawani R., McLane M., Beig N., Ghose S., Prasanna P., Velcheti V., Madabhushi A. Радиомика и радиогеномика при раке легких: обзор для клинициста. Рак легких. 2018; 115:34–41. doi: 10.1016/j.lungcan.2017.10.015. [PubMed] [CrossRef] [Google Scholar]71. Патель Х., Якуб Н., Мишра Р., Уайт А., Лонг Ю., Аланази С., Гаррет Дж.Т. Современные достижения в лечении BRAF-мутантной меланомы.Cancers (Базель) 2020; 12(2) doi: 10.3390/cancers12020482. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]72. Франкен М.Г., Леенеман Б., Георге М., Уйл-де Гроот К.А., Хаанен Дж., ван Баал П.Х.М. Систематический обзор литературы и сетевой метаанализ результатов эффективности и безопасности при распространенной меланоме. Евр Джей Рак. 2019;123:58–71. doi: 10.1016/j.ejca.2019.08.032. [PubMed] [CrossRef] [Google Scholar]73. Gallardo F., Teiti I., Rochaix P., Demilly E., Jullien D., Mariamé B., Tilkin-Mariamé A.-Ф. Макроциклические лактоны блокируют рост меланомы, развитие метастазов и потенцируют активность ингибиторов анти-BRAF V600. Клинический рак кожи. 2016;1(1):4–14. doi: 10.1016/j.clsc.2016.05.001. е3. [CrossRef] [Google Scholar] 74. Дэн Ф., Сюй К., Лонг Дж., Се Х. Подавление ROS-TFE3-зависимой аутофагии усиливает индуцированный ивермектином апоптоз в клетках меланомы человека. Журнал клеточной биохимии. 2018;120(2):1702–1715. doi: 10.1002/jcb.27490. [PubMed] [CrossRef] [Google Scholar]75. Нагата С. Апоптоз и очистка апоптотических клеток.Анну Рев Иммунол. 2018; 36: 489–517. doi: 10.1146/annurev-иммунол-042617-053010. [PubMed] [CrossRef] [Google Scholar]76. Дегтерев А., Юань Дж. Расширение и эволюция программ клеточной гибели. Nat Rev Mol Cell Biol. 2008;9(5):378–390. doi: 10.1038/nrm2393. [PubMed] [CrossRef] [Google Scholar]79. Гевирц Д.А. Четыре лица аутофагии: последствия для терапии рака. Рак рез. 2014;74(3):647–651. doi: 10.1158/0008-5472.Can-13-2966. [PubMed] [CrossRef] [Google Scholar]80. Галлуцци Л., Пьетрокола Ф., Браво-Сан-Педро Дж.М., Амаравади Р.К., Баереке Э.Х., Чеккони Ф., Кодоньо П., Дебнат Дж., Гевирц Д.А., Каранца В., Киммельман А., Кумар С., Левин Б., Майури М.С., Мартин С.Дж., Пеннингер Дж., Пьячентини М., Рубинштейн Д.К., Саймон Х.У., Симонсен А., Торберн А.М., Веласко Г., Райан К.М., Кремер Г. Аутофагия при злокачественной трансформации и прогрессировании рака. Эмбо Дж. 2015;34(7):856–880. doi: 10.15252/embj.2014. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]81. Галлуцци Л., Браво-Сан Педро Дж.М., Демария С., Форменти С.К., Кремер Г. Активация аутофагии для усиления иммуногенной химиотерапии и лучевой терапии. Nat Rev Clin Oncol. 2017;14(4):247–258. doi: 10.1038/nrclinonc.2016.183. [PubMed] [CrossRef] [Google Scholar]82. Равенини Г., Саммарини Г., Наннини М., Панталео М.А., Биаско Г., Грелия П., Анджелини С. Стромальные опухоли желудочно-кишечного тракта (GIST): смерть клеток между аутофагией и апоптозом. Аутофагия. 2017;13(3):452–463. doi: 10.1080/15548627.2016.1256522. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]83.Марино Г., Нисо-Сантано М., Бэреке Э.Х., Кремер Г. Самопотребление: взаимодействие аутофагии и апоптоза. Nat Rev Mol Cell Biol. 2014;15(2):81–94. doi: 10.1038/nrm3735. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]84. Фан Ю., Тянь С., Пан Ю., Ли В., Ван К., Тан Ю., Ю Т., Ву С., Ши Ю., Ма П., Шу Ю. Пироптоз: новый рубеж в лечении рака . Биомед Фармаколог. 2020;121:109595. doi: 10.1016/j.biopha.2019.109595. [PubMed] [CrossRef] [Google Scholar]85. Гун Т., Лю Л., Цзян В., Чжоу Р. DAMP-чувствительные рецепторы при стерильном воспалении и воспалительных заболеваниях. Нат Рев Иммунол. 2020;20(2):95–112. doi: 10.1038/s41577-019-0215-7. [PubMed] [CrossRef] [Google Scholar]86. Liu X., Zhang Z., Ruan J., Pan Y., Magupalli V.G., Wu H., Lieberman J. Газдермин D, активируемый инфламмасомой, вызывает пироптоз путем образования мембранных пор. Природа. 2016;535(7610):153–158. doi: 10.1038/nature18629. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]88. Хан С.Дж., Ловази М., Ким М., Д’Агати В., Хаско Г., Ли Х.Т. Рецептор P2X4 усугубляет ишемическое ОПП и индуцирует передачу сигналов воспаления NLRP3 в проксимальных канальцах почек. Фасеб Дж. 2020;34(4):5465–5482. doi: 10.1096/fj.201
- Альтретамин
- Бендамустин
- Бусульфан
- Карбоплатин
- Кармустин
- Хлорамбуцил
- Цисплатин
- Циклофосфамид
- Дакарбазин
- Ифосфамид
- Ломустин
- Мехлорэтамин
- Мелфалан
- Оксалиплатин
- Темозоломид
- Тиотепа
- Трабекедв
- Кармустин
- Ломустин
- Стрептозоцин
- Азацитидин
- 5-фторурацил (5-ФУ)
- 6-меркаптопурин (6-МП)
- Капецитабин (Кселода)
- Кладрибин
- Клофарабин
- Цитарабин (Ара-С)
- Децитабин
- Флоксуридин
- Флударабин
- Гемцитабин (Гемзар)
- Гидроксимочевина
- Метотрексат
- Неларабин
- Пеметрексед (Алимта)
- Пентостатин
- Пралатрексат
- Тиогуанин
- Комбинация трифлуридин/типирацил
- Даунорубицин
- Доксорубицин (адриамицин)
- Доксорубицин липосомальный
- Эпирубицин
- Идарубицин
- Валрубицин
- Блеомицин
- Дактиномицин
- Митомицин-С
- Митоксантрон (также действует как ингибитор топоизомеразы II, см. ниже)
- Иринотекан
- Иринотекан липосомальный
- Топотекан
- Этопозид (ВП-16)
- Митоксантрон (также действует как противоопухолевый антибиотик )
- Тенипозид
- Таксаны включают:
- Кабазитаксел
- Доцетаксел
- Наб-паклитаксел
- Паклитаксел
Алкалоиды барвинка - включают:
- Винбластин
- Винкристин
- Винкристин липосомальный
- Винорелбин
- Преднизолон
- Метилпреднизолон
- Дексаметазон
- Полностью транс-ретиноевая кислота
- Триоксид мышьяка
- Аспарагиназа
- Эрибулин
- Гидроксимочевина
- Иксабепилон
- Митотане
- Омацетаксин
- Пегаспаргаз
- Прокарбазин
- Ромидепсин
- Вориностат
- Понимать процессы, посредством которых противораковые препараты убивают чувствительные опухолевые клетки
- Выяснить этапы, связанные с передачей сигналов от исходной мишени лекарственного средства к цитотоксическому механизму внутри клеток
- Определите, как различия в этих сигнальных этапах от одной опухоли к другой влияют на чувствительность и резистентность к противоопухолевым препаратам
- Используйте эти новые идеи для разработки биомаркеров чувствительности и резистентности к противоопухолевым препаратам, которые потенциально могут быть применены в клинике для оценки того, могут ли определенные методы лечения быть полезными или нет
- 1.
- 1.
- 1.
- 1.
алкилирующий агенты: хлормерный, циклофосфамид, IFosfamide, Pormylmerphalan, * глицифосфорамид, * мельфалан, кармастина, ломестин, семустин, нитрокафан,* альтретамин, хлорамбуцил, тиотепа, бусульфан
- 2.
Антиметаболиты: метотрексат, меркаптопурин, фторурацил, тегафур, цитарабин, гидроксикарбамид
3,Противораковые антибиотики: актиномицин D (Gengshengmeisu *), митомицин C, pingyangmycin, * даунорубицин, доксорубицин, аклациномицин A
+ 4. девяносто одна тысяча сто двадцать-дварастений противоопухолевых препаратов: винбластин, винкристин, этопозид, homoharringtonine, * гидроксикамптотецина, * тенипозид
- 5.
- 5.
- 5.
- 5.
Эндокринные противоопухолевые агенты: тамоксифен, аминоглутетимид, медроксипрогестерон ацетат
- 6.
Другие противоопухолевые агенты: Procarbazine, Dacarbazine, Cisplatin, карбоплатин, L-аспарагиназа, интерферон, кальций, митоксантрон, Ondansetron , месна, циклоспорин А, лентинан
- 1.
- 1.
- 1.
- 1.
алкилирующий агенты: хлормерный, циклофосфамид, IFosfamide, Pormylmerphalan, * глицифосфорамид, * мельфалан, кармастина, ломестин, семустин, нитрокафан,* альтретамин, хлорамбуцил, тиотепа, бусульфан
- 2.
Антиметаболиты: метотрексат, меркаптопурин, фторурацил, тегафур, цитарабин, гидроксикарбамид
3,Противораковые антибиотики: актиномицин D (Gengshengmeisu *), митомицин C, pingyangmycin, * даунорубицин, доксорубицин, аклациномицин A
+ 4. девяносто одна тысяча сто двадцать-дварастений противоопухолевых препаратов: винбластин, винкристин, этопозид, homoharringtonine, * гидроксикамптотецина, * тенипозид
- 5.
- 5.
- 5.
- 5.
Эндокринные противоопухолевые агенты: тамоксифен, аминоглутетимид, медроксипрогестерон ацетат
- 6.
Другие противоопухолевые агенты: Procarbazine, Dacarbazine, Cisplatin, карбоплатин, L-аспарагиназа, интерферон, кальций, митоксантрон, Ondansetron , месна, циклоспорин А, лентинан
7R. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]89. О’Брайен К.А., Кресо А., Джеймисон К.Х. Раковые стволовые клетки и самообновление. Клин Рак Рез. 2010;16(12):3113–3120. doi: 10.1158/1078-0432.CCR-09-2824. [PubMed] [CrossRef] [Google Scholar]90. Хуанг З., Ву Т., Лю А.Ю., Оуян Г. Дифференциация и трансдифференцировочный потенциал раковых стволовых клеток.Онкотаргет. 2015;6(37):39550–39563. doi: 10.18632/oncotarget.6098. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]91. Бао С., Ву К., МакЛендон Р.Э., Хао Ю., Ши К., Хьельмеланд А.Б., Дьюхерст М.В., Бигнер Д.Д., Рич Дж.Н. Стволовые клетки глиомы способствуют радиорезистентности за счет преимущественной активации реакции на повреждение ДНК. Природа. 2006; 444(7120):756–760. doi: 10.1038/nature05236. [PubMed] [CrossRef] [Google Scholar]92. Дин М., Фойо Т., Бейтс С. Опухолевые стволовые клетки и лекарственная устойчивость. Нат Рев Рак.2005;5(4):275–284. doi: 10.1038/nrc1590. [PubMed] [CrossRef] [Google Scholar]93. Li X., Lewis MT, Huang J., Gutierrez C., Osborne CK, Wu MF, Hilsenbeck SG, Pavlick A., Zhang X., Chamness GC, Wong H., Rosen J., Chang JC Внутренняя резистентность онкогенной груди раковые клетки к химиотерапии. J Natl Cancer Inst. 2008;100(9):672–679. doi: 10.1093/jnci/djn123. [PubMed] [CrossRef] [Google Scholar]94. Дин М., Кларк М.Ф. Раковые стволовые клетки и лучевая терапия: новый взгляд на радиорезистентность опухоли.J Natl Cancer Inst. 2006; 98(24):1755–1757. doi: 10.1093/jnci/djj505. [PubMed] [CrossRef] [Google Scholar]95. Домингес-Гомес Г., Чавес-Бланко А., Медина-Франко Х.Л., Салдивар-Гонсалес Ф., Флорес-Торронтеги Ю., Хуарес М., Диас-Чавес Х., Гонсалес-Фьерро А., Дуэньяс-Гонсалес А. Ивермектин как ингибитор раковых стволовых клеток. Mol Med Rep. 2018;17(2):3397–3403. doi: 10.3892/mmr.2017.8231. [PubMed] [CrossRef] [Google Scholar]96. Ким Дж. Х., Чой Х. С., Ким С. Л., Ли Д. С. Сигнальный путь PAK1-Stat3 активирует транскрипцию гена IL-6 и образование стволовых клеток рака молочной железы человека.Cancers (Базель) 2019; 11(10) doi: 10.3390/cancers11101527. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]97. Ван Дж., Сибахер Н., Ши Х., Кан К., Дуан З. Новые стратегии предотвращения развития множественной лекарственной устойчивости (МЛУ) при раке. Онкотаргет. 2017;8(48):84559–84571. doi: 10.18632/oncotarget.19187. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]98. Ниази М., Закери-Милани П., Наджафи Хадживар С., Солеймани Голудже М., Гобахлоу Н., Шахбази Моджаррад Дж., Вализаде Х. Стратегии на основе нанотехнологий для преодоления лекарственной устойчивости, опосредованной p-гликопротеином.Мнение эксперта Препарат Метаб Токсикол. 2016;12(9):1021–1033. doi: 10.1080/17425255.2016.1196186. [PubMed] [CrossRef] [Google Scholar]99. Дун Дж., Цинь З., Чжан В.Д., Ченг Г., Иегуда А.Г., Эшби Ч.Р., мл., Чен З.С., Ченг X.Д., Цинь Дж.Дж. Стратегии медицинской химии для обнаружения ингибиторов P-гликопротеина: обновление. Обновление устойчивости к наркотикам. 2020;49:100681. doi: 10.1016/j.drup.2020.100681. [PubMed] [CrossRef] [Google Scholar] 100. Кибрия Г., Хатакеяма Х., Харашима Х. Множественная лекарственная устойчивость рака: задействованные механизмы и стратегии обхода с использованием системы доставки лекарств.Арч Фарм Рез. 2014;37(1):4–15. doi: 10.1007/s12272-013-0276-2. [PubMed] [CrossRef] [Google Scholar] 101. Lespine A., Dupuy J., Orlowski S., Nagy T., Glavinas H., Krajcsi P., Alvinerie M. Взаимодействие ивермектина с белками множественной лекарственной устойчивости (MRP1, 2 и 3) Chem Biol Interact. 2006;159(3):169–179. doi: 10.1016/j.cbi.2005.11.002. [PubMed] [CrossRef] [Google Scholar] 102. Pouliot J.F., L’Heureux F., Liu Z., Prichard R.K., Georges E. Реверсирование множественной лекарственной устойчивости, связанной с P-гликопротеином, с помощью ивермектина.Биохим Фармакол. 1997;53(1):17–25. doi: 10.1016/s0006-2952(96)00656-9. [PubMed] [CrossRef] [Google Scholar] 103. Леспин А., Мартин С., Дюпюи Дж., Руле А., Пино Т., Орловски С., Альвиньери М. Взаимодействие макроциклических лактонов с Р-гликопротеином: взаимосвязь структура-аффинность. Eur J Pharm Sci. 2007;30(1):84–94. doi: 10.1016/j.ejps.2006.10.004. [PubMed] [CrossRef] [Google Scholar] 104. Цзян Л., Ван П., Сунь Ю.Дж., Ву Ю.Дж. Ивермектин меняет лекарственную устойчивость раковых клеток через путь EGFR/ERK/Akt/NF-kappaB.J Exp Clin Cancer Res. 2019;38(1):265. doi: 10.1186/s13046-019-1251-7. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]105. Лойбл С., Джанни Л. HER2-положительный рак молочной железы. Ланцет. 2017;389(10087):2415–2429. doi: 10.1016/s0140-6736(16)32417-5. [PubMed] [CrossRef] [Google Scholar] 106. Лим С.М., Син Н.Л., Чо Б.К., Су Р.А. Приобретенная устойчивость к таргетной терапии EGFR при немелкоклеточном раке легкого: механизмы и терапевтические стратегии. Cancer Treat Rev. 2018; 65:1–10. doi: 10.1016/j.ctrv.2018.02.006. [PubMed] [CrossRef] [Google Scholar] 107. Чой С.К., Кам Х., Ким К.Ю., Пак С.И., Ли Ю.С. Ориентация на белок теплового шока 27 при раке: лекарственная мишень для лечения рака? Cancers (Базель) 2019; 11(8) doi: 10.3390/cancers11081195. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]108. Кумар Р., Гурурай А.Е., Барнс С.Дж. Активируемые p21 киназы при раке. Нат Рев Рак. 2006;6(6):459–471. doi: 10.1038/nrc1892. [PubMed] [CrossRef] [Google Scholar] 109. Rane CK, Minden A. P21 активировала передачу сигналов киназы при раке.Семин Рак Биол. 2019;54:40–49. doi: 10.1016/j.semcancer.2018.01.006. [PubMed] [CrossRef] [Google Scholar] 110. Dammann K., Khare V., Gasche C. Отслеживание PAK от воспаления желудочно-кишечного тракта до рака. Кишка. 2014;63(7):1173–1184. doi: 10.1136/gutjnl-2014-306768. [PubMed] [CrossRef] [Google Scholar] 111. Кумар Р., Ли Д.К. PAK в прогрессировании рака человека: от зарождения до лечения рака и до онкобиологии будущего. Adv Рак Res. 2016; 130:137–209. doi: 10.1016/bs.acr.2016.01.002. [PubMed] [CrossRef] [Google Scholar] 112.Гуццо К.А., Фуртек С.И., Поррас А.Г., Чен С., Типпинг Р., Клинешмидт С.М., Скиберрас Д.Г., Хси Дж.Ю., Лассетер К.С. Безопасность, переносимость и фармакокинетика повышения высоких доз ивермектина у здоровых взрослых субъектов. Дж. Клин Фармакол. 2002;42(10):1122–1133. doi: 10.1177/00
Как работает химиотерапия? | Виды химиотерапии
Для лечения рака используется множество различных видов химиотерапии или химиопрепаратов — отдельно или в сочетании с другими лекарствами или методами лечения.Эти лекарства сильно различаются по своему химическому составу (из чего они сделаны), по способу их назначения и приема, по степени их полезности при лечении определенных видов рака и по возможным побочным эффектам.
Важно знать, что не все лекарства и препараты для лечения рака действуют одинаково. Другие лекарства для лечения рака действуют иначе, например, таргетная терапия, гормональная терапия и иммунотерапия. Информация ниже описывает, как работает традиционная или стандартная химиотерапия.
Химиотерапия воздействует на клеточный цикл
Каждый раз, когда формируется любая новая клетка, она проходит обычный процесс, чтобы стать полностью функционирующей (или зрелой) клеткой. Этот процесс включает ряд фаз и называется клеточным циклом .
Химиотерапевтические препараты воздействуют на клетки на разных фазах клеточного цикла. Понимание того, как работают эти препараты, помогает врачам прогнозировать, какие препараты будут хорошо работать вместе. Врачи также могут планировать, как часто следует вводить дозы каждого препарата, исходя из сроков клеточных фаз.
Раковые клетки имеют тенденцию образовывать новые клетки быстрее, чем нормальные клетки, и это делает их лучшей мишенью для химиотерапевтических препаратов. Однако химиопрепараты не могут отличить здоровые клетки от раковых. Это означает, что нормальные клетки повреждаются вместе с раковыми клетками, что вызывает побочные эффекты. Каждый раз, когда назначается химиотерапия, это означает попытку найти баланс между уничтожением раковых клеток (чтобы вылечить или контролировать болезнь) и сохранением нормальных клеток (чтобы уменьшить побочные эффекты).
Хорошая новость заключается в том, что большинство нормальных клеток со временем восстанавливаются после химиотерапии. Но раковые клетки — это мутировавшие (не нормальные) клетки, и они обычно не восстанавливаются после химиотерапии. Вот почему химиотерапия хорошо убивает многие типы раковых клеток.
Типы химиопрепаратов
Химиопрепараты можно сгруппировать по тому, как они действуют, по их химической структуре и взаимосвязи с другими препаратами. Некоторые препараты действуют более чем одним способом и могут принадлежать более чем к одной группе.(Примечание: здесь перечислены не все химиотерапевтические препараты.)
Знание того, как действует лекарство, важно для прогнозирования его побочных эффектов. Это помогает врачам решить, какие препараты будут хорошо работать вместе. Если будет использоваться более одного препарата, эта информация также поможет им точно спланировать, когда следует давать каждый из препаратов (в каком порядке и как часто).
Алкилирующие агенты
Алкилирующие агенты препятствуют размножению клетки (копированию самой себя), повреждая ее ДНК.Эти препараты действуют на всех фазах клеточного цикла и используются для лечения многих различных видов рака, включая рак легких, молочной железы и яичников, а также лейкемию, лимфому, болезнь Ходжкина, множественную миелому и саркому.
Поскольку эти препараты повреждают ДНК, они могут воздействовать на клетки костного мозга, которые производят новые клетки крови. В редких случаях это может привести к лейкемии. Риск лейкемии от алкилирующих агентов «зависит от дозы», что означает, что риск невелик при более низких дозах, но возрастает по мере увеличения общего количества используемого препарата.Риск лейкемии после приема алкилирующих агентов наиболее высок примерно через 5–10 лет после лечения.
Примеры алкилирующих агентов включают:
Нитромочевина
Нитромочевины представляют собой группу алкилирующих агентов, обладающих особым действием.Другие перечисленные выше алкилирующие агенты не могут попасть в мозг, но нитромочевины могут это сделать. Они могут проникать в мозг, потому что способны преодолевать область, известную как гематоэнцефалический барьер, особую область, которая удерживает большинство лекарств от попадания в мозг. Это действие делает эти препараты полезными при лечении некоторых видов опухолей головного мозга.
Примеры нитрозомочевины включают:
Антиметаболиты
Антиметаболиты воздействуют на ДНК и РНК, действуя как заменитель обычных строительных блоков РНК и ДНК.Когда это происходит, ДНК не может копировать себя, и клетка не может воспроизводиться. Они обычно используются для лечения лейкемии, рака молочной железы, яичников и желудочно-кишечного тракта, а также других видов рака.
Примеры антиметаболитов включают:
Противоопухолевые антибиотики
Эти препараты не похожи на антибиотики, используемые для лечения инфекций.Они работают, изменяя ДНК внутри раковых клеток, чтобы предотвратить их рост и размножение.
Антрациклины: Антрациклины являются противоопухолевыми антибиотиками, которые воздействуют на ферменты, участвующие в копировании ДНК во время клеточного цикла. Они связываются с ДНК, поэтому она не может создавать свои копии, а клетка не может воспроизводиться. (Ферменты — это белки, которые запускают, помогают или ускоряют скорость химических реакций в клетках.) Они широко используются для лечения различных видов рака.
Примеры антрациклинов включают:
Основная проблема при назначении этих препаратов заключается в том, что они могут необратимо повредить сердце, если принимать их в больших дозах.По этой причине для этих препаратов часто устанавливаются предельные дозы на всю жизнь (также называемые кумулятивной дозой ).
Противоопухолевые антибиотики, не являющиеся антрациклинами, включают:
Ингибиторы топоизомеразы
Эти препараты также называют растительными алкалоидами . Они взаимодействуют с ферментами, называемыми топоизомеразами , которые помогают разделять нити ДНК, чтобы их можно было копировать.(Ферменты — это белки, вызывающие химические реакции в живых клетках.) Ингибиторы топоизомеразы используются для лечения некоторых лейкозов, а также рака легких, яичников, желудочно-кишечного тракта, толстой кишки и поджелудочной железы.
Ингибиторы топоизомеразы сгруппированы в зависимости от типа фермента, на который они воздействуют:
Ингибиторы топоизомеразы I (также называемые камптотецинами ) включают:
Ингибиторы топоизомеразы II (также называемые эпиподофиллотоксинами ) включают:
Ингибиторы топоизомеразы II могут повышать риск возникновения второго рака.
Ингибиторы митоза
Митотические ингибиторы также называются растительными алкалоидами . Это соединения, полученные из натуральных продуктов, таких как растения. Они работают, останавливая деление клеток для образования новых клеток, но могут повреждать клетки на всех этапах, не давая ферментам вырабатывать белки, необходимые для размножения клеток.
Примеры митотических ингибиторов включают таксаны и алкалоиды барвинка.
Они используются для лечения многих различных видов рака, включая рак молочной железы, легких, миеломы, лимфомы и лейкозы.Эти препараты могут вызвать повреждение нервов, что может ограничить количество, которое можно давать.
Кортикостероиды
Кортикостероиды, часто называемые просто стероидами , являются естественными гормонами и гормоноподобными препаратами, которые полезны при лечении многих видов рака, а также других заболеваний. Когда эти препараты используются как часть лечения рака, они считаются химиотерапевтическими препаратами.
Примеры кортикостероидов включают:
Стероиды также широко используются для предотвращения тошноты и рвоты, вызванных химиотерапией.Они используются перед некоторыми видами химиотерапии, чтобы предотвратить тяжелые аллергические реакции.
Прочие химиотерапевтические препараты
Некоторые химиотерапевтические препараты действуют несколько иначе и не вписываются ни в одну из других категорий. Вот несколько примеров:
Другие виды лекарств, используемых для лечения рака
Другие лекарства и биологические методы лечения используются для лечения рака, но не считаются химиотерапией.Они часто имеют другие побочные эффекты, чем химиотерапия. Многие из них используются вместе с хирургией, химиотерапией или лучевой терапией.
Таргетная терапия
Таргетная терапия работает путем обнаружения определенных веществ, называемых белками или рецепторами , которые есть у некоторых раковых клеток. Препарат точно нацелен на белок или рецептор, поэтому лекарства не влияют на нормальные клетки. Это отличается от того, как работают традиционные химиотерапевтические препараты. Таргетные препараты могут использоваться в качестве основного лечения рака или их можно использовать после лечения, чтобы держать рак под контролем или предотвратить его рецидив.
Чтобы узнать больше, см. Таргетную терапию.
Гормональная терапия
Препараты этой категории воздействуют на различные действия гормонов, вызывающих рост некоторых видов рака. Эти препараты используются для замедления роста некоторых видов рака молочной железы, предстательной железы и эндометрия (матки), которые обычно растут в ответ на естественные половые гормоны в организме. Они работают, делая раковые клетки неспособными использовать гормон, необходимый им для роста, или препятствуя выработке гормона организмом.
Иммунотерапия
Иммунотерапия — это тип лечения, при котором используются лекарства для повышения или изменения иммунной системы человека. Эти препараты используются при определенных видах рака, чтобы помочь иммунной системе пациента распознать раковые клетки и атаковать их.
Чтобы узнать больше, см. Иммунотерапия.
Обзор — Лаборатория противораковых препаратов
Новые открытия в лечении ракаНаша цель — улучшить терапию рака за счет лучшего понимания механизмов, с помощью которых противораковые препараты убивают чувствительные опухолевые клетки.
Обзор
Лаборатория действия противоопухолевых препаратов Скотта Х. Кауфманна, доктора медицинских наук, в клинике Майо фокусирует свои исследования на понимании механизма действия противоопухолевых препаратов и факторов, влияющих на чувствительность и резистентность опухолевых клеток.
Подавляющее большинство больных раком получают противораковые препараты в какой-то момент течения болезни. Понимание факторов, влияющих на чувствительность и резистентность к противоопухолевым препаратам, может дать важную новую информацию о том, может ли конкретное лекарство быть эффективным при лечении рака или нет.
Цели и темы исследований
Цели наших исследований:
Хотя основное внимание мы уделяем раку яичников и лейкемии, результаты наших исследований потенциально применимы и к другим видам рака.
Подходы, используемые лабораторией доктора Кауфманна, варьируются от анализа очищенных белков в бесклеточных условиях до исследований клеточных линий тканевых культур, моделей ксенотрансплантатов, полученных от пациентов, и образцов опухолей, полученных от пациентов, включенных в клинические испытания.
О докторе Кауфманн
Помимо того, что он является главным научным сотрудником лаборатории, доктор Кауфманн является онкологом в клинике Майо в Рочестере, штат Миннесота, и занимается лечением пациентов с раком яичников и лейкемией. Он профессор медицины и фармакологии в Медицинском и научном колледже клиники Мэйо, а также Хелен С.Левит профессор. Доктор Кауфманн имеет совместные должности в Отделе онкологических исследований и Отделе молекулярной фармакологии и экспериментальной терапии, которые он в настоящее время возглавляет.
Филиалы
Лаборатория доктора Кауфманна имеет несколько филиалов в клинике Майо:
.
Антиканцероген — обзор | ScienceDirect Topics
12.1 Введение в историю исследований противораковых препаратов в Китае
Противораковые препараты имеют долгую историю, в частности, некоторые травы, используемые для лечения онкологических больных, можно найти в старой литературе.Но химиотерапия рака как наука началась в 1940-х годах; В то время было обнаружено, что азотистый иприт эффективно лечит лимфому. 1 Он привлек большое внимание в медицинских кругах и способствовал дальнейшей разработке многих противораковых препаратов, включая синтетические соединения, лекарственные растения и антибиотики. В настоящее время химиотерапия рака стала одной из очень важных дисциплин в лечении рака.
В Китае до 1949 года химиотерапия рака не применялась.После основания Китайской Народной Республики в 1950-х годах правительство обратило внимание на проблему борьбы с раком. В конце 1955 г. под эгидой Китайской академии наук в Пекине состоялась международная конференция по антибиотикам 2 , на которой некоторыми учеными была поставлена задача исследования новых противораковых антибиотиков. В 1956 году был инициирован 12-летний план (1956–1967) развития науки и техники в Китае, в который также были включены исследования противораковых препаратов.К этой исследовательской программе стали подключаться многие подразделения, связанные с исследовательскими институтами, медицинскими школами, фармацевтическими компаниями, а также больницами. В конце 1958 года движение «Большой скачок вперед» подтолкнуло людей к поиску методов и препаратов для борьбы с раком, который считался очень опасным заболеванием и очень сложной исследовательской задачей. С тех пор распространился массовый скрининг китайских лекарственных трав и народных средств для лечения рака. После совместной работы были доказаны некоторые эффективные средства для определенных видов больных раком.Тем временем в Пекине было организовано Национальное бюро по профилактике и лечению рака при Министерстве здравоохранения КНР. Она состояла из более чем 10 отраслевых организаций, одной из которых была совместная группа по исследованию противораковых препаратов, и д-р Б. Сюй был назначен руководителем этой группы. Для организации совместных задач и обмена информацией о различных противоопухолевых агентах периодически проводились встречи и конференции в разных городах Китая.Например, в то время была начата и продолжалась до последних лет Национальная конференция фармакологии и химиотерапии опухолей. Некоторые записи этих конференций можно увидеть в таблице 12.1.
Таблица 12.1. Национальные конференции опухолевой фармакологии и химиотерапии 3
| Дата открытия | Place | ||
|---|---|---|---|
| 1983, 9 | Далянь | 148 | |
| 1987, 11 | Hangzhou | 234 | |
| 1989, 11 | Наньнинский | 240 | |
| 1992, 10 | Чжэнчжоу | 404 | |
| 1995 10 | Тяньцзинь | 370 | |
| 1998 9 | Taian | 300 | 300 |
| 2001, 10 | FUZHOU | 246 | 246 |
Несколько перспективных антинопластичных агентов было эффективным, а также было организовано шесть программ совместных исследований, в том числе (1) Camptotheca Acumanata , (2) Cephalotaxus удачи , (3) Кантаридин , (4) Безвременник осенний nale , (5) Crotalaria sessiliflora L., (6) Curcuma zedoaria (Berg) Роза и так далее. Совместными усилиями различных подразделений ряд лечебных препаратов был детально изучен как экспериментально, так и клинически. Некоторые из них были рекомендованы для клинического применения и производства. Новые противоопухолевые препараты, обычно используемые в других странах, также исследовались в Китае с использованием местного материала и методов, таких как алкалоиды из Vinca rosea , производные азотистого иприта, антиметаболиты и другие (в то время Китай был изолирован от зарубежья).В этот период, который считался ранней стадией исследований противораковых препаратов в Китае, многие специалисты в этой области накопили много знаний и опыта, а также многому научились из иностранной литературы. Тем временем была заложена фундаментальная основа исследований, образования и производства противоопухолевых препаратов.
Позже, в 1970-х — 1990-х годах, под влиянием национальной политики реформ и открытости двери Китая все больше открывались, и некоторые специалисты и ученые имели возможность выезжать за границу и узнавать новые достижения в мире, обогащая свои знания о химиотерапии рака.В Китае были представлены новые дисциплины, такие как клеточная кинетика, молекулярная фармакология опухолей, стандартные процедуры оценки новых противоопухолевых агентов как в лаборатории, так и в клинике, эффективные методы скрининга и квалифицированные клинические испытания, комбинированная химиотерапия для различных видов рака и т. д. Некоторые ведущие учреждения в этой области, такие как Шанхайский институт лекарственных веществ (SIMM), Китайская академия наук (CAS), Институт лекарственных веществ в Пекине (IMM), Китайская академия медицинских наук (CAMS), Институт Фармакология и токсикология Академии военно-медицинских наук Китая, Шанхайских институтов фармацевтической промышленности, Института антибиотиков в Пекине, онкологических больниц, расположенных в Пекине, Шанхае и Гуанчжоу, сыграли важную роль в повышении уровня химиотерапии рака в китайской практике и активно обмен знаниями для поиска и производства новых противоопухолевых препаратов.За короткое время большинство известных в мире противоопухолевых препаратов уже могли производиться в Китае и удовлетворять клинические потребности. Некоторые лекарства, в том числе ряд препаратов собственной разработки Китая, экспортировались в другие страны, например, алкалоиды барвинка, камптотецины и так далее. В табл. 12.2 показаны основные противоопухолевые препараты, применявшиеся в то время в клинической практике. Это также означало, что наиболее популярные противоопухолевые препараты могли производиться и поставляться китайскими фармацевтическими компаниями.
Таблица 12.2. Основные противоопухолевые препараты составили 47, утвержденные Министерством здравоохранения Китая в 1993 году 4
В дальнейшем базовые противоопухолевые препараты периодически менялись.Некоторые старые лекарства были заменены новыми агентами или более эффективными соединениями. В последнее время также был включен ряд таргетных препаратов и биотерапевтических агентов.
В последние годы знания о природе рака значительно расширились, а молекулярная онкология, молекулярная фармакология, генная инженерия и другие дисциплины значительно расширили сферу исследований противоопухолевых препаратов. В частности, было обнаружено много новых мишеней, препятствующих росту и метастазированию опухоли.Основываясь на новых данных и с помощью новых методов и технологий, многие новые лекарственные средства, включая цитостатические агенты, ингибиторы тирозинкиназы, ингибиторы ангиогенеза, препараты, препятствующие передаче сигнала, противоопухолевые антитела, агенты, индуцирующие дифференцировку, новые поколения антиметаболитов и цитотоксические агенты. были разработаны. Некоторые китайские научно-исследовательские лаборатории и фармацевтические заводы активно участвуют в совместной работе с зарубежными фармацевтическими компаниями и другими организациями; уже открыто много новых находок и лекарственных препаратов.В настоящее время почти все новые противораковые препараты можно найти на китайских фармацевтических рынках и в клинических больницах. Тысячи научных статей, связанных с исследованием и производством различных противоопухолевых препаратов, ежегодно публикуются китайскими специалистами в журналах, книгах или в сети Интернет. Многие важные вклады в эту область можно найти по разным каналам. Здесь мы рассмотрим некоторые достижения, полученные в Китае, которые более тесно связаны с нашей работой (таблицы 12.3 и 12.4).
Таблица 12.3. Химические структуры выбранных соединений и их активность на ферменте и уровнях клетки
| номер | R | биологические анализы | |||||
|---|---|---|---|---|---|---|---|
| ингибирование фермента A ингибирование (%) | скорость торможения опухоли или IC 50 (μMol / L) B | ||||||
| 1 | 0 | 60,5 | |||||
| 3 | 0 | 45.5 | |||||
| 4A | 8038 | 8,6 | 6.1 | ||||
| 4B | 3,7 | 7.3 | |||||
Таблица 12.4. Химические структуры выбранных соединений и их ингибируют фермент
| номер | R 1 | R 2 | Ферментные анализы ингибирования на 10 мкмоль / л (%) A | |||||
|---|---|---|---|---|---|---|---|---|
| EGFR | ||||||||
| EGFR | FGFR | VEGFR | PDGFR | PDGFR | ||||
| 5A | CH 2 CO 2 et | H | 20.2 | 1,7 | 38,6 | 11,5 | ||
| 5b | СН 2 СО 2 Et | Br | 29,5 | Н.А. | 32,4 | 16,1 | ||
| 5с | СН 2 СО 2 М | Н | 35,5 | 10,4 | 35,3 | 16,8 | ||
| 5d | СН 2 СО 2 М | Br | 10 .1 | 5,8 | 36,7 | 8,0 | ||
| 5e | СН 3 | Н | 18,4 | 19,4 | 38,6 | 25,4 | ||
| 5f | СН 3 | BR | 12.1 | 1,1 | 38.6 | 17.4 | 17.4 | |
| 5G | CH 3 | NO 2 | 44.2 | 10.5 | 27.6 | 9.4 | 9.4 | |
| 5h | CH 3 | H | 36.7 | 18.12 | 4,6 | 2.0 | 2,0 | |
AntiCarcinognen — обзор | ScienceDirect Topics
12.1 Введение в историю исследований противораковых препаратов в Китае
Противораковые препараты имеют долгую историю, в частности, некоторые травы, используемые для лечения онкологических больных, можно найти в старой литературе.Но химиотерапия рака как наука началась в 1940-х годах; В то время было обнаружено, что азотистый иприт эффективно лечит лимфому. 1 Он привлек большое внимание в медицинских кругах и способствовал дальнейшей разработке многих противораковых препаратов, включая синтетические соединения, лекарственные растения и антибиотики. В настоящее время химиотерапия рака стала одной из очень важных дисциплин в лечении рака.
В Китае до 1949 года химиотерапия рака не применялась.После основания Китайской Народной Республики в 1950-х годах правительство обратило внимание на проблему борьбы с раком. В конце 1955 г. под эгидой Китайской академии наук в Пекине состоялась международная конференция по антибиотикам 2 , на которой некоторыми учеными была поставлена задача исследования новых противораковых антибиотиков. В 1956 году был инициирован 12-летний план (1956–1967) развития науки и техники в Китае, в который также были включены исследования противораковых препаратов.К этой исследовательской программе стали подключаться многие подразделения, связанные с исследовательскими институтами, медицинскими школами, фармацевтическими компаниями, а также больницами. В конце 1958 года движение «Большой скачок вперед» подтолкнуло людей к поиску методов и препаратов для борьбы с раком, который считался очень опасным заболеванием и очень сложной исследовательской задачей. С тех пор распространился массовый скрининг китайских лекарственных трав и народных средств для лечения рака. После совместной работы были доказаны некоторые эффективные средства для определенных видов больных раком.Тем временем в Пекине было организовано Национальное бюро по профилактике и лечению рака при Министерстве здравоохранения КНР. Она состояла из более чем 10 отраслевых организаций, одной из которых была совместная группа по исследованию противораковых препаратов, и д-р Б. Сюй был назначен руководителем этой группы. Для организации совместных задач и обмена информацией о различных противоопухолевых агентах периодически проводились встречи и конференции в разных городах Китая.Например, в то время была начата и продолжалась до последних лет Национальная конференция фармакологии и химиотерапии опухолей. Некоторые записи этих конференций можно увидеть в таблице 12.1.
Таблица 12.1. Национальные конференции опухолевой фармакологии и химиотерапии 3
| Дата открытия | Place | ||
|---|---|---|---|
| 1983, 9 | Далянь | 148 | |
| 1987, 11 | Hangzhou | 234 | |
| 1989, 11 | Наньнинский | 240 | |
| 1992, 10 | Чжэнчжоу | 404 | |
| 1995 10 | Тяньцзинь | 370 | |
| 1998 9 | Taian | 300 | 300 |
| 2001, 10 | FUZHOU | 246 | 246 |
Несколько перспективных антинопластичных агентов было эффективным, а также было организовано шесть программ совместных исследований, в том числе (1) Camptotheca Acumanata , (2) Cephalotaxus удачи , (3) Кантаридин , (4) Безвременник осенний nale , (5) Crotalaria sessiliflora L., (6) Curcuma zedoaria (Berg) Роза и так далее. Совместными усилиями различных подразделений ряд лечебных препаратов был детально изучен как экспериментально, так и клинически. Некоторые из них были рекомендованы для клинического применения и производства. Новые противоопухолевые препараты, обычно используемые в других странах, также исследовались в Китае с использованием местного материала и методов, таких как алкалоиды из Vinca rosea , производные азотистого иприта, антиметаболиты и другие (в то время Китай был изолирован от зарубежья).В этот период, который считался ранней стадией исследований противораковых препаратов в Китае, многие специалисты в этой области накопили много знаний и опыта, а также многому научились из иностранной литературы. Тем временем была заложена фундаментальная основа исследований, образования и производства противоопухолевых препаратов.
Позже, в 1970-х — 1990-х годах, под влиянием национальной политики реформ и открытости двери Китая все больше открывались, и некоторые специалисты и ученые имели возможность выезжать за границу и узнавать новые достижения в мире, обогащая свои знания о химиотерапии рака.В Китае были представлены новые дисциплины, такие как клеточная кинетика, молекулярная фармакология опухолей, стандартные процедуры оценки новых противоопухолевых агентов как в лаборатории, так и в клинике, эффективные методы скрининга и квалифицированные клинические испытания, комбинированная химиотерапия для различных видов рака и т. д. Некоторые ведущие учреждения в этой области, такие как Шанхайский институт лекарственных веществ (SIMM), Китайская академия наук (CAS), Институт лекарственных веществ в Пекине (IMM), Китайская академия медицинских наук (CAMS), Институт Фармакология и токсикология Академии военно-медицинских наук Китая, Шанхайских институтов фармацевтической промышленности, Института антибиотиков в Пекине, онкологических больниц, расположенных в Пекине, Шанхае и Гуанчжоу, сыграли важную роль в повышении уровня химиотерапии рака в китайской практике и активно обмен знаниями для поиска и производства новых противоопухолевых препаратов.За короткое время большинство известных в мире противоопухолевых препаратов уже могли производиться в Китае и удовлетворять клинические потребности. Некоторые лекарства, в том числе ряд препаратов собственной разработки Китая, экспортировались в другие страны, например, алкалоиды барвинка, камптотецины и так далее. В табл. 12.2 показаны основные противоопухолевые препараты, применявшиеся в то время в клинической практике. Это также означало, что наиболее популярные противоопухолевые препараты могли производиться и поставляться китайскими фармацевтическими компаниями.
Таблица 12.2. Основные противоопухолевые препараты составили 47, утвержденные Министерством здравоохранения Китая в 1993 году 4
В дальнейшем базовые противоопухолевые препараты периодически менялись.Некоторые старые лекарства были заменены новыми агентами или более эффективными соединениями. В последнее время также был включен ряд таргетных препаратов и биотерапевтических агентов.
В последние годы знания о природе рака значительно расширились, а молекулярная онкология, молекулярная фармакология, генная инженерия и другие дисциплины значительно расширили сферу исследований противоопухолевых препаратов. В частности, было обнаружено много новых мишеней, препятствующих росту и метастазированию опухоли.Основываясь на новых данных и с помощью новых методов и технологий, многие новые лекарственные средства, включая цитостатические агенты, ингибиторы тирозинкиназы, ингибиторы ангиогенеза, препараты, препятствующие передаче сигнала, противоопухолевые антитела, агенты, индуцирующие дифференцировку, новые поколения антиметаболитов и цитотоксические агенты. были разработаны. Некоторые китайские научно-исследовательские лаборатории и фармацевтические заводы активно участвуют в совместной работе с зарубежными фармацевтическими компаниями и другими организациями; уже открыто много новых находок и лекарственных препаратов.В настоящее время почти все новые противораковые препараты можно найти на китайских фармацевтических рынках и в клинических больницах. Тысячи научных статей, связанных с исследованием и производством различных противоопухолевых препаратов, ежегодно публикуются китайскими специалистами в журналах, книгах или в сети Интернет. Многие важные вклады в эту область можно найти по разным каналам. Здесь мы рассмотрим некоторые достижения, полученные в Китае, которые более тесно связаны с нашей работой (таблицы 12.3 и 12.4).
Таблица 12.3. Химические структуры выбранных соединений и их активность на ферменте и уровнях клетки
| номер | R | биологические анализы | |||||
|---|---|---|---|---|---|---|---|
| ингибирование фермента A ингибирование (%) | скорость торможения опухоли или IC 50 (μMol / L) B | ||||||
| 1 | 0 | 60,5 | |||||
| 3 | 0 | 45.5 | |||||
| 4A | 8038 | 8,6 | 6.1 | ||||
| 4B | 3,7 | 7.3 | |||||
Таблица 12.4. Химические структуры выбранных соединений и их ингибируют фермент
| номер | R 1 | R 2 | Ферментные анализы ингибирования на 10 мкмоль / л (%) A | |||||
|---|---|---|---|---|---|---|---|---|
| EGFR | ||||||||
| EGFR | FGFR | VEGFR | PDGFR | PDGFR | ||||
| 5A | CH 2 CO 2 et | H | 20.2 | 1,7 | 38,6 | 11,5 | ||
| 5b | СН 2 СО 2 Et | Br | 29,5 | Н.А. | 32,4 | 16,1 | ||
| 5с | СН 2 СО 2 М | Н | 35,5 | 10,4 | 35,3 | 16,8 | ||
| 5d | СН 2 СО 2 М | Br | 10 .1 | 5,8 | 36,7 | 8,0 | ||
| 5e | СН 3 | Н | 18,4 | 19,4 | 38,6 | 25,4 | ||
| 5f | СН 3 | BR | 12.1 | 1,1 | 38.6 | 17.4 | 17.4 | |
| 5G | CH 3 | NO 2 | 44.2 | 10.5 | 27.6 | 9.4 | 9.4 | |
| 5h | CH 3 | H | 36.7 | 36. | ||||

 Поэтому их также
называют тормозными. В результате Т-клетки обнаруживают злокачественные,
уничтожают их или, по крайней мере, останавливают их рост. При меланоме (раке кожи) и некоторых формах рака
легких с помощью ингибиторов контрольно-пропускной способности
удается достичь опухолевых образований различной степени прогрессирования.
Ингибиторы контрольной точки также используются при раке
почек и мочевого пузыря, а также опухолях в области
горла, носа и ушей.
Поэтому их также
называют тормозными. В результате Т-клетки обнаруживают злокачественные,
уничтожают их или, по крайней мере, останавливают их рост. При меланоме (раке кожи) и некоторых формах рака
легких с помощью ингибиторов контрольно-пропускной способности
удается достичь опухолевых образований различной степени прогрессирования.
Ингибиторы контрольной точки также используются при раке
почек и мочевого пузыря, а также опухолях в области
горла, носа и ушей. В человеческом организме все
сбалансировано, если иммунитет «слишком активен», то он начинает атаковать
здоровые клетки, провоцируя развитие аутоиммунных заболеваний. Ипилимумаб
останавливает блокировку иммунной системы, повышая количество T-лимфоцитов,
атакующих опухоль.
В человеческом организме все
сбалансировано, если иммунитет «слишком активен», то он начинает атаковать
здоровые клетки, провоцируя развитие аутоиммунных заболеваний. Ипилимумаб
останавливает блокировку иммунной системы, повышая количество T-лимфоцитов,
атакующих опухоль. сайт медиа-кита
сайт медиа-кита