Препараты против старения работают вовсе не так, как думали учёные
Учёные из Института цитологии РАН в Санкт-Петербурге обнаружили, что препараты, назначение которых — омолаживание организма (сенолитики) работают совсем не так, как считалось ранее.
Механизм их действия на практике заметно отличается от теоретических выкладок. И это новое открытие можно будет использовать в разработке модернизированных препаратов «от старости».
Напомним, что клетки стареют либо в ответ на воздействие стрессовых факторов, повреждающих их ДНК, либо когда они исчерпывают отведённый им природой лимит на деление. В обоих случаях в них включается запрограмированный процесс апоптоза, или клеточной смерти, который очищающим образом воздействует на организм.
С возрастом в тканях накапливается всё больше старых клеток, в которых процесс апоптоза не произошёл. Они больше не делятся, но и не гибнут, выделяя в организм вещества, вызывающие воспаление, перерождение здоровых клеток в злокачественные и повышающие риск развития болезней Паркинсона и Альцгеймера.
Это происходит потому, что иммунитет пожилых людей перестаёт справляться с задачей уничтожения отживших свой век клеток. Чтобы вновь запустить этот процесс, медики назначают пациентам специальные препараты — сенолитики. Они избирательно уничтожают старые клетки.
Ранее считалось, что механизм действия этих препаратов заключается в преодолении устойчивости старых клеток к апоптозу. Однако российские учёные доказали, что это не совсем верно.
Исследователи провели ряд экспериментов на мезенхимальных стволовых клетках (МСК) человека. Они способны трансформироваться в разные типы клеток: жировой, костной или хрящевой ткани, в клетки мышечной и нервной тканей.
Чтобы имитировать их старение, учёные подвергли стволовые клетки воздействию повреждающих ДНК соединений и перекиси водорода: она запускает окислительный стресс. Также авторы работы состарили клетки естественным образом: просто долго выращивали культуру.
Совместное культивирование молодых и старых стволовых клеток.
Затем учёные попытались уничтожить постаревшие клетки с помощью сенолитиков уабаина и буфалина.
Оказалось, что не у всех стареющих клеток развивается устойчивость к апоптозу.
Более того, оказалось, что сенолитики действуют только на те клетки, которые не приобрели при старении такую устойчивость. Получается, что механизм их действия отличается от предполагаемого.
Авторы работы считают, что эти препараты влияют не на антиапоптотические пути, а на другие механизмы, важные для выживания клеток. Но только на те, которые уже изменены и ослаблены у старых клеток.
«Все типы стареющих МСК оказались невосприимчивы к действию препаратов как раз из-за устойчивости к апоптозу. Если в них дополнительно подавлять активность белков, определяющих это свойство, можно сделать их чувствительными к сенолизису», – отметила соавтор исследования Александра Бородкина из ИНЦ РАН.
Вывод, к которому пришли исследователи, однозначен: разработанные на сегодняшний день сенолитики не эффективны в отношении старых мезенхимальных стволовых клеток.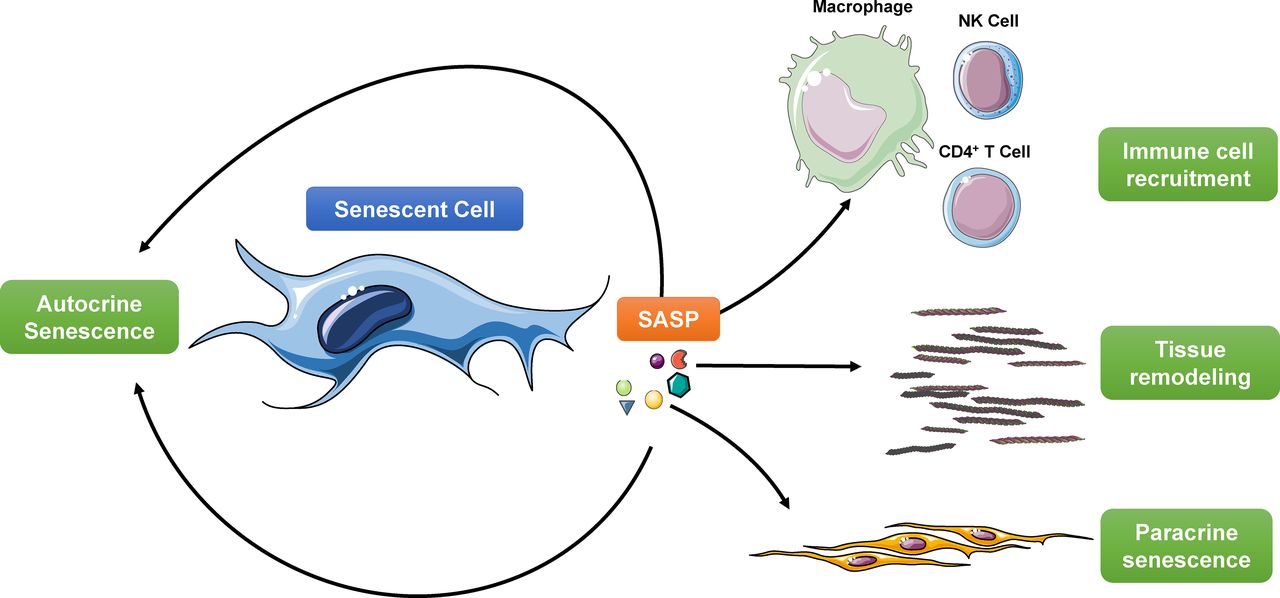 Впрочем, в организме много других клеток. Другое дело, что многие же начинают свою жизнь с МСК.
Впрочем, в организме много других клеток. Другое дело, что многие же начинают свою жизнь с МСК.
Также учёные отмечают, что известные препараты способны запустить процесс апоптоза в постаревших клетках, однако для этого необходимо дополнительное воздействие на систему защиты от «программируемой смерти».
Авторы работы Павел Дерябин и Александра Бородкина.
Специалисты ИНЦ РАН сейчас занимаются поиском и разработкой более универсальных сенолитиков, основываясь на результатах нового исследования.Работа российских учёных была опубликована в научном журнале Cellular and Molecular Life Sciences 29 октября 2021 года.
Ранее мы рассказывали о том, почему люди стареют по-разному, а также о том, как с помощью стволовых клеток удалось вернуть подвижность людям с серьёзными травмами спинного мозга.
Кроме того, мы писали о том что клеточное перепрограммирование помогло замедлить процессы старения. Рассказывали мы и о том, что ключевые процессы старения можно обернуть вспять с помощью «альтернативной энергии» для митохондрий.
Больше новостей из мира науки и медицины вы найдёте в разделах «Наука» и «Медицина» на медиаплатформе «Смотрим».
Сенолитики | Патогенез
- A. A. Paltsyn Федеральное государственное бюджетное научное учреждение «Научно-исследовательский институт общей патологии и патофизиологии», Москва, Россия; Федеральное Государственное бюджетное образовательное учреждение дополнительного профессионального образования «Российская медицинская Академия непрерывного профессионального образования» Министерства здравоохранения Российской Федерации, Москва, Россия
Ключевые слова: старение, апоптоз, сенолитики, старые клетки, возрастные болезни, старческий секреторный фенотип
Аннотация
Клеточное старение – главная причина возрастных хронических болезней и основной массы морбидности, мортальности и затрат на здоровье.

Сенолитики – проблема или решение? / Хабр
Когда сенолитики вызывают гибель сенесцентных клеток, иные (более юные) клетки обязаны реплицироваться и занимать место убитых клеток. Эта репликация клеток вызывает укорочение теломер, что может привести к образованию новых сенесцентных клеток. Как получается, что процесс уничтожения сенесцентных клеток не является саморазрушающим, если создаются новые сенесцентные клетки?
Есть несколько способов ответить на этот вопрос. Во-первых, просто взгляните на восхитительные эффекты
сенолитических препаратовили
генной терапииу старых мышей и мышиных моделей возрастных заболеваний. В этих экспериментах сенолитические препараты восстановили физическую активность и способность формировать новые
прогениторныекровяные и иммунные клетки на уровне юных мышей, при этом предотвращая возрастную гипофункцию лёгких, жировые инфильтрации в печень, ослабление или остановку сердца,
остеопороз и облысение. Также они предотвратили или вылечили мышиные модели заболеваний старения, таких как остеоартрит, фиброзных заболеваний лёгких,
Также они предотвратили или вылечили мышиные модели заболеваний старения, таких как остеоартрит, фиброзных заболеваний лёгких,
(НАЖБП), атеросклероза, рака и побочных эффектов обычной химиотерапии, а также нейродегенеративные заболевания, такие как болезни Паркинсона и Альцгеймера и многие иные! Таким образом, какой бы побочный ущерб ни происходил при убийстве сенесцентных клеток, совершенно ясно, что сенолитическое лечение приносит намного больше пользы.
Но давайте лучше рассмотрим основную причину вопроса. Предположим (в соответствии с вопросом), что каждый раз, когда вы уничтожаете
клетку,
прогениторная клетка (одна из частично специализированных тканеспецифических клеток, которые заселяют ткань зрелыми клетками, специфичными этой ткани), реплицируется, чтобы создать новую клетку. И эксперименты показывают, что когда сенесцентные клетки погибают в ткани, прогениторные клетки начинают размножаться и / или функционировать лучше. Но причины не в том, что прогениторные клетки автоматически реплицируются и замещают сенесцентную клетку, а в том, что
Но причины не в том, что прогениторные клетки автоматически реплицируются и замещают сенесцентную клетку, а в том, что
, выбрасываемые из сенесцентных клеток, подавляют их регенеративную функцию, так что уничтожение сенесцентных клеток позволяет им начать снова работать нормально. Это наблюдается в клетках костного мозга, в прогениторных клетках сердечной мышцы, в клетках, образующих кости, и в клетках, образующих новые жировые клетки – как у мышей, так и (в небольшом клиническом испытании)
у человека!Ну и правы ли вопрошающие? На самом деле, нет. Требуется всего лишь минутная мысль, чтобы понять, что одной такой репликации может быть мало, чтобы привести стволовую / прогениторную клетку к сенесцентности: если бы это было так, конечно, сенолитическая терапия не смогла бы уменьшить общее число сенесцентных клеток. Но эксперименты ясно показывают, что использование сенолитиков снижает общее число сенесцентных клеток в тканях.
Кроме того, если бы эти препараты не убивали больше сенесцентных клеток, чем они генерировали косвенно, вы бы не получили указанные феноменальные эффекты – и, конечно, вы их получили во многих тканях и многих моделях старения и возрастных заболеваний.
Возвращаясь к вопросу
Тем не менее, даже если
одногокурса сенолитиков мало, чтобы вызвать старение стволовых клеток, что, если вы запускаете старение стволовых клеток в тканях каждые два курса – или каждые три, или четыре, или десять? Может ли один курс сенолитических препаратов принести чистую пользу, в то время как циклическое лечение в течение всей жизни будет постепенно истощать пулы стволовых клеткок ткани, и в конечном итоге насыщая организм сенесцентными клетками и оставляя пациента (мышь или человека) хуже в перспективе?
К счастью, у нас есть исследования этого вопроса – и они снова говорят нам, что ответ «нет».
В эксперименте, который сыграл решающую роль в запуске революции в сенолитических терапиях, мыши были спроектированы с генетическим механизмом апоптоза, встроенным во все их клетки, который не функционировал, пока не активировался инструкцией из двух частей: экспрессией гена p16, которая характерна для сенесцентных клеток; и активирующим лекарством, которое учёные могли применять в целях контроля темпа сенолитической активности. Затем учёные подождали, пока животным не исполнится 12 месяцев (по человеческим меркам это похоже на человека в возрасте 40 лет), прежде чем вводить препарат впервые. Затем они продолжили вводить лекарство каждые две недели в течение следующих шести месяцев, и всего животные получили 13 циклов сенолитической терапии и были примерно похожи на людей в возрасте 50 лет.
Затем учёные подождали, пока животным не исполнится 12 месяцев (по человеческим меркам это похоже на человека в возрасте 40 лет), прежде чем вводить препарат впервые. Затем они продолжили вводить лекарство каждые две недели в течение следующих шести месяцев, и всего животные получили 13 циклов сенолитической терапии и были примерно похожи на людей в возрасте 50 лет.
Эксперименты явно показали, что животные получили пользу от сенолитической терапии даже после многих непрерывных циклов в течение их естественного среднего и по ранний пожилой возраст. Например, животные, чей механизм саморазрушения сенесцентных клеток был запущен, лучше сохранили функцию почек, и меньшее количество из них умерло в среднем и в раннем пожилом возрасте.
Учёные изучали влияние нескольких курсов сенолитической терапии на общее число сенесцентных клеток, а также существенно ли они истощали запасы функциональных прогениторных клеток у животных. Для этого учёные изучили влияние терапии на преадипоциты (клетки, образующие жировые клетки (адипоциты)) в жировой ткани животных – удобное место поиска, поскольку её легко найти, и она накапливает немалое число сенесцентных клеток.
После примерно 13 циклов сенолитической терапии у животных была лишь 1/8 числа сенесцентных преадипоцитов по сравнению с контролем (рис. 1 (а)) – очень существенное явное снижение. Но и в этом случае у животных оставалось функциональных прогениторных клеток как в контроле. (Рис. 1 (b)).
Активация сенолитических генов «самоуничтожения» в течение всей жизни сокращает число сенесцентных клеток (а), практически не влияя на число прогениторных (б) в жировой ткани. Столбцы в (b) с # являются статистически значимыми различиями.
В иной работе учёные использовали физетин – растительное сенолитическое вещество – мышам каждые сутки, начиная с момента, когда они уже находились в раннем пожилом возрасте (и, таким образом, уже имели как большое число сенесцентных клеток, так и истощающееся количество прогениторных клеток) и продолжали до их смерти. Указанное лечение сократило количество сенесцентных клеток в большинстве тканей примерно на 50%. Кроме этого, животные жили значительно дольше, а в их тканях были менее выражены возрастные изменения, чем у контрольных животные.
Убираем старое – и вживляем новое
И всё же, важно иметь много функциональных клеток, чтобы воспользоваться всеми преимуществами сенолитической терапии. Это было проиллюстрировано в эксперименте с использованием сенолитических лекарств или генов «самоуничтожения» в лечении животных моделей
остеоартрита. Когда заболевание суставов было инициировано травмой у молодых животных, оно привело к хроническому повреждению суставов и накоплению сенесцентных клеток в
синовиуме(мембрана, окружающая сустав, в которой живут клетки, вырабатывающие специальную жидкость, которая смазывает сустав). Уничтожение сенесцентных клеток уменьшило воспаление в суставе, предотвратило его разрушение и облегчило боли у животных.
Но сенолитическое лечение было намного менее эффективным, когда учёные повторили эксперимент на старых животных, и причины пролили некоторый свет на наш первоначальный вопрос. По сравнению с юными животными, старые животные накапливали гораздо больше сенесцентных клеток после того, как их суставы были повреждены, и эти клетки располагались в более глубоких слоях ткани, что сопровождалось более тяжёлым остеоартритом. Возможно, это связано с тем, что у старых животных больше клеток уже получили немалый ущерб от старения и намного легче превращались в сенесцентные. И когда старым животным ввели сенолитическое лечение, оставшиеся здоровые клетки также не реагировали: бремя клеток зомби уменьшилось, и старые животные всё ещё получили некоторое облегчение боли, но гены, которые помогли юным животным восстановить их повреждённые суставы не были активированы, и их хрящи не улучшились. Учёные полагают, что это может быть связано со снижением числа или функции прогениторных хрящообразующих клеток, вызванных процессами старения.
Возможно, это связано с тем, что у старых животных больше клеток уже получили немалый ущерб от старения и намного легче превращались в сенесцентные. И когда старым животным ввели сенолитическое лечение, оставшиеся здоровые клетки также не реагировали: бремя клеток зомби уменьшилось, и старые животные всё ещё получили некоторое облегчение боли, но гены, которые помогли юным животным восстановить их повреждённые суставы не были активированы, и их хрящи не улучшились. Учёные полагают, что это может быть связано со снижением числа или функции прогениторных хрящообразующих клеток, вызванных процессами старения.
Точно так же, уничтожение сенесцентных клеток у старых мышей уменьшило излишнее число остеокластов (клеток, разрушающих кость), накапливающихся в стареющей кости, но не восстановило уменьшающийся запас костеобразующих остеобластов, малое число которых, несомненно, ограничило омолаживающие эффекты лечения.
В обоих случаях отсутствие увеличения числа или активности юных клеток не было результатом повреждения сенолитического лечения: уменьшение их числа уже произошло раньше начала лечения. Таким образом, проблема не в том, что сенолитическая терапия перестаёт работать или становится разрушающей со временем: а скорее в её нацеленности лишь на один тип повреждения, в то время как старение вызывает болезни из-за накопления многих типов клеточных и молекулярных повреждений в наших тканях. Решение состоит в том, чтобы соединить уничтожение сенесцентных клеток с инъекциями свежих новых функциональных клеток при помощи клеточной терапии. (Наш анализ прошлой работы по сенолитической терапии в моделях болезни Паркинсона в целях клинического применения в комбинированной терапии).
Таким образом, проблема не в том, что сенолитическая терапия перестаёт работать или становится разрушающей со временем: а скорее в её нацеленности лишь на один тип повреждения, в то время как старение вызывает болезни из-за накопления многих типов клеточных и молекулярных повреждений в наших тканях. Решение состоит в том, чтобы соединить уничтожение сенесцентных клеток с инъекциями свежих новых функциональных клеток при помощи клеточной терапии. (Наш анализ прошлой работы по сенолитической терапии в моделях болезни Паркинсона в целях клинического применения в комбинированной терапии).
И если вернуться к начальному вопросу, это также окажется решением, если внезапно выяснится, что многие циклы сенолитической терапии приведут к старению слишком большого числа стволовых клеток. Но, как мы видели, все данные свидетельствуют – что это не будет проблемой в течение нашей нынешней жизни.
Ссылки- Zhu Y, Tchkonia T, Pirtskhalava T, Gower AC, Ding H, Giorgadze N, Palmer AK, Ikeno Y, Hubbard GB, Lenburg M, O’Hara SP, LaRusso NF, Miller JD, Roos CM, Verzosa GC, LeBrasseur NK, Wren JD, Farr JN, Khosla S, Stout MB, McGowan SJ, Fuhrmann-Stroissnigg H, Gurkar AU, Zhao J, Colangelo D, Dorronsoro A, Ling YY, Barghouthy AS, Navarro DC, Sano T, Robbins PD, Niedernhofer LJ, Kirkland JL.
 The Achilles’ heel of senescent cells: from transcriptome to senolytic drugs. Aging Cell. 2015 Aug;14(4):644-58. doi: 10.1111/acel.12344. Epub 2015 Apr 22. PubMed PMID: 25754370; PubMed Central PMCID: PMC4531078.
The Achilles’ heel of senescent cells: from transcriptome to senolytic drugs. Aging Cell. 2015 Aug;14(4):644-58. doi: 10.1111/acel.12344. Epub 2015 Apr 22. PubMed PMID: 25754370; PubMed Central PMCID: PMC4531078. - Baar MP, Brandt RMC, Putavet DA, Klein JDD, Derks KWJ, Bourgeois BRM, Stryeck S, Rijksen Y, van Willigenburg H, Feijtel DA, van der Pluijm I, Essers J, van Cappellen WA, van IJcken WF, Houtsmuller AB, Pothof J, de Bruin RWF, Madl T, Hoeijmakers JHJ, Campisi J, de Keizer PLJ. Targeted Apoptosis of Senescent Cells Restores Tissue Homeostasis in Response to Chemotoxicity and Aging. Cell. 2017 Mar 23;169(1):132-147.e16. doi: 10.1016/j.cell.2017.02.031. PubMed PMID: 28340339; PubMed Central PMCID: PMC5556182.
- Chang J, Wang Y, Shao L, Laberge RM, Demaria M, Campisi J, Janakiraman K, Sharpless NE, Ding S, Feng W, Luo Y, Wang X, Aykin-Burns N, Krager K, Ponnappan U, Hauer-Jensen M, Meng A, Zhou D. Clearance of senescent cells by ABT263 rejuvenates aged hematopoietic stem cells in mice.
 Nat Med. 2016 Jan;22(1):78-83. doi: 10.1038/nm.4010. Epub 2015 Dec 14. PubMed PMID: 26657143; PubMed Central PMCID: PMC4762215.
Nat Med. 2016 Jan;22(1):78-83. doi: 10.1038/nm.4010. Epub 2015 Dec 14. PubMed PMID: 26657143; PubMed Central PMCID: PMC4762215. - Hashimoto M, Asai A, Kawagishi H, Mikawa R, Iwashita Y, Kanayama K, Sugimoto K, Sato T, Maruyama M, Sugimoto M. Elimination of p19(ARF)-expressing cells enhances pulmonary function in mice. JCI Insight. 2016 Aug 4;1(12):e87732. doi: 10.1172/jci.insight.87732. PubMed PMID: 27699227; PubMed Central PMCID: PMC5033852.
- Ogrodnik M, Miwa S, Tchkonia T, Tiniakos D, Wilson CL, Lahat A, Day CP, Burt A, Palmer A, Anstee QM, Grellscheid SN, Hoeijmakers JHJ, Barnhoorn S, Mann DA, Bird TG, Vermeij WP, Kirkland JL, Passos JF, von Zglinicki T, Jurk D. Cellular senescence drives age-dependent hepatic steatosis. Nat Commun. 2017 Jun 13;8:15691. doi: 10.1038/ncomms15691. PubMed PMID: 28608850; PubMed Central PMCID: PMC5474745.
- Lewis-McDougall FC, Ruchaya PJ, Domenjo-Vila E, Shin Teoh T, Prata L, Cottle BJ, Clark JE, Punjabi PP, Awad W, Torella D, Tchkonia T, Kirkland JL, Ellison-Hughes GM.
 Aged-senescent cells contribute to impaired heart regeneration. Aging Cell. 2019 Jun;18(3):e12931. doi: 10.1111/acel.12931. Epub 2019 Mar 10. PubMed PMID: 30854802; PubMed Central PMCID: PMC6516154.
Aged-senescent cells contribute to impaired heart regeneration. Aging Cell. 2019 Jun;18(3):e12931. doi: 10.1111/acel.12931. Epub 2019 Mar 10. PubMed PMID: 30854802; PubMed Central PMCID: PMC6516154. - Anderson R, Lagnado A, Maggiorani D, Walaszczyk A, Dookun E, Chapman J, Birch J, Salmonowicz H, Ogrodnik M, Jurk D, Proctor C, Correia-Melo C, Victorelli S, Fielder E, Berlinguer-Palmini R, Owens A, Greaves LC, Kolsky KL, Parini A, Douin-Echinard V, LeBrasseur NK, Arthur HM, Tual-Chalot S, Schafer MJ, Roos CM, Miller JD, Robertson N, Mann J, Adams PD, Tchkonia T, Kirkland JL, Mialet-Perez J, Richardson GD, Passos JF. Length-independent telomere damage drives post-mitotic cardiomyocyte senescence. EMBO J. 2019 Mar 1;38(5). pii: e100492. doi: 10.15252/embj.2018100492. Epub 2019 Feb 8. PubMed PMID: 30737259; PubMed Central PMCID: PMC6396144.
- Farr JN, Xu M, Weivoda MM, Monroe DG, Fraser DG, Onken JL, Negley BA, Sfeir JG, Ogrodnik MB, Hachfeld CM, LeBrasseur NK, Drake MT, Pignolo RJ, Pirtskhalava T, Tchkonia T, Oursler MJ, Kirkland JL, Khosla S.
 Targeting cellular senescence prevents age-related bone loss in mice. Nat Med. 2017 Sep;23(9):1072-1079. doi: 10.1038/nm.4385. Epub 2017 Aug 21. Erratum in: Nat Med. 2017 Nov 7;23 (11):1384. PubMed PMID: 28825716; PubMed Central PMCID: PMC5657592.
Targeting cellular senescence prevents age-related bone loss in mice. Nat Med. 2017 Sep;23(9):1072-1079. doi: 10.1038/nm.4385. Epub 2017 Aug 21. Erratum in: Nat Med. 2017 Nov 7;23 (11):1384. PubMed PMID: 28825716; PubMed Central PMCID: PMC5657592. - Yosef R, Pilpel N, Tokarsky-Amiel R, Biran A, Ovadya Y, Cohen S, Vadai E, Dassa L, Shahar E, Condiotti R, Ben-Porath I, Krizhanovsky V. Directed elimination of senescent cells by inhibition of BCL-W and BCL-XL. Nat Commun. 2016 Apr 6;7:11190. doi: 10.1038/ncomms11190. PubMed PMID: 27048913; PubMed Central PMCID: PMC4823827.
- Jeon OH, Kim C, Laberge RM, Demaria M, Rathod S, Vasserot AP, Chung JW, Kim DH, Poon Y, David N, Baker DJ, van Deursen JM, Campisi J, Elisseeff JH. Local clearance of senescent cells attenuates the development of post-traumatic osteoarthritis and creates a pro-regenerative environment. Nat Med. 2017 Jun;23(6):775-781. doi: 10.1038/nm.4324. Epub 2017 Apr 24. PubMed PMID: 28436958; PubMed Central PMCID: PMC5785239.

- Schafer MJ, White TA, Iijima K, Haak AJ, Ligresti G, Atkinson EJ, Oberg AL, Birch J, Salmonowicz H, Zhu Y, Mazula DL, Brooks RW, Fuhrmann-Stroissnigg H, Pirtskhalava T, Prakash YS, Tchkonia T, Robbins PD, Aubry MC, Passos JF, Kirkland JL, Tschumperlin DJ, Kita H, LeBrasseur NK. Cellular senescence mediates fibrotic pulmonary disease. Nat Commun. 2017 Feb 23;8:14532. doi: 10.1038/ncomms14532. PubMed PMID: 28230051; PubMed Central PMCID: PMC5331226.
- Pan J, Li D, Xu Y, Zhang J, Wang Y, Chen M, Lin S, Huang L, Chung EJ, Citrin DE, Wang Y, Hauer-Jensen M, Zhou D, Meng A. Inhibition of Bcl-2/xl With ABT-263 Selectively Kills Senescent Type II Pneumocytes and Reverses Persistent Pulmonary Fibrosis Induced by Ionizing Radiation in Mice. Int J Radiat Oncol Biol Phys. 2017 Oct 1;99(2):353-361. doi: 10.1016/j.ijrobp.2017.02.216. Epub 2017 Mar 4. PubMed PMID: 28479002.
- Roos CM, Zhang B, Palmer AK, Ogrodnik MB, Pirtskhalava T, Thalji NM, Hagler M, Jurk D, Smith LA, Casaclang-Verzosa G, Zhu Y, Schafer MJ, Tchkonia T, Kirkland JL, Miller JD.
 Chronic senolytic treatment alleviates established vasomotor dysfunction in aged or atherosclerotic mice. Aging Cell. 2016 Oct;15(5):973-7. doi: 10.1111/acel.12458. Epub 2016 Aug 5. PubMed PMID: 26864908; PubMed Central PMCID: PMC5013022.
Chronic senolytic treatment alleviates established vasomotor dysfunction in aged or atherosclerotic mice. Aging Cell. 2016 Oct;15(5):973-7. doi: 10.1111/acel.12458. Epub 2016 Aug 5. PubMed PMID: 26864908; PubMed Central PMCID: PMC5013022. - Childs BG, Baker DJ, Wijshake T, Conover CA, Campisi J, van Deursen JM. Senescent intimal foam cells are deleterious at all stages of atherosclerosis. Science. 2016 Oct 28;354(6311):472-477. Epub 2016 Oct 27. PubMed PMID: 27789842; PubMed Central PMCID: PMC5112585.
- Baker DJ, Childs BG, Durik M, Wijers ME, Sieben CJ, Zhong J, Saltness RA, Jeganathan KB, Verzosa GC, Pezeshki A, Khazaie K, Miller JD, van Deursen JM. Naturally occurring p16(Ink4a)-positive cells shorten healthy lifespan. Nature. 2016 Feb 11;530(7589):184-9. doi: 10.1038/nature16932. Epub 2016 Feb 3. PubMed PMID: 26840489; PubMed Central PMCID: PMC4845101.
- Demaria M, O’Leary MN, Chang J, Shao L, Liu S, Alimirah F, Koenig K, Le C, Mitin N, Deal AM, Alston S, Academia EC, Kilmarx S, Valdovinos A, Wang B, de Bruin A, Kennedy BK, Melov S, Zhou D, Sharpless NE, Muss H, Campisi J.
 Cellular Senescence Promotes Adverse Effects of Chemotherapy and Cancer Relapse. Cancer Discov. 2017 Feb;7(2):165-176. doi: 10.1158/2159-8290.CD-16-0241. Epub 2016 Dec 15. PubMed PMID: 27979832; PubMed Central PMCID: PMC5296251.
Cellular Senescence Promotes Adverse Effects of Chemotherapy and Cancer Relapse. Cancer Discov. 2017 Feb;7(2):165-176. doi: 10.1158/2159-8290.CD-16-0241. Epub 2016 Dec 15. PubMed PMID: 27979832; PubMed Central PMCID: PMC5296251. - Chinta SJ, Woods G, Demaria M, Rane A, Zou Y, McQuade A, Rajagopalan S, Limbad C, Madden DT, Campisi J, Andersen JK. Cellular Senescence Is Induced by the Environmental Neurotoxin Paraquat and Contributes to Neuropathology Linked to Parkinson’s Disease. Cell Rep. 2018 Jan 23;22(4):930-940. doi: 10.1016/j.celrep.2017.12.092. Epub 2018 Jan 28. PubMed PMID: 29386135; PubMed Central PMCID: PMC5806534.
- Zhang P, Kishimoto Y, Grammatikakis I, Gottimukkala K, Cutler RG, Zhang S, Abdelmohsen K, Bohr VA, Misra Sen J, Gorospe M, Mattson MP. Senolytic therapy alleviates Aβ-associated oligodendrocyte progenitor cell senescence and cognitive deficits in an Alzheimer’s disease model. Nat Neurosci. 2019 May;22(5):719-728. doi: 10.1038/s41593-019-0372-9.
 Epub 2019 Apr 1. PubMed PMID: 30936558; PubMed Central PMCID: PMC6605052.
Epub 2019 Apr 1. PubMed PMID: 30936558; PubMed Central PMCID: PMC6605052. - Bussian TJ, Aziz A, Meyer CF, Swenson BL, van Deursen JM, Baker DJ. Clearance of senescent glial cells prevents tau-dependent pathology and cognitive decline. Nature. 2018 Oct;562(7728):578-582. doi: 10.1038/s41586-018-0543-y. Epub 2018 Sep 19. PubMed PMID: 30232451; PubMed Central PMCID: PMC6206507.
- Musi N, Valentine JM, Sickora KR, Baeuerle E, Thompson CS, Shen Q, Orr ME. Tau protein aggregation is associated with cellular senescence in the brain. Aging Cell. 2018 Dec;17(6):e12840. doi: 10.1111/acel.12840. Epub 2018 Oct 11. PubMed PMID: 30126037; PubMed Central PMCID: PMC6260915.
- Xu M, Palmer AK, Ding H, Weivoda MM, Pirtskhalava T, White TA, Sepe A, Johnson KO, Stout MB, Giorgadze N, Jensen MD, LeBrasseur NK, Tchkonia T, Kirkland JL. Targeting senescent cells enhances adipogenesis and metabolic function in old age. Elife. 2015 Dec 19;4:e12997. doi: 10.7554/eLife.12997. PubMed PMID: 26687007; PubMed Central PMCID: PMC4758946.

- Hickson LJ, Langhi Prata LGP, Bobart SA, Evans TK, Giorgadze N, Hashmi SK, Herrmann SM, Jensen MD, Jia Q, Jordan KL, Kellogg TA, Khosla S, Koerber DM, Lagnado AB, Lawson DK, LeBrasseur NK, Lerman LO, McDonald KM, McKenzie TJ, Passos JF, Pignolo RJ, Pirtskhalava T, Saadiq IM, Schaefer KK, Textor SC, Victorelli SG, Volkman TL, Xue A, Wentworth MA, Wissler Gerdes EO, Zhu Y, Tchkonia T, Kirkland JL. Senolytics decrease senescent cells in humans: Preliminary report from a clinical trial of Dasatinib plus Quercetin in individuals with diabetic kidney disease. EBioMedicine. 2019 Sep;47:446-456. doi: 10.1016/j.ebiom.2019.08.069. Epub 2019 Sep 18. PubMed PMID: 31542391.
- Yousefzadeh MJ, Zhu Y, McGowan SJ, Angelini L, Fuhrmann-Stroissnigg H, Xu M, Ling YY, Melos KI, Pirtskhalava T, Inman CL, McGuckian C, Wade EA, Kato JI, Grassi D, Wentworth M, Burd CE, Arriaga EA, Ladiges WL, Tchkonia T, Kirkland JL, Robbins PD, Niedernhofer LJ. Fisetin is a senotherapeutic that extends health and lifespan.
 EBioMedicine. 2018 Oct;36:18-28. doi: 10.1016/j.ebiom.2018.09.015. Epub 2018 Sep 29. PubMed PMID: 30279143; PubMed Central PMCID: PMC6197652.
EBioMedicine. 2018 Oct;36:18-28. doi: 10.1016/j.ebiom.2018.09.015. Epub 2018 Sep 29. PubMed PMID: 30279143; PubMed Central PMCID: PMC6197652.
Сенолитики: Senolytics | Request PDF
Клеточное старение — главная причина возрастных хронических болезней и основной массы морбидности, мортальности и затрат на здоровье. Специфические особенности стареющих клеток: утрата пролиферативной способности, усиленная секреция проинфломаторных цитокинов, хемокинов, факторов протеолиза и экстрацеллюлярных матриксных протеаз, что вместе создает старческий секреторный фенотип (senescence-associated secretory phenotype — SASP). Увеличивающееся с возрастом содержание таких клеток нарушает физиологическую регенерацию тканей и оборачивается пандемиями современного человечества: атеросклерозом, другими сердечно-сосудистыми болезнями, диабетом, раком, воспалительными заболеваниями легких, когнитивными болезнями, саркопенией, остеопорозом и др. Стареющие клетки, подобно раковым, относительно устойчивы к апоптозу. На преодолении этой их особенности основывается недавно возникшее в медицине направление — лечение сенолитиками, препаратами, способствующими апоптозу. Сегодня, уже в многочисленных экспериментальных работах найдено, что сенолитики могут улучшать практически все показатели здоровья и увеличивать продолжительность календарной и физически-активной жизни мышей. Клинические работы по теме пока редки и скромны по числу и значимости изучаемых параметров. Однако есть сообщения о благоприятных результатах применения сенолитиков.
Cell aging is the major cause of age-related chronic diseases and most of morbidity, mortality, and health care expenses. Specific features of senescent cells, such as loss of proliferative capacity, increased secretion of proinflammatory cytokines, chemokines, proteolytic factors, and extracellular matrix proteases, together create the senescence-associated secretory phenotype (SASP). Content of such cells increases with age to break the physiological regeneration of tissues, which turns into the pandemics of modern humanity, including atherosclerosis, other cardiovascular diseases, diabetes, cancer, inflammatory lung diseases, cognitive disorders, sarcopenia, osteoporosis, etc.
На преодолении этой их особенности основывается недавно возникшее в медицине направление — лечение сенолитиками, препаратами, способствующими апоптозу. Сегодня, уже в многочисленных экспериментальных работах найдено, что сенолитики могут улучшать практически все показатели здоровья и увеличивать продолжительность календарной и физически-активной жизни мышей. Клинические работы по теме пока редки и скромны по числу и значимости изучаемых параметров. Однако есть сообщения о благоприятных результатах применения сенолитиков.
Cell aging is the major cause of age-related chronic diseases and most of morbidity, mortality, and health care expenses. Specific features of senescent cells, such as loss of proliferative capacity, increased secretion of proinflammatory cytokines, chemokines, proteolytic factors, and extracellular matrix proteases, together create the senescence-associated secretory phenotype (SASP). Content of such cells increases with age to break the physiological regeneration of tissues, which turns into the pandemics of modern humanity, including atherosclerosis, other cardiovascular diseases, diabetes, cancer, inflammatory lung diseases, cognitive disorders, sarcopenia, osteoporosis, etc. Aging cells, like cancerous cells, are relatively resistant to apoptosis. A recent prospect in medicine, the therapy with senolytic drugs that promote apoptosis, is based on overcoming this feature. By present, already numerous experimental studies have shown that senolytics can improve almost all indexes of health and increase duration of both chronological and physically active life of mice. Clinical studies in this field as yet are scarce and modest in terms of the number and significance of studied parameters. However, some of the studies have reported favorable results of using the senolytics.
Aging cells, like cancerous cells, are relatively resistant to apoptosis. A recent prospect in medicine, the therapy with senolytic drugs that promote apoptosis, is based on overcoming this feature. By present, already numerous experimental studies have shown that senolytics can improve almost all indexes of health and increase duration of both chronological and physically active life of mice. Clinical studies in this field as yet are scarce and modest in terms of the number and significance of studied parameters. However, some of the studies have reported favorable results of using the senolytics.
Ученые опровергли представление о действии омолаживающих препаратов — Наука
ТАСС, 20 декабря. Российские молекулярные биологи выяснили, что не все стареющие клетки теряют чувствительность к клеточным сигналам, которые заставляют их самоуничтожаться. Это опровергает популярную теорию, объясняющую омолаживающее действие сенолитиков, пишет пресс-служба Российского научного фонда. Результаты их исследования опубликовал научный журнал Cellular and Molecular Life Sciences.
«Мы провели ряд экспериментов на стареющих клетках различной природы и выяснили, что не у всех из них развивается устойчивость к апоптозу. Более того, оказалось, что сенолитики действуют только на те клетки, которые при старении эту устойчивость не приобрели. Значит, механизм их действия отличается от общепринятого», — рассказала Александра Бородкина, один из авторов исследования, старший научный сотрудник Института цитологии РАН (Санкт-Петербург).
Сенолитиками называют вещества, которые способны проникать в стареющие клетки и запускать в них программу клеточного самоуничтожения. Опыты на мышах показали, что в результате подобной процедуры можно омолодить пожилых грызунов и продлить их жизни на 20-30%.
Подобные открытия, как отмечают Бородкина и ее коллеги, заставили биологов активно искать и изучать свойства сенолитиков. Особенный интерес у ученых вызвал факт, что подобными качествами обладают популярные лекарства на базе сердечных гликозидов, веществ растительного происхождения, которые меняют баланс ионов в клетках сердечной мышцы.
Российские исследователи детально изучили, как эти препараты действуют на различные типы человеческих клеток, извлеченных из организма пожилых людей, или состаренных искусственным образом. В их число вошли фрагменты здоровых тканей тела, а также взрослые стволовые клетки и образцы различных раковых опухолей.
Считается, что сердечные гликозиды уничтожают престарелые клетки благодаря тому, что лишают их стойкости к действию клеточных сигналов, которые запускают апоптоз — программу клеточного самоуничтожения. Однако опыты биологов из Института цитологии РАН показали, что на самом деле это не так.
В частности, ученые обнаружили, что сразу два подобных сенолитика, уабаин и буфалин, не действовали на определенные типы взрослых стволовых клеток из организма пожилых людей. При этом оказалось, что те тельца, на которые эти препараты действовали, активно реагировали на клеточные сигналы, запускающие апоптоз в человеческих клетках, и без применения сенолитиков.
Подобные результаты ставят под сомнение то, что сенолитики из числа сердечных гликозидов делают престарелые клетки более чувствительными к клеточным сигналам. Бородкина и ее коллеги надеются, что в дальнейших исследованиях ученые узнают реальный механизм их действия, что ускорит разработку лекарств для омоложения организма пациентов.
Бородкина и ее коллеги надеются, что в дальнейших исследованиях ученые узнают реальный механизм их действия, что ускорит разработку лекарств для омоложения организма пациентов.
пять многообещающих методов — Реальное время
Ученые поделились секретами долголетия
Как продлить жизнь — вопрос, который волновал человечество с давних времен. Но именно в последние годы в биологии старения произошла тихая научная революция. Об этом в своей статье для международного издания The Conversation пишут ученые Ричард Фарагер из Брайтонского университета и Линн Кокс из Оксфордского университета. «Реальное время» предлагает ознакомиться с переводом публикации.
Большинство людей хотят прожить долгую и счастливую жизнь или, по крайней мере, избежать короткой и несчастной жизни. Если вы в этом большинстве, то вам повезло. За последнее десятилетие в нашем понимании в биологии старения произошла тихая исследовательская революция.
За последнее десятилетие в нашем понимании в биологии старения произошла тихая исследовательская революция.
Задача состоит в том, чтобы превратить эти знания в советы и методы лечения, которые нам могут пригодиться. Сейчас мы развенчиваем миф о том, что увеличение продолжительности жизни — это научная фантастика, и показываем, что это научный факт.
Фото: pxfuel.com1. Питание и образ жизниСуществует множество доказательств преимущества таких рутинных занятий, как, например, правильное питание. Исследование таргет-групп среднестатистических людей показывает, что снижение веса, отказ от курения, умеренное употребление алкоголя и употребление не менее пяти порций фруктов и овощей в день могут увеличить продолжительность жизни на 7—14 лет по сравнению с теми, кто курит, слишком много пьет и имеет лишний вес.
Сокращение примерно на треть калорий — так называемое ограничение питания — улучшает здоровье и продлевает жизнь мышей и обезьян, если они едят правильные продукты, хотя это непростая задача для людей, постоянно подверженных пищевым соблазнам. Считается, что менее экстремальные варианты ограниченного по времени или прерывистого голодания, например только один прием пищи в течение восьмичасового дня каждый день или голодание в течение двух дней в неделю, уменьшают риск возрастных заболеваний.
Считается, что менее экстремальные варианты ограниченного по времени или прерывистого голодания, например только один прием пищи в течение восьмичасового дня каждый день или голодание в течение двух дней в неделю, уменьшают риск возрастных заболеваний.
Да, невозможно соблюсти вечную идеальную диету, но это не значит, что упражнения не принесут вам пользы. В глобальном понимании бездействие напрямую является причиной примерно 10 процентов всех преждевременных смертей от хронических заболеваний, таких как ишемическая болезнь сердца, диабет второго типа и различные виды рака. Если завтра все на Земле будут заниматься спортом, это, вероятно, приведет к увеличению продолжительности здоровой жизни человека почти на год.
Но сколько упражнений оптимально? Очень высокие уровни физической активности на самом деле вредны для вас, не только с точки зрения разрыва мышц или растяжения связок. Это может подавить иммунную систему и увеличить риск заболевания верхних дыхательных путей. Большинству людей достаточно чуть более 30 минут умеренной или высокой физической активности в день. Это не только делает вас сильнее и крепче, но даже улучшает настроение.
Большинству людей достаточно чуть более 30 минут умеренной или высокой физической активности в день. Это не только делает вас сильнее и крепче, но даже улучшает настроение.
В какой хорошей физической форме вы бы ни были и как бы хорошо вы ни питались, ваша иммунная система, к сожалению, станет менее эффективной по мере того, как вы станете старше. Плохая реакция на вакцинацию и неспособность бороться с инфекцией — последствия этого «иммунного старения». Все начинает ухудшаться в раннем взрослом возрасте, когда вилочковая железа — орган в горле в форме галстука-бабочки — начинает увядать.
Звучит это не очень, но вам становится еще более тревожно, когда вы понимаете, что именно иммунные агенты в вилочковой железе, называемые Т-клетками, больше не могут «учиться» бороться с инфекциями. Закрытие такого крупного «образовательного центра» для Т-клеток означает, что они не смогут научиться распознавать новые инфекции или эффективно бороться с раком у пожилых людей.
Вы можете им немного помочь, убедившись, что у вас в организме достаточно основных витаминов, особенно A и D. Многообещающая область исследований — изучение сигналов, которые тело посылает, чтобы помочь выработать больше иммунных клеток, особенно молекулы под названием IL-7. Возможно, вскоре мы сможем производить лекарства, содержащие эту молекулу, потенциально укрепляющую иммунную систему у пожилых людей. Другой подход заключается в использовании спермидина в качестве пищевой добавки, чтобы заставить иммунные клетки очищать свой внутренний мусор, такой как поврежденные белки, который настолько улучшает иммунную систему пожилых людей, что в настоящее время тестируется как способ получения лучших ответов на вакцины COVID-19 у пожилых людей.
Фото: cgon.rospotrebnadzor.ru4. Омоложение клеток Старение — это токсическое состояние, в которое клетки входят по мере того, как мы стареем, они сеют хаос по всему телу и порождают хронические воспаления и болезни, по сути вызывая биологическое старение. В 2009 году ученые доказали, что мыши среднего возраста жили дольше и оставались более здоровыми, если им давали небольшое количество препарата под названием рапамицин, который ингибирует ключевой белок под названием mTOR, помогающий регулировать реакцию клеток на питательные вещества, стресс, гормональные скачки и внешние повреждения.
В 2009 году ученые доказали, что мыши среднего возраста жили дольше и оставались более здоровыми, если им давали небольшое количество препарата под названием рапамицин, который ингибирует ключевой белок под названием mTOR, помогающий регулировать реакцию клеток на питательные вещества, стресс, гормональные скачки и внешние повреждения.
В лаборатории такие препараты, как рапамицин (называемые ингибиторами mTOR), заставляют стареющие клетки человека выглядеть и вести себя так же, как и молодые. Хоть еще и слишком рано назначать эти препараты для общего применения, недавно было начато новое клиническое испытание, чтобы проверить, действительно ли низкие дозы рапамицина могут замедлять старение у людей.
Обнаруженный в почве острова Пасхи, рапамицин несет в себе определенную загадочность и некогда был провозглашен в популярной прессе как возможный «эликсир молодости». Это уже помогло улучшить память мышей с заболеванием похожим на слабоумие.
Но у всех лекарств есть свои плюсы и минусы, а поскольку слишком большое количество рапамицина подавляет иммунную систему, многие врачи не хотят даже рассматривать его для предотвращения возрастных заболеваний. Однако именно доза имеет решающее значение, и новые препараты, такие как RTB101, которые действуют аналогично рапамицину, поддерживают иммунную систему у пожилых людей и даже могут снизить частоту и тяжесть заражения COVID-19.
Однако именно доза имеет решающее значение, и новые препараты, такие как RTB101, которые действуют аналогично рапамицину, поддерживают иммунную систему у пожилых людей и даже могут снизить частоту и тяжесть заражения COVID-19.
Полное избавление от стареющих клеток — еще один многообещающий путь вперед. Растущее число лабораторных исследований на мышах, на которых тестируются препараты для уничтожения стареющих клеток — так называемые «сенолитики», показывают общее улучшение здоровья, и, поскольку мыши не умирают от болезней, они в конечном итоге живут дольше.
Удаление стареющих клеток также помогает и людям. В небольшом клиническом исследовании люди с тяжелым фиброзом легких сообщили об улучшении общей их функции, в том числе о том, как далеко и быстро они могли ходить после лечения сенолитическими препаратами. Но это только верхушка айсберга. Диабет и ожирение, а также заражение некоторыми бактериями и вирусами могут привести к образованию большего количества стареющих клеток. Стареющие клетки также делают легкие более восприимчивыми к инфекции COVID-19, а он как раз и вызывает сильное старение большего количества клеток. Важно отметить, что избавление от стареющих клеток у старых мышей помогло им пережить инфекцию COVID-19.
Диабет и ожирение, а также заражение некоторыми бактериями и вирусами могут привести к образованию большего количества стареющих клеток. Стареющие клетки также делают легкие более восприимчивыми к инфекции COVID-19, а он как раз и вызывает сильное старение большего количества клеток. Важно отметить, что избавление от стареющих клеток у старых мышей помогло им пережить инфекцию COVID-19.
Старение и инфекции — двойной удар по человеческому организму. У пожилых людей увеличивается количество инфекционных заболеваний, поскольку их иммунная система замедляет защитные механизмы, в то время как инфекция ускоряет старение. Поскольку старение неразрывно связано как с хроническими, так и с инфекционными заболеваниями у пожилых людей, лечение старения, вероятно, улучшит их здоровье во всех отношениях.
Приятно то, что некоторые из этих новых методов лечения уже проходят клинические испытания и смогут скоро стать доступными для всех нас.
Ричард Фарагер, Линн Кокс, перевела Анна Николаева
ОбществоМедицинаКоличество старых клеток в жировой ткани диабетиков уменьшили за две недели
Биологи из клиники Майо опубликовали результаты третьего клинического испытания сенолитиков — препаратов, которые должны избирательно уничтожать старые клетки в тканях. Девять пациентов с диабетом и почечной недостаточностью принимали сенолитики в течение трех дней, а уже через 11 дней исследователи обнаружили, что старых клеток в их жировой ткани стало меньше. Это первое экспериментальное подтверждение того, что сенолитики выполняют свою непосредственную функцию у людей, пишут ученые в журнале EBioMedicine.
Девять пациентов с диабетом и почечной недостаточностью принимали сенолитики в течение трех дней, а уже через 11 дней исследователи обнаружили, что старых клеток в их жировой ткани стало меньше. Это первое экспериментальное подтверждение того, что сенолитики выполняют свою непосредственную функцию у людей, пишут ученые в журнале EBioMedicine.
Одной из причин возрастных патологий в организме человека считаются старые (или сенесцентные) клетки. Это группа клеток, которые не размножаются, не умирают, не выполняют отведенных им функций в ткани, но вызывают воспаление. Бороться с ними можно с помощью препаратов сенолитиков: они блокируют механизмы, с помощью которых сенесцентные клетки сопротивляются смерти.
Сенолитики уже хорошо проявили себя в экспериментах на мышах: с их помощью удалось уничтожить старые клетки в разных тканях, включая жировую и нервную, а также продлить жизнь животных на 36 процентов.
На людях же пока прошли только два клинических испытания. В январе 2019 года ученые из клиники Майо отчитались об успешном применении сенолитиков у пациентов с фиброзом легких: физическое состояние испытуемых улучшилось, хотя функции легких не восстановились. В июне 2019 года компания Unity Biotechnology рассказала об испытании сенолитиков у пациентов с остеоартритом: субъективные ощущения боли стали слабее, хотя физиологические показатели — например, концентрация провоспалительных веществ в крови — изменились несущественно.
В январе 2019 года ученые из клиники Майо отчитались об успешном применении сенолитиков у пациентов с фиброзом легких: физическое состояние испытуемых улучшилось, хотя функции легких не восстановились. В июне 2019 года компания Unity Biotechnology рассказала об испытании сенолитиков у пациентов с остеоартритом: субъективные ощущения боли стали слабее, хотя физиологические показатели — например, концентрация провоспалительных веществ в крови — изменились несущественно.
Сейчас группа исследователей из клиники Майо под руководством Джеймса Киркленда (James Kirkland) подвела промежуточные итоги третьего клинического испытания. Его участники — девять пациентов с хронической почечной недостаточностью, которая вызвана диабетом. По замыслу авторов эксперимента, два сенолитика — дазатиниб и кверцетин — должны улучшить функцию почек в долгосрочной перспективе.
Уже после первого курса препаратов (прием в течение трех дней) ученые решили проверить, есть ли изменения в тканях пациентов. Предыдущие клинические испытания оценивали только субъективные ощущения и качество работы органов, но не проверяли главное — уничтожают ли сенолитики свою непосредственную мишень. В этот раз исследователи взяли у пациентов не только плазму крови на анализ, но также и биопсию кожи и жировой ткани, где образуется особенно много сенесцентных клеток при ожирении и диабете.
Предыдущие клинические испытания оценивали только субъективные ощущения и качество работы органов, но не проверяли главное — уничтожают ли сенолитики свою непосредственную мишень. В этот раз исследователи взяли у пациентов не только плазму крови на анализ, но также и биопсию кожи и жировой ткани, где образуется особенно много сенесцентных клеток при ожирении и диабете.
Исследователи обнаружили, что через 11 дней после приема сенолитиков количество старых клеток уменьшилось. Их наличие определяли разными способами (через экспрессию характерных генов или окрашиванием специфичными маркерами) и в зависимости от метода оценки их количество в жировой ткани снизилось на 17-62 процента, и на 20-31 процент — в коже.
Сенесцентные клетки известны также своей способностью вызывать воспаление и привлекать иммунные клетки в ткань. Поэтому ученые измерили количество макрофагов в жировой ткани: по отношению к собственно жировым клеткам их стало на 28 процентов меньше, чем до приема сенолитиков. Снизилось и количество провоспалительных веществ, которые выделяют старые клетки в кровь.
Снизилось и количество провоспалительных веществ, которые выделяют старые клетки в кровь.
О долгосрочных последствиях приема сенолитиков при диабете пока ничего не известно. Тем не менее, уже на ранних стадиях видно, что эти препараты работают на клеточном уровне: это позволяет предположить, что успехи предыдущих клинических испытаний тоже непосредственно связаны с уничтожением старых клеток.
Сенолитики — одно из так называемых возможных «лекарств от старости»: как и все подобные средства, их приходится испытывать на людях с возрастными заболеваниями. Если они окажутся эффективны против конкретных болезней — остеоартрита, диабета или других — то дальше можно будет изучить, как они влияют на другие процессы старения в организме испытуемых. По этому принципу было устроено одно недавнее исследование: пациентам пытались восстановить работу тимуса (органа иммунной системы) с помощью комбинации препаратов, а в процессе оказалось, что их эпигенетический возраст стал меньше на несколько лет.
Источник: https://nplus1.ru
Сенолитические препараты: от открытия до воплощения
Сенолитики — это класс препаратов, которые избирательно уничтожают стареющие клетки (СК). Первые сенолитические препараты дазатиниб, кверцетин, физетин и навитоклакс были открыты с использованием подхода, основанного на гипотезах. СК накапливаются с возрастом и в очагах множественных хронических заболеваний, в том числе заболеваний, на долю которых приходится основная часть заболеваемости, смертности и расходов на здравоохранение. Наиболее вредные СК устойчивы к апоптозу и активируют антиапоптотические пути, которые защищают СК от их собственного секреторного фенотипа, ассоциированного с воспалительным старением (SASP), что позволяет им выживать, несмотря на уничтожение соседних клеток.Сенолитики временно отключают эти SCAP, вызывая апоптоз тех SC с тканеразрушающим SASP. Поскольку для повторного накопления SC требуются недели, сенолитики можно вводить с перерывами — подход «бей и беги». В доклинических моделях сенолитики задерживают, предотвращают или облегчают слабость, рак и сердечно-сосудистые, нервно-психические, заболевания печени, почек, опорно-двигательного аппарата, легких, глаз, гематологические, метаболические и кожные нарушения, а также осложнения трансплантации органов, лучевой терапии и лечения рака.Как и ожидалось для агентов, воздействующих на основные механизмы старения, которые являются «первопричиной» многих заболеваний, потенциальное использование сенолитиков многообразно, потенциально облегчая более 40 состояний в доклинических исследованиях, открывая новый путь для лечения возрастных дисфункций и заболеваний. Ранние пилотные испытания сенолитиков предполагают, что они уменьшают количество стареющих клеток, уменьшают воспаление и облегчают слабость у людей. Клинические испытания для лечения диабета, идиопатического легочного фиброза, болезни Альцгеймера, COVID-19, остеоартрита, остеопороза, глазных заболеваний и трансплантации костного мозга, а также детей, перенесших рак, продолжаются или начинаются.
В доклинических моделях сенолитики задерживают, предотвращают или облегчают слабость, рак и сердечно-сосудистые, нервно-психические, заболевания печени, почек, опорно-двигательного аппарата, легких, глаз, гематологические, метаболические и кожные нарушения, а также осложнения трансплантации органов, лучевой терапии и лечения рака.Как и ожидалось для агентов, воздействующих на основные механизмы старения, которые являются «первопричиной» многих заболеваний, потенциальное использование сенолитиков многообразно, потенциально облегчая более 40 состояний в доклинических исследованиях, открывая новый путь для лечения возрастных дисфункций и заболеваний. Ранние пилотные испытания сенолитиков предполагают, что они уменьшают количество стареющих клеток, уменьшают воспаление и облегчают слабость у людей. Клинические испытания для лечения диабета, идиопатического легочного фиброза, болезни Альцгеймера, COVID-19, остеоартрита, остеопороза, глазных заболеваний и трансплантации костного мозга, а также детей, перенесших рак, продолжаются или начинаются. Пока такие исследования не проведены, применять сенолитики вне клинических испытаний преждевременно.
Пока такие исследования не проведены, применять сенолитики вне клинических испытаний преждевременно.
Ключевые слова: дазатиниб; физетин; кверцетин; антиапоптотические пути стареющих клеток; сенолитики; унитарная теория фундаментальных процессов старения.
Границы | Оценка ценности использования сенолитиков и сеностатиков на основе нутрицевтиков при старении
Введение
Старение — это связанное со временем ухудшение физиологических функций, необходимых для выживания и фертильности (Gilbert, 2000).На клеточном уровне старение сопровождается накоплением клеток, которые принимают определенный фенотип, известный как старение, процесс, который сохраняется у разных видов. Старение в основном характеризуется необратимой остановкой клеточного цикла и секрецией группы факторов, известных как секреторный фенотип, ассоциированный со старением (SASP), при сохранении метаболической активности (Wiley and Campisi, 2016). Со временем стареющие клетки накапливаются во всех тканях и органах, способствуя их функциональному ухудшению (van Deursen, 2014).Постоянное прекращение клеточной пролиферации рассматривается как способ избежать неопластического роста, что означает, что в этом контексте старение можно рассматривать как механизм подавления опухоли (Dimri, 2005). Для остановки роста стареющие клетки увеличивают экспрессию ингибиторов циклинзависимых киназ (CDKI), таких как p21, p16 или p27 (Alcorta et al., 1996; Hernández-Segura et al., 2018).
Со временем стареющие клетки накапливаются во всех тканях и органах, способствуя их функциональному ухудшению (van Deursen, 2014).Постоянное прекращение клеточной пролиферации рассматривается как способ избежать неопластического роста, что означает, что в этом контексте старение можно рассматривать как механизм подавления опухоли (Dimri, 2005). Для остановки роста стареющие клетки увеличивают экспрессию ингибиторов циклинзависимых киназ (CDKI), таких как p21, p16 или p27 (Alcorta et al., 1996; Hernández-Segura et al., 2018).
SASP, который способен способствовать восстановлению и регенерации тканей, создает микроокружение, которое может стимулировать пролиферацию или даже старение соседних клеток, тем самым способствуя нарушению тканевого гомеостаза (Rodier and Campisi, 2011).Таким образом, с полезными свойствами в начале жизни и пагубными последствиями в более позднем возрасте феномен старения является примером так называемой антагонистической плейотропии (Rodier and Campisi, 2011; Giaimo and d’Adda di Fagagna, 2012).
Из-за общей недостаточной специфичности необходимо рассматривать и проверять одновременно несколько маркеров для идентификации стареющих клеток. Эти маркеры включают, помимо прочего, связанное со старением окрашивание бета-галактозидазой (SA-β-Gal), остановку клеточного цикла, морфологические и ядерные изменения и экспрессию определенных белков (Hooten and Evans, 2017).Важно дифференцировать стареющие клетки от покоящихся и терминально дифференцированных клеток, таких как нейроны, макрофаги и мышечные клетки (Rodier and Campisi, 2011). Покоящиеся клетки сохраняют способность повторно вступать в цикл роста при стимуляции ростовыми сигналами и являются ключом к регенерации тканей, поддерживая постоянное состояние сбалансированной пролиферации (Yao, 2014).
Причины клеточного старения
Репликативное старение
Hayflick и Moorhead впервые наблюдали старение в соматических клетках, серийно пассированных в культуре (Hayflick and Moorhead, 1961).Нормальные клетки претерпевают множественные митотические клеточные деления, в конечном итоге достигая предела, при котором их пролиферативные способности теряются. Сейчас это называется репликативным старением. Человеческие фибробласты, первоначально описанный тип клеток, имели предел около 50 пассажей. С тех пор другие формы старения были обнаружены и применены в моделях исследований in vitro и in vivo .
Сейчас это называется репликативным старением. Человеческие фибробласты, первоначально описанный тип клеток, имели предел около 50 пассажей. С тех пор другие формы старения были обнаружены и применены в моделях исследований in vitro и in vivo .
Большинство типов старения в значительной степени запускаются путями реакции на повреждение ДНК (DDR) (Fumagalli et al., 2014). DDR состоит из восходящих компонентов, таких как ATM (мутированная атаксия телеангиэктазии) и ATR (мутированная атаксия телеангиэктазии и Rad3), которые активируют белки контрольных точек клеточного цикла CHK1 и CHK2. В конце концов, циклинзависимые киназы (CDK) ингибируются, что приводит к остановке клеточного цикла (Jackson and Bartek, 2009). В стареющих клетках основными белками, участвующими в остановке пролиферации, являются CDKI p21 и p16. Обнаружено, что они сверхэкспрессированы и часто используются в качестве маркеров остановки клеточного цикла и старения.
При репликативном старении активация DDR запускается за счет укорочения теломер. Изменение содержания ДНК после потери длины теломер распознается как повреждение, приводящее к инициации ответа DDR (Serrano and Muñoz-Espín, 2014). Теломеры представляют собой комплексы, состоящие из белков и нуклеотидов повторов TTAGGG на концах эукариотических хромосом, которые считаются защитными структурами (Bernadotte et al., 2016). Когда клетка делится, хромосомы реплицируются, а длина теломер укорачивается с каждым клеточным делением.Увеличение количества фокусов, связанных с теломерами, наблюдается в связи со старением (Hewitt et al., 2012). Предполагается, что потеря длины теломер является биомаркером выбора при репликативном старении (Bernadotte et al., 2016). Следует отметить, что выбор образа жизни, такой как курение, диета, стресс и физические упражнения, может влиять на истощение теломер (Shammas, 2011). Истощение теломер происходит в клетках, в которых репрессирована экспрессия теломеразы, как в случае соматических клеток взрослого человека (Calado and Dumitriu, 2013).Напротив, мыши регулируют длину теломер и активность теломеразы иначе, чем люди, и поэтому по своей природе ограничены в исследованиях репликативного старения (Zhang et al.
Изменение содержания ДНК после потери длины теломер распознается как повреждение, приводящее к инициации ответа DDR (Serrano and Muñoz-Espín, 2014). Теломеры представляют собой комплексы, состоящие из белков и нуклеотидов повторов TTAGGG на концах эукариотических хромосом, которые считаются защитными структурами (Bernadotte et al., 2016). Когда клетка делится, хромосомы реплицируются, а длина теломер укорачивается с каждым клеточным делением.Увеличение количества фокусов, связанных с теломерами, наблюдается в связи со старением (Hewitt et al., 2012). Предполагается, что потеря длины теломер является биомаркером выбора при репликативном старении (Bernadotte et al., 2016). Следует отметить, что выбор образа жизни, такой как курение, диета, стресс и физические упражнения, может влиять на истощение теломер (Shammas, 2011). Истощение теломер происходит в клетках, в которых репрессирована экспрессия теломеразы, как в случае соматических клеток взрослого человека (Calado and Dumitriu, 2013).Напротив, мыши регулируют длину теломер и активность теломеразы иначе, чем люди, и поэтому по своей природе ограничены в исследованиях репликативного старения (Zhang et al. , 2016).
, 2016).
Преждевременное старение, вызванное стрессом (SIPS)
Одно- и двухцепочечные разрывы ДНК (вызванные воздействием радиации, гиперэкспрессией онкогенов, окислительным стрессом и т. д.) приводят к активации DDR и в конечном итоге могут привести к стресс-индуцированному преждевременному старению (SIPS), которое не зависит от длина теломер (Boothman and Suzuki, 2008). In vitro Модели SIPS были созданы с использованием окислительного стресса, ионизирующего излучения или агентов, вызывающих повреждение ДНК, таких как блеомицин (González-Hunt et al., 2018).
Было обнаружено, что сверхэкспрессия онкогена ras в клетках человека и грызунов вызывает фенотип, сходный с клеточным старением, что подтверждает тот факт, что старение является механизмом подавления опухоли. С тех пор было обнаружено, что другие онкогены также вызывают старение, в том числе; Raf, c-Myc, Akt и E2F3 (Серрано и др., 1997; Эстл и др., 2011; Цянь и Чен, 2012 г.; Ко и др., 2018).
Модели SIPS in vivo включают ускоренное старение мышей в результате дефектов генов. Например, мутации в гене LMNA у мышей могут приводить к возникновению синдрома прогерии Хатчинсона-Гилфорда, дефицит nfkb1 может приводить к раннему старению фенотипа у мышей среднего возраста, а у мышей с дефицитом белка WRN развивается синдром Вернера, болезнь преждевременного старения (Kõks et al., 2016).Недавние модели включают сингенную трансплантацию стареющих клеток мышам, приводящую к признакам физической дисфункции (Xu et al., 2018). Эти модели стали основой для исследований старения, особенно для тестирования потенциальных препаратов против старения.
ХАРАКТЕРИСТИКИ КЛЕТОЧНОГО СТАРЕНИЯ
Как показано ниже и показано на рисунке 1, стареющие клетки демонстрируют изменения в морфологии, увеличение количества определенных белков, связанных с клеточным циклом, ядерные изменения и присутствие SASP.
Рисунок 1. Характеристики клеточного старения. Стареющие клетки претерпевают множественные изменения: морфология становится более крупной и плоской, увеличивается экспрессия активности SA-β-Gal, теряется целостность ядерной мембраны, прекращается клеточная пролиферация и продукция SASP, включая повышенную экспрессию матриксных металлопротеаз (ММП). ), цитокины и хемокины.
Стареющие клетки претерпевают множественные изменения: морфология становится более крупной и плоской, увеличивается экспрессия активности SA-β-Gal, теряется целостность ядерной мембраны, прекращается клеточная пролиферация и продукция SASP, включая повышенную экспрессию матриксных металлопротеаз (ММП). ), цитокины и хемокины.
Морфология
Стареющие клетки в культуре имеют характерную морфологию, которая отличает их от пролиферирующих клеток (Dimri, 1995).В старости клетки становятся более плоскими, а ядро увеличивается. Причина этих морфологических изменений до конца не выяснена, но увеличение размера клеток может быть связано с процессом остановки клеточного цикла, когда дисбаланс соотношения ДНК: цитоплазма сам по себе может способствовать старению (Neurohr et al., 2019).
Активность SA-β-Gal
Цитоплазматический состав стареющих клеток также изменяется с увеличением лизосомальной активности SA-β-Gal. Считается, что этот фермент существует в клеточных лизосомах, которые, как известно, увеличиваются в размерах по мере старения клеток. Следовательно, можно ожидать высокой активности SA-β-Gal в стареющих клетках. Однако это не считается исключительным, так как его можно обнаружить и в других типах клеток нестареющей природы, а в некоторых случаях его нельзя установить при старении (Dimri, 1995; Lee et al., 2006; Huang and Rivera). -Перес, 2014).
Следовательно, можно ожидать высокой активности SA-β-Gal в стареющих клетках. Однако это не считается исключительным, так как его можно обнаружить и в других типах клеток нестареющей природы, а в некоторых случаях его нельзя установить при старении (Dimri, 1995; Lee et al., 2006; Huang and Rivera). -Перес, 2014).
Остановка клеточного цикла
Комплексы CDK/циклин необходимы для прохождения клеточного цикла. В стареющих клетках это взаимодействие между циклинами и CDK блокируется CDKI (Blagosklonny, 2011).Ген INK4A кодирует белок p16, который ингибирует комплекс Cyclin D/CDK4/6, чтобы остановить прогрессирование фазы G1 в фазу S (Jingwen et al., 2017). Его часто используют в качестве маркера стареющих клеток из-за его повышенного уровня экспрессии. Ген CDKN1A кодирует p21, который ингибирует комплексы Cyclin E/CDK2 и Cyclin B/CDK1 (Jingwen et al., 2017). Ингибитор также обычно используется в качестве маркера, но он менее специфичен, поскольку его можно активировать в других ситуациях (Hernandez-Segura et al. , 2018).
, 2018).
Ядерные изменения
В дополнение к увеличению размера ядра стареющие клетки имеют изменения в ядерной пластинке, которые влияют на стабильность ядра (Hernández-Segura et al., 2018). Ядерная пластинка состоит из ламиновых белков, которые представляют собой промежуточные филаменты типа V, и разбирается и собирается заново при каждом митотическом делении (Freund et al., 2012). Ламин B1 экспрессируется по-разному в престареющих и стареющих клетках: в различных первичных клеточных линиях фибробластов человека можно наблюдать снижение экспрессии белка и мРНК ламина B1, что предполагает его использование в качестве биомаркера стареющих клеток (Freund et al., 2012).
Изменения в структуре хроматина также проявляются в стареющих клетках. Гетерохроматин становится более заметным, с областями ядра, имеющими более плотные очаги, окрашенные DAPI (диамидинофенилиндол), которые были названы ассоциированными со старением гетерохроматиновыми очагами (SAHF) и могут быть вовлечены в замалчивание генов пролиферационных генов (Aird and Zhang, 2012). Эти SAHF также можно отличить по специфическим эпигенетическим маркерам, таким как h4K9me3, h4K27me3 и macroh3A, факультативный вариант гистона гетерохроматина (Parry and Narita, 2016).Паттерны метилирования ДНК также меняются в процессе старения с гипометилированием в гетерохроматиновых областях и фокальным гиперметилированием в ген-ассоциированных цитозин-гуаниновых островках (CGI) (Ciccarone et al., 2018). Модификации гистонов могут вызывать репрессию определенных генов, подавляя те, которые участвуют в развитии клеточного цикла.
Эти SAHF также можно отличить по специфическим эпигенетическим маркерам, таким как h4K9me3, h4K27me3 и macroh3A, факультативный вариант гистона гетерохроматина (Parry and Narita, 2016).Паттерны метилирования ДНК также меняются в процессе старения с гипометилированием в гетерохроматиновых областях и фокальным гиперметилированием в ген-ассоциированных цитозин-гуаниновых островках (CGI) (Ciccarone et al., 2018). Модификации гистонов могут вызывать репрессию определенных генов, подавляя те, которые участвуют в развитии клеточного цикла.
САСП
SASP состоит из набора молекул, секретируемых стареющими клетками, которые формируют микроокружение. Эти молекулы включают протеазы и факторы роста, хемокины и цитокины, такие как ИЛ-6, ИЛ-8 и ИЛ-1β (Borodkina et al., 2018). Интерлейкины принимают участие в активации сигнальных путей, таких как Jak/STAT, PI3K и MAPK (Garbers et al., 2013). Протеазы, такие как матриксные металлопротеазы (ММП) и сериновые протеазы, участвуют в развитии и регенерации внеклеточного матрикса. Ингибиторы этих белков и сигнальных молекул также секретируются стареющими клетками для регуляции их функций (Borodkina et al., 2018), поэтому общий эффект зависит от этого баланса. Хотя SASP способствует восстановлению и регенерации тканей и поощряет иммунный надзор, он также может быть вредным для здоровья.Например, за счет паракринной индукции эпителиально-мезенхимального перехода и привлечения иммуносупрессивных иммунных клеток он может способствовать онкогенезу и метастазированию при раке (González-Meljem et al., 2018).
Ингибиторы этих белков и сигнальных молекул также секретируются стареющими клетками для регуляции их функций (Borodkina et al., 2018), поэтому общий эффект зависит от этого баланса. Хотя SASP способствует восстановлению и регенерации тканей и поощряет иммунный надзор, он также может быть вредным для здоровья.Например, за счет паракринной индукции эпителиально-мезенхимального перехода и привлечения иммуносупрессивных иммунных клеток он может способствовать онкогенезу и метастазированию при раке (González-Meljem et al., 2018).
Химические подходы к регулированию накопления и активности стареющих клеток
Характеристика соединений, которые могут противодействовать процессу старения, недавно стала приоритетной задачей, учитывая их огромный терапевтический потенциал. Эти соединения против старения делятся на две категории: сенолитики и сеностатики.Сенолитики – это препараты, избирательно индуцирующие апоптоз стареющих клеток. Впервые они были обнаружены Zhu et al. (2015), в работе которых комбинация кверцетина и дазатиниба продемонстрировала потенциальную апоптотическую активность в отношении элиминации стареющих клеток (Zhu et al. , 2015). С другой стороны, сеностатики — это препараты, способные вмешиваться в процесс старения клеток или модулировать их активность за счет снижения образования SASP (Short et al., 2019).
, 2015). С другой стороны, сеностатики — это препараты, способные вмешиваться в процесс старения клеток или модулировать их активность за счет снижения образования SASP (Short et al., 2019).
Сенолитики могут подавлять антиапоптотические пути в стареющих клетках (Short et al., 2019). Одним из наиболее хорошо изученных сенолитиков является комбинация дазатиниба и кверцетина. Дазатиниб — признанный противораковый препарат, который при введении мышам вместе с кверцетином избирательно уничтожает стареющие клетки, что приводит к улучшению физической функции и увеличению выживаемости in vivo (Xu et al., 2018). Эта комбинация в настоящее время тестируется в рамках клинических испытаний для изучения ее потенциала у пациентов с идиопатическим легочным фиброзом, при этом предварительные результаты уже показывают улучшение сердечно-легочной функции (Justice et al., 2019). Многие соединения исследуются на предмет их потенциальных сенолитических свойств. Другие синтетические сенолитические препараты включают ингибитор BCL ABT-737, панобиностат, ингибиторы HSP90 или сердечные гликозиды (Yosef et al. , 2016; Fuhrmann-Stroissnigg et al., 2017; Samaraweera et al., 2017; Xu et al., 2018; Guerrero). и др., 2019; Триана-Мартинес и др., 2019).
, 2016; Fuhrmann-Stroissnigg et al., 2017; Samaraweera et al., 2017; Xu et al., 2018; Guerrero). и др., 2019; Триана-Мартинес и др., 2019).
Сеностатики могут работать, подавляя паракринную передачу сигналов или противодействуя эффектам SASP при старении (Short et al., 2019).Они также могут предотвращать появление стареющих клеток путем блокирования фундаментальных стадий эффекторных механизмов фенотипа, таких как активация пути p53 (Althubiti et al., 2016). Примеры сеностатиков, которые доказали свою эффективность на мышиных моделях, включают рапамицин и метформин (Short et al., 2019). Рапамицин — антибиотик природного происхождения с дополнительными противогрибковыми и иммунодепрессантными свойствами. Соединение макролида является ингибитором mTOR, замедляет прогрессирование старения и улучшает здоровье в моделях на животных (Blenis et al., 2014; Ван и др., 2017). Метформин, первоначально полученный из Galega officinalis , также известного как Goat’s Rue (Bailey, 2017), является хорошо зарекомендовавшим себя противодиабетическим препаратом, который, как ранее было показано, ингибирует SASP, вмешиваясь в путь NFκB (Moiseeva et al. , 2013).
, 2013).
Сенолитики и сеностатики на основе нутрицевтиков
Синтетические соединения с сенолитическими или сеностатическими свойствами могут быть эффективными, однако они неспецифичны, а системные побочные эффекты могут быть серьезными и вредными для здоровых клеток (Malavolta et al., 2018). Следовательно, началось движение к исследованиям соединений на природной основе (нутрицевтиков) с потенциальными свойствами против старения. Нутрицевтики представляют собой биологически активные соединения, получаемые из пищи, в том числе из растительного сырья, с физиологическими преимуществами в профилактике или лечении заболеваний (Rafieian-Kopaei et al., 2014). Например, полифенолы, обнаруженные в большом количестве в растениях, являются биологически активными соединениями с антиоксидантными и противовоспалительными свойствами, что делает их потенциальными сеностатиками, блокируя прооксидантную и провоспалительную сигнализацию стареющих клеток (Gurău et al., 2018). Цель по-прежнему заключается в том, чтобы найти потенциальную омолаживающую терапию, которая эффективна, но имеет минимальные побочные эффекты, и некоторые натуральные растительные соединения могут соответствовать этому критерию. Ниже мы обсудим изученные примеры нутрицевтиков, которые могут действовать как сенолитики или сеностатики, как показано на рисунке 2.
Ниже мы обсудим изученные примеры нутрицевтиков, которые могут действовать как сенолитики или сеностатики, как показано на рисунке 2.
Оливковые фенолы
Оливковое масло содержит большое количество фенольных соединений, которые проявляют потенциальные полезные свойства в отношении здоровья сердца, защиты от рака и противомикробного действия (Tuck and Hayball, 2002; Markovic et al., 2019). In vitro , два фенола оливы, называемые гидрокситирозол (HT) и олеуропеин агликон (OLE), противодействуют старению за счет значительного снижения окрашивания SA-β-Gal, уровней p16 и уровней SASP в предстареющих фибробластах легких человека (MRC5). и неонатальные дермальные фибробласты человека (Menicacci et al., 2017). ГТ также была исследована в модели индуцированного УФА старения в дермальных фибробластах человека (HDF), и после лечения наблюдалось значительное снижение позитивности SA-β-Gal и уровней экспрессии мРНК для генов, связанных с SASP (Jeon and Choi, 2018).
OLE уменьшает окислительный стресс и ингибирует mTOR, который является ключевым модулятором старения (Johnson et al. , 2013; Sun et al., 2017). Однако пока нет данных о потенциальном влиянии OLE на старение организма. В процессе старения происходит накопление неправильно свернутых и поврежденных белков, которые расщепляются и удаляются за счет активности протеасом (Sáez and Vílchez, 2014). Было показано, что OLE улучшает активность протеасом, тем самым замедляя старение фибробластов человека.Кроме того, было показано, что непрерывная обработка OLE эмбриональных фибробластов человека на раннем пассаже снижает уровни АФК, сдерживает прогрессирование фенотипа старения за счет ослабления изменений в морфологии, наблюдаемых при старении, и снижает смертность клеток (Katsiki et al., 2007; Giovannelli, 2012). ; Меникаччи и др., 2017).
, 2013; Sun et al., 2017). Однако пока нет данных о потенциальном влиянии OLE на старение организма. В процессе старения происходит накопление неправильно свернутых и поврежденных белков, которые расщепляются и удаляются за счет активности протеасом (Sáez and Vílchez, 2014). Было показано, что OLE улучшает активность протеасом, тем самым замедляя старение фибробластов человека.Кроме того, было показано, что непрерывная обработка OLE эмбриональных фибробластов человека на раннем пассаже снижает уровни АФК, сдерживает прогрессирование фенотипа старения за счет ослабления изменений в морфологии, наблюдаемых при старении, и снижает смертность клеток (Katsiki et al., 2007; Giovannelli, 2012). ; Меникаччи и др., 2017).
Катехины зеленого чая
Катехин — это танин, содержащийся в зеленом чае, обладающий высокими антиоксидантными свойствами. Как полифенол, он существует в нескольких формах, включая галлат эпигаллокатехина (EGCG), который в изобилии содержится в чайных листьях (Unno, 2016). Исследование влияния EGCG на репликативное старение первичных клеток (гладкомышечные клетки сосудов крысы, HDF (дермальные фибробласты человека) и суставные хондроциты человека) показало потенциальное сеностатическое действие нутрицевтика (Han et al., 2012). Окрашивание SA-β-Gal клеток HDF, обработанных EGCG, на ранних и поздних пассажах показало меньше положительных клеток в обработанных, чем в контроле (Han et al., 2012). Кроме того, было показано, что p53 значительно снижен в клетках, обработанных EGCG (Han et al., 2012). Однако анализ клеточного цикла HDF с обработкой EGCG и без нее показал, что обработанные клетки имели такой же процент клеток в S-фазе, как и контрольные клетки.
Исследование влияния EGCG на репликативное старение первичных клеток (гладкомышечные клетки сосудов крысы, HDF (дермальные фибробласты человека) и суставные хондроциты человека) показало потенциальное сеностатическое действие нутрицевтика (Han et al., 2012). Окрашивание SA-β-Gal клеток HDF, обработанных EGCG, на ранних и поздних пассажах показало меньше положительных клеток в обработанных, чем в контроле (Han et al., 2012). Кроме того, было показано, что p53 значительно снижен в клетках, обработанных EGCG (Han et al., 2012). Однако анализ клеточного цикла HDF с обработкой EGCG и без нее показал, что обработанные клетки имели такой же процент клеток в S-фазе, как и контрольные клетки.
EGCG подавляет преждевременное старение в преадипоцитах, при этом обработанные клетки демонстрируют значительное подавление ROS, SASP и опосредованную p53 остановку клеточного цикла в дополнение к подавлению антиапоптотического белка BCL-2 и увеличению гибели клеток (Kumar и др. , 2018). Это говорит о том, что EGCG может обладать сенолитическими свойствами.
, 2018). Это говорит о том, что EGCG может обладать сенолитическими свойствами.
Влияние катехинов зеленого чая на старение было изучено с использованием модели мышей с ускоренным старением (SAMP 10 ), которые демонстрируют короткую продолжительность жизни, церебральную атрофию и когнитивную дисфункцию (Unno et al., 2006). В возрасте от 1 до 15 месяцев мышам давали 35 мг/кг/день катехинов зеленого чая. Анализ крови и ткани головного мозга выявил снижение окислительного повреждения ДНК у мышей, которых кормили катехином, наряду с более высоким сохранением памяти (Unno et al., 2006). Исследование, изучающее влияние EGCG на здоровых крысах, показало среднее увеличение продолжительности жизни на 8–12 недель по сравнению с контрольной группой.В группе, получавшей EGCG, наблюдалось значительное снижение уровней IL-6 и ROS в печени и почках, оба из которых, как известно, активируются с возрастом (Niu et al., 2013). Это показывает потенциальные полезные системные эффекты EGCG в различных органах.
Тем не менее, была проведена интервенционная программа тестирования, в рамках которой экстракт зеленого чая вводили генетически гетерогенной мышиной модели с раннего возраста. Результаты не показали значительных изменений продолжительности жизни (Strong et al., 2012). Хотя ограниченное исследование EGCG в связи со старением не позволяет сделать определенные выводы, он широко используется в качестве косметического средства из-за его потенциального защитного действия на кожу. 2018) и выпускается в виде таблеток экстракта зеленого чая.
Фисетин
Физетин представляет собой биологически активную молекулу флавонола, которая содержится во фруктах и овощах, таких как огурцы, яблоки, виноград и лук, причем самая высокая концентрация содержится в клубнике (Khan et al., 2013). Он обладает антиоксидантными, апоптотическими и антипролиферативными свойствами (Khan et al., 2013). Применение 5 мкМ физетина в течение 48 часов приводило к значительному снижению позитивности SA-β-Gal в индуцированных окислительным стрессом стареющих мышиных эмбриональных фибробластах (Yousefzadeh et al.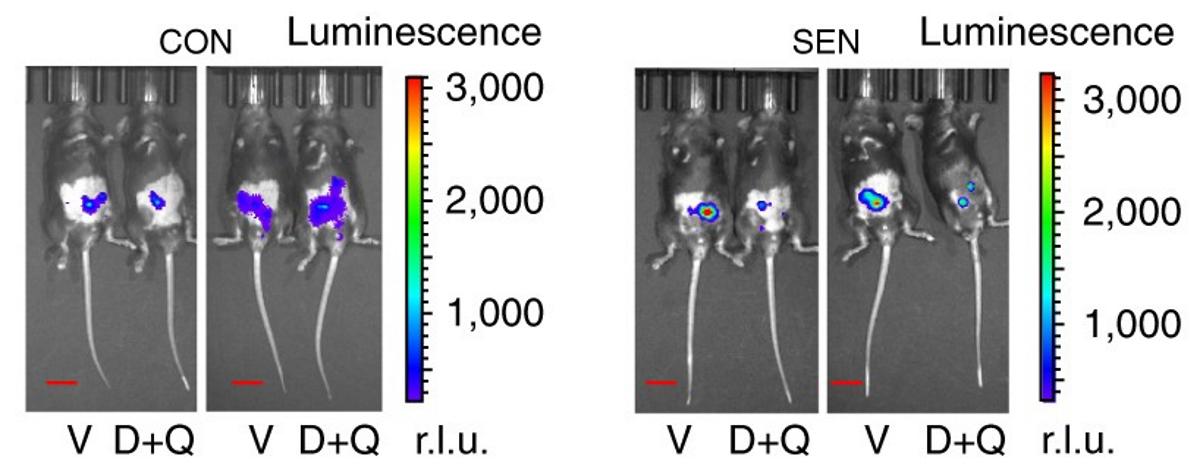 , 2018b). Прогероид Ercc1 –/Δ и старые мыши дикого типа, получавшие диету с добавлением физетина в течение двух 14-дневных периодов в течение 14 недель в концентрации 60 мг/кг/день, значительно снизили экспрессию p16 в жировой ткани, в дополнение к уменьшению САСП.У мышей линии естественного возраста C57BL/6, которым в возрасте 22–24 месяцев перорально вводили 100 мг/кг физетина в течение 5 дней, наблюдалось снижение стареющих клеток в белой жировой ткани (Yousefzadeh et al., 2018b). Этот результат был воспроизведен в эксплантатах жировой ткани человека, которые были обработаны физетином и культивированы ex vivo , что показало снижение активности маркеров SASP, IL-6, IL-8, MCP-1 и SA-β-Gal (Yousefzadeh et al. и др., 2018б). Кроме того, лечение физетином в возрасте 85 недель значительно увеличило продолжительность жизни этих мышей еще на 3 месяца.
, 2018b). Прогероид Ercc1 –/Δ и старые мыши дикого типа, получавшие диету с добавлением физетина в течение двух 14-дневных периодов в течение 14 недель в концентрации 60 мг/кг/день, значительно снизили экспрессию p16 в жировой ткани, в дополнение к уменьшению САСП.У мышей линии естественного возраста C57BL/6, которым в возрасте 22–24 месяцев перорально вводили 100 мг/кг физетина в течение 5 дней, наблюдалось снижение стареющих клеток в белой жировой ткани (Yousefzadeh et al., 2018b). Этот результат был воспроизведен в эксплантатах жировой ткани человека, которые были обработаны физетином и культивированы ex vivo , что показало снижение активности маркеров SASP, IL-6, IL-8, MCP-1 и SA-β-Gal (Yousefzadeh et al. и др., 2018б). Кроме того, лечение физетином в возрасте 85 недель значительно увеличило продолжительность жизни этих мышей еще на 3 месяца.
Это исследование положило начало клиническому испытанию Fisetin по облегчению слабости, воспалений и связанных с ними мер у пожилых людей (AFFIRM-LITE). В настоящее время на этапе набора в исследование надеются набрать 40 участников в возрасте от 70 до 90 лет, которые будут принимать перорально 2-дневную дозу плацебо или физетина в дозе 20 мг/кг/день с акцентом на анализе маркеров слабости, воспаления, резистентность к инсулину и костный метаболизм (Clinicaltrials.gov, 2019a).
В настоящее время на этапе набора в исследование надеются набрать 40 участников в возрасте от 70 до 90 лет, которые будут принимать перорально 2-дневную дозу плацебо или физетина в дозе 20 мг/кг/день с акцентом на анализе маркеров слабости, воспаления, резистентность к инсулину и костный метаболизм (Clinicaltrials.gov, 2019a).
Ресвератрол
Ресвератрол представляет собой полифенол стильбена, обычно встречающийся в пигментированных фруктах и овощах, таких как виноград и ягоды (Risuleo, 2016; Salehi et al., 2018). Биологическая активность ресвератрола включает противоопухолевую, фитоэстрогенную, антиоксидантную и противовирусную активность (Risuleo, 2016). При старении ресвератрол исследовали на предмет его воздействия на человеческие фибробласты WI-38 и клетки HT-1080 с индуцируемым эктопическим p21. При применении ресвератрола в концентрации 50 мкМ стареющая морфология обоих типов клеток, основанных на модели SIPS, была предотвращена, что свидетельствует о сеностатическом эффекте. Более того, при этих концентрациях количество клеток увеличилось в 2 раза, что свидетельствует о том, что ресвератрол помогает преодолеть остановку клеточного цикла.Следует отметить, что полифенол оказался цитотоксичным только в концентрациях более 200 мкМ (Демиденко, Благосклонный, 2009).
Более того, при этих концентрациях количество клеток увеличилось в 2 раза, что свидетельствует о том, что ресвератрол помогает преодолеть остановку клеточного цикла.Следует отметить, что полифенол оказался цитотоксичным только в концентрациях более 200 мкМ (Демиденко, Благосклонный, 2009).
Обработка ресвератролом эндотелиальных клеток-предшественников (EPC) также показала предотвращение репликативного старения с уменьшением положительного окрашивания SA-β-Gal по сравнению с контролем (Xia et al., 2009). Лечение также продемонстрировало увеличение пролиферативной и миграционной способности ЭПК наряду с дозозависимым увеличением активности теломеразы, что еще больше подчеркивает потенциальные эффекты ресвератрола против старения.Это увеличение активности теломеразы было связано с активацией пути PI3K-AKT, который, как было показано, фосфорилируется в зависимости от дозы ресвератрола (Xia et al., 2009).
Более того, когда параллельно с лечением рапамицином проводилось крупномасштабное исследование in vivo ресвератрола на генетически гетерогенных (беспородных) мышах, анализ активности показал, что не было существенной разницы между контрольной группой и мышами, получавшими ресвератрол. Однако у мышей, получавших рапамицин, медианная выживаемость у самцов и самок увеличилась на 10% и 18% соответственно (Miller et al., 2010). В исследовании подчеркивается минимальное влияние ресвератрола на общую выживаемость in vivo , даже если исследования in vitro предполагали потенциальные антистареющие свойства. В соответствии с этим исследования in vivo в рамках Interventions Testing Program, в которых изучалось влияние введения ресвератрола на генетически гетерогенную модель мыши с раннего возраста, не показали значительных положительных или отрицательных эффектов на продолжительность жизни (Strong et al., 2012). ).
Однако у мышей, получавших рапамицин, медианная выживаемость у самцов и самок увеличилась на 10% и 18% соответственно (Miller et al., 2010). В исследовании подчеркивается минимальное влияние ресвератрола на общую выживаемость in vivo , даже если исследования in vitro предполагали потенциальные антистареющие свойства. В соответствии с этим исследования in vivo в рамках Interventions Testing Program, в которых изучалось влияние введения ресвератрола на генетически гетерогенную модель мыши с раннего возраста, не показали значительных положительных или отрицательных эффектов на продолжительность жизни (Strong et al., 2012). ).
Тем не менее, клинические испытания с применением ресвератрола у пожилых пациентов продолжаются, участники принимают плацебо, 1000 мг или 1500 мг в день в форме капсул.В исследовании будут рассмотрены митохондриальные и физические функции с упором на эффекты в мышцах. Показатели результатов включают уровни митохондриальных ферментов, скорость ходьбы, уровень глюкозы в крови, артериальное давление, уровни белка AMPK и устойчивость к мышечной усталости (REVIVE – Clinicaltrials. gov, 2019b). Несмотря на то, что исследования и исследования ресвератрола все еще проводятся, он также широко доступен в виде таблеток и содержится во многих косметических средствах на основе антивозрастных средств.
gov, 2019b). Несмотря на то, что исследования и исследования ресвератрола все еще проводятся, он также широко доступен в виде таблеток и содержится во многих косметических средствах на основе антивозрастных средств.
Заключение: впереди долгий путь
В связи с увеличением ожидаемой продолжительности жизни и ростом гериатрической популяции с хроническими заболеваниями лечение пожилых людей должно быть сосредоточено на предотвращении дисфункции тканей и поддержании лучшего качества жизни в течение более длительного времени, что известно как увеличение продолжительности жизни.В последнее десятилетие в области старения появились сенолитические методы лечения, которые интенсивно исследуются в рамках исследований in vivo и, в последнее время, переходят к клиническим испытаниям. В настоящее время универсальный стандарт исследования старения не признан. Различные группы смогли создать модели in vitro , используя несколько индукторов, чтобы вызвать повреждение ДНК. Все исследования должны быть направлены на тестирование нутрицевтиков сначала на модели in vitro , предпочтительно на клетках, полученных от человека, которые вступили в репликативное старение в результате многократного пассирования.Однако при таком способе подготовки клеток потребуется много времени, чтобы достичь старения, и будет получено только конечное количество клеток для тестирования. В качестве альтернативы, использование модели репликативного старения мышей in vitro более осуществимо, поскольку клетки перестают пролиферировать после 5–6 пассажей (Khan and Gasser, 2016). Затем можно было бы применить сенолитики или сеностатики in vivo с использованием старых мышей дикого типа. Несмотря на это, существует несколько моделей мышей для тестирования применения сенолитиков и сеностатиков, таких как мыши-прогероиды, которые имитируют человеческий синдром, известный как прогерия.Мыши естественным образом достигают полного срока в течение 6 месяцев и могут происходить от штаммов BubR1 H/H , Zmpste24 –/– , Sod1 –/– или Ercc –/ Δ (Yousefzadeh et al.
Все исследования должны быть направлены на тестирование нутрицевтиков сначала на модели in vitro , предпочтительно на клетках, полученных от человека, которые вступили в репликативное старение в результате многократного пассирования.Однако при таком способе подготовки клеток потребуется много времени, чтобы достичь старения, и будет получено только конечное количество клеток для тестирования. В качестве альтернативы, использование модели репликативного старения мышей in vitro более осуществимо, поскольку клетки перестают пролиферировать после 5–6 пассажей (Khan and Gasser, 2016). Затем можно было бы применить сенолитики или сеностатики in vivo с использованием старых мышей дикого типа. Несмотря на это, существует несколько моделей мышей для тестирования применения сенолитиков и сеностатиков, таких как мыши-прогероиды, которые имитируют человеческий синдром, известный как прогерия.Мыши естественным образом достигают полного срока в течение 6 месяцев и могут происходить от штаммов BubR1 H/H , Zmpste24 –/– , Sod1 –/– или Ercc –/ Δ (Yousefzadeh et al.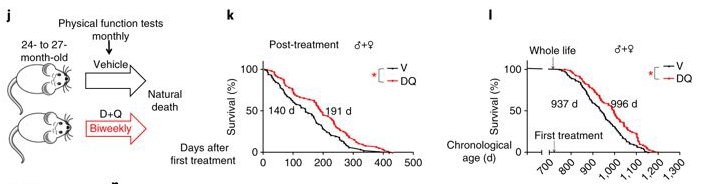 , 2018a).
, 2018a).
можно использовать в качестве профилактического средства у пожилых людей, как добавку для очищения стареющих клеток, чтобы таким образом улучшить или сохранить здоровье тканей и органов. Их также рассматривают в качестве адъювантной терапии рака с целью очистки вызванных лечением сенесцентных клеток и, таким образом, снижения вероятности рецидива (Tabasso et al., 2019). Они также исследуются в области биологии теломер. Теломераза способна обращать вспять эрозию теломер, и на нее нацелены активаторы теломеразы растительного происхождения в мононуклеарных клетках периферической крови (Tsoukalas et al., 2019). Было показано, что TA-65, производное Astragalus membranaceus , удлиняет теломеразу на модели мышей с дефицитом теломер (de Jesus et al., 2011).
Недавние исследования доказывают патогенную роль стареющих клеток, которые могут способствовать ряду связанных со старением заболеваний, таких как остеоартрит (Jeon et al., 2018), сердечно-сосудистых заболеваний (Childs et al. , 2018) и катаракты (Fu et al., 2016). Стареющие клетки обнаруживаются при снижении когнитивных функций, связанном со старением, а также при нейродегенеративных заболеваниях, таких как болезнь Альцгеймера и болезнь Паркинсона (Baker and Petersen, 2018), которые обычно выявляются клинически и дополнительно охарактеризованы с помощью визуализации или вскрытия. Поэтому возможное применение сенолитиков в широком диапазоне клинических сценариев становится привлекательной концепцией (Paez-Ribes et al., 2019).
, 2018) и катаракты (Fu et al., 2016). Стареющие клетки обнаруживаются при снижении когнитивных функций, связанном со старением, а также при нейродегенеративных заболеваниях, таких как болезнь Альцгеймера и болезнь Паркинсона (Baker and Petersen, 2018), которые обычно выявляются клинически и дополнительно охарактеризованы с помощью визуализации или вскрытия. Поэтому возможное применение сенолитиков в широком диапазоне клинических сценариев становится привлекательной концепцией (Paez-Ribes et al., 2019).
Однако для того, чтобы сенолитики широко применялись в пожилом, но в остальном здоровом населении для предотвращения дисфункции тканей, нежелательные побочные эффекты должны быть сведены к минимуму. Использование сенолитиков на основе нутрицевтиков может привести к меньшему количеству осложнений, сохраняя при этом эффекты против старения. Несмотря на многообещающие отчеты in vitro , данные об эффективности нутрицевтических сенолитиков in vivo все еще немногочисленны и, в некоторых случаях, противоречивы. Таким образом, все еще необходимы дополнительные исследования, чтобы определить, могут ли они быть привлекательной альтернативой наиболее часто используемым химическим сенолитикам, таким как дазатиниб + кверцетин, которые показали многообещающие результаты в предварительных краткосрочных клинических испытаниях (Hickson et al., 2019).
Таким образом, все еще необходимы дополнительные исследования, чтобы определить, могут ли они быть привлекательной альтернативой наиболее часто используемым химическим сенолитикам, таким как дазатиниб + кверцетин, которые показали многообещающие результаты в предварительных краткосрочных клинических испытаниях (Hickson et al., 2019).
Также следует учитывать, что эта терапевтическая область является новой, и использование нутрицевтиков в качестве сенолитиков также может иметь свои недостатки. Необходимо тщательно изучить потенциальную токсичность соединений и их неблагоприятное взаимодействие с существующими методами лечения других проблем со здоровьем. Из-за этого вызывает беспокойство то, что некоторые из этих соединений стали известны широкой публике без надлежащей проверки или полных исследований безопасности. При общении с ними следует проявлять осторожность.Возможно, следует отказаться от использования нутрицевтических сенолитиков в качестве безвредных добавок до тех пор, пока не будет получено больше информации.
Вклад авторов
AK исследовал и составил рукопись. CS обсудил данные. CS и SM отредактировали рукопись.
Финансирование
AK получает финансируемую стипендию в рамках программы MIBTP (Midlands Integrative Biosciences Training Partnership), финансируемой BBSRC (Совет по исследованиям в области биотехнологии и биологических наук).
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Каталожные номера
Алькорта, Д., Сюн, Ю., Фелпс, Д., Хэннон, Г., Бич, Д., и Барретт, Дж. (1996). Участие ингибитора циклинзависимой киназы p16 (INK4a) в репликативном старении нормальных фибробластов человека. Проц. Натл. акад. науч. НАС.А. 93, 13742–13747. doi: 10.1073/pnas.93.24.13742
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Альтубити, М. , Рада, М., Самуэль, Дж., Эскорса, Дж., Наджиб, Х., Ли, К., и др. (2016). BTK модулирует активность p53 для усиления апоптотических и старческих реакций. Рак Res. 76, 5405–5414. doi: 10.1158/0008-5472.CAN-16-0690
, Рада, М., Самуэль, Дж., Эскорса, Дж., Наджиб, Х., Ли, К., и др. (2016). BTK модулирует активность p53 для усиления апоптотических и старческих реакций. Рак Res. 76, 5405–5414. doi: 10.1158/0008-5472.CAN-16-0690
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Эстл, М., Ханнан, К., Нг, П., Ли, Р., Джордж, А., Хсу, А., и соавт. (2011). AKT индуцирует старение клеток человека через mTORC1 и p53 в отсутствие повреждения ДНК: последствия для нацеливания на mTOR при злокачественных новообразованиях. Онкоген 31, 1949–1962. doi: 10.1038/onc.2011.394
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Бейкер, Д. Дж., и Петерсен, Р. К. (2018). Клеточное старение при старении мозга и нейродегенеративных заболеваниях: данные и перспективы. Дж. Клин. расследование 128, 1208–1216. дои: 10.1172/ДЖКИ95145
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Бернадот А. , Михельсон В. и Спивак И. (2016). Маркеры клеточного старения. Укорочение теломер как маркер клеточного старения. Старение 8, 3–11. doi: 10.18632/aging.100871
, Михельсон В. и Спивак И. (2016). Маркеры клеточного старения. Укорочение теломер как маркер клеточного старения. Старение 8, 3–11. doi: 10.18632/aging.100871
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Бородкина А.В., Дерябин П.И., Глукова А.А., Никольский Н.Н. (2018). «Социальная жизнь» стареющих клеток: что такое SASP и зачем ее изучать? Acta Nat. 10, 4–14. дои: 10.32607/20758251-2018-10-1-4-14
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Чиккароне Ф., Тальятеста С., Кайафа П. и Зампиери М. (2018). Динамика метилирования ДНК при старении: насколько мы далеки от понимания механизмов? Мех. Возраст. Дев. 174, 3–17. doi: 10.1016/j.mad.2017.12.002
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
де Хесус Б., Шнеебергер К., Вера Э., Техера А., Харли, К., и Бласко, М. (2011). Активатор теломеразы ТА-65 удлиняет короткие теломеры и увеличивает продолжительность жизни взрослых/старых мышей без увеличения заболеваемости раком. Ячейка старения 10, 604–621. doi: 10.1111/j.1474-9726.2011.00700.x
Ячейка старения 10, 604–621. doi: 10.1111/j.1474-9726.2011.00700.x
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Демиденко З.Н. и Благосклонный М.В. (2009). В концентрациях, которые ингибируют mTOR, ресвератрол способствует клеточному старению. Клеточный цикл 8, 1901–1904.doi: 10.4161/cc.8.12.8810
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Fu, Q., Qin, Z., Yu, J., Yu, Y., Tang, Q., Lyu, D., et al. (2016). Влияние стареющих эпителиальных клеток хрусталика на тяжесть возрастной кортикальной катаракты у людей. Медицина 95:3869. doi: 10.1097/MD.0000000000003869
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Фурманн-Стройснигг, Х., Линг, Ю., Чжао, Дж., Макгоуэн, С., Чжу, Ю., Брукс, Р., и другие. (2017). Идентификация ингибиторов HSP90 как нового класса сенолитиков. Нац. коммун. 8:422. doi: 10.1038/s41467-017-00314-z
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Фумагалли, М. , Россиелло, Ф., Монделло, К., и д’Адда ди Фаганья, Ф. (2014). Стабильное клеточное старение связано с постоянной активацией DDR. PLoS One 9:110969. doi: 10.1371/journal.pone.0110969
, Россиелло, Ф., Монделло, К., и д’Адда ди Фаганья, Ф. (2014). Стабильное клеточное старение связано с постоянной активацией DDR. PLoS One 9:110969. doi: 10.1371/journal.pone.0110969
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Гарберс, К., Kuck, F., Aparicio-Siegmund, S., Konzak, K., Kessenbrock, M., Sommerfeld, A., et al. (2013). Клеточное старение или передача сигналов EGFR индуцирует экспрессию рецептора интерлейкина 6 (IL-6), контролируемую мишенью рапамицина млекопитающих (mTOR). Клеточный цикл 12, 3421–3432. doi: 10.4161/cc.26431
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Гилберт, С. Ф. (2000). «Биология развития», в Aging: The Biology of Senescence , 6th Edn, eds TJ Mauch and G.К. Шенвольф (Сандерленд, Массачусетс: Sinauer Associates).
Академия Google
Джованнелли, Л. (2012). Благотворное влияние фенолов оливкового масла на процесс старения: экспериментальные данные и возможные механизмы действия. Нутр. Старение 1, 207–223. doi: 10.3233/nua-130016
Нутр. Старение 1, 207–223. doi: 10.3233/nua-130016
Полнотекстовая перекрестная ссылка | Академия Google
Гонсалес-Хант, К., Вадхва, М., и Сандерс, Л. (2018). Повреждение ДНК окислительным стрессом: стратегии измерения для двух геномов. Курс.мнение Токсикол. 7, 87–94. doi: 10.1016/j.cotox.2017.11.001
Полнотекстовая перекрестная ссылка | Академия Google
Гонсалес-Мельем, Дж., Ас, Дж., Фрейзер, Х., и Мартинес-Барбера, Дж. (2018). Паракринные роли клеточного старения в стимуляции онкогенеза. Бр. Дж. Рак 118, 1283–1288. doi: 10.1038/s41416-018-0066-1
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Герреро, А., Эрранц, Н., Сан, Б., Вагнер, В., Галлаж, С., Гихо, Р., и другие. (2019). Сердечные гликозиды являются сенолитиками широкого спектра действия. Нац. Метаб. 1, 1074–1088. doi: 10.1038/s42255-019-0122-z
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Гурэу Ф. , Бальдони С., Праттичиццо Ф., Эспиноза Э., Амента Ф., Прокопио А. и др. (2018). Соединения против старения: потенциальный нутрицевтический подход к здоровому старению. Сопротивление старению. Ред. 46, 14–31. doi: 10.1016/j.arr.2018.05.001
, Бальдони С., Праттичиццо Ф., Эспиноза Э., Амента Ф., Прокопио А. и др. (2018). Соединения против старения: потенциальный нутрицевтический подход к здоровому старению. Сопротивление старению. Ред. 46, 14–31. doi: 10.1016/j.arr.2018.05.001
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Хан, Д.В., Ли, М.Х., Ким, Б., Ли, Дж.Дж., Хён, С.Х., и Парл, Дж.К. (2012). Профилактические эффекты эпигаллокатехин-3-О-галлата против репликативного старения, связанного с ацетилированием p53 в дермальных фибробластах человека. Оксид. Мед. Клетка. Лонгев. 2012:850684.
Академия Google
Хейфлик, Л., и Мурхед, П. (1961). Серийное культивирование штаммов диплоидных клеток человека. Экспл. Сотовый рез. 25, 585–621. дои: 10.1016/0014-4827(61)
-6
Полнотекстовая перекрестная ссылка | Академия Google
Хьюитт, Г., Юрк Д., Маркес Ф., Коррейя-Мело К., Харди Т., Гаковска А. и соавт. (2012). Теломеры являются излюбленными мишенями стойкой реакции на повреждение ДНК при старении и стресс-индуцированном старении.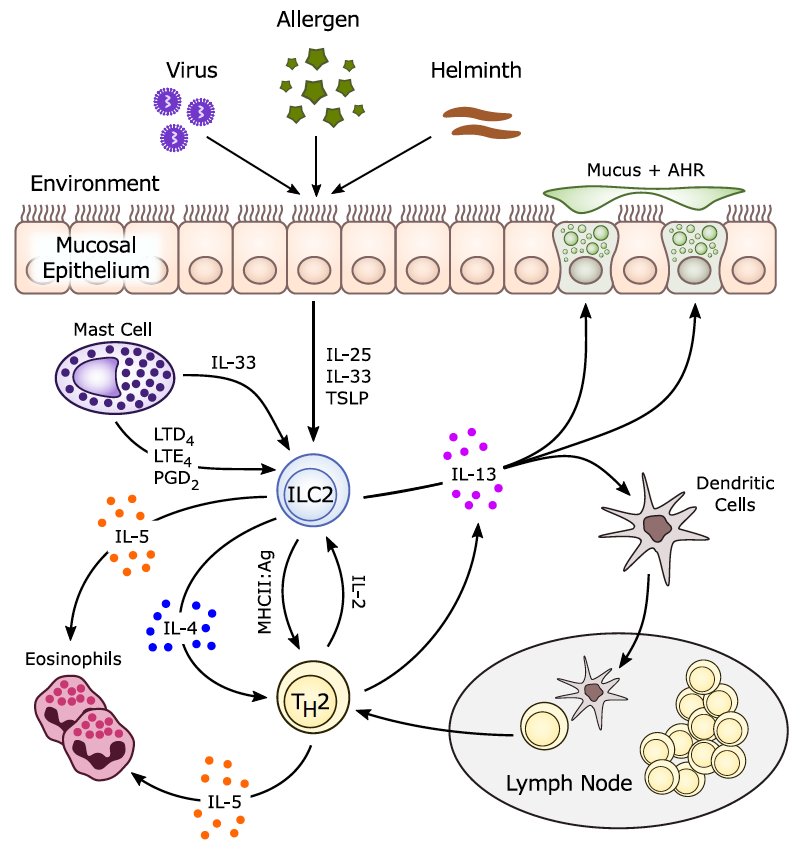 Нац. коммун. 3:708. doi: 10.1038/ncomms1708
Нац. коммун. 3:708. doi: 10.1038/ncomms1708
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Хиксон Л., Ланги Прата Л., Бобарт С., Эванс Т., Гиоргадзе Н., Хашми С. и др. (2019). Сенолитики уменьшают количество стареющих клеток у людей: предварительный отчет о клиническом испытании дазатиниба в сочетании с кверцетином у людей с диабетической болезнью почек. EBioMedicine 47, 446–456. doi: 10.1016/j.ebiom.2019.08.069
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Хутен, Н., и Эванс, М. (2017). Методы индукции и количественного определения клеточного старения. Дж. Виз. Эксп. 123:55533.
Академия Google
Хуанг, Т., и Ривера-Перес, Дж. (2014). Ассоциированная со старением активность β-галактозидазы отмечает висцеральную энтодерму эмбрионов мышей, но не указывает на старение. Бытие 52, 300–308.doi: 10.1002/dvg.22761
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Чон, С. , и Чой, М. (2018). Противовоспалительное и омолаживающее действие гидрокситирозола на дермальные фибробласты человека (HDF). Биомед. Дерматол. 2:21.
, и Чой, М. (2018). Противовоспалительное и омолаживающее действие гидрокситирозола на дермальные фибробласты человека (HDF). Биомед. Дерматол. 2:21.
Академия Google
Цзинвэнь Б., Яочэнь Л. и Гоцзюнь З. (2017). Регуляция клеточного цикла и открытие противоопухолевых препаратов. Рак Биол. Мед. 14, 348–362.
Академия Google
Джастис, Дж., Nambiar, A., Tchkonia, T., LeBrasseur, N., Pascual, R., Hashmi, S., et al. (2019). Сенолитики при идиопатическом легочном фиброзе: результаты первого открытого пилотного исследования на людях. EBioMedicine 40, 554–563. doi: 10.1016/j.ebiom.2018.12.052
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Кацики М., Чондроянни Н., Чиноу И., Риветт А. и Гонос Э. (2007). Олеуропеин, входящий в состав оливы, проявляет стимулирующие протеасомы свойства in vitro и увеличивает продолжительность жизни эмбриональных фибробластов человека. Омоложение. Рез. 10, 157–172. doi: 10.1089/rej.2006.0513
doi: 10.1089/rej.2006.0513
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ким, Э., Хван, К., Ли, Дж., Хан, С., Ким, Э., Парк, Дж., и другие. (2018). Защитный эффект эпигаллокатехина галлата на кожу. Междунар. Дж. Мол. науч. 19:173. дои: 10.3390/ijms173
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ко, А., Хан, С., Чой, К., Чо, Х., Ли, М., Ким, С., и др. (2018). Онкоген-индуцированное старение, опосредованное c-Myc, требует USP10-зависимого деубиквитинирования и стабилизации p14ARF. Дифф. гибели клеток. 25, 1050–1062. doi: 10.1038/s41418-018-0072-0
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Кокс С., Доган С., Туна Б., Гонсалес-Наварро Х., Поттер П. и Ванденбрук Р. (2016). Мышиные модели старения и их связь с болезнями. Мех. Старение Дев. 160, 41–53. doi: 10.1016/j.mad.2016.10.001
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Кумар Р. , Шарма А., Кумари А., Гулати А., Падвад Ю. и Шарма Р. (2018). Галлат эпигаллокатехина способствует преждевременному старению преадипоцитов путем ингибирования пути PI3K/Akt/mTOR и вызывает гибель стареющих клеток путем регуляции пути Bax/Bcl-2. Биогеронтология 20, 171–189. doi: 10.1007/s10522-018-9785-1
, Шарма А., Кумари А., Гулати А., Падвад Ю. и Шарма Р. (2018). Галлат эпигаллокатехина способствует преждевременному старению преадипоцитов путем ингибирования пути PI3K/Akt/mTOR и вызывает гибель стареющих клеток путем регуляции пути Bax/Bcl-2. Биогеронтология 20, 171–189. doi: 10.1007/s10522-018-9785-1
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Lee, B., Han, J., Im, J., Morrone, A., Johung, K., Goodwin, E., et al. (2006). Бета-галактозидаза, связанная со старением, представляет собой лизосомальную бета-галактозидазу. Ячейка старения 5, 187–195. doi: 10.1111/j.1474-9726.2006.00199.x
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Малавольта М., Браччи М., Сантарелли Л., Сайед М., Пьерпаоли Э., Джаккони Р. и др. (2018). Индукторы старения, токсичные соединения и сенолитики: многогранность фитохимических веществ, активирующих Nrf2, в адъювантной терапии рака. Медиаторы воспаления. 2018, 1–32. дои: 10.1155/2018/4159013
2018, 1–32. дои: 10.1155/2018/4159013
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Маркович, А.К., Торич Дж., Барбарич М. и Брала С.Дж. (2019). Гидрокситирозол, тирозол и производные и их потенциальное воздействие на здоровье человека. Молекулы 24:2001. doi: 10.3390/молекулы24102001
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Меникаччи Б., Чиприани К., Маргери Ф., Мокали А. и Джованнелли Л. (2017). Модуляция связанного со старением воспалительного фенотипа в фибробластах человека оливковыми фенолами. Междунар. Дж. Мол. науч. 18:2275.дои: 10.3390/ijms18112275
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Миллер Р., Харрисон Д., Астл С., Баур Дж., Бойд А., де Кабо Р. и др. (2010). Рапамицин, но не ресвератрол или симвастатин, увеличивает продолжительность жизни генетически гетерогенных мышей. Дж. Геронтол. сер. А 66А, 191–201. doi: 10.1093/gerona/glq178
doi: 10.1093/gerona/glq178
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Моисеева О., Дешен-Симар Х., Сен-Жермен Э., Igelmann, S., Huot, G., Cadar, A., et al. (2013). Метформин ингибирует секреторный фенотип, связанный со старением, вмешиваясь в активацию IKK/NF-κB. Ячейка старения 12, 489–498. doi: 10.1111/ускор.12075
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Neurohr, G., Terry, R., Lengefeld, J., Bonney, M., Brittingham, G., Moretto, F., et al. (2019). Чрезмерный рост клеток вызывает разжижение цитоплазмы и способствует старению. Сотовый 176, 1083–1097.doi: 10.1016/j.cell.2019.01.018
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Niu, Y., Na, L., Feng, R., Gong, L., Zhao, Y., Li, Q., et al. (2013). Фитохимическое вещество, EGCG, продлевает жизнь за счет уменьшения повреждения функции печени и почек и уменьшения возрастного воспаления и окислительного стресса у здоровых крыс. Ячейка старения 12, 1041–1049. doi: 10.1111/ускор.12133
Ячейка старения 12, 1041–1049. doi: 10.1111/ускор.12133
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Паес-Рибес, М., Гонсалес-Гуальда, Э., Доэрти, Г., и Муньос-Эспин, Д. (2019). Ориентация на стареющие клетки в трансляционной медицине. EMBO мол. Мед. 11:e10234.
Академия Google
Рафиян-Копаи, М., Ширзад, Х., Барадаран, А., и Насри, Х. (2014). Новые концепции нутрицевтиков как альтернативы фармацевтике. Междунар. Дж. Предотвратить. Мед. 5, 1487–1499.
Академия Google
Рисулео, Г. (2016). Ресвератрол. Нутрицевтики 5, 453–464.
Академия Google
Саес, И., и Вилчес, Д. (2014). Механистические связи между активностью протеасом, старением и возрастными заболеваниями. Курс. Геномика 15, 38–51. дои: 10.2174/138920291501140306113344
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Салехи Б., Мишра А., Нигам М.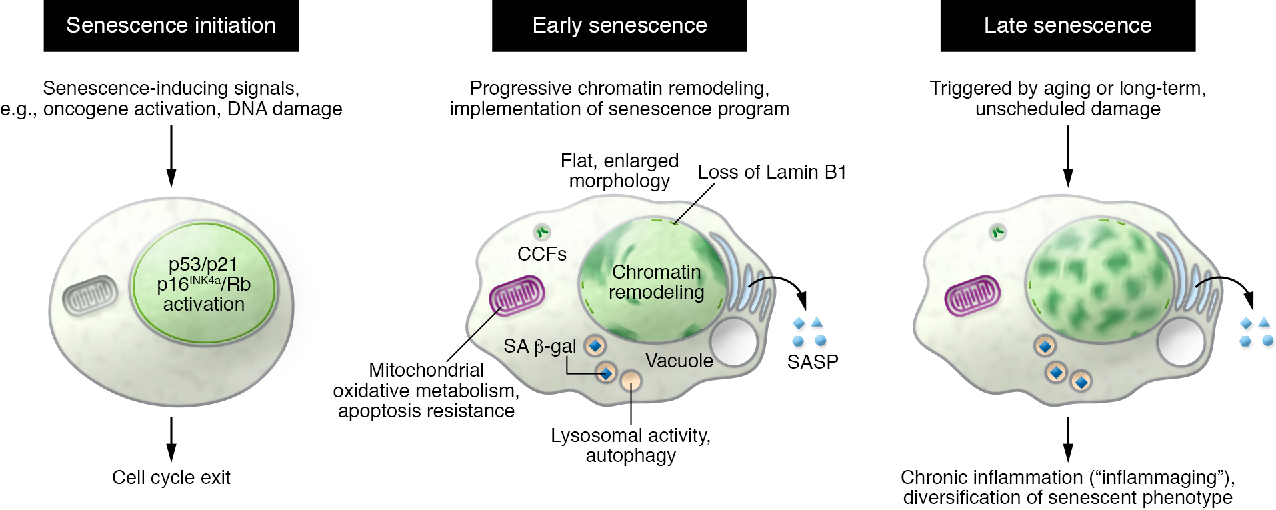 , Сенер Б., Килич М., Шарифи-Рад М. и др. (2018). Ресвератрол: палка о двух концах в пользе для здоровья. Биомедицина 6:91.doi: 10.3390/биомедицины6030091
, Сенер Б., Килич М., Шарифи-Рад М. и др. (2018). Ресвератрол: палка о двух концах в пользе для здоровья. Биомедицина 6:91.doi: 10.3390/биомедицины6030091
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Самаравира, Л., Адомако, А., Родригес-Габин, А., и МакДейд, Х. (2017). Новое показание для панобиностата в качестве сенолитического препарата при НМРЛ и ПРГШ. Науч. Респ. 7:1900. doi: 10.1038/s41598-017-01964-1
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Серрано М., Лин А., МакКаррах М., Бич Д. и Лоу С. (1997). Онкогенный ras вызывает преждевременное старение клеток, связанное с накоплением p53 и p16INK4a. Сотовый 88, 593–602. doi: 10.1016/s0092-8674(00)81902-9
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Strong, R., Miller, R., Astle, C., Baur, J., de Cabo, R., Fernández, E., et al. (2012). Оценка влияния ресвератрола, экстракта зеленого чая, куркумина, щавелевоуксусной кислоты и триглицеридного масла со средней длиной цепи на продолжительность жизни генетически гетерогенных мышей. Дж. Геронтол. сер. биол. науч. Мед. науч. 68, 6–16. doi: 10.1093/gerona/gls070
Дж. Геронтол. сер. биол. науч. Мед. науч. 68, 6–16. doi: 10.1093/gerona/gls070
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Вс, Западная, Фрост Б. и Лю Дж. (2017). Олеуропеин, неожиданные преимущества! Онкоцель 8:17409.
Академия Google
Табассо, А., Джонс, Д., Джонс, Г., и Мацип, С. (2019). Старение, вызванное лучевой терапией, и его влияние на реакцию на лечение. клин. Онкол. 31, 283–289. doi: 10.1016/j.clon.2019.02.003
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Триана-Мартинес Ф., Пикаллос-Рабина П., Да Силва-Альварес С., Пьетрокола Ф., Лланос С., Родилла В. и соавт. (2019). Идентификация и характеристика сердечных гликозидов как сенолитических соединений. Нац. коммун. 10:4731. doi: 10.1038/s41467-019-12888-x
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Цукалас Д., Фрагкиадаки П., Докеа А.О., Алегакис А. К., Саранди Э., Танасоула М. и др. (2019). Открытие мощных активаторов теломеразы: открытие новых терапевтических и антивозрастных перспектив. Мол. Мед. Респ. 20, 3701–3708. doi: 10.3892/ммр.2019.10614
К., Саранди Э., Танасоула М. и др. (2019). Открытие мощных активаторов теломеразы: открытие новых терапевтических и антивозрастных перспектив. Мол. Мед. Респ. 20, 3701–3708. doi: 10.3892/ммр.2019.10614
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Унно, К. (2016). Предотвращение старения мозга компонентами зеленого чая: роль катехинов и теанина. J. Phys. Фитнес Спорт Мед. 5, 117–122. doi: 10.7600/jpfsm.5.117
Полнотекстовая перекрестная ссылка | Академия Google
Унно К., Такабаяси Ф., Йошида Х., Чоба Д., Фукутоми Р., Кикунага Н. и др. (2006). Ежедневное потребление катехина зеленого чая задерживает регрессию памяти у старых мышей. Биогеронтология 8, 89–95. doi: 10.1007/s10522-006-9036-8
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Wang, R., Yu, Z., Sunchu, B., Shoaf, J., Dang, I., Zhao, S., et al. (2017). Рапамицин ингибирует секреторный фенотип стареющих клеток с помощью Nrf2-независимого механизма.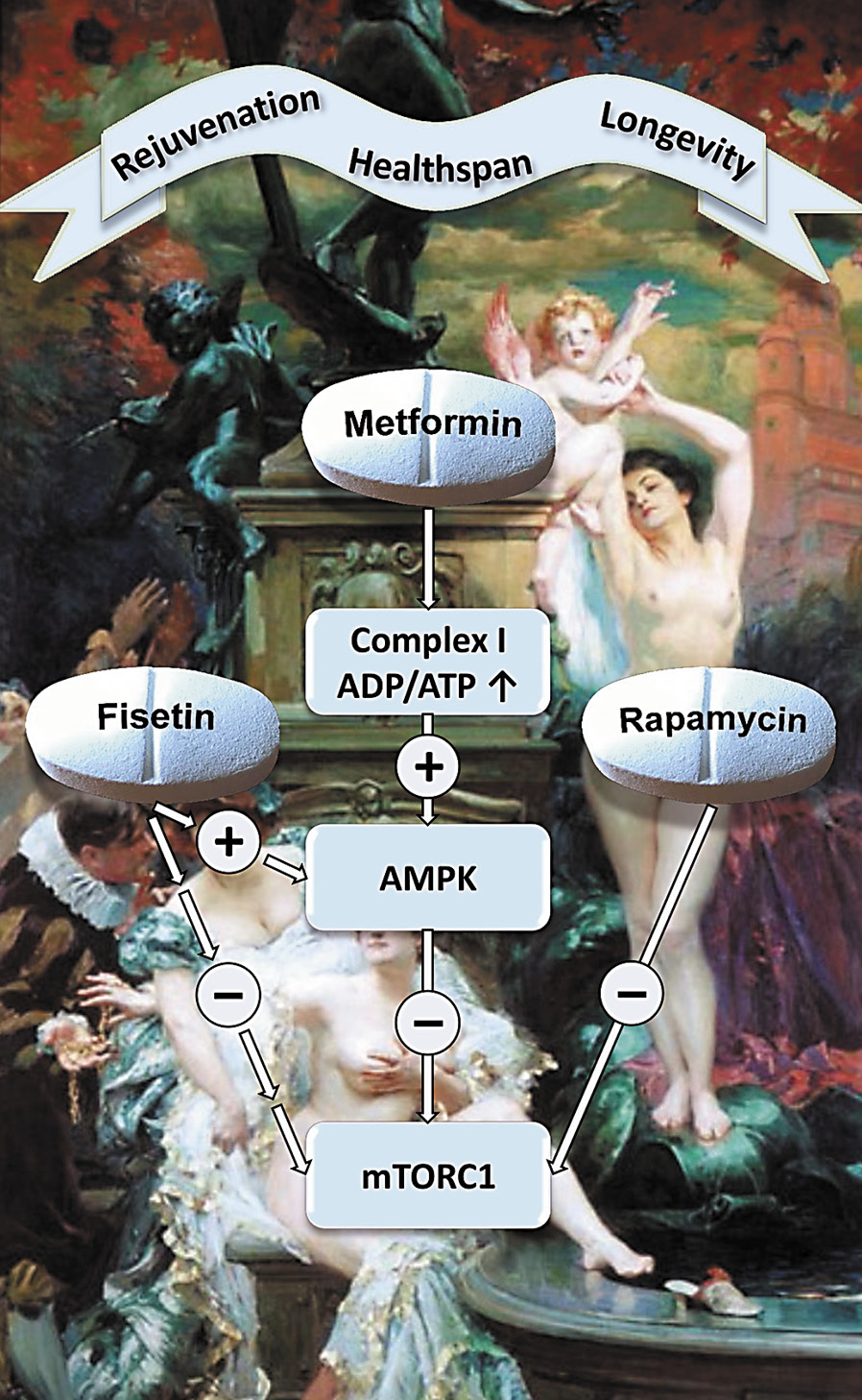 Ячейка старения 16, 564–574. doi: 10.1111/ускор.12587
Ячейка старения 16, 564–574. doi: 10.1111/ускор.12587
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Уайли, К., и Кампизи, Дж. (2016).От древних путей к стареющим клеткам — соединение метаболизма и клеточного старения. Сотовый метаб. 23, 1013–1021. doi: 10.1016/j.cmet.2016.05.010
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Xia, L., Wang, X., Hu, X., Guo, X., Shang, Y., Chen, H., et al. (2009). Ресвератрол снижает старение эндотелиальных клеток-предшественников за счет увеличения активности теломеразы с помощью Akt-зависимых механизмов. Бр. Дж. Фармакол. 155, 387–394. дои: 10.1038/bjp.2008.272
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Сюй М., Пирцхалава Т., Фарр Дж., Вейганд Б., Палмер А., Вейвода М. и соавт. (2018). Сенолитики улучшают физическую функцию и увеличивают продолжительность жизни в пожилом возрасте. Нац. Мед. 24, 1246–1256. doi: 10.1038/s41591-018-0092-9
24, 1246–1256. doi: 10.1038/s41591-018-0092-9
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Йосеф Р., Пилпель Н., Токарски-Амиэль Р., Биран А., Овадья Ю., Коэн С. и соавт. (2016).Направленная элиминация стареющих клеток путем ингибирования BCL-W и BCL-XL. Нац. коммун. 7:11190. doi: 10.1038/ncomms11190
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Юсефзаде М., Мелос К., Анджелини Л., Бурд К., Роббинс П. и Нидернхофер Л. (2018a). Мышиные модели ускоренного клеточного старения. Методы Мол. биол. 1896, 203–230. дои: 10.1007/978-1-4939-8931-7_17
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Юсефзаде М., Zhu, Y., McGowan, S., Angelini, L., Fuhrmann-Stroissnigg, H., Xu, M., et al. (2018б). Физетин — сенотерапевтическое средство, продлевающее здоровье и продолжительность жизни. EBioMedicine 36, 18–28. doi: 10.1016/j.ebiom.2018.09.015
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Чжу Ю. , Чкония Т., Пирцхалава Т., Гауэр А., Дин Х., Гиоргадзе Н. и др. (2015). Ахиллесова пята стареющих клеток: от транскриптома к сенолитическим препаратам. Ячейка старения 14, 644–658.doi: 10.1111/ускорение.12344
, Чкония Т., Пирцхалава Т., Гауэр А., Дин Х., Гиоргадзе Н. и др. (2015). Ахиллесова пята стареющих клеток: от транскриптома к сенолитическим препаратам. Ячейка старения 14, 644–658.doi: 10.1111/ускорение.12344
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
границ | Сенолитики: трансляционный мост между клеточным старением и старением организма
Старение
Ограниченная продолжительность репликативной жизни была впервые описана Hayflick и Moorhead (1961), которые показали, что диплоидные фибробласты человека обладают конечной способностью к репликации, после чего они входят в метаболически активное, но необратимо остановленное пролиферативное состояние. Старение широко изучалось на модельных организмах, таких как Caenorhabditis elegans , и на него влияют различные факторы, такие как стресс, потребление питательных веществ, пол и экспрессия генов (Moskalev et al., 2015). В этих относительно простых модельных организмах было обнаружено несколько генов, таких как DAF-2 (гомолог рецептора инсулина/инсулиноподобного фактора роста-1), мутация которых приводит к почти удвоению продолжительности жизни C. elegans (Kenyon, 2011). . Успех в манипулировании продолжительностью жизни этих модельных организмов положил начало масштабной охоте за открытием большего количества генов, механизмов и терапевтических соединений, связанных со старением. В настоящее время база данных препаратов, влияющих на старение, The DrugAge перечисляет около 567 различных химических возмущающих факторов, которые могут значительно увеличить продолжительность жизни в подмножестве моделей, не связанных со старением, охватывающих более 30 видов (Baardo et al., 2017). Недавно были начаты клинические испытания, такие как исследование «Метформин в исследовании долголетия» (MILES), для оценки омолаживающего потенциала метформина в отсрочке возрастных заболеваний у людей (Crandall, 2015; Piskovatka et al., 2019). Одним из важных компонентов для изучения старения и возрастных заболеваний у человека являются биомаркеры, указывающие на хронологический возраст (Calimport et al., 2019). Недавно было показано, что паттерны метилирования ДНК демонстрируют сильную корреляцию с хронологическим возрастом, и эти «эпигенетические часы» эффективны для прогнозирования смертности от всех причин с возрастом (Horvath, 2013).
elegans (Kenyon, 2011). . Успех в манипулировании продолжительностью жизни этих модельных организмов положил начало масштабной охоте за открытием большего количества генов, механизмов и терапевтических соединений, связанных со старением. В настоящее время база данных препаратов, влияющих на старение, The DrugAge перечисляет около 567 различных химических возмущающих факторов, которые могут значительно увеличить продолжительность жизни в подмножестве моделей, не связанных со старением, охватывающих более 30 видов (Baardo et al., 2017). Недавно были начаты клинические испытания, такие как исследование «Метформин в исследовании долголетия» (MILES), для оценки омолаживающего потенциала метформина в отсрочке возрастных заболеваний у людей (Crandall, 2015; Piskovatka et al., 2019). Одним из важных компонентов для изучения старения и возрастных заболеваний у человека являются биомаркеры, указывающие на хронологический возраст (Calimport et al., 2019). Недавно было показано, что паттерны метилирования ДНК демонстрируют сильную корреляцию с хронологическим возрастом, и эти «эпигенетические часы» эффективны для прогнозирования смертности от всех причин с возрастом (Horvath, 2013). Анализ раковых тканей с помощью этих эпигенетических часов, состоящих из уровней метилирования 353 CpG, показал, что ткани раковых больных, получавших различные методы лечения, оказались в среднем на 36 лет старше по сравнению с фактическим хронологическим возрастом пациентов, в то время как индуцированные плюрипотентные стволовые клетки (ИПСК) от тех же людей показали сброс часов к нулевому эпигенетическому возрасту. Однако биологические механизмы, лежащие в основе этого эпигенетического биомаркера, остаются неизвестными, особенно из-за отсутствия корреляции с данными об экспрессии генов.
Анализ раковых тканей с помощью этих эпигенетических часов, состоящих из уровней метилирования 353 CpG, показал, что ткани раковых больных, получавших различные методы лечения, оказались в среднем на 36 лет старше по сравнению с фактическим хронологическим возрастом пациентов, в то время как индуцированные плюрипотентные стволовые клетки (ИПСК) от тех же людей показали сброс часов к нулевому эпигенетическому возрасту. Однако биологические механизмы, лежащие в основе этого эпигенетического биомаркера, остаются неизвестными, особенно из-за отсутствия корреляции с данными об экспрессии генов.
Старение
Старение относится к состоянию постоянной остановки пролиферации, характеризующейся нечувствительностью к факторам роста и митогенам (Kuilman et al., 2010). Одним из механизмов, регулирующих эту нечувствительность, является нарушение регуляции нормального эндоцитоза (Wheaton et al., 2001; Rajarajacholan et al., 2013). Было показано, что стареющие клетки сверхэкспрессируют кавеолины, основной компонент аппарата эндоцитоза, что предотвращает их способность фосфорилировать Erk-1/2 фосфорилирование после стимуляции EGF, которое восстанавливается путем подавления с помощью антисмысловых олигонуклеотидов. Подобное подавление активации Erk-1/2 также наблюдалось в нестареющих клетках после сверхэкспрессии кавеолина (Park, 2002; Park et al., 2002). В клеточной культуре, по наблюдениям Hayflick и Moorhead (1961), состояние старения достигается при повторном пассировании, и, как будет показано далее, оно происходит в основном за счет укорочения теломерной ДНК, обнаруживаемой на концах хромосом (Harley et al., 1990). ), который активирует мутированную атаксию-телеангиэктазию (ATM) (Vaziri et al., 1997) и p53-опосредованный (Atadja et al., 1995) ответ на повреждение ДНК.Сначала это было выдвинуто гипотезой как проблема конечной репликации; как следствие полуконсервативной репликации ДНК, позднее подтвержденной Блэкберном, Грейдером и Шостаком (Lundblad and Szostak, 1989; Blackburn, 1991). Стареющие клетки обычно имеют увеличенную морфологию и чаще всего выявляются гистохимически по повышенной активности β-галактозидазы, известной как связанная со старением β-галактозидаза (SA-βGAL) (Itahana et al.
Подобное подавление активации Erk-1/2 также наблюдалось в нестареющих клетках после сверхэкспрессии кавеолина (Park, 2002; Park et al., 2002). В клеточной культуре, по наблюдениям Hayflick и Moorhead (1961), состояние старения достигается при повторном пассировании, и, как будет показано далее, оно происходит в основном за счет укорочения теломерной ДНК, обнаруживаемой на концах хромосом (Harley et al., 1990). ), который активирует мутированную атаксию-телеангиэктазию (ATM) (Vaziri et al., 1997) и p53-опосредованный (Atadja et al., 1995) ответ на повреждение ДНК.Сначала это было выдвинуто гипотезой как проблема конечной репликации; как следствие полуконсервативной репликации ДНК, позднее подтвержденной Блэкберном, Грейдером и Шостаком (Lundblad and Szostak, 1989; Blackburn, 1991). Стареющие клетки обычно имеют увеличенную морфологию и чаще всего выявляются гистохимически по повышенной активности β-галактозидазы, известной как связанная со старением β-галактозидаза (SA-βGAL) (Itahana et al. , 2007), которая коррелирует с повышенной аутофагией (Young и др., 2009).Другие биомаркеры старения включают повышенную экспрессию общих медиаторов старения, таких как p16, p21, p53 и p47ING1a (Kuilman et al., 2010; Rajarajacholan et al., 2013). Однако не все типы старения являются результатом истощения теломер. Например, до 50% мышиных эмбриональных фибробластов (MEF’s) проявляют фенотип старения после всего лишь пяти пассажей в результате чувствительности к кислороду из-за ROS-индуцированного повреждения ДНК (Parrinello et al., 2003). Эти взаимозависимые особенности отмены клеточного цикла, повреждения макромолекул, нарушения регуляции метаболизма и измененного секреторного фенотипа, ассоциированного со старением (SASP), были описаны как отличительные признаки фенотипа старения, хотя нет маркеров, которые, по-видимому, являются универсальными для всех типов стареющих клеток.Поэтому для обеспечения точной идентификации стареющих клеток Международная ассоциация клеточного старения рекомендовала использовать несколько маркеров в трехэтапном протоколе идентификации старения (Gorgoulis et al.
, 2007), которая коррелирует с повышенной аутофагией (Young и др., 2009).Другие биомаркеры старения включают повышенную экспрессию общих медиаторов старения, таких как p16, p21, p53 и p47ING1a (Kuilman et al., 2010; Rajarajacholan et al., 2013). Однако не все типы старения являются результатом истощения теломер. Например, до 50% мышиных эмбриональных фибробластов (MEF’s) проявляют фенотип старения после всего лишь пяти пассажей в результате чувствительности к кислороду из-за ROS-индуцированного повреждения ДНК (Parrinello et al., 2003). Эти взаимозависимые особенности отмены клеточного цикла, повреждения макромолекул, нарушения регуляции метаболизма и измененного секреторного фенотипа, ассоциированного со старением (SASP), были описаны как отличительные признаки фенотипа старения, хотя нет маркеров, которые, по-видимому, являются универсальными для всех типов стареющих клеток.Поэтому для обеспечения точной идентификации стареющих клеток Международная ассоциация клеточного старения рекомендовала использовать несколько маркеров в трехэтапном протоколе идентификации старения (Gorgoulis et al. , 2019).
, 2019).
Механизмы и стимулы старения
Широкий спектр стимулов, влияющих на несколько молекулярных путей, участвует в индукции необратимой остановки старения в состоянии, напоминающем G 0 клеточного цикла в клетках млекопитающих (Kuilman et al., 2010; Муньос-Эспин и Серрано, 2014 г.). Эти пути широко классифицируются как активирующие p16 (Alcorta et al., 1996) или p21 (Brown et al., 1997) через супрессор опухоли p53 (Atadja et al., 1995; Vaziri et al., 1997). сигналы сходятся, чтобы продуцировать высокие уровни активного гипофосфорилированного Rb (ретинобластома) опухолевого супрессора (Chicas et al., 2010; Rajarajacholan et al., 2013). Опухолесупрессивная природа клеточного старения совершенно очевидна из того факта, что вмешательство в уровни некоторых из этих онкогенов/опухолевых супрессоров может привести к избавлению от старения (Campisi, 1997).Вообще говоря, старение может быть вызвано многочисленными стрессами, включая повреждение ДНК, окислительный стресс и стресс, вызванный онкогенами.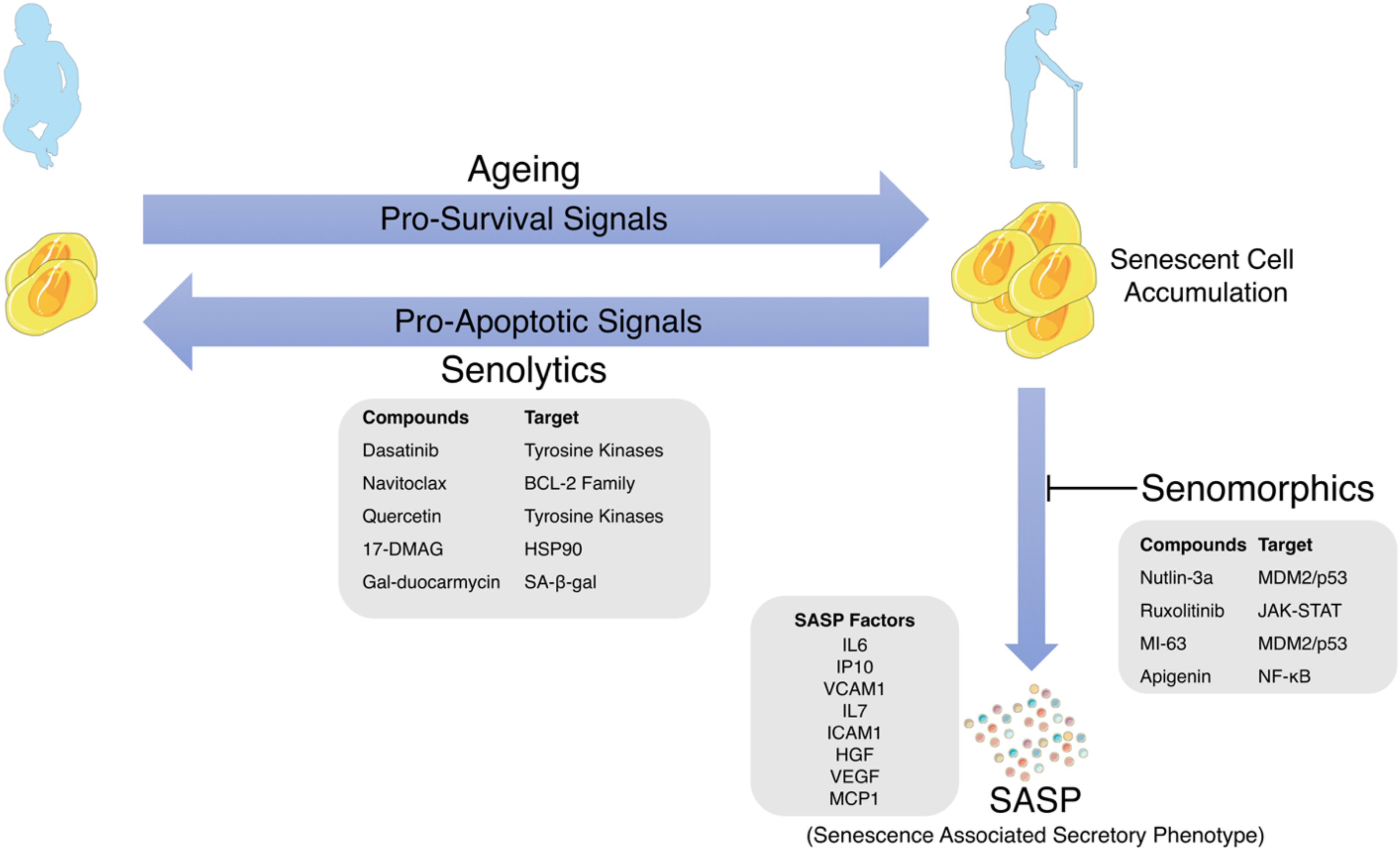 Стареющие клетки, вызванные повреждением ДНК, в основном наблюдаются у онкологических больных после введения лучевой и химиотерапии (Robles et al., 1999; Gewirtz et al., 2008), и лечение приводит к ускоренной потере теломер (Unryn et al., 2006). Лучевая терапия и химиотерапия не только воздействуют на раковую ткань, но также вызывают старение окружающих здоровых тканей.Несколько наблюдений подтвердили, что воздействие ингибиторов топоизомеразы, таких как доксорубицин и этопозид, вызывает старение первичных диплоидных фибробластов человека in vitro (Robles et al., 1999). Исследования также показали, что белки SASP, которые высвобождаются из этих окружающих стареющих клеток, могут индуцировать эпителиально-мезенхимальный переход (EMT) и, следовательно, способствовать злокачественности в обычно неагрессивных клеточных линиях рака молочной железы человека (Coppé et al., 2008). Другим важным игроком в индукции старения является ING1a из IN ингибитора G семейства эпигенетических регуляторов rowth.
Стареющие клетки, вызванные повреждением ДНК, в основном наблюдаются у онкологических больных после введения лучевой и химиотерапии (Robles et al., 1999; Gewirtz et al., 2008), и лечение приводит к ускоренной потере теломер (Unryn et al., 2006). Лучевая терапия и химиотерапия не только воздействуют на раковую ткань, но также вызывают старение окружающих здоровых тканей.Несколько наблюдений подтвердили, что воздействие ингибиторов топоизомеразы, таких как доксорубицин и этопозид, вызывает старение первичных диплоидных фибробластов человека in vitro (Robles et al., 1999). Исследования также показали, что белки SASP, которые высвобождаются из этих окружающих стареющих клеток, могут индуцировать эпителиально-мезенхимальный переход (EMT) и, следовательно, способствовать злокачественности в обычно неагрессивных клеточных линиях рака молочной железы человека (Coppé et al., 2008). Другим важным игроком в индукции старения является ING1a из IN ингибитора G семейства эпигенетических регуляторов rowth. Семейство генов ING , первоначально идентифицированное в 1996 г. путем субтрактивной гибридизации между кДНК нормальных эпителиальных клеток молочной железы и трансформированных клеток рака молочной железы, является эволюционно консервативным, а белки ING преимущественно локализуются в ядре (Garkavtsev et al., 1996). Наша лаборатория показала, что изоформа ING1a, которая экспрессируется в стареющих, но не низкопассажных фибробластах, индуцирует старение при эктопической экспрессии в несколько раз быстрее (24–36 ч) по сравнению с другими агентами, вызывающими старение, такими как t-BHP (трет-бутилгидропероксид). ) и доксорубицин (Rajarajacholan and Riabowol, 2015).Мы показали, что ингибирование эндоцитоза является одним из основных механизмов, с помощью которых ING1a вызывает старение (Rajarajacholan et al., 2013; Rajarajacholan and Riabowol, 2015). Это происходит путем воздействия по меньшей мере на три независимых члена пути Rb, включая Rb, p16 INK4a и p57 Kip2 .
Семейство генов ING , первоначально идентифицированное в 1996 г. путем субтрактивной гибридизации между кДНК нормальных эпителиальных клеток молочной железы и трансформированных клеток рака молочной железы, является эволюционно консервативным, а белки ING преимущественно локализуются в ядре (Garkavtsev et al., 1996). Наша лаборатория показала, что изоформа ING1a, которая экспрессируется в стареющих, но не низкопассажных фибробластах, индуцирует старение при эктопической экспрессии в несколько раз быстрее (24–36 ч) по сравнению с другими агентами, вызывающими старение, такими как t-BHP (трет-бутилгидропероксид). ) и доксорубицин (Rajarajacholan and Riabowol, 2015).Мы показали, что ингибирование эндоцитоза является одним из основных механизмов, с помощью которых ING1a вызывает старение (Rajarajacholan et al., 2013; Rajarajacholan and Riabowol, 2015). Это происходит путем воздействия по меньшей мере на три независимых члена пути Rb, включая Rb, p16 INK4a и p57 Kip2 . ING1a индуцирует экспрессию Intersectin 2, впоследствии изменяя стехиометрию аппарата эндоцитоза и блокируя передачу сигналов митогенами (Rajarajacholan et al., 2013). Это представляет собой новый механизм индукции старения, который не зависит от истощения теломер и передачи сигналов о повреждении ДНК.
ING1a индуцирует экспрессию Intersectin 2, впоследствии изменяя стехиометрию аппарата эндоцитоза и блокируя передачу сигналов митогенами (Rajarajacholan et al., 2013). Это представляет собой новый механизм индукции старения, который не зависит от истощения теломер и передачи сигналов о повреждении ДНК.
Клеточное старение и старение организма
Одним из признаков старения млекопитающих является накопление необратимо остановленных стареющих клеток в различных тканях (рис. 1). В исследовании на приматах 2006 г. было замечено, что стареющие клетки, о чем свидетельствует активация АТМ, действительно накапливаются и могут достигать более 15% от общей клеточной популяции у пожилых людей (Herbig et al., 2006). В отличие от подавляющего большинства исследований in vitro , это было одно из первых исследований, демонстрирующих четкую связь между старением и накоплением стареющих клеток in vivo .Хотя это установило сильную корреляцию, предпринимались попытки установить причинно-следственную связь между накоплением стареющих клеток и старением in vivo . В 2011 году лаборатория Kirkland показала, что удаление p16 Ink4a позитивных стареющих клеток отсрочивает возрастные расстройства и увеличивает продолжительность здоровья в модели ускоренного старения мышей с прогероидом BubR1 (Baker et al., 2011). Это было достигнуто с использованием нового трансгена, состоящего из промотора p16 Ink4a , управляющего слитым белком FKBP-Caspase-8, который избирательно экспрессируется в стареющих клетках и может быть активирован синтетическим лекарственным средством AP20187.Эти трансгенные мыши показали отсроченное начало саркопении, катаракты, значительно лучшие результаты тестов с физической нагрузкой и снижение других возрастных патологий. Более поздние исследования подтвердили положительные эффекты удаления стареющих клеток у мышей дикого типа, которые показали увеличение средней продолжительности жизни, замедление онкогенеза и ослабление возрастного полиорганного ухудшения (Baker et al., 2016). Было также показано, что удаление стареющих клеток у мышей ослабляет маркеры возрастных нейродегенеративных заболеваний, таких как гиперфосфорилирование тау и отложение нейрофибриллярных клубков (Bussian et al.
В 2011 году лаборатория Kirkland показала, что удаление p16 Ink4a позитивных стареющих клеток отсрочивает возрастные расстройства и увеличивает продолжительность здоровья в модели ускоренного старения мышей с прогероидом BubR1 (Baker et al., 2011). Это было достигнуто с использованием нового трансгена, состоящего из промотора p16 Ink4a , управляющего слитым белком FKBP-Caspase-8, который избирательно экспрессируется в стареющих клетках и может быть активирован синтетическим лекарственным средством AP20187.Эти трансгенные мыши показали отсроченное начало саркопении, катаракты, значительно лучшие результаты тестов с физической нагрузкой и снижение других возрастных патологий. Более поздние исследования подтвердили положительные эффекты удаления стареющих клеток у мышей дикого типа, которые показали увеличение средней продолжительности жизни, замедление онкогенеза и ослабление возрастного полиорганного ухудшения (Baker et al., 2016). Было также показано, что удаление стареющих клеток у мышей ослабляет маркеры возрастных нейродегенеративных заболеваний, таких как гиперфосфорилирование тау и отложение нейрофибриллярных клубков (Bussian et al. , 2018). Поскольку вполне вероятно, что даже небольшой процент стареющих клеток может вызывать существенные вредные эффекты, могут существовать естественные механизмы, которые очищают эти стареющие клетки in vivo для поддержания общей пригодности. Было обнаружено, что одним первичным ответом на активацию p53 при карциноме печени мышей является накопление стареющих клеток, которые впоследствии, как было показано, удаляются врожденным иммунным ответом (Xue et al., 2011). Также было обнаружено, что NK-клетки элиминируют стареющие клетки in vivo посредством экзоцитоза гранул, опосредованного перфорином (Prf) (Sagiv et al., 2013) и мыши Prf1 -/- показали 4-кратное накопление стареющих клеток и снижение средней продолжительности жизни на 21%, что было облегчено за счет клиренса стареющих клеток (Ovadya et al., 2018).
, 2018). Поскольку вполне вероятно, что даже небольшой процент стареющих клеток может вызывать существенные вредные эффекты, могут существовать естественные механизмы, которые очищают эти стареющие клетки in vivo для поддержания общей пригодности. Было обнаружено, что одним первичным ответом на активацию p53 при карциноме печени мышей является накопление стареющих клеток, которые впоследствии, как было показано, удаляются врожденным иммунным ответом (Xue et al., 2011). Также было обнаружено, что NK-клетки элиминируют стареющие клетки in vivo посредством экзоцитоза гранул, опосредованного перфорином (Prf) (Sagiv et al., 2013) и мыши Prf1 -/- показали 4-кратное накопление стареющих клеток и снижение средней продолжительности жизни на 21%, что было облегчено за счет клиренса стареющих клеток (Ovadya et al., 2018).
Рисунок 1. Схематическое представление связи между клеточным старением и старением с примерами факторов SASP, сенолитиков и сеноморфных препаратов и их мишеней действия.
Дополнительные доказательства связи между клеточным старением и старением организма получены из синдромов ускоренного старения, таких как HGPS (синдром прогерии Хатчинсона-Гилфорда).Более высокая доля фибробластов HGPS является SA-β-Gal-положительной по сравнению с фибробластами из нормальных контрольных групп того же возраста, и их можно вернуть в нормальное репликативное состояние за счет экзогенной экспрессии субъединицы TERT теломеразы (Benson et al., 2010). ). Сходным образом, экспрессия прогерина, мутантного белка lamin-A, который, как известно, вызывает HGPS, в первичных клетках, полученных от здоровых людей, приводит к экспрессии маркеров старения (Cao et al., 2011). Эти результаты свидетельствуют о том, что индуцированная прогерином дисфункция теломер может привести к преждевременному клеточному старению, что приводит к симптомам ускоренного старения, наблюдаемым у пациентов с HGPS.
Сенолитики и сеноморфные препараты
Вещественные доказательства, полученные за последнее десятилетие, связывающие накопление стареющих клеток, возрастные заболевания и роль в продолжительности жизни и продолжительности здоровья, подтолкнули к поиску терапевтических соединений, которые могли бы избирательно воздействовать на стареющие клетки. Транскриптомный анализ между стареющими и пролиферирующими клетками показал повышенную экспрессию про-выживающих/антиапоптотических генов, таких как Bcl-xL (В-клеточная лимфома-экстракрупная), члена семейства белков Bcl-2, который регулирует запрограммированные клетки. смерть за счет блокирования активации каспазы (Zhu et al., 2016). Это предоставило доказательства, подтверждающие наблюдение, что стареющие клетки накапливаются с возрастом, будучи устойчивыми к различным стрессам, которые обычно вызывают апоптоз (Wang, 1995). В соответствии с этой идеей, siRNAs для снижения экспрессии Bcl-xL избирательно снижают выживаемость и жизнеспособность стареющих клеток, не влияя при этом на пролиферирующие клетки (Zhu et al., 2015). На основе этих наблюдений кверцетин и дазатиниб были получены в результате скрининга наркотиков (Hickson et al., 2019). Кверцетин (флавоноид) и дазатиниб (противораковое средство) являются известными ингибиторами различных тирозинкиназ (Huang et al., 1999; Монтеро и др.
Транскриптомный анализ между стареющими и пролиферирующими клетками показал повышенную экспрессию про-выживающих/антиапоптотических генов, таких как Bcl-xL (В-клеточная лимфома-экстракрупная), члена семейства белков Bcl-2, который регулирует запрограммированные клетки. смерть за счет блокирования активации каспазы (Zhu et al., 2016). Это предоставило доказательства, подтверждающие наблюдение, что стареющие клетки накапливаются с возрастом, будучи устойчивыми к различным стрессам, которые обычно вызывают апоптоз (Wang, 1995). В соответствии с этой идеей, siRNAs для снижения экспрессии Bcl-xL избирательно снижают выживаемость и жизнеспособность стареющих клеток, не влияя при этом на пролиферирующие клетки (Zhu et al., 2015). На основе этих наблюдений кверцетин и дазатиниб были получены в результате скрининга наркотиков (Hickson et al., 2019). Кверцетин (флавоноид) и дазатиниб (противораковое средство) являются известными ингибиторами различных тирозинкиназ (Huang et al., 1999; Монтеро и др. , 2011). Эти соединения являются одними из первых обнаруженных представителей класса сенолитических препаратов, которые избирательно индуцируют апоптоз в стареющих клетках. Через четыре года после их первоначальной идентификации в качестве потенциальных сенолитиков комбинация дазатиниб + кверцетин, как сообщалось, уменьшала нагрузку стареющих клеток у людей в рамках клинического испытания фазы 1 у пациентов с диабетической болезнью почек (Hickson et al., 2019). Это исследование 2019 года было первым рецензируемым исследованием, демонстрирующим эффективность сенолитиков для снижения нагрузки стареющих клеток у людей.Это было проведено после завершения первоначального пилотного исследования в начале 2019 года у 14 пациентов с идиопатическим легочным фиброзом (ИЛФ) для оценки возможности применения сенолитического лечения (Justice et al., 2019). Теперь остается определить, продемонстрируют ли будущие клинические испытания какие-либо положительные медицинские результаты в результате снижения нагрузки стареющих клеток при диабете и других возрастных заболеваниях.
, 2011). Эти соединения являются одними из первых обнаруженных представителей класса сенолитических препаратов, которые избирательно индуцируют апоптоз в стареющих клетках. Через четыре года после их первоначальной идентификации в качестве потенциальных сенолитиков комбинация дазатиниб + кверцетин, как сообщалось, уменьшала нагрузку стареющих клеток у людей в рамках клинического испытания фазы 1 у пациентов с диабетической болезнью почек (Hickson et al., 2019). Это исследование 2019 года было первым рецензируемым исследованием, демонстрирующим эффективность сенолитиков для снижения нагрузки стареющих клеток у людей.Это было проведено после завершения первоначального пилотного исследования в начале 2019 года у 14 пациентов с идиопатическим легочным фиброзом (ИЛФ) для оценки возможности применения сенолитического лечения (Justice et al., 2019). Теперь остается определить, продемонстрируют ли будущие клинические испытания какие-либо положительные медицинские результаты в результате снижения нагрузки стареющих клеток при диабете и других возрастных заболеваниях.
Другой сенолитической стратегией является ингибирование взаимодействия между Mouse Double Minute 2 (MDM2) и р53, которое обычно приводит к убиквитинированию и протеасомной деградации р53 (Nag et al., 2013; Уэйд и др., 2013). Белок MDM2 действует как убиквитинлигаза E3 и способствует деградации p53. MDM2 содержит два промотора: P1 и P2. P1 конститутивно активен на низких уровнях, в то время как промотор P2 имеет сайты связывания p53 и действует как негативный регулятор p53 (Hollerer et al., 2019). Было показано, что антагонисты MDM2 Nutlin-3a и MI-63 повышают уровень p53 и ослабляют секреторный фенотип стареющих клеток (SASP) (Wiley et al., 2018). Они представляют собой новый класс соединений, известных как «сеноморфные», которые ослабляют экспрессию цитокинов, таких как IL-6 (интерлейкин-6), входящих в состав SASP.UBX0101, соединение из разработки Unity Biotechnology, является еще одним многообещающим сенолитиком, который ингибирует взаимодействие MDM2/p53 и в настоящее время проходит фазу 1 клинических испытаний против остеоартрита. Сообщалось, что введение UBX0101 уменьшает классические фенотипы, связанные с остеоартритом, такие как эрозия хряща и боль в суставах у мышей, путем опосредованного p53 очищения стареющих клеток. Это исследование показало, что стареющие клетки могут способствовать развитию остеоартрита (Jeon et al., 2017), еще одной значимой с медицинской точки зрения возрастной патологии.
Сообщалось, что введение UBX0101 уменьшает классические фенотипы, связанные с остеоартритом, такие как эрозия хряща и боль в суставах у мышей, путем опосредованного p53 очищения стареющих клеток. Это исследование показало, что стареющие клетки могут способствовать развитию остеоартрита (Jeon et al., 2017), еще одной значимой с медицинской точки зрения возрастной патологии.
Белок теплового шока 90 (HSP90) может представлять собой еще одну мишень для сенолиза. Этот белок является одним из членов большого семейства шаперонов, которые помогают другим белкам сворачиваться и рефолдироваться после клеточного стресса, и косвенно участвует в широком спектре клеточных процессов, таких как репарация ДНК, реакция на тепловой стресс и нейродегенеративные патологии (Schopf et al., 2017). В то время как уровни HSP90 остаются относительно одинаковыми в стареющих и нестареющих клетках, AKT (протеинкиназа B), которая является нижестоящим эффектором HSP90, высоко экспрессируется в стареющих клетках. Ингибирование HSP90 дестабилизирует AKT и приводит к усилению апоптоза (Karkoulis et al., 2013). Ингибиторы HSP90, такие как 17-DMAG, были обнаружены в результате скрининга сенолитических соединений на основе подсчета SA-βGAL-положительных клеток в качестве конечной точки. Кроме того, было показано, что 17-DMAG является сенолитиком in vivo за счет уменьшения p16-позитивных клеток и увеличения продолжительности жизни у мышей Ercc1 -/Δ (Fuhrmann-Stroissnigg et al., 2017).
Ингибирование HSP90 дестабилизирует AKT и приводит к усилению апоптоза (Karkoulis et al., 2013). Ингибиторы HSP90, такие как 17-DMAG, были обнаружены в результате скрининга сенолитических соединений на основе подсчета SA-βGAL-положительных клеток в качестве конечной точки. Кроме того, было показано, что 17-DMAG является сенолитиком in vivo за счет уменьшения p16-позитивных клеток и увеличения продолжительности жизни у мышей Ercc1 -/Δ (Fuhrmann-Stroissnigg et al., 2017).
Новое поколение сенолитиков
Поскольку старение представляет собой сложный фенотип, включающий несколько путей и белков, маловероятно, что одно сенолитическое соединение, нацеленное на один белок, сможет уничтожить все типы стареющих клеток.Например, кверцетин более селективен в отношении стареющих эндотелиальных клеток человека, тогда как дазатиниб гораздо более эффективен в отношении стареющих первичных преадипоцитов человека (Hickson et al., 2019). Точно так же, хотя Навитоклакс, сенолитический агент, нацеленный на семейство белков Bcl-2, является селективным в отношении стареющих эпителиальных клеток пупочной вены человека (HUVEC) и фибробластов легких человека IMR90, он не особенно эффективен в отношении первичных преадипоцитов человека (Zhu et al. , 2016). ). Таким образом, сенолитические соединения, которые более широко воздействуют на стареющие клетки, сохраняя при этом низкую цитотоксичность за счет повышенной селективности исключительно к действительно стареющим клеткам, представляют большой интерес! Повышенная активность лизосомальной β-галактозидазы, которая является почти универсальной характеристикой стареющих клеток (Lee et al., 2006) и использовался в качестве биомаркера старения, а также может быть использован для селективности лекарств против широкого спектра стареющих клеток. Одним из примеров является система доставки лекарств, использующая инкапсуляцию цитотоксических препаратов с галактоолигосахаридами (Muñoz-Espín et al., 2018). Эти капсулы, которые могут быть загружены различными цитотоксическими соединениями, используют высокую активность лизосомальной β-галактозидазы стареющих клеток для предпочтительного высвобождения своего груза внутри стареющих клеток. В совсем недавнем исследовании также использовалась аналогичная стратегия с использованием пролекарства, модифицированного галактозой.
, 2016). ). Таким образом, сенолитические соединения, которые более широко воздействуют на стареющие клетки, сохраняя при этом низкую цитотоксичность за счет повышенной селективности исключительно к действительно стареющим клеткам, представляют большой интерес! Повышенная активность лизосомальной β-галактозидазы, которая является почти универсальной характеристикой стареющих клеток (Lee et al., 2006) и использовался в качестве биомаркера старения, а также может быть использован для селективности лекарств против широкого спектра стареющих клеток. Одним из примеров является система доставки лекарств, использующая инкапсуляцию цитотоксических препаратов с галактоолигосахаридами (Muñoz-Espín et al., 2018). Эти капсулы, которые могут быть загружены различными цитотоксическими соединениями, используют высокую активность лизосомальной β-галактозидазы стареющих клеток для предпочтительного высвобождения своего груза внутри стареющих клеток. В совсем недавнем исследовании также использовалась аналогичная стратегия с использованием пролекарства, модифицированного галактозой. Здесь предпочтительная обработка модифицированным галактозой дуокармицином (GMD), цитотоксическим конъюгатом, использовалась для устранения широкого спектра типов стареющих клеток (Guerrero et al., 2019). Нацеливание на белки клеточной поверхности, обогащенные стареющими клетками, такие как DPP4 (дипептидилпептидаза 4), также может быть использовано для повышения селективности (Kim et al., 2017). Другой белок клеточной поверхности, рецептор CD9, также использовался для нацеливания на стареющие клетки и их секреторный фенотип с помощью инкапсулированных моноклональных антител против CD9, наночастиц, обернутых лактозой, нагруженных рапамицином в качестве полезной нагрузки (Thapa et al., 2017). Эти наночастицы обладают двойной селективностью по отношению к стареющим клеткам, основанной как на увеличении количества рецепторов CD9 на клеточной поверхности, так и на увеличении экспрессии лизосомальной β-галактозидазы.
Здесь предпочтительная обработка модифицированным галактозой дуокармицином (GMD), цитотоксическим конъюгатом, использовалась для устранения широкого спектра типов стареющих клеток (Guerrero et al., 2019). Нацеливание на белки клеточной поверхности, обогащенные стареющими клетками, такие как DPP4 (дипептидилпептидаза 4), также может быть использовано для повышения селективности (Kim et al., 2017). Другой белок клеточной поверхности, рецептор CD9, также использовался для нацеливания на стареющие клетки и их секреторный фенотип с помощью инкапсулированных моноклональных антител против CD9, наночастиц, обернутых лактозой, нагруженных рапамицином в качестве полезной нагрузки (Thapa et al., 2017). Эти наночастицы обладают двойной селективностью по отношению к стареющим клеткам, основанной как на увеличении количества рецепторов CD9 на клеточной поверхности, так и на увеличении экспрессии лизосомальной β-галактозидазы.
Заключение
Роль клеточного старения в старении организма была хорошо установлена за последние два десятилетия для различных организмов (Fick et al. , 2012; Heidinger et al., 2012; Muñoz-Lorente et al., 2019). Из первоначальных мыслей, указывающих на то, что старение служит в первую очередь противораковым механизмом, мы отмечаем появившееся представление о том, что старение также действует как движущая сила широкого спектра возрастных патологий (Fernandes et al., 2016). Более поздние исследования последнего десятилетия, которые привели к разработке трансгенов и химических возмущающих факторов, наконец дали нам инструменты для избирательного управления количеством стареющих клеток in vivo . Тщательная характеристика их вредоносного секреторного фенотипа, который различается в разных типах клеток, продолжает улучшать наше понимание того, как они способствуют широкому спектру возрастных заболеваний, наблюдаемых в наших популяциях. Наконец, когда первые сенолитики проходят клинические испытания, мы находимся на пороге установления трансляционного моста между клеточным старением и старением организма (Muñoz-Espín and Serrano, 2014; Calimport et al.
, 2012; Heidinger et al., 2012; Muñoz-Lorente et al., 2019). Из первоначальных мыслей, указывающих на то, что старение служит в первую очередь противораковым механизмом, мы отмечаем появившееся представление о том, что старение также действует как движущая сила широкого спектра возрастных патологий (Fernandes et al., 2016). Более поздние исследования последнего десятилетия, которые привели к разработке трансгенов и химических возмущающих факторов, наконец дали нам инструменты для избирательного управления количеством стареющих клеток in vivo . Тщательная характеристика их вредоносного секреторного фенотипа, который различается в разных типах клеток, продолжает улучшать наше понимание того, как они способствуют широкому спектру возрастных заболеваний, наблюдаемых в наших популяциях. Наконец, когда первые сенолитики проходят клинические испытания, мы находимся на пороге установления трансляционного моста между клеточным старением и старением организма (Muñoz-Espín and Serrano, 2014; Calimport et al.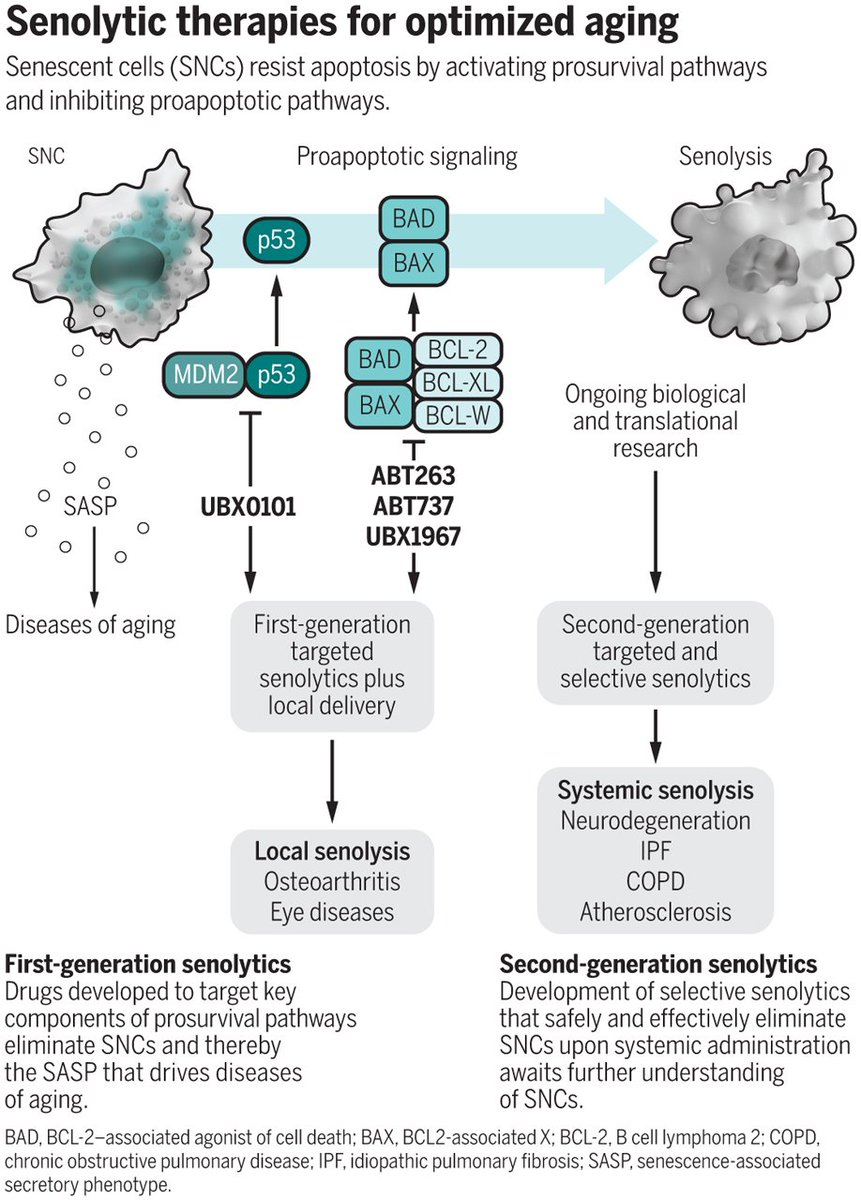 , 2019; Gorgoulis et al., 2019), которые могут помочь облегчить бремя многих возрастных патологий.
, 2019; Gorgoulis et al., 2019), которые могут помочь облегчить бремя многих возрастных патологий.
Вклад авторов
Все перечисленные авторы внесли существенный, непосредственный и интеллектуальный вклад в работу и одобрили ее для публикации.
Финансирование
Работа выполнена при поддержке гранта КР Канадского института медицинских исследований (MOP-133646).
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Каталожные номера
Alcorta, D.A., Xiong, Y., Phelps, D., Hannon, G., Beach, D., and Barrett, J.C. (1996). Участие ингибитора циклинзависимой киназы p16 (INK4a) в репликативном старении нормальных фибробластов человека. Проц. Натл. акад. науч. США 93, 13742–13747. doi: 10.1073/pnas.93.24.13742
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Атаджа, П.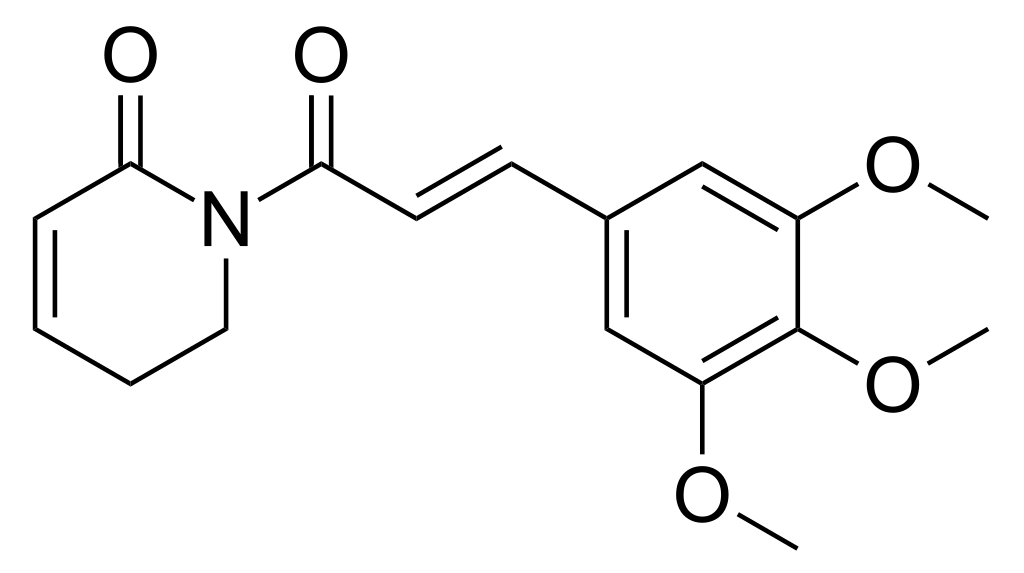 , Вонг, Х., Гаркавцев, И., Вейлетт, К. и Рябоволь, К. (1995).Повышенная активность р53 в стареющих фибробластах. Проц. Натл. акад. науч. США 92, 8348–8352. doi: 10.1073/pnas.92.18.8348
, Вонг, Х., Гаркавцев, И., Вейлетт, К. и Рябоволь, К. (1995).Повышенная активность р53 в стареющих фибробластах. Проц. Натл. акад. науч. США 92, 8348–8352. doi: 10.1073/pnas.92.18.8348
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Бейкер, Д. Дж., Чайлдс, Б. Г., Дурик, М., Вайерс, М. Е., Зибен, С. Дж., Чжун, Дж., и соавт. (2016). Встречающиеся в природе p16 Ink4a-положительные клетки сокращают продолжительность здоровой жизни. Природа 530, 184–189. doi: 10.1038/nature16932
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Бейкер, Д.J., Wijshake, T., Tchkonia, T., Lebrasseur, N.K., Childs, B.G., Van De Sluis, B., et al. (2011). Удаление p16 Ink4a-позитивных стареющих клеток задерживает связанные со старением расстройства. Природа 479, 232–236. doi: 10.1038/nature10600
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Барардо Д., Торнтон Д., Топпил Х. , Уолш М., Шарифи С., Феррейра С. и др. (2017). База данных наркотиков, связанных со старением. Ячейка старения 16, 594–597.doi: 10.1111/ускор.12585
, Уолш М., Шарифи С., Феррейра С. и др. (2017). База данных наркотиков, связанных со старением. Ячейка старения 16, 594–597.doi: 10.1111/ускор.12585
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Бенсон, Э.К., Ли, С.В., и Ааронсон, С.А. (2010). Роль индуцированной прогерином дисфункции теломер в преждевременном клеточном старении HGPS. J. Cell Sci. 123, 2605–2612. doi: 10.1242/jcs.067306
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Браун, Дж. П., Вей, В., и Седиви, Дж. М. (1997). Обход сенесценции после разрушения гена p21(CIP1)/(WAF1) в нормальных диплоидных фибробластах человека. Наука 277, 831–834. doi: 10.1126/наука.277.5327.831
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Буссиан, Т.Дж., Азиз, А., Мейер, К.Ф., Свенсон, Б.Л., ван Дерсен, Дж.М., и Бейкер, Д.Дж. (2018). Удаление стареющих глиальных клеток предотвращает тау-зависимую патологию и снижение когнитивных функций. Природа 562, 578–582. doi: 10.1038/s41586-018-0543-y
Природа 562, 578–582. doi: 10.1038/s41586-018-0543-y
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Калимпорт, С.Р.Г., Бентли Б.Л., Стюарт С.Е., Павелец Г., Скутери А., Винчигерра М. и соавт. (2019). Чтобы помочь стареющему населению, классифицируйте старение организма. Наука 366, 576–578. doi: 10.1126/science.aay7319
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Кампизи, Дж. (1997). Биология репликативного старения. евро. J. Cancer Part A 33, 703–709. doi: 10.1016/S0959-8049(96)00058-5
Полнотекстовая перекрестная ссылка | Академия Google
Цао, К., Blair, C.D., Faddah, D.A., Kieckhaefer, J.E., Olive, M., Erdos, M.R., et al. (2011). Дисфункция прогерина и теломер совместно запускает клеточное старение в нормальных фибробластах человека. Дж. Клин. Вкладывать деньги. 121, 2833–2844. DOI: 10.1172/JCI43578
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Chicas, A. , Wang, X., Zhang, C., McCurrach, M., Zhao, Z., Mert, O., et al. (2010). Анализ уникальной роли супрессора опухоли ретинобластомы во время клеточного старения. Раковая клетка 17, 376–387. doi: 10.1016/j.ccr.2010.01.023
, Wang, X., Zhang, C., McCurrach, M., Zhao, Z., Mert, O., et al. (2010). Анализ уникальной роли супрессора опухоли ретинобластомы во время клеточного старения. Раковая клетка 17, 376–387. doi: 10.1016/j.ccr.2010.01.023
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Коппе, Дж. П., Патил, С. К., Родье, Ф., Сан, Ю., Муньос, Д. П., Гольдштейн, Дж., и соавт. (2008). Ассоциированные со старением секреторные фенотипы обнаруживают клеточно-неавтономные функции онкогенной RAS и опухолевого супрессора p53. PLoS Биол. 6: 2853–68. doi: 10.1371/journal.pbio.0060301
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Фернандес, М., Wan, C., Tacutu, R., Barardo, D., Rajput, A., Wang, J., et al. (2016). Систематический анализ геронтома выявляет связь между старением и возрастными заболеваниями. Гул. Мол. Жене. 25, 4804–4818. DOI: 10.1093/hmg/ddw307
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Fick, L. J., Fick, G.H., Li, Z., Cao, E., Bao, B., Heffelfinger, D., et al. (2012). Длина теломер коррелирует с продолжительностью жизни собак разных пород. Cell Rep. 2, 15:30–15:36. дои: 10.1016/j.celrep.2012.11.021
J., Fick, G.H., Li, Z., Cao, E., Bao, B., Heffelfinger, D., et al. (2012). Длина теломер коррелирует с продолжительностью жизни собак разных пород. Cell Rep. 2, 15:30–15:36. дои: 10.1016/j.celrep.2012.11.021
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Fuhrmann-Stroissnigg, H., Ling, Y.Y., Zhao, J., McGowan, S.J., Zhu, Y., Brooks, R.W., et al. (2017). Идентификация ингибиторов HSP90 как нового класса сенолитиков. Нац. коммун. 8:422. doi: 10.1038/s41467-017-00314-z
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Гаркавцев И., Казаров А., Гудков А. и Рябовол К. (1996). Подавление нового ингибитора роста p33(ING1) способствует неопластической трансформации. Нац. Жене. 14, 415–420. doi: 10.1038/ng1296-415
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Гевирц, Д. А., Холт, С. Е., и Элмор, Л. В. (2008). Ускоренное старение: новая роль в ответе опухолевых клеток на химиотерапию и облучение.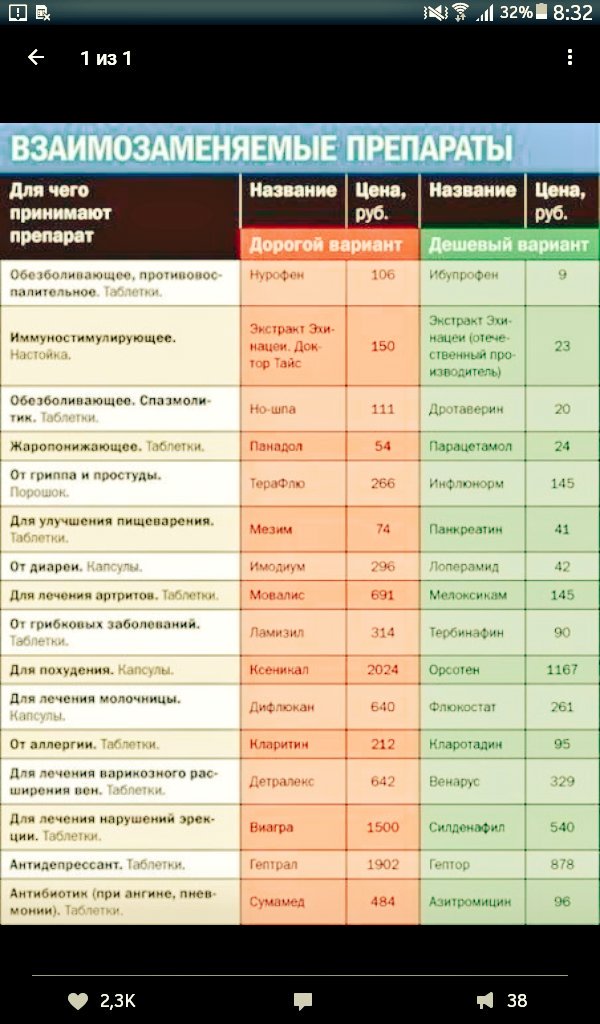 Биохим. Фармакол. 76, 947–957. doi: 10.1016/j.bcp.2008.06.024
Биохим. Фармакол. 76, 947–957. doi: 10.1016/j.bcp.2008.06.024
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Горгулис, В., Адамс, П. Д., Алимонти, А., Bennett, D.C., Bischof, O., Bishop, C., et al. (2019). Клеточное старение: определение пути вперед. Сотовый 179, 813–827. doi: 10.1016/j.cell.2019.10.005
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Герреро, А., Гихо, Р., Эрранц, Н., Урен, А., Уизерс, Д. Дж., Мартинес-Барбера, Дж. П., и другие. (2019). Пролекарства дуокармицина, модифицированные галактозой, в качестве сенолитиков. bioRxiv [Препринт] doi: 10.1101/746669
Полнотекстовая перекрестная ссылка | Академия Google
Хейфлик, Л.и Мурхед, П. С. (1961). Серийное культивирование штаммов диплоидных клеток человека. Экспл. Сотовый рез. 25, 585–621. дои: 10.1016/0014-4827(61)
-6
Полнотекстовая перекрестная ссылка | Академия Google
Хайдингер, Б. Дж., Блаунт, Дж. Д., Бонер, В., Гриффитс, К., Меткалф, Н. Б., и Монаган, П. (2012). Длина теломер в раннем возрасте предсказывает продолжительность жизни. Проц. Натл. акад. науч. США 109, 1743–1748. doi: 10.1073/pnas.1113306109
Дж., Блаунт, Дж. Д., Бонер, В., Гриффитс, К., Меткалф, Н. Б., и Монаган, П. (2012). Длина теломер в раннем возрасте предсказывает продолжительность жизни. Проц. Натл. акад. науч. США 109, 1743–1748. doi: 10.1073/pnas.1113306109
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Хиксон, Л.Т.Дж., Ланги Прата, Л.Г.П., Бобарт, С.А., Эванс, Т.К., Гиоргадзе, Н., Хашми, С.К., и соавт. (2019). Сенолитики уменьшают количество стареющих клеток у людей: предварительный отчет о клиническом испытании дазатиниба в сочетании с кверцетином у людей с диабетической болезнью почек. EBioMedicine 47, 446–456. doi: 10.1016/j.ebiom.2019.08.069
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Холлерер И., Баркер Дж. К., Йоргенсен В., Трезенридер А., Дугаст-Дарзак К., Chan, L.Y., et al. (2019). Доказательства встроенного механизма репрессии генов, основанного на переключении изоформ мРНК в клетках человека. G3 9, 1045–1053. doi: 10.1534/g3.118.200802
doi: 10.1534/g3.118.200802
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Huang, Y.T., Hwang, J.J., Lee, P.P., Ke, F.C., Huang, J.H., Huang, C.J., et al. (1999). Влияние лютеолина и кверцетина, ингибиторов тирозинкиназы, на рост клеток и свойства, связанные с метастазированием, в клетках A431, сверхэкспрессирующих рецептор эпидермального фактора роста. Бр. Дж. Фармакол. 128, 999–1010. doi: 10.1038/sj.bjp.0702879
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Чон, О. Х., Ким, К., Лаберж, Р. М., Демария, М., Ратод, С., Вассерот, А. П., и соавт. (2017). Локальный клиренс стареющих клеток ослабляет развитие посттравматического остеоартрита и создает прорегенеративную среду. Нац. Мед. 23, 775–781. doi: 10.1038/nm.4324
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Джастис, Дж.N., Nambiar, A.M., Tchkonia, T., LeBrasseur, N.K., Pascual, R., Hashmi, S. K., et al. (2019). Сенолитики при идиопатическом легочном фиброзе: результаты первого открытого пилотного исследования на людях. EBioMedicine 40, 554–563. doi: 10.1016/j.ebiom.2018.12.052
K., et al. (2019). Сенолитики при идиопатическом легочном фиброзе: результаты первого открытого пилотного исследования на людях. EBioMedicine 40, 554–563. doi: 10.1016/j.ebiom.2018.12.052
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Каркулис П.К., Стравоподис Д.Дж., Константинаку Э.Г. и Вутсинас Г.Е. (2013). Направленное ингибирование белка теплового шока 90 нарушает несколько онкогенных сигнальных путей, вызывая, таким образом, остановку клеточного цикла и запрограммированную гибель клеток в клеточных линиях рака мочевого пузыря человека. Раковая ячейка Int. 13:11. дои: 10.1186/1475-2867-13-11
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Kim, K.M., Noh, J.H., Bodogai, M., Martindale, J.L., Yang, X., Indig, F.E., et al. (2017). Идентификация нацеливаемого белка DPP4 на поверхности стареющих клеток. Гены Дев. 31, 1529–1534. doi: 10.1101/gad.302570.117
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ли, Б. Ю., Хан, Дж.А., Им, Дж.С., Морроне, А., Johung, K., Goodwin, E.C., et al. (2006). Бета-галактозидаза, связанная со старением, представляет собой лизосомальную бета-галактозидазу. Ячейка старения 5, 187–195. doi: 10.1111/j.1474-9726.2006.00199.x
Ю., Хан, Дж.А., Им, Дж.С., Морроне, А., Johung, K., Goodwin, E.C., et al. (2006). Бета-галактозидаза, связанная со старением, представляет собой лизосомальную бета-галактозидазу. Ячейка старения 5, 187–195. doi: 10.1111/j.1474-9726.2006.00199.x
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Монтеро, Дж. К., Сеоане, С., Окана, А., и Пандиелла, А. (2011). Ингибирование дазатинибом киназ семейства Src и рецепторных тирозинкиназ: возможные комбинации при солидных опухолях. клин. Рак рез. 17, 5546–5552. дои: 10.1158/1078-0432.CCR-10-2616
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Москалев А., Чернягина Э., де Магальяйнс Дж. П., Барардо Д., Топпил Х., Шапошников М. и др. (2015). Geroprotectors.org: новая, структурированная и курируемая база данных текущих терапевтических вмешательств при старении и возрастных заболеваниях. Старение 7, 616–628. doi: 10.18632/aging.100799
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Муньос-Лоренте, М. А., Кано-Мартин, А.С., и Бласко, Массачусетс (2019). Мыши со сверхдлинными теломерами демонстрируют меньшее метаболическое старение и большую продолжительность жизни. Нац. коммун. 10:4723. doi: 10.1038/s41467-019-12664-x
А., Кано-Мартин, А.С., и Бласко, Массачусетс (2019). Мыши со сверхдлинными теломерами демонстрируют меньшее метаболическое старение и большую продолжительность жизни. Нац. коммун. 10:4723. doi: 10.1038/s41467-019-12664-x
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Муньос-Эспин, Д., Ровира, М., Галиана, И., Хименес, К., Лосано-Торрес, Б., Паес-Рибес, М., и др. (2018). Универсальная система доставки лекарств, нацеленная на стареющие клетки. EMBO мол. Мед. 10: e9355. doi: 10.15252/emmm.201809355
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Наг, С., Цинь, Дж., Шривенугопал, К.С., Ван, М., и Чжан, Р. (2013). Пересмотр пути MDM2-p53. Дж. Биомед. Рез. 27, 254–271. doi: 10.7555/JBR.27.20130030
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Овадья Ю., Ландсбергер Т., Лейнс Х., Вадаи Э., Гал Х., Биран А. и др. (2018). Нарушение иммунного надзора ускоряет накопление стареющих клеток и старение.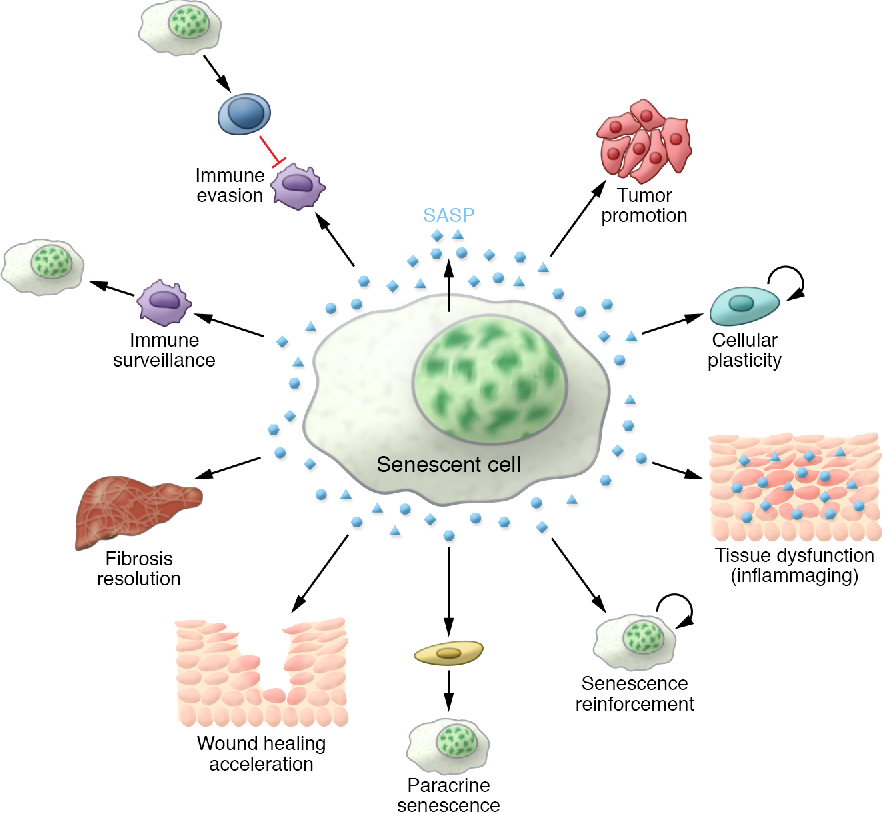 Нац. коммун. 9:5435. doi: 10.1038/s41467-018-07825-3
Нац. коммун. 9:5435. doi: 10.1038/s41467-018-07825-3
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Park, S.C., Park, J.S., Park, WY, Cho, K.A., Ahn, J.S., and Jang, I.S. (2002). Понижение регуляции рецептор-опосредованного эндоцитоза ответственно за гипореактивность, связанную со старением. Энн. Н. Я. акад. науч. 959, 45–49. doi: 10.1111/j.1749-6632.2002.tb02081.x
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Парринелло, С., Сампер Э., Кртолица А., Гольдштейн Дж., Мелов С. и Кампизи Дж. (2003). Чувствительность к кислороду серьезно ограничивает репликативную продолжительность жизни мышиных фибробластов. Нац. Клеточная биол. 5, 741–747. дои: 10.1038/ncb1024
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Писковацкая В., Стефанишин Н., Стори К. Б., Вайсерман А. М. и Лущак О. (2019). Метформин как геропротектор: экспериментальные и клинические данные. Биогеронтология 20, 33–48.doi: 10.1007/s10522-018-9773-5
Биогеронтология 20, 33–48.doi: 10.1007/s10522-018-9773-5
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Раджараджачолан, Великобритания, и Риабовол, К. (2015). Старение с ING: сравнительное исследование различных форм преждевременного старения, вызванного стрессом. Онкотарджет 6, 34118–34127. doi: 10.18632/oncotarget.5947
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Раджараджачолан, Великобритания, Талаппилли, С., и Риабовол, К. (2013). Супрессор опухоли ING1a регулирует эндоцитоз, чтобы вызвать клеточное старение через путь Rb-E2F. PLoS Биол. 11: e1001502. doi: 10.1371/journal.pbio.1001502
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Роблес, С.Дж., Бюлер, П.В., Негруш, А., и Адами, Г.Р. (1999). Постоянная остановка клеточного цикла в асинхронно пролиферирующих нормальных фибробластах человека, обработанных доксорубицином или этопозидом, но не камптотецином. Биохим. Фармакол. 58, 675–685. дои: 10.1016/S0006-2952(99)00127-6
Полнотекстовая перекрестная ссылка | Академия Google
Сагив, А., Биран А., Йон М., Саймон Дж., Лоу С.В. и Крижановский В. (2013). Экзоцитоз гранул опосредует иммунный надзор за стареющими клетками. Онкоген 32, 1971–1977. doi: 10.1038/onc.2012.206
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Thapa, R.K., Nguyen, H.T., Jeong, J.H., Kim, J.R., Choi, H.G., Yong, C.S., et al. (2017). Прогрессирующее замедление/предотвращение клеточного старения за счет доставки рапамицина, нацеленного на CD9, с использованием наночастиц карбоната кальция, обернутых лактозой. Науч. Респ. 7:43299. дои: 10.1038/srep43299
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Унрин, Б.М., Хао, Д., Глюк, С., и Риабоволь, К.Т. (2006). Ускорение потери теломер при химиотерапии выше у пожилых пациентов с местнораспространенным раком головы и шеи. клин. Рак рез. 12, 6345–6350. doi: 10.1158/1078-0432.CCR-06-0486
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Вазири, Х., Уэст, М.D., Allsopp, R.C., Davison, T.S., Wu, Y.S., Arrowsmith, C.H., et al. (1997). АТМ-зависимая потеря теломер в стареющих диплоидных фибробластах человека и повреждение ДНК приводят к посттрансляционной активации белка р53 с участием поли(АДФ-рибозо)полимеразы. EMBO J. 16, 6018–6033. doi: 10.1093/emboj/16.19.6018
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ван, Э. (1995). Стареющие фибробласты человека сопротивляются запрограммированной гибели клеток, и в этом участвует неспособность подавить белл. Рак Res. 55, 2284–2292.
Академия Google
Уитон, К., Сэмпсел, К., Бойсверт, Ф.М., Дэви, А., Роббинс, С., и Риабовол, К. (2001). Потеря функциональных кавеол при старении фибробластов человека. Дж. Сотовый. Физиол. 187, 226–235. doi: 10.1002/jcp.1071
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Wiley, C.D., Schaum, N., Alimirah, F., Lopez-Dominguez, J.A., Orjalo, A.V., Scott, G., et al. (2018).Низкомолекулярные антагонисты MDM2 ослабляют секреторный фенотип, связанный со старением. Науч. Респ. 8:2410. doi: 10.1038/s41598-018-20000-4
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Xue, W., Zender, L., Miething, C., Dickins, R. A., Hernando, E., Krizhanovsky, V., et al. (2011). Старение и удаление опухоли запускается восстановлением р53 в карциномах печени мышей (Nature (2007) 445 (656-660)). Природа 473:544. doi: 10.1038/nature09909
Полнотекстовая перекрестная ссылка | Академия Google
Янг, А.R.J., Narita, M., Ferreira, M., Kirschner, K., Sadaie, M., Darot, J.F.J., et al. (2009). Аутофагия опосредует переход к митотическому старению. Гены Дев. 23, 798–803. doi: 10.1101/gad.519709
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Zhu, Y., Tchkonia, T., Fuhrmann-Stroissnigg, H., Dai, H.M., Ling, Y.Y., Stout, M.B., et al. (2016). Идентификация нового сенолитического агента, навитоклакса, нацеленного на семейство антиапоптотических факторов Bcl-2. Ячейка старения 15, 428–435. doi: 10.1111/ускор.12445
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Чжу, Ю., Чкония, Т., Пирцхалава, Т., Гауэр, А.С., Дин, Х., Гиоргадзе, Н., и соавт. (2015). Ахиллесова пята стареющих клеток: от транскриптома к сенолитическим препаратам. Ячейка старения 14, 644–658. doi: 10.1111/ускорение.12344
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Что такое сенолитики? Краткий обзор сенотерапии
В этой статье мы рассмотрим сенолитики и то, как они могут обратить вспять некоторые аспекты процесса старения.
Стареющие клетки и старениеПо мере того, как ваше тело стареет, все большее количество ваших клеток вступает в состояние старения. Стареющие клетки не делятся и не поддерживают ткани, частью которых они являются; вместо этого они излучают ряд потенциально вредных химических сигналов, которые побуждают близлежащие клетки переходить в такое же старческое состояние. Сигналы, которые они секретируют, представляют собой провоспалительные цитокины, хемокины и протеазы внеклеточного матрикса, которые вместе образуют секреторный фенотип, ассоциированный со старением, или SASP.
Их присутствие вызывает множество проблем: они ухудшают функцию тканей, повышают уровень хронического воспаления и даже могут в конечном итоге повысить риск развития рака. Стареющие клетки обычно уничтожают себя посредством запрограммированного процесса, называемого апоптозом, и они также удаляются иммунной системой; однако с возрастом иммунная система ослабевает, и все большее количество этих стареющих клеток ускользает от этого процесса и накапливается.
К тому времени, когда люди достигают старости, в организме накапливается значительное количество этих стареющих клеток, вызывая воспаление и повреждение окружающих клеток и тканей.Накопление стареющих клеток является одной из причин нашего старения [1-2].
Что такое сенолитики?Давно предполагалось, что терапевтическое удаление стареющих клеток может быть решением проблемы их накопления.
Новый класс препаратов, известных как сенолитики, направлен на уничтожение этих упрямых «неподдающихся смерти» клеток в организме с целью уменьшения воспаления и улучшения функции тканей. Эти препараты разрабатываются как селективные, что означает, что они могут запускать апоптоз в стареющих определенных клетках, оставляя здоровые клетки в покое.
Как действуют сенолитики?Сенолитики работают, воздействуя на один из нескольких путей выживания, которые стареющие клетки используют, чтобы избежать апоптоза и цепляться за жизнь. Одна из проблем при работе со стареющими клетками заключается в том, что в наших тканях и органах существует ряд различных популяций этих клеток, каждая из которых использует разные пути выживания. Возможно, необходимо использовать несколько сенолитических препаратов для удаления стареющих клеток с использованием различных путей выживания.
Кроме того, некоторые стареющие клетки также играют роль в заживлении ран, поэтому лучше понять, что делают эти разные популяции стареющих клеток, крайне важно, прежде чем решать, на какие из них нацеливаться.
Как были открыты сенолитикиБыло показано, что здоровье и продолжительность жизни мышей улучшаются при удалении стареющих клеток (и снижении SASP) с использованием трансгенного суицидного гена [3], а дополнительные эксперименты показали, что того же можно добиться с помощью малых молекул.Считается, что SASP в значительной степени способствует старению [4] и раку [5]; таким образом, сенолитики и удаление SASP являются потенциальной стратегией укрепления здоровья и долголетия.
С помощью анализа транскриптов было обнаружено, что стареющие клетки имеют повышенную экспрессию генов, способствующих выживанию, что согласуется с их устойчивостью к апоптозу [6]. Лекарства, воздействующие на эти факторы выживания, избирательно убивают стареющие клетки. Двумя такими препаратами были дазатиниб и кверцетин, которые оба были способны удалять стареющие клетки, но были лучше в разных типах тканей.
Однако было обнаружено, что комбинация двух препаратов образует синергию, значительно более эффективную при удалении некоторых типов стареющих клеток [7].
В других исследованиях удаления только тридцати процентов стареющих клеток было достаточно, чтобы замедлить возрастное снижение. Эти результаты свидетельствуют о возможности селективной абляции стареющих клеток и эффективности сенолитиков в облегчении болезней старения и продвижении здорового долголетия [8, 9, 10].
Сенолитики и возрастные заболеванияЕще раз подтверждая потенциал сенолитиков для лечения возрастных заболеваний, недавнее исследование продемонстрировало преимущества сенолитиков при определенных аспектах старения сосудов [11].Это было первое исследование, показавшее, что удаление стареющих клеток улучшает аспекты старения сосудов и хронической гиперхолестеринемии, что делает сенолитики возможным жизнеспособным методом снижения заболеваемости и смертности от сердечно-сосудистых заболеваний.
Еще недавно был достигнут прогресс в лечении атеросклероза с использованием сенолитиков для воздействия на «пенистые клетки», которые способствуют этому заболеванию [12]. Также был достигнут прогресс в лечении диабета 2 типа с помощью удаления стареющих клеток [13].Сенолитики также могут замедлять старение кожи [14] и лечить остеоартрит [15].
Стареющие клетки, однако, не все плохие, и данные показывают, что они играют роль в клеточном перепрограммировании [16] и заживлении ран. Как и все в биологии, это явно вопрос баланса: слишком большой клиренс стареющих клеток будет плохим для заживления ран и клеточного перепрограммирования, но слишком много стареющих клеток приведет к повреждению [17, 18].
Таким образом, ключом к разработке эффективной сенолитической терапии, которая борется с болезнями старения, является создание еще более точных биомаркеров для измерения числа стареющих клеток в ткани [19] в сочетании с эффективными методами доставки для селективного удаления стареющих клеток.
Компании-разработчики сенолитиковЗа последние несколько лет интерес к сенолитикам резко возрос. В эту область области притекают инвестиционные деньги, и сегодня существует множество компаний, разрабатывающих сенолитические препараты. Это ни в коем случае не исчерпывающий список, и мы будем добавлять его в ближайшие месяцы.
Юнити БиотехнологияБазирующаяся в Южном Сан-Франциско компания Unity Biotechnology была основана в 2011 году доктором.Натаниэль Дэвид, Ян Ван Дерсен, Джуди Кампизи и Даохун Чжоу. Компания получила значительные инвестиции от Longevity Fund, Jeff Bezos Expeditions, Founders Fund и ARCH Venture Partners. Unity получила 200 миллионов долларов венчурного финансирования и привлекла 85 миллионов долларов на IPO.
Unity был создан на основе открытий лаборатории ван Дерсена в клинике Майо и лаборатории Кампизи в Институте Бака, которые предположили, что очистка стареющих клеток полезна для мышей и может увеличить продолжительность здоровья и, возможно, продолжительность жизни.
Будучи лидером стаи и первой биотехнологической компанией, поразившей клинику сенолитиками, Unity всегда приходилось труднее, чем компаниям, следующим за ней. Делать что-то первым, продвигаться вперед в неизвестность и пытаться изменить правила игры редко бывает легко.
Об этом свидетельствуют некоторые разочаровывающие новости для биотехнологической компании Unity в прошлом году: их первый удар по воротам кандидата в лекарства UBX0101, ингибитора MDM2-p53 для лечения остеоартрита коленного сустава, к сожалению, не увенчался успехом.Биология старения сложна, результаты у мышей не всегда проявляются, и не всегда все идет так, как хотелось бы, это просто природа зверя.
Удар на дороге, но исследования продолжаютсяК счастью, Unity продолжает настойчиво работать над другими лекарствами-кандидатами в процессе разработки.
ПрепаратUBX1325 для лечения диабетического макулярного отека в настоящее время находится на стадии 1 клинического исследования. Препарат ингибирует Bcl-xL (семейство Bcl-2), альтернативный путь выживания, который стареющие клетки используют для уклонения от апоптоза.В настоящее время идет набор участников, и мы ожидаем, что результаты испытания будут объявлены где-то в июле 2021 года или вскоре после этого.
UBX1967 также разрабатывается для лечения заболеваний глаз, которые могут включать диабетический макулярный отек, диабетическую ретинопатию и дегенерацию желтого пятна у взрослых. В настоящее время нет никаких сроков, когда это может достичь клинических испытаний.
Кроме того, Unity также имеет ранние разработки в области неврологии благодаря тому, что исследователи из клиники Майо обнаружили связь со стареющими глиальными клетками и патологией тау и, как следствие, возникновением нейродегенеративных заболеваний в исследовании 2018 года.
Неопределенное будущееUnity использует низкомолекулярный подход с перепрофилированными противораковыми препаратами, и ограничивающим фактором для этого может быть токсичность. Эти противораковые препараты могут быть вредны для здоровых клеток, а также для стареющих клеток, что ограничивает дозировку, которую можно использовать, и затрудняет системное лечение.
Например, известно, что ингибиторы Bcl-xL (включая UBX1325) разрушают тромбоциты и могут вызывать тромбоцитопению в высоких дозах. Возможно, локальных инъекций этих препаратов в низких дозах недостаточно для эффективного удаления стареющих клеток и вредных SASP, которые они производят.
Еще одна вещь, которую следует учитывать, это то, что Unity использует сенолитики первого поколения на основе исследований, в которых использовались перепрофилированные противораковые препараты, такие как дазатиниб и навитоклакс, или растительные флавонолы с плохой биодоступностью, такие как кверцетин и физетин. Это может стать проблемой в будущем, поскольку компании, идущие по пятам, уже разрабатывают сенолитики второго поколения, которые потенциально могут быть более избирательными и могут быть доставлены более эффективно с помощью таких методов, как генная терапия и системы доставки наночастиц.
Это не значит, что Unity не может добиться успеха здесь, но быть лидером стаи нелегко, когда ставки так высоки, а рядом есть другие, стремящиеся внедрить инновации в то, что было раньше.
Сива ТерапьютиксSiwa работает с нами с 2006 года, что делает их старейшей компанией по производству сенолитиков в этой области. Основанная Льюисом Грубером и Мисти Грубер, компания базируется в Чикаго, штат Иллинойс. По сравнению с Unity у компании гораздо скромнее $1.6 миллионов в фондировании их кандидата 318H, который в настоящее время находится на доклиническом этапе.
Их подход несколько более необычен, чем типичный низкомолекулярный подход, используемый другими, поскольку они решили разработать иммунотерапевтический ответ на стареющие клетки, в частности моноклональное антитело.
ОсновательЛьюис Грубер сказал в интервью Lifespan.io в 2020 году: «Это просто типичный продукт моноклональных антител, тот же вид иммунотерапии, который используется в различных методах лечения рака.
SIWA определила, что как стареющие, так и раковые клетки имеют более высокие уровни гликолиза, первого этапа расщепления глюкозы для извлечения энергии, которая будет использоваться в клеточном метаболизме. Моноклональное антитело 318H нацелено на стареющие и раковые клетки посредством антигенного маркера этого повышенного гликолиза, который компания еще не раскрыла.
В доклинических исследованиях у мышей естественного возраста, которым вводили 318H, наблюдалось снижение на 66% p16INK4a-позитивных стареющих клеток и увеличение мышечной массы.Потеря мышечной массы, известная как саркопения, обычно наблюдается во время старения, и ее изменение предполагает некоторый уровень омоложения тканей в результате лечения. SIWA также сообщает о значительном снижении метастазирования на 30% в моделях мышей с тройным негативным раком молочной железы.
Хотя SIWA еще не объявила дату начала каких-либо клинических испытаний, они завершили исследования переносимости на приматах и готовят заявку на получение нового исследовательского препарата (IND) в FDA.Вполне вероятно, что 318H найдет применение при раке раньше, чем при возрастных заболеваниях.
Сенолитическая терапияКомпания Senolytic Therapeutics, расположенная в Барселоне и входящая в группу компаний Life Biosciences, была создана в 2017 году и соучредителями которой являются доктор Марк Рамис Кастельторт и доктор Мануэль Серрано.
Подробности того, над чем работает компания, в настоящее время окутаны тайной из-за того, что они не раскрывают публично слишком много информации о своем конвейере.Тем не менее, есть некоторая информация, если достаточно поискать, чтобы собрать воедино хотя бы часть того, что они делают.
У них есть два кандидата в сенолитики, STX519 и STX43, и, основываясь на презентациях этой компании на конференции, кажется вероятным, что будущие клинические испытания будут сосредоточены на фиброзных заболеваниях печени, легких и почек.
У них также есть STX255, моноклональное антитело, которое нацеливается на белки поверхности стареющих клеток, а затем привлекает иммунную систему для очищения стареющих клеток.STX255 был лицензирован швейцарской биотехнологической компанией Rejuveron, которая занимается иммуноопосредованным удалением стареющих клеток в области онкологии и старения. Этот подход к близнецовому раку и стареющим клеткам имеет смысл, поскольку известно, что суровая химиотерапия создает стареющие клетки в качестве побочного повреждения, поэтому удаление стареющих клеток, вызванных химиотерапией, может помочь предотвратить рецидив рака.
Они также разрабатывают систему доставки наночастиц, чтобы обеспечить более целенаправленный подход и доставлять сенолитические полезные нагрузки в целевые клеточные популяции.
ЗаключениеИсследование сенолитиков резко возросло за последние несколько лет, и в настоящее время многие компании разрабатывают эти препараты. Поскольку некоторые из них в настоящее время проходят испытания на людях, а другие уже позади, есть надежда, что вскоре один из них добьется успеха.
Другой подход к проблемным клеткам заключается не в их уничтожении, а в изменении посылаемых ими сигналов. Это известно как сеноморфия. В случае успеха это сделает клетки менее воспалительными и вредными.
Какой из двух методов борьбы со стареющими клетками является наиболее эффективным, в настоящее время неизвестно, и оба подхода в настоящее время разрабатываются.
Литература[1] Лопес-Отин, К., Бласко, М.А., Партридж, Л., Серрано, М., и Кремер, Г. (2013). Признаки старения. Сотовый, 153 (6), 1194-1217.
[2] ван Дерсен, Дж. М. (2014). Роль стареющих клеток в старении. Природа, 509 (7501), 439–446.
[3] Бейкер, Д. Дж., Вийшейк, Т., Чкония, Т., ЛеБрассер, Н.К., Чайлдс, Б.Г., Ван Де Слуис, Б., … и ван Дерсен, Дж. М. (2011). Клиренс p16Ink4a-позитивных стареющих клеток задерживает возрастные расстройства. Природа, 479(7372), 232–236.
[4] Фройнд, А., Орьяло, А.В., Деспре, П.Ю., и Кампизи, Дж. (2010). Воспалительные сети при клеточном старении: причины и последствия. Тенденции в молекулярной медицине, 16(5), 238–246.
[5] Коппе, Дж. П., Деспре, П. Ю., Кртолика, А., и Кампизи, Дж.(2010). Секреторный фенотип, связанный со старением: темная сторона подавления опухоли. Ежегодный обзор патологии, 5, 99.
[6] Чжу, Ю., Чкония, Т., Пирцхалава, Т., Гауэр, А.С., Дин, Х., Гиоргадзе, Н., … и О’Хара, С.П. (2015). Ахиллесова пята стареющих клеток: от транскриптома к сенолитическим препаратам. Ячейка старения, 14(4), 644–658.
[7] Чжу, Ю., Чкония, Т., Пирцхалава, Т., Гауэр, А.С., Дин, Х., Гиоргадзе, Н., … и О’Хара, С.П. (2015). Ахиллесова пята стареющих клеток: от транскриптома к сенолитическим препаратам.Ячейка старения, 14(4), 644–658.
[8] Чкония, Т., Чжу, Ю., Ван Дерсен, Дж., Кампизи, Дж., и Киркланд, Дж. Л. (2013). Клеточное старение и старческий секреторный фенотип: терапевтические возможности. Журнал клинических исследований, 123(3), 966–972.
[9] Чжу, Ю., Армстронг, Дж. Л., Чкония, Т., и Киркланд, Дж. Л. (2014). Клеточное старение и старческий секреторный фенотип при возрастных хронических заболеваниях. Current Opinion in Clinical Nutrition & Metabolic Care, 17(4), 324–328.
[10] Чжу, Ю., Чкония, Т., Пирцхалава, Т., Гауэр, А.С., Дин, Х., Гиоргадзе, Н., … и О’Хара, С.П. (2015). Ахиллесова пята стареющих клеток: от транскриптома к сенолитическим препаратам. Ячейка старения, 14(4), 644–658.
[11] Роос, К.М., Чжан, Б., Палмер, А.К., Огродник, М.Б., Пирцхалава, Т., Талджи, Н.М., … и Чжу, Ю. (2016). Хроническое лечение сенолитиками облегчает установившуюся вазомоторную дисфункцию у старых мышей или мышей с атеросклерозом. Стареющая клетка.
[12] Чайлдс, Б.Г., Бейкер, Д. Дж., Вийшейк, Т., Коновер, К. А., Кампизи, Дж., И ван Дерсен, Дж. М. (2016). Стареющие пенистые клетки интимы вредны на всех стадиях атеросклероза. Наука, 354(6311), 472–477.
[13] Палмер, А. К., Чкония, Т., ЛеБрассер, Н. К., Чини, Е. Н., Сюй, М., и Киркланд, Дж. Л. (2015). Клеточное старение при диабете 2 типа: терапевтическая возможность. Диабет, 64(7), 2289–2298.
[14] Веларде, М. К., и Демария, М. (2016). Ориентация на стареющие клетки: возможные последствия для замедления старения кожи: мини-обзор.Геронтология.
[15] Сюй, М., Брэдли, Э. У., Вейвода, М. М., Хван, С. М., Пирцхалава, Т., Деклевер, Т., … и Лоу, В. (2016). Трансплантированные стареющие клетки вызывают у мышей состояние, подобное остеоартрозу. Журналы геронтологии, серия A: биологические науки и медицинские науки, glw154.
[16] Льюк Мостейро, Кристина Пантойя, Ноэлия Алькасар и др. (2016)Повреждение тканей и старение обеспечивают критические сигналы для клеточного перепрограммирования in vivo. Наука, 354 (6315).
[17] Демария, М., Отани, Н., Юссеф, С.А., Родье, Ф., Туссен, В., Митчелл, Дж. Р., … и Хоймейкерс, Дж. Х. (2014). Важная роль стареющих клеток в оптимальном заживлении ран благодаря секреции PDGF-AA. Ячейка развития, 31(6), 722-733.
[18] Томинага, К. (2015). Возникающая роль стареющих клеток в тканевом гомеостазе и патофизиологии. Патобиология старения и возрастных заболеваний, 5.
[19] Матьюсайтис М., Чин Г., Сарноски Э.А.и Штользинг, А. (2016). Биомаркеры для выявления и выделения стареющих клеток. Обзоры исследований старения, 29, 1–12.
Этот препарат на основе сенолитических антител может бороться со старением и болезнями, которые он вызывает
В последнее десятилетие стремление продлить человеческую жизнь и уменьшить страдания в сумерках обрело нового главного героя: сенолитики. Эти препараты способны уничтожать поврежденные клетки, которые накапливаются в нашем организме с возрастом, останавливая связанные с этим процессы заболевания, от болезни Альцгеймера до рака.Однако до недавнего времени они не были достаточно точными — наверняка атаковали проблемные клетки, но, вероятно, и хорошие.
Теперь пришло второе поколение сенолитиков. В прошлом месяце группа исследователей из университетов Лестера и Кембриджа объявила, что они разработали антитела, способные связываться со специфическими белками на поверхности клеток-мишеней, оставляя мало шансов на дружественный огонь и его неблагоприятные побочные эффекты. Каждое антитело, по сути, представляет собой ракету для поиска белка, нагруженную токсинами; он попадает внутрь, «а оказавшись внутри, он как бы взрывается», — говорит Сальвадор Масип, ведущий исследователь группы.«Вот почему мы называем это интеллектуальной бомбой».
Лекарство — творческий подход к существующему лекарству от рака — еще не тестировалось на людях или животных. Но этот прогресс приближает медицину на шаг ближе к решению того, что, по-видимому, является основной причиной многих возрастных заболеваний. И по мере того, как технология, стоящая за этим, совершенствуется, Масип и другие специалисты в его области надеются когда-нибудь противодействовать некоторым трудностям старения, таким как дряхлость. Хотя маловероятно, что мы когда-нибудь победим смерть, сенолитики могут помочь нам завершить нашу жизнь в здоровом теле и разуме.
Клетки нежити
Жизнь тяжела для наших клеток. На протяжении многих лет, когда они подвергаются воздействию химических веществ, инфекций, радиации и других факторов стресса, некоторые из них получают настолько серьезные повреждения, что могут представлять для нас только опасность, продолжая размножаться. Когда это время приходит, они жертвуют собой ради большего здоровья, прекращая делиться в процессе, известном как клеточное старение. Это предотвращает безудержное распространение дисфункциональных клеток, которое мы знаем как рак. Это важное звено в нашей физиологической броне.
Но, хотя сенесцентные клетки отключились в одном смысле, они остаются активными в другом. Ученые часто сравнивают их с зомби: по сути мертвыми, но тем не менее опасными. Они продолжают выделять химические вещества, которые способствуют воспалению, а иногда и стареют здоровые соседние клетки — цепная реакция, которая только усиливает метафору нежити. Когда иммунная система работает должным образом, эти бездельники быстро уничтожаются посредством апоптоза или запрограммированной гибели клеток. Но поскольку наша защита с возрастом ослабевает, они накапливаются.
Теперь эксперты считают, что разрастание стареющих клеток является причиной многих болезней, от которых страдают пожилые люди. За последнее десятилетие или около того исследования показали, что их удаление может отсрочить — даже обратить вспять — начало определенных патологий. Ажиотаж начался в 2011 году, когда исследователи из клиники Майо успешно вылечили катаракту, дегенерацию мышц и потерю жира с помощью сенолитиков первого поколения.
Однако с тех пор в поле боялись побочные эффекты.Хорошее эмпирическое правило, когда дело доходит до разработки медицинских методов лечения: лекарство не может быть хуже, чем проблема. Химиотерапия, как известно, ужасна, но мы часто терпим ее, когда альтернативой является смерть. Напротив, для многих других болезней, например, артрита, альтернативой лечению является просто дискомфорт. В таких случаях «побочные эффекты должны быть близки к нулю», — говорит Масип. «Вот почему нам нужны гораздо более специфические сенолитики».
Будущее борьбы со старением
Задача разработки методов лечения, которые будут воздействовать исключительно на нужные клетки, не исчезла с появлением новых антител.Это связано с тем, что любая мишень, на которой могут зафиксироваться антитела (в данном случае поверхностный белок), скорее всего, существует и в здоровых клетках, и во всем организме. Чтобы избежать попадания в товарищеские матчи, Масип предлагает будущим исследователям использовать два, три или более маркеров, увеличивая вероятность того, что комбинация будет ограничена стареющими клетками. Для каждого маркера можно сконструировать отдельные антитела, и только когда они все соберутся вместе, они взорвутся.
Но это головоломка для третьего и четвертого поколений.Что касается того препарата, который он помог запустить, Масип говорит: «Я надеюсь, что в течение следующего десятилетия мы увидим, как один или несколько целевых сенолитиков дойдут до испытаний». Он и его коллеги не единственные, кто работает над этой проблемой. Другая группа исследователей, возглавляемая онкологом из Кембриджа Даниэлем Муньос-Эспином, в прошлом году совершила прорыв, представив сенолитическое лечение рака, которое, похоже, выполняет свою миссию более тщательно, чем его предшественники.
По мере повышения точности сенолитики будут совместимы с более широким спектром заболеваний.Масип обрисовал примерное возможное развитие жизнеспособных методов лечения: сначала фиброз легких и рак, обе смертельные болезни, не поддающиеся лечению; затем болезнь Альцгеймера, также фатальная и неизлечимая, но менее изнуряющая физически; затем менее агрессивные расстройства, такие как диабет. Наконец, конечная цель состоит в том, чтобы выйти за рамки войны с конкретными болезнями и противостоять их общему знаменателю: старости. «Это своего рода смена парадигмы, — говорит Масип. «Вместо того, чтобы лечить болезнь, мы лечим состояние, которое приводит к болезни.Мы лечим старение».
Распространено заблуждение, что конечной целью исследований в области борьбы со старением является вечная жизнь, источник молодости или какая-то связанная с этим фантазия. «Это определенно не то, чем мы занимаемся», — говорит Масип. Скорее, идея состоит в том, чтобы прожить наши последние годы в хорошей форме, без слабости и дискомфорта. Может быть, мы сможем бегать марафоны в свои 70 или просто оставаться такими же активными, как и в 50. Это то, что медицинские работники имеют в виду под «продлением продолжительности жизни». Это вполне может привести к увеличению продолжительности жизни, но цель не в бессмертии.«Это не повернуть время вспять, — говорит Масип, — а сохранить здоровье кого-то дольше».
Сенолитики и сеноморфные препараты: природные и синтетические терапевтические средства для лечения старения и хронических заболеваний
Клеточное старение представляет собой гетерогенный процесс, управляемый генетическими, эпигенетическими факторами и факторами окружающей среды, характеризующий многие типы соматических клеток. Это было предложено в качестве признака старения, который, как полагают, способствует старению и хроническим заболеваниям. Стареющие клетки (SC) демонстрируют специфический секреторный фенотип, связанный со старением (SASP), в основном характеризующийся продукцией провоспалительных и разрушающих матрикс молекул.При накоплении SC индуцируется хроническое системное слабовыраженное воспаление, известное как воспаление. В свою очередь, эта хроническая активация иммунной системы приводит к снижению клиренса SC, создавая тем самым порочный круг, который подпитывает воспаление. Накопление СК является причинным фактором различных возрастных патологий. Ориентация на несколько признаков старения была предложена в качестве стратегии улучшения продолжительности здоровья и, возможно, продолжительности жизни. Следовательно, SC и SASP рассматриваются как потенциальные терапевтические мишени либо за счет селективного уничтожения SC, либо за счет селективной блокировки SASP с помощью природных или синтетических соединений.Эти соединения являются членами семейства агентов, называемых сенотерапевтическими средствами, которые подразделяются на сенолитики и сеноморфные средства. Некоторые из них уже проходят клинические испытания и, возможно, представляют собой будущее лечение возрастных патологий, включая такие заболевания, как атеросклероз, остеоартрит, остеопороз, рак, диабет, нейродегенеративные заболевания, такие как болезнь Альцгеймера, сердечно-сосудистые заболевания, стеатоз печени, хроническая обструктивная болезнь легких. , идиопатический легочный фиброз и возрастная дегенерация желтого пятна.В этом обзоре мы представляем уже идентифицированные сенолитики и сеноморфные препараты, уделяя особое внимание их окислительно-восстановительным свойствам. Мы описываем исследования, которые выявили их влияние на клеточное старение и позволили их номинировать в качестве новых антивозрастных средств. Мы ссылаемся на сенолитики, которые уже проходят клинические испытания, и представляем различные побочные эффекты, проявляемые сенотерапевтическими препаратами до сих пор. Наконец, мы обсуждаем аспекты сенотерапевтических средств, которые нуждаются в улучшении, и мы предлагаем дизайн будущих сенотерапевтических средств для нацеливания на определенные окислительно-восстановительные сигнальные пути, участвующие либо в регуляции SASP, либо в элиминации SC.
Сенолитики стучат, стучат, стучат в дверь старения
В 1974 году Боб Дилан попросил нас оставаться вечно молодыми. Сегодня захватывающие разработки в области долголетия могут в конечном итоге позволить нам удовлетворить амбициозный спрос восьмидесятилетнего певца, замедляя, останавливая или даже обращая вспять последствия старения и связанных со старением болезней.
Старение характеризуется прогрессирующим снижением физиологических функций и увеличением смертности. Это тесно связано с возникновением рака, неврологических расстройств, сердечно-сосудистых заболеваний и множества других патологий.Среди нескольких клеточных виновников старения — процесс клеточного старения.
Старение клеток
Еще в 1960-х годах, когда Дилан повторно посетил шоссе 61, микробиолог Леонард Хейфлик впервые предположил клеточное старение, когда обнаружил, что нормальные клетки естественным образом достигают предела числа клеточных делений, которым они подвергаются, — так называемого «предела Хейфлика». Это прекращение клеточного деления считается защитной реакцией на экологические и генетические стрессы, такие как повреждение теломер в результате прогрессирующего клеточного деления, окислительное повреждение ДНК и активация онкогенов, вызывающих рак.
В некоторых случаях клеточное старение на самом деле полезно, будучи механизмом наряду с апоптозом — запрограммированной гибелью клеток — который предотвращает превращение поврежденной клетки в рак. Также считается, что стареющие клетки играют важную роль в заживлении ран и эмбриогенезе млекопитающих.
К сожалению, старение клеток имеет патологическую сторону. Стареющие клетки выделяют в окружающую среду различную смесь биомолекул — «секреторный фенотип, связанный со старением» или «SASP», — который может разрушать или нарушать функцию соседних здоровых клеток или даже вызывать их превращение в раковые.
Убедительные экспериментальные данные показывают вредную прямую связь между стареющими клетками, SASP и старением. В некоторых исследованиях удаление стареющих клеток у мышей приводило к замедлению прогрессирования заболеваний, связанных со старением, в то время как, наоборот, трансплантация только 1 стареющей клетки на 15 000 молодых мышей ускоряла развитие слабости и прогрессирование старения.
Сенолитики
Очевидно, что воздействие на стареющие клетки и SASP может помочь остановить старение и возрастные заболевания, и сенолитические молекулы демонстрируют многообещающие результаты в этих усилиях.Идея сенолитиков состоит в том, чтобы устранить или уменьшить количество стареющих клеток в организме, тем самым избегая вредного воздействия SASP. Здесь мы рассмотрим лишь небольшую часть многих обнадеживающих сенолитиков, которые уже находятся в разработке.
Oisín Biotechnologies применяет подход к генной терапии с использованием конструкции ДНК, кодирующей «суицидальный белок» каспазу-9, инкапсулированную системой доставки липидных наночастиц. Хотя конструкция может проникать как в здоровые, так и в стареющие клетки, ее программа самоубийства активируется только в присутствии p16, белка-регулятора клеточного цикла, которого особенно много в стареющих клетках, таким образом избирательно убивая стареющие клетки, сохраняя их здоровые соседи.Было показано, что этот подход задерживает образование опухолевых клеток, одновременно уменьшая возрастное ухудшение состояния некоторых органов без явных побочных эффектов.
По другую сторону Атлантики компания Cleara Biotech изучает белок p53, чья способность индуцировать апоптоз подавляется его взаимодействием с белком O4 forkhead box (FOXO4), который выделяет p53 в ядро стареющих клеток. Это взаимодействие может быть нарушено терапевтическим пептидом FOXO4, вызывая высвобождение р53 из ядра и заставляя стареющие клетки подвергаться апоптозу.Эксперименты показали, что эта стратегия привела к восстановлению физической формы, плотности меха и функции почек у мышей естественного возраста, а также у быстро стареющих мутантов.
С точки зрения иммунологии, исследователи из Мемориального онкологического центра имени Слоана-Кеттеринга используют Т-клетки с химерными антигенными рецепторами (CAR-T-клетки), которые уже обладают широким терапевтическим потенциалом (см. наш блог «Борьба с раком с помощью CAR-T-терапии» ). В этом случае Т-клетки сконструированы так, чтобы нацеливаться на поверхностный рецептор урокиназы активатора плазминогена (uPAR), белок заживления ран, который пронизывает стареющие клетки, чтобы рекрутировать иммунную систему против них.Этот метод показал впечатляющие результаты, улучшая выживаемость в моделях рака легких и фиброза печени у мышей. Поскольку uPAR относительно отсутствует в здоровых клетках, есть надежда, что uPAR CAR-T клетки могут избирательно убивать стареющие клетки, оставляя соседние здоровые клетки неповрежденными.

 The Achilles’ heel of senescent cells: from transcriptome to senolytic drugs. Aging Cell. 2015 Aug;14(4):644-58. doi: 10.1111/acel.12344. Epub 2015 Apr 22. PubMed PMID: 25754370; PubMed Central PMCID: PMC4531078.
The Achilles’ heel of senescent cells: from transcriptome to senolytic drugs. Aging Cell. 2015 Aug;14(4):644-58. doi: 10.1111/acel.12344. Epub 2015 Apr 22. PubMed PMID: 25754370; PubMed Central PMCID: PMC4531078. Nat Med. 2016 Jan;22(1):78-83. doi: 10.1038/nm.4010. Epub 2015 Dec 14. PubMed PMID: 26657143; PubMed Central PMCID: PMC4762215.
Nat Med. 2016 Jan;22(1):78-83. doi: 10.1038/nm.4010. Epub 2015 Dec 14. PubMed PMID: 26657143; PubMed Central PMCID: PMC4762215. Aged-senescent cells contribute to impaired heart regeneration. Aging Cell. 2019 Jun;18(3):e12931. doi: 10.1111/acel.12931. Epub 2019 Mar 10. PubMed PMID: 30854802; PubMed Central PMCID: PMC6516154.
Aged-senescent cells contribute to impaired heart regeneration. Aging Cell. 2019 Jun;18(3):e12931. doi: 10.1111/acel.12931. Epub 2019 Mar 10. PubMed PMID: 30854802; PubMed Central PMCID: PMC6516154. Targeting cellular senescence prevents age-related bone loss in mice. Nat Med. 2017 Sep;23(9):1072-1079. doi: 10.1038/nm.4385. Epub 2017 Aug 21. Erratum in: Nat Med. 2017 Nov 7;23 (11):1384. PubMed PMID: 28825716; PubMed Central PMCID: PMC5657592.
Targeting cellular senescence prevents age-related bone loss in mice. Nat Med. 2017 Sep;23(9):1072-1079. doi: 10.1038/nm.4385. Epub 2017 Aug 21. Erratum in: Nat Med. 2017 Nov 7;23 (11):1384. PubMed PMID: 28825716; PubMed Central PMCID: PMC5657592.
 Cellular Senescence Promotes Adverse Effects of Chemotherapy and Cancer Relapse. Cancer Discov. 2017 Feb;7(2):165-176. doi: 10.1158/2159-8290.CD-16-0241. Epub 2016 Dec 15. PubMed PMID: 27979832; PubMed Central PMCID: PMC5296251.
Cellular Senescence Promotes Adverse Effects of Chemotherapy and Cancer Relapse. Cancer Discov. 2017 Feb;7(2):165-176. doi: 10.1158/2159-8290.CD-16-0241. Epub 2016 Dec 15. PubMed PMID: 27979832; PubMed Central PMCID: PMC5296251. Epub 2019 Apr 1. PubMed PMID: 30936558; PubMed Central PMCID: PMC6605052.
Epub 2019 Apr 1. PubMed PMID: 30936558; PubMed Central PMCID: PMC6605052.
 EBioMedicine. 2018 Oct;36:18-28. doi: 10.1016/j.ebiom.2018.09.015. Epub 2018 Sep 29. PubMed PMID: 30279143; PubMed Central PMCID: PMC6197652.
EBioMedicine. 2018 Oct;36:18-28. doi: 10.1016/j.ebiom.2018.09.015. Epub 2018 Sep 29. PubMed PMID: 30279143; PubMed Central PMCID: PMC6197652.