все самое интересное о ее повадках, рационе питания
Описание, строение, характеристикаБелки – мелкие грызуны из семейства белячьих весьма распространены в мире, много их живет, как в диких лесах, так и городских парках, скверах, садах. Все знают, что более всего белки любят орешки, и порой, постукиванием этих самых орешков белку можно даже приманить поближе. Какие повадки у белки, места обитания, рацион питания и много другое интересное об этом удивительном зверьке читайте далее.
Описание, строение, характеристика
Внешний вид белки, пожалуй, знаком каждому – длинное тело, такие же длинные ушки, пушистый хвост. Уши белки вытянутые, порой с кисточками на конце.
Хвост у белки весьма длинный, он составляет целых 2/3 от общего размера этого грызуна, и столь большой хвост природа белкам подарила не только лишь красоты ради, он также имеет одну важную и полезную функцию – служит белкам своеобразным «рулем» при полетах с дерева на дерево. А еще во время сна белки укрывают свое тело хвостом словно одеялом.
Размеры белок зависят от вида, в среднем белка имеет 20-31 см в длину, хотя встречаются, как и более крупные белки, имеющие 50 см длины, так и более маленькие белки, чья длина тела составляет всего лишь 5-6 см. Такая например самая маленькая мышиная белка.
Шубка белки различается зимой и летом, по причине, что этот зверек линяет два раза в год. Зимой шерсть белки пушистая и плотная, а летом наоборот короткая и более редкая. Зимний окрас белки обычно темно-бурый, рыжий, серый, с белым животиком, в летнее время белка, как правило, рыжая.
Также у белок-летяг по бокам имеется специальная перепонка, позволяющая им планировать во время полета.
Продолжительность жизни
Сколько живут белки в природе и домашних условиях? Максимальная продолжительность жизни белки составляет 12 лет. Вот только до столь почтенного (по меркам белки, разумеется) возраста эти грызуны доживают лишь в домашних условиях, в неволе. Белки, живущие в лесу, обычно редко когда доживают даже до 4 лет. Не только потому, что у них много природных врагов, но и часто лесные белки погибают от голода, холода и болезней.
Места обитания
Где живут белки? Белки обитают практически везде, за исключением Австралии, острова Мадагаскар, полярных территорий, юга Южной Америки и пустынной части Африки.
В качестве мест обитания белки живут исключительно в лесах, там, где много деревьев, поэтому их не встретить в пустынях северной Африки и в целом, в местах с минимальной растительностью. Деревья и белки – извечные спутники, где есть деревья, там с большой вероятностью будут и эти грызуны.
Питание
Что едят белки? Чем питаются эти милые зверьки? Разумеется, лесными орехами, но не только лишь ими, помимо орехов в рацион питания белки входят желуди, семена хвойных деревьев: ели, сосны, кедра и других, также грибы и разные зерна. Будучи всеядным животным, белка не прочь полакомится и разными жуками, жабами, ящерицами и даже птенцами птиц. При неурожае и голоде белка поедает кору деревьев, лишайники, корневища и травянистые растения.
Враги в природе
Сама же белка также может стать добычей, благо в природных условиях у нее множество врагов, которые не прочь полакомится белкой. Среди них куницы, совы, лисы и даже кошки.
Зимовка
К приходу зимы все белки готовятся основательно. Прежде всего, они делают множество укрытий для своих съестных запасов, которые также заблаговременно собирают. Как правило, они собирают желуди, орехи и грибы, которые затем прячут в дуплах деревьев или вырытых норах. К сожалению, собранные беличьи запасы часто разворовываются другими животными, а про некоторые свои укрытия пушистые грызуны и вовсе забывают. Впрочем, эта забывчивость белок идет на пользу лесу, так как забытые белками семена, желуди и орехи часто прорастают и обзаводятся новыми насаждениями.
Как правило, они собирают желуди, орехи и грибы, которые затем прячут в дуплах деревьев или вырытых норах. К сожалению, собранные беличьи запасы часто разворовываются другими животными, а про некоторые свои укрытия пушистые грызуны и вовсе забывают. Впрочем, эта забывчивость белок идет на пользу лесу, так как забытые белками семена, желуди и орехи часто прорастают и обзаводятся новыми насаждениями.
Что же касается поведения белок в зимнее время, то во время сильных морозов белки сидят в своих дуплах, погруженные в полудрему. Если же зимние холода не такие сильные белки ведут обычный активный образ жизни, порой даже разворовывают тайники мышей и бурундуков.
Белка весной
А вот ранняя весна – наиболее трудное время для белок, так как зимние запасы уже съедены или забыты, а новые еще не появились и не выросли. В этом время белками практически нечего есть и именно ранней весной белки могут погибать от голода. Чтобы выжить грызунам остается только питаться корой деревьев, побегами растений.
Виды, фото и названия
Всего на планете Земля живет целых 280 видов белок, которые входят в 48 родов. Далее мы опишем наиболее интересные виды белок.
Белка обыкновенная
Это самый распространенный вид беличьего семейства, обыкновенная белка обитает по всей Евразии от Ирландии до Японии, в том числе не боится жить рядом с человеком. Именно ее мы чаще всего видим, гуляя в парке или лесу. Имеет рыжий окрас.
Белка Аберта
Эта белка живет в хвойных лесах США и Мексики. От других белок отличается более крупными размерами, ее длина составляет 46-58 см и шерстю серого цвета.
Бразильская белка
Она же Гвианская белка, живет в ряде стран Южной Америки. Небольшого размера, всего 20 см в длину. Имеет темно-коричневый окрас.
Кавказская белка
Также известна как персидская белка, обитает на Ближнем Востоке и Кавказе. Имеет средние беличьи размеры и буровато-серый окрас.
Каролинская белка
Еще один представитель американских белок, каролинская белка обитает в лесах США, Мексики и Канады. Имеет серый окрас с коричневыми и рыжими подпалинами. Размеры этих белок также несколько большие – 40-50 см в длину.
Имеет серый окрас с коричневыми и рыжими подпалинами. Размеры этих белок также несколько большие – 40-50 см в длину.
Огненная белка
Эта живущая в Венесуэле белка имеет голову и уши характерного красного цвета, благодаря чему получила свое название.
Краснохвостая белка
Обитающая в тропических лесах Центральной и Южной Америки краснохвостая белка может похвастаться своим ярким красным хвостом и более крупными (30-50 см в длину) как для остальных белок размерами.
Западная серая белка
Эта белка примечательна, прежде всего, тем, что это самая большая белка в мире, она имеет длину тела в 50-60 см. Также имеет серебристо-серый окрас, а вот брюшко у нее белого цвета. Живет в Мексике и США, в основном в дубовых и хвойных лесах.
Японская белка
Обитающая на японских островах белка японская имеет красивый серый окрас и средние беличьи размеры.
Мышиная белка
А эта белка наоборот примечательна тем, что это самая маленькая белка в мире, она имеет всего лишь 5-6 см в длину.
Размножение
Брачный сезон для большинства видов белок наступает весной, как ни парадоксально в самое трудное время для этих зверьков. Причем белки обычно ведут одиночный способ жизни, и только на время спаривания ищут себе партнера. Вокруг одной самки зачастую собирает двое-трое самцов. Самцы начинают настоящую борьбу за самку, они урчат друг на друга, стараются напугать конкурента, а порой и устраивают настоящие драки с погонями по веткам. Как и полагается в природе, в результате самка достается самому сильному самцу, сумевшему отогнать своих конкурентов.
После спаривания беременная самка строит отдельное гнездо для будущего потомства. Беременность у белки длится 35-38 дней. За раз может появиться от 1 до вплоть 10 детенышей. Рождаются бельчата без шерсти и слепые, только через 2 недели они начинают прозревать. Первые 50 дней жизни бельчата находятся под опекой матери, кормятся ее молоком. Но по прошествии двух месяцев они начинают быстро взрослеть, покидают материнское гнездо, а через год стают уже взрослыми и половозрелыми белками.
Содержание в домашних условиях
Так как белка является весьма милым зверьком, то не удивительно, что порой люди их содержат в неволе. При содержании белки дома важно создать ей подходящие условия для жизни. Так как белка – активный грызун, ей нужен просторный вольер с длиной и шириной хотя б по пол метра. В вольере должно быть гнездо или скворечник, ветки, по которым белка будет прыгать, полки на которых она будет сидеть.
Также, разумеется, весьма важно обеспечить белке правильное питание. Кормить этого зверька можно свежими либо сушеными грибами, кедровыми орехами, желудями, фундуком. Шишки с семенами также придутся белке по нраву. Для восполнения дефицита белка будет полезно давать вашему питомцу мел или яичную скорлупу.
При должной усидчивости можно приручить белку есть с руки. Важно, не стоит кормить белку арахисом и солеными семечками, они для нее вредны.
Интересные факты
- Все белки очень чистоплотны, но особенно чистоплотны белки самцы, так самец тратит даже больше времени на уход за своей шубкой нежели самка.

- Строение тела белки такое, что чем то напоминает парашют, благодаря этому даже при падении с высоты до 30 метров белка не получит никаких повреждений.
- Белки могут быть весьма прожорливыми и при благоприятных условиях белка способна съесть еды, равной массе самой белки.
Видео
И в завершение очень интересные документальный фильм о необычных способностях белок – «Супер белки».
Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту [email protected] или в Фейсбук, с уважением автор.
Анализ крови и продолжительность жизни: дайджест РБК Трендов № 33
Новый вид пластика разлагается на солнце всего за неделю, а продолжительность жизни теперь можно узнать по анализу крови
Темы недели
Найден способ предсказать продолжительность жизни по анализу крови
Американские ученые разработали систему предсказания продолжительности жизни по анализу крови человека.
На основе анализа определенных белков, указывающих на общий уровень воспаления, теперь можно определить биологический возраст, узнать риск развития сердечно-сосудистых заболеваний и оценить ожидаемую продолжительность жизни.
Исследователи изучили образцы крови 1 001 человека в возрасте 8–96 лет. Они решили выяснить, как признаки хронического системного воспаления меняются с возрастом. Ранее ученые определили девять отличительных черт процесса старения. Теперь они обнаружили десятый признак — возрастную дисфункцию иммунной системы. Данный показатель, по мнению специалистов, может оказаться самым информативным.
Теперь они обнаружили десятый признак — возрастную дисфункцию иммунной системы. Данный показатель, по мнению специалистов, может оказаться самым информативным.
Авторы идентифицировали особый биомаркер иммунного старения — хемокин CXCL9. С возрастом, по мере роста системного воспаления, его высвобождение увеличивается, что в итоге способствует клеточному старению и нарушению функции кровеносных сосудов.
У одних людей признаки системного воспаления проявляются раньше, а у других позже.
Созданный учеными алгоритм иммунных «часов» iAge позволяет не только оценить состояние иммунной и сердечно-сосудистой системы человека, но и предсказать темпы его старения в будущем.
Исследование проводилось в США с 1948 года. В группе были 97 чрезвычайно здоровых людей в возрасте от 25 до 90 лет из Калифорнии, а также долгожители из Болоньи в Италии.
«В среднем долгожители имеют иммунный возраст примерно на 40 лет моложе того, что считается нормой. У нас есть отдельный случай суперздорового 105-летнего мужчины из Италии, возраст иммунной системы которого находится на уровне 25-летнего человека», — отметил руководитель исследования Дэвид Фурман.
В то же время пока ученые не до конца разобрались в основных триггерах, которые вызывают возрастное воспаление. Поэтому в ближайшее время вряд ли получится разработать лекарства, которые нацелены на воспаление, не нанося ущерба иммунной системе в целом.
В Китае создали пластик, который разлагается на солнце и воздухе
Китайские специалисты создали новый тип пластика, который разлагается при воздействии солнечного света и воздуха. Данная разработка может стать настоящим прорывом в борьбе с пластиковыми отходами.
Китайские ученые пытались усовершенствовать химический датчик, который применялся для измерения уровня кислотности. При этом совершенно случайно открыли новый материал. Они разработали полимерную пленку, которая выступала в качестве индикатора и меняла цвет в зависимости от химического состава окружающей среды. А спустя семь дней она полностью разложилась под солнечными лучами.
В то же время, использовать изделия из данного вида пластика можно только в темных и герметичных местах. Иначе воздействие воздуха и света уничтожит их. Зато из нового полимера можно изготавливать детали для электронного оборудования или техники, где он будет изолирован от воздуха и света в течение всего срока службы. Это может существенно облегчить утилизацию электронных устройств в будущем.
Иначе воздействие воздуха и света уничтожит их. Зато из нового полимера можно изготавливать детали для электронного оборудования или техники, где он будет изолирован от воздуха и света в течение всего срока службы. Это может существенно облегчить утилизацию электронных устройств в будущем.
Сообщается, что в процессе распада, который происходит всего за неделю, пленка выделяет безопасную янтарную кислоту, которая активно применяется в пищевой промышленности и производстве лекарств. Для внедрения экопластика в массовое производство потребуется еще серия исследований.
Новости недели
- Johnson & Johnson и AstraZeneca пробуют изменить вакцины, чтобы исключить появление тромбов.
- Власти Китая запускают систему торговли квотами на вредные выбросы.
- ЕС готовит масштабный план по борьбе с изменением климата.
- NASA заключило контракт на строительство жилого модуля окололунной станции.
- В Германии научились извлекать кобальт из горных отходов.

- Представлен самый маленький портативный МРТ-сканер.
- Российские ученые узнали, как удвоить скорость заживления переломов.
Цифры недели
- «Уралхим» вложил ₽300 млн в разработку альтернативных продуктов из гороха
Крупный производитель удобрений планирует заняться новым бизнес-направлением — производством растительных белков.
- В США продали картридж с игрой «Super Mario 64» за $1,5 млн
Стартовая цена лота на аукционе Heritage Auctions составляла 100 тыс., но в ходе торгов она выросла более, чем в 15 раз, побив мировой рекорд.
- Японцы впервые обнаружили водоросли с тремя полами
Исследователи узнали, что зеленые водоросли Pleodorina starrii имеют три разных пола — мужской, женский и «третий».
Исследование недели
Для «сведения концов с концами» семье в России нужно минимум ₽61 тыс.
Российским домохозяйствам, чтобы свести концы с концами, нужно хотя бы ₽61 тыс. в месяц. Это на ₽2,5 тыс. больше, чем два года назад, показал опрос, который провел Росстат.
в месяц. Это на ₽2,5 тыс. больше, чем два года назад, показал опрос, который провел Росстат.
Финансовые затруднения в той или иной степени испытывают 75,7% домохозяйств в России. 24,3% семей легко могут свести концы с концами при покупке самого необходимого. Таковы главные итоги масштабного исследования «Комплексное наблюдение условий жизни населения» за 2020 год.
Ситуация по этому параметру улучшилась по сравнению с 2018 годом (исследование проводится раз в два года), когда 79,5% семей испытывали трудности с покупкой самого необходимого. В 2016 году таких домохозяйств было 84,6%.
Больше всего минимальный необходимый доход вырос для молодых семей с детьми — на 17% до ₽80,9 тыс., и для семей с детьми-инвалидами — на 13% до ₽88,4 тыс.
При этом точная формулировка в рамках опроса была такой: «Какой минимальный месячный доход необходим вашему домохозяйству, чтобы свести концы с концами, то есть оплатить все необходимые ежедневные расходы?» Другими словами, необходимый минимум товаров понимался в опросе субъективно. Прожиточный минимум в России на 2021 год составляет ₽11,65 тыс. на душу населения.
Прожиточный минимум в России на 2021 год составляет ₽11,65 тыс. на душу населения.
В опросе приняли участие более 100 тыс. российских семей.
Что почитать
За первое полугодие 2021 года в России заблокировали свыше 22 тыс. сайтов и отдельных страниц ресурсов с призывами к суициду или описанием его способов. Это в два раза больше, чем за тот же период годом ранее. За весь 2020 год было заблокировано 25 тыс. таких страниц, сообщили в Роскомнадзоре. Эксперты связывают рост с массовым переходом на удаленную работу и дистанционное обучение, а также с появлением вирусных сообщений, якобы предупреждающих об опасности, но на деле только порождающих хайп среди подростков и панику среди их родителей.
Что послушать
Что такое культурная диффузия? Этот термин, возникший в XIX веке, предполагает, что культурные практики перетекают от одних людей к другим так же плавно и естественно, как чернила по бумаге. Одним из важнейших каналов распространения культуры был плен. Даже под гнетом рабства и презрения люди, попавшие в плен, приносили захватчикам новые идеи и технологии.
Даже под гнетом рабства и презрения люди, попавшие в плен, приносили захватчикам новые идеи и технологии.
Что посмотреть
- Новый робот поможет одеваться маломобильным людям
У роботов огромный потенциал. Они способны помогать одеваться людям с ограниченными возможностями. Но это достаточно сложная задача, которая требует ловкости и скорости. Ученым удалось разработать специальный алгоритм, благодаря которому роботы научились одевать людей, не мешая им.
- Миллиардер Ричард Брэнсон слетал к границе космоса
Космолет Unity-22 Virgin Galactic совершил первый в истории туристический суборбитальный полет с экипажем, прямая трансляция велась на YouTube-канале и официальном сайте компании.
Учёные рассказали, как насытить организм «белком долголетия» без голодания
Группа красноярских исследователей доказала положительное влияние диеты с включением продуктов на основе гречневой крупы на организм млекопитающих. Эффект связан с умеренным повышением уровня сиртуина1, известного как «белок долголетия» (SIRT1). В ходе эксперимента обнаружилось, что группа животных, чей рацион на 30% состоял из гречки, продемонстрировала оптимальный уровень прибавки веса. Кроме того, в желудке, печени, почках и сыворотке крови этих животных возрос уровень SIRT1, производство которого замедляет старение и повышает стрессоустойчивость организма. Результаты исследования опубликованы в Journal of Cereal Science.
Сиртуины — обширное семейство белков, участвующих в образовании жировых клеток и метаболизме глюкозы. Белок SIRT1, входящий в семейство сиртуинов, участвует в работе множества внутриклеточных процессов, в том числе лежащих в основе старения. Максимальное количество сиртуина организм производит во время стресса — например, если ограничить калорийность ежедневного рациона. Проще говоря, чем меньше калорий мы потребляем — тем выше будет уровень экспрессии «белка долголетия». Известно, что голодание запускает процессы репарации — «ремонта» клеток и увеличивает срок их службы. Казалось бы, решение найдено: следует время от времени недоедать во имя здоровья и долгих лет жизни, однако этот способ точно не является оптимальным.
Максимальное количество сиртуина организм производит во время стресса — например, если ограничить калорийность ежедневного рациона. Проще говоря, чем меньше калорий мы потребляем — тем выше будет уровень экспрессии «белка долголетия». Известно, что голодание запускает процессы репарации — «ремонта» клеток и увеличивает срок их службы. Казалось бы, решение найдено: следует время от времени недоедать во имя здоровья и долгих лет жизни, однако этот способ точно не является оптимальным.
«Прямая взаимосвязь между выработкой SIRT1 и долголетием не вызывает сомнений, но стимулировать производство этого белка при помощи голодания — не выход. Есть люди с тяжёлыми хроническими заболеваниями, беременные женщины, дети, чей организм должен получать определённое количество калорий для полноценного развития, — им голодание категорически противопоказано, а сиртуин при этом необходим. Нашей задачей было найти продукт, который поможет вырабатывать достаточное количество этого белка без жёсткого ограничения рациона., — рассказала заведующая кафедрой биофизики СФУ Валентина Кратасюк.Таким продуктом является хорошо знакомая соотечественникам гречневая крупа (или мука), широко представленная в национальных кухнях России, Китая, Японии, Кореи и даже Индии, которая является исторической родиной растения»
Инициатор исследования, научный сотрудник лаборатории биолюминесцентных биотехнологий, доцент СФУ Шубхра Панде считает гречку отличным объектом исследования: этот продукт богат растительным белком и аминокислотами, которые, в свою очередь, организм человека использует для производства собственных белков. Прибавить к этому большое количество витаминов группы B, способствующих здоровью нервной, кровеносной и иммунной систем, а также значительное количество клетчатки, отвечающей за чувство сытости, и получится, что гречиха — настоящий суперфуд, доступный сибирякам круглый год.
«Мы первыми в мире решили исследовать именно гречиху в связи с экспрессией SIRT1 в организме., — отметила Шубхра Панде.Она любима диетологами за высокие пищевые качества, её легко приобрести. Есть работы, посвящённые антиоксиданту ресвератролу — он содержится в винограде и тоже считается полезным для продления жизни клеток. Но виноград и производящиеся из него продукты, во-первых, малодоступны во многих регионах мира (в частности, в Сибири), во-вторых, эта ягода очень калорийна и не отличается диетическими свойствами. Сложно представить, сколько винограда придётся съесть, чтобы запустить механизмы клеточного восстановления»
Проведённый эксперимент показал, что крысы, употреблявшие пищу, обогащённую перемолотыми ядрами гречки, демонстрировали оптимальную прибавку веса. Также в организме этих животных был обнаружен повышенный в 30 раз уровень SIRT1, что подтвердило гипотезу учёных.
«Мы наблюдали высокие показатели экспрессии SIRT1 у подопытных животных, чей рацион был ограничен по калорийности. Такой стресс-фактор, связанный с недоеданием, повышает стабильность ДНК, запускает процессы репарации клетки, тем самым увеличивая продолжительность её жизни., — добавила соавтор исследования, магистрант Института фундаментальной биологии и биотехнологии СФУ Мария Рязанова.Но при этом ограничение калорийности привело к снижению общего количества белка в крови на 19%, в желудке на 95%, а в печени и почках 35,2% и 27% соответственно. Нечто подобное можно наблюдать у людей, которые садятся на жёсткие диеты, избегая физических нагрузок: их мышечная ткань и весь организм в целом страдает от недостатка главного строительного материала – белков. У группы крыс, в чей рацион входила гречка, мы обнаружили умеренную экспрессию «белка долголетия» SIRT1. Она не была слишком низкой или опасно высокой. Это именно «золотая середина», которая положительно влияет на здоровье организма»
Учёные также дали некоторые рекомендации по употреблению гречихи. Шубхра Панде считает, что есть эту вкусную и полезную крупу следует в больших количествах, добавляя в салаты, гарниры, супы или употребляя в виде традиционных каш. Главное — не переусердствовать, чтобы не приобрести к продукту отвращение. Впрочем, в отличие от голодания, употребление гречки даже в больших количествах не вызовет чрезмерное производство SIRT1, а значит, не вызовет опасный для организма окислительный стресс — побочный эффект «перепроизводства» сиртуина.
Впрочем, в отличие от голодания, употребление гречки даже в больших количествах не вызовет чрезмерное производство SIRT1, а значит, не вызовет опасный для организма окислительный стресс — побочный эффект «перепроизводства» сиртуина.
В исследовательскую группу помимо учёных Сибирского федерального университета вошли сотрудники Красноярского государственного медицинского университета имени профессора В.Ф. Войно-Ясенецкого, Научно-исследовательского института медицинских проблем Севера и Института биофизики ФИЦ КНЦ СО РАН.
Ученые обнаружили белок, контролирующий продолжительность жизни круглых червей — Наука
ТАСС, 9 августа. Исследователи из Германии обнаружили особый белок, контролирующий сохранение мышечной массы и продолжительность жизни у круглых червей. Полученные данные позволят ученым продвинуться в исследовании аналогичных генетических механизмов у людей, сообщил в пятницу научный портал EurekAlert.
Белок LIN-53 — это шаперон (класс белка, отвечающий за восстановление правильной структуры белков и образование комплексов белков), который связывается со специальными молекулами (гистонами), обеспечивающими «упаковку» нитей ДНК в ядре клетки. Различные модификации гистонов могут усилить или ослабить экспрессию генов, а белок участвует в процессах активации и деактивации генов, что влияет на формирование наследственных признаков без изменения основной последовательности ДНК. Авторы научной работы попытались понять, влияет ли белок LIN-53 на продолжительность жизни и здоровое долголетие, рассмотрев действие белка на примере круглых червей Caenorhabditis elegans (C. Elegans, нематоды), которые имеют много общего с организмом человека в отношении генетических процессов.
Различные модификации гистонов могут усилить или ослабить экспрессию генов, а белок участвует в процессах активации и деактивации генов, что влияет на формирование наследственных признаков без изменения основной последовательности ДНК. Авторы научной работы попытались понять, влияет ли белок LIN-53 на продолжительность жизни и здоровое долголетие, рассмотрев действие белка на примере круглых червей Caenorhabditis elegans (C. Elegans, нематоды), которые имеют много общего с организмом человека в отношении генетических процессов.
«Исследователи из Берлинского института медицинской системной биологии Центра молекулярной медицины имени Макса Дельбрюка обнаружили белок, который оказывает существенное влияние на здоровье мышц и продолжительность жизни. Животные, которым не хватает белка LIN-53, имеют серьезные мышечные дефекты, ограниченную подвижность и умирают раньше, чем животные, в организме которых белок есть. Это ясно указывает на то, что LIN-53 играет роль в сохранении здоровых мышц [с возрастом] и продолжительности жизни», — говорится в сообщении.
Группа ученых выяснила, что белок LIN-53 является частью семи различных молекулярных комплексов, регулирующих модификацию и структуру хроматина. Специалисты считают, что тем самым они смогли четко определить комплексы, имеющие важное значение для продолжительности жизни и здоровья. Также выяснилось, что животные без этого белка обладают очень низким уровнем сахара — органического соединения трегалоза из группы дисахаридов. Ученые предполагают, что белок участвует в процессах, регулирующих на генетическом уровне обмен веществ и производство трегалозы.
«Поскольку белок LIN-53 очень похож на человеческий белок RBBP4/7, исследователи могут использовать информацию, полученную от микроскопических червей, чтобы определить, где искать ответы на аналогичные вопросы у людей», — говорится в статье.
Выявление генетических факторов, влияющих на продолжительность жизни и здоровое долголетие, важны для поиска эффективных методов борьбы с «болезнями старости» у человека, среди которых — мышечная дистрофия. Результаты научной работы опубликованы в журнале Aging Cell.
Результаты научной работы опубликованы в журнале Aging Cell.
Факты о крови и клетках крови
Эта информация поможет вам узнать о различных компонентах крови и их функциях.
Ваша кровь разносит кислород и питательные элементы ко всем клеткам организма. Кроме того, клетки крови противостоят инфекциям и останавливают кровотечение.
Большинство клеток крови вырабатываются в костном мозге. Их образование и замещение происходит непрерывно. Время существования клетки крови до ее замещения называется продолжительностью жизни клетки.
Кровь состоит из четырех компонентов: эритроцитов, лейкоцитов, тромбоцитов и плазмы.
Вернуться к началуКомпоненты крови
Эритроциты (красные кровяные тельца)
Красные кровяные тельца несут кислород из легких к тканям организма. Также они несут углекислый газ обратно в легкие.
Эритроциты составляют почти половину от общего объема крови. Продолжительность жизни этих клеток — около 120 дней.
Лейкоциты (белые кровяные тельца)
Лейкоциты противостоят инфекциям и являются важным элементом иммунной системы. Они составляют очень малую часть от общего объема крови (менее 1 %).
Существует три типа лейкоцитов: гранулоциты, моноциты и лимфоциты. Каждый тип играет важную роль.
- Гранулоциты бывают 3 типов:
- Нейтрофилы помогают противостоять бактериальным и грибковым инфекциям.
- Базофилы принимают участие в иммунной реакции организма. Их точная функция изучена недостаточно.
- Эозинофилы помогают бороться с инфекциями, возбудителями которых являются паразиты.
- Моноциты разрушают и выводят из организма чужеродные микроорганизмы и отмирающие клетки.
- Лимфоциты формируют иммунную систему.
Продолжительность жизни лейкоцитов варьируется в широких пределах — от часов до нескольких лет.
Тромбоциты
Тромбоциты — это небольшие фрагменты клеток. Их основной функцией является остановка кровотечения.
Они составляют очень малую часть от общего объема крови (менее 1 %). Продолжительность жизни тромбоцитов — около 9–12 дней.
Их основной функцией является остановка кровотечения.
Они составляют очень малую часть от общего объема крови (менее 1 %). Продолжительность жизни тромбоцитов — около 9–12 дней.
Плазма
Плазма — это бледно-желтая жидкая часть крови, в которой содержатся все клетки крови. Она составляет чуть больше половины от общего объема крови.
Плазма помогает разносить воду, питательные элементы, минеральные вещества, лекарства и гормоны по всему организму. Также она переносит отходы к почкам. Затем почки фильтруют кровь, очищая ее от этих отходов. Плазма состоит из воды, белка, липидов (жиров). Она несет воду, жирорастворительные питательные элементы и другие вещества к различным органам и от них.
Вернуться к началуИсточники информации
Больница Джонса Хопкинса (Johns Hopkins Medicine)
www.hopkinsmedicine.org/health/wellness-and-prevention/facts-about-blood
На этом веб-сайте приводится информация о крови, клетках крови и их количестве.
Американский Красный Крест (American Red Cross)
www.redcrossblood.org
Американский Красный Крест предоставляет различную информацию о компонентах крови и роли клеток крови.
Детская больница в Стэнфорде (Stanford Children’s Health)
www.stanfordchildrens.org
Детская больница в Стэнфорде предоставляет различную информацию о компонентах крови и роли клеток крови.
Здоровье: Наука и техника: Lenta.ru
Израильские ученые научились продлевать жизнь мышей на 23 процента и уверены, что метод может работать на людях. Команда специалистов из израильского Университета имени Бар-Илана и Национального института здравоохранения США выявили белок SIRT6, повышение уровня которого увеличило продолжительность жизни мышей и даже укрепило их устойчивость к онкологии, пишет The Times Of Israel.
Запас белка SIRT6 с возрастом уменьшается. Увеличение белка позитивно отражается на продолжительности жизни, молодости и устойчивости к раку у мышей, написали ученые в журнале Nature Communications. «Изменение ожидаемой продолжительности жизни оказалось значительным, если учесть, что эквивалентный скачок ожидаемой продолжительности жизни человека привел бы к тому, что мы жили бы в среднем почти до 120 лет», — отметил профессор Хаим Коэн (Haim Cohen) из Университета Бар-Илана.
«Изменение ожидаемой продолжительности жизни оказалось значительным, если учесть, что эквивалентный скачок ожидаемой продолжительности жизни человека привел бы к тому, что мы жили бы в среднем почти до 120 лет», — отметил профессор Хаим Коэн (Haim Cohen) из Университета Бар-Илана.
Материалы по теме:
В 2012 году Коэн стал первым исследователем, который фактически увеличил уровень белка у животных и продолжительность их жизни, заставив самцов мышей жить на 15 процентов дольше. На самок опыт никак не повлиял. В сотрудничестве с профессором Рафаэлем де Кабо (Rafael de Cabo) из Национального института здравоохранения США Коэн довел метод до выявления скачка ожидаемой продолжительности жизни и среди самцов, и среди самок мышей. Причем самцы жили на 30 процентов дольше, чем самцы из контрольной группы, а самки — на 15 процентов дольше.
При оценке молодости мышей ученые заметили, что они не потеряли способности генерировать энергию после короткого голодания из жиров и молочной кислоты, что обычно происходит при старении. У них было меньше холестерина, они реже болели раком и могли бегать быстрее. «Это открытие показывает, что SIRT6 контролирует скорость здорового старения. То есть повышение его активности потенциально может замедлить старение», — пояснил Коэн, отметив, что пока не существует инструментов для перевода успеха с мышами на людей, но через два-три года его лаборатория справится с задачей. Ученые уже разрабатывают небольшие молекулы, которые могут повысить уровень SIRT6 или сделать существующие количества белка более активными в организме человека.
У них было меньше холестерина, они реже болели раком и могли бегать быстрее. «Это открытие показывает, что SIRT6 контролирует скорость здорового старения. То есть повышение его активности потенциально может замедлить старение», — пояснил Коэн, отметив, что пока не существует инструментов для перевода успеха с мышами на людей, но через два-три года его лаборатория справится с задачей. Ученые уже разрабатывают небольшие молекулы, которые могут повысить уровень SIRT6 или сделать существующие количества белка более активными в организме человека.
Ранее ученые из Сингапура, России и США под руководством Петра Федичева из Московского физико-технического института разработали новый метод определения биологического возраста по анализу крови. Тест позволяет по анализу крови определить показатель динамического состояния организма, характеризующий общий уровень физиологической устойчивости. В результате ученые установили максимально возможную продолжительность жизни человека, которая гораздо длиннее ста лет.
Прионовые болезни
Прионовые болезни – это прогрессирующие нейродегенеративные заболевания с летальным исходом. Механизм возникновения прионовых болезней изучен не до конца, однако в настоящее время считается, что заболевание развивается при накоплении в клетках центральной нервной системы избыточного количества патологического прионного белка.
Прионовые болезни встречаются очень редко – ежегодно регистрируется один случай на миллион человек. На данный момент известны 5 разновидностей этой патологии – спорадическая болезнь Крейцфельда-Якоба, новый вариант болезни Крейцфельда-Якоба, куру, синдром Герстманна-Штройслера-Шейнкера и фатальная семейная инсомния. Наиболее широко распространена спорадическая болезнь Крейцфельда-Якоба.
Болезнь может возникать попадании в организм патологического прионного белка извне (от человека или животного), иметь наследственную природу или возникать спонтанно как следствие генетических аномалий de novo. Течение определенных вариантов зависит от типа прионного белка. Инкубационный период может достигать 15 лет. Продолжительность жизни пациентов с прионными болезнями чаще всего составляет около года, реже – чуть более двух лет. Лечениесимптоматическое.
Инкубационный период может достигать 15 лет. Продолжительность жизни пациентов с прионными болезнями чаще всего составляет около года, реже – чуть более двух лет. Лечениесимптоматическое.
Синонимы русские
Трансмиссивная губчатая энцефалопатия.
Синонимы английские
Human prion diseases, transmissible spongiform encephalopathies, TSE.
Симптомы
Симптомыпатологии могут возникнуть в период от полугода до 10-15 лет после заражения. Проявления болезни могут развиваться постепенно, с неспецифических симптомов – бессонницы, вялости, апатии, заторможенности. В ряде случаев болезнь начинается внезапно и может напоминать делирий. Наиболее частыми проявлениями прионовых болезней являются:
- Прогрессирующая деменция
- Нарушение зрения
- Нарушение координации
- Нарушение речи
- Тремор
- Ригидность мышц
- Миоклонии
- Депрессия
- Тревожность
- Эмоциональная лабильность
Все проявления прионных болезней неуклонно прогрессирую, приводя в конечных стадиях болезни к акинетическому мутизму и коме.
Общая информация о заболевании
Прионные болезни встречаются как у человека, так и среди животных. Патогенез прионных болезней связывают с накоплением в организме патологического прионного белка. Прионный белок в норме присутствует в клетках организма животных и человека – это так называемый нормальный прионный белок. Он находится в наибольших количествах в нейронах и частично в клетках лимфоидной ткани. Прионный белок устойчив к высоким температурам, радиации, действию протеаз и химических веществ – алкоголя, формалина и других. Функции прионных белков неизвестны. Информация о структуре этих полипептидов закодирована в коротком плече 20 хромосомы у человека.
При изменении конфигурации нормальный прионный белок может превращаться в патологический. Патологический прионный белок, в свою очередь, способен запускать механизм преобразования нормального прионного белка в патологическую форму. Патологический прионный белок может возникать в организме спонтанно. В некоторых случаях накопление патологического прионного белка связано с наследственными генетическими нарушениями. На данный момент известно порядка 30 вариантов генетических нарушений, в результате которых меняется структура прионного белка. В ряде случае прионные болезни носят инфекционную природу. Это означает, что патологический прионный белок может попасть в организм человека извне – при пересадке роговицы, твердой мозговой оболочки, нейрохирургических операциях. В данном случае большое значение имеет устойчивость прионов к любым видам стерилизации. Известны случаи заражения патологоанатомов. Считается, что существует вероятность заражения человека при употреблении мяса коров, зараженных коровьим бешенством.
В некоторых случаях накопление патологического прионного белка связано с наследственными генетическими нарушениями. На данный момент известно порядка 30 вариантов генетических нарушений, в результате которых меняется структура прионного белка. В ряде случае прионные болезни носят инфекционную природу. Это означает, что патологический прионный белок может попасть в организм человека извне – при пересадке роговицы, твердой мозговой оболочки, нейрохирургических операциях. В данном случае большое значение имеет устойчивость прионов к любым видам стерилизации. Известны случаи заражения патологоанатомов. Считается, что существует вероятность заражения человека при употреблении мяса коров, зараженных коровьим бешенством.
Несмотря на то, что часть прионных заболеваний имеет инфекционную природу, прионы отличаются от других инфекционных агентов – в их составе отсутствуют нуклеиновые кислоты (ДНК или РНК). Это осложняет процесс изучения патогенеза прионовых болезней. Известно, что накопление патологического прионового белка приводит к разрушению клеток нервной системы, мультифокальным спонгиоформным (губкоподобным) повреждениям тканей нервной системы, астроглиозу при отсутствии признаков воспалительной реакции. В связи с устойчивостью к действию протеаз, патологический прионный белок не может быть выведен из организма. Около 85 % пациентов погибают в течение года после появления первых симптомов болезни.
В связи с устойчивостью к действию протеаз, патологический прионный белок не может быть выведен из организма. Около 85 % пациентов погибают в течение года после появления первых симптомов болезни.
Кто в группе риска?
- Люди определенных профессий (медицинские работники, ветеринары, работники скотобоен, зоологи)
- Люди, перенесшие хирургические вмешательства, в том числе гемотрансфузии
- Люди, среди родственников которых были выявлены случаи наследственных прионных болезней
- Люди, употребляющие плохо термически обработанное мясо
Диагностика
К сожалению, на данный момент диагностика прионных болезней возможна лишь после возникновения клинических проявлений, то есть на этапе, когда болезнь зашла уже достаточно далеко. Раннее, пресимптоматическое выявление данной патологии невозможно. Схема диагностики прионных болезней не разработана окончательно.
Лабораторная диагностика:
- Исследование состава спинномозговой жидкости.
 При прионных болезнях состав спинномозговой жидкости не изменен или изменен незначительно.
При прионных болезнях состав спинномозговой жидкости не изменен или изменен незначительно. - Выявление в крови патологического прионного белка методом вестерн-блоттинга.
- Исследование аутопсийного материала. Позволяет выявить признаки характерных атрофических изменений в тканях нервной системы пациента.
- Генетические исследования. Позволяют выявить аномалии в структуре генов, кодирующих прионные белки.
Инструментальная диагностика:
- Электроэнцефалография (ЭЭГ). Признаки патологических изменений в структуре головного выявляются на ЭЭГ приблизительно у половины пациентов с прионными болезнями.
- Магнитно-резонансная и компьютерная томография (МРТ и КТ). Позволяют выявить признаки атрофии коры головного мозга, расширения ликворопроводящей системы.
Лечение
Лечениетолько симптоматическое.
Профилактика
- Использование стерильных и, в определенных случаях, одноразовых хирургических инструментов, индивидуальных средств защиты
- Контроль качества мясных продуктов
Рекомендуемые анализы
Белковый гомеостаз: живи долго, не процветай
Nat Rev Mol Cell Biol. Авторская рукопись; доступно в PMC 1 июля 2013 г.
Авторская рукопись; доступно в PMC 1 июля 2013 г.
Опубликован в окончательной отредактированной форме как:
PMCID: PMC3570024
NIHMSID: NIHMS439038
Институт биологических исследований, лаборатория молекулярной и клеточной биологии им. Солка, 10010 N. Torrey Pines Road, La Jolla, CA
USA
См. Другие статьи в PMC, в которых цитируется опубликованная статья.Abstract
Белковый оборот является эффективным способом поддержания функционального протеома, поскольку старые и потенциально поврежденные полипептиды разрушаются и заменяются вновь синтезированными копиями.Однако было идентифицировано все большее количество внутриклеточных белков, которые уклоняются от этого процесса обновления и вместо этого сохраняются на протяжении всей жизни клетки. Эта разнообразная группа долгоживущих белков может быть особенно склонна к накоплению повреждений и, таким образом, играет критическую роль в функциональном ухудшении ключевых регуляторных процессов во время старения.
Старение — это универсальное явление, которое бросает вызов всем биологическим системам на нескольких уровнях и в конечном итоге приводит к их функциональному снижению.Зависимые от возраста изменения можно наблюдать у широкого круга организмов, от снижения репликативного потенциала, наблюдаемого у одноклеточных дрожжей 1 , до снижения производительности жизненно важных органов у более сложных организмов, таких как человек. Скорость старения клеток и организмов широко варьируется, и было показано, что генетические факторы и факторы окружающей среды участвуют в возрастном снижении функции клеток и тканей. Хотя старение — сложное явление, становится ясно, что неспособность клетки поддерживать надлежащий белковый гомеостаз играет важную роль в старении и возрастных заболеваниях 2 .Постоянный обмен белка — одна из основных стратегий, используемых для поддержания этого гомеостаза, и ей уделялось большое внимание. Недавние исследования старения сделали новый акцент на буквально старых виновниках: долгоживущих белках, которые уклоняются от оборота 3, 4 . В этой статье мы обсуждаем различные контексты, в которых были охарактеризованы долгоживущие белки, и возможные функциональные последствия их персистенции. Мы утверждаем, что эти долгоживущие белки играют большую роль в старении организма, чем считалось ранее.
В этой статье мы обсуждаем различные контексты, в которых были охарактеризованы долгоживущие белки, и возможные функциональные последствия их персистенции. Мы утверждаем, что эти долгоживущие белки играют большую роль в старении организма, чем считалось ранее.
Исключения из правила
Белки постоянно разлагаются и впоследствии заменяются вновь синтезированными копиями. Этот процесс обновления обеспечивает постоянную поставку новых и функциональных белков, позволяя уничтожить нефункциональные, поврежденные или даже токсичные виды. Скорость обновления, однако, может широко варьироваться от белка к белку, с периодом полураспада в пределах одной и той же клетки. Исследования на почкующихся дрожжах (~ 1,5 часа клеточного цикла) показали, что средний и средний период полураспада белка при нормальных условиях роста составляет ~ 43 минуты 5 .Эта цифра увеличивается до 0,5–35 часов в делящихся клетках млекопитающих (~ 24 часа клеточного цикла) и ~ 43 часов в неделящихся клетках 6, 7 . Исследования оборота на мышах (продолжительность жизни ~ 1,5 года) показали, что средний период полураспада белков в головном мозге, печени и крови составляет от 3 до 9 дней 8 . Хотя период полураспада различных белков в клетке может варьироваться от минут до дней, скорость оборота белков часто коррелирует с их функцией или субклеточной локализацией. Например, белки в митохондриях и эндоплазматическом ретикулуме в среднем имеют более длительный период полураспада, чем другие белки 8 .Большие комплексы, такие как рибосомы и протеасомы, также имеют очень похожие скорости оборота для каждого из своих компонентов 6, 8 .
Исследования оборота на мышах (продолжительность жизни ~ 1,5 года) показали, что средний период полураспада белков в головном мозге, печени и крови составляет от 3 до 9 дней 8 . Хотя период полураспада различных белков в клетке может варьироваться от минут до дней, скорость оборота белков часто коррелирует с их функцией или субклеточной локализацией. Например, белки в митохондриях и эндоплазматическом ретикулуме в среднем имеют более длительный период полураспада, чем другие белки 8 .Большие комплексы, такие как рибосомы и протеасомы, также имеют очень похожие скорости оборота для каждого из своих компонентов 6, 8 .
Из всех исследований белкового обмена на сегодняшний день большинство сосредоточено на обмене в течение относительно коротких периодов времени (то есть значительно короче, чем продолжительность жизни в клетках и организме), поэтому осталось мало исследований, посвященных белкам с длительным периодом полураспада. Хотя долгоживущим белкам в последнее время уделяется больше внимания, существование долгоживущих белков было хорошо установленным фактом в течение нескольких десятилетий. Еще в 1966 году радиоизотопное импульсное мечение (вставка 1) использовалось для идентификации гистонов с длительным периодом полураспада 9 . Более поздние исследования 1970-х годов также использовали радиоизотопы для идентификации миелина и миелиновых протеолипидных белков как долгоживущих 10, 11 . Также в 1970-х годах альтернативный метод, рацемизация L-D-аспарагиновой кислоты (вставка 1), был использован для мониторинга белкового обмена, выявления нескольких коллагенов, эластина, кристаллинов хрусталика глаза, зубной эмали и зубного дентина, у которых период полураспада порядок лет () 12–17 .
Еще в 1966 году радиоизотопное импульсное мечение (вставка 1) использовалось для идентификации гистонов с длительным периодом полураспада 9 . Более поздние исследования 1970-х годов также использовали радиоизотопы для идентификации миелина и миелиновых протеолипидных белков как долгоживущих 10, 11 . Также в 1970-х годах альтернативный метод, рацемизация L-D-аспарагиновой кислоты (вставка 1), был использован для мониторинга белкового обмена, выявления нескольких коллагенов, эластина, кристаллинов хрусталика глаза, зубной эмали и зубного дентина, у которых период полураспада порядок лет () 12–17 .
Box 1
Методы идентификации долгоживущих белков
L / D рацемизация аспарагиновой кислоты. Все живые организмы включают исключительно L-энантиомеры аминокислот в свои белки. Однако в процессе, который зависит от времени и температуры, эти аминокислоты очень медленно рацемизируются до смеси L- и D-энантиомеров. Следовательно, при тщательной калибровке соотношения содержания L- и D-энантиомеров могут определить возраст белка. Хотя низкая скорость рацемизации больше подходит для определения возраста белков, которым тысячи лет, рацемизация аспарагиновой кислоты является самой быстрой среди аминокислот и использовалась для определения периода полужизни особенно долгоживущих белков 12 , 13, 15–17 .Радиоизотопная импульсная маркировка. Включение и последующее сохранение радиоизотопов можно использовать для идентификации долгоживущих белков. В данном случае радиоактивный предшественник, часто лейцин для белков, вводится в ткань животного, представляющего интерес, или добавляется в среду в культуре клеток. Введенных животных умерщвляют или собирают клетки в различные моменты времени, экстрагируют или иммунопреципитируют специфические белки и измеряют радиоактивность. Устойчивая радиоактивность указывает на стабильный или долгоживущий белок, и путем многократных измерений после инъекции можно определить период полураспада интересующего белка 3, 9–11, 18, 72–74, 77, 78 .
Хотя низкая скорость рацемизации больше подходит для определения возраста белков, которым тысячи лет, рацемизация аспарагиновой кислоты является самой быстрой среди аминокислот и использовалась для определения периода полужизни особенно долгоживущих белков 12 , 13, 15–17 .Радиоизотопная импульсная маркировка. Включение и последующее сохранение радиоизотопов можно использовать для идентификации долгоживущих белков. В данном случае радиоактивный предшественник, часто лейцин для белков, вводится в ткань животного, представляющего интерес, или добавляется в среду в культуре клеток. Введенных животных умерщвляют или собирают клетки в различные моменты времени, экстрагируют или иммунопреципитируют специфические белки и измеряют радиоактивность. Устойчивая радиоактивность указывает на стабильный или долгоживущий белок, и путем многократных измерений после инъекции можно определить период полураспада интересующего белка 3, 9–11, 18, 72–74, 77, 78 .
Масс-спектрометрия с отслеживанием импульсов стабильных изотопов. Включение и последующее сохранение стабильного изотопа 15N также можно использовать для идентификации долгоживущих белков. Здесь 2 поколения крыс получают диету, в которой единственным источником азота являются водоросли 15N, в результате получается животное с однородной меткой 15N 19 . Затем диету переключают на нормальную диету 14N на период погони, и животных умерщвляют в соответствующие моменты времени 4 . Затем ткани можно собирать и переваривать с последующим проведением рассеянного склероза.MS не только идентифицирует каждый детектируемый белок, но также может определять относительные отношения версий 15N к их эквивалентам 14N 79 . Любые идентифицированные белки со значительным 15N после длительного периода погони будут считаться долгоживущими.
Включение и последующее сохранение стабильного изотопа 15N также можно использовать для идентификации долгоживущих белков. Здесь 2 поколения крыс получают диету, в которой единственным источником азота являются водоросли 15N, в результате получается животное с однородной меткой 15N 19 . Затем диету переключают на нормальную диету 14N на период погони, и животных умерщвляют в соответствующие моменты времени 4 . Затем ткани можно собирать и переваривать с последующим проведением рассеянного склероза.MS не только идентифицирует каждый детектируемый белок, но также может определять относительные отношения версий 15N к их эквивалентам 14N 79 . Любые идентифицированные белки со значительным 15N после длительного периода погони будут считаться долгоживущими.
Таблица 1
Известные долгоживущие белки и молекулы. Перечислены все известные долгоживущие белки или молекулы. Период полураспада указывается после определения. В противном случае указанный возраст — это возраст, по крайней мере, для части молекулы (время жизни). Методы, используемые для определения продолжительности жизни, включают: рацемизацию L / D-аспарагиновой кислоты (L / D Race), импульсное мечение радиоизотопов (RI-PL) и импульсное / последовательное мечение стабильных изотопов, анализируемое с помощью МС (SI-PC-MS).
Методы, используемые для определения продолжительности жизни, включают: рацемизацию L / D-аспарагиновой кислоты (L / D Race), импульсное мечение радиоизотопов (RI-PL) и импульсное / последовательное мечение стабильных изотопов, анализируемое с помощью МС (SI-PC-MS).
| Молекула | Возраст | Измерение | Организм | Метод | Ссылка |
|---|---|---|---|---|---|
| Кристаллин хрусталика глаза | > 70 лет | Продолжительность жизни | Человек | L / D Race | 15 |
| Коллаген | 117 лет | Halflife | Человек | L / D Race | 12 |
| Эластин | > 78 лет | Срок службы | Человек | L / D Раса | 14 |
| Эмаль / дентин | > 70 лет | Срок службы | Человек | L / D Race | 16, 17 |
| Histones | 223 дня | Halflife | Mouse | RI-PL | 77 |
| 117 дней | Halflife | Mouse | RI-PL | 9 | |
| 218 дней | Halflife | Крыса | RI-PL | 78 | |
| Ядерные поровые белки | > 1 месяц | Срок службы | Черви | RI-PL | 3 |
| > 1 год | Срок службы | Крыса | SI-PC-MS | 4 | |
| Миелин | 95 дней | Halflife | Крыса | RI-PL | 11 |
| > 100 дней | Halflife | Mouse | RI-PL | 10 | |
| Миелиновый протеолипидный белок | > 100 дней | Halflife | Мышь | RI-PL | 10 |
| Сплоченность Rec8 | > недель | Срок службы | Мышь | RI-PL | 18 |
| мРНК | неопределенный? | Срок службы | Семена растений | Н / Д | 71 |
| > 2 года | Halflife | Ооциты лягушки | RI-PL | 72 | |
| Холестерин | > 18 месяцев | Срок службы | Кролик | RI-PL | 74 |
| Фосфолипиды | > 192 дней | Продолжительность жизни | Кролик | RI-PL | 73 |
Последние достижения в области импульсного мечения предоставляют убедительные доказательства того, что еще предстоит открыть более долгоживущие белки . В двух недавних исследованиях было обнаружено, что белки комплексов ядерных пор (NPC) и главный компонент когезинового комплекса ДНК были долгоживущими 3,18 . В то время как предыдущие исследования, которые идентифицировали эти долгоживущие белки, обязательно основывались на априорном знании того, что они действительно могут быть долгоживущими, недавние достижения в области масс-спектрометрии (МС) с высоким разрешением в сочетании со стабильным изотопным методом отслеживания импульсов целых животных (вставка 1 ) 19 , позволил объективно идентифицировать долгоживущие белки.Эти исследования подтвердили долговечность белков миелина и гистонов и увеличили известную продолжительность жизни белков NPC до более чем 1 года 4 . Удивительный вывод всех этих исследований состоит в том, что небольшая, но важная часть клеточного протеома так же стара, как клетки-хозяева, и они могут играть важную роль в возрастном функциональном снижении соответствующих тканей.
В двух недавних исследованиях было обнаружено, что белки комплексов ядерных пор (NPC) и главный компонент когезинового комплекса ДНК были долгоживущими 3,18 . В то время как предыдущие исследования, которые идентифицировали эти долгоживущие белки, обязательно основывались на априорном знании того, что они действительно могут быть долгоживущими, недавние достижения в области масс-спектрометрии (МС) с высоким разрешением в сочетании со стабильным изотопным методом отслеживания импульсов целых животных (вставка 1 ) 19 , позволил объективно идентифицировать долгоживущие белки.Эти исследования подтвердили долговечность белков миелина и гистонов и увеличили известную продолжительность жизни белков NPC до более чем 1 года 4 . Удивительный вывод всех этих исследований состоит в том, что небольшая, но важная часть клеточного протеома так же стара, как клетки-хозяева, и они могут играть важную роль в возрастном функциональном снижении соответствующих тканей.
Долгоживущие белки и старение
Чтобы проиллюстрировать, как недостаток обмена белков может способствовать процессу старения, мы будем использовать аналогию с современным автомобилем. Автомобили, на которых мы сегодня ездим, представляют собой сложные машины, состоящие из множества компонентов. Части автомобиля, находящиеся в постоянной эксплуатации, со временем изнашиваются. Часто это не проблема, так как такие детали, как шины и фильтры, заменяются, что продлевает срок службы машины. Однако двигатель и шасси большие и дорогие, и обычно не подлежат замене в течение всего срока службы автомобиля. Они являются долговечными компонентами, и, поскольку они теряют свою функцию, то же самое происходит и с автомобилем.
Автомобили, на которых мы сегодня ездим, представляют собой сложные машины, состоящие из множества компонентов. Части автомобиля, находящиеся в постоянной эксплуатации, со временем изнашиваются. Часто это не проблема, так как такие детали, как шины и фильтры, заменяются, что продлевает срок службы машины. Однако двигатель и шасси большие и дорогие, и обычно не подлежат замене в течение всего срока службы автомобиля. Они являются долговечными компонентами, и, поскольку они теряют свою функцию, то же самое происходит и с автомобилем.
Хотя биологические системы, такие как клетки, не являются механическими устройствами, а работают на принципах статистической термодинамики, идея непрерывной замены отдельных частей для поддержания всей системы может быть применена.Мы уже упоминали процесс оборота белка, в котором полипептиды постоянно разрушаются и заменяются вновь синтезированными копиями, устраняя повреждения или токсичные виды белков. Однако, если белок не может быть перевернут, его персистенция может привести к повреждению, которое нелегко восстановить, что, в свою очередь, может отрицательно повлиять на функцию клеток (.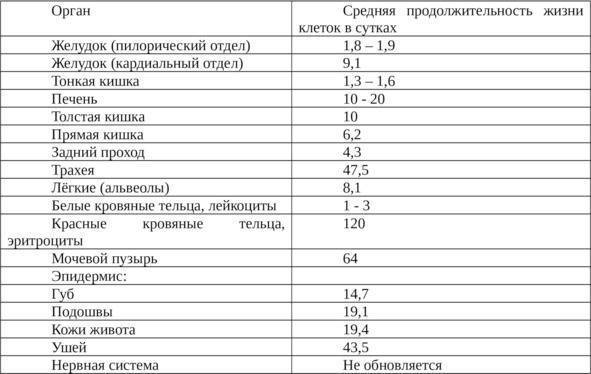 ). Чтобы проиллюстрировать потенциальное влияние долгой жизни на функцию белков, мы сначала обсудим кристаллин, хорошо изученный долгоживущий белок, который ограничен клетками хрусталика глаза и испытывает хорошо описанные возрастные изменения и модификации, но имеет физиологические последствия. которые изолированы от хрусталика глаза, и белки внеклеточного матрикса (ЕСМ) коллаген и эластин.Во-вторых, мы обсудим NPC, мультибелковую сборку, содержащую долгоживущие компоненты, которые не только имеют структурную природу, но также играют активную роль в переносе молекул в ядра и из всех ядер. Это всего лишь несколько примеров долгоживущих белков с важными функциями; поскольку эти долгоживущие белки стареют, их функции снижаются, что может играть важную роль в старении соответствующих клеток и тканей.
). Чтобы проиллюстрировать потенциальное влияние долгой жизни на функцию белков, мы сначала обсудим кристаллин, хорошо изученный долгоживущий белок, который ограничен клетками хрусталика глаза и испытывает хорошо описанные возрастные изменения и модификации, но имеет физиологические последствия. которые изолированы от хрусталика глаза, и белки внеклеточного матрикса (ЕСМ) коллаген и эластин.Во-вторых, мы обсудим NPC, мультибелковую сборку, содержащую долгоживущие компоненты, которые не только имеют структурную природу, но также играют активную роль в переносе молекул в ядра и из всех ядер. Это всего лишь несколько примеров долгоживущих белков с важными функциями; поскольку эти долгоживущие белки стареют, их функции снижаются, что может играть важную роль в старении соответствующих клеток и тканей.
Долгоживущие белки и накопление повреждений.Большинство белков участвуют в постоянном цикле синтеза и распада. Однако некоторые белки ускользают от деградации и являются долгоживущими. Из-за своей долговечности эти долгоживущие белки более склонны к накоплению повреждений, которые могут привести к нарушению функции белков и старению клеток.
Из-за своей долговечности эти долгоживущие белки более склонны к накоплению повреждений, которые могут привести к нарушению функции белков и старению клеток.
Кристаллин и структура хрусталика
Кристаллины из хрусталика глаза были одними из первых обнаруженных долгоживущих белков и представляют, пожалуй, наиболее полную картину на сегодняшний день, связывая продолжительность жизни белков и неблагоприятные последствия 15 .Белки кристаллина, которые выражаются в трех различных изоформах (альфа, бета и гамма), составляют более 90% от общего содержания белка в клетках волокон хрусталика глаза и более 35% их сырого веса 20, 21 . Их долголетие обусловлено уникальной программой развития, которую проходят клетки волокон хрусталика во время эмбриогенеза и взрослой жизни. Основная часть линзы состоит из неделящихся волоконных клеток хрусталика, которые меняются с возрастом, причем самые старые волокнистые клетки находятся в центральном «ядре», а клетки уменьшающегося возраста с каждым слоем наружу () 22 . Самый внешний слой состоит из реплицирующейся популяции клеток, которая дает начало клеткам нижележащих волокон. После дифференцировки в неделящиеся волоконно-линзовые клетки их органеллы, включая ядро, все разрушаются посредством регулируемых процессов, которые используют протеазы и нуклеазы, оставляя после себя заключенные в мембраны мешки с белком кристаллина 23 . Эта эвакуация органелл необходима для обеспечения прозрачности хрусталика, поскольку органеллы рассеивают свет, а упорядоченные белки (кристаллины) — нет. 24 .Этот процесс дифференциации происходит на протяжении всей взрослой жизни, производя кольца из новых волоконных клеток, аналогичные кольцам дерева. Поскольку клеточные волокна не имеют органелл, синтез белка минимален или отсутствует, как и деградация белка, в результате чего возникают белки-кристаллины и, возможно, другие, которые синтезируются при рождении клетки и сохраняются на протяжении всей жизни организма.
Самый внешний слой состоит из реплицирующейся популяции клеток, которая дает начало клеткам нижележащих волокон. После дифференцировки в неделящиеся волоконно-линзовые клетки их органеллы, включая ядро, все разрушаются посредством регулируемых процессов, которые используют протеазы и нуклеазы, оставляя после себя заключенные в мембраны мешки с белком кристаллина 23 . Эта эвакуация органелл необходима для обеспечения прозрачности хрусталика, поскольку органеллы рассеивают свет, а упорядоченные белки (кристаллины) — нет. 24 .Этот процесс дифференциации происходит на протяжении всей взрослой жизни, производя кольца из новых волоконных клеток, аналогичные кольцам дерева. Поскольку клеточные волокна не имеют органелл, синтез белка минимален или отсутствует, как и деградация белка, в результате чего возникают белки-кристаллины и, возможно, другие, которые синтезируются при рождении клетки и сохраняются на протяжении всей жизни организма.
Структура хрусталика глаза. а) Положение хрусталика показано в поперечном сечении глаза, а также общая организация структуры хрусталика (вставка).Хрусталик глаза растет в радиальном направлении, причем более старые клетки волокон хрусталика располагаются в центре, а более молодые клетки — на внешних кольцах. б) Клетки хрусталика в результате старения. По мере старения хрусталика глаза долгоживущие молекулы кристаллина накапливают повреждения, что приводит к их агрегации в более крупные упорядоченные структуры, что нарушает их свойства прозрачности.
а) Положение хрусталика показано в поперечном сечении глаза, а также общая организация структуры хрусталика (вставка).Хрусталик глаза растет в радиальном направлении, причем более старые клетки волокон хрусталика располагаются в центре, а более молодые клетки — на внешних кольцах. б) Клетки хрусталика в результате старения. По мере старения хрусталика глаза долгоживущие молекулы кристаллина накапливают повреждения, что приводит к их агрегации в более крупные упорядоченные структуры, что нарушает их свойства прозрачности.
Поскольку волокна хрусталика не обладают способностью поддерживать гомеостаз белков посредством белкового обмена, должны быть задействованы другие механизмы, помогающие сохранить правильное свернутое состояние кристаллинов.Во-первых, альфа-кристаллин действует как молекулярный шаперон, связывая и поддерживая свернутое состояние бета- и гамма-кристаллинов, 25, 26 , отсутствие или мутации которых ускоряют агрегацию белков хрусталика 26, 27 . Второй механизм — использование поглотителей активных форм кислорода в клетках волокна. Соединения, такие как восстановленный глутатион (GSH), циркулируют из внешнего эпителия хрусталика по всему внутреннему пространству хрусталика, очищая кислородные радикалы и другие окисляющие соединения от волоконных клеток 28, 29 .Эти системы помогают предотвратить неправильную укладку, агрегацию и накопление повреждений на долгоживущих кристаллинах. Тем не менее, их активность снижается с повреждением и возрастом 30–33 .
Второй механизм — использование поглотителей активных форм кислорода в клетках волокна. Соединения, такие как восстановленный глутатион (GSH), циркулируют из внешнего эпителия хрусталика по всему внутреннему пространству хрусталика, очищая кислородные радикалы и другие окисляющие соединения от волоконных клеток 28, 29 .Эти системы помогают предотвратить неправильную укладку, агрегацию и накопление повреждений на долгоживущих кристаллинах. Тем не менее, их активность снижается с повреждением и возрастом 30–33 .
Эти механизмы контроля качества белков-кристаллинов ограничены и со временем не могут удовлетворить потребности протеома хрусталиковых клеток, подвергающегося все более стрессовой нагрузке. Кристаллины линз должны выдерживать уникальные нагрузки, такие как ультрафиолетовое излучение, а также обычные, такие как окислительные стрессы. Эти инсульты приводят к нескольким модификациям белков хрусталика, включая дезамидирование, гликирование, смешанные дисульфиды и усечение 34–39 (Box 2). В ответ на повреждение, белки-кристаллины разворачиваются и начинают агрегировать в частицы с большой молекулярной массой 40, 41 . Эти большие агрегаты менее прозрачны, чем природно свернутый белок, что приводит к непрозрачным линзам и ухудшению зрения, также известному как катаракта (.). Хотя механизмы биологического восстановления исчерпаны, современная медицина изобрела способ возродить эти стареющие линзы с помощью хирургической операции по замене линз катаракты. Однако другие долгоживущие белки могут не иметь столь элегантного решения.
В ответ на повреждение, белки-кристаллины разворачиваются и начинают агрегировать в частицы с большой молекулярной массой 40, 41 . Эти большие агрегаты менее прозрачны, чем природно свернутый белок, что приводит к непрозрачным линзам и ухудшению зрения, также известному как катаракта (.). Хотя механизмы биологического восстановления исчерпаны, современная медицина изобрела способ возродить эти стареющие линзы с помощью хирургической операции по замене линз катаракты. Однако другие долгоживущие белки могут не иметь столь элегантного решения.
Box 2
Повреждение белка
Белки могут накапливать различные формы повреждений и модификаций, их слишком много, чтобы перечислять их здесь. Ниже приведены основные формы повреждений, упомянутых в этом обзоре.
Деамидирование: Деамидирование — неферментативная потеря амидных групп в боковых цепях остатков аспарагина и глутамина. Этот процесс зависит от контекста, модулируется окружающими аминокислотами, а также структурой и приводит к отрицательному заряду в боковой цепи, который может влиять на степень гидролиза белков 80 . Продукты с улучшенным окончанием гликирования (AGE): AGE представляет собой разнообразную группу модификаций, представляющих собой конъюгацию углеводов или углеводных фрагментов с белками. Эта модификация может привести к сшиванию различных пептидов, включая глиоксаль, метилглиоксаль и карбоксиметил-лизин среди многих других. 81 . Уровни AGE могут быть увеличены в старых тканях, таких как пожилой миокард 82 .
Продукты с улучшенным окончанием гликирования (AGE): AGE представляет собой разнообразную группу модификаций, представляющих собой конъюгацию углеводов или углеводных фрагментов с белками. Эта модификация может привести к сшиванию различных пептидов, включая глиоксаль, метилглиоксаль и карбоксиметил-лизин среди многих других. 81 . Уровни AGE могут быть увеличены в старых тканях, таких как пожилой миокард 82 .
Смешанные дисульфиды: по мере увеличения нагрузки окислительного стресса могут возникать аберрантные дисульфидные поперечные связи между белковыми цистеинами и GSH или с другими цистеинами, образующими внутри- или межмолекулярные поперечные связи. 83, 84 .Эти сшивки могут приводить к образованию крупных белков, часто встречающихся в агрегатах 84 .
Усечение: белки могут подвергаться усечению, когда аминокислоты теряются с нор С-концов 85 или расщепляются по внутренним остаткам 86 . Усечение может быть причиной или продуктами других типов повреждений.
Агрегация белков: Агрегация белков — это образование ненативных высокомолекулярных структур. Эти агрегаты обычно выводят из строя агрегированный белок и могут быть результатом других модификаций, таких как дезамидирование, гликирование и смешанные дисульфиды.Агрегаты также являются признаком ряда нейродегенеративных заболеваний, таких как болезни Хантингтона и Альцгеймера 87 .
Карбонилирование: одна из наиболее изученных модификаций окислительного повреждения, карбонилирование — это необратимое присоединение карбонильной группы, обычно к остаткам лизина, аргенина или пролина. Эта модификация окисления, катализируемого металлами (MCO), является результатом образования активных форм кислорода (ROS) внутри клетки 88 .
Коллаген и эластин
Исследования долговечности коллагена и эластина следовали той же траектории, что и кристаллины хрусталика, и аналогично неактивной среде клеток волокон хрусталика, коллагены и эластин обычно находятся во внеклеточных областях, которые изолированы от клеточных. среда.Коллагены и эластины представляют собой агрегаты белков, которые синтезируются клеткой в качестве пре-протеинов, а затем расщепляются и секретируются в ЕСМ, где они сшиваются и образуют структуры более высокого порядка. Несмотря на то, что он оснащен надежной сетью протеаз, используемых для ремоделирования ECM, ECM не находится под постоянным потоком белкового обмена, которому внутриклеточные белки подвергаются 42 .
среда.Коллагены и эластины представляют собой агрегаты белков, которые синтезируются клеткой в качестве пре-протеинов, а затем расщепляются и секретируются в ЕСМ, где они сшиваются и образуют структуры более высокого порядка. Несмотря на то, что он оснащен надежной сетью протеаз, используемых для ремоделирования ECM, ECM не находится под постоянным потоком белкового обмена, которому внутриклеточные белки подвергаются 42 .
Подобно кристаллинам хрусталика, коллаген и эластин также особенно подвержены повреждению, предположительно из-за их долговечности.Эти химические модификации включают гликирование, сшивание и фрагментацию их больших белковых структур 13, 43–45 . По мере накопления этого повреждения наблюдаются сопутствующие изменения физических свойств коллагена и эластина, такие как повышенная жесткость, устойчивость к денатурации 13, 44, 45 и ухудшение характеристик подлежащей ткани 45–48 . Хотя было определено, что коллаген и эластин являются долгоживущими, в отличие от кристаллинов, имеются значительные доказательства их продолжающейся экспрессии и деградации на протяжении всей жизни организма-хозяина 13 . Таким образом, точный вклад долгоживущих коллагенов и эластинов в процесс старения по сравнению с вновь синтезируемыми, еще предстоит полностью понять.
Таким образом, точный вклад долгоживущих коллагенов и эластинов в процесс старения по сравнению с вновь синтезируемыми, еще предстоит полностью понять.
Долгоживущие белки в метаболически активных клетках
Открытие того, что NPC содержат долгоживущие белки, стало неожиданностью, потому что, в отличие от кристаллинов, это внутриклеточная структура и она экспрессируется повсеместно. NPC представляет собой белковую структуру восьмикратной симметрии ~ 90MDa, которая состоит из ~ 30 нуклеопоринов (Nups) в множественных копиях 49, 50 .Этот комплекс встроен в ядерную оболочку (NE) в местах соединения внутренней ядерной мембраны (INM) и внешней ядерной мембраны (ONM) 51 . NPC действуют как эксклюзивные транспортные каналы, которые опосредуют весь ядерный трафик и, таким образом, поддерживают надлежащую ядерную / цитоплазматическую компартментализацию 52 . Действительно, NPC представляет собой один из наиболее активных транспортных каналов, поскольку каждый NPC может осуществлять транспортировку груза до 1000 раз в секунду 53 . Имея тысячи ядерных пор на ядро 54 , NPC данной клетки несут ответственность за правильное прохождение миллионов транспортных грузов, исключая все другие комплексы.Разрушение этих важных ворот приведет к потере надлежащей ядерной / цитоплазматической компартментализации и, следовательно, всей клеточной регуляции, которая зависит от этой секвестрации.
Имея тысячи ядерных пор на ядро 54 , NPC данной клетки несут ответственность за правильное прохождение миллионов транспортных грузов, исключая все другие комплексы.Разрушение этих важных ворот приведет к потере надлежащей ядерной / цитоплазматической компартментализации и, следовательно, всей клеточной регуляции, которая зависит от этой секвестрации.
Подобно другим большим белковым ансамблям, NPC состоит из нескольких субкомплексов, каждый из которых вносит определенные функции и биофизические свойства в поры (). Во-первых, это по крайней мере три трансмембранных Nups, которые, как полагают, закрепляют NPC на мембране 55–57 . Внутри поры находится каркас Nups, состоящий из многокомпонентных комплексов Nup107 / 160 и Nup205 58, 59 .Считается, что эти каркасные комплексы обеспечивают структурную основу, с которой связаны несколько других комплексов Nup 60 . К каркасу в центре поры прикреплены FG-Nups, которые содержат домены, богатые фенилаланином / глицином 61 и, как было показано, создают барьер ядерной проницаемости, позволяя зависимое от сигнала прохождение груза 62, 63 . Наконец, периферические Nups, которые простираются в цитоплазматическое и ядерное пространство и образуют цитоплазматические филаменты и ядерную корзину, соответственно.Эти периферийные комплексы способствуют транспорту и его направленности, обеспечивая места стыковки грузов и других транспортных молекул 49, 52 .
Наконец, периферические Nups, которые простираются в цитоплазматическое и ядерное пространство и образуют цитоплазматические филаменты и ядерную корзину, соответственно.Эти периферийные комплексы способствуют транспорту и его направленности, обеспечивая места стыковки грузов и других транспортных молекул 49, 52 .
Схема ядерного порового комплекса. NPC встроен в двойную мембранную структуру, разделяющую ядро и цитоплазму. Он состоит из нескольких субкомплексов, включая периферические, мембранные, канальные FG и каркасные Nups. В то время как периферические, канальные и мембранные Nups постоянно обновляются, Nups каркаса стабильны.Мы полагаем, что такая стабильность необходима, и что быстрая замена или потеря этих компонентов приведет к нарушению барьера проницаемости. Таким образом, обслуживание или обновление этих комплексов каркасов обязательно происходит медленно, если вообще происходит.
Первое доказательство того, что белки NPC являются долгоживущими, было получено при исследовании NPC C. elegans, в ходе которого было обнаружено, что экспрессия каркасных Nups, но не периферических Nups, практически отсутствует в зрелом возрасте, хотя соответствующие белки все еще присутствуют. 3 .Это говорит о том, что в то время как периферические Nups постоянно переворачиваются, каркас NPC строится во время эмбриогенеза и длится всю жизнь червя, которая составляет порядка недель. Эти результаты дополнили другие работы, демонстрирующие, что белки каркасных NPC могут сохраняться в ядерной поре без обмена в течение часов 64 . Это было в отличие от периферических Nups, которые находились в поре всего за секунды, что представляет собой разницу в 4 порядка во времени пребывания различных компонентов одного и того же комплекса.
elegans, в ходе которого было обнаружено, что экспрессия каркасных Nups, но не периферических Nups, практически отсутствует в зрелом возрасте, хотя соответствующие белки все еще присутствуют. 3 .Это говорит о том, что в то время как периферические Nups постоянно переворачиваются, каркас NPC строится во время эмбриогенеза и длится всю жизнь червя, которая составляет порядка недель. Эти результаты дополнили другие работы, демонстрирующие, что белки каркасных NPC могут сохраняться в ядерной поре без обмена в течение часов 64 . Это было в отличие от периферических Nups, которые находились в поре всего за секунды, что представляет собой разницу в 4 порядка во времени пребывания различных компонентов одного и того же комплекса.
В более позднем исследовании использовалось мечение стабильного изотопного импульса, проанализированное с помощью MS (вставка 1), для определения продолжительности жизни NPC у крысы, которая имеет более сложную физиологию и большую продолжительность жизни, порядка 2 лет 4 . В этом исследовании крыс умерщвляли через 6 и 12 месяцев преследования, и ядра печени и ткани мозга анализировали с помощью MS. Данные для каждого белка NPC были получены из ядер тканей мозга и печени, и действительно было обнаружено, что только белки каркаса NPC все еще были помечены импульсным изотопом через 6 и 12 месяцев, особенно в головном мозге, а не в печени.Это указывало на то, что эти Nups каркаса были старше 1 года, что намного превышало нормальную продолжительность жизни белка и находилось на одном уровне с некоторыми из самых долгоживущих белков, известных на сегодняшний день.
В этом исследовании крыс умерщвляли через 6 и 12 месяцев преследования, и ядра печени и ткани мозга анализировали с помощью MS. Данные для каждого белка NPC были получены из ядер тканей мозга и печени, и действительно было обнаружено, что только белки каркаса NPC все еще были помечены импульсным изотопом через 6 и 12 месяцев, особенно в головном мозге, а не в печени.Это указывало на то, что эти Nups каркаса были старше 1 года, что намного превышало нормальную продолжительность жизни белка и находилось на одном уровне с некоторыми из самых долгоживущих белков, известных на сегодняшний день.
Исследования на червях и крысах сходным образом обнаружили, что только каркасные комплексы Nup107 / 160 и Nup205, но не периферические, мембранные или FG Nups, являются долгоживущими 3, 4 . Таким образом, в отличие от больших белковых комплексов, таких как рибосома или протеасома, кажется, что NPC не оборачивается как единое целое, а вместо этого индивидуальные субкомплексы имеют разные скорости оборота, а некоторые демонстрируют отсутствие оборота или очень малый обмен.
Сохранение этих долгоживущих компонентов NPC, кажется, не происходит без последствий, и теперь мы знаем некоторые из разветвлений их долговечности. Было обнаружено, что ядра, изолированные от старых червей и крыс, имеют пониженные уровни каркасных Nups, а также увеличение окислительного повреждения по сравнению с более молодыми ядрами 3 . В обоих случаях это привело к нарушению барьера ядерной проницаемости и неожиданному открытию агрегатов тубулина внутри ядер из старых мозгов крыс.Присутствие ядерных агрегатов в старых ядрах мозга важно, поскольку эти типы агрегатов были связаны с несколькими нейродегенеративными заболеваниями 65 .
Почему динамический белковый комплекс может содержать долгоживущие компоненты, особенно если есть известные разветвления? Возможно, это связано с тем, что NPC представляет собой внедренную в мембрану многокомплексную структуру, которая должна постоянно поддерживать селективный барьер проницаемости. Многие белки функционируют как часть больших многокомпонентных комплексов, которые необходимо сначала разобрать, прежде чем переворачивать. Эта разборка приводит к потере функции этого комплекса, что часто не имеет никакого значения, поскольку замещающие комплексы уже присутствуют. Однако что произойдет, если потеря функции всего нескольких комплексов будет иметь серьезные последствия? Это может иметь место для NPC, поскольку потеря нескольких ядерных пор может привести к потере цитоплазматической / ядерной компартментализации 66 . Таким образом, оборот NPC будет обеспечивать тонкий баланс между удалением и заменой компонентов, сохраняя при этом достаточную целостность ядерных пор для поддержания барьера проницаемости.Так как периферийные Nups часто включаются и выключаются NPC и могут присутствовать в избытке, их можно легко заменить 64 . Чего нельзя сказать о каркасных Nups, которые отвечают за структурную целостность NPC и действуют как точки, с которыми связаны Nups периферического и центрального каналов. Таким образом, удаление больших частей каркаса может не только дестабилизировать NPC, но также обязательно смещать любые связанные периферические и канальные Nups.
Эта разборка приводит к потере функции этого комплекса, что часто не имеет никакого значения, поскольку замещающие комплексы уже присутствуют. Однако что произойдет, если потеря функции всего нескольких комплексов будет иметь серьезные последствия? Это может иметь место для NPC, поскольку потеря нескольких ядерных пор может привести к потере цитоплазматической / ядерной компартментализации 66 . Таким образом, оборот NPC будет обеспечивать тонкий баланс между удалением и заменой компонентов, сохраняя при этом достаточную целостность ядерных пор для поддержания барьера проницаемости.Так как периферийные Nups часто включаются и выключаются NPC и могут присутствовать в избытке, их можно легко заменить 64 . Чего нельзя сказать о каркасных Nups, которые отвечают за структурную целостность NPC и действуют как точки, с которыми связаны Nups периферического и центрального каналов. Таким образом, удаление больших частей каркаса может не только дестабилизировать NPC, но также обязательно смещать любые связанные периферические и канальные Nups. Потеря ядер каркаса, таких как Nup93, приводит к потере барьера проницаемости, поэтому непрерывный обмен этими ядерными ядрами Nups при одновременном обеспечении целостности пор и надлежащих транспортных функций может оказаться невозможным 3 ().Это можно рассматривать как замену частей двигателя автомобиля во время работы.
Потеря ядер каркаса, таких как Nup93, приводит к потере барьера проницаемости, поэтому непрерывный обмен этими ядерными ядрами Nups при одновременном обеспечении целостности пор и надлежащих транспортных функций может оказаться невозможным 3 ().Это можно рассматривать как замену частей двигателя автомобиля во время работы.
Для деления клеток бывают моменты, когда NPC «выключен», и поэтому существует окно возможностей для оборота NPC. Во время митоза в делящихся клетках, NE разрушается (NEBD), приводя к разборке и диспергированию NPC в цитозоль и ER 67 . Это может быть единственным моментом для замены Nups каркаса вновь синтезированными копиями, поскольку цитоплазматическая / ядерная компартментализация отсутствует или необходима.Как только митоз завершился и Nups получили возможность оборота, NE затем повторно собирается вокруг хроматина вместе с NPCs, и вскоре восстанавливается барьер проницаемости 68 . Если клетка вышла из клеточного цикла и больше не делится (например, нейроны), или если в митозе нет NEBD (например, у почкующихся дрожжей), может не быть простого способа заменить потенциально поврежденные NPC. Таким образом, для борьбы с накоплением повреждений в Nups должны использоваться другие новые способы оборота или обслуживания, но в конечном итоге это может иметь негативные последствия для стареющих NPC.
Таким образом, для борьбы с накоплением повреждений в Nups должны использоваться другие новые способы оборота или обслуживания, но в конечном итоге это может иметь негативные последствия для стареющих NPC.
Как можно ослабить негативные последствия старения NPC в неделящихся клетках млекопитающих? Тщательный анализ данных об обороте NPC-крыс может дать некоторые подсказки. В этом исследовании были долгоживущие 15N-меченые каркасные Nups даже после 1 года погони, но более 50% пептидов из соответствующих белков были 14N 4 . Один из вариантов может заключаться в ограничении роста клеток или оборота тканей в период преследования, поскольку эти 15N-пептиды были обнаружены в головном мозге, которые содержат сложную смесь глиальных и нейрональных клеток.Другой возможностью было бы введение новых NPC, которые разбавили бы старые пептиды, меченные импульсной меткой. Хотя в интерфазе NPC действительно могут быть вставлены в интактный NE 69 , такой процесс должен быть связан с удалением всего NPC в постмитотических клетках, чтобы избежать неконтролируемого увеличения ядерных пор. Наконец, наиболее вероятный сценарий состоит в том, что существует минимальная замена отдельных подкомплексов при сохранении общей структуры и функций NPC. Хотя время пребывания для Nups каркаса велико, оно не бесконечно 64 , и небольшая и нечастая временная потеря некоторых Nups каркаса может быть допустимой.Этот медленный процесс обмена, следовательно, поможет предотвратить накопление поврежденных Nups каркаса посредством нормального, хотя и медленного, механизма оборота белка. Независимо от того, какой сценарий окажется правильным, все еще существует значительная популяция компонентов NPC, возраст которых превышает 1 год. Это делает компоненты NPC одними из самых старых полипептидов, которые являются частью активной белковой машины. Присутствие этих долгоживущих белков в неделящихся клетках, таких как нейроны, может представлять функциональную проблему, поскольку, в отличие от глазных линз, нейроны практически незаменимы, а нарушение их функции может привести к их необратимой утрате.
Наконец, наиболее вероятный сценарий состоит в том, что существует минимальная замена отдельных подкомплексов при сохранении общей структуры и функций NPC. Хотя время пребывания для Nups каркаса велико, оно не бесконечно 64 , и небольшая и нечастая временная потеря некоторых Nups каркаса может быть допустимой.Этот медленный процесс обмена, следовательно, поможет предотвратить накопление поврежденных Nups каркаса посредством нормального, хотя и медленного, механизма оборота белка. Независимо от того, какой сценарий окажется правильным, все еще существует значительная популяция компонентов NPC, возраст которых превышает 1 год. Это делает компоненты NPC одними из самых старых полипептидов, которые являются частью активной белковой машины. Присутствие этих долгоживущих белков в неделящихся клетках, таких как нейроны, может представлять функциональную проблему, поскольку, в отличие от глазных линз, нейроны практически незаменимы, а нарушение их функции может привести к их необратимой утрате.
Другие долгоживущие молекулы
Долгоживущие молекулы не ограничиваются белками; они появляются в нескольких других биологических процессах. Геном клетки воспроизводится полуконсервативным образом перед митозом и, как следствие, никогда не заменяется после того, как клетка перестает делиться. Таким образом, ДНК в нейронах так же стара, как и сам организм, что было подтверждено углеродным датированием 14C 70 . Другие нуклеиновые кислоты могут быть долгоживущими; исследования семян растений обнаружили пулы мРНК, которые находятся в состоянии покоя, возможно, в течение многих лет, пока не начнется прорастание 71 , а пулы РНК в ооцитах Xenopus laevis имеют период полураспада более 2 лет 72 .Наконец, ранние изотопные исследования также показали, что холестерин и липиды, связанные с миелиновой оболочкой, были долгоживущими 73, 74 . Это согласуется с наблюдением, что два других компонента оболочки, основной белок миелина и протеолипидный белок, также являются долгоживущими. Долговечность этих небелковых молекул подчеркивает, что недостаток обновления может не быть проблемой, связанной с протеомом старения, но может влиять на возрастное накопление повреждений на других компонентах клетки.
Долговечность этих небелковых молекул подчеркивает, что недостаток обновления может не быть проблемой, связанной с протеомом старения, но может влиять на возрастное накопление повреждений на других компонентах клетки.
Заключительные мысли
Наша оценка того, что подмножество ядерных белков является долгоживущим и, следовательно, уклоняется от белкового обмена, имеет важные последствия для клеточного старения и старения организма, как это обсуждалось для кристаллина хрусталика глаза и белков ядерных пор. Могут ли долгоживущие гистоны быть ответственными за наблюдаемую потерю программ экспрессии молодых генов в постмитотических тканях 75 ? Способствует ли продолжительность жизни Rec8 возрастному увеличению ошибок мейоза, как предполагали авторы 18 ? Возможно, самый важный вопрос на этом этапе заключается в том, существуют ли дополнительные долгоживущие белки, которые еще предстоит обнаружить в головном мозге или других тканях с ограниченным оборотом, таких как сердце и яичники 76 ? Важно ответить на эти вопросы, поскольку, возможно, при ограниченных средствах восстановления возрастных повреждений долгоживущие белки могут оказаться ахиллесовой пятой протеома старения.
Благодарности
Авторы благодарят сотрудников лаборатории Hetzer и E.Q. Тояме за полезные советы и критическое прочтение рукописи. B.H.T поддерживается Фондом Хьюитта; M.W.H Медицинским фондом Эллисона, Национальными институтами здравоохранения США (NIH) (R01GM098749) и Национальным институтом рака (номер награды P30CA014195).
Ссылки
3. Д’Анджело М.А., Райс М., Пановски С.Х., Hetzer MW. Зависимое от возраста разрушение комплексов ядерных пор вызывает потерю ядерной целостности в постмитотических клетках.Клетка. 2009; 136: 284–95. [Бесплатная статья PMC] [PubMed] [Google Scholar] 4. Савас Дж. Н., Тояма Б. Х., Сюй Т., Йетс Дж. Р., 3-й, Хетцер М.В. Чрезвычайно долгоживущие белки ядерных пор в мозгу крысы. Наука. 2012; 335: 942. [Бесплатная статья PMC] [PubMed] [Google Scholar] 5. Белль А., Танай А., Битинка Л., Шамир Р., О’Ши Е.К. Количественная оценка периода полужизни белка в протеоме почкующихся дрожжей. Proc Natl Acad Sci U S. A. 2006; 103: 13004–9. [Бесплатная статья PMC] [PubMed] [Google Scholar] 6. Cambridge SB, et al. Общесистемный протеомный анализ в клетках млекопитающих показывает консервативный функциональный обмен белков.J Proteome Res. 2011; 10: 5275–84. [PubMed] [Google Scholar] 7. Yen HC, Xu Q, Chou DM, Zhao Z, Elledge SJ. Профилирование глобальной стабильности белков в клетках млекопитающих. Наука. 2008; 322: 918–23. [PubMed] [Google Scholar] 8. Price JC, Guan S, Burlingame A, Prusiner SB, Ghaemmaghami S. Анализ динамики протеома в мозге мышей. Proc Natl Acad Sci U S. A. 2010; 107: 14508–13. [Бесплатная статья PMC] [PubMed] [Google Scholar] 9. Piha RS, Cuenod M, Waelsch H. Метаболизм гистонов мозга и печени. J Biol Chem.1966; 241: 2397–404. [PubMed] [Google Scholar] 10. Фишер К.А., Морелл П. Оборот белков в миелине и миелиноподобном материале головного мозга мыши. Brain Res. 1974; 74: 51–65. [PubMed] [Google Scholar] 11. Родригес де Лорес А., Альберичи де Канал М., Де Робертис Э. Оборот белков в субклеточных фракциях коры головного мозга крыс. Brain Res. 1971; 31: 179–84.
Cambridge SB, et al. Общесистемный протеомный анализ в клетках млекопитающих показывает консервативный функциональный обмен белков.J Proteome Res. 2011; 10: 5275–84. [PubMed] [Google Scholar] 7. Yen HC, Xu Q, Chou DM, Zhao Z, Elledge SJ. Профилирование глобальной стабильности белков в клетках млекопитающих. Наука. 2008; 322: 918–23. [PubMed] [Google Scholar] 8. Price JC, Guan S, Burlingame A, Prusiner SB, Ghaemmaghami S. Анализ динамики протеома в мозге мышей. Proc Natl Acad Sci U S. A. 2010; 107: 14508–13. [Бесплатная статья PMC] [PubMed] [Google Scholar] 9. Piha RS, Cuenod M, Waelsch H. Метаболизм гистонов мозга и печени. J Biol Chem.1966; 241: 2397–404. [PubMed] [Google Scholar] 10. Фишер К.А., Морелл П. Оборот белков в миелине и миелиноподобном материале головного мозга мыши. Brain Res. 1974; 74: 51–65. [PubMed] [Google Scholar] 11. Родригес де Лорес А., Альберичи де Канал М., Де Робертис Э. Оборот белков в субклеточных фракциях коры головного мозга крыс. Brain Res. 1971; 31: 179–84. [PubMed] [Google Scholar] 12. Verzijl N, et al. Влияние обмена коллагена на накопление конечных продуктов гликирования. J Biol Chem. 2000; 275: 39027–31.[PubMed] [Google Scholar] 13. Продам Д., Монье В. Комплексная физиология. 235–305. Американское физиологическое общество; 2011. [Google Scholar] 14. Шапиро С.Д., Эндикотт С.К., Провинция Массачусетс, Пирс Дж. А., Кэмпбелл Э. Дж. Заметная долговечность эластических волокон паренхимы легких человека определяется преобладанием D-аспартата и радиоуглерода, связанного с ядерным оружием. J Clin Invest. 1991; 87: 1828–34. [Бесплатная статья PMC] [PubMed] [Google Scholar] 15. Мастерс П.М., Бада Дж. Л., Зиглер Дж. С., младший. Рацемизация аспарагиновой кислоты в хрусталике человека во время старения и при образовании катаракты.Природа. 1977; 268: 71–3. [PubMed] [Google Scholar] 17. Helfman PM, Bada JL. Рацемизация аспарагиновой кислоты в дентине как мера старения. Природа. 1976; 262: 279–81. [PubMed] [Google Scholar] 18. Tachibana-Konwalski K, et al.
[PubMed] [Google Scholar] 12. Verzijl N, et al. Влияние обмена коллагена на накопление конечных продуктов гликирования. J Biol Chem. 2000; 275: 39027–31.[PubMed] [Google Scholar] 13. Продам Д., Монье В. Комплексная физиология. 235–305. Американское физиологическое общество; 2011. [Google Scholar] 14. Шапиро С.Д., Эндикотт С.К., Провинция Массачусетс, Пирс Дж. А., Кэмпбелл Э. Дж. Заметная долговечность эластических волокон паренхимы легких человека определяется преобладанием D-аспартата и радиоуглерода, связанного с ядерным оружием. J Clin Invest. 1991; 87: 1828–34. [Бесплатная статья PMC] [PubMed] [Google Scholar] 15. Мастерс П.М., Бада Дж. Л., Зиглер Дж. С., младший. Рацемизация аспарагиновой кислоты в хрусталике человека во время старения и при образовании катаракты.Природа. 1977; 268: 71–3. [PubMed] [Google Scholar] 17. Helfman PM, Bada JL. Рацемизация аспарагиновой кислоты в дентине как мера старения. Природа. 1976; 262: 279–81. [PubMed] [Google Scholar] 18. Tachibana-Konwalski K, et al. Rec8-содержащий когезин поддерживает биваленты без обновления во время фазы роста ооцитов мыши. Genes Dev. 2010; 24: 2505–16. [Бесплатная статья PMC] [PubMed] [Google Scholar] 19. McClatchy DB, Dong MQ, Wu CC, Venable JD, Yates JR., 3-е 15N метаболическое мечение ткани млекопитающих с медленным обменом белка.J Proteome Res. 2007; 6: 2005–10. [Бесплатная статья PMC] [PubMed] [Google Scholar] 21. Гроу Дж. Генетика кристаллинов: катаракта и не только. Exp Eye Res. 2009. 88: 173–89. [PubMed] [Google Scholar] 22. Райд М.А. Дифференциация клеток линзового волокна и потеря органелл: многие пути приводят к ясности. Philos Trans R Soc Lond B Biol Sci. 2011; 366: 1219–33. [Бесплатная статья PMC] [PubMed] [Google Scholar] 24. Bassnett S, Shi Y, Vrensen GF. Биологическое стекло: структурные детерминанты прозрачности хрусталика глаза. Philos Trans R Soc Lond B Biol Sci.2011; 366: 1250–64. [Бесплатная статья PMC] [PubMed] [Google Scholar] 26. Рао П.В., Хуанг К.Л., Хорвиц Дж., Зиглер Дж. С., младший.
Rec8-содержащий когезин поддерживает биваленты без обновления во время фазы роста ооцитов мыши. Genes Dev. 2010; 24: 2505–16. [Бесплатная статья PMC] [PubMed] [Google Scholar] 19. McClatchy DB, Dong MQ, Wu CC, Venable JD, Yates JR., 3-е 15N метаболическое мечение ткани млекопитающих с медленным обменом белка.J Proteome Res. 2007; 6: 2005–10. [Бесплатная статья PMC] [PubMed] [Google Scholar] 21. Гроу Дж. Генетика кристаллинов: катаракта и не только. Exp Eye Res. 2009. 88: 173–89. [PubMed] [Google Scholar] 22. Райд М.А. Дифференциация клеток линзового волокна и потеря органелл: многие пути приводят к ясности. Philos Trans R Soc Lond B Biol Sci. 2011; 366: 1219–33. [Бесплатная статья PMC] [PubMed] [Google Scholar] 24. Bassnett S, Shi Y, Vrensen GF. Биологическое стекло: структурные детерминанты прозрачности хрусталика глаза. Philos Trans R Soc Lond B Biol Sci.2011; 366: 1250–64. [Бесплатная статья PMC] [PubMed] [Google Scholar] 26. Рао П.В., Хуанг К.Л., Хорвиц Дж., Зиглер Дж. С., младший. Доказательства того, что альфа-кристаллин предотвращает неспецифическую агрегацию белка в неповрежденном хрусталике глаза. Biochim Biophys Acta. 1995; 1245: 439–47. [PubMed] [Google Scholar] 27. Си Дж. Х. и др. Механизм функции малого белка теплового шока in vivo: модель «нокаута» на мышах демонстрирует, что мутация R49C в альфа-А-кристаллине увеличивает нерастворимость белка и гибель клеток. J Biol Chem. 2008; 283: 5801–14.[PubMed] [Google Scholar] 28. Гиблин Ф.Дж. Глутатион: жизненно важный антиоксидант хрусталика. J Ocul Pharmacol Ther. 2000. 16: 121–35. [PubMed] [Google Scholar] 29. Лу М.Ф. Редокс-регулирование в линзе. Prog Retin Eye Res. 2003. 22: 657–82. [PubMed] [Google Scholar] 30. Xing KY, Lou MF. Влияние возраста на системы тиолтрансферазы (глутаредоксина) и тиоредоксина в хрусталике человека. Инвестируйте Ophthalmol Vis Sci. 2010. 51: 6598–604. [Бесплатная статья PMC] [PubMed] [Google Scholar] 31. Шарма К.К., Ортверт Б.Дж. Влияние поперечного сшивания на шапероноподобную функцию альфа-кристаллина.
Доказательства того, что альфа-кристаллин предотвращает неспецифическую агрегацию белка в неповрежденном хрусталике глаза. Biochim Biophys Acta. 1995; 1245: 439–47. [PubMed] [Google Scholar] 27. Си Дж. Х. и др. Механизм функции малого белка теплового шока in vivo: модель «нокаута» на мышах демонстрирует, что мутация R49C в альфа-А-кристаллине увеличивает нерастворимость белка и гибель клеток. J Biol Chem. 2008; 283: 5801–14.[PubMed] [Google Scholar] 28. Гиблин Ф.Дж. Глутатион: жизненно важный антиоксидант хрусталика. J Ocul Pharmacol Ther. 2000. 16: 121–35. [PubMed] [Google Scholar] 29. Лу М.Ф. Редокс-регулирование в линзе. Prog Retin Eye Res. 2003. 22: 657–82. [PubMed] [Google Scholar] 30. Xing KY, Lou MF. Влияние возраста на системы тиолтрансферазы (глутаредоксина) и тиоредоксина в хрусталике человека. Инвестируйте Ophthalmol Vis Sci. 2010. 51: 6598–604. [Бесплатная статья PMC] [PubMed] [Google Scholar] 31. Шарма К.К., Ортверт Б.Дж. Влияние поперечного сшивания на шапероноподобную функцию альфа-кристаллина. Exp Eye Res. 1995; 61: 413–21. [PubMed] [Google Scholar] 32. Гупта Р., Шривастава ОП. Деамидирование влияет на структурные и функциональные свойства человеческого альфа-кристаллина и его олигомеризацию с альфа-В-кристаллином. J Biol Chem. 2004. 279: 44258–69. [PubMed] [Google Scholar] 35. Хансон С.Р., Хасан А., Смит Д.Л., Смит Дж. Б. Основными модификациями нерастворимых в воде кристаллинов хрусталика человека in vivo являются дисульфидные связи, дезамидирование, окисление метионина и расщепление основной цепи. Exp Eye Res. 2000. 71: 195–207.[PubMed] [Google Scholar] 36. Ортверт Б.Дж., Олесен ПР. Исследования по солюбилизации нерастворимой в воде фракции хрусталика и катаракты человека. Exp Eye Res. 1992; 55: 777–83. [PubMed] [Google Scholar] 37. Ахмед Н и др. Гидроимидазолон, полученный из метилглиоксаля, улучшает конечные продукты гликирования белков хрусталика человека. Инвестируйте Ophthalmol Vis Sci. 2003; 44: 5287–92. [PubMed] [Google Scholar] 38. Takemoto LJ. Количественное определение дезамидирования аспарагина-101 из альфа-A-кристаллина при старении хрусталика человека.
Exp Eye Res. 1995; 61: 413–21. [PubMed] [Google Scholar] 32. Гупта Р., Шривастава ОП. Деамидирование влияет на структурные и функциональные свойства человеческого альфа-кристаллина и его олигомеризацию с альфа-В-кристаллином. J Biol Chem. 2004. 279: 44258–69. [PubMed] [Google Scholar] 35. Хансон С.Р., Хасан А., Смит Д.Л., Смит Дж. Б. Основными модификациями нерастворимых в воде кристаллинов хрусталика человека in vivo являются дисульфидные связи, дезамидирование, окисление метионина и расщепление основной цепи. Exp Eye Res. 2000. 71: 195–207.[PubMed] [Google Scholar] 36. Ортверт Б.Дж., Олесен ПР. Исследования по солюбилизации нерастворимой в воде фракции хрусталика и катаракты человека. Exp Eye Res. 1992; 55: 777–83. [PubMed] [Google Scholar] 37. Ахмед Н и др. Гидроимидазолон, полученный из метилглиоксаля, улучшает конечные продукты гликирования белков хрусталика человека. Инвестируйте Ophthalmol Vis Sci. 2003; 44: 5287–92. [PubMed] [Google Scholar] 38. Takemoto LJ. Количественное определение дезамидирования аспарагина-101 из альфа-A-кристаллина при старении хрусталика человека. Curr Eye Res.1998. 17: 247–50. [PubMed] [Google Scholar] 39. Wilmarth PA, et al. Возрастные изменения кристаллинов человека, определенные на основе сравнительного анализа посттрансляционных модификаций молодых и старых хрусталиков: вносит ли дезамидирование вклад в нерастворимость кристаллина? J Proteome Res. 2006; 5: 2554–66. [Бесплатная статья PMC] [PubMed] [Google Scholar] 40. Bloemendal H, et al. Старение и зрение: структура, стабильность и функция кристаллинов хрусталика. Prog Biophys Mol Biol. 2004. 86: 407–85. [PubMed] [Google Scholar] 41.Рой Д., Спектор А. Отсутствие низкомолекулярного альфа-кристаллина в ядерной области старых хрусталиков человека. Proc Natl Acad Sci U S. A. 1976; 73: 3484–7. [Бесплатная статья PMC] [PubMed] [Google Scholar] 42. Керриган Дж. Дж., Мэнселл Дж. П., Сэнди Дж. Р. Матрица оборачиваемости. J Orthod. 2000. 27: 227–33. [PubMed] [Google Scholar] 43. Браверман И.М., Фонферко Е. Исследования старения кожи: I. Сеть эластичных волокон. J Invest Dermatol. 1982; 78: 434–43.
Curr Eye Res.1998. 17: 247–50. [PubMed] [Google Scholar] 39. Wilmarth PA, et al. Возрастные изменения кристаллинов человека, определенные на основе сравнительного анализа посттрансляционных модификаций молодых и старых хрусталиков: вносит ли дезамидирование вклад в нерастворимость кристаллина? J Proteome Res. 2006; 5: 2554–66. [Бесплатная статья PMC] [PubMed] [Google Scholar] 40. Bloemendal H, et al. Старение и зрение: структура, стабильность и функция кристаллинов хрусталика. Prog Biophys Mol Biol. 2004. 86: 407–85. [PubMed] [Google Scholar] 41.Рой Д., Спектор А. Отсутствие низкомолекулярного альфа-кристаллина в ядерной области старых хрусталиков человека. Proc Natl Acad Sci U S. A. 1976; 73: 3484–7. [Бесплатная статья PMC] [PubMed] [Google Scholar] 42. Керриган Дж. Дж., Мэнселл Дж. П., Сэнди Дж. Р. Матрица оборачиваемости. J Orthod. 2000. 27: 227–33. [PubMed] [Google Scholar] 43. Браверман И.М., Фонферко Е. Исследования старения кожи: I. Сеть эластичных волокон. J Invest Dermatol. 1982; 78: 434–43.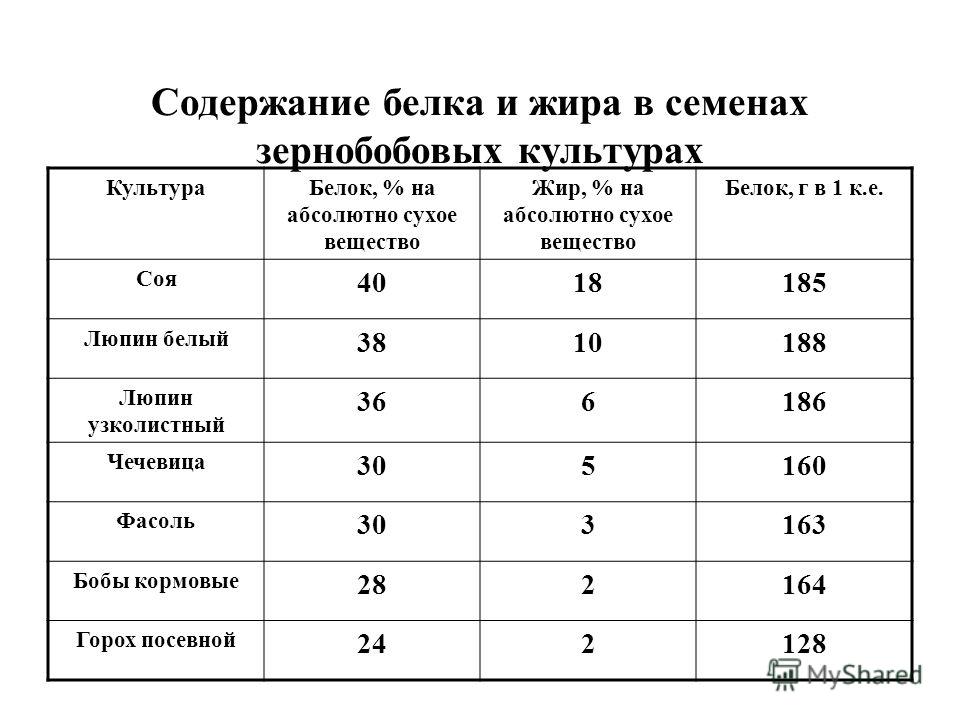 [PubMed] [Google Scholar] 44. Kragstrup TW, Kjaer M, Mackey AL. Структурные, биохимические, клеточные и функциональные изменения внеклеточного матрикса скелетных мышц с возрастом.Scand J Med Sci Sports. 2011; 21: 749–57. [PubMed] [Google Scholar] 45. Продам DR, Monnier VM. Молекулярные основы артериальной жесткости: роль гликирования — мини-обзор. Геронтология. 2012; 58: 227–37. [PubMed] [Google Scholar] 46. Фонк Э. и др. Влияние старения на функциональность эластина в артериях головного мозга человека. Гладить. 2009. 40: 2552–6. [PubMed] [Google Scholar] 47. Госселин Л.Е., Адамс К., Коттер Т.А., Маккормик Р.Дж., Томас Д.П. Влияние тренировок на пассивную жесткость опорно-двигательных скелетных мышц: роль внеклеточного матрикса.J Appl Physiol. 1998. 85: 1011–6. [PubMed] [Google Scholar] 48. Haus JM, Carrithers JA, Trappe SW, Trappe TA. Коллаген, сшивание и конечные продукты гликирования в стареющих скелетных мышцах человека. J Appl Physiol. 2007; 103: 2068–76. [PubMed] [Google Scholar] 49.
[PubMed] [Google Scholar] 44. Kragstrup TW, Kjaer M, Mackey AL. Структурные, биохимические, клеточные и функциональные изменения внеклеточного матрикса скелетных мышц с возрастом.Scand J Med Sci Sports. 2011; 21: 749–57. [PubMed] [Google Scholar] 45. Продам DR, Monnier VM. Молекулярные основы артериальной жесткости: роль гликирования — мини-обзор. Геронтология. 2012; 58: 227–37. [PubMed] [Google Scholar] 46. Фонк Э. и др. Влияние старения на функциональность эластина в артериях головного мозга человека. Гладить. 2009. 40: 2552–6. [PubMed] [Google Scholar] 47. Госселин Л.Е., Адамс К., Коттер Т.А., Маккормик Р.Дж., Томас Д.П. Влияние тренировок на пассивную жесткость опорно-двигательных скелетных мышц: роль внеклеточного матрикса.J Appl Physiol. 1998. 85: 1011–6. [PubMed] [Google Scholar] 48. Haus JM, Carrithers JA, Trappe SW, Trappe TA. Коллаген, сшивание и конечные продукты гликирования в стареющих скелетных мышцах человека. J Appl Physiol. 2007; 103: 2068–76. [PubMed] [Google Scholar] 49. Hoelz A, Debler EW, Blobel G. Структура ядерного порового комплекса. Анну Рев Биохим. 2011; 80: 613–43. [PubMed] [Google Scholar] 50. Кроншоу Дж. М., Крутчинский А. Н., Чжан В., Чайт Б. Т., Матунис М.Дж. Протеомный анализ комплекса ядерных пор млекопитающих.J Cell Biol. 2002; 158: 915–27. [Бесплатная статья PMC] [PubMed] [Google Scholar] 51. Hetzer MW, Wente SR. Пограничный контроль в ядре: биогенез и организация ядерной мембраны и поровых комплексов. Dev Cell. 2009; 17: 606–16. [Бесплатная статья PMC] [PubMed] [Google Scholar] 54. Гарсия-Сегура Л.М., Лафарга М., Берчиано М.Т., Эрнандес П., Андрес М.А. Распределение ядерных пор и организация хроматина в нейронах и глиальных клетках коры мозжечка крыс. J Comp Neurol. 1989; 290: 440–50. [PubMed] [Google Scholar] 56.Hallberg E, Wozniak RW, Blobel G. Интегральный мембранный белок порового мембранного домена ядерной оболочки содержит нуклеопорин-подобную область. J Cell Biol. 1993; 122: 513–21. [Бесплатная статья PMC] [PubMed] [Google Scholar] 57.
Hoelz A, Debler EW, Blobel G. Структура ядерного порового комплекса. Анну Рев Биохим. 2011; 80: 613–43. [PubMed] [Google Scholar] 50. Кроншоу Дж. М., Крутчинский А. Н., Чжан В., Чайт Б. Т., Матунис М.Дж. Протеомный анализ комплекса ядерных пор млекопитающих.J Cell Biol. 2002; 158: 915–27. [Бесплатная статья PMC] [PubMed] [Google Scholar] 51. Hetzer MW, Wente SR. Пограничный контроль в ядре: биогенез и организация ядерной мембраны и поровых комплексов. Dev Cell. 2009; 17: 606–16. [Бесплатная статья PMC] [PubMed] [Google Scholar] 54. Гарсия-Сегура Л.М., Лафарга М., Берчиано М.Т., Эрнандес П., Андрес М.А. Распределение ядерных пор и организация хроматина в нейронах и глиальных клетках коры мозжечка крыс. J Comp Neurol. 1989; 290: 440–50. [PubMed] [Google Scholar] 56.Hallberg E, Wozniak RW, Blobel G. Интегральный мембранный белок порового мембранного домена ядерной оболочки содержит нуклеопорин-подобную область. J Cell Biol. 1993; 122: 513–21. [Бесплатная статья PMC] [PubMed] [Google Scholar] 57.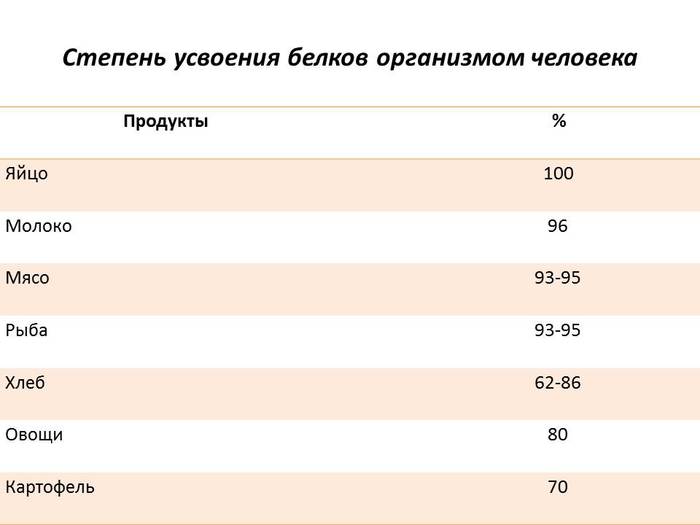 Greber UF, Senior A, Gerace L. Главный гликопротеин комплекса ядерных пор представляет собой трансмембранный полипептид с большим просветным доменом и маленьким цитоплазматическим хвостом. EMBO J. 1990; 9: 1495–502. [Бесплатная статья PMC] [PubMed] [Google Scholar] 58. Siniossoglou S, et al. Новый комплекс нуклеопоринов, который включает Sec13p и гомолог Sec13p, необходим для нормальных ядерных пор.Клетка. 1996. 84: 265–75. [PubMed] [Google Scholar] 59. Гранди П. и др. Nup93, позвоночный гомолог дрожжевого грибка Nic96p, образует комплекс с новым 205-кДа белком и необходим для правильной сборки ядерных пор. Mol Biol Cell. 1997; 8: 2017–38. [Бесплатная статья PMC] [PubMed] [Google Scholar] 60. Альбер Ф. и др. Молекулярная архитектура комплекса ядерных пор. Природа. 2007; 450: 695–701. [PubMed] [Google Scholar] 61. Hu T, Guan T, Gerace L. Молекулярная и функциональная характеристика комплекса p62, сборки гликопротеинов комплекса ядерных пор.J Cell Biol. 1996; 134: 589–601. [Бесплатная статья PMC] [PubMed] [Google Scholar] 62.
Greber UF, Senior A, Gerace L. Главный гликопротеин комплекса ядерных пор представляет собой трансмембранный полипептид с большим просветным доменом и маленьким цитоплазматическим хвостом. EMBO J. 1990; 9: 1495–502. [Бесплатная статья PMC] [PubMed] [Google Scholar] 58. Siniossoglou S, et al. Новый комплекс нуклеопоринов, который включает Sec13p и гомолог Sec13p, необходим для нормальных ядерных пор.Клетка. 1996. 84: 265–75. [PubMed] [Google Scholar] 59. Гранди П. и др. Nup93, позвоночный гомолог дрожжевого грибка Nic96p, образует комплекс с новым 205-кДа белком и необходим для правильной сборки ядерных пор. Mol Biol Cell. 1997; 8: 2017–38. [Бесплатная статья PMC] [PubMed] [Google Scholar] 60. Альбер Ф. и др. Молекулярная архитектура комплекса ядерных пор. Природа. 2007; 450: 695–701. [PubMed] [Google Scholar] 61. Hu T, Guan T, Gerace L. Молекулярная и функциональная характеристика комплекса p62, сборки гликопротеинов комплекса ядерных пор.J Cell Biol. 1996; 134: 589–601. [Бесплатная статья PMC] [PubMed] [Google Scholar] 62. Frey S, Richter RP, Gorlich D. Богатые FG повторы белков ядерных пор образуют трехмерную сеть с гидрогелеподобными свойствами. Наука. 2006; 314: 815–7. [PubMed] [Google Scholar] 63. Hulsmann BB, Labokha AA, Gorlich D. Проницаемость восстановленных ядерных пор является прямым доказательством селективной фазовой модели. Клетка. 2012; 150: 738–51. [PubMed] [Google Scholar] 64. Rabut G, Doye V, Ellenberg J. Картирование динамической организации комплекса ядерных пор внутри отдельных живых клеток.Nat Cell Biol. 2004; 6: 1114–21. [PubMed] [Google Scholar] 65. Woulfe JM. Аномалии ядра и ядерных включений при нейродегенеративном заболевании: работа в стадии разработки. Neuropathol Appl Neurobiol. 2007; 33: 2–42. [PubMed] [Google Scholar] 66. Ленарт П. и др. Разрушение ядерной оболочки в ооцитах морских звезд происходит путем частичной разборки NPC с последующей быстро распространяющейся фенестрацией ядерных мембран. J Cell Biol. 2003. 160: 1055–68. [Бесплатная статья PMC] [PubMed] [Google Scholar] 67.
Frey S, Richter RP, Gorlich D. Богатые FG повторы белков ядерных пор образуют трехмерную сеть с гидрогелеподобными свойствами. Наука. 2006; 314: 815–7. [PubMed] [Google Scholar] 63. Hulsmann BB, Labokha AA, Gorlich D. Проницаемость восстановленных ядерных пор является прямым доказательством селективной фазовой модели. Клетка. 2012; 150: 738–51. [PubMed] [Google Scholar] 64. Rabut G, Doye V, Ellenberg J. Картирование динамической организации комплекса ядерных пор внутри отдельных живых клеток.Nat Cell Biol. 2004; 6: 1114–21. [PubMed] [Google Scholar] 65. Woulfe JM. Аномалии ядра и ядерных включений при нейродегенеративном заболевании: работа в стадии разработки. Neuropathol Appl Neurobiol. 2007; 33: 2–42. [PubMed] [Google Scholar] 66. Ленарт П. и др. Разрушение ядерной оболочки в ооцитах морских звезд происходит путем частичной разборки NPC с последующей быстро распространяющейся фенестрацией ядерных мембран. J Cell Biol. 2003. 160: 1055–68. [Бесплатная статья PMC] [PubMed] [Google Scholar] 67. Берк Б., Элленберг Дж.Ремоделирование стенок ядра. Nat Rev Mol Cell Biol. 2002; 3: 487–97. [PubMed] [Google Scholar] 68. Андерсон DJ, Hetzer MW. Формирование эндоплазматической сети в ядерную оболочку. J Cell Sci. 2008; 121: 137–42. [PubMed] [Google Scholar] 69. Doucet CM, Talamas JA, Hetzer MW. Зависимые от клеточного цикла различия в сборке комплекса ядерных пор у многоклеточных. Клетка. 2010; 141: 1030–41. [Бесплатная статья PMC] [PubMed] [Google Scholar] 70. Spalding KL, Bhardwaj RD, Buchholz BA, Druid H, Frisen J. Ретроспективное датирование рождения клеток у людей.Клетка. 2005; 122: 133–43. [PubMed] [Google Scholar] 71. Дуре Л., Уотерс Л. Долгоживущий посланник РНК: свидетельства прорастания семян хлопка. Наука. 1965; 147: 410–2. [PubMed] [Google Scholar] 72. Форд П.Дж., Мэтисон Т., Росбаш М. Очень долгоживущие информационные РНК в яичниках Xenopus laevis. Dev Biol. 1977; 57: 417–26. [PubMed] [Google Scholar] 73. Дэвисон А.Н., Морган Р.С., Вайда М., Райт Г.П. Метаболизм липидов миелина: включение [3-14c] серина в липиды мозга развивающегося кролика и их сохранение в центральной нервной системе.
Берк Б., Элленберг Дж.Ремоделирование стенок ядра. Nat Rev Mol Cell Biol. 2002; 3: 487–97. [PubMed] [Google Scholar] 68. Андерсон DJ, Hetzer MW. Формирование эндоплазматической сети в ядерную оболочку. J Cell Sci. 2008; 121: 137–42. [PubMed] [Google Scholar] 69. Doucet CM, Talamas JA, Hetzer MW. Зависимые от клеточного цикла различия в сборке комплекса ядерных пор у многоклеточных. Клетка. 2010; 141: 1030–41. [Бесплатная статья PMC] [PubMed] [Google Scholar] 70. Spalding KL, Bhardwaj RD, Buchholz BA, Druid H, Frisen J. Ретроспективное датирование рождения клеток у людей.Клетка. 2005; 122: 133–43. [PubMed] [Google Scholar] 71. Дуре Л., Уотерс Л. Долгоживущий посланник РНК: свидетельства прорастания семян хлопка. Наука. 1965; 147: 410–2. [PubMed] [Google Scholar] 72. Форд П.Дж., Мэтисон Т., Росбаш М. Очень долгоживущие информационные РНК в яичниках Xenopus laevis. Dev Biol. 1977; 57: 417–26. [PubMed] [Google Scholar] 73. Дэвисон А.Н., Морган Р.С., Вайда М., Райт Г.П. Метаболизм липидов миелина: включение [3-14c] серина в липиды мозга развивающегося кролика и их сохранение в центральной нервной системе.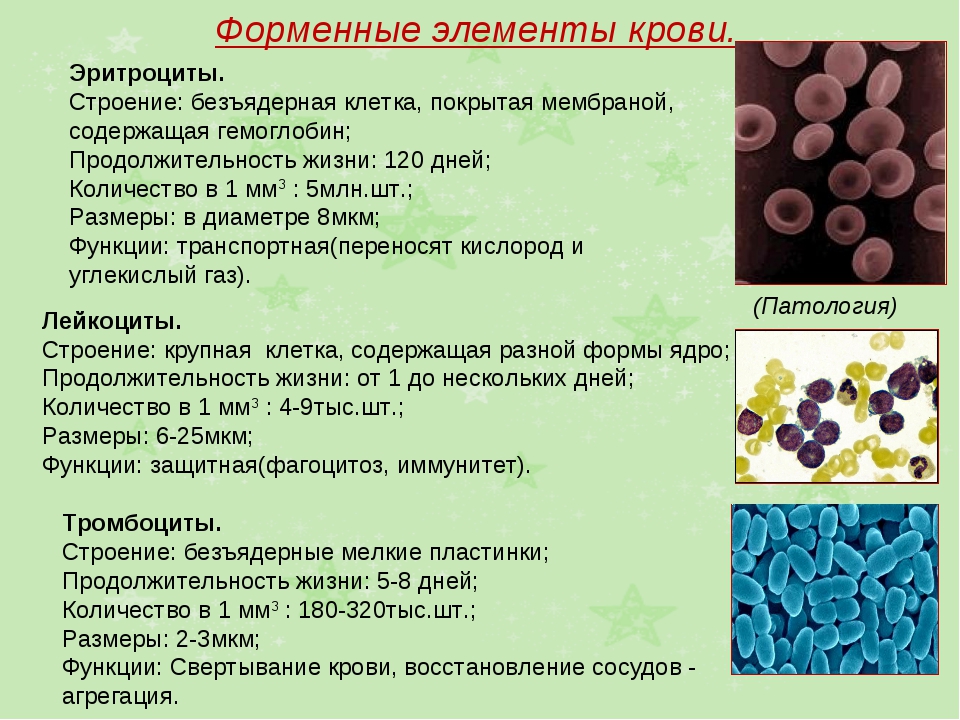 J Neurochem. 1959; 4: 360–365. [Google Scholar] 74. Дэвисон А.Н., Вайда М. Метаболизм липидов миелина: оценка и разделение липидов мозга у развивающегося кролика. J Neurochem. 1959; 4: 353–9. [PubMed] [Google Scholar] 77. Коммерфорд С.Л., Карстен А.Л., Кронкайт Е.П. Оборот гистонов в непролиферирующих клетках. Proc Natl Acad Sci U S. 1982, 79: 1163–5. [Бесплатная статья PMC] [PubMed] [Google Scholar] 78. Duerre JA, Lee CT. Метилирование и оборот гистонов головного мозга крысы in vivo. J Neurochem. 1974; 23: 541–7.[PubMed] [Google Scholar] 79. Park SK, Venable JD, Xu T, Yates JR., 3rd Программный инструмент количественного анализа для протеомики на основе масс-спектрометрии. Нат методы. 2008; 5: 319–22. [Бесплатная статья PMC] [PubMed] [Google Scholar] 81. Semba RD, Nicklett EJ, Ferrucci L. Способствует ли накопление конечных продуктов гликирования фенотипу старения? J Gerontol A Biol Sci Med Sci. 2010; 65: 963–75. [Бесплатная статья PMC] [PubMed] [Google Scholar] 82. Шлейхер Э.Д., Вагнер Э.
J Neurochem. 1959; 4: 360–365. [Google Scholar] 74. Дэвисон А.Н., Вайда М. Метаболизм липидов миелина: оценка и разделение липидов мозга у развивающегося кролика. J Neurochem. 1959; 4: 353–9. [PubMed] [Google Scholar] 77. Коммерфорд С.Л., Карстен А.Л., Кронкайт Е.П. Оборот гистонов в непролиферирующих клетках. Proc Natl Acad Sci U S. 1982, 79: 1163–5. [Бесплатная статья PMC] [PubMed] [Google Scholar] 78. Duerre JA, Lee CT. Метилирование и оборот гистонов головного мозга крысы in vivo. J Neurochem. 1974; 23: 541–7.[PubMed] [Google Scholar] 79. Park SK, Venable JD, Xu T, Yates JR., 3rd Программный инструмент количественного анализа для протеомики на основе масс-спектрометрии. Нат методы. 2008; 5: 319–22. [Бесплатная статья PMC] [PubMed] [Google Scholar] 81. Semba RD, Nicklett EJ, Ferrucci L. Способствует ли накопление конечных продуктов гликирования фенотипу старения? J Gerontol A Biol Sci Med Sci. 2010; 65: 963–75. [Бесплатная статья PMC] [PubMed] [Google Scholar] 82. Шлейхер Э.Д., Вагнер Э.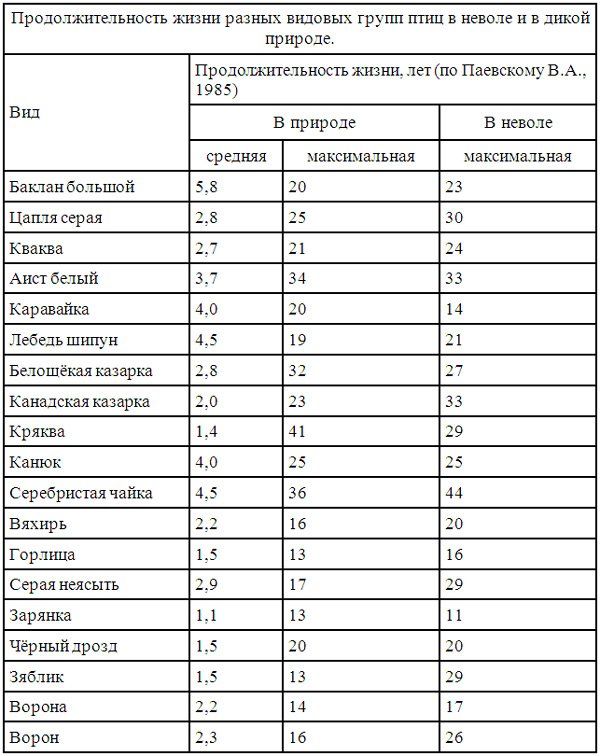 , Нерлих АГ. Повышенное накопление продукта гликоксидирования N (эпсилон) — (карбоксиметил) лизина в тканях человека при диабете и старении.J Clin Invest. 1997. 99: 457–68. [Бесплатная статья PMC] [PubMed] [Google Scholar] 83. Лян Дж. Н., Пеллетье MR. Дестабилизация конформации белков хрусталика смешанным дисульфидом глутатиона. Exp Eye Res. 1988; 47: 17–25. [PubMed] [Google Scholar] 84. Spector A, Roy D. Связанный с дисульфидом высокомолекулярный белок, связанный с катарактой человека. Proc Natl Acad Sci U S. A. 1978; 75: 3244–8. [Бесплатная статья PMC] [PubMed] [Google Scholar] 85. Miesbauer LR, et al. Посттрансляционные модификации водорастворимых кристаллинов хрусталика человека молодых людей.J Biol Chem. 1994; 269: 12494–502. [PubMed] [Google Scholar] 86. Лунд А. Л., Смит Дж. Б., Смит Д. Л.. Модификации нерастворимых в воде альфа-кристаллов хрусталика человека. Exp Eye Res. 1996; 63: 661–72. [PubMed] [Google Scholar] 87. Моримото Р.И. Реакция теплового шока: системная биология протеотоксического стресса при старении и болезнях.
, Нерлих АГ. Повышенное накопление продукта гликоксидирования N (эпсилон) — (карбоксиметил) лизина в тканях человека при диабете и старении.J Clin Invest. 1997. 99: 457–68. [Бесплатная статья PMC] [PubMed] [Google Scholar] 83. Лян Дж. Н., Пеллетье MR. Дестабилизация конформации белков хрусталика смешанным дисульфидом глутатиона. Exp Eye Res. 1988; 47: 17–25. [PubMed] [Google Scholar] 84. Spector A, Roy D. Связанный с дисульфидом высокомолекулярный белок, связанный с катарактой человека. Proc Natl Acad Sci U S. A. 1978; 75: 3244–8. [Бесплатная статья PMC] [PubMed] [Google Scholar] 85. Miesbauer LR, et al. Посттрансляционные модификации водорастворимых кристаллинов хрусталика человека молодых людей.J Biol Chem. 1994; 269: 12494–502. [PubMed] [Google Scholar] 86. Лунд А. Л., Смит Дж. Б., Смит Д. Л.. Модификации нерастворимых в воде альфа-кристаллов хрусталика человека. Exp Eye Res. 1996; 63: 661–72. [PubMed] [Google Scholar] 87. Моримото Р.И. Реакция теплового шока: системная биология протеотоксического стресса при старении и болезнях. Колд Спринг Харб Symp Quant Biol. 2011; 76: 91–9. [PubMed] [Google Scholar] 88. Моллер IM, Rogowska-Wrzesinska A, Rao RS. Карбонилирование белков и катализируемое металлами окисление белков в клеточной перспективе.J Proteomics. 2011; 74: 2228–42. [PubMed] [Google Scholar]
Колд Спринг Харб Symp Quant Biol. 2011; 76: 91–9. [PubMed] [Google Scholar] 88. Моллер IM, Rogowska-Wrzesinska A, Rao RS. Карбонилирование белков и катализируемое металлами окисление белков в клеточной перспективе.J Proteomics. 2011; 74: 2228–42. [PubMed] [Google Scholar]Белковый гомеостаз: живи долго, не процветай
Nat Rev Mol Cell Biol. Авторская рукопись; доступно в PMC 1 июля 2013 г.
Опубликован в окончательной отредактированной форме как:
PMCID: PMC3570024
NIHMSID: NIHMS439038
Институт биологических исследований, лаборатория молекулярной и клеточной биологии им. Солка, 10010 N. Torrey Pines Road, La Jolla, CA
USA
См. Другие статьи в PMC, в которых цитируется опубликованная статья.Abstract
Белковый оборот является эффективным способом поддержания функционального протеома, поскольку старые и потенциально поврежденные полипептиды разрушаются и заменяются вновь синтезированными копиями. Однако было идентифицировано все большее количество внутриклеточных белков, которые уклоняются от этого процесса обновления и вместо этого сохраняются на протяжении всей жизни клетки. Эта разнообразная группа долгоживущих белков может быть особенно склонна к накоплению повреждений и, таким образом, играет критическую роль в функциональном ухудшении ключевых регуляторных процессов во время старения.
Эта разнообразная группа долгоживущих белков может быть особенно склонна к накоплению повреждений и, таким образом, играет критическую роль в функциональном ухудшении ключевых регуляторных процессов во время старения.
Старение — это универсальное явление, которое бросает вызов всем биологическим системам на нескольких уровнях и в конечном итоге приводит к их функциональному снижению. Зависимые от возраста изменения можно наблюдать у широкого круга организмов, от снижения репликативного потенциала, наблюдаемого у одноклеточных дрожжей 1 , до снижения производительности жизненно важных органов у более сложных организмов, таких как человек. Скорость старения клеток и организмов широко варьируется, и было показано, что генетические факторы и факторы окружающей среды участвуют в возрастном снижении функции клеток и тканей.Хотя старение — сложное явление, становится ясно, что неспособность клетки поддерживать надлежащий белковый гомеостаз играет важную роль в старении и возрастных заболеваниях 2 . Постоянный обмен белка — одна из основных стратегий, используемых для поддержания этого гомеостаза, и ей уделялось большое внимание. Недавние исследования старения сделали новый акцент на буквально старых виновниках: долгоживущих белках, которые уклоняются от оборота 3, 4 . В этой статье мы обсуждаем различные контексты, в которых были охарактеризованы долгоживущие белки, и возможные функциональные последствия их персистенции.Мы утверждаем, что эти долгоживущие белки играют большую роль в старении организма, чем считалось ранее.
Постоянный обмен белка — одна из основных стратегий, используемых для поддержания этого гомеостаза, и ей уделялось большое внимание. Недавние исследования старения сделали новый акцент на буквально старых виновниках: долгоживущих белках, которые уклоняются от оборота 3, 4 . В этой статье мы обсуждаем различные контексты, в которых были охарактеризованы долгоживущие белки, и возможные функциональные последствия их персистенции.Мы утверждаем, что эти долгоживущие белки играют большую роль в старении организма, чем считалось ранее.
Исключения из правила
Белки постоянно разлагаются и впоследствии заменяются вновь синтезированными копиями. Этот процесс обновления обеспечивает постоянную поставку новых и функциональных белков, позволяя уничтожить нефункциональные, поврежденные или даже токсичные виды. Скорость обновления, однако, может широко варьироваться от белка к белку, с периодом полураспада в пределах одной и той же клетки.Исследования на почкующихся дрожжах (~ 1,5 часа клеточного цикла) показали, что средний и средний период полураспада белка при нормальных условиях роста составляет ~ 43 минуты 5 . Эта цифра увеличивается до 0,5–35 часов в делящихся клетках млекопитающих (~ 24 часа клеточного цикла) и ~ 43 часов в неделящихся клетках 6, 7 . Исследования оборота на мышах (продолжительность жизни ~ 1,5 года) показали, что средний период полураспада белков в головном мозге, печени и крови составляет от 3 до 9 дней 8 . Хотя период полураспада различных белков в клетке может варьироваться от минут до дней, скорость оборота белков часто коррелирует с их функцией или субклеточной локализацией.Например, белки в митохондриях и эндоплазматическом ретикулуме в среднем имеют более длительный период полураспада, чем другие белки 8 . Большие комплексы, такие как рибосомы и протеасомы, также имеют очень похожие скорости оборота для каждого из своих компонентов 6, 8 .
Эта цифра увеличивается до 0,5–35 часов в делящихся клетках млекопитающих (~ 24 часа клеточного цикла) и ~ 43 часов в неделящихся клетках 6, 7 . Исследования оборота на мышах (продолжительность жизни ~ 1,5 года) показали, что средний период полураспада белков в головном мозге, печени и крови составляет от 3 до 9 дней 8 . Хотя период полураспада различных белков в клетке может варьироваться от минут до дней, скорость оборота белков часто коррелирует с их функцией или субклеточной локализацией.Например, белки в митохондриях и эндоплазматическом ретикулуме в среднем имеют более длительный период полураспада, чем другие белки 8 . Большие комплексы, такие как рибосомы и протеасомы, также имеют очень похожие скорости оборота для каждого из своих компонентов 6, 8 .
Из всех исследований белкового обмена на сегодняшний день большинство сосредоточено на обмене в течение относительно коротких периодов времени (то есть значительно короче, чем продолжительность жизни в клетках и организме), поэтому осталось мало исследований, посвященных белкам с длительным периодом полураспада. Хотя долгоживущим белкам в последнее время уделяется больше внимания, существование долгоживущих белков было хорошо установленным фактом в течение нескольких десятилетий. Еще в 1966 году радиоизотопное импульсное мечение (вставка 1) использовалось для идентификации гистонов с длительным периодом полураспада 9 . Более поздние исследования 1970-х годов также использовали радиоизотопы для идентификации миелина и миелиновых протеолипидных белков как долгоживущих 10, 11 . Также в 1970-х годах альтернативный метод, рацемизация L-D-аспарагиновой кислоты (вставка 1), был использован для мониторинга белкового обмена, выявления нескольких коллагенов, эластина, кристаллинов хрусталика глаза, зубной эмали и зубного дентина, у которых период полураспада порядок лет () 12–17 .
Хотя долгоживущим белкам в последнее время уделяется больше внимания, существование долгоживущих белков было хорошо установленным фактом в течение нескольких десятилетий. Еще в 1966 году радиоизотопное импульсное мечение (вставка 1) использовалось для идентификации гистонов с длительным периодом полураспада 9 . Более поздние исследования 1970-х годов также использовали радиоизотопы для идентификации миелина и миелиновых протеолипидных белков как долгоживущих 10, 11 . Также в 1970-х годах альтернативный метод, рацемизация L-D-аспарагиновой кислоты (вставка 1), был использован для мониторинга белкового обмена, выявления нескольких коллагенов, эластина, кристаллинов хрусталика глаза, зубной эмали и зубного дентина, у которых период полураспада порядок лет () 12–17 .
Box 1
Методы идентификации долгоживущих белков
L / D рацемизация аспарагиновой кислоты. Все живые организмы включают исключительно L-энантиомеры аминокислот в свои белки. Однако в процессе, который зависит от времени и температуры, эти аминокислоты очень медленно рацемизируются до смеси L- и D-энантиомеров. Следовательно, при тщательной калибровке соотношения содержания L- и D-энантиомеров могут определить возраст белка. Хотя низкая скорость рацемизации больше подходит для определения возраста белков, которым тысячи лет, рацемизация аспарагиновой кислоты является самой быстрой среди аминокислот и использовалась для определения периода полужизни особенно долгоживущих белков 12 , 13, 15–17 .Радиоизотопная импульсная маркировка. Включение и последующее сохранение радиоизотопов можно использовать для идентификации долгоживущих белков. В данном случае радиоактивный предшественник, часто лейцин для белков, вводится в ткань животного, представляющего интерес, или добавляется в среду в культуре клеток. Введенных животных умерщвляют или собирают клетки в различные моменты времени, экстрагируют или иммунопреципитируют специфические белки и измеряют радиоактивность.
Однако в процессе, который зависит от времени и температуры, эти аминокислоты очень медленно рацемизируются до смеси L- и D-энантиомеров. Следовательно, при тщательной калибровке соотношения содержания L- и D-энантиомеров могут определить возраст белка. Хотя низкая скорость рацемизации больше подходит для определения возраста белков, которым тысячи лет, рацемизация аспарагиновой кислоты является самой быстрой среди аминокислот и использовалась для определения периода полужизни особенно долгоживущих белков 12 , 13, 15–17 .Радиоизотопная импульсная маркировка. Включение и последующее сохранение радиоизотопов можно использовать для идентификации долгоживущих белков. В данном случае радиоактивный предшественник, часто лейцин для белков, вводится в ткань животного, представляющего интерес, или добавляется в среду в культуре клеток. Введенных животных умерщвляют или собирают клетки в различные моменты времени, экстрагируют или иммунопреципитируют специфические белки и измеряют радиоактивность. Устойчивая радиоактивность указывает на стабильный или долгоживущий белок, и путем многократных измерений после инъекции можно определить период полураспада интересующего белка 3, 9–11, 18, 72–74, 77, 78 .
Устойчивая радиоактивность указывает на стабильный или долгоживущий белок, и путем многократных измерений после инъекции можно определить период полураспада интересующего белка 3, 9–11, 18, 72–74, 77, 78 .
Масс-спектрометрия с отслеживанием импульсов стабильных изотопов. Включение и последующее сохранение стабильного изотопа 15N также можно использовать для идентификации долгоживущих белков. Здесь 2 поколения крыс получают диету, в которой единственным источником азота являются водоросли 15N, в результате получается животное с однородной меткой 15N 19 . Затем диету переключают на нормальную диету 14N на период погони, и животных умерщвляют в соответствующие моменты времени 4 . Затем ткани можно собирать и переваривать с последующим проведением рассеянного склероза.MS не только идентифицирует каждый детектируемый белок, но также может определять относительные отношения версий 15N к их эквивалентам 14N 79 . Любые идентифицированные белки со значительным 15N после длительного периода погони будут считаться долгоживущими.
Таблица 1
Известные долгоживущие белки и молекулы. Перечислены все известные долгоживущие белки или молекулы. Период полураспада указывается после определения. В противном случае указанный возраст — это возраст, по крайней мере, для части молекулы (время жизни).Методы, используемые для определения продолжительности жизни, включают: рацемизацию L / D-аспарагиновой кислоты (L / D Race), импульсное мечение радиоизотопов (RI-PL) и импульсное / последовательное мечение стабильных изотопов, анализируемое с помощью МС (SI-PC-MS).
| Молекула | Возраст | Измерение | Организм | Метод | Ссылка |
|---|---|---|---|---|---|
| Кристаллин хрусталика глаза | > 70 лет | Продолжительность жизни | Человек | L / D Race | 15 |
| Коллаген | 117 лет | Halflife | Человек | L / D Race | 12 |
| Эластин | > 78 лет | Срок службы | Человек | L / D Раса | 14 |
| Эмаль / дентин | > 70 лет | Срок службы | Человек | L / D Race | 16, 17 |
| Histones | 223 дня | Halflife | Mouse | RI-PL | 77 |
| 117 дней | Halflife | Mouse | RI-PL | 9 | |
| 218 дней | Halflife | Крыса | RI-PL | 78 | |
| Ядерные поровые белки | > 1 месяц | Срок службы | Черви | RI-PL | 3 |
| > 1 год | Срок службы | Крыса | SI-PC-MS | 4 | |
| Миелин | 95 дней | Halflife | Крыса | RI-PL | 11 |
| > 100 дней | Halflife | Mouse | RI-PL | 10 | |
| Миелиновый протеолипидный белок | > 100 дней | Halflife | Мышь | RI-PL | 10 |
| Сплоченность Rec8 | > недель | Срок службы | Мышь | RI-PL | 18 |
| мРНК | неопределенный? | Срок службы | Семена растений | Н / Д | 71 |
| > 2 года | Halflife | Ооциты лягушки | RI-PL | 72 | |
| Холестерин | > 18 месяцев | Срок службы | Кролик | RI-PL | 74 |
| Фосфолипиды | > 192 дней | Продолжительность жизни | Кролик | RI-PL | 73 |
Последние достижения в области импульсного мечения предоставляют убедительные доказательства того, что еще предстоит открыть более долгоживущие белки . В двух недавних исследованиях было обнаружено, что белки комплексов ядерных пор (NPC) и главный компонент когезинового комплекса ДНК были долгоживущими 3,18 . В то время как предыдущие исследования, которые идентифицировали эти долгоживущие белки, обязательно основывались на априорном знании того, что они действительно могут быть долгоживущими, недавние достижения в области масс-спектрометрии (МС) с высоким разрешением в сочетании со стабильным изотопным методом отслеживания импульсов целых животных (вставка 1 ) 19 , позволил объективно идентифицировать долгоживущие белки.Эти исследования подтвердили долговечность белков миелина и гистонов и увеличили известную продолжительность жизни белков NPC до более чем 1 года 4 . Удивительный вывод всех этих исследований состоит в том, что небольшая, но важная часть клеточного протеома так же стара, как клетки-хозяева, и они могут играть важную роль в возрастном функциональном снижении соответствующих тканей.
В двух недавних исследованиях было обнаружено, что белки комплексов ядерных пор (NPC) и главный компонент когезинового комплекса ДНК были долгоживущими 3,18 . В то время как предыдущие исследования, которые идентифицировали эти долгоживущие белки, обязательно основывались на априорном знании того, что они действительно могут быть долгоживущими, недавние достижения в области масс-спектрометрии (МС) с высоким разрешением в сочетании со стабильным изотопным методом отслеживания импульсов целых животных (вставка 1 ) 19 , позволил объективно идентифицировать долгоживущие белки.Эти исследования подтвердили долговечность белков миелина и гистонов и увеличили известную продолжительность жизни белков NPC до более чем 1 года 4 . Удивительный вывод всех этих исследований состоит в том, что небольшая, но важная часть клеточного протеома так же стара, как клетки-хозяева, и они могут играть важную роль в возрастном функциональном снижении соответствующих тканей.
Долгоживущие белки и старение
Чтобы проиллюстрировать, как недостаток обмена белков может способствовать процессу старения, мы будем использовать аналогию с современным автомобилем. Автомобили, на которых мы сегодня ездим, представляют собой сложные машины, состоящие из множества компонентов. Части автомобиля, находящиеся в постоянной эксплуатации, со временем изнашиваются. Часто это не проблема, так как такие детали, как шины и фильтры, заменяются, что продлевает срок службы машины. Однако двигатель и шасси большие и дорогие, и обычно не подлежат замене в течение всего срока службы автомобиля. Они являются долговечными компонентами, и, поскольку они теряют свою функцию, то же самое происходит и с автомобилем.
Автомобили, на которых мы сегодня ездим, представляют собой сложные машины, состоящие из множества компонентов. Части автомобиля, находящиеся в постоянной эксплуатации, со временем изнашиваются. Часто это не проблема, так как такие детали, как шины и фильтры, заменяются, что продлевает срок службы машины. Однако двигатель и шасси большие и дорогие, и обычно не подлежат замене в течение всего срока службы автомобиля. Они являются долговечными компонентами, и, поскольку они теряют свою функцию, то же самое происходит и с автомобилем.
Хотя биологические системы, такие как клетки, не являются механическими устройствами, а работают на принципах статистической термодинамики, идея непрерывной замены отдельных частей для поддержания всей системы может быть применена.Мы уже упоминали процесс оборота белка, в котором полипептиды постоянно разрушаются и заменяются вновь синтезированными копиями, устраняя повреждения или токсичные виды белков. Однако, если белок не может быть перевернут, его персистенция может привести к повреждению, которое нелегко восстановить, что, в свою очередь, может отрицательно повлиять на функцию клеток (.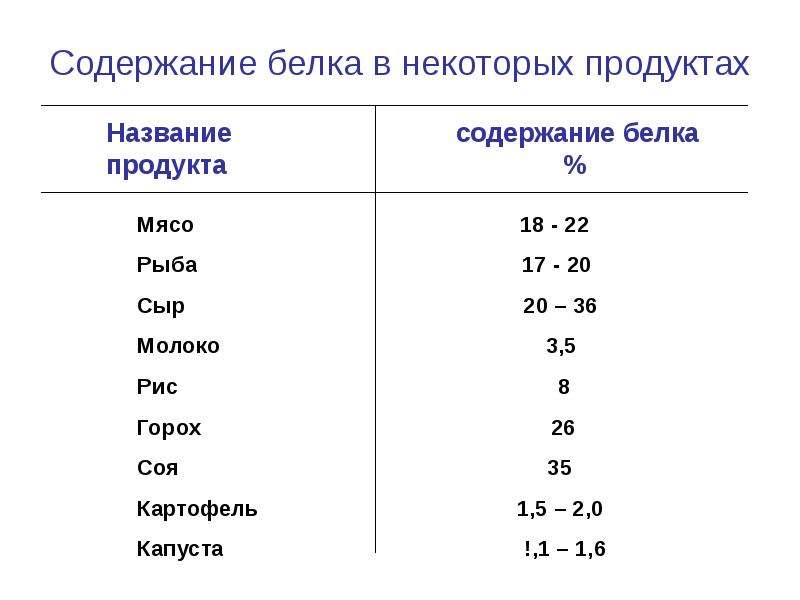 ). Чтобы проиллюстрировать потенциальное влияние долгой жизни на функцию белков, мы сначала обсудим кристаллин, хорошо изученный долгоживущий белок, который ограничен клетками хрусталика глаза и испытывает хорошо описанные возрастные изменения и модификации, но имеет физиологические последствия. которые изолированы от хрусталика глаза, и белки внеклеточного матрикса (ЕСМ) коллаген и эластин.Во-вторых, мы обсудим NPC, мультибелковую сборку, содержащую долгоживущие компоненты, которые не только имеют структурную природу, но также играют активную роль в переносе молекул в ядра и из всех ядер. Это всего лишь несколько примеров долгоживущих белков с важными функциями; поскольку эти долгоживущие белки стареют, их функции снижаются, что может играть важную роль в старении соответствующих клеток и тканей.
). Чтобы проиллюстрировать потенциальное влияние долгой жизни на функцию белков, мы сначала обсудим кристаллин, хорошо изученный долгоживущий белок, который ограничен клетками хрусталика глаза и испытывает хорошо описанные возрастные изменения и модификации, но имеет физиологические последствия. которые изолированы от хрусталика глаза, и белки внеклеточного матрикса (ЕСМ) коллаген и эластин.Во-вторых, мы обсудим NPC, мультибелковую сборку, содержащую долгоживущие компоненты, которые не только имеют структурную природу, но также играют активную роль в переносе молекул в ядра и из всех ядер. Это всего лишь несколько примеров долгоживущих белков с важными функциями; поскольку эти долгоживущие белки стареют, их функции снижаются, что может играть важную роль в старении соответствующих клеток и тканей.
Долгоживущие белки и накопление повреждений.Большинство белков участвуют в постоянном цикле синтеза и распада. Однако некоторые белки ускользают от деградации и являются долгоживущими. Из-за своей долговечности эти долгоживущие белки более склонны к накоплению повреждений, которые могут привести к нарушению функции белков и старению клеток.
Из-за своей долговечности эти долгоживущие белки более склонны к накоплению повреждений, которые могут привести к нарушению функции белков и старению клеток.
Кристаллин и структура хрусталика
Кристаллины из хрусталика глаза были одними из первых обнаруженных долгоживущих белков и представляют, пожалуй, наиболее полную картину на сегодняшний день, связывая продолжительность жизни белков и неблагоприятные последствия 15 .Белки кристаллина, которые выражаются в трех различных изоформах (альфа, бета и гамма), составляют более 90% от общего содержания белка в клетках волокон хрусталика глаза и более 35% их сырого веса 20, 21 . Их долголетие обусловлено уникальной программой развития, которую проходят клетки волокон хрусталика во время эмбриогенеза и взрослой жизни. Основная часть линзы состоит из неделящихся волоконных клеток хрусталика, которые меняются с возрастом, причем самые старые волокнистые клетки находятся в центральном «ядре», а клетки уменьшающегося возраста с каждым слоем наружу () 22 . Самый внешний слой состоит из реплицирующейся популяции клеток, которая дает начало клеткам нижележащих волокон. После дифференцировки в неделящиеся волоконно-линзовые клетки их органеллы, включая ядро, все разрушаются посредством регулируемых процессов, которые используют протеазы и нуклеазы, оставляя после себя заключенные в мембраны мешки с белком кристаллина 23 . Эта эвакуация органелл необходима для обеспечения прозрачности хрусталика, поскольку органеллы рассеивают свет, а упорядоченные белки (кристаллины) — нет. 24 .Этот процесс дифференциации происходит на протяжении всей взрослой жизни, производя кольца из новых волоконных клеток, аналогичные кольцам дерева. Поскольку клеточные волокна не имеют органелл, синтез белка минимален или отсутствует, как и деградация белка, в результате чего возникают белки-кристаллины и, возможно, другие, которые синтезируются при рождении клетки и сохраняются на протяжении всей жизни организма.
Самый внешний слой состоит из реплицирующейся популяции клеток, которая дает начало клеткам нижележащих волокон. После дифференцировки в неделящиеся волоконно-линзовые клетки их органеллы, включая ядро, все разрушаются посредством регулируемых процессов, которые используют протеазы и нуклеазы, оставляя после себя заключенные в мембраны мешки с белком кристаллина 23 . Эта эвакуация органелл необходима для обеспечения прозрачности хрусталика, поскольку органеллы рассеивают свет, а упорядоченные белки (кристаллины) — нет. 24 .Этот процесс дифференциации происходит на протяжении всей взрослой жизни, производя кольца из новых волоконных клеток, аналогичные кольцам дерева. Поскольку клеточные волокна не имеют органелл, синтез белка минимален или отсутствует, как и деградация белка, в результате чего возникают белки-кристаллины и, возможно, другие, которые синтезируются при рождении клетки и сохраняются на протяжении всей жизни организма.
Структура хрусталика глаза. а) Положение хрусталика показано в поперечном сечении глаза, а также общая организация структуры хрусталика (вставка).Хрусталик глаза растет в радиальном направлении, причем более старые клетки волокон хрусталика располагаются в центре, а более молодые клетки — на внешних кольцах. б) Клетки хрусталика в результате старения. По мере старения хрусталика глаза долгоживущие молекулы кристаллина накапливают повреждения, что приводит к их агрегации в более крупные упорядоченные структуры, что нарушает их свойства прозрачности.
а) Положение хрусталика показано в поперечном сечении глаза, а также общая организация структуры хрусталика (вставка).Хрусталик глаза растет в радиальном направлении, причем более старые клетки волокон хрусталика располагаются в центре, а более молодые клетки — на внешних кольцах. б) Клетки хрусталика в результате старения. По мере старения хрусталика глаза долгоживущие молекулы кристаллина накапливают повреждения, что приводит к их агрегации в более крупные упорядоченные структуры, что нарушает их свойства прозрачности.
Поскольку волокна хрусталика не обладают способностью поддерживать гомеостаз белков посредством белкового обмена, должны быть задействованы другие механизмы, помогающие сохранить правильное свернутое состояние кристаллинов.Во-первых, альфа-кристаллин действует как молекулярный шаперон, связывая и поддерживая свернутое состояние бета- и гамма-кристаллинов, 25, 26 , отсутствие или мутации которых ускоряют агрегацию белков хрусталика 26, 27 .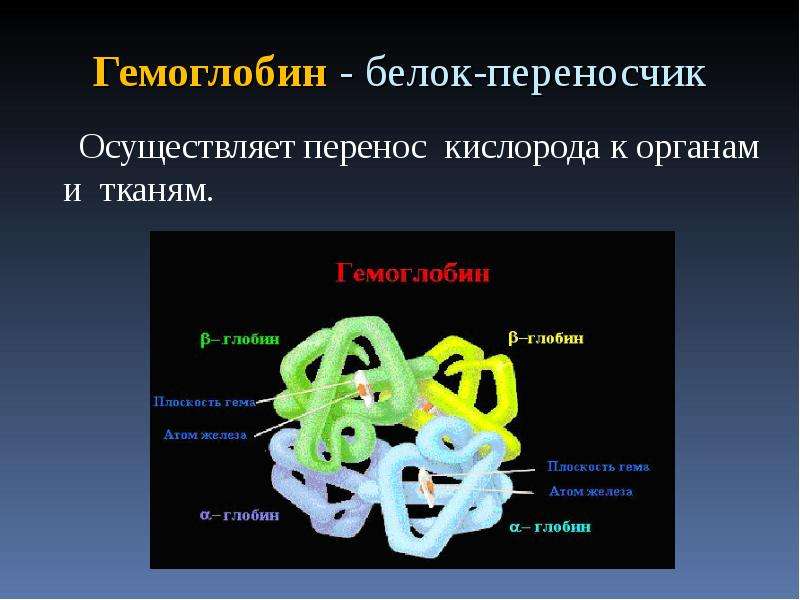 Второй механизм — использование поглотителей активных форм кислорода в клетках волокна. Соединения, такие как восстановленный глутатион (GSH), циркулируют из внешнего эпителия хрусталика по всему внутреннему пространству хрусталика, очищая кислородные радикалы и другие окисляющие соединения от волоконных клеток 28, 29 .Эти системы помогают предотвратить неправильную укладку, агрегацию и накопление повреждений на долгоживущих кристаллинах. Тем не менее, их активность снижается с повреждением и возрастом 30–33 .
Второй механизм — использование поглотителей активных форм кислорода в клетках волокна. Соединения, такие как восстановленный глутатион (GSH), циркулируют из внешнего эпителия хрусталика по всему внутреннему пространству хрусталика, очищая кислородные радикалы и другие окисляющие соединения от волоконных клеток 28, 29 .Эти системы помогают предотвратить неправильную укладку, агрегацию и накопление повреждений на долгоживущих кристаллинах. Тем не менее, их активность снижается с повреждением и возрастом 30–33 .
Эти механизмы контроля качества белков-кристаллинов ограничены и со временем не могут удовлетворить потребности протеома хрусталиковых клеток, подвергающегося все более стрессовой нагрузке. Кристаллины линз должны выдерживать уникальные нагрузки, такие как ультрафиолетовое излучение, а также обычные, такие как окислительные стрессы. Эти инсульты приводят к нескольким модификациям белков хрусталика, включая дезамидирование, гликирование, смешанные дисульфиды и усечение 34–39 (Box 2). В ответ на повреждение, белки-кристаллины разворачиваются и начинают агрегировать в частицы с большой молекулярной массой 40, 41 . Эти большие агрегаты менее прозрачны, чем природно свернутый белок, что приводит к непрозрачным линзам и ухудшению зрения, также известному как катаракта (.). Хотя механизмы биологического восстановления исчерпаны, современная медицина изобрела способ возродить эти стареющие линзы с помощью хирургической операции по замене линз катаракты. Однако другие долгоживущие белки могут не иметь столь элегантного решения.
В ответ на повреждение, белки-кристаллины разворачиваются и начинают агрегировать в частицы с большой молекулярной массой 40, 41 . Эти большие агрегаты менее прозрачны, чем природно свернутый белок, что приводит к непрозрачным линзам и ухудшению зрения, также известному как катаракта (.). Хотя механизмы биологического восстановления исчерпаны, современная медицина изобрела способ возродить эти стареющие линзы с помощью хирургической операции по замене линз катаракты. Однако другие долгоживущие белки могут не иметь столь элегантного решения.
Box 2
Повреждение белка
Белки могут накапливать различные формы повреждений и модификаций, их слишком много, чтобы перечислять их здесь. Ниже приведены основные формы повреждений, упомянутых в этом обзоре.
Деамидирование: Деамидирование — неферментативная потеря амидных групп в боковых цепях остатков аспарагина и глутамина. Этот процесс зависит от контекста, модулируется окружающими аминокислотами, а также структурой и приводит к отрицательному заряду в боковой цепи, который может влиять на степень гидролиза белков 80 . Продукты с улучшенным окончанием гликирования (AGE): AGE представляет собой разнообразную группу модификаций, представляющих собой конъюгацию углеводов или углеводных фрагментов с белками. Эта модификация может привести к сшиванию различных пептидов, включая глиоксаль, метилглиоксаль и карбоксиметил-лизин среди многих других. 81 . Уровни AGE могут быть увеличены в старых тканях, таких как пожилой миокард 82 .
Продукты с улучшенным окончанием гликирования (AGE): AGE представляет собой разнообразную группу модификаций, представляющих собой конъюгацию углеводов или углеводных фрагментов с белками. Эта модификация может привести к сшиванию различных пептидов, включая глиоксаль, метилглиоксаль и карбоксиметил-лизин среди многих других. 81 . Уровни AGE могут быть увеличены в старых тканях, таких как пожилой миокард 82 .
Смешанные дисульфиды: по мере увеличения нагрузки окислительного стресса могут возникать аберрантные дисульфидные поперечные связи между белковыми цистеинами и GSH или с другими цистеинами, образующими внутри- или межмолекулярные поперечные связи. 83, 84 .Эти сшивки могут приводить к образованию крупных белков, часто встречающихся в агрегатах 84 .
Усечение: белки могут подвергаться усечению, когда аминокислоты теряются с нор С-концов 85 или расщепляются по внутренним остаткам 86 . Усечение может быть причиной или продуктами других типов повреждений.
Агрегация белков: Агрегация белков — это образование ненативных высокомолекулярных структур. Эти агрегаты обычно выводят из строя агрегированный белок и могут быть результатом других модификаций, таких как дезамидирование, гликирование и смешанные дисульфиды.Агрегаты также являются признаком ряда нейродегенеративных заболеваний, таких как болезни Хантингтона и Альцгеймера 87 .
Карбонилирование: одна из наиболее изученных модификаций окислительного повреждения, карбонилирование — это необратимое присоединение карбонильной группы, обычно к остаткам лизина, аргенина или пролина. Эта модификация окисления, катализируемого металлами (MCO), является результатом образования активных форм кислорода (ROS) внутри клетки 88 .
Коллаген и эластин
Исследования долговечности коллагена и эластина следовали той же траектории, что и кристаллины хрусталика, и аналогично неактивной среде клеток волокон хрусталика, коллагены и эластин обычно находятся во внеклеточных областях, которые изолированы от клеточных. среда.Коллагены и эластины представляют собой агрегаты белков, которые синтезируются клеткой в качестве пре-протеинов, а затем расщепляются и секретируются в ЕСМ, где они сшиваются и образуют структуры более высокого порядка. Несмотря на то, что он оснащен надежной сетью протеаз, используемых для ремоделирования ECM, ECM не находится под постоянным потоком белкового обмена, которому внутриклеточные белки подвергаются 42 .
среда.Коллагены и эластины представляют собой агрегаты белков, которые синтезируются клеткой в качестве пре-протеинов, а затем расщепляются и секретируются в ЕСМ, где они сшиваются и образуют структуры более высокого порядка. Несмотря на то, что он оснащен надежной сетью протеаз, используемых для ремоделирования ECM, ECM не находится под постоянным потоком белкового обмена, которому внутриклеточные белки подвергаются 42 .
Подобно кристаллинам хрусталика, коллаген и эластин также особенно подвержены повреждению, предположительно из-за их долговечности.Эти химические модификации включают гликирование, сшивание и фрагментацию их больших белковых структур 13, 43–45 . По мере накопления этого повреждения наблюдаются сопутствующие изменения физических свойств коллагена и эластина, такие как повышенная жесткость, устойчивость к денатурации 13, 44, 45 и ухудшение характеристик подлежащей ткани 45–48 . Хотя было определено, что коллаген и эластин являются долгоживущими, в отличие от кристаллинов, имеются значительные доказательства их продолжающейся экспрессии и деградации на протяжении всей жизни организма-хозяина 13 . Таким образом, точный вклад долгоживущих коллагенов и эластинов в процесс старения по сравнению с вновь синтезируемыми, еще предстоит полностью понять.
Таким образом, точный вклад долгоживущих коллагенов и эластинов в процесс старения по сравнению с вновь синтезируемыми, еще предстоит полностью понять.
Долгоживущие белки в метаболически активных клетках
Открытие того, что NPC содержат долгоживущие белки, стало неожиданностью, потому что, в отличие от кристаллинов, это внутриклеточная структура и она экспрессируется повсеместно. NPC представляет собой белковую структуру восьмикратной симметрии ~ 90MDa, которая состоит из ~ 30 нуклеопоринов (Nups) в множественных копиях 49, 50 .Этот комплекс встроен в ядерную оболочку (NE) в местах соединения внутренней ядерной мембраны (INM) и внешней ядерной мембраны (ONM) 51 . NPC действуют как эксклюзивные транспортные каналы, которые опосредуют весь ядерный трафик и, таким образом, поддерживают надлежащую ядерную / цитоплазматическую компартментализацию 52 . Действительно, NPC представляет собой один из наиболее активных транспортных каналов, поскольку каждый NPC может осуществлять транспортировку груза до 1000 раз в секунду 53 .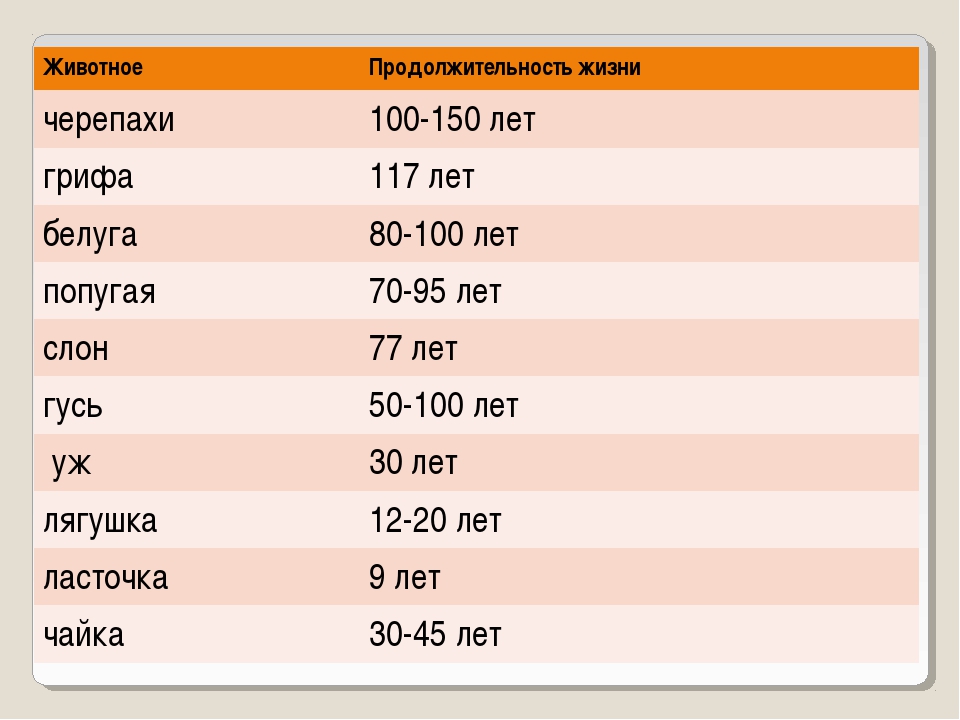 Имея тысячи ядерных пор на ядро 54 , NPC данной клетки несут ответственность за правильное прохождение миллионов транспортных грузов, исключая все другие комплексы.Разрушение этих важных ворот приведет к потере надлежащей ядерной / цитоплазматической компартментализации и, следовательно, всей клеточной регуляции, которая зависит от этой секвестрации.
Имея тысячи ядерных пор на ядро 54 , NPC данной клетки несут ответственность за правильное прохождение миллионов транспортных грузов, исключая все другие комплексы.Разрушение этих важных ворот приведет к потере надлежащей ядерной / цитоплазматической компартментализации и, следовательно, всей клеточной регуляции, которая зависит от этой секвестрации.
Подобно другим большим белковым ансамблям, NPC состоит из нескольких субкомплексов, каждый из которых вносит определенные функции и биофизические свойства в поры (). Во-первых, это по крайней мере три трансмембранных Nups, которые, как полагают, закрепляют NPC на мембране 55–57 . Внутри поры находится каркас Nups, состоящий из многокомпонентных комплексов Nup107 / 160 и Nup205 58, 59 .Считается, что эти каркасные комплексы обеспечивают структурную основу, с которой связаны несколько других комплексов Nup 60 . К каркасу в центре поры прикреплены FG-Nups, которые содержат домены, богатые фенилаланином / глицином 61 и, как было показано, создают барьер ядерной проницаемости, позволяя зависимое от сигнала прохождение груза 62, 63 . Наконец, периферические Nups, которые простираются в цитоплазматическое и ядерное пространство и образуют цитоплазматические филаменты и ядерную корзину, соответственно.Эти периферийные комплексы способствуют транспорту и его направленности, обеспечивая места стыковки грузов и других транспортных молекул 49, 52 .
Наконец, периферические Nups, которые простираются в цитоплазматическое и ядерное пространство и образуют цитоплазматические филаменты и ядерную корзину, соответственно.Эти периферийные комплексы способствуют транспорту и его направленности, обеспечивая места стыковки грузов и других транспортных молекул 49, 52 .
Схема ядерного порового комплекса. NPC встроен в двойную мембранную структуру, разделяющую ядро и цитоплазму. Он состоит из нескольких субкомплексов, включая периферические, мембранные, канальные FG и каркасные Nups. В то время как периферические, канальные и мембранные Nups постоянно обновляются, Nups каркаса стабильны.Мы полагаем, что такая стабильность необходима, и что быстрая замена или потеря этих компонентов приведет к нарушению барьера проницаемости. Таким образом, обслуживание или обновление этих комплексов каркасов обязательно происходит медленно, если вообще происходит.
Первое доказательство того, что белки NPC являются долгоживущими, было получено при исследовании NPC C. elegans, в ходе которого было обнаружено, что экспрессия каркасных Nups, но не периферических Nups, практически отсутствует в зрелом возрасте, хотя соответствующие белки все еще присутствуют. 3 .Это говорит о том, что в то время как периферические Nups постоянно переворачиваются, каркас NPC строится во время эмбриогенеза и длится всю жизнь червя, которая составляет порядка недель. Эти результаты дополнили другие работы, демонстрирующие, что белки каркасных NPC могут сохраняться в ядерной поре без обмена в течение часов 64 . Это было в отличие от периферических Nups, которые находились в поре всего за секунды, что представляет собой разницу в 4 порядка во времени пребывания различных компонентов одного и того же комплекса.
elegans, в ходе которого было обнаружено, что экспрессия каркасных Nups, но не периферических Nups, практически отсутствует в зрелом возрасте, хотя соответствующие белки все еще присутствуют. 3 .Это говорит о том, что в то время как периферические Nups постоянно переворачиваются, каркас NPC строится во время эмбриогенеза и длится всю жизнь червя, которая составляет порядка недель. Эти результаты дополнили другие работы, демонстрирующие, что белки каркасных NPC могут сохраняться в ядерной поре без обмена в течение часов 64 . Это было в отличие от периферических Nups, которые находились в поре всего за секунды, что представляет собой разницу в 4 порядка во времени пребывания различных компонентов одного и того же комплекса.
В более позднем исследовании использовалось мечение стабильного изотопного импульса, проанализированное с помощью MS (вставка 1), для определения продолжительности жизни NPC у крысы, которая имеет более сложную физиологию и большую продолжительность жизни, порядка 2 лет 4 . В этом исследовании крыс умерщвляли через 6 и 12 месяцев преследования, и ядра печени и ткани мозга анализировали с помощью MS. Данные для каждого белка NPC были получены из ядер тканей мозга и печени, и действительно было обнаружено, что только белки каркаса NPC все еще были помечены импульсным изотопом через 6 и 12 месяцев, особенно в головном мозге, а не в печени.Это указывало на то, что эти Nups каркаса были старше 1 года, что намного превышало нормальную продолжительность жизни белка и находилось на одном уровне с некоторыми из самых долгоживущих белков, известных на сегодняшний день.
В этом исследовании крыс умерщвляли через 6 и 12 месяцев преследования, и ядра печени и ткани мозга анализировали с помощью MS. Данные для каждого белка NPC были получены из ядер тканей мозга и печени, и действительно было обнаружено, что только белки каркаса NPC все еще были помечены импульсным изотопом через 6 и 12 месяцев, особенно в головном мозге, а не в печени.Это указывало на то, что эти Nups каркаса были старше 1 года, что намного превышало нормальную продолжительность жизни белка и находилось на одном уровне с некоторыми из самых долгоживущих белков, известных на сегодняшний день.
Исследования на червях и крысах сходным образом обнаружили, что только каркасные комплексы Nup107 / 160 и Nup205, но не периферические, мембранные или FG Nups, являются долгоживущими 3, 4 . Таким образом, в отличие от больших белковых комплексов, таких как рибосома или протеасома, кажется, что NPC не оборачивается как единое целое, а вместо этого индивидуальные субкомплексы имеют разные скорости оборота, а некоторые демонстрируют отсутствие оборота или очень малый обмен.
Сохранение этих долгоживущих компонентов NPC, кажется, не происходит без последствий, и теперь мы знаем некоторые из разветвлений их долговечности. Было обнаружено, что ядра, изолированные от старых червей и крыс, имеют пониженные уровни каркасных Nups, а также увеличение окислительного повреждения по сравнению с более молодыми ядрами 3 . В обоих случаях это привело к нарушению барьера ядерной проницаемости и неожиданному открытию агрегатов тубулина внутри ядер из старых мозгов крыс.Присутствие ядерных агрегатов в старых ядрах мозга важно, поскольку эти типы агрегатов были связаны с несколькими нейродегенеративными заболеваниями 65 .
Почему динамический белковый комплекс может содержать долгоживущие компоненты, особенно если есть известные разветвления? Возможно, это связано с тем, что NPC представляет собой внедренную в мембрану многокомплексную структуру, которая должна постоянно поддерживать селективный барьер проницаемости. Многие белки функционируют как часть больших многокомпонентных комплексов, которые необходимо сначала разобрать, прежде чем переворачивать.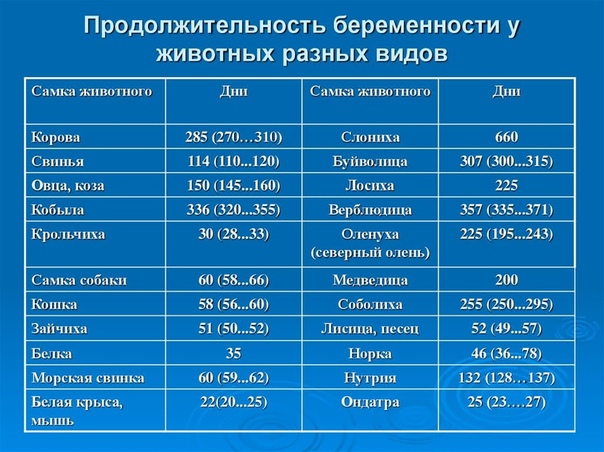 Эта разборка приводит к потере функции этого комплекса, что часто не имеет никакого значения, поскольку замещающие комплексы уже присутствуют. Однако что произойдет, если потеря функции всего нескольких комплексов будет иметь серьезные последствия? Это может иметь место для NPC, поскольку потеря нескольких ядерных пор может привести к потере цитоплазматической / ядерной компартментализации 66 . Таким образом, оборот NPC будет обеспечивать тонкий баланс между удалением и заменой компонентов, сохраняя при этом достаточную целостность ядерных пор для поддержания барьера проницаемости.Так как периферийные Nups часто включаются и выключаются NPC и могут присутствовать в избытке, их можно легко заменить 64 . Чего нельзя сказать о каркасных Nups, которые отвечают за структурную целостность NPC и действуют как точки, с которыми связаны Nups периферического и центрального каналов. Таким образом, удаление больших частей каркаса может не только дестабилизировать NPC, но также обязательно смещать любые связанные периферические и канальные Nups.
Эта разборка приводит к потере функции этого комплекса, что часто не имеет никакого значения, поскольку замещающие комплексы уже присутствуют. Однако что произойдет, если потеря функции всего нескольких комплексов будет иметь серьезные последствия? Это может иметь место для NPC, поскольку потеря нескольких ядерных пор может привести к потере цитоплазматической / ядерной компартментализации 66 . Таким образом, оборот NPC будет обеспечивать тонкий баланс между удалением и заменой компонентов, сохраняя при этом достаточную целостность ядерных пор для поддержания барьера проницаемости.Так как периферийные Nups часто включаются и выключаются NPC и могут присутствовать в избытке, их можно легко заменить 64 . Чего нельзя сказать о каркасных Nups, которые отвечают за структурную целостность NPC и действуют как точки, с которыми связаны Nups периферического и центрального каналов. Таким образом, удаление больших частей каркаса может не только дестабилизировать NPC, но также обязательно смещать любые связанные периферические и канальные Nups. Потеря ядер каркаса, таких как Nup93, приводит к потере барьера проницаемости, поэтому непрерывный обмен этими ядерными ядрами Nups при одновременном обеспечении целостности пор и надлежащих транспортных функций может оказаться невозможным 3 ().Это можно рассматривать как замену частей двигателя автомобиля во время работы.
Потеря ядер каркаса, таких как Nup93, приводит к потере барьера проницаемости, поэтому непрерывный обмен этими ядерными ядрами Nups при одновременном обеспечении целостности пор и надлежащих транспортных функций может оказаться невозможным 3 ().Это можно рассматривать как замену частей двигателя автомобиля во время работы.
Для деления клеток бывают моменты, когда NPC «выключен», и поэтому существует окно возможностей для оборота NPC. Во время митоза в делящихся клетках, NE разрушается (NEBD), приводя к разборке и диспергированию NPC в цитозоль и ER 67 . Это может быть единственным моментом для замены Nups каркаса вновь синтезированными копиями, поскольку цитоплазматическая / ядерная компартментализация отсутствует или необходима.Как только митоз завершился и Nups получили возможность оборота, NE затем повторно собирается вокруг хроматина вместе с NPCs, и вскоре восстанавливается барьер проницаемости 68 . Если клетка вышла из клеточного цикла и больше не делится (например, нейроны), или если в митозе нет NEBD (например, у почкующихся дрожжей), может не быть простого способа заменить потенциально поврежденные NPC. Таким образом, для борьбы с накоплением повреждений в Nups должны использоваться другие новые способы оборота или обслуживания, но в конечном итоге это может иметь негативные последствия для стареющих NPC.
Таким образом, для борьбы с накоплением повреждений в Nups должны использоваться другие новые способы оборота или обслуживания, но в конечном итоге это может иметь негативные последствия для стареющих NPC.
Как можно ослабить негативные последствия старения NPC в неделящихся клетках млекопитающих? Тщательный анализ данных об обороте NPC-крыс может дать некоторые подсказки. В этом исследовании были долгоживущие 15N-меченые каркасные Nups даже после 1 года погони, но более 50% пептидов из соответствующих белков были 14N 4 . Один из вариантов может заключаться в ограничении роста клеток или оборота тканей в период преследования, поскольку эти 15N-пептиды были обнаружены в головном мозге, которые содержат сложную смесь глиальных и нейрональных клеток.Другой возможностью было бы введение новых NPC, которые разбавили бы старые пептиды, меченные импульсной меткой. Хотя в интерфазе NPC действительно могут быть вставлены в интактный NE 69 , такой процесс должен быть связан с удалением всего NPC в постмитотических клетках, чтобы избежать неконтролируемого увеличения ядерных пор. Наконец, наиболее вероятный сценарий состоит в том, что существует минимальная замена отдельных подкомплексов при сохранении общей структуры и функций NPC. Хотя время пребывания для Nups каркаса велико, оно не бесконечно 64 , и небольшая и нечастая временная потеря некоторых Nups каркаса может быть допустимой.Этот медленный процесс обмена, следовательно, поможет предотвратить накопление поврежденных Nups каркаса посредством нормального, хотя и медленного, механизма оборота белка. Независимо от того, какой сценарий окажется правильным, все еще существует значительная популяция компонентов NPC, возраст которых превышает 1 год. Это делает компоненты NPC одними из самых старых полипептидов, которые являются частью активной белковой машины. Присутствие этих долгоживущих белков в неделящихся клетках, таких как нейроны, может представлять функциональную проблему, поскольку, в отличие от глазных линз, нейроны практически незаменимы, а нарушение их функции может привести к их необратимой утрате.
Наконец, наиболее вероятный сценарий состоит в том, что существует минимальная замена отдельных подкомплексов при сохранении общей структуры и функций NPC. Хотя время пребывания для Nups каркаса велико, оно не бесконечно 64 , и небольшая и нечастая временная потеря некоторых Nups каркаса может быть допустимой.Этот медленный процесс обмена, следовательно, поможет предотвратить накопление поврежденных Nups каркаса посредством нормального, хотя и медленного, механизма оборота белка. Независимо от того, какой сценарий окажется правильным, все еще существует значительная популяция компонентов NPC, возраст которых превышает 1 год. Это делает компоненты NPC одними из самых старых полипептидов, которые являются частью активной белковой машины. Присутствие этих долгоживущих белков в неделящихся клетках, таких как нейроны, может представлять функциональную проблему, поскольку, в отличие от глазных линз, нейроны практически незаменимы, а нарушение их функции может привести к их необратимой утрате.
Другие долгоживущие молекулы
Долгоживущие молекулы не ограничиваются белками; они появляются в нескольких других биологических процессах. Геном клетки воспроизводится полуконсервативным образом перед митозом и, как следствие, никогда не заменяется после того, как клетка перестает делиться. Таким образом, ДНК в нейронах так же стара, как и сам организм, что было подтверждено углеродным датированием 14C 70 . Другие нуклеиновые кислоты могут быть долгоживущими; исследования семян растений обнаружили пулы мРНК, которые находятся в состоянии покоя, возможно, в течение многих лет, пока не начнется прорастание 71 , а пулы РНК в ооцитах Xenopus laevis имеют период полураспада более 2 лет 72 .Наконец, ранние изотопные исследования также показали, что холестерин и липиды, связанные с миелиновой оболочкой, были долгоживущими 73, 74 . Это согласуется с наблюдением, что два других компонента оболочки, основной белок миелина и протеолипидный белок, также являются долгоживущими. Долговечность этих небелковых молекул подчеркивает, что недостаток обновления может не быть проблемой, связанной с протеомом старения, но может влиять на возрастное накопление повреждений на других компонентах клетки.
Долговечность этих небелковых молекул подчеркивает, что недостаток обновления может не быть проблемой, связанной с протеомом старения, но может влиять на возрастное накопление повреждений на других компонентах клетки.
Заключительные мысли
Наша оценка того, что подмножество ядерных белков является долгоживущим и, следовательно, уклоняется от белкового обмена, имеет важные последствия для клеточного старения и старения организма, как это обсуждалось для кристаллина хрусталика глаза и белков ядерных пор. Могут ли долгоживущие гистоны быть ответственными за наблюдаемую потерю программ экспрессии молодых генов в постмитотических тканях 75 ? Способствует ли продолжительность жизни Rec8 возрастному увеличению ошибок мейоза, как предполагали авторы 18 ? Возможно, самый важный вопрос на этом этапе заключается в том, существуют ли дополнительные долгоживущие белки, которые еще предстоит обнаружить в головном мозге или других тканях с ограниченным оборотом, таких как сердце и яичники 76 ? Важно ответить на эти вопросы, поскольку, возможно, при ограниченных средствах восстановления возрастных повреждений долгоживущие белки могут оказаться ахиллесовой пятой протеома старения.
Благодарности
Авторы благодарят сотрудников лаборатории Hetzer и E.Q. Тояме за полезные советы и критическое прочтение рукописи. B.H.T поддерживается Фондом Хьюитта; M.W.H Медицинским фондом Эллисона, Национальными институтами здравоохранения США (NIH) (R01GM098749) и Национальным институтом рака (номер награды P30CA014195).
Ссылки
3. Д’Анджело М.А., Райс М., Пановски С.Х., Hetzer MW. Зависимое от возраста разрушение комплексов ядерных пор вызывает потерю ядерной целостности в постмитотических клетках.Клетка. 2009; 136: 284–95. [Бесплатная статья PMC] [PubMed] [Google Scholar] 4. Савас Дж. Н., Тояма Б. Х., Сюй Т., Йетс Дж. Р., 3-й, Хетцер М.В. Чрезвычайно долгоживущие белки ядерных пор в мозгу крысы. Наука. 2012; 335: 942. [Бесплатная статья PMC] [PubMed] [Google Scholar] 5. Белль А., Танай А., Битинка Л., Шамир Р., О’Ши Е.К. Количественная оценка периода полужизни белка в протеоме почкующихся дрожжей. Proc Natl Acad Sci U S. A. 2006; 103: 13004–9. [Бесплатная статья PMC] [PubMed] [Google Scholar] 6. Cambridge SB, et al. Общесистемный протеомный анализ в клетках млекопитающих показывает консервативный функциональный обмен белков.J Proteome Res. 2011; 10: 5275–84. [PubMed] [Google Scholar] 7. Yen HC, Xu Q, Chou DM, Zhao Z, Elledge SJ. Профилирование глобальной стабильности белков в клетках млекопитающих. Наука. 2008; 322: 918–23. [PubMed] [Google Scholar] 8. Price JC, Guan S, Burlingame A, Prusiner SB, Ghaemmaghami S. Анализ динамики протеома в мозге мышей. Proc Natl Acad Sci U S. A. 2010; 107: 14508–13. [Бесплатная статья PMC] [PubMed] [Google Scholar] 9. Piha RS, Cuenod M, Waelsch H. Метаболизм гистонов мозга и печени. J Biol Chem.1966; 241: 2397–404. [PubMed] [Google Scholar] 10. Фишер К.А., Морелл П. Оборот белков в миелине и миелиноподобном материале головного мозга мыши. Brain Res. 1974; 74: 51–65. [PubMed] [Google Scholar] 11. Родригес де Лорес А., Альберичи де Канал М., Де Робертис Э. Оборот белков в субклеточных фракциях коры головного мозга крыс. Brain Res. 1971; 31: 179–84.
Cambridge SB, et al. Общесистемный протеомный анализ в клетках млекопитающих показывает консервативный функциональный обмен белков.J Proteome Res. 2011; 10: 5275–84. [PubMed] [Google Scholar] 7. Yen HC, Xu Q, Chou DM, Zhao Z, Elledge SJ. Профилирование глобальной стабильности белков в клетках млекопитающих. Наука. 2008; 322: 918–23. [PubMed] [Google Scholar] 8. Price JC, Guan S, Burlingame A, Prusiner SB, Ghaemmaghami S. Анализ динамики протеома в мозге мышей. Proc Natl Acad Sci U S. A. 2010; 107: 14508–13. [Бесплатная статья PMC] [PubMed] [Google Scholar] 9. Piha RS, Cuenod M, Waelsch H. Метаболизм гистонов мозга и печени. J Biol Chem.1966; 241: 2397–404. [PubMed] [Google Scholar] 10. Фишер К.А., Морелл П. Оборот белков в миелине и миелиноподобном материале головного мозга мыши. Brain Res. 1974; 74: 51–65. [PubMed] [Google Scholar] 11. Родригес де Лорес А., Альберичи де Канал М., Де Робертис Э. Оборот белков в субклеточных фракциях коры головного мозга крыс. Brain Res. 1971; 31: 179–84. [PubMed] [Google Scholar] 12. Verzijl N, et al. Влияние обмена коллагена на накопление конечных продуктов гликирования. J Biol Chem. 2000; 275: 39027–31.[PubMed] [Google Scholar] 13. Продам Д., Монье В. Комплексная физиология. 235–305. Американское физиологическое общество; 2011. [Google Scholar] 14. Шапиро С.Д., Эндикотт С.К., Провинция Массачусетс, Пирс Дж. А., Кэмпбелл Э. Дж. Заметная долговечность эластических волокон паренхимы легких человека определяется преобладанием D-аспартата и радиоуглерода, связанного с ядерным оружием. J Clin Invest. 1991; 87: 1828–34. [Бесплатная статья PMC] [PubMed] [Google Scholar] 15. Мастерс П.М., Бада Дж. Л., Зиглер Дж. С., младший. Рацемизация аспарагиновой кислоты в хрусталике человека во время старения и при образовании катаракты.Природа. 1977; 268: 71–3. [PubMed] [Google Scholar] 17. Helfman PM, Bada JL. Рацемизация аспарагиновой кислоты в дентине как мера старения. Природа. 1976; 262: 279–81. [PubMed] [Google Scholar] 18. Tachibana-Konwalski K, et al.
[PubMed] [Google Scholar] 12. Verzijl N, et al. Влияние обмена коллагена на накопление конечных продуктов гликирования. J Biol Chem. 2000; 275: 39027–31.[PubMed] [Google Scholar] 13. Продам Д., Монье В. Комплексная физиология. 235–305. Американское физиологическое общество; 2011. [Google Scholar] 14. Шапиро С.Д., Эндикотт С.К., Провинция Массачусетс, Пирс Дж. А., Кэмпбелл Э. Дж. Заметная долговечность эластических волокон паренхимы легких человека определяется преобладанием D-аспартата и радиоуглерода, связанного с ядерным оружием. J Clin Invest. 1991; 87: 1828–34. [Бесплатная статья PMC] [PubMed] [Google Scholar] 15. Мастерс П.М., Бада Дж. Л., Зиглер Дж. С., младший. Рацемизация аспарагиновой кислоты в хрусталике человека во время старения и при образовании катаракты.Природа. 1977; 268: 71–3. [PubMed] [Google Scholar] 17. Helfman PM, Bada JL. Рацемизация аспарагиновой кислоты в дентине как мера старения. Природа. 1976; 262: 279–81. [PubMed] [Google Scholar] 18. Tachibana-Konwalski K, et al. Rec8-содержащий когезин поддерживает биваленты без обновления во время фазы роста ооцитов мыши. Genes Dev. 2010; 24: 2505–16. [Бесплатная статья PMC] [PubMed] [Google Scholar] 19. McClatchy DB, Dong MQ, Wu CC, Venable JD, Yates JR., 3-е 15N метаболическое мечение ткани млекопитающих с медленным обменом белка.J Proteome Res. 2007; 6: 2005–10. [Бесплатная статья PMC] [PubMed] [Google Scholar] 21. Гроу Дж. Генетика кристаллинов: катаракта и не только. Exp Eye Res. 2009. 88: 173–89. [PubMed] [Google Scholar] 22. Райд М.А. Дифференциация клеток линзового волокна и потеря органелл: многие пути приводят к ясности. Philos Trans R Soc Lond B Biol Sci. 2011; 366: 1219–33. [Бесплатная статья PMC] [PubMed] [Google Scholar] 24. Bassnett S, Shi Y, Vrensen GF. Биологическое стекло: структурные детерминанты прозрачности хрусталика глаза. Philos Trans R Soc Lond B Biol Sci.2011; 366: 1250–64. [Бесплатная статья PMC] [PubMed] [Google Scholar] 26. Рао П.В., Хуанг К.Л., Хорвиц Дж., Зиглер Дж. С., младший.
Rec8-содержащий когезин поддерживает биваленты без обновления во время фазы роста ооцитов мыши. Genes Dev. 2010; 24: 2505–16. [Бесплатная статья PMC] [PubMed] [Google Scholar] 19. McClatchy DB, Dong MQ, Wu CC, Venable JD, Yates JR., 3-е 15N метаболическое мечение ткани млекопитающих с медленным обменом белка.J Proteome Res. 2007; 6: 2005–10. [Бесплатная статья PMC] [PubMed] [Google Scholar] 21. Гроу Дж. Генетика кристаллинов: катаракта и не только. Exp Eye Res. 2009. 88: 173–89. [PubMed] [Google Scholar] 22. Райд М.А. Дифференциация клеток линзового волокна и потеря органелл: многие пути приводят к ясности. Philos Trans R Soc Lond B Biol Sci. 2011; 366: 1219–33. [Бесплатная статья PMC] [PubMed] [Google Scholar] 24. Bassnett S, Shi Y, Vrensen GF. Биологическое стекло: структурные детерминанты прозрачности хрусталика глаза. Philos Trans R Soc Lond B Biol Sci.2011; 366: 1250–64. [Бесплатная статья PMC] [PubMed] [Google Scholar] 26. Рао П.В., Хуанг К.Л., Хорвиц Дж., Зиглер Дж. С., младший.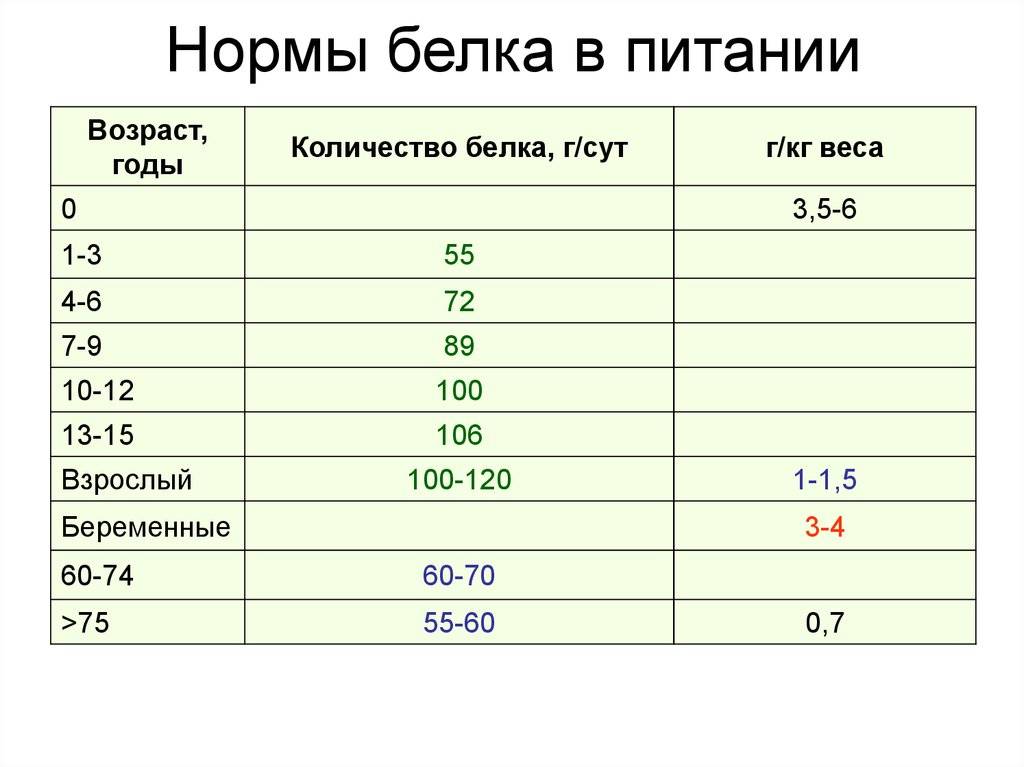 Доказательства того, что альфа-кристаллин предотвращает неспецифическую агрегацию белка в неповрежденном хрусталике глаза. Biochim Biophys Acta. 1995; 1245: 439–47. [PubMed] [Google Scholar] 27. Си Дж. Х. и др. Механизм функции малого белка теплового шока in vivo: модель «нокаута» на мышах демонстрирует, что мутация R49C в альфа-А-кристаллине увеличивает нерастворимость белка и гибель клеток. J Biol Chem. 2008; 283: 5801–14.[PubMed] [Google Scholar] 28. Гиблин Ф.Дж. Глутатион: жизненно важный антиоксидант хрусталика. J Ocul Pharmacol Ther. 2000. 16: 121–35. [PubMed] [Google Scholar] 29. Лу М.Ф. Редокс-регулирование в линзе. Prog Retin Eye Res. 2003. 22: 657–82. [PubMed] [Google Scholar] 30. Xing KY, Lou MF. Влияние возраста на системы тиолтрансферазы (глутаредоксина) и тиоредоксина в хрусталике человека. Инвестируйте Ophthalmol Vis Sci. 2010. 51: 6598–604. [Бесплатная статья PMC] [PubMed] [Google Scholar] 31. Шарма К.К., Ортверт Б.Дж. Влияние поперечного сшивания на шапероноподобную функцию альфа-кристаллина.
Доказательства того, что альфа-кристаллин предотвращает неспецифическую агрегацию белка в неповрежденном хрусталике глаза. Biochim Biophys Acta. 1995; 1245: 439–47. [PubMed] [Google Scholar] 27. Си Дж. Х. и др. Механизм функции малого белка теплового шока in vivo: модель «нокаута» на мышах демонстрирует, что мутация R49C в альфа-А-кристаллине увеличивает нерастворимость белка и гибель клеток. J Biol Chem. 2008; 283: 5801–14.[PubMed] [Google Scholar] 28. Гиблин Ф.Дж. Глутатион: жизненно важный антиоксидант хрусталика. J Ocul Pharmacol Ther. 2000. 16: 121–35. [PubMed] [Google Scholar] 29. Лу М.Ф. Редокс-регулирование в линзе. Prog Retin Eye Res. 2003. 22: 657–82. [PubMed] [Google Scholar] 30. Xing KY, Lou MF. Влияние возраста на системы тиолтрансферазы (глутаредоксина) и тиоредоксина в хрусталике человека. Инвестируйте Ophthalmol Vis Sci. 2010. 51: 6598–604. [Бесплатная статья PMC] [PubMed] [Google Scholar] 31. Шарма К.К., Ортверт Б.Дж. Влияние поперечного сшивания на шапероноподобную функцию альфа-кристаллина. Exp Eye Res. 1995; 61: 413–21. [PubMed] [Google Scholar] 32. Гупта Р., Шривастава ОП. Деамидирование влияет на структурные и функциональные свойства человеческого альфа-кристаллина и его олигомеризацию с альфа-В-кристаллином. J Biol Chem. 2004. 279: 44258–69. [PubMed] [Google Scholar] 35. Хансон С.Р., Хасан А., Смит Д.Л., Смит Дж. Б. Основными модификациями нерастворимых в воде кристаллинов хрусталика человека in vivo являются дисульфидные связи, дезамидирование, окисление метионина и расщепление основной цепи. Exp Eye Res. 2000. 71: 195–207.[PubMed] [Google Scholar] 36. Ортверт Б.Дж., Олесен ПР. Исследования по солюбилизации нерастворимой в воде фракции хрусталика и катаракты человека. Exp Eye Res. 1992; 55: 777–83. [PubMed] [Google Scholar] 37. Ахмед Н и др. Гидроимидазолон, полученный из метилглиоксаля, улучшает конечные продукты гликирования белков хрусталика человека. Инвестируйте Ophthalmol Vis Sci. 2003; 44: 5287–92. [PubMed] [Google Scholar] 38. Takemoto LJ. Количественное определение дезамидирования аспарагина-101 из альфа-A-кристаллина при старении хрусталика человека.
Exp Eye Res. 1995; 61: 413–21. [PubMed] [Google Scholar] 32. Гупта Р., Шривастава ОП. Деамидирование влияет на структурные и функциональные свойства человеческого альфа-кристаллина и его олигомеризацию с альфа-В-кристаллином. J Biol Chem. 2004. 279: 44258–69. [PubMed] [Google Scholar] 35. Хансон С.Р., Хасан А., Смит Д.Л., Смит Дж. Б. Основными модификациями нерастворимых в воде кристаллинов хрусталика человека in vivo являются дисульфидные связи, дезамидирование, окисление метионина и расщепление основной цепи. Exp Eye Res. 2000. 71: 195–207.[PubMed] [Google Scholar] 36. Ортверт Б.Дж., Олесен ПР. Исследования по солюбилизации нерастворимой в воде фракции хрусталика и катаракты человека. Exp Eye Res. 1992; 55: 777–83. [PubMed] [Google Scholar] 37. Ахмед Н и др. Гидроимидазолон, полученный из метилглиоксаля, улучшает конечные продукты гликирования белков хрусталика человека. Инвестируйте Ophthalmol Vis Sci. 2003; 44: 5287–92. [PubMed] [Google Scholar] 38. Takemoto LJ. Количественное определение дезамидирования аспарагина-101 из альфа-A-кристаллина при старении хрусталика человека. Curr Eye Res.1998. 17: 247–50. [PubMed] [Google Scholar] 39. Wilmarth PA, et al. Возрастные изменения кристаллинов человека, определенные на основе сравнительного анализа посттрансляционных модификаций молодых и старых хрусталиков: вносит ли дезамидирование вклад в нерастворимость кристаллина? J Proteome Res. 2006; 5: 2554–66. [Бесплатная статья PMC] [PubMed] [Google Scholar] 40. Bloemendal H, et al. Старение и зрение: структура, стабильность и функция кристаллинов хрусталика. Prog Biophys Mol Biol. 2004. 86: 407–85. [PubMed] [Google Scholar] 41.Рой Д., Спектор А. Отсутствие низкомолекулярного альфа-кристаллина в ядерной области старых хрусталиков человека. Proc Natl Acad Sci U S. A. 1976; 73: 3484–7. [Бесплатная статья PMC] [PubMed] [Google Scholar] 42. Керриган Дж. Дж., Мэнселл Дж. П., Сэнди Дж. Р. Матрица оборачиваемости. J Orthod. 2000. 27: 227–33. [PubMed] [Google Scholar] 43. Браверман И.М., Фонферко Е. Исследования старения кожи: I. Сеть эластичных волокон. J Invest Dermatol. 1982; 78: 434–43.
Curr Eye Res.1998. 17: 247–50. [PubMed] [Google Scholar] 39. Wilmarth PA, et al. Возрастные изменения кристаллинов человека, определенные на основе сравнительного анализа посттрансляционных модификаций молодых и старых хрусталиков: вносит ли дезамидирование вклад в нерастворимость кристаллина? J Proteome Res. 2006; 5: 2554–66. [Бесплатная статья PMC] [PubMed] [Google Scholar] 40. Bloemendal H, et al. Старение и зрение: структура, стабильность и функция кристаллинов хрусталика. Prog Biophys Mol Biol. 2004. 86: 407–85. [PubMed] [Google Scholar] 41.Рой Д., Спектор А. Отсутствие низкомолекулярного альфа-кристаллина в ядерной области старых хрусталиков человека. Proc Natl Acad Sci U S. A. 1976; 73: 3484–7. [Бесплатная статья PMC] [PubMed] [Google Scholar] 42. Керриган Дж. Дж., Мэнселл Дж. П., Сэнди Дж. Р. Матрица оборачиваемости. J Orthod. 2000. 27: 227–33. [PubMed] [Google Scholar] 43. Браверман И.М., Фонферко Е. Исследования старения кожи: I. Сеть эластичных волокон. J Invest Dermatol. 1982; 78: 434–43. [PubMed] [Google Scholar] 44. Kragstrup TW, Kjaer M, Mackey AL. Структурные, биохимические, клеточные и функциональные изменения внеклеточного матрикса скелетных мышц с возрастом.Scand J Med Sci Sports. 2011; 21: 749–57. [PubMed] [Google Scholar] 45. Продам DR, Monnier VM. Молекулярные основы артериальной жесткости: роль гликирования — мини-обзор. Геронтология. 2012; 58: 227–37. [PubMed] [Google Scholar] 46. Фонк Э. и др. Влияние старения на функциональность эластина в артериях головного мозга человека. Гладить. 2009. 40: 2552–6. [PubMed] [Google Scholar] 47. Госселин Л.Е., Адамс К., Коттер Т.А., Маккормик Р.Дж., Томас Д.П. Влияние тренировок на пассивную жесткость опорно-двигательных скелетных мышц: роль внеклеточного матрикса.J Appl Physiol. 1998. 85: 1011–6. [PubMed] [Google Scholar] 48. Haus JM, Carrithers JA, Trappe SW, Trappe TA. Коллаген, сшивание и конечные продукты гликирования в стареющих скелетных мышцах человека. J Appl Physiol. 2007; 103: 2068–76. [PubMed] [Google Scholar] 49.
[PubMed] [Google Scholar] 44. Kragstrup TW, Kjaer M, Mackey AL. Структурные, биохимические, клеточные и функциональные изменения внеклеточного матрикса скелетных мышц с возрастом.Scand J Med Sci Sports. 2011; 21: 749–57. [PubMed] [Google Scholar] 45. Продам DR, Monnier VM. Молекулярные основы артериальной жесткости: роль гликирования — мини-обзор. Геронтология. 2012; 58: 227–37. [PubMed] [Google Scholar] 46. Фонк Э. и др. Влияние старения на функциональность эластина в артериях головного мозга человека. Гладить. 2009. 40: 2552–6. [PubMed] [Google Scholar] 47. Госселин Л.Е., Адамс К., Коттер Т.А., Маккормик Р.Дж., Томас Д.П. Влияние тренировок на пассивную жесткость опорно-двигательных скелетных мышц: роль внеклеточного матрикса.J Appl Physiol. 1998. 85: 1011–6. [PubMed] [Google Scholar] 48. Haus JM, Carrithers JA, Trappe SW, Trappe TA. Коллаген, сшивание и конечные продукты гликирования в стареющих скелетных мышцах человека. J Appl Physiol. 2007; 103: 2068–76. [PubMed] [Google Scholar] 49. Hoelz A, Debler EW, Blobel G. Структура ядерного порового комплекса. Анну Рев Биохим. 2011; 80: 613–43. [PubMed] [Google Scholar] 50. Кроншоу Дж. М., Крутчинский А. Н., Чжан В., Чайт Б. Т., Матунис М.Дж. Протеомный анализ комплекса ядерных пор млекопитающих.J Cell Biol. 2002; 158: 915–27. [Бесплатная статья PMC] [PubMed] [Google Scholar] 51. Hetzer MW, Wente SR. Пограничный контроль в ядре: биогенез и организация ядерной мембраны и поровых комплексов. Dev Cell. 2009; 17: 606–16. [Бесплатная статья PMC] [PubMed] [Google Scholar] 54. Гарсия-Сегура Л.М., Лафарга М., Берчиано М.Т., Эрнандес П., Андрес М.А. Распределение ядерных пор и организация хроматина в нейронах и глиальных клетках коры мозжечка крыс. J Comp Neurol. 1989; 290: 440–50. [PubMed] [Google Scholar] 56.Hallberg E, Wozniak RW, Blobel G. Интегральный мембранный белок порового мембранного домена ядерной оболочки содержит нуклеопорин-подобную область. J Cell Biol. 1993; 122: 513–21. [Бесплатная статья PMC] [PubMed] [Google Scholar] 57.
Hoelz A, Debler EW, Blobel G. Структура ядерного порового комплекса. Анну Рев Биохим. 2011; 80: 613–43. [PubMed] [Google Scholar] 50. Кроншоу Дж. М., Крутчинский А. Н., Чжан В., Чайт Б. Т., Матунис М.Дж. Протеомный анализ комплекса ядерных пор млекопитающих.J Cell Biol. 2002; 158: 915–27. [Бесплатная статья PMC] [PubMed] [Google Scholar] 51. Hetzer MW, Wente SR. Пограничный контроль в ядре: биогенез и организация ядерной мембраны и поровых комплексов. Dev Cell. 2009; 17: 606–16. [Бесплатная статья PMC] [PubMed] [Google Scholar] 54. Гарсия-Сегура Л.М., Лафарга М., Берчиано М.Т., Эрнандес П., Андрес М.А. Распределение ядерных пор и организация хроматина в нейронах и глиальных клетках коры мозжечка крыс. J Comp Neurol. 1989; 290: 440–50. [PubMed] [Google Scholar] 56.Hallberg E, Wozniak RW, Blobel G. Интегральный мембранный белок порового мембранного домена ядерной оболочки содержит нуклеопорин-подобную область. J Cell Biol. 1993; 122: 513–21. [Бесплатная статья PMC] [PubMed] [Google Scholar] 57. Greber UF, Senior A, Gerace L. Главный гликопротеин комплекса ядерных пор представляет собой трансмембранный полипептид с большим просветным доменом и маленьким цитоплазматическим хвостом. EMBO J. 1990; 9: 1495–502. [Бесплатная статья PMC] [PubMed] [Google Scholar] 58. Siniossoglou S, et al. Новый комплекс нуклеопоринов, который включает Sec13p и гомолог Sec13p, необходим для нормальных ядерных пор.Клетка. 1996. 84: 265–75. [PubMed] [Google Scholar] 59. Гранди П. и др. Nup93, позвоночный гомолог дрожжевого грибка Nic96p, образует комплекс с новым 205-кДа белком и необходим для правильной сборки ядерных пор. Mol Biol Cell. 1997; 8: 2017–38. [Бесплатная статья PMC] [PubMed] [Google Scholar] 60. Альбер Ф. и др. Молекулярная архитектура комплекса ядерных пор. Природа. 2007; 450: 695–701. [PubMed] [Google Scholar] 61. Hu T, Guan T, Gerace L. Молекулярная и функциональная характеристика комплекса p62, сборки гликопротеинов комплекса ядерных пор.J Cell Biol. 1996; 134: 589–601. [Бесплатная статья PMC] [PubMed] [Google Scholar] 62.
Greber UF, Senior A, Gerace L. Главный гликопротеин комплекса ядерных пор представляет собой трансмембранный полипептид с большим просветным доменом и маленьким цитоплазматическим хвостом. EMBO J. 1990; 9: 1495–502. [Бесплатная статья PMC] [PubMed] [Google Scholar] 58. Siniossoglou S, et al. Новый комплекс нуклеопоринов, который включает Sec13p и гомолог Sec13p, необходим для нормальных ядерных пор.Клетка. 1996. 84: 265–75. [PubMed] [Google Scholar] 59. Гранди П. и др. Nup93, позвоночный гомолог дрожжевого грибка Nic96p, образует комплекс с новым 205-кДа белком и необходим для правильной сборки ядерных пор. Mol Biol Cell. 1997; 8: 2017–38. [Бесплатная статья PMC] [PubMed] [Google Scholar] 60. Альбер Ф. и др. Молекулярная архитектура комплекса ядерных пор. Природа. 2007; 450: 695–701. [PubMed] [Google Scholar] 61. Hu T, Guan T, Gerace L. Молекулярная и функциональная характеристика комплекса p62, сборки гликопротеинов комплекса ядерных пор.J Cell Biol. 1996; 134: 589–601. [Бесплатная статья PMC] [PubMed] [Google Scholar] 62. Frey S, Richter RP, Gorlich D. Богатые FG повторы белков ядерных пор образуют трехмерную сеть с гидрогелеподобными свойствами. Наука. 2006; 314: 815–7. [PubMed] [Google Scholar] 63. Hulsmann BB, Labokha AA, Gorlich D. Проницаемость восстановленных ядерных пор является прямым доказательством селективной фазовой модели. Клетка. 2012; 150: 738–51. [PubMed] [Google Scholar] 64. Rabut G, Doye V, Ellenberg J. Картирование динамической организации комплекса ядерных пор внутри отдельных живых клеток.Nat Cell Biol. 2004; 6: 1114–21. [PubMed] [Google Scholar] 65. Woulfe JM. Аномалии ядра и ядерных включений при нейродегенеративном заболевании: работа в стадии разработки. Neuropathol Appl Neurobiol. 2007; 33: 2–42. [PubMed] [Google Scholar] 66. Ленарт П. и др. Разрушение ядерной оболочки в ооцитах морских звезд происходит путем частичной разборки NPC с последующей быстро распространяющейся фенестрацией ядерных мембран. J Cell Biol. 2003. 160: 1055–68. [Бесплатная статья PMC] [PubMed] [Google Scholar] 67.
Frey S, Richter RP, Gorlich D. Богатые FG повторы белков ядерных пор образуют трехмерную сеть с гидрогелеподобными свойствами. Наука. 2006; 314: 815–7. [PubMed] [Google Scholar] 63. Hulsmann BB, Labokha AA, Gorlich D. Проницаемость восстановленных ядерных пор является прямым доказательством селективной фазовой модели. Клетка. 2012; 150: 738–51. [PubMed] [Google Scholar] 64. Rabut G, Doye V, Ellenberg J. Картирование динамической организации комплекса ядерных пор внутри отдельных живых клеток.Nat Cell Biol. 2004; 6: 1114–21. [PubMed] [Google Scholar] 65. Woulfe JM. Аномалии ядра и ядерных включений при нейродегенеративном заболевании: работа в стадии разработки. Neuropathol Appl Neurobiol. 2007; 33: 2–42. [PubMed] [Google Scholar] 66. Ленарт П. и др. Разрушение ядерной оболочки в ооцитах морских звезд происходит путем частичной разборки NPC с последующей быстро распространяющейся фенестрацией ядерных мембран. J Cell Biol. 2003. 160: 1055–68. [Бесплатная статья PMC] [PubMed] [Google Scholar] 67. Берк Б., Элленберг Дж.Ремоделирование стенок ядра. Nat Rev Mol Cell Biol. 2002; 3: 487–97. [PubMed] [Google Scholar] 68. Андерсон DJ, Hetzer MW. Формирование эндоплазматической сети в ядерную оболочку. J Cell Sci. 2008; 121: 137–42. [PubMed] [Google Scholar] 69. Doucet CM, Talamas JA, Hetzer MW. Зависимые от клеточного цикла различия в сборке комплекса ядерных пор у многоклеточных. Клетка. 2010; 141: 1030–41. [Бесплатная статья PMC] [PubMed] [Google Scholar] 70. Spalding KL, Bhardwaj RD, Buchholz BA, Druid H, Frisen J. Ретроспективное датирование рождения клеток у людей.Клетка. 2005; 122: 133–43. [PubMed] [Google Scholar] 71. Дуре Л., Уотерс Л. Долгоживущий посланник РНК: свидетельства прорастания семян хлопка. Наука. 1965; 147: 410–2. [PubMed] [Google Scholar] 72. Форд П.Дж., Мэтисон Т., Росбаш М. Очень долгоживущие информационные РНК в яичниках Xenopus laevis. Dev Biol. 1977; 57: 417–26. [PubMed] [Google Scholar] 73. Дэвисон А.Н., Морган Р.С., Вайда М., Райт Г.П. Метаболизм липидов миелина: включение [3-14c] серина в липиды мозга развивающегося кролика и их сохранение в центральной нервной системе.
Берк Б., Элленберг Дж.Ремоделирование стенок ядра. Nat Rev Mol Cell Biol. 2002; 3: 487–97. [PubMed] [Google Scholar] 68. Андерсон DJ, Hetzer MW. Формирование эндоплазматической сети в ядерную оболочку. J Cell Sci. 2008; 121: 137–42. [PubMed] [Google Scholar] 69. Doucet CM, Talamas JA, Hetzer MW. Зависимые от клеточного цикла различия в сборке комплекса ядерных пор у многоклеточных. Клетка. 2010; 141: 1030–41. [Бесплатная статья PMC] [PubMed] [Google Scholar] 70. Spalding KL, Bhardwaj RD, Buchholz BA, Druid H, Frisen J. Ретроспективное датирование рождения клеток у людей.Клетка. 2005; 122: 133–43. [PubMed] [Google Scholar] 71. Дуре Л., Уотерс Л. Долгоживущий посланник РНК: свидетельства прорастания семян хлопка. Наука. 1965; 147: 410–2. [PubMed] [Google Scholar] 72. Форд П.Дж., Мэтисон Т., Росбаш М. Очень долгоживущие информационные РНК в яичниках Xenopus laevis. Dev Biol. 1977; 57: 417–26. [PubMed] [Google Scholar] 73. Дэвисон А.Н., Морган Р.С., Вайда М., Райт Г.П. Метаболизм липидов миелина: включение [3-14c] серина в липиды мозга развивающегося кролика и их сохранение в центральной нервной системе. J Neurochem. 1959; 4: 360–365. [Google Scholar] 74. Дэвисон А.Н., Вайда М. Метаболизм липидов миелина: оценка и разделение липидов мозга у развивающегося кролика. J Neurochem. 1959; 4: 353–9. [PubMed] [Google Scholar] 77. Коммерфорд С.Л., Карстен А.Л., Кронкайт Е.П. Оборот гистонов в непролиферирующих клетках. Proc Natl Acad Sci U S. 1982, 79: 1163–5. [Бесплатная статья PMC] [PubMed] [Google Scholar] 78. Duerre JA, Lee CT. Метилирование и оборот гистонов головного мозга крысы in vivo. J Neurochem. 1974; 23: 541–7.[PubMed] [Google Scholar] 79. Park SK, Venable JD, Xu T, Yates JR., 3rd Программный инструмент количественного анализа для протеомики на основе масс-спектрометрии. Нат методы. 2008; 5: 319–22. [Бесплатная статья PMC] [PubMed] [Google Scholar] 81. Semba RD, Nicklett EJ, Ferrucci L. Способствует ли накопление конечных продуктов гликирования фенотипу старения? J Gerontol A Biol Sci Med Sci. 2010; 65: 963–75. [Бесплатная статья PMC] [PubMed] [Google Scholar] 82. Шлейхер Э.Д., Вагнер Э.
J Neurochem. 1959; 4: 360–365. [Google Scholar] 74. Дэвисон А.Н., Вайда М. Метаболизм липидов миелина: оценка и разделение липидов мозга у развивающегося кролика. J Neurochem. 1959; 4: 353–9. [PubMed] [Google Scholar] 77. Коммерфорд С.Л., Карстен А.Л., Кронкайт Е.П. Оборот гистонов в непролиферирующих клетках. Proc Natl Acad Sci U S. 1982, 79: 1163–5. [Бесплатная статья PMC] [PubMed] [Google Scholar] 78. Duerre JA, Lee CT. Метилирование и оборот гистонов головного мозга крысы in vivo. J Neurochem. 1974; 23: 541–7.[PubMed] [Google Scholar] 79. Park SK, Venable JD, Xu T, Yates JR., 3rd Программный инструмент количественного анализа для протеомики на основе масс-спектрометрии. Нат методы. 2008; 5: 319–22. [Бесплатная статья PMC] [PubMed] [Google Scholar] 81. Semba RD, Nicklett EJ, Ferrucci L. Способствует ли накопление конечных продуктов гликирования фенотипу старения? J Gerontol A Biol Sci Med Sci. 2010; 65: 963–75. [Бесплатная статья PMC] [PubMed] [Google Scholar] 82. Шлейхер Э.Д., Вагнер Э. , Нерлих АГ. Повышенное накопление продукта гликоксидирования N (эпсилон) — (карбоксиметил) лизина в тканях человека при диабете и старении.J Clin Invest. 1997. 99: 457–68. [Бесплатная статья PMC] [PubMed] [Google Scholar] 83. Лян Дж. Н., Пеллетье MR. Дестабилизация конформации белков хрусталика смешанным дисульфидом глутатиона. Exp Eye Res. 1988; 47: 17–25. [PubMed] [Google Scholar] 84. Spector A, Roy D. Связанный с дисульфидом высокомолекулярный белок, связанный с катарактой человека. Proc Natl Acad Sci U S. A. 1978; 75: 3244–8. [Бесплатная статья PMC] [PubMed] [Google Scholar] 85. Miesbauer LR, et al. Посттрансляционные модификации водорастворимых кристаллинов хрусталика человека молодых людей.J Biol Chem. 1994; 269: 12494–502. [PubMed] [Google Scholar] 86. Лунд А. Л., Смит Дж. Б., Смит Д. Л.. Модификации нерастворимых в воде альфа-кристаллов хрусталика человека. Exp Eye Res. 1996; 63: 661–72. [PubMed] [Google Scholar] 87. Моримото Р.И. Реакция теплового шока: системная биология протеотоксического стресса при старении и болезнях.
, Нерлих АГ. Повышенное накопление продукта гликоксидирования N (эпсилон) — (карбоксиметил) лизина в тканях человека при диабете и старении.J Clin Invest. 1997. 99: 457–68. [Бесплатная статья PMC] [PubMed] [Google Scholar] 83. Лян Дж. Н., Пеллетье MR. Дестабилизация конформации белков хрусталика смешанным дисульфидом глутатиона. Exp Eye Res. 1988; 47: 17–25. [PubMed] [Google Scholar] 84. Spector A, Roy D. Связанный с дисульфидом высокомолекулярный белок, связанный с катарактой человека. Proc Natl Acad Sci U S. A. 1978; 75: 3244–8. [Бесплатная статья PMC] [PubMed] [Google Scholar] 85. Miesbauer LR, et al. Посттрансляционные модификации водорастворимых кристаллинов хрусталика человека молодых людей.J Biol Chem. 1994; 269: 12494–502. [PubMed] [Google Scholar] 86. Лунд А. Л., Смит Дж. Б., Смит Д. Л.. Модификации нерастворимых в воде альфа-кристаллов хрусталика человека. Exp Eye Res. 1996; 63: 661–72. [PubMed] [Google Scholar] 87. Моримото Р.И. Реакция теплового шока: системная биология протеотоксического стресса при старении и болезнях. Колд Спринг Харб Symp Quant Biol. 2011; 76: 91–9. [PubMed] [Google Scholar] 88. Моллер IM, Rogowska-Wrzesinska A, Rao RS. Карбонилирование белков и катализируемое металлами окисление белков в клеточной перспективе.J Proteomics. 2011; 74: 2228–42. [PubMed] [Google Scholar] Диета с низким содержанием белка
Колд Спринг Харб Symp Quant Biol. 2011; 76: 91–9. [PubMed] [Google Scholar] 88. Моллер IM, Rogowska-Wrzesinska A, Rao RS. Карбонилирование белков и катализируемое металлами окисление белков в клеточной перспективе.J Proteomics. 2011; 74: 2228–42. [PubMed] [Google Scholar] Диета с низким содержанием белкаможет продлить продолжительность жизни | Наука
Страна: Страна * AfghanistanAland IslandsAlbaniaAlgeriaAndorraAngolaAnguillaAntarcticaAntigua и BarbudaArgentinaArmeniaArubaAustraliaAustriaAzerbaijanBahamasBahrainBangladeshBarbadosBelarusBelgiumBelizeBeninBermudaBhutanBolivia, многонациональное государство ofBonaire, Синт-Эстатиус и SabaBosnia и HerzegovinaBotswanaBouvet IslandBrazilBritish Индийский океан TerritoryBrunei DarussalamBulgariaBurkina FasoBurundiCambodiaCameroonCanadaCape VerdeCayman IslandsCentral африканских RepublicChadChileChinaChristmas IslandCocos (Килинг) IslandsColombiaComorosCongoCongo, Демократическая Республика theCook IslandsCosta RicaCote D’IvoireCroatiaCubaCuraçaoCyprusCzech RepublicDenmarkDjiboutiDominicaDominican RepublicEcuadorEgyptEl SalvadorEquatorial GuineaEritreaEstoniaEthiopiaFalkland острова (Мальвинские ) Фарерские острова, Фиджи, Финляндия, Франция, Французская Гвиана, Французская Полинезия, Французские Южные территории, Габон, Гамбия, Грузия, Германия, Гана, Гибралтар, Греция, Гренландия, Гренада, Гваделупа, Гватемала, Гернси, Гвинея, Гвинея-Бисау, Гайана, Гаити, Остров Херд и МакДональда IslandsHoly Престол (Ватикан) HondurasHong KongHungaryIcelandIndiaIndonesiaIran, Исламская Республика ofIraqIrelandIsle из ManIsraelItalyJamaicaJapanJerseyJordanKazakhstanKenyaKiribatiKorea, Корейская Народно-Демократическая Республика ofKorea, Республика ofKuwaitKyrgyzstanLao Народная Демократическая RepublicLatviaLebanonLesothoLiberiaLibyan Арабская JamahiriyaLiechtensteinLithuaniaLuxembourgMacaoMacedonia, бывшая югославская Республика ofMadagascarMalawiMalaysiaMaldivesMaliMaltaMartiniqueMauritaniaMauritiusMayotteMexicoMoldova, Республика ofMonacoMongoliaMontenegroMontserratMoroccoMozambiqueMyanmarNamibiaNauruNepalNetherlandsNew CaledoniaNew ZealandNicaraguaNigerNigeriaNiueNorfolk IslandNorwayOmanPakistanPalestinianPanamaPapua Новый GuineaParaguayPeruPhilippinesPitcairnPolandPortugalQatarReunionRomaniaRussian FederationRWANDASaint BarthélemySaint Елены, Вознесения и Тристан-да-КуньяСент-Китс и НевисСент-ЛюсияСент-Мартен (французская часть) Сен-Пьер и Микелон Сент-Винсент и ГренадиныСам oaSan MarinoSao Том и PrincipeSaudi ArabiaSenegalSerbiaSeychellesSierra LeoneSingaporeSint Маартен (Голландская часть) SlovakiaSloveniaSolomon IslandsSomaliaSouth AfricaSouth Джорджия и Южные Сандвичевы IslandsSouth SudanSpainSri LankaSudanSurinameSvalbard и Ян MayenSwazilandSwedenSwitzerlandSyrian Arab RepublicTaiwanTajikistanTanzania, Объединенная Республика ofThailandTimor-LesteTogoTokelauTongaTrinidad и TobagoTunisiaTurkeyTurkmenistanTurks и Кайкос IslandsTuvaluUgandaUkraineUnited арабского EmiratesUnited KingdomUnited StatesUruguayUzbekistanVanuatuVenezuela, Боливарианская Республика ofVietnamVirgin остров, BritishWallis и Футуна Западная Сахара Йемен Замбия Зимбабве
Пожертвовать сейчасПоддержка некоммерческой научной журналистики
Если мы чему-то научились из пандемии COVID-19, так это тому, что мы не можем дождаться реакции кризиса. Science и AAAS неустанно работают над предоставлением достоверной, основанной на фактах информации о последних научных исследованиях и политике с широким бесплатным освещением пандемии. Ваш не облагаемый налогом взнос играет решающую роль в поддержании этих усилий.
Science и AAAS неустанно работают над предоставлением достоверной, основанной на фактах информации о последних научных исследованиях и политике с широким бесплатным освещением пандемии. Ваш не облагаемый налогом взнос играет решающую роль в поддержании этих усилий.
границ | Количество, качество и физическая активность белков в пище — ключ к здоровому образу жизни: мышечная перспектива на протяжении всей жизни
Введение
Разработка схемы здорового питания или определение лучших сочетаний продуктов и количеств для включения в рацион важны для поддержки физической работоспособности, контроля веса и снижения риска заболеваний.Что касается продуктов, содержащих белок, качество и количество белка являются двумя основными факторами при формировании здорового образа питания независимо от возраста. Качество пищевого белка традиционно зависит от содержания в нем аминокислот и доступности этих аминокислот в кровотоке — факторов, которые могут влиять на их метаболизм в различных пулах белков организма. Следовательно, качество протеина часто основывается на методах ранжирования усвояемости протеина, таких как оценка аминокислот с поправкой на усвояемость протеина (PDCAAS) или оценка усвояемых незаменимых аминокислот (DIAAS), как будет подчеркнуто ниже.Последний метод получил признание Продовольственной и сельскохозяйственной организации Объединенных Наций (ФАО) после последнего обзора «лучших» методов определения качества белка для питания человека (1).
Качество пищевого белка традиционно зависит от содержания в нем аминокислот и доступности этих аминокислот в кровотоке — факторов, которые могут влиять на их метаболизм в различных пулах белков организма. Следовательно, качество протеина часто основывается на методах ранжирования усвояемости протеина, таких как оценка аминокислот с поправкой на усвояемость протеина (PDCAAS) или оценка усвояемых незаменимых аминокислот (DIAAS), как будет подчеркнуто ниже.Последний метод получил признание Продовольственной и сельскохозяйственной организации Объединенных Наций (ФАО) после последнего обзора «лучших» методов определения качества белка для питания человека (1).
Независимо от метода, используемого для измерения усвояемости белка в продуктах питания человека (1), также важно учитывать показатели оценки усвояемости белка с другими соответствующими метаболическими процессами человека (2), такими как способность влиять на обмен белка (т. Е. Синтез и деградация) белков организма.Учитывая, что основная роль пищевых аминокислот заключается в поддержании метаболической потребности в белке и покрытии обязательных потерь белка (3), возможно, важно рассмотреть возможность сочетания методов оценки усвояемости белка с прямыми измерениями скорости синтеза белка (например, в скелетных мышцах) и в целом. скорость окисления аминокислот в организме. Например, аминокислоты могут «храниться» только в функциональных белках, которые, учитывая их размер и чувствительность к питательным веществам, позиционируют белок скелетных мышц как основной резервуар для пищевых аминокислот (4).Таким образом, подтверждение того, что потребляемая белковая пища стимулирует постпрандиальный синтез мышечного белка без чрезмерной скорости окисления аминокислот, дает подтверждение того, что доступные диетические аминокислоты в обращении используются для поддержки этой жизненно важной ткани.
скорость окисления аминокислот в организме. Например, аминокислоты могут «храниться» только в функциональных белках, которые, учитывая их размер и чувствительность к питательным веществам, позиционируют белок скелетных мышц как основной резервуар для пищевых аминокислот (4).Таким образом, подтверждение того, что потребляемая белковая пища стимулирует постпрандиальный синтез мышечного белка без чрезмерной скорости окисления аминокислот, дает подтверждение того, что доступные диетические аминокислоты в обращении используются для поддержки этой жизненно важной ткани.
Потребность в белке установлена как минимальная потребность для предотвращения чистых потерь азота, но, возможно, недостаточна для учета всех факторов, влияющих на качество жизни на протяжении всей жизни (например, привычки к упражнениям, старение, госпитализация или болезнь) (5).Таким образом, это послужило толчком к изменениям для лучшего определения «оптимального» потребления белка (5, 6). Было высказано предположение, что больше внимания уделяется скелетным мышцам, когда цель состоит в том, чтобы определить оптимальную потребность в потреблении белка, особенно на протяжении всей пожилой взрослой жизни (7). Обоснование этой идеи заключается в том, что скелетные мышцы представляют собой значительную долю общего белка тела у взрослых или являются большим хранилищем энергии и пищевых аминокислот и вносят ~ 25–30% в скорость синтеза белка в организме (8).Более того, мышцы играют очевидную роль в физической работоспособности, но метаболически они играют важную роль в регулировании утилизации глюкозы ( cf . резистентность к инсулину), окисления жиров и энергетического баланса (9). Это якобы подчеркивает, что его поддержание особенно актуально в среднем и пожилом возрасте. Однако растущая распространенность метаболических нарушений в педиатрической популяции и возможность раннего программирования мышечной ткани на более поздний этап жизни (10, 11), вероятно, переориентируют проблему оптимизации количества и качества мышц как важнейших на протяжении всей жизни.
Обоснование этой идеи заключается в том, что скелетные мышцы представляют собой значительную долю общего белка тела у взрослых или являются большим хранилищем энергии и пищевых аминокислот и вносят ~ 25–30% в скорость синтеза белка в организме (8).Более того, мышцы играют очевидную роль в физической работоспособности, но метаболически они играют важную роль в регулировании утилизации глюкозы ( cf . резистентность к инсулину), окисления жиров и энергетического баланса (9). Это якобы подчеркивает, что его поддержание особенно актуально в среднем и пожилом возрасте. Однако растущая распространенность метаболических нарушений в педиатрической популяции и возможность раннего программирования мышечной ткани на более поздний этап жизни (10, 11), вероятно, переориентируют проблему оптимизации количества и качества мышц как важнейших на протяжении всей жизни.
Поэтому в этом обзоре мы обсуждаем роль качества и количества диетического белка с точки зрения оптимизации мышечной массы от детства до старости как цели поддержания метаболического здоровья и физической работоспособности. Мы также обсуждаем, что переход к целостной структуре в области белкового питания, вероятно, необходим для точного определения оптимального потребления белка для мышц. Это включает в себя смещение акцента с определения влияния отдельных питательных веществ (или частей пищи) на метаболические результаты в пользу рассмотрения того, как интегративный целостный подход (например,(g., привычки к упражнениям, режим питания и матрица питания, в которой потребляется белок) влияет на общую рекомендацию по белку и связанные с ним метаболические результаты в мышцах.
Мы также обсуждаем, что переход к целостной структуре в области белкового питания, вероятно, необходим для точного определения оптимального потребления белка для мышц. Это включает в себя смещение акцента с определения влияния отдельных питательных веществ (или частей пищи) на метаболические результаты в пользу рассмотрения того, как интегративный целостный подход (например,(g., привычки к упражнениям, режим питания и матрица питания, в которой потребляется белок) влияет на общую рекомендацию по белку и связанные с ним метаболические результаты в мышцах.
Качество диетического протеина
Рекомендуется, чтобы режим здорового питания состоял из употребления разнообразных высококачественных белковых продуктов, чтобы обеспечить достаточный запас аминокислот для поддержания или роста безжировой массы (например, мышц) и общего качества диеты (12). Другими словами, аминокислоты, входящие в состав белковой пищи, должны соответствовать требованиям потребителя и состоять из разнообразных белковых продуктов для обеспечения плотности питательных веществ. Действительно, в диетических рекомендациях произошел сдвиг в сторону моделей питания на основе растений, чтобы предположительно максимизировать пользу для здоровья населения и поддерживать экологическую устойчивость (13). Например, эпидемиологические данные показывают, что минимизация потребления красного мяса в рамках диеты способствует снижению риска заболеваний (диабет 2 типа, сердечно-сосудистые заболевания и т. Д.) (14, 15). Однако эти данные сложно интерпретировать, поскольку диета для сравнения часто является смешивающим фактором (например,, различные составы макроэлементов, переработанные и необработанные, или различные процентные содержания жира в потребляемом мясе) (16) и / или отсутствие контроля над моделями физической активности участников. Также уместно подчеркнуть, что определение потребления белка на основе очень общих определений, таких как «эквиваленты унций», как это предусмотрено в документе «Выбери мою тарелку» Министерства сельского хозяйства США, не учитывает значения показателей качества белка и калорий, необходимых для удовлетворения минимальных потребностей в незаменимых аминокислотах между животное vs.
Действительно, в диетических рекомендациях произошел сдвиг в сторону моделей питания на основе растений, чтобы предположительно максимизировать пользу для здоровья населения и поддерживать экологическую устойчивость (13). Например, эпидемиологические данные показывают, что минимизация потребления красного мяса в рамках диеты способствует снижению риска заболеваний (диабет 2 типа, сердечно-сосудистые заболевания и т. Д.) (14, 15). Однако эти данные сложно интерпретировать, поскольку диета для сравнения часто является смешивающим фактором (например,, различные составы макроэлементов, переработанные и необработанные, или различные процентные содержания жира в потребляемом мясе) (16) и / или отсутствие контроля над моделями физической активности участников. Также уместно подчеркнуть, что определение потребления белка на основе очень общих определений, таких как «эквиваленты унций», как это предусмотрено в документе «Выбери мою тарелку» Министерства сельского хозяйства США, не учитывает значения показателей качества белка и калорий, необходимых для удовлетворения минимальных потребностей в незаменимых аминокислотах между животное vs. растительные продукты, как указано в другом месте (17).
растительные продукты, как указано в другом месте (17).
Роль качества пищевого белка также, возможно, важна при определении более рациональных диет для удовлетворения потребностей в питании растущего населения мира (18). Защита планеты (т. Е. Управление выбросами парниковых газов при использовании земли и воды) и обеспечение устойчивого образа жизни также являются важными темами при рассмотрении качества пищевого белка (19). Таким образом, очевидно, что необходим ряд методов для оценки качества протеина, чтобы отразить заявление о «высоком» качестве пищевых продуктов в зависимости от желаемого физиологического результата.Это также должно быть сбалансировано с учетом потенциального воздействия на окружающую среду и важности максимального использования природных ресурсов для производства высококачественных белков, которые обеспечивают заданные количества незаменимых аминокислот для поддержания или роста мышечной массы (19).
DIAAS — это текущий метод ранжирования качества протеина, рекомендованный Продовольственной и сельскохозяйственной организацией Объединенных Наций (ФАО) (20).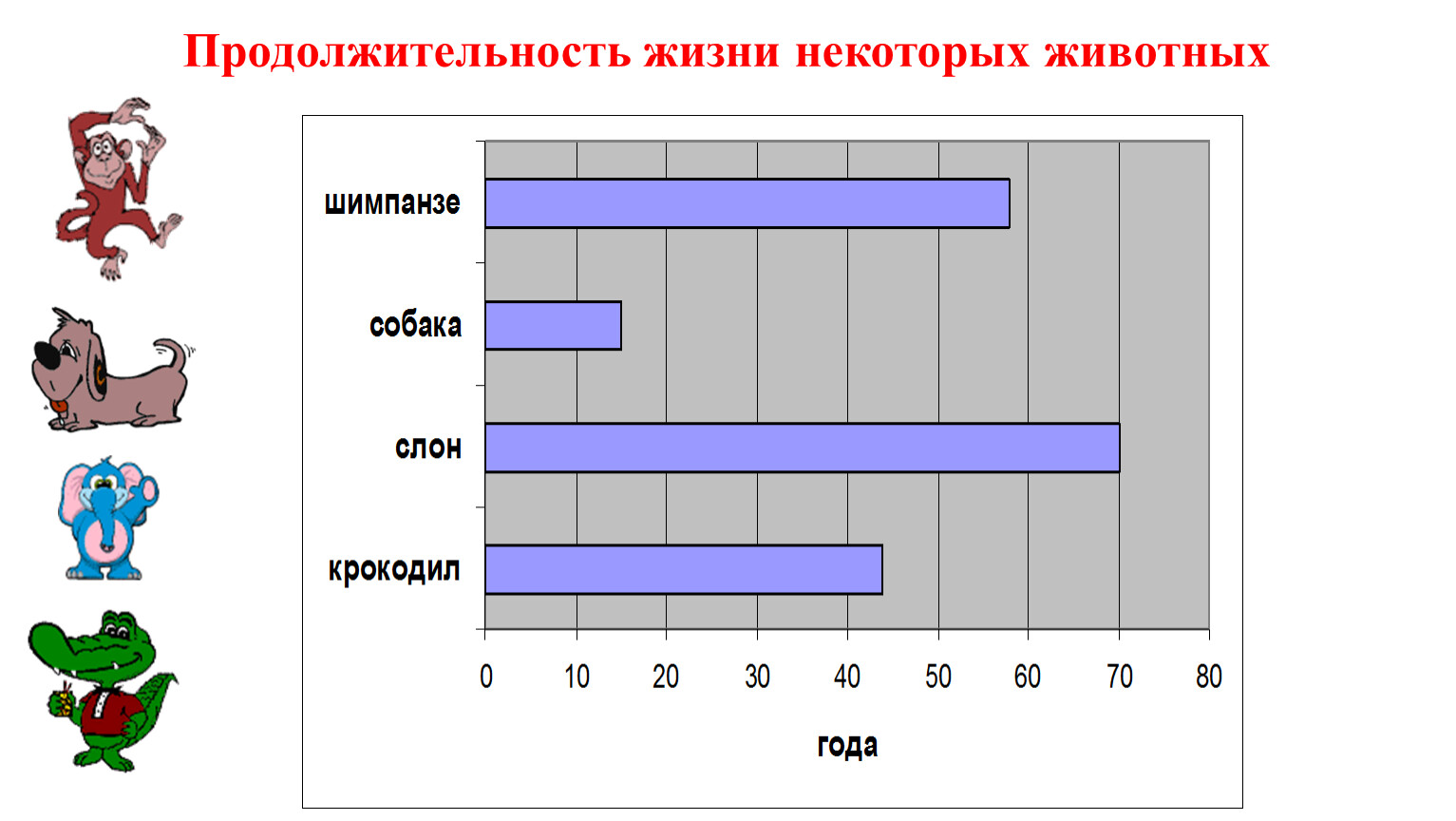 Обоснование этой рекомендации состоит в том, что оценки усвояемости (качества) белка должны основываться на истинной перевариваемости подвздошной кишки (т.е., определяется в конце тонкого кишечника, где абсорбируются аминокислоты) и идеально выполняется у людей. Таким образом, этот метод направлен на определение того, какие аминокислоты могут ограничивать циркуляцию после учета переваривания и всасывания для поддержки метаболизма белков в организме. Однако нереально выполнять повседневную перевариваемость подвздошной кишки у людей. Следовательно, модель растущей свиньи часто используется из-за сходства между пищеварительным трактом свиней и людей и готовности свиней есть продукты, входящие в рацион человека (21).Пороговые значения DIAAS были предложены в качестве основы для заявлений о качестве протеина с учетом количества потребленного протеина, например, отличное / высокое (100 или более), хорошее (22–46) и отсутствие заявлений (<75 ) (20).
Обоснование этой рекомендации состоит в том, что оценки усвояемости (качества) белка должны основываться на истинной перевариваемости подвздошной кишки (т.е., определяется в конце тонкого кишечника, где абсорбируются аминокислоты) и идеально выполняется у людей. Таким образом, этот метод направлен на определение того, какие аминокислоты могут ограничивать циркуляцию после учета переваривания и всасывания для поддержки метаболизма белков в организме. Однако нереально выполнять повседневную перевариваемость подвздошной кишки у людей. Следовательно, модель растущей свиньи часто используется из-за сходства между пищеварительным трактом свиней и людей и готовности свиней есть продукты, входящие в рацион человека (21).Пороговые значения DIAAS были предложены в качестве основы для заявлений о качестве протеина с учетом количества потребленного протеина, например, отличное / высокое (100 или более), хорошее (22–46) и отсутствие заявлений (<75 ) (20).
Большая часть работы DIAAS была проделана в отношении сырых пищевых продуктов, а в недавних исследованиях основное внимание уделялось тому, как метод приготовления влияет на качество пищевого белка (47). Это актуально, так как многие из обычно потребляемых белковых продуктов в рационе человека проходят термическую обработку перед употреблением, что может повлиять на содержание в них аминокислот и общее качество питания (48).Как показано в Таблице 1, было установлено, что метод приготовления (т.е. сырое, вареное, жареное, жареное или жареное) мяса влияет на его структурные свойства и последующий DIAAS (47). Общепринято, что приготовление пищи (внутренняя температура 70 ° C) увеличивает перевариваемость белка за счет денатурирования белка и, таким образом, обеспечивает большую биодоступность протеолитических ферментов к сайтам его расщепления (47, 53). Однако было продемонстрировано, что DIAAS превосходил условия сырого, вареного и обжаренного говяжьего фарша по сравнению с жареной или жареной говядиной у растущих свиней (47).В совокупности эти данные подчеркивают, что пищевой матрицей, например структурой пищи, можно управлять с помощью тепловой обработки для изменения показателей качества белка.
Это актуально, так как многие из обычно потребляемых белковых продуктов в рационе человека проходят термическую обработку перед употреблением, что может повлиять на содержание в них аминокислот и общее качество питания (48).Как показано в Таблице 1, было установлено, что метод приготовления (т.е. сырое, вареное, жареное, жареное или жареное) мяса влияет на его структурные свойства и последующий DIAAS (47). Общепринято, что приготовление пищи (внутренняя температура 70 ° C) увеличивает перевариваемость белка за счет денатурирования белка и, таким образом, обеспечивает большую биодоступность протеолитических ферментов к сайтам его расщепления (47, 53). Однако было продемонстрировано, что DIAAS превосходил условия сырого, вареного и обжаренного говяжьего фарша по сравнению с жареной или жареной говядиной у растущих свиней (47).В совокупности эти данные подчеркивают, что пищевой матрицей, например структурой пищи, можно управлять с помощью тепловой обработки для изменения показателей качества белка.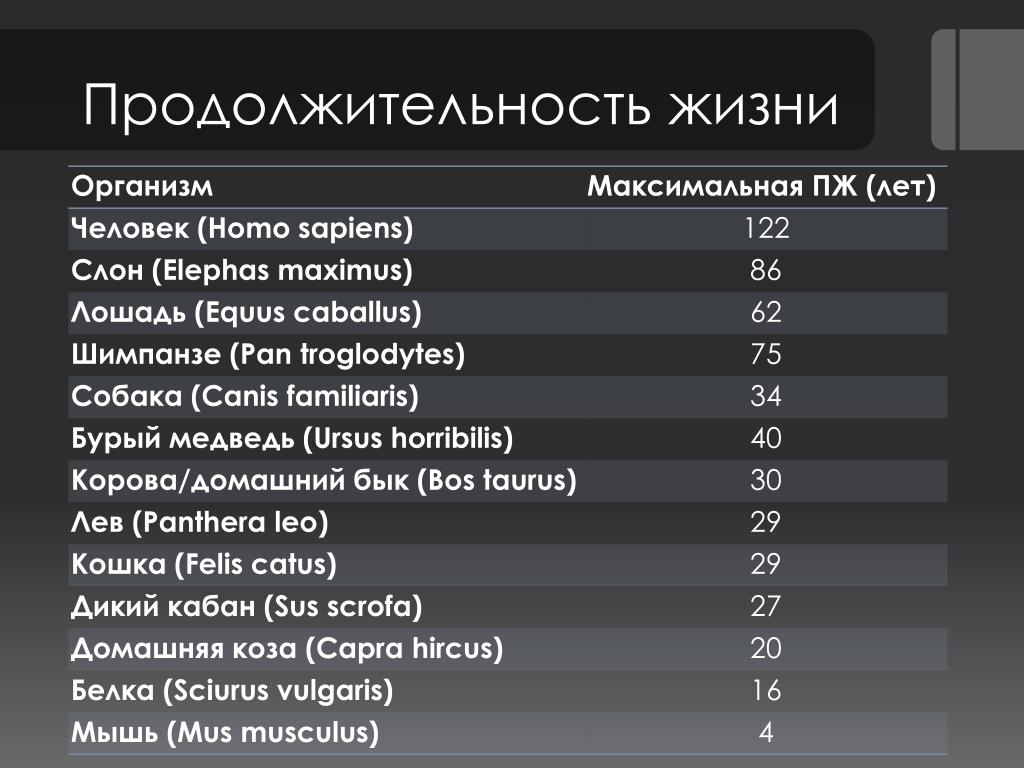 Однако важно помнить, что жесткая термическая обработка или длительное хранение может повлиять на пищевую ценность аминокислот (например, лизина) (54).
Однако важно помнить, что жесткая термическая обработка или длительное хранение может повлиять на пищевую ценность аминокислот (например, лизина) (54).
Таблица 1 . Метод приготовления и его влияние на показатели качества белка.
Безусловно, в течение дня чаще употребляют смешанные блюда, а не отдельные нутриенты, и поэтому важно иметь оценки качества протеина в контексте смешанных продуктов / ингредиентов, чтобы лучше информировать различные нормативные системы питания (55). .Проблема с этим подходом, ориентированным на продукты питания, может заключаться в выявлении, не говоря уже о тестировании, множества комбинаций различных продуктов питания для оценки взаимодействий между продуктами питания и ингредиентами. Тем не менее, исследования начали решать эту проблему за счет сочетания одновременного приема макроэлементов. Например, с точки зрения перевариваемости белка было установлено, что совместное употребление липидов с белком улучшает перевариваемость / качество белка у растущих свиней за счет замедления скорости опорожнения желудка, чтобы дать потребляемому белку больше времени для воздействия протеолитических ферментов и / или уменьшение скорости прохождения через тонкий кишечник, чтобы дать аминокислотам больше времени для всасывания (56).
Примечательно, однако, то, что исследователи разработали инструменты для оценки качества источников пищевого белка с целью поддержки ремоделирования белков всего тела и мышц. В частности, пищевые белки с внутренней меткой, посредством которых стабильные изотопные индикаторы включаются в белковую матрицу, более легко применяются в модели человека, чтобы обеспечить индекс перевариваемости белка и последующую доступность пищевых аминокислот после приема пищи (57-59). Используя подход с использованием маркированного пищевого белка, было установлено, что совместный прием макронутриентов с изолированными источниками белка модулирует доступность аминокислот, полученных из белка после приема пищи, в кровообращении, но не стимуляцию скорости синтеза мышечных белков после приема пищи у здоровых взрослых (60, 61). .Это подчеркивает потенциальное несоответствие между способностью аминокислот, полученных из белка после приема пищи, в кровотоке и последующим ответом на синтез мышечного белка после приема пищи, который в противном случае можно было бы пропустить без метаболического индикатора, который можно отслеживать ото рта к мышце (60–63). Эти результаты подтверждают идею о том, что показатели качества белка необходимо сочетать с другими физиологическими коррелятами (например, обменом белка), чтобы лучше определить влияние белковой пищи с более «общечеловеческой» точки зрения.Это, в свою очередь, поможет информировать о режимах здорового питания и разработать эффективные сообщения общественного здравоохранения для достижения цели оптимизации мышечной массы и здоровья (2).
Эти результаты подтверждают идею о том, что показатели качества белка необходимо сочетать с другими физиологическими коррелятами (например, обменом белка), чтобы лучше определить влияние белковой пищи с более «общечеловеческой» точки зрения.Это, в свою очередь, поможет информировать о режимах здорового питания и разработать эффективные сообщения общественного здравоохранения для достижения цели оптимизации мышечной массы и здоровья (2).
Определение оптимального и рекомендуемого потребления белка
Текущие рекомендации по белку, как это определено рекомендуемой диетой (RDA) или эталонным потреблением населения (PRI) на протяжении всей жизни, показаны в таблице 2. Рекомендации по белку установлены как самый низкий уровень потребления белка, чтобы предотвратить чистую потерю азота и сократить риск заболевания почти у всех (97–98%) здоровых людей при энергетическом балансе (64).Однако эти рекомендации по белкам могут быть неоптимальными для удовлетворения метаболических потребностей очень активных людей, таких как люди, тренированные на силу (65) и выносливость (66). Однако это не совсем удивительно, учитывая, что потребности в белке предназначены для предотвращения дефицита белка, что особенно актуально для детей и взрослых в развивающихся странах, но не столь актуально для более развитых стран (67). Следовательно, образ жизни и цели данной группы населения (например, спортивные результаты, рост / поддержание мышечной массы, функциональная независимость и т. Д.) необходимо учитывать при определении минимального и оптимального потребления белка.
Однако это не совсем удивительно, учитывая, что потребности в белке предназначены для предотвращения дефицита белка, что особенно актуально для детей и взрослых в развивающихся странах, но не столь актуально для более развитых стран (67). Следовательно, образ жизни и цели данной группы населения (например, спортивные результаты, рост / поддержание мышечной массы, функциональная независимость и т. Д.) необходимо учитывать при определении минимального и оптимального потребления белка.
Таблица 2 . Рекомендации по потреблению протеина на протяжении всей жизни в соответствии с рекомендуемой диетой (RDA), эталонными потребностями населения (PRI) или рекомендациями, основанными на еде, ориентированной на мышцы.
«Лучший» метод определения оптимального потребления белка, безусловно, является предметом дискуссий (68–70) и будет зависеть от исследуемой популяции (например, детей или взрослых). Методы стабильных изотопных индикаторов, такие как индикаторное окисление аминокислот (IAAO) или методы прямого включения для определения синтеза мышечного белка, показали свою полезность для определения рекомендаций по белку для разных возрастов и в зависимости от условий физических упражнений (71–74) . Мы считаем, что изучение потребностей в питательных веществах в контексте физических упражнений должно быть более предметным, поскольку повышение уровня физической активности, в том числе включение структурированных режимов упражнений, несомненно, является одним из наиболее важных стилей образа жизни для улучшения здоровья (75) и, возможно, наш генетический «эволюционный дефолт», поскольку мы рождены, чтобы двигаться. Важно отметить, что упражнения также напрямую влияют на усвоение питательных веществ и потребность в них по сравнению с сидячим состоянием. Следовательно, рекомендации по питанию и физическим упражнениям неразрывно связаны и должны рассматриваться вместе, когда цель состоит в том, чтобы определить «оптимальное» потребление белка для улучшения здоровья.
Мы считаем, что изучение потребностей в питательных веществах в контексте физических упражнений должно быть более предметным, поскольку повышение уровня физической активности, в том числе включение структурированных режимов упражнений, несомненно, является одним из наиболее важных стилей образа жизни для улучшения здоровья (75) и, возможно, наш генетический «эволюционный дефолт», поскольку мы рождены, чтобы двигаться. Важно отметить, что упражнения также напрямую влияют на усвоение питательных веществ и потребность в них по сравнению с сидячим состоянием. Следовательно, рекомендации по питанию и физическим упражнениям неразрывно связаны и должны рассматриваться вместе, когда цель состоит в том, чтобы определить «оптимальное» потребление белка для улучшения здоровья.
Важно отметить, что режим упражнений (силовые упражнения против упражнений на выносливость) напрямую влияет на метаболизм диетического белка на уровне всего тела и мышц (рис. 1). Например, упражнения с отягощениями по своей сути являются анаболическими благодаря улучшению баланса чистого мышечного белка (определяемого как синтез мышечного белка за вычетом его распада) на срок до 2 дней (78). Более того, выполнение упражнений с отягощениями приводит к большему использованию пищевых аминокислот для стимуляции скорости синтеза мышечного белка после приема пищи в течение ближайшего (0–4 часа) (71, 79) и длительного периода восстановления (~ 24 часа) (76, 80).Другими словами, потребление 10 г незаменимых аминокислот (что эквивалентно ~ 25 г высококачественного протеина) необходимо для максимального увеличения дозозависимости потребляемого протеина от скорости синтеза мышечного протеина в сидячем состоянии (81). Однако сразу после тренировки требуется прием ~ 8,6 г незаменимых аминокислот (что эквивалентно ~ 20 г высококачественного протеина), чтобы стабилизировать постпрандиальный синтетический ответ мышечного протеина (71). Это означает, что упражнения с отягощениями повышают чувствительность к аминокислотам в пище при синтезе мышечного белка, так что для достижения сильного анаболического эффекта требуется меньшее количество белка по сравнению с сидячим состоянием.Точно так же было установлено, что ткань скелетных мышц становится большим «стоком» для пищевых аминокислот во время восстановления после упражнений с отягощениями, о чем свидетельствует повышенное включение диетического фенилаланина в мышечный белок по сравнению с сидячим состоянием (82).
Более того, выполнение упражнений с отягощениями приводит к большему использованию пищевых аминокислот для стимуляции скорости синтеза мышечного белка после приема пищи в течение ближайшего (0–4 часа) (71, 79) и длительного периода восстановления (~ 24 часа) (76, 80).Другими словами, потребление 10 г незаменимых аминокислот (что эквивалентно ~ 25 г высококачественного протеина) необходимо для максимального увеличения дозозависимости потребляемого протеина от скорости синтеза мышечного протеина в сидячем состоянии (81). Однако сразу после тренировки требуется прием ~ 8,6 г незаменимых аминокислот (что эквивалентно ~ 20 г высококачественного протеина), чтобы стабилизировать постпрандиальный синтетический ответ мышечного протеина (71). Это означает, что упражнения с отягощениями повышают чувствительность к аминокислотам в пище при синтезе мышечного белка, так что для достижения сильного анаболического эффекта требуется меньшее количество белка по сравнению с сидячим состоянием.Точно так же было установлено, что ткань скелетных мышц становится большим «стоком» для пищевых аминокислот во время восстановления после упражнений с отягощениями, о чем свидетельствует повышенное включение диетического фенилаланина в мышечный белок по сравнению с сидячим состоянием (82). Наконец, регулярные силовые тренировки приводят к увеличению удержания азота во всем теле по сравнению с нетренированным состоянием (83). Принимая во внимание эти факторы, кажется, что большее соотношение циркулирующих аминокислот сохраняется в самом большом пуле белка в организме (скелетных мышцах) как при голодании, так и при сытости после упражнений с отягощениями.Такие данные свидетельствуют о том, что регулярные силовые тренировки — это стратегия оптимизации использования белков с пищей (рис. 1).
Наконец, регулярные силовые тренировки приводят к увеличению удержания азота во всем теле по сравнению с нетренированным состоянием (83). Принимая во внимание эти факторы, кажется, что большее соотношение циркулирующих аминокислот сохраняется в самом большом пуле белка в организме (скелетных мышцах) как при голодании, так и при сытости после упражнений с отягощениями.Такие данные свидетельствуют о том, что регулярные силовые тренировки — это стратегия оптимизации использования белков с пищей (рис. 1).
Рисунок 1 . Употребление достаточного количества белка в состоянии покоя (т. Е. В отсутствие предшествующей физической нагрузки) обычно приводит к удвоению синтетической реакции миофибриллярного (сократительного) белка по сравнению с пост-абсорбционными значениями у здоровых молодых людей (20–35 лет). По сути, анаболическая природа упражнений с отягощениями приводит к взаимодействию между кормлением и физической нагрузкой во время восстановления, так что стимуляция скорости синтеза миофибриллярного белка после приема пищи усиливается по сравнению с уровнем покоя. Это взаимодействие по стимуляции скорости синтеза миофибриллярного белка после тренировки не наблюдается во время восстановления после упражнений на выносливость (бег на беговой дорожке с 70% пика VO2 в течение 1 часа). Данные адаптированы из Burd et al. (76) и Abou Sawan et al. (77). * отличается от постабсорбтивного значения в состоянии покоя. † отличается от постпрандиального значения в покое.
Это взаимодействие по стимуляции скорости синтеза миофибриллярного белка после тренировки не наблюдается во время восстановления после упражнений на выносливость (бег на беговой дорожке с 70% пика VO2 в течение 1 часа). Данные адаптированы из Burd et al. (76) и Abou Sawan et al. (77). * отличается от постабсорбтивного значения в состоянии покоя. † отличается от постпрандиального значения в покое.
Интересно, что упражнения на выносливость, по-видимому, находятся на другом конце спектра с точки зрения их влияния на использование белка с пищей. Окисление эндогенных аминокислот может составлять лишь часть общего запаса энергии во время упражнений (~ 2–10% в зависимости от наличия углеводов), но их использование увеличивается с увеличением интенсивности (84) и продолжительности упражнений на выносливость (85, 86).Например, оценки скорости окисления лейцина во время упражнений средней интенсивности (~ 60% от максимального потребления кислорода; VO2max) составляют ~ 8 мг / (кг · ч) (87) со скоростью, увеличивающейся до ~ 10 мг / (кг · ч) при более высокая интенсивность (~ 70% VO2max) (88) у спортсменов, тренированных на выносливость. Это может привести к общей потере лейцина до ~ 1,5 г за 2 часа (89). Действительно, регулярные тренировки на выносливость подавляют вызванную упражнениями стимуляцию скорости окисления лейцина (90), и было показано, что на 24-часовой чистый баланс лейцина не влияет резкая езда на велосипеде, выполняемая дважды в день (~ 50% VO2max в течение 90 минут). за сеанс) (91).Таким образом, можно предположить, что происходит аккомодация диетического белка, тем самым сводя к минимуму дополнительную потребность в диетическом белке при тренировках на выносливость (89).
Это может привести к общей потере лейцина до ~ 1,5 г за 2 часа (89). Действительно, регулярные тренировки на выносливость подавляют вызванную упражнениями стимуляцию скорости окисления лейцина (90), и было показано, что на 24-часовой чистый баланс лейцина не влияет резкая езда на велосипеде, выполняемая дважды в день (~ 50% VO2max в течение 90 минут). за сеанс) (91).Таким образом, можно предположить, что происходит аккомодация диетического белка, тем самым сводя к минимуму дополнительную потребность в диетическом белке при тренировках на выносливость (89).
Однако наши исследовательские группы недавно показали, что 1 час работы на беговой дорожке с пиковым уровнем VO2 70% приводит к стимуляции скорости окисления лейцина и чистому балансу лейцина, который был более отрицательным по сравнению с состоянием покоя у спортсменов (88). Примечательно, что чистый баланс лейцина оставался отрицательным в течение всего постпрандиального периода, даже если спортсменам давали большое количество высококачественного белка (18 г цельного яичного белка) сразу после острого приступа (88).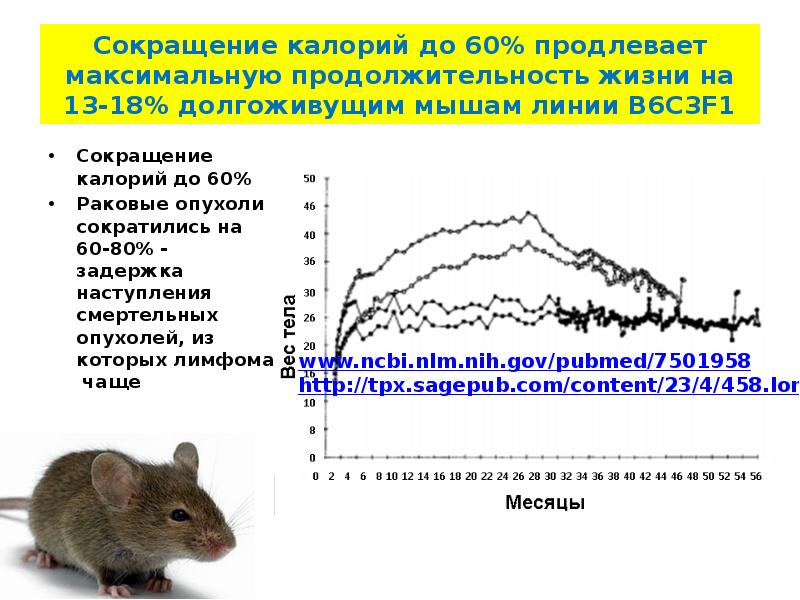 Также не наблюдалось аддитивного влияния питания и упражнений на выносливость на стимуляцию скорости синтеза мышечного белка после тренировки у этих спортсменов (рис.1) (77), что является отличительной чертой синтетического ответа мышечного белка во время восстановления после упражнений с отягощениями в сочетании с кормление (71). Эти результаты значительны (77, 88), поскольку мы предоставили количество белка (~ 0,25 г белка / кг на один прием пищи) сразу после тренировки на острую выносливость, которое обычно рекомендуется для максимальной стимуляции скорости синтеза мышечного белка после тренировки после сопротивления. упражнение (71).Следовательно, мы предполагаем, что упражнения на выносливость предъявляют больше требований к диетическому белку, который, вероятно, зависит от интенсивности и продолжительности упражнений, из-за необходимости компенсировать вызванные упражнениями потери окисления аминокислот, а также поддерживать ремоделирование мышечного белка в процессе восстановления по сравнению с упражнениями с отягощениями.
Также не наблюдалось аддитивного влияния питания и упражнений на выносливость на стимуляцию скорости синтеза мышечного белка после тренировки у этих спортсменов (рис.1) (77), что является отличительной чертой синтетического ответа мышечного белка во время восстановления после упражнений с отягощениями в сочетании с кормление (71). Эти результаты значительны (77, 88), поскольку мы предоставили количество белка (~ 0,25 г белка / кг на один прием пищи) сразу после тренировки на острую выносливость, которое обычно рекомендуется для максимальной стимуляции скорости синтеза мышечного белка после тренировки после сопротивления. упражнение (71).Следовательно, мы предполагаем, что упражнения на выносливость предъявляют больше требований к диетическому белку, который, вероятно, зависит от интенсивности и продолжительности упражнений, из-за необходимости компенсировать вызванные упражнениями потери окисления аминокислот, а также поддерживать ремоделирование мышечного белка в процессе восстановления по сравнению с упражнениями с отягощениями. . Эти концепции могут быть подтверждены недавними оценками увеличения суточной потребности в белке (потенциально в первую очередь за счет аминокислот с разветвленной цепью, которые предпочтительно окисляются во время упражнений) для оптимизации анаболизма сытости всего тела у тренированных на выносливость спортсменов во время восстановления (92, 93).В целом, рекомендации по белку для физически активных взрослых, вероятно, более детализированы, так как «оптимальное» количество потребляемого белка должно учитывать режим упражнений, интенсивность, продолжительность и / или цели в отношении здоровья / производительности в рамках рекомендации. Это понятие согласуется с периодическими схемами питания для углеводов, которые обычно рекомендуются для оптимизации тренировочных предписаний и адаптации, особенно для спортсменов (94).
. Эти концепции могут быть подтверждены недавними оценками увеличения суточной потребности в белке (потенциально в первую очередь за счет аминокислот с разветвленной цепью, которые предпочтительно окисляются во время упражнений) для оптимизации анаболизма сытости всего тела у тренированных на выносливость спортсменов во время восстановления (92, 93).В целом, рекомендации по белку для физически активных взрослых, вероятно, более детализированы, так как «оптимальное» количество потребляемого белка должно учитывать режим упражнений, интенсивность, продолжительность и / или цели в отношении здоровья / производительности в рамках рекомендации. Это понятие согласуется с периодическими схемами питания для углеводов, которые обычно рекомендуются для оптимизации тренировочных предписаний и адаптации, особенно для спортсменов (94).
Наконец, также важно осознавать, что назначение потребности в белке в виде единой суточной нормы, как показано в таблице 2, вероятно, затемняет важность распределения белка и частоты приема пищи для оптимизации постпрандиального синтетического ответа мышечного белка в течение дня (95, 96) .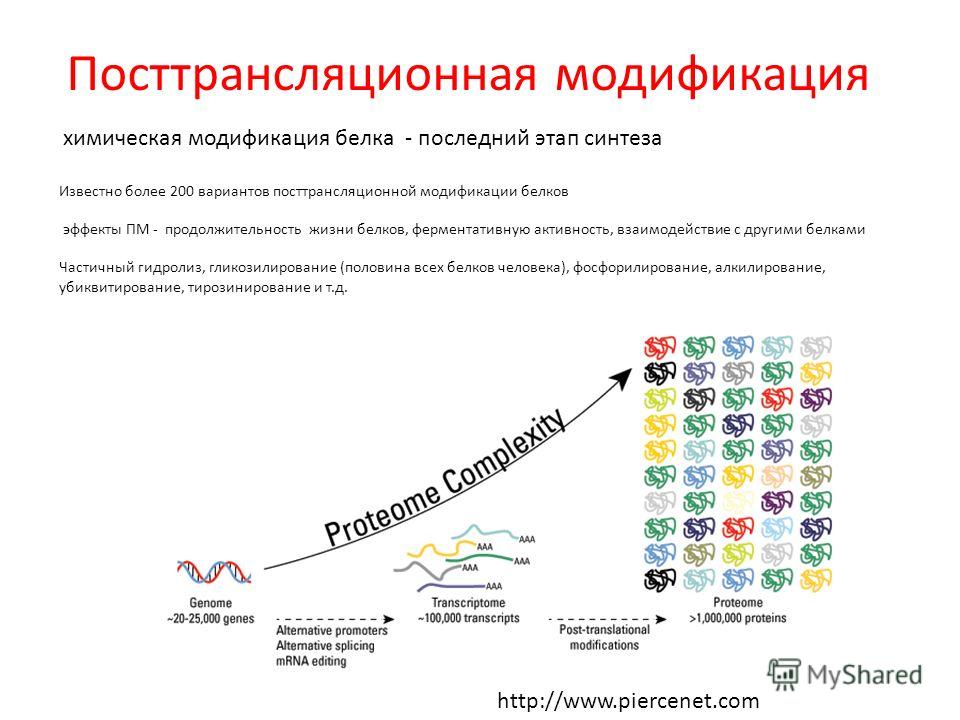 Короче говоря, диетические рекомендации признают здоровое питание с точки зрения плотности и достаточности питательных веществ, но в настоящее время не учитывают частоту приема пищи. Например, взрослые, особенно американцы, часто искажают общее потребление белка на ужин с меньшими порциями белка, потребляемыми на завтрак и обед (96). Вопреки предположениям о том, что не существует практического максимального анаболического ответа на потребление пищевого белка (97), очевидно, что синтез мышечного белка (71) и чистый белковый баланс всего тела (73) имеют ограниченную способность усваивать пищевые аминокислоты.Это, в конечном итоге, приведет к необратимой потере диетических аминокислот в результате окисления, в отличие от их использования для наращивания мышечного белка после еды за ужином при несбалансированном суточном распределении белка (71, 96). Таким образом, при определении оптимального потребления белка необходимо учитывать частоту приема пищи и давать рекомендации для каждого приема пищи, чтобы учесть распределение белка как важный фактор для стимуляции постпрандиального синтеза мышечного белка в течение дня.
Короче говоря, диетические рекомендации признают здоровое питание с точки зрения плотности и достаточности питательных веществ, но в настоящее время не учитывают частоту приема пищи. Например, взрослые, особенно американцы, часто искажают общее потребление белка на ужин с меньшими порциями белка, потребляемыми на завтрак и обед (96). Вопреки предположениям о том, что не существует практического максимального анаболического ответа на потребление пищевого белка (97), очевидно, что синтез мышечного белка (71) и чистый белковый баланс всего тела (73) имеют ограниченную способность усваивать пищевые аминокислоты.Это, в конечном итоге, приведет к необратимой потере диетических аминокислот в результате окисления, в отличие от их использования для наращивания мышечного белка после еды за ужином при несбалансированном суточном распределении белка (71, 96). Таким образом, при определении оптимального потребления белка необходимо учитывать частоту приема пищи и давать рекомендации для каждого приема пищи, чтобы учесть распределение белка как важный фактор для стимуляции постпрандиального синтеза мышечного белка в течение дня.
Рекомендации по употреблению белков для детей и подростков
Развитие мышечной массы в детстве и подростковом возрасте важно для поддержания метаболизма и здоровья скелета. Приверженность к активному образу жизни связана с большей безжировой массой тела и мышечной массой по всему спектру роста (98) и из-за механических сил, которые мышцы могут оказывать на растущие кости, может быть независимым предиктором пиковой костной массы (99, 100). При условии, что потребление энергии является достаточным для поддержания активного образа жизни и метаболической потребности в соматическом росте, диетический белок, возможно, представляет собой наиболее важный макроэлемент для роста и развития мышечной массы.
Общие потребности в белке на ~ 20–60% выше у детей и подростков, чем минимальная безопасная доза для взрослых, чтобы учесть метаболические потребности линейного и ускоренного, соответственно, роста этих молодых популяций (101–103). В настоящее время RDA, полученная по азотному балансу, составляет 0,95 г / кг / день, а PRI — 0,90 г / кг / день и основывается в основном на данных взрослого населения с предполагаемой потребностью в росте (определяемой факторным методом) (102 ). Напротив, современные методы на основе стабильных изотопов (т.например, индикатор окисления аминокислот) предполагают, что потребность в максимальном синтезе белка в организме (в качестве показателя для компенсации любой потери белка в состоянии натощак) может достигать 1,5 г / кг / день (103). Тем не менее, при потреблении белка на уровне ~ 15% от энергии эти рекомендуемые уровни потребления обычно удовлетворяются в США, когда общее потребление энергии является достаточным (22). Более того, учет качества белка и индивидуальных потребностей детей в аминокислотах вряд ли станет проблемой при употреблении типичной смешанной белковой диеты (т.е., растительный и животный белок) на текущих уровнях (23). Важно отметить, что независимо от метода (например, азотного баланса по сравнению с IAAO) предварительные исследования показывают, что, как и у взрослых, потребности в белке у активных детей и подростков могут быть (~ 50%) повышены, хотя и относительно меньше, чем у таких же активных. взрослые (10).
Напротив, современные методы на основе стабильных изотопов (т.например, индикатор окисления аминокислот) предполагают, что потребность в максимальном синтезе белка в организме (в качестве показателя для компенсации любой потери белка в состоянии натощак) может достигать 1,5 г / кг / день (103). Тем не менее, при потреблении белка на уровне ~ 15% от энергии эти рекомендуемые уровни потребления обычно удовлетворяются в США, когда общее потребление энергии является достаточным (22). Более того, учет качества белка и индивидуальных потребностей детей в аминокислотах вряд ли станет проблемой при употреблении типичной смешанной белковой диеты (т.е., растительный и животный белок) на текущих уровнях (23). Важно отметить, что независимо от метода (например, азотного баланса по сравнению с IAAO) предварительные исследования показывают, что, как и у взрослых, потребности в белке у активных детей и подростков могут быть (~ 50%) повышены, хотя и относительно меньше, чем у таких же активных. взрослые (10). Эта повышенная суточная потребность может быть связана с необходимостью компенсировать любые потери, вызванные физическими упражнениями, и / или поддерживать повышенные темпы обновления и / или роста безжировой массы тела (10).
Эта повышенная суточная потребность может быть связана с необходимостью компенсировать любые потери, вызванные физическими упражнениями, и / или поддерживать повышенные темпы обновления и / или роста безжировой массы тела (10).
Потребление белка с пищей у взрослых увеличивает вызванное физическими упражнениями увеличение скорости синтеза белка в скелетных мышцах и всего тела (4), последний из которых, как правило, является целевым результатом для помощи в ремоделировании и росте этой ткани у взрослых (24). В отличие от взрослых с относительно стабильным весом, у детей наблюдается рост всего тела на ~ 5 см в высоту и ~ 3 кг массы тела в год, который может ускоряться в 3 раза во время всплеска подросткового роста (98). Чтобы приспособиться к этому соматическому росту всего тела, который усиливается за счет активного образа жизни (6), возможно, более актуально оценить факторы питания, которые улучшают обмен белка во всем организме и чистый белковый баланс (т.е., суррогатный маркер острого «роста») у детей и подростков. Как и у взрослых, потребление белка после тренировки увеличивает чистый белковый баланс всего тела у детей и подростков в зависимости от дозы (25, 26, 73). Возможно, в соответствии с требованием поддерживать рост всего тела, активные дети и подростки, по-видимому, более «анаболически чувствительны» к диетическому белку, чем взрослые, поскольку чистый белковый баланс всего тела выше в этих молодых популяциях при неоптимальном (т.е., <~ 0,3 г / кг) потребление белка с пищей (10). Однако, как и у взрослых, чистый белковый баланс всего тела насыщается при потреблении белка у активных детей и подростков (26, 73). Например, скорость окисления лейцина во всем организме (оценка окисления белка) плато при приеме ~ 34 мг лейцина / кг (эквивалент ~ 0,34 г / кг высококачественного, обогащенного лейцином белка) с более высокими потреблением, что приводит к увеличению пула аминокислот в плазме (26), который представляет собой метаболический профиль, который может указывать на острый избыток питательных веществ (27).
Как и у взрослых, потребление белка после тренировки увеличивает чистый белковый баланс всего тела у детей и подростков в зависимости от дозы (25, 26, 73). Возможно, в соответствии с требованием поддерживать рост всего тела, активные дети и подростки, по-видимому, более «анаболически чувствительны» к диетическому белку, чем взрослые, поскольку чистый белковый баланс всего тела выше в этих молодых популяциях при неоптимальном (т.е., <~ 0,3 г / кг) потребление белка с пищей (10). Однако, как и у взрослых, чистый белковый баланс всего тела насыщается при потреблении белка у активных детей и подростков (26, 73). Например, скорость окисления лейцина во всем организме (оценка окисления белка) плато при приеме ~ 34 мг лейцина / кг (эквивалент ~ 0,34 г / кг высококачественного, обогащенного лейцином белка) с более высокими потреблением, что приводит к увеличению пула аминокислот в плазме (26), который представляет собой метаболический профиль, который может указывать на острый избыток питательных веществ (27). Таким образом, имеющиеся данные предполагают, что детям и подросткам следует ориентироваться на потребление белка с пищей примерно на 0,3 г / кг, чтобы максимизировать чистый белковый баланс всего тела во время восстановления после острых физических нагрузок (26, 73), потребление, которое, кстати, также было показано для максимального увеличения после тренировки. — тренировать синтез мышечного протеина у взрослых (71).
Таким образом, имеющиеся данные предполагают, что детям и подросткам следует ориентироваться на потребление белка с пищей примерно на 0,3 г / кг, чтобы максимизировать чистый белковый баланс всего тела во время восстановления после острых физических нагрузок (26, 73), потребление, которое, кстати, также было показано для максимального увеличения после тренировки. — тренировать синтез мышечного протеина у взрослых (71).
Было высказано предположение, что время и распределение потребления белка в течение дня представляют собой изменяемый фактор для оптимизации использования белка с пищей у взрослых (95).Сообщается, что, как и взрослые, дети в Соединенных Штатах потребляют асимметричный белок, при этом большая часть дневной нормы потребляется вечером (28). Принимая во внимание, что существует определенная поддержка потребления сбалансированного ежедневного распределения белка для улучшения белкового баланса у детей (29, 30), этот вывод не универсален (31). Возможно, что потребности в питательных веществах для роста у активных детей и подростков делают их более чувствительными к диетическим аминокислотам и, таким образом, меньше подвержены влиянию изменений в распределении белков. Это может быть похоже на способность упражнений с отягощениями у взрослых, которая, возможно, только параллельна «росту» в этой популяции, увеличивать чувствительность синтеза мышечного белка к диетическим аминокислотам на срок до 24 часов (76). Тем не менее, учитывая, что анаболический ответ на болюсный прием белка является насыщенным, разумный совет может заключаться в том, чтобы нацелить на повторное употребление умеренно белковой пищи, чтобы оптимизировать анаболическую эффективность ежедневного потребления белка. Однако, как и в случае со взрослыми, необходимы дополнительные исследования для определения анаболического потенциала различных источников белка независимо и в составе цельных пищевых матриц и смешанных приемов пищи.
Это может быть похоже на способность упражнений с отягощениями у взрослых, которая, возможно, только параллельна «росту» в этой популяции, увеличивать чувствительность синтеза мышечного белка к диетическим аминокислотам на срок до 24 часов (76). Тем не менее, учитывая, что анаболический ответ на болюсный прием белка является насыщенным, разумный совет может заключаться в том, чтобы нацелить на повторное употребление умеренно белковой пищи, чтобы оптимизировать анаболическую эффективность ежедневного потребления белка. Однако, как и в случае со взрослыми, необходимы дополнительные исследования для определения анаболического потенциала различных источников белка независимо и в составе цельных пищевых матриц и смешанных приемов пищи.
Рекомендации по содержанию белка с возрастом
Хорошо известно, что в более старшем возрасте происходит постепенная потеря массы и функции скелетных мышц, и что это разрушение мышц обычно сочетается с малоподвижным образом жизни (32). Например, считается, что возрастная потеря массы скелетных мышц начинается примерно в 50 лет и прогрессирует со скоростью примерно 0,8% в год (33), тогда как снижение силы, хотя и связано с потерей мышечной массы, происходит быстрее. ставка ~ 2–3% в год (34).Таким образом, когда человек достигает 70-летнего возраста, он может потерять ~ 16% своей мышечной массы и ~ 50% своей силы по сравнению с молодостью.
ставка ~ 2–3% в год (34).Таким образом, когда человек достигает 70-летнего возраста, он может потерять ~ 16% своей мышечной массы и ~ 50% своей силы по сравнению с молодостью.
Возрастное снижение общей массы скелетных мышц может быть связано с дисбалансом между синтезом мышечного белка и скоростью распада, что приводит к отрицательному балансу мышечного белка (35). Не было обнаружено заметных различий в скорости синтеза мышечного протеина после абсорбции между молодыми и пожилыми мужчинами (36, 81) и женщинами (37).Следовательно, возрастное снижение мышечной массы, как полагают, связано с притуплением постпрандиального синтетического ответа мышечного белка на прием белка по сравнению с их более молодыми аналогами (36, 38, 81). Нарушение способности стареющих мышц вызывать устойчивый постпрандиальный синтетический ответ мышечного белка на повышенную доступность пищевых аминокислот в кровообращении получило название «анаболическая резистентность» (39). В попытке преодолеть это возрастное анаболическое сопротивление скорости синтеза мышечного протеина использовались различные стратегии, такие как увеличение плотности протеина во время еды (40, 41), методы обогащения пищи, включая дополнительный лейцин в качестве анаболического триггера (42) и пищевые комбинации (60, 61). Однако наиболее многообещающей и рентабельной стратегией образа жизни для улучшения постпрандиальной реакции синтеза мышечного протеина на прием протеина в более старшем возрасте являются регулярные упражнения (82). Последний момент, которому уделяется мало внимания, — это потенциальный половой диморфизм в возрастных изменениях скорости синтеза мышечного белка в ответ на белок. Есть некоторые признаки того, что стареющие мужчины и женщины могут по-разному реагировать на пищевые стимулы (43, 44), но оба пола явно обладают анаболической устойчивостью (43).Однако в настоящее время недостаточно данных, чтобы четко определить, отличаются ли потребности пожилых женщин в белке по сравнению с мужчинами старшего возраста.
Однако наиболее многообещающей и рентабельной стратегией образа жизни для улучшения постпрандиальной реакции синтеза мышечного протеина на прием протеина в более старшем возрасте являются регулярные упражнения (82). Последний момент, которому уделяется мало внимания, — это потенциальный половой диморфизм в возрастных изменениях скорости синтеза мышечного белка в ответ на белок. Есть некоторые признаки того, что стареющие мужчины и женщины могут по-разному реагировать на пищевые стимулы (43, 44), но оба пола явно обладают анаболической устойчивостью (43).Однако в настоящее время недостаточно данных, чтобы четко определить, отличаются ли потребности пожилых женщин в белке по сравнению с мужчинами старшего возраста.
Несмотря на установленную с возрастом анаболическую резистентность, текущие потребности в белке, установленные методами азотного баланса всего тела, одинаковы на протяжении всей взрослой жизни (Таблица 2). Однако при использовании подхода к потреблению белка, ориентированного на мышцы, мы заметили, что относительное количество белка для максимизации постпрандиального синтетического ответа мышечного белка больше у пожилых мужчин по сравнению с молодыми мужчинами. В частности, мы установили, что пожилые мужчины продемонстрировали кривую зависимости от дозы потребляемого белка для скорости синтеза мышечного белка после приема пищи до ~ 0,40 г / кг за один прием пищи, что почти вдвое больше по сравнению с молодыми людьми (~ 0,24 г / кг за прием пищи). (72). При рассмотрении значения распределения потребления белка во время каждого приема пищи (например, завтрака, обеда, ужина и вечерней закуски) для максимального анаболического потенциала мышц (45, 96), кажется, что потребление белка у пожилых людей, вероятно, выше. чем текущий RDA или PRI ~ 0.8 г / кг / сут и приближается к значениям, близким к ≥1,2 г / кг / сут. Эти рекомендации подтверждаются оценками индикаторов всего тела с использованием методики окисления индикаторных аминокислот с безопасным потреблением ~ 1,25 г / кг / день для пожилых людей (т.е.> 65 лет) (46). Кроме того, потеря безжировой массы тела за 3 года является самой низкой у пожилых людей, потребляющих ≥1,2 г / кг / день (104), что в совокупности поддерживает диетический белок как изменяемый фактор риска возрастной потери мышечной массы (и мышечной массы).
В частности, мы установили, что пожилые мужчины продемонстрировали кривую зависимости от дозы потребляемого белка для скорости синтеза мышечного белка после приема пищи до ~ 0,40 г / кг за один прием пищи, что почти вдвое больше по сравнению с молодыми людьми (~ 0,24 г / кг за прием пищи). (72). При рассмотрении значения распределения потребления белка во время каждого приема пищи (например, завтрака, обеда, ужина и вечерней закуски) для максимального анаболического потенциала мышц (45, 96), кажется, что потребление белка у пожилых людей, вероятно, выше. чем текущий RDA или PRI ~ 0.8 г / кг / сут и приближается к значениям, близким к ≥1,2 г / кг / сут. Эти рекомендации подтверждаются оценками индикаторов всего тела с использованием методики окисления индикаторных аминокислот с безопасным потреблением ~ 1,25 г / кг / день для пожилых людей (т.е.> 65 лет) (46). Кроме того, потеря безжировой массы тела за 3 года является самой низкой у пожилых людей, потребляющих ≥1,2 г / кг / день (104), что в совокупности поддерживает диетический белок как изменяемый фактор риска возрастной потери мышечной массы (и мышечной массы). Тем не менее, проспективное многоцентровое рандомизированное контрольное исследование с определенным потреблением белка, охватывающим от достаточного до недостаточного, с учетом привычной активности и функциональных конечных точек (например,g., мышечная сила / масса), в конечном счете, необходим для руководства передовой практикой в рекомендациях по питанию.
Тем не менее, проспективное многоцентровое рандомизированное контрольное исследование с определенным потреблением белка, охватывающим от достаточного до недостаточного, с учетом привычной активности и функциональных конечных точек (например,g., мышечная сила / масса), в конечном счете, необходим для руководства передовой практикой в рекомендациях по питанию.
Целостный подход для лучшего определения оптимального потребления белка для мышц?
Редукционистские подходы внесли значительный вклад в понимание взаимодействия питательных веществ и мышц. Например, было установлено, что аминокислоты, полученные из пищевого белка, особенно незаменимые аминокислоты (105), в основном ответственны за стимуляцию скорости синтеза мышечного белка после приема пищи.Более того, аминокислота с разветвленной цепью, лейцин, привлекла большое внимание из-за ее двойной роли как анаболической сигнальной молекулы (106, 107), а также как субстрата для синтеза белка (108, 109). Однако с учетом общей озабоченности данной области изучения отдельных частей (то есть изолированных белков и свободных аминокислот) питания типичным восходящим образом, наш нынешний подход к пониманию питания человека, возможно, приближается к своим пределам, чтобы адекватно определить роль качества и количества протеина для мышечной массы и здоровья при полноценном питании.
Как показано на рисунке 2, целостная точка зрения предполагает, что белковое питание следует иерархической организации, где каждый уровень демонстрирует усиливающий фактор в следующем для общей рекомендации по белку (110, 112). Используя нисходящий подход, который учитывает окружающую среду (например, время года, географическое положение и устойчивые методы ведения сельского хозяйства), качество жизни (например, физическая активность / привычки к упражнениям или травмы), режим питания (например, западный, Средиземноморская, или вегетарианская), белковая пища (напр.g., говядина или киноа), чистый эффект пищевой матрицы (например, структура пищи и взаимодействие питательных веществ) и, наконец, самый основной компонент белка (например, диетические аминокислоты), поможет продвинуть область исследований и возможно, являются наиболее экологически обоснованными диетическими советами (112, 113).
Рисунок 2 . Чтобы правильно определить оптимальное потребление белка, важно рассмотреть комплексный целостный подход. Этот подход «сверху вниз» предполагает, что разные уровни добавляются к следующему для разработки рекомендаций по питанию (110, 111).Диетические модели (животные и растительные) и связанные с ними белковые продукты напрямую связаны. Белковая пища — это больше, чем сумма составляющих ее аминокислот, и чистый эффект пищевой матрицы или пищевых комбинаций (например, комплементарное сочетание белков с растительной пищей), вероятно, оказывает влияние на стимуляцию постпрандиальных синтетических реакций мышечного белка. и общее качество диеты. На самом высоком уровне важными факторами являются устойчивость пищевых продуктов, пищевые отходы и другие решения человека.На самом низком (редукционистском) уровне аминокислоты представляют собой основные строительные блоки белка и сами по себе являются анаболическими агентами (то есть инициируют синтез белка). Помимо факторов питания, достаточная физическая активность, включая регулярные структурированные упражнения, является важным компонентом здорового образа жизни и оказывает прямое влияние на использование белка и общие рекомендации по питанию.
Этот подход «сверху вниз» предполагает, что разные уровни добавляются к следующему для разработки рекомендаций по питанию (110, 111).Диетические модели (животные и растительные) и связанные с ними белковые продукты напрямую связаны. Белковая пища — это больше, чем сумма составляющих ее аминокислот, и чистый эффект пищевой матрицы или пищевых комбинаций (например, комплементарное сочетание белков с растительной пищей), вероятно, оказывает влияние на стимуляцию постпрандиальных синтетических реакций мышечного белка. и общее качество диеты. На самом высоком уровне важными факторами являются устойчивость пищевых продуктов, пищевые отходы и другие решения человека.На самом низком (редукционистском) уровне аминокислоты представляют собой основные строительные блоки белка и сами по себе являются анаболическими агентами (то есть инициируют синтез белка). Помимо факторов питания, достаточная физическая активность, включая регулярные структурированные упражнения, является важным компонентом здорового образа жизни и оказывает прямое влияние на использование белка и общие рекомендации по питанию.
На более высоких уровнях важно сначала рассмотреть структуру питания населения, поскольку диетические рекомендации состоят из моделей питания и соответствующего выбора продуктов питания для обеспечения достаточности питательных веществ и общего качества диеты.Диетические режимы питания часто адаптируются к личным предпочтениям с общими моделями, включая животные (например, в американском стиле) или растительные (например, вегетарианские) режимы питания. Действительно, часто считается, что растительные диеты хуже стимулируют постпрандиальный синтез мышечного белка (114). Продукты растительного происхождения, если рассматривать их изолированно, содержат меньше лейцина, лизина и метионина по общему содержанию аминокислот по сравнению с продуктами животного происхождения (115). Таким образом, было продемонстрировано, что прием изолята соевого протеина приводит к снижению реакции синтеза мышечного протеина после приема пищи по сравнению с приемом сывороточного протеина у здоровых молодых мужчин (116). Однако вегетарианские и веганские диеты весьма разнообразны и, как правило, состоят из употребления разнообразных растительных продуктов в течение дня, чтобы обеспечить более сбалансированный профиль незаменимых аминокислот для стимуляции постпрандиального синтеза мышечного белка (117). Однако прямых сравнений не существует в отношении способности смешанных пищевых продуктов на растительной основе увеличивать скорость синтеза мышечного белка после приема пищи по сравнению с приемом пищи животного происхождения.
Однако вегетарианские и веганские диеты весьма разнообразны и, как правило, состоят из употребления разнообразных растительных продуктов в течение дня, чтобы обеспечить более сбалансированный профиль незаменимых аминокислот для стимуляции постпрандиального синтеза мышечного белка (117). Однако прямых сравнений не существует в отношении способности смешанных пищевых продуктов на растительной основе увеличивать скорость синтеза мышечного белка после приема пищи по сравнению с приемом пищи животного происхождения.
Также важно разработать рекомендации по белку в отношении подходов к цельным продуктам питания, которые учитывают аминокислотный состав потребляемой белковой пищи, а также связанный с этим чистый эффект пищевой матрицы (118).Пищевая матрица описывает питательные и непитательные компоненты пищевых продуктов, а также их структуру и взаимодействие (113, 119). Пищевая матрица может влиять на переваривание, всасывание питательных веществ и, с точки зрения белков, содержащих пищевые матрицы, на чистое анаболическое действие на стимуляцию скорости синтеза мышечного белка (62, 120–123). Такие результаты убедительно свидетельствуют о том, что внутри пищевой матрицы происходят взаимодействия, усиливающие общий анаболический эффект на мышцы, который сильнее, чем индивидуальное действие только аминокислот (118).В целом, диета состоит из продуктов, пищевых комбинаций и связанных с ними пищевых компонентов и питательных веществ. Безусловно, важно разобраться в диетических схемах и впоследствии понять, как отдельные части продуктов (например, аминокислоты) активируют анаболические сигнальные пути и стимулируют постпрандиальный синтетический ответ мышечного белка, чтобы понять механистическую основу рекомендаций по питанию. Однако также важно сбалансировать знания, полученные при изучении отдельных компонентов пищи, с взаимодействиями, происходящими между физическими упражнениями, режимами питания и продуктами (и входящими в их состав питательными веществами) при предоставлении рекомендаций по питанию (рис. 2).
Такие результаты убедительно свидетельствуют о том, что внутри пищевой матрицы происходят взаимодействия, усиливающие общий анаболический эффект на мышцы, который сильнее, чем индивидуальное действие только аминокислот (118).В целом, диета состоит из продуктов, пищевых комбинаций и связанных с ними пищевых компонентов и питательных веществ. Безусловно, важно разобраться в диетических схемах и впоследствии понять, как отдельные части продуктов (например, аминокислоты) активируют анаболические сигнальные пути и стимулируют постпрандиальный синтетический ответ мышечного белка, чтобы понять механистическую основу рекомендаций по питанию. Однако также важно сбалансировать знания, полученные при изучении отдельных компонентов пищи, с взаимодействиями, происходящими между физическими упражнениями, режимами питания и продуктами (и входящими в их состав питательными веществами) при предоставлении рекомендаций по питанию (рис. 2).
Заключение
Определение оптимального количества и качества белковой пищи для употребления в рамках диеты необходимо для обеспечения рекомендаций по диете. Мы обсудили оптимальное потребление белка с точки зрения мышечной активности, учитывая его роль в работе мышц и метаболическом здоровье. Существует небольшая неуверенность в том, что при рассмотрении «оптимального» потребления белка необходимо иметь некоторую степень гибкости, которую следует включить в рацион на протяжении всей жизни.С точки зрения RDA или PRI белка, эти значения представляют собой минимальную цель для предотвращения дефицита белка в пределах безопасности и, возможно, неадекватны для поддержки ремоделирования мышечного белка с помощью регулярных тренировок (6) и / или учета увеличения рациона питания. количества белка, необходимого для преодоления анаболически устойчивых старых мышц (7). Более того, качество белка также является важным аспектом диетического плана. DIAAS диетического белка может дать более прямую информацию о перевариваемости белка (2), но в настоящее время существует ограниченное количество доступных DIAAS, основанных на большом разнообразии пищевых белков.
Мы обсудили оптимальное потребление белка с точки зрения мышечной активности, учитывая его роль в работе мышц и метаболическом здоровье. Существует небольшая неуверенность в том, что при рассмотрении «оптимального» потребления белка необходимо иметь некоторую степень гибкости, которую следует включить в рацион на протяжении всей жизни.С точки зрения RDA или PRI белка, эти значения представляют собой минимальную цель для предотвращения дефицита белка в пределах безопасности и, возможно, неадекватны для поддержки ремоделирования мышечного белка с помощью регулярных тренировок (6) и / или учета увеличения рациона питания. количества белка, необходимого для преодоления анаболически устойчивых старых мышц (7). Более того, качество белка также является важным аспектом диетического плана. DIAAS диетического белка может дать более прямую информацию о перевариваемости белка (2), но в настоящее время существует ограниченное количество доступных DIAAS, основанных на большом разнообразии пищевых белков. Более того, DIAAS не учитывает влияние тренировок на изменение усвояемости белка и передачи биологически активной пищи (118), которая будет играть роль в определении оптимального качества белка.
Более того, DIAAS не учитывает влияние тренировок на изменение усвояемости белка и передачи биологически активной пищи (118), которая будет играть роль в определении оптимального качества белка.
В какой-то момент также важно признать целостную структуру питания, в которой существует взаимосвязь между экологическими соображениями, физической активностью и схемами упражнений, режимами питания, белковой пищей и питательными веществами (аминокислотами), что превращается в общие рекомендации по питанию (рис. 2).Точно так же важно иметь в виду, что существует возможность адаптации к любой рекомендации по белку на протяжении всей жизни / стадии здоровья, которая учитывает цели в отношении здоровья или производительности, периоды госпитализации или состояние болезни. В свою очередь, это даст лучший компас для определения «оптимального» потребления белка для всех возрастов.
Авторские взносы
Н.Б., К.П. и Д.М. составили рукопись. КП, АС и КМ подготовили таблицы и рисунки. Все авторы участвовали в доработке рукописи, прочитали и одобрили представленную версию.
Все авторы участвовали в доработке рукописи, прочитали и одобрили представленную версию.
Заявление о конфликте интересов
NB получил гранты на исследования, гонорары за консультации и гонорары за выступления от PepsiCo, Национальной ассоциации животноводов по говядине и Альянса по исследованиям и образованию в области картофеля (APRE). DM получила гранты на исследования, гонорары за консультации и гонорары за выступления от Nestec S.A., Ajinomoto Co. Inc., Dairy Management Incorporated и Iovate Health Sciences International.
Остальные авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Список литературы
1. Альберт Дж., Вайзелл Р., Ли В. Т., Томе Д., Курпад А. В., Уауи Р. Исследовательские подходы и методы оценки качества белка в продуктах питания человека, предложенные рабочей группой экспертов ФАО в 2014 году. J Nutr. (2016) 146: 929–32. DOI: 10.3945 / jn.115.222109
J Nutr. (2016) 146: 929–32. DOI: 10.3945 / jn.115.222109
PubMed Аннотация | CrossRef Полный текст | Google Scholar
2. Вулф Р.Р., Резерфард С.М., Ким И.Ю., Моуган П.Дж. Качество белка, определяемое по шкале усвояемых незаменимых аминокислот: оценка факторов, лежащих в основе расчета. Nutr Ред. (2016) 74: 584–99. DOI: 10.1093 / Nutrit / nuw022
PubMed Аннотация | CrossRef Полный текст | Google Scholar
4. Бурд Н.А., Тан Дж. Э., Мур Д. Р., Филлипс С. М.. Физические упражнения и метаболизм белка: влияние сокращения, потребления белка и различий по признаку пола. J Appl Physiol. (2009) 106: 1692–701. DOI: 10.1152 / japplphysiol.
.2008PubMed Аннотация | CrossRef Полный текст | Google Scholar
5. Непрофессионал Д.К., Энтони Т.Г., Расмуссен Б.Б., Адамс С.Х., Линч С.Дж., Бринкворт Г.Д. и др.Определение потребности в пище в белке для оптимизации метаболической роли аминокислот. Am J Clin Nutr. (2015) 101: 1330S-8S.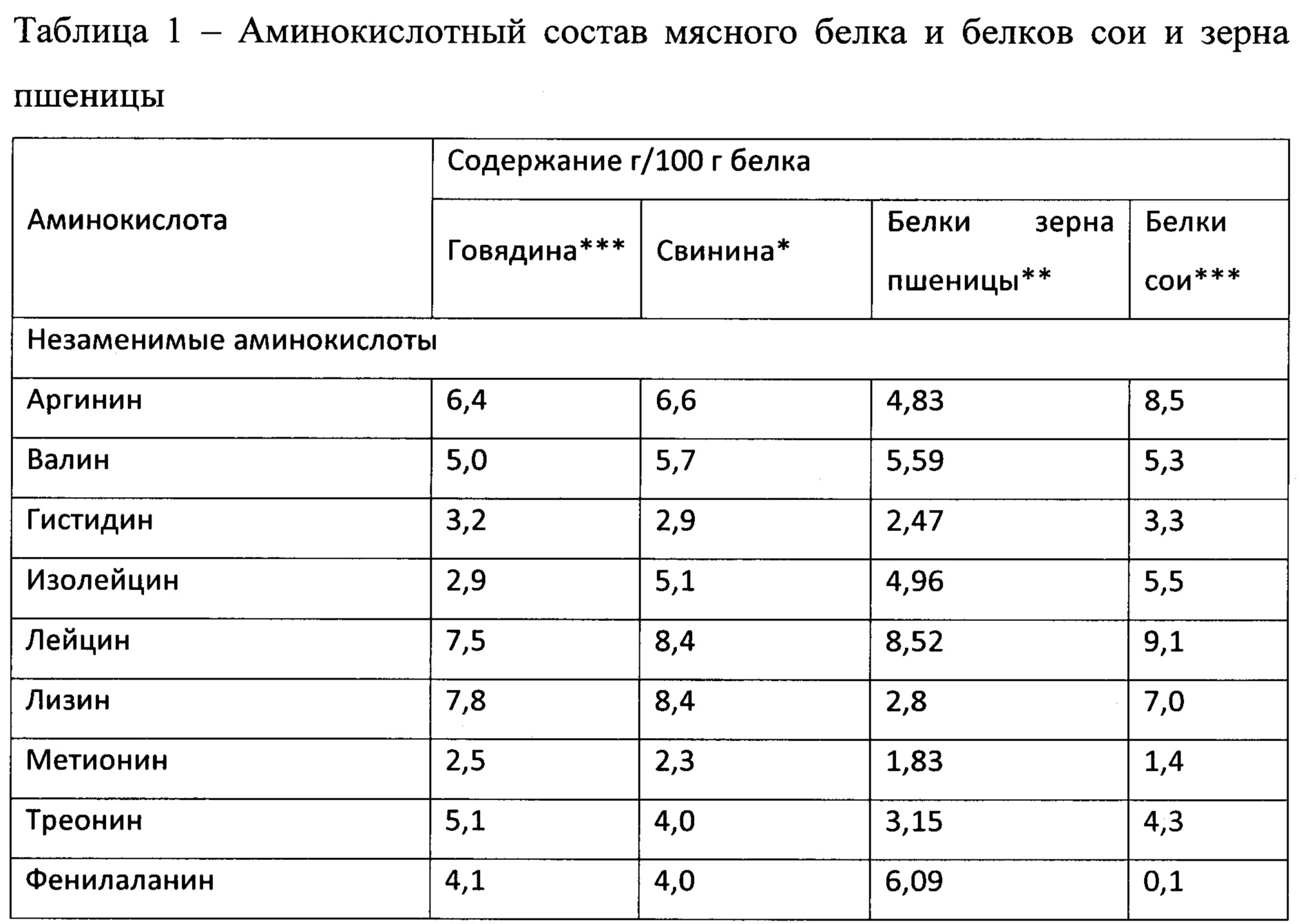 DOI: 10.3945 / ajcn.114.084053
DOI: 10.3945 / ajcn.114.084053
PubMed Аннотация | CrossRef Полный текст | Google Scholar
6. Филлипс С.М., Шевалье С., Лейди Х.Дж. «Требования» к белку сверх рекомендованной суточной нормы: значение для оптимизации здоровья. Appl Physiol Nutr Metabol. (2016) 41: 565–72. DOI: 10.1139 / apnm-2015-0550
PubMed Аннотация | CrossRef Полный текст | Google Scholar
7.Трайлор Д.А., Гориссен ШМ, Филлипс С.М. Перспектива: потребности в белке и оптимальное потребление при старении: готовы ли мы рекомендовать больше, чем рекомендуемая суточная норма? Adv Nutr. (2018) 9: 171–82. DOI: 10.1093 / авансы / nmy003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
8. Наир К.С., Холлидей Д., Григгс Р.С. Включение лейцина в смешанный белок скелетных мышц у человека. Am J Physiol. (1988) 254 (2 Pt 1): E208–13.
PubMed Аннотация | Google Scholar
11.Orsso CE, Tibaes JRB, Oliveira CLP, Rubin DA, Field CJ, Heymsfield SB и др. Низкая мышечная масса и сила у педиатрических пациентов: зачем нам это нужно? Clin Nutr. (2019) 2019: S0261–5614 (19) 30185-2. DOI: 10.1016 / j.clnu.2019.04.012
Низкая мышечная масса и сила у педиатрических пациентов: зачем нам это нужно? Clin Nutr. (2019) 2019: S0261–5614 (19) 30185-2. DOI: 10.1016 / j.clnu.2019.04.012
CrossRef Полный текст | Google Scholar
12. Филлипс С.М., Фулгони В.Л. III, Хини Р.П., Никлас Т.А., Славин Дж.Л., Уивер С.М. Обычно потребляемые белковые продукты способствуют потреблению питательных веществ, качеству диеты и достаточности питательных веществ. Am J Clin Nutr. (2015) 101: 1346S-52S. DOI: 10.3945 / ajcn.114.084079
PubMed Аннотация | CrossRef Полный текст | Google Scholar
13. Комитет DGA. Научный отчет Консультативного комитета по диетическим рекомендациям 2015 г .: Консультативный отчет для министра здравоохранения и социальных служб и министра сельского хозяйства . Министерство сельского хозяйства США. Вашингтон, округ Колумбия (2015).
Google Scholar
14. Мика Р., Уоллес Сара К., Мозаффариан Д. Потребление красного и переработанного мяса и риск возникновения ишемической болезни сердца, инсульта и сахарного диабета.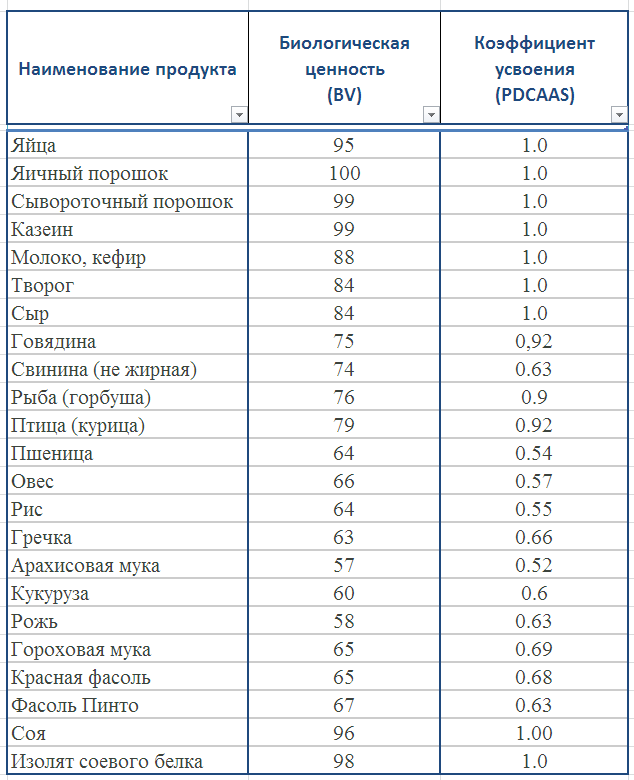 Обращение. (2010) 121: 2271–83. DOI: 10.1161 / CIRCULATIONAHA.109.924977
Обращение. (2010) 121: 2271–83. DOI: 10.1161 / CIRCULATIONAHA.109.924977
PubMed Аннотация | CrossRef Полный текст | Google Scholar
15. Пан А., Сан К., Бернштейн А. М., Мэнсон Дж. Э., Уиллетт В. К., Ху Ф. Б.. Изменения в потреблении красного мяса и последующий риск развития сахарного диабета 2 типа: три группы мужчин и женщин в США, потребляющие красное мясо и диабет 2 типа, повышали риск потребления мяса и риск развития диабета 2 типа. JAMA Internal Med. (2013) 173: 1328–35. DOI: 10.1001 / jamainternmed.2013.6633
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16. Гуаш-Ферре М., Сатия А., Блондин Стейси А., Янишевски М., Эмлен Е., О’Коннор, Лорен Е. и др. Метаанализ рандомизированных контролируемых исследований потребления красного мяса в сравнении с различными диетами сравнения по факторам риска сердечно-сосудистых заболеваний. Обращение. (2019) 139: 1828–45. DOI: 10.1161 / CIRCULATIONAHA.118.035225
PubMed Аннотация | CrossRef Полный текст | Google Scholar
18. Лезер С. Отчет ФАО 2013 г. об оценке качества диетического белка в питании человека: рекомендации и последствия. Nutr Bull. (2013) 38: 421–8. DOI: 10.1111 / nbu.12063
Лезер С. Отчет ФАО 2013 г. об оценке качества диетического белка в питании человека: рекомендации и последствия. Nutr Bull. (2013) 38: 421–8. DOI: 10.1111 / nbu.12063
CrossRef Полный текст | Google Scholar
19. Непрофессионал ДК (2018). Оценка роли крупного рогатого скота в устойчивых пищевых системах. 53: 160–5. DOI: 10.1097 / NT.0000000000000286
CrossRef Полный текст | Google Scholar
20. Оценка качества диетического белка в питании человека. Rep FAQ Expert Consult FAO Food Nutr Pap. (2013) 92: 1–66.
Google Scholar
21. Деглер А., Бос С., Томе Д., Моуган П.Дж. Илеальная усвояемость пищевого белка у растущей свиньи и взрослого человека. Br J Nutr. (2009) 102: 1752–9. DOI: 10.1017 / S00071145099
PubMed Аннотация | CrossRef Полный текст | Google Scholar
22. Фульгони В.Л. III. Текущее потребление белка в Америке: анализ Национального исследования здоровья и питания, 2003-2004 гг.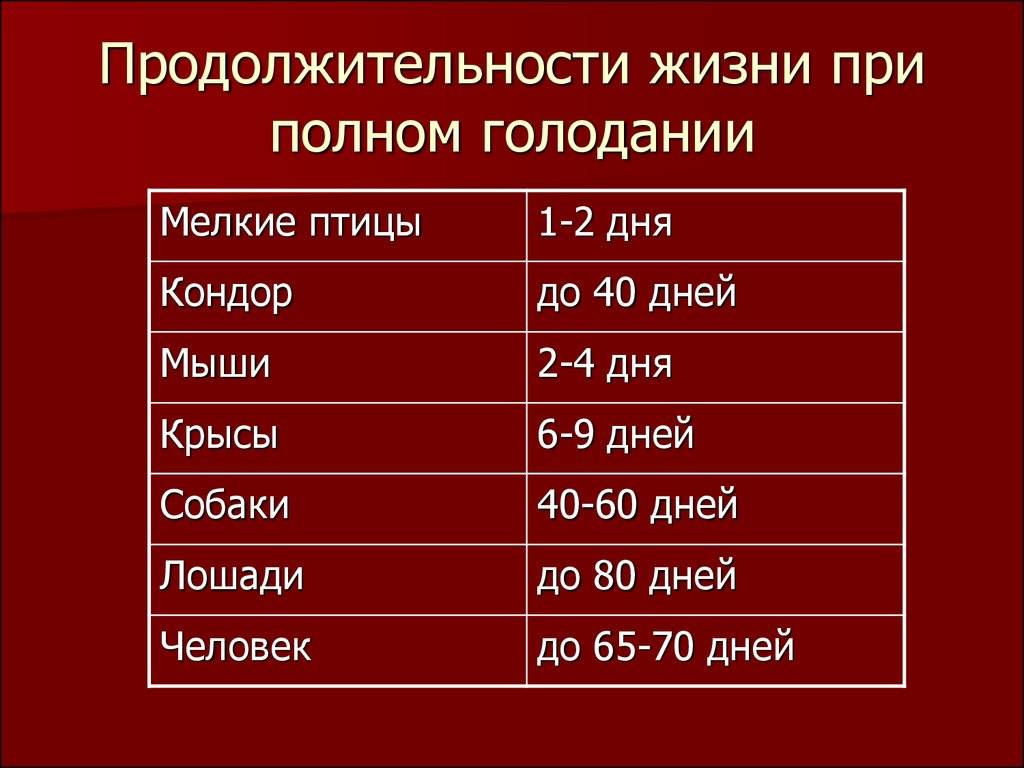 Am J Clin Nutr. (2008) 87: 1554S-7S. DOI: 10.1093 / ajcn / 87.5.1554S
Am J Clin Nutr. (2008) 87: 1554S-7S. DOI: 10.1093 / ajcn / 87.5.1554S
PubMed Аннотация | CrossRef Полный текст | Google Scholar
23. Пасиакос С.М., Агарвал С., Либерман Х.Р., Фульгони В.Л. III. Источники и объемы потребления животного, молочного и растительного белка взрослым населением США в 2007-2010 гг. Питательные вещества. (2015) 7: 7058–69. DOI: 10.3390 / nu7085322
PubMed Аннотация | CrossRef Полный текст | Google Scholar
24. Бурд Н.А., Де Лисио М. Ремоделирование скелетных мышц: взаимосвязь между стволовыми клетками и обменом белков. Exerc Sport Sci Rev. (2017) 45: 187–91. DOI: 10.1249 / JES.0000000000000117
PubMed Аннотация | CrossRef Полный текст | Google Scholar
25. Мур Д.Р., Вольтерман К.А., Обейд Дж., Оффорд Е.А., Тиммонс Б.В. Прием протеина после тренировки увеличивает чистый протеиновый баланс всего тела у здоровых детей. J Appl Physiol. (2014) 117: 1493–501. DOI: 10.1152 / japplphysiol. 00224.2014
00224.2014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
26.Вольтерман К.А., Мур Д.Р., Брейтаупт П., Годин Дж. П., Карагунис Л.Г., Оффорд Е.А. и др. Прием диетического белка после тренировки увеличивает лейциновый баланс всего тела у здоровых детей в зависимости от дозы. J Nutr. (2017) 147: 807–15. DOI: 10.3945 / jn.116.239756
PubMed Аннотация | CrossRef Полный текст | Google Scholar
28. Матиас К.С., Алмосави С., Карагунис Л.Г. Потребление белка и энергии у детей и подростков в Соединенных Штатах смещено к вечеру: NHANES 2013–2014. J Nutr. (2017) 147: 1160–6. DOI: 10.3945 / jn.116.245621
PubMed Аннотация | CrossRef Полный текст | Google Scholar
29. Барджа I, Арая Х, Муньос П., Вега Л., Артеага А, Тагле Массачусетс. Влияние интервального потребления белка на баланс азота у нормальных детей. Am J Clin Nutr. (1972) 25: 506–11. DOI: 10.1093 / ajcn / 25.5.506
PubMed Аннотация | CrossRef Полный текст | Google Scholar
30. Вольтерман К.А., Мур Д.Р., Брейтхаупт П., Гратвол Д., Оффорд Е.А., Карагунис Л.Г. и др.Время и характер приема протеина после тренировки влияет на белковый баланс всего тела у здоровых детей: рандомизированное исследование. Appl Physiol Nutr Metab. (2017) 42: 1142–8. DOI: 10.1139 / apnm-2017-0185
Вольтерман К.А., Мур Д.Р., Брейтхаупт П., Гратвол Д., Оффорд Е.А., Карагунис Л.Г. и др.Время и характер приема протеина после тренировки влияет на белковый баланс всего тела у здоровых детей: рандомизированное исследование. Appl Physiol Nutr Metab. (2017) 42: 1142–8. DOI: 10.1139 / apnm-2017-0185
PubMed Аннотация | CrossRef Полный текст | Google Scholar
31. Карагунис Л.Г., Вольтерман К.А., Брей Д., Оффорд Е.А., Эмади-Азар С., Мур ДР. Потребление белка во время завтрака способствует положительному белковому балансу во всем организме в зависимости от дозы у здоровых детей: рандомизированное исследование. J Nutr. (2018) 148: 729–37. DOI: 10.1093 / jn / nxy026
PubMed Аннотация | CrossRef Полный текст | Google Scholar
32. Маклеод М., Брин Л., Гамильтон Д. Л., Филп А. Живите сильной и процветайте: важность силы скелетных мышц для здорового старения. Биогеронтология. (2016) 17: 497–510. DOI: 10.1007 / s10522-015-9631-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
36.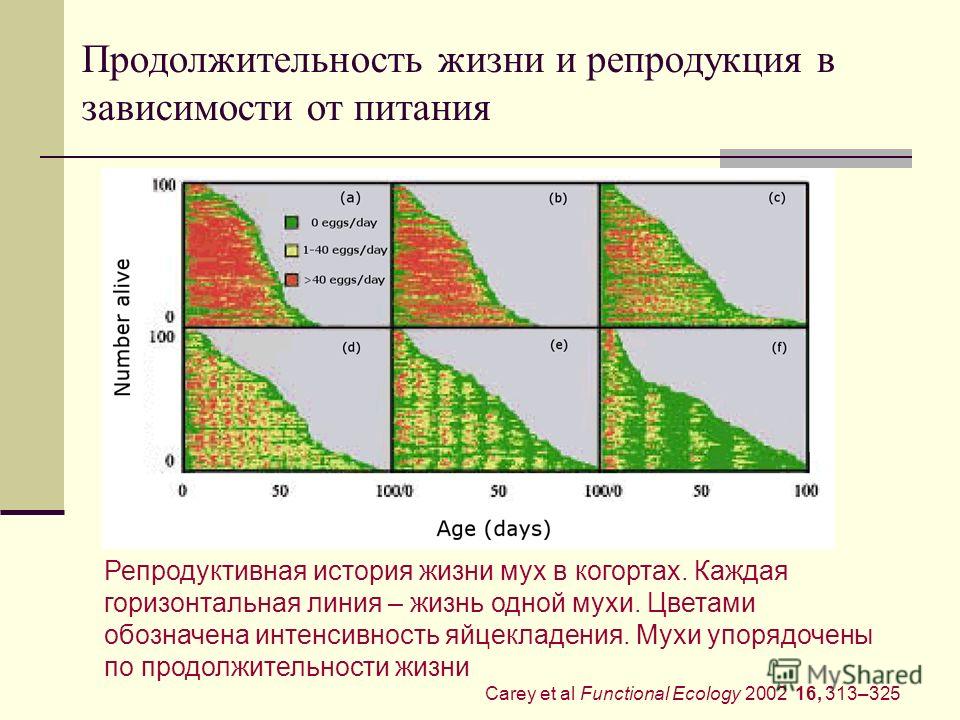 Уолл Б.Т., Гориссен С.Х., Пеннингс Б., Купман Р., Гроен Б.Б., Вердейк Л.Б. и др.Старение сопровождается притуплением синтетической реакции мышечного протеина на прием протеина. PLoS ONE. (2015) 10: e0140903. DOI: 10.1371 / journal.pone.0140903
Уолл Б.Т., Гориссен С.Х., Пеннингс Б., Купман Р., Гроен Б.Б., Вердейк Л.Б. и др.Старение сопровождается притуплением синтетической реакции мышечного протеина на прием протеина. PLoS ONE. (2015) 10: e0140903. DOI: 10.1371 / journal.pone.0140903
PubMed Аннотация | CrossRef Полный текст | Google Scholar
37. Маркофски М.М., Дикинсон Дж. М., Драммонд М. Дж., Фрай С. С., Фуджита С., Гундерманн Д. М. и др. Влияние возраста на синтез базального мышечного белка и передачу сигналов mTORC1 в большой когорте молодых и пожилых мужчин и женщин. Exp Gerontol. (2015) 65: 1–7.DOI: 10.1016 / j.exger.2015.02.015
PubMed Аннотация | CrossRef Полный текст | Google Scholar
38. Кацанос К.С., Кобаяши Н., Шеффилд-Мур М., Арсланд А., Вулф Р.Р. Старение связано с уменьшением накопления мышечных белков после приема небольшого количества незаменимых аминокислот. Am J Clin Nutr. (2005) 82: 1065–73. DOI: 10.1093 / ajcn / 82.5.1065
PubMed Аннотация | CrossRef Полный текст | Google Scholar
39. Ренни MJ. Анаболическая резистентность: влияние старения, полового диморфизма и иммобилизации на обмен мышечного белка человека. Appl Physiol Nutr Metab. (2009) 34: 377–81. DOI: 10.1139 / H09-012
Ренни MJ. Анаболическая резистентность: влияние старения, полового диморфизма и иммобилизации на обмен мышечного белка человека. Appl Physiol Nutr Metab. (2009) 34: 377–81. DOI: 10.1139 / H09-012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
40. Пеннингс Б., Гроен Б., де Ланге А., Гийсен А.П., Зоренц А.Х., Зенден Дж. М. и др. Всасывание аминокислот и последующее наращивание мышечного протеина после постепенного приема сывороточного протеина у пожилых мужчин. Am J Physiol Endocrinol Metab. (2012) 302: E992–9. DOI: 10.1152 / ajpendo.00517.2011ajpendo.00517.2011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
41.Ян Й., Брин Л., Бурд Н. А., Гектор А. Дж., Черчвард-Венне Т. А., Джосс А. Р. и др. Упражнения с отягощениями усиливают синтез миофибриллярного протеина за счет постепенного приема сывороточного протеина у пожилых мужчин. Br J Nutr. 108: 1780–8. DOI: 10.1017 / S0007114511007422
PubMed Аннотация | CrossRef Полный текст | Google Scholar
42. Wall BT, Hamer HM, de Lange A, Kiskini A, Groen BB, Senden JM и др. Совместное употребление лейцина улучшает постпрандиальный рост мышечного белка у пожилых мужчин. Clin Nutr. (2013) 32: 412–9. DOI: 10.1016 / j.clnu.2012.09.002
Wall BT, Hamer HM, de Lange A, Kiskini A, Groen BB, Senden JM и др. Совместное употребление лейцина улучшает постпрандиальный рост мышечного белка у пожилых мужчин. Clin Nutr. (2013) 32: 412–9. DOI: 10.1016 / j.clnu.2012.09.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
43. Смит Г. И., Атертон П., Вильярреал Д. Т., Фримел Т. Н., Рэнкин Д., Ренни М. Дж. И др. Различия в синтезе мышечного белка и анаболической передаче сигналов в постабсорбционном состоянии и в ответ на пищу у мужчин и женщин 65-80 лет. PLoS ONE. (2008) 3: e1875. DOI: 10.1371 / journal.pone.0001875
PubMed Аннотация | CrossRef Полный текст | Google Scholar
44.Смит Г.И., Ридс Д.Н., Холл А.М., Чемберс К.Т., Финк Б.Н., Миттендорфер Б. Половой диморфный эффект старения на синтез белка в скелетных мышцах. Biol Половые различия. (2012) 3:11. DOI: 10.1186 / 2042-6410-3-11
PubMed Аннотация | CrossRef Полный текст | Google Scholar
45. Коув И.В., Холверда А.М., Троммелен Дж., Крамер И.Ф., Бастиаанс Дж., Халсон С.Л. и др. Употребление белка перед сном увеличивает скорость синтеза мышечного белка в течение ночи у здоровых пожилых мужчин: рандомизированное контролируемое исследование. J Nutr. (2017) 147: 2252–61. DOI: 10.3945 / jn.117.254532
Коув И.В., Холверда А.М., Троммелен Дж., Крамер И.Ф., Бастиаанс Дж., Халсон С.Л. и др. Употребление белка перед сном увеличивает скорость синтеза мышечного белка в течение ночи у здоровых пожилых мужчин: рандомизированное контролируемое исследование. J Nutr. (2017) 147: 2252–61. DOI: 10.3945 / jn.117.254532
PubMed Аннотация | CrossRef Полный текст | Google Scholar
46. Rafii M, Chapman K, Owens J, Elango R, Campbell WW, Ball RO и др. Потребность в белке у взрослых женщин старше 65 лет, определенная методом индикаторного окисления аминокислот, превышает текущие рекомендации. J Nutr. (2015) 145: 18–24. DOI: 10.3945 / jn.114.197517
PubMed Аннотация | CrossRef Полный текст | Google Scholar
47.Hodgkinson SM, Montoya CA, Scholten PT, Rutherfurd SM, Moughan PJ. Условия приготовления влияют на содержание истинно усвояемых аминокислот в подвздошной кишке и показатель усвояемых незаменимых аминокислот (DIAAS) бычьего мяса, определяемый на свиньях. J Nutr. (2018) 148: 1564–9. DOI: 10.1093 / jn / nxy153
J Nutr. (2018) 148: 1564–9. DOI: 10.1093 / jn / nxy153
PubMed Аннотация | CrossRef Полный текст | Google Scholar
48. Williams PA, Hodgkinson SM, Rutherfurd SM, Hendriks WH. Содержание лизина в рационе собак может быть серьезно повреждено нагреванием J Nutr. (2006) 136: 1998S – 2000S. DOI: 10.1093 / jn / 136.7.1998S
PubMed Аннотация | CrossRef Полный текст | Google Scholar
49. Носуорси М.Г., Медина Г., Францик А.Дж., Нойфельд Дж., Аппа П., Утиох А. и др. Влияние обработки на качество белка in vitro, и in vivo, бобов (Phaseolus vulgaris и Vicia Faba ). Питательные вещества. (2018) 10: 671. DOI: 10.3390 / nu10060671
PubMed Аннотация | CrossRef Полный текст | Google Scholar
50.Носуорти М.Г., Францик А.Дж., Медина Дж., Нойфельд Дж., Аппа П., Утиох А. и др. Влияние обработки на качество белка in vitro, и in vivo, желтого и зеленого колотого гороха (Pisum sativum). J Agric Food Chem. (2017) 65: 7790–6. DOI: 10.1021 / acs.jafc.7b03597
J Agric Food Chem. (2017) 65: 7790–6. DOI: 10.1021 / acs.jafc.7b03597
PubMed Аннотация | CrossRef Полный текст | Google Scholar
51. Носуорси М.Г., Медина Дж., Францик А.Дж., Нойфельд Дж., Аппа П., Утиох А. и др. Влияние обработки на качество белка in vitro, и in vivo, красной и зеленой чечевицы (Lens culinaris). Food Chem. (2018) 240: 588–93. DOI: 10.1016 / j.foodchem.2017.07.129
PubMed Аннотация | CrossRef Полный текст | Google Scholar
52. Ким Б.Г., Кил Д.Й., Чжан Й., Стейн Х.Х. Концентрации анализируемого или реактивного лизина, но не сырого протеина, могут предсказать концентрацию перевариваемого лизина в сушеных зернах дистилляторов с растворимыми веществами, подаваемыми свиньям1. J Anim Sci. (2012) 90: 3798–808. DOI: 10.2527 / jas.2011-4692
CrossRef Полный текст | Google Scholar
53.Evenepoel P, Geypens B, Luypaerts A, Hiele M, Ghoos Y, Rutgeerts P. Усвояемость вареного и сырого яичного белка у людей по оценке с помощью методов стабильных изотопов.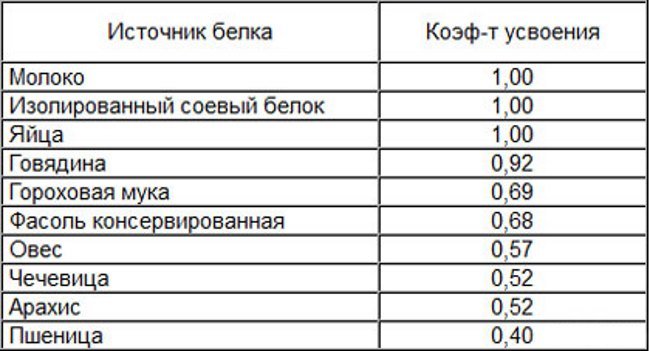 J Nutr. (1998) 128: 1716–22.
J Nutr. (1998) 128: 1716–22.
PubMed Аннотация | Google Scholar
54. Mehta BM, Deeth HC. Блокированный лизин в молочных продуктах: образование, возникновение, анализ и последствия для питания. Compr Rev Food Sci Безопасность пищевых продуктов. (2016) 15: 206–18. DOI: 10.1111 / 1541-4337.12178
CrossRef Полный текст | Google Scholar
55.Marinangeli CPF, House JD. Возможное влияние показателя усвояемой незаменимой аминокислоты как показателя качества белка на правила питания и здоровье. Nutr Ред. (2017) 75: 658–67. DOI: 10.1093 / Nutrit / nux025
PubMed Аннотация | CrossRef Полный текст | Google Scholar
56. Cervantes-Pahm SK, Stein HH. Влияние диетического соевого масла и концентрации соевого белка на концентрацию усвояемых аминокислот в соевых продуктах, скармливаемых растущим свиньям1. J Anim Sci. (2008) 86: 1841–9. DOI: 10.2527 / jas.2007-0721
CrossRef Полный текст | Google Scholar
57. Boirie Y, Fauquant J, Rulquin H, Maubois JL, Beaufrere B. Производство больших количеств белков молока, обогащенных [13C] лейцином, лактирующими коровами. J Nutr. (1995) 125: 92–8.
Boirie Y, Fauquant J, Rulquin H, Maubois JL, Beaufrere B. Производство больших количеств белков молока, обогащенных [13C] лейцином, лактирующими коровами. J Nutr. (1995) 125: 92–8.
Google Scholar
58. van Loon LJ, Boirie Y, Gijsen AP, Fauquant J, de Roos AL, Kies AK, et al. Производство молочного белка с внутренней меткой представляет собой функциональный инструмент для исследований в области питания человека. J Dairy Sci. (2009) 92: 4812–22. DOI: 10.3168 / jds.2009-2317
PubMed Аннотация | CrossRef Полный текст | Google Scholar
59. van Vliet S, Beals JW, Parel JT, Hanna CD, Utterback PL, Dilger AC, et al. Разработка яиц и мяса птицы с внутренней маркировкой для использования в исследованиях метаболизма человека. J Nutr. (2016) 146: 1428–33. DOI: 10.3945 / jn.115.228338
PubMed Аннотация | CrossRef Полный текст | Google Scholar
60. Гориссен С.Х., Бурд Н.А., Хамер Х.М., Гийсен А.П., Гроен Б.Б., ван Лун Л.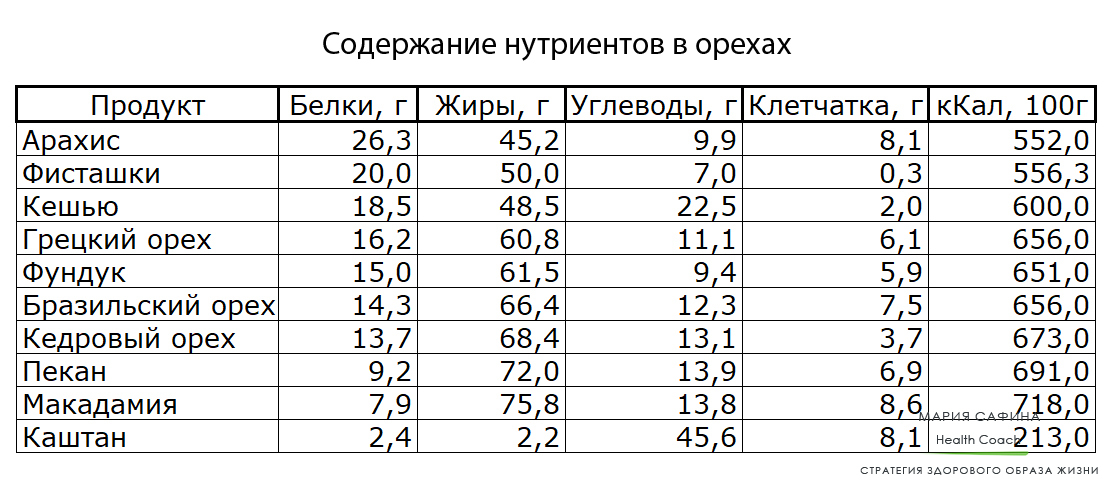 Дж.Совместное употребление углеводов замедляет переваривание и всасывание диетического белка, но не модулирует постпрандиальное накопление мышечного белка. J Clin Endocrinol Metab. (2014) 99: 2250–8. DOI: 10.1210 / jc.2013-3970
Дж.Совместное употребление углеводов замедляет переваривание и всасывание диетического белка, но не модулирует постпрандиальное накопление мышечного белка. J Clin Endocrinol Metab. (2014) 99: 2250–8. DOI: 10.1210 / jc.2013-3970
CrossRef Полный текст | Google Scholar
61. Гориссен С.Х., Бурд Н.А., Крамер И.Ф., ван Краненбург Дж., Гийсен А.П., Ройакерс О. и др. Совместное употребление молочного жира с мицеллярным казеином не влияет на постпрандиальную обработку белка у здоровых пожилых мужчин. Clin Nutr. (2017) 36: 429–37.DOI: 10.1016 / j.clnu.2015.12.011
CrossRef Полный текст | Google Scholar
62. Бурд Н.А., Гориссен С.Х., ван Влит С., Снейдерс Т., ван Лун Л.Дж. Различия в потреблении белка после еды после говядины по сравнению с потреблением молока во время восстановления после тренировки: рандомизированное контролируемое исследование. Am J Clin Nutr. (2015) 102: 828–36. DOI: 10.3945 / ajcn.114.103184
PubMed Аннотация | CrossRef Полный текст | Google Scholar
63. Черчворд-Венне Т.А., Снайдерс Т., Линкенс А.М., Хамер Х.М., ван Краненбург Дж., Ван Лун Л.Дж.Попадание казеина в матрицу молока модулирует кинетику переваривания и абсорбции пищевого белка, но не влияет на синтез мышечного белка после приема пищи у пожилых мужчин. J Nutr. (2015) 145: 1438–45. DOI: 10.3945 / jn.115.213710
Черчворд-Венне Т.А., Снайдерс Т., Линкенс А.М., Хамер Х.М., ван Краненбург Дж., Ван Лун Л.Дж.Попадание казеина в матрицу молока модулирует кинетику переваривания и абсорбции пищевого белка, но не влияет на синтез мышечного белка после приема пищи у пожилых мужчин. J Nutr. (2015) 145: 1438–45. DOI: 10.3945 / jn.115.213710
CrossRef Полный текст | Google Scholar
64. Trumbo P, Schlicker S, Yates AA, Poos M. Диетические справочные данные о потреблении энергии, углеводов, клетчатки, жиров, жирных кислот, холестерина, белка и аминокислот. J Am Dietetic Assoc. (2002) 102: 1621–30.DOI: 10.1016 / S0002-8223 (02)-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
65. Тарнопольский М.А., Аткинсон С.А., Макдугалл Д.Д., Чесли А., Филлипс С., Шварц ХП. Оценка потребности в белке тренированных силовых атлетов. J Appl Physiol. (1992) 73: 1986–95. DOI: 10.1152 / jappl.1992.73.5.1986
PubMed Аннотация | CrossRef Полный текст | Google Scholar
66. Тарнопольский М.А., Макдугалл Д.Д., Аткинсон С.А. Влияние потребления белка и тренировочного статуса на азотный баланс и безжировую массу тела. J Appl Physiol. (1988) 64: 187–93. DOI: 10.1152 / jappl.1988.64.1.187
Тарнопольский М.А., Макдугалл Д.Д., Аткинсон С.А. Влияние потребления белка и тренировочного статуса на азотный баланс и безжировую массу тела. J Appl Physiol. (1988) 64: 187–93. DOI: 10.1152 / jappl.1988.64.1.187
PubMed Аннотация | CrossRef Полный текст | Google Scholar
67. Ким И-И, Вулф Р.Р., Чифелли А.М., Костас Г. Оптимизация потребления белка у взрослых: интерпретация и применение рекомендуемой диетической нормы по сравнению с допустимым диапазоном распределения макронутриентов. Adv Nutr. (2017) 8: 266–75. DOI: 10.3945 / an.116.013821
PubMed Аннотация | CrossRef Полный текст | Google Scholar
71.Мур Д. Р., Робинсон М. Дж., Фрай Дж. Л., Тан Дж. Э., Гловер Е. И., Уилкинсон С. Б. и др. Дозовая реакция потребляемого белка в мышцах и синтез белка альбумина после упражнений с отягощениями у молодых мужчин. Am J Clin Nutr. (2009) 89: 161–8. DOI: 10.3945 / ajcn.2008.26401
PubMed Аннотация | CrossRef Полный текст | Google Scholar
72. Мур Д.Р., Черчвард-Венн Т.А., Витард О., Брин Л., Бурд Н.А., Типтон К.Д. и др. Потребление белка для стимуляции синтеза миофибриллярного белка требует большего относительного потребления белка у здоровых пожилых мужчин по сравнению с молодыми мужчинами. J Gerontol A Biol Sci Med Sci. (2015) 70: 57–62. DOI: 10.1093 / gerona / glu103
PubMed Аннотация | CrossRef Полный текст | Google Scholar
73. Mazzulla M, Volterman KA, Packer JE, Wooding DJ, Brooks JC, Kato H, et al. Плато баланса чистого белка всего тела в ответ на увеличение потребления белка во время восстановления после тренировки у взрослых и подростков. Nutr Metab. (2018) 15:62. DOI: 10.1186 / s12986-018-0301-z
PubMed Аннотация | CrossRef Полный текст | Google Scholar
74.Holwerda AM, Paulussen KJM, Overkamp M, Goessens JPB, Kramer IF, Wodzig W и др. Дозозависимое увеличение чистого белкового баланса всего тела и включение аминокислот, полученных из пищевого белка, в миофибриллярный белок во время восстановления после упражнений с отягощениями у пожилых мужчин. J Nutr. (2019) 149: 221–30. DOI: 10.1093 / jn / nxy263
CrossRef Полный текст | Google Scholar
75. Пирси К.Л., Троиано Р.П., Баллард Р.М., Карлсон С.А., Фултон Дж. Э., Галуска Д.А. и др. Рекомендации по физической активности для американцев. JAMA. (2018) 320: 2020–8. DOI: 10.1001 / jama.2018.14854
PubMed Аннотация | CrossRef Полный текст | Google Scholar
76. Бурд Н.А., Вест Д.В., Мур Д.Р., Атертон П.Дж., Стейплз А.В., Приор Т. и др. Повышенная аминокислотная чувствительность при синтезе миофибриллярного белка сохраняется до 24 часов после упражнений с отягощениями у молодых мужчин. J Nutr. (2011) 141: 568–73. DOI: 10.3945 / jn.110.135038
PubMed Аннотация | CrossRef Полный текст | Google Scholar
77.Абу Саван С., ван Влит С., Парел Дж. Т., Билс Дж. В., Мацзулла М., West DWD и др. Совместная локализация транслокации и белкового комплекса mTOR связана с постпрандиальным синтезом миофибриллярных белков в покое и после упражнений на выносливость. Physiol Rep. 6: 5. DOI: 10.14814 / phy2.13628
PubMed Аннотация | CrossRef Полный текст | Google Scholar
78. Филипс С.М., Типтон К.Д., Аарсланд А., Вольф С.Е., Вулф Р.Р. Синтез и распад смешанного мышечного белка после упражнений с отягощениями у людей. Am J Physiol. (1997) 273 (1, часть 1): E99–107.
PubMed Аннотация | Google Scholar
79. Биоло Дж., Типтон К.Д., Кляйн С., Вулф Р.Р. Обильный запас аминокислот усиливает метаболический эффект упражнений на мышечный белок. Am J Physiol. (1997) 273 (1, часть 1): E122–9.
PubMed Аннотация | Google Scholar
80. Уолл Б.Т., Бурд Н.А., Франссен Р., Гориссен С.Х., Снейдерс Т., Сенден Дж.М. и др. Прием протеина перед сном не нарушает синтетический ответ мышечного протеина на протеин, принятый на следующее утро. Am J Physiol Endocrinol Metab. (2016) 311: E964–73. DOI: 10.1152 / ajpendo.00325.2016
CrossRef Полный текст | Google Scholar
81. Катбертсон Д., Смит К., Бабрадж Дж., Лиз Дж., Уодделл Т., Атертон П. и др. Дефицит анаболической передачи сигналов лежит в основе аминокислотной устойчивости истощенных, стареющих мышц. Faseb J. (2005) 19: 422–4.doi: 10.1096 / fj.04-2640fje
PubMed Аннотация | CrossRef Полный текст | Google Scholar
82. Пеннингс Б., Купман Р., Белен М., Сенден Дж.М., Сарис У.Х., ван Лун Л.Дж.Выполнение упражнений до приема протеина позволяет более эффективно использовать аминокислоты, полученные из пищевых белков, для синтеза мышечного протеина de novo как у молодых, так и у пожилых мужчин. Am J Clin Nutr. (2011) 93: 322–31. DOI: 10.3945 / ajcn.2010.29649
PubMed Аннотация | CrossRef Полный текст | Google Scholar
83. Мур Д.Р., Дель Бел NC, Низи К.И., Хартман Дж. У., Тан Дж. Э., Армстронг Д. и др. Тренировка с отягощениями снижает обмен лейцина натощак и после еды и увеличивает удержание азота в рационе у ранее нетренированных молодых людей. J Nutr. (2007) 137: 985–91. DOI: 10.1093 / jn / 137.4.985
PubMed Аннотация | CrossRef Полный текст | Google Scholar
85. Хараламби Г., Берг А. Изменения мочевины в сыворотке и аминного азота в зависимости от продолжительности упражнений. Eur J Appl Physiol Occup Physiol. (1976) 36: 39–48.
PubMed Аннотация | Google Scholar
86. Ламонт Л.С., Мак-Каллоу А.Дж., Калхан С.К. Взаимосвязь между окислением лейцина и потреблением кислорода во время упражнений в устойчивом состоянии. Медико-спортивные упражнения . (2001) 33: 237–41.
PubMed Аннотация | Google Scholar
87. Bowtell JL, Leese GP, Smith K, Watt PW, Nevill A, Rooyackers O, et al. Регулирование белкового обмена во всем организме во время и после упражнений путем изменения диетического белка. J Appl Physiol. (1998) 85: 1744–52. DOI: 10.1152 / jappl.1998.85.5.1744
PubMed Аннотация | CrossRef Полный текст | Google Scholar
88. Mazzulla M, Parel JT, Beals JW, VAN Vliet S, Abou Sawan S, West DWD и др.Упражнения на выносливость снижают постпрандиальный баланс лейцина во всем теле у тренированных мужчин. Медико-спортивные упражнения. (2017) 49: 2585–92. DOI: 10.1249 / MSS.0000000000001394
PubMed Аннотация | CrossRef Полный текст | Google Scholar
89. Мур Д.Р., камера DM, Арета Д.Л., Хоули Д.А. Помимо гипертрофии мышц: почему диетический белок важен для спортсменов на выносливость. Appl Physiol Nutr Metabol. (2014) 39: 987–97. DOI: 10.1139 / apnm-2013-0591
PubMed Аннотация | CrossRef Полный текст | Google Scholar
90.Маккензи С., Филлипс С.М., Картер С.Л., Лоутер С., Гибала М.Дж., Тарнопольский М.А. Тренировка на выносливость снижает окисление лейцина и активацию BCOAD во время тренировки у людей. Am J Physiol Endocrinol Metab. (2000) 278: E580–7. DOI: 10.1152 / ajpendo.2000.278.4.E580
PubMed Аннотация | CrossRef Полный текст | Google Scholar
91. Форслунд А.Х., Эль-Хури А.Э., Олссон Р.М., Сьодин А.М., Хамбреус Л., Янг В.Р. Влияние потребления белка и физической активности на суточный график и скорость использования макроэлементов. Am J Physiol. (1999) 276: E964–76. DOI: 10.1152 / ajpendo.1999.276.5.E964
PubMed Аннотация | CrossRef Полный текст | Google Scholar
92. Като Х, Сузуки К., Баннаи М, Мур ДР. Потребность в белке повышается у спортсменов на выносливость после тренировки, что определяется методом окисления индикаторных аминокислот. PLoS ONE. (2016) 11: e0157406. DOI: 10.1371 / journal.pone.0157406
PubMed Аннотация | CrossRef Полный текст | Google Scholar
93.Като Х, Сузуки К., Баннаи М, Мур ДР. Аминокислоты с разветвленной цепью являются основными ограничивающими аминокислотами в рационе тренированных на выносливость мужчин после серии длительных упражнений. J Nutr. (2018) 148: 925–31. DOI: 10.1093 / jn / nxy048
PubMed Аннотация | CrossRef Полный текст | Google Scholar
95. Арета Дж. Л., Берк Л. М., Росс М. Л., Камера Д. М., Вест Д. В., Броуд Е. М. и др. Время и распределение потребления белка во время длительного восстановления после упражнений с отягощениями изменяет синтез миофибриллярного белка. J Physiol. (2013) 591 (Pt 9): 2319–31. DOI: 10.1113 / jphysiol.2012.244897
PubMed Аннотация | CrossRef Полный текст | Google Scholar
96. Mamerow MM, Mettler JA, English KL, Casperson SL, Arentson-Lantz E, Sheffield-Moore M, et al. Распределение диетического белка положительно влияет на 24-часовой синтез мышечного белка у здоровых взрослых. J Nutr. (2014) 144: 876–80. DOI: 10.3945 / jn.113.185280
PubMed Аннотация | CrossRef Полный текст | Google Scholar
98.Бакстер-Джонс А.Д., Эйзенманн Дж. К., Мирвальд Р. Л., Фолкнер Р. А., Бейли Д. А.. Влияние физической активности на рост мышечной массы в подростковом возрасте: продольный анализ. J Appl Physiol. (2008) 105: 734–41. DOI: 10.1152 / japplphysiol.00869.2007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
99. Яковски С.А., Фолкнер Р.А., Фартинг Дж. П., Контулайнен С.А., Бек Т.Дж., Бакстер-Джонс ADG. Пиковое нарастание мышечной массы предшествует изменениям показателей прочности костей проксимального отдела бедренной кости во время пубертатного скачка роста. Кость. (2009) 44: 1186–90. DOI: 10.1016 / j.bone.2009.02.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
100. Яковски С.А., Лановаз Дж. Л., Ван Оорт К., Бакстер-Джонс ADGJOI. Влияет ли увеличение мышечной массы в подростковом возрасте на структурную прочность костей проксимального отдела бедренной кости в молодом взрослом возрасте? Osteoporos Int. (2014) 25: 1297–304. DOI: 10.1007 / s00198-013-2592-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
101.Хумаюн М.А., Эланго Р., Болл Р.О., Пенчарз ПБ. Переоценка потребности в белке у молодых мужчин с помощью методики окисления индикаторных аминокислот. Am J Clin Nutr. (2007) 86: 995–1002. DOI: 10.1093 / ajcn / 86.4.995
PubMed Аннотация | CrossRef Полный текст | Google Scholar
102. Совместная ВОЗ. Ф. А. О. У. Н. У. Э. К. (2007). Потребность в белках и аминокислотах в питании человека. World Health Organ Tech Rep Ser. 935: 1–265.
Google Scholar
103.Эланго Р., Хумаюн М.А., Болл Р.О., Пенчарз ПБ. Потребность в белке здоровых детей школьного возраста определялась индикаторным методом аминокислотного окисления. Am J Clin Nutr. (2011) 94: 1545–52. DOI: 10.3945 / ajcn.111.012815
PubMed Аннотация | CrossRef Полный текст | Google Scholar
104. Study HA, Newman AB, Nicklas BJ, Tylavsky FA, Ding J, Lee JS, et al. Потребление белка с пищей связано с изменением мышечной массы у пожилых людей, проживающих в сообществах: исследование «Здоровье, старение и состав тела» (Health ABC). Am J Clin Nutr. (2008) 87: 150–5. DOI: 10.1093 / ajcn / 87.1.150
CrossRef Полный текст | Google Scholar
105. Вольпи Э, Кобаяши Х, Шеффилд-Мур М, Миттендорфер Б, Вулф Р. Незаменимые аминокислоты в первую очередь отвечают за аминокислотную стимуляцию анаболизма мышечного белка у здоровых пожилых людей. Am J Clin Nutr. (2003) 78: 250–8. DOI: 10.1093 / ajcn / 78.2.250
PubMed Аннотация | CrossRef Полный текст | Google Scholar
106.Атертон П.Дж., Смит К., Этеридж Т., Рэнкин Д., Ренни М.Дж. Отчетливые анаболические реакции передачи сигналов на аминокислоты в клетках скелетных мышц C2C12. Аминокислоты. (2010) 38: 1533–9. DOI: 10.1007 / s00726-009-0377-x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
107. Haegens A, Schols AM, van Essen AL, van Loon LJ, Langen RC. Лейцин индуцирует накопление миофибриллярного белка в культивируемых скелетных мышцах посредством mTOR-зависимого и независимого контроля уровней мРНК тяжелой цепи миозина. Mol Nutr Food Res. (2012) 56: 741–52. DOI: 10.1002 / mnfr.201100695
PubMed Аннотация | CrossRef Полный текст | Google Scholar
108. Крозье С.Дж., Кимбалл С.Р., Эммерт С.В., Энтони Дж.С., Джефферсон Л.С. Пероральное введение лейцина стимулирует синтез белка в скелетных мышцах крыс. J Nutr. (2005) 135: 376–82. DOI: 10.1093 / jn / 135.3.376
PubMed Аннотация | CrossRef Полный текст | Google Scholar
109. Уилкинсон Д. Д., Хоссейн Т., Хилл Д. С., Филлипс Б. Э., Кроссленд Н., Уильямс Дж. И др.Влияние лейцина и его метаболита β-гидрокси-β-метилбутирата на метаболизм белков скелетных мышц человека. J Physiol. (2013) 591: 2911–23. DOI: 10.1113 / jphysiol.2013.253203
PubMed Аннотация | CrossRef Полный текст | Google Scholar
110. Фардет А., Рок Э. К новой философии профилактического питания: от редукциониста к целостной парадигме улучшения рекомендаций по питанию. Adv Nutr. (2014) 5: 430–46. DOI: 10.3945 / an.114.006122
PubMed Аннотация | CrossRef Полный текст | Google Scholar
112.Джейкобс Д.Р., Тапселл Л.С. Еда, а не питательные вещества, является основной единицей питания. Nutr Ред. (2007) 65: 439–50. DOI: 10.1111 / j.1753-4887.2007.tb00269.x
CrossRef Полный текст | Google Scholar
114. van Vliet S, Burd NA, van Loon LJ. Анаболический ответ скелетных мышц на потребление растительного белка по сравнению с потреблением животного белка. J Nutr. (2015) 145: 1981–91. DOI: 10.3945 / jn.114.204305
PubMed Аннотация | CrossRef Полный текст | Google Scholar
115.Gorissen SHM, Crombag JJR, Senden JMG, Waterval WAH, Bierau J, Verdijk LB и др. Содержание белка и аминокислотный состав коммерчески доступных изолятов белков растительного происхождения. Аминокислоты. (2018) 50: 1685–95. DOI: 10.1007 / s00726-018-2640-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
116. Тан Дж. Э., Мур Д. Р., Куйбида Г. В., Тарнопольский М. А., Филлипс С. М.. Прием гидролизата сыворотки, казеина или изолята соевого белка: влияние на синтез смешанного мышечного белка в состоянии покоя и после упражнений с отягощениями у молодых мужчин. J Appl Physiol. (2009) 107: 987–92. DOI: 10.1152 / japplphysiol.00076.2009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
118. Бурд Н. А., Билс Дж. В., Мартинес И. Г., Сальвадор А. Ф., Скиннер СКДЖСМ. Подход, основанный на еде, для улучшения регуляции синтеза и ремоделирования белка скелетных мышц после тренировки. Sports Med. (2019) 49: 59–68. DOI: 10.1007 / s40279-018-1009-y
PubMed Аннотация | CrossRef Полный текст | Google Scholar
119.Fardet A, Dupont D, Rioux LE, Turgeon SL. Влияние структуры пищи на биодоступность молочного белка, липидов и кальция: повествовательный обзор доказательств. Crit Rev Food Sci Nutr. (2018) 1–24. DOI: 10.1080 / 10408398.2018.1435503. [Epub перед печатью].
PubMed Аннотация | CrossRef Полный текст | Google Scholar
120. Эллиот Т.А., Кри М.Г., Сэнфорд А.П., Вулф Р.Р., Типтон К.Д. Прием молока стимулирует синтез чистого мышечного протеина после упражнений с отягощениями. Медико-спортивные упражнения. (2006) 38: 667–74. DOI: 10.1249 / 01.mss.0000210190.64458.25
PubMed Аннотация | CrossRef Полный текст | Google Scholar
121. Катсанос К.С., Чинкс Д.Л., Паддон-Джонс Д., Чжан Икс-джей, Аарсланд А., Вулф Р.Р. Прием сывороточного протеина пожилыми людьми приводит к большему накоплению мышечного протеина, чем прием составляющих его незаменимых аминокислот. Nutr Res. (2008) 28: 651–8. DOI: 10.1016 / j.nutres.2008.06.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
122.ван Влит С., Шай Э.Л., Абу Саван С., Билс Дж. В., Вест Д. В., Скиннер С. К. и др. Употребление цельных яиц способствует большей стимуляции синтеза мышечного протеина после тренировки, чем потребление изонитрогенного количества яичного белка у молодых мужчин. Am J Clin Nutr. (2017) 106: 1401–12. DOI: 10.3945 / ajcn.117.159855
PubMed Аннотация | CrossRef Полный текст | Google Scholar
123. Абу Саван С., ван Влит С., Вест DWD, Билс Дж. У., Палуска С. А., Бурд Н. А. и др. Прием внутрь цельного яйца, но не яичного белка, вызывает колокализацию mTOR с лизосомами после упражнений с отягощениями. Am J Physiol Cell Physiol. (2018) 315: C537–43. DOI: 10.1152 / ajpcell.00225.2018
CrossRef Полный текст | Google Scholar
ученых продемонстрировали прямую связь между сокращением ошибок в производстве белка и продолжительностью жизни
Исследователи из Лондонского института медицинских наук UCL и MRC продемонстрировали, что уменьшение естественных ошибок в синтезе белка улучшает как здоровье, так и продолжительность жизни у различных модельных организмов. Результаты, полученные на дрожжах, круглых червях и плодовых мушках, впервые демонстрируют прямую связь между меньшим количеством ошибок, связанных с белками, и долголетием.Исследование также показало, что некоторые препараты, одобренные для использования человеком и обладающие антивозрастными свойствами, исправляют ошибки в белках.
«Мы часто слышим о мутациях ДНК, которые могут вызывать рак и считаются одной из основных причин старения», — прокомментировала Ивана Бьедов, доктор философии из Института рака UCL. «Однако ошибками в белках, которые влияют на здоровье организма, в значительной степени пренебрегают, несмотря на то, что ошибки, вносимые во время синтеза новых белков, встречаются гораздо чаще, чем мутации, сделанные во время репликации ДНК.Поэтому в этом исследовании мы сосредоточились на ошибках, связанных с белками, и задались вопросом, улучшит ли здоровье меньшее количество ошибок, связанных с белками ». Бьедов является старшим автором статьи, опубликованной командой в Cell Metabolism , которая озаглавлена «Повышенная точность синтеза белка увеличивает продолжительность жизни».
В том, что авторы назвали «разительным контрастом с хорошо установленным влиянием мутаций ДНК на старение и болезни многоклеточного организма», роль ошибок в трансляции белков гораздо менее изучена и понятна, несмотря на то, что неправильный перевод является наиболее подверженным ошибкам шагом в экспрессия гена.«Частота белковых ошибок оценивается от 10 -3 до 10 -6 , в зависимости от организма и кодона», — писали они. Это на несколько порядков выше по сравнению с мутациями ДНК. И на самом деле, продолжили они, «нарушение протеостаза является критическим фактором, лежащим в основе старения и возрастных заболеваний, а трансляция — одна из его ключевых детерминант. Следовательно, очень необходимо более глубокое понимание биологического воздействия ошибок перевода в контексте старения организма.”
В своем опубликованном исследовании ученые исследовали эволюционную мутацию «сверхточной», известную как RPS23 K60R, обнаруженную в рибосомах (это фабрики по производству белка клетки) гипертермофильных архей, одноклеточного организма, который может жить при чрезвычайно высоких температурах. температуры. Используя методы редактирования генома, команда сконструировала рибосому многоклеточных животных, несущую ту же мутацию (изменение одной аминокислоты), что и гипертермофильные археи, и воспроизвела ее влияние на синтез белка на простых модельных организмах, а именно на плодовой мушке , Drosophila melanogaster , дрожжах ( Schizosaccharomyces pombe ) и аскариды Caenorhabditis elegans .
«Мы выдвинули гипотезу, что повышение точности синтеза белка может быть вмешательством против старения в многоклеточных организмах», — писали они. «Здесь мы исследовали физиологические последствия прямой мутации одного эволюционно законсервированного остатка в декодирующем центре рибосомы и впервые исследовали у многоклеточных животных влияние повышенной верности синтеза белка на старение».
Анализ ученых подтвердил, что в белках организмов было меньше ошибок, и в результате они стали термостойкими и жили дольше.«При введении в эукариотические гомологи RPS23 эта мутация приводит к точному преобразованию, а также к устойчивости к тепловому шоку и увеличению продолжительности жизни у дрожжей, червей и мух», — заявила команда. Первый автор, Виктория Евгения Мартинес-Мигель, доктор философии из Института рака Калифорнийского университета в Лос-Анджелесе, сказала: «Процесс создания белков не безошибочный — рибосомы совершают ошибки. Мы впервые показали, что замена одной аминокислоты в центре декодирования рибосом снижает ошибки синтеза белка и улучшает стрессоустойчивость организма и его продолжительность жизни.”
В дополнение к переработанным рибосомам, исследователи обнаружили, что некоторые препараты, одобренные для использования человеком, также могут уменьшить количество ошибок в белках. «Большой интерес к биологии старения проистекает из возможности улучшить здоровье пожилых людей, имитируя влияние мутаций долголетия на физиологию организма с помощью фармакологических подходов», — заявили они. Интересно, что эти препараты, рапамицин, торин и траметиниб, также известны как препараты против старения. Они влияют на способность клеток воспринимать питательные вещества и, следовательно, при применении в небольших количествах могут иметь такой же эффект, как ограничение калорий, известное лечение, способствующее долголетию.Новое исследование предполагает, что уменьшение количества ошибок, связанных с белками, является объединяющим механизмом антивозрастных препаратов, которые могут способствовать здоровому старению.
«… мы показываем, что препараты против старения, такие как рапамицин, торин1 и траметиниб, уменьшают ошибки трансляции, и что рапамицин увеличивает продолжительность жизни организма у мутантов с повышенной точностью RPS23», — заявили ученые. «Наша работа демонстрирует, что повышенная точность перевода может быть достигнута фармакологически, и приводит аргументы в пользу скрининга соединений, которые могут снизить количество ошибок, связанных с белками во время старения.”
Соавтор-корреспондент Филипе Кабрейро, доктор философии из Лондонского института медицинских наук MRC, далее отметил: «Это первое исследование организма многоклеточных животных, которое показало, что меньшее количество ошибок в белках может продлить здоровье и долголетие; мы ожидаем, что наши результаты по дрожжам, червям и мухам будут распространены на млекопитающих, что потенциально может привести к лечению для улучшения здоровья пожилых людей ». Авторы пришли к выводу, что «в совокупности эти результаты свидетельствуют в пользу исследования методов лечения, направленных на повышение точности перевода в контексте старения и возрастных заболеваний, особенно нейродегенеративных заболеваний, на которые в первую очередь влияет ухудшение протеостаза.”
Диетический белок и продолжительность жизни через границу метаморфизма: ограниченные белком личинки развиваются в недолговечных взрослых особей
Фонтана, Л., Партридж, Л. и Лонго, В. Д. Увеличение продолжительности здоровой жизни — от дрожжей до человека. Science 328, 321–326 (2010).
ADS CAS Статья PubMed Google Scholar
Накагава, С., Лагиш, М., Гектор, К. Л. и Спенсер, Х. Г. Сравнительные и метааналитические исследования продления жизни за счет ограничения питания.Aging Cell 11, 401–409 (2012).
CAS Статья PubMed Google Scholar
Боггс, К. Л. Понимание истории жизни и старения насекомых через призму распределения ресурсов. Функц. Экол. 23, 27–37 (2009).
Артикул Google Scholar
Холлидей, Р. Питание, воспроизводство и долголетие: является ли увеличение продолжительности жизни животных с ограничением калорий эволюционной адаптацией? Биологические исследования 10, 125–127 (1989).
CAS Статья PubMed Google Scholar
Пайпер, М. Д. У., Майр, В. и Партридж, Л. Подсчет калорий: роль определенных питательных веществ в увеличении продолжительности жизни за счет ограничения питания. Журнал «Геронтол сер А-биол научная медицина» 60, 549–555 (2005).
Артикул Google Scholar
Майр В., Пайпер М. Д. У. и Партридж Л. Калории не объясняют продление жизни дрозофилы ограничением в питании.PLoS Biol 3, 1305–1311 (2005).
CAS Статья Google Scholar
Ли, К. П. и др. Продолжительность жизни и размножение у дрозофилы: новые открытия из геометрии питания. Proc Natl Acad Sci USA 105, 2498–2503 (2008).
ADS CAS Статья PubMed Google Scholar
Раубенхаймер, Д., Симпсон, С. Дж. И Майнц, Д. Питание, экология и экология питания: к интегрированной структуре.Funct Ecol 23, 4–16 (2009).
Артикул Google Scholar
Маклаков А.А. и др. Влияние приема питательных веществ на репродуктивную функцию и продолжительность жизни с учетом пола. Curr Biol 18, 1062–1066 (2008).
CAS Статья PubMed Google Scholar
Фэнсон, Б. Г., Велдон, К. В., Перес-Стейплс, Д., Симпсон, С. Дж. И Тейлор, П. В. Питательные вещества, а не ограничение калорийности, увеличивают продолжительность жизни плодовых мух Квинсленда ( Bactrocera tryoni ).Aging Cell 8, 514–523 (2009).
CAS Статья PubMed Google Scholar
Симпсон, С. Дж. И Раубенхаймер, Д. Баланс макронутриентов и продолжительность жизни. Aging-Us 1, 875–880 (2009).
CAS Статья Google Scholar
Hunt, J. et al. Высококачественные самцы полевых сверчков активно участвуют в сексуальной демонстрации, но умирают молодыми. Nature 432, 1024–1027 (2004).
ADS CAS Статья PubMed Google Scholar
Боггс, К. Л. и Фриман, К. Д. Ограничение питания личинок у бабочек: влияние на распределение ресурсов и приспособленность взрослых особей. Oecologia 144, 353–361 (2005).
ADS Статья PubMed Google Scholar
Цваан, Б. Дж., Бийлсма, Р. и Хекстра, Р. Ф. О теории развития старения.I. Устойчивость к голоданию и долголетие у Drosophila melanogaster в связи с условиями размножения до взрослой особи. Наследственность 66, 29–39 (1991).
Артикул PubMed Google Scholar
Ту, М. П. и Татар, М. Ограничение рациона несовершеннолетних, старение и размножение взрослых особей Drosophila melanogaster . Ячейка старения 2, 327–333 (2003).
CAS Статья PubMed Google Scholar
Бондурянский, р.Эволюция зависимого от состояния полового диморфизма. Am Nat 169, 9–19 (2007).
Артикул PubMed Google Scholar
Зайичек, Ф., Хант, Дж., Дженнионс, М. Д., Холл, М. Д. и Брукс, Р. С. Влияние диеты для молодых и взрослых особей на старение и репродуктивную способность самцов и самок черных полевых сверчков, Teleogryllus productus. Funct Ecol 23, 602–611 (2009).
Артикул Google Scholar
Джой, Т.К., Арик, А. Дж., Корби-Харрис, В., Джонсон, А. А. и Риле, М. А. Влияние ограничения питания личинок и взрослых особей на продолжительность жизни, размножение и рост комара Aedes aegypti . Exp Gerontol 45, 685–690 (2010).
Артикул PubMed Google Scholar
Адлер, М. И., Кэссиди, Э. Дж., Фрике, К. и Бондуриански, Р. Компромисс между продолжительностью жизни и воспроизводством при ограничении питания зависит от пола и контекста.Эксп. Геронтол 48, 539–548 (2013).
Артикул PubMed Google Scholar
Келли, К. Д., Нейер, А. А. и Гресс, Б. Е. Реакции анамнеза жизни с учетом пола на качество нимфальной диеты и иммунный статус у полевого сверчка. Журнал Evol Biol. 27, 381–390 (2014).
CAS Статья PubMed Google Scholar
Раубенхаймер Д. и Симпсон С. Дж. Геометрия компенсирующего питания саранчи.Anim Behav 45, 953–964 (1993).
Артикул Google Scholar
Sentinella, A. T., Crean, A. J. и Bonduriansky, R. Диетический белок опосредует компромисс между выживанием личинок и развитием вторичных половых признаков самцов. Funct Ecol 27, 1134–1144 (2013).
Артикул Google Scholar
Телеман, А.А. Молекулярные механизмы метаболической регуляции инсулином у дрозофилы.Биохимический журнал 425, 13–26 (2010).
CAS Статья Google Scholar
Бриттон Дж. С. и Эдгар Б. А. Экологический контроль клеточного цикла у дрозофилы: питание активирует митотические и эндорепликативные клетки с помощью различных механизмов. Development 125, 2149–2158 (1998).
CAS PubMed Google Scholar
Боггс, К. Л. Детерминанты питания и жизненного цикла распределения ресурсов голометаболических насекомых.Am Nat 117, 692–709 (1981).
Артикул Google Scholar
Боггс, К. Л. Репродуктивное распределение из резервов и доходов у видов бабочек с различным рационом взрослых особей. Экология 78, 181–191 (1997).
Артикул Google Scholar
Дмитриев, К. и Роу, Л. Влияние питания личинок на репродуктивную способность в условиях ограниченного питания взрослых особей.PLoS One 6, e17399 (2011).
ADS CAS Статья PubMed Google Scholar
Агила, Дж. Р., Сушко, Дж., Гиббс, А. Г. и Хошизаки, Д. К. Роль личиночных жировых клеток у взрослых особей Drosophila melanogaster . J Exp Biol 210, 956–963 (2007).
Артикул PubMed Google Scholar
Бондурянский Р., Маклаков А., Зайичек Ф.И Брукс, Р. Половой отбор, сексуальные конфликты и эволюция старения и продолжительности жизни. Funct Ecol 22, 443–453 (2008).
Артикул Google Scholar
Бондурианский Р. и Брассил К. Э. Репродуктивное старение и половой отбор в зависимости от размера тела самцов в дикой популяции пантовых мух ( Protopiophila litigata ). J. Evol Biol. 18, 1332–1340 (2005).
CAS Статья PubMed Google Scholar
Бондурянский, р.И Хед М. Влияние состояний матери и отца на фенотип потомства у Telostylinus angusticollis (Diptera: Neriidae). J. Evol Biol. 20, 2379–2388 (2007).
CAS Статья PubMed Google Scholar
Кавасаки, Н., Брассил, К.Э., Брукс, Р.С. и Бондуриански, Р. Влияние окружающей среды на выражение продолжительности жизни и старения: крайний контраст между дикими и содержащимися в неволе когортами Telostylinus angusticollis (Diptera: Neriidae) .Am Nat 172, 346–357 (2008).
Артикул PubMed Google Scholar
Адлер М. И., Бондурианский Р. Разные издержки любви и войны: возрастная смертность как функция функционального соотношения полов. Журнал Evol Biol. 24, 1169–1177 (2011).
CAS Статья PubMed Google Scholar
Точное производство протеина способствует долголетию
Согласно статье, опубликованной на этой неделе (14 сентября) в Cell Metabolism , генетическая поправка, улучшающая точность синтеза протеина, может продлить продолжительность жизни организма.Результаты были одинаковыми для трех видов — нематоды Caenorhabditis elegans , плодовой мухи Drosophila melanogaster и дрожжей Schizosaccharomyces pombe — предполагая, что формирование лучших белков может быть связано с долголетием и у других видов.
«Работа очень убедительна, очень убедительна, и я думаю, что она решает действительно важный нерешенный вопрос в области старения: как лучше всего заботиться о наших белках и помогать себе дольше функционировать лучше?» говорит исследователь белка Джон Лаббадиа из Университетского колледжа Лондона, который не принимал участия в исследовании.
По мере старения организма эффективность и точность его клеточных процессов ухудшаются. Например, производство, сворачивание и деградация белка ухудшаются по качеству, так что потеря гомеостаза белка (протеостаза) является «основным признаком старения» и возрастных заболеваний, говорит молекулярный биолог Патриция ван Остен-Хавл из Университета. Лидса, которые не принимали участие в исследовании.
В случае производства белка — трансляции РНК-кода в пептидные цепи — распространенность ошибок «положительно коррелирует с продолжительностью жизни», — пишет в своей статье Вера Горбунова, исследовательница старения из Университета Рочестера. электронное письмо на номер The Scientist .Однако «доказательств того, что можно взять недолговечный организм и продлить его жизнь, сделав перевод более точным, не хватало», — пишет она, добавляя, что новая статья Cell Metabolism «дает последнее недостающее доказательство».
Внутри белковых фабрик клетки, известных как рибосомы, белок под названием RPS23 считается критически важным для точности трансляции. Таким образом, RPS23 был очевидным кандидатом при поиске способов повышения точности воспроизведения, объясняет молекулярный биолог Ивана Бьедов из Института рака Университетского колледжа Лондона.Ее команда изучила RPS23 у различных видов, от млекопитающих до микробов. Внутри белка они обнаружили область настолько высококонсервативной, что, за исключением некоторых микроорганизмов, которые живут в чрезвычайно жаркой среде, у всех видов была идентичная аминокислота в одном и том же положении.
Как лучше всего заботиться о наших белках и помогать себе дольше функционировать?
—Джон Лаббадиа, Университетский колледж Лондона
Бьедов задался вопросом, как изменение одной аминокислоты, наблюдаемое у термофилов, может повлиять на точность перевода.Ее команда внесла изменение в ген RPS23 у D. melanogaster и обнаружила, что не только повысилась точность перевода, но и мухи могли выжить при более высоких температурах и жили примерно на 10-20 процентов дольше, чем контрольные мухи.
Сотрудник Бедова, Филипе Кабрейро из MRC Лондонского института медицинских наук, затем ввел такую же замену аминокислоты RPS23 в C. elegans и получил аналогичные результаты. Дальнейшие исследования показали, что замена аминокислот повысила точность трансляции и увеличила продолжительность жизни дрожжей.
Получение стабильных результатов по трем видам «дает больше уверенности в том, что вы видите», — говорит Кабрейро. «Это надежное наблюдение».
У мух и червей мутация, продлевающая жизнь, была связана с задержкой развития и размножения, хотя в конечном итоге количество полученного потомства было таким же, как у контрольных животных. Точно так же у дрожжей мутация заставляла колонии расти медленнее. Неясно, почему мутация вызвала задержку в развитии.Скорость трансляции между подопытными и контрольными животными оказалась равной, как и другие фенотипические признаки. Но задержка может объяснить, почему мутация, которая в остальном казалась бы полезной, не так широко распространена в природе, говорят исследователи.
Наконец, команда показала, что, по крайней мере, для мух, животные не только продлили жизнь, но и улучшили здоровье: гериатрические тестовые мухи все еще карабкались по стенкам их пузырьков, тогда как контрольные мухи того же возраста уже не делали этого. так.По сути, тестовые мухи дольше оставались молодыми.
Следующим важным шагом в этом исследовании, по словам ван Остен-Хаула, будет «посмотреть, что произойдет в модельных системах позвоночных».



 Таким продуктом является хорошо знакомая соотечественникам гречневая крупа (или мука), широко представленная в национальных кухнях России, Китая, Японии, Кореи и даже Индии, которая является исторической родиной растения»
Таким продуктом является хорошо знакомая соотечественникам гречневая крупа (или мука), широко представленная в национальных кухнях России, Китая, Японии, Кореи и даже Индии, которая является исторической родиной растения» Она любима диетологами за высокие пищевые качества, её легко приобрести. Есть работы, посвящённые антиоксиданту ресвератролу — он содержится в винограде и тоже считается полезным для продления жизни клеток. Но виноград и производящиеся из него продукты, во-первых, малодоступны во многих регионах мира (в частности, в Сибири), во-вторых, эта ягода очень калорийна и не отличается диетическими свойствами. Сложно представить, сколько винограда придётся съесть, чтобы запустить механизмы клеточного восстановления»
Она любима диетологами за высокие пищевые качества, её легко приобрести. Есть работы, посвящённые антиоксиданту ресвератролу — он содержится в винограде и тоже считается полезным для продления жизни клеток. Но виноград и производящиеся из него продукты, во-первых, малодоступны во многих регионах мира (в частности, в Сибири), во-вторых, эта ягода очень калорийна и не отличается диетическими свойствами. Сложно представить, сколько винограда придётся съесть, чтобы запустить механизмы клеточного восстановления» Но при этом ограничение калорийности привело к снижению общего количества белка в крови на 19%, в желудке на 95%, а в печени и почках 35,2% и 27% соответственно. Нечто подобное можно наблюдать у людей, которые садятся на жёсткие диеты, избегая физических нагрузок: их мышечная ткань и весь организм в целом страдает от недостатка главного строительного материала – белков. У группы крыс, в чей рацион входила гречка, мы обнаружили умеренную экспрессию «белка долголетия» SIRT1. Она не была слишком низкой или опасно высокой. Это именно «золотая середина», которая положительно влияет на здоровье организма»
Но при этом ограничение калорийности привело к снижению общего количества белка в крови на 19%, в желудке на 95%, а в печени и почках 35,2% и 27% соответственно. Нечто подобное можно наблюдать у людей, которые садятся на жёсткие диеты, избегая физических нагрузок: их мышечная ткань и весь организм в целом страдает от недостатка главного строительного материала – белков. У группы крыс, в чей рацион входила гречка, мы обнаружили умеренную экспрессию «белка долголетия» SIRT1. Она не была слишком низкой или опасно высокой. Это именно «золотая середина», которая положительно влияет на здоровье организма» При прионных болезнях состав спинномозговой жидкости не изменен или изменен незначительно.
При прионных болезнях состав спинномозговой жидкости не изменен или изменен незначительно.