Тайны женского оргазма — BBC News Україна
- Линда Геддес
- BBC Future
От загадочной точки G до возникновения множественного оргазма — женская сексуальность всегда удивляла ученых. Корреспондент BBC Future Линда Геддес рассказывает о смелых экспериментах, которые наконец позволили ученым найти ответы на эти вопросы.
Моя стиральная машинка имеет кнопку блокировки. Для ее активации необходимо удерживать кнопку запуска некоторое время с определенной интенсивностью. Если нажимать слишком слабо, ничего не происходит, нажмешь сильнее, чем надо, — и машина сердито подает звуковой сигнал. Но как только вы освоите технику, все становится очень легко. Включаются огоньки, механизм начинает двигаться и в конечном итоге достигает кульминации с дрожью и крещендо. Куча запутанной, влажной, но свежей одежды выпадает с другой стороны. Для непосвященных — это удивительный процесс.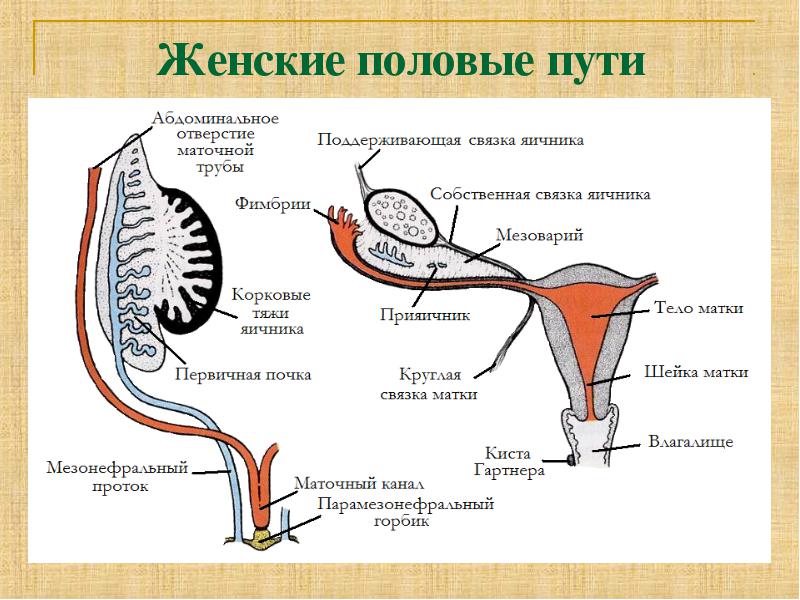
Дж. Д. Сэлинджер написал однажды: «Женское тело — это как скрипка. Чтобы уметь играть на ней, надо быть отличным музыкантом». Правильный напор и ласки отправляют женщину в такой экстаз, что на несколько секунд остальной мир перестает для нее существовать. Но сделайте что-то немного не так, и в результате — боль, разочарование или просто ничего. У мужчин все совсем иначе. Только у них появляется эрекция, несколько минут энергичной стимуляции обычно приводят к эякуляции.
Почему оргазм приносит такое удовольствие? Откуда у женщин способность к множественному оргазму? И на самом ли деле существует мистическая точка G? У медицины долго не было ответов на эти вопросы. «Мы можем полететь на Луну, но мы все еще так мало знаем о нашем собственном теле», — говорит Эммануил Джанини из Римского университета Тор Вергата, который вместе со своими коллегами посвятил свою карьеру исследованию человеческой сексуальности. Эти реальные «Мастера секса» («Masters of Sex» — американский телесериал, посвященный пионерам в области исследования сексуальности человека Уильяму Мастерса и Вирджинии Джонсон. — Ред.) провели множество экспериментов в течение последних лет и пришли к некоторым важным выводам.
— Ред.) провели множество экспериментов в течение последних лет и пришли к некоторым важным выводам.
Мозг в огне
Самая сложная задача для ученых — убедить женщин отбросить стеснительность и принять участие в экспериментах, которые предусматривают мастурбацию или половой акт в лабораторных условиях и под неудобным глазом МРТ-сканера. Один из лидеров этого исследования, доктор Барри Комисарук из Рутгерского университета в штате Нью-Джерси, попытался проверить гипотезу, согласно которой разница между женским и мужским оргазмом объясняется различными реакциями в мозге.
Исследования показали, что несмотря на довольно разные пути к оргазму, и мужчины, и женщины демонстрировали похожую нейронную активность головного мозга. «Во время оргазма реакции мозга мужчин и женщин скорее показывают больше сходства, чем различий, — рассказывает доктор Комисарук. — Мы видим тотальную активацию головного мозга. Говоря простым языком, это как все системы включаются одновременно».
Автор фото, Getty
Підпис до фото,Мозг женщины продолжает получать сигналы от гениталий после оргазма, что объясняет способность женского организма к множественным оргазмам
Это объясняет, почему оргазмы такие всепоглощающие — если пылает весь лес, очень трудно определить, где началось возгорание. «Если во время оргазма все части мозга активируются одновременно, почти невозможно отличить деятельность его отдельных участков», — говорит профессор Комисарук. Именно поэтому мы не можем думать ни о чем другом.
Этот костер все же имеет горячие точки. Одной из них является так называемое прилегающее ядро — отдел мозга, отвечающий за удовольствие, запускающий действие специфического гормона дофамина. Во время экспериментов крысы предпочитали электрическую стимуляцию этой области мозга еде настолько, что могли голодать до смерти. Кроме секса, эта область также активируется под действием кокаина, амфетамина, кофеина, никотина и шоколада. Неудивительно, что оргазмы заставляют нас хотеть еще.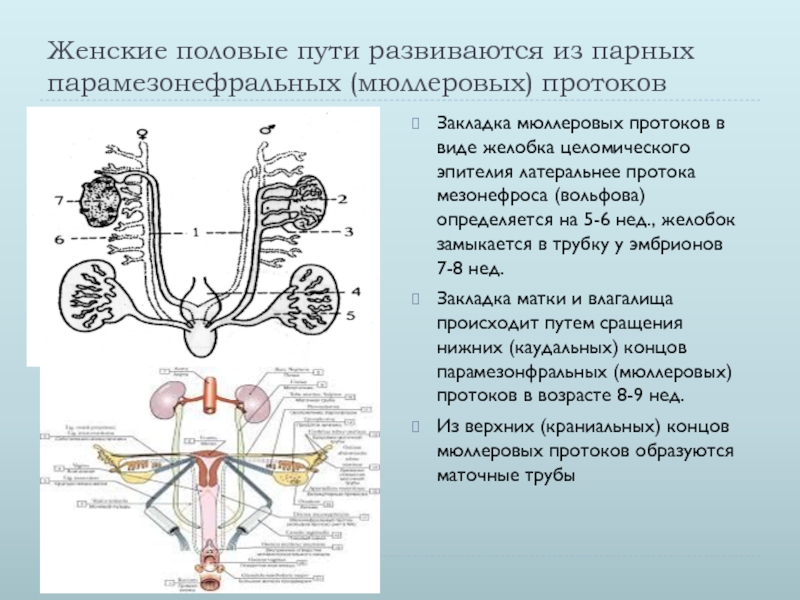
Однако после оргазма возникают некоторые важные различия, которые объясняют, почему мужчины и женщины после кульминации реагируют по-разному. Доктор Комисарук вместе с коллегой Качин Аллен обнаружили предыдущие свидетельства того, что определенные участки головного мозга мужчин перестают отвечать на дальнейшую сенсорную стимуляцию половых органов сразу после оргазма. В то время как мозг женщин остается активированным. Это открытие может быть ответом на вопрос, почему женщины способны испытывать множественные оргазмы, а мужчины — нет.
Анатомия удовольствия
Самым сложным вопросом для науки остается анатомия оргазма. Пенис имеет только один путь для передачи сенсорного ощущения в мозг, тогда как женские половые органы — три или четыре.
Центром женской сексуальности является клитор — небольшой округлый холм, расположенный в неудобном месте на расстоянии сантиметра от входа во влагалище. Кто именно открыл значимость клитора в достижении оргазма, остается неизвестным. Первые изображения этого органа появились на палеолитических Венерах — женских статуэтках с большой грудью, округлым животом, увеличенными половыми органами, которые символизировали культ плодородия.
Первые изображения этого органа появились на палеолитических Венерах — женских статуэтках с большой грудью, округлым животом, увеличенными половыми органами, которые символизировали культ плодородия.
В XVI веке клитор был впервые описан как отдельный орган женского организма, который вызывает удовольствие. Итальянский хирург и анатом эпохи Возрождения Реальд Коломбо в своей книге De re anatomica, опубликованной в 1559 году, описал клитор как «центр удовольствия женщины». Тем не менее, в последующие века женское удовольствие отошло на задний план, и о клиторе забыли — по крайней мере, анатомы и врачи.
Автор фото, Getty
Підпис до фото,Сможет ли наука объяснить, почему женщины и мужчины воспринимают секс по-разному?
Он снова появился в медицинских трудах в XX веке, но ему не уделяли должного внимания. Хотя Зигмунд Фрейд признавал, что клитор помогает испытать оргазм, он считал, что клиторальный оргазм не является зрелым и должен с возрастом вытесняться вагинальным. Неспособность испытывать вагинальный оргазм ученый связывал с психосексуального незрелостью.
Неспособность испытывать вагинальный оргазм ученый связывал с психосексуального незрелостью.
Более поздние исследования показали, что метр психоанализа ошибался. Около 30-40% женщин утверждают, что никогда не достигали оргазма с помощью только вагинальной стимуляции.
Предположение, что вагинальный оргазм важнее клиторальнлшл, вызвало возмущение среди феминисток. Это звучит так, будто женщины, которые не испытывают вагинального оргазма, просто не достаточно стараются. Итак, вагинальный оргазм возможен у всех женщин или это привилегия счастливого меньшинства? Возможно ли иметь оргазм даже при отсутствии клитора?
Доктор Барри Комисарук сделал первые шаги к ответу на эти вопросы случайно, в ходе исследования брачного поведения крыс. Во время одного эксперимента он вставил стержень во влагалище самки крысы, и это вызвало странную реакцию животного. «Как только я коснулся шейки матки, самка стала совершенно неподвижной», — рассказывает ученый. Кроме того, при такой стимуляции крысы были нечувствительными к боли. Дальнейшие эксперименты подтвердили гипотезу ученого — вагинальная стимуляция блокировала ощущение боли. Но как это происходит?
Дальнейшие эксперименты подтвердили гипотезу ученого — вагинальная стимуляция блокировала ощущение боли. Но как это происходит?
Чтобы узнать о причинах такой реакции, доктор Комисарук провел исследование вместе с профессором Беверли Випплом, изучая женщин с разной степенью повреждения спинного мозга. Исследования показали, что даже когда нервные пути в спинном мозге от половых органов к головному мозгу были повреждены из-за травмы, женщины могли чувствовать прикосновения к влагалищу и шейке матки. Некоторые из них были способны испытывать оргазм, даже когда их половой нерв, который передает ощущение от клитора мозгу, был полностью блокирован. «Женщины с повреждением спинного мозга, которые не могли чувствовать свой клитор, тем не менее испытывали оргазм с помощью вагинальной стимуляции», — рассказывает доктор Комисарук. «Наверное, это лучшее доказательство того, что вагинальный оргазм существует».
Автор фото, Getty
Підпис до фото,Женские половые органы связаны с мозгом многими нервными путями
Ощущение из влагалища передаются в мозг с помощью так называемых блуждающих нервов, расположенных за пределами спинного мозга. «Женщины описывают клиторальный оргазм как более местный и внешний, тогда как вагинальный оргазм охватывает все тело. Вполне вероятно, это вызвано тем, что нервы, которые передают ощущения от клитора, отличаются от вагинальных», — добавляет доктор Комисарук. А что касается того, что вагинальный оргазм загадочным образом блокирует боль, может объясняться тем, что нервы спинного мозга вырабатывают гормон нейромедиатор, участвующий в восприятии боли. После того, как сигналы достигают мозга, они могут также вызвать высвобождение гормонов, таких как эндорфины, которые уменьшают боль.
«Женщины описывают клиторальный оргазм как более местный и внешний, тогда как вагинальный оргазм охватывает все тело. Вполне вероятно, это вызвано тем, что нервы, которые передают ощущения от клитора, отличаются от вагинальных», — добавляет доктор Комисарук. А что касается того, что вагинальный оргазм загадочным образом блокирует боль, может объясняться тем, что нервы спинного мозга вырабатывают гормон нейромедиатор, участвующий в восприятии боли. После того, как сигналы достигают мозга, они могут также вызвать высвобождение гормонов, таких как эндорфины, которые уменьшают боль.
Итак, если разные нервы передают ощущения с разных участков женских половых органов — и все они могут вызвать оргазм — возможно, некоторые участки влагалища более чувствительны, чем другие? Как парам поймать неуловимый вагинальный оргазм?
Точка G
Знаменитая точка G в течение долгого времени оставалась объектом горячих дебатов. Впервые термин ввел немецкий акушер и гинеколог Эрнст Грефенберг (первая буква его имени дала название этой точки. — Ред.) в начале 80-х. В 1950-е годы он описал эрогенную зону на передней стенке влагалища, которая расположена на уровне уретры. Дальнейшие исследования показали, что в этом месте находится комплекс кровеносных сосудов, нервных окончаний, а также остаток железы, которая является эквивалентом мужской простаты. Исследования показывают, что небольшое количество женщин — особенно те, которые имеют сильные мышцы тазового дна — с помощью стимуляции этой области могут чувствовать мощные оргазмы, сопровождаемые выбросом небольшого количества жидкости из мочевого пузыря, которая не является мочой.
— Ред.) в начале 80-х. В 1950-е годы он описал эрогенную зону на передней стенке влагалища, которая расположена на уровне уретры. Дальнейшие исследования показали, что в этом месте находится комплекс кровеносных сосудов, нервных окончаний, а также остаток железы, которая является эквивалентом мужской простаты. Исследования показывают, что небольшое количество женщин — особенно те, которые имеют сильные мышцы тазового дна — с помощью стимуляции этой области могут чувствовать мощные оргазмы, сопровождаемые выбросом небольшого количества жидкости из мочевого пузыря, которая не является мочой.
Автор фото, Getty
Підпис до фото,Охота на загадочную точку G открыла сложную анатомию женской половой системы
Вдруг все начали говорить об этой волшебной кнопке на передней стенке влагалища. Пары прилагали усилия — часто вполне бесполезные — в поисках этого участка. Между тем, некоторые феминистки заявили, что все большая популярность точки G — это попытка мужчин возродить важность вагинального проникновения после того, как во времена сексуальной революции 60-70-х годов его затмил клиторальный оргазм.
Данные, подтверждающие или опровергающие существование точки G, часто непоследовательны и преувеличены. Одно исследование, которое отрицало существование точки G, базировалось на результатах МРТ только одной женщины. Дебаты все усложняются препирательствами о правильности терминологии для различных внутренних участков женских половых органов, а также о том, что считать началом и концом этой области. Тем не менее, кажется, физические различия между женщинами, которые испытывали вагинальный оргазм, и теми, кто не испытывал его, все же есть. В 2008 году доктор Джаннини опубликовал исследование с участием девяти женщин, которые имели вагинальный оргазм и 11-ти, которые утверждали, что никогда не достигали кульминации во время проникающего секса. Ультразвуковое исследование показало более толстую зону ткани в пространстве между вагиной и уретрой у первой группы респондентов.
Сначала доктор Джаннини пришел к выводу, что эта зона и является легендарной точкой G. Но дальнейшие исследования заставили переосмыслить этот вывод. «Слово «точка» предполагает нечто вроде кнопки, которую достаточно нажать, чтобы получить удовольствие, — говорит он. — Она или есть, или ее нет. Но никто не смог описать конкретное местоположение этого участка».
Но дальнейшие исследования заставили переосмыслить этот вывод. «Слово «точка» предполагает нечто вроде кнопки, которую достаточно нажать, чтобы получить удовольствие, — говорит он. — Она или есть, или ее нет. Но никто не смог описать конкретное местоположение этого участка».
Итак, если это не кнопка, то что тогда? Для многих ученых ответ очевиден — это клитор. Недавние МРТ исследования клитора показали, что представление о нем, как о крохотном органе под поверхностью кожи, далеко от истины. Анализы показывают большую, выпуклую структуру почти 9 см в длину, вилообразной формы. Она расположена от края влагалища до середины таза вдоль уретры.
Верхняя часть этого органа — наиболее чувствительная — расположена на поверхности. А ее дуги охватывают обе стороны влагалища и продолжаются в половых губах.
Этот орган женского организма имеет такое же происхождение, как и мужской пенис. Оба органа формируются из одной эмбриональной ткани на ранних стадиях развития плода. Но есть важные отличия: мужской половой орган не зависит от действия гормонов, например, тестостерона, после того как период созревания заканчивается. Влагалище, наоборот, реагирует на гормоны, в частности эстроген, объясняет, почему сексуальное желание женщины колеблется в течение всей жизни.
Но есть важные отличия: мужской половой орган не зависит от действия гормонов, например, тестостерона, после того как период созревания заканчивается. Влагалище, наоборот, реагирует на гормоны, в частности эстроген, объясняет, почему сексуальное желание женщины колеблется в течение всей жизни.
Cложное строение половых органов объясняет, почему так трудно доказать — или опровергнуть — существование точки G. Итак, стимуляция передней стенки влагалища невозможна без соприкосновения с внутренними частями клитора и уретры.
Размер имеет значение?
Учитывая эти исследования, ученые начали задумываться, могут ли размер и расположение клитора у здоровых женщин влиять на легкость, с которой они достигают оргазма во время проникающего секса. МРТ-сканирование показало, что чем меньше размер внешней части клитора и чем дальше он расположен от входа во влагалище, тем труднее женщинам достичь оргазма с помощью только вагинальной стимуляции.
Таким образом эти исследования доказывают, что женщины могут достичь оргазма многими путями — с помощью либо вагинальной стимуляции, либо стимуляции клитора, либо и того и другого. Дальнейшие исследования доктора Комисарука показали, что ощущения с разных участков женских половых органов — а также сосков — поступают в одну область головного мозга, хотя и в несколько различные участки.
Дальнейшие исследования доктора Комисарука показали, что ощущения с разных участков женских половых органов — а также сосков — поступают в одну область головного мозга, хотя и в несколько различные участки.
«Таким образом, различные типы оргазмов имеют нейро-анатомическое объяснение, — говорит доктор Комисарук. — Это доказывает, почему одновременно стимуляция клитора, влагалища и шейки матки приводит к более интенсивным, сложным и приятным оргазмам, которые описывают женщины».
Женщинам, которым трудно достичь кульминации во время проникающего секса, или любого секса, ученые рекомендуют одно — экспериментировать.
Автор фото, Getty
Підпис до фото,Универсального рецепта для хорошего секса не существует
«Мои пациентки говорят: «Я не могу иметь вагинальный оргазм, поэтому со мной что-то не так, — говорит доктор Рэйчел Полз из Цинциннати в штате Огайо. — Но это не так. Каждая женщина имеет индивидуальные особенности. Кому-то достаточно стимуляции клитора во время проникающего секса, для кого-то — это несколько сложнее и требует дополнительной стимуляции.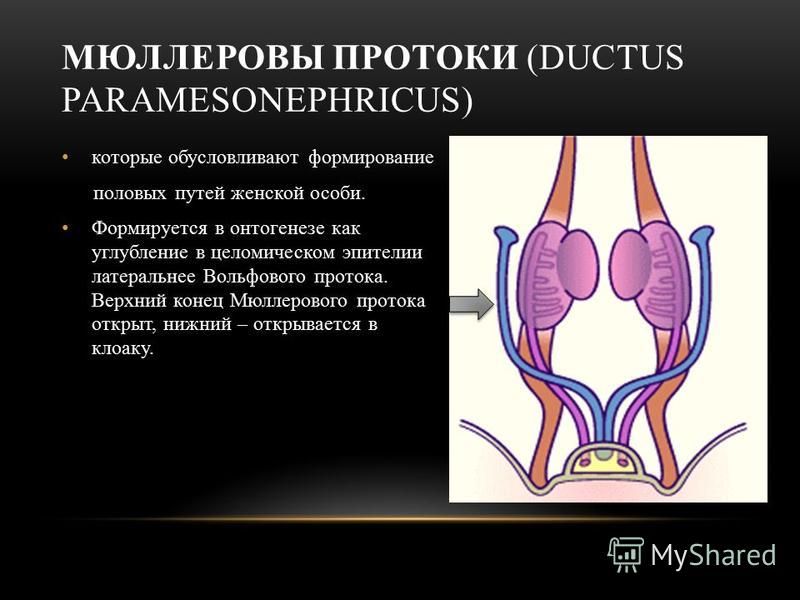 Но женщины должны знать, что если они не испытывают оргазм от вагинального проникновения, то это вполне нормально».
Но женщины должны знать, что если они не испытывают оргазм от вагинального проникновения, то это вполне нормально».
Послание профессора Джаннини женщинам гласит: «Наслаждайтесь не только сексом, но и познанием собственного тела, поймите, кто вы есть сегодня, потому что завтра вы, возможно, будете другой. Не игнорируйте бесконечное разнообразие, которое нам предлагает природа. Женский организм — это не машина, которая всегда работает одинаково».
Аномалии развития женских половых органов
Пороки развития внутренних половых органов — врождённые нарушения формы и структуры матки и влагалища. Пороки развития женских половых органов составляют 4% среди всех врождённых аномалий развития. Их выявляют у 3,2% женщин репродуктивного возраста. Пороки развития мочеполовой системы занимают 4-е место (9,7%) в структуре всех аномалий развития современного человека.
К группе риска по рождению девочек с пороками развития относятся женщины, имеющие профессиональные вредности и вредные привычки (алкоголизм, курение), перенесшие в сроки беременности от 8 до 16 недели вирусные инфекции. До настоящего времени не установлено точно, что именно лежит в основе возникновения пороков развития матки и влагалища. Однако несомненна роль наследственных факторов, биологической неполноценности клеток, формирующих половые органы, воздействия вредных физических, химических и биологических агентов. Возникновение различных форм пороков развития матки и влагалища зависит от патологического влияния тератогенных факторов или реализации наследственной предрасположенности в процессе эмбриогенеза.
До настоящего времени не установлено точно, что именно лежит в основе возникновения пороков развития матки и влагалища. Однако несомненна роль наследственных факторов, биологической неполноценности клеток, формирующих половые органы, воздействия вредных физических, химических и биологических агентов. Возникновение различных форм пороков развития матки и влагалища зависит от патологического влияния тератогенных факторов или реализации наследственной предрасположенности в процессе эмбриогенеза.
В пубертатном возрасте у пациенток с аплазией влагалища, матки, атрезией гимена, аплазией всего или части влагалища при функционирующей матке наблюдаются первичная аменорея (отсутствие менструаций) и (или) болевой синдром. У девушек с аплазией влагалища и матки характерной жалобой бывает отсутствие менструаций, в дальнейшем ― невозможность половой жизни. При таких видах пороков, как полное удвоение матки и влагалища, двурогая матка, внутриматочная перегородка (полная или неполная), клинические проявления заболевания могут отсутствовать, либо пациентки предъявляют жалобы на болезненные менструации.
Хирургическое лечение.
У больных с аплазией влагалища и матки применяют хирургический кольпопоэз. В современных условиях «золотым стандартом» хирургического кольпопоэза у больных с аплазией влагалища и матки считают кольпопоэз из тазовой брюшины с лапароскопическим ассистированием. Отдалённые результаты показали, что практически все пациентки удовлетворены половой жизнью. При гинекологическом осмотре видимая граница между преддверием влагалища и созданным неовлагалищем отсутствует, длина (11–12 см), растяжимость и ёмкость влагалища вполне достаточны.
Внутриматочная перегородка в несколько раз увеличивает вероятность невынашивания беременности и нарушает контрактильную способность миометрия при завершении родов через естественные родовые пути. Наиболее точным методом диагностики внутриматочной перегородки является магнитно-резонансная томография малого таза. Окончательный диагноз выставляется на диагностической гистероскопии, она сразу может быть переведена в лечебную гистерорезектоскопию.
Гистероскопическая диагностика затруднена при локализации перегородки до внутреннего зева, когда определяется одна полость и одно устье маточной трубы. Данный тип трудно дифференцировать от двурогой матки, так как гистероскопическая картина их идентична, поэтому диагностическая гистероскопия должна сочетаться с лапароскопией.
Для рассечения внутриматочной перегородки в нашей клинике используется биполярная петля гистерорезектоскопа.
В сравнении с традиционным хирургическим лечением, гистерорезектоскопия обладает рядом преимуществ, таких как: меньшая травматичность, более высокая экономичность (в частности, благодаря значительному снижению послеоперационного койко-дня), уменьшение длительности вмешательства. Это делает ее применение в хирургии внутриматочной перегородки очень перспективным, позволяет избежать радикальных операций, позволяет сохранить репродуктивный орган – матку, что на сегодняшний день является важной психологической и медицинской проблемой.
Гигиена новорожденной девочки
Главная / Гигиена новорожденной девочкиУход за телом должен осуществляться с первых минут жизни. Гигиенические процедуры новорожденных девочек несколько сложнее, чем у мальчиков, потому что половые органы первых находятся внутри, и всегда существует риск занесения инфекции из-за частого мочеиспускания и дефекации. Фундамент интимного здоровья взрослой женщины закладывается еще в родильном доме, поэтому так важно уделить этому особое внимание.
Средства для детской гигиены
Современный рынок просто пестрит различными средствами для гигиены новорожденных девочек. Но все ли можно применять, ухаживая за малышкой?
При выборе средств руководствуйтесь следующими критериями:
- не использовать обычное мыло – только специальное детское;
- детские средства гигиены должны поддерживать природный уровень рН, сохранять естественную микрофлору половых органов, иметь знак рекомендации педиатров, быть гипоаллергенными, не содержать красителей и отдушек.

Кроме того, недопустимо девочке делить с мамой или сестрой предметы гигиены: полотенце, мыло и ватные диски должны принадлежать только ей. А использование таких ненавистных бабушками одноразовых подгузников не только облегчает маме жизнь, но и защищает малышку от заболеваний мочеполовой системы, если мама использует их по назначению: прогулка или сон, но не более.
Первые дни жизни
В роддоме за девочкой уход осуществляет медицинский персонал. Хорошо, если мать и ребенок перебывают в общей палате – медсестры могут одновременно обучить этому искусству и новоиспеченную мамочку.
Первые несколько дней на коже, в том числе и на складках половых губ вашей дочери, может наблюдаться слой вещества светло-серого или кремового цвета. Это vernix – первородная смазка. Неонатологи не рекомендуют ее смывать – она питает и защищает кожу новорожденной от внешних воздействий и многих инфекций. Но если налета много, лучше удалить излишки, потому что жир, содержащийся в смазке, окислится и станет отличной средой для размножения микробов.
Очистку надо проводить ватой, смоченной в теплой кипяченой воде (t ? 37 °C, проверяйте ее на запястье) или стерильным маслом. Ни в коем случае не нужно стараться очистить его за раз – действуйте деликатно, и за пару дней налет пропадет.
Уход после выписки из роддома
Оказавшись дома, молодая мама ищет советов, прежде всего, у новоиспеченных бабушек. Хотя не ко всем советам стоит прислушиваться – многие методики не только устарели, но и опасны для здоровья.
- Нет необходимости кипятить воду. Это не защищает кожу крохи от вредоносных бактерий.
- Малышку нужно сначала подмыть, потом купать.
- Нельзя добавлять в ванночку отвары трав – они могут пересушивать кожу. Делайте это только по рекомендации педиатра.
- Но если малышка сходила «по большому», осторожно протрите каловые массы влажной салфеткой (без спирта или антисептика), а потом подмойте теплой проточной водой движениями от лобка до заднего прохода. Мыть в тазике запрещается.
- Купают ребенка ежедневно 1-2 раза в 5 дней с детским мылом, наружные половые органы и ягодицы (промежность) – 1 раз в день на ночь или после дефекации.

- Подмывания осуществлять только чистыми руками, вспомогательные приспособления не нужны.
- Запрещается вытирать кожу – только промакивать бережными движениями.
- После мытья дайте коже малышки 10-15 минут «подышать» воздухом, а затем обработайте детским кремом.
Рекомендации по уходу за молочными железами
Спустя пару дней после рождения у малышки часто происходит опухание, покраснения груди или даже выделения капелек молозива. Это не отклонение, а свидетельство присутствия маминых гормонов. Ваша задача – минимизировать механическое воздействие на молочные железы и в случае их сильного покраснения и набухания сообщить педиатру.
Эти рекомендации помогут маме избежать многих неприятностей, связанных с инфекционными заболеваниями.
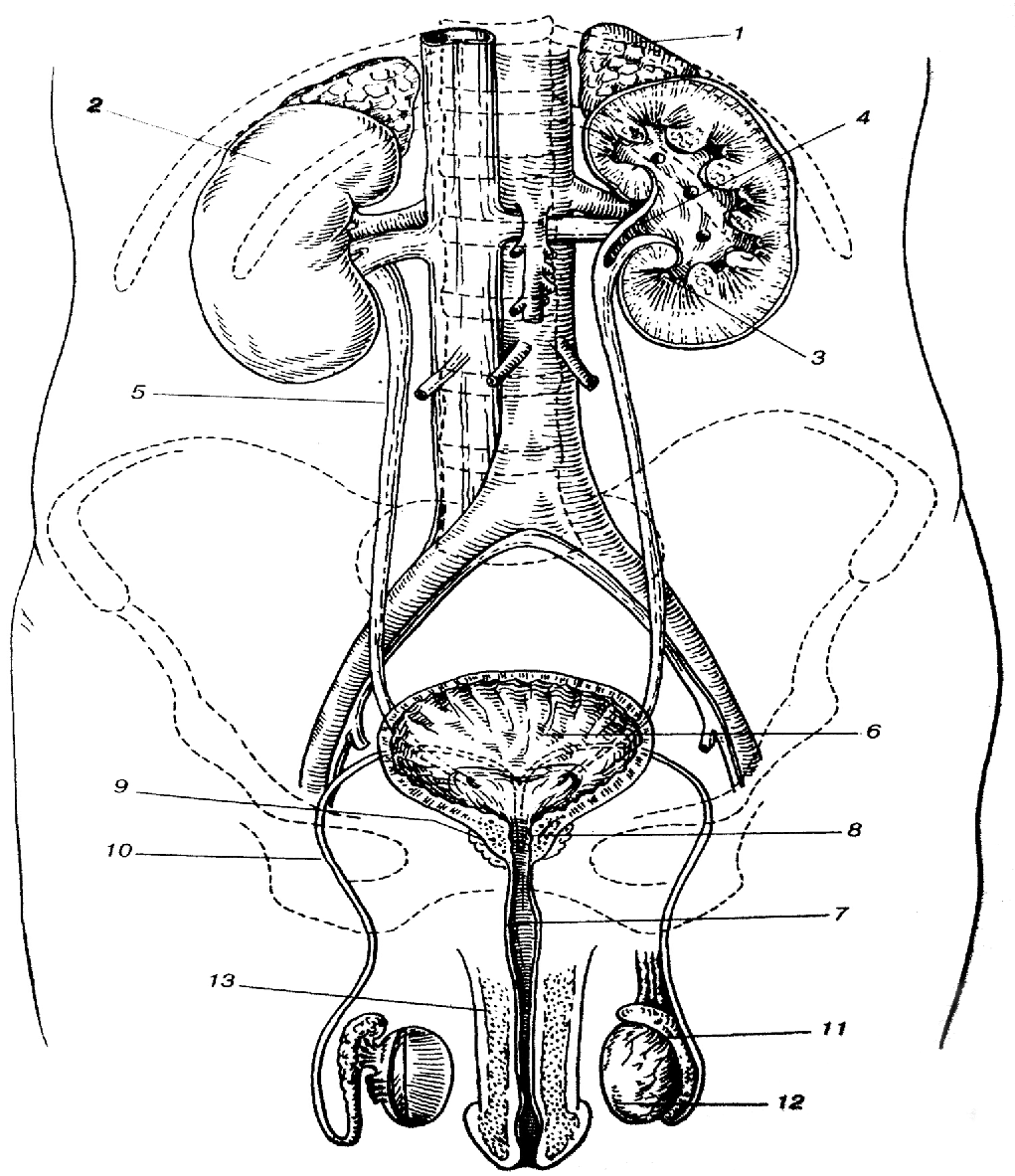
Строение мужской половой системы
Мужская половая система включает внешние и внутренние половые органы. Они предназначены для вывода мочи из организма, формирования и доставки сперматозоидов (репродуктивная функция). К первым относится мошонка и половой член. Ко вторым – яички, придатки яичек, семенные пузырьки, семявыводящий канал и предстательную железу.
К первым относится мошонка и половой член. Ко вторым – яички, придатки яичек, семенные пузырьки, семявыводящий канал и предстательную железу.
Каждый из компонентов мочеполовой системы обладает особенностями строения и функциональным назначением. В данной статье рассматриваются половые органы взрослого мужчины, возможные общие проблемы, которые могут возникнуть с каждым из них.
Наружные (внешние) половые органы
Половой член (фаллос или пенис) – половой орган, с помощью которого из организма выводится моча и сперма во время полового акта. Член имеет корень или основание, ствол и головку. Корень скрепляется с лобковой костной тканью. Ствол состоит из пещеристых и губчатых тел, которые наполняются кровью. В конце ствола находится головка, покрытая нежной кожей, обладающей железами, вырабатывающими смегму.
Крайняя плоть соединяется с головкой эластичной кожной складкой – уздечкой. С её помощью во время эрекции головка полностью обнажается. Надрывы болезненны, разрыв же может повлиять на нарушение половой функции.
На самой головке имеется большое количество нервных окончаний, что делает её крайне чувствительной. Чуть меньшей чувствительностью обладает ствол члена на участке 2-3 см ниже головки. Вверху головки имеется отверстие, которое является выходом из уретры, через которое выводится моча или сперма во время эякуляции.
Внешне половой член может различаться. Во время эрекции он часто искривляется, в прямом виде при в возбуждённом состоянии бывает редко. Средние размеры члена зависят от состояния: в спокойном – 5-10 см, во время эрекции – 14-16 см, то есть соответствуют глубине женского влагалища.
Смегма (смазка) – является секретом желез крайней плоти, состоящим из жиров микобактерий. Они имеют белый цвет и равномерно распределяются по поверхности головки. Её функция – уменьшение трения головки о крайнюю плоть.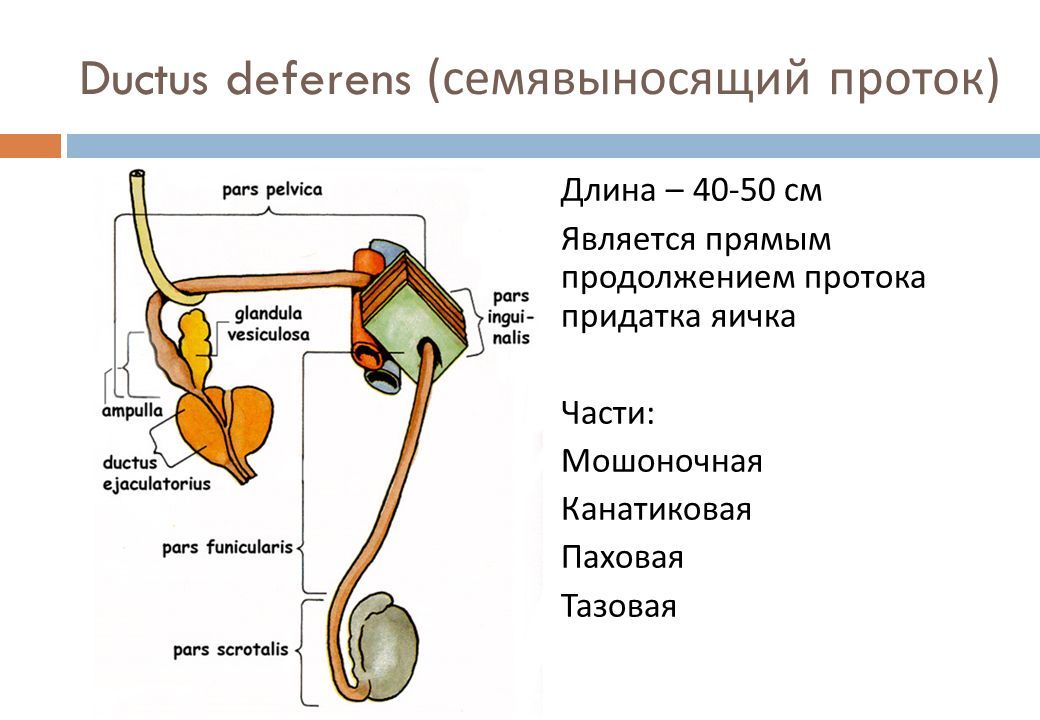
Сперма – это смесь, выделяемая при эякуляции (оргазме) во время полового акта или мастурбации. Она является продуктом внутренних половых органов: яичек и их придатков, предстательной железы, уретры и семенных пузырьков. Она состоит из семенной плазмы и сперматозоидов.
Состав спермы:
- жидкость семенных пузырьков – 65%;
- жидкость простаты – 30%;
- сперматозоиды – 5%.
Согласно медицинским нормам, удельный вес подвижных сперматозоидов должен составлять не менее 70% от общего числа. Эти данные определяются с помощью специального теста, который проходится в рамках обследования половой системы мужчины – спермограммы.
Мошонка – кожно-мышечный орган, состоящий из внешнего кожного покрова и внутренней полости, где располагаются яички, их придатки и начальный отдел семенного канатика.
Ваш лечащий доктор
Калайчев Онис Владимирович
Внутренние половые органы
Яички – половая железа, имеющая парную структуру. Её функция – образование сперматозоидов и выделение мужских половых гормонов (тестостерона). Они располагаются в мошонке на разном уровне, левое чуть ниже правого. Могут быть разных размеров – 4-6 см в длину и 2,5-3,5 в ширину.
Их температура должна быть ниже общей температуры тела примерно на 4 градуса, в противном случае сперматозоиды могут не вырабатываться. Также пагубное влияние на них оказывает сидячий образ жизни или работы.
Семявыводящие пути – протоки, по которым сперма выводится из яичек. Представляют собой продолжение канала придатка яичка, проходящего через паховый канал. Продвижение спермы по осуществляется в результате их сокращений при оргазме, в результате попадая в уретру.
Продвижение спермы по осуществляется в результате их сокращений при оргазме, в результате попадая в уретру.
Семенной канатик – парный анатомический компонент, располагающийся от придатка яичка до места слияния с протоком семенного пузырька. Он снабжает яички необходимым для их функционирования потоком крови и семя из в семявыводящий проток.
Предстательная железа (простата) – орган половой системы, вырабатывающий секрет, который входит в состав спермы. Она располагается между мочевым пузырём и прямой кишкой. Через предстательную неё проходит уретра. Секрет простаты разжижает сперму, активизируя движение сперматозоидов. Простата также участвует в формировании либидо и оргазма.
Семенные пузырьки – железистые образования, вырабатывающие секрет, входящий в состав спермы.
Каждый орган мочеполовой системы имеет важное значение, поэтому в случае возникновения каких-либо проблем, болевых ощущений, жжения, рези и др. симптомов во время мочеиспускания и полового акта, в том числе, оргазма, следует как можно быстрее обратиться к врачу.
Медицинский цент «Онис-клиник» располагает современным медицинским оборудованием, лабораторией и опытным персоналом. У нас можно пройти диагностику, физиотерапию, лечение, а также проконсультироваться со специалистами по любым вопросам, касающихся мужской половой системы.
Гинекология (внелегочной туберкулез)
Солонка Ирина Иосифовна, к.м.н., фтизиогинеколог
Время работы с 09.00 до 14.00 в будние дни.
Консультативная помощь осуществляется в день обращения.
Дату и время консультации необходимо предварительно согласовать по тел. 289-83-52.
Туберкулёз — инфекционное заболевание, вызываемое микобактериями туберкулеза (МБТ). Генитальный туберкулёз или туберкулез женских половых органов, как правило, не является самостоятельным заболеванием, а развивается вторично путём заноса инфекции из первичного очага поражения (чаще из лёгких, реже — из кишечника). Наиболее часто при генитальном туберкулезе поражаются маточные трубы и матка, реже — яичники и шейка матки, крайне редко — влагалище и наружные половые органы.
Наиболее часто при генитальном туберкулезе поражаются маточные трубы и матка, реже — яичники и шейка матки, крайне редко — влагалище и наружные половые органы.
Впервые информация о туберкулезе женских половых органов появилась в конце восемнадцатого века. Известный анатом Morgani в 1779 году описал случай бугорчатки половых органов у 14-летней девушки, умершей от туберкулезного перитонита.
Риск заражения туберкулезом грозит любому человеку. При контакте с МБТ происходит инфицирование организма, однако у 90% инфицированных лиц туберкулез не развивается, если их иммунная система не ослаблена ВИЧ-инфекцией или другими факторами. На месте внедрения МБТ формируется очаг первичного воспаления. Как правило на этом воспалительный процесс и заканчивается, не получая дальнейшего развития.
Из первичного очага при снижении иммунологической резистентности организма микобактерии туберкулеза попадают в половые органы. Снижению защитных сил организма способствуют хронические инфекции, стрессы, недостаточное питание и др. Распространение инфекции происходит в основном гематогенным путём, чаще при первичной диссеминации в детстве или в период полового созревания. В других случаях при туберкулёзном поражении брюшины лимфогенно или контактным путём возбудитель попадает на маточные трубы.
Распространение инфекции происходит в основном гематогенным путём, чаще при первичной диссеминации в детстве или в период полового созревания. В других случаях при туберкулёзном поражении брюшины лимфогенно или контактным путём возбудитель попадает на маточные трубы.
Возбудитель туберкулеза может некоторое время себя не проявлять и лишь при появлении неблагоприятных факторов (снижение иммунитета, изменение гормонального фона) активируется и приводит к развитию вторичного туберкулеза.
Симптомы
Туберкулез женских половых органов может проявиться в любом возрасте, но чаще всего его обнаруживают у женщин в возрасте 20-40 лет.
Генитальный туберкулёз в основном протекает со стёртой клинической картиной. Снижение репродуктивной функции (бесплодие) — основной, а иногда и единственный симптом заболевания. По статистике 10-22% всех случаев бесплодия могут быть результатом туберкулеза половых органов. Так как процесс главным образом локализуется в маточных трубах, то причиной бесплодия является нарушение проходимости маточных труб, спаечный процесс в малом тазу, а также гормональные нарушения, связанные с выработкой половых гормонов, нарушения овуляции.
При распространении туберкулеза на матку возрастает риск нарушения детородной функции из-за наличия грубых сращений (синехий), деформирующих полость матки.
Воспаление в половых органах и спайки в области малого таза могут сопровождаться ноющими и тянущими болями в нижней части живота, дискомфортом при интимной близости.
У большей части пациенток нарушается менструальная функция. У трети пациенток могут наблюдаться признаки туберкулёзной интоксикации (повышение температуры тела, быстрая утомляемость, общая слабость, снижение массы тела и потливость в ночное время).
Диагностика и выявление
Заподозрить туберкулезную этиологию заболевания помогает анамнез (указания на контакт с больным туберкулезом; перенесенные в прошлом пневмония, плеврит, бронхоаденит; наблюдение в противотуберкулезном диспансере; наличие в организме экстрагенитальных очагов туберкулеза). Важное значение имеют данные анамнеза гинекологической патологии (неэффективность противовоспалительной и гормональной терапии; возникновение воспалительного процесса у молодых пациенток, не живших половой жизнью; длительный субфебрилитет). При подозрении на туберкулез половых органов пациентка направляется на консультацию к фтизиогинекологу для прохождения дополнительного обследования. Проводятся специальные пробы — реакция Манту, Диаскинтест; посевы мочи, менструальной крови, содержимого полости матки, жидкости из заднего свода на МБТ. Возможно проведение ПЦР-диагностики. Для выявления изменений в матке и маточных трубах выполняется гистеросальпингография. Ультразвуковое исследование органов брюшной полости и малого таза помогает выявить патологию (утолщенные и деформирование в виде «четок» маточные трубы, синехии в полости матки). Проводится гистероскопия, во время которой осматривается полость матки и выполняется ее выскабливание с дальнейшим микробиологическим и гистологическим изучением полученного материала.
При подозрении на туберкулез половых органов пациентка направляется на консультацию к фтизиогинекологу для прохождения дополнительного обследования. Проводятся специальные пробы — реакция Манту, Диаскинтест; посевы мочи, менструальной крови, содержимого полости матки, жидкости из заднего свода на МБТ. Возможно проведение ПЦР-диагностики. Для выявления изменений в матке и маточных трубах выполняется гистеросальпингография. Ультразвуковое исследование органов брюшной полости и малого таза помогает выявить патологию (утолщенные и деформирование в виде «четок» маточные трубы, синехии в полости матки). Проводится гистероскопия, во время которой осматривается полость матки и выполняется ее выскабливание с дальнейшим микробиологическим и гистологическим изучением полученного материала.
Так как туберкулез половых органов может сочетаться с туберкулезом легких и мочевой системы, то обязательно выполняется лучевое исследование органов грудной клетки, а при наличии показаний –исследование мочевыводящих путей.
Лечение
В случае диагностирования туберкулеза половых органов назначается противотуберкулезная терапия, длительность которой составляет от полугода и более. Залогом успешного лечения является адекватный подбор противотуберкулезных лекарственных средств с учетом чувствительности возбудителя, своевременность приема лекарственных средств, использование новейших химиопрепаратов. На протяжении курса лечения используют также лекарства, направленные на устранение спаечных образований в области малого таза, антиоксиданты, иммуномодуляторы, витамины, проводят коррекцию нарушений менструальной функции. После стихания активного воспалительного процесса показана физиотерапия.
Правила интимной гигиены девочки
Физиология девочки
Слизистая оболочка влагалища и его преддверия с самого рождения выделяет секрет, скапливающийся между большими и малыми половыми губами в виде маслянистого вещества белого или серого цвета, с трудом поддающегося удалению. Кожные покровы наружных половых органов до периода полового созревания отличаются повышенной ранимостью, так как состоят из меньшего числа слоёв клеток. Поэтому если выделения не удалить, то они могут вызвать раздражение кожи, зуд, а присоединение микроорганизмов может спровоцировать начало развития воспалительного процесса. Кроме того, попадание мочи и кала на нежную кожу промежности и половых органов в грудном возрасте может спровоцировать у девочек развитие опрелости, дерматита и вульвовагинита. Также при ненадлежащем уходе нередко происходит сращениемалых половых губ как исход хронического воспаления (синехии).
Кожные покровы наружных половых органов до периода полового созревания отличаются повышенной ранимостью, так как состоят из меньшего числа слоёв клеток. Поэтому если выделения не удалить, то они могут вызвать раздражение кожи, зуд, а присоединение микроорганизмов может спровоцировать начало развития воспалительного процесса. Кроме того, попадание мочи и кала на нежную кожу промежности и половых органов в грудном возрасте может спровоцировать у девочек развитие опрелости, дерматита и вульвовагинита. Также при ненадлежащем уходе нередко происходит сращениемалых половых губ как исход хронического воспаления (синехии).
Предотвратить появление подобных проблем можно, соблюдая правила интимной гигиены.
Правила интимной гигиены девочки
- Вымойте руки с мылом перед уходом за половыми органами девочки (подмываться только чистыми руками, никаких мочалок, тряпок, губок, ваты и т.п.!) Подмывайте только под проточной тёплой водой. Зону анального отверстия подмывайте, заведя руку назад движением спереди назад и вверх.
 Зону наружных половых органов – другой рукой сзади наперёд и вниз, не касаясь зоны анального отверстия и тщательно вымывая складки между половыми губами и клитором. Водная струя при мытье наружных половых органов должна быть направлена спереди назад. Не следует направлять сильную струю воды во влагалище. Если не разделять зоны подмывания на анальную и половую, то направление подмывания – только спереди назад!
Зону наружных половых органов – другой рукой сзади наперёд и вниз, не касаясь зоны анального отверстия и тщательно вымывая складки между половыми губами и клитором. Водная струя при мытье наружных половых органов должна быть направлена спереди назад. Не следует направлять сильную струю воды во влагалище. Если не разделять зоны подмывания на анальную и половую, то направление подмывания – только спереди назад! - После интимной гигиены кожу просушите отдельным чистым полотенцем. Вытирайте промакивающими движениями, а не растирающими. Недопустимо использование этого полотенца другими членами семьи. Кроме того,мыло и мочалка у девочки также должны быть свои, приучайте к этому с рождения.
- В случае накопления белого налёта между большими и малыми половыми губами, удалите его у малышки с помощью ватного диска, смоченного в пастеризованном растительном масле. В старшем возрасте, девочка должна самостоятельно удалять секрет под проточной водой.
- Нижнее бельё для девочки выбирайте из натуральных материалов (хлопок, лён), без синтетических примесей и, желательно, белого цвета(при наличии патологических выделений на белом фоне можно более объективно оценить их, чем на цветном, а вот красивые яркие трусики – это, в первую очередь, текстильные красители, которые могут вызвать покраснение и воспаление).
 Одежда не должна стягивать область половых органов, сковывать движения. Стирайте детское бельё и одежду отдельно от взрослых вещей (до 3-х лет), используя моющие средства, рекомендованные для детского белья. Нижнее бельё тщательно проглаживайте горячим утюгом изнутри, особенно если девочка склонна к аллергии и воспалению.
Одежда не должна стягивать область половых органов, сковывать движения. Стирайте детское бельё и одежду отдельно от взрослых вещей (до 3-х лет), используя моющие средства, рекомендованные для детского белья. Нижнее бельё тщательно проглаживайте горячим утюгом изнутри, особенно если девочка склонна к аллергии и воспалению. - Без рекомендаций врача избегайте использования в качестве средств для интимной гигиены растительных настоек, любых дезинфицирующих веществ (например, марганцовка и другие химические антисептики). Категорически запрещается применять с целью интимной гигиены взрослые косметические средства, хозяйственное мыло, влажные салфетки, в составе которых есть спиртовой раствор.
- Детским мылом или специальным жидким мылом обязательно промывайте половые органы после акта дефекации. Нужно следить, чтобы моющее средство не попадало в половую щель: моется только поверхность половых органов.
- При появлении у девочки выделений, покраснения и зуда в области наружных половых органов, жжения и болезненности при мочеиспускании обращайтесь к педиатру и детскому гинекологу.

Возрастные особенности
С рождения до 1, 5 лет. Подмывайте малышку 1-2 раза в день проточной водой, после акта дефекации – с мылом, в походных условиях – влажные салфетки. При необходимости остатки каловых масс перед подмыванием осторожно удалите смоченным уголком пелёнки, смоченным ватным диском или влажной салфеткой. Если гигиеническая процедура осуществляется на пеленальном столике, воспользуйтесь влажными салфетками или ватными тампонами. Очень полезны воздушные ванны после подмывания. Девочку выкладывайте на спинку с разведёнными ножками без подгузника на 10-15 минут. После воздушной ванны кожные складки и половые губы смазывайте пастеризованным натуральным жирным маслом, приготовить пастеризованное растительное масло можно самим – на водяной бане 15 минут.Подгузники меняйте не реже, чем через 3-4 часа, под подгузник и при опрелостях – цинксодержащие мази (например, судокрем, или можно даже самую дешёвую цинковую мазь). Приучение к горшку возможно с 6-7 месяцев, если у ребенка выработался режим опорожнения кишечника.
С 1,5 лет. Обязательное приучение к горшку. Начинайте учить девочку подмываться. Подмывайте девочку после каждого опорожнения кишечника или используйте влажную салфетку. После подмывания и вытирания области промежности внешнюю часть половых органов смажьте детским кремом. Не позволяйте малышке сидеть без трусиков или штанишек на полу, стульчике, диване и любых других поверхностях, чистота которых может оказаться сомнительной. Будьте осторожны с острыми предметами, остроконечными пирамидками, ножками детских стульчиков во избежание травмы половых органов и прямой кишки (девочка может сесть на торчащую ножку или острую пирамидку).
С 2,5 лет. Девочка уже способна во время купания с помощью мамы совершать туалет интимных органов. Подмывайте 2 раза в день, например, утром после ночного сна и вечером перед сном, обязательно после дефекации. Дневное подмывание перед сном можно заменить вытиранием влажной салфеткой с экстрактом ромашки. По возможности меняйте малышке трусики дважды в день. Если ночной сон ребенок проводит без трусиков, в свободной пижаме, то эта пижама должна меняться через день.
По возможности меняйте малышке трусики дважды в день. Если ночной сон ребенок проводит без трусиков, в свободной пижаме, то эта пижама должна меняться через день.
Оправляя в садик. Объясните дочке, что никто не имеет права прикасаться к её половым органам, кроме мамы и врача в мамином присутствии. Кладите малышке в кармашек влажные салфетки в отдельных упаковках. Обеспечьте достаточное количество запасных трусиков в шкафчике. Обучите ребенка вытирать половые органы туалетной бумагой, не растирая, а промакивая.
К 5-6 годам. Расскажите девочке простые правила повседневной интимной гигиены: желательно аккуратно промокать половые органы туалетной бумагой после каждого мочеиспускания, менять трусики каждый день. Покажите, каким образом она самостоятельно может совершать интимный туалет половых органов с помощью биде, ручного душа или ковшика. Родители должны контролировать, как она с этим справляется.
К 9 годам.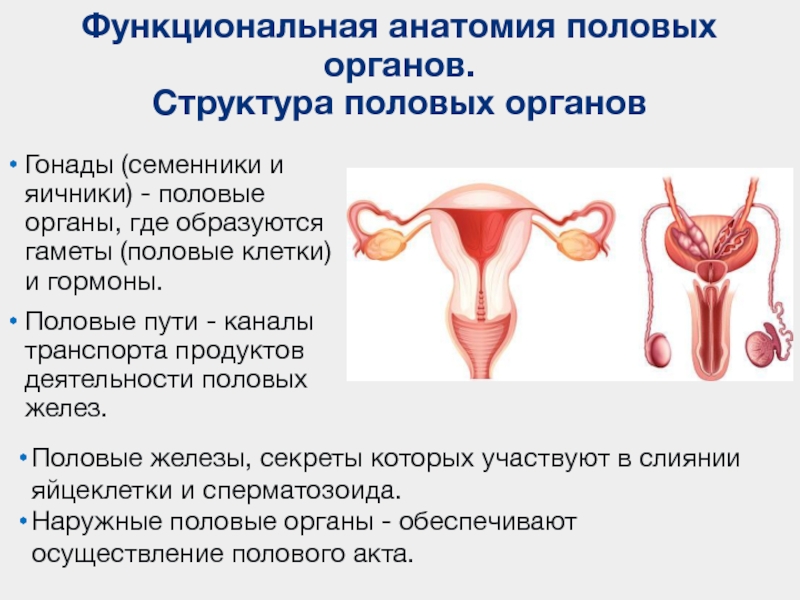 Подмывать наружные половые органы девочка должна не реже1-2 раз в день, используя специальное жидкое мыло. В этом возрасте носить стринги и использовать ежедневные прокладки девочкам категорически запрещается. Девочка уже должна знать о взрослении и менструации и необходимых средствах гигиены в этот период.
Подмывать наружные половые органы девочка должна не реже1-2 раз в день, используя специальное жидкое мыло. В этом возрасте носить стринги и использовать ежедневные прокладки девочкам категорически запрещается. Девочка уже должна знать о взрослении и менструации и необходимых средствах гигиены в этот период.
С наступлением первых менструаций. В период менструации подмывание должно быть особенно тщательным. Сначала необходимо обмывать наружные половые органы, потом кожу бёдер ив последнюю очередь – область заднего прохода. Принимать ванну и посещать баню не следует. Прокладки необходимо менять не реже 4-5 раз в день в сочетании с обмыванием половых органов и бёдер 2-3 раза в день. Пользоваться тампонами девочкам, не живущим половой жизнью не рекомендуется за исключением девочек-спортсменок и некоторых других категорий(соревнования, необходимость одеть обтягивающее белье и т.д.).
Эти правила личной гигиены очень важно знать мамам и папам, чтобы вырастить здоровую и счастливую девочку, которая в дальнейшем станет мамой.
Материал подготовлен детским гинекологом Центральной медицинской клиники CMD Перово, ул. Новогиреевская Смирновой Татьяной Николаевной.
Женский репродуктивный тракт — TeachMeAnatomy
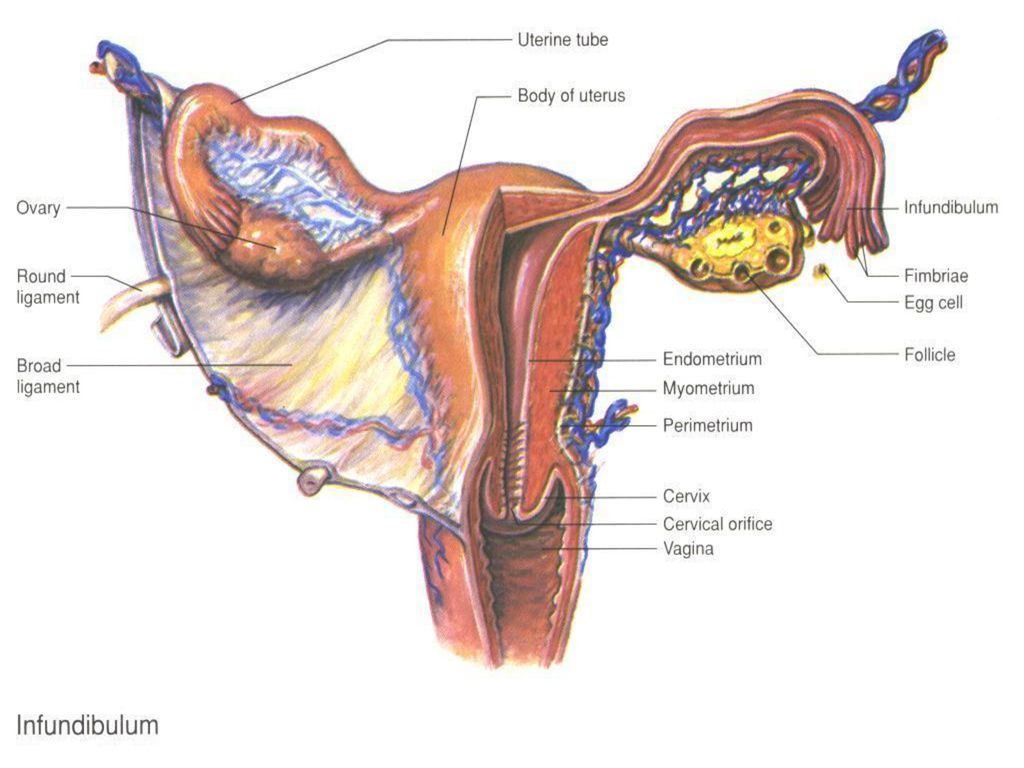
Женский репродуктивный тракт расположен в пределах таза. Он состоит из вульвы, влагалища, шейки матки, матки, маточных труб и яичников. Эти органы поддерживаются в тазу связками.
Вульва относится к наружным женским гениталиям. Его анатомическая структура может быть разбита на лобок, большие и малые половые губы, преддверие, бартолиновые железы и клитор.
Влагалище представляет собой растяжимую мышечную трубку, которая соединяет матку и шейку матки с наружным отверстием влагалища.Он расположен кзади от мочевого пузыря и уретры и кпереди от прямой кишки и анального канала. Влагалище участвует в половом акте, родах и менструации.
Шейка матки — это нижняя часть матки, чуть выше влагалища. На каждом конце есть шейные зевы, узкие отверстия, ведущие в матку и влагалище с обеих сторон. Это облегчает прохождение спермы, сохраняя при этом стерильную среду в верхней репродуктивной системе женщины.
Это облегчает прохождение спермы, сохраняя при этом стерильную среду в верхней репродуктивной системе женщины.
Матка, обычно называемая маткой, является местом нормальной имплантации раннего эмбриона.Он имеет большое разнообразие положений в тазу, которое описывается степенью антеверсии или ретроверсии, а также антефлексии или ретрофлексии.
Фаллопиевы трубы соединяют яичники с маткой и, следовательно, выполняют функцию транспортировки яйцеклетки к матке. Их длина разделена на секции: фимбрии, инфундибулум, ампула и перешеек.
Яичники — женские гонады, и они являются местом гаметогенеза. Они располагаются сбоку от матки и вплотную примыкают к фимбриям маточных труб.
Существует множество связок женского репродуктивного тракта, которые поддерживают органы женского репродуктивного тракта, а также действуют как канал для нервно-сосудистых структур, питающих их.
В этом разделе вы узнаете больше о женских половых путях, включая вульву, влагалище, шейку матки, матку, маточные трубы, яичники и связки женских половых путей.
Развитие женских половых путей и расстройства детского возраста
- Содержание главы
- Содержание книги
Abstract
Развитие женского репродуктивного тракта — сложный процесс, неразрывно связанный с формированием паттерна мужского (вольфианского) репродуктивного тракта и зачатка почек. Развитие начинается с недифференцированной мезодермы, известной как генитальный гребень, при этом половые клетки мигрируют в это место из желточного мешка. Мюллеров проток начинается с инвагинации целомического эпителия на вершине генитального гребня и удлиняется за счет активной пролиферации клеток, используя вольфов проток в качестве ориентира.Многие гены были связаны с развитием женских репродуктивных путей, но только некоторые из них были напрямую задействованы в моделях нокаута на животных; это связано с тем, что простой образец женского репродуктивного тракта (т. е. один с одной шейкой матки и маткой, с двумя отдельными фаллопиевыми трубами) ограничен людьми и другими приматами. Совсем недавно геномное секвенирование выявило больше генов, в основном факторов транскрипции и внеклеточных сигнальных молекул, а также мутации в этих генах, связанные с пороками развития женских половых путей.Наиболее частая врожденная аномалия женских половых путей у человека возникает, когда парные мюллеровы протоки не сливаются или последующая перегородка не может рассасываться, что приводит к целому ряду аномалий матки, включая двурогую и двурогую матку. Для развития наружных женских половых путей требуется как отсутствие ключевого мужского определяющего фактора (SRY), так и присутствие его антагониста (WNT4). Вирилизация генетически женских плодов происходит из-за избыточного количества андрогенов из-за врожденной гиперплазии надпочечников или материнской крови.
е. один с одной шейкой матки и маткой, с двумя отдельными фаллопиевыми трубами) ограничен людьми и другими приматами. Совсем недавно геномное секвенирование выявило больше генов, в основном факторов транскрипции и внеклеточных сигнальных молекул, а также мутации в этих генах, связанные с пороками развития женских половых путей.Наиболее частая врожденная аномалия женских половых путей у человека возникает, когда парные мюллеровы протоки не сливаются или последующая перегородка не может рассасываться, что приводит к целому ряду аномалий матки, включая двурогую и двурогую матку. Для развития наружных женских половых путей требуется как отсутствие ключевого мужского определяющего фактора (SRY), так и присутствие его антагониста (WNT4). Вирилизация генетически женских плодов происходит из-за избыточного количества андрогенов из-за врожденной гиперплазии надпочечников или материнской крови.
Ключевые слова
Развитие женских половых путей
неоднозначные гениталии
пороки развития матки
патологии гонад
преждевременное половое созревание
Рекомендуемые статьиЦитирующие статьи (0)
Inc. Все права защищены.
Все права защищены.
Рекомендуемые статьи
Цитирующие статьи
Обзор женских половых путей человека и свиньи и связанной с ними иммунной системы с точки зрения использования мини-свиней в качестве модели генитальной хламидийной инфекции человека | Ветеринарные исследования
Lantier F (2014) Животные модели возникающих болезней: необходимое предварительное условие для исследований и разработки мер контроля. Anim Front 4: 7–12
Статья Google Scholar
De Clercq E, Kalmar I, Vanrompay D (2013) Животные модели для изучения инфекции женских половых путей Chlamydia trachomatis. Infect Immun 81: 3060–3067
PubMed Central Статья PubMed Google Scholar
O’Meara CP, Andrew DW, Beagley KW (2014) Мышиная модель инфекции половых путей Chlamydia: обзор инфекции, болезни, иммунитета и разработки вакцины. Curr Mol Med 14: 396–421
Статья PubMed Google Scholar

Mestas J, Hughes CCW (2004) О мышах, а не о людях: различия между иммунологией мыши и человека. J Immunol 172: 2731–2738
CAS Статья PubMed Google Scholar
Schautteet K, Stuyven E, Beeckman DSA, Van Acker S, Carlon M, Chiers K, Cox E, Vanrompay D (2011) Защита свиней от заражения Chlamydia trachomatis путем введения ДНК-вакцины на основе MOMP в слизистую оболочку влагалища. Вакцина 29: 1399–1407
CAS Статья PubMed Google Scholar
Денайер Т., Штер Т., Ван Рой М. (2014) Животные модели в трансляционной медицине: проверка и прогнозирование. New Horizons Transl Med 2: 5–11
Статья Google Scholar
Hein WR, Griebel PJ (2003) Менее популярный путь: модели на крупных животных в иммунологических исследованиях. Nat Rev Immunol 3: 79–85
CAS Статья PubMed Google Scholar

Жирар М.П., Плоткин С.А. (2012) Разработка вакцины против ВИЧ на рубеже 21 века. Curr Opin HIV AIDS 7: 4–9
CAS Статья PubMed Google Scholar
Schautteet K, Stuyven E, Cox E, Vanrompay D (2011) Валидация модели свиней с генитальным заражением Chlamydia trachomatis для тестирования рекомбинантных белковых вакцин.J Med Microbiol 60: 117–127
CAS Статья PubMed Google Scholar
Dodet B (2014) Текущие препятствия, проблемы и возможности для разработки эффективных вакцин против ИППП: точка зрения производителей вакцин, биотехнологических компаний и финансовых агентств. Vaccine 32: 1624–1629
Статья PubMed Google Scholar
Bode G, Clausing P, Gervais F, Loegsted J, Luft J, Nogues V, Sims J (2010) Использование мини-свиньи в качестве модели животных в нормативной токсикологии. J Pharmacol Toxicol Methods 62: 196–220
J Pharmacol Toxicol Methods 62: 196–220
CAS Статья PubMed Google Scholar
Squier CA, Mantz MJ, Schlievert PM, Davis CC (2008) Влагалище свиньи ex vivo как модель для изучения проницаемости и патогенеза слизистой оболочки. J Pharm Sci 97: 9–21
CAS Статья PubMed Google Scholar
Turk JR, Henderson KK, Vanvickle GD, Watkins J, Laughlin MH (2005) Артериальная эндотелиальная функция в модели ранней стадии атеросклеротического сосудистого заболевания у свиней.Int J Exp Pathol 86: 335–345
PubMed Central Статья PubMed Google Scholar
Мошенничество М.М. (2007) Свинья в лаборатории. CRC Press, Бока-Ратон
Книга Google Scholar
The Göttingen minipig [www.minipigs.dk] По состоянию на 5 мая 2015 г.
Vanrompay D, Hoang TQT, De Vos L, Verminnen K, Harkinezhad T, Chiers K, Morré SA, Cox E (2005) Свиньи, свободные от специфических патогенов, в качестве животной модели для изучения генитальной инфекции chlamydia trachomatis.Infect Immun 73: 8317–8321
PubMed Central CAS Статья PubMed Google Scholar
База данных PubMed [http://www.ncbi.nlm.nih.gov/pubmed/], дата обращения 20 октября 2014 г.
База данных Google Scholar [https://scholar.google.dk /] Получено 20 октября 2014 г.
Silverthorn DU (2007) Human Physiology. Пирсон Бенджамин Каммингс, Соединенные Штаты Америки
Google Scholar
Senger PL (2005) Пути к беременности и родам. Current Conceptions Inc., Вашингтон
Google Scholar
Eurell JA, Frappier BL (2006) Учебник ветеринарной гистологии Деллманна. Blackwell Publishing, Соединенные Штаты Америки
Blackwell Publishing, Соединенные Штаты Америки
Google Scholar
Corpus Luteum [http://www.glowm.com/section_view/heading/Corpus Luteum / item / 290] Проверено 5 мая 2015 г.
König HE, Liebich HG (2009) Anatomie Der Haussäugetiere. Schattauer, Штутгарт
Google Scholar
Конар Х. (2014) Учебник акушерства Д.К. Датта. Jaypee Brothers Medical Publishers Ltd., Нью-Дели
Google Scholar
Конар Х. (2014) Учебник гинекологии Д.К. Датта. Jaypee Brothers Medical Publishers Ltd, Нью-Дели
Google Scholar
Ledger WL, Tan SL, Bahathiq AOS (2010) Фаллопиевы трубы в практике бесплодия и ЭКО. Издательство Кембриджского университета, Кембридж
Книга Google Scholar

Краузе В.Дж. (2005) Основы гистологии человека Краузе для студентов-медиков. Universal Publishers, Соединенные Штаты Америки
Google Scholar
Бача В.Дж., Бача Л.М. (2000) Цветовой атлас ветеринарной гистологии.Lippincott Williams & Wilkins, Соединенные Штаты Америки
Google Scholar
Kaeoket K, Persson E, Dalin A-M (2002) Исправление к «Эндометрий свиноматки на разных стадиях цикла эструса: исследования морфологических изменений и инфильтрации клетками иммунной системы» [Anim. Репрод. Sci. 65 (2001) 95–114]. Anim Reprod Sci 73: 89–107
CAS Статья PubMed Google Scholar
Штраус Дж. Ф., Барбьери Р. Л. (2014) Репродуктивная эндокринология Йена и Яффе: физиология, патофизиология и клиническое управление. Saunders Elsevier, Филадельфия
Google Scholar
Darville T, Hiltke TJJ (2010) Патогенез заболевания половых путей, вызванного Chlamydia trachomatis. J Infect Dis 201 (Приложение 2): 114–125
Статья Google Scholar
Hussein AM, Newby TJ, Bourne FJ (1983) Иммуногистохимические исследования местной иммунной системы в репродуктивном тракте свиноматки.J Reprod Immunol 5: 1–15
CAS Статья PubMed Google Scholar
Brunham RC, Rey-Ladino J (2005) Иммунология хламидийной инфекции: значение вакцины против Chlamydia trachomatis. Nat Rev Immunol 5: 149–161
CAS Статья PubMed Google Scholar
Howard C, Friedman DL, Leete JK, Christensen ML (1991) Корреляция процента положительных тестов прямого флуоресцентного обнаружения антител Chlamydia trachomatis с адекватностью сбора образцов.Диагностика Microbiol Infect Dis 14: 233–237
CAS Статья PubMed Google Scholar

Шейка матки свиньи [http://ex-epsilon.slu.se:8080/archive/00003222/01/EEF_Karin_Edstrom.pdf] по состоянию на 6 мая 2015 г.
Meurens F, Summerfield A , Nauwynck H, Saif L, Gerdts V (2012) Свинья: модель инфекционных заболеваний человека. Trends Microbiol 20: 50–57
CAS Статья PubMed Google Scholar
McAnulty PA, Dayan AD, Ganderup N-C, Hastings KL (eds) (2011) Мини-свинья в биомедицинских исследованиях. CRC Press, Соединенные Штаты Америки
Google Scholar
Биннс Р.М., Пабст Р. (1994) Структура лимфоидной ткани и движение лимфоцитов у свиньи. Vet Immunol Immunopathol 43: 79–87
CAS Статья PubMed Google Scholar
Rothkötter H-J (2009) Анатомические особенности иммунной системы свиней — взгляд врача.Dev Comp Immunol 33: 267–272
Статья PubMed Google Scholar

Маир К.Х., Седлак С., Кезер Т., Пастернак А., Леваст Б., Гернер В., Заальмюллер А., Саммерфилд А., Гердтс В., Уилсон Г.Л., Меуренс Ф. (2014) Врожденная иммунная система свиней: обновление. Dev Comp Immunol 45: 321–343
CAS Статья PubMed Google Scholar
Fairbairn L, Kapetanovic R, Sester DP, Hume DA (2011) Мононуклеарная фагоцитарная система свиньи как модель для понимания врожденного иммунитета человека и болезней.J Leukoc Biol 89: 855–871
CAS Статья PubMed Google Scholar
Цукерманн Ф.А., Гаскинс Х.Р. (1996) Распределение двойных положительных по CD4 / CD8 Т-лимфоцитов свиней в лимфоидных тканях, ассоциированных со слизистой оболочкой. Иммунология 87: 493–499
PubMed Central CAS Статья PubMed Google Scholar
Saalmüller A, Maurer S (1994) Главный антиген гистосовместимости класса II, экспрессирующие покоящиеся Т-лимфоциты свиньи, являются мощными антигенпрезентирующими клетками в смешанной культуре лейкоцитов. Иммунобиология 190: 23–34
Иммунобиология 190: 23–34
Статья PubMed Google Scholar
Holling TM, Schooten E, van Den Elsen PJ (2004) Функция и регуляция молекул MHC класса II в Т-лимфоцитах: мышей и мужчин. Hum Immunol 65: 282–290
CAS Статья PubMed Google Scholar
Murtaugh MP, Johnson CR, Xiao Z, Scamurra RW, Zhou Y (2009) Специализация видов в биологии цитокинов: является ли интерлейкин-4 центральным в парадигме Th2-Th3 у свиней? Dev Comp Immunol 33: 344–352
CAS Статья PubMed Google Scholar
Snoeck V, Peters IR, Cox E (2006) Система IgA: сравнение структуры и функции у разных видов. Vet Res 37: 455–467
CAS Статья PubMed Google Scholar
Гиббонс Д.Л., Спенсер Дж. (2011) Мышиный и человеческий кишечный иммунитет: тот же пример, разные игроки; разные правила, одинаковый счет. Имунол слизистой оболочки 4: 148–157
Имунол слизистой оболочки 4: 148–157
CAS Статья Google Scholar
Mills FC, Harindranath N, Mitchell M, Max EE (1997) Комплексы энхансеров, расположенные ниже обоих генов человеческого иммуноглобулина Calpha. J Exp Med 186: 845–858
PubMed Central CAS Статья PubMed Google Scholar
Van der Boog PJM, van Kooten C, de Fijter JW, Daha MR (2005) Роль макромолекулярного IgA в IgA нефропатии. Kidney Int 67: 813–821
Артикул PubMed Google Scholar
Vaerman J, Langendries A, Reinhardt P, Rothkötter H (1997) Вклад сывороточного IgA в лимфатический IgA кишечника и наоборот у мини-свиней. Vet Immunol Immunopathol 58: 301–308
CAS Статья PubMed Google Scholar
Cerutti A (2008) Регулирование переключения класса IgA. Nat Rev Immunol 8: 421–434
Nat Rev Immunol 8: 421–434
PubMed Central CAS Статья PubMed Google Scholar
Quayle AJ (2002) Врожденный и ранний иммунный ответ на заражение патогеном в женских половых путях и центральная роль эпителиальных клеток. J Reprod Immunol 57: 61–79
CAS Статья PubMed Google Scholar
Хики Д.К., Патель М.В., Фэхи Дж. В., Вира С.Р. (2011) Врожденный и адаптивный иммунитет на слизистых оболочках женских половых путей: стратификация и интеграция иммунной защиты от передачи инфекций, передаваемых половым путем.J Reprod Immunol 88: 185–194
PubMed Central CAS Статья PubMed Google Scholar
Ochiel DO, Fahey JV, Ghosh M, Haddad SN, Wira CR (2008) Врожденный иммунитет в женском репродуктивном тракте: роль половых гормонов в регулировании защиты эпителиальных клеток матки от патогенов. Curr Women’s Heal Rev 4: 102–117
Curr Women’s Heal Rev 4: 102–117
CAS Статья Google Scholar
Рассел М.В., Местецки Дж. (2002) Гуморальные иммунные ответы на микробные инфекции половых путей. Микробы заражают 4: 667–677
CAS Статья PubMed Google Scholar
Wira CR, Fahey JV, Ghosh M, Patel MV, Hickey DK, Ochiel DO (2010) Регуляция половыми гормонами врожденного иммунитета в женском репродуктивном тракте: роль эпителиальных клеток в балансировании репродуктивного потенциала с защитой от возбудители, передающиеся половым путем.Am J Reprod Immunol 63: 544–565
CAS Статья PubMed Google Scholar
Stanberry LR, Rosenthal SL (Eds) (2012) Болезни, передаваемые половым путем: вакцины, профилактика и контроль. Академик Пресс, Оксфорд.
Yeaman GR, Wirat R, Guyre PM, Gonzalez J, Collins JE, Stern JE (1997) Уникальные лимфоидные агрегаты, богатые Т-лимфоцитами CD8, в эндометрии матки человека. J Leukoc Biol 61: 427–435
J Leukoc Biol 61: 427–435
CAS PubMed Google Scholar
Букер С.С., Джаянетти С., Каралак С., Хсиу Дж.Г., Арчер Д.Ф. (1994) Влияние прогестерона на накопление лейкоцитов в эндометрии человека. Am J Obstet Gynecol 171: 139–142
CAS Статья PubMed Google Scholar
Камат Б.Р., Исааксон П.Г. (1987) Иммуноцитохимическое распределение лейкоцитарных субпопуляций в эндометрии человека. Am J Pathol 127: 66–73
PubMed Central CAS PubMed Google Scholar
Dalin A-M, Kaeoket K, Persson E (2004) Инфильтрация иммунных клеток нормального и нарушенного эндометрия свиноматки. Anim Reprod Sci 82–83: 401–413
Статья PubMed Google Scholar
Бишоф Р.Дж., Брэндон М.Р., Ли С.С. (1994) Исследования распределения иммунных клеток в матке у свинок препубертатного и циклического возраста. J Reprod Immunol 26: 111–129
J Reprod Immunol 26: 111–129
CAS Статья PubMed Google Scholar
Mestecky J, Alexander RC, Wei Q, Moldoveanu Z (2011) Методы оценки гуморальных иммунных ответов в секретах половых путей человека. Am J Reprod Immunol 65: 361–367
PubMed Central CAS Статья PubMed Google Scholar
Ребелло Р., Грин Ф (1975) Исследование секреторной иммунной системы в женских половых путях. Br J Obstet Gynaecol 82: 812–816
CAS Статья PubMed Google Scholar
Wright PF (2011) Индуктивные / эффекторные механизмы гуморального иммунитета на участках слизистой оболочки. Am J Reprod Immunol 65: 248–252
CAS Статья PubMed Google Scholar
Kutteh WH, Prince SJ, Hammond KR, Kutteh CC, Mestecky J (1996) Вариации иммуноглобулинов и подклассов IgA цервикального секрета матки человека во время овуляции. Clin Exp Immunol 104: 538–542
Clin Exp Immunol 104: 538–542
PubMed Central CAS Статья PubMed Google Scholar
Hussein AM, Newby TJ, Stokes CR, Bourne FJ (1983) Количественное определение и происхождение иммуноглобулинов A, G и M в секретах и жидкостях репродуктивного тракта свиноматки. J Reprod Immunol 5: 17–26
CAS Статья PubMed Google Scholar
Woof JM, Mestecky J (2005) Иммуноглобулины слизистой оболочки. Immunol Rev 206: 64–82
CAS Статья PubMed Google Scholar
Kutteh WH, Prince SJ, Mestecky J (1982) Тканевое происхождение человеческого полимерного и мономерного IgA. J Immunol 128: 990–995
CAS PubMed Google Scholar
Мерфи К. (2011) Иммунобиология Джейнуэй. Garland Science, Соединенные Штаты Америки
Google Scholar

Батлер JE, Brown WR (1994) Иммуноглобулины и гены иммуноглобулинов свиней.Vet Immunol Immunopathol 43: 5–12
CAS Статья PubMed Google Scholar
Ивасаки А. (2010) Противовирусные иммунные ответы в половых путях: ключи к вакцинам. Nat Rev Immunol 10: 699–711
PubMed Central CAS Статья PubMed Google Scholar
Наз РК (2012) Иммунитет женских половых путей: отдельные иммунологические проблемы для разработки вакцины.J Reprod Immunol 93: 1–8
CAS Статья PubMed Google Scholar
Mestecky J, Raska M, Novak J, Alexander RC, Moldoveanu Z (2010) Опосредованная антителами защита и иммунная система слизистой оболочки половых путей: актуальность для дизайна вакцины. J Reprod Immunol 85: 81–85
PubMed Central CAS Статья PubMed Google Scholar

Хафнер Л.М., Уилсон Д.П., Тиммс П. (2014) Состояние разработки и будущие перспективы вакцины против инфекции Chlamydia trachomatis.Vaccine 32: 1563–1571
Статья PubMed Google Scholar
Farage MA, Miller KW, Sobel JD (2010) Динамика вагинальной экосистемы — гормональные влияния. Infect Dis Res Treat 3: 1–15
Статья Google Scholar
Zhou X, Bent SJ, Schneider MG, Davis CC, Islam MR, Forney LJ (2004) Характеристика вагинальных микробных сообществ у взрослых здоровых женщин с использованием методов, не зависящих от культивирования.Микробиология 150: 2565–2573
CAS Статья PubMed Google Scholar
Mastromarino P, Di Pietro M, Schiavoni G, Nardis C, Gentile M, Sessa R (2014) Эффекты вагинальных лактобацилл при инфекции Chlamydia trachomatis. Int J Med Microbiol 304: 654–661
Статья PubMed Google Scholar

Ларсен Б., Мониф ГРГ (2001) Понимание бактериальной флоры женских половых путей.Clin Infect Dis 32: 69–77
Статья Google Scholar
Бара М., МакГоуэн М., О’Бойл Д., Кэмерон Р. (1993) Исследование микробной флоры передней части влагалища нормальных свиноматок на разных стадиях репродуктивного цикла. Aust Vet J 70: 256–259
CAS Статья PubMed Google Scholar
Mather EC, Day BN (1977) «IN VIVO» значения pH эстрального репродуктивного тракта свиньи.Териогенология 8: 323–327
Статья Google Scholar
Haley PJ (2003) Видовые различия в структуре и функции иммунной системы. Токсикология 188: 49–71
CAS Статья PubMed Google Scholar
Treuting PM, Dintzis SM (eds) (2012) Сравнительная анатомия и гистология — Атлас мышей и людей. Академик, Оксфорд
Академик, Оксфорд
Google Scholar
Goldman JM, Murr AS, Cooper RL (2007) Эстральный цикл грызунов: характеристика цитологии влагалища и ее полезность в токсикологических исследованиях. Врожденные дефекты Res 80: 84–97
CAS Статья Google Scholar
Gallichan WS, Rosenthal KL (1996) Влияние эстрального цикла на местные гуморальные иммунные ответы и защиту интраназально иммунизированных самок мышей против инфекции вируса простого герпеса 2 типа в половых путях.Вирусология 224: 487–497
CAS Статья PubMed Google Scholar
Манипуляции с эстральным циклом у свиней [http://www2.ca.uky.edu/agc/pubs/asc/asc152/asc152.htm] По состоянию на 6 мая 2015 г.
Простагландины и репродуктивный цикл [http://www.glowm.com/section_view/heading/Prostaglandins and the Reproductive Cycle / item / 313] Доступ 5 мая 2015 г.
D’Hooghe TM, Nyachieo A, Chai DC , Kyama CM, Spiessens C, Mwenda JM (2008) Репродуктивные исследования у нечеловеческих приматов в Институте исследований приматов в Найроби, Кения (Сотрудничающий центр ВОЗ): платформа для развития служб клинического бесплодия? Репродукция Человека 2008: 102–107
Google Scholar
Wolfe-Coote S (ed) (2005) Примат лаборатории. Elsevier Academic Press, Сан-Диего
Google Scholar
Swindle MM, Makin A, Herron AJ, Clubb FJ, Frazier KS (2012) Свиньи как модели в биомедицинских исследованиях и токсикологических испытаниях. Vet Pathol 49: 344–356
CAS Статья PubMed Google Scholar
Коулман Д.Л., Калисс Н., Дагг С.П., Рассел Э.С., Фуллер Д.Л., Стаатс Дж., Грин М.С., Рассел С.П.Д.С., Статс JLFJ (1966) Биология лабораторной мыши.Dover Publications inc. , Нью-Йорк
, Нью-Йорк
Google Scholar
D’Cruz OJ, Erbeck D, Uckun FM (2005) Исследование потенциала свиней в качестве модели вагинального раздражения хлорида бензалкония по сравнению с нераздражающим микробицидом PHI-443 и спермицидом ванадоценом. дитиокарбамат. Toxicol Pathol 33: 465–476
Статья PubMed Google Scholar
Berrington JE, Barge D, Fenton AC, Cant AJ, Spickett GP (2005) Субпопуляции лимфоцитов у доношенных и значительно недоношенных младенцев в Великобритании на первом году жизни проанализированы с помощью проточной цитометрии на одной платформе. Clin Exp Immunol 140: 289–292
PubMed Central CAS Статья PubMed Google Scholar
Pomorska-Mól M, Markowska-Daniel I (2011) Возрастные изменения относительного и абсолютного размера субпопуляций лимфоцитов в крови свиней от рождения до убоя. Bull Vet Inst Pulawy 55: 305–310
Bull Vet Inst Pulawy 55: 305–310
Google Scholar
Pudney J, Quayle AJ, Anderson DJ (2005) Иммунологическая микросреда во влагалище и шейке матки человека: Медиаторы клеточного иммунитета сосредоточены в зоне трансформации шейки матки. Биол Репрод 73: 1253–1263
CAS Статья PubMed Google Scholar
White HD, Crassi KM, Givan A, Stern JE, Memoli VA, Green WR, Wirat CR (1997) Активность CD3 + CD8 + CTL в женском репродуктивном тракте человека.J Immunol 158: 3017–3027
CAS PubMed Google Scholar
Jiwakanon J, Persson E, Kaeoket K, Dalin A-M (2005) Эндосальпинкс свиноматки на разных стадиях эстрального цикла и во время анэструса: исследования морфологических изменений и инфильтрации клетками иммунной системы. Reprod Domest Anim 40: 28–39
CAS Статья PubMed Google Scholar

Usala S, Usala F, Holt J, Schumacher G (1989) Содержание IgG и IgA во влагалищной жидкости во время менструального цикла. J Reprod Med 34: 292–294
CAS PubMed Google Scholar
Nardelli-Haefliger D, Wirthner D, Schiller JT, Lowy DR, Hildesheim A, Ponci F, De Grandi P (2003) Уровни специфических антител в шейке матки во время менструального цикла у женщин, вакцинированных вирусом папилломы человека 16 -подобные частицы. J Natl Cancer Inst 95: 1128–1137
Статья PubMed Google Scholar
Keller MJ, Guzman E, Hazrati E, Kasowitz A, Cheshenko N, Wallenstein S, Cole AL, Cole AM, Profy AT, Wira CR, Hogarty K, Herold BC (2007) PRO 2000 вызывает снижение иммунных медиаторов половых путей без нарушение внутренней антимикробной активности. AIDS 21: 467–476
CAS Статья PubMed Google Scholar
Thiruchelvam U, Dransfield I, Saunders PTK, Critchley HOD (2013) Важность макрофагов в эндометрии человека.J Leukoc Biol 93: 217–225
CAS Статья PubMed Google Scholar
Йеман Г.Р., Коллинз Дж. Э., Фангер М. В., Free R (2001) CD8 + Т-клетки в лимфоидных агрегатах эндометрия матки человека: доказательства накопления клеток в результате незаконного оборота. Иммунология 102: 434–440
PubMed Central CAS Статья PubMed Google Scholar
Shaw JLV, Fitch P, Cartwright J, Entrican G, Schwarze J, Critchley HOD, Hornea AW (2011) Популяции лимфоидных и миелоидных клеток в фаллопиевой трубе небеременного человека и при внематочной беременности.J Reprod Immunol 89: 84–91
PubMed Central CAS Статья PubMed Google Scholar
Kaeoket K, Dalin AM, Magnusson U, Persson E (2002) Исправление к «Эндометрий свиноматки на разных стадиях эстрального цикла: исследования распределения CD2, CD4, CD8 и экспрессии MHC класса II» клетки. [Аним. Репрод. Sci. 68 (2001) 99-109]. Anim Reprod Sci 73: 109–119
[Аним. Репрод. Sci. 68 (2001) 99-109]. Anim Reprod Sci 73: 109–119
CAS Статья PubMed Google Scholar
Обструкция оттока половых путей: история болезни, патофизиология, этиология
Автор
Лата Чандран, MBBS, MD, MPH Профессор педиатрии, заместитель декана по медицинскому образованию, Медицинская школа Университета Стони Брук, Нью-Йорк
Лата Чандран, MBBS, MD, MPH является членом следующих медицинских обществ: Американская академия педиатрии
Раскрытие: нечего раскрывать.
Специальная редакционная коллегия
Мэри Л. Виндл, PharmD Адъюнкт-профессор, Фармацевтический колледж Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие информации: нечего раскрывать.
Уэйн Вольфрам, доктор медицины, магистр здравоохранения Профессор отделения неотложной медицины, Медицинский центр Мерси Сент-Винсент; Председатель Наблюдательного совета педиатрического учреждения, Медицинский центр Мерси Сент-Винсент, Толедо, Огайо
Уэйн Вольфрам, доктор медицины, магистр здравоохранения является членом следующих медицинских обществ: Американской академии экстренной медицины, Американской академии педиатрии, Общества академической неотложной медицины
Раскрытие: Ничего не нужно раскрывать.
Главный редактор
Андреа Л. Цукерман, доктор медицины Адъюнкт-профессор акушерства / гинекологии, Медицинский факультет Университета Тафтса; Директор отдела детской и подростковой гинекологии, Медицинский центр Тафтс
Андреа Л. Цукерман, доктор медицины, является членом следующих медицинских обществ: Американского колледжа акушеров и гинекологов, Массачусетского медицинского общества, Североамериканского общества детской и подростковой гинекологии
Раскрытие информации: Нечего раскрывать.
Дополнительные участники
Элизабет Олдерман, доктор медицины Директор, программа педиатрической ординатуры, директор программы стажировок, подростковая медицина, профессор клинической педиатрии, кафедра педиатрии, отделение подростковой медицины, Медицинский колледж Альберта Эйнштейна и детская больница в Монтефиоре
Элизабет Олдерман , MD является членом следующих медицинских обществ: Американской педиатрической академии, Американского педиатрического общества, Североамериканского общества детской и подростковой гинекологии, Общества здоровья подростков и медицины
Раскрытие информации: не раскрывать.
Благодарности
Джозеф А. Пуччо, доктор медицины, FAAP Директор, Отделение подростковой медицины, Университетская больница Стоуни-Брук; Доцент кафедры педиатрии медицинского факультета Университета Стоуни-Брук
Джозеф А. Пуччио, доктор медицины, FAAP является членом следующих медицинских обществ: Американской академии педиатрии и Общества подростковой медицины
Раскрытие: Ничего не раскрывать.
SSA — POMS: DI 23022.315 — Мелкоклеточный рак женских половых путей
Система руководств по операциям с программами (POMS)
TN 36 (09-20)
ИНФОРМАЦИЯ О ДОПОЛНИТЕЛЬНЫХ РАЗВИТИЯХ | ||
|---|---|---|
МАЛЫЙ КЛЕТОЧНЫЙ РАК ЖЕНСКИХ ПОЛОВЫХ ПОЛОВ ТРАКТ | ||
| АЛЬТЕРНАТИВНЫЕ ИМЕНА | Мелкоклеточная карцинома матки; Мелкоклеточная карцинома влагалища; Маленькая ячейка Карцинома вульвы; Мелкоклеточная карцинома эндометрия; Мелкоклеточная карцинома фаллопиевой трубы; Мелкоклеточный рак яичника; Мелкоклеточный рак шейки матки; Мелкоклеточная карцинома влагалища; Мелкоклеточный рак влагалища; Первичные вагинальные мелкоклеточные Карцинома; Слабо дифференцированный нейроэндокринный рак влагалища | |
ОПИСАНИЕ | Мелкоклеточный рак (SCC) женских половых путей (FGT) чаще всего встречается в шейке матки, но также может возникать в эндометрии, яичниках,
маточная труба, влагалище и вульва. | |
ДИАГНОСТИЧЕСКИЕ ИСПЫТАНИЯ, ФИЗИЧЕСКИЕ РЕЗУЛЬТАТЫ И МКБ-9-СМ / МКБ-10-СМ КОДИРОВКА | Диагностическое обследование: КТ головного мозга, головного мозга, грудной клетки, брюшной полости и таза; и исследование костного мозга. Физические данные: пациенты с SCC FGT могут протекать бессимптомно, но обычно имеют:
МКБ-9: 179.; 180,1; 180,8; 183,0; 183,2; 183,3; 183,5; 183,8; 183,9; 184,4; 184,8; 184,9 МКБ-10: C57.9 | |
ЛЕЧЕНИЕ | Стандартного лечения SCC FGT не существует.Лечение зависит от симптомов и обычно состоит из комбинации хирургического вмешательства; радиация; химиотерапия; и иммунотерапия. | |
ПРОГРЕССИЯ | ПКР матки или шейки матки — это высокоагрессивная опухоль, которая часто рано дает метастазы. | |
ПРЕДЛАГАЕМАЯ ПРОГРАММНАЯ ОЦЕНКА * | ||
Предлагаемый MER для оценки:
| ||
Предлагаемые списки для оценки: | ||
ОПРЕДЕЛЕНИЕ | ЛИСТИНГ | ЗАМЕЧАНИЯ |
соответствует | 13.23 F | SCC FGT соответствует критериям из списка 13.23 F после подтвержденного диагноза. |
равно | ||
* Судьи могут по своему усмотрению использовать медицинские свидетельства записи или листинги предложили оценить претензию.Однако решение разрешить или отрицать иск остается на рассмотрении арбитра. | ||
Перенос IgG в женские половые пути с помощью MHC класса I неонатального Fc-рецептора (FcRn) обеспечивает защитный иммунитет против вагинальной инфекции
Abstract
IgG является основным подклассом Ig в секретах слизистой оболочки женских половых путей человека, где он преобладает над изотипом IgA. Несмотря на обилие IgG, на удивление мало известно о том, где и как IgG попадает в просвет половых путей и о точной роли, которую местные IgG играют в предотвращении заболеваний, передающихся половым путем. Мы демонстрируем здесь, что неонатальный рецептор Fc, FcRn, экспрессируется в эпителиальных клетках женских половых путей людей и мышей и связывает IgG зависимым от pH образом. In vitro мы показываем, что FcRn опосредует двунаправленный транспорт IgG через поляризованные монослои HEC-1-A эндометрия человека и первичные генитальные эпителиальные клетки человека.Более того, закисление эндосом, по-видимому, является предпосылкой для FcRn-опосредованного трансцитоза IgG; Трансцитоз IgG был продемонстрирован in vivo путем транслокации системно вводимого IgG в просвет гениталий у мышей WT, но не у мышей FcRn-KO. Биологическая значимость IgG, переносимого FcRn, была продемонстрирована путем пассивной иммунизации с использованием поликлональной сыворотки, специфичной к вирусу простого герпеса-2 (HSV-2), которая обеспечивала значительно более высокую защиту от интравагинальной контрольной инфекции штаммом HSV-2 186 у мышей WT, чем у мышей WT.
Несмотря на обилие IgG, на удивление мало известно о том, где и как IgG попадает в просвет половых путей и о точной роли, которую местные IgG играют в предотвращении заболеваний, передающихся половым путем. Мы демонстрируем здесь, что неонатальный рецептор Fc, FcRn, экспрессируется в эпителиальных клетках женских половых путей людей и мышей и связывает IgG зависимым от pH образом. In vitro мы показываем, что FcRn опосредует двунаправленный транспорт IgG через поляризованные монослои HEC-1-A эндометрия человека и первичные генитальные эпителиальные клетки человека.Более того, закисление эндосом, по-видимому, является предпосылкой для FcRn-опосредованного трансцитоза IgG; Трансцитоз IgG был продемонстрирован in vivo путем транслокации системно вводимого IgG в просвет гениталий у мышей WT, но не у мышей FcRn-KO. Биологическая значимость IgG, переносимого FcRn, была продемонстрирована путем пассивной иммунизации с использованием поликлональной сыворотки, специфичной к вирусу простого герпеса-2 (HSV-2), которая обеспечивала значительно более высокую защиту от интравагинальной контрольной инфекции штаммом HSV-2 186 у мышей WT, чем у мышей WT. Мыши FcRn-KO.Эти исследования демонстрируют, что опосредованный FcRn транспорт является механизмом, с помощью которого IgG могут действовать локально в женских половых путях при иммунном надзоре и защите хозяина от заболеваний, передающихся половым путем.
Мыши FcRn-KO.Эти исследования демонстрируют, что опосредованный FcRn транспорт является механизмом, с помощью которого IgG могут действовать локально в женских половых путях при иммунном надзоре и защите хозяина от заболеваний, передающихся половым путем.
Большинство патогенов инициируют инфекцию, вступая в контакт с поляризованными эпителиальными клетками на поверхности слизистой оболочки. Иммуноглобулины, присутствующие в секрете слизистой оболочки, действуют как первая линия защиты от патогенов, передаваемых через слизистую оболочку (1). В желудочно-кишечном тракте и верхних дыхательных путях основными видами Ig, обнаруженными на поверхности слизистой оболочки, являются секреторный IgA (S-IgA), который, как известно, в первую очередь является результатом активного транспорта димерного IgA полимерным рецептором IgA (pIgR) через поляризованный эпителий ( 2).Хотя S-IgA обычно считается основным компонентом опосредованной антителами защиты в кишечнике, несколько линий доказательств указывают на то, что IgG также присутствует в секретах слизистой оболочки и поддерживает роль IgG в защите слизистой оболочки хозяина. Во-первых, IgG присутствует в секретах слизистой оболочки полости рта, тонкого и толстого кишечника и легких человека (3, 4). Во-вторых, количество локальных IgG-секретирующих клеток в тканях слизистой оболочки и уровни антиген-специфического IgG в секретах слизистой оболочки резко увеличиваются как после слизистой, так и после системной иммунизации (5-7).В-третьих, изотипический паттерн и концентрации IgG в секрете слизистой оболочки четко отличаются от таковых в сыворотке, что свидетельствует об активном и селективном представлении IgG в участке слизистой оболочки (8).
Во-первых, IgG присутствует в секретах слизистой оболочки полости рта, тонкого и толстого кишечника и легких человека (3, 4). Во-вторых, количество локальных IgG-секретирующих клеток в тканях слизистой оболочки и уровни антиген-специфического IgG в секретах слизистой оболочки резко увеличиваются как после слизистой, так и после системной иммунизации (5-7).В-третьих, изотипический паттерн и концентрации IgG в секрете слизистой оболочки четко отличаются от таковых в сыворотке, что свидетельствует об активном и селективном представлении IgG в участке слизистой оболочки (8).
IgG — преобладающий подкласс Ig в женских половых путях человека, где его концентрация превышает таковую IgA (9). IgG также был обнаружен в маточно-цервикальной жидкости (10) и вагинальных смывах (5, 11). Важность IgG при генитальных инфекциях была продемонстрирована преобладанием специфических для вируса иммунодефицита человека (ВИЧ-1) ответов IgG на поверхности слизистой оболочки ВИЧ-1-инфицированных женщин (6, 11). В этих исследованиях наблюдалась обратная корреляция между количеством присутствующего IgG в слизистой оболочке и вирусной нагрузкой. Следовательно, ВИЧ-специфический IgG может иметь гораздо большее значение для защиты слизистой оболочки, чем считалось ранее. В отличие от S-IgA, механизм (ы), с помощью которого антитело IgG транспортируется через генитальный эпителий, и роль IgG в защите слизистой оболочки гениталий не исследовались. Неполное понимание транспорта IgG в половых путях и его роли в борьбе с генитальными инфекциями препятствовало разработке и разработке вакцин и профилактических методов лечения заболеваний, передаваемых половым путем (ЗППП).Исторически источник IgG в половых путях приписывался простой пассивной параклеточной диффузии из кровотока или местной продукции плазматическими клетками, ассоциированными с эпителием (12). Эта точка зрения была поставлена под сомнение из-за растущих доказательств того, что на уровни IgG в секрете слизистой оболочки половых органов могут резко повлиять генитальные инфекции (6, 13–16), эстральный цикл (17) и иммунизация (7, 8, 15, 18).
В этих исследованиях наблюдалась обратная корреляция между количеством присутствующего IgG в слизистой оболочке и вирусной нагрузкой. Следовательно, ВИЧ-специфический IgG может иметь гораздо большее значение для защиты слизистой оболочки, чем считалось ранее. В отличие от S-IgA, механизм (ы), с помощью которого антитело IgG транспортируется через генитальный эпителий, и роль IgG в защите слизистой оболочки гениталий не исследовались. Неполное понимание транспорта IgG в половых путях и его роли в борьбе с генитальными инфекциями препятствовало разработке и разработке вакцин и профилактических методов лечения заболеваний, передаваемых половым путем (ЗППП).Исторически источник IgG в половых путях приписывался простой пассивной параклеточной диффузии из кровотока или местной продукции плазматическими клетками, ассоциированными с эпителием (12). Эта точка зрения была поставлена под сомнение из-за растущих доказательств того, что на уровни IgG в секрете слизистой оболочки половых органов могут резко повлиять генитальные инфекции (6, 13–16), эстральный цикл (17) и иммунизация (7, 8, 15, 18). В совокупности эти наблюдения открывают возможность существования активной транспортной системы, через которую IgG проникает через генитальный эпителий.
В совокупности эти наблюдения открывают возможность существования активной транспортной системы, через которую IgG проникает через генитальный эпителий.
Неонатальный рецептор Fc для IgG (FcRn) представляет собой гетеродимер, состоящий из мембраносвязанной тяжелой цепи 45-50 кДа, неконвалентно связанной с 12-кДа β 2 -микроглобулин (β 2 m) (19 ). FcRn был первоначально идентифицирован в кишечнике новорожденных грызунов, но он также экспрессируется и функционально активен в различных тканях и клетках взрослых (20–22). Кроме того, FcRn отвечает за транспортировку материнского IgG через плаценту и IgG молозива через кишечник в кровоток плода и новорожденного, соответственно (20, 21).Способность FcRn транспортировать IgG позволяет новорожденным приобретать гуморальный иммунитет в виде материнских антител до того, как их собственная иммунная система полностью созреет. Кроме того, FcRn способен защищать IgG и альбумин от катаболизма (22, 23), и эта защита способствует тому, что они являются наиболее распространенными белками в крови. Эта защитная функция FcRn играет важную роль в продлении периода полужизни и поддержании функциональных уровней IgG после иммунизации или инфекции и, следовательно, способствует длительному защитному иммунитету.Взаимодействие FcRn и IgG заметно зависит от pH: связывание IgG в кислых (≤6,5) условиях и высвобождение IgG в нейтральных (7,0–7,5) условиях (23). Таким образом, FcRn, вероятно, будет функционировать в основном в подкисленных эндосомах, где связывание IgG, вероятно, происходит после поглощения жидкой фазы.
Эта защитная функция FcRn играет важную роль в продлении периода полужизни и поддержании функциональных уровней IgG после иммунизации или инфекции и, следовательно, способствует длительному защитному иммунитету.Взаимодействие FcRn и IgG заметно зависит от pH: связывание IgG в кислых (≤6,5) условиях и высвобождение IgG в нейтральных (7,0–7,5) условиях (23). Таким образом, FcRn, вероятно, будет функционировать в основном в подкисленных эндосомах, где связывание IgG, вероятно, происходит после поглощения жидкой фазы.
Хотя FcRn играет критическую роль в приобретении материнского гуморального иммунитета в раннем возрасте и в регуляции катаболизма IgG у взрослых, его функция в IgG-опосредованном иммунитете женских половых путей еще предстоит установить.Поскольку IgG является основным изотипом Ig в половых путях, мы предположили, что FcRn в поляризованных генитальных эпителиальных клетках функционирует как рецептор внутриклеточного переноса и опосредует трансцитоз IgG через эпителий половых путей, что приводит к обогащению IgG в секретах слизистой оболочки гениталий. Наши результаты показывают, что FcRn в эпителии женских половых органов как человека, так и мышей способен транспортировать IgG как апикально, так и базолатерально. Более того, FcRn-трансцитозированный вирусоспецифический IgG обеспечивает защиту от заражения слизистой оболочки модельным патогеном HSV-2.Эти результаты показывают неожиданную и важную роль FcRn, действующего на эпителий женских половых органов, в иммунном надзоре и защите хозяина от ЗППП.
Наши результаты показывают, что FcRn в эпителии женских половых органов как человека, так и мышей способен транспортировать IgG как апикально, так и базолатерально. Более того, FcRn-трансцитозированный вирусоспецифический IgG обеспечивает защиту от заражения слизистой оболочки модельным патогеном HSV-2.Эти результаты показывают неожиданную и важную роль FcRn, действующего на эпителий женских половых органов, в иммунном надзоре и защите хозяина от ЗППП.
Результаты
Анализ экспрессии FcRn в эпителиальных клетках женских половых органов человека.
Чтобы определить, экспрессируется ли FcRn в эпителиальных клетках женских половых органов, был проведен ОТ-ПЦР анализ общей РНК, полученной из четырех линий эпителиальных клеток женских половых органов человека (End1, эндоцервикальный; Ect1, экзоцервикальный; HEC-1-A, маточный; и VK2, вагинальный) и две контрольные линии клеток человека (линия эпителиальных клеток кишечника HT29 и линия макрофагоподобных клеток THP-1). КДНК человеческого FcRn была амплифицирована в виде единственной полосы длиной 296 п.о. во всех исследованных линиях клеток, и последовательности продуктов ПЦР были подтверждены секвенированием ДНК (фиг. 1 A ). Более того, обнаруженная нами последовательность кДНК FcRn была идентична предсказанной последовательности, экспрессируемой плацентой человека, как сообщалось ранее (24). Экспрессию белка FcRn оценивали с помощью вестерн-блоттинга с использованием кроличьих антител против FcRn человека (анти-hFcRn) (25). Линия клеток эпителия кишечника человека Caco-2, экспрессирующая FcRn, была использована в качестве положительного контроля (20), а линия клеток эпителия шейки матки человека HeLa была использована в качестве отрицательного контроля (25).Полоса 45 кДа, обнаруженная во всех четырех линиях генитальных эпителиальных клеток (фиг. 1 B ), соответствовала известной молекулярной массе тяжелой цепи hFcRn и соответствовала тяжелой цепи FcRn, экспрессируемой клетками Caco-2 (фиг.
КДНК человеческого FcRn была амплифицирована в виде единственной полосы длиной 296 п.о. во всех исследованных линиях клеток, и последовательности продуктов ПЦР были подтверждены секвенированием ДНК (фиг. 1 A ). Более того, обнаруженная нами последовательность кДНК FcRn была идентична предсказанной последовательности, экспрессируемой плацентой человека, как сообщалось ранее (24). Экспрессию белка FcRn оценивали с помощью вестерн-блоттинга с использованием кроличьих антител против FcRn человека (анти-hFcRn) (25). Линия клеток эпителия кишечника человека Caco-2, экспрессирующая FcRn, была использована в качестве положительного контроля (20), а линия клеток эпителия шейки матки человека HeLa была использована в качестве отрицательного контроля (25).Полоса 45 кДа, обнаруженная во всех четырех линиях генитальных эпителиальных клеток (фиг. 1 B ), соответствовала известной молекулярной массе тяжелой цепи hFcRn и соответствовала тяжелой цепи FcRn, экспрессируемой клетками Caco-2 (фиг. 1 ). В , переулок 6).
1 ). В , переулок 6).
Обнаружение экспрессии гена hFcRn в линиях генитальных эпителиальных клеток. ( A ) Полуколичественная RT-PCR мРНК hFcRn, полученной из клеточных линий женских половых путей, кишечника или макрофагов. Пары праймеров амплифицировали α2-домен hFcRn.РНК из линии клеток эпителия кишечника человека HT-29 и линии макрофагоподобных клеток THP-1 использовали в качестве положительного контроля. Отрицательный контроль RT-PCR проводили без RT. GAPDH использовали в качестве внутреннего контроля качества и загрузки РНК. Ect1, экзоцервикальные клетки; End1 — эндоцервикальные клетки; HEC-1-A, эпителиальные клетки матки человека; ВК2, вагинальные клетки. ( B ) Вестерн-блоттинг экспрессии hFcRn в генитальных эпителиальных клетках человека. Лизаты клеток из HeLa (дорожка 5) и эпителиальных клеток кишечника человека Caco-2 (дорожка 6) использовали в качестве отрицательного и положительного контролей соответственно.Блоты зондировали аффинно очищенным кроличьим анти-hFcRn-специфическим антителом ( верхний ) или β-тубулин-специфическим антителом ( нижний ) с последующей инкубацией с конъюгированным с HRP анти-IgG антителом. ( C ) Иммуногистохимическое окрашивание экспрессии hFcRn в тканях матки и влагалища человека. Срезы тканей окрашивали аффинно очищенным кроличьим антителом против hFcRn, а затем IgG, конъюгированным с Alexa Fluor 555 (красный). Окрашивание FcRn не наблюдалось в присутствии нормального IgG.DAPI (синий) указывает на ядерное окрашивание. Данные являются репрезентативными как минимум для трех разделов. Изображения были получены с помощью объектива с водным объективом 40x. (Масштаб: 50 мкм.)
( C ) Иммуногистохимическое окрашивание экспрессии hFcRn в тканях матки и влагалища человека. Срезы тканей окрашивали аффинно очищенным кроличьим антителом против hFcRn, а затем IgG, конъюгированным с Alexa Fluor 555 (красный). Окрашивание FcRn не наблюдалось в присутствии нормального IgG.DAPI (синий) указывает на ядерное окрашивание. Данные являются репрезентативными как минимум для трех разделов. Изображения были получены с помощью объектива с водным объективом 40x. (Масштаб: 50 мкм.)
Экспрессия FcRn в тканях матки и влагалища человека была дополнительно подтверждена иммунным окрашиванием с использованием антител против hFcRn (25). FcRn был локализован как в тканях матки, так и во влагалище, с наиболее интенсивным окрашиванием в эпителии (рис. 1 C ). Иммунное окрашивание стромы было слабым в матке и почти не обнаруживалось во влагалище.Многие разбросанные клетки в собственной пластинке матки также показали слабое цитоплазматическое окрашивание (рис. 1 C ). При использовании нерелевантного кроличьего IgG окрашивания не наблюдалось (фиг. 1 C ), что свидетельствует о специфичности антител против hFcRn. Вместе эти результаты показывают, что человеческий вагинальный, эктоцервикальный, эндоцервикальный и эндометриальный эпителии экспрессируют тяжелую цепь FcRn массой 45 кДа. Присутствие обильных мРНК и белка FcRn в эпителиальных клетках женских половых органов человека и его наблюдаемое клеточное распределение согласуются с данными, полученными в энтероцитах тонкой кишки человека (20).
При использовании нерелевантного кроличьего IgG окрашивания не наблюдалось (фиг. 1 C ), что свидетельствует о специфичности антител против hFcRn. Вместе эти результаты показывают, что человеческий вагинальный, эктоцервикальный, эндоцервикальный и эндометриальный эпителии экспрессируют тяжелую цепь FcRn массой 45 кДа. Присутствие обильных мРНК и белка FcRn в эпителиальных клетках женских половых органов человека и его наблюдаемое клеточное распределение согласуются с данными, полученными в энтероцитах тонкой кишки человека (20).
Опосредованный рецептором трансцитоз IgG в клетках HEC-1-A.
Мы выбрали клетку HEC-1-A для изучения трансцитоза IgG, поскольку она экспрессирует FcRn (рис. 1 A ) и была использована для демонстрации pIgR-опосредованного трансцитоза IgA (26). FcRn-зависимый транспорт IgG измеряли по трансэпителиальному потоку человеческого IgG. Как показано на фиг. 2 A , интактный человеческий IgG, нанесенный на апикальную (дорожка 4) или базолатеральную (дорожка 3) клеточные поверхности, транспортировался как в просвете, так и в аблюменальном направлении через монослои клеток HEC-1-A, по оценке вестерн-блоттинга. .Транспорт IgG, на что указывает присутствие его тяжелой цепи (55 кДа), был обнаружен в монослоях, инкубированных при 37 ° C (дорожки 3 и 4), но не при 4 ° C (дорожки 5 и 6). Чтобы показать, не опосредован ли трансцитоз IgG с помощью FcγRIII ( результаты SI и фиг. S1), транспорт IgG ингибировался нокдауном FcRn или конкурентным ингибированием функции FcRn фрагментом B стафилококкового белка A (фиг. S2). Напротив, куриный IgY, который структурно подобен IgG, но не связывает FcRn, не пересекает монослои клеток HEC-1-A ни в одном направлении при 37 ° C (рис.S3 A , дорожки 3 и 4). Таким образом, трансэпителиальный поток меченого биотином IgG не происходил путем пассивной диффузии через межклеточные плотные контакты или утечки монослоя. Эти данные показывают, что IgG может проникать как в апикальные, так и в базолатеральные трансцитотические пути в клетках HEC-1-A. В отдельном эксперименте было определено, что апикально направленный транспортный путь примерно в два раза более эффективен для транспорта IgG, чем базолатерально направленный путь (рис.
.Транспорт IgG, на что указывает присутствие его тяжелой цепи (55 кДа), был обнаружен в монослоях, инкубированных при 37 ° C (дорожки 3 и 4), но не при 4 ° C (дорожки 5 и 6). Чтобы показать, не опосредован ли трансцитоз IgG с помощью FcγRIII ( результаты SI и фиг. S1), транспорт IgG ингибировался нокдауном FcRn или конкурентным ингибированием функции FcRn фрагментом B стафилококкового белка A (фиг. S2). Напротив, куриный IgY, который структурно подобен IgG, но не связывает FcRn, не пересекает монослои клеток HEC-1-A ни в одном направлении при 37 ° C (рис.S3 A , дорожки 3 и 4). Таким образом, трансэпителиальный поток меченого биотином IgG не происходил путем пассивной диффузии через межклеточные плотные контакты или утечки монослоя. Эти данные показывают, что IgG может проникать как в апикальные, так и в базолатеральные трансцитотические пути в клетках HEC-1-A. В отдельном эксперименте было определено, что апикально направленный транспортный путь примерно в два раза более эффективен для транспорта IgG, чем базолатерально направленный путь (рис. S3 B ).В этом эксперименте количество IgG, транспортируемого в любом направлении, измеряли с помощью количественного ELISA с использованием контрольного IgG в качестве стандарта.
S3 B ).В этом эксперименте количество IgG, транспортируемого в любом направлении, измеряли с помощью количественного ELISA с использованием контрольного IgG в качестве стандарта.
Двунаправленный трансцитоз IgG. ( A ) Клетки HEC-1-A (5 × 10 5 клеток на лунку) выращивали во вставках Transwell с 12 лунками. Когда трансэпителиальное сопротивление монослоя достигало 300–400 Ом / см 2 , клетки загружали 500 мкг / мл человеческого IgG либо в апикальную (дорожки 4 и 6), либо в базолатеральную (дорожки 3 и 5) камеру и инкубировали при 37 ° C или 4 ° C.Через три часа культуральную среду собирали из противоположной камеры и подвергали Вестерн-блоттингу. Дорожка 1 представляет собой IgG. Результаты являются репрезентативными для трех отдельных экспериментов. ( B ) Клетки HEC-1-A инкубировали в присутствии (дорожка 3) или в отсутствие (дорожка 4) бафиломицина A1 (0,1 мкМ) и измеряли базолатерально направленный транспорт IgG-биотина (100 мкг / мл). после 3 ч инкубации. Трансцитозированный IgG измеряли с помощью вестерн-блоттинга. ( C ) Трансцитоз IgG в модели ткани EpiVaginal.Ткань EpiVaginal выращивали во вставке Transwell с 12 лунками. Когда трансэпителиальное сопротивление монослоя достигало 300–400 Ом / см 2 , клетки загружали человеческим IgG-биотином (100 мкг / мл) (дорожки 3–6) или куриным IgY-биотином (дорожки 8 и 9) в либо апикальной (дорожки 4, 6 и 9), либо базолатеральной (дорожки 3, 5 и 8) камеры и инкубировали при 37 ° C или 4 ° C. Дорожки 1 и 7 представляют стандарт IgG или IgY соответственно. Клетки нагревали до 37 ° C для стимуляции трансцитоза; Среду собирали из ненагружаемого отсека через 3 часа и подвергали анализу на авидин-блоттинг.Отрицательный контроль проводили без добавления IgG (дорожка 2). Результаты представляют как минимум три независимых эксперимента. А, апикальный; Б — базолатеральный; HC, тяжелая цепь; LC, легкая цепь.
после 3 ч инкубации. Трансцитозированный IgG измеряли с помощью вестерн-блоттинга. ( C ) Трансцитоз IgG в модели ткани EpiVaginal.Ткань EpiVaginal выращивали во вставке Transwell с 12 лунками. Когда трансэпителиальное сопротивление монослоя достигало 300–400 Ом / см 2 , клетки загружали человеческим IgG-биотином (100 мкг / мл) (дорожки 3–6) или куриным IgY-биотином (дорожки 8 и 9) в либо апикальной (дорожки 4, 6 и 9), либо базолатеральной (дорожки 3, 5 и 8) камеры и инкубировали при 37 ° C или 4 ° C. Дорожки 1 и 7 представляют стандарт IgG или IgY соответственно. Клетки нагревали до 37 ° C для стимуляции трансцитоза; Среду собирали из ненагружаемого отсека через 3 часа и подвергали анализу на авидин-блоттинг.Отрицательный контроль проводили без добавления IgG (дорожка 2). Результаты представляют как минимум три независимых эксперимента. А, апикальный; Б — базолатеральный; HC, тяжелая цепь; LC, легкая цепь.
Чтобы продемонстрировать зависимость трансцитоза IgG от pH, клетки HEC-1-A инкубировали в присутствии или в отсутствие бафиломицина A1 (0,1 мкМ).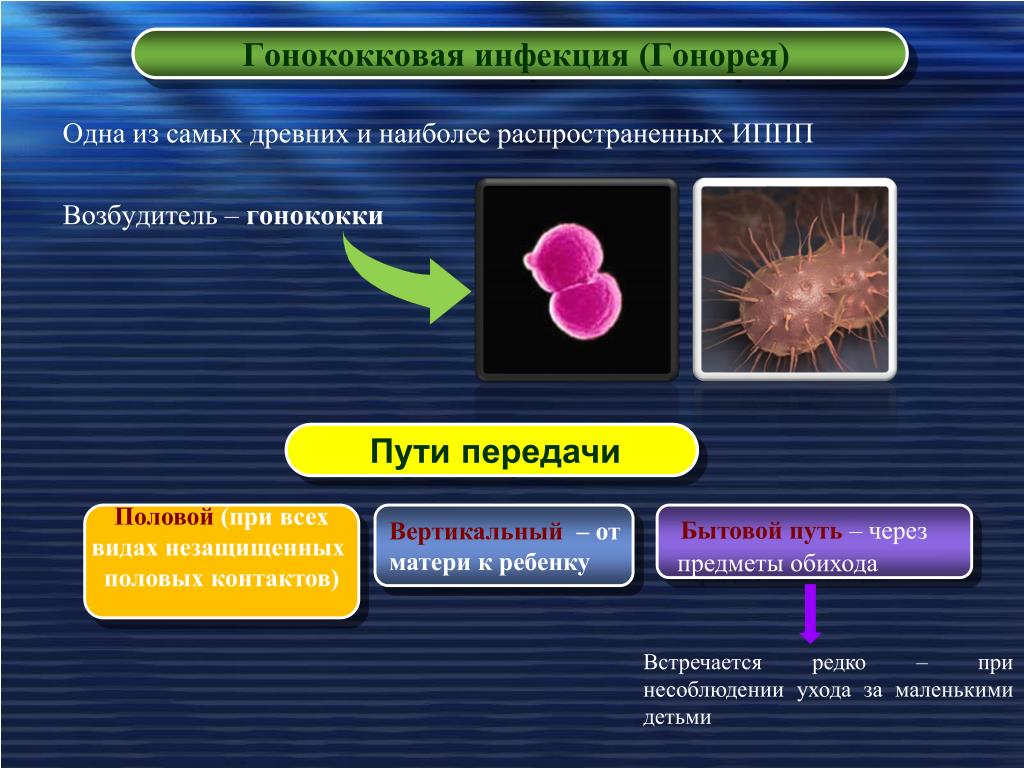 Бафиломицин A1 является специфическим ингибитором вакуолярной АТФазы H + , которая разрушает градиенты pH во внутриклеточных везикулах, но не препятствует перемещению через мембрану (20).Фиг. 2 B показывает, что бафиломицин A1 полностью ингибировал апикально-базолатеральный транспорт IgG (дорожка 3). Инкубация при 37 ° C и 4 ° C в отсутствие бафиломицина A1 обеспечила положительный и отрицательный внутренний контроль (дорожки 2 и 4, соответственно). Идентичные результаты были получены при исследовании апикально направленного транспорта IgG. Таким образом, FcRn-опосредованный трансэпителиальный транспорт IgG в клетках HEC-1-A требует кислых условий во внутриклеточных компартментах.
Бафиломицин A1 является специфическим ингибитором вакуолярной АТФазы H + , которая разрушает градиенты pH во внутриклеточных везикулах, но не препятствует перемещению через мембрану (20).Фиг. 2 B показывает, что бафиломицин A1 полностью ингибировал апикально-базолатеральный транспорт IgG (дорожка 3). Инкубация при 37 ° C и 4 ° C в отсутствие бафиломицина A1 обеспечила положительный и отрицательный внутренний контроль (дорожки 2 и 4, соответственно). Идентичные результаты были получены при исследовании апикально направленного транспорта IgG. Таким образом, FcRn-опосредованный трансэпителиальный транспорт IgG в клетках HEC-1-A требует кислых условий во внутриклеточных компартментах.
Транспорт IgG первичными клетками генитального эпителия человека.
Чтобы проверить, является ли трансцитоз IgG, наблюдаемый в клетках HEC-1-A, общим свойством генитальных эпителиальных тканей человека, коммерчески доступной первичной генитальной эпителиальной ткани человека, Human EpiVaginal Tissue Model (VEC-100-FT), которая точно отражает в условиях in vivo. Экспрессия человеческого FcRn была подтверждена в этих первичных генитальных эпителиальных тканях человека с помощью RT-PCR-амплификации с FcRn-специфическими праймерами (фиг. S4 A ) и вестерн-блоттинга с FcRn-специфическими антителами (фиг.S4 B ). Специфичность обнаружения FcRn была подтверждена либо с FcRn-отрицательными клетками HeLa (дорожка 2), либо с FcRn-положительными клетками HEC-1-A (дорожка 1) (фиг. S4 B ). Когда меченный биотином человеческий IgG (100 мкг / мл) загружали либо в апикальную, либо в базолатеральную камеру, первичные генитальные эпителиальные клетки человека трансцитировали IgG либо в апикально-базолатеральном направлении (дорожка 4), либо в базолатеральном направлении. апикальное направление (дорожка 3) (рис. 2 C ). Транспорт IgG не происходил, когда ткани инкубировали при 4 ° C (дорожки 5 и 6).Кроме того, меченный биотином IgY не трансцитировался ни в одном направлении при 37 ° C (фиг. 2 C , дорожки 8 и 9). В целом, результаты показывают, что человеческий IgG избирательно и двунаправленно транспортируется через первичные эпителиальные клетки женских половых органов человека и что перераспределение не было вызвано пассивной диффузией через параклеточные пути или утечкой в модели ткани.
Экспрессия человеческого FcRn была подтверждена в этих первичных генитальных эпителиальных тканях человека с помощью RT-PCR-амплификации с FcRn-специфическими праймерами (фиг. S4 A ) и вестерн-блоттинга с FcRn-специфическими антителами (фиг.S4 B ). Специфичность обнаружения FcRn была подтверждена либо с FcRn-отрицательными клетками HeLa (дорожка 2), либо с FcRn-положительными клетками HEC-1-A (дорожка 1) (фиг. S4 B ). Когда меченный биотином человеческий IgG (100 мкг / мл) загружали либо в апикальную, либо в базолатеральную камеру, первичные генитальные эпителиальные клетки человека трансцитировали IgG либо в апикально-базолатеральном направлении (дорожка 4), либо в базолатеральном направлении. апикальное направление (дорожка 3) (рис. 2 C ). Транспорт IgG не происходил, когда ткани инкубировали при 4 ° C (дорожки 5 и 6).Кроме того, меченный биотином IgY не трансцитировался ни в одном направлении при 37 ° C (фиг. 2 C , дорожки 8 и 9). В целом, результаты показывают, что человеческий IgG избирательно и двунаправленно транспортируется через первичные эпителиальные клетки женских половых органов человека и что перераспределение не было вызвано пассивной диффузией через параклеточные пути или утечкой в модели ткани.
Трансцитоз IgG в половых путях мышей.
Предыдущие сообщения показали, что IgG является основным Ig, присутствующим в смывах из влагалища человека (27).Мы предположили, что дифференциальный транспорт Ig в половые пути может быть результатом локальной экспрессии FcRn и эффективного FcRn-опосредованного переноса базолатерального к апикальному IgG через эпителий. Таким образом, мы исследовали уровень экспрессии мышиного FcRn в матке и влагалище взрослых мышей с помощью вестерн-блоттинга и иммунофлуоресценции с печенью и кишечником в качестве положительного и отрицательного контроля, соответственно. Мы обнаружили, что FcRn экспрессируется в эпителиальных клетках как матки, так и влагалища (фиг. 3 A ).Как и ожидалось, мышиный FcRn был обнаружен в печени, но не в тонком кишечнике взрослых мышей, что согласуется с данными о том, что транскрипция мышиного FcRn в кишечном эпителии значительно снижается после отлучения от груди (22, 23). Используя гранулы IgG-агарозы в качестве лиганда, тяжелая цепь мышиного FcRn была специфически удалена при pH 6,0, но не при pH 7,4 (Фиг. 3 B ) из клеточных лизатов как маточных (дорожки 1 и 2), так и вагинальных (дорожки 3). и 4) ткани. Кроме того, замороженные срезы тканей влагалища мыши (рис.3 C , верхний ) и слизистые оболочки матки (рис. 3 C , нижний ) показали специфический образец эпителиального окрашивания FcRn. Взятые вместе, эти данные показывают, что, как и у людей, эпителиальные клетки половых путей мыши экспрессируют высокие уровни функционально активного FcRn.
3 B ) из клеточных лизатов как маточных (дорожки 1 и 2), так и вагинальных (дорожки 3). и 4) ткани. Кроме того, замороженные срезы тканей влагалища мыши (рис.3 C , верхний ) и слизистые оболочки матки (рис. 3 C , нижний ) показали специфический образец эпителиального окрашивания FcRn. Взятые вместе, эти данные показывают, что, как и у людей, эпителиальные клетки половых путей мыши экспрессируют высокие уровни функционально активного FcRn.
Экспрессия мышиного FcRn (mFcRn) в половых путях. ( A ) Обнаружение белка mFcRn в свежевыделенных эпителиальных клетках вестерн-блоттингом. Мембраны зондировали аффинно очищенным кроличьим антителом против mFcRn или β-тубулина и конъюгированным с HRP ослиным антителом против кроличьего IgG.Стрелки указывают расположение тяжелой цепи mFcRn и β-тубулина. ( B ) pH-зависимое связывание IgG в эпителиальных клетках мышей из тканей влагалища и матки. Эпителиальные клетки матки мыши (дорожки 1 и 2) и влагалища (дорожки 3 и 4) выделяли и лизировали в PBS (pH 6,0 или 7,4) с 0,5% 3 [(3-холамидопробил) диметиламмонио] -1-пропансульфонатом (CHAPS ) и ингибиторы протеаз. Приблизительно 0,5 мг растворимых белков инкубировали с человеческим IgG-сефарозой при 4 ° C.Элюированные белки или клеточные лизаты подвергали вестерн-блоттингу. Лизаты клеток матки (дорожка 5) или влагалища (дорожка 6) использовали в качестве положительного контроля. Мембраны зондировали аффинно очищенным кроличьим антителом против mFcRn и конъюгированным с HRP ослиным антителом против кроличьего IgG. Тяжелая цепь mFcRn указана стрелкой. ( C ) Иммуноокрашивание mFcRn в тканях влагалища и матки мышей. Криосрезы получали из тканей влагалища и матки самок мышей C57L / B6. Срезы окрашивали на антитело mFcRn плюс IgG, конъюгированный с Alexa Fluor 488 (зеленый).Кроличий IgG использовали в качестве отрицательного контроля. Влагалище ( верхний ) и матка ( нижний ) нормальной взрослой мыши показали точечное окрашивание, видимое на апикальной цитоплазматической мембране и в апикальной цитоплазме. Ядро окрашивают DAPI (синий). Изображения были получены с помощью объектива с водяным объективом 40x.
Приблизительно 0,5 мг растворимых белков инкубировали с человеческим IgG-сефарозой при 4 ° C.Элюированные белки или клеточные лизаты подвергали вестерн-блоттингу. Лизаты клеток матки (дорожка 5) или влагалища (дорожка 6) использовали в качестве положительного контроля. Мембраны зондировали аффинно очищенным кроличьим антителом против mFcRn и конъюгированным с HRP ослиным антителом против кроличьего IgG. Тяжелая цепь mFcRn указана стрелкой. ( C ) Иммуноокрашивание mFcRn в тканях влагалища и матки мышей. Криосрезы получали из тканей влагалища и матки самок мышей C57L / B6. Срезы окрашивали на антитело mFcRn плюс IgG, конъюгированный с Alexa Fluor 488 (зеленый).Кроличий IgG использовали в качестве отрицательного контроля. Влагалище ( верхний ) и матка ( нижний ) нормальной взрослой мыши показали точечное окрашивание, видимое на апикальной цитоплазматической мембране и в апикальной цитоплазме. Ядро окрашивают DAPI (синий). Изображения были получены с помощью объектива с водяным объективом 40x. Стрелки указывают просвет. (Масштаб: 50 мкм.)
Стрелки указывают просвет. (Масштаб: 50 мкм.)
Поскольку FcRn высоко экспрессируется в генитальных эпителиальных клетках мышей, мы затем спросили, может ли мышиный FcRn опосредовать транспорт IgG через генитальный барьер слизистой оболочки in vivo.Во-первых, мы выяснили, влияет ли FcRn на количество эндогенного IgG в просвете женских половых путей. Как показано на рис. S5 A и B , в смывах из влагалища мышей FcRn-WT присутствовали значительно более высокие уровни IgG, чем в смывах от мышей FcRn-KO, даже с большими вариациями, вызванными эстральным циклом и, кроме того, анализом IgG. Соотношение титров -to-IgA выявило преобладание IgG (рис. S5 B ). Во-вторых, мы проверили, требуется ли системно вводимый IgG FcRn для доступа к просвету половых путей.Препубертатных мышей использовали для минимизации изменчивости, вызванной эстральным циклом. Меченый биотином мышиный IgG вводили внутрибрюшинно. у мышей WT (100 мкг) или FcRn-KO (200 мкг) (у мышей FcRn-KO использовали вдвое больше IgG, чтобы компенсировать снижение циркулирующего IgG, которое происходит в отсутствие FcRn) (28). Через двенадцать часов после введения отбирали образцы смывов из влагалища и подвергали анализу на авидин-блоттинг. На фиг. 4 показано, что сывороточные концентрации IgG были аналогичными у мышей WT и FcRn-KO (дорожки 3 и 4).Однако IgG обнаруживался только в смывах из влагалища мышей WT (дорожка 5), но не в смывах из влагалища мышей FcRn-KO (дорожка 6). Эти результаты указывают на то, что FcRn опосредует передачу IgG от базолатерального к апикальному пути в женских половых путях. Наконец, чтобы выяснить, является ли FcRn-зависимый транспорт в этом сайте двунаправленным, мы провели параллельный эксперимент, в котором IgG вводили интравагинально (в / в) мышам WT и FcRn-KO. IgG легко обнаруживался в сыворотке мышей WT, но не мышей FcRn-KO (рис.4, дорожка 7). Взятые вместе, эти данные убедительно подтверждают идею, что FcRn обеспечивает как апикально-базолатеральный, так и базолатеральный-апикальный транспорт IgG в женских половых путях.
Через двенадцать часов после введения отбирали образцы смывов из влагалища и подвергали анализу на авидин-блоттинг. На фиг. 4 показано, что сывороточные концентрации IgG были аналогичными у мышей WT и FcRn-KO (дорожки 3 и 4).Однако IgG обнаруживался только в смывах из влагалища мышей WT (дорожка 5), но не в смывах из влагалища мышей FcRn-KO (дорожка 6). Эти результаты указывают на то, что FcRn опосредует передачу IgG от базолатерального к апикальному пути в женских половых путях. Наконец, чтобы выяснить, является ли FcRn-зависимый транспорт в этом сайте двунаправленным, мы провели параллельный эксперимент, в котором IgG вводили интравагинально (в / в) мышам WT и FcRn-KO. IgG легко обнаруживался в сыворотке мышей WT, но не мышей FcRn-KO (рис.4, дорожка 7). Взятые вместе, эти данные убедительно подтверждают идею, что FcRn обеспечивает как апикально-базолатеральный, так и базолатеральный-апикальный транспорт IgG в женских половых путях.
IgG в половых путях мыши. FcRn-опосредованный транспорт IgG in vivo. Вводили меченный биотином мышиный IgG i. п. (дорожки 3–6) или i.vag. (дорожки 7 и 8) мышам WT (дорожки 3, 5 и 7) или FcRn-KO (дорожки 4, 6 и 8). Дорожка 2 представляет собой отрицательный контроль. Образцы сыворотки и смыв из влагалища отбирали, как указано, и подвергали анализу авидин-блоттинг.Результаты являются репрезентативными для трех отдельных экспериментов. HC, тяжелая цепь; LC, легкая цепь.
FcRn-опосредованный транспорт IgG in vivo. Вводили меченный биотином мышиный IgG i. п. (дорожки 3–6) или i.vag. (дорожки 7 и 8) мышам WT (дорожки 3, 5 и 7) или FcRn-KO (дорожки 4, 6 и 8). Дорожка 2 представляет собой отрицательный контроль. Образцы сыворотки и смыв из влагалища отбирали, как указано, и подвергали анализу авидин-блоттинг.Результаты являются репрезентативными для трех отдельных экспериментов. HC, тяжелая цепь; LC, легкая цепь.
Профилактическая эффективность антител IgG против генитальных инфекций.
Поскольку мы обнаружили, что FcRn опосредует транспорт IgG в просвет половых путей, мы затем спросили, может ли этот механизм защитить от генитальной инфекции. ВПГ-2 был выбран в качестве нашего модельного патогена, поскольку вагинальная инфекция мышей препубертатного возраста вирусом ВПГ-2 дикого типа вызывает тяжелые неврологические расстройства и летальность в течение 8–14 дней (29).Во-первых, систему Transwell использовали для исследования способности антител, специфичных к HSV-2, инактивировать живые вирусные частицы HSV-2 после трансцитоза через монослой поляризованных клеток HEC-1-A. В базолатеральную камеру добавляли специфические кроличьи антитела к HSV-2 или нормальную кроличью сыворотку, а затем в противоположную апикальную камеру добавляли вирус HSV-2, чтобы допустить апикальную инфекцию. Выход вируса измеряли в апикальной среде через 24 часа с помощью стандартного анализа бляшек. Поликлональные антитела, специфичные к HSV-2, снижали выход вируса HSV-2 в 10 раз по сравнению с клетками, обработанными нормальной кроличьей сывороткой (рис.5 А ). Затем мы определили, обеспечивает ли трансцитозированный патоген-специфический IgG защиту хозяина от инфекции в половых путях in vivo. Препубертатным мышам WT или FcRn-KO инокулировали i.vag. смертельной дозой штамма 186 HSV-2 (1,4 × 10 6 БОЕ) через 12 ч после внутрибрюшинного введения. введение антител, специфичных к HSV-2, или нормальной контрольной сыворотки. Выживаемость (рис. 5 B ) для животных WT, которые получали сыворотку, специфичную для HSV-2, составила 80%, тогда как выжили только 20% животных в группе FcRn-KO ( P = 0.
В базолатеральную камеру добавляли специфические кроличьи антитела к HSV-2 или нормальную кроличью сыворотку, а затем в противоположную апикальную камеру добавляли вирус HSV-2, чтобы допустить апикальную инфекцию. Выход вируса измеряли в апикальной среде через 24 часа с помощью стандартного анализа бляшек. Поликлональные антитела, специфичные к HSV-2, снижали выход вируса HSV-2 в 10 раз по сравнению с клетками, обработанными нормальной кроличьей сывороткой (рис.5 А ). Затем мы определили, обеспечивает ли трансцитозированный патоген-специфический IgG защиту хозяина от инфекции в половых путях in vivo. Препубертатным мышам WT или FcRn-KO инокулировали i.vag. смертельной дозой штамма 186 HSV-2 (1,4 × 10 6 БОЕ) через 12 ч после внутрибрюшинного введения. введение антител, специфичных к HSV-2, или нормальной контрольной сыворотки. Выживаемость (рис. 5 B ) для животных WT, которые получали сыворотку, специфичную для HSV-2, составила 80%, тогда как выжили только 20% животных в группе FcRn-KO ( P = 0.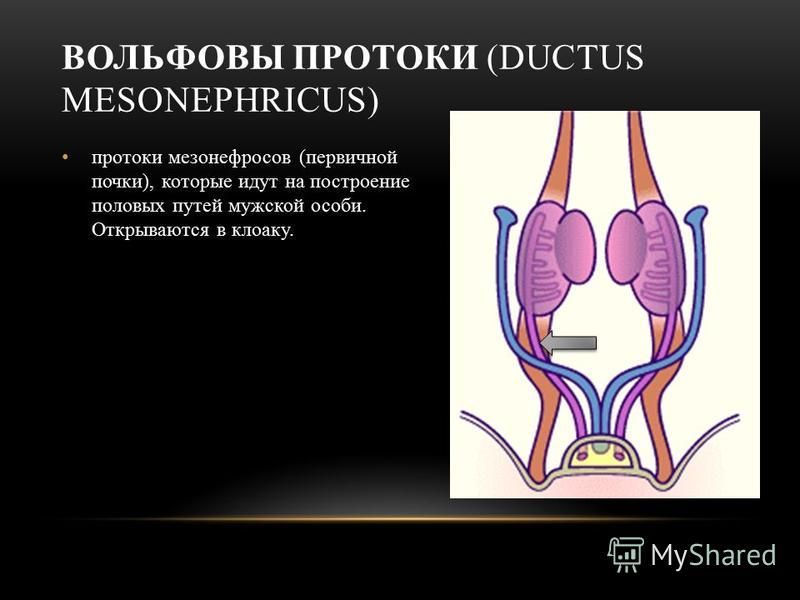 0437). Все животные, которым вводили нормальную сыворотку, умерли от инфекции в течение 6-7 дней после заражения ( P = 0,0079 для мышей WT, получавших вирусспецифическую сыворотку по сравнению с контрольной сывороткой). Важно отметить, что не было разницы в выживаемости между мышами FcRn-KO, которые получали нормальную сыворотку по сравнению с вирус-специфической сывороткой ( P = 0,3255). Следовательно, системное введение антител, специфичных к HSV-2, обеспечивает защиту от генитальной инфекции FcRn-зависимым образом.
0437). Все животные, которым вводили нормальную сыворотку, умерли от инфекции в течение 6-7 дней после заражения ( P = 0,0079 для мышей WT, получавших вирусспецифическую сыворотку по сравнению с контрольной сывороткой). Важно отметить, что не было разницы в выживаемости между мышами FcRn-KO, которые получали нормальную сыворотку по сравнению с вирус-специфической сывороткой ( P = 0,3255). Следовательно, системное введение антител, специфичных к HSV-2, обеспечивает защиту от генитальной инфекции FcRn-зависимым образом.
Трансцитоз HSV-2-специфических антител в просвет влагалища и защита от заражения вирусом HSV-2.( A ) Трансцитоз кроличьих антител против HSV-2 через поляризованные монослои HEC-1-A и нейтрализация вируса HSV-2. Титры вирусов измеряли стандартным анализом бляшек на монослоях клеток Vero. Титр вируса в апикальных отделах сравнивали в группах, получавших нормальную кроличью сыворотку или кроличью сыворотку против HSV-2. Звездочки указывают на значительную разницу по сравнению с нормальным контролем кроличьей сыворотки ( P < 0,05). ( B ) Выживаемость мышей после FcRn-опосредованного переноса кроличьих антител против HSV-2.Показаны средние показатели выживаемости после переноса адоптивной сыворотки и заражения генитальным вирусом простого герпеса 2 типа. Выживаемость рассчитывалась как процент выживших мышей препубертатного возраста, деленный на общее количество мышей в группе. Результаты являются репрезентативными для трех отдельных экспериментов. n = 15 мышей на группу.
( B ) Выживаемость мышей после FcRn-опосредованного переноса кроличьих антител против HSV-2.Показаны средние показатели выживаемости после переноса адоптивной сыворотки и заражения генитальным вирусом простого герпеса 2 типа. Выживаемость рассчитывалась как процент выживших мышей препубертатного возраста, деленный на общее количество мышей в группе. Результаты являются репрезентативными для трех отдельных экспериментов. n = 15 мышей на группу.
Обсуждение
Настоящее исследование ясно демонстрирует, что трансцитоз IgG в эпителиальных клетках женских половых органов является двунаправленным и зависит от FcRn. Как и было предсказано на основании определенных функций hFcRn в трофобластах плаценты и эпителиальных клетках кишечника (22, 23), наши результаты подтвердили, что FcRn транспортирует IgG через монослои эпителиальных клеток HEC-1-A.Кроме того, мы установили, что FcRn обильно экспрессируется в эпителии матки и влагалища человека и что первичные женские генитальные эпителиальные ткани человека способны участвовать в устойчивом двунаправленном трансцитозе IgG посредством FcRn. Хотя остается неизвестным, опосредует ли FcRn транспорт IgG в женских половых путях взрослого человека, эта возможность, вероятно, основана на наших результатах, показывающих, что мышиные эпителиальные клетки, выстилающие как влагалище, так и матку, экспрессируют высокие уровни FcRn и опосредуют эффективный транспорт IgG.В целом, эти данные демонстрируют FcRn-зависимый механизм двунаправленного транспорта IgG через генитальный эпителий, который может обеспечивать иммунитет против местной инфекции.
Хотя остается неизвестным, опосредует ли FcRn транспорт IgG в женских половых путях взрослого человека, эта возможность, вероятно, основана на наших результатах, показывающих, что мышиные эпителиальные клетки, выстилающие как влагалище, так и матку, экспрессируют высокие уровни FcRn и опосредуют эффективный транспорт IgG.В целом, эти данные демонстрируют FcRn-зависимый механизм двунаправленного транспорта IgG через генитальный эпителий, который может обеспечивать иммунитет против местной инфекции.
Слизистая оболочка женских половых органов представляет собой динамическую ткань, гормональные колебания которой существенно влияют на структуру, функцию и экспрессию белков эпителия половых путей (30). Действительно, наши результаты показали, что на локальные уровни IgG существенно влияет стадия эстрального цикла. Как гормональные изменения в эстральном цикле влияют на транспорт IgG через слизистую оболочку половых органов, в настоящее время неизвестно; у нас есть предварительные данные, свидетельствующие о том, что гормоны модулируют транспорт IgG, регулируя экспрессию FcRn в эпителии женских половых органов. Для формального рассмотрения этой возможности потребуются будущие исследования.
Для формального рассмотрения этой возможности потребуются будущие исследования.
Слизистая оболочка женских половых органов различается, потому что верхние отделы, включая шейку матки, матку и маточные трубы, состоят в основном из поляризованного простого столбчатого эпителия (9, 31), внеклеточная среда которого при нормальных физиологических условиях имеет нейтральный pH. Мы представили доказательства того, что в стабильном состоянии в клетках HEC-1-A FcRn локализуется во внутриклеточных везикулах (рис. S6), распределение аналогично тому, которое наблюдается в энтероцитах тонкой кишки человека и эндотелии сосудов.Поскольку связывание IgG с FcRn зависит от pH, IgG может получить доступ к трансцитотическому пути в таких клетках только посредством эндоцитоза в жидкой фазе с последующим связыванием с FcRn в кислых внутриклеточных компартментах, а не на поверхности клетки, потому что оба связывания лиганд-рецептор в кислых везикулах и Бафиломицин A1-чувствительный мембранный трафик оказался необходимым для трансцитоза IgG. Напротив, нижний тракт (влагалище) имеет частично ороговевший псевдостратифицированный эпителий, который предположительно необходим для создания более прочного физического барьера (9, 31).Хотя то, как FcRn транспортирует IgG через простой столбчатый эпителий, кажется очевидным, менее ясно, способен ли FcRn транспортировать IgG через псевдостратифицированный эпителий, даже несмотря на то, что FcRn в значительной степени экспрессируется в этой ткани. Возможно, что FcRn прогрессивно транспортирует IgG через этот стратифицированный слой или что FcRn в вагинальном эпителии не участвует в активном транспорте IgG. У женщин, перенесших гистерэктомию, наблюдается снижение уровня Ig, включая IgG, в вагинальных секретах примерно на 95% (32), что позволяет предположить, что матка является основным источником иммуноглобулинов в секретах женских половых путей.
Напротив, нижний тракт (влагалище) имеет частично ороговевший псевдостратифицированный эпителий, который предположительно необходим для создания более прочного физического барьера (9, 31).Хотя то, как FcRn транспортирует IgG через простой столбчатый эпителий, кажется очевидным, менее ясно, способен ли FcRn транспортировать IgG через псевдостратифицированный эпителий, даже несмотря на то, что FcRn в значительной степени экспрессируется в этой ткани. Возможно, что FcRn прогрессивно транспортирует IgG через этот стратифицированный слой или что FcRn в вагинальном эпителии не участвует в активном транспорте IgG. У женщин, перенесших гистерэктомию, наблюдается снижение уровня Ig, включая IgG, в вагинальных секретах примерно на 95% (32), что позволяет предположить, что матка является основным источником иммуноглобулинов в секретах женских половых путей.
Просвет влагалища кислый (pH 4,0 для человека и pH 6,2–6,5 для мышей) (33) из-за кислых продуктов, возникающих в результате анаэробного метаболизма вагинального гликогена (34). При таком низком влагалищном pH FcRn клеточной поверхности может эффективно захватывать IgG посредством рецептор-опосредованного эндоцитоза, защищая IgG от деградации и высвобождая его в локальных участках, где физиологический pH близок к нейтральному. Более того, иммунизация ослабленным вирусом HSV-2 вызвала 86-кратное увеличение количества плазматических клеток IgG в слизистой оболочке влагалища (16).Следовательно, кислая влагалищная среда может обеспечивать физиологическую среду, в которой FcRn изолирует IgG, поставляемый не только из кровотока, но также из местных плазматических клеток. Заражение болезнетворными микроорганизмами, передающимися половым путем, может быть быстрым и массовым. IgG, хранящийся в локальном резерве в женских половых путях с помощью FcRn, может вооружить этот сайт для борьбы с такими инфекциями.
При таком низком влагалищном pH FcRn клеточной поверхности может эффективно захватывать IgG посредством рецептор-опосредованного эндоцитоза, защищая IgG от деградации и высвобождая его в локальных участках, где физиологический pH близок к нейтральному. Более того, иммунизация ослабленным вирусом HSV-2 вызвала 86-кратное увеличение количества плазматических клеток IgG в слизистой оболочке влагалища (16).Следовательно, кислая влагалищная среда может обеспечивать физиологическую среду, в которой FcRn изолирует IgG, поставляемый не только из кровотока, но также из местных плазматических клеток. Заражение болезнетворными микроорганизмами, передающимися половым путем, может быть быстрым и массовым. IgG, хранящийся в локальном резерве в женских половых путях с помощью FcRn, может вооружить этот сайт для борьбы с такими инфекциями.
Двунаправленный транспорт IgG, который мы документируем для слизистой оболочки половых органов, предлагает потенциальный путь обнаружения и реагирования на генитальные инфекции. Транспортировка антигенов через эпителиальные барьеры является первым шагом, необходимым для создания эффективных иммунных ответов слизистой оболочки и системного иммунного ответа после инфекции слизистой оболочки (16). Известно, что высокоспециализированные микроскладчатые (М) клетки в фолликул-ассоциированном эпителии как в кишечнике, так и в носовом тракте переносят антигены (31). Однако в половых путях как мужчин, так и женщин отсутствуют фолликул-ассоциированный эпителий и типичные М-клетки (9), и поэтому они должны полагаться на альтернативные механизмы иммунитета слизистой оболочки. Двунаправленный транспорт IgG через генитальный эндотелий с помощью FcRn может способствовать как местным, так и системным ответным реакциям, доставляя антигенспецифические IgG через генитальный эпителиальный барьер в просвет гениталий (апикальная сторона) и затем восстанавливая захваченные родственные антигены как часть иммунных комплексов. в собственной пластинке (базолатеральная сторона) для захвата антигенпрезентирующими клетками.
Транспортировка антигенов через эпителиальные барьеры является первым шагом, необходимым для создания эффективных иммунных ответов слизистой оболочки и системного иммунного ответа после инфекции слизистой оболочки (16). Известно, что высокоспециализированные микроскладчатые (М) клетки в фолликул-ассоциированном эпителии как в кишечнике, так и в носовом тракте переносят антигены (31). Однако в половых путях как мужчин, так и женщин отсутствуют фолликул-ассоциированный эпителий и типичные М-клетки (9), и поэтому они должны полагаться на альтернативные механизмы иммунитета слизистой оболочки. Двунаправленный транспорт IgG через генитальный эндотелий с помощью FcRn может способствовать как местным, так и системным ответным реакциям, доставляя антигенспецифические IgG через генитальный эпителиальный барьер в просвет гениталий (апикальная сторона) и затем восстанавливая захваченные родственные антигены как часть иммунных комплексов. в собственной пластинке (базолатеральная сторона) для захвата антигенпрезентирующими клетками. Было показано, что аналогичный двунаправленный механизм контролирует иммунитет IgG к просветным бактериям в кишечнике (35).
Было показано, что аналогичный двунаправленный механизм контролирует иммунитет IgG к просветным бактериям в кишечнике (35).
Наконец, наши результаты, показывающие, что FcRn транспортирует нейтрализующие поликлональные антитела к HSV-2 через эпителиальные клетки и значительно защищает мышей после интравагинального заражения летальным HSV-2, ясно демонстрируют, что FcRn является эффективным каналом для доставки нейтрализующего IgG из большого круга кровообращения в бороться с генитальной инфекцией. Наблюдение за тем, что макакам-резусам, пассивно вводящим смесь нейтрализующих IgG, защищается от вагинальной передачи ВИЧ-1 (36, 37), можно объяснить аналогичным FcRn-зависимым механизмом.Возможно, что путем перехвата микробов до контакта и прикрепления к слизистой оболочке и / или путем блокирования входа в целевой эпителий, IgG может оказаться более важным, чем IgA для защиты хозяина в женских половых путях. IgG также может элиминировать локально инфицированные клетки посредством антителозависимых клеточно-опосредованных цитотоксических реакций. Следовательно, системная и местная индукция высоких уровней антител IgG, которые транспортируются к поверхности слизистой оболочки с помощью FcRn, обеспечивает важный компонент иммунного надзора и защиты хозяина на слизистой оболочке половых органов.
Следовательно, системная и местная индукция высоких уровней антител IgG, которые транспортируются к поверхности слизистой оболочки с помощью FcRn, обеспечивает важный компонент иммунного надзора и защиты хозяина на слизистой оболочке половых органов.
В заключение, это исследование документирует действие FcRn-опосредованной системы трансцитоза IgG в эпителии женских половых органов, которая напоминает системы, обнаруженные в других эпителиях слизистой оболочки (38). Эта локальная система, по-видимому, является основным источником IgG в генитальной слизи и обеспечивает эффективный защитный механизм против генитальной инфекции. Наши результаты показывают, что вакцины, которые вызывают высокие уровни широко нейтрализующих антител IgG, могут обеспечивать эффективную защиту от инфекции слизистой оболочки и передачи инфекции.Дальнейшие усилия по пониманию того, как человеческие антитела IgG опосредуют эту защиту, могут дать представление об иммунитете слизистых оболочек и облегчить разработку безопасных и эффективных вакцин для слизистых оболочек против ЗППП. Кроме того, открытие FcRn-опосредованного транспорта IgG в половых путях может обеспечить основу для подхода пассивной иммунопрофилактики для предотвращения передачи ВИЧ и других патогенов, передаваемых половым путем, через слизистые оболочки.
Кроме того, открытие FcRn-опосредованного транспорта IgG в половых путях может обеспечить основу для подхода пассивной иммунопрофилактики для предотвращения передачи ВИЧ и других патогенов, передаваемых половым путем, через слизистые оболочки.
Методы
Клеточные линии, вирусы и животные.
Клеточные линии Vk2, Ect1 и End1 были описаны ранее (39).Срезы вагинальных и эпителиальных тканей человека были приобретены у Abcam или Integrated Laboratory Services-Biotech. Модель ткани EpiVaginal человека VEC-100-FT была приобретена у MatTek. Штамм 186 HSV-2 был предоставлен Лоуренсом Стэнберри (Колумбийский университет, Нью-Йорк). Мышей FcRn-KO (28) были приобретены в лаборатории Джексона. Поликлональная сыворотка, специфичная для HSV-2, с титром нейтрализации 1:32 была приобретена у Dako. Все исследования на животных были рассмотрены и одобрены институциональным комитетом по уходу и использованию животных.
Выделение РНК и полуколичественная ОТ-ПЦР.
Тотальную РНК выделяли из клеток с использованием TRIzol (Invitrogen). Праймеры для амплификации FcRn и GAPDH описаны в другом месте (40).
Праймеры для амплификации FcRn и GAPDH описаны в другом месте (40).
Сбор вагинальной жидкости и определение эстрального цикла мышей.
Промывки влагалища собирали, как описано ранее (15). Для определения стадии эстрального цикла использовались вагинальные мазки, как описано ранее (41). Было проведено окрашивание по Маю – Грюнвальду – Гимзе вагинальных мазков четырех различных стадий эстрального цикла (диэструса, проэструса, эструса и метэструса 1 и 2).
Выделение эпителиальных клеток влагалища и матки.
При вскрытии ткани влагалища и матки собирали и промывали PBS для удаления возможного загрязнения крови. Эпителиальные клетки влагалища или матки выделяли методом, описанным Wira et al. (30), с некоторыми изменениями. Вкратце, ткань влагалища или матки осторожно измельчали на мелкие кусочки и переваривали в течение 20 минут при 37 ° C с перемешиванием в HBSS с добавлением 200 Ед / мл гиалуронидазы, 1 мг / мл коллагеназы типа IV, 0.2 мг / мл ДНКазы I и 1 мг / мл БСА. Переваренную смесь собирали и пропускали через сито 100 мкм и промывали RPMI, содержащим 10% FBS. Эпителиальные клетки разделяли на прерывистых градиентах Перколла (Pharmacia) с центрифугированием при 453 × g в течение 20 мин. Для получения дополнительных сведений см. SI Methods .
Переваренную смесь собирали и пропускали через сито 100 мкм и промывали RPMI, содержащим 10% FBS. Эпителиальные клетки разделяли на прерывистых градиентах Перколла (Pharmacia) с центрифугированием при 453 × g в течение 20 мин. Для получения дополнительных сведений см. SI Methods .
Анализ связывания IgG и трансцитоз IgG.
Анализ связывания IgG выполняли, как описано (27). Очищенный человеческий IgG или куриный IgY биотинилировали сульфо-NHS-биотином (Pierce).Транспорт IgG осуществляли, как описано с модификациями (20). Эту же процедуру использовали для выполнения трансцитоза IgG в первичной ткани женских половых органов человека VEC-100-FT. Для транспорта IgG in vivo внутрибрюшинно вводили 200 мкг биотинилированного мышиного IgG в 100 мкл PBS. мышам WT или FcRn-KO. Кроме того, внутривенно вводили биотинилированный IgG в 30 мкл PBS. мышам WT (50 мкг на мышь) и мышам FcRn-KO (100 мкг на мышь). Промывание влагалища или сыворотка собирались через 12 ч после лечения. IgG анализировали с помощью SDS / PAGE и авидин-блота-ECL.
IgG анализировали с помощью SDS / PAGE и авидин-блота-ECL.
Иммунофлуоресценция, конфокальная микроскопия и вестерн-блоттинг.
Иммунофлуоресцентное окрашивание клеток или замороженных тканевых срезов проводили, как описано (25). Для вестерн-блоттинга лизаты клеток (50 мкг) разделяли электрофорезом на 12% SDS / PAGE гелях и переносили на нитроцеллюлозные мембраны. Мембраны блокировали 5% обезжиренным молоком и зондировали аффинно очищенными кроличьими антителами против FcRn человека или мыши, мышиными антителами против β-тубулина или кроличьими антителами против β 2 m Ab. Полосы белка визуализировали с помощью ECL.
Пассивный перенос антител и заражение вирусом.
Для нейтрализации in vitro кроличью сыворотку против HSV-2 или нормальную кроличью сыворотку добавляли в базолатеральную камеру поляризованных клеток HEC-1-A и инкубировали в течение 12 часов. Штамм 186 HSV-2 инокулировали в апикальную камеру при множественности инфицирования (MOI) 0,1. Среду в апикальной камере собирали через 24 часа, и титры вирусов определяли с помощью анализа бляшек. Для тестирования функции FcRn in vivo самкам мышей в возрасте 4 недель давали один препарат i.п. инъекция кроличьего анти-HSV-2 IgG (100 мкг) в 100 мкл PBS за 12 ч до заражения. Под наркозом мышей инфицировали внутривенно. с 1,4 × 10 6 БОЕ HSV-2. Мыши FcRn-KO получали внутрибрюшинные инъекции 20-40 мкг IgG каждые 24 часа в течение 7 дней подряд после заражения, чтобы компенсировать деградацию IgG. За мышами наблюдали в течение 12 дней на предмет патологии и смерти.
Среду в апикальной камере собирали через 24 часа, и титры вирусов определяли с помощью анализа бляшек. Для тестирования функции FcRn in vivo самкам мышей в возрасте 4 недель давали один препарат i.п. инъекция кроличьего анти-HSV-2 IgG (100 мкг) в 100 мкл PBS за 12 ч до заражения. Под наркозом мышей инфицировали внутривенно. с 1,4 × 10 6 БОЕ HSV-2. Мыши FcRn-KO получали внутрибрюшинные инъекции 20-40 мкг IgG каждые 24 часа в течение 7 дней подряд после заражения, чтобы компенсировать деградацию IgG. За мышами наблюдали в течение 12 дней на предмет патологии и смерти.
Статистический анализ.
Данные выражены как среднее ± SEM. Статистическую значимость определяли с помощью теста Стьюдента t (двусторонний).Для данных о выживаемости животных статистическую значимость определяли с помощью лог-рангового теста (анализ выживаемости Каплана-Мейера). P <0,05 считали значимым.
Благодарности
Мы благодарны доктору Райне Фичоровой, доктору Лоуренсу Стэнберри и доктору Ричарду Блумбергу за предоставленные клеточные линии и реагенты, доктору Нилу Симистеру за полезные обсуждения катаболизма мышиного IgG и доктору Лилин Йе. , Ю Бай, доктору Синдун Лю и доктору Ли Лу за техническую помощь. Эта работа была частично поддержана грантами Национальных институтов здравоохранения AI67965, AI65892 и AI73139 (к X.Z.) и DK56597 (в округ Колумбия) и конкурсными грантами Мэрилендской сельскохозяйственной экспериментальной станции от Университета Мэриленда (X.Z.).
, Ю Бай, доктору Синдун Лю и доктору Ли Лу за техническую помощь. Эта работа была частично поддержана грантами Национальных институтов здравоохранения AI67965, AI65892 и AI73139 (к X.Z.) и DK56597 (в округ Колумбия) и конкурсными грантами Мэрилендской сельскохозяйственной экспериментальной станции от Университета Мэриленда (X.Z.).
Сноски
Вклад авторов: Z.L., W.T. и X.Z. спланированное исследование; З.Л., С.П., Р.З. и X.Z. проведенное исследование; D.C.R. внесены новые реагенты / аналитические инструменты; Z.L., W.T., D.C.R. и X.Z. проанализированные данные; и Z.L., W.T., D.C.R. и X.Z. написал газету.
Авторы заявляют об отсутствии конфликта интересов.
Эта статья представляет собой прямое представление PNAS.
Эта статья содержит вспомогательную информацию на сайте www.pnas.org/lookup/suppl/doi:10.1073/pnas.1012861108/-/DCSupplemental.
Врожденные аномалии женских половых путей — O&G Magazine
Врожденные аномалии женских половых путей — это редкие, но важные диагнозы, которые могут быть поставлены в детском или подростковом возрасте. Патологии наружных половых органов, такие как общий урогенитальный синус, клоака или неоднозначные гениталии, как правило, диагностируются при рождении или вскоре после этого.Им будет управлять многопрофильная команда детских хирургов, врачей и детских гинекологов. К диагностике и лечению мюллеровской аномалии с большей вероятностью привлечет терапевт или гинеколог; в подростковом возрасте с нарушениями менструального цикла или болями или в детородном возрасте с проблемами фертильности.
Патологии наружных половых органов, такие как общий урогенитальный синус, клоака или неоднозначные гениталии, как правило, диагностируются при рождении или вскоре после этого.Им будет управлять многопрофильная команда детских хирургов, врачей и детских гинекологов. К диагностике и лечению мюллеровской аномалии с большей вероятностью привлечет терапевт или гинеколог; в подростковом возрасте с нарушениями менструального цикла или болями или в детородном возрасте с проблемами фертильности.
Мюллеровы аномалии встречаются примерно у 7% девочек и являются результатом аномального сращения или канализации мюллеровых протоков.Предполагаются как факторы окружающей среды, так и генетические факторы, но они не были доказаны. Современная литература не поддерживает риск передачи отдельных мюллеровских аномалий потомству.
Развитие репродуктивного тракта
Присутствие или отсутствие гена, определяющего пол (SRY) на Y-хромосоме, приводит к дифференцировке индифферентных гонад и формированию наружных гениталий по женскому или мужскому фенотипу.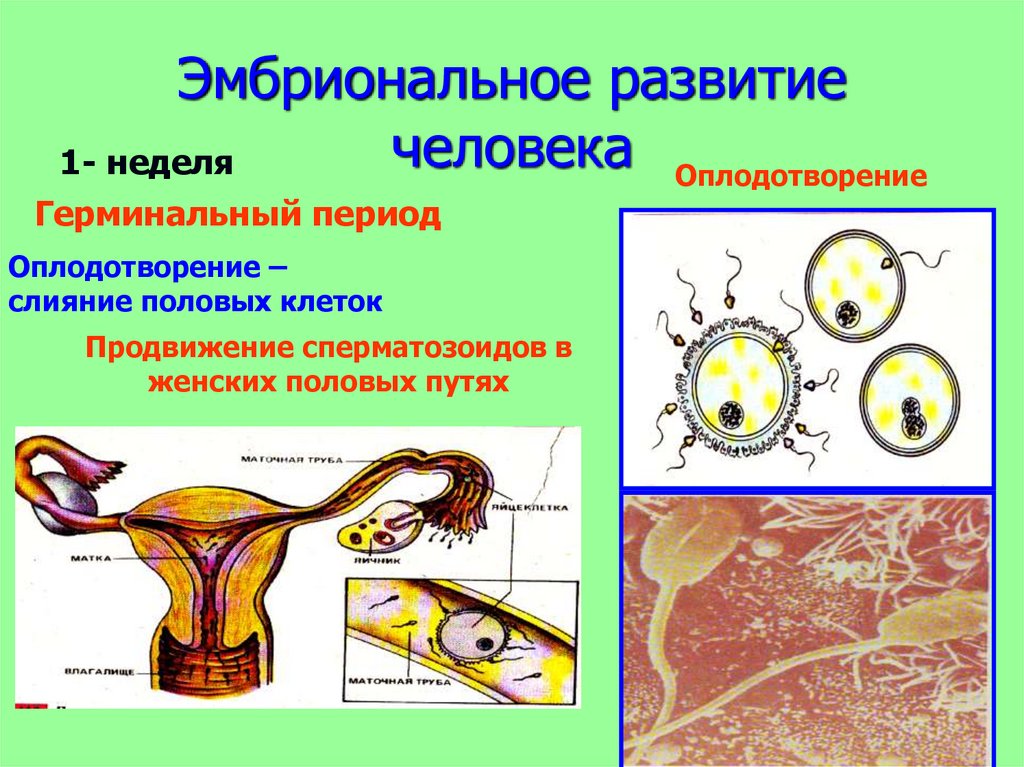 Когда ген SRY отсутствует, индифферентные гонады образуют яичник, и антимюллеров гормон (АМГ), продуцируемый семенниками плода, не выделяется.Отсутствие АМГ приводит к развитию мюллерова протоков и регрессии волльфиевых (мезонефрических) протоков. Мюллеровы протоки срастаются примерно с шести недель беременности. После завершения сращения происходит канализация с образованием полости матки. Развивающееся влагалище сливается с мочеполовой пазухой на влагалищной пластинке (синовагинальная луковица), а затем к третьему триместру формируется канал, образуя функциональный вагинальный канал. В результате этого процесса верхние две трети влагалища выходят из Мюллерова протоков, а нижняя треть — из мочеполовой пазухи (рис. 1).
Когда ген SRY отсутствует, индифферентные гонады образуют яичник, и антимюллеров гормон (АМГ), продуцируемый семенниками плода, не выделяется.Отсутствие АМГ приводит к развитию мюллерова протоков и регрессии волльфиевых (мезонефрических) протоков. Мюллеровы протоки срастаются примерно с шести недель беременности. После завершения сращения происходит канализация с образованием полости матки. Развивающееся влагалище сливается с мочеполовой пазухой на влагалищной пластинке (синовагинальная луковица), а затем к третьему триместру формируется канал, образуя функциональный вагинальный канал. В результате этого процесса верхние две трети влагалища выходят из Мюллерова протоков, а нижняя треть — из мочеполовой пазухи (рис. 1).
Рисунок 1. Развитие женских половых путей.
Аномалии развития могут возникнуть на любом этапе процесса сращения и канализации. Из-за большого разнообразия потенциальных аномалий было разработано несколько систем классификации, наиболее часто используемая система была разработана Американским обществом репродуктивной медицины (ASRM) (рис. 2). Для клинических целей аномалии Мюллера также можно разделить на обструктивные и необструктивные аномалии.
2). Для клинических целей аномалии Мюллера также можно разделить на обструктивные и необструктивные аномалии.
Мюллеровы аномалии характеризуются высокой частотой сопутствующих почечных (40%) и спинальных (10–20%) аномалий. Почечные аномалии могут включать одностороннюю агенезию, подковообразную почку или почку таза. Важно, чтобы оценка этих связанных аномалий проводилась по показаниям.
Рис. 2. Система классификации мюллеровых аномалий по ASRM.
Обструктивные аномалии
Обструктивные аномалии проявляются двояко: у подростков с первичной аменореей и циклической болью или как прогрессивно ухудшающаяся дисменорея при нормальной менструации.
Обструкция с первичной аменореей и циклической болью
Эти аномалии обычно диагностируются в раннем периоде полового созревания после исследования циклической боли при отсутствии менархе. Из-за нерегулярных циклов в подростковом возрасте боль может не возникать ежемесячно, поэтому диагноз может быть отложен. Обструкция оттока приводит к скоплению менструальной крови во влагалище (haematocolpos) или матке (haematometra). При нормально функционирующих матке и яичниках эта непроходимость может возникать на любом уровне влагалища или шейки матки.
Обструкция оттока приводит к скоплению менструальной крови во влагалище (haematocolpos) или матке (haematometra). При нормально функционирующих матке и яичниках эта непроходимость может возникать на любом уровне влагалища или шейки матки.
Наиболее частая обструктивная аномалия — неперфорированная девственная плева, встречающаяся у 1/2000 молодых женщин. У девочек будет вторичная боль, вызванная гематометракольпозом. В тяжелых случаях они могут даже испытывать задержку мочи или жалобы на работу кишечника. Новообразование может пальпироваться в брюшной полости, и при осмотре вульвы часто выявляется синюшная выпуклая мембрана девственной плевы. Это может быть диагностировано клинически или подтверждено ультразвуковым исследованием органов малого таза.
Поперечная перегородка влагалища — гораздо более редкое заболевание, встречающееся в 1 / 2100–72000.Обструкция может возникать на любом уровне влагалища, чаще всего (40 процентов) в верхней трети влагалища. 2 Влагалищная перегородка может быть тонкой или толстой. Более обширные сегменты закупоренного влагалища представляют собой частичную или полную агенезию влагалища. Девочки будут выглядеть так же, как неперфорированная девственная плева. Однако при осмотре вульвы будет видно нормальное отверстие девственной плевы без выпуклой мембраны. Для оценки степени и местоположения поперечной перегородки требуется визуализация с помощью УЗИ органов малого таза / транслабиальной / прямой кишки и МРТ.
Более обширные сегменты закупоренного влагалища представляют собой частичную или полную агенезию влагалища. Девочки будут выглядеть так же, как неперфорированная девственная плева. Однако при осмотре вульвы будет видно нормальное отверстие девственной плевы без выпуклой мембраны. Для оценки степени и местоположения поперечной перегородки требуется визуализация с помощью УЗИ органов малого таза / транслабиальной / прямой кишки и МРТ.
Агенезия шейки матки или дисгенезия при нормально функционирующей матке — редкое заболевание с неизвестной частотой. Обычно это проявляется раньше из-за боли в области гематометры. До 50% имеют сопутствующую агенезию влагалища, а 33% — другие связанные с ней аномалии Мюллера. Необходима помощь и консультации специалиста, чтобы определить, сможет ли шейка матки быть функциональной в будущем, обеспечивая потенциал для поддержания фертильности.
Обструкция при нормальной менструации и обострении дисменореи
До 94 процентов подростков страдают дисменореей. Большинство из них не имеют мюллеровской аномалии, а имеют либо первичную дисменорею, либо другую причину вторичной дисменореи. Следует рассмотреть возможность частичной обструкции тракта Мюллера и исключить его у девочек с ухудшением симптомов, несмотря на консервативные методы лечения (обезболивающие или циклическую гормональную терапию). Наиболее частая аномалия — закупорка гемивагина с полным дублированием матки, шейки матки и верхней части влагалища. Осмотр может быть нормальным или выявить образование в брюшной полости. Цифровое влагалищное исследование может быть предпринято у более старших / сексуально активных девочек, выявляющих латеральное образование во влагалище.Визуализация должна включать УЗИ органов малого таза и почек, а также МРТ органов малого таза.
Большинство из них не имеют мюллеровской аномалии, а имеют либо первичную дисменорею, либо другую причину вторичной дисменореи. Следует рассмотреть возможность частичной обструкции тракта Мюллера и исключить его у девочек с ухудшением симптомов, несмотря на консервативные методы лечения (обезболивающие или циклическую гормональную терапию). Наиболее частая аномалия — закупорка гемивагина с полным дублированием матки, шейки матки и верхней части влагалища. Осмотр может быть нормальным или выявить образование в брюшной полости. Цифровое влагалищное исследование может быть предпринято у более старших / сексуально активных девочек, выявляющих латеральное образование во влагалище.Визуализация должна включать УЗИ органов малого таза и почек, а также МРТ органов малого таза.
Закупорка или не сообщающийся рог матки проявляется аналогично закупорке гемивагина, но обычно на более ранней стадии. Обследование покажет нормальные вульву и влагалище с единственной шейкой матки. Обследование должно включать УЗИ органов малого таза и почек, а также МРТ органов малого таза.
Управление непроходимой аномалией
Быстрое лечение закупорки оттока очень важно из-за риска развития эндометриоза, воспалительных заболеваний органов малого таза и гематосальпинкса.Гормональное подавление может быть начато при получении точного диагноза или в случае задержки в доступе к окончательному хирургическому лечению. Подавление менструального цикла также рекомендуется в тех случаях, когда требуется пред- или послеоперационное расширение влагалища, давая время, пока ребенок не достигнет возраста, необходимого для проведения лечения. Варианты подавления включают непрерывный прием прогестерона (перорально / депо), непрерывные комбинированные противозачаточные таблетки эстрогена и прогестерона или агонист гонадотропин-рилизинг-гормона (GnRH).Если менструация не подавляется или сохраняется боль, показано хирургическое вмешательство.
Неперфорированная девственная плева требует неотложного хирургического лечения с иссечением девственной плевы под общим наркозом. Знание точного расположения и толщины поперечной перегородки влагалища является важной частью предоперационного планирования. Тонкая перегородка может быть удалена путем непосредственного закрытия стенок влагалища, тогда как толстая перегородка или сегменты атрета могут потребовать лоскута или пересадки кожи. Существует значительный риск стеноза влагалища, и в послеоперационном периоде могут потребоваться расширители.
Знание точного расположения и толщины поперечной перегородки влагалища является важной частью предоперационного планирования. Тонкая перегородка может быть удалена путем непосредственного закрытия стенок влагалища, тогда как толстая перегородка или сегменты атрета могут потребовать лоскута или пересадки кожи. Существует значительный риск стеноза влагалища, и в послеоперационном периоде могут потребоваться расширители.
При закупорке гемивагина требуется хирургическое иссечение влагалищной перегородки и анастомоз слизистой оболочки влагалища для закрытия дефекта между двумя частями влагалища. Не сообщающийся рог матки можно удалить лапароскопическим способом с хорошими результатами.
Необструктивные аномалии
Необструктивные аномалии женских половых путей часто протекают бессимптомно и не связаны с аномалиями наружных половых органов. Диагноз может быть поставлен, если у девочки или молодой женщины имеется первичная аменорея, диспареуния, повторный выкидыш или осложнения при беременности.
Агенезия матки и влагалища
Синдром Майера-Рокитанского-Кустера-Хаузера (MRKH) — это маточно-влагалищная агенезия из-за недостаточности развития мюллеровых протоков. Это редкое заболевание, поражающее 1/4500–5000 девочек и проявляющееся в подростковом возрасте с первичной аменореей, но с нормальными вторичными половыми признаками. Тазовое обследование покажет нормальные наружные гениталии с нормальной девственной плевой и вагинальную ямку переменной длины проксимальнее девственной плевы. Необходимо организовать обследование для подтверждения диагноза и исключения других различий (Таблица 1).
Основным дифференциальным диагнозом маточно-влагалищной агенезии является синдром полной нечувствительности к андрогенам (CAIS), Х-сцепленное рецессивное состояние, влияющее на ген рецептора андрогенов, приводящее к неспособности тканей реагировать на тестостерон и дигидротестостерон с распространенностью 1 из 20 000– 64000. Девочки будут фенотипически женскими с нормальным развитием груди, но с редкими лобковыми волосами и с первичной аменореей. Из-за кариотипа 46XY яички вырабатывают нормальное количество АМГ, что приводит к регрессии мюллерова протоков.Однако, поскольку ткани не реагируют на андрогены, разовьются женские наружные гениталии, и ароматизация тестостерона в эстроген приведет к развитию груди в период полового созревания. Обследование покажет нормальную вульву с обычно короткой вагинальной ямкой проксимальнее девственной плевы.
Из-за кариотипа 46XY яички вырабатывают нормальное количество АМГ, что приводит к регрессии мюллерова протоков.Однако, поскольку ткани не реагируют на андрогены, разовьются женские наружные гениталии, и ароматизация тестостерона в эстроген приведет к развитию груди в период полового созревания. Обследование покажет нормальную вульву с обычно короткой вагинальной ямкой проксимальнее девственной плевы.
Первоначальное лечение MRKH и CAIS включает вдумчивое раскрытие диагноза подростку и ее семье и оказание соответствующей поддержки. Постоянная психологическая поддержка специалистов, обученных в этой области, может быть неоценимой.Когда молодая женщина психологически готова, можно начинать дальнейшее обсуждение и управление. Создание функционального влагалища часто может быть достигнуто путем прогрессивного расширения влагалища, которое считается вариантом первой линии с высокими показателями успеха (90–92%) и минимальными осложнениями. Расширение выполняется ежедневно, и для достижения нормального размера может потребоваться несколько месяцев, после чего требуется поддерживающее расширение или регулярный половой акт для поддержания состояния влагалища. Хирургическое создание нового влагалища предназначено для женщин, которые не смогли или не смогли добиться расширения влагалища.Существует множество различных методов создания неовагины, в том числе хирургическая дилатация (процедура Веккиетти), вагинопластика с пересадкой кожи с расщепленной толщиной или амнионом (процедура Макиндо) или тазовой брюшины (процедура Давыдова), кишечная вагинопластика (обычно с использованием сигмовидной кишки), или создание промежностного мешочка с кожными лоскутами от половых губ.1 Независимо от того, какая хирургическая процедура выполняется, женщине может потребоваться регулярное расширение или половой акт для поддержания влагалища.
Хирургическое создание нового влагалища предназначено для женщин, которые не смогли или не смогли добиться расширения влагалища.Существует множество различных методов создания неовагины, в том числе хирургическая дилатация (процедура Веккиетти), вагинопластика с пересадкой кожи с расщепленной толщиной или амнионом (процедура Макиндо) или тазовой брюшины (процедура Давыдова), кишечная вагинопластика (обычно с использованием сигмовидной кишки), или создание промежностного мешочка с кожными лоскутами от половых губ.1 Независимо от того, какая хирургическая процедура выполняется, женщине может потребоваться регулярное расширение или половой акт для поддержания влагалища.
Обсуждение будущей фертильности должно произойти, когда молодая женщина будет готова. Женщины с MRKH могут иметь биологических детей посредством сбора ооцитов и суррогатного материнства. Есть потенциал для трансплантации матки в будущем; однако в настоящее время это все еще исследуется. Женщины с CAIS не смогут иметь биологических детей, но по-прежнему могут быть родителями через суррогатное материнство с донорскими ооцитами или усыновление. Кроме того, существует риск злокачественного новообразования гонад, который в детстве невелик (~ 5%) и увеличивается в зрелом возрасте (~ 14%), поэтому следует обсудить гонадэктомию в раннем взрослом возрасте (16-25 лет).
Кроме того, существует риск злокачественного новообразования гонад, который в детстве невелик (~ 5%) и увеличивается в зрелом возрасте (~ 14%), поэтому следует обсудить гонадэктомию в раннем взрослом возрасте (16-25 лет).
Таблица 2. Осложнения беременности, связанные с аномалиями Мюллера.
Продольная перегородка влагалища
Продольная перегородка влагалища возникает в результате неудачного сращения мюллерова протоков и обычно связана с диделфисом матки из-за неудачного сращения. У женщин может появиться диспареуния, подтекание при использовании тампонов или диагноз во время обычного мазка Папаниколау. Влагалищную перегородку необходимо удалять только при наличии симптомов или при подготовке к попытке родоразрешения через естественные родовые пути.
Врожденные аномалии матки
Аномалии матки возникают либо из-за ошибки объединения (нарушение слияния мюллеровских протоков), либо из-за ошибки канализации (невозможность резорбции сросшейся части мюллерова протоков по средней линии). Изменения анатомии матки протекают бессимптомно, но могут вызвать осложнения при беременности. В таблице 2 приведены ассоциации.
Изменения анатомии матки протекают бессимптомно, но могут вызвать осложнения при беременности. В таблице 2 приведены ассоциации.
Диагностика аномалий матки может проводиться с помощью визуализации с помощью гистеросальпингограммы (HSG), гистероконтрастной сонографии (HyCoSy), МРТ или трехмерного УЗИ органов малого таза; или с помощью гистероскопии и лапароскопии для прямой визуализации органов малого таза.
Хирургическое лечение перегородки матки противоречиво, некоторые гинекологи рекомендуют немедленную резекцию перегородки, в то время как другие резектируют перегородку только в случае возникновения таких осложнений, как повторный выкидыш. Большинство женщин с перегородкой матки (75–80 процентов) имеют нормальную репродуктивную функцию.
Рудиментарные рога матки трудно диагностировать, но их следует удалить из-за высокой вероятности разрыва, если беременность происходит в роге.
Заключение
Врожденные аномалии женских половых путей — редкий, но важный диагноз среди подростков. Молодые женщины могут протекать бессимптомно или иметь первичную аменорею, признаки нарушения менструального цикла, диспареунию или проблемы с фертильностью. Перед планированием окончательного лечения критически важны тщательный сбор анамнеза, осмотр и соответствующие исследования, чтобы были доступны соответствующие процедуры и знания. Необходимо срочно лечить затрудненную менструацию с помощью медицинских или хирургических средств, чтобы предотвратить будущие осложнения, такие как эндометриоз или инфекция. Диагноз MRKH или CAIS требует осторожного раскрытия и деликатного обращения с соответствующей психологической поддержкой.Многие из этих женщин могут получить функциональное влагалище за счет прогрессивного расширения влагалища, и лишь нескольким женщинам требуется хирургическое вмешательство. Мюллеровы аномалии матки связаны с неблагоприятными исходами беременности, включая выкидыш в первом триместре, преждевременные роды, неправильное предлежание, ограничение роста плода и кесарево сечение.
Молодые женщины могут протекать бессимптомно или иметь первичную аменорею, признаки нарушения менструального цикла, диспареунию или проблемы с фертильностью. Перед планированием окончательного лечения критически важны тщательный сбор анамнеза, осмотр и соответствующие исследования, чтобы были доступны соответствующие процедуры и знания. Необходимо срочно лечить затрудненную менструацию с помощью медицинских или хирургических средств, чтобы предотвратить будущие осложнения, такие как эндометриоз или инфекция. Диагноз MRKH или CAIS требует осторожного раскрытия и деликатного обращения с соответствующей психологической поддержкой.Многие из этих женщин могут получить функциональное влагалище за счет прогрессивного расширения влагалища, и лишь нескольким женщинам требуется хирургическое вмешательство. Мюллеровы аномалии матки связаны с неблагоприятными исходами беременности, включая выкидыш в первом триместре, преждевременные роды, неправильное предлежание, ограничение роста плода и кесарево сечение.



 Зону наружных половых органов – другой рукой сзади наперёд и вниз, не касаясь зоны анального отверстия и тщательно вымывая складки между половыми губами и клитором. Водная струя при мытье наружных половых органов должна быть направлена спереди назад. Не следует направлять сильную струю воды во влагалище. Если не разделять зоны подмывания на анальную и половую, то направление подмывания – только спереди назад!
Зону наружных половых органов – другой рукой сзади наперёд и вниз, не касаясь зоны анального отверстия и тщательно вымывая складки между половыми губами и клитором. Водная струя при мытье наружных половых органов должна быть направлена спереди назад. Не следует направлять сильную струю воды во влагалище. Если не разделять зоны подмывания на анальную и половую, то направление подмывания – только спереди назад! Одежда не должна стягивать область половых органов, сковывать движения. Стирайте детское бельё и одежду отдельно от взрослых вещей (до 3-х лет), используя моющие средства, рекомендованные для детского белья. Нижнее бельё тщательно проглаживайте горячим утюгом изнутри, особенно если девочка склонна к аллергии и воспалению.
Одежда не должна стягивать область половых органов, сковывать движения. Стирайте детское бельё и одежду отдельно от взрослых вещей (до 3-х лет), используя моющие средства, рекомендованные для детского белья. Нижнее бельё тщательно проглаживайте горячим утюгом изнутри, особенно если девочка склонна к аллергии и воспалению.
 Это чрезвычайно агрессивный рак с биологическим
поведение, подобное мелкоклеточному раку легкого. Нейроэндокринные опухоли
FGT, из которых SCC FGT являются подмножеством, являются редкими формами рака, на которые приходится менее
2% гинекологических онкологических заболеваний.
Это чрезвычайно агрессивный рак с биологическим
поведение, подобное мелкоклеточному раку легкого. Нейроэндокринные опухоли
FGT, из которых SCC FGT являются подмножеством, являются редкими формами рака, на которые приходится менее
2% гинекологических онкологических заболеваний.
 и широко как лимфатическим, так и гематогенным путями и включает региональные и отдаленные
лимфатические узлы, легкие, кости, мозг и печень.Безрецидивный интервал обычно составляет
менее двух лет с почти 70% рецидивом в течение 12 месяцев с момента постановки диагноза.
Для людей с клинически локализованным раком возможно долгосрочное выживание.
к шейке матки, но люди с более поздней стадией заболевания плохо переносят
очень мало людей, выживших долгое время.
и широко как лимфатическим, так и гематогенным путями и включает региональные и отдаленные
лимфатические узлы, легкие, кости, мозг и печень.Безрецидивный интервал обычно составляет
менее двух лет с почти 70% рецидивом в течение 12 месяцев с момента постановки диагноза.
Для людей с клинически локализованным раком возможно долгосрочное выживание.
к шейке матки, но люди с более поздней стадией заболевания плохо переносят
очень мало людей, выживших долгое время.