Кофермент PQQ – пищевая добавка, которая поможет снизить уровень ЛПНП-холестерина в крови
Что такое кофермент PQQ (Пирролохинолинхинон), и как он помогает бороться с повышенным уровнем ЛПНП-холестерина?
В статье описаны функции кофетамина PQQ и ЛПНП-холестерина. Обозначена необходимость снижения уровня ЛПНП и представлен список продуктов, позволяющих сделать это.
Пирролохинолинхинон (PQQ, витамин B₁₄, метоксантин) способен полностью растворяться в воде и оказывает благоприятное влияние на работу репродуктивной системы человека. Это вещество устойчиво к воздействию высоких температур, активизирует выработку лизина и приводит к снижению ЛПНП-холестерина.
Функции PQQ
Несмотря на то что ученые до сих пор спорят относительно признания кофермента витамином, необходимо отметить его разносторонние функции:
- участие в транспортировке кислорода к дыхательной системе;
- интенсификация работоспособности эритроцитов;
- поддержка психоэмоционального состояния;
- прекращение развития патологических процессов;
- стимуляция деятельности иммунной системы;
- выработка аминокислот;
- улучшение кровообращения;
- замедление процессов старения.

Данный список можно продолжать очень долго, да и суточная норма витамина B₁₄ достаточно невелика. Для поддержания стабильного уровня кофермента PQQ достаточно употреблять в пищу продукты с его содержанием.
Основные функции холестерина ЛПНП
Холестерин представляет собой жироподобную субстанцию, которая попадает в организм с продуктами питания животного происхождения. Нормативные показатели холестерина ЛПНП позволяют обеспечить:
- построение мембранных клеток;
- биосинтез стероидных гормонов;
- выработку холиевых кислот.
Внимание! Повышенный уровень холестерина приводит к различным патологиям: провоцирует ожирение, способствует гормональным перестройкам, негативно влияет на работу системы кровообращения, почек, печени, поджелудочной железы. Для контроля уровня этого показателя необходимо регулярно проводить анализ крови.
PQQ против ЛПНП-холестерина
Помимо пересмотра рациона питания, употребления продуктов, богатых полиненасыщенными жирными кислотами, и активных занятий спортом, снизить уровень ЛПНП-холестерина может помочь новая пищевая добавка – кофермент PQQ.
При использовании безопасной формы витамина B₁₄ его ферменты начинают регулировать уровень липидов в крови.
Внимание! Как показывает статистика исследований, снизить уровень холестерина и триглицеридов до нормального и среднего возможно даже в 40–57 лет. При этом необходимая суточная доза витамина B₁₄ не превышала 20 мг.
Было отмечено, что данная добавка снижает выработку холестерина группы ЛПНП благодаря активации фермента AMPk, который является основным перераспределителем энергетического обмена. В результате активности фермента AMPk благодаря коферменту, помимо снижения уровня холестерина, происходит замедление процессов старения и стабилизация уровня сахара в крови.
В результате активности фермента AMPk благодаря коферменту, помимо снижения уровня холестерина, происходит замедление процессов старения и стабилизация уровня сахара в крови.
Повышаем PQQ, понижаем ЛПНП
Обеспечить суточную норму кофермента способен прием продуктов с высоким содержанием PQQ:
- зелень салата;
- ароматная петрушка;
- огородный шпинат;
- пахучий укроп.
Отказ от ответсвенности
Обращаем ваше внимание, что вся информация, размещённая на сайте
Prowellness предоставлена исключительно в ознакомительных целях и не является персональной программой, прямой рекомендацией к действию или врачебными советами.
[Internet Market from Japan SAKURA]DHC PQQ + Q10 Пирролохинолинхинон (на 30 дней)
DHC PQQ + Q10 Пирролохинолинхинон (на 30 дней)
| Bec товара | 20 г |
| Номер товара | 4511413621110 |
| Стоимость в йенах | 3,200 иен |
| Стоимость в рублях | ≈ 2,259.80 руб |
| Готовится к отправке | 1〜3 рабочих дней |
Специально разработанный комплекс для здоровья и активности головного мозга, а также для омоложения организма в целом.

Входящие в состав компоненты помогают улучшить работу центральной нервной системы, предупредить старение клеток и развитие возрастных заболеваний. При регулярном употреблении препарата DHC PQQ + Q10 наблюдается нормализация когнитивных функций, в частности, повышение способности к запоминанию, мышлению, отмечается увеличение словарного запаса. Заметно повышаются интеллектуальные способности.
Пирролохинолинхинон, он же PQQ, способствует стимуляции выработки новых и нормализации функций уже присутствующий митохондрий ? структурных элементов клетки, которые обеспечивают организм энергией. Коэнзим Q10 оказывает мощный антиоксидантный эффект, который наблюдается не только со стороны головного мозга. После прохождения курса приема БАД DHC PQQ + Q10 наблюдается омоложение организма в целом, происходит нормализация функций каждого органа, отмечается повышение упругости и тонуса кожных покровов, устранение возрастных изменений.
 Под действием данного компонента происходит рост новых митохондрий ? основного источника энергии в клетках. PQQ способствует регенерации нервных волокон, улучшает функции ЦНС, восстанавливает память, повышает внимательность и концентрацию. Под влиянием пирролохинолинхинона происходит повышение циркуляции крови, что увеличивает транспорт кислорода к клеткам и улучшает работу кровеносных структур, сердечной мышцы. PQQ положительно влияет на кожу, ногти и волосы, способствуя их укреплению, устранению возрастных изменений.
Под действием данного компонента происходит рост новых митохондрий ? основного источника энергии в клетках. PQQ способствует регенерации нервных волокон, улучшает функции ЦНС, восстанавливает память, повышает внимательность и концентрацию. Под влиянием пирролохинолинхинона происходит повышение циркуляции крови, что увеличивает транспорт кислорода к клеткам и улучшает работу кровеносных структур, сердечной мышцы. PQQ положительно влияет на кожу, ногти и волосы, способствуя их укреплению, устранению возрастных изменений.Экстракт корня Бакопа Монье (брахми)- уникальное растение, оказывающее обезболивающее действие, обладает антиоксидантными, противосудорожными, ноотропными и нейропротекторными свойствами. Бакозиды, которые содержатся в растении, способствуют интенсификации процесса синтезирования протеина в клетках головного мозга, чем стимулирующе влияют на способность к обучению, память и сообразительность.
Коэнзим Q10 ? катализатор молодости и красоты, а также источник энергии для клеток, обеспечивает организм жизненной энергией, позволяет предупредить возрастные изменения, благотворно влияет на головной мозг.
 Прием коэнзима Q10 способствует нормализации работы сердца и сосудов, укреплению иммунной системы.
Прием коэнзима Q10 способствует нормализации работы сердца и сосудов, укреплению иммунной системы. Кокосовое масло ускоряет метаболические процессы, предупреждает скопление холестерина в сосудах, способствует уменьшению массы тела.
Также в комплексе содержатся полиненасыщенные жирные кислоты — DHA и EPA. Данные вещества просто необходимы для правильной работы головного мозга, обеспечения умственной и интеллектуальной деятельности, концентрации внимания. Также компоненты улучшают функции ЦНС, оказывают умеренное противострессовое влияние.
В качестве дополнительных компонентов в комплексе присутствуют экстракт соевого лецитина, глицерин, желатин, пчелиный воск.
СПОСОБ ПРИМЕНЕНИЯ:
1 капсулу в деньСОСТАВ:
PQQ — 20 мг, коэнзим Q10 — 35 мг, экстракт Бакопа Монье — 10 мг (бакозиды 50%), токотриенола — 9. 8 мг, кокосовое масло — 5мг, экстракт корня колокольчика — 2 мг, фосфатидилсерин — 1.5 мг, DHA — 64 мг, EPA — 13 мг
8 мг, кокосовое масло — 5мг, экстракт корня колокольчика — 2 мг, фосфатидилсерин — 1.5 мг, DHA — 64 мг, EPA — 13 мгПирролохинолинхинон, коэнзим Q10, ацетилцистеин и глутатион, PQQ, CoQ-10 with NAC & Glutathione, Solaray, 30 вегетарианских капсул, z02846
Витамин B14, коэнзим Q10, ацетилцистеин и глутатион, PQQ, CoQ-10, Solaray – биодобавка, которая поддерживает здоровье всего организма, и в частности здоровье сердечно-сосудистой системы и выработку клеточной энергии. Пирролохинолинхинон (витамин В14) препятствует разрушению митохондрий (которые вырабатывают основной объем энергии, необходимой для жизнедеятельности клеток) и положительно влияет на их работу. Пирролохинолинхинон — антиоксидант, обладающий мощнейшим противоокислительным свойством, не только защищает митохондрии от окисления, но и способствует их продуктивной деятельности. Коэнзим Q10 — один из мощных антиоксидантов, облегчает производство клеточной энергии; способен предупредить или излечить заболевания сердца и сосудов; стабилизирует клеточные мембраны и борется со свободными радикалами, тем самым улучшает обменные процессы, жизненно важные для клеток.
Предлагаемое использование: использовать только по назначению. Принимать по 1 вегетарианской капсуле с едой или стаканом воды.
Другие ингредиенты: растительная целлюлозная капсула, целлюлоза и кремнезем.
Предупреждения: не использовать, если защитная мембрана повреждена или отсутствует. Хранить в месте, недоступном для детей. Хранить при комнатной температуре.
Хранить при комнатной температуре.
Состав
|
Состав |
||
|
Размер порции: 1 вегетарианская капсула |
||
|
Количество порций: 30 |
||
|
Количество на порцию: |
% от суточной потребности |
|
|
Динатриевая соль пирролохинолинхинона (PQQ), витамин В14 |
10 мг |
*** |
|
Коэнзим Q-10 |
100 мг |
*** |
|
NAC (N-ацетил-L-цистеин) |
255 мг |
*** |
|
L-глутатион (пониженный) |
250 мг |
*** |
|
*** Суточная потребность не определена. |
||
PQQ (пирролохинолинхинон) 10 мг
- Пирролохинолинхинон (PQQ)
- Поддерживает функцию митохондрий
- Не содержит ГМО, глютена и сои
Улучшить состояние нервной, сердечно-сосудистой и эндокринной систем поможет витамин B14. Накапливаясь в тканях, комбинация пирролохинолинхинона и метоксантина, поддерживается тонус, улучшает общее самочувствие. Также, назначается при снижении либидо, нарушении репродуктивной функции.
Главная функция пирролохинолинхинона заключается в стимулировании организма к выработке новых митохондрий. Митохонодрии обеспечивают организм энергией на 90%. Именно от выработки и продолжительности жизни митохондрий зависит адекватная работа сердца и мозга. Как правило, эти органы очень подвержены окислению, которое провоцируют свободные радикалы. PQQ (витамин В14), являясь мощным антиоксидантом, эффективно справляется с этой проблемой. Его антиоксидантные свойства могут повысить жизнеспособность многих систем организма, включая мозг, иммунную работоспособность, здоровье кожи, слизистых оболочек и так далее. Пирролохинолинхинон от Jarrow Formulas будет полезен для всех взрослых и пожилых людей, а также для тех, кто имеет сердечно-сосудистые заболевания, расстройство когнитивных способностей, проблемы с памятью, частые головные боли и другие симптомы нарушений работы мозга.
Пирролохинолинхинон от Jarrow Formulas будет полезен для всех взрослых и пожилых людей, а также для тех, кто имеет сердечно-сосудистые заболевания, расстройство когнитивных способностей, проблемы с памятью, частые головные боли и другие симптомы нарушений работы мозга.
Состав порции (1 растительная капсула):
Пирролохинолинхинон (PQQ) — 10 мг
из натриевой соли PQQ
Другие ингредиенты:
рисовая мука, гидроксипропилметилцеллюлоза, рисовая шелуха, экстракт рисовых отрубей. При производстве не используются молоко, яйца, рыба, моллюски, древесные орехи, арахис, пшеница, соя и глютен; Производится на предприятии, проходящем независимые проверки и имеющем регистрацию GMP, где могут обрабатываться другие продукты, содержащие эти аллергены и ингредиенты.
Рекомендации по применению:
принимать по 1 капсуле в день (независимо от приема пищи) или по назначению врача.
Порций в упаковке: 60
Противопоказания:
индивидуальная непереносимость компонентов продукта, беременным и кормящим женщинам. Перед применением проконсультироваться со специалистом.
Перед применением проконсультироваться со специалистом.
Примечание:
не является лекарственным средством.
Условия хранения:
хранить в закрытом состоянии в сухом, прохладном месте. Срок реализации указан на упаковке. Беречь от детей!
Пирролохинолинхинон — Pyrroloquinoline quinone — qaz.wiki
| Идентификаторы | |
|---|---|
| 3D модель ( JSmol ) | |
| ЧЭБИ | |
| ChemSpider | |
| КЕГГ | |
| MeSH | PQQ + кофактор |
| UNII | |
| |
| |
| Свойства | |
| C 14 H 6 N 2 O 8 | |
| Молярная масса | 330,208 г · моль -1 |
| Плотность | 1,963 г / см 3 |
| Опасности | |
| точка возгорания | 569,8 ° С (1057,6 ° F, 842,9 К) |
| N проверить ( что есть ?) Y N | |
| Ссылки на инфобоксы | |
Пирролохинолинхинон ( PQQ ), также называемый метоксатином , является редокс-кофактором и антиоксидантом . Он содержится в почве и таких продуктах, как киви , а также в грудном молоке человека . Ферменты, содержащие PQQ, называются хинопротеинами. Дегидрогеназы глюкозы , один из quinoproteins, используется в качестве сенсора глюкозы. PQQ стимулирует рост бактерий.
Он содержится в почве и таких продуктах, как киви , а также в грудном молоке человека . Ферменты, содержащие PQQ, называются хинопротеинами. Дегидрогеназы глюкозы , один из quinoproteins, используется в качестве сенсора глюкозы. PQQ стимулирует рост бактерий.
История
Он был открыт JG Hauge как третий окислительно-восстановительный кофактор после никотинамида и флавина у бактерий (хотя он предположил, что это был нафтохинон ). Энтони и Затман также обнаружили неизвестный редокс-кофактор в алкогольдегидрогеназе . В 1979 годе , Солсбери и его коллеги, а также Duine и его коллеги экстрагировали эту протезную группу из метанолдегидрогеназы из метилотрофов и идентифицировали его молекулярную структуру. Адачи и его коллеги обнаружили, что PQQ также был обнаружен в Acetobacter .
Биосинтез
Новым аспектом PQQ является его биосинтез в бактериях из транслируемого рибосомами пептида-предшественника, PqqA. Глутаминовая кислота и тирозин в PqqA сшиты с помощью радикальной SAM фермента PqqE на первой стадии модификации PqqA. Попытки понять биосинтез PQQ способствовали широкому интересу к радикальным ферментам SAM и их способности модифицировать белки, и с тех пор был обнаружен аналогичный радикальный ферментно-зависимый путь SAM, который продуцирует предполагаемый переносчик электронов микофактоцин с использованием валина и тирозина из пептид-предшественник, MftA.
Глутаминовая кислота и тирозин в PqqA сшиты с помощью радикальной SAM фермента PqqE на первой стадии модификации PqqA. Попытки понять биосинтез PQQ способствовали широкому интересу к радикальным ферментам SAM и их способности модифицировать белки, и с тех пор был обнаружен аналогичный радикальный ферментно-зависимый путь SAM, который продуцирует предполагаемый переносчик электронов микофактоцин с использованием валина и тирозина из пептид-предшественник, MftA.
Споры относительно роли витамина
Научный журнал Nature опубликовал статью Касахары и Като за 2003 год, в которой по существу констатировал, что PQQ был новым витамином, а в 2005 году — статью Энтони и Фентон, в которой говорилось, что в статье Касахары и Като 2003 года были сделаны неправильные и необоснованные выводы. В статье, опубликованной в The Proceedings of the National Academy of Sciences в 2018 году, пирролохинолинхинон определен как «витамин долголетия», не необходимый для немедленного выживания, но необходимый для долгосрочного здоровья.
Смотрите также
Рекомендации
<img src=»https://en.wikipedia.org//en.wikipedia.org/wiki/Special:CentralAutoLogin/start?type=1×1″ alt=»» title=»»>Source Naturals, PQQ для мозга, пирролохинолинхинон, метоксантин, 60 таблеток
Пищевая добавка
Нейропротекторная поддержка когнитивной функции
ПХХ, PQQ (pyrroloquinoline quinone) — недавно обнаруженный микроэлемент, который естественным образом содержится в таких продуктах, как соя, петрушка и зеленый перец. Последние доклинические исследования свидетельствуют о том, он может оказать серьезное влияние на нервы и неврологическое здоровье в качестве антиоксиданта. Тестирования на людях показывают, что пирролохинолинхинон помогает улучшить когнитивные функции. Вдобавок ПХХ способствует митохондриальному биогенезу, который замедляет процесс старения и увеличивает уровень энергии. р>
Рекомендации по Применению
По 1 таблетке ежедневно.р>
Другие Ингредиенты
Двухосновный фосфат кальция, микрокристаллическая целлюлоза, стеариновая кислота, стеарат магния и диоксид кремния.
Подходит для вегетарианцев и гипоаллерген: не содержит дрожжей, молочных продуктов, яиц, клейковины, кукурузы, сои или пшеницы. Не содержит сахара, крахмала, соли, консервантов или искусственного цвета, вкуса или аромата.
Предупреждения
Примечание: если вы беременны, планируете беременность или кормите грудью, перед применением проконсультируйтесь с врачом.
Не использовать, если мембрана защиты от вскрытия повреждена или отсутствует.
Хранить в недоступном для детей месте.
Хранить в сухом и прохладном месте.
Отказ от ответственности
Mukownino.ru делает всё возможное для того, чтобы изображения и информация о продукции были предоставлены своевременно и корректно. Однако, иногда обновление данных может производиться с задержкой. Даже в случаях, когда маркировка полученной Вами продукции отличается от представленной на сайте, мы гарантируем свежесть товаров. Мы рекомендуем ознакомиться с инструкцией по применению, указанной на товаре, перед его использованием, а не только полностью полагаться на описание, представленное на сайте Mukownino. ru.
ru.
Оставить отзыв
Пирролохинолинхинон (PQQ ) – мощное средство для профилактики нейродегенеративных заболеваний | Здоровье
Пирролохинолинхинон (PQQ) особенно важен для здоровья и защиты ваших митохондрий. Он также помогает восстановить новые митохондрии. Было показано, что PQQ улучшает функцию поврежденных бета-амилоидом клеток мозга (отличительная черта болезни Альцгеймера) и предотвращает образование белка альфа-синклеина, связанного с болезнью Паркинсона. Он может даже помочь предотвратить гибель нервных клеток в случае черепно-мозговой травмы.
Хотя ваша диета является одним из наиболее важных инструментов контроля здоровья, некоторые добавки могут быть полезны, особенно когда речь идет об улучшении работы митохондрий. Одной из особенно мощных в этом отношении является пирролохинолинхинон (PQQ), который, как было показано, способствует росту новых митохондрий (митохондриальный биогенез).
Джозеф Меркола: PQQ для здоровья мозга
Ваши митохондрии также требуют PQQ для катализа энергетических реакций, и это имеет решающее значение для защиты от повреждений митохондрий, которые являются крошечными производителями энергии внутри клеток. Митохондриальная дисфункция лежит в основе почти всех хронических заболеваний, старости и смерти.
Подписывайтесь на наш аккаунт в INSTAGRAM!
Чтобы ваше тело функционировало должным образом, ему нужно достаточно энергии, а для этого необходимы хорошо питающиеся и функционирующие митохондрии. PQQ является важным игроком в этом отношении. Как отметил Дейв Аспри, основатель Bulletproof и автор книг по энергии, продолжительности жизни и интеллектуальному потенциалу:
«Борьба со старением начинается на клеточном уровне, и PQQ — это простой способ защитить ваши клетки, помогая при этом улучшить состояние частей тела с самым плотным содержанием митохондрий, таких как мозг и сердце».
PQQ повышает плотность и улучшает работу митохондрий
PQQ относительно уникален своей способностью усиливать митохондриальный биогенез, т. е. Создавать новые здоровые митохондрии в стареющих клетках, что является основой многих его преимуществ для здоровья. Как сообщает журнал Better Nutrition:
е. Создавать новые здоровые митохондрии в стареющих клетках, что является основой многих его преимуществ для здоровья. Как сообщает журнал Better Nutrition:
«В дополнение к улучшению производства энергии, эта характеристика PQQ дает задний ход процессу старения. В исследовании Калифорнийского Университета в Дэвисе, ученые дали небольшой группе мужчин и женщин добавки PQQ и проверили эффекты 76 часов спустя.
Используя анализы крови и мочи, они обнаружили, что PQQ улучшил работу митохондрий и уменьшил хроническое воспаление. Эффективная доза составила 0,3 мг PQQ на килограмм веса тела — например, 20 мг PQQ для человека весом 150 фунтов».
Одним из механизмов, посредством которого PQQ снижает воспаление, улучшает функцию митохондрий и стимулирует митохондриальный биогенез, является активация экспрессии Nrf2, биологического гормона, который активирует межклеточные антиоксиданты, такие как супероксиддисмутаза и каталаза.
Также было показано, что PQQ повышает активность основных транскрипционных факторов продления продолжительности жизни, что заставило исследователей предположить, что PQQ может играть «новую роль» в долголетии. Действительно, он модулирует множество сигнальных путей, включая mTOR, который играет роль в старении и раке, и помогает восстанавливать ДНК, помогая вам дольше жить.
Действительно, он модулирует множество сигнальных путей, включая mTOR, который играет роль в старении и раке, и помогает восстанавливать ДНК, помогая вам дольше жить.
PQQ также усиливает NADH, который преобразуется в NAD+, когда пища расщепляется на энергию. Когда восстанавливается повреждение ДНК, NAD+ расходуется, и, если запас исчерпан, процесс не может продолжаться, что, вероятно, является основной причиной большинства болезней, которые мы наблюдаем в современном мире.
Как PQQ защищает и приносит пользу вашему мозгу
Способность PQQ оградить клетки вашего мозга и их ДНК от вреда также говорит о том, что он может быть мощным средством профилактики нейродегенеративных заболеваний. Митохондриальная ДНК склонна к повреждению от свободных радикалов и прооксидантов. Большинство свободных радикалов в организме вырабатываются в самих митохондриях, поэтому они так восприимчивы.
Свободные радикалы являются неизбежным артефактом превращения пищи в клеточное топливо, и ваша пища в конечном итоге метаболизируется в митохондриях. PQQ, как было показано, защищает от такого рода повреждений. Он также активирует встроенные механизмы восстановления и репликации митохондрий.
PQQ, как было показано, защищает от такого рода повреждений. Он также активирует встроенные механизмы восстановления и репликации митохондрий.
В мозге практическим конечным результатом является общее улучшение неврологической функции, включая познание, обучение и память, а также снижение риска нейродегенеративных заболеваний. Исследования показали, что PQQ защищает и улучшает выживание нейронов, стимулируя синтез фактора роста нервов (NGF) в определенных глиальных клетках, находящихся в вашей центральной нервной системе.
Также было показано, что он улучшает функцию поврежденных бета-амилоидом клеток мозга (отличительный признак болезни Альцгеймера) и предотвращает образование белков альфа-синклеина, связанных с болезнью Паркинсона.
Согласно исследованию 2012 года, PQQ может даже помочь предотвратить гибель нервных клеток в случаях черепно-мозговой травмы. По мнению авторов этого исследования, «PQQ может играть важную роль в восстановлении после ЧМТ».
Добавление CoQ10 обеспечивает синергетические преимущества
Исследования как на животных, так и на людях с использованием доз от 10 до 20 миллиграммов PQQ продемонстрировали улучшение умственной обработки и памяти сами по себе, но сочетание с коэнзимом Q10 потенциально может быть даже более полезным.
Одно исследование показало, что PQQ в сочетании с CoQ10 давал лучшие результаты, чем только одно из питательных веществ. Я рекомендую использовать восстановленную форму CoQ10, которая называется убихинол, так как она более доступна для вашего тела.
Подписывайтесь на Эконет в Pinterest!
И CoQ10, и PQQ являются жирорастворимыми, поэтому их лучше всего принимать с небольшим количеством жира во время еды, а не натощак. Помимо того, что CoQ10/убихинол является мощным антиоксидантом, он также способствует рециркуляции (каталитической конверсии) других антиоксидантов, поэтому при его приеме в сочетании с PQQ вы усиливаете антиоксидантную способность своего организма.
PQQ — мощный антиоксидант и усилитель работы иммунной системы
Еще одна причина, почему PQQ так полезен, связана с его мощной антиоксидантной активностью. Он способен проходить более 20000 каталитических превращений, при которых антиоксидант нейтрализует свободный радикал. Другими словами, PQQ является удивительно эффективным антиоксидантом. Для сравнения, витамин С может пройти только четыре каталитических превращения, прежде чем он будет израсходован.
Другими словами, PQQ является удивительно эффективным антиоксидантом. Для сравнения, витамин С может пройти только четыре каталитических превращения, прежде чем он будет израсходован.
Исследования показали, что PQQ снижает уровень воспалительных биомаркеров С-реактивного белка и интерлейкина-6 у людей в дозах от 0,2 до 0,3 мг на кг.
PQQ также поддерживает вашу работу иммунной системы, а его дефицит связан с иммунной дисфункцией. В одном исследовании добавление PQQ увеличило чувствительность B- и T-клеток (белых кровяных телец, играющих центральную роль в иммунном ответе) к митогенам (белкам, которые вызывают деление клеток или митоз).
PQQ активирует главный метаболический переключатель
Список потенциальных применений для PQQ чрезвычайно длинный, поскольку его метаболические эффекты выходят далеко за рамки улучшения работы митохондрий. Например, он помогает активировать аденозин-монофосфат-активируемую протеинкиназу (АМФК), которая является важной молекулярной мишенью для метаболического здоровья.
АМФК является ферментом в клетках вашего тела. Ее иногда называют «главным переключателем метаболизма», потому что она играет важную роль в регулировании обмена веществ. Как отмечено в журнале Natural Medicine:
«АМФК вызывает каскад событий внутри клеток, которые участвуют в поддержании энергетического гомеостаза… АМФК регулирует множество биологических активностей, которые нормализуют липидный, глюкозный и энергетический дисбалансы.
Метаболический синдром (MetS) возникает, когда эти регулируемые АМФК пути отключены, вызывая синдром, который включает гипергликемию, диабет, нарушения липидного обмена и энергетический дисбаланс…
АМФК помогает координировать реакцию на эти стрессоры, перемещая энергию в направлении восстановления клеток, поддержания или возврата к гомеостазу и повышения вероятности выживания.
Гормоны лептин и адипонектин активируют АМФК. Другими словами, ее активация может принести те же преимущества, что и физические упражнения, диета и потеря веса. Эти модификации образа жизни считаются полезными для целого ряда заболеваний».
Эти модификации образа жизни считаются полезными для целого ряда заболеваний».
С возрастом уровень АМФК падает естественным образом, но плохое питание может снизить ее активность в любом возрасте. Этот фермент играет главную роль в составе жировых отложений, воспалении и липидах в крови, поэтому повышение его активности может иметь большое значение для улучшения контроля сахара в крови, сокращения висцерального жира и снижения уровня холестерина ЛПНП.
Лучшие публикации в Telegram-канале Econet.ru. Подписывайтесь!
АМФК также стимулирует митохондриальную аутофагию (митофагия) и митохондриальный биогенез, а также пять других критически важных путей: инсулин, лептин, mTOR, инсулиноподобный фактор роста 1 (IGF-1) и ко-активатор гамма-рецептора, активируемый пролифератором 1-альфа (PGC-1α).
Важно отметить, что PQQ, скорее всего, не будет работать, если вы едите круглосуточно, поскольку повышенный уровень инсулина активирует mTOR и ингибирует АМФК, ограничивая тем самым способность PQQ увеличивать его.
Другие преимущества PQQ
PQQ также был связан с рядом других преимуществ для здоровья, в том числе:
- Улучшение репродуктивных результатов у животных (дефицит PQQ был связан с нарушением репродуктивной функции)
- Сниженный риск неалкогольной жировой болезни печени у потомства мышей с ожирением во время беременности и кормления
- Улучшенный сон (модуляция реакции кортизола на пробуждение)
Как видите, список пользы для здоровья PQQ довольно обширный. И, хотя он содержится в таких продуктах, как натто, петрушка, зеленый перец, шпинат, папайя, киви и зеленый чай, дозы, которые вы получаете из рациона, вероятно, будут недостаточными, если вы хотите пожинать все его полезные для здоровья плоды.
Принимая добавку PQQ, вы узнаете, подходит ли вам бренд и дозировка в течение нескольких недель. В целом, вы должны чувствовать себя лучше, иметь больше энергии и более ясное мышление.опубликовано econet.ru.
Автор Джозеф Меркола
Подписывайтесь на наш youtube канал!
youtube.com/embed/F9EUMEmZnBc» allow=»encrypted-media» allowfullscreen=»allowfullscreen»/>
P.S. И помните, всего лишь изменяя свое сознание — мы вместе изменяем мир! © econet
Источник: https://econet.ru/
2+ Преимущества PQQ + Диетические источники и побочные эффекты
Митохондрии — это батареи, которые обеспечивают энергией ваше тело. С возрастом количество и производительность митохондрий в ваших клетках уменьшается, что, возможно, способствует эффектам старения. PQQ (пирролохинолинхинон) усиливает образование новых митохондрий и увеличивает выработку клеточной энергии.
Что такое PQQ?Пирролохинолинхинон (PQQ) был впервые обнаружен как кофактор ферментативных реакций у бактерий, в которых он выполняет аналогичную функцию витаминов группы В для человека [1].
Назвать что-то «кофактором» просто означает, что он помогает ферментам выполнять свою работу. Существует класс этих молекул кофакторов, которые переносят электроны во время реакций; этот перенос важен для выработки энергии митохондриями.
Основными кофакторами, переносящими электроны, о которых вы, возможно, знаете, являются глутатион (увеличивает NAC), CoQ10, FAD, витамин C и NAD. У них разные функции в организме, поэтому их эффекты могут совпадать, но не все одинаковы.
PQQ у людейПирролохинолинхинон (PQQ) был впервые выделен в 1979 году, когда было обнаружено, что он является кофактором ферментативных реакций у бактерий [2].
Последующие исследования на свиньях показали аналогичную роль у млекопитающих. Однако современный научный консенсус состоит в том, что, в отличие от растений и бактерий, PQQ, вероятно, не является ферментативным кофактором у человека [3, 4, 5].
Предоставление животным диеты с дефицитом PQQ ограничивает рост и воспроизводство [6, 7].
Считается, что PQQ в высоком уровне в грудном молоке человека является невитаминным фактором роста . Следовательно, у крыс, лишенных PQQ, наблюдается снижение роста [8].
PQQ обнаружен в тканях млекопитающих. Считается, что у людей концентрация PQQ в тканях составляет около 0,8–5,8 нг / г [9].
Считается, что у людей концентрация PQQ в тканях составляет около 0,8–5,8 нг / г [9].
PQQ был впервые обнаружен как ферментативный кофактор у бактерий. У людей он, по-видимому, действует как невитаминный фактор роста, особенно высокие концентрации которого обнаруживаются в грудном молоке.
Механизм действияPQQ может связываться с белками человеческого тела, называемыми хинопротеинами, и изменять их активность [10].
Это чрезвычайно эффективный антиоксидант — примерно в 100 раз более эффективный, чем витамин С, в устранении свободных радикалов [11, 12].
Ингибирование ферментаPQQ ингибирует тиоредоксинредуктазу 1 (TrxR1), фермент, восстанавливающий тиоредоксин [13].
Ингибирование активности TrxR1 увеличивает активность Nrf2, что в конечном итоге приводит к увеличению продукции антиоксидантов [14, 15].
Генетическая экспрессия Истощение PQQ влияет на способ экспрессии многих генов [16].
Одним из ключевых генов, на которые влияет PQQ, является PGC-1a. Активируя PGC-1a, PQQ вызывает митохондриальный биогенез (рост новых митохондрий), а также множество других полезных эффектов [17].
Люди производят от 100 до 400 нанограмм PQQ каждый день [12, 18].
В настоящее время мы не знаем, как люди синтезируют PQQ. У бактерий PQQ синтезируется из аминокислот L-тирозина и глутамата [19, 20].
PQQ, по-видимому, регулирует экспрессию генов, хотя его точная роль у людей неясна.
Snapshot Сторонники:- Лучшая митохондриальная и повышающая энергию добавка
- Улучшает когнитивные функции
- Улучшает настроение и психическое здоровье
- Улучшает сон
- Увеличивает бодрствование 000
- Хорошо, чтобы отдохнуть от этого
- Может быть слишком стимулирующим для некоторых
- Возможна головная боль, если принять слишком много
PQQ — это естественное соединение, которое уже существует в наших клетках, но мы еще не до конца понимаем, как он работает, для чего он полезен и приносит ли его добавка пользу для здоровья. Что еще более усложняет ситуацию, большая часть механизма действия PQQ была изучена только на животных моделях, что делает его роль в здоровье человека еще более туманной.
Что еще более усложняет ситуацию, большая часть механизма действия PQQ была изучена только на животных моделях, что делает его роль в здоровье человека еще более туманной.
В конечном счете, добавки PQQ не были одобрены FDA для медицинского использования и, как правило, не имеют достоверных клинических исследований. Правила устанавливают для них производственные стандарты, но не гарантируют их безопасность или эффективность. Перед приемом добавок проконсультируйтесь с врачом.
Недостаточно доказательств для
Следующие предполагаемые преимущества подтверждаются только ограниченными низкокачественными клиническими исследованиями.Недостаточно доказательств, подтверждающих использование PQQ для любого из перечисленных ниже целей. Не забудьте поговорить с врачом, прежде чем принимать PQQ, и никогда не используйте его вместо того, что рекомендует или предписывает ваш врач.
1) Воспаление и окислительный стресс
Здоровые люди, принимавшие 20 мг PQQ (для мужчины весом 150 фунтов), имели значительное снижение уровней С-реактивного белка (на 45% через 3 недели) и IL-6. . Более низкая дозировка не уменьшила воспаление [21].
. Более низкая дозировка не уменьшила воспаление [21].
Также улучшились различные маркеры окислительного стресса в моче, что согласуется с усилением функции митохондрий.
2) Сон и усталость
PQQ может улучшить качество сна и сократить время, необходимое для засыпания.
Одно открытое исследование на людях, проведенное с использованием 20 мг PQQ в течение 8 недель с участием 17 человек с усталостью или нарушением сна, показало, что PQQ способен значительно улучшить качество сна, при этом улучшение продолжительности и качества сна появилось при первом тестировании. период через 4 недели. Это также привело к уменьшению времени, необходимого для засыпания, но потребовалось 8 недель для достижения значимости [22].
Это исследование также отметило улучшение аппетита, навязчивой идеи и оценки боли, которые могли быть вторичными по отношению к улучшению сна; удовлетворенность жизнью имела тенденцию к значимости в течение 8 недель, но результаты были неубедительными [22].
Это очень ранние результаты одного очень небольшого исследования. Для подтверждения роли PQQ в обеспечении сна и утомляемости потребуются более масштабные и надежные испытания на людях.
В очень небольшом клиническом исследовании добавка PQQ улучшила качество и продолжительность сна, а также другие показатели, вторичные по отношению к улучшению сна.Это исследование никогда не воспроизводилось.
Исследования на животных и клетках (доказательства отсутствуют)
Эти функции и преимущества были изучены на животных или клетках, но еще не на людях. Таким образом, мы пока не знаем, применимы ли они к здоровью человека и насколько они применимы.
3) Новые митохондрии: роль PGC-1a
Биогенез митохондрий связан со многими преимуществами для здоровья, такими как уменьшение воспаления, увеличение продолжительности жизни, улучшение использования энергии и защита от свободных радикалов [23, 24].
У мышей и крыс, получавших рационы с недостатком пирролохинолинхинона (PQQ), снижено содержание митохондрий. Создание новых митохондрий с помощью PQQ происходит за счет активации CREB и PGC-1alpha, путей, которые, как известно, усиливают биогенез митохондрий [25].
Создание новых митохондрий с помощью PQQ происходит за счет активации CREB и PGC-1alpha, путей, которые, как известно, усиливают биогенез митохондрий [25].
В результате активации пути PGC-1alpha, PQQ увеличил NRiF-1 и NRF-2, белки (факторы транскрипции), которые защищают нас от свободных радикалов за счет увеличения нашего внутреннего производства антиоксидантов. Они также защищают нас от токсинов, ультрафиолета и т. Д.
PGC-1a — это «главный регулятор», который напрямую стимулирует гены, которые способствуют митохондриальному и клеточному дыханию, росту и пролиферации [26].
У грызунов, которых кормили рационом без PQQ, было меньше митохондрий. В клетках PQQ увеличивает факторы транскрипции, которые активируют антиоксидантные пути.
4) Память и рассуждение: роль CREB
PQQ может активировать белок, называемый CREB, который играет ключевую роль в росте и экспрессии генов. CREB также стимулирует рост новых митохондрий и увеличивает BDNF [27, 26].
В исследованиях на животных PQQ обратил вспять когнитивные нарушения, вызванные хроническим окислительным стрессом, и улучшил результаты тестов на память. Эта потенциальная польза еще не исследована на людях [28, 29].
5) Функция мозга
Добавка PQQ стимулировала выработку и высвобождение факторов роста нервов в клетках, которые поддерживают нейроны в головном мозге. Это может помочь объяснить, почему повышенный PQQ связан с улучшенными показателями познания и обучения у стареющих людей и крыс [30].
PQQ также увеличивает количество шванновских клеток за счет усиления сигнального пути PI3K / Akt [31].
6) Нейрозащита
PQQ представляет собой нейрозащитное соединение, которое может поддерживать память и познавательные способности у стареющих животных и людей [32].
PQQ увеличивает белок (DJ-1), который важен для здоровья и функционирования мозга. Этот белок, который увеличивает функцию и выживаемость клеток за счет борьбы с интенсивным окислительным стрессом, вероятно, важен для здоровья и функционирования мозга [33].
Мутации DJ-1 окончательно связаны с возникновением редких наследственных форм болезни Паркинсона и других неврологических расстройств.
PQQ подавляет активные формы азота , которые вызывают инсульты и травмы головного мозга. Таким образом, он обеспечивает защиту от нервных повреждений [34].
В моделях на животных введение PQQ непосредственно перед индукцией инсульта значительно уменьшало размер поврежденной области мозга [35].
PQQ также защищает нейроны, предотвращая долгосрочную сверхактивацию рецепторов NMDA, которая приводит к эксайтотоксичности. Длительная чрезмерная стимуляция нейронов связана со многими нейродегенеративными заболеваниями и судорогами [36, 37].
Он также защищает мозг от нейротоксичности, вызванной другими мощными токсинами, включая ртуть и оксидопамин, токсины, которые, как предполагается, вызывают болезни Альцгеймера и Паркинсона соответственно [38, 39, 40, 41].
PQQ также предотвращает агрегацию альфа-синуклеина и бета-амилоида, белков, связанных с болезнями Паркинсона и Альцгеймера соответственно [42, 43].
Роль PQQ в нейропротекции у людей до конца не изучена, а потенциальная польза от добавления PQQ не исследовалась.Требуется еще много клинических испытаний.
Согласно исследованиям на животных, PQQ может играть роль в нейропротекции, памяти и когнитивном снижении, связанном с возрастом.
7) Здоровье сердца
Введение PQQ уменьшило размер поврежденных участков в моделях на животных от острого сердечного приступа. Это произошло независимо от того, было ли введено химическое вещество до или после самого ишемического события, что позволяет предположить, что введение в течение первых часов после медицинского ответа может принести пользу жертвам сердечного приступа; это не было исследовано на людях.[44].
Исследователи сравнили PQQ со стандартным клиническим лечением после сердечного приступа (метопролол, бета-блокатор) у крыс. Оба вида лечения уменьшали размер поврежденных участков и защищали от дисфункции сердечной мышцы. Только PQQ уменьшал повреждение клеток (перекисное окисление липидов), и эффекты были более значительными. Эти результаты привели исследователей к выводу, что «PQQ превосходит метопролол в защите митохондрий от ишемии / реперфузионного окислительного повреждения», но этот результат не был повторен у людей [45].
Эти результаты привели исследователей к выводу, что «PQQ превосходит метопролол в защите митохондрий от ишемии / реперфузионного окислительного повреждения», но этот результат не был повторен у людей [45].
Последующие исследования также показали, что PQQ помогает клеткам сердечной мышцы противостоять острому окислительному стрессу, сохраняя и улучшая функцию митохондрий [46, 47].
Потребуются испытания на людях, чтобы определить роль PQQ в защите сердца.
PQQ, по-видимому, играет роль в сердечной мышце, но пока это плохо изучено. Введение PQQ животным после сердечного приступа уменьшило повреждение тканей.
8) Инсулинорезистентность
По мнению некоторых исследователей, PQQ может уменьшать инсулинорезистентность, индуцированную жиром, за счет увеличения митохондриального биогенеза в мышечных клетках, подобно упражнениям [48].
PQQ может увеличивать содержание перекиси водорода, но, делая это, он может ингибировать фермент PTP1B и повышать чувствительность к инсулину [49, 50].
Мыши, лишенные способности производить PTP1B, показали устойчивость к ожирению и были более чувствительны к инсулину. Между тем у людей с раком груди, как правило, повышенный уровень этого белка [51].
Потребуются исследования на людях, чтобы определить роль PQQ в чувствительности к инсулину.
PQQ может уменьшить резистентность к инсулину и помочь противостоять ожирению, но эти эффекты были изучены и наблюдались только на животных.
9) Ожирение и контроль веса
У крыс с дефицитом PQQ скорость метаболизма на 10% ниже, чем у крыс с нормальным уровнем PQQ [52].
Исследователи предположили, что добавка PQQ может увеличивать общую скорость метаболизма, но этот потенциальный эффект еще не исследован на людях.
10) Immune Health
Лишение мышей пищевого PPQ вызывало нарушение иммунной функции и дисфункциональный иммунный ответ на стрессоры [7, 53].
Добавление PQQ в рацион мышей увеличивало уровни CD8 + клеток и лимфоцитов (важных иммунных регуляторов) [54].
Связь между PQQ и иммунитетом на людях еще не исследована.
Cancer ResearchВ настоящее время исследователи изучают целесообразность дальнейшего изучения PQQ на животных моделях лейкемии и меланомы [55, 56].
Это очень раннее исследование, и нет никаких доказательств того, что прием добавок PQQ предотвращает или подавляет рак.
Природные источники PQQ PQQ FoodsPQQ естественным образом встречается почти во всех пищевых продуктах, в диапазоне от 0,19 до 61 нг / г, но особенно сконцентрирован в следующих продуктах [9, 57]:
- Ферментированный соевые продукты (например, натто) [57]
- Зеленые соевые бобы [9]
- Шпинат [57]
- Полевая горчица (5,54 +/- 1,50 нг / г сырого веса) [57]
- Тофу [9]
- Зеленый чай [9]
- Зеленый перец [9]
- Петрушка [9]
- Киви [9]
Содержание PQQ даже в самых богатых PQQ продуктах намного ниже, чем количество, которое вы можете получить из добавок (От 5 до 20 мг).
У крыс 62% PQQ абсорбировалось в кишечнике при приеме с едой [58].
У грызунов PQQ в основном (86%) выводится через 24 часа после приема внутрь. Однако некоторые остатки PQQ остаются в коже и почках [58].
PQQ почти полностью метаболизируется, прежде чем вывести его [59].
Дозировка PQQОбратите внимание, что FDA не одобрило PQQ для каких-либо медицинских целей, и не существует безопасной и эффективной дозы, потому что не проводились исследования, чтобы найти ее.При этом клинические исследования показали преимущества, связанные со следующими дозами:
- Подходящая доза для улучшения митохондрий составляет от 0,075 до 0,3 мг / кг в день [59]
- Около 20 мг уменьшало воспаление у мужчин со средним весом [21]
Исследование показало, что недельное потребление до 0,3 мг / кг PQQ (20 мг для мужчины весом 70 кг) не вызвало каких-либо побочных эффектов [59].
Чрезвычайно высокие внутривенные дозы PQQ (от 500 до 1000 мг / кг массы тела) могут вызвать смерть у крыс [60, 61].
Побочные эффекты PQQНа основании этих результатов был определен уровень отсутствия наблюдаемых побочных эффектов 100 мг / кг / день для BioPQQ у крыс, самая высокая доза, испытанная в 13-недельном исследовании [62] .
Однако, как ни странно, некоторые люди сообщают о легких головных болях и бессоннице — обычно либо при слишком большом приеме, либо если кто-то очень чувствителен к воздействию добавок.
Takeaway
PQQ — это ферментативный кофактор и фактор роста, который часто встречается у бактерий и наиболее часто встречается в грудном молоке человека.Его роль плохо изучена, но исследователи считают, что он способствует росту и регулирует экспрессию генов.
В качестве добавки PQQ может уменьшить воспаление и окислительный стресс, а также улучшить качество сна. Исследования на животных указали на другие возможные преимущества для сердца, обмена веществ и нервной системы. Сообщалось о нескольких побочных эффектах, но данные о безопасности неполны.
Сообщалось о нескольких побочных эффектах, но данные о безопасности неполны.
Что такое PQQ? Часто задаваемые вопросы о PQQ (пирролохинолинхиноне)
Каковы преимущества PQQ?Помимо широкого спектра преимуществ, PQQ широко используется в качестве средства профилактики старения и защиты здоровья наиболее важных органов, включая мозг, сердце и печень .Исследования показали, что PQQ может предоставить:
Неврологическое сопровождение:PQQ улучшает когнитивные функции и кратковременную память. Это может помочь мозгу предотвратить потерю памяти и снижение когнитивных функций из-за возраста и нейродегенеративных расстройств. Обладая способностью восстанавливать поврежденные мозговые и нервные клетки, он также способствует выздоровлению в случаях инсульта и инфаркта мозга.
Поддержка сердечно-сосудистой системы: PQQ улучшает кровообращение и сердечную функцию, поддерживая выработку энергии в сердце и обеспечивая мощную антиоксидантную защиту. Исследования показывают, что PQQ также может способствовать восстановлению после сердечных приступов и уменьшению размера инфаркта.
Исследования показывают, что PQQ также может способствовать восстановлению после сердечных приступов и уменьшению размера инфаркта.
PQQ помогает печени в метаболизме жиров расщеплять больше жиров и превращать их в большее количество энергии. Клинические результаты показывают, что он может также обратить вспять острые и хронические повреждения печени, включая повреждение от жировой болезни печени.
Помимо поддержки жизненно важных органов, PQQ используется в качестве регулярной добавки к для увеличения и поддержания более высоких уровней производства естественной энергии .Стимулируя выработку чистой энергии вашим телом на клеточном уровне, PQQ служит отличной энергетической добавкой для самых разных целей. Он особенно идеален в качестве спортивной и фитнес-добавки для спортсменов, которые ищут более чистые и естественные альтернативы для повышения своей производительности.
Возможно, самым уникальным и неожиданным преимуществом PQQ является его использование для косметических приложений и средств ухода за кожей . Он омолаживает клетки кожи, восстанавливая здоровые ткани, делая кожу более толстой и уменьшая количество морщин.PQQ может быть эффективным средством профилактики старения не только для мозга, сердца и печени, но и как косметическое средство против старения для вашей кожи.
Он омолаживает клетки кожи, восстанавливая здоровые ткани, делая кожу более толстой и уменьшая количество морщин.PQQ может быть эффективным средством профилактики старения не только для мозга, сердца и печени, но и как косметическое средство против старения для вашей кожи.
Короче говоря, PQQ — это новая суперзвездная добавка, обладающая множеством преимуществ для оздоровления вашего разума и тела.
Пирролохинолинхинон — фактор стимуляции роста растений, продуцируемый Pseudomonas fluorescens B16
- © 2008 Американское общество биологов растений
Реферат
Pseudomonas fluorescens B16 — это ризобактерии, способствующие росту растений.Чтобы определить факторы, участвующие в стимулировании роста растений этим организмом, мы мутагенизировали штамм B16 дикого типа, используя элементы ΩKm, и выделили один мутант, K818, который не способствует стимулированию роста растений, в системе культивирования минеральной ваты. Клон космиды, pOK40, который дополняет мутант K818, был выделен из геномной библиотеки родительского штамма. Tn 3 — gusA мутагенез pOK40 показал, что гены, ответственные за стимуляцию роста растений, находятся во фрагменте Bam HI размером 13,3 т.п.н.Анализ последовательности ДНК фрагмента выявил 11 предполагаемых открытых рамок считывания, состоящих из семи известных и четырех ранее не идентифицированных генов биосинтеза пирролохинолинхинона (PQQ). Все гены pqq проявляли экспрессию только в условиях ограничения питательных веществ PqqH-зависимым образом. Электрораспылительный ионизационно-масс-спектрометрический анализ фильтрата культур подтвердил, что B16 дикого типа продуцирует PQQ, тогда как мутанты, дефектные в стимулировании роста растений, этого не делают. Применение B16 дикого типа на растениях томата ( Solanum lycopersicum ), культивируемых в системе гидропонного культивирования, значительно увеличивало высоту, количество цветков, количество плодов и общий вес плодов, тогда как ни один из штаммов, не продуцирующих PQQ, не способствовал росту томатов.
Tn 3 — gusA мутагенез pOK40 показал, что гены, ответственные за стимуляцию роста растений, находятся во фрагменте Bam HI размером 13,3 т.п.н.Анализ последовательности ДНК фрагмента выявил 11 предполагаемых открытых рамок считывания, состоящих из семи известных и четырех ранее не идентифицированных генов биосинтеза пирролохинолинхинона (PQQ). Все гены pqq проявляли экспрессию только в условиях ограничения питательных веществ PqqH-зависимым образом. Электрораспылительный ионизационно-масс-спектрометрический анализ фильтрата культур подтвердил, что B16 дикого типа продуцирует PQQ, тогда как мутанты, дефектные в стимулировании роста растений, этого не делают. Применение B16 дикого типа на растениях томата ( Solanum lycopersicum ), культивируемых в системе гидропонного культивирования, значительно увеличивало высоту, количество цветков, количество плодов и общий вес плодов, тогда как ни один из штаммов, не продуцирующих PQQ, не способствовал росту томатов. .Кроме того, от 5 до 1000 нм синтетического PQQ приводило к значительному увеличению сырой массы проростков огурца ( Cucumis sativus ), подтверждая, что PQQ является фактором стимулирования роста растений. Обработка дисков листьев огурца PQQ и B16 дикого типа привела к удалению активных форм кислорода и перекиси водорода, что позволяет предположить, что PQQ действует как антиоксидант в растениях.
.Кроме того, от 5 до 1000 нм синтетического PQQ приводило к значительному увеличению сырой массы проростков огурца ( Cucumis sativus ), подтверждая, что PQQ является фактором стимулирования роста растений. Обработка дисков листьев огурца PQQ и B16 дикого типа привела к удалению активных форм кислорода и перекиси водорода, что позволяет предположить, что PQQ действует как антиоксидант в растениях.
Бактерии, колонизирующие корни растений и усиливающие рост растений с помощью любого механизма, называются ризобактериями, способствующими росту растений (PGPR).PGPR применяли к различным культурам для увеличения роста, всхожести семян, урожайности и борьбы с болезнями, а некоторые из них были коммерциализированы (Kloepper, 1992; Glick, 1995; Dey et al., 2004). Использование PGPR в устойчивом сельском хозяйстве неуклонно растет и предлагает привлекательный способ заменить химические удобрения, пестициды и добавки.
PGPR может прямо или косвенно способствовать росту растений. Непрямое стимулирование роста растений опосредуется антибиотиками или сидерофорами, продуцируемыми PGPR, которые уменьшают или предотвращают вредные эффекты патогенных для растений микроорганизмов (Leong, 1986; Sivan and Chet, 1992).Факторы, непосредственно способствующие росту растений, включают различные фитогормоны (Xie et al., 1996), солюбилизацию почвенного фосфора и железа (De Freitas et al., 1997), фиксацию N 2 (Christiansen-Weneger, 1992), увеличение содержания нитратов. поглощение (Sophie et al., 2006), снижение мембранного потенциала в корнях (Bashan and Levanony, 1991), 1-аминоциклопропан-1-карбоксилатдезаминаза (которая модулирует рост и развитие растений; Safronova et al., 2006) и производство летучих веществ в качестве потенциальных сигнальных молекул (Ryu et al., 2003).
Непрямое стимулирование роста растений опосредуется антибиотиками или сидерофорами, продуцируемыми PGPR, которые уменьшают или предотвращают вредные эффекты патогенных для растений микроорганизмов (Leong, 1986; Sivan and Chet, 1992).Факторы, непосредственно способствующие росту растений, включают различные фитогормоны (Xie et al., 1996), солюбилизацию почвенного фосфора и железа (De Freitas et al., 1997), фиксацию N 2 (Christiansen-Weneger, 1992), увеличение содержания нитратов. поглощение (Sophie et al., 2006), снижение мембранного потенциала в корнях (Bashan and Levanony, 1991), 1-аминоциклопропан-1-карбоксилатдезаминаза (которая модулирует рост и развитие растений; Safronova et al., 2006) и производство летучих веществ в качестве потенциальных сигнальных молекул (Ryu et al., 2003).
У млекопитающих пирролохинолинхинон (PQQ) действует как мощный фактор роста, хотя его биологические функции полностью не изучены (Smidt et al., 1991; Steinberg et al., 1994). PQQ вызывает значительный интерес из-за его присутствия в широком спектре пищевых продуктов и его замечательных антиоксидантных свойств (Smidt et al. , 1991; Kumazawa et al., 1995; Mitchell et al., 1999; He et al., 2003). PQQ обнаруживается в тканях растений и животных в диапазоне от нанограмма до грамма, хотя сами растения и животные не производят PQQ (Kumazawa et al., 1992, 1995). PQQ растворим в воде, термостабилен и способен выполнять окислительно-восстановительные циклы (Stites et al., 2000). Сообщалось, что PQQ действует как поглотитель активных форм кислорода (АФК), напрямую нейтрализуя активные формы в Escherichia coli (Misra et al., 2004). PQQ действует как нековалентно связанный окислительно-восстановительный кофактор некоторых бактериальных дегидрогеназ, включая метанолдегидрогеназу и Glc-дегидрогеназу (GDH; Duine et al., 1990; Stites et al., 2000). GDH представляет собой хинопротеин, который использует PQQ в качестве кофактора и участвует в периплазматическом окислении Glc до глюконовой кислоты, что приводит к солюбилизации плохо растворимого фосфата кальция (Babu-Khan et al., 1995). У млекопитающих пикомолярные количества PQQ усиливают активность синтеза ДНК в фибробластах человека и проявляют активность, индуцирующую фактор роста нервов (Naito et al.
, 1991; Kumazawa et al., 1995; Mitchell et al., 1999; He et al., 2003). PQQ обнаруживается в тканях растений и животных в диапазоне от нанограмма до грамма, хотя сами растения и животные не производят PQQ (Kumazawa et al., 1992, 1995). PQQ растворим в воде, термостабилен и способен выполнять окислительно-восстановительные циклы (Stites et al., 2000). Сообщалось, что PQQ действует как поглотитель активных форм кислорода (АФК), напрямую нейтрализуя активные формы в Escherichia coli (Misra et al., 2004). PQQ действует как нековалентно связанный окислительно-восстановительный кофактор некоторых бактериальных дегидрогеназ, включая метанолдегидрогеназу и Glc-дегидрогеназу (GDH; Duine et al., 1990; Stites et al., 2000). GDH представляет собой хинопротеин, который использует PQQ в качестве кофактора и участвует в периплазматическом окислении Glc до глюконовой кислоты, что приводит к солюбилизации плохо растворимого фосфата кальция (Babu-Khan et al., 1995). У млекопитающих пикомолярные количества PQQ усиливают активность синтеза ДНК в фибробластах человека и проявляют активность, индуцирующую фактор роста нервов (Naito et al. , 1993; Yamaguchi et al., 1993). Рацион с дефицитом PQQ ухудшает рост, вызывает иммунологические дефекты и снижает фертильность у мышей (Killgore et al., 1989; Steinberg et al., 1994). Недавно было предложено, чтобы PQQ действовал как витамин у млекопитающих, после идентификации первого потенциального эукариотического PQQ-зависимого фермента (Kasahara and Kato, 2003).Тем не менее, эта идея остается спорная, и неизвестно, влияет ли PQQ развития растений и рост в естественных условиях.
, 1993; Yamaguchi et al., 1993). Рацион с дефицитом PQQ ухудшает рост, вызывает иммунологические дефекты и снижает фертильность у мышей (Killgore et al., 1989; Steinberg et al., 1994). Недавно было предложено, чтобы PQQ действовал как витамин у млекопитающих, после идентификации первого потенциального эукариотического PQQ-зависимого фермента (Kasahara and Kato, 2003).Тем не менее, эта идея остается спорная, и неизвестно, влияет ли PQQ развития растений и рост в естественных условиях.
Биохимические пути биосинтеза PQQ до конца не изучены, но известно, что Glu и Tyr являются предшественниками (Houck et al., 1991; Unkefer et al., 1995). Гены, участвующие в биосинтезе PQQ, были идентифицированы у различных бактерий, включая Acinetobacter calcoaceticus (Goosen et al., 1989), Methylobacterium extorquens AM1 (Toyama et al., 1997), Klebsiella pneumoniae (Meulenberg et al., 1992), Gluconobacter oxydans (Felder et al., 2000) и Pseudomonas fluorescens CHA0 (Schnider et al. , 1991). Гены pqqABCDEF консервативны у бактерий, но биохимические функции кодируемых белков в значительной степени неясны. Недавно сообщалось, что PqqC является последним катализатором при производстве PQQ (Magnusson et al., 2004).
, 1991). Гены pqqABCDEF консервативны у бактерий, но биохимические функции кодируемых белков в значительной степени неясны. Недавно сообщалось, что PqqC является последним катализатором при производстве PQQ (Magnusson et al., 2004).
Мы изучили стимулирование роста растений P.fluorescens B16, который был выделен из корней злаковых растений. B16 дикого типа колонизирует корни различных растений и продуцирует антибактериальное соединение, которое эффективно против патогенов корней растений, таких как Agrobacterium tumefaciens и Ralstonia solanacearum (Kang and Park, 1997; Kim et al., 1998; Kim и др., 2003). Этот организм также значительно способствует росту огурца ( Cucumis sativus ) и ячменя ( Hordeum vulgare ) в тепличных и полевых условиях (Kim et al., 1998). Однако механизм стимуляции роста растений этим штаммом неизвестен. В этом исследовании мы сообщаем, что PQQ, синтезируемый P. fluorescens B16, является ключевым фактором, участвующим в стимулировании роста томатов ( Solanum lycopersicum ), огурцов, арабидопсиса ( Arabidopsis thaliana ) и острого перца ( Capsicum annuum. ). Кроме того, мы сообщаем о четырех ранее не идентифицированных генах pqq и демонстрируем, что экспрессия генов pqq регулируется активатором транскрипции, PqqH.В этой статье сообщается, что PQQ способствует росту растений in vivo.
). Кроме того, мы сообщаем о четырех ранее не идентифицированных генах pqq и демонстрируем, что экспрессия генов pqq регулируется активатором транскрипции, PqqH.В этой статье сообщается, что PQQ способствует росту растений in vivo.
РЕЗУЛЬТАТЫ
Выделение мутанта, нарушающего стимуляцию роста растений
После случайного мутагенеза P. fluorescens B16 с помощью ΩKm мутант K818 был выделен из 2000 прототрофных колоний из-за его неспособности стимулировать рост сорта томата «Kwangsoo» в системе минеральной ваты. Высоту растений томата измеряли каждые 3 дня до 27 дней после обработки растений томата на стадии четырех или пяти листьев K818 или B16 дикого типа.Мутант K818 не способствовал росту томатов, тогда как высота растений, обработанных B16, увеличивалась примерно на 25% через 27 дней после обработки (рис. 1). Чтобы определить, способен ли K818 колонизировать корни томатов, были исследованы популяции бактерий на корнях. Колонизирующие популяции B16 и мутантного штамма K818 на корнях составляли 5,2 × 10 5 и 5,3 × 10 5 колониеобразующих единиц (КОЕ) г -1 корней, соответственно, что указывает на то, что растение не способствует росту растений. мутант K818 обладает такой же активностью по колонизации корней, что и B16 дикого типа.
Колонизирующие популяции B16 и мутантного штамма K818 на корнях составляли 5,2 × 10 5 и 5,3 × 10 5 колониеобразующих единиц (КОЕ) г -1 корней, соответственно, что указывает на то, что растение не способствует росту растений. мутант K818 обладает такой же активностью по колонизации корней, что и B16 дикого типа.
Стимулирование роста растений томата после обработки диким типом P. fluorescens B16, мутантом K818 и K818, несущим pOK40. Высота растений томатов регистрировалась с 3-х дневными интервалами до 31 дня после инокуляции. Значения представляют собой средние значения трех повторов на эксперимент, объединенные из трех экспериментов. Вертикальные полосы обозначают sds.
Идентификация генов, ответственных за рост растений
Для идентификации генов, которые обеспечивают стимуляцию роста растений в B16 дикого типа, область ДНК, фланкирующая вставку ΩKm в мутанте K818, была выделена путем самолигирования хромосомной ДНК, расщепленной Eco RI. Восстановленная плазмида pOK8 имела вставку размером 5,8 т.п.н., а фрагмент Pst I размером 2,8 т.п.н. из pOK8 был субклонирован в pBluescriptII SK +, в результате чего была получена pOK12. Анализ последовательностей ДНК фланкирующих областей от pOK12 показал, что элемент ΩKm в мутанте K818 был вставлен в ген, гомологичный регулятору транскрипции LysR-типа P. fluorescens Pf0-1 (таблицы I и II; рис. 2). Космидный клон pOK40, охватывающий фланкирующие области гена, разрушенного в K818, был выделен из геномной библиотеки B16 дикого типа путем гибридизации колоний с использованием 1.8 kb Hin dIII / Pst I фрагмент pOK12 в качестве зонда (рис. 2). Когда pOK40 была мобилизована в мутант K818, эффект стимуляции роста растений восстановился до эффекта B16 дикого типа (рис. 1).
Восстановленная плазмида pOK8 имела вставку размером 5,8 т.п.н., а фрагмент Pst I размером 2,8 т.п.н. из pOK8 был субклонирован в pBluescriptII SK +, в результате чего была получена pOK12. Анализ последовательностей ДНК фланкирующих областей от pOK12 показал, что элемент ΩKm в мутанте K818 был вставлен в ген, гомологичный регулятору транскрипции LysR-типа P. fluorescens Pf0-1 (таблицы I и II; рис. 2). Космидный клон pOK40, охватывающий фланкирующие области гена, разрушенного в K818, был выделен из геномной библиотеки B16 дикого типа путем гибридизации колоний с использованием 1.8 kb Hin dIII / Pst I фрагмент pOK12 в качестве зонда (рис. 2). Когда pOK40 была мобилизована в мутант K818, эффект стимуляции роста растений восстановился до эффекта B16 дикого типа (рис. 1).
Бактериальные штаммы и плазмиды
Amp r , устойчивость к ампициллину; Cm r , устойчивость к хлорамфениколу; Km r , устойчивость к канамицину; Nal r , устойчивость к налидиксовой кислоте; Rif r , устойчивость к рифампицину; Sm r , устойчивость к стрептомицину; Sp r , устойчивость к спектиномицину; Tet r , устойчивость к тетрациклину.
Аннотация генов P. fluorescens B16, кодирующих белки Pqq
Рисунок 2.Организация генов pqqABCDEFHIJKM . Белые стрелки указывают положение и ориентацию генов биосинтеза PQQ. Вертикальные полосы на картах указывают положения и ориентации вставок Tn 3 — gusA , и основные фенотипы мутантов представлены под рестрикционной картой. Вертикальная полоса с черным кружком указывает положение вставки ΩKm в мутантном штамме K818.Вертикальная полоса с черным треугольником указывает положение вставки кассеты Ω. B, Bam HI; E, Eco RI; H, Hin dIII.
Была построена карта рестрикционного фермента вставки pOK40 размером 25 т.п.н. (фиг. 2). Чтобы дополнительно охарактеризовать вставку, мы мутагенизировали pOK40 и pOK53, которые содержат фрагмент HI Bam HI размером 13,4 т.п.н. из pOK40 в pLAFR3, с Tn 3 — gusA , с последующим обменом маркера на B16 дикого типа.Мы идентифицировали 12 Tn 3 — вставок gusA , которые мешают стимулированию роста растений, очерчивая важные области для этой функции (Рис. 2). Фрагмент Bam HI размером 13,4 т.п.н. из pOK40 был субклонирован в pBluescriptII SK +, что привело к pOK51, для секвенирования ДНК. Последовательность фрагмента содержит 11 потенциальных открытых рамок считывания (ORF), которые получили названия pqqA , B , C , D , E , F , H , I , J , K и M , поскольку вставки Tn 3 — gusA в каждой ORF отменили производство PQQ (рис.2). Гены pqqA , B , C , D , E , F и M демонстрируют сильное сходство с генами штамма P. fluorescens Pf0-1 (Таблица II; Рис. . 3). Белки PqqH и I из P. fluorescens B16 очень похожи на регулятор транскрипции LysR-типа и аминотрансферазу класса III, присутствующие перед кластером генов pqq в P. fluorescens Pf0-1, соответственно (Таблица II ).Предполагается, что pqqJ кодирует белок массой 13,6 кДа, проявляющий 53% идентичности и 68% сходства с предполагаемым цитоплазматическим белком из Salmonella enterica sp.
2). Фрагмент Bam HI размером 13,4 т.п.н. из pOK40 был субклонирован в pBluescriptII SK +, что привело к pOK51, для секвенирования ДНК. Последовательность фрагмента содержит 11 потенциальных открытых рамок считывания (ORF), которые получили названия pqqA , B , C , D , E , F , H , I , J , K и M , поскольку вставки Tn 3 — gusA в каждой ORF отменили производство PQQ (рис.2). Гены pqqA , B , C , D , E , F и M демонстрируют сильное сходство с генами штамма P. fluorescens Pf0-1 (Таблица II; Рис. . 3). Белки PqqH и I из P. fluorescens B16 очень похожи на регулятор транскрипции LysR-типа и аминотрансферазу класса III, присутствующие перед кластером генов pqq в P. fluorescens Pf0-1, соответственно (Таблица II ).Предполагается, что pqqJ кодирует белок массой 13,6 кДа, проявляющий 53% идентичности и 68% сходства с предполагаемым цитоплазматическим белком из Salmonella enterica sp. enterica серовар Choleraesuis str. SC-B67 (Таблица II). Предполагается, что PqqK представляет собой белок с массой 11,6 кДа, который подобен ДНК-связывающему белку Sinorhizobium meliloti 1021 (таблица II).
enterica серовар Choleraesuis str. SC-B67 (Таблица II). Предполагается, что PqqK представляет собой белок с массой 11,6 кДа, который подобен ДНК-связывающему белку Sinorhizobium meliloti 1021 (таблица II).
Сравнение кластеров генов pqq из P. fluorescens B16 с кластерами из P.fluorescens Pf0-1, Klebsiella pneumoniae , Acinetobacter calcoaceticus , Gluconobacter oxydans ATCC9937 и Methylobacterium extorquens AM1. Положения и ориентации генов pqq показаны белыми и цветными стрелками. Те же цвета представляют гомологичные кодируемые белки. Организация и размер генов изображены на основе данных нуклеотидных последовательностей из GenBank. Были использованы следующие гены: P. fluorescens Pf0-1 (номер доступа в GenBank.CP000094), K. pneumoniae (X58778), A. calcoaceticus (от P07778 до P07783), G. oxydans ATCC9937 (AJ277117), PqqAB из M. extorquens AM1 (L25889), PqEq из AM1 (L25889), PqEq из M. extorquens AM1 (U72662) и PqqFG из M. extorquens AM1 (L43135).
extorquens AM1 (L25889), PqEq из AM1 (L25889), PqEq из M. extorquens AM1 (U72662) и PqqFG из M. extorquens AM1 (L43135).
Экспрессия генов
pqq PqqH-зависимым образом в условиях ограничения питательных веществ Чтобы определить, как гены pqq P.fluorescens B16, мы проанализировали их уровни экспрессии с использованием слитых мутантов pqq ∷Tn 3 — gusA , выращенных в среде Лурия-Бертани (LB) или минимальной среде Agrobacterium (AB). Ни один из генов pqq не экспрессировался на высоких уровнях в среде LB, но каждый из них экспрессировался более сильно в среде AB (таблица III). Этот результат указывает на то, что гены pqq экспрессируются только в условиях ограничения питательных веществ. Поскольку PqqH проявляет сходство с регулятором транскрипции, мы оценили, влияет ли PqqH на экспрессию других генов pqq , построив слияния Tn 3 — gusA каждого гена pqq в мутанте BK1 pqqH ∷Ω. Уровни экспрессии генов pqq были значительно ниже у мутанта BK1 pqqH andΩ и восстанавливались путем предоставления pOK59, несущего pqqH в транс (Таблица III), что указывает на то, что PqqH является активатором транскрипции в экспрессии гена pqq . Уровень экспрессии pqqA был выше, чем у других генов pqq , и на него в меньшей степени влиял PqqH (Таблица III).
Уровни экспрессии генов pqq были значительно ниже у мутанта BK1 pqqH andΩ и восстанавливались путем предоставления pOK59, несущего pqqH в транс (Таблица III), что указывает на то, что PqqH является активатором транскрипции в экспрессии гена pqq . Уровень экспрессии pqqA был выше, чем у других генов pqq , и на него в меньшей степени влиял PqqH (Таблица III).
Экспрессия генов pqqABCDEFHIJM в среде LB или AB
Бактериальные клетки выращивали в течение 12 часов.Одна единица GUS была определена как 1 нмоль 4-метиллумбеллиферона, высвобождаемого одной бактерией в минуту. Все значения представляют собой средние значения ± стандартное отклонение значений из трех экспериментов. -, Не определено.
Содействие росту растений томата в системе гидропонного культивирования
Поскольку B16 дикого типа стимулировал рост растений томатов в системе минеральной ваты, мы проверили, может ли он способствовать росту растений томатов в системе гидропонного культивирования. В этой системе B16 дикого типа увеличивал высоту растений на 19.8% и количество цветков на 42%, как измерено через 65 дней после обработки (рис. 4). Кроме того, обработка B16 увеличивала количество плодов и общий вес плодов после окончательного сбора урожая на 41% и 36% соответственно (рис. 4). Как и ожидалось, мутант K818 не способствовал стимулированию роста, а K818, несущий pOK40, действительно стимулировал рост (фиг. 4). Мы повторили исследование роста растений томатов в системе гидропонной культуры дважды в течение 2 лет и получили очень похожие результаты; поэтому на Рисунке 4 представлены данные только за 1 год.Эти результаты показывают, что стимуляция роста растений томата с помощью B16 дикого типа может быть достигнута в системе гидропонного культивирования.
В этой системе B16 дикого типа увеличивал высоту растений на 19.8% и количество цветков на 42%, как измерено через 65 дней после обработки (рис. 4). Кроме того, обработка B16 увеличивала количество плодов и общий вес плодов после окончательного сбора урожая на 41% и 36% соответственно (рис. 4). Как и ожидалось, мутант K818 не способствовал стимулированию роста, а K818, несущий pOK40, действительно стимулировал рост (фиг. 4). Мы повторили исследование роста растений томатов в системе гидропонной культуры дважды в течение 2 лет и получили очень похожие результаты; поэтому на Рисунке 4 представлены данные только за 1 год.Эти результаты показывают, что стимуляция роста растений томата с помощью B16 дикого типа может быть достигнута в системе гидропонного культивирования.
Влияние P. fluorescens B16 дикого типа и мутанта K818 на рост и урожай томатов в гидропонной культуре в 2002 г. A, Высота. B, количество цветов. C. Количество плодов семи урожаев. D, Общий вес плодов за один урожай. Вертикальные полосы обозначают SD. Данные представляют собой среднее значение трех повторностей (три растения в повторении) для каждой обработки.Различные буквы указывают на существенные различия между обработками в соответствии с защищенным тестом LSD Фишера ( P = 0,05).
Вертикальные полосы обозначают SD. Данные представляют собой среднее значение трех повторностей (три растения в повторении) для каждой обработки.Различные буквы указывают на существенные различия между обработками в соответствии с защищенным тестом LSD Фишера ( P = 0,05).
PQQ — ключевой элемент стимулирования роста растений
Основываясь на том факте, что мутации в генах pqq отменяют стимулирующую рост растений активность B16 дикого типа, мы исследовали, продуцирует ли штамм PQQ, анализируя супернатанты культур с помощью обращенно-фазовой (RP) -HPLC. PQQ был обнаружен как 5-ацетонил-PQQ при сравнении со временем элюирования синтетического PQQ и 5-ацетонил-PQQ на хроматограммах RP-HPLC (рис.5Б). Анализ масс-спектрометрии (МС) с ионизацией электрораспылением (ESI) фракции пиков, соответствующей 5-ацетонил-PQQ, из фильтрата культуры B16 и стандарта выявил ионы [MH] — при отношении массы к заряду 387 (рис. ).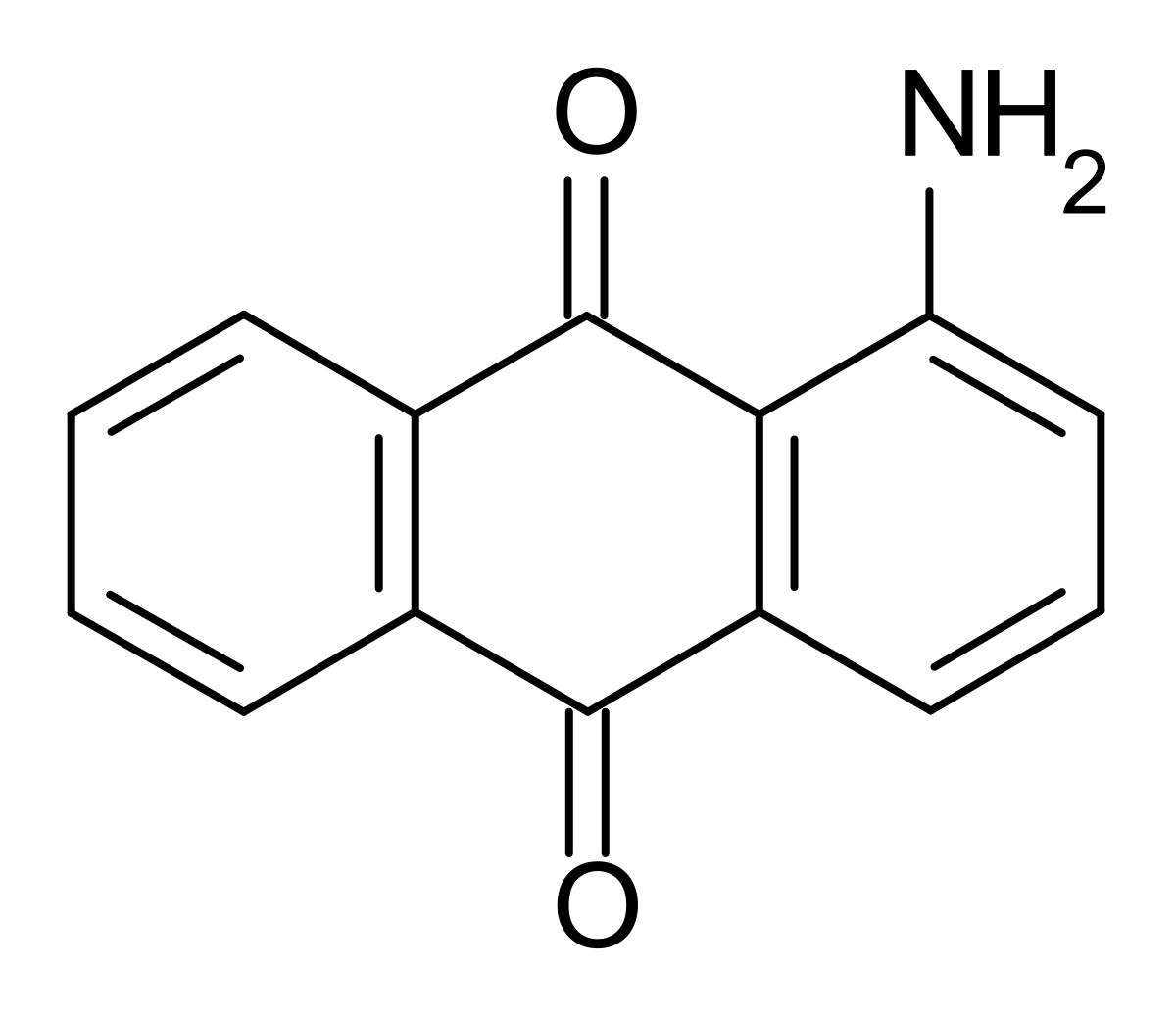 Этот результат подтвердил, что B16 дикого типа продуцирует PQQ in vitro. Ни один из мутантов, дефектных в стимуляции роста растений, не продуцировал PQQ, а pOK53, несущий все гены pqq , обеспечивал продукцию PQQ у мутантов (один пример показан на рис.5Б).
Этот результат подтвердил, что B16 дикого типа продуцирует PQQ in vitro. Ни один из мутантов, дефектных в стимуляции роста растений, не продуцировал PQQ, а pOK53, несущий все гены pqq , обеспечивал продукцию PQQ у мутантов (один пример показан на рис.5Б).
Анализ PQQ, синтезированного штаммом дикого типа P. fluorescens B16 и мутантом BK433 с дефицитом PQQ. A, Структура PQQ и 5-ацетонил-PQQ (PQQ, дериватизированный ацетоном). B: определение PQQ и 5-ацетонил-PQQ с помощью ВЭЖХ. Стрелки указывают 5-ацетонил-PQQ. C, ESI-MS в отрицательном режиме 5-ацетонил-PQQ из синтетического PQQ и очищенного PQQ из штамма B16 дикого типа.
Чтобы подтвердить, что PQQ способствует росту растений, синтетический PQQ применяли к прорастающим проросткам огурца сорта «Eunsungbagdadagi», поскольку сеянцы томатов плохо росли на среде Мурасиге и Скуга или в песке.Использовали концентрации синтетического PQQ от 0 до 1000 нм. Значительное увеличение сырой массы наблюдали у проростков огурцов, растущих на среде Мурашиге и Скуга, которые были обработаны концентрациями PQQ> 100 нМ (фиг. 6А). Сеянцы огурца, растущие в песке, обработанном синтетическим PQQ, показали значительно больший вес в свежем виде, чем саженцы, растущие в среде Мурасиге и Скуга (рис. 6В). Обработка 50, 100 или 1000 нм PQQ увеличивала сырую массу проростков огурцов, растущих в песке, на 18.4%, 17,1% и 23,9% соответственно (рис. 6). Чтобы определить, способствует ли PQQ росту различных растений, синтетический PQQ применяли к прорастающим проросткам Arabidopsis экотипа Columbia и сорта острого перца «Bukang» на среде Мурасиге и Скуга. Вес в свежем и сухом виде Arabidopsis и размер семядолей острого перца, обработанных 25 нм PQQ, были увеличены (данные не показаны).
6А). Сеянцы огурца, растущие в песке, обработанном синтетическим PQQ, показали значительно больший вес в свежем виде, чем саженцы, растущие в среде Мурасиге и Скуга (рис. 6В). Обработка 50, 100 или 1000 нм PQQ увеличивала сырую массу проростков огурцов, растущих в песке, на 18.4%, 17,1% и 23,9% соответственно (рис. 6). Чтобы определить, способствует ли PQQ росту различных растений, синтетический PQQ применяли к прорастающим проросткам Arabidopsis экотипа Columbia и сорта острого перца «Bukang» на среде Мурасиге и Скуга. Вес в свежем и сухом виде Arabidopsis и размер семядолей острого перца, обработанных 25 нм PQQ, были увеличены (данные не показаны).
Стимуляция роста огурца, обработанного синтетическим PQQ. Показаны растения огурцов, выращенные на среде Мурашиге и Скуга (A) или песке (B), содержащей 5, 50, 100 или 1000 нм PQQ.C. Свежий вес огурца, обработанного синтетическим PQQ в экспериментах A и B, описанных выше. Фотографии были сделаны через 13 дней после пересадки. Все значения являются средними из трех экспериментов. Значения на графике, за которыми следует одна и та же буква, существенно не различаются в соответствии с защищенным тестом lsd Фишера ( P = 0,05). Штанга = 5 см.
Все значения являются средними из трех экспериментов. Значения на графике, за которыми следует одна и та же буква, существенно не различаются в соответствии с защищенным тестом lsd Фишера ( P = 0,05). Штанга = 5 см.
PQQ удаляет АФК и H
2 O 2 в листьях огурца Чтобы определить возможные биохимические механизмы, участвующие в стимулировании роста растений с помощью PQQ, мы оценили способность B16 и PQQ дикого типа in planta поглощать АФК и перекись водорода (H 2 O 2 ) с использованием нитросинего тетразолия (NBT ) и диаминобензидином (DAB) соответственно.Поврежденные листовые диски сорта огурца «Eunsungbagdadagi», обработанные PQQ-дефицитным мутантным штаммом BK433 или водой, явно показали более высокую продукцию ROS, чем листовые диски из растений, обработанных B16 дикого типа (фиг. 7A). Отложение синего формазана, свидетельствующее о продукции АФК в листовых дисках, уменьшалось, когда концентрация PQQ превышала 100 нм (фиг. 7A). Раненые листовые диски окрашивали DAB, чтобы определить местонахождение H 2 O 2 , и меньше H 2 O 2 накопление наблюдалось в листовых дисках, обработанных диким типом B16, чем с PQQ-дефицитным мутантом BK433 или водой. (Рис.7Б). Окрашивание было намного менее интенсивным после обработки 100 или 1000 нм синтетическим PQQ, чем после водной обработки, что позволяет предположить, что PQQ эффективно поглощал H 2 O 2 в поврежденных листьях огурца.
7A). Раненые листовые диски окрашивали DAB, чтобы определить местонахождение H 2 O 2 , и меньше H 2 O 2 накопление наблюдалось в листовых дисках, обработанных диким типом B16, чем с PQQ-дефицитным мутантом BK433 или водой. (Рис.7Б). Окрашивание было намного менее интенсивным после обработки 100 или 1000 нм синтетическим PQQ, чем после водной обработки, что позволяет предположить, что PQQ эффективно поглощал H 2 O 2 в поврежденных листьях огурца.
Обнаружение под микроскопом ROS (A) и H 2 O 2 (B) в дисках листьев огурца. Листовые диски обрабатывали водой (а), B16 дикого типа (b), PQQ-дефицитным мутантным штаммом BK433 (c), 10 нм PQQ (d), 100 нм PQQ (e) или 1000 нм PQQ (f). На вставках показаны целые листовые диски, окрашенные NBT (A) или DAB (B).Третьи листья проростков огурцов окрашивали NBT или DAB через 7 дней после инокуляции бактериями. Для каждой обработки использовали восемь листовых дисков. Синий цвет указывает на образование нерастворимых отложений формазана, которые образуются, когда NBT реагирует с ROS. Темно-коричневый цвет получается в результате реакции DAB с H 2 O 2 . Эксперимент был повторен трижды с устойчивыми результатами. Бар = 200 мкм м.
Синий цвет указывает на образование нерастворимых отложений формазана, которые образуются, когда NBT реагирует с ROS. Темно-коричневый цвет получается в результате реакции DAB с H 2 O 2 . Эксперимент был повторен трижды с устойчивыми результатами. Бар = 200 мкм м.
Чтобы определить, влияет ли PQQ на активность антиоксидантных ферментов, таких как супероксиддисмутаза (SOD), аскорбатпероксидаза (APX) и каталаза, экстракты листьев огурца, обработанные синтетическим PQQ, штамм дикого типа B16 или штамм-мутант с дефицитом PQQ BK433 исследовали с использованием методов активного окрашивания в нативном PAGE.Не было обнаружено различий в активности SOD, APX или каталазы между обработками (данные не показаны).
Солюбилизация минерального фосфата
Для определения активности солюбилизации минерального фосфата (MPS) B16 дикого типа и мутантов pqq ∷Tn 3 — gusA , мы провели анализ MPS на чашках с минимальной средой Glc с агаром, содержащим трикальцийфосфат (TCP). Как B16 дикого типа, так и все мутанты pqq ∷Tn 3 — gusA показали очень низкую активность MPS без значительных различий (данные не показаны).
Как B16 дикого типа, так и все мутанты pqq ∷Tn 3 — gusA показали очень низкую активность MPS без значительных различий (данные не показаны).
ОБСУЖДЕНИЕ
Содействие росту растений от PGPR привлекло внимание по академическим и практическим причинам, потому что полезные взаимодействия между PGPR и растениями открывают огромный потенциал для применения в полевых условиях. Чтобы быть эффективным PGPR, организм должен иметь возможность колонизировать корни, потому что организму необходимо закрепиться в ризосфере при плотности популяции, достаточной для получения положительного эффекта. Таким образом, предыдущие неудачи в исследованиях стимулирования роста растений в полевых условиях часто коррелировали с плохой корневой колонизацией (Bloemberg and Lutenberg, 2001).Мы обнаружили, что мутант K818 с дефицитом стимуляции роста растений сохранял способность колонизировать корни, что позволяет предположить, что для стимуляции роста растений необходимы дополнительные факторы, помимо колонизации корней. Этот результат позволил нам идентифицировать новый фактор стимуляции роста растений, PQQ, из P. fluorescens B16.
Этот результат позволил нам идентифицировать новый фактор стимуляции роста растений, PQQ, из P. fluorescens B16.
В этом исследовании мы идентифицировали четыре ранее не идентифицированных гена pqq . Неясно, как эти гены участвуют в биохимических путях биосинтеза PQQ.Были предложены возможные пути биосинтеза PQQ, начинающиеся с остатков Tyr и Glu, поскольку небольшой пептид PqqA содержит остатки Glu и Tyr в консервативных положениях (Houck et al., 1991). Если это так, PqqA может быть предшественником в биосинтезе PQQ, что потребовало бы его синтеза в стехиометрических количествах, а не каталитических количествах других белков Pqq, участвующих в биосинтезе PQQ. Это подтверждается тем фактом, что экспрессия pqqA выше, чем экспрессия других генов pqq .Экспрессия генов pqq зависела от PqqH, который очень похож на регулятор LysR-типа, но из этого исследования мы не знаем, нужен ли PqqH коиндуктор, как и другим регуляторам LysR-типа. Предполагается, что PqqK является ДНК-связывающим белком, но его биохимическая роль еще предстоит выяснить.
Предполагается, что PqqK является ДНК-связывающим белком, но его биохимическая роль еще предстоит выяснить.
Тот факт, что экспрессия генов pqq регулируется PqqH в условиях ограничения питательных веществ, согласуется с другими сообщениями о том, что PGPR часто эффективны в условиях с низким содержанием питательных веществ и оказывают незначительное влияние или не оказывают никакого измеримого воздействия на рост растений, когда растения выращивают. в богатой питательными веществами почве в оптимальных условиях (Penrose and Glick, 2003).Этот результат также объясняет, почему и B16 дикого типа, и PQQ эффективно способствуют росту растений на минеральной вате, системе гидропонного культивирования и в песке. Наши результаты показывают, что уровень питательности почвы имеет решающее значение для отбора кандидатов PGPR.
Сообщается некоторая информация о биохимических функциях PQQ. Известно, что PQQ является кофактором аминоадипической 6-полуальдегид-дегидрогеназы (U26), которая участвует в деградации Lys у мышей. Многочисленные исследования показали, что PGPR способен солюбилизировать неорганические и / или органические фосфаты в почве после образования холофермента GDH-PQQ (Liu et al., 1992). Однако тот факт, что мутанты B16 дикого типа и pqq ∷Tn 3 — gusA проявляли очень низкую и примерно одинаковую активность MPS, предполагает, что PQQ играет не только роль кофактора PQQ-зависимого дегидрогеназа для стимуляции роста растений.
Многочисленные исследования показали, что PGPR способен солюбилизировать неорганические и / или органические фосфаты в почве после образования холофермента GDH-PQQ (Liu et al., 1992). Однако тот факт, что мутанты B16 дикого типа и pqq ∷Tn 3 — gusA проявляли очень низкую и примерно одинаковую активность MPS, предполагает, что PQQ играет не только роль кофактора PQQ-зависимого дегидрогеназа для стимуляции роста растений.
Кроме того, PQQ действует как антиоксидант в клетках животных, предотвращая повреждение клеток (Smidt et al., 1991). Клетки E. coli , синтезирующие PQQ, показали повышенную экспрессию антиоксидантных ферментов, таких как каталаза и SOD, что обеспечивает высокий уровень защиты клеток от фотодинамически продуцируемых ROS (Khairnar et al., 2003). Также было сообщение, что PQQ действует как поглотитель ROS, напрямую нейтрализуя реактивные виды, тем самым защищая бактериальные клетки от окислительного стресса (Misra et al. , 2004). Прямое удаление ROS с помощью PQQ в листьях огурца, в отличие от PQQ, усиливающего активность антиоксидантных ферментов, как это наблюдается у бактерий и крыс, может быть усилено молекулярно-биологическими средствами, которые могут поддержать наши данные анализа дисков листьев, полученные путем окрашивания. Однако никаких маркеров молекулярных генов, связанных с генами антиоксидантных ферментов огурца, для использования в Нозерн-блот-анализе не было.Тем не менее, наши результаты согласуются с PQQ, непосредственно поглощающим супероксид (Urakami et al., 1997). Кроме того, PQQ может служить прямым акцептором электронов в реакциях с активными формами азота, таким образом защищая нейроны от токсичности пероксинитрита в нейронах переднего мозга крысы во время культивирования (Zhang and Rosenberg, 2002).
, 2004). Прямое удаление ROS с помощью PQQ в листьях огурца, в отличие от PQQ, усиливающего активность антиоксидантных ферментов, как это наблюдается у бактерий и крыс, может быть усилено молекулярно-биологическими средствами, которые могут поддержать наши данные анализа дисков листьев, полученные путем окрашивания. Однако никаких маркеров молекулярных генов, связанных с генами антиоксидантных ферментов огурца, для использования в Нозерн-блот-анализе не было.Тем не менее, наши результаты согласуются с PQQ, непосредственно поглощающим супероксид (Urakami et al., 1997). Кроме того, PQQ может служить прямым акцептором электронов в реакциях с активными формами азота, таким образом защищая нейроны от токсичности пероксинитрита в нейронах переднего мозга крысы во время культивирования (Zhang and Rosenberg, 2002).
PQQ как минимум в 100 раз более эффективен, чем аскорбиновая кислота, изофлавоноиды и полифенольные соединения в анализах, оценивающих потенциалы окислительно-восстановительного цикла (Stites et al. , 2000). В дополнение к улавливанию супероксида, PQQ может также улавливать другие токсичные свободные радикалы, как и витамин E, β -каротин и каротиноиды, витамин C, флавоноиды, конъюгированная линолевая кислота и фенольные соединения (McIntire, 1998). Следовательно, антиоксидант PQQ, вероятно, способствует стимулированию роста растений в очень низких концентрациях, продуцируемых штаммом B16 дикого типа.
, 2000). В дополнение к улавливанию супероксида, PQQ может также улавливать другие токсичные свободные радикалы, как и витамин E, β -каротин и каротиноиды, витамин C, флавоноиды, конъюгированная линолевая кислота и фенольные соединения (McIntire, 1998). Следовательно, антиоксидант PQQ, вероятно, способствует стимулированию роста растений в очень низких концентрациях, продуцируемых штаммом B16 дикого типа.
Было проведено несколько исследований функциональной роли PQQ в растениях. Известно, что PQQ стимулирует прорастание пыльцы in vitro у растений видов Lilium , Tulipa и Camellia (Xiong et al., 1988, 1990), но механизмы неясны. Это исследование доказывает, что PQQ является фактором стимулирования роста растений из-за его антиоксидантной активности. Таким образом, мы считаем, что биохимическая основа стимуляции роста растений, опосредованная PQQ, аналогична таковой у млекопитающих. Было бы целесообразно изучить широкий спектр PGPR для производства PQQ. Мы ожидаем, что многие PGPR продуцируют PQQ, который проливает свет на ранее неизвестные механизмы стимулирования роста растений. Как и у млекопитающих, PQQ имеет большой потенциал для использования в качестве фактора стимуляции роста растений.
Мы ожидаем, что многие PGPR продуцируют PQQ, который проливает свет на ранее неизвестные механизмы стимулирования роста растений. Как и у млекопитающих, PQQ имеет большой потенциал для использования в качестве фактора стимуляции роста растений.
МАТЕРИАЛЫ И МЕТОДЫ
Бактериальные штаммы и условия роста
Бактериальные штаммы и плазмиды, использованные в этом исследовании, перечислены в таблице I. Штаммы Escherichia coli культивировали на среде LB при 37 ° C. Pseudomonas fluorescens штамм B16 обычно культивировали при 28 ° C на среде LB или минимальной среде AB (0,3% K 2 HPO 4 , 0,1% NaH 2 PO 4 , 0,1% NH 4 Cl , 0.03% MgSO 4 · 7H 2 O, 0,015% KCl, 0,01% CaCl 2 · 2H 2 O, 0,00025% FeSO 4 · 7H 2 O, pH 7,0) с добавлением 0,2% Glc. Антибиотики использовали в следующих концентрациях: ампициллин 100 мкг мкг / мл -1 ; хлорамфеникол, 34 мкл мкг / мл -1 ; гентамицин, 50 мкг мкг / мл -1 ; канамицин, 50 мкг мкг / мл -1 ; налидиксовая кислота, 20 мк г / мл -1 ; рифампицин, 50 мкг мкг / мл -1 ; спектиномицин, 50 мкг мкг / мл -1 ; и тетрациклин, 50 мкг мкг / мл -1 .
Манипуляции с ДНК и мутагенез транспозонов
Стандартные методы использовали для клонирования ДНК, рестрикционного картирования и гель-электрофореза, как описано Sambrook et al. (1989). Самоубийственная плазмида pJFF350 (Fellay et al., 1989) была использована для создания вставок транспозона в хромосому штамма B16. Поскольку элемент ΩKm несет точку начала репликации и не содержит сайт Eco RI, 1 мкл г полной геномной ДНК мутантов было расщеплено Eco RI, самолигировано и трансформировано в E.coli DH5 α с последующим отбором на агаровой среде LB, содержащей канамицин, для спасения области, фланкирующей вставку. Фланкирующую область секвенировали с помощью праймера HR (5′-TGCTTCAATCAATCACCGG-3 ‘). pOK40 и pOK53, которые несут все гены биосинтеза PQQ, были мутагенизированы Tn 3 — gusA , как описано Bonas et al. (1989). Сайт инсерции и ориентация Tn 3 — gusA в каждом мутанте были картированы анализом переваривания рестриктазой и прямым секвенированием плазмиды с использованием праймера Tn3gus (5′-CCGGTCATCTGAGACCATTAAAAGA-3 ‘), который позволяет секвенировать из Tn 3 — gusA последовательность. Для создания мутанта pqqH фрагмент Ω был вставлен в сайт Psh AI pOK40, который несет ген pqqH , с последующим клонированием в pRK415, что привело к pOK67. Мутагенизированные плазмиды, несущие вставки Tn 3 — gusA или фрагмент Ω, вводили индивидуально в родительский штамм B16 путем конъюгации и замены маркера в штамм B16 дикого типа, как описано (Fellay et al., 1989). Все замены маркеров подтверждали анализом гибридизации по Саузерну.
Для создания мутанта pqqH фрагмент Ω был вставлен в сайт Psh AI pOK40, который несет ген pqqH , с последующим клонированием в pRK415, что привело к pOK67. Мутагенизированные плазмиды, несущие вставки Tn 3 — gusA или фрагмент Ω, вводили индивидуально в родительский штамм B16 путем конъюгации и замены маркера в штамм B16 дикого типа, как описано (Fellay et al., 1989). Все замены маркеров подтверждали анализом гибридизации по Саузерну.
Секвенирование ДНК и анализ данных
Вставка размером 13,4 т.п.н. в pOK51, несущая все гены pqq , была расщеплена соответствующими рестрикционными ферментами и субклонирована в соответствующие сайты в pBluescriptII SK +. Фрагменты ДНК секвенировали с помощью набора терминаторов BigDye (Applied Biosystems) с универсальным и обратным праймерами. Синтетические грунтовки были разработаны для прогулок по грунтовке при необходимости. Последовательности ДНК были собраны, и ORF были идентифицированы с использованием подпрограммы SeqManII DNASTAR. Все потенциальные ORF размером более 249 п.н. были исследованы на предмет возможных сайтов связывания с рибосомами и аннотированы с использованием протоколов BLASTX и BLASTP (Altschul et al., 1990). Последовательности ДНК анализировали с использованием программы BLAST в Национальном центре биотехнологической информации (Gish and States, 1993), MEGALIGN (DNASTAR) и GENETYX-WIN (Software Development, Inc.).
Все потенциальные ORF размером более 249 п.н. были исследованы на предмет возможных сайтов связывания с рибосомами и аннотированы с использованием протоколов BLASTX и BLASTP (Altschul et al., 1990). Последовательности ДНК анализировали с использованием программы BLAST в Национальном центре биотехнологической информации (Gish and States, 1993), MEGALIGN (DNASTAR) и GENETYX-WIN (Software Development, Inc.).
Анализ GUS
Ферментный анализ GUS (Jefferson et al., 1987) был выполнен с некоторыми модификациями.Все штаммы P. fluorescens B16 выращивали в минимальной среде AB, содержащей 0,04% глюконовой кислоты, центрифугировали, ресуспендировали в буфере для экстракции GUS и лизировали обработкой ультразвуком с помощью ультразвукового устройства VCX-400 (Sonics and Materials, Inc.). Экстракт подвергали ферментному анализу GUS с 4-метилумбеллиферилглюкуронидом в качестве субстрата. Флуоресценцию измеряли при 365 нм для возбуждения и 460 нм для эмиссии на флуорометре TKO100 (Hoefer Scientific Instruments). Одна единица GUS была определена как 1 нмоль 4-метилумбеллиферона, высвобождаемого одной бактерией в минуту.
Одна единица GUS была определена как 1 нмоль 4-метилумбеллиферона, высвобождаемого одной бактерией в минуту.
Измерения стимулирования роста растений и колонизации корней
семян томата ( Solanum lycopersicum ‘Kwangsoo’) выращивали до стадии четырех или пяти листьев в пробках из минеральной ваты. Корневые системы проростков погружали на 1 час в бактериальные суспензии (10 8 КОЕ мл -1 ) для бактериализации, затем пересаживали в кубики минеральной ваты (10 × 10 × 7 см) и хранили в теплице при 25 ° C. ± 3 ° С. Раствор гидропонной культуры половинной концентрации (COSEAL) подавали два раза в неделю.Кубики минеральной ваты были расположены в случайном порядке. Повторные полевые испытания проводились в течение 2 лет в системе гидропонного культивирования (12,6 × 1,9 м). Испытания проводились при естественном освещении при температуре 25 ° C ± 3 ° C с декабря 2002 г. по апрель 2003 г. в течение первого года и с сентября 2003 г. по январь 2004 г. в течение второго года. Проростки томатов на стадии четырех или пяти листьев в пробках из минеральной ваты обрабатывали бактериальными суспензиями (10 8 КОЕ мл -1 ) и переносили в систему гидропонной культуры.Затем бактериальную суспензию (10 8 КОЕ мл -1 ) наносили на растения семь раз с 10-дневными интервалами после пересадки, чтобы обеспечить достаточное количество бактериальных клеток и убедиться, что размер бактериальной популяции не является ограничивающим фактором. . Раствор гидропонной культуры половинной концентрации подавали пять раз в день в течение 2 минут. Растения томатов выращивали 5 месяцев.
по январь 2004 г. в течение второго года. Проростки томатов на стадии четырех или пяти листьев в пробках из минеральной ваты обрабатывали бактериальными суспензиями (10 8 КОЕ мл -1 ) и переносили в систему гидропонной культуры.Затем бактериальную суспензию (10 8 КОЕ мл -1 ) наносили на растения семь раз с 10-дневными интервалами после пересадки, чтобы обеспечить достаточное количество бактериальных клеток и убедиться, что размер бактериальной популяции не является ограничивающим фактором. . Раствор гидропонной культуры половинной концентрации подавали пять раз в день в течение 2 минут. Растения томатов выращивали 5 месяцев.
Стимуляция роста растений оценивалась в двух различных условиях. В кубиках из минеральной ваты высоту растений томатов измеряли через 21 день после инокуляции.Образцы корней, собранные из кубиков минеральной ваты на 21 день, мацерировали в стерильной ступке с помощью пестика. Плотность популяции бактерий на корнях определяли путем подсчета в чашке для разведения. В системе гидропонного культивирования высоту, толщину, количество стеблей и количество цветков регистрировали с 7-дневными интервалами, а зрелые плоды томатов собирали семь раз.
В системе гидропонного культивирования высоту, толщину, количество стеблей и количество цветков регистрировали с 7-дневными интервалами, а зрелые плоды томатов собирали семь раз.
Анализ PQQ
Для измерения продукции PQQ бактерии выращивали в течение 48 ч при 28 ° C в минимальной среде AB, содержащей 0.4% глюконовая кислота. Один объем клеточной культуры разбавляли девятью объемами метанола и осажденные материалы удаляли центрифугированием. После выпаривания метанола картридж Sep-Pak C 18 (Waters) промывали 10 мл метанола, а затем 10 мл воды. Образец подкисляли HCl до pH 2,0 и загружали в картридж. После промывания 10 мл 2 мМ HCl PQQ элюировали 70% метанолом. Для определения пика PQQ 200 мкл л образца были смешаны с 100 мкл мкл 0.2 м Na 2 B 4 O 7 и доводили до pH 8,0 с помощью HCl и 90 мкл л 0,5% (об. / Об.) Ацетона. ОФ-ВЭЖХ выполняли с использованием системы ВЭЖХ Shimadzu LC-6A, как описано ранее (Van der Meer et al. , 1990), с детектором флуоресценции. Флуоресценцию контролировали при e x = 360 и e m = 480 нм. Колонку C 18 (внутренний диаметр 150 мм × 4,6 мм, размер частиц 5- мкм, мкм; Phenomenex) использовали для аналитического разделения.Фракции, соответствующие аддукту с ацетоном (5-ацетонил-PQQ), анализировали с помощью ESI-MS (JEOL).
, 1990), с детектором флуоресценции. Флуоресценцию контролировали при e x = 360 и e m = 480 нм. Колонку C 18 (внутренний диаметр 150 мм × 4,6 мм, размер частиц 5- мкм, мкм; Phenomenex) использовали для аналитического разделения.Фракции, соответствующие аддукту с ацетоном (5-ацетонил-PQQ), анализировали с помощью ESI-MS (JEOL).
Стимулирование роста растений с помощью Synthetic PQQ
Семена арабидопсиса ( Arabidopsis thaliana экотип Columbia), острого перца ( Capsicum annum ‘Bukang’) и огурца ( Cucumis sativus ‘Eunsungbagdadagi’) подвергали поверхностной стерилизации (70% этанола в течение 5 минут с последующим добавлением 1% натрия. гипохлорита в течение 15 мин), промыли 10 раз стерильной дистиллированной водой, поместили в чашки Петри, содержащие среду, состоящую из солей Мурашиге и Скуга половинной концентрации (Sigma), 0.4% агара и 3% Suc, и дали прорасти в течение 2 дней при 28 ° C. Стеклянные бутылки (8,5 × 16 см) были приготовлены со средой Мурашиге и Скуга половинной концентрации, содержащей 5, 50, 100 или 1000 нм синтетического PQQ (Sigma). Двухдневные проростки огурцов переносили в стеклянные бутылки. Проросшие проростки арабидопсиса и острого перца переносили в стеклянные бутылки со средой Мурашиге и Скуга половинной концентрации, содержащей 25 нм синтетического PQQ. В качестве контроля использовали воду. Стеклянные бутылки были расположены в случайном порядке.
Стеклянные бутылки (8,5 × 16 см) были приготовлены со средой Мурашиге и Скуга половинной концентрации, содержащей 5, 50, 100 или 1000 нм синтетического PQQ (Sigma). Двухдневные проростки огурцов переносили в стеклянные бутылки. Проросшие проростки арабидопсиса и острого перца переносили в стеклянные бутылки со средой Мурашиге и Скуга половинной концентрации, содержащей 25 нм синтетического PQQ. В качестве контроля использовали воду. Стеклянные бутылки были расположены в случайном порядке.
Песок промывали дистиллированной водой в течение 3 дней и дважды автоклавировали. Семена огурца стерилизовали поверхность и помещали в чашки Петри, содержащие стерильную воду, для прорастания при 28 ° C. Двухдневные проростки огурцов погружали на 1 час в 10 мл 5, 50, 100 или 1000 нм синтетического PQQ, переносили в песок, и оставшийся после обработки избыток раствора синтетического PQQ выливали в песок. В качестве контроля использовали воду. Стеклянные флаконы и растения, пересаженные в песок, помещали в камеру для выращивания, настроенную на цикл 14 часов света / 10 часов темноты при 24 ° C ± 1 ° C и относительной влажности 60%. Свежую массу растений регистрировали через 13 дней после пересадки.
Свежую массу растений регистрировали через 13 дней после пересадки.
Обнаружение локального накопления ROS и H
2 O 2 в листовых дисках Огурцы выращивали до стадии трехлистных втулок из минеральной ваты. Корневые системы проростков погружали на 1 ч в бактериальную суспензию (10 8 КОЕ мл -1 ) для бактериализации. Восемь листовых дисков (диаметром 7 мм) из третьих листьев проростков огурцов использовали для обнаружения ROS и H 2 O 2 через 7 дней после инокуляции.Для обработки PQQ листовые диски погружали на 14 ч при 25 ° C в синтетический PQQ с длиной волны 0, 10, 100 или 1000 нм. Все листовые диски подвергали вакуумной инфильтрации 1 мг мл -1 NBT в 10 мм калий-фосфатном буфере (pH 7,8) или растворе DAB и инкубировали при 25 ° C на свету в течение 2 часов. Листовые диски промывали 80% (об. / Об.) Этанолом в течение 10 мин при 70 ° C, помещали на предметное стекло в молочной кислоте: феноле: воде (1: 1: 1 [об / об / об]) и фотографировали. непосредственно с помощью микроскопа (Carl Zeiss).
непосредственно с помощью микроскопа (Carl Zeiss).
Native-PAGE Анализ активности SOD, APX и каталазы
Для определения активности антиоксидантных ферментов листья огурца (1 г) замораживали в жидком азоте, измельчали и ресуспендировали в 150 мк л 50 мм KH 2 PO 4 (pH 7.8). Гомогенат центрифугировали при 13000 g в течение 15 мин и определяли содержание белка в супернатанте (анализ белка Бредфорда; Bio-Rad). Образцы из 30 мкл г белка из каждого гомогената ткани разделяли в 10% природных полиакриламидных гелях. Активность СОД в гелях определяли модифицированным методом окрашивания (McCord, Fridovich, 1969). Гели выдерживали в темноте в течение 30 мин в смеси 1: 1 0,06 мМ рибофлавина + 0,651% (мас. / Об.) TEMED и 2,5 мМ NBT, оба в 50 мМ фосфатном буфере при pH 7.8, а затем проявляли в течение 20 мин при умеренном освещении. Активность APX и каталазы определяли с использованием ранее описанных процедур (Wayne and Diaz, 1986; Mittler and Zilinskas, 1993).
Анализ активности растворения минерального фосфата
MPS-активность бактерий проверяли на чашках с минимальной средой Glc с агаром, содержащим TCP, как описано ранее (Krishnaraj and Goldstein, 2001). Бактериальные культуры выращивали в течение ночи и приблизительно 5 × 10 8 КОЕ / мл -1 клеток каждой бактерии наносили на чашку с агаром TCP.Планшеты инкубировали при 28 ° C в течение 48 часов. Отмечено образование просветляющих ореолов в пластинах.
Статистический анализ
Экспериментальные данные были проанализированы статистически с использованием ANOVA (Институт SAS). Достоверность эффекта лечения определялась величиной значения F ( P = 0,05). Когда был получен значительный тест F для обработок, разделение средних значений было выполнено с помощью защищенного lsd Фишера.
Данные последовательности из этой статьи можно найти в библиотеках данных GenBank под номером доступа AY780887.
Сноски
Автор, ответственный за распространение материалов, составляющих выводы, представленные в этой статье, в соответствии с политикой, описанной в Инструкциях для авторов (www.plantphysiol.org): Ingyu Hwang (ingyu {at} snu.ac.kr).
www.plantphysiol.org / cgi / doi / 10.1104 / pp.107.112748
№1 Эта работа была поддержана Центром функциональной геномики сельскохозяйственных культур Программы исследований и разработок 21st Century Frontier (грант № CG2131), финансируемым Министерством науки и технологий Республики Корея, и грантом Корейского исследовательского фонда, финансируемым Правительство Кореи (Министерство образования и развития человеческих ресурсов, Фонд содействия фундаментальным исследованиям; грант № KRF – 2006–005 – J04701).
- Поступила 06.
 11.2007.
11.2007. - Принята к печати 20 ноября 2007 г.
- Опубликована 30 ноября 2007 г.
ЦИТИРОВАННАЯ ЛИТЕРАТУРА
- ↵
Альтшул С.Ф., Гиш В., Миллер В., Майерс Е.В., Липман Д.Д. (1990) Базовый инструмент локального поиска совмещения. J Mol Biol 215 : 403–410
- ↵
Бабу-Хан С., Йео Т.С., Мартин В.Л., Дурон М.Р., Роджерс Р.Д., Голдштейн А.Х. (1995) Клонирование гена, солюбилизирующего минеральный фосфат, из Pseudomonas cepacia. Appl Environ Microbiol 61 : 972–978
- ↵
Bashan Y, Levanony H (1991) Изменения мембранного потенциала и оттока в корнях растений, вызванные Azospirillum brasilense. Растительная почва 137 : 99–103
- ↵
Bloemberg GV, Lutenberg BJ (2001) Молекулярные основы стимулирования роста растений и биоконтроля с помощью ризобактерий.
 Curr Opin Microbiol 4 : 343–350
Curr Opin Microbiol 4 : 343–350 - ↵
Bonas U, Stall RE, Staskawicz BJ (1989) Генетическая и структурная характеристика гена авирулентности avrBs3 из Xanthomonas campestris pv. vesicatoria. Mol Gen Genet 218 : 127–136
- ↵
Christiansen-Weneger C (1992) N 2 — фиксация с помощью выделяющего аммоний Azospirillum brasilense в ауксин-индуцированных опухолях пшеницы ( Triticum aestivum L.). Biol Fertil Soils 12 : 85–100
- ↵
De Freitas JR, Banerjee MR, Germida JJ (1997) Ризобактерии, солюбилизирующие фосфат, усиливают рост и урожай, но не поглощают фосфор канолой ( Brassica napus L.). Biol Fertil Soils 24 : 358–364
- ↵
Дей Р.
 , Пал К.К., Бхатт Д.М., Чаухан С.М. (2004) Стимуляция роста и повышение урожайности арахиса ( Arachis hypogaea L.) путем применения ризобактерий, способствующих росту растений. Microbiol Res 159 : 371–394
, Пал К.К., Бхатт Д.М., Чаухан С.М. (2004) Стимуляция роста и повышение урожайности арахиса ( Arachis hypogaea L.) путем применения ризобактерий, способствующих росту растений. Microbiol Res 159 : 371–394 - ↵
Duine JA, van der Meer RA, Groen BW (1990) Кофактор пирролохинолинхинон. Анну Рев Нутр 10 : 297–318
- ↵
Felder M, Gupta A, Verma V, Kumar A, Qazi GN, Cullum J (2000) Гены синтеза пирролохинолинхинона Gluconobacter oxydans. FEMS Microbiol Lett 193 : 231–236
- ↵
Fellay R, Kresch HM, Prentki P, Frey J (1989) Omegon-Km: мобильный элемент, разработанный для in vivo инсерционного мутагенеза и клонирования генов в грамотрицательных. Ген 76 : 215–226
- ↵
Gish W, States DJ (1993) Идентификация областей, кодирующих белок, путем поиска сходства в базе данных.
 Нат Генет 3 : 266–272
Нат Генет 3 : 266–272 - ↵
Glick BR (1995) Усиление роста растений свободноживущими бактериями. Can J Microbiol 41 : 109–117
- ↵
Goosen N, Horsman HPA, Huien RGM, Putte PVD (1989) Гены Acinetobacter calcoaceticus , участвующие в биосинтезе кофермента пирролохинолинхинона: нуклеотидная последовательность и экспрессия в Escherichia-coli .J Бактериол 171 : 447–455
- ↵
He K, Nukada H, Urakami T, Murphy MP (2003) Антиоксидантные и прооксидантные свойства пирролохинолинхинона (PQQ): последствия для его функции в биологической системе. Biochem Pharmacol 65 : 67–74
- ↵
Houck DR, Hanners JL, Unkefer CJ (1991) Биосинтез пирролохинолинхинона.
 2. Биосинтетическая сборка из глутамата и тирозина.J Am Chem Soc 113 : 3162–3166
2. Биосинтетическая сборка из глутамата и тирозина.J Am Chem Soc 113 : 3162–3166 - ↵
Jefferson RA, Kavanagh TA, Bevan MW (1987) Gus fusions: β -глюкуронидаза как чувствительный и универсальный маркер слияния генов у высших растений. EMBO J 6 : 3901–3907
- ↵
Канг Дж. Х., Парк CS (1997) Картина колонизации флуоресцентных псевдомонад на семенах огурцов и ризопланах. Корейский завод J Plant Pathol 13 : 160–166
- ↵
Kasahara T, Kato R (2003) Новый витамин с редокс-кофактором для млекопитающих.Природа 422 : 832
Keen NT, Tamaki S, Kobayashi D, Trollinger D (1988) Улучшенные плазмиды с широким кругом хозяев для клонирования ДНК в грамотрицательных бактериях.
 Джин 70 : 191–197
Джин 70 : 191–197 - ↵
Khairnar NP, Misra HS, Apte SK (2003) Пирролохинолин-хинон, синтезированный в Escherichia coli с помощью пирролохинолин-хинон-синтазы , Deinococcus radiodurans играет роль не только солюбилизации минерального фосфата.Biochem Biophys Res Commun 312 : 303–308
- ↵
Killgore J, Smidt C, Duich L, Romero-Chapman N, Tinker D, Reiser K, Melko M, Hyde D, Rucker RB (1989) Пищевая ценность пирролохинолинхинона. Наука 245 : 850–852
- ↵
Kim J, Choi O, Kang JH, Ryu CM, Jeong MJ, Kim JW, Park CS (1998) Отслеживание некоторых корневых колоний Pseudomonas в ризосфере с использованием бактерий, интродуцированных геном lux .Корейский завод J Plant Pathol 14 : 13–18
- ↵
Kim J, Kim JG, Park BK, Choi O, Park CS, Hwang I (2003) Идентификация генов биосинтеза антибактериального соединения формы Pseudomonas fluorescens B16 и его активности против Ralstonia solanacearum.
 J Microbiol Biotechnol 13 : 292–300
J Microbiol Biotechnol 13 : 292–300 - ↵
Kloepper JW (1992) Ризобактерии, способствующие росту растений, как агенты биологической борьбы. В FB Metting Jr, ed., Soil Microbial Ecology: Applications in Agriculture and Environmental Management. Марсель Деккер, Нью-Йорк, стр. 255–274
- ↵
Krishnaraj PU, Goldstein AH (2001) Клонирование фрагмента ДНК Serratia marcescens , который индуцирует опосредованное хинопротеином глюкозодегидрогеназу продукцию глюконовой кислоты в Escherichia coli в присутствии стационарной фазы ns Serratia marcescecens. FEMS Microbiol Lett 205 : 215–220
- ↵
Кумазава Т., Сато К., Сено Х., Исии А., Сузуки О (1995) Уровни пирролохинолинхинона в различных продуктах питания. Biochem J 307 : 331–333
- ↵
Кумазава Т.
 , Сено Х., Ураками Т., Мацумото Т., Сузуки О (1992) Следовые уровни пирролохинолинхинона в образцах человека и крысы, обнаруженные с помощью газовой хроматографии / масс-спектрометрии.Biochim Biophys Acta 1156 : 62–66
, Сено Х., Ураками Т., Мацумото Т., Сузуки О (1992) Следовые уровни пирролохинолинхинона в образцах человека и крысы, обнаруженные с помощью газовой хроматографии / масс-спектрометрии.Biochim Biophys Acta 1156 : 62–66 - ↵
Leong J (1986) Сидерофоры: их биохимия и возможная роль в биоконтроле патогенов растений. Анну Рев Фитопатол 24 : 187–208
- ↵
Liu ST, Lee LY, Tai CY, Hung CH, Chang YS, Wolfram JH, Rogers R, Goldstein AH (1992) Клонирование гена Erwinia herbicola , необходимого для производства глюконовой кислоты и повышения солюбилизации минеральных фосфатов в Escherichia coli HB101.J Бактериол 174 : 5814–5819
- ↵
Magnusson OT, Toyama H, Saeki M, Rojas A, Reed JC, Liddington RC, Klinman JP, Schwarzenbacher R (2004) Биогенез хинона: структура и механизм PqqC, конечного катализатора производства пирролохинолинхинона.
 Proc Natl Acad Sci USA 101 : 7913–7918
Proc Natl Acad Sci USA 101 : 7913–7918 - ↵
McCord JM, Fridovich I (1969) Супероксиддисмутаза: ферментативная функция этрокупреина (гемокупреина).J Biol Chem 244 : 6049–6055
- ↵
McIntire WS (1998) Недавно открытые окислительно-восстановительные кофакторы: возможное пищевое, медицинское и фармакологическое значение для высших животных. Annu Rev Nutr 18 : 145–177
- ↵
Meulenberg JJ, Sellink E, Riegman NH, Postma PW (1992) Нуклеотидная последовательность и структура оперона Klebsiella pneumoniae pqq .Mol Gen Genet 232 : 284–294
- ↵
Misra HS, Khairnar NP, Barik A, Priyadarsini K, Mohan H, Apte SK (2004) Пирролохинолин-хинон: поглотитель активных форм кислорода в бактериях.
 FEBS Lett 578 : 26–30
FEBS Lett 578 : 26–30 - ↵
Mitchell AE, Jones AD, Mercer RS, Rucker RB (1999) Характеристика производных пирролохинолинхинона аминокислот с помощью масс-спектрометрии с ионизацией электрораспылением и обнаружения в материнском молоке.Анал Биохим 269 : 317–325
- ↵
Mittler R, Zilinskas BA (1993) Обнаружение активности аскорбатпероксидазы в нативных гелях путем ингибирования аскорбат-зависимого восстановления нитросинего тетразолия. Анал Биохим 212 : 540–546
- ↵
Naito Y, Kumazawa T, Kino I, Suzuki O (1993) Влияние пирролохинолинхинона (PQQ) и PQQ-оксазола на синтез ДНК культивируемых фибробластов человека.Life Sci 52 : 1909–1915
- ↵
Penrose DM, Glick BR (2003) Способы выделения и характеристики содержащих АСС дезаминазу ризобактерий, способствующих росту растений.
 Physiol Plant 118 : 10–15
Physiol Plant 118 : 10–15 Prentki P, Krisch HM (1984) Инсерционный мутагенез in vitro с выбираемым фрагментом ДНК. Ген 29 : 303–313
- ↵
Ryu CM, Farag MA, Hu CH, Reddy MS, Wei HX, Paré PW, Kloepper JW (2003) Летучие бактерии способствуют росту арабидопсиса.Proc Natl Acad Sci USA 100 : 4927–4932
- ↵
Сафронова В.И., Степанок В.В., Энгквист Г.Л., Алексеев Ю.В., Белимов А.А. (2006) Связанные с корнем бактерии, содержащие 1-аминоциклопропан-1-карбоксиатдезаминазу, улучшают рост и поглощение питательных веществ генотипами гороха, выращиваемыми в почве с добавлением кадмия. Biol Fertil Soils 42 : 267–272
- ↵
Sambrook J, Fritsh EF, Maniatis T (1989) Molecular Cloning: A Laboratory Manual.
 Лабораторный пресс Колд-Спринг-Харбор, Колд-Спринг-Харбор, Нью-Йорк
Лабораторный пресс Колд-Спринг-Харбор, Колд-Спринг-Харбор, Нью-Йорк - ↵
Schnider U, Keel C, Voisard C, Défage G, Haas D (1991) Tn 5 -направленное клонирование pqq генов из Pseudomonas fluorescens CHA0: мутационная инактивация генов приводит к перепроизводству антибиотик пиолуторин. Appl Environ Microbiol 61 : 3856–3864
Саймон Р., Прифер У., Пюлер А (1983) Система мобилизации широкого круга хозяев для генной инженерии in vivo: мутагенез транспозонов в грамотрицательных бактериях.Био / технологии 1 : 784–791
- ↵
Sivan A, Chet I (1992) Микробный контроль болезней растений. В Р. Митчелл, изд., Экологическая микробиология. Willey-Liss, New York, pp 335–354
- ↵
Smidt CR, Steinberg FM, Rucker RB (1991) Физиологическое значение пирролохинолинхинона.
 Proc Soc Exp Biol Med 197 : 19–26
Proc Soc Exp Biol Med 197 : 19–26 - ↵
Sophie M, Guilhem D, Marièle L, Timothy JT, Jean-Claude CM, Bruno T (2006) Нитрат-зависимый контроль корневой архитектуры и азотного питания изменяются способствующими росту растений Phyllobacterium sp.Planta 223 : 591–603
Stachel SE, An G, Flores C., Nester EW (1985) Транспозон Tn 3 lacZ для случайной генерации слияния гена β -галактозидазы: применение для анализа экспрессии генов в Agrobacterium. EMBO J 4 : 891–898
Staskawicz B, Dahlbeck D, Keen N, Napoli C (1987) Молекулярная характеристика клонированных генов авирулентности из расы 0 и расы 1 Pseudomonas syringae pv. glycinea. Дж Бактериол 169 : 5789–5794
- ↵
Steinberg FM, Gershwin ME, Rucker RB (1994) Диетический пирролохинолинхинон: рост и иммунный ответ у мышей BALB / C.
 J Nutr 124 : 744–753
J Nutr 124 : 744–753 - ↵
Stites TE, Mitchell AE, Rucker RB (2000) Физиологическое значение хиноферментов и кофакторов семейства O -хинонов. J Nutr 130 : 719–727
- ↵
Toyama H, Chistoserdova L, Lidstrom ME (1997) Анализ последовательности генов pqq , необходимых для биосинтеза пирролохинолинхинона в Methylobacterium extorquens AM1 и очистки промежуточного биосинтеза.Микробиология 143 : 595–602
- ↵
Unkefer CJ, Houck DR, Britt BM, Sosnick TR, Hanners JL (1995) Биогенез пирролохинолинхинона из 3C-меченного тирозина. Методы Enzymol 258 : 227–235
- ↵
Urakami T, Yoshida C, Akaike T, Maeda H, Nishigori H, Niki E (1997) Синтез моноэфиров пирролохинолинхинона и имидазопирролохинолина, а также активности по улавливанию радикалов с использованием электронно-спинового резонанса in vitro и фармакологической активности in vitro естественным образом.
 J Nutr Sci Vitaminol (Токио) 43 : 19–33
J Nutr Sci Vitaminol (Токио) 43 : 19–33 - ↵
Van der Meer RA, Groen BW, van Kleef MAG, Frank J, Jongejan JA, Duine JA (1990) Выделение, получение и анализ пирролохинолинхинона. Методы Enzymol 188 : 260–283
- ↵
Wayne LG, Diaz GA (1986) Метод двойного окрашивания для различения двух классов микобактериальной каталазы в полиакриламидных гелях для электрофореза.Анал Биохим 157 : 89–92
- ↵
Xie H, Pasternak JJ, Glick BR (1996) Выделение и характеристика мутантов стимулирующих рост растений ризобактерий Pseudomonas putida GR12-2, которые продуцируют избыточную индолуксусную кислоту. Curr Microbiol 32 : 67–71
- ↵
Xiong LB, Sekity J, Shimose N (1988) Стимуляция прорастания пыльцы Lillium пирролохинолинхинином.
 Agric Biol Chem 52 : 1065–1066
Agric Biol Chem 52 : 1065–1066 - ↵
Xiong LB, Sekity J, Shimose N (1990) Встречаемость пирролохинолинхинона (PQQ) в пестиках и пыльцевых зернах высших растений. Agric Biol Chem 54 : 249–250
- ↵
Ямагути К., Сасано А., Ураками Т., Цуджи Т., Кондо К. (1993) Стимуляция выработки фактора роста нервов пирролохинолинхиноном и его производными in vitro, и in vivo. Biosci Biotechnol Biochem 57 : 1231–1233
- ↵
Zhang Y, Rosenberg PA (2002) Незаменимое питательное вещество пирролохинолинхинон может действовать как нейропротектор, подавляя образование пероксинитрита. Eur J Neurosci 16 : 1015–1024
Влияние добавок пирролохинолинхинона (PQQ) на митохондриальный биогенез, митохондриальную функцию и выполнение аэробных упражнений у нетренированных мужчин.

Абстрактные
Тренировка на выносливость улучшает аэробные характеристики и улучшает биогенез, функцию и антиоксидантную способность митохондрий. Пирролохинолинхинон (PQQ) — это новая добавка, участвующая в таких процессах, как митохондриальный биогенез, клеточный энергетический метаболизм и редокс-модуляция. Поскольку упражнения на выносливость и PQQ демонстрируют сходные механизмы митохондриального биогенеза, вполне вероятно, что PQQ может иметь эргогенное значение. В настоящее время нет исследований, изучающих влияние добавок PQQ в сочетании с упражнениями на выносливость.Таким образом, это исследование преследовало двоякую цель: (1) изучить острые эффекты добавления PQQ с упражнениями на экспрессию генов, участвующих в биогенезе / функции митохондрий; (2) изучить влияние 6-недельной программы тренировок на выносливость на биогенез / функцию митохондрий, карбонилы белков и аэробную производительность у нетренированных мужчин. Двадцать три мужчины, ведущие малоподвижный образ жизни, были рандомизированы для приема 20 мг PQQ или плацебо (PLC) в день. Обе группы следовали контролируемой 6-недельной программе тренировок на выносливость.Гены, указывающие на биогенез митохондрий (PGC-1, кардиолипинсинтаза (CLS), цитрат-синтаза (CS)) и функции (цитохром C-1 (CYC-1), сукцинатдегидрогеназа (SDH) и цитохром с оксидаза (COX4 / 1) ) были проанализированы, чтобы оценить острые эффекты добавок PQQ с упражнениями. Маркеры аэробной производительности, митохондриального биогенеза, функции и окислительного стресса измерялись после 6-недельной программы тренировок на выносливость. Острая доза PQQ с упражнениями не показала значимых различий по всем интересующим генам.Не было значительных различий между группами по всем параметрам аэробной производительности после тренировки на выносливость (p> 0,05). Тем не менее, наблюдались значительные улучшения VO2peak, процента порога вентиляции на VO2peak и общей продолжительности нагрузочного теста после тренировки на выносливость независимо от группы (p <0,05). Группа PQQ значительно повысила уровень белка PGC-1 после тренировки на выносливость (p <0,05).
Обе группы следовали контролируемой 6-недельной программе тренировок на выносливость.Гены, указывающие на биогенез митохондрий (PGC-1, кардиолипинсинтаза (CLS), цитрат-синтаза (CS)) и функции (цитохром C-1 (CYC-1), сукцинатдегидрогеназа (SDH) и цитохром с оксидаза (COX4 / 1) ) были проанализированы, чтобы оценить острые эффекты добавок PQQ с упражнениями. Маркеры аэробной производительности, митохондриального биогенеза, функции и окислительного стресса измерялись после 6-недельной программы тренировок на выносливость. Острая доза PQQ с упражнениями не показала значимых различий по всем интересующим генам.Не было значительных различий между группами по всем параметрам аэробной производительности после тренировки на выносливость (p> 0,05). Тем не менее, наблюдались значительные улучшения VO2peak, процента порога вентиляции на VO2peak и общей продолжительности нагрузочного теста после тренировки на выносливость независимо от группы (p <0,05). Группа PQQ значительно повысила уровень белка PGC-1 после тренировки на выносливость (p <0,05). Существенных различий между группами по содержанию карбонила белка не выявлено (p> 0.05). Добавка PQQ не улучшала дифференциально активность Комплекса I, Комплекса III, Комплекса IV и CS (p> 0,05). Однако активность Комплекса I, Комплекса IV и CS значительно улучшилась независимо от группы после тренировки на выносливость (p <0,05). Хотя добавка PQQ не привела к улучшению эргогенности, увеличение содержания белка PGC-1 свидетельствует о митохондриальной адаптации. Необходимы дальнейшие исследования с вариациями интенсивности и продолжительности, чтобы выяснить, имеет ли PQQ какие-либо эргогенные преимущества при выполнении упражнений.
Существенных различий между группами по содержанию карбонила белка не выявлено (p> 0.05). Добавка PQQ не улучшала дифференциально активность Комплекса I, Комплекса III, Комплекса IV и CS (p> 0,05). Однако активность Комплекса I, Комплекса IV и CS значительно улучшилась независимо от группы после тренировки на выносливость (p <0,05). Хотя добавка PQQ не привела к улучшению эргогенности, увеличение содержания белка PGC-1 свидетельствует о митохондриальной адаптации. Необходимы дальнейшие исследования с вариациями интенсивности и продолжительности, чтобы выяснить, имеет ли PQQ какие-либо эргогенные преимущества при выполнении упражнений.
Пирролохинолинхинон | CAS 72909-34-3 | SCBT
Пирролохинолинхинон | CAS 72909-34-3 | SCBT — Santa Cruz Biotechnology Пирролохинолинхинон CAS: 72909-34-3MF: C14H6N2O8
MW: 330,20
Редокс / кофактор, обнаруженный в классе ферментов, называемых хинопротеинами.

- Дом
- Химические вещества
- Прочие химические вещества
- Кофакторы
- Пирролохинолинхинон
Альтернативные имена: PQQ
Количество CAS: 72909-34-3
Молекулярный вес:
330. 20
20
Молекулярная формула: C 14 H 6 N 2 O 8
Только для исследовательского использования. Не предназначено для диагностического или терапевтического использования.
* Данные по партии (включая содержание воды) см. В Сертификате анализа.Нажмите на изображение или кнопку увеличения, чтобы увеличить
Закрыть
Пирролохинолинхинон является кофактором микробного хинопротеинового фермента и имидазопирролина. Редокс / кофактор, обнаруженный в классе ферментов, называемых хинопротеинами.
Редокс / кофактор, обнаруженный в классе ферментов, называемых хинопротеинами.
Растворимость :
Растворим в метаноле и воде
Место хранения :
Хранить при -20 ° C
Только для исследовательского использования. Не предназначено для диагностического или терапевтического использования.
Улыбки :
OC (= O) C1 = CC2 = C (N1) C1 = C (N = C (C = C1C (O) = O) C (O) = O) C (= O) C2 = O
Adobe Acrobat Reader требуется
для надежного просмотра, печати и комментирования PDF-документов.
Дата выпуска: 2015-06-21
Santa Cruz Biotechnology, Inc. — мировой лидер в разработке продуктов для рынка биомедицинских исследований. Позвоните нам по бесплатному телефону 1-800-457-3801 .
Авторские права © 2007-2021 Santa Cruz Biotechnology, Inc.Все права защищены. «Santa Cruz Biotechnology» и логотип Santa Cruz Biotechnology, Inc., «Santa Cruz Animal Health», «San Juan Ranch», «Дополнение чемпионов», логотип San Juan Ranch, «Ultracruz», «Chemcruz», » Immunocruz »,« Exactacruz »и« EZ Touch »являются зарегистрированными товарными знаками Santa Cruz Biotechnology, Inc.
Все товарные знаки являются собственностью соответствующих владельцев.
Получена ваша подписка на рассылку новостей и объявлений по электронной почте.Регистрируясь, вы подтверждаете, что прочитали и согласны с условиями нашей политики конфиденциальности. Вы имеете право отказаться от подписки в любое время, щелкнув ссылку «отказаться от подписки» в любом полученном вами электронном письме с новостями и объявлениями.
Чтобы разместить заказ с использованием юаней или отправить товар в континентальный Китай, посетите сайт www.scbio.cn
Влияние пирролохинолинхинона на экспрессию WISP1 при черепно-мозговой травме
WISP1, как член семейства белков CCN4, обладает клеточными защитными эффектами, способствуя пролиферации клеток и подавляя апоптоз клеток. Хотя некоторые исследования подтвердили, что WISP1 связан с раком толстой кишки и раком легких, имеется мало сообщений о влиянии WISP1 на черепно-мозговые травмы.Здесь мы обнаружили, что экспрессия мРНК и белка WISP1 снижалась через 3 дня, а затем увеличивалась через 5 дней после черепно-мозговой травмы (TBI). Между тем, иммунофлуоресценция показала, что было небольшое совместное размещение WISP1 с GFAP, Iba1 и WISP1, частично локализованным с NeuN. WISP1 колокализуется с LC3, но совместное размещение WISP1 с расщепленной каспазой-3 было незначительным. Последующее исследование показало, что экспрессия белка β -катенин была идентична экспрессии WISP1 после TBI.WISP1 в основном локализован в цитоплазме клеток PC12 или SHSY5Y. По сравнению с группой отрицательного контроля, экспрессия WISP1 явно снижалась в клетках SHSY5Y, трансфицированных si-РНК WISP1. Анализ CCK-8 показал, что пирролохинолинхинон (PQQ) мало влияет на жизнеспособность клеток PC12 и SHSY5Y. Эти результаты предполагают, что WISP1 играет защитную роль после черепно-мозговой травмы у крыс, и этот эффект может быть связан с аутофагией, вызванной черепно-мозговой травмой.
Хотя некоторые исследования подтвердили, что WISP1 связан с раком толстой кишки и раком легких, имеется мало сообщений о влиянии WISP1 на черепно-мозговые травмы.Здесь мы обнаружили, что экспрессия мРНК и белка WISP1 снижалась через 3 дня, а затем увеличивалась через 5 дней после черепно-мозговой травмы (TBI). Между тем, иммунофлуоресценция показала, что было небольшое совместное размещение WISP1 с GFAP, Iba1 и WISP1, частично локализованным с NeuN. WISP1 колокализуется с LC3, но совместное размещение WISP1 с расщепленной каспазой-3 было незначительным. Последующее исследование показало, что экспрессия белка β -катенин была идентична экспрессии WISP1 после TBI.WISP1 в основном локализован в цитоплазме клеток PC12 или SHSY5Y. По сравнению с группой отрицательного контроля, экспрессия WISP1 явно снижалась в клетках SHSY5Y, трансфицированных si-РНК WISP1. Анализ CCK-8 показал, что пирролохинолинхинон (PQQ) мало влияет на жизнеспособность клеток PC12 и SHSY5Y. Эти результаты предполагают, что WISP1 играет защитную роль после черепно-мозговой травмы у крыс, и этот эффект может быть связан с аутофагией, вызванной черепно-мозговой травмой.
1. Введение
Черепно-мозговая травма (ЧМТ), также известная как травма головного мозга, в основном вызывается внешними механическими силами.Наблюдался ряд патологических, физиологических и биохимических изменений, таких как субарахноидальное кровоизлияние, спазмы церебральной трубки крови, нарушение мозгового кровообращения и отек мозга. Все эти вторичные и первичные травмы головного мозга привели к более высокому уровню смертности. В настоящем исследовании метод Фини и др. [1] был использован для создания модели черепно-мозговой травмы (ЧМТ) у крыс.
WISP1 (белок 1 индуцируемого Wnt1 сигнального пути) является членом семейства CCN, который в более широком смысле идентифицируется с развитием и онкогенезом [2].Семейство белков CCN состоит из 6 членов семейства, включая богатый цистеином белок 61 (CYR61 / CNN1) и фактор роста соединительной ткани (CTGF / CCN2), а также сверхэкспрессируемый нефробластомой секретируемый белок (NOV / CCN3), WISP1 (CCN4), WISP2 (CCN5) и WISP3 (CCN6) [3]. Семейство CCN характеризуется четырьмя богатыми цистеином модульными доменами, которые включают домен связывания инсулиноподобного фактора роста, модуль фактора фон Виллебранда типа C, домен тромбоспондина и C-концевой домен, напоминающий узелок цистеина. Во внеклеточном матриксе WISP1 объединяет богатые лейцином протеогликаны и влияет на способность клетки закреплять внеклеточный матрикс [4].
Семейство CCN характеризуется четырьмя богатыми цистеином модульными доменами, которые включают домен связывания инсулиноподобного фактора роста, модуль фактора фон Виллебранда типа C, домен тромбоспондина и C-концевой домен, напоминающий узелок цистеина. Во внеклеточном матриксе WISP1 объединяет богатые лейцином протеогликаны и влияет на способность клетки закреплять внеклеточный матрикс [4].
WISP1 может экспрессироваться в различных тканях, и специфических тканей нет. Pennica et al. обнаружили, что WISP1 экспрессируется во многих тканях, включая сердце, легкие, почки, тонкий кишечник, селезенку, поджелудочную железу, яичники и мозг взрослого человека, но были существенные изменения в уровнях экспрессии среди различных тканей [5]. WISP1 может блокировать p53-опосредованные повреждения ДНК и апоптоз [6], а также способствовать пролиферации и адгезии клеток [7]. WISP1 был связан с неопластическим ростом [8].WISP1 связан с формированием и развитием рака легких, почечно-клеточной карциномы, колоректального рака и других опухолей. В последние годы исследования показали, что WISP1 может способствовать ремоделированию сердца после инфаркта миокарда [7], а также восстановлению и отрастанию легочной ткани [9]. Кроме того, WISP1 может играть жизненно важную роль в формировании костей и восстановлении переломов [10, 11] и может ограничивать повреждение нейрональных клеток во время окислительного стресса [12].
В последние годы исследования показали, что WISP1 может способствовать ремоделированию сердца после инфаркта миокарда [7], а также восстановлению и отрастанию легочной ткани [9]. Кроме того, WISP1 может играть жизненно важную роль в формировании костей и восстановлении переломов [10, 11] и может ограничивать повреждение нейрональных клеток во время окислительного стресса [12].
β -Катенин — растворимый белок, расположенный в цитоплазме, впервые обнаруженный в 1980 году немецкими учеными [13].Последующие исследования показали, что β -катенин является гомологичным аналогом гена броненосца дрозофилы у млекопитающих [14]. Внутриклеточный β -катенин в основном существует в клеточной мембране, цитоплазме или ядре в сложных формах. Расположение β -катенина в клетке связано с биологическими функциями. Для β -катенин в клеточной мембране, белок β -катенин в нормальных зрелых клетках опосредует клеточную адгезию и миграцию и влияет на полярность и целостность эпителия [15]. β -Катенин из цитоплазмы проходит в ядро, приводя к транскрипции гена, которая тесно связана с развитием и прогрессированием многих заболеваний [16]. β -катенин в ядре способствует транскрипции последующих генов-мишеней, которые ускоряют клеточный цикл, способствуют пролиферации клеток, продуцируют аномальный белок и в конечном итоге приводят к возникновению опухоли [17].
β -Катенин из цитоплазмы проходит в ядро, приводя к транскрипции гена, которая тесно связана с развитием и прогрессированием многих заболеваний [16]. β -катенин в ядре способствует транскрипции последующих генов-мишеней, которые ускоряют клеточный цикл, способствуют пролиферации клеток, продуцируют аномальный белок и в конечном итоге приводят к возникновению опухоли [17].
WISP1, как член семейства CCN, использует защитные пути, которые включают традиционную бескрылую каноническую и неканоническую передачу сигналов Wnt1.Кроме того, WISP1 может увеличивать ядерную экспрессию β -катенина [4]. Интересно, что исследование обнаружило, что β -catenin может способствовать экспрессии WISP1 с помощью передачи сигналов Wnt1 [18]. WISP1 и его сигнальные пути с β -катенином представляют собой новую мишень, которая обладает потенциальной способностью способствовать пролиферации, репарации и регенерации тканей во многих клеточных системах [4, 19, 20].
Пирролохинолинхинон (PQQ) — новый кофермент оксидоредуктазы, открытый в конце 1970-х годов 20-го века.И это анионное водорастворимое соединение, которое существует почти во всех биологических тканях [21]. PQQ также широко используется в диетологии и фармакологии как важный антиоксидант или питательное вещество. Многочисленные исследования показали, что PQQ обладает множеством других фармакологических эффектов, таких как противовоспалительное действие, защита печени и сердца [22]. Сообщается, что диета с дефицитом PQQ вызывает нарушение роста, иммунологические дефекты и снижение фертильности у мышей [23].
Недавние исследования показали, что PQQ изменяет внутриклеточные сигнальные пути.Например, когда пути передачи сигналов фосфатидилинозитол-3-киназы (PI3K) / AKT заблокированы, защитные эффекты PQQ будут потеряны, что означает, что PQQ может регулировать выживание нейрональных клеток с помощью пути передачи сигналов (PI3K) / AKT [24]. Сходным образом, WISP1, как было показано, полагается на PI3K и AKT для обеспечения цитопротекции в нейронах [4, 12]. WISP1 в конечном итоге модулирует пути апоптоза Bad, гликогенсинтазы киназы-3 β (GSK-3 β ), Bim, Bcl-xL, проницаемости митохондриальной мембраны, высвобождения цитохрома с и активации каспазы для предотвращения повреждения клеток [12].PI3K и AKT являются критическими путями для стимулирования клеточной пролиферации и блокирования апоптотических повреждений. Однако не сообщалось, может ли WISP1 быть затронутым активацией PQQ с помощью PI3K / AKT.
WISP1 в конечном итоге модулирует пути апоптоза Bad, гликогенсинтазы киназы-3 β (GSK-3 β ), Bim, Bcl-xL, проницаемости митохондриальной мембраны, высвобождения цитохрома с и активации каспазы для предотвращения повреждения клеток [12].PI3K и AKT являются критическими путями для стимулирования клеточной пролиферации и блокирования апоптотических повреждений. Однако не сообщалось, может ли WISP1 быть затронутым активацией PQQ с помощью PI3K / AKT.
Хотя многие эксперименты подтвердили очевидную эффективность WISP1 в отношении пролиферации, восстановления и регенерации тканей, имеется мало сообщений о влиянии WISP1 на черепно-мозговые травмы. В настоящем исследовании мы пытаемся изучить влияние белка WISP1 на экспрессию клеток, что необходимо для лечения травм головного мозга, понимая процессы восстановления после травм.Поэтому мы создали модель черепно-мозговой травмы на крысах, чтобы попытаться продолжить исследование функции WISP1 при черепно-мозговой травме.
2.
 Материалы и методы
Материалы и методы2.1. Животные и крысы линии TBI Model
Sprague-Dawley (SD) (200–250 г) были получены из Центра экспериментальных животных Университета Наньтун (Наньтун, Китай). Все животные () были разделены на тринадцать групп: фиктивные, 1 день, 3 дня, 5 дней и 7 дней после ЧМТ и 1 день, 3 дня, 5 дней и 7 дней после ЧМТ + 1 мМ PQQ или 2 мМ. PQQ. Ссылаясь на Feeney et al.В [1] модели метода TBI, вкратце, крыс подвергали глубокой анестезии хлоралгидратом (10% раствор), головы фиксировали в стереотаксической раме и выполняли краниотомию диаметром 10 мм рядом с центральным швом, на полпути. между лямбдой и брегмой. Твердая мозговая оболочка над корой оставалась нетронутой. Травма была нанесена в результате воздействия на правую кору головного мозга устройством для перкуссии головного мозга (AmScien Instruments, Ричмонд, США). Трепанацию черепа проводили только крысам-симуляторам (). После всех процедур животных возвращали в клетки и позволяли свободно получать пищу и воду. Животных содержали при 12-часовом цикле свет / темнота и поддерживали комнатную температуру на уровне 25 ± 0,5 ° C.
Животных содержали при 12-часовом цикле свет / темнота и поддерживали комнатную температуру на уровне 25 ± 0,5 ° C.
2.2. Анализ ПЦР в реальном времени
Суммарную РНК экстрагировали из замороженных тканей коры головного мозга с помощью реагента ТРИЗОЛ (Sigma) в соответствии с рекомендациями производителя. РНК подвергали обратной транскрипции в кДНК с использованием набора для обратной транскрипции (Thermo) с праймерами oligo (dT) 18 . Праймеры WISP1 и GAPDH были сконструированы с помощью программного обеспечения праймера 5 и синтезированы биотехнологической компанией (GENEray, Шанхай, Китай), смысловой праймер WISP1: 5′-GCCCGAGGTACGCAATAGGAGT-3 ‘и антисмысловой праймер: 5′-CCCACGGTGCCATCAATACAGG-3′; Смысловой праймер GAPDH был также сконструирован таким же образом: смысловой праймер GAPDH: 5’-CAACGGGAAACCCATCACCA-3 ‘и антисмысловой праймер: 5′-ACGCCAGTAGACTCCACGACAT-3’.Количественный анализ ПЦР в реальном времени выполняли с помощью LightCycler 96 (Roche), применяя технологию SYBR Green PCR в реальном времени (Roche). Реакционные смеси содержали 5 мкл мкл SYBR Master Mix, 0,1 мкл мкл каждого прямого и обратного праймера для ПЦР (10 мкл мкл), 1 мкл мкл кДНК и 3,9 мкл мкл воды, свободной от нуклеаз. для конечного объема 10 мкм л. После одного цикла 95 ° C в течение 10 минут было выполнено 45 циклов ПЦР, каждый из которых состоит из этапа денатурации (95 ° C, 10 с) и этапа отжига (60 ° C, 30 с).Концентрации общей РНК из каждого образца нормализовали по количеству мРНК GAPDH. Все эксперименты повторяли не менее трех раз.
Реакционные смеси содержали 5 мкл мкл SYBR Master Mix, 0,1 мкл мкл каждого прямого и обратного праймера для ПЦР (10 мкл мкл), 1 мкл мкл кДНК и 3,9 мкл мкл воды, свободной от нуклеаз. для конечного объема 10 мкм л. После одного цикла 95 ° C в течение 10 минут было выполнено 45 циклов ПЦР, каждый из которых состоит из этапа денатурации (95 ° C, 10 с) и этапа отжига (60 ° C, 30 с).Концентрации общей РНК из каждого образца нормализовали по количеству мРНК GAPDH. Все эксперименты повторяли не менее трех раз.
2.3. Вестерн-блот
Ткани мозга хранили при -80 ° C; образцы тканей лизировали буфером для экстракции. Концентрацию белка тестировали с использованием набора для анализа бицинхониновой кислоты (Beyotime, Jiangsu, China) с последующим разделением электрофорезом на SDS-PAGE, а затем переносили на мембрану PVDF (Millipore, Bedford, MA, USA) на 120 мин при 100 В .Мембраны блокировали 5% обезжиренным молоком, а затем инкубировали в течение ночи с антителом WISP1 (разведенным 1: 500 в TBS; Santa Cruz, Cell Signaling Technology), β -актином (1: 4000, Sigma) и β — катенин (1: 500, Санта-Крус). Мембрану из PVDF промывали TBST (TBS с 0,1% Tween 20) в течение 10 минут по крайней мере три раза и инкубировали с соответствующим конъюгированным с HRP вторичным антителом в течение 2 часов при комнатной температуре. После промывки PVDF-мембраны в течение 10 мин не менее 3 раз белок визуализировали с помощью Beyo ECL Star (Beyotime, Jiangsu, China).
Мембрану из PVDF промывали TBST (TBS с 0,1% Tween 20) в течение 10 минут по крайней мере три раза и инкубировали с соответствующим конъюгированным с HRP вторичным антителом в течение 2 часов при комнатной температуре. После промывки PVDF-мембраны в течение 10 мин не менее 3 раз белок визуализировали с помощью Beyo ECL Star (Beyotime, Jiangsu, China).
2.4. Иммунофлуоресценция
Ткань мозга фиксировали 4% параформальдегидом при 4 ° C, после того, как ткани мозга опустились на дно флакона и после дегидратации градиентом концентрации (10%, 20%, 30% и 5%). а затем были приготовлены и исследованы 12 замороженных срезов размером мкм и мкм. Все срезы блокировали блокирующим раствором (10% козьей сыворотки, 3% BSA и 0,1% Triton X-100) в течение 1 ч при 37 ° C, инкубируя в течение ночи с антителом WISP1 (разведенным 1: 500; Santa Cruz), анти- GFAP (1: 400; BD Pharmingen), анти-NeuN (1: 1000; Abcam), β -катенин (1: 500; Santa Cruz), анти-расщепленная каспаза-3 (1: 400; Cell Signaling Technology) , анти-LC3 (1: 500; Cell Signaling Technology) и анти-Iba1 (1: 1000; Wako), а затем промывка их 0. 01 M PBS в течение 10 минут 3 раза с последующей инкубацией со смесью вторичных антител, конъюгированных с FITC или Cy3, в течение 2 часов при комнатной температуре, а затем снова промывают в PBS в течение 10 минут 3 раза. Окрашенные срезы исследовали с помощью флуоресцентного микроскопа Leica (Leica DM 5000B, Германия).
01 M PBS в течение 10 минут 3 раза с последующей инкубацией со смесью вторичных антител, конъюгированных с FITC или Cy3, в течение 2 часов при комнатной температуре, а затем снова промывают в PBS в течение 10 минут 3 раза. Окрашенные срезы исследовали с помощью флуоресцентного микроскопа Leica (Leica DM 5000B, Германия).
2,5. EdU Assay
Пролиферацию клеток определяли с помощью набора для пролиферации клеток ДНК Cell-Light EdU (RiboBio, Гуанчжоу, Китай) в соответствии с инструкциями производителя. Астроциты культивировали в 96-луночных планшетах из расчета 4 × 10 4 клеток / лунку.После инкубирования с 50 μ M EdU в течение 24 часов клетки промывали PBS с последующей фиксацией в 4% формальдегиде в течение 30 минут, а затем пермеабилизировали в 0,5% Triton X-100 в течение 10 минут. После обширной промывки PBS клетки инкубировали с Apollo в течение 30 минут и Hoechst в течение 30 минут. Пролиферативные клетки рассчитывали как процент EdU-положительных клеток по отношению к общему количеству клеток.
2.6. Анализ миграции через лунки
Астроциты культивировали при 4 × 10 3 клеток / лунку с DMEM в верхней камере 24-луночной камеры трансвелл с 8 поликарбонатными фильтрами с размером пор мкм мкм (Costar).10% фибронектин добавляли в нижнюю камеру в качестве хемоаттрактанта. Астроциты мигрируют в течение 24 часов, а затем фиксируют в 4% формальдегиде в течение 1 часа и окрашивают 0,1% кристаллическим фиолетовым. Изображения были получены с помощью микроскопа, и были подсчитаны пять полей.
2.7. Культура клеток
Клетки SHSY5Y и PC12 были получены из Китайской академии наук (Шанхай, Китай). Клетки культивировали в среде DMEM с 10% FBS при 37 ° C в инкубаторе, содержащем 5% CO 2 .
2.8. Трансфекция
Чтобы подавить экспрессию гена WISP1, получали si-РНК WISP1 (Invitrogen), смысловой праймер WISP1: 5′-GGACAUCCAUACACACAUUTT-3 ‘и антисмысловой праймер: 5′-AAUGAGUGUAUGGAUGUCCTT-3’. Трансфекцию si-РНК выполняли липофектамином 3000 (Invitrogen) в соответствии с инструкциями производителя. Все данные были получены после трансфекции в течение 72 часов.
Все данные были получены после трансфекции в течение 72 часов.
2.9. CCK-8 Test
КлеткиSHSY5Y и клетки PC12 высевали на 96-луночный планшет заранее, а затем обрабатывали различными концентрациями PQQ в течение 24 часов.Затем клетки инкубировали в увлажненной атмосфере с 5% CO 2 при 37 ° C в течение 2 часов после добавления тестового раствора CCK-8 (Dojindo, Япония), и жизнеспособность клеток определяли с помощью устройства для считывания микропланшетов при 450 нм.
2.10. Статистический анализ
Для каждого эксперимента определяли среднее значение и стандартную ошибку. Данные были проанализированы с помощью дисперсионного анализа (односторонний ANOVA). Статистическая значимость определялась на уровне.
3. Результаты
3.1. Экспрессия и локализация WISP1 после TBI
. Чтобы наблюдать экспрессию мРНК WISP1 после TBI, выполняли qRT-PCR. Результаты показали, что по сравнению с фиктивной группой мРНК WISP1 немного снизилась через 1 день, достигла минимума через 3 дня после TBI, а затем восстановилась через 5 и 7 дней после TBI. Между тем, 1 мМ или 2 мМ PQQ увеличивали экспрессию мРНК WISP1 через 3, 5 и 7 дней после TBI, но эффект 1 мМ PQQ был очевиден для 2 мМ PQQ (рис. 1).
Между тем, 1 мМ или 2 мМ PQQ увеличивали экспрессию мРНК WISP1 через 3, 5 и 7 дней после TBI, но эффект 1 мМ PQQ был очевиден для 2 мМ PQQ (рис. 1).
Для исследования типа клеток, локализованных WISP1, была проведена иммунофлуоресценция с двойной меткой.Были исследованы совместные локализации WISP1 с маркером астроцитов GFAP, нейрональным маркером NeuN, маркером микроглии Iba1 соответственно. По сравнению с фиктивной группой, WISP1-положительные сигналы немного уменьшились в контрольном боковом мозге и значительно уменьшились в ипсилатеральном мозге. Однако положительные сигналы GFAP немного увеличились в контрольном боковом мозге и резко увеличились в ипсилатеральном мозге. Между WISP1 и GFAP в фиктивной группе наблюдалась небольшая совместная локализация. Однако очевидные колокализации наблюдались в головном мозге через 3 дня после ЧМТ, включая ипсилатеральный и контрольный боковой мозг (рис. 2).
NeuN-положительные сигналы, очевидно, уменьшились в ипсилатеральном мозге и немного уменьшились в контрольном боковом мозге по сравнению с фиктивной группой (рис. 3). Иммунофлуоресценция с двойной меткой продемонстрировала, что наблюдались очевидные колокации WISP1 и NeuN либо в ипсилатеральном, либо в контрольном боковом мозге после ЧМТ через 3 дня по сравнению с фиктивной группой.
3). Иммунофлуоресценция с двойной меткой продемонстрировала, что наблюдались очевидные колокации WISP1 и NeuN либо в ипсилатеральном, либо в контрольном боковом мозге после ЧМТ через 3 дня по сравнению с фиктивной группой.
В то же время произошло небольшое совместное размещение WISP1 и Iba1. По сравнению с фиктивной группой, Iba1-положительные сигналы значительно увеличились в ипсилатеральном мозге (рис. 4).
3.2. WISP1 и взаимосвязь между аутофагией и апоптозом
Повреждение мозга часто сопровождалось возникновением апоптоза и аутофагии. В настоящем исследовании двойная иммунофлуоресценция использовалась для обнаружения совместной локализации WISP1 и маркера аутофагии LC3 и маркера апоптоза, расщепленного каспазой-3. По сравнению с фиктивной группой, LC3-положительные сигналы имели существенное увеличение в ипсилатеральном мозге и не имели значительного изменения в контрольном боковом мозге через 3 дня после ЧМТ.После обработки 1 мМ PQQ через 3 дня после ЧМТ, WISP1-положительные сигналы явно усилились; Положительные сигналы LC3 заметно уменьшились в ипсилатеральном мозге. Иммунофлуоресценция с двойной меткой показала, что была большая совместная локализация WISP1 и LC3 (рис. 5).
Иммунофлуоресценция с двойной меткой показала, что была большая совместная локализация WISP1 и LC3 (рис. 5).
Через 3 дня после TBI, по сравнению с фиктивной группой, экспрессия расщепленной каспазы-3 явно повышалась в ипсилатеральном мозге и не имела значительных изменений в контрольной боковой части мозга. После лечения 1 мМ PQQ через 3 дня после ЧМТ, положительные сигналы от расщепленной каспазы-3 явно снизились в ипсилатеральном мозге.Иммунофлуоресценция с двойной меткой показала небольшую совместную локализацию WISP1 и расщепленной каспазы-3 (фиг. 6).
3.3. Взаимосвязь WISP1 и
β -катенин Изменения экспрессии белка WISP1 и β -катенин были выполнены с помощью вестерн-блоттинга, который показал, что тенденция экспрессии белка WISP1 аналогична тенденции экспрессии белка β -катенина при разные моменты времени после ЧМТ. Экспрессия белка WISP1 и β -катенина немного снизилась через 1 день после TBI, минимизировалась через 3 дня после TBI и снова выросла через 5 дней после TBI и немного снизилась через 7 дней после TBI по сравнению с фиктивной группой (рис. 7 (а)).Между тем, обработка 1 мМ PQQ увеличивала экспрессию белка WISP1 и β -катенина через 3 дня, 5 дней и 7 дней после TBI (фигура 7 (b)). При обработке 2 мМ PQQ не было явной тенденции изменения (рис. 7 (c)).
7 (а)).Между тем, обработка 1 мМ PQQ увеличивала экспрессию белка WISP1 и β -катенина через 3 дня, 5 дней и 7 дней после TBI (фигура 7 (b)). При обработке 2 мМ PQQ не было явной тенденции изменения (рис. 7 (c)).
Через 3 дня после ЧМТ, что касается фиктивной группы, экспрессия WISP1 значительно снизилась в ипсилатеральном мозге и немного снизилась в контрольном мозге. Более того, тенденция изменения сигнала β -катенин-положительного сигнала была аналогична таковой для WISP1. Иммунофлуоресценция с двойной меткой показала, что была большая совместная локализация WISP1 с β -катенином (фиг. 8).
Вводили ингибитор PI3K LY294002 (10 мкМ М) и GSK-3 β ингибитор SB21673 (5 мкМ М) с WISP1 (10 нг / мл). Эксперименты показали, что экспрессия WISP1 снижается при введении глутамата, а затем повышается после использования 50 мкл M PQQ, а также белка WISP1. Интересно, что экспрессия WISP1 не увеличивалась под действием глутамата после блокирования сигнального пути PI3K / GSK-3 β , так же как и β -катенин (фиг. 9).
9).
Иммунофлуоресценция с двойной меткой показала, что WISP1 и нейрон в значительной степени совмещаются в TBI, поэтому для дальнейшего изучения были выбраны клетки SHSY5Y и клетки PC12. Иммунофлуоресценция показала, что WISP1 распределяется в цитоплазме либо в клетках SHSY5Y, либо в клетках PC12 (фиг.10).
Совместная локализация WISP1 и β -катенина была обнаружена в клетках SHSY5Y или клетках PC12. Иммунофлуоресценция показала, что β -катенин был распределен в цитоплазме клеток SHSY5Y или клеток PC12, и была очевидная экспрессия в ядре клеток SHSY5Y.Иммунофлуоресценция с двойной меткой показала, что WISP1 колокализируется с β -катенином в цитоплазме клеток SHSY5Y или PC12 (фиг. 11).
3.4. Влияние PQQ на жизнеспособность клеток
Влияние различных концентраций или времени PQQ на активность клеток PC12 и SHSY5Y проводили с помощью анализа CCK-8. Результаты показали, что при инкубации клеток PC12 в течение 24 часов с 10, 20, 30, 40 и 50 мкл M PQQ не наблюдалось явного влияния на активность клеток PC12 по сравнению с контрольной группой (фигура 12 (а)). Между тем аналогичные результаты были получены на клетках SHSY5Y. То есть не было очевидного изменения жизнеспособности клеток SHSY5Y, обработанных с 10, 20, 30, 40 и 50 мкл M PQQ или без них в течение 24 часов (фигура 12 (b)). Когда 50 мкл M PQQ инкубировали в течение 6 часов, 12 часов, 24 часов и 48 часов в клетках PC12, наблюдалось небольшое влияние на активность клеток PC12 через 48 часов (фигура 12 (c)). В то же время, применяя тот же подход к клеткам SHSY5Y, активность клеток SHSY5Y соответствовала активности клеток PC12 (фигура 12 (d)).
Между тем аналогичные результаты были получены на клетках SHSY5Y. То есть не было очевидного изменения жизнеспособности клеток SHSY5Y, обработанных с 10, 20, 30, 40 и 50 мкл M PQQ или без них в течение 24 часов (фигура 12 (b)). Когда 50 мкл M PQQ инкубировали в течение 6 часов, 12 часов, 24 часов и 48 часов в клетках PC12, наблюдалось небольшое влияние на активность клеток PC12 через 48 часов (фигура 12 (c)). В то же время, применяя тот же подход к клеткам SHSY5Y, активность клеток SHSY5Y соответствовала активности клеток PC12 (фигура 12 (d)).
Вестерн-блоттинг был использован для определения экспрессии белка WISP1 в клетках PC12 или SHSY5Y, которые обрабатывали различными концентрациями PQQ в течение 24 часов. По сравнению с контрольной группой, экспрессия WISP1 незначительно увеличивалась с 10 мкМ М PQQ, достигала пика в клетках PC12, обработанных 20 мкМ М PQQ в течение 24 часов, а затем в других группах постепенно снижалась. Более того, экспрессия β -катенина в клетках PC12 достигла пика при 20 μ M PQQ в течение 24 часов. Не было очевидной разницы с 10, 30, 40 и 50 мкМ M PQQ (рисунок 13 (а)).Между тем аналогичные результаты были получены на клетках SHSY5Y (фиг. 13 (b)).
Не было очевидной разницы с 10, 30, 40 и 50 мкМ M PQQ (рисунок 13 (а)).Между тем аналогичные результаты были получены на клетках SHSY5Y (фиг. 13 (b)).
50 мкМ M PQQ использовали для обнаружения экспрессии белка WISP1 в клетках PC12 или SHSY5Y через 6, 12, 24 и 48 часов. По сравнению с контрольной группой результаты показали, что экспрессия WISP1 постепенно снижалась в зависимости от времени и достигла минимума в клетках PC12, обработанных 50 мкл M PQQ в течение 48 часов. Экспрессия белка β -катенин в клетках PC12 достигла минимума через 48 часов и немного увеличилась через 6, 12 и 24 часа по сравнению с контрольной группой, но не была значительной () (рис. 14 (а)).В то же время аналогичные результаты были получены на клетках SHSY5Y. Экспрессия WISP1 в клетках SHSY5Y была аналогична экспрессии β -катенина в клетках PC12; Экспрессия белка β -катенин в клетках SHSY5Y достигла минимума через 48 часов и немного увеличилась через 6 часов и 12 часов, но не было существенной разницы по сравнению с контрольной группой () (фигура 14 (b)).
Перед добавлением глутамата в клеточную среду добавляли 25 μ M, 50 μ M и 100 μ M PQQ соответственно.Результаты анализа EdU показали, что PQQ может способствовать пролиферации астроцитов, ингибируемой глутаматом (,) (рис. 15).
Анализ миграции через лунки показал, что 5 μ M, 50 μ M и 100 μ M PQQ могут обратить вспять миграцию астроцитов, ингибируемую глутаматом (,) (фигура 16).
Для наблюдения за функцией WISP1 si-РНК WISP1 трансфицировали в астроциты. По сравнению с группой отрицательного контроля, экспрессия WISP1 явно снижалась после трансфекции si-РНК WISP1 в течение 48 часов, что позволяет предположить, что si-РНК WISP1 была эффективной (,) (Рисунки 17 (a), 17 (b) и 17 (в)).
Экспрессия WISP1 была подавлена, и был проведен анализ EdU. WISP1 может увеличивать положительные сигналы астроцитов () (Рисунки 17 (d) и 17 (e)). Сходным образом, чтобы определить, играет ли WISP1 важную роль в миграции клеток, был использован анализ миграции через лунки для обнаружения миграции астроцитов; результаты показывают, что количество мигрировавших клеток значительно увеличилось после интерференционной экспрессии WISP1 () (Фигуры 17 (f) и 17 (g)).
4. Обсуждение
Черепно-мозговая травма (ЧМТ) в основном вызывается внешней механической силой, которую можно разделить на первичные и вторичные повреждения.ЧМТ можно классифицировать по степени тяжести или механизму травмы, а также по другим признакам. В большинстве случаев ЧМТ приводит к более высокому уровню смертности и инвалидности; кроме того, ЧМТ может вызывать физические, патологические и поведенческие эффекты. Таким образом, все больше и больше людей привлекали всеобщее внимание. Защита нейронов является основным методом лечения церебральной травмы, и цели лечения сосредоточены на целях программы гибели клеток. Однако до сих пор не существует эффективного метода лечения ЧМТ.
WISP1 — это семейство секретируемых белков, регулирующих различные процессы развития.Белки Wnt1 объединяют рецептор клеточной мембраны посредством аутокринных или паракринных эффектов, активируют внутриклеточные сигнальные пути, регулируют экспрессию генов-мишеней и играют важную роль в пролиферации, полярности и дифференцировке клеток, а также миграции. WISP1 секретирует индуцированный Wnt1 белок 1, также известный как CCN4, когнитивный фактор роста соединительной ткани (CTGF) [2]. WISP1 позже был связан с опухолевым ростом в желудочно-кишечном тракте [25]. В настоящем исследовании экспрессия мРНК WISP1 была обнаружена с помощью qRT-PCR после травмы головного мозга.По сравнению с фиктивной группой экспрессия мРНК WISP1 достигала минимума через 3 дня, а затем восстанавливалась через 5 дней после TBI. Между тем, экспрессия мРНК WISP1 увеличивалась с 1 мМ или 2 мМ PQQ в разное время после TBI, но эффект 1 мМ PQQ был очевиден для 2 мМ PQQ, что может быть концентрацией 1 мМ PQQ у животных, которые могут достичь оптимальной сывороточной концентрации при ЧМТ.
WISP1 секретирует индуцированный Wnt1 белок 1, также известный как CCN4, когнитивный фактор роста соединительной ткани (CTGF) [2]. WISP1 позже был связан с опухолевым ростом в желудочно-кишечном тракте [25]. В настоящем исследовании экспрессия мРНК WISP1 была обнаружена с помощью qRT-PCR после травмы головного мозга.По сравнению с фиктивной группой экспрессия мРНК WISP1 достигала минимума через 3 дня, а затем восстанавливалась через 5 дней после TBI. Между тем, экспрессия мРНК WISP1 увеличивалась с 1 мМ или 2 мМ PQQ в разное время после TBI, но эффект 1 мМ PQQ был очевиден для 2 мМ PQQ, что может быть концентрацией 1 мМ PQQ у животных, которые могут достичь оптимальной сывороточной концентрации при ЧМТ.
Активация астроцитов — обычная реакция в центральной нервной системе во многих патофизиологических ситуациях, которые предполагают гипертрофию клеток астроцитов, набухание, расширение выпуклостей и увеличение экспрессии кислого белка глиальных фибриллярных фибрилляций [26, 27]. Астроциты начали активироваться после ЧМТ и даже могут вызвать несколько нейродегенеративных заболеваний. В этой статье иммунофлуоресценция с двойной меткой была проведена для определения типа клеток, которые WISP1 расположены в головном мозге. Результаты показали, что WISP1 располагается в основном в нейроне мозга благодаря совместной локализации WISP1 с маркером астроцитов GFAP, нейрональным маркером NeuN и маркером микроглии Iba1, соответственно.
Астроциты начали активироваться после ЧМТ и даже могут вызвать несколько нейродегенеративных заболеваний. В этой статье иммунофлуоресценция с двойной меткой была проведена для определения типа клеток, которые WISP1 расположены в головном мозге. Результаты показали, что WISP1 располагается в основном в нейроне мозга благодаря совместной локализации WISP1 с маркером астроцитов GFAP, нейрональным маркером NeuN и маркером микроглии Iba1, соответственно.
После черепно-мозговой травмы уровни аутофагии различаются. Аутофагия подразделяется на три различные категории, называемые микроаутофагией, макроаутофагией и опосредованной шаперонами аутофагией [28].Аутофагия — это метаболический процесс эукариотических клеток, аутофагия, связанная с заболеванием, постепенно усиливается в последние годы. Аутофагия участвует в патогенезе повреждения и гибели нейронов, включая повреждение митохондрий, активацию воспаления, окислительные свободные радикалы и активацию каспаз [29]. Помимо гибели клеток, которая была вызвана ЧМТ, аутофагическая гибель клеток и апоптоз занимают значительную долю, аутофагия защищает поврежденные клетки, а также усугубляет повреждение клеток, которое в основном зависит от роли аутофагии после повреждения и стадии. Аутофагия участвует в регуляции выживаемости клеток после смерти при черепно-мозговой травме, и, как следствие, аутофагия важна для травм головного мозга, а также повреждения и восстановления нервов [30]. Двойная иммунофлуоресценция WISP1 и маркера аутофагии LC3 показала, что WISP1 и LC3 имели высокую совместную локализацию через 3 дня после TBI. После обработки 1 мМ PQQ, WISP1-положительные сигналы явно усилились; LC3-положительные сигналы заметно снизились в ипсилатеральном мозге. Все эти данные продемонстрировали, что PQQ может играть защитную роль в аутофагии.Кроме того, считается, что апоптоз вносит значительный вклад в патогенез множества заболеваний после ЧМТ. Например, в мозге пациентов с болезнью Альцгеймера наблюдались апоптотическая фрагментация ДНК [31] и активация каспаз [32]. Активация каспазы-3 имеет отношение к апоптозу нейронов после различных типов повреждений. В этом исследовании иммунофлуоресценция с двойной меткой показала, что WISP1 частично колокализуется с расщепленной каспазой.
Аутофагия участвует в регуляции выживаемости клеток после смерти при черепно-мозговой травме, и, как следствие, аутофагия важна для травм головного мозга, а также повреждения и восстановления нервов [30]. Двойная иммунофлуоресценция WISP1 и маркера аутофагии LC3 показала, что WISP1 и LC3 имели высокую совместную локализацию через 3 дня после TBI. После обработки 1 мМ PQQ, WISP1-положительные сигналы явно усилились; LC3-положительные сигналы заметно снизились в ипсилатеральном мозге. Все эти данные продемонстрировали, что PQQ может играть защитную роль в аутофагии.Кроме того, считается, что апоптоз вносит значительный вклад в патогенез множества заболеваний после ЧМТ. Например, в мозге пациентов с болезнью Альцгеймера наблюдались апоптотическая фрагментация ДНК [31] и активация каспаз [32]. Активация каспазы-3 имеет отношение к апоптозу нейронов после различных типов повреждений. В этом исследовании иммунофлуоресценция с двойной меткой показала, что WISP1 частично колокализуется с расщепленной каспазой. Экспрессия расщепленной каспазы-3 явно усиливалась в ипсилатеральном мозге через 3 дня после ЧМТ.После обработки 1 мМ PQQ, положительные сигналы от расщепленной каспазой-3 явно снизились, что напомнило, что WISP1 может не участвовать непосредственно в процессе апоптоза.
Экспрессия расщепленной каспазы-3 явно усиливалась в ипсилатеральном мозге через 3 дня после ЧМТ.После обработки 1 мМ PQQ, положительные сигналы от расщепленной каспазой-3 явно снизились, что напомнило, что WISP1 может не участвовать непосредственно в процессе апоптоза.
WISP1 и β -катенин действуют как новые мишени, исследованные в последние годы, которые могут способствовать пролиферации тканей, а также различному восстановлению клеток. Что касается канонических путей Wnt1 [33], то WISP1 может блокировать фосфорилирование β -catenin в нейронах, что может быть опосредовано посредством ингибирования GSK-3 β , которые предотвращают фосфорилирование β -catenin [33].WISP1 также может блокировать активность GSK-3 β в других клеточных системах, таких как клетки сердца [12, 34]. В нейронах WISP1 посредством пути, опосредованного PI3K, способствует экспрессии в ядре β -катенина [4]. Кроме того, экспрессия WISP1 регулируется активностью β -катенина, а WISP1 регулирует свою собственную экспрессию посредством способности WISP1 контролировать фосфорилирование β -катенина и ядерную транслокацию [4]. Вестерн-блоттинг показал, что экспрессия белка WISP1 и β -катенина минимизировалась через 3 дня и снова повысилась через 5 дней после TBI по сравнению с фиктивной группой.Между тем, обработка 1 мМ или 2 мМ PQQ увеличивала экспрессию белка WISP1 и β -катенина соответственно. Все эти результаты продемонстрировали, что WISP1 может модулировать экспрессию белка β -катенина.
Вестерн-блоттинг показал, что экспрессия белка WISP1 и β -катенина минимизировалась через 3 дня и снова повысилась через 5 дней после TBI по сравнению с фиктивной группой.Между тем, обработка 1 мМ или 2 мМ PQQ увеличивала экспрессию белка WISP1 и β -катенина соответственно. Все эти результаты продемонстрировали, что WISP1 может модулировать экспрессию белка β -катенина.
PQQ, также известный как метоксатин, был обнаружен в широком спектре пищевых продуктов и других источников. PQQ, как важный антиоксидант и питательное вещество, также начал уделять внимание нутриологии и фармакологии. PQQ относится к витамину B [21]. PQQ обладает множеством других фармакологических эффектов, в том числе противовоспалительным, гепатопротекторным, защитным и антиоксидантным действием [22, 35, 36].PQQ обладает нейропротекторной функцией и очень хорошо влияет на модель эпилепсии посредством сигнального пути PI3K / AKT [37]. Хотя роль PQQ в качестве витамина в человека или животного питания является спорным, накапливая данные свидетельствуют о том, что PQQ играет важную роль по защите клеток. В эксперименте мы использовали различные концентрации PQQ для обработки клеток SHSY5Y или PC12; результаты показали, что PQQ не оказывает токсического воздействия на клеточные линии. Точно так же PQQ не оказал значительного влияния на животное без TBI. В последующих экспериментах, кроме того, PQQ может защищать клетки, влияя на экспрессию WISP1.
В эксперименте мы использовали различные концентрации PQQ для обработки клеток SHSY5Y или PC12; результаты показали, что PQQ не оказывает токсического воздействия на клеточные линии. Точно так же PQQ не оказал значительного влияния на животное без TBI. В последующих экспериментах, кроме того, PQQ может защищать клетки, влияя на экспрессию WISP1.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Выражение признательности
Эта работа была поддержана Национальным естественнонаучным фондом Китая (31370803), программой прикладных исследований города Наньтун (BK2013004), программой ранних предварительных исследований Университета Наньтун (10ZY013) и докторской программой Университета Наньтун ( 12В035).
Пирролохинолинхинон (PQQ) Добавки обладают антивозрастным действием и полезны для здоровья мозга
Ученые все больше узнают о питательных веществах, влияющих на клетки и мозг.Пирролохинолинхинон (PQQ) — это питательное вещество, содержащееся в некоторых фруктах, овощах, чае и яйцах. Добавки PQQ улучшают работу митохондрий и мозг. С возрастом крошечные митохондрии внутри клеток становятся все более поврежденными. PQQ — это хинон, который может оказаться важной добавкой против старения.
Добавки PQQ улучшают работу митохондрий и мозг. С возрастом крошечные митохондрии внутри клеток становятся все более поврежденными. PQQ — это хинон, который может оказаться важной добавкой против старения.
Человек не может производить собственный пирролохинолинхинон. Вы можете получить немного PQQ через свой рацион. PQQ естественным образом содержится в таких продуктах питания, как бананы, капуста, морковь, сельдерей, яичные желтки, бобы, горчица, зеленый перец, киви, мисо, натто (ферментированные соевые бобы), апельсины, папайя, петрушка, картофель, шпинат, сладкий картофель. , тофу, помидоры и зеленый чай.Бактерии внутри людей могут производить некоторое количество PQQ. Однако добавки PQQ обеспечивают стабильную и предсказуемую дозу. Мы рекомендуем всего от 10 до 20 мг добавок PQQ в день.
Исследование пирролохинолинхинона
Люди с высоким риском неврологических заболеваний, особенно пожилые люди, должны знать о текущих исследованиях PQQ:
- Может увеличить приток крови к префронтальной коре 1 , таким образом защищая от когнитивного снижения, связанного с возрастом
- Может защитить мозг от болезни Паркинсона, болезни Альцгеймера и травм головного мозга.
 2
2
3 - Снижает агрегацию альфа-синуклеина и бета-амилоида, связанную с некоторыми неврологическими заболеваниями 4 5
- Улучшает качество сна 6
- Снижает воспаление 7 , вызывающее широкий спектр заболеваний старения
PQQ и микроконидии
PQQ имеет решающее значение для функционирования митохондрий. Как батареи клетки, митохондриальная активность, по-видимому, контролирует процесс старения и долголетие. 8 PQQ стимулирует биогенез митохондрий.
Нарушения походки при болезни Паркинсона
Пациенты с болезнью Паркинсона часто имеют нарушения походки. Ходьба требует, чтобы многие части мозга работали вместе. Исследования показали, что добавка PQQ улучшает нарушения походки у пациентов с болезнью Паркинсона. 9 10
Natural Eye Care предлагает PQQ в своем интернет-магазине. Также ознакомьтесь с книгой Майкла Эдсона « Natural Parkinson’s Support » для получения информации о PQQ и многом другом.




 11.2007.
11.2007. Curr Opin Microbiol 4 : 343–350
Curr Opin Microbiol 4 : 343–350  , Пал К.К., Бхатт Д.М., Чаухан С.М. (2004) Стимуляция роста и повышение урожайности арахиса ( Arachis hypogaea L.) путем применения ризобактерий, способствующих росту растений. Microbiol Res 159 : 371–394
, Пал К.К., Бхатт Д.М., Чаухан С.М. (2004) Стимуляция роста и повышение урожайности арахиса ( Arachis hypogaea L.) путем применения ризобактерий, способствующих росту растений. Microbiol Res 159 : 371–394  Нат Генет 3 : 266–272
Нат Генет 3 : 266–272  2. Биосинтетическая сборка из глутамата и тирозина.J Am Chem Soc 113 : 3162–3166
2. Биосинтетическая сборка из глутамата и тирозина.J Am Chem Soc 113 : 3162–3166  Джин 70 : 191–197
Джин 70 : 191–197  J Microbiol Biotechnol 13 : 292–300
J Microbiol Biotechnol 13 : 292–300  , Сено Х., Ураками Т., Мацумото Т., Сузуки О (1992) Следовые уровни пирролохинолинхинона в образцах человека и крысы, обнаруженные с помощью газовой хроматографии / масс-спектрометрии.Biochim Biophys Acta 1156 : 62–66
, Сено Х., Ураками Т., Мацумото Т., Сузуки О (1992) Следовые уровни пирролохинолинхинона в образцах человека и крысы, обнаруженные с помощью газовой хроматографии / масс-спектрометрии.Biochim Biophys Acta 1156 : 62–66  Proc Natl Acad Sci USA 101 : 7913–7918
Proc Natl Acad Sci USA 101 : 7913–7918  FEBS Lett 578 : 26–30
FEBS Lett 578 : 26–30  Physiol Plant 118 : 10–15
Physiol Plant 118 : 10–15  Лабораторный пресс Колд-Спринг-Харбор, Колд-Спринг-Харбор, Нью-Йорк
Лабораторный пресс Колд-Спринг-Харбор, Колд-Спринг-Харбор, Нью-Йорк  Proc Soc Exp Biol Med 197 : 19–26
Proc Soc Exp Biol Med 197 : 19–26  J Nutr 124 : 744–753
J Nutr 124 : 744–753  J Nutr Sci Vitaminol (Токио) 43 : 19–33
J Nutr Sci Vitaminol (Токио) 43 : 19–33  Agric Biol Chem 52 : 1065–1066
Agric Biol Chem 52 : 1065–1066  2
2