Как принимать л карнитин во время тренировки
КОМУ? СКОЛЬКО? ЗАЧЕМ?Инструктор групповых программ Юлия Бисерова: в погоне за быстрым результатом в борьбе с лишним весом люди готовы на многое… Начну с самого часто задаваемого вопроса в моей тренерской практике: «помогает ли L-carnitine жечь жир?» Ответ утвердительный, НО существует ряд условий, которые необходимо соблюдать, чтобы не причинить своему организму вред вместо пользы
Итак, разберёмся. Основное условие приема L-carnitine – спортивные нагрузки, так как вещество само по себе не сжигает жир, а является помощником в этом процессе – это витаминообразное вещество, которое вырабатывается в организме, синтезируется из двух аминокислот: лизин и метионин, доставляет жирные кислоты прямиком в «сердце» клеток – митохондрии. Недостаток витаминообразного вещества может возникнуть у людей сидящих на диете, а также с заболеваниями желудочно-кишечного тракта вследствие приема некоторых антибиотиков и препаратов, которые влияют на свертываемость крови; у вегетарианцев и сыроедов.
Польза L-carnitine:
— благотворно влияет на клетки головного мозга, замедляет их старение
— увеличивает регенерацию клеток, замедляет процессы старения
— улучшает память— повышает физическую выносливость и работоспособность
— помогает насытить клетки кислородом
— снижает уровень плохого холестерина
— способствует сжиганию жира
⠀
Принимать данное вещество дополнительно можно не более 2 гр в сутки. По мнению врачей наш организм не способен усвоить больше, но при ОБЯЗАТЕЛЬНОМ соблюдении условий: Вы регулярно тренируетесь и правильно питаетесь. Лёжа на диване, создавая физическую нагрузку ротовой полости в виде пережёвывания картохи «фри», чипсов и заливая колу, карнитин не работает. Из моих личных наблюдений и логических суждений: чрезмерное употребление данного вещества чревато бессонницей, головной болью, тошнотой.
 Уместно допустить, что наш организм замедляет или прекращает выработку собственного карнитина, т.к. получает с лихвой из вне. А если Вы резко прекратите приём, то пойдёт обратный эффект: слабость, сонливость и т.д.
Уместно допустить, что наш организм замедляет или прекращает выработку собственного карнитина, т.к. получает с лихвой из вне. А если Вы резко прекратите приём, то пойдёт обратный эффект: слабость, сонливость и т.д.⠀
Признаки переизбытка вещества в организме:
— диарея
— учащенное сердцебиение
— повышение уровня аммиака в организме
— судороги
— тошнота
И, конечно, о побочном действии:
— нарушения сна при приеме препарата во второй половине дня или на ночь
— диспепсия
Если говорить о себе, то принимаю L-carnitine редко и только перед тренировкой в дозировке 0.5 — 1.5 г
Бесплатная тренировка
Смотрите так же:
О пользе и вреде сыра рассказала врач-диетолог
Наталья Николаевна, гаудой и маасдамом, которые лет 15 назад считались в нашей стране деликатесами, сейчас уже никого не удивишь. Теперь российские производители научились делать даже страчателлу и буррату, освоили выпуск сыров с плесенью. Выдерживается ли технология, которая оттачивалась веками? Как покупателю сориентироваться в многообразии сыров?
Выдерживается ли технология, которая оттачивалась веками? Как покупателю сориентироваться в многообразии сыров?
Наталья Денисова: Главное – продукт должен быть безопасным. Поэтому важно, чтобы сыр был изготовлен из пастеризованного молока. Недобросовестные производители могут допускать нарушение технологий, из-за чего сыр оказывается заражен листериями. Это род грамположительных палочковидных бактерий. Некоторые виды являются возбудителями заболеваний животных и человека. При употреблении такого сыра возможно развитие инфекционного заболевания – листериоза. Оно проявляется обычно рвотой и диареей. Листериями чаще всего бывают заражены мягкие молодые сыры.
При этом ведь сыр – полезный продукт. Говорят, он способствует укреплению костей, нормализует кровяное давление.
Наталья Денисова: Регулярное употребление твердых сортов сыра действительно полезно. Содержащиеся в них кальций, белок, магний, цинк и витамины A, D и K способствуют укреплению костей у детей и молодых людей и профилактике остеопороза у пожилых. Также употребление сыра положительно влияет на зубы. Есть исследования, свидетельствующие о том, что сыр повышает уровень рН в зубном налете, обеспечивая защиту от кариеса.
Также употребление сыра положительно влияет на зубы. Есть исследования, свидетельствующие о том, что сыр повышает уровень рН в зубном налете, обеспечивая защиту от кариеса.
Сыры полезны и для здоровья кровеносных сосудов. В 2014 году исследователи пришли к выводу, что молочные продукты, к которым относится и сыр, могут быть источником антиоксиданта глутатиона, который играет важную роль в здоровье мозга и предотвращении возрастной нейродегенерации.
К другим полезным свойствам сыра можно отнести содержание кислот, предупреждающих развитие онкологических заболеваний.
А кому сыр противопоказан?
Наталья Денисова: Значительное потребление насыщенных жиров может увеличить риск развития сахарного диабета, ожирения и сердечно-сосудистых заболеваний. Наряду с жиром возможно высокое содержание натрия в твердых выдержанных сырах, избыток которого приводит к повышению артериального давления и увеличению риска сердечно-сосудистой патологии.
Сыр также противопоказан людям с непереносимостью лактозы. Но уровни переносимости индивидуальны, поэтому некоторые с такой особенностью все же могут позволить себе определенные твердые сыры, такие как чеддер и пармезан.
Но уровни переносимости индивидуальны, поэтому некоторые с такой особенностью все же могут позволить себе определенные твердые сыры, такие как чеддер и пармезан.
Беременным женщинам надо с осторожностью употреблять мягкие сорта сыра, так как они могут быть изготовлены из непастеризованного молока, а это чревато листериозом, о котором я рассказала ранее. Также тем, кто ожидает ребенка, лучше исключить лакомства с благородной плесенью и специями из-за риска развития аллергии. Кроме того, сыры с плесенью не рекомендуются людям с болезнями ЖКТ.
А можно ли назвать сыр незаменимым продуктом в рационе здорового человека?
Наталья Денисова: Сыр – это источник таких незаменимых аминокислот, как лизин, метионин, триптофан. Последняя аминокислота – антидепрессант.
Этот продукт очень питательный и хорошо усваивается организмом. Например, в 100 граммах сыра содержится почти суточная норма кальция. А людям от 19 до 50 лет рекомендуется потреблять 1000 миллиграммов кальция в день. Однако не стоит забывать, что сыр – это калорийный продукт, поэтому хорош в меру.
Однако не стоит забывать, что сыр – это калорийный продукт, поэтому хорош в меру.
Какие группы сыров выделяют технологи?
Наталья Денисова: Есть несколько основных видов.
Цельномолочный сыр – в 100 граммах этого вида сыра содержится от 20 до 35 граммов жира, из них насыщенных жиров – 12–20 граммов.
Сыры быстрого созревания – те, что не требуют длительного времени на приготовление. Они обычно имеют более высокое содержание влаги, мягкую текстуру и вкус. К таким видам сыров относятся рикотта, сливочный сыр, маскарпоне.
Выдержанные твердые сыры имеют более твердую текстуру и, как правило, созревают в течение шести месяцев или дольше. Чем длительнее выдерживаются такие сыры, тем более концентрированный или резкий у них вкус. К таким видам сыров относятся чеддер, швейцарский, пармезан и др.
Обработанный сыр – это плавленый сыр, колбасный и сырные продукты. Данные виды нельзя отнести к классическому сыру, и этикетка должна отражать это.
Немолочные сыры подходят людям, которые не употребляют молочные продукты. К таким сырам относится соевый сыр тофу. По вкусу продукт уступает молочным собратьям, но богат растительными белками. Тофу рекомендован людям с заболеваниями органов ЖКТ.
Аминокислота DL-метионин для птиц | МЕГАМИКС
Кормовая компания Мегамикс Контакты:Адрес: ул. Б.Грузинская, д. 61, стр.2 123056 г. Москва Телефон: (495) 123-34-45 Электронная почта: [email protected] 55.772386,37.584479
Адрес: п. Первомайский, промышленная зона 040706 Республика Казахстан, Алматинская обл. Телефон: +7 (727) 299-39-99 Электронная почта: [email protected] 44.800584,78.1726
Адрес: ул.Городецкая 38А, офис 16
220125
Республика Беларусь, г. Минск
Телефон: +7 (017) 361-60-61, 361-60-62
Электронная почта: effektivft@gmail.
Адрес: Гипрозем 16 734067 Республика Таджикистан, г.Душанбе Телефон: +9 (22) 372-31-08-63 Электронная почта: [email protected] 41.285265,69.309687
Адрес: ул. Фаргона йули, 23 100005 Республика Узбекистан, г.Ташкент Телефон: +998 (71) 291-62-49 Электронная почта: [email protected] 41.285265,69.309687
Адрес: ул.Добролюбова, 53/4 офис35 г. Ставрополь Телефон: +7(8652)99-70-17 Электронная почта: [email protected] 45.037088,41.990607
Адрес: пер. Почтовый, д. 9 460000 г. Оренбург Телефон: +7 (8442) 97-97-97 доб. 181 Электронная почта: [email protected] 51.760596,55.108337
Адрес: ул.Нальчикское шоссе,13
Ставропольский край, Пятигорск
Телефон: +7-926-029-79-00
Электронная почта: kavkaz@megamix. ru
44.00935,43.104312
ru
44.00935,43.104312
Адрес: Ракитянский р-он, ул. Пролетарская, д. 2А. 309310 Белгородская обл., п. Ракитное Телефон: +7 (8442) 97- 97- 97 доб. 496 Электронная почта: [email protected] 50.834087,35.834156
Адрес: ул. Куйбышева, 1 Челябинская область, г.Коркино Телефон: +7 (8442) 97-97-97 доб. 491 Электронная почта: [email protected] 54.900808,61.396526
Адрес: ул. Дорожная, 5г 399540 Липецкая область, с. Тербуны Телефон: +7 (8442) 97-97-97 доб.432 Электронная почта: [email protected] 52.123517,38.273675
Адрес: пос. Новофедоровское, д.Кузнецово, а/д «Украина», 60 км 108805 г. Москва Телефон: +7 (495)122-23-70 Электронная почта: [email protected] 55.454195,36.949652
Адрес: пл. А.Невского, д. 2, БЦ Москва, оф. 1108
191167
г. Санкт-Петербург
Телефон: +7 (8442) 97-97-97 доб. 172
Электронная почта: [email protected]
59.924697,30.386157
А.Невского, д. 2, БЦ Москва, оф. 1108
191167
г. Санкт-Петербург
Телефон: +7 (8442) 97-97-97 доб. 172
Электронная почта: [email protected]
59.924697,30.386157
Адрес: ул. Хрустальная, д. 107, оф.1 400123 г. Волгоград Телефон: (8442) 97-97-97 Электронная почта: [email protected] 48.793832,44.534699
Польза аминокислот для организма. Как восполнить баланс
Аминокислоты необходимые элементы для нормального функционирования организма. Благодаря наличию аминокислот происходит лучшее усвоение витаминов и минеральных веществ. Также при помощи аминокислот осуществляется деятельность нервной системы, в частности осуществляется передача сигналов к головному мозгу. Существуют определенные аминокислоты, действие которых направлено на восстановление мышечных клеток, что является очень важным для человеческого организма.
Все аминокислоты можно разделить на три типа: заменимые, незаменимые и полузаменимые.
Заменимые аминокислоты организм вырабатывает самостоятельно. Как правило, в здоровом организме их достаточное количество. А вот незаменимые аминокислоты организм может получить только извне.
Незаменимые аминокислоты способствуют похудению. Худеющий человек может включить в свой рацион специальные пищевые добавки, которые содержат аминокислоты. Благодаря таким добавкам процесс похудения пройдет гораздо быстрее. Объясняется это тем, что аминокислоты наращивают мышечную массу, ускоряя при этом расщепления массы жировой.
Наличие незаменимых аминокислот необходимо для нормального функционирования различных процессов в организме. При их нехватке человек становится аморфным, снижается активность, также начинается стремительный рост жировых тканей.
Получить незаменимые аминокислоты можно из различных продуктов: яйца, рыба, мясо. Самым богатым продуктом, содержащим незаменимые аминокислоты являются панты марала. Именно поэтому пантолечение так популярно в современном обществе.
Именно поэтому пантолечение так популярно в современном обществе.
К незаменимым аминокислотам относят следующие вещества:
- Изолейцин и лейцин участвуют в синтезе белка, способствуют укреплению иммунитета.
- Фенилаланин способствует выработке коллагена, а также норэпинерфина, за счет которого осуществляется передача нервных сигналов от органических тканей в головной мозг.
- Валин улучшает регенерацию клеток, а также дает человеку возможность чувствовать себя в хорошем состоянии при резких перепадах температуры.
- Метионин улучшает регенерацию клеток печени
7 удивительных преимуществ метионина для здоровья
Добавки с метионином уместны в определенных ситуациях для повышения защитных сил организма, но это соединение следует использовать с осторожностью.
Что такое метионин?
Метионин — незаменимая аминокислота в организме, которую часто называют L-метионином. Эта аминокислота является важным компонентом в производстве многих других веществ, включая креатин и новые кровеносные сосуды по всему телу. Возможно, что наиболее важно, метионин является предшественником таурина и цистеина, двух других аминокислот.Это также связано с образованием хрящевой ткани. По сути, наличие надлежащего уровня этой аминокислоты очень важно для нормального функционирования организма, а также для процессов восстановления. [1]
Возможно, что наиболее важно, метионин является предшественником таурина и цистеина, двух других аминокислот.Это также связано с образованием хрящевой ткани. По сути, наличие надлежащего уровня этой аминокислоты очень важно для нормального функционирования организма, а также для процессов восстановления. [1]
С возрастом наш организм вырабатывает меньше этой и всех других аминокислот, что может потребовать приема добавок. При этом наличие слишком большого количества этого вещества в организме также может быть опасным, поскольку может привести к серьезным хроническим заболеваниям. Важно проконсультироваться с врачом, прежде чем принимать добавки с метионином или менять свой рацион, чтобы включить в него продукты, содержащие естественные формы этой аминокислоты.
Питательная миска сырых овсяных хлопьев. Фото: Shutterstock
Methionine Foods
Если вы хотите увеличить количество этой аминокислоты в своем теле, особенно если вы пытаетесь увеличить мышечный рост и повысить энергетический обмен, попробуйте есть больше следующих продуктов:
Эти продукты также являются отличным источником метионина. Также нетрудно внести небольшие изменения в свой рацион, чтобы повысить уровень метионина. При этом, если вы испытываете серьезный дефицит этой аминокислоты, могут потребоваться добавки. [2]
Также нетрудно внести небольшие изменения в свой рацион, чтобы повысить уровень метионина. При этом, если вы испытываете серьезный дефицит этой аминокислоты, могут потребоваться добавки. [2]
Преимущества метионина
Многие преимущества метионина включают его влияние на следующее:
- Инфекции мочевыводящих путей
- Уровни токсичности в организме
- Минеральная плотность костей
- Болезни Паркинсона
- Иммунная система
- Колоректальный рак
- Усилия по снижению веса
Давайте обсудим их подробно ниже.
Болезнь Паркинсона
Некоторые исследования показали, что дефицит этого соединения связан с болезнью Паркинсона, поэтому наличие этой аминокислоты в вашем рационе может помочь противодействовать или смягчать последствия этого изнурительного нейродегенеративного заболевания. [3]
Снижение веса
Как уже упоминалось, метионин является одним из ключевых ингредиентов креатина, который улучшает развитие мышц за счет жира. Это может помочь увеличить скорость метаболизма и помочь в борьбе с лишним весом. [4]
Это может помочь увеличить скорость метаболизма и помочь в борьбе с лишним весом. [4]
Минеральная плотность костей
Многие спортсмены выбирают эту добавку, потому что она может помочь в развитии и укреплении костей, что очень необходимо спортсменам, особенно если они получили травмы. [5]
Иммунная система
Было обнаружено, что наличие надлежащих уровней метионина в организме коррелирует с присутствием других аминокислот, многие из которых играют важную роль в функции иммунной системы. Метионин является предшественником некоторых из этих иммуностимулирующих аминокислот, которые могут помочь в защите и восстановлении.
Инфекции мочевыводящих путей
Метионин может слегка подкислять организм при приеме в виде добавок, что означает, что он также может сделать мочу более кислой.В такой среде инфекциям мочевыводящих путей трудно прижиться, что защищает женщин от этой неприятной проблемы, особенно тех, у кого рецидивирующие ИМП. [6]
[6]
Уровни токсичности
В присутствии других питательных веществ и соединений это соединение может стимулировать функцию печени и уменьшать последствия заболевания печени, тем самым выводя токсины на большую часть организма. [7]
Колоректальный рак
Были проведены специальные исследования воздействия метионина на колоректальный рак, как с точки зрения предотвращения риска, так и лечения.Высокий уровень аминокислот может обеспечить правильное образование в организме антиоксидантов, а именно глутатиона, поэтому людям с риском хронических заболеваний может потребоваться добавка метионина. [8]
Как использовать метионин?
Прежде всего, если вы хотите получить доступ к этой аминокислоте в продуктах питания, очень важно не подвергать продукты воздействию высоких температур в течение длительных периодов времени, так как это может привести к денатурированию аминокислот и их утрате. польза в организме. Однако, если вы хотите использовать добавки, важно знать, в какой дозировке их употреблять. Если вы принимаете чистую добавку, не употребляйте более 500 миллиграммов в день. Однако вы также можете найти эту конкретную аминокислоту в общей аминокислотной добавке; шанс потребления излишка в этом контексте маловероятен.
Однако, если вы хотите использовать добавки, важно знать, в какой дозировке их употреблять. Если вы принимаете чистую добавку, не употребляйте более 500 миллиграммов в день. Однако вы также можете найти эту конкретную аминокислоту в общей аминокислотной добавке; шанс потребления излишка в этом контексте маловероятен.
Как упоминалось ранее, наличие надлежащего баланса этой аминокислоты имеет решающее значение, поскольку слишком много или слишком мало может быть опасно.Некоторые из побочных эффектов чрезмерного употребления метионина включают следующее:
- Тошнота и рвота
- Повышенный риск заболевания печени
- Осложнения для беременных
- Неприятный запах изо рта (неприятный запах изо рта)
- Запор
Перед использованием этой добавки , это мудрый выбор — поговорить со своим врачом, особенно если вы принимаете какие-либо другие лекарства или у вас уже есть какие-либо заболевания.
Имеет ли L-метионин пользу для здоровья? Проверено 12 научных статей
Соня Ристевски Б.Sc.
В этой статье цитируется 12 научных работ и рассматривается 6 популярных заявлений.
L-метионин (L-Met), также известный как метионин, представляет собой аминокислоту, необходимую для образования белка в организме. Кроме того, как я обнаружил, ему приписывают много других ценных претензий.
Какие из этих заявлений?
Вот некоторые из тех, с которыми я столкнулся и буду заниматься: помогает с симптомами отмены лекарств, уменьшает тремор, связанный с болезнью Паркинсона, снижает риск колоректального рака, укрепляет костную ткань и полезен для набора веса. потеря.
Что такое L-метионин?
J.H. Мюллер, исследователь из Колумбийского университета в Нью-Йорке, впервые открыл метионин в 1922 году, когда выделил «сернистую аминокислоту». Однако, как гласит история, он представил неверную формулу. Три года спустя его коллега из Японии исправил формулу и назвал ее «метионин». Шесть лет спустя Г. Баргер и Ф. Койн определил его структуру.
Шесть лет спустя Г. Баргер и Ф. Койн определил его структуру.
Эти открытия были продолжены в послевоенные годы для лечения хронической белковой недостаточности, от которой страдают солдаты, возвращающиеся домой с войны.В 1946/47 году был осуществлен первый технически осуществимый синтез L-Met (1).
L-Met — одна из девяти незаменимых аминокислот, она важна для многих функций организма, включая рост и восстановление тканей (2). Аминокислоты сами по себе являются строительными блоками белка. Те, что называются «незаменимыми», не могут вырабатываться организмом, поэтому должны поступать с пищей.
Это потому, что у них есть углеродный скелет, который невозможно сделать из более простых молекул, чтобы удовлетворить потребности организма.Какие продукты содержат L-Met? По мере образования белка пищевые источники белка, такие как бобовые, орехи, мясо, рыба и молочные продукты, являются диетическими источниками аминокислоты (2).
Структурно L-Met представляет собой серосодержащую L-аминокислоту с молекулярной формулой C5h21NO2S. Это необходимо для выработки аминокислоты цистеина, являющейся принятым метаболическим предшественником. Только атом серы из L-Met переносится на цистеин; углеродный скелет цистеина предоставляется серином. Помимо L-Met, цистеин является единственной другой серосодержащей аминокислотой (2, 12).
Это необходимо для выработки аминокислоты цистеина, являющейся принятым метаболическим предшественником. Только атом серы из L-Met переносится на цистеин; углеродный скелет цистеина предоставляется серином. Помимо L-Met, цистеин является единственной другой серосодержащей аминокислотой (2, 12).
Есть ли исследования?
Поиск в PubMed статей с поисковыми запросами «L-метионин» или «метионин» на английском языке дает более десяти тысяч статей. Если сузить это до документов, предназначенных только для людей, термины предлагают чуть меньше трех тысяч работ. Сколько из них представляют собой высококачественные метаанализы или систематические обзоры? Сорок — с 1994 по текущий, 2017 год.
Каким образом это резюме исследования L-Met сравнивается с исследованиями чего-то еще популярного? Аминокислоты, в том числе L-Met, являются строительными блоками белка.На рынке есть много протеиновых добавок. Поиск качественных статей (метаанализы или систематические обзоры) по белку дал более тысячи статей, и это только статьи, относящиеся только к людям.
Давайте рассмотрим некоторые конкретные претензии индивидуально. Опять же, я сосредотачиваюсь на мощных метаанализах и систематических обзорах, которые предоставляют доказательства самого высокого качества, актуальные для людей и на английском языке.
Снижает ли L-метионин риск колоректального рака?
L-Met вовлечен в риск развития колоректального рака.Однако в литературе есть несоответствия: некоторые исследования показывают, что L-Met ограничивает опухолевые эффекты, тогда как другие предполагают, что избыток может иметь неблагоприятные результаты (4, 5).
Я нашел один метаанализ, посвященный диетическому потреблению L-Met в этом контексте, начиная с 2013 года. Он рассматривает 8 проспективных исследований с участием 431 029 участников с выявленным 6 331 случаем колоректального рака. Их результаты показывают, что диетический L-Met может быть связан со снижением риска колоректального рака, особенно рака толстой кишки.Однако они признают, что для подтверждения этих результатов необходимы дополнительные проспективные исследования с более длительным периодом наблюдения (4).
Существует один систематический обзор модели на животных (мышах). В нем рассматривается роль L-Met и фолиевой кислоты в развитии опухолей кишечника. Было обнаружено, что модуляция питания L-Met по-разному влияет на рак кишечника в зависимости от таких факторов, как дозировка, продолжительность и время вмешательства (5).
Bottom Line
Доказательства минимального качества, специфичные для людей, о роли L-Met в снижении риска колоректального рака.Чтобы сделать вывод, необходимо более качественное исследование.
Уменьшает ли тремор у пациентов с болезнью Паркинсона?
Мне не удалось найти никаких статей, не говоря уже о метаанализе или систематических обзорах, о роли L-Met или SAMe (S-аденозил-L-метионина) в болезни Паркинсона. Я расширил поиск, включив в него исследования на людях и животных.
Итог
Нет качественных доказательств роли L-Met в уменьшении тремора у пациентов с болезнью Паркинсона.
Повышает ли он прочность костей?
Согласно моему поиску, не было доступных качественных документов, подтверждающих роль L-Met или SAMe в укреплении прочности костей в исследованиях на людях или животных.
Мы можем сравнить это с доказательствами, доступными для Cissus Quadrangularis (CQ), традиционного аюрведического лекарственного растения, которое мы исследовали ранее. Мета-анализ 2017 года, оценивающий общую эффективность и безопасность этого растения, включал три исследования пациентов с переломами костей.Результаты были положительными в отношении роли в заживлении переломов костей и уменьшении боли в костях, при этом было показано, что CQ влияет на кости несколькими способами.
Bottom Line
Нет качественных доказательств роли L-Met или SAMe в наращивании прочности костей.
Помогает ли оно похуданию?
Мне не удалось найти ни метаанализов, ни систематических обзоров роли L-Met или SAMe в потере веса. Я расширил поиск, включив в него исследования на животных, и, аналогично, не смог найти здесь никаких качественных доказательств.
Я расширил поиск, включив в него исследования на животных, и, аналогично, не смог найти здесь никаких качественных доказательств.
Bottom Line
Нет доступных качественных доказательств, указывающих на роль L-Met или SAMe в содействии снижению веса человека.
Помогает ли это людям, страдающим от отмены наркотиков?
В этой категории не найдено ни систематических обзоров, ни метаанализов. Поисковые запросы включали L-Met и SAMe, отмену наркотиков, детокс и детоксикацию.
Bottom Line
Нет качественных доказательств, указывающих на роль L-Met или SAMe в поддержке отмены лекарств у людей.
Поддерживает ли он хорошее функционирование печени?
Мне не удалось найти никаких работ по L-Met, в частности, в контексте улучшения функции печени. В авторитетном интернет-источнике (PubChem) отмечается, что L-Met «помогает снизить уровень холестерина, увеличивая производство лецитина печенью, и уменьшает жир в печени. Он также может защитить от токсического воздействия токсинов печени, таких как парацетамол ». (2)
Он также может защитить от токсического воздействия токсинов печени, таких как парацетамол ». (2)
Как этого добиться, не совсем понятно. Считается, что метаболизм высоких доз парацетамола в печени приводит к снижению уровня глутатиона в печени, антиоксиданта, и усилению окислительного стресса.L-Met является предшественником L-цистеина, который может обладать антиоксидантной активностью.
L-цистеин также является предшественником антиоксиданта глутатиона. Антиоксидантная активность L-Met и метаболитов L-Met, по-видимому, объясняет его возможную защитную активность в отношении печени. Недавние исследования показывают, что сам L-Met обладает активностью по улавливанию свободных радикалов благодаря своей сере, а также своей хелатирующей способности (6).
Существует несколько систематических обзоров и метаанализов, посвященных влиянию SAMe на заболевания печени.SAMe является основным донором метила в реакциях метилтрансферазы, и хорошо известно, что добавка SAMe восстанавливает уровень глутатиона в печени, основного клеточного антиоксиданта, и снижает эффект повреждения печени.
Уровни SAMe в клетках печени могут влиять на различные патофизиологические процессы, включая окислительное состояние тканей, гибель клеток печени и злокачественную трансформацию. Его синтез снижен при хронических заболеваниях печени. Доклинические исследования показывают, что это может усугубить повреждение печени, и может оказаться полезным прием SAMe.Он широко используется в Восточной Европе, России, Китае, Южной Азии и Южной Америке при хронических заболеваниях печени. (7)
Сравнительно недавний (2015 г.) систематический обзор и метаанализ (8) рассматривали SAMe для лечения хронических заболеваний печени. Их результаты показывают, что SAMe может быть использован в качестве основы для режима лечения для улучшения функции печени из-за его безопасности. Однако SAMe также продемонстрировал ограниченную клиническую ценность при лечении некоторых хронических заболеваний печени.
В статье 2012 года была рассмотрена роль SAMe при заболеваниях печени (7). Поскольку не было проведено крупных высококачественных рандомизированных исследований, которые окончательно установили бы клиническую полезность при определенных болезненных состояниях, они не смогли сделать вывод о роли SAMe в функции печени.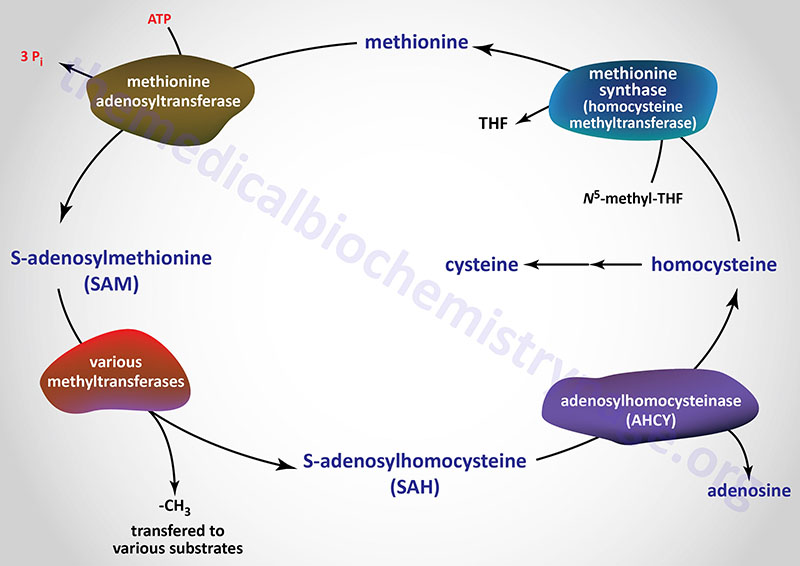
Интересно, что при использовании L-Met у пациентов с тяжелым поражением печени рекомендуется соблюдать осторожность, поскольку он может усугубить печеночную энцефалопатию (потеря функции мозга, когда поврежденная печень не выводит токсины из крови) (9) .
Bottom Line
Имеются некоторые доказательства и качественная литература о роли L-Met и слабые доказательства роли SAMe в поддержке функции печени у людей. Чтобы сделать окончательные выводы, необходимы более масштабные и качественные исследования. Осторожность рекомендуется тем, у кого уже имеется серьезное повреждение печени.
Есть ли у L-Met доказанные преимущества?
По данным PubChem, L-Met дает преимущества, в основном из-за его содержания серы. PubChem — это база данных химических молекул и их активности в отношении биологических анализов.Система поддерживается Национальным центром биотехнологической информации (NCBI), компонентом Национальной медицинской библиотеки, входящей в состав Национальных институтов здравоохранения США (NIH).
Например, за счет включения серы «L-Met» улучшает тонус и эластичность кожи, волос и укрепляет ногти. Сера, обеспечиваемая L-Met, ценная во многих процессах детоксикации, также защищает клетки от загрязняющих веществ, замедляет старение клеток и необходима для абсорбции и биодоступности селена и цинка.
L-Met хелатирует тяжелые металлы, такие как свинец и ртуть, способствуя их выведению. Он также действует как липотропный агент и предотвращает избыточное накопление жира в печени ». (2) L-Met и цистеин, уникально, являются единственными серосодержащими аминокислотами, последняя из которых получает серу из L-Met.
Сера из L-Met также может быть использована для образования ценного соединения, известного как S-аденозил-L-метионин (SAMe), которое обладает известной противовоспалительной активностью (3).
Безопасен ли L-Met и есть ли взаимодействия?
L-Met может вызывать тошноту, рвоту, сонливость и раздражительность.Не следует применять пациентам с ацидозом. Он может усугубить печеночную энцефалопатию (потеря функции мозга, когда поврежденная печень не выводит токсины из крови) у пациентов с установленным повреждением печени, поэтому его следует использовать с осторожностью у пациентов с тяжелым заболеванием печени (9).
Он может усугубить печеночную энцефалопатию (потеря функции мозга, когда поврежденная печень не выводит токсины из крови) у пациентов с установленным повреждением печени, поэтому его следует использовать с осторожностью у пациентов с тяжелым заболеванием печени (9).
Известно, что L-Met усугубляет психопатологические симптомы у больных шизофренией, хотя нет данных о подобных эффектах у здоровых людей.
Роль L-Met как предшественника гомоцистеина вызывает наибольшее беспокойство.Повышенный уровень гомоцистеина использовался как индикатор предрасположенности к сердечно-сосудистым заболеваниям. «Загрузка» метионина (0,1 г / кг) привела к кратковременному увеличению уровня гомоцистеина в плазме. Хотя эта процедура приводит к сосудистой дисфункции, она кратковременна и вряд ли приведет к необратимым повреждениям. Однако ошибочно введенная в десять раз большая доза привела к смерти.
В исследовании возможной связи между гомоцистеином и болезнью Альцгеймера сообщается о смерти контрольного субъекта после пероральной нагрузки L-Met (10). У субъекта развилась концентрация L-Met в плазме после нагрузки, намного превышающая те, о которых сообщалось ранее, у людей, получавших обычную пероральную нагрузочную дозу L-Met (100 мг / кг массы тела). Наиболее вероятное объяснение состоит в том, что субъект получил передозировку аминокислоты.
У субъекта развилась концентрация L-Met в плазме после нагрузки, намного превышающая те, о которых сообщалось ранее, у людей, получавших обычную пероральную нагрузочную дозу L-Met (100 мг / кг массы тела). Наиболее вероятное объяснение состоит в том, что субъект получил передозировку аминокислоты.
Долгосрочные исследования у взрослых не выявили неблагоприятных последствий умеренных колебаний в потреблении L-Met с пищей, но дозы, превышающие нормальную дозу более чем в 5 раз, приводили к повышению уровня гомоцистеина. Эти эффекты L-Met на гомоцистеин и функцию сосудов смягчаются добавками витаминов B6, B12, C и фолиевой кислоты.
У младенцев потребление L-Met в 2–5 раз больше нормы приводило к нарушению роста и чрезвычайно высоким уровням L-Met в плазме, но не наблюдалось никаких долгосрочных неблагоприятных последствий (11).
Заключение
На основании имеющихся в настоящее время качественных доказательств для L-Met и, в частности, относящихся к перечисленным выше утверждениям, которые были сделаны для этой незаменимой аминокислоты, на самом деле особо нечего делать. Существует около сорока убедительных статей, но очень немногие из них конкретно касаются заявлений, сделанных выше.
Существует около сорока убедительных статей, но очень немногие из них конкретно касаются заявлений, сделанных выше.
Потребление аминокислоты с пищей кажется достаточным, и чрезмерные дозы L-Met могут быть поводом для беспокойства. Это «незаменимая» аминокислота, но явно не столь «важная» по отношению к некоторым из ее заявлений, находящихся в обращении в настоящее время.
Влияние диетического ограничения метионина на биомаркеры метаболического здоровья
Prog Mol Biol Transl Sci. Авторская рукопись; доступно в PMC 2014, 9 июня.
Опубликован в окончательной отредактированной форме как:
PMCID: PMC4049285
NIHMSID: NIHMS592501
Лаборатория датчиков питательных веществ и передачи сигналов адипоцитов, Pennington Biomedical Research Center, Луизиана,
, Батонский центр биомедицинских исследований, США. См. Другие статьи в PMC, в которых цитируется опубликованная статья.Abstract
Ограничение калорий без недоедания, обычно называемое диетическим ограничением (DR), приводит к хорошо задокументированному увеличению продолжительности жизни. DR также вызывает значительные и продолжительные улучшения биомаркеров метаболического здоровья, которые начинают накапливаться вскоре после его введения. Эти улучшения частично объясняются влиянием DR на энергетический баланс, которое ограничивает накопление жира за счет снижения потребления энергии. Накопление лишнего жира в организме происходит, когда потребление энергии постоянно превышает затраты энергии на рост и поддержание существующей ткани.Возникающее в результате ожирение способствует развитию инсулинорезистентности, нарушению липидного обмена и повышенной экспрессии воспалительных маркеров в периферических тканях. Связь между продлевающими жизнь эффектами ДР и ожирением является предметом постоянных дебатов, но ясно, что уменьшение накопления жира улучшает чувствительность к инсулину и оказывает благотворное влияние на общее метаболическое здоровье. За последние 20 лет диетическое ограничение метионина (MR) стало многообещающим миметиком DR, поскольку оно обеспечивает сопоставимое увеличение продолжительности жизни, но, что удивительно, не требует ограничения в пище.
DR также вызывает значительные и продолжительные улучшения биомаркеров метаболического здоровья, которые начинают накапливаться вскоре после его введения. Эти улучшения частично объясняются влиянием DR на энергетический баланс, которое ограничивает накопление жира за счет снижения потребления энергии. Накопление лишнего жира в организме происходит, когда потребление энергии постоянно превышает затраты энергии на рост и поддержание существующей ткани.Возникающее в результате ожирение способствует развитию инсулинорезистентности, нарушению липидного обмена и повышенной экспрессии воспалительных маркеров в периферических тканях. Связь между продлевающими жизнь эффектами ДР и ожирением является предметом постоянных дебатов, но ясно, что уменьшение накопления жира улучшает чувствительность к инсулину и оказывает благотворное влияние на общее метаболическое здоровье. За последние 20 лет диетическое ограничение метионина (MR) стало многообещающим миметиком DR, поскольку оно обеспечивает сопоставимое увеличение продолжительности жизни, но, что удивительно, не требует ограничения в пище. Диетическая MR также снижает ожирение, но делает это за счет парадоксального увеличения потребления и расхода энергии. Увеличение расхода энергии полностью компенсирует повышенное потребление энергии и эффективно ограничивает отложение жира. Возможно, что более важно, диета увеличивает метаболическую гибкость и общую чувствительность к инсулину, а также улучшает липидный обмен, уменьшая при этом системное воспаление. В этой главе мы описываем последние достижения в нашем понимании механизмов и эффектов диетической МР и обсуждаем оставшиеся препятствия на пути применения МР в качестве лечения метаболических заболеваний.
Диетическая MR также снижает ожирение, но делает это за счет парадоксального увеличения потребления и расхода энергии. Увеличение расхода энергии полностью компенсирует повышенное потребление энергии и эффективно ограничивает отложение жира. Возможно, что более важно, диета увеличивает метаболическую гибкость и общую чувствительность к инсулину, а также улучшает липидный обмен, уменьшая при этом системное воспаление. В этой главе мы описываем последние достижения в нашем понимании механизмов и эффектов диетической МР и обсуждаем оставшиеся препятствия на пути применения МР в качестве лечения метаболических заболеваний.
1. ОБОСНОВАНИЕ ДЛЯ ИССЛЕДОВАНИЯ ОГРАНИЧЕНИЯ МЕТИОНИНА В ДИЕТЕ
Незаменимые аминокислоты (EAAs) (например, метионин, лизин, лейцин, изолейцин, триптофан, валин, треонин, фенилаланин и гистидин) не могут быть синтезированы эндогенно, 10– Каждый день из потребляемого белка необходимо получать 20 мг / кг массы тела каждого из них. Более того, источники диетического белка должны содержать полный набор EAA, поскольку белки, дефицитные по одному или нескольким EAA, быстро вызывают отвращающую реакцию на кормление, что приводит к значительному снижению потребления пищи. Полусинтетические диеты без единого EAA использовались для изучения механизмов восприятия и передачи сигналов, которые опосредуют поведенческие и физиологические реакции на депривацию EAA. 1–6 Важным следствием этой работы является то, что пищевые аминокислоты функционируют во многом как рецепторные лиганды в том смысле, что определенные диапазоны концентраций задействуют сигнальные системы, связанные с молекулярными ответами, которые имеют биохимические и физиологические последствия. Важным отличием является то, что отсутствие EAA (например,g., депривация EAA) — это сигнал, который инициирует полный сигнальный ответ, предполагая, что ограничение EAA должно достигать некоторого порога ограничения для запуска ответа. Это предположение было подтверждено значительными эмпирическими данными, но несколько неожиданным открытием является то, что диетическое ограничение (DR) EAA в узко определенных диапазонах оказалось очень полезным для метаболического статуса и общего состояния здоровья.
Полусинтетические диеты без единого EAA использовались для изучения механизмов восприятия и передачи сигналов, которые опосредуют поведенческие и физиологические реакции на депривацию EAA. 1–6 Важным следствием этой работы является то, что пищевые аминокислоты функционируют во многом как рецепторные лиганды в том смысле, что определенные диапазоны концентраций задействуют сигнальные системы, связанные с молекулярными ответами, которые имеют биохимические и физиологические последствия. Важным отличием является то, что отсутствие EAA (например,g., депривация EAA) — это сигнал, который инициирует полный сигнальный ответ, предполагая, что ограничение EAA должно достигать некоторого порога ограничения для запуска ответа. Это предположение было подтверждено значительными эмпирическими данными, но несколько неожиданным открытием является то, что диетическое ограничение (DR) EAA в узко определенных диапазонах оказалось очень полезным для метаболического статуса и общего состояния здоровья. В частности, положительные реакции, возникающие в результате ограничения нормального потребления метионина с пищей в пределах определенного диапазона, являются предметом данной главы.
В частности, положительные реакции, возникающие в результате ограничения нормального потребления метионина с пищей в пределах определенного диапазона, являются предметом данной главы.
2. ПРОИСХОЖДЕНИЕ ДИЕТИЧЕСКОГО ОГРАНИЧЕНИЯ МЕТИОНИНА КАК ЭКСПЕРИМЕНТАЛЬНЫЙ ПОДХОД К ПОВЫШЕНИЮ ДОЛГОЛЕТИЯ
Первые сообщения о пользе для здоровья ограничения диетического метионина (MR) были получены из группы Орентрейха. 7,8 Они обнаружили, что удаление цистеина и снижение содержания метионина в рационе от контрольных уровней 0,86% (т.е. 8,6 г / кг рациона) до ограниченных уровней 0,17% (1,7 г / кг рациона) увеличивают продолжительность жизни на 30–40%. Существенное различие между этой и другими моделями DR состоит в том, что не было никаких ограничений в еде, и крысам давали диету ad libitum.В ходе важного продолжения своей первоначальной работы авторы показали, что диетическая MR увеличивает продолжительность жизни у различных линий крыс с различными патологическими профилями. 9 Эти данные показали, что диетическая MR снижает смертность от всех причин смерти, и подтверждают мнение о том, что такой диетический подход влияет на общую скорость старения. В двух своих исследованиях 7,9 Орентрейх и др. . кормили вторую контрольную группу попарно контрольной диетой до уровня потребления группы MR.Они обнаружили, что продолжительность жизни не увеличивалась в группе с парным кормлением, показывая, что ограничение метионина, а не общий DR, было ответственным за увеличение продолжительности жизни в группе MR.
9 Эти данные показали, что диетическая MR снижает смертность от всех причин смерти, и подтверждают мнение о том, что такой диетический подход влияет на общую скорость старения. В двух своих исследованиях 7,9 Орентрейх и др. . кормили вторую контрольную группу попарно контрольной диетой до уровня потребления группы MR.Они обнаружили, что продолжительность жизни не увеличивалась в группе с парным кормлением, показывая, что ограничение метионина, а не общий DR, было ответственным за увеличение продолжительности жизни в группе MR.
Диетический MR также увеличивает продолжительность жизни мышей 10,11 и мух 12 , поэтому кажется вероятным, что MR, как и DR, окажется эффективным для многих видов. Грандисон и др. . 12 использовал Drosophila в качестве модельного организма для идентификации питательных веществ, ограниченных во время DR, которые опосредовали увеличение продолжительности жизни и снижение плодовитости. В природе Drosophila питается дрожжами, поэтому реализация DR достигается путем разбавления дрожжей и обеспечения неограниченного потребления разбавленной диеты. При использовании этого подхода увеличение продолжительности жизни и снижение плодовитости, по-видимому, опосредуются в первую очередь определенными питательными веществами дрожжей и не зависят от количества потребляемых калорий. 13 Использование мух в качестве модельного организма, Grandison et al . 12 исследовали, какие питательные вещества были ответственны за увеличение продолжительности жизни и снижение плодовитости путем систематического добавления питательных веществ в ограниченный рацион.Они обнаружили, что добавление углеводов или жиров не имело никакого эффекта, но добавление всех 10 ЕАА уменьшало продолжительность жизни и увеличивало плодовитость в той же степени, что и полноценное кормление. Интересно, что добавление одного только метионина полностью восстановило плодовитость, но не уменьшило продолжительность жизни.
В природе Drosophila питается дрожжами, поэтому реализация DR достигается путем разбавления дрожжей и обеспечения неограниченного потребления разбавленной диеты. При использовании этого подхода увеличение продолжительности жизни и снижение плодовитости, по-видимому, опосредуются в первую очередь определенными питательными веществами дрожжей и не зависят от количества потребляемых калорий. 13 Использование мух в качестве модельного организма, Grandison et al . 12 исследовали, какие питательные вещества были ответственны за увеличение продолжительности жизни и снижение плодовитости путем систематического добавления питательных веществ в ограниченный рацион.Они обнаружили, что добавление углеводов или жиров не имело никакого эффекта, но добавление всех 10 ЕАА уменьшало продолжительность жизни и увеличивало плодовитость в той же степени, что и полноценное кормление. Интересно, что добавление одного только метионина полностью восстановило плодовитость, но не уменьшило продолжительность жизни.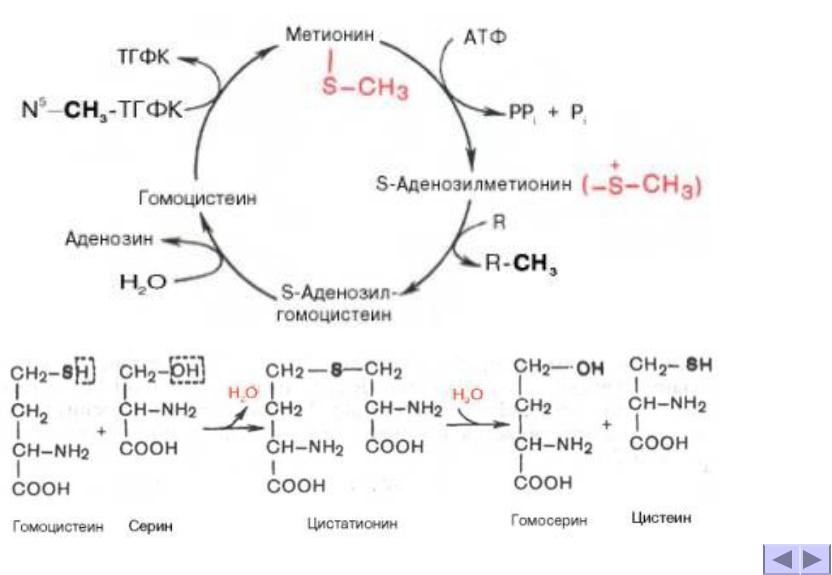 Таким образом, ограничение метионина DR было единственной причиной снижения плодовитости, в то время как ограничение метионина и дополнительных EAA требовалось для увеличения продолжительности жизни. 12 Потребуется дальнейшее изучение сравнительных механизмов, задействованных DR у мух и MR у грызунов, чтобы понять, как ограничение функций метионина влияет на продолжительность жизни и продолжительность здоровья в двух моделях.
Таким образом, ограничение метионина DR было единственной причиной снижения плодовитости, в то время как ограничение метионина и дополнительных EAA требовалось для увеличения продолжительности жизни. 12 Потребуется дальнейшее изучение сравнительных механизмов, задействованных DR у мух и MR у грызунов, чтобы понять, как ограничение функций метионина влияет на продолжительность жизни и продолжительность здоровья в двух моделях.
Дополнительные работы, указывающие на роль метаболизма метионина в долголетии, получены из подходов на модельных организмах, где манипуляции с генами, участвующими в восстановлении окисленных остатков метионина, влияют на продолжительность жизни. 14,15 Окисление свободного метионина или метионина в белках происходит естественным образом и дает смесь двух диастереомеров, метионин- R -сульфоксида и метионин- S -сульфоксида. Сульфоксид метионина со временем накапливается в тканевых белках и постепенно нарушает их функцию. Окисление метионина обычно обращено метионинсульфоксидредуктазами A и B (MsrA и MsrB), которые восстанавливают два диастереоизомера до метионина. У дрожжей сверхэкспрессия MsrA или MsrB увеличивала репликативную продолжительность жизни дрожжей, тогда как делеция любой изоформы сокращала продолжительность жизни дрожжей. 14 Чтобы проверить гипотезу о том, что эти манипуляции влияют на продолжительность жизни за счет увеличения количества метионина, Koc et al . 14 изменил концентрацию метионина в среде и обнаружил, что увеличение метионина снижает продолжительность жизни, а ограничение метионина увеличивает репликативную продолжительность жизни дрожжей.В дополнительных исследованиях с участием Drosophila , Ruan et al . 15 показали, что сверхэкспрессия трансгенной MsrA заметно увеличивает продолжительность жизни мух. Кроме того, целенаправленное разрушение MsrA у мышей значительно сокращает продолжительность их жизни, увеличивает их восприимчивость к окислительному стрессу и усиливает накопление окисленных белков в их тканях.
Окисление метионина обычно обращено метионинсульфоксидредуктазами A и B (MsrA и MsrB), которые восстанавливают два диастереоизомера до метионина. У дрожжей сверхэкспрессия MsrA или MsrB увеличивала репликативную продолжительность жизни дрожжей, тогда как делеция любой изоформы сокращала продолжительность жизни дрожжей. 14 Чтобы проверить гипотезу о том, что эти манипуляции влияют на продолжительность жизни за счет увеличения количества метионина, Koc et al . 14 изменил концентрацию метионина в среде и обнаружил, что увеличение метионина снижает продолжительность жизни, а ограничение метионина увеличивает репликативную продолжительность жизни дрожжей.В дополнительных исследованиях с участием Drosophila , Ruan et al . 15 показали, что сверхэкспрессия трансгенной MsrA заметно увеличивает продолжительность жизни мух. Кроме того, целенаправленное разрушение MsrA у мышей значительно сокращает продолжительность их жизни, увеличивает их восприимчивость к окислительному стрессу и усиливает накопление окисленных белков в их тканях. 16 В совокупности эти исследования подтверждают, что генетические манипуляции с генами, участвующими в восстановлении окисленного метионина, влияют на продолжительность жизни у многих видов.Хотя лежащие в основе механизмы далеки от ясности, ограничение метионина в рационе имитирует эффекты, достигаемые за счет генетического улучшения восстановления метионина, в то время как увеличение количества метионина в рационе усиливает накопление окисленного метионина. Как показано в последующих разделах, ограничение диетического метионина вызывает ряд других краткосрочных и долгосрочных метаболических реакций, которые могут быть не менее важны как медиаторы его воздействия на долголетие. Оценка их относительной значимости является предметом растущего интереса к данной области.
16 В совокупности эти исследования подтверждают, что генетические манипуляции с генами, участвующими в восстановлении окисленного метионина, влияют на продолжительность жизни у многих видов.Хотя лежащие в основе механизмы далеки от ясности, ограничение метионина в рационе имитирует эффекты, достигаемые за счет генетического улучшения восстановления метионина, в то время как увеличение количества метионина в рационе усиливает накопление окисленного метионина. Как показано в последующих разделах, ограничение диетического метионина вызывает ряд других краткосрочных и долгосрочных метаболических реакций, которые могут быть не менее важны как медиаторы его воздействия на долголетие. Оценка их относительной значимости является предметом растущего интереса к данной области.
3. Противовоспалительные реакции на ограничение и долголетие диетических метионинов
Оригинальные исследования диетической MR на крысах показали, что в дополнение к увеличению продолжительности жизни диета приводила к пожизненному снижению массы тела и накоплению жировой ткани. 7,8 Ограничение калорий до 40% от потребления ad libitum (DR) также обеспечивает надежное увеличение средней и максимальной продолжительности жизни у разных видов, 17–19 наряду с ожидаемым снижением накопления жира.Помимо сопоставимых эффектов на долголетие и ожирение, DR и MR имеют другие положительные результаты, включая повышенную чувствительность к инсулину и всестороннее улучшение биомаркеров метаболического здоровья. 8,10,20–24 Предыдущие исследования установили, что снижение ожирения, вызванное DR, связано со снижением экспрессии провоспалительных маркеров в периферических тканях. 25 Таким образом, появляется новая гипотеза о том, что DR задерживает смерть отчасти за счет снижения сопутствующих заболеваний, связанных с хроническими воспалительными состояниями, такими как ожирение, диабет и сердечно-сосудистые заболевания. 26 Влияние диетической МР на воспаление в значительной степени не изучено, и остается важный вопрос, на который нет ответа, — приводит ли снижение ожирения, независимо от механизма, к сопоставимому снижению системного воспаления.
7,8 Ограничение калорий до 40% от потребления ad libitum (DR) также обеспечивает надежное увеличение средней и максимальной продолжительности жизни у разных видов, 17–19 наряду с ожидаемым снижением накопления жира.Помимо сопоставимых эффектов на долголетие и ожирение, DR и MR имеют другие положительные результаты, включая повышенную чувствительность к инсулину и всестороннее улучшение биомаркеров метаболического здоровья. 8,10,20–24 Предыдущие исследования установили, что снижение ожирения, вызванное DR, связано со снижением экспрессии провоспалительных маркеров в периферических тканях. 25 Таким образом, появляется новая гипотеза о том, что DR задерживает смерть отчасти за счет снижения сопутствующих заболеваний, связанных с хроническими воспалительными состояниями, такими как ожирение, диабет и сердечно-сосудистые заболевания. 26 Влияние диетической МР на воспаление в значительной степени не изучено, и остается важный вопрос, на который нет ответа, — приводит ли снижение ожирения, независимо от механизма, к сопоставимому снижению системного воспаления. Используя транскрипционное профилирование периферических тканей после длительного DR и MR, мы недавно исследовали системную биологию 59 сетей, аннотированных для воспалительного процесса. 27 Несмотря на сопоставимое снижение ожирения при обеих диетах, противовоспалительные реакции на MR были гораздо более обширными, чем на DR, и нацелены на различные воспалительные процессы как в печени, так и в белой жировой ткани (WAT).В частности, первичные пути, затронутые MR в паховой белой жировой ткани (IWAT), включают миграцию фагоцитов и макрофагов, и большинство генов в этих путях подавляется MR. 27 Основные пути, на которые влияет MR в печени, включают накопление, активацию и морфологию лейкоцитов и макрофагов, и, как и IWAT, подавляющая регуляция большинства затронутых генов. 27 Еще одно важное наблюдение состоит в том, что изменения транскрипции кажутся временно не связанными с улучшением метаболических биомаркеров и происходят спустя много времени после того, как диета снижает отложение жира, предполагая, что противовоспалительные эффекты MR не ответственны за повышение чувствительности к инсулину.
Используя транскрипционное профилирование периферических тканей после длительного DR и MR, мы недавно исследовали системную биологию 59 сетей, аннотированных для воспалительного процесса. 27 Несмотря на сопоставимое снижение ожирения при обеих диетах, противовоспалительные реакции на MR были гораздо более обширными, чем на DR, и нацелены на различные воспалительные процессы как в печени, так и в белой жировой ткани (WAT).В частности, первичные пути, затронутые MR в паховой белой жировой ткани (IWAT), включают миграцию фагоцитов и макрофагов, и большинство генов в этих путях подавляется MR. 27 Основные пути, на которые влияет MR в печени, включают накопление, активацию и морфологию лейкоцитов и макрофагов, и, как и IWAT, подавляющая регуляция большинства затронутых генов. 27 Еще одно важное наблюдение состоит в том, что изменения транскрипции кажутся временно не связанными с улучшением метаболических биомаркеров и происходят спустя много времени после того, как диета снижает отложение жира, предполагая, что противовоспалительные эффекты MR не ответственны за повышение чувствительности к инсулину. 21,27 В совокупности эти результаты предполагают интересную возможность того, что задержка возрастного воспаления из-за МР является вторичной по отношению к метаболическим эффектам диеты, а не прямым результатом снижения ожирения.
21,27 В совокупности эти результаты предполагают интересную возможность того, что задержка возрастного воспаления из-за МР является вторичной по отношению к метаболическим эффектам диеты, а не прямым результатом снижения ожирения.
4. ВЛИЯНИЕ ДИЕТИЧЕСКОГО MR НА ПОТРЕБЛЕНИЕ ЭНЕРГИИ И ЖИРНОСТЬ
В первоначальных сообщениях о том, что диетический MR увеличивал продолжительность жизни у крыс, сообщалось, что диета уменьшала накопление массы тела примерно на 40% в течение 2 лет. 7,8 Парадоксально, но потребление корма с поправкой на вес в группе MR было на ~ 90% выше, чем в контрольной группе, в течение первых 3 месяцев и на 62% выше, чем через 2 года. 7 Диетическая MR вызывает аналогичное увеличение потребления энергии у мышей, как в расчете на мышь (увеличение ~ 20%), так и с поправкой на вес (увеличение ~ 60%). 28,29 Чтобы оценить влияние диетической MR на энергетический баланс и проверить метаболические эффекты диеты, группа Орентрейха использовала подход парного кормления, скармливая третью группу крыс контрольным рационом в количествах, потребляемых MR. группа. 7,22 Группа, получавшая парное вскармливание, набрала на 75 г больше, чем группа MR, за первые 3 месяца 7 и на 115 г больше, чем группа MR, через 63 недели. 22 Эти данные предоставляют prima facie доказательства того, что диетическая MR увеличивает энергетические затраты на поддержание массы тела, и весьма наводит на мысль о том, что этот механизм включает увеличение расхода энергии (EE).
группа. 7,22 Группа, получавшая парное вскармливание, набрала на 75 г больше, чем группа MR, за первые 3 месяца 7 и на 115 г больше, чем группа MR, через 63 недели. 22 Эти данные предоставляют prima facie доказательства того, что диетическая MR увеличивает энергетические затраты на поддержание массы тела, и весьма наводит на мысль о том, что этот механизм включает увеличение расхода энергии (EE).
Влияние диетической MR на состав тела первоначально оценивали путем сравнения веса жировых подушечек с контрольными крысами после разного времени на диете. Например, диетическая MR в течение 18 месяцев снизила массу рассекаемого висцерального жира с 72 г в контрольной группе до 20 г в группе MR.Выраженная в процентах от массы тела, MR диета снизила массу подушечек висцерального жира с 13,7% до 7,4% на основе этого метода оценки состава тела. 22 Более точные и всесторонние оценки состава тела с использованием методов DEXA и ЯМР показали, что у контрольных крыс ожирение увеличивается с ~ 16% до почти 30% в течение 2-летнего периода после отлучения от груди. 21 У крыс, потребляющих диету MR, увеличение ожирения ограничивается увеличением на 4% с 16% до 20% за тот же период. 21 Это 4% -ное увеличение в группе MR достигается в первые 3 месяца после введения MR, поэтому от 3 до 20 месяцев ожирение по существу ограничивается 20% в группе MR. Напротив, ожирение увеличивается с 16% до 22% в течение первых 3 месяцев на контрольной диете и с 22% до 26% с 3 до 9 месяцев. 21 Когда диета MR начинается после физической зрелости (например, в возрасте 6 месяцев), их начальное ожирение (23%) остается неизменным в течение следующих 6 месяцев, в то время как ожирение в контрольной группе увеличивается с 23% до 27% за тот же период. 21 Масса тела также не изменилась в течение 6 месяцев после введения диетической МР, тогда как масса тела в контрольной группе увеличилась с 385 до 480 г. 21 Эти исследования показывают, что введение MR у подростков или взрослых эффективно ограничивает отложение жира и ограничивает увеличение массы жировой ткани.
21 У крыс, потребляющих диету MR, увеличение ожирения ограничивается увеличением на 4% с 16% до 20% за тот же период. 21 Это 4% -ное увеличение в группе MR достигается в первые 3 месяца после введения MR, поэтому от 3 до 20 месяцев ожирение по существу ограничивается 20% в группе MR. Напротив, ожирение увеличивается с 16% до 22% в течение первых 3 месяцев на контрольной диете и с 22% до 26% с 3 до 9 месяцев. 21 Когда диета MR начинается после физической зрелости (например, в возрасте 6 месяцев), их начальное ожирение (23%) остается неизменным в течение следующих 6 месяцев, в то время как ожирение в контрольной группе увеличивается с 23% до 27% за тот же период. 21 Масса тела также не изменилась в течение 6 месяцев после введения диетической МР, тогда как масса тела в контрольной группе увеличилась с 385 до 480 г. 21 Эти исследования показывают, что введение MR у подростков или взрослых эффективно ограничивает отложение жира и ограничивает увеличение массы жировой ткани.
Диета MR после отъема у мышей вызывает аналогичные, но зависящие от штамма изменения массы тела и ожирения. У мышей FVB диетическая MR эффективно ограничивала увеличение массы тела или ожирения в течение 10-недельного исследования, тогда как ожирение контрольных мышей увеличилось с ~ 14% до ~ 25% за тот же период. 28 Увеличение ожирения аналогично ограничивалось MR в течение 10-недельного исследования на мышах C57BL / 6J, а увеличение массы тела было ограничено до 3 г (например, с ~ 18 до ~ 21 г). 29 У мышей на контрольной диете масса тела увеличилась с 18 до 28 г за тот же период, а ожирение увеличилось с 12% до 21%. 29 Как хорошо задокументировано на крысах, мыши также реагируют на диетический MR увеличением как абсолютного, так и скорректированного по весу потребления пищи, 28,29 подтверждая точку зрения, что диета ограничивает отложение жира, несмотря на увеличение потребления энергии.В совокупности эти результаты убедительно свидетельствуют о том, что диетическая MR, независимо от того, когда она начата, влияет на распределение питательных веществ между отложениями жира и белка посредством воздействия как на потребление энергии, так и на ЭЭ.
5. ВЛИЯНИЕ DIETARY MR НА РАСХОДЫ ЭНЕРГИИ
Групповые различия в ожирении, не связанные с различиями в потреблении энергии, позволяют сделать вывод о групповых различиях в ЭЭ, а расширенный доступ к непрямой калориметрии мелких животных сделал ее методом выбора для измерения ЭЭ в грызуны.Вычислительные проблемы, связанные с применением этого метода, являются существенными в тех случаях, когда генотип или диета приводят к значительным групповым различиям в размере и / или составе тела. Один из неизменных законов калориметрии, начиная с работ Лавуазье и Лапласа в восемнадцатом веке и распространяясь на последующие работы Рубнера, Броуди и Клейбера, 30,31 , заключается в том, что ЭЭ пропорциональна некоторой функции размера тела. Таким образом, EE необходимо соответственно масштабировать, чтобы определить, остаются ли различия в группах после корректировки размера.Это как раз та проблема, с которой сталкиваются после длительной МРТ, когда групповые различия в массе тела и составе сильно различаются. Хорошо известно, что такие различия не являются несущественными, поскольку жир и мышечная ткань вносят уникальный удельный вес в общий EE. Масштабирование к массе тела предполагает, что все ткани имеют одинаковую скорость метаболизма, в то время как масштабирование до безжировой массы предполагает, что жировая ткань метаболически инертна. Соответствующие предположения явно неверны, но ошибка, вносимая масштабированием по массе тела, намного более значительна и увеличивается пропорционально разнице в массе сравниваемых групп. 32–36 Очевидно, что масштабирование по массе тела после длительной МРТ особенно нецелесообразно. 22 Хотя это и не идеально, масштабирование EE на безжировую массу тела вносит гораздо меньшую систематическую ошибку в сравнения групп. Применение этого подхода на крысах после 3 месяцев MR показало, что ЭЭ в ночное время (кДж / ч / кг безжировой массы тела) было на 70% выше в группе MR, чем в контроле, тогда как дневное ЭЭ было только на 25% выше.
Хорошо известно, что такие различия не являются несущественными, поскольку жир и мышечная ткань вносят уникальный удельный вес в общий EE. Масштабирование к массе тела предполагает, что все ткани имеют одинаковую скорость метаболизма, в то время как масштабирование до безжировой массы предполагает, что жировая ткань метаболически инертна. Соответствующие предположения явно неверны, но ошибка, вносимая масштабированием по массе тела, намного более значительна и увеличивается пропорционально разнице в массе сравниваемых групп. 32–36 Очевидно, что масштабирование по массе тела после длительной МРТ особенно нецелесообразно. 22 Хотя это и не идеально, масштабирование EE на безжировую массу тела вносит гораздо меньшую систематическую ошибку в сравнения групп. Применение этого подхода на крысах после 3 месяцев MR показало, что ЭЭ в ночное время (кДж / ч / кг безжировой массы тела) было на 70% выше в группе MR, чем в контроле, тогда как дневное ЭЭ было только на 25% выше. 21 После 9 месяцев диеты как ночная, так и дневная ЭЭ были на ~ 90% выше в группе MR, тогда как разница уменьшилась до 25% после 20 месяцев диеты. 21 Когда MR был введен после физического созревания, диета увеличивала EE на 21% по сравнению с контролем и давала на 20% более высокое потребление энергии. 21 Сравнимое увеличение потребления энергии и ЭЭ соответствует стабильной массе тела и составу, которые наблюдались в группе MR в течение 6-месячного периода исследования. 21
21 После 9 месяцев диеты как ночная, так и дневная ЭЭ были на ~ 90% выше в группе MR, тогда как разница уменьшилась до 25% после 20 месяцев диеты. 21 Когда MR был введен после физического созревания, диета увеличивала EE на 21% по сравнению с контролем и давала на 20% более высокое потребление энергии. 21 Сравнимое увеличение потребления энергии и ЭЭ соответствует стабильной массе тела и составу, которые наблюдались в группе MR в течение 6-месячного периода исследования. 21
Измерения EE у мышей после различных интервалов диетической MR представляют те же проблемы, что и пропорциональное масштабирование EE с группами, различающимися по размеру и составу.Например, в конце 10-недельного исследования мыши FVB на контрольной диете были на 19% тяжелее и имели на 80% больше жира в тушах, чем мыши в группе MR. 28 Однако, несмотря на эти различия, безжировая масса тела мышей на двух диетах сравнима. К концу исследования EE, приведенное к безжировой массе, было на 31% выше в группе MR, чем в контрольной. 28 В совокупности наблюдения предоставляют убедительные доказательства того, что диетическая MR ограничивает рост и отложение жира за счет снижения метаболической эффективности за счет механизма, который увеличивает EE на единицу безжировой массы.
28 В совокупности наблюдения предоставляют убедительные доказательства того, что диетическая MR ограничивает рост и отложение жира за счет снижения метаболической эффективности за счет механизма, который увеличивает EE на единицу безжировой массы.
Альтернативой нормализации EE на основе соотношений является анализ ковариации (ANCOVA), который использует анализ наименьших квадратов для оценки влияния вариации в фиксированном (например, генотипе) и непрерывном (состав тела, потребление и активность) переменные, связанные с вариациями EE между животными. Первоначально ANCOVA был рекомендован для анализа данных непрямой калориметрии грызунов в 2006 году, 33 , и в ряде недавних работ этот подход использовался для оценки относительного вклада безжировой массы, жировой массы, активности и потребления энергии в общий ЭЭ. 34,35,37 Применение ANCOVA для анализа влияния диетической MR на EE, включая состав тела, активность и потребление энергии в модель, показало, что 10 недель диетической MR увеличивают EE у мышей C57BL / 6J примерно на 35 %. 29 Хотя может показаться несколько неожиданным, что ANCOVA и масштабирование EE на основе отношений предоставили аналогичные оценки влияния MR на EE, следует учитывать два дополнительных момента. Во-первых, применение ANCOVA к данным косвенной калориметрии как у людей, так и у грызунов показало, что на безжировую массу тела приходится ~ 70–75% вариации общего суточного ЭЭ. 38,39 Во-вторых, вариативность добровольной активности составляет ~ 20% вариации ЭЭ у людей 39,40 и предположительно грызунов. Следовательно, если диетическая MR вызывает изменения в произвольной активности, учет этого источника вариации в ANCOVA уменьшит вариацию EE, относящуюся к MR. Однако анализ ответов мышей 28,29 и крыс 21 на MR не дает никаких доказательств того, что диета изменяет произвольную активность. Это указывает на то, что диетическая MR влияет на энергетический баланс через изменения не зависящих от активности компонентов EE.
29 Хотя может показаться несколько неожиданным, что ANCOVA и масштабирование EE на основе отношений предоставили аналогичные оценки влияния MR на EE, следует учитывать два дополнительных момента. Во-первых, применение ANCOVA к данным косвенной калориметрии как у людей, так и у грызунов показало, что на безжировую массу тела приходится ~ 70–75% вариации общего суточного ЭЭ. 38,39 Во-вторых, вариативность добровольной активности составляет ~ 20% вариации ЭЭ у людей 39,40 и предположительно грызунов. Следовательно, если диетическая MR вызывает изменения в произвольной активности, учет этого источника вариации в ANCOVA уменьшит вариацию EE, относящуюся к MR. Однако анализ ответов мышей 28,29 и крыс 21 на MR не дает никаких доказательств того, что диета изменяет произвольную активность. Это указывает на то, что диетическая MR влияет на энергетический баланс через изменения не зависящих от активности компонентов EE.
Наконец, в нескольких недавних публикациях были рассмотрены дополнительные конструктивные соображения при применении непрямой калориметрии для проверки различий в лечении ЭЭ. 34,37,41 Одна из рекомендаций состоит в том, чтобы проверить групповые различия в ЭЭ у животных до появления вызванных лечением изменений в размере и / или составе тела. В недавних исследованиях в лаборатории авторов мы использовали этот подход и оценили острые эффекты диетической MR на EE после первого получения исходных показателей EE у мышей на контрольной диете перед введением диетической MR.Мы обнаружили, что на 6-й день после начала MR, ночное EE (кДж / ч / мышь) на 20% выше, чем в контроле, и увеличение EE происходит вместе с увеличением потребления энергии. Затем к 10-му дню ЭЭ как в ночное, так и в дневное время на ~ 30% выше у мышей на диете MR по сравнению с контролем (неопубликованные данные авторов). Наблюдаемое увеличение EE произошло задолго до вызванных диетой изменений массы тела или состава тела, что дополнительно подтверждает вывод о том, что увеличение EE, вызванное MR, не является аналитическим артефактом пропорционального масштабирования данных косвенной калориметрии.
34,37,41 Одна из рекомендаций состоит в том, чтобы проверить групповые различия в ЭЭ у животных до появления вызванных лечением изменений в размере и / или составе тела. В недавних исследованиях в лаборатории авторов мы использовали этот подход и оценили острые эффекты диетической MR на EE после первого получения исходных показателей EE у мышей на контрольной диете перед введением диетической MR.Мы обнаружили, что на 6-й день после начала MR, ночное EE (кДж / ч / мышь) на 20% выше, чем в контроле, и увеличение EE происходит вместе с увеличением потребления энергии. Затем к 10-му дню ЭЭ как в ночное, так и в дневное время на ~ 30% выше у мышей на диете MR по сравнению с контролем (неопубликованные данные авторов). Наблюдаемое увеличение EE произошло задолго до вызванных диетой изменений массы тела или состава тела, что дополнительно подтверждает вывод о том, что увеличение EE, вызванное MR, не является аналитическим артефактом пропорционального масштабирования данных косвенной калориметрии. Наконец, постоянный мониторинг произвольной активности до и после начала МР показывает, что активность не различалась между диетическими группами в любое время в течение исследования. В совокупности анализ ЭЭ с использованием непрямой калориметрии после краткосрочной и долгосрочной диетической MR дает убедительную поддержку вывода о том, что диета вызывает быстро развивающееся и долгосрочное увеличение ЭЭ, которое разъединяет периферическое окисление топлива и увеличивает энергетические затраты на поддержание и рост. Важной постоянной задачей является определение молекулярного механизма (ов) разобщения и идентификации участков ткани, где это происходит.
Наконец, постоянный мониторинг произвольной активности до и после начала МР показывает, что активность не различалась между диетическими группами в любое время в течение исследования. В совокупности анализ ЭЭ с использованием непрямой калориметрии после краткосрочной и долгосрочной диетической MR дает убедительную поддержку вывода о том, что диета вызывает быстро развивающееся и долгосрочное увеличение ЭЭ, которое разъединяет периферическое окисление топлива и увеличивает энергетические затраты на поддержание и рост. Важной постоянной задачей является определение молекулярного механизма (ов) разобщения и идентификации участков ткани, где это происходит.
6. ВЛИЯНИЕ DIETARY MR НА ВЫБОР ТОПЛИВА И МЕТАБОЛИЧЕСКУЮ ГИБКОСТЬ
Коэффициент респираторного обмена (RER) обеспечивает в реальном времени индекс использования субстрата во время фаз метаболического цикла. RER рассчитывается из молярных соотношений потребленного O 2 и CO 2 , произведенного во время окисления глюкозы (1,00), липидов (0,70) и белка (0,80). 42–44 RER обычно приближается к 1 во время переключения на использование глюкозы в состоянии сытости и приближается к 0.7 при переходе на утилизацию жира во время голодания. Метаболическая гибкость измеряет, насколько эффективно происходит переключение субстрата во время переходов между голодным и сытым состояниями. Эта концепция возникла из признания Келли и Мандарино 45 того, что ежедневные переходы от использования жиров к потреблению углеводов нарушались инсулинорезистентностью (ИР). Нарушение распознается как уменьшение нормального увеличения RER, которое происходит при возобновлении кормления, и объясняется нарушением инсулинозависимого поглощения глюкозы периферическими тканями. 46,47 Увеличение использования глюкозы, связанное с улучшенной чувствительностью к инсулину, отражается сопутствующим увеличением RER в состоянии питания. Исследования на крысах показывают, что диетическая MR расширяет динамический диапазон экскурсий RER во время переходов между состояниями сытости и голодания, 21 подтверждая вывод о том, что метаболическая гибкость значительно повышается с помощью диетической MR.
42–44 RER обычно приближается к 1 во время переключения на использование глюкозы в состоянии сытости и приближается к 0.7 при переходе на утилизацию жира во время голодания. Метаболическая гибкость измеряет, насколько эффективно происходит переключение субстрата во время переходов между голодным и сытым состояниями. Эта концепция возникла из признания Келли и Мандарино 45 того, что ежедневные переходы от использования жиров к потреблению углеводов нарушались инсулинорезистентностью (ИР). Нарушение распознается как уменьшение нормального увеличения RER, которое происходит при возобновлении кормления, и объясняется нарушением инсулинозависимого поглощения глюкозы периферическими тканями. 46,47 Увеличение использования глюкозы, связанное с улучшенной чувствительностью к инсулину, отражается сопутствующим увеличением RER в состоянии питания. Исследования на крысах показывают, что диетическая MR расширяет динамический диапазон экскурсий RER во время переходов между состояниями сытости и голодания, 21 подтверждая вывод о том, что метаболическая гибкость значительно повышается с помощью диетической MR.
Повышение метаболической гибкости указывает на повышение общей чувствительности к инсулину и часто сопровождается снижением уровней инсулина как натощак, так и после приема пищи.Malloy et al. 22 сообщил, что 80 недель диеты MR снизили уровень базального инсулина у крыс в семь раз по сравнению с контролем. Эта разница возникает из-за того, что инсулин не увеличивается с возрастом в группе MR, как это происходит в контрольной группе, где уровни инсулина повышаются с ~ 1 нг / мл после отлучения от груди до более 7 нг / мл через 80 недель. 22 Авторы также оценили способность крыс избавиться от глюкозы через 23 и 72 недели на соответствующих диетах и обнаружили умеренное улучшение клиренса глюкозы в группе MR только через 72 недели. 22 Однако инсулин натощак был ниже в группе MR как на 23, так и на 72 неделе, и увеличение инсулина, необходимое для устранения глюкозного провока, было намного меньше, чем увеличение в контрольной группе в оба момента времени. 22
22
У мышей снижение базального инсулина, продуцируемого диетической МР, может быть обнаружено в течение 7 дней после введения диеты, а через 8 недель снижение составляет ~ четырехкратное. 29 Как наблюдалось на крысах, 21 динамический диапазон дневных и ночных переходов RER также увеличивается у мышей после 8 недель диетического MR. 28 В совокупности эти наблюдения убедительно свидетельствуют о том, что общая чувствительность к инсулину повышается за счет МР диеты, но не дают представления о том, как диета изменила чувствительность к инсулину в отдельных тканях. В недавних исследованиях, проведенных в сотрудничестве с Центром метаболического фенотипирования мышей при Университете Вандербильта, гиперинсулинемико-эугликемические зажимы, проведенные после 8 недель диетической МРТ, предоставили доказательства того, что диета значительно увеличивает инсулинозависимое поглощение глюкозы во всех периферических тканях.Скорость инфузии глюкозы, необходимая для поддержания эугликемии во время клэмп-теста, была в три раза выше в группе MR по сравнению с контролем (неопубликованные результаты авторов). Это увеличение использования глюкозы согласуется с трех- или четырехкратным снижением базального инсулина, наблюдаемым после 8 недель диетической MR. Что еще более важно, данные клэмп-теста показывают, что MR увеличивает как способность инсулина подавлять продукцию глюкозы в печени, так и инсулинозависимое поглощение 2-дезоксиглюкозы мышечной и жировой тканью (неопубликованные данные авторов).Важной постоянной задачей является определение конкретных механизмов, задействованных МР, которые обеспечивают равномерное улучшение чувствительности к инсулину среди всех тканей.
Это увеличение использования глюкозы согласуется с трех- или четырехкратным снижением базального инсулина, наблюдаемым после 8 недель диетической MR. Что еще более важно, данные клэмп-теста показывают, что MR увеличивает как способность инсулина подавлять продукцию глюкозы в печени, так и инсулинозависимое поглощение 2-дезоксиглюкозы мышечной и жировой тканью (неопубликованные данные авторов).Важной постоянной задачей является определение конкретных механизмов, задействованных МР, которые обеспечивают равномерное улучшение чувствительности к инсулину среди всех тканей.
Одна привлекательная гипотеза состоит в том, что эндокринные изменения, вызванные диетой, работают через общий механизм во всех тканях, повышая чувствительность к инсулину. Например, как гормон адипоцитов (адипонектин), так и гормон печени (фактор роста фибробластов 21, FGF-21) улучшают чувствительность к инсулину, и оба значительно повышаются при диетической МР. 21,22,24,29,48 Действие обоих гормонов сложное и включает функции, дополнительные к регуляции чувствительности к инсулину. Роль каждого гормона в опосредовании физиологических реакций на диетический MR в настоящее время неизвестна, но оценивается с использованием подходов с потерей функции на адипонектин- и FGF-21-нулевых мышах. Очевидно, что способность диетической МР ограничивать рост жировой ткани также играет важную роль, и кажется вероятным, что эндокринные изменения, вызываемые МР, не являются полностью вторичными по отношению к уменьшению ожирения.Напротив, новые данные подтверждают роль FGF-21 в ремоделировании жировой ткани, увеличении адипонектина, регуляции EE и усилении действия инсулина. 49–53 Таким образом, гипотеза о том, что диетическая MR вызывает некоторые из своих метаболических эффектов посредством модуляции циркулирующего FGF-21, является интригующей и, несомненно, будет оценена в ближайшем будущем.
Роль каждого гормона в опосредовании физиологических реакций на диетический MR в настоящее время неизвестна, но оценивается с использованием подходов с потерей функции на адипонектин- и FGF-21-нулевых мышах. Очевидно, что способность диетической МР ограничивать рост жировой ткани также играет важную роль, и кажется вероятным, что эндокринные изменения, вызываемые МР, не являются полностью вторичными по отношению к уменьшению ожирения.Напротив, новые данные подтверждают роль FGF-21 в ремоделировании жировой ткани, увеличении адипонектина, регуляции EE и усилении действия инсулина. 49–53 Таким образом, гипотеза о том, что диетическая MR вызывает некоторые из своих метаболических эффектов посредством модуляции циркулирующего FGF-21, является интригующей и, несомненно, будет оценена в ближайшем будущем.
Диетическая MR изучалась в доклинических условиях, которые включают введение диеты вскоре после отлучения от груди и после физического созревания, но трансляционный потенциал диетической MR наверняка будет включать в себя оценки ее эффективности у взрослых и, вероятно, у субъектов с ожирением, которые проявляются маркеры нарушения обмена веществ. Доказательства доклинических экспериментов на крысах, включающих введение в рацион MR после физического созревания, показывают, что диета полностью эффективна в снижении базального инсулина. 21 Эффективность диетической MR также оценивалась на склонных к ожирению крысах Osborne-Mendel и мышах C57BL / 6J, которые оба чувствительны к ожирению от диет с высоким содержанием жиров. В обоих отчетах метионин был ограничен в рационах с высоким содержанием жиров 60 ккал% и предоставлялся в течение ~ 4 месяцев после отлучения от груди. 21,48 Диетический MR снижал базальный инсулин примерно в три раза в каждом случае, а у мышей авторы сообщали, что толерантность к глюкозе и способность инсулина снижать уровень глюкозы в крови улучшались за счет диеты. 48 Таким образом, в обеих моделях ожирения диетическая МР может улучшить развитие ожирения и связанное с ним развитие ИР.
Доказательства доклинических экспериментов на крысах, включающих введение в рацион MR после физического созревания, показывают, что диета полностью эффективна в снижении базального инсулина. 21 Эффективность диетической MR также оценивалась на склонных к ожирению крысах Osborne-Mendel и мышах C57BL / 6J, которые оба чувствительны к ожирению от диет с высоким содержанием жиров. В обоих отчетах метионин был ограничен в рационах с высоким содержанием жиров 60 ккал% и предоставлялся в течение ~ 4 месяцев после отлучения от груди. 21,48 Диетический MR снижал базальный инсулин примерно в три раза в каждом случае, а у мышей авторы сообщали, что толерантность к глюкозе и способность инсулина снижать уровень глюкозы в крови улучшались за счет диеты. 48 Таким образом, в обеих моделях ожирения диетическая МР может улучшить развитие ожирения и связанное с ним развитие ИР.
Остается важный вопрос: может ли диетическая МР уменьшить и / или обратить вспять существующее ожирение и ИР. Это наиболее актуальный переводной контекст для диетической МРТ. Самцы мышей C57BL / 6J являются одной из наиболее изученных доклинических моделей метаболического заболевания, вызванного диетой, у которых развивается ИР и нарушается регуляция липидного обмена при кормлении диетой с высоким содержанием насыщенных жиров. 54 Развитие и тяжесть ИР зависят от количества пищевых жиров и продолжительности диеты. Например, составы диеты с очень высоким содержанием жиров (например, 55–60 ккал% жира) вызывают быстрое ухудшение чувствительности к инсулину всего тела, которое постепенно ухудшается и затрагивает как печеночный, так и периферический ИР. 55–58 В недавнем совместном исследовании с Центром метаболического фенотипирования мышей при университете Вандербильта мы проверили эффективность кратковременного (например, 8 недель) диетического МР для обратного ИР, установленного у мышей C57BL / 6J после хронического употребления (e .г., 16 недель) диеты с очень высоким содержанием жиров (например, 58 ккал%).
Это наиболее актуальный переводной контекст для диетической МРТ. Самцы мышей C57BL / 6J являются одной из наиболее изученных доклинических моделей метаболического заболевания, вызванного диетой, у которых развивается ИР и нарушается регуляция липидного обмена при кормлении диетой с высоким содержанием насыщенных жиров. 54 Развитие и тяжесть ИР зависят от количества пищевых жиров и продолжительности диеты. Например, составы диеты с очень высоким содержанием жиров (например, 55–60 ккал% жира) вызывают быстрое ухудшение чувствительности к инсулину всего тела, которое постепенно ухудшается и затрагивает как печеночный, так и периферический ИР. 55–58 В недавнем совместном исследовании с Центром метаболического фенотипирования мышей при университете Вандербильта мы проверили эффективность кратковременного (например, 8 недель) диетического МР для обратного ИР, установленного у мышей C57BL / 6J после хронического употребления (e .г., 16 недель) диеты с очень высоким содержанием жиров (например, 58 ккал%). Гиперинсулинемически-эугликемический зажимы, проведенные после восстановления мышей в течение 8 последующих недель МР, показали, что диета МР улучшает общую чувствительность к инсулину на 50% и снижает массу тела примерно на 18% (неопубликованные данные авторов). Улучшение общей чувствительности к инсулину было в первую очередь результатом усиленного подавления выработки глюкозы в печени инсулином. Дополнительные эксперименты с этой моделью потребуются для оценки способности MR увеличивать чувствительность к инсулину в других тканях.Также будет интересно определить, сможет ли длительное потребление МР с пищей полностью изменить вызванное диетой ожирение и ИР. Коллективное мнение состоит в том, что диетическая МР очень эффективна для повышения чувствительности к инсулину во многих биологических контекстах, но, что более важно, способна обратить вспять ранее существовавшую ИР, связанную с ожирением, вызванным диетой.
Гиперинсулинемически-эугликемический зажимы, проведенные после восстановления мышей в течение 8 последующих недель МР, показали, что диета МР улучшает общую чувствительность к инсулину на 50% и снижает массу тела примерно на 18% (неопубликованные данные авторов). Улучшение общей чувствительности к инсулину было в первую очередь результатом усиленного подавления выработки глюкозы в печени инсулином. Дополнительные эксперименты с этой моделью потребуются для оценки способности MR увеличивать чувствительность к инсулину в других тканях.Также будет интересно определить, сможет ли длительное потребление МР с пищей полностью изменить вызванное диетой ожирение и ИР. Коллективное мнение состоит в том, что диетическая МР очень эффективна для повышения чувствительности к инсулину во многих биологических контекстах, но, что более важно, способна обратить вспять ранее существовавшую ИР, связанную с ожирением, вызванным диетой.
7. ВЛИЯНИЕ ДИЕТИЧЕСКОГО МРТ НА ОБМЕН ЛИПИДОВ ПЕЧЕНИ: ТРАНСКРИПЦИОННЫЕ МЕХАНИЗМЫ
Нарушение регуляции липидного обмена и эктопическое накопление липидов в периферических тканях являются признаками метаболического синдрома, в то время как снижение уровня циркулирующих и тканевых липидов является биомаркером здоровья. Эффекты диетической MR на метаболизм липидов были первоначально описаны Malloy et al . 22 , которые сообщили, что MR ослабляет возрастное увеличение циркулирующего холестерина и триглицеридов у крыс. Авторы изучили реакцию крыс, которые потребляли диету MR в разное время после отлучения от груди. Они обнаружили, что уровень триглицеридов в сыворотке не увеличивался между 16 и 81 неделей у крыс на диете MR, в то время как у крыс на контрольной диете уровни увеличились на ~ 70% за тот же период.Уровень холестерина в сыворотке крови также увеличился на 65% в контрольной группе между 16 и 105 неделями, в то время как увеличение было ограничено до 16% в группе MR. 22 В исследованиях более короткой продолжительности MR вызывал трехкратное снижение уровня триглицеридов в сыворотке крови, которое было очевидным через 1 месяц после введения диеты. 59 Эти данные показывают, что диетическая MR снижает липиды сыворотки вскоре после ее введения, но они также показывают, что она предотвращает последующее возрастное повышение, которое обычно происходит в сочетании с увеличением ожирения.
Эффекты диетической MR на метаболизм липидов были первоначально описаны Malloy et al . 22 , которые сообщили, что MR ослабляет возрастное увеличение циркулирующего холестерина и триглицеридов у крыс. Авторы изучили реакцию крыс, которые потребляли диету MR в разное время после отлучения от груди. Они обнаружили, что уровень триглицеридов в сыворотке не увеличивался между 16 и 81 неделей у крыс на диете MR, в то время как у крыс на контрольной диете уровни увеличились на ~ 70% за тот же период.Уровень холестерина в сыворотке крови также увеличился на 65% в контрольной группе между 16 и 105 неделями, в то время как увеличение было ограничено до 16% в группе MR. 22 В исследованиях более короткой продолжительности MR вызывал трехкратное снижение уровня триглицеридов в сыворотке крови, которое было очевидным через 1 месяц после введения диеты. 59 Эти данные показывают, что диетическая MR снижает липиды сыворотки вскоре после ее введения, но они также показывают, что она предотвращает последующее возрастное повышение, которое обычно происходит в сочетании с увеличением ожирения. 22,59
22,59
Изменения липидов сыворотки часто указывают на изменения липогенеза и / или высвобождения в печени в сочетании с изменениями способности жировой ткани высвобождать и / или хранить триглицериды. В дополнение к снижению липидов сыворотки, диетическая MR снижает липиды печени в два-три раза как у мышей 29 , так и у крыс, 60 , что позволяет предположить печень как важную мишень MR и потенциально ответственную за снижение липидов в сыворотке. Избыточное накопление жира в печени обычно является результатом некоторой комбинации увеличения доставки, увеличения синтеза и снижения окисления или уменьшения экспорта. 61 Следовательно, дисфункциональные этапы, которые приводят к увеличению содержания жира в печени, обеспечивают полезную основу для оценки механизмов, посредством которых диетическая MR производит противоположный эффект и снижает как плазменные, так и печеночные триглицериды.
На сегодняшний день исследования в основном касались транскрипционных эффектов MR на гены, участвующие в липогенезе или окислении жирных кислот 60,62 , и были объединены с анализами ex vivo и in vivo для оценки биологической значимости наблюдаемых изменений генов в определенных путях. Например, ферменты, ограничивающие скорость липогенеза de novo (ацетил-КоА-карбоксилаза 1, АСС-1; синтаза жирных кислот, FASN) и синтез триглицеридов (стеароил-КоА-десатураза 1, SCD-1), были идентифицированы как транскрипционные мишени. МР в печени. 62 Таким образом, наблюдаемое снижение мРНК FASN и ACC-1, согласно прогнозам, снижает способность липогенеза в печени de novo , в то время как уменьшение мРНК SCD-1 должно уменьшать образование предпочтительных мононенасыщенных жирных кислот (C16: 1 и C18: 1) используется на первой стадии синтеза TG.Следовательно, наблюдаемое снижение уровня триглицеридов в печени с помощью диетической MR согласуется с прогнозируемым снижением липогенной способности печени, но они не устанавливают причинно-следственную связь или то, что in vivo скорости липогенеза печени снижаются с помощью MR. Однако недавние исследования в нашей лаборатории оценили физиологическое значение транскрипционных изменений липогенных генов печени 60 путем измерения 2 H-обогащения пальмитатом через 12 часов после инъекции контрольным мышам и мышам MR 2 H 2 O ( неопубликованные данные авторов).
Например, ферменты, ограничивающие скорость липогенеза de novo (ацетил-КоА-карбоксилаза 1, АСС-1; синтаза жирных кислот, FASN) и синтез триглицеридов (стеароил-КоА-десатураза 1, SCD-1), были идентифицированы как транскрипционные мишени. МР в печени. 62 Таким образом, наблюдаемое снижение мРНК FASN и ACC-1, согласно прогнозам, снижает способность липогенеза в печени de novo , в то время как уменьшение мРНК SCD-1 должно уменьшать образование предпочтительных мононенасыщенных жирных кислот (C16: 1 и C18: 1) используется на первой стадии синтеза TG.Следовательно, наблюдаемое снижение уровня триглицеридов в печени с помощью диетической MR согласуется с прогнозируемым снижением липогенной способности печени, но они не устанавливают причинно-следственную связь или то, что in vivo скорости липогенеза печени снижаются с помощью MR. Однако недавние исследования в нашей лаборатории оценили физиологическое значение транскрипционных изменений липогенных генов печени 60 путем измерения 2 H-обогащения пальмитатом через 12 часов после инъекции контрольным мышам и мышам MR 2 H 2 O ( неопубликованные данные авторов). Как и ожидалось, рассчитанные скорости липогенеза de novo в печени мышей MR были в три-четыре раза ниже, чем у контрольных мышей. Влияние диетической MR на окисление печеночных жирных кислот также измерялось у крыс, у которых после 9 месяцев на диете способность окислять 14 C-пальмитат увеличивалась примерно на 40% по сравнению с контрольной группой. 60 Наконец, влияние MR на экспорт триглицеридов в печень не измерялось, но, основываясь на значительном снижении липидов в сыворотке крови, кажется вероятным, что сочетание повышенной окислительной способности и снижения липогенной функции является наиболее доминирующим эффектом диета на метаболизм липидов в печени.
Как и ожидалось, рассчитанные скорости липогенеза de novo в печени мышей MR были в три-четыре раза ниже, чем у контрольных мышей. Влияние диетической MR на окисление печеночных жирных кислот также измерялось у крыс, у которых после 9 месяцев на диете способность окислять 14 C-пальмитат увеличивалась примерно на 40% по сравнению с контрольной группой. 60 Наконец, влияние MR на экспорт триглицеридов в печень не измерялось, но, основываясь на значительном снижении липидов в сыворотке крови, кажется вероятным, что сочетание повышенной окислительной способности и снижения липогенной функции является наиболее доминирующим эффектом диета на метаболизм липидов в печени.
Для более полного анализа транскрипционных ответов на диетический MR использовались подходы на основе микрочипов с высоким содержанием для выявления затронутых биологических процессов. Например, Perrone и др. . 24 использовали анализ обогащения набора генов своих данных микроматрицы, чтобы идентифицировать биологический процесс, на который по-разному повлияли периферические ткани к 3 месяцам МРТ. Обсуждение обширных транскрипционных эффектов MR выходит за рамки данной главы, но если внимание ограничивается метаболизмом липидов в печени, несколько удивительно, что их алгоритм обогащения набора генов не смог идентифицировать синтез липидов или жирных кислот как пути, которые были подавлены. пользователя MR.Напротив, как окисление жирных кислот в печени, так и метаболизм холестерина / изопреноидов были идентифицированы как пути подавления. 24 Эти выводы несколько расходятся с их предыдущими данными, показывающими значительное подавление липогенных генов печени, активацию окислительных генов и повышенную активность цитратсинтазы печени. 59,62 Чтобы оценить функциональную значимость наблюдаемых изменений в экспрессии генов, Perrone et al . 24 объединил объективный метаболомический анализ тканей и сыворотки с их анализом транскрипции для оценки влияния диетической MR на метаболом.Этот всесторонний анализ должен предоставить ценный постоянный ресурс для изучения того, как транскрипционные изменения генов в определенных тканях влияют на уровни связанных метаболитов в сыворотке.
Обсуждение обширных транскрипционных эффектов MR выходит за рамки данной главы, но если внимание ограничивается метаболизмом липидов в печени, несколько удивительно, что их алгоритм обогащения набора генов не смог идентифицировать синтез липидов или жирных кислот как пути, которые были подавлены. пользователя MR.Напротив, как окисление жирных кислот в печени, так и метаболизм холестерина / изопреноидов были идентифицированы как пути подавления. 24 Эти выводы несколько расходятся с их предыдущими данными, показывающими значительное подавление липогенных генов печени, активацию окислительных генов и повышенную активность цитратсинтазы печени. 59,62 Чтобы оценить функциональную значимость наблюдаемых изменений в экспрессии генов, Perrone et al . 24 объединил объективный метаболомический анализ тканей и сыворотки с их анализом транскрипции для оценки влияния диетической MR на метаболом.Этот всесторонний анализ должен предоставить ценный постоянный ресурс для изучения того, как транскрипционные изменения генов в определенных тканях влияют на уровни связанных метаболитов в сыворотке.
Другая недавняя оценка с высоким содержанием транскрипционных ответов на хроническую MR определила метаболизм липидов как один из основных биологических процессов, на которые влияет диета в печени и жировой ткани. 60 Последние разработки в области программного обеспечения для биоинформатики не только включают улучшенную аннотацию системной биологии транскрипционных изменений, но также предоставляют новые алгоритмы, которые стремятся идентифицировать механизмы транскрипции по наблюдаемым изменениям в экспрессии генов.Эта аналитическая стратегия направлена на выявление факторов транскрипции (TF) и ядерных рецепторов, опосредующих пищевые ответы, на основе ожидаемых причинных эффектов TF / ядерных рецепторов на известные гены-мишени относительно наблюдаемых изменений этих генов в наборе данных. Изучая направление изменения экспрессии целевого гена, алгоритм предсказывает, активируются или ингибируются определенные TF / ядерные рецепторы. В печени скоординированное подавление более 30 генов, участвующих в метаболизме липидов, привело к предсказанию, что SREBF1, SFEBF2 и MLXIPL ингибируются MR. 60 Более того, тот факт, что большинство репрессированных генов получают транскрипционный ввод от двух или более из этих TF, дополнительно подтверждает взаимосвязанность регуляторной сети. Вызванное диетой снижение экспрессии печеночного SREBP-1c согласуется с репрессивным эффектом MR на экспрессию липогенных генов. SREBP-1c и ChRE-BP также регулируются холестерином и глюкозой, и оба уменьшаются с помощью диетической MR. 23 Однако остается неясным, является ли снижение холестерина и глюкозы причиной или продуктом транскрипционных ответов на MR.В любом случае печеночный SREBP-1c, по-видимому, является ключевой мишенью механизма, посредством которого MR снижает липогенез в печени de novo , синтез триглицеридов и содержание липидов. 60 Важной остающейся проблемой является идентификация дополнительных TFs / ядерных рецепторов, рекрутируемых диетическим MR, и изучение сигнальных механизмов, участвующих в их рекрутировании в качестве медиаторов транскрипционных ответов на диету.
60 Более того, тот факт, что большинство репрессированных генов получают транскрипционный ввод от двух или более из этих TF, дополнительно подтверждает взаимосвязанность регуляторной сети. Вызванное диетой снижение экспрессии печеночного SREBP-1c согласуется с репрессивным эффектом MR на экспрессию липогенных генов. SREBP-1c и ChRE-BP также регулируются холестерином и глюкозой, и оба уменьшаются с помощью диетической MR. 23 Однако остается неясным, является ли снижение холестерина и глюкозы причиной или продуктом транскрипционных ответов на MR.В любом случае печеночный SREBP-1c, по-видимому, является ключевой мишенью механизма, посредством которого MR снижает липогенез в печени de novo , синтез триглицеридов и содержание липидов. 60 Важной остающейся проблемой является идентификация дополнительных TFs / ядерных рецепторов, рекрутируемых диетическим MR, и изучение сигнальных механизмов, участвующих в их рекрутировании в качестве медиаторов транскрипционных ответов на диету.
8. ТРАНСКРИПЦИОННОЕ ВЛИЯНИЕ ДИЕТИЧЕСКОГО МРТ НА ЖИРОВУЮ ТКАНЬ
Диетический МРТ вызывает значительные изменения массы жировой ткани, морфологии клеток, содержания митохондрий и эндокринной функции. 21,23,28,29,60,62 Оценка транскрипционных ответов периферических тканей на MR (например, печени, IWAT, скелетных мышц и коричневой жировой ткани (BAT)) показывает, что> 75% всех дифференциально экспрессированные гены были обнаружены в печени и IWAT. 60 Липидный метаболизм — это главный молекулярный и клеточный процесс, на который влияет MR в обеих тканях, но, что интересно, диета оказывает противоположное влияние на гены, связанные с синтезом липидов в этих двух тканях. 60 Например, подавление липогенных генов в печени отражается реципрокной активацией ключевых липогенных генов в депо WAT. 60 QRT-PCR и вестерн-блоттинг ферментов, ограничивающих скорость de novo липогенеза (FASN и ACC-1) и синтеза триглицеридов (SCD-1), показывают, что MR увеличивает экспрессию их мРНК и белка во всех депо WAT. 60 Эти данные показывают, что MR с пищей трансформировал WAT в потенциально важный участок синтеза липидов, чтобы компенсировать потерю липогенной способности печени. 60 Этот вывод подтверждается двумя линиями доказательств. Во-первых, RER постоянно превышают 1 ночью в группе MR, что свидетельствует о высоких скоростях использования глюкозы в сочетании с взаимным превращением в жир в результате липогенеза de novo . 63,64 Учитывая, что липогенная способность печени серьезно нарушается MR, кажется вероятным, что WAT — это место, где происходит взаимное превращение глюкозы в липид. Вторая линия доказательств исходит из измерения 2 H-обогащения пальмитатом у мышей, которым остро инъецировали 2H 2 O. Как и предполагалось, рассчитанные скорости de novo липогенеза в забрюшинном WAT, IWAT, эпидидимальном WAT и BAT от мышей MR были в три-четыре раза выше, чем у контрольных мышей (неопубликованные наблюдения авторов), установив, что и WAT, и BAT являются важными участками липогенеза de novo после MR.
60 Эти данные показывают, что MR с пищей трансформировал WAT в потенциально важный участок синтеза липидов, чтобы компенсировать потерю липогенной способности печени. 60 Этот вывод подтверждается двумя линиями доказательств. Во-первых, RER постоянно превышают 1 ночью в группе MR, что свидетельствует о высоких скоростях использования глюкозы в сочетании с взаимным превращением в жир в результате липогенеза de novo . 63,64 Учитывая, что липогенная способность печени серьезно нарушается MR, кажется вероятным, что WAT — это место, где происходит взаимное превращение глюкозы в липид. Вторая линия доказательств исходит из измерения 2 H-обогащения пальмитатом у мышей, которым остро инъецировали 2H 2 O. Как и предполагалось, рассчитанные скорости de novo липогенеза в забрюшинном WAT, IWAT, эпидидимальном WAT и BAT от мышей MR были в три-четыре раза выше, чем у контрольных мышей (неопубликованные наблюдения авторов), установив, что и WAT, и BAT являются важными участками липогенеза de novo после MR. Вместе взятые, эти результаты показывают, что диетическая MR произвела фундаментальные изменения в соответствующих функциях печени и жировой ткани, особенно в состоянии питания, когда роли жировой ткани и печени в липогенезе de novo были обращены вспять.
Вместе взятые, эти результаты показывают, что диетическая MR произвела фундаментальные изменения в соответствующих функциях печени и жировой ткани, особенно в состоянии питания, когда роли жировой ткани и печени в липогенезе de novo были обращены вспять.
Транскрипционные ответы на MR в WAT также включали гены, участвующие в окислении липидов, цикле трикарбоновых кислот (TCA), функции дыхательной цепи и адаптивном термогенезе. 21,24,28,60 Чтобы оценить влияние этих изменений, была измерена способность ex vivo свежевыделенных тканей окислять жирные кислоты с использованием 14 C-пальмитата в сочетании с измерениями активности цитрат-синтазы в качестве суррогат потока цикла TCA.MR вызывал пятикратное увеличение как окисления пальмитата, так и активности цитратсинтазы в IWAT, наряду с удвоением количества митохондрий. 60 Транскрипционное ремоделирование WAT похоже на «потемнение» WAT, которое происходит в WAT во время воздействия холода, и включает многие из тех же изменений, которые наблюдаются при MR, включая уменьшение размера клеток, образование мультилокулярных адипоцитов и увеличение количества разобщающего белка. 1 (UCP1) выражение. 21,28 Хорошо известно, что воздействие холода, действуя через норэпинефрин, вызывает одновременное увеличение поглощения глюкозы, липогенеза и β-окисления в BAT. 65,66 Более того, после хронического воздействия холода увеличенное количество коричневых адипоцитов в WAT увеличивает захват глюкозы и липогенную функцию в этих депо. Недавняя работа подчеркнула важность BAT для клиренса триглицеридов, документируя регулирующую роль симпатической нервной системы (SNS) в этом процессе. 67 Таким образом, одновременное увеличение экспрессии липогенных и окислительных генов в WAT может отражать обширное ремоделирование депо WAT, продуцируемых диетическим MR посредством воздействия на активность SNS.Этот вывод подтверждается нашей предыдущей работой, показывающей, что диетическая MR увеличивала мРНК UCP1 в 3-10 раз среди депо WAT, 21,28 и недавние наблюдения, что MR удваивает плотность митохондрий среди депо WAT и увеличивает окислительную способность IWAT в пять раз.
1 (UCP1) выражение. 21,28 Хорошо известно, что воздействие холода, действуя через норэпинефрин, вызывает одновременное увеличение поглощения глюкозы, липогенеза и β-окисления в BAT. 65,66 Более того, после хронического воздействия холода увеличенное количество коричневых адипоцитов в WAT увеличивает захват глюкозы и липогенную функцию в этих депо. Недавняя работа подчеркнула важность BAT для клиренса триглицеридов, документируя регулирующую роль симпатической нервной системы (SNS) в этом процессе. 67 Таким образом, одновременное увеличение экспрессии липогенных и окислительных генов в WAT может отражать обширное ремоделирование депо WAT, продуцируемых диетическим MR посредством воздействия на активность SNS.Этот вывод подтверждается нашей предыдущей работой, показывающей, что диетическая MR увеличивала мРНК UCP1 в 3-10 раз среди депо WAT, 21,28 и недавние наблюдения, что MR удваивает плотность митохондрий среди депо WAT и увеличивает окислительную способность IWAT в пять раз.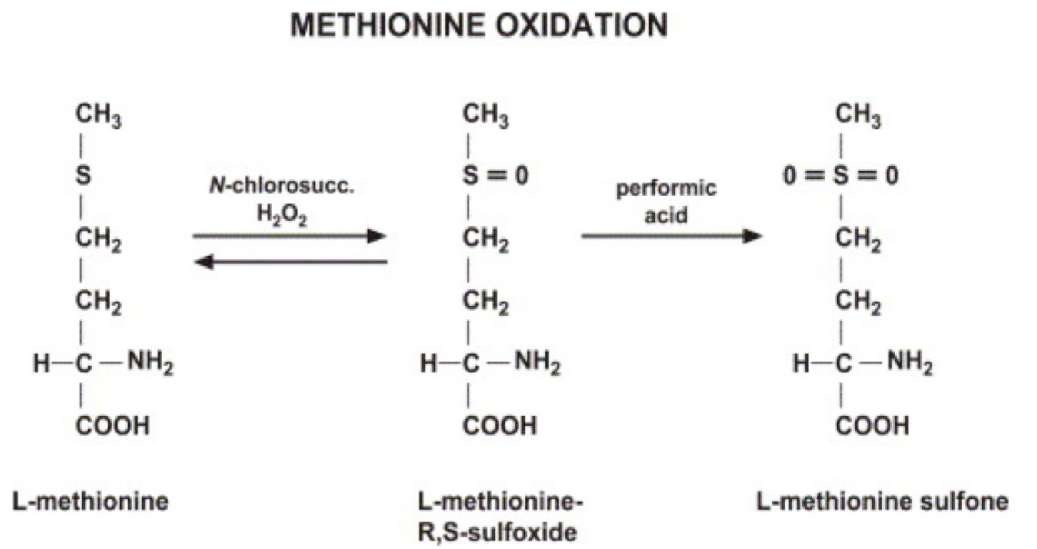 60 Многие из этих реакций, характерных для реакции «потемнения» в WAT, также производятся или усиливаются FGF-21. 53 Учитывая значительную повышающую регуляцию экспрессии и высвобождения FGF-21 в печени с помощью MR, 24 , будет интересно оценить относительную роль SNS и FGF-21 как медиаторов ремоделирования WAT и увеличения EE, вызываемого диета.
60 Многие из этих реакций, характерных для реакции «потемнения» в WAT, также производятся или усиливаются FGF-21. 53 Учитывая значительную повышающую регуляцию экспрессии и высвобождения FGF-21 в печени с помощью MR, 24 , будет интересно оценить относительную роль SNS и FGF-21 как медиаторов ремоделирования WAT и увеличения EE, вызываемого диета.
Диетический MR увеличивает EE за счет увеличения несвязанного дыхания в периферических тканях, но полный учет вовлеченных участков и тканеспецифических механизмов является неполным. Доказательства убедительны, что индукция UCP1 в BAT и WAT с помощью MR увеличивает несвязанное дыхание в обеих тканях. Увеличение составляет ~ 50% от общего увеличения EE, вызванного диетой, 21,28 , оставляя ~ 50% MR-индуцированного увеличения общего EE, опосредованного UCP1-независимыми механизмами. Недавние исследования на адаптированных к холоду UCP1-нулевых мышах показали, что высокие скорости несвязанного дыхания не требуют присутствия UCP1. 68 Хотя активация термогенного дыхания во время воздействия холода увеличивает β-окисление жирных кислот, она также вызывает скоординированное увеличение утилизации глюкозы в сочетании с парадоксальным увеличением липогенеза de novo . 66,69,70 Интересной особенностью взаимного превращения глюкозы в липид перед окислением является то, что он выделяет больше тепла и улавливает меньше потенциальной энергии, обычно получаемой при прямом окислении глюкозы. 66,70 Таким образом, увеличивая теплопотери и уменьшая чистую генерацию АТФ из глюкозы во время взаимного превращения в липид, липогенез de novo представляет собой метаболически неэффективный субстратный цикл, способный вносить значительный вклад, не зависящий от UCP1, в негибкий термогенез, особенно во время периодов. высокой утилизации глюкозы. 70 Взаимное превращение глюкозы в липид до окисления дает RER 1,0, когда скорости липогенеза de novo и окисления липидов равны.
68 Хотя активация термогенного дыхания во время воздействия холода увеличивает β-окисление жирных кислот, она также вызывает скоординированное увеличение утилизации глюкозы в сочетании с парадоксальным увеличением липогенеза de novo . 66,69,70 Интересной особенностью взаимного превращения глюкозы в липид перед окислением является то, что он выделяет больше тепла и улавливает меньше потенциальной энергии, обычно получаемой при прямом окислении глюкозы. 66,70 Таким образом, увеличивая теплопотери и уменьшая чистую генерацию АТФ из глюкозы во время взаимного превращения в липид, липогенез de novo представляет собой метаболически неэффективный субстратный цикл, способный вносить значительный вклад, не зависящий от UCP1, в негибкий термогенез, особенно во время периодов. высокой утилизации глюкозы. 70 Взаимное превращение глюкозы в липид до окисления дает RER 1,0, когда скорости липогенеза de novo и окисления липидов равны. 43,44 Таким образом, влияние этого неэффективного превращения глюкозы в липид минимально, когда скорость окисления жирных кислот низка (например, состояние сытости при температуре окружающей среды). Однако скорость окисления жирных кислот увеличивается более чем в 12 раз у UCP1-нулевых мышей во время воздействия холода, 68 и RQ в ночное время достигают или превышают 1.0, гарантируя, что скорость превращения глюкозы в липид пропорционально увеличивалась, чтобы соответствовать или превышать увеличение окисления липидов. Другими словами, увеличенный поток глюкозы через этот метаболически неэффективный путь способен значительно увеличить выработку тепла и ЭЭ посредством механизма, который не требует, но может быть усилен UCP1. В наших исследованиях с MR диета обеспечивает последовательное усиление липогенеза de novo , которое временно совпадает с увеличением EE в ночное время.Мы предполагаем, что усиление субстратного цикла глюкозы через этот механизм в ночное время является важным компонентом несвязанного дыхания и метаболической неэффективности, вызванной диетической МР.
43,44 Таким образом, влияние этого неэффективного превращения глюкозы в липид минимально, когда скорость окисления жирных кислот низка (например, состояние сытости при температуре окружающей среды). Однако скорость окисления жирных кислот увеличивается более чем в 12 раз у UCP1-нулевых мышей во время воздействия холода, 68 и RQ в ночное время достигают или превышают 1.0, гарантируя, что скорость превращения глюкозы в липид пропорционально увеличивалась, чтобы соответствовать или превышать увеличение окисления липидов. Другими словами, увеличенный поток глюкозы через этот метаболически неэффективный путь способен значительно увеличить выработку тепла и ЭЭ посредством механизма, который не требует, но может быть усилен UCP1. В наших исследованиях с MR диета обеспечивает последовательное усиление липогенеза de novo , которое временно совпадает с увеличением EE в ночное время.Мы предполагаем, что усиление субстратного цикла глюкозы через этот механизм в ночное время является важным компонентом несвязанного дыхания и метаболической неэффективности, вызванной диетической МР.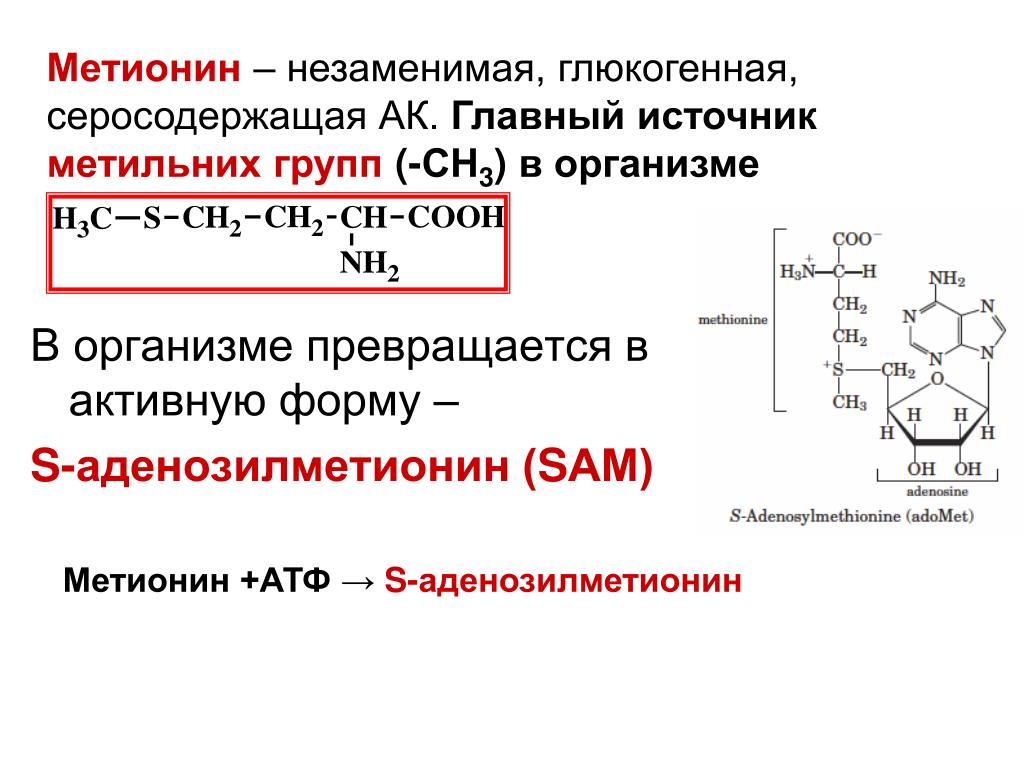 Однако ЭЭ у животных на диете MR также выше, чем в контрольной группе, в течение дня, когда жир становится основным метаболическим топливом и цикл субстрата через гликогенный / липогенный механизм исключается. А поскольку грызуны в основном спят в течение дня, групповые различия в ЭЭ в состоянии покоя позволяют предположить, что диетическая MR также влияет на общую ЭЭ, снижая метаболическую эффективность окисления жиров.Неясно, ограничивается ли это разобщение окисления жира конкретными тканями или MR вызывает метаболическую неэффективность во многих тканях. Эти вопросы изучаются с использованием подходов с потерей функции с UCP1-нулевыми мышами и с мышами, лишенными β-адренорецепторов. Соответствующие линии мышей позволят нам определить пропорции увеличенного EE, которые зависят от UCP1, и степень, в которой повышенная активация SNS требуется для ремоделирования транскрипции жировой ткани.Учитывая роль SNS в регуляции эндокринной функции жировой ткани, также кажется вероятным, что MR может использовать SNS в качестве моторной руки для производства компонентов своего фенотипа энергетического баланса посредством снижения экспрессии и высвобождения лептина.
Однако ЭЭ у животных на диете MR также выше, чем в контрольной группе, в течение дня, когда жир становится основным метаболическим топливом и цикл субстрата через гликогенный / липогенный механизм исключается. А поскольку грызуны в основном спят в течение дня, групповые различия в ЭЭ в состоянии покоя позволяют предположить, что диетическая MR также влияет на общую ЭЭ, снижая метаболическую эффективность окисления жиров.Неясно, ограничивается ли это разобщение окисления жира конкретными тканями или MR вызывает метаболическую неэффективность во многих тканях. Эти вопросы изучаются с использованием подходов с потерей функции с UCP1-нулевыми мышами и с мышами, лишенными β-адренорецепторов. Соответствующие линии мышей позволят нам определить пропорции увеличенного EE, которые зависят от UCP1, и степень, в которой повышенная активация SNS требуется для ремоделирования транскрипции жировой ткани.Учитывая роль SNS в регуляции эндокринной функции жировой ткани, также кажется вероятным, что MR может использовать SNS в качестве моторной руки для производства компонентов своего фенотипа энергетического баланса посредством снижения экспрессии и высвобождения лептина. 21,22,28 Например, уменьшение лептина в плазме, продуцируемого MR, непропорционально уменьшению массы жировой ткани, производимой диетой, 21,22,28 , производя сильный орексигенный сигнал, который, возможно, частично ответственен за это. для гиперфагической реакции на диетический MR.Привлекательной моделью для исследования этой гипотезы является мышь ob / ob , у которой отсутствует способность экспрессировать функциональный лептин из-за мутации внутри гена. 71 Однако мутация ob приводит к вторичным изменениям в β-адренергической передаче сигналов в жировой ткани, что ставит под угрозу способность как BAT, так и WAT полностью отвечать на вход SNS. 72,73 Мы предполагаем, что MR-зависимое увеличение поступления SNS в жировую ткань является важным компонентом механизма, с помощью которого диета влияет на энергетический баланс.Следовательно, будет интересно определить экспериментально, в какой степени метаболические нарушения у мышей ob / ob ставят под угрозу их способность отвечать на диетический MR.
21,22,28 Например, уменьшение лептина в плазме, продуцируемого MR, непропорционально уменьшению массы жировой ткани, производимой диетой, 21,22,28 , производя сильный орексигенный сигнал, который, возможно, частично ответственен за это. для гиперфагической реакции на диетический MR.Привлекательной моделью для исследования этой гипотезы является мышь ob / ob , у которой отсутствует способность экспрессировать функциональный лептин из-за мутации внутри гена. 71 Однако мутация ob приводит к вторичным изменениям в β-адренергической передаче сигналов в жировой ткани, что ставит под угрозу способность как BAT, так и WAT полностью отвечать на вход SNS. 72,73 Мы предполагаем, что MR-зависимое увеличение поступления SNS в жировую ткань является важным компонентом механизма, с помощью которого диета влияет на энергетический баланс.Следовательно, будет интересно определить экспериментально, в какой степени метаболические нарушения у мышей ob / ob ставят под угрозу их способность отвечать на диетический MR.
Если рассматривать в физиологическом контексте, транскрипционное и морфологическое ремоделирование WAT с помощью диетической MR вызывает фундаментальные изменения в способе функционирования WAT как при приеме пищи, так и при голодании. В состоянии сытости WAT становится важным местом поглощения и использования глюкозы для взаимного превращения в липиды, в то время как в состоянии натощак увеличение окислительной способности расширяет его участие в окислении жирных кислот.Общий эффект заключается в ограничении общего увеличения массы жировой ткани и эктопического накопления липидов, но изменения также изменяют соответствующие роли жировой ткани и печени, особенно с точки зрения липогенеза. При совокупном рассмотрении тканеспецифические транскрипционные реакции на диетический MR убедительно свидетельствуют о том, что диета эффективно изменила интеграцию липидного обмена между печенью и жировой тканью таким образом, что это благоприятно сказывается на общем метаболическом профиле животного.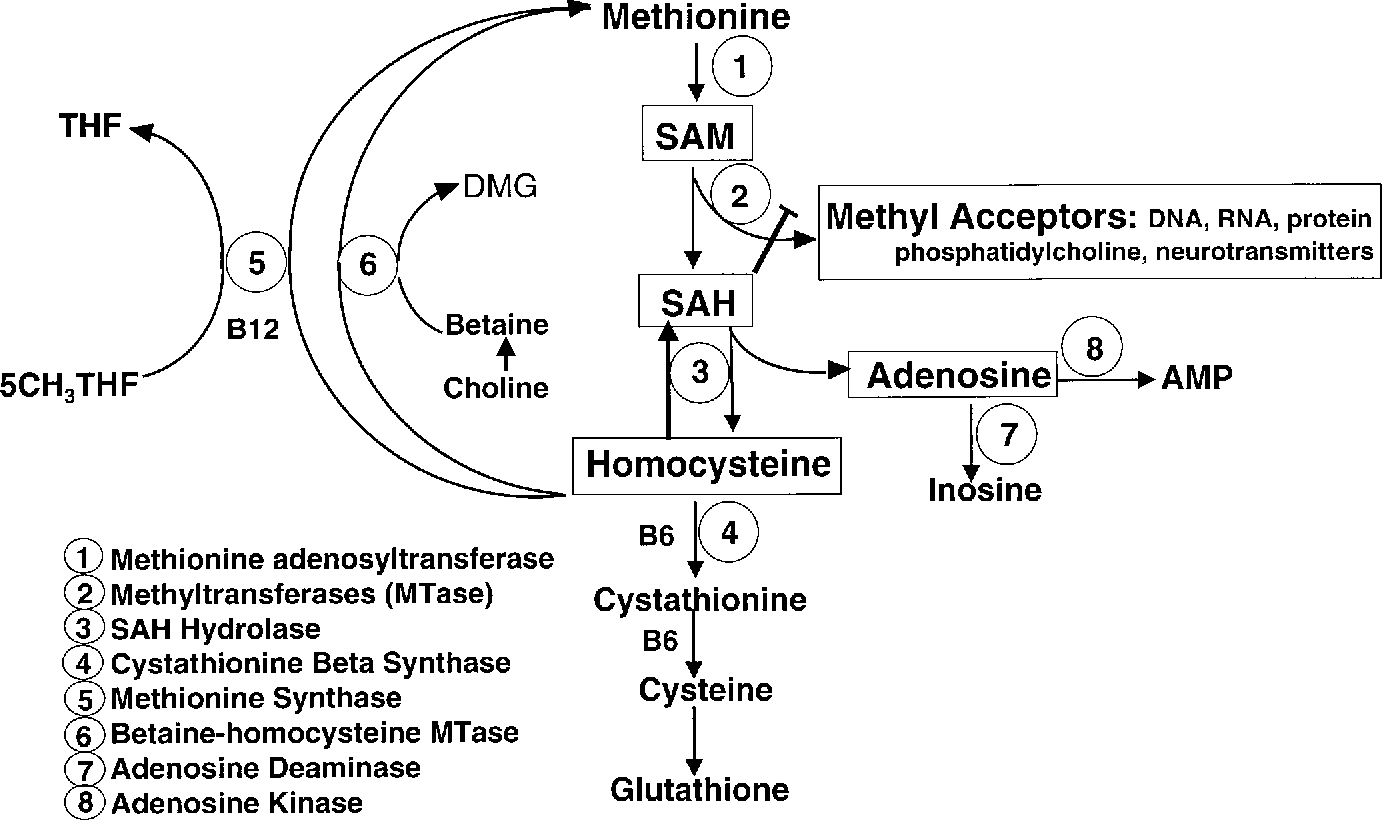
9. ДИЕТИЧЕСКОЕ ОПРЕДЕЛЕНИЕ MR
Важный вопрос, на который нет ответа, заключается в том, как обнаруживается ограничение пищевого метионина и как ощущение ограничения транслируется в высокоинтегрированные транскрипционные ответы в печени и WAT. Ограничение доступности EAA эффективно ограничивает заряд тРНК родственной аминокислотой и активирует высококонсервативную и повсеместно экспрессируемую протеинкиназу GCN2 (общий контроль недерепрессируемый 2), что ограничивает рибосомную трансляцию большинства мРНК. 74–76 Транскрипционные эффекты депривации EAA на липогенные гены были первоначально идентифицированы в клетках HepG2 человека, где среда, лишенная одного EAA, снижает инициацию транскрипции и экспрессию FASN. 77 Эти исследования предполагают интересную возможность того, что MR действует через GCN2 для снижения экспрессии липогенных генов в печени. Однако MR увеличивает экспрессию липогенных генов в WAT и мышцах, что свидетельствует против роли GCN2 и предполагает участие дополнительных сенсорных систем в этих тканях. Альтернативно, WAT и мышца могут реагировать на эндокринные сигналы, исходящие из разных тканей, или на нервные сигналы, возникающие в результате центрального восприятия снижения циркулирующего метионина. Эти вопросы изучаются на GCN2-нулевых мышах в настоящее время, и полученные на сегодняшний день данные свидетельствуют о том, что многие из ответов на диетический MR остаются неизменными в отсутствие GCN2. Хотя предварительные, эти находки предоставляют убедительные доказательства того, что сенсорные и сигнальные системы в дополнение к GCN2 участвуют в обнаружении и опосредовании физиологических, биохимических и транскрипционных ответов на диетический MR.
Альтернативно, WAT и мышца могут реагировать на эндокринные сигналы, исходящие из разных тканей, или на нервные сигналы, возникающие в результате центрального восприятия снижения циркулирующего метионина. Эти вопросы изучаются на GCN2-нулевых мышах в настоящее время, и полученные на сегодняшний день данные свидетельствуют о том, что многие из ответов на диетический MR остаются неизменными в отсутствие GCN2. Хотя предварительные, эти находки предоставляют убедительные доказательства того, что сенсорные и сигнальные системы в дополнение к GCN2 участвуют в обнаружении и опосредовании физиологических, биохимических и транскрипционных ответов на диетический MR.
10. ПЕРСПЕКТИВЫ И БУДУЩИЕ НАПРАВЛЕНИЯ
В нашей работе над диетической MR на сегодняшний день мы определили диапазон концентраций метионина в рационе, который приводит к значительному улучшению биомаркеров метаболического здоровья. Следующие важные шаги — уточнить наше понимание степени MR, связанной с каждым компонентом, и распространить эту работу на диетическое ограничение других EAA.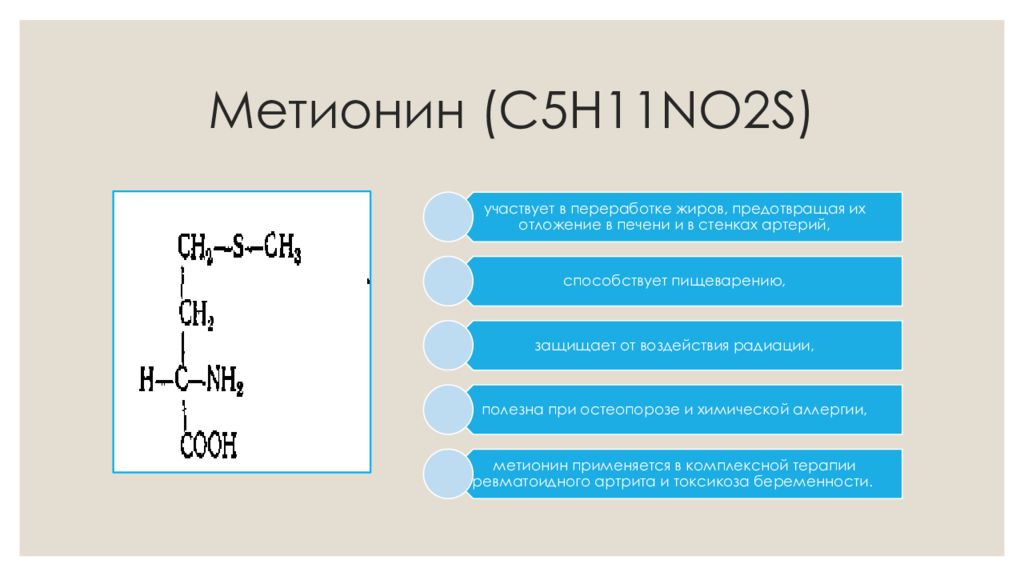 Значительный объем работ был посвящен изучению диетической депривации лейцина. Недавно мы опубликовали подробный отчет о сходствах и различиях между ответами, вызванными двумя диетами. 29 Одним из важных отличий является то, что диетическая MR вызывает гиперфагию, в то время как диетическая депривация лейцина вызывает значительное отвращение к пище и быстро развивающийся отрицательный энергетический баланс, который не может поддерживаться дольше нескольких недель. Следует отметить, что ограничение диетического метионина до уровней, намного более низких, чем 0,17% метионина, предусмотренного в рецептуре MR-диеты, вызывает отвращение к пище и такие же пагубные эффекты, как лишение лейцина. Следовательно, сравнение физиологических реакций на диетический MR и лишение лейцина предполагает, что EAAs в некотором смысле функционируют как лиганды, а ответы определяются степенью ограничения.Из этого следует, что важной будущей целью будет систематическое изучение физиологических реакций на постепенное ограничение метионина, лейцина и других EAA.
Значительный объем работ был посвящен изучению диетической депривации лейцина. Недавно мы опубликовали подробный отчет о сходствах и различиях между ответами, вызванными двумя диетами. 29 Одним из важных отличий является то, что диетическая MR вызывает гиперфагию, в то время как диетическая депривация лейцина вызывает значительное отвращение к пище и быстро развивающийся отрицательный энергетический баланс, который не может поддерживаться дольше нескольких недель. Следует отметить, что ограничение диетического метионина до уровней, намного более низких, чем 0,17% метионина, предусмотренного в рецептуре MR-диеты, вызывает отвращение к пище и такие же пагубные эффекты, как лишение лейцина. Следовательно, сравнение физиологических реакций на диетический MR и лишение лейцина предполагает, что EAAs в некотором смысле функционируют как лиганды, а ответы определяются степенью ограничения.Из этого следует, что важной будущей целью будет систематическое изучение физиологических реакций на постепенное ограничение метионина, лейцина и других EAA. Помимо определения ряда наиболее полезных ограничений, этот подход может также предоставить важные механистические идеи относительно механизмов зондирования, специфичных для ЕАА. Например, в предварительных исследованиях на сегодняшний день мы обнаружили, что ограничение лейцина в пище воспроизводит некоторые, но не все физиологические реакции, вызываемые диетической МР.Эти модели обещают обеспечить плодотворный подход к анализу и выявлению уникальных механизмов, задействованных в диетическом ограничении метионина для улучшения метаболического здоровья.
Помимо определения ряда наиболее полезных ограничений, этот подход может также предоставить важные механистические идеи относительно механизмов зондирования, специфичных для ЕАА. Например, в предварительных исследованиях на сегодняшний день мы обнаружили, что ограничение лейцина в пище воспроизводит некоторые, но не все физиологические реакции, вызываемые диетической МР.Эти модели обещают обеспечить плодотворный подход к анализу и выявлению уникальных механизмов, задействованных в диетическом ограничении метионина для улучшения метаболического здоровья.
Другая экспериментальная стратегия, направленная на лучшее понимание компонентов сложных реакций на диетическую МР, состоит в изучении их пространственной и временной организации. Например, трудно отличить прямые эффекты MR в конкретной ткани от ответов, которые модулируются путем обнаружения ограничения в другом анатомическом сайте, которое затем может обеспечивать вторичный сигнальный или эндокринный ввод в исходный сайт.Таким образом, в дополнение к своей пространственной организации индивидуальный компонент ответа на MR также организован во времени, развиваясь в воспроизводимой прогрессии после введения диеты. В недавнем обзоре ( 29 ) мы предложили четыре потенциальных места определения ограничения ЕАА в рационе: (1) прямое определение люминальных или абсорбированных ЕАА в кишечнике, (2) определение ЕАА в портальном кровотоке и / или печени (3). ) прямое определение сниженных ЕАА тканями и (4) определение ЕАА в различных областях мозга.Существуют огромные пробелы в нашем понимании того, как эти и еще неизвестные сенсорные компоненты функционируют вместе, опосредуя комплексные физиологические реакции на изменения в содержании ЕАА в пище. Будет особенно важно идентифицировать центральные системы восприятия аминокислот и составить карту того, как они организованы, чтобы обеспечить интегрированное регулирование компонентов энергетического баланса и коммуникации с периферическими тканями. Лучшее понимание того, как диетическая МРТ увеличивает тканеспецифическую и общую чувствительность к инсулину, также является центральным вопросом.Общий метаболический фенотип, вызванный депривацией ЕАА по сравнению с ограничением, является продуктом ряда реакций, которые организованы анатомически и временно и во многих случаях взаимозависимы.
В недавнем обзоре ( 29 ) мы предложили четыре потенциальных места определения ограничения ЕАА в рационе: (1) прямое определение люминальных или абсорбированных ЕАА в кишечнике, (2) определение ЕАА в портальном кровотоке и / или печени (3). ) прямое определение сниженных ЕАА тканями и (4) определение ЕАА в различных областях мозга.Существуют огромные пробелы в нашем понимании того, как эти и еще неизвестные сенсорные компоненты функционируют вместе, опосредуя комплексные физиологические реакции на изменения в содержании ЕАА в пище. Будет особенно важно идентифицировать центральные системы восприятия аминокислот и составить карту того, как они организованы, чтобы обеспечить интегрированное регулирование компонентов энергетического баланса и коммуникации с периферическими тканями. Лучшее понимание того, как диетическая МРТ увеличивает тканеспецифическую и общую чувствительность к инсулину, также является центральным вопросом.Общий метаболический фенотип, вызванный депривацией ЕАА по сравнению с ограничением, является продуктом ряда реакций, которые организованы анатомически и временно и во многих случаях взаимозависимы. Таким образом, серьезной постоянной задачей в данной области будет разработка экспериментальных подходов, позволяющих различать прямые тканеспецифические ответы на МР и ответы, воспринимаемые в одном анатомическом участке и модулируемые в другом.
Таким образом, серьезной постоянной задачей в данной области будет разработка экспериментальных подходов, позволяющих различать прямые тканеспецифические ответы на МР и ответы, воспринимаемые в одном анатомическом участке и модулируемые в другом.
Наконец, трансляционный потенциал концепций, разработанных в доклинических исследованиях диетической МР, был недавно оценен в когорте людей, отвечающих критериям метаболического синдрома. 78 Диетическая MR была достигнута с использованием полусинтетического лечебного питания Hominex-2® (Abbott Nutrition, Колумбус, Огайо) в краткосрочном исследовании (16 недель) для оценки метаболических последствий ограничения диетического метионина с 35 мг / кг массы тела. / сут до 2 мг / кг МТ / сут. Экспериментальная диета (Hominex-2®) представляет собой коммерческий продукт питания, предназначенный для обеспечения нутритивной поддержки пациентов с не отвечающей на пиридоксин гомоцистинурией или гиперметионинемией. Он частично состоит из элементарных аминокислот, и связанные с ними низкие вкусовые качества привели к высокой частоте отмены и подняли вопросы о соблюдении и достижении желаемой степени MR. Еще одно беспокойство после исследования связано с тем фактом, что, хотя Hominex-2® является дефицитным по метионину, он содержит метионинсберегающий цистин. 79 Это может быть значительным, поскольку в диете MR для грызунов отсутствует цистин, а недавнее исследование показало, что добавление его обратно в состав MR для грызунов полностью изменило многие полезные метаболические эффекты MR. 59 Таким образом, цистин в Hominex-2® может ограничивать полную эффективность MR, достигаемую с помощью этого подхода. Несмотря на эти экспериментальные ограничения, мы обнаружили, что диетическая MR увеличивает окисление жиров и снижает содержание липидов в печени у субъектов с метаболическим заболеванием. 78 Разработка методов производства очень вкусных, обедненных метионином белков представляет собой лучший подход, поскольку он решит как проблемы цистина, так и вкусовых качеств. Это представляет собой область повышенного интереса в нашей лаборатории и, вероятно, обеспечит лучшую стратегию для тестирования трансляционного потенциала диетической МРТ в клинике.
Еще одно беспокойство после исследования связано с тем фактом, что, хотя Hominex-2® является дефицитным по метионину, он содержит метионинсберегающий цистин. 79 Это может быть значительным, поскольку в диете MR для грызунов отсутствует цистин, а недавнее исследование показало, что добавление его обратно в состав MR для грызунов полностью изменило многие полезные метаболические эффекты MR. 59 Таким образом, цистин в Hominex-2® может ограничивать полную эффективность MR, достигаемую с помощью этого подхода. Несмотря на эти экспериментальные ограничения, мы обнаружили, что диетическая MR увеличивает окисление жиров и снижает содержание липидов в печени у субъектов с метаболическим заболеванием. 78 Разработка методов производства очень вкусных, обедненных метионином белков представляет собой лучший подход, поскольку он решит как проблемы цистина, так и вкусовых качеств. Это представляет собой область повышенного интереса в нашей лаборатории и, вероятно, обеспечит лучшую стратегию для тестирования трансляционного потенциала диетической МРТ в клинике.
БЛАГОДАРНОСТИ
Гранты или стипендии в поддержку написания главы: Эта работа была частично поддержана ADA 1-12-BS-58 (T.W. G) и NIH RO1DK-096311 (T. W. G.). В этой работе также использовались основные средства Genomics и Cell Biology & Bioimaging, поддерживаемые NIH P20-GM103528 (T. W. G.) и NIH P30 DK072476. D. W. поддерживается грантом на институциональное обучение NIH, 5T32DK064584-10 и стипендией для постдокторантов ADA 7-13-MI-05.
СПИСОК СОКРАЩЕНИЙ
| ACC-1 | ацетил-КоА карбоксилаза 1 | ||||
| ANCOVA | анализ ковариантности | ||||
| BAT10 | коричневая диета | коричневая диета | EAA | незаменимые аминокислоты | |
| EE | Энергозатраты | ||||
| FASN | Синтаза жирных кислот | ||||
| FGF-21 | фактор роста фибробластов 907 907 | ||||
| IR | инсулинорезистентность | ||||
| IWAT | паховая белая жировая ткань | ||||
| MR | ограничение метионина | ||||
| MsrA7 | B MsrAER и MsrA10 9070 | респиратор коэффициент обмена | |||
| SCD-1 | стеароил-КоА-десатураза 1 | ||||
| SNS | Симпатическая нервная система | ||||
| TCA | ТФКЦП | разобщающий белок 1 | |||
| WAT | белая жировая ткань |
ССЫЛКИ
1. Энтони Т.Г., Макдэниел Б.Дж., Байерли Р.Л. и др. Сохранение синтеза белка в печени во время диетической депривации лейцина происходит за счет массы скелетных мышц у мышей, удаленных для киназы eIF2 GCN2. J Biol Chem. 2004; 279: 36553–36561. [PubMed] [Google Scholar] 2. Го Ф, Кавенер ДР. Киназа GCN2 eIF2alpha регулирует гомеостаз жирных кислот в печени во время лишения незаменимой аминокислоты. Cell Metab. 2007. 5: 103–114. [PubMed] [Google Scholar] 3. Сяо Ф, Хуанг З., Ли Х и др. Депривация лейцина увеличивает чувствительность печени к инсулину через пути GCN2 / mTOR / S6K1 и AMPK.Сахарный диабет. 2011; 60: 746–756. [Бесплатная статья PMC] [PubMed] [Google Scholar] 4. Xia T, Cheng Y, Zhang Q и др. S6K1 в центральной нервной системе регулирует расход энергии через пути MC4R / CRH в ответ на лишение незаменимой аминокислоты. Сахарный диабет. 2012; 61: 2461–2471. [Бесплатная статья PMC] [PubMed] [Google Scholar] 5. Cheng Y, Meng Q, Wang C и др. Депривация лейцина снижает жировую массу за счет стимуляции липолиза в белой жировой ткани и активации разобщающего белка 1 (UCP1) в коричневой жировой ткани.
Энтони Т.Г., Макдэниел Б.Дж., Байерли Р.Л. и др. Сохранение синтеза белка в печени во время диетической депривации лейцина происходит за счет массы скелетных мышц у мышей, удаленных для киназы eIF2 GCN2. J Biol Chem. 2004; 279: 36553–36561. [PubMed] [Google Scholar] 2. Го Ф, Кавенер ДР. Киназа GCN2 eIF2alpha регулирует гомеостаз жирных кислот в печени во время лишения незаменимой аминокислоты. Cell Metab. 2007. 5: 103–114. [PubMed] [Google Scholar] 3. Сяо Ф, Хуанг З., Ли Х и др. Депривация лейцина увеличивает чувствительность печени к инсулину через пути GCN2 / mTOR / S6K1 и AMPK.Сахарный диабет. 2011; 60: 746–756. [Бесплатная статья PMC] [PubMed] [Google Scholar] 4. Xia T, Cheng Y, Zhang Q и др. S6K1 в центральной нервной системе регулирует расход энергии через пути MC4R / CRH в ответ на лишение незаменимой аминокислоты. Сахарный диабет. 2012; 61: 2461–2471. [Бесплатная статья PMC] [PubMed] [Google Scholar] 5. Cheng Y, Meng Q, Wang C и др. Депривация лейцина снижает жировую массу за счет стимуляции липолиза в белой жировой ткани и активации разобщающего белка 1 (UCP1) в коричневой жировой ткани. Сахарный диабет. 2010; 59: 17–25. [Бесплатная статья PMC] [PubMed] [Google Scholar] 6. Cheng Y, Zhang Q, Meng Q, et al. Депривация лейцина стимулирует потерю жира за счет увеличения экспрессии CRH в гипоталамусе и активации симпатической нервной системы. Мол Эндокринол. 2011; 25: 1624–1635. [Бесплатная статья PMC] [PubMed] [Google Scholar] 7. Орентрайх Н., Матиас Дж. Р., ДеФеличе А., Циммерман Дж. А. Низкое потребление метионина крысами увеличивает продолжительность жизни. J Nutr. 1993; 123: 269–274. [PubMed] [Google Scholar] 8. Ричи Дж. П., мл., Лойцингер Ю., Партасарати С., Маллой В., Орентрайх Н., Циммерман Дж. А.Ограничение метионина увеличивает глутатион в крови и увеличивает продолжительность жизни у крыс F344. FASEB J. 1994; 8: 1302–1307. [PubMed] [Google Scholar] 9. Циммерман Дж. А., Маллой В., Крайчик Р., Орентрайх Н. Контроль над питанием при старении. Exp Gerontol. 2003; 38: 47–52. [PubMed] [Google Scholar] 10. Миллер Р.А., Бюнер Дж., Чанг И., Харпер Дж. М., Сиглер Р., Смит-Уилок М.
Сахарный диабет. 2010; 59: 17–25. [Бесплатная статья PMC] [PubMed] [Google Scholar] 6. Cheng Y, Zhang Q, Meng Q, et al. Депривация лейцина стимулирует потерю жира за счет увеличения экспрессии CRH в гипоталамусе и активации симпатической нервной системы. Мол Эндокринол. 2011; 25: 1624–1635. [Бесплатная статья PMC] [PubMed] [Google Scholar] 7. Орентрайх Н., Матиас Дж. Р., ДеФеличе А., Циммерман Дж. А. Низкое потребление метионина крысами увеличивает продолжительность жизни. J Nutr. 1993; 123: 269–274. [PubMed] [Google Scholar] 8. Ричи Дж. П., мл., Лойцингер Ю., Партасарати С., Маллой В., Орентрайх Н., Циммерман Дж. А.Ограничение метионина увеличивает глутатион в крови и увеличивает продолжительность жизни у крыс F344. FASEB J. 1994; 8: 1302–1307. [PubMed] [Google Scholar] 9. Циммерман Дж. А., Маллой В., Крайчик Р., Орентрайх Н. Контроль над питанием при старении. Exp Gerontol. 2003; 38: 47–52. [PubMed] [Google Scholar] 10. Миллер Р.А., Бюнер Дж., Чанг И., Харпер Дж. М., Сиглер Р., Смит-Уилок М. Диета с дефицитом метионина увеличивает продолжительность жизни мышей, замедляет старение иммунной системы и хрусталика, изменяет уровни глюкозы, Т4, IGF-I и инсулина, а также увеличивает MIF гепатоцитов. уровни и стрессоустойчивость.Ячейка старения. 2005. 4: 119–125. [Бесплатная статья PMC] [PubMed] [Google Scholar] 11. Сун Л., Садыги Аха А.А., Миллер Р.А., Харпер Дж. М.. Увеличение продолжительности жизни мышей за счет ограничения еды перед отъемом и ограничения метионина в среднем возрасте. J Gerontol A Biol Sci Med Sci. 2009; 64: 711–722. [Бесплатная статья PMC] [PubMed] [Google Scholar] 12. Грандисон Р.К., Пайпер, доктор медицины, Партридж Л. Аминокислотный дисбаланс у дрозофилы объясняет увеличение продолжительности жизни ограничением в питании. Природа. 2009; 462: 1061–1064. [Бесплатная статья PMC] [PubMed] [Google Scholar] 13.Майр В., Пайпер, доктор медицины, Партридж Л. Калории не объясняют увеличение продолжительности жизни диетическим ограничением у дрозофилы. PLoS Biol. 2005; 3: e223.
Диета с дефицитом метионина увеличивает продолжительность жизни мышей, замедляет старение иммунной системы и хрусталика, изменяет уровни глюкозы, Т4, IGF-I и инсулина, а также увеличивает MIF гепатоцитов. уровни и стрессоустойчивость.Ячейка старения. 2005. 4: 119–125. [Бесплатная статья PMC] [PubMed] [Google Scholar] 11. Сун Л., Садыги Аха А.А., Миллер Р.А., Харпер Дж. М.. Увеличение продолжительности жизни мышей за счет ограничения еды перед отъемом и ограничения метионина в среднем возрасте. J Gerontol A Biol Sci Med Sci. 2009; 64: 711–722. [Бесплатная статья PMC] [PubMed] [Google Scholar] 12. Грандисон Р.К., Пайпер, доктор медицины, Партридж Л. Аминокислотный дисбаланс у дрозофилы объясняет увеличение продолжительности жизни ограничением в питании. Природа. 2009; 462: 1061–1064. [Бесплатная статья PMC] [PubMed] [Google Scholar] 13.Майр В., Пайпер, доктор медицины, Партридж Л. Калории не объясняют увеличение продолжительности жизни диетическим ограничением у дрозофилы. PLoS Biol. 2005; 3: e223. [Бесплатная статья PMC] [PubMed] [Google Scholar] 14. Коч А., Гаш А.П., Резерфорд Дж. К., Ким Х. Ю., Гладышев В. Н.. Регулирование продолжительности жизни дрожжей с помощью метионинсульфоксидредуктазы выявляет зависимые и независимые от активных форм кислорода компоненты старения. Proc Natl Acad Sci U S. A. 2004; 101: 7999–8004. [Бесплатная статья PMC] [PubMed] [Google Scholar] 15. Руан Х., Тан XD, Чен М.Л. и др.Качественное продление жизни за счет фермента пептида метионин сульфоксидредуктазы. Proc Natl Acad Sci U S. A. 2002; 99: 2748–2753. [Бесплатная статья PMC] [PubMed] [Google Scholar] 16. Московиц Дж., Бар-Ной С., Уильямс В.М., Рекена Дж., Берлетт Б.С., Штадтман Э.Р. Метионинсульфоксидредуктаза (MsrA) является регулятором антиоксидантной защиты и продолжительности жизни у млекопитающих. Proc Natl Acad Sci U S. A. 2001; 98: 12920–12925. [Бесплатная статья PMC] [PubMed] [Google Scholar] 17. Дейл З., Юрикова М., Стучликова Е. Влияние режима питания на концентрацию коллагена и выживаемость крыс.
[Бесплатная статья PMC] [PubMed] [Google Scholar] 14. Коч А., Гаш А.П., Резерфорд Дж. К., Ким Х. Ю., Гладышев В. Н.. Регулирование продолжительности жизни дрожжей с помощью метионинсульфоксидредуктазы выявляет зависимые и независимые от активных форм кислорода компоненты старения. Proc Natl Acad Sci U S. A. 2004; 101: 7999–8004. [Бесплатная статья PMC] [PubMed] [Google Scholar] 15. Руан Х., Тан XD, Чен М.Л. и др.Качественное продление жизни за счет фермента пептида метионин сульфоксидредуктазы. Proc Natl Acad Sci U S. A. 2002; 99: 2748–2753. [Бесплатная статья PMC] [PubMed] [Google Scholar] 16. Московиц Дж., Бар-Ной С., Уильямс В.М., Рекена Дж., Берлетт Б.С., Штадтман Э.Р. Метионинсульфоксидредуктаза (MsrA) является регулятором антиоксидантной защиты и продолжительности жизни у млекопитающих. Proc Natl Acad Sci U S. A. 2001; 98: 12920–12925. [Бесплатная статья PMC] [PubMed] [Google Scholar] 17. Дейл З., Юрикова М., Стучликова Е. Влияние режима питания на концентрацию коллагена и выживаемость крыс. Adv Exp Med Biol. 1975. 53: 359–369. [PubMed] [Google Scholar] 18. Маккей К.М., Кроуэлл М.Ф., Мейнард, Лос-Анджелес. Влияние замедленного роста на продолжительность жизни и конечный размер тела. 1935. Питание. 1989. 5: 155–171. [PubMed] [Google Scholar] 20. Барзилай Н., Габриэли И. Роль истощения жировых отложений в биологической пользе ограничения калорийности. J Nutr. 2001; 131: 903С – 906С. [PubMed] [Google Scholar] 21. Хасек Б.Е., Стюарт Л.К., Хенаган Т.М. и др. Ограничение метионина в пище увеличивает метаболическую гибкость и увеличивает несвязанное дыхание как при приеме пищи, так и при голодании.Am J Physiol Regul Integr Comp Physiol. 2010; 299: R728 – R739. [Бесплатная статья PMC] [PubMed] [Google Scholar] 22. Malloy VL, Krajcik RA, Bailey SJ, Hristopoulos G, Plummer JD, Orentreich N. Ограничение метионина снижает массу висцерального жира и сохраняет действие инсулина у стареющих самцов крыс Fischer 344 независимо от ограничения энергии. Ячейка старения. 2006; 5: 305–314. [PubMed] [Google Scholar] 23.
Adv Exp Med Biol. 1975. 53: 359–369. [PubMed] [Google Scholar] 18. Маккей К.М., Кроуэлл М.Ф., Мейнард, Лос-Анджелес. Влияние замедленного роста на продолжительность жизни и конечный размер тела. 1935. Питание. 1989. 5: 155–171. [PubMed] [Google Scholar] 20. Барзилай Н., Габриэли И. Роль истощения жировых отложений в биологической пользе ограничения калорийности. J Nutr. 2001; 131: 903С – 906С. [PubMed] [Google Scholar] 21. Хасек Б.Е., Стюарт Л.К., Хенаган Т.М. и др. Ограничение метионина в пище увеличивает метаболическую гибкость и увеличивает несвязанное дыхание как при приеме пищи, так и при голодании.Am J Physiol Regul Integr Comp Physiol. 2010; 299: R728 – R739. [Бесплатная статья PMC] [PubMed] [Google Scholar] 22. Malloy VL, Krajcik RA, Bailey SJ, Hristopoulos G, Plummer JD, Orentreich N. Ограничение метионина снижает массу висцерального жира и сохраняет действие инсулина у стареющих самцов крыс Fischer 344 независимо от ограничения энергии. Ячейка старения. 2006; 5: 305–314. [PubMed] [Google Scholar] 23. Perrone CE, Mattocks DA, Hristopoulos G, Plummer JD, Krajcik RA, Orentreich N. Эффекты ограничения метионина на активность 11β-HSD1 и липогенный / липолитический баланс в жировой ткани крысы F344.J Lipid Res. 2008; 49: 12–23. [PubMed] [Google Scholar] 24. Perrone CE, Mattocks DA, Plummer JD и др. Геномные и метаболические реакции на диеты с ограничением по метионину и с ограничением по метионину, с добавлением цистеина в паховой жировой ткани, печени и четырехглавой мышце крыс Fischer 344. J Nutrigenet Nutrigenomics. 2012; 5: 132–157. [PubMed] [Google Scholar] 25. Park S, Park NY, Valacchi G, Lim Y. Ограничение калорий с помощью диеты с высоким содержанием жиров эффективно ослабляло воспалительную реакцию и маркеры, связанные с окислительным стрессом, в тучных тканях крыс, получавших высокую диету.Медиаторы Inflamm. 2012; 2012: 984643. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28. Plaisance EP, Henagan TM, Echlin H, et al. Роль β-адренорецепторов в гиперфагических и гиперметаболических ответах на ограничение метионина с пищей.
Perrone CE, Mattocks DA, Hristopoulos G, Plummer JD, Krajcik RA, Orentreich N. Эффекты ограничения метионина на активность 11β-HSD1 и липогенный / липолитический баланс в жировой ткани крысы F344.J Lipid Res. 2008; 49: 12–23. [PubMed] [Google Scholar] 24. Perrone CE, Mattocks DA, Plummer JD и др. Геномные и метаболические реакции на диеты с ограничением по метионину и с ограничением по метионину, с добавлением цистеина в паховой жировой ткани, печени и четырехглавой мышце крыс Fischer 344. J Nutrigenet Nutrigenomics. 2012; 5: 132–157. [PubMed] [Google Scholar] 25. Park S, Park NY, Valacchi G, Lim Y. Ограничение калорий с помощью диеты с высоким содержанием жиров эффективно ослабляло воспалительную реакцию и маркеры, связанные с окислительным стрессом, в тучных тканях крыс, получавших высокую диету.Медиаторы Inflamm. 2012; 2012: 984643. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28. Plaisance EP, Henagan TM, Echlin H, et al. Роль β-адренорецепторов в гиперфагических и гиперметаболических ответах на ограничение метионина с пищей. Am J Physiol Regul Integr Comp Physiol. 2010; 299: R740 – R750. [Бесплатная статья PMC] [PubMed] [Google Scholar] 29. Энтони Т.Г., Моррисон CD, Gettys TW. Ремоделирование липидного обмена за счет диетического ограничения незаменимых аминокислот. Сахарный диабет. 2013; 62: 2635–2644. [Бесплатная статья PMC] [PubMed] [Google Scholar] 30.Клейбер М. Огонь жизни. Введение в энергетику животных. John Wiley & Sons, Inc.; Нью-Йорк, Нью-Йорк: 1961. [Google Scholar] 31. Броуди С. Биоэнергетика и рост. Рейнхольд; Нью-Йорк, Нью-Йорк: 1945. [Google Scholar] 32. Дворецкий А.А., Козак Л.П. Постоянно возникающая проблема с анализом расхода энергии в генетических моделях, выражающих фенотипы худого и ожирения. Сахарный диабет. 2010. 59: 323–329. [Бесплатная статья PMC] [PubMed] [Google Scholar] 33. Арка-младший, Хислоп Д., Ван С.Дж., Спикман-младший. Некоторые математические и технические вопросы измерения и интерпретации косвенной калориметрии открытого цикла у мелких животных.Инт Дж. Обес (Лондон), 2006; 30: 1322–1331.
Am J Physiol Regul Integr Comp Physiol. 2010; 299: R740 – R750. [Бесплатная статья PMC] [PubMed] [Google Scholar] 29. Энтони Т.Г., Моррисон CD, Gettys TW. Ремоделирование липидного обмена за счет диетического ограничения незаменимых аминокислот. Сахарный диабет. 2013; 62: 2635–2644. [Бесплатная статья PMC] [PubMed] [Google Scholar] 30.Клейбер М. Огонь жизни. Введение в энергетику животных. John Wiley & Sons, Inc.; Нью-Йорк, Нью-Йорк: 1961. [Google Scholar] 31. Броуди С. Биоэнергетика и рост. Рейнхольд; Нью-Йорк, Нью-Йорк: 1945. [Google Scholar] 32. Дворецкий А.А., Козак Л.П. Постоянно возникающая проблема с анализом расхода энергии в генетических моделях, выражающих фенотипы худого и ожирения. Сахарный диабет. 2010. 59: 323–329. [Бесплатная статья PMC] [PubMed] [Google Scholar] 33. Арка-младший, Хислоп Д., Ван С.Дж., Спикман-младший. Некоторые математические и технические вопросы измерения и интерпретации косвенной калориметрии открытого цикла у мелких животных.Инт Дж. Обес (Лондон), 2006; 30: 1322–1331.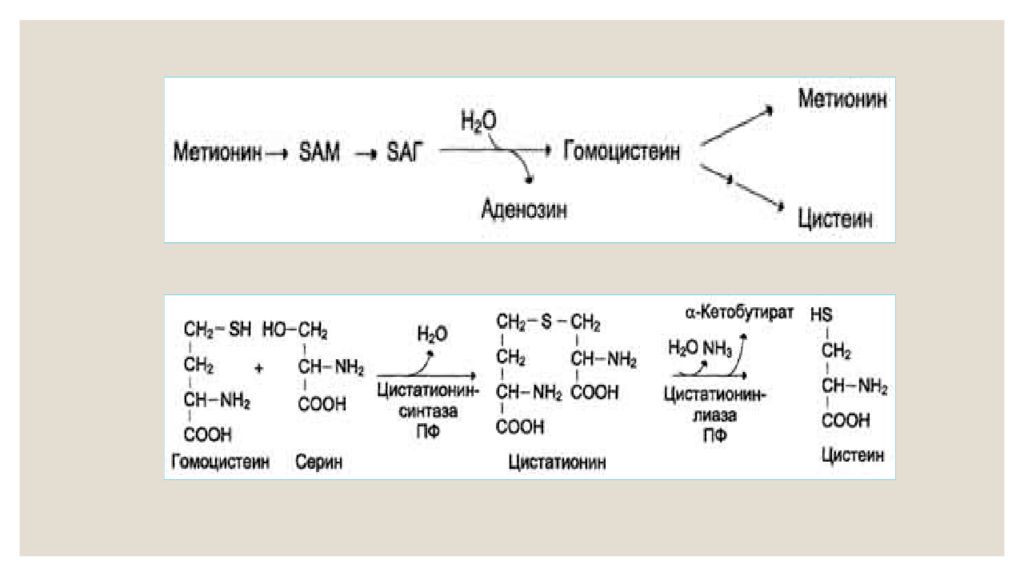 [PubMed] [Google Scholar] 35. Кайяла К.Дж., Шварц М.В. К более полному (и менее спорному) пониманию расхода энергии и его роли в патогенезе ожирения. Сахарный диабет. 2011; 60: 17–23. [Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Кайяла К.Дж., Мортон Г.Дж., Леру Б.Г., Огимото К., Висс Б., Шварц М.В. Идентификация жировой массы тела как основного фактора, определяющего скорость метаболизма у мышей. Сахарный диабет. 2010; 59: 1657–1666. [Бесплатная статья PMC] [PubMed] [Google Scholar] 37.Даже ПК, Надкарни Н.А. Косвенная калориметрия у лабораторных мышей и крыс: принципы, практические соображения, интерпретация и перспективы. Am J Physiol Regul Integr Comp Physiol. 2012; 303: R459 – R476. [PubMed] [Google Scholar] 38. Bogardus C, Lillioja S, Ravussin E, et al. Семейная зависимость скорости обмена веществ в состоянии покоя. N Engl J Med. 1986; 315: 96–100. [PubMed] [Google Scholar] 39. Ravussin E, Lillioja S, Anderson TE, Christin L, Bogardus C. Детерминанты 24-часового расхода энергии у человека.
[PubMed] [Google Scholar] 35. Кайяла К.Дж., Шварц М.В. К более полному (и менее спорному) пониманию расхода энергии и его роли в патогенезе ожирения. Сахарный диабет. 2011; 60: 17–23. [Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Кайяла К.Дж., Мортон Г.Дж., Леру Б.Г., Огимото К., Висс Б., Шварц М.В. Идентификация жировой массы тела как основного фактора, определяющего скорость метаболизма у мышей. Сахарный диабет. 2010; 59: 1657–1666. [Бесплатная статья PMC] [PubMed] [Google Scholar] 37.Даже ПК, Надкарни Н.А. Косвенная калориметрия у лабораторных мышей и крыс: принципы, практические соображения, интерпретация и перспективы. Am J Physiol Regul Integr Comp Physiol. 2012; 303: R459 – R476. [PubMed] [Google Scholar] 38. Bogardus C, Lillioja S, Ravussin E, et al. Семейная зависимость скорости обмена веществ в состоянии покоя. N Engl J Med. 1986; 315: 96–100. [PubMed] [Google Scholar] 39. Ravussin E, Lillioja S, Anderson TE, Christin L, Bogardus C. Детерминанты 24-часового расхода энергии у человека. Методы и результаты с использованием респираторной камеры.J Clin Invest. 1986; 78: 1568–1578. [Бесплатная статья PMC] [PubMed] [Google Scholar] 40. Редман Л.М., Хайльбронн Л.К., Мартин К.К. и др. Метаболические и поведенческие компенсации в ответ на ограничение калорийности: значение для поддержания потери веса. PLoS One. 2009; 4: e4377. [Бесплатная статья PMC] [PubMed] [Google Scholar] 41. Munzberg H, Henagan TM, Gettys TW. Модели ожирения на животных: проблемы перевода технических достижений в механистические идеи. В: Брей Г.А., Бушар С., редакторы. Справочник ожирения.3-е изд. Informa Books, Inc .; Лондон: 2013. [Google Scholar] 42. Ферраннини Э. Теоретические основы непрямой калориметрии: обзор. Обмен веществ. 1988; 37: 287–301. [PubMed] [Google Scholar] 43. Элиа М., Ливси Г. Теория и достоверность косвенной калориметрии во время чистого синтеза липидов. Am J Clin Nutr. 1988; 47: 591–607. [PubMed] [Google Scholar] 44. Саймонсон Д.К., ДеФронцо Р.А. Косвенная калориметрия: методологические и интерпретационные проблемы.
Методы и результаты с использованием респираторной камеры.J Clin Invest. 1986; 78: 1568–1578. [Бесплатная статья PMC] [PubMed] [Google Scholar] 40. Редман Л.М., Хайльбронн Л.К., Мартин К.К. и др. Метаболические и поведенческие компенсации в ответ на ограничение калорийности: значение для поддержания потери веса. PLoS One. 2009; 4: e4377. [Бесплатная статья PMC] [PubMed] [Google Scholar] 41. Munzberg H, Henagan TM, Gettys TW. Модели ожирения на животных: проблемы перевода технических достижений в механистические идеи. В: Брей Г.А., Бушар С., редакторы. Справочник ожирения.3-е изд. Informa Books, Inc .; Лондон: 2013. [Google Scholar] 42. Ферраннини Э. Теоретические основы непрямой калориметрии: обзор. Обмен веществ. 1988; 37: 287–301. [PubMed] [Google Scholar] 43. Элиа М., Ливси Г. Теория и достоверность косвенной калориметрии во время чистого синтеза липидов. Am J Clin Nutr. 1988; 47: 591–607. [PubMed] [Google Scholar] 44. Саймонсон Д.К., ДеФронцо Р.А. Косвенная калориметрия: методологические и интерпретационные проблемы. Am J Physiol. 1990; 258: E399 – E412. [PubMed] [Google Scholar] 45.Kelley DE, Mandarino LJ. Выбор топлива в скелетных мышцах человека при инсулинорезистентности: новое исследование. Сахарный диабет. 2000; 49: 677–683. [PubMed] [Google Scholar] 46. Галгани Дж. Э., Хейльбронн Л. К., Адзума К. и др. У людей с диабетом 2 типа метаболическая гибкость в ответ на глюкозу не нарушается после контроля скорости утилизации глюкозы. Сахарный диабет. 2008; 57: 841–845. [Бесплатная статья PMC] [PubMed] [Google Scholar] 47. Галгани Дж. Э., Моро С., Равуссин Э. Метаболическая гибкость и инсулинорезистентность. Am J Physiol Endocrinol Metab.2008; 295: E1009 – E1017. [Бесплатная статья PMC] [PubMed] [Google Scholar] 48. Ables GP, Perrone CE, Orentreich D, Orentreich N. Ограниченные метионином мыши C57BL / 6J устойчивы к ожирению, вызванному диетой, и инсулинорезистентности, но имеют низкую плотность костей. PLoS One. 2012; 7: e51357. [Бесплатная статья PMC] [PubMed] [Google Scholar] 49. Холланд В.Л., Адамс А.
Am J Physiol. 1990; 258: E399 – E412. [PubMed] [Google Scholar] 45.Kelley DE, Mandarino LJ. Выбор топлива в скелетных мышцах человека при инсулинорезистентности: новое исследование. Сахарный диабет. 2000; 49: 677–683. [PubMed] [Google Scholar] 46. Галгани Дж. Э., Хейльбронн Л. К., Адзума К. и др. У людей с диабетом 2 типа метаболическая гибкость в ответ на глюкозу не нарушается после контроля скорости утилизации глюкозы. Сахарный диабет. 2008; 57: 841–845. [Бесплатная статья PMC] [PubMed] [Google Scholar] 47. Галгани Дж. Э., Моро С., Равуссин Э. Метаболическая гибкость и инсулинорезистентность. Am J Physiol Endocrinol Metab.2008; 295: E1009 – E1017. [Бесплатная статья PMC] [PubMed] [Google Scholar] 48. Ables GP, Perrone CE, Orentreich D, Orentreich N. Ограниченные метионином мыши C57BL / 6J устойчивы к ожирению, вызванному диетой, и инсулинорезистентности, но имеют низкую плотность костей. PLoS One. 2012; 7: e51357. [Бесплатная статья PMC] [PubMed] [Google Scholar] 49. Холланд В.Л., Адамс А. С., Брозиник Дж. Т. и др. Ось FGF21-адипонектин-церамид контролирует расход энергии и действие инсулина у мышей. Cell Metab. 2013; 17: 790–797. [Бесплатная статья PMC] [PubMed] [Google Scholar] 50.Линь З., Тиан Х., Лам К.С. и др. Адипонектин опосредует метаболические эффекты FGF21 на гомеостаз глюкозы и чувствительность к инсулину у мышей. Cell Metab. 2013; 17: 779–789. [PubMed] [Google Scholar] 51. Veniant MM, Hale C, Helmering J и др. FGF21 способствует метаболическому гомеостазу через белый жир и лептин у мышей. PLoS One. 2012; 7: e40164. [Бесплатная статья PMC] [PubMed] [Google Scholar] 52. Berglund ED, Li CY, Bina HA и др. Фактор роста фибробластов 21 контролирует гликемию посредством регуляции потока глюкозы в печени и чувствительности к инсулину.Эндокринология. 2009; 150: 4084–4093. [Бесплатная статья PMC] [PubMed] [Google Scholar] 53. Фишер Ф.М., Кляйнер С., Дурис Н. и др. FGF21 регулирует PGC-1альфа и потемнение белых жировых тканей в адаптивном термогенезе. Genes Dev. 2012; 26: 271–281.
С., Брозиник Дж. Т. и др. Ось FGF21-адипонектин-церамид контролирует расход энергии и действие инсулина у мышей. Cell Metab. 2013; 17: 790–797. [Бесплатная статья PMC] [PubMed] [Google Scholar] 50.Линь З., Тиан Х., Лам К.С. и др. Адипонектин опосредует метаболические эффекты FGF21 на гомеостаз глюкозы и чувствительность к инсулину у мышей. Cell Metab. 2013; 17: 779–789. [PubMed] [Google Scholar] 51. Veniant MM, Hale C, Helmering J и др. FGF21 способствует метаболическому гомеостазу через белый жир и лептин у мышей. PLoS One. 2012; 7: e40164. [Бесплатная статья PMC] [PubMed] [Google Scholar] 52. Berglund ED, Li CY, Bina HA и др. Фактор роста фибробластов 21 контролирует гликемию посредством регуляции потока глюкозы в печени и чувствительности к инсулину.Эндокринология. 2009; 150: 4084–4093. [Бесплатная статья PMC] [PubMed] [Google Scholar] 53. Фишер Ф.М., Кляйнер С., Дурис Н. и др. FGF21 регулирует PGC-1альфа и потемнение белых жировых тканей в адаптивном термогенезе. Genes Dev. 2012; 26: 271–281.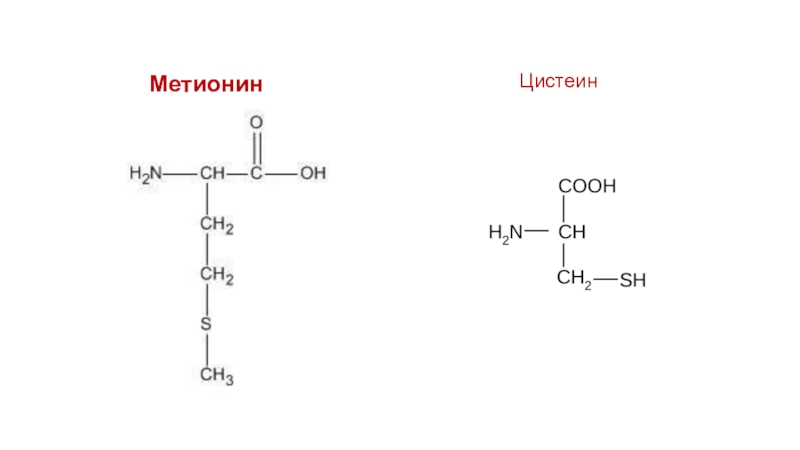 [Бесплатная статья PMC] [PubMed] [Google Scholar] 54. Сурвит Р.С., Кун С.М., Кокрейн К., МакКуббин Дж. А., Фейнглос М.Н. Диета-индуцированный диабет II типа у мышей C57BL / 6J. Сахарный диабет. 1988. 37: 1163–1167. [PubMed] [Google Scholar] 55. Пак С.Ю., Чо Ю.Р., Ким Х.Дж. и др. Выявление временного характера индуцированной диетой резистентности к инсулину в отдельных органах и сердечной дисфункции у мышей C57BL / 6.Сахарный диабет. 2005; 54: 3530–3540. [PubMed] [Google Scholar] 56. Сторлиен Л.Х., Джеймс Д.Э., Берли К.М., Чизхолм Диджей, Креген Е.В. Жирное кормление вызывает широко распространенную инсулинорезистентность in vivo, снижение расхода энергии и ожирение у крыс. Am J Physiol. 1986; 251: E576 – E583. [PubMed] [Google Scholar] 57. Нешен С., Морино К., Хаммонд Л. Е. и др. Профилактика стеатоза печени и инсулинорезистентности печени у мышей с нокаутом митохондрий ацил-КоА: глицерин-sn-3-фосфатацилтрансфераза 1. Cell Metab. 2005; 2: 55–65.[PubMed] [Google Scholar] 58. Самуэль В.Т.
[Бесплатная статья PMC] [PubMed] [Google Scholar] 54. Сурвит Р.С., Кун С.М., Кокрейн К., МакКуббин Дж. А., Фейнглос М.Н. Диета-индуцированный диабет II типа у мышей C57BL / 6J. Сахарный диабет. 1988. 37: 1163–1167. [PubMed] [Google Scholar] 55. Пак С.Ю., Чо Ю.Р., Ким Х.Дж. и др. Выявление временного характера индуцированной диетой резистентности к инсулину в отдельных органах и сердечной дисфункции у мышей C57BL / 6.Сахарный диабет. 2005; 54: 3530–3540. [PubMed] [Google Scholar] 56. Сторлиен Л.Х., Джеймс Д.Э., Берли К.М., Чизхолм Диджей, Креген Е.В. Жирное кормление вызывает широко распространенную инсулинорезистентность in vivo, снижение расхода энергии и ожирение у крыс. Am J Physiol. 1986; 251: E576 – E583. [PubMed] [Google Scholar] 57. Нешен С., Морино К., Хаммонд Л. Е. и др. Профилактика стеатоза печени и инсулинорезистентности печени у мышей с нокаутом митохондрий ацил-КоА: глицерин-sn-3-фосфатацилтрансфераза 1. Cell Metab. 2005; 2: 55–65.[PubMed] [Google Scholar] 58. Самуэль В.Т. , Лю ZX, Ку X и др. Механизм инсулинорезистентности печени при неалкогольной жировой болезни печени. J Biol Chem. 2004; 279: 32345–32353. [PubMed] [Google Scholar] 59. Эльшорбаджи А.К., Вальдивия-Гарсия М., Мэттокс Д.А. и др. Добавление цистеина отменяет эффекты ограничения метионина на ожирение крыс: значение стеароил-кофермента А-десатуразы. J Lipid Res. 2011; 52: 104–112. [Бесплатная статья PMC] [PubMed] [Google Scholar] 60. Hasek BE, Boudreau A, Shin J, et al.Ремоделирование интеграции липидного обмена между печенью и жировой тканью путем ограничения диетического метионина у крыс. Сахарный диабет. 2013; 62: 3362–3372. [Бесплатная статья PMC] [PubMed] [Google Scholar] 61. Postic C, Girard J. Вклад синтеза жирных кислот de novo в стеатоз печени и инсулинорезистентность: уроки генетически модифицированных мышей. J Clin Invest. 2008. 118: 829–838. [Бесплатная статья PMC] [PubMed] [Google Scholar] 62. Perrone CE, Mattocks DA, Jarvis-Morar M, Plummer JD, Orentreich N.Эффекты ограничения метионина на биогенез митохондрий и аэробную способность в белой жировой ткани, печени и скелетных мышцах крыс F344.
, Лю ZX, Ку X и др. Механизм инсулинорезистентности печени при неалкогольной жировой болезни печени. J Biol Chem. 2004; 279: 32345–32353. [PubMed] [Google Scholar] 59. Эльшорбаджи А.К., Вальдивия-Гарсия М., Мэттокс Д.А. и др. Добавление цистеина отменяет эффекты ограничения метионина на ожирение крыс: значение стеароил-кофермента А-десатуразы. J Lipid Res. 2011; 52: 104–112. [Бесплатная статья PMC] [PubMed] [Google Scholar] 60. Hasek BE, Boudreau A, Shin J, et al.Ремоделирование интеграции липидного обмена между печенью и жировой тканью путем ограничения диетического метионина у крыс. Сахарный диабет. 2013; 62: 3362–3372. [Бесплатная статья PMC] [PubMed] [Google Scholar] 61. Postic C, Girard J. Вклад синтеза жирных кислот de novo в стеатоз печени и инсулинорезистентность: уроки генетически модифицированных мышей. J Clin Invest. 2008. 118: 829–838. [Бесплатная статья PMC] [PubMed] [Google Scholar] 62. Perrone CE, Mattocks DA, Jarvis-Morar M, Plummer JD, Orentreich N.Эффекты ограничения метионина на биогенез митохондрий и аэробную способность в белой жировой ткани, печени и скелетных мышцах крыс F344. Обмен веществ. 2009. 59: 1000–1011. [PubMed] [Google Scholar] 63. Jequier E, Felber JP. Косвенная калориметрия. Baillieres Clin Endocrinol Metab. 1987; 1: 911–935. [PubMed] [Google Scholar] 64. Ливси Дж., Элиа М. Оценка расхода энергии, чистого использования углеводов и чистого окисления и синтеза жиров с помощью косвенной калориметрии: оценка ошибок с особым упором на подробный состав топлива.Am J Clin Nutr. 1988. 47: 608–628. [PubMed] [Google Scholar] 65. Inokuma K, Ogura-Okamatsu Y, Toda C, Kimura K, Yamashita H, Saito M. Разъединение белка 1 необходимо для индуцированного норэпинефрином использования глюкозы в коричневой жировой ткани. Сахарный диабет. 2005; 54: 1385–1391. [PubMed] [Google Scholar] 66. Ю. ХХ, Левин Д.А., Форрест В., Адамс Ш. Холод вызывает одновременную индукцию синтеза жирных кислот и бета-окисления в коричневой жировой ткани мыши: прогноз на основе дифференциальной экспрессии генов и подтверждение in vivo.FASEB J. 2002; 16: 155–168. [PubMed] [Google Scholar] 67. Бартельт А.
Обмен веществ. 2009. 59: 1000–1011. [PubMed] [Google Scholar] 63. Jequier E, Felber JP. Косвенная калориметрия. Baillieres Clin Endocrinol Metab. 1987; 1: 911–935. [PubMed] [Google Scholar] 64. Ливси Дж., Элиа М. Оценка расхода энергии, чистого использования углеводов и чистого окисления и синтеза жиров с помощью косвенной калориметрии: оценка ошибок с особым упором на подробный состав топлива.Am J Clin Nutr. 1988. 47: 608–628. [PubMed] [Google Scholar] 65. Inokuma K, Ogura-Okamatsu Y, Toda C, Kimura K, Yamashita H, Saito M. Разъединение белка 1 необходимо для индуцированного норэпинефрином использования глюкозы в коричневой жировой ткани. Сахарный диабет. 2005; 54: 1385–1391. [PubMed] [Google Scholar] 66. Ю. ХХ, Левин Д.А., Форрест В., Адамс Ш. Холод вызывает одновременную индукцию синтеза жирных кислот и бета-окисления в коричневой жировой ткани мыши: прогноз на основе дифференциальной экспрессии генов и подтверждение in vivo.FASEB J. 2002; 16: 155–168. [PubMed] [Google Scholar] 67. Бартельт А. , Брунс О.Т., Реймер Р. и др. Активность коричневой жировой ткани контролирует клиренс триглицеридов. Nat Med. 2011; 17: 200–205. [PubMed] [Google Scholar] 68. Укропек Дж., Анунсиадо Р.П., Равуссин Ю., Халвер М.В., Козак Л.П. UCP1-независимый термогенез в белой жировой ткани акклиматизированных к холоду мышей Ucp1 — / -. J Biol Chem. 2006; 281: 31894–31908. [PubMed] [Google Scholar] 69. Трейхурн П. Выбор топлива в коричневой жировой ткани. Proc Nutr Soc. 1995; 54: 39–47.[PubMed] [Google Scholar] 70. Масоро Э. Роль липогенеза в неподвижном термогенезе. Fed Proc. 1963; 22: 868–873. [PubMed] [Google Scholar] 71. Чжан Ю., Проенка Р., Маффей М., Бароне М., Леопольд Л., Фридман Дж. М.. Позиционное клонирование гена ожирения мыши и его человеческого гомолога. Природа. 1994; 372: 425–432. [PubMed] [Google Scholar] 72. Геттис Т.В., Рамкумар В., Ухинг Р.Дж., Сегер Л., Тейлор Иллинойс. Изменения уровней мРНК, экспрессии и функции GTP-связывающих регуляторных белков в адипоцитах мышей с ожирением (C57BL / 6J-ob / ob) J Biol Chem.
, Брунс О.Т., Реймер Р. и др. Активность коричневой жировой ткани контролирует клиренс триглицеридов. Nat Med. 2011; 17: 200–205. [PubMed] [Google Scholar] 68. Укропек Дж., Анунсиадо Р.П., Равуссин Ю., Халвер М.В., Козак Л.П. UCP1-независимый термогенез в белой жировой ткани акклиматизированных к холоду мышей Ucp1 — / -. J Biol Chem. 2006; 281: 31894–31908. [PubMed] [Google Scholar] 69. Трейхурн П. Выбор топлива в коричневой жировой ткани. Proc Nutr Soc. 1995; 54: 39–47.[PubMed] [Google Scholar] 70. Масоро Э. Роль липогенеза в неподвижном термогенезе. Fed Proc. 1963; 22: 868–873. [PubMed] [Google Scholar] 71. Чжан Ю., Проенка Р., Маффей М., Бароне М., Леопольд Л., Фридман Дж. М.. Позиционное клонирование гена ожирения мыши и его человеческого гомолога. Природа. 1994; 372: 425–432. [PubMed] [Google Scholar] 72. Геттис Т.В., Рамкумар В., Ухинг Р.Дж., Сегер Л., Тейлор Иллинойс. Изменения уровней мРНК, экспрессии и функции GTP-связывающих регуляторных белков в адипоцитах мышей с ожирением (C57BL / 6J-ob / ob) J Biol Chem. 1991; 266: 15949–15955. [PubMed] [Google Scholar] 73. Коллинз С., Дэниел К.В., Рольфс Э.М., Рамкумар В., Тейлор И.Л., Gettys TW. Нарушение экспрессии и функциональной активности адренорецепторов β-3 и β-1 в жировой ткани мышей с врожденным ожирением (C57BLJ6-ob / ob). Мол Эндокринол. 1994; 8: 518–527. [PubMed] [Google Scholar] 74. Деваль С., Шаверу С., Маурин А.С. и др. Ограничение аминокислот регулирует экспрессию генов, участвующих в нескольких конкретных биологических процессах, посредством GCN2-зависимых и GCN2-независимых путей.FEBS J. 2009; 276: 707–718. [PubMed] [Google Scholar] 75. Палий С.С., Кейс С.Э., Деваль С., Брюа А., Фафурну П., Килберг М.С. Специфичность экспрессии генов, регулируемых аминокислотами: анализ генов, подвергнутых полному или единственному аминокислотному лишению. Аминокислоты. 2009; 37: 79–88. [Бесплатная статья PMC] [PubMed] [Google Scholar] 76. Шан Дж, Орд Д, Орд Т, Килберг М.С. Повышенная экспрессия ATF4 в отсутствие других сигналов является достаточной для индукции транскрипции посредством элементов ответа фактора транскрипции, активирующего энхансер CCAAT, связывающего белок.
1991; 266: 15949–15955. [PubMed] [Google Scholar] 73. Коллинз С., Дэниел К.В., Рольфс Э.М., Рамкумар В., Тейлор И.Л., Gettys TW. Нарушение экспрессии и функциональной активности адренорецепторов β-3 и β-1 в жировой ткани мышей с врожденным ожирением (C57BLJ6-ob / ob). Мол Эндокринол. 1994; 8: 518–527. [PubMed] [Google Scholar] 74. Деваль С., Шаверу С., Маурин А.С. и др. Ограничение аминокислот регулирует экспрессию генов, участвующих в нескольких конкретных биологических процессах, посредством GCN2-зависимых и GCN2-независимых путей.FEBS J. 2009; 276: 707–718. [PubMed] [Google Scholar] 75. Палий С.С., Кейс С.Э., Деваль С., Брюа А., Фафурну П., Килберг М.С. Специфичность экспрессии генов, регулируемых аминокислотами: анализ генов, подвергнутых полному или единственному аминокислотному лишению. Аминокислоты. 2009; 37: 79–88. [Бесплатная статья PMC] [PubMed] [Google Scholar] 76. Шан Дж, Орд Д, Орд Т, Килберг М.С. Повышенная экспрессия ATF4 в отсутствие других сигналов является достаточной для индукции транскрипции посредством элементов ответа фактора транскрипции, активирующего энхансер CCAAT, связывающего белок. J Biol Chem. 2009; 284: 21241–21248. [Бесплатная статья PMC] [PubMed] [Google Scholar] 77. Дудек С.М., Семенкович В.Ф. Незаменимые аминокислоты регулируют экспрессию синтазы жирных кислот посредством незаряженного механизма передачи РНК. J Biol Chem. 1995; 270: 29323–29329. [PubMed] [Google Scholar] 78. Plaisance EP, Greenway FL, Boudreau A и др. Ограничение диетического метионина увеличивает окисление жиров у взрослых с ожирением и метаболическим синдромом. J Clin Endocrinol Metab. 2011; 96: E836 – E840. [Бесплатная статья PMC] [PubMed] [Google Scholar] 79.Броснан Дж. Т., Броснан МЭ. Серосодержащие аминокислоты: обзор. J Nutr. 2006; 136: 1636S – 1640S. [PubMed] [Google Scholar]
J Biol Chem. 2009; 284: 21241–21248. [Бесплатная статья PMC] [PubMed] [Google Scholar] 77. Дудек С.М., Семенкович В.Ф. Незаменимые аминокислоты регулируют экспрессию синтазы жирных кислот посредством незаряженного механизма передачи РНК. J Biol Chem. 1995; 270: 29323–29329. [PubMed] [Google Scholar] 78. Plaisance EP, Greenway FL, Boudreau A и др. Ограничение диетического метионина увеличивает окисление жиров у взрослых с ожирением и метаболическим синдромом. J Clin Endocrinol Metab. 2011; 96: E836 – E840. [Бесплатная статья PMC] [PubMed] [Google Scholar] 79.Броснан Дж. Т., Броснан МЭ. Серосодержащие аминокислоты: обзор. J Nutr. 2006; 136: 1636S – 1640S. [PubMed] [Google Scholar]Есть ли преимущества от приема и ограничения метионина?
Ограничение метионина было известно в течение десятилетий в исследованиях долголетия, хотя исследователи не нашли никаких однозначных ответов. Некоторые говорят, что меньшее количество метионина не обязательно лучше, а иногда может быть хуже.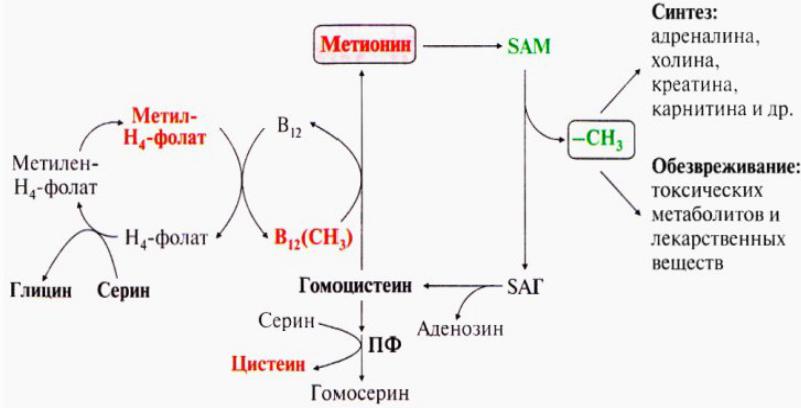 Они в чем-то правы? Давайте взглянем на новейшие исследования, чтобы устранить некоторую путаницу.
Они в чем-то правы? Давайте взглянем на новейшие исследования, чтобы устранить некоторую путаницу.
Путаница
Некоторые люди предполагают, что метионин — это то, что необходимо уменьшить в рационе, чтобы быть оптимально здоровым.
Но, как и почти все остальное в биологии, метионин ни хорош, ни плох. Мы знаем, что это незаменимая аминокислота — для хорошего здоровья нам необходимо получать ее определенное количество с пищей.
С другой стороны, люди сталкиваются с некоторыми страшными опасностями, связанными с этой аминокислотой, ища в Интернете.От повреждения мозга до риска сердечно-сосудистых заболеваний метионин, кажется, не совсем полезен.
Начнем с того, что метионин считается безопасным в количествах, которые люди принимают с пищей. Это также безопасно при правильном использовании в лечебных количествах. Серьезные опасности возникают только при использовании очень высоких доз (перорально или внутривенно) [1, 2].
Этот пост призван прояснить влияние метионина на здоровье и выяснить, есть ли какие-либо преимущества для более высоких или более низких уровней.
Ограничение науки
Исследования на животных показали, что ограничение потребления метионина может увеличить продолжительность жизни, но это никогда не было подтверждено на людях [3].
Исследование 2005 года показало, что ограничение метионина без ограничения калорий увеличивает продолжительность жизни мышей [4].
Несколько исследований показали, что ограничение метионина также подавляет некоторые связанные со старением болезненные процессы у мышей. Но никакие надлежащие исследования на людях не изучали влияние метионина на связанные со старением пути и болезни у людей [5, 6, 7].
У крыс диетический метионин увеличивает выработку митохондриальных АФК и окислительное повреждение ДНК печени. Исследователи подозревают, что это правдоподобный механизм его чрезмерной токсичности для печени, но человеческих данных для подтверждения этого недостаточно [8].
Есть несколько генов, которые могут влиять на количество диетического метионина, но их влияние на уровень метионина у людей мало изучено.
Ген MTR, кодирующий фермент MTR, который превращает гомоцистеин в метионин (см. Соответствующие SNP). Ген MTHFR косвенно влияет на превращение гомоцистеина в метионин, продуцируя активную форму фолиевой кислоты [9].
Людям с плохо функционирующим геном обычно требуется больше фолиевой кислоты.Недостаток фолиевой кислоты может повысить уровень гомоцистеина и снизить уровень метионина [10].
Синдром Линча — это тип наследственного онкологического синдрома, связанный с генетической предрасположенностью к различным типам рака. У людей с синдромом Линча низкое потребление метионина было связано с повышенным риском колоректальной опухоли у лиц с MTHFR 677 (AA) по сравнению с людьми с низким потреблением и нормальным генотипом [11].
Однако ни одно исследование не повторило эти результаты. Мы также не знаем, как они относятся к людям без синдрома Линча.Наконец, это исследование выявило только потенциальные ассоциации. Он не дает информации о причинах [11].
Мы также не знаем, как они относятся к людям без синдрома Линча.Наконец, это исследование выявило только потенциальные ассоциации. Он не дает информации о причинах [11].
Незаменимая аминокислота
Поскольку метионин является незаменимой аминокислотой, его нельзя полностью удалить из рациона животных без болезни или смерти со временем. Например, у крыс, получавших диету без метионина, развились ожирение печени, анемия и они потеряли две трети своего веса за 5 недель [12, 13].
Метионин — только одна из двух аминокислот, которые обеспечивают организм серой, которая используется для создания белков и сульфатирования некоторых соединений [14].
Требуется всасываниеРекомендуемая суточная норма метионина (в сочетании с цистеином) для взрослых составляет 14 мг / кг массы тела.
Следовательно, человеку весом 70 кг, независимо от возраста и пола, требуется около 1,1 г метионина / цистеина в день [15].
диетического метионина может быть достаточно, чтобы обеспечить организм всей необходимой серой (кроме тиамина и биотина).Однако необходимы дополнительные исследования, чтобы понять, сколько всего нужно нашему организму [15].
Ученые отмечают, что минимальные требования (RDA) для всех незаменимых аминокислот, возможно, придется пересмотреть. Рекомендуемая суточная норма потребления рассчитывается на основе количества аминокислот, необходимых для поддержания баланса азота, который необходим организму для создания белков. Но этот метод не учитывает баланс серы [15].
Рекомендации ВОЗ по потреблению метионина / цистеина в дозе 13 мг / кг массы тела находятся в том же диапазоне, что и рекомендации RDA.
Однако существует консенсус, что при заболеваниях и после травм эти значения могут быть в 2 или 3 раза выше [16].
Одно исследование показало, что кормление очищенных аминокислот, содержащих различные количества метионина, пожилым людям в больнице VA требует значительно более высоких уровней метионина, чем те, которые ранее были установлены RDA. Всем им требовалось более 2,1 г / день, а некоторым испытуемым требовалось до 3,0 г / день, чтобы поддерживать положительный азотный баланс [17].
Всем им требовалось более 2,1 г / день, а некоторым испытуемым требовалось до 3,0 г / день, чтобы поддерживать положительный азотный баланс [17].
Потребление белков по сравнению с овощами
Высокий уровень метионина содержится в продуктах животного происхождения (яйцах, рыбе, мясе) и некоторых орехах и семенах; метионин также содержится в зернах.
Белки содержат от 3 до 6% серных аминокислот. Незначительное количество серы поступает в виде так называемых неорганических сульфатов и других форм органической серы , которая содержится в овощах, таких как чеснок, лук и брокколи [15].
Пара исследований показывает, что по сравнению с мясоедами и рыбоядными веганы потребляют меньше всего метионина [18, 19].
Среднее потреблениеПотребление метионина / цистеина, измеренное у 32 человек, в одном исследовании колебалось от 1,8 до 6,0 г / день (14 и 45 ммоль / день) [15].
На приведенном ниже рисунке сравнивается потребление серных аминокислот (SAA) в г / день, связанное с потреблением различных диет [20]:
| Группа | SAA (г / день) | |
| Я | с высоким содержанием белка | 6,8 |
| II | Высокопротеиновый низкокалорийный | 5.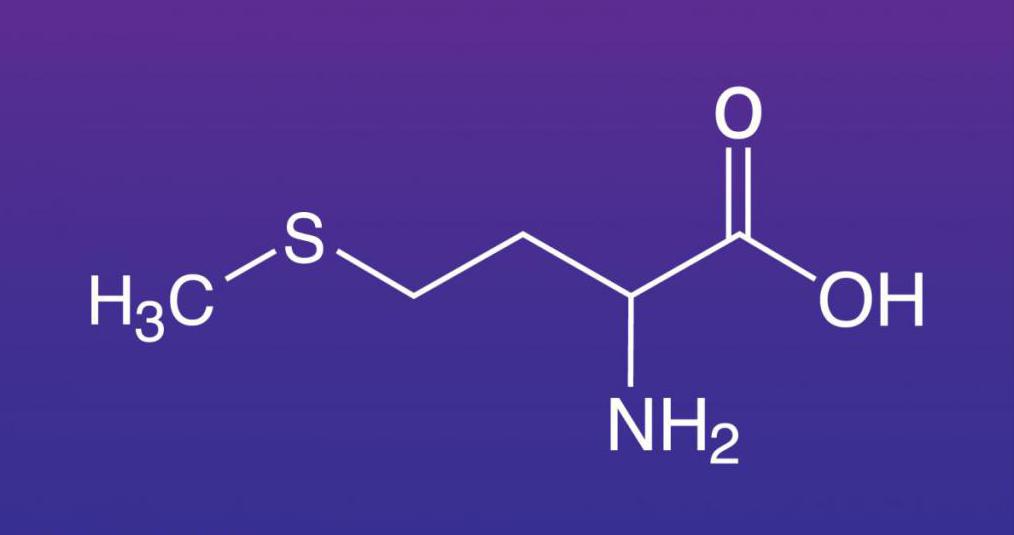 0 0 |
| III | Восточно-американский | 4,8 |
| IV | Средне сбалансированное | 4,3 |
| В | Фастфуд | 4,1 |
| VI | Дитер | 3,5 |
| VII | Лакто-ово-вегетарианские | 3,0 |
| VIII | Диета, заботящаяся о своем здоровье | 2,6 |
| IX | Веганский | 2.3 |
| X | пожилых людей (75 лет) | 1,8 |
Авторы заметили, что содержание серосодержащих аминокислот было ниже у людей, которые были более заботливыми о своем здоровье и не потребляли красного мяса и мало животного белка, а также у тех, кто придерживался «модных диет» [15].
Они также указали, что многие пожилые люди могут оказаться с полным дефицитом (определена в исследовании как группа X). Необходимы дополнительные исследования на людях [15].
А как насчет добавок?
Метионин (в форме SAM-e) и цистеин (в форме NAC) являются относительно популярными добавками. Однако в большинстве случаев нет достаточных доказательств, подтверждающих их использование.
Некоторые люди утверждают, что, поскольку метионин превращается в цистеин, добавление цистеина снижает потребность в метионине. Хотя это возможно, нет убедительных доказательств этого в исследованиях на людях [15].
Также имейте в виду, что добавки не были одобрены FDA для медицинского применения.Добавки, как правило, не имеют достоверных клинических исследований. Правила устанавливают для них производственные стандарты, но не гарантируют их безопасность или эффективность. Перед приемом добавок проконсультируйтесь с врачом.
Предполагаемая польза для здоровья от метионина
Возможно эффективно для
Отравление ацетаминофеном Сульфатирование является основным путем детоксикации фармакологических агентов печенью.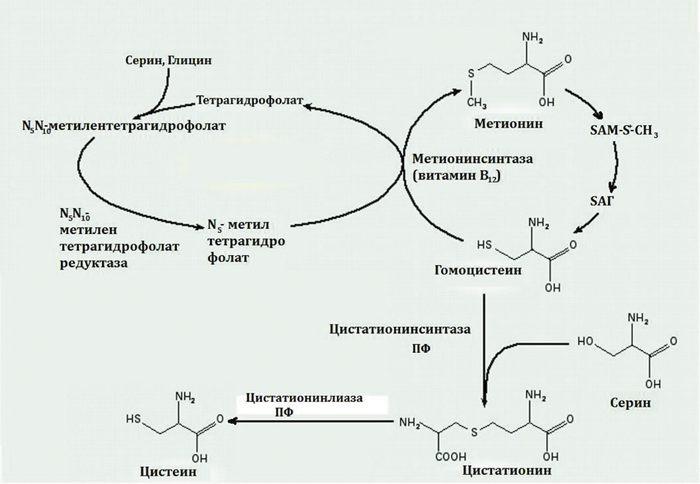
Метионин, принимаемый внутрь, по-видимому, эффективен при лечении отравления парацетамолом.
Прием 2,5 грамма каждые 4 часа четыре раза в целом был так же эффективен, как и ацетилцистеин, в предотвращении повреждения печени и смерти после передозировки ацетаминофена (тайленола). Это имело место только в том случае, если метионин вводился в течение 10 часов после приема парацетамола [21].
Тайленол требует для выведения сульфата, и его часто дают для облегчения боли. Высокие дозы сульфата, обедненного тайленолом, у лабораторных животных были исправлены метионином. Тайленол был более токсичным и медленнее выводился у животных с дефицитом сульфата [15].
Недостаточно доказательств для:
Следующие предполагаемые преимущества слабо подтверждены ограниченными низкокачественными исследованиями на людях.
Недостаточно доказательств, подтверждающих использование метионина для любого из перечисленных ниже применений.
Не забудьте поговорить с врачом перед приемом добавок метионина. Метионин никогда не следует использовать в качестве замены одобренных медицинских методов лечения.
Метионин никогда не следует использовать в качестве замены одобренных медицинских методов лечения.
Совместная опора
Сульфаты / сера имеют решающее значение для синтеза гликозаминогликанов, что важно для хрящевой ткани.Однако в не было клинических исследований, проверяющих влияние метионина на здоровье суставов [15].
Одно исследование пришло к выводу, что большая часть населения, особенно пожилые люди, могут не получать достаточно серы. Было предложено, чтобы пищевые добавки, такие как сульфат глюкозамина / хондроитина, поставляли серу, но исследования на людях не подтвердили этот механизм [22].
В сельском хозяйстве цыплятам добавляют метионин / цистеин для увеличения их роста [15].
Воспалительные состояния
Ученые подозревают, что наши потребности в серных аминокислотах, таких как метионин, повышаются при воспалительных условиях и окислительном стрессе. Они предполагают, что это может быть отчасти из-за повышенной потребности в глутатионе и экскреции серы [23].
В экспериментах на свиньях стимуляция иммунной системы приводила к увеличению использования метионина [24].
Наблюдения за экспериментальными животными показывают, что антиоксидантная защита истощается во время инфекции и после травмы.Например, у мышей, инфицированных вирусом гриппа, наблюдалось снижение содержания GSH в крови на 45% [25].
Согласно ограниченным небольшим исследованиям на людях, глутатион может снижаться в:
- Бессимптомная ВИЧ-инфекция [26]
- Плановые абдоминальные операции [27]
- Гепатит C [28]
- Язвенный колит [28]
- Рак [28]
- Цирроз [28]
- Сепсис [29]
Тем не менее, не проводилось исследований, в которых проверялось, будет ли прием метионина полезным в этих случаях .Также неизвестно, может ли диета с высоким содержанием метионина играть роль в предотвращении воспалительных состояний и других состояний, связанных с низким содержанием глутатиона. Требуются дополнительные исследования.
Требуются дополнительные исследования.
Волчанка
Согласно двум небольшим исследованиям, метионин и другие доноры метила, включая цистеин, холин и кофакторы, такие как витамин B6, были значительно ниже у пациентов с волчанкой / СКВ по сравнению со здоровыми подобранными контрольными группами [30].
Однако еще не проводились клинические испытания эффективности и безопасности добавок метионина у пациентов с волчанкой.
Уменьшение содержания метионина и холина в рационе увеличивало тяжесть волчанки у генетически предрасположенных мышей [31].
Венозный тромбоз
В одном исследовании случай-контроль с участием почти 700 человек низкие концентрации метионина натощак были связаны с риском рецидивирующего венозного тромбоза. Влияние добавок на здоровье вен неизвестно [32].
Отсутствуют доказательства (исследования на животных)
Нет клинических данных, подтверждающих использование метионина при каких-либо состояниях, перечисленных в этом разделе.
Ниже приводится краткое изложение существующих исследований на животных и клетках, которые должны направить дальнейшие исследования. Однако исследования, перечисленные ниже, не следует интерпретировать как подтверждающие какую-либо пользу для здоровья.
Увеличение глутатиона
Цистеин и метионин в организме не хранятся. Сера помогает организму вырабатывать глутатион, который считается критически важным для антиоксидантной защиты [15].
Некоторые ученые предположили, что дефицит серных аминокислот, таких как метионин, может привести к тому, что уровни глутатиона пострадают больше, чем более важные процессы, такие как синтез белка [15].
Исследования показывают, что любой избыток пищи легко окисляется до сульфата, выводится с мочой (или реабсорбируется в зависимости от уровня пищи) или сохраняется в форме глутатиона (GSH) [33].
Согласно ограниченным исследованиям, уровни глутатиона ниже при большом количестве заболеваний и при приеме некоторых лекарств. Может ли прием метионина повлиять на этот баланс, неизвестно [15].
Одна из гипотез гласит, что метионин и сера должны быть в состоянии предотвратить потери глутатиона, связанные с диетическим дефицитом и повышенным использованием из-за болезни или измененной иммунной функции.Это еще предстоит доказать [15].
У животных в условиях низкого содержания метионина снижается синтез сульфата и глутатиона. Исследователи полагают, что это может негативно повлиять на функцию иммунной системы и механизмы антиоксидантной защиты, но исследования на людях отсутствуют [15].
Кроме того, животные, находящиеся на диете с ограничением метионина / низким содержанием метионина, живут в стерильных и идеальных условиях, в отличие от людей. Результаты исследований животных нельзя передать людям.
Поседение волос
Потеря метионина связана с старческим поседением волос. Ученые предполагают, что его дефицит приводит к накоплению перекиси водорода в волосяных фолликулах и постепенной потере цвета волос. Необходимы исследования на людях [34].
Здоровье кишечника
Метионин часто содержится в одних и тех же продуктах с цистеином. Ограниченные данные свидетельствуют о том, что диетический метионин (и цистеин) может иметь важное значение для обеспечения здоровья кишечника и иммунной функции во время развития и при воспалительных состояниях.Крупные исследования на людях еще не подтвердили это, и большая часть данных основана на экспериментах на животных [35].
Например, по сравнению со здоровыми поросятами, получавшими недостаточный рацион, поросята с добавлением цистеина (0,25 г / кг) и метионина (25 г / кг) имели меньший окислительный стресс в кишечнике. Они также улучшили высоту и площадь ворсинок, глубину крипт и большее количество бокаловидных клеток [35].
Ученые считают, что в основе воздействия метионина на кишечник могут лежать следующие метаболические пути:
- Превращение в GSH, таурин и цистеин
- Снижение кишечного оксидативного стресса
- Поражает структуру кишечника, бокаловидные клетки и клетки крипт
Эти механизмы не исследовались на людях.
Иммунный ответ
Исследования показывают, что метионин может иметь важное значение для иммунной системы и метилирования [36, 23, 37, 11].
Клеточные исследования изучают его влияние на иммунную систему и увеличивает ли метионин глутатион, таурин, CD4 + и CD8 + клетки [23].
Поддержка метилирования
Метионин участвует в метилировании как предшественник SAM-e [37, 11].
На основании этого некоторые люди утверждают, что увеличение потребления метионина — хорошая идея при плохих метилаторах.Однако не совсем ясно, какие эффекты метионин оказывает на метилирование.
Клеточные исследования показывают, что метионин может вызывать определенные изменения в метилировании и экспрессии генов.
Остается определить, имеют ли высокие дозы большую тенденцию к гипер- или гипометилированию ДНК и в каких областях. До года влияние добавок метионина на здоровье человека через метилирование остается неясным.
Ученые подозревают, что метионин может быть палкой о двух концах: в одних случаях он полезен, а в других — вреден.Необходимы дальнейшие исследования, чтобы точно выяснить, на какие гены и процессы он влияет у человека [37].
Здоровье сердца
Метионин является промежуточным звеном в биосинтезе цистеина, карнитина, таурина, лецитина, фосфатидилхолина и других фосфолипидов. Ученые изучают, может ли неправильное преобразование метионина привести к атеросклерозу [38].
Фертильность
У животных ограничение метионина вызывает снижение фертильности. Это не было проверено на людях [39, 40].
Эпигенетика и стрессовые состояния
Потомство стрессированных крыс имеет эпигенетические изменения в метилировании рецептора кортизола (GR), которые могут вызывать изменения в оси HPA и отрицательно влиять на это потомство [41].
Введение метионина взрослым крысам устраняет негативные эпигенетические эффекты на метилирование ДНК, связывание белка А, индуцируемого фактором роста нервов, рецептор кортизола (GR), а также гипоталамо-гипофизарно-надпочечниковые и поведенческие реакции на стресс [41].
Эти эффекты не исследовались на людях.
Сколько метионина слишком много?Безопасность
Метионин считается безопасным в количествах, которые люди принимают с пищей [1, 2].
Это также безопасно при правильном применении в лечебных количествах [1, 2].
О серьезных опасностях сообщалось только у людей, принимающих чрезвычайно высокие дозы (перорально или внутривенно). Исследования показывают, что следует избегать доз более 100 мг / кг, чтобы предотвратить тяжелое и потенциально летальное повреждение головного мозга. [1, 2].
Аналогичным образом, метионин безопасен в тех количествах, которые содержатся в продуктах питания и при введении детям в медицинских целях. Вероятно, это небезопасно для новорожденных, получающих внутривенное питание [42].
Беременным и кормящим женщинам следует избегать приема добавок метионина. Диетический метионин считается безопасным.
Эксперименты по токсикологии
«Ударная доза» метионина (100 мг / кг) резко увеличивалась в гомоцистеине плазмы, и ее использовали в качестве показателя предрасположенности к сердечно-сосудистым заболеваниям.Ошибочно введенная в 10 раз большая доза привела к смерти [43].
Долгосрочные исследования у взрослых не выявили неблагоприятных последствий умеренных колебаний в потреблении метионина с пищей, но дозы, превышающие норму в 5 раз, приводили к повышению уровня гомоцистеина [43].
Другие долгосрочные исследования у взрослых не показали отрицательных последствий умеренных колебаний в потреблении метионина с пищей, но потребление выше нормы в 5 раз привело к повышению уровня гомоцистеина [43].
У младенцев прием метионина в 2-5 раз выше нормы приводил к нарушению роста и высоким уровням метионина, но не наблюдалось никаких неблагоприятных долгосрочных последствий [44].
Дополнительные меры предосторожностиУ животных высокие уровни метионина были способны вызывать шизофрению за счет метилирования и остановки выработки гена GABRB2, который контролирует выработку определенного компонента рецептора ГАМК. Снижение ГАМКергической функции связано с шизофренией [45].
Влияние повышенного потребления или добавок метионина на людей с шизофренией или тех, кто находится в группе риска, неизвестно.
Одно исследование показывает, что людям с высоким потреблением метионина следует уделять внимание поддержанию адекватного потребления фолиевой кислоты и витаминов B-6 и B-12 [23].
Дело против ограничения метионина?Ограничение метионина было известно в течение десятилетий в исследованиях долголетия животных [46].
Некоторые люди утверждают, что если ограничение метионина может продлить жизнь животных, то почему бы нам не попробовать это сделать? Посмотрим, что говорит наука.
Возможные ошибки в исследованиях ограничения метионина
Есть три заблуждения, с которыми следует проявлять осторожность, когда дело доходит до выводов об оптимальном уровне метионина.
- Если ограничение метионина увеличивает максимальную продолжительность жизни, то ограничение не обязательно оптимально здоровым.
- Если избыток метионина — это плохо, это не значит, что его ограничение — это хорошо.
- Если он работает на животных, увеличивая продолжительность жизни, это не значит, что он работает на людях, потому что у нас совсем другая среда и несколько иная биология.
Такое вещество, как метионин, по-видимому, имеет так называемый двухфазный ответ . Слишком мало или слишком много может вызвать проблемы. Исследования показывают, что людям может потребоваться сбалансированная сумма. Этот уровень может быть разным для всех, но крупные исследования на людях еще не определили его.
1) Исследования долголетия не равны оптимальному здоровьюПрочитав какое-то время исследования долголетия, многие люди начинают понимать, что это не так уж важно для людей.
Многие вещества способствуют долголетию клеток или червей. Это не означает, что они имеют какое-либо медицинское значение. Напротив, большинство подходов, которые исследуются на клетках или простых организмах, таких как черви, не проходят дальнейшие исследования на животных или клинические испытания из-за отсутствия безопасности или эффективности.
Проблема с ограничением метионина заключается в том, в какой степени вам придется снижать содержание метионина, поскольку это может быть потенциально полезно для долголетия животных, нецелесообразно для других целей.Мы также не можем переводить дозы от животных на человека.
Некоторые критики говорят, что ограничение метионина не сильно отличается от снижения количества свободных радикалов путем бездыхания. Они говорят, что в долгосрочной перспективе это непрактично из-за возможных побочных эффектов.
Метионин важен для иммунной системы. Ограниченные исследования показывают, что более низкое потребление метионина может в долгосрочной перспективе повысить восприимчивость к хроническим инфекциям (а это может вызвать множество проблем) [47, 3].
Животные, участвующие в исследованиях долголетия, находятся в стерильных условиях.Подопытные животные, которые дольше живут в стерильной среде, могут не испытывать того же в реальном мире.
Кроме того, определенные способы долголетия не обязательно благоприятны для всех аспектов здоровья. Снижение уровня IGF-1 может быть исследовано для увеличения продолжительности жизни, но повышение уровня может быть исследовано для других целей.
2) Метионин и гомоцистеинНекоторые говорят, что метионин вреден, потому что он повышает уровень гомоцистеина, а повышенный уровень гомоцистеина связан с отрицательными последствиями для здоровья.Это утверждение основано на неправильной интерпретации того факта, что метионин является предшественником гомоцистеина.
Однако исследования показывают, что колебания в потреблении метионина с пищей не влияют на концентрацию гомоцистеина в крови [48, 49].
Для увеличения гомоцистеина требуется высокая доза чистого метионина. По оценкам, эта доза примерно в 5 раз превышает нормальную суточную дозу метионина [50, 51, 49, 52].
Вегетарианцы, у которых было более низкое потребление метионина, на самом деле имели более высокий уровень гомоцистеина из-за более низкого уровня B12 в одном исследовании [53].
Кроме того, у мясоедов другие факторы могут уравновешивать индуцированный метионином гомоцистеин. Например, предполагается, что глицин и серин уравновешивают отрицательные эффекты высоких доз метионина на гомоцистеин. Однако это не было подтверждено крупными исследованиями на людях. Требуются дополнительные исследования [54].
Глицин, серин и B12 богаты пищевыми продуктами животного происхождения, но не веганами.
3) Метионин не действует сам по себеИсследование, опубликованное в журнале Nature , показало, что добавление незаменимой аминокислоты метионина к рациону плодовых мушек при диетических ограничениях, включая ограничение незаменимых аминокислот, восстанавливает фертильность, не сокращая более продолжительную продолжительность жизни, типичную для диетических ограничений [39].
Это привело исследователей к выводу, что метионин может «действовать в сочетании с одной или несколькими другими незаменимыми аминокислотами» [39, 40].
Однако это еще предстоит определить в дальнейших исследованиях на животных и клинических испытаниях.
Дополнительный продукт: высокобелковая диета и здоровье кишечника
Ограниченные исследования показывают, что не только общее потребление белка, но и доступность определенных диетических аминокислот (в частности, глутамина, глутамата и аргинина, и, возможно, метионина, цистеина и треонина) имеют важное значение для оптимизации иммунных функций кишечника и проксимальные резидентные иммунные клетки.Исследования на людях еще предстоит провести [55].
Каждая из этих аминокислот обладает уникальными свойствами, включая поддержание целостности, роста и функции кишечника. Ученые исследуют, могут ли они нормализовать секрецию воспалительных цитокинов и улучшить количество Т-лимфоцитов, специфические функции Т-клеток и секрецию IgA клетками собственной пластинки [55].
Резюме роли аминокислот в кишечной лимфоидной ткани (GALT) и кишечнике на основе данных на животных и клетках [56] *:
| Аминокислота | Функции |
| Глютамин | • Окислительный субстрат для иммунных клеток и IEC |
| • Предшественник глутамата / GSH | |
| • Рост, структура и функции кишечника (молодняк и болезненные состояния) | |
| • Поддерживает скорость пролиферации и снижает апоптоз IEC | |
| • Исследовано против E.coli / LPS-индуцированное повреждение структуры и барьерной функции кишечника | |
| • Снижает воспалительные процессы и увеличивает продукцию иммунорегуляторных цитокинов | |
| • Улучшает пролиферативные ответы IELs и MLN клеток | |
| • Уровни IgA в кишечнике | |
| • Увеличивает количество лимфоцитов в PP, собственной пластинке и IELs | |
| Глутамат | • Окислительный субстрат для иммунных клеток и IEC |
| • Предшественник GSH и других аминокислот (т.е.е. аргинин) | |
| • Рост, структура и функции кишечника | |
| • Действует как иммунотрансмиттер между дендритными клетками и Т-клетками * | |
| • Способствует пролиферации Т-клеток и выработке Th2 и провоспалительных цитокинов | |
| Аргинин | • Прекурсор NO и глутамата в IEC и иммунных клетках |
| • Рост, структура и функции кишечника | |
| • Поддерживает микроциркуляторное русло слизистой оболочки кишечника | |
| • Повышает экспрессию HSP70 для защиты слизистой оболочки кишечника | |
| • Исследовано против E.coli / LPS-индуцированное повреждение структуры и барьерной функции кишечника | |
| • Облегчает уничтожение нейтрофилов и макрофагов за счет iNOS-опосредованного производства NO | |
| • Повышает уровень IgA в кишечнике | |
| • Снижает уровень воспалительных цитокинов в кишечнике | |
| • Увеличивает количество Т-лимфоцитов в собственной пластинке, PPs, интраэпителиальных пространствах | |
| Метионин и цистеин | • Прекурсор GSH, таурина и цистеина |
| • Снижает окислительный стресс кишечника | |
| • Структура кишечника | |
| • Увеличивает бокаловидные клетки и пролиферируют клетки крипт | |
| • Защищает от повреждения кишечника, вызванного DSS (модель колита), снижая воспаление, повреждение крипт и проницаемость кишечника. | |
| Треонин | • Синтез муцина |
| • Строение и функции кишечника | |
| • Уровни IgA в кишечнике |
* Ни один из этих механизмов не был исследован на людях.
границ | Увеличение продолжительности жизни клеток за счет ограничения метионина влечет за собой изменения в центральном метаболизме углерода и является зависимым от митофагии
Введение
Диета с ограничением метионина значительно увеличивает продолжительность жизни множества модельных организмов.Грызуны с ограничением по метионину живут до 45% дольше, чем однопометники, получавшие контрольное питание, и аналогичные улучшения в продолжительности жизни наблюдались у мух и червей, подвергшихся этому вмешательству (Orentreich et al., 1993; Richie et al., 1994; Miller et al., 2005; Troen et al., 2007; Cabreiro et al., 2013; Lee et al., 2014). Чтобы получить представление о молекулярных механизмах, лежащих в основе преимуществ ограничения метионина (MR) для здоровья, мы ранее использовали несколько модельных систем на основе культур клеток млекопитающих и почкующихся дрожжей (Johnson and Johnson, 2014).Используя последнее, мы оценили влияние MR на способность дрожжей переносить различные цитотоксические стрессы, а также влияние MR на хронологическую продолжительность жизни (CLS), определяемую как период времени, в течение которого дрожжи могут оставаться жизнеспособными в нерабочем состоянии. разделяющее государство (Fabrizio, Longo, 2007). При определенных условиях считается, что анализ CLS моделирует старение покоящихся популяций клеток у высших организмов, но производство определенных токсичных метаболитов дрожжами стационарной фазы означает, что CLS часто более точно считается мерой устойчивости клеток к стрессу (Burtner и другие., 2009). Тем не менее, используя вышеупомянутые подходы, мы обнаружили, что MR наделяет дрожжи стрессоустойчивостью и значительно расширяет CLS (Johnson and Johnson, 2014). Более того, эти преимущества включают ретроградную передачу сигналов митохондрий (RTG), поскольку делеция гена, кодирующего важный фактор передачи сигналов RTG стресса Rtg3, отменяет как устойчивость к стрессу, так и увеличенную продолжительность жизни ограниченных метионином клеток. В том же исследовании мы также получили доказательства того, что MR задействует сходные стресс-ответные пути в культивируемых клетках мыши и человека, улучшая их выживаемость при воздействии множественных цитотоксических стрессов и задерживая начало репликативного старения.В совокупности эти результаты открывают возможность того, что митохондриальная передача сигналов может лежать в основе, по крайней мере частично, преимуществ MR для млекопитающих.
Хотя эти исследования предполагают предполагаемую роль митохондрий в поддержке преимуществ МР, способствующих долголетию, многие из молекулярных механизмов, лежащих в основе этих преимуществ, остались неизвестными. Параллельно с нашим исследованием ряд других групп опубликовали работы, описывающие расширение CLS с помощью MR (Wu et al., 2013; Lee et al., 2014; Ruckenstuhl et al., 2014). Примечательно, что Ruckenstuhl et al. (2014) описали образование подкисленных вакуолей у дрожжей, подвергающихся MR, и продемонстрировали потребность в MR-индуцированном удлинении CLS на основных факторах аутофагии (Atg5, Atg7 и Atg8) и вакуолярной АТФазе. В более недавнем исследовании описано использование профилей рибосом и RNA-seq для оценки трансляционных и транскрипционных изменений в дрожжах, ограниченных метионином (Zou et al., 2017). В соответствии с результатами Ruckenstuhl et al. (2014) авторы обнаружили, что, среди прочего, пути, участвующие в индукции аутофагии, по-разному регулируются в клетках, ограниченных метионином.Действительно, этот результат хорошо подтверждает анализ экспрессии генов из нашего предыдущего отчета, который выявил, что несколько факторов, участвующих в аутофагии, активируются MR (Johnson and Johnson, 2014). Вместе эти исследования убедительно свидетельствуют о том, что ключевым компонентом положительного воздействия MR на выживаемость и долголетие клеток является активация аутофагии.
В текущем исследовании мы показываем работу, направленную на выяснение механистической взаимосвязи между аутофагией и MR-зависимым расширением CLS.В соответствии с предыдущими исследованиями, а также с предположением, что повышенная аутофагическая способность важна для преимуществ MR, мы показываем, что потеря любого из нескольких факторов, участвующих в инициации аутофагии, отменяет распространение CLS с помощью MR. Мы также представляем анализ эпистаза, который предоставляет дополнительные доказательства того, что увеличение аутофагической способности напрямую лежит в основе преимуществ MR для дрожжей. Важно отметить, что наши данные также ясно демонстрируют, что из многих известных типов селективной аутофагии, MR-опосредованное удлинение CLS требует только митофагии, аутофагической рециклинга митохондрий.Как и ожидалось, учитывая как этот вывод, так и наше предыдущее наблюдение, что преимущества MR требуют наличия интактной митохондриальной сигнальной системы RTG, мы демонстрируем, что функциональные митохондрии необходимы для полного преимущества MR для CLS. Наконец, мы наблюдаем, что дрожжи с ограничением по метионину демонстрируют существенные изменения в метаболизме углерода, и предоставляют доказательства того, что такие изменения вносят значительный вклад в увеличение продолжительности жизни дрожжей с ограничением по метионину. Взятые вместе, наши данные согласуются с тем, что MR вызывает изменения в метаболизме углерода, которые работают в сочетании с окислительным метаболизмом митохондрий, чтобы напрямую улучшить выживаемость клеток.
Результаты
Расширение CLS с помощью MR включает связанный с аутофагией фосфатидилинозитол-3-киназный комплекс I
В предыдущей работе, направленной на изучение молекулярных механизмов, лежащих в основе преимуществ MR для дрожжевого CLS и устойчивости к стрессу (Johnson and Johnson, 2014), мы выполнили профилирование экспрессии дрожжей с ограничением по метионину. Эти анализы показали, что ряд факторов, играющих роль в широком диапазоне биологических процессов, по-разному экспрессируется в клетках, ограниченных метионином, по сравнению с контролем.Особый интерес для нас вызвала повышающая регуляция нескольких MR-чувствительных транскриптов, которые кодируют факторы, участвующие в аутофагии ( VPS15 , VPS30 , VPS34 , ATG7 , ATG9 , ATG14 , , ATG1794 ATG1794 ATG27 , ATG29 , ATG31 , ATG33 и IML1 ) (Johnson and Johnson, 2014). Действительно, недавнее исследование Zou et al. (2017) также обнаружили, что пути, управляющие аутофагией, дифференциально регулируются у дрожжей, ограниченных метионином.Кроме того, было продемонстрировано, что основные факторы аутофагии Atg5, Atg7 и Atg8 незаменимы для MR-зависимого удлинения дрожжевого CLS (Ruckenstuhl et al., 2014). Растущее количество работ вовлекает аутофагию почти во все вмешательства, которые способствуют долголетию у млекопитающих, включая ограничение калорий, лечение рапамицином, модуляцию сиртуина, введение спермидина и другие (Eisenberg et al., 2009; Mercken et al., 2014; Мадео и др., 2015). То, что аутофагия играет филогенетически консервативную роль в регуляции долголетия, возможно, неудивительно, учитывая, что подавляющее большинство вмешательств, которые, как известно, продлевают продолжительность здоровья млекопитающих, были сначала определены как способствующие выживанию дрожжей.Вдохновленные такими выводами, мы сочли, что наблюдаемая повышающая регуляция некоторых (или всех) факторов аутофагии, отвечающих за MR, которые мы определили выше, может быть вовлечена либо в активацию аутофагии, либо в увеличение аутофагической способности, что, в свою очередь, способствует расширению CLS, наблюдаемому для клетки, ограниченные метионином. Чтобы изучить эту возможность, мы оценили продолжительность жизни ограниченных метионином клеток, удаленных по многим из вышеуказанных факторов аутофагии, чтобы определить, какие из них, если таковые имеются, могут аннулировать увеличенную продолжительность жизни, связанную с МР.Для этих экспериментов состояние, ограниченное метионином, было продуцировано с помощью «генетической MR» (G-MR), которая является результатом любой из нескольких генетических манипуляций (например, met15Δ ), которые ставят под угрозу биосинтетический аппарат клетки метионина, и которые, как мы ранее продемонстрировали, придают как стрессоустойчивость, так и увеличенную продолжительность жизни клеток дрожжевым и культивированным фибробластам млекопитающих (Johnson and Johnson, 2014). Мы обнаружили, что единичные делеции VPS15 , VPS30 и VPS34 все значительно нарушают расширенный CLS, обычно связанный с MR ( p <0.0001) (Рисунки 1A, B, G). Примечательно, что в случае клеток, лишенных VPS34 , MR не может дать никаких преимуществ этому мутанту, который демонстрирует фенотип медленного роста и является одним из самых короткоживущих штаммов, с которыми мы когда-либо сталкивались; действительно, эти клетки не могут выжить более 3 дней в культуре, момент времени, когда обычно начинаются анализы CLS (рис. 1G). Для клеток, лишенных VPS15 и VPS30 , потеря этих факторов не приводит к снижению CLS в условиях дикого типа, что демонстрирует снижение продолжительности жизни, наблюдаемое для мутантов vps15Δ и vps30Δ под действием метионина- Ограничение условий связано с ограничением льгот, связанных с МР, а не с неспецифическим заболеванием (Рисунки 1D, E).Медиана выживаемости клеток met15Δ atg14Δ значительно меньше, чем у контрольных клеток, ограниченных метионином ( p = 0,0107), хотя сокращение их максимальной продолжительности жизни только приближается к значимости ( p = 0,0878) (рис. 1C). Кроме того, одиночные мутантные клетки, лишенные только Atg14, чрезвычайно недолговечны (Figure 1F), что повышает вероятность того, что нарушение CLS в atg14Δ клетках может быть функцией негативных эффектов как на аутофагию, так и на важные независимые от аутофагии функции Atg14.Что касается функций Vps15, Vps30, Vps34 и Atg14, все эти факторы являются членами тетрамерного фосфатидилинозитол-3-киназного комплекса I, который локализуется в преаутофагосоме и вакуоли и необходим для инициирования практически всех аутофагических процессов (Kihara et al., 2001; Wen, Klionsky, 2017). Vps34 является каталитической субъединицей, которая обладает активностью PI3-киназы, тогда как три других фактора регулируют ее активность по-разному. Таким образом, можно ожидать, что Vps34 будет наиболее критическим членом комплекса для аутофагической активности, которая, по-видимому, важна для преимуществ MR для CLS.Действительно, это представление согласуется с нашим наблюдением, что клеток met15Δ vps34Δ являются чрезвычайно короткоживущими (рис. 1G). Тем не менее, существует еще один комплекс PI3K (комплекс II), который содержит Vps38 вместо комплексного I-специфического фактора Atg14 и функционирует в сортировке вакуолярных белков, а не в аутофагии (Kihara et al., 2001; Obara et al., 2006). Чтобы подтвердить, что MR-зависимое удлинение CLS требует активностей Vps15, Vps30 и VPS34, способствующих аутофагии, а не их роли в сортировке вакуолярных белков, мы оценили потребность в комплексном II-специфическом факторе Vps38 для расширенного CLS клеток, подвергающихся G-MR.Мы обнаружили, что vps38Δ met15Δ двойных мутантных клеток не короче, чем met15Δ клеток (рис. 1H), что указывает на то, что активность комплекса II необходима для полного расширения CLS с помощью MR. Сходным образом удаление связанного с аутофагией фактора Iml1 из клеток, подвергающихся G-MR, также не может сократить продолжительность жизни (Figure 1I). В то время как Iml1 является положительным регулятором аутофагии, которая, как было установлено, активируется MR, он является частью комплекса, который специально необходим для аутофагии, вызванной неазотным голоданием, и не требуется для аутофагии при всех условиях (Wu and Tu, 2011 ).Взятые вместе, вышеупомянутые эксперименты согласуются с MR, увеличивающим CLS, по крайней мере частично, за счет усиления экспрессии всех четырех членов комплекса PI3K I и тем самым увеличения аутофагической способности дрожжей.
Рисунок 1. Связанный с аутофагией комплекс PI3K I обеспечивает MR-зависимое удлинение CLS. Делеция каждого из генов, кодирующих связанные с аутофагией члены комплекса PI3K I (A) Vps15, (B) Vps30 и (C) Atg14, умеренно снижает CLS ограниченных метионином дрожжей.Напротив, в противном случае клетки дикого типа, удаленные для генов, кодирующих (D), Vps15 и (E), Vps30, не оказывают отрицательного воздействия на CLS. (F) В противном случае клетки дикого типа, лишенные Atg14, и клетки (G) , ограниченные метионином, не содержащие Vps34, являются чрезвычайно короткоживущими. Ни (H) Vps38, ни (I) Iml1 не требуются для максимального продления срока службы G-MR. Для всех панелей столбцы обозначают стандартную ошибку среднего (SEM).
Enzymatic MR расширяет CLS
Учитывая, что MR изменяет уровни генов, участвующих в аутофагии, многие из которых необходимы для увеличения продолжительности жизни клеток, ограниченных метионином, мы стремились провести исследования генетического эпистаза, чтобы дополнительно изучить возможность того, что повышенная аутофагическая способность лежит в основе MR-зависимого расширения CLS. .С этой целью мы создали новую систему для создания состояния, ограниченного метионином, в клетках дикого типа, выращенных в среде, содержащей метионин, — вмешательство, которое мы называем «ферментативный MR» (E-MR). В частности, мы клонировали ген L -метионин гамма-лиазы (MGL) из бактерии Clostridium sporogenes в конструкцию для конститутивной высокоуровневой экспрессии в дрожжах. MGL представляет собой фермент, который эффективно гидролизует метионин как in vitro, , так и in vivo (Kreis and Hession, 1973a, b), и предполагается, что он снижает клеточные уровни метионина в дрожжах, содержащих вышеупомянутую плазмиду.Как и ожидалось, E-MR надежно расширяет CLS дрожжей дикого типа, выдержанных в среде, содержащей метионин ( p <0,0001) (рис. 2A). Более того, продолжительность продления сравнима с тем, что мы обычно наблюдаем для G-MR или аналогичного третьего вмешательства, которое мы ранее продемонстрировали для увеличения дрожжевого CLS и которое мы называем «D-MR» (диетический MR; т. Е. рост клеток дикого типа в среде без метионина и цистеина) (Johnson and Johnson, 2014). Это демонстрирует, что E-MR вызывает состояние, ограниченное метионином, по крайней мере так же эффективно, как G-MR или D-MR, что делает его полезным инструментом для экспериментов по генетическому эпистазу, изучающих взаимосвязь между MR и активацией аутофагии (см. Ниже).
Рис. 2. Ферментативный MR (E-MR) и азотное голодание увеличивают CLS, в зависимости от аутофагии, и являются эпистатическими. (A) Клетки дикого типа, содержащие плазмиду, которая конститутивно экспрессирует метионин-гаммалиазу (т.е. E-MR), являются долгоживущими по сравнению с контрольными клетками, содержащими пустой вектор. (B) Азотное голодание (NS) расширяет CLS и является эпистатическим с E-MR. Расширение CLS с помощью (C), E-MR и (D) азотного голодания отменяется в клетках с дефицитом аутофагии ( atg5Δ ).Кроме того, клетки с дефицитом аутофагии, одновременно испытывающие как E-MR, так и азотное голодание, не могут получить пользу от любого вмешательства в CLS. Полоски обозначают SEM.
MR-зависимое расширение CLS эпистазно с расширением CLS, опосредованным азотным голоданием, оба из которых требуют аутофагии
Чтобы напрямую оценить, может ли MR способствовать развитию CLS помимо воздействия на аутофагию, мы выполнили генетический анализ эпистаза. Было продемонстрировано, что азотное голодание (то есть инкубация клеток в среде, лишенной ключевого донора азота), надежно активирует аутофагию у дрожжей, и что такое вмешательство расширяет CLS (Takeshige et al., 1992; Онодера и Осуми, 2005; Powers et al., 2006). Мы повторили это открытие в наших условиях, наблюдая, что клетки дикого типа, состарившиеся в условиях дефицита азота (т.е. без сульфата аммония), живут примерно в два раза дольше, чем клетки, выдержанные в нормальной среде ( p <0,0001) (31 день против 15 дней; рис. 2Б). Затем мы состарили клетки, подвергшиеся E-MR в условиях недостатка азота, и обнаружили, что они не являются значительно более долгоживущими, чем контрольные клетки, выдержанные в тех же условиях ( p = 0.4116) (Рисунок 2B). Эта эпистатическая взаимосвязь между MR и увеличением продолжительности жизни за счет азотного голодания предоставила еще больше доказательств того, что увеличение аутофагической способности лежит в основе преимущества MR для долголетия дрожжей. Чтобы продолжить эти результаты, мы удалили ген, необходимый для аутофагии ( ATG5 ) из клеток дикого типа, и обнаружили, что они не могут положительно реагировать на E-MR (Рисунок 2C), азотное голодание (Рисунок 2D) или их комбинацию. обоих вмешательств ( p <0.0001) (Рисунок 2D). Вместе эти результаты согласуются с основным преимуществом МР для хронологического долголетия, заключающимся в увеличении аутофагической способности.
Активация аутофагии экспрессией пептида, производного Vps30, расширяет CLS
Член комплекса фосфатидилинозитол-3-киназы Vps30 является дрожжевым гомологом Beclin1 млекопитающих, и исследование Shoji-Kawata et al. (2013) продемонстрировали, что введение пептида, производного от Beclin1 (аминокислотные остатки 267-284) мышам, надежно активировало аутофагию in vivo .Механически это было достигнуто за счет конкурентного связывания пептида с GAPR-1, ингибитором Beclin1. Учитывая гомологию между Vps30 и Beclin1, а также между ингибитором GAPR-1 и дрожжевым фактором Pry3, мы предположили, что подобный подход может быть использован для стимулирования аутофагии у дрожжей. Мы рассудили, что если эта манипуляция расширит CLS, это предоставит более прямые доказательства причинной связи между аутофагической способностью и продолжительностью жизни, чем расширение CLS за счет азотного голодания, поскольку последняя манипуляция имеет много других эффектов, помимо простого стимулирования аутофагии.Поэтому мы создали конструкцию для принудительной экспрессии части Vps30 (а.о. 320-336), соответствующую конструкции, использованной Shoji-Kawata et al. (2013) для их усеченной версии Beclin1. Как и ожидалось, мы обнаружили, что экспрессия Vps30 320–336 в дрожжах дикого типа приводит к умеренному увеличению CLS ( p <0,0001) (21 день против 17 дней; дополнительный рисунок S1A). Более того, это расширение зависит от аутофагии, поскольку экспрессия VPS30 320–336 неспособна распространять CLS в клетках, лишенных Atg5 (дополнительный рисунок S1B).Таким образом, эти данные предоставляют дополнительные доказательства того, что стимулирование аутофагии расширяет CLS и, взятые с исследованиями эпистаза дрожжей, испытывающих недостаток азота, указывают на то, что MR, вероятно, расширяет CLS за счет увеличения аутофагической способности.
MR
не влияет на массовую аутофагиюУчитывая, что анализ генетической зависимости и эпистаза убедительно свидетельствует об участии аутофагии в MR-зависимом распространении CLS, мы стремились определить, была ли ключевой активностью массовая аутофагия (например, макроаутофагия), одной из многих избирательных форм аутофагии [i .е., митофагия, пексофагия, нуклеофагия, рибофагия или путь нацеливания из цитоплазмы в вакуоль (Cvt)] или некоторые их комбинации. Чтобы ответить на этот вопрос, необходимо было сначала оценить, активируется ли статическая макроаутофагия с помощью MR. С этой целью мы использовали анализ высвобождения GFP, впервые предложенный группой Дэниела Клионски (Cheong and Klionsky, 2008). В этом подходе опосредованный аутофагией процессинг GFP-Atg8 приводит к высвобождению GFP, что, в свою очередь, измеряется с помощью вестерн-блоттинга.Мы оценили относительные уровни свободного GFP в дрожжах, подвергнутых G-MR ( met15Δ ), по сравнению с контрольными клетками и не обнаружили заметной разницы в высвобождении GFP (Фигуры 3A, B). В качестве дополнительного подхода мы также разработали анализ для измерения накопления липофусцина, аутофлуоресцентных скоплений поврежденных белков и других биомолекул, которые накапливаются с возрастом (Terman and Brunk, 1998; Reverter-Branchat et al., 2004). Мы ожидали, что усиление макроаутофагии, если оно произойдет в клетках, ограниченных метионином, приведет к снижению накопления липофусцина.Действительно, лишенные азота клетки дикого типа (которые активируют аутофагию и являются долгоживущими) демонстрируют стабильно низкие уровни липофусцин-ассоциированной флуоресценции после целых 9 дней хронологического старения (Рисунки 3C, D). С другой стороны, клетки как дикого типа, так и клетки с ограничением по метионину демонстрируют гораздо большую интенсивность флуоресценции, которая со временем увеличивается. Кроме того, уровни липофусцин-ассоциированной флуоресценции в клетках, ограниченных метионином, существенно не отличаются от уровней контрольной группы дикого типа по окончании эксперимента (день 9, p = 0.1931) и на самом деле выше, хотя и незначительно, в более ранний момент времени (День 3, p = 0,005). Таким образом, эти клетки обладают сходной, если не идентичной, степенью неспецифической макроаутофагической активности. В совокупности результаты двух вышеупомянутых анализов показывают, что объемная аутофагия не регулируется в значительной степени MR.
Рис. 3. Макроаутофагия, по-видимому, не регулируется MR. (A) Прямая оценка стационарной макроаутофагии в клетках дикого типа (контроль), с дефицитом аутофагии ( atg5Δ ) и ограниченными по метионину ( met15Δ ) клетками с использованием иммуноблоттинга для измерения аутофагического расщепления GFP-Atg8 ∗∗ , чтобы освободить GFP ∗ .Образцы получали из клеток, содержащих либо плазмиду, кодирующую GFP-Atg8, либо пустой вектор, как указано. Азотное голодание (NS) также использовалось, как указано, для активации аутофагии. (B) Количественное определение относительных количеств высвобожденного GFP (в AU, условных единицах), обнаруженных с помощью иммуноблоттинга. Косвенная оценка стационарной макроаутофагии путем обнаружения липофусцина (C) рано (день 3) и (D) поздно (день 9) во время хронологического старения клеток дикого типа и клеток, ограниченных метионином.Включены интенсивности флуоресценции нуждающихся в азоте клеток дикого типа (NS), для которых активация аутофагии ограничивает накопление липофусцина. Значения интенсивности флуоресценции даны в относительных единицах флуоресценции (RFU). Для панелей C и D полоски обозначают SEM.
Митофагия, но не другие формы избирательной аутофагии, необходимы для расширения CLS по MR
Затем мы рассмотрели возможность того, что селективная форма аутофагии (например,, митофагия, нуклеофагия и т. д.) м. быть активными в клетках, подвергающихся MR, и это, скорее, чем макроаутофагия, может быть релевантной активностью, лежащей в основе расширения CLS, порождаемого MR. С этой целью мы идентифицировали 16 генов, которые, как считается, однозначно связаны с различными формами селективной аутофагии, кодирующие факторы, необходимые для митофагии, пексофагии, нуклеофагии, рибофагии и пути Cvt, соответственно. Затем мы определили, необходимы ли эти гены для расширенного CLS ограниченных метионином клеток.За исключением подмножества генов, кодирующих факторы, участвующие в процессе митофагии, все другие исследованные гены оказались незаменимыми для увеличения продолжительности жизни, связанной с MR (дополнительный рисунок S2). В случае клеток met15Δ также отсутствует ATG32 [который кодирует белок митохондриальной мембраны, необходимый для инициации митофагии (Kanki et al., 2009; Okamoto et al., 2009; Kondo-Okamoto et al., 2012). ], максимальная продолжительность жизни снижается на 43% по сравнению с митофаги-компетентными контрольными клетками, подвергнутыми G-MR ( p <0.0001) (21 день против 37 дней; рисунок 4A и дополнительный рисунок S2). Генетически ограниченные метионином клетки, лишенные Uth2, второго белка митохондриальной мембраны, необходимого для митофагии (Kissova et al., 2004), также недолговечны ( p <0,0001) (21 день против 37 дней; Рисунок 4A и дополнительная информация Рисунок S2). Кроме того, наблюдаемое в этих случаях снижение CLS не связано с какой-либо предполагаемой неспецифической болезнью, связанной с этими делециями, поскольку ни одиночные мутанты atg32Δ , ни uth2Δ не являются короткоживущими по сравнению с диким типом (рис. 4B).Если, как предполагалось, увеличение зависимого от аутофагии оборота митохондрий действительно должно было лежать в основе увеличенной продолжительности жизни ограниченных метионином клеток, можно было бы ожидать, что деление митохондрий [само по себе, как известно, необходимо для эффективного митофагического потока (Мао и Клионский, 2013)] будет незаменим для продолжительности жизни, зависящей от MR. Чтобы проверить это, мы оценили CLS клеток met15Δ , лишенных Dnm1, связанной с динамином ГТФазы, необходимой для деления митохондрий (Gammie et al., 1995; Otsuga et al., 1998; Bleazard et al., 1999), чтобы определить, как он будет сравниваться с CLS контрольного штамма, подвергающегося G-MR. Как и в случае штаммов двойных мутантов met15Δ atg32Δ и met15Δ uth2Δ , клетки met15Δ dnm1Δ демонстрируют значительно более короткий CLS, чем клетки met15Δ ( p <0,0001) (21 день против 37 дней; 4A и дополнительный рисунок S2). Кроме того, это снижение CLS не отражает какого-либо общего заболевания, которое могло бы возникнуть в результате делеции DNM1 , поскольку одиночные мутантные клетки dnm1Δ столь же долгоживущи, как и клетки дикого типа (фиг. 4B).Взятые вместе, эти эксперименты убедительно подтверждают, что аутофагическая активность, лежащая в основе расширения CLS с помощью MR, является специфической митофагией, в отличие от неспецифической макроаутофагии или любой другой известной формы избирательной аутофагии.
Рисунок 4. Нарушение митофагии ставит под угрозу расширенный CLS дрожжей, ограниченных метионином. (A) Факторы, связанные с митофагией Atg32, Uth2 и Dnm1, все необходимы для максимального распространения CLS с помощью G-MR. (B) Напротив, делеция этих факторов из клеток дикого типа не оказывает отрицательного воздействия на CLS. Для обеих панелей Control обозначает CLS клеток дикого типа, а столбцы обозначают SEM.
Функция митохондрий необходима для расширения CLS по MR
Критическая роль митофагии заключается в поддержании популяции неповрежденных функциональных митохондрий, в первую очередь за счет целенаправленного разрушения дефектных митохондрий. Интересно, что некоторые исследования также показали, что при определенных условиях митофагия может положительно регулировать митохондриальный биогенез de novo (Camougrand et al., 2000; Sin et al., 2016). Учитывая эти факты, а также очевидное участие митофагии в распространении CLS с помощью MR, мы предположили, что функция митохондрий будет незаменимой для преимуществ MR перед CLS. Чтобы проверить это, мы использовали два различных метода для отмены функции митохондрий: (1) обработка клеток митохондриальным токсином, паракватом и (2) делеция MIP1 , который кодирует митохондриальную ДНК-полимеразу, необходимую для поддержания митохондриальный геном (Genga et al., 1986; Foury, 1989). Для первого метода мы состарили как дрожжи дикого типа, так и клетки, подвергшиеся G-MR в присутствии и в отсутствие параквата. Количество параквата, выбранного для этих экспериментов (1 мМ), было основано на исследовании Cocheme and Murphy (2008), в котором эта концентрация оказалась самой низкой, которая полностью подавляет рост дрожжей дикого типа с использованием глицерина в качестве источника углерода. , способность, которая требует функциональных митохондрий. Важно отметить, что авторы также продемонстрировали, что рост клеток, культивируемых в среде, содержащей глюкозу (т.е.е. среда, обычно используемая для анализов CLS) не была затронута этим уровнем параквата. Мы наблюдали, что клетки дикого типа, инкубированные в среде с добавлением параквата, не затрагиваются в отношении их CLS (рис. 5А). Напротив, расширенный CLS ограниченных метионином клеток полностью блокируется обработкой паракватом, в результате чего CLS идентичен таковому у контрольных клеток (11 дней; фиг. 5A). Этот результат согласуется с тем, что функция митохондрий важна для расширенного CLS ограниченных метионином клеток, но необязательна для нормальной продолжительности жизни клеток дикого типа.Чтобы подтвердить, что некоторые аспекты митохондриальной функции или метаболизма необходимы для удлинения CLS с помощью MR, мы также оценили, в какой степени клетки, неспособные поддерживать митохондриальную ДНК ( mip1Δ ), демонстрируют увеличенную продолжительность жизни, обычно связанную с G-MR. Мы наблюдали, что mip1Δ met15Δ клеток значительно короче, чем met15Δ положительных контрольных клеток (11 дней против 35 дней; фиг. 5B), показывая максимальную продолжительность жизни, идентичную контрольным клеткам дикого типа; это открытие аналогично описанному выше случаю для ограниченных по метионину клеток, обработанных паракватом (рис. 5А).Тем не менее, потеря функции Mip1 также приводит к умеренному снижению CLS в клетках дикого типа (9 дней против 11 дней; не показано), что потенциально указывает на то, что (а) функция митохондрий важна для выживания клеток дикого типа. дрожжи, выдержанные в среде, содержащей глюкозу, и обработка паракватом представляет собой менее серьезное митохондриальное поражение, чем делеция MIP1 или (b) потеря некоторых митохондриально-независимых функций Mip1 немного вредна для выживания клеток с избытком метионина.В любом случае остается очевидным, что функциональные митохондрии необходимы для полного преимущества программы MR для долголетия дрожжей.
Рисунок 5. Функция митохондрий необходима для MR-зависимого расширения CLS и, вероятно, улучшается с помощью MR. (A) Обработка низкого уровня (1 мМ) дрожжей, ограниченных метионином, митохондриальным ядом паракватом ( met15Δ + PQ) снижает CLS таких клеток до уровня клеток дикого типа (контроль), при этом не обнаруживая видимых изменений. влияние на продолжительность жизни клеток дикого типа (PQ). (B) Аналогичным образом делеция MIP1 , которая кодирует ДНК-полимеразу, необходимую для митохондриальной функции, снижает CLS ограниченных по метионину клеток ( met15Δ mip1Δ ) до таковой дикого типа. (C) Уровни перекиси водорода, присутствующей в культуральной среде хронологически стареющих (дни 2–5) метионин-ограниченных клеток ( met15Δ ), составляют примерно половину от уровней, присутствующих в культурах контрольных клеток. Высокие статистически значимые различия ( p <0.01) указаны ( ∗∗ ) для клеток, ограниченных метионином, по сравнению с контролем дикого типа. Для всех панелей полоски обозначают SEM.
Накопление активных форм кислорода снижается за счет ограничения метионина в зависимости от митофагии
Хотя из приведенных выше исследований ясно, что функция митохондрий необходима для увеличения продолжительности жизни дрожжей от MR, а участие митофагии предполагает, что клетки, ограниченные метионином, содержат больше функциональных митохондрий по сравнению с их аналогами, насыщенными метионином, мы еще не сделали этого. получить фактические доказательства, подтверждающие эту возможность.Чтобы проверить, может ли активированная митофагия в клетках, подвергающихся МР, привести к увеличению доли функциональных, высококачественных митохондрий, мы оценили накопление пероксида в культуральной среде как клеток дикого типа, так и клеток, подвергающихся G-MR. Поскольку нарушение цепи переноса электронов в дисфункциональных митохондриях приводит к производству супероксида и пероксида водорода (Cocheme and Murphy, 2008; Brand, 2010, 2016), мы ожидали, что любое увеличение количества функциональных митохондрий приведет к снижению накопления пероксида. .Мы предпочли этот анализ оценке количества копий митохондриальной ДНК, поскольку он позволяет определить относительные функциональные возможности митохондрий внутри клеток, а не просто определять их количество, измерение, которое не предоставит информации об относительном качестве этих органелл. Мы наблюдали, что во все оцениваемые моменты времени уровни перекиси в культуре, продуцируемой клетками, подвергающимися G-MR, были примерно вдвое меньше уровней, продуцируемых контрольными клетками (рис. 5C).Хотя уровни обнаруженного пероксида были относительно низкими в обоих случаях, что позволяет предположить наличие митохондрий высокого качества, присутствующих даже в контрольных клетках, MR, тем не менее, приводит к дальнейшему снижению образования пероксида. Чтобы проверить, включают ли эти эффекты митофагическое удаление дефектных митохондрий, мы также оценили, способны ли митофаги-дефицитные ( atg32Δ ) клетки снижать уровни перекиси в культуре в ответ на MR (дополнительный рисунок S3A). В обоих тестируемых временных точках MR не смог значительно снизить накопление пероксида в культурах клеток с дефицитом митофагии (День 4, p = 0.0905; День 5, р = 0,3137). Взятые вместе, эти данные позволяют предположить, что митофагическая активность дрожжей, ограниченных метионином, приводит к обогащению функциональных митохондрий, что, в свою очередь, приводит к более эффективному респираторному метаболизму.
Измененный метаболизм углерода лежит в основе преимущества MR по отношению к CLS
Учитывая, что митохондрии необходимы для аэробного дыхания, а также для увеличения продолжительности жизни ограниченных метионином клеток, мы рассмотрели возможность того, что MR может увеличивать CLS, изменяя метаболизм стареющих клеток.Действительно, было продемонстрировано, что хронологически стареющие дрожжи используют ферментацию для производства энергии в течение первых нескольких дней роста, после чего они переходят к аэробному дыханию. Более того, время и масштабы этого явления, известного как «диауксический сдвиг», могут иметь серьезные последствия для хронологического долголетия (Fabrizio and Longo, 2003). Если бы польза MR для дрожжевого CLS действительно заключалась в изменении кинетики (т. Е. Времени и / или эффективности) аэробного дыхания, а также сопутствующем снижении ферментации, то можно было бы предсказать (A), что клетки стареют в среде содержащий источник углерода, который требует окислительного метаболизма митохондрий для производства энергии, может быть долгоживущим, и (B) такое вмешательство устранит относительную пользу MR.Фактически, из ранее опубликованного исследования известно, что клетки, состарившиеся в таких условиях (т.е. в среде, содержащей глицерин), являются долгоживущими по сравнению с контрольными клетками, выдержанными в среде, содержащей глюкозу (Burtner et al., 2009). Чтобы подтвердить это открытие в нашей лаборатории, мы выдержали дрожжи дикого типа в среде, содержащей глюкозу или глицерин, последняя из которых требует наличия функциональных митохондрий для производства энергии, роста и долгосрочной жизнеспособности. Как и ожидалось, клетки, выдержанные в среде, содержащей глицерин, значительно дольше живут, чем клетки, выдержанные в среде, содержащей глюкозу ( p <0.0001) (21 день против 11 дней; рисунок 6A). Кроме того, все клетки, выдержанные в глицеринсодержащей среде, являются одинаково долгоживущими, независимо от того, ограничены ли они метионином ( p = 0,5016) (рис. 6A). Это открытие демонстрирует, что MR неспособен расширять CLS клеток, которые полагаются на митохондрии для производства энергии, и такой идеальный эпистаз согласуется с моделью, согласно которой MR увеличивает продолжительность жизни клеток, способствуя зависимым от митохондрий изменениям в метаболизме углерода.
Рисунок 6. Изменения в углеродном обмене могут увеличивать CLS и вызываются MR. (A) Дрожжи дикого типа, выдержанные в среде, содержащей глицерин вместо глюкозы (GLY), являются долгоживущими, тогда как дрожжи с ограничением метионина не получают дополнительной пользы от роста глицерина, когда эти вмешательства объединены ( met15Δ + GLY ). Определение различных концентраций (B), этанола, (C) ацетата и (D) сукцината в дрожжах дикого типа (контроль) и с ограничением по метионину ( met15Δ ) с хронологическим возрастом (дни 2 –5).Для панелей B – D все MR-зависимые изменения имеют высокую статистическую значимость ( p <0,01). Полоски обозначают SEM.
Хотя вышеупомянутые генетические исследования предполагают метаболические изменения в распространении CLS с помощью MR, мы стремились подтвердить такие изменения непосредственно с помощью биохимических методов. Хорошо задокументировано, что этанол и уксусная кислота являются побочными продуктами ферментативного метаболизма углерода в дрожжах (Dickinson and Schweizer, 2004), поэтому мы использовали два колориметрических анализа для измерения абсолютных уровней этих метаболитов в культурах контрольных клеток и клеток, подвергающихся воздействию G -МИСТЕР.Таким образом, мы оценили степень, в которой клетки использовали ферментацию, а не аэробное дыхание, для производства энергии в различные моменты времени. Мы наблюдали, что клетки дикого типа, выдержанные в среде с высоким содержанием метионина, продуцируют значительное количество этанола (~ 70 мМ) на ранних этапах хронологического старения (рис. 6В), уровни которого постепенно снижаются до уровня ниже уровня обнаружения к 4 дню. Это согласуется с аналогичные анализы производства этанола клетками дикого типа, подвергающимися хронологическому старению (Zampar et al., 2013). Однако, вопреки нашим ожиданиям, содержание этанола в среде стареющих клеток, подвергающихся G-MR, остается относительно высоким (~ 70 мМ) на протяжении всего эксперимента (5 дней). Учитывая, что диауксический сдвиг обычно включает превращение этанола в ацетальдегид, а затем в ацетат, это открытие предполагает, что клетки, подвергающиеся G-MR, вероятно, не демонстрируют этого преобразования и, следовательно, должны накапливать относительно низкие уровни уксусной кислоты. Если это правда, такое открытие согласуется с нашим предыдущим наблюдением, что клетки с ограниченным содержанием метионина подкисляют свою культуральную среду с меньшей скоростью по сравнению с контрольными образцами с высоким содержанием метионина (Johnson and Johnson, 2014).Как и ожидалось, контрольные клетки дикого типа, выдержанные в среде с высоким содержанием метионина, демонстрируют постепенное увеличение уровней культурального ацетата с течением времени (фигура 6C). Кроме того, это увеличение временно соответствует вышеупомянутому снижению концентрации этанола (рис. 6В), как можно было бы спрогнозировать с учетом превращения этанола в ацетат. Поразительно, но количество ацетата, продуцируемого клетками, подвергающимися G-MR, остается низким во все моменты времени, при концентрациях чуть выше определения (рис. 6C).
Для дальнейшего изучения изменения углеродного метаболизма под действием MR мы также оценили уровни сукцината, присутствующего в культурах стареющих дрожжей.Сукцинат, вместе с NADH, является первичными донорами электронов для митохондриальной цепи переноса электронов, а первый образуется в результате комбинированного действия циклов лимонной кислоты и глиоксилата (Dickinson and Schweizer, 2004). Учитывая его роль донора электронов, можно ожидать, что любое изменение уровней сукцината будет связано с изменением потока через цепь переноса электронов. Подобно результатам, наблюдаемым выше для образования пероксида, мы обнаружили, что уровни сукцината, присутствующие в культурах клеток с ограниченным содержанием метионина, примерно вдвое меньше, чем у контрольных клеток с высоким содержанием метионина (фигура 6D).Это снижение наблюдалось на протяжении всего эксперимента и является дополнительным доказательством того, что дрожжи, подвергающиеся MR, демонстрируют совершенно иную программу углеродного метаболизма по сравнению с контрольными клетками. Кроме того, очевидно, что указанная программа отмечена резким снижением накопления множества токсичных метаболитов (то есть уксусной кислоты и активных форм кислорода), которые ограничивают продолжительность жизни дрожжей.
Обсуждение
В предыдущей работе мы продемонстрировали, что и G-MR, и D-MR расширяют CLS дрожжей, идентифицировали незаменимую роль передачи сигналов RTG в этом расширении и охарактеризовали изменения транскрипции, которые являются результатом MR (Johnson and Johnson, 2014).Хотя мы определили несколько факторов, участвующих в аутофагии, которые по-разному экспрессируются в клетках, подвергающихся МР, предполагая роль этого процесса в поддержке преимуществ МР, Ruckenstuhl et al. (2014) наблюдали присутствие зависимых от аутофагии подкисленных везикул в клетках, ограниченных метионином. Поэтому мы стремились дополнительно изучить участие аутофагии в преимуществах MR для дрожжей, начав с оценки того, действительно ли различные факторы аутофагии, которые, как было продемонстрировано, активируются MR, действительно необходимы для долголетия клеток, подвергшихся этому вмешательству.Этот подход предполагает, что активность факторов комплекса I PI3K является существенной для полного преимущества MR для CLS, что согласуется с ролью этого комплекса в поддержке макроаутофагии, а также различных форм избирательной аутофагии (Cebollero and Reggiori, 2009; Delorme -Axford et al., 2015). Хотя усиление регуляции массовой аутофагии не наблюдалось, генетические исследования вместо этого показали, что повышенная аутофагическая способность, связанная с повышенной активностью комплекса I PI3K в ограниченных метионином клетках, вероятно, поддерживает активированную митофагию, поскольку мы обнаружили, что последняя необходима для полного распространения CLS. пользователя MR.Тем не менее, наше открытие, что макроаутофагия не активируется MR, не исключает предполагаемую роль этого процесса (независимо от поддержки митофагии) в расширении MR-зависимой CLS. Действительно, будущие исследования могут выявить такую роль. На данный момент, однако, ясно, что процесс митофагии незаменим в пользу MR для CLS.
Хотя функция митофагии заключается в удалении старых и / или поврежденных митохондрий, она также участвует в регуляции митохондриального биогенеза (Camougrand et al., 2000; Sin et al., 2016). Можно ожидать, что активированная митофагия приведет к увеличению общего числа функциональных митохондрий с одновременным увеличением дыхательной способности путем избирательного устранения дисфункциональных митохондрий или активации новых, неповрежденных митохондрий. Действительно, что подтверждается сниженным накоплением перекиси, мы обнаружили, что окислительный метаболизм улучшается в клетках с ограничением по метионину в зависимости от функциональной митофагической системы. Кроме того, прямые измерения нескольких метаболитов в культурах стареющих дрожжей выявили значительные изменения в метаболизме углерода для клеток, подвергающихся МР, по сравнению с контрольными клетками с избытком метионина.Однако, в отличие от накопления пероксида, MR-зависимые изменения уровней этанола, ацетата и сукцината в культуре не требуют митофагии (дополнительные рисунки S3B – D). Что касается таких изменений, мы обнаружили, что MR приводит к устойчиво высоким уровням этанола в культуре для всех оцениваемых временных точек. Это резко контрастирует с контрольными клетками, которые демонстрируют прогрессирующее истощение этанола (начало уменьшаться на 3-й день и полностью не обнаруживается на 4-й день), предположительно, поскольку этот двухуглеродный спирт превращается в ацетальдегид, а затем в ацетат путем действие алкогольдегидрогеназы и альдегиддегидрогеназы соответственно (Bennetzen and Hall, 1982; Meaden et al., 1997; Boubekeur et al., 1999; Наварро-Авино и др., 1999; Saint-Prix et al., 2004). Формально наблюдаемые различия в уровнях этанола, присутствующего в культурах стареющих дрожжей с ограничением по метионину и с избытком метионина, могут быть связаны с двумя различными механизмами: (1) изменениями в метаболизме или (2) разной проницаемостью / транспортом этих молекул. через клеточную мембрану. Хотя для некоторых оцениваемых метаболитов существуют активные переносчики (например, ацетат активно транспортируется Jen1 и Ady2), этанол, как было показано, пассивно диффундирует через плазматическую мембрану дрожжей (Guijarro and Lagunas, 1984; Paiva et al., 2004; Соарес-Силва и др., 2007). Таким образом, измененные уровни этанола в культуре в результате MR должны быть связаны с эффектами на метаболизм этанола, а не на его транспорт. Другими словами, ясно, что MR должен вызывать изменения в центральном углеродном метаболизме, которые уменьшают превращение этанола в ацетальдегид после диуксического сдвига, тем самым ограничивая образование ацетата.
Устойчивый высокий уровень этанола (а также низкий уровень ацетата) в культуральной среде клеток, ограниченных метионином, предполагает, что либо активность Adh3 (которая отвечает за превращение этанола в ацетальдегид) отсутствует, либо образование этанол из ацетальдегида (из-за действия Adh2, Adh4, Adh5 и / или Adh5) настолько хорош, что компенсирует переработку этого спирта Adh3 (Bennetzen and Hall, 1982; Young and Pilgrim, 1985; Drewke and Ciriacy, 1988; Смит и др., 2004). Интересно, что экспрессия ADh5 , как было обнаружено, повышается в клетках с ограниченным содержанием метионина (3,5X) по сравнению с контролем с избытком метионина (Johnson and Johnson, 2014). Предполагаемое уменьшение потока от этанола к ацетату после диауксического сдвига в клетках, ограниченных метионином, будет соответствовать измеренным уровням этих метаболитов в культуре. Однако мы считаем маловероятным, что повышение активности алкогольдегидрогеназы могло быть единственным механизмом, ответственным за наблюдаемые низкие уровни ацетата в культуре.Это связано с тем, что в нашем предыдущем исследовании было обнаружено, что ген, кодирующий изоформу пируватдекарбоксилазы ( PDC6 ), сильно активирован (56X) в клетках, ограниченных метионином (Johnson and Johnson, 2014). Pdc6 является одним из трех ферментов пируватдекарбоксилазы, которые катализируют декарбоксилирование пирувата до ацетальдегида (Hohmann, 1991). Таким образом, вероятно, что в клетках, ограниченных метионином, существует значительный метаболический поток углерода от пирувата до ацетальдегида, часть которого, как ожидается, претерпит превращение в ацетат.Стабильно низкие уровни культурального ацетата, продуцируемого метионин-ограниченными клетками, вероятно, затем будут достигнуты за счет повышенного использования этого метаболита циклами лимонной кислоты и глиоксилата в форме ацетил-КоА (который затем превращается в цитрат под действием цитрат-синтазы ). Хотя в предыдущем отчете предполагалось, что на самом деле использование уксусной кислоты токсично для хронологически стареющих дрожжей (Orlandi et al., 2013), наши данные вместо этого показывают, что биологические процессы, которые потребляют ацетат (тем самым снижая его уровень), служат для защиты клетки против индуцированного уксусной кислотой убийства.Например, мы обнаружили, что потеря активности Acs2 у дрожжей дикого типа резко повышает чувствительность клеток к краткосрочным инкубациям с экзогенной уксусной кислотой (200 мМ) (данные не показаны). Acs2 (изоформа 2 ацетил-КоА-синтетазы) генерирует ядерный пул ацетил-КоА, используемый для ацетилирования гистонов из ацетата (Guranowski et al., 1994; van den Berg et al., 1996; Takahashi et al., 2006), и снижается. ожидается, что активность этого фермента повысит уровень уксусной кислоты. Следовательно, Acs2, вероятно, обеспечивает защиту от индуцированного уксусной кислотой гибели за счет простого снижения уровней ацетата.Точно так же возможно, что в клетках, ограниченных метионином, с повышенным митохондриально-зависимым окислительным метаболизмом повышенная потребность в сукцинате донора электронов может способствовать эффективному истощению пула ацетата.
В целом, наши данные подтверждают модель, в которой MR изменяет углеродный метаболизм по крайней мере двумя способами, чтобы уменьшить накопление токсичных метаболитов и улучшить долгосрочную выживаемость дрожжей (рис. 7). Первый механизм связан с уменьшением потока углерода от этанола к ацетату, который в своей кислотной форме токсичен для дрожжей.Действительно, постоянно высокие уровни этанола, присутствующие в культурах клеток, ограниченных метионином, представляют собой пул углерода, который остается недоступным для производства ацетата. Как упоминалось выше, относительное снижение активности одного фермента [Adh3, единственной алкогольдегидрогеназы, которая, как известно, участвует в превращении этанола в ацетальдегид (Bennetzen and Hall, 1982)], теоретически может вызвать такое состояние. И наоборот, неспособность клеток метаболизировать этанол в культуре может быть связана с более сложными изменениями, такими как увеличение активности любой из множества других алкогольдегидрогеназ (или их комбинации).Второй механизм, способствующий уменьшению накопления уксусной кислоты и активных форм кислорода, — это зависящее от митохондрий усиление эффективного аэробного дыхания, которое способствует утилизации ацетата и снижению выработки супероксида / пероксида. Этот механизм хорошо подтверждается нашими данными, демонстрирующими (A), что функция митохондрий необходима для MR-зависимого удлинения CLS, (B), что диетические вмешательства, которые способствуют аэробному респираторному метаболизму, продлевают CLS, и (C) что такие вмешательства показывают положительный эпистаз с MR по поводу CLS.Частично это связано с тем, что рост на глицерине (и неферментируемых источниках углерода, таких как лактат и этанол) способствует биогенезу митохондрий (Ibrahim et al., 1973; Damsky, 1976; Visser et al., 1995) и что стареющие клетки в среде, содержащей такие источники углерода, расширяют CLS (Figure 6A) (Burtner et al., 2009). Учитывая, что такие вмешательства эпистатичны для МР в отношении положительного воздействия на долголетие, мы поэтому считаем весьма вероятным, что ключевым преимуществом МР является усиление окислительного метаболизма митохондрий.
Рисунок 7. MR изменяет углеродный метаболизм и способствует долголетию, в зависимости от функции митохондрий. В стандартных условиях роста (слева) почкующиеся дрожжи демонстрируют диауксический рост с фазой первичного аэробного гликолиза (или ферментации), при которой глюкоза быстро превращается в этанол (показан синим цветом; многоступенчатые преобразования обозначены штриховыми линиями). После того, как вся глюкоза израсходована, клетки затем превращают этанол в ацетат, который затем переводится в циклы лимонной кислоты и глиоксилата в форме ацетил-КоА.Затем продуцируются многочисленные метаболиты, включая сукцинат, который можно использовать в качестве донора электронов для митохондриальной цепи переноса электронов. Существуют альтернативные пути преобразования пирувата либо в ацетил-КоА, либо в оксалоацетат без предварительного декарбоксилирования до ацетальдегида. В ответ на MR (справа) клетки демонстрируют совершенно иной паттерн углеродного метаболизма. Уровни этанола остаются постоянно высокими (метаболиты и процессы, которые активируются MR, показаны красным), очевидно, не могут быть преобразованы в ацетат.В результате уровень ацетата остается постоянно низким (метаболиты и процессы, которые подавляются MR, показаны зеленым). Это примечательно, поскольку уксусная кислота является токсичным промежуточным продуктом, который убивает клетки во время хронологического старения. Уровни сукцината также низкие (отчасти из-за более низких уровней ацетата в равновесном состоянии), а устойчиво низкие уровни как ацетата, так и сукцината, вероятно, также связаны с повышенным потреблением этих соединений более функциональными митохондриями в результате митофагии.
Хотя использование углерода, очевидно, несколько отличается у млекопитающих по сравнению с дрожжами, будущие эксперименты покажут, возникают ли изменения в метаболизме двухуглеродных соединений и активности митохондрий в тканях мышей и / или людей с ограничением по метионину и как они может быть причинно связано с МР-опосредованным улучшением продолжительности здоровья организма. Действительно, уже были опубликованы некоторые исследования, в которых описывается роль MR в изменении метаболизма глюкозы (Miller et al., 2005) и продукции митохондриальных активных форм кислорода (Sanz et al., 2006; Perrone et al., 2010) у грызунов. Хотя эти изменения, вероятно, улучшат продолжительность жизни животных с ограничением по метионину, будет интересно точно определить, в какой степени они способствуют увеличению продолжительности жизни, зависящей от МР, и возможно ли разработать новые вмешательства (фармакологические или иные), которые вызывают аналогичные изменения, способствующие здоровью, в контексте нормальной диеты с высоким содержанием метионина.
Материалы и методы
Конструкция штаммов дрожжей и плазмид
Все эксперименты проводились с использованием гаплоидных штаммов, полученных из фона BY4741 / BY4742 ( his3Δ1, leu2Δ0, ura3Δ0 ) (Brachmann et al., 1998). В частности, использованные штаммы происходили из (или происходили из штаммов, полученных из) коммерчески доступной коллекции Yeast Knockout (YKO) (GE Healthcare Dharmacon; Лафайет, Колорадо, США). Коллекция YKO включает штаммы, в которых представляющие интерес делеции генов отмечены кассетой устойчивости к лекарствам KanMX (за исключением met15Δ0 , his3Δ1 , leu2Δ0 и ura3Δ0 .Напротив, штамм iml1Δ был получен путем разрушения локуса IML1 в BY4741 с использованием плазмиды мини-транспозона im1Δ (mTn) (GE Healthcare Dharmacon; Лафайет, Колорадо, США). В полученном штамме делеция IML1 отмечена кассетой разрушения размером 6 т.п.н., несущей lacZ , URA3 , tet и три копии кодирующей области для эпитопа гемагглютинина ( 3X-HA ). Метионин-гамма-лиаза и экспрессионные плазмиды Vps30 320–336 были созданы с использованием комбинации традиционного клонирования и системы Saccharomyces cerevisiae Advanced Gateway Cloning (Alberti et al., 2007). В первом случае ген MGL был амплифицирован с помощью ПЦР из ДНК бактерии C. sporogenes с использованием следующих праймеров (5′-GGGGACAAGTTTGTACAAAAAAGCAGGCTTGAAAGGG GATTAATATATATGGATTGAAAGGG GATTAATATATGGATGATGTGACGACGACCACGACTAGTCCACCACCGACTCCGACCCCACCGACTCC). Полученный фрагмент вводили в Advanced Gateway Entry Vector pDONR221, используя реакцию рекомбинации клоназы BP. ORF MGL затем переносили в вектор-адресат Advanced Gateway pAG425GPD-ccdB (плазмида Addgene # 14154; RRID: Addgene_14154), используя реакцию рекомбинации клоназы LR, в результате чего получали плазмиду, кодирующую метионин-гаммалиазу под контролем 914 конститутивно активной GPDD. промоутер.Для плазмиды, кодирующей пептид активации аутофагии Vps30, область ORF VPS30 , соответствующая аминокислотам 320-336, была амплифицирована с помощью ПЦР из ДНК S. cerevisiae с использованием следующих праймеров (5′-GGGGACAAGTTTTGTACAAAAAAAAGCAGGCTGTAGA TTCTCAATCCATTCTAAGTGGCAAA). Как указано выше, полученный фрагмент вводили в Advanced Gateway Entry Vector pDONR221, используя реакцию рекомбинации клоназы BP. Затем фрагмент VPS30 320–336 был субклонирован в вектор-адресат Advanced Gateway pAG425GPD-EGFP-ccdB (плазмида Addgene № 14322; RRID: Addgene_14322) с использованием реакции рекомбинации клоназы LR, в результате чего образовалась плазмида, кодирующая GFP. Vps30 320–336 под контролем конститутивно активного промотора GPD .Векторы адресатов расширенного шлюза были получены от Сьюзан Линдквист. Для исследований высвобождения GFP (см. Ниже) мы использовали основанную на pRS416 плазмиду, экспрессирующую GFP-Atg8, pGFP-ATG8 (416) / GFP-AUT7 (416). Эта плазмида была получена от Daniel Klionsky (плазмида Addgene # 49425; RRID: Addgene_49425) (Guan et al., 2001).
Анализ хронологического старения дрожжей
. Анализы хронологического старения выполняли, как описано ранее (Johnson and Johnson, 2014), с изменениями в протоколах Longo et al.(1996). Вкратце, клетки наносили на твердую среду YPAD из замороженных исходных материалов или планшетов для препарирования и позволяли расти при 30 ° C в течение 48 часов перед тем, как колонии были инокулированы в жидкую синтетическую полную (SC) среду. После дополнительных 48 часов роста аликвоты переносили в свежую среду SC с концентрацией ~ 2 × 10 5 клеток / мл и выращивали при 30 ° C. Через 3 дня роста, после диауксического сдвига, аликвоты удаляли с 48-часовыми интервалами и оценивали их колониеобразующие единицы (КОЕ) на чашках с агаром YPAD ( n = 4 для каждого условия).Для каждой культуры точка, в которой оставшиеся КОЕ оказались менее 10% от максимального значения, считалась концом продолжительности жизни. Это пороговое значение было выбрано, чтобы избежать возможного смешения с фенотипом GASP (Growth Advantage in Stationary Phase), который отмечен циклическим ростом и гибелью небольшой популяции клеток (Fabrizio and Longo, 2007). Анализы старения проводили с использованием среды SC, составленной следующим образом: 0,67% азотистого основания дрожжей без аминокислот, 2% глюкозы, 0,45% казаминокислот, 0.01% триптофана, 0,008% сульфата аденина и 0,009% уридина. Для экспериментов с использованием сред без аминокислот контрольные среды были составлены следующим образом: 0,67% дрожжевого азотного основания без аминокислот, 2% глюкозы, 0,0018% сульфата аденина, 0,037% лейцина и 0,0073% каждого из следующих веществ: аланин, аргинин, аспарагин, аспарагиновая кислота, цистеин, глутамин, глутаминовая кислота, глицин, гистидин, инозитол, изолейцин, лизин, метионин, парааминобензойная кислота, фенилаланин, пролин, серин, треонин, триптофан, тирозин, уридин и валид.Среды с ограничением аминокислот получали, как описано, но без соответствующих аминокислот (например, лейцина, уридина и т. Д.). Для экспериментов с активацией аутофагии, опосредованной азотным голоданием, среда была составлена следующим образом: 0,67% дрожжевого азотного основания без аминокислот и сульфата аммония, 2% глюкозы, 0,018% лейцина и по 0,009% гистидина, уридина и лизина. . При необходимости для поддержки роста генетически ограниченных метионином клеток ( met15Δ ) в среду азотного голодания добавляли 0.009% метионин. Для экспериментов по хронологическому старению дрожжей в среде, содержащей глицерин, он был сформулирован следующим образом: 0,67% азотного основания дрожжей без аминокислот, 2% глицерина, 0,45% казаминокислот, 0,01% триптофана, 0,008% сульфата аденина и 0,009% уридин. Чтобы оценить значимость различий в продолжительности жизни между штаммами и / или условиями, вычисляли 10% -ные значения выживаемости (в днях), которые использовали для выполнения непарных двусторонних тестов t . Для всех статистических анализов использовали программу Prism (Graph-Pad Software; Ла-Хойя, Калифорния, США).
Измерения аутофагии с помощью вестерн-блоттинга GFP-Atg8 и флуорометрические анализы липофусцина
Чтобы оценить объемную аутофагию, мы использовали метод, описанный лабораторией Даниэля Клионски, для мониторинга аутофагической деградации слитого белка GFP-Atg8 с помощью иммуноблоттинга (Cheong and Klionsky, 2008). Этот анализ был выполнен в основном, как описано, с некоторыми незначительными изменениями. Вкратце, штаммы, несущие либо плазмиду GFP-ATG8 (416) / GFP-AUT7 (416), либо пустой вектор, были хронологически состарены в среде SC без уридина или в среде азотного голодания, как указано.Клетки собирали после 7 дней старения и использовали для получения белковых экстрактов, осажденных TCA. Для иммуноблоттинга блоты инкубировали в течение ночи с первичным антителом против GFP 1: 4000 (ab290; Abcam; Кембридж, Соединенное Королевство) при 4 ° C с последующей инкубацией в течение 1 часа в пероксидазе хрена козьих антител против кроличьих IgG 1: 10000. конъюгированное вторичное антитело (1706515; Bio-Rad; Hercules, CA, США) при комнатной температуре. Блоты были разработаны с использованием хемилюминесцентного субстрата SuperSignal West Pico Plus (Thermo Fisher Scientific; Карлсбад, Калифорния, США) и визуализированы с помощью молекулярного имидж-сканера Bio-Rad ChemiDoc XRS +.Анализ изображений и денситометрия были выполнены с использованием Bio-Rad Image Lab версии 4.1. Нормализацию для вариаций загрузки геля проводили с использованием денситометрии репрезентативных полос белка на блотах, окрашенных красителем Ponceau S (Sigma-Aldrich; Сент-Луис, Миссури, США).
В качестве косвенной оценки объемной аутофагии накопление флуоресцентных агрегатов липофусцина измеряли в живых дрожжах с использованием микропланшетного ридера Molecular Devices SpectraMax M5 (Molecular Devices LLC; Сан-Хосе, Калифорния, США).Для каждого условия примерно 100 мкл аликвот хронологически стареющих дрожжевых культур (нормализованных по плотности клеток, OD 600 ) переносили в лунки 96-луночного планшета с плоским дном и измеряли их интенсивности флуоресценции при длине волны возбуждения 350 нм и длиной волны излучения 440 нм. Эти длины волн были определены как оптимальные для измерения флуоресценции липофусцина с использованием сканирования возбуждения и излучения. Все измерения были выполнены в двух экземплярах, а статистический анализ был проведен с использованием непарных двусторонних тестов t .
Колориметрическое определение уровней перекиси, этанола, ацетата и сукцината в культуре
Образцы сред, использованные для измерения уровней пероксида и ферментативных / респираторных метаболитов, были выделены из стареющих дрожжевых культур, приготовленных, как описано в разделе выше, касающемся анализа хронологического старения дрожжей. В указанные дни отбирали аликвоты по 100 мкл, осветляли центрифугированием и хранили при -20 ° C. Колориметрические анализы для измерения пероксида (MAK311), этанола (MAK076), ацетата (MAK086) и сукцината (MAK184) были коммерчески доступны (Sigma-Aldrich; St.Луис, Миссури, США) и выполнены в соответствии с рекомендациями производителя. Как правило, различные количества культуральной среды добавляли к многокомпонентным реакционным смесям ферментов в прозрачных 96-луночных планшетах с плоским дном, инкубировали в течение указанного времени и измеряли их оптическую плотность (пероксид — 585 нм; этанол — 570 нм; ацетат. -450 нм; сукцинат-450 нм) с использованием ридера для микропланшетов Molecular Devices SpectraMax M5. Две биологические повторности и две технические повторности были выполнены для каждого условия, а статистический анализ был выполнен с использованием непарных двусторонних тестов t .
Заявление о доступности данных
Все наборы данных, созданные для этого исследования, включены в статью / Дополнительные материалы.
Авторские взносы
JJ и JP задумали, спроектировали и провели эксперименты. JJ написал эту рукопись.
Финансирование
Работа выполнена при поддержке Фонда Орентрейха по развитию науки (гранты CCL022 и CCL023).
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Мы благодарны Ф. Брэду Джонсону за подарочные штаммы дрожжей и хотели бы поблагодарить Ф. Брэда Джонсона и Джессику Тайлер за полезные комментарии во время подготовки этой рукописи.
Дополнительные материалы
Дополнительные материалы к этой статье можно найти в Интернете по адресу: https://www.frontiersin.org/articles/10.3389/fcell.2019.00301/full#supplementary-material
Сноски
Список литературы
Альберти, С., Гитлер, А.Д., и Линдквист, С. (2007). Набор векторов клонирования Gateway для высокопроизводительного генетического анализа в Saccharomyces cerevisiae . Дрожжи 24, 913–919. DOI: 10.1002 / yea.1502
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Беннетцен, Дж. Л., и Холл, Б. Д. (1982). Первичная структура гена Saccharomyces cerevisiae алкогольдегидрогеназы. J. Biol. Chem. 257, 3018–3025.
PubMed Аннотация | Google Scholar
Близард, W., McCaffery, J.M., King, E.J., Bale, S., Mozdy, A., Tieu, Q., et al. (1999). Связанная с динамином GTPase Dnm1 регулирует деление митохондрий у дрожжей. Нат. Cell Biol. 1, 298–304. DOI: 10.1038 / 13014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Boubekeur, S., Bunoust, O., Camougrand, N., Castroviejo, M., Rigoulet, M., and Guerin, B. (1999). Обход митохондрий пируватдегидрогеназы в дрожжах Saccharomyces cerevisiae . Дж.Биол. Chem. 274, 21044–21048. DOI: 10.1074 / jbc.274.30.21044
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Брахманн, К. Б., Дэвис, А., Кост, Г. Дж., Капуто, Э., Ли, Дж., Хитер, П. и др. (1998). Дизайнерские штаммы с делециями, полученные из Saccharomyces cerevisiae, S288C: полезный набор штаммов и плазмид для опосредованного ПЦР разрушения генов и других применений. Дрожжи 14, 115–132. DOI: 10.1002 / (sici) 1097-0061 (19980130) 14: 2 <115 :: help-yea204> 3.0.co; 2-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бранд, М. Д. (2016). Митохондриальная генерация супероксида и перекиси водорода как источник митохондриальной окислительно-восстановительной передачи сигналов. Свободный Радик. Биол. Med. 100, 14–31. DOI: 10.1016 / j.freeradbiomed.2016.04.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бёртнер, К. Р., Мураками, К. Дж., Кеннеди, Б. К., и Кеберлейн, М. (2009). Молекулярный механизм хронологического старения дрожжей. Cell Cycle 8, 1256–1270. DOI: 10.4161 / cc.8.8.8287
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Cabreiro, F., Au, C., Leung, K. Y., Vergara-Irigaray, N., Cocheme, H.M., Noori, T., et al. (2013). Метформин замедляет старение C. elegans, изменяя метаболизм фолиевой кислоты и метионина в микробах. Ячейка 153, 228–239. DOI: 10.1016 / j.cell.2013.02.035
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Камугран, Н.М., Муассит, М., Велюр, Г. М., и Герен, М. Г. (2000). Семейство «SUN»: UTh2, ген старения, также участвует в регуляции биогенеза митохондрий в Saccharomyces cerevisiae . Arch. Биохим. Биофиз. 375, 154–160. DOI: 10.1006 / abbi.1999.1655
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кохем, Х. М., и Мерфи, М. П. (2008). Комплекс I является основным местом производства митохондриального супероксида паракватом. Дж.Биол. Chem. 283, 1786–1798. DOI: 10.1074 / jbc.m708597200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дамский, К. Х. (1976). Экологические изменения митохондрий и эндоплазматического ретикулума дрожжей Saccharomyces carlsbergensis . J. Cell Biol. 71, 123–135. DOI: 10.1083 / jcb.71.1.123
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Делорм-Аксфорд, Э., Гимарайнш, Р. С., Реджиори, Ф., и Клионски, Д.Дж. (2015). Дрожжи Saccharomyces cerevisiae : обзор методов изучения прогрессирования аутофагии. Методы 75, 3–12. DOI: 10.1016 / j.ymeth.2014.12.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дикинсон, Дж. Р., и Швейцер, М. (2004). Метаболизм и молекулярная физиология Saccharomyces Cerevisiae , 2-е изд. Бока-Ратон: CRC Press.
Google Scholar
Дрюк К. и Сириаси М. (1988).Сверхэкспрессия, очистка и свойства алкогольдегидрогеназы IV из Saccharomyces cerevisiae . Biochim. Биофиз. Acta 950, 54–60. DOI: 10.1016 / 0167-4781 (88)
-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Eisenberg, T., Knauer, H., Schauer, A., Buttner, S., Ruckenstuhl, C., Carmona-Gutierrez, D., et al. (2009). Индукция аутофагии спермидином способствует долголетию. Нат. Cell Biol. 11, 1305–1314. DOI: 10.1038 / ncb1975
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Foury, F. (1989). Клонирование и секвенирование ядерного гена MIP1, кодирующего каталитическую субъединицу митохондриальной ДНК-полимеразы дрожжей. J. Biol. Chem. 264, 20552–20560.
PubMed Аннотация | Google Scholar
Гэмми А. Э., Курихара Л. Дж., Валле Р. Б. и Роуз М. Д. (1995). DNM1, ген, связанный с динамином, участвует в эндосомном перемещении дрожжей. Дж.Cell Biol. 130, 553–566. DOI: 10.1083 / jcb.130.3.553
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Genga, A., Bianchi, L., and Foury, F. (1986). Ядерный мутант Saccharomyces cerevisiae, лишенный репликации митохондриальной ДНК и полимеразной активности. J. Biol. Chem. 261, 9328–9332.
PubMed Аннотация | Google Scholar
Гуан Дж., Стромхауг П. Э., Джордж М. Д., Хабибзадегах-Тари П., Беван А., Данн В. А. и др.(2001). Cvt18 / Gsa12 необходим для транспорта из цитоплазмы в вакуоль, пексофагии и аутофагии в Saccharomyces cerevisiae и Pichia pastoris . Мол. Биол. Cell 12, 3821–3838. DOI: 10.1091 / mbc.12.12.3821
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гихарро, Дж. М., и Лагунас, Р. (1984). Saccharomyces cerevisiae не накапливает этанол против градиента концентрации. J. Bacteriol. 160, 874–878.
Google Scholar
Гурановский, А., Гюнтер Силлеро, М.А., и Силлеро, А. (1994). Аденозин-5′-тетрафосфат и аденозин-5′-пентафосфат синтезируются дрожжевой ацетилкофермент-синтетазой. J. Bacteriol. 176, 2986–2990. DOI: 10.1128 / jb.176.10.2986-2990.1994
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хохманн, С. (1991). Характеристика PDC6, третьего структурного гена пируватдекарбоксилазы в Saccharomyces cerevisiae . J. Bacteriol. 173, 7963–7969.DOI: 10.1128 / jb.173.24.7963-7969.1991
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ибрагим, Н. Г., Стучелл, Р. Н., и Битти, Д. С. (1973). Формирование митохондриальной мембраны дрожжей. 2. Влияние репрессии глюкозы на синтез митохондриального белка. Eur. J. Biochem. 36, 519–527. DOI: 10.1111 / j.1432-1033.1973.tb02938.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Джонсон, Дж. Э., и Джонсон, Ф. Б.(2014). Ограничение метионина активирует ретроградный ответ и придает устойчивость к стрессу и увеличивает продолжительность жизни дрожжевым, мышиным и человеческим клеткам. PLoS One 9: e97729. DOI: 10.1371 / journal.pone.0097729
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Канки, Т., Ван, К., Цао, Ю., Баба, М., и Клионски, Д. Дж. (2009). Atg32 — это митохондриальный белок, который придает селективность во время митофагии. Дев. Cell 17, 98–109. DOI: 10.1016 / j.devcel.2009.06.014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кихара А., Нода Т., Исихара Н. и Осуми Ю. (2001). Два отдельных комплекса Vps34 фосфатидилинозитол 3-киназы функционируют в аутофагии и сортировке карбоксипептидазы Y в Saccharomyces cerevisiae . J. Cell Biol. 152, 519–530. DOI: 10.1083 / jcb.152.3.519
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кисова И., Деффье М., Манон С., и Камугран, Н. (2004). Uth2p участвует в аутофагической деградации митохондрий. J. Biol. Chem. 279, 39068–39074. DOI: 10.1074 / jbc.m406960200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кондо-Окамото Н., Нода Н. Н., Судзуки С. В., Накатогава Х., Такахаши И., Мацунами М. и др. (2012). Связанный с аутофагией белок 32 действует как аутофагический дегрон и непосредственно инициирует митофагию. J. Biol. Chem. 287, 10631–10638. DOI: 10.1074 / jbc.M111.299917
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Kreis, W., and Hession, C. (1973a). Биологические эффекты ферментативной депривации L-метионина в культуре клеток и экспериментальной опухоли. Cancer Res. 33, 1866–1869.
Google Scholar
Kreis, W., and Hession, C. (1973b). Выделение и очистка L-метионин-альфа-деамино-гамма-меркаптометан-лиазы (L-метиониназы) из Clostridium sporogenes . Cancer Res. 33, 1862–1865.
Google Scholar
Ли, Б. К., Кая, А., Ма, С., Ким, Г., Геращенко, М. В., Йим, С. Х. и др. (2014). Ограничение метионина увеличивает продолжительность жизни Drosophila melanogaster в условиях низкого аминокислотного статуса. Нат. Commun. 5: 3592. DOI: 10.1038 / ncomms4592
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лонго В. Д., Гралла Э. Б. и Валентин Дж. С. (1996). Активность супероксиддисмутазы важна для выживания в стационарной фазе у Saccharomyces cerevisiae .Митохондриальная продукция токсичных форм кислорода in vivo . J. Biol. Chem. 271, 12275–12280. DOI: 10.1074 / jbc.271.21.12275
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Миден, П. Г., Дикинсон, Ф. М., Мифсуд, А., Тессье, В., Вестуотер, Дж., Бусси, Х. и др. (1997). Ген ALD6 Saccharomyces cerevisiae кодирует цитозольную, Mg (2 +) — активированную ацетальдегиддегидрогеназу. Дрожжи 13, 1319–1327. DOI: 10.1002 / (sici) 1097-0061 (199711) 13:14 <1319 :: help-yea183> 3.0.co; 2-t
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Mercken, E.M., Hu, J., Krzysik-Walker, S., Wei, M., Li, Y., McBurney, M. W., et al. (2014). SIRT1, но не его повышенная экспрессия, важны для увеличения продолжительности жизни у мышей с ограничением калорийности. Ячейка старения 13, 193–196.
Google Scholar
Миллер Р. А., Бюнер Г., Чанг Ю., Харпер Дж. М., Сиглер Р. и Смит-Уилок М.(2005). Диета с дефицитом метионина увеличивает продолжительность жизни мышей, замедляет старение иммунной системы и хрусталика, изменяет уровни глюкозы, Т4, IGF-I и инсулина, а также увеличивает уровни MIF гепатоцитов и устойчивость к стрессу. Ячейка старения 4, 119–125.
PubMed Аннотация | Google Scholar
Наварро-Авино, Дж. П., Прасад, Р., Мираллес, В. Дж., Бенито, Р. М., и Серрано, Р. (1999). Предложение по номенклатуре альдегиддегидрогеназ в Saccharomyces cerevisiae и характеристика стресс-индуцируемых генов ALD2 и ALD3. Дрожжи 15, 829–842. DOI: 10.1002 / (sici) 1097-0061 (199907) 15: 10a> 829 :: help-yea423> 3.0.co; 2-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Обара, К., Секито, Т., и Осуми, Ю. (2006). Ассортимент фосфатидилинозитол-3-киназных комплексов – Atg14p направляет ассоциацию комплекса I с преаутофагосомной структурой у Saccharomyces cerevisiae. Мол. Биол. Cell 17, 1527–1539.
PubMed Аннотация | Google Scholar
Окамото, К., Кондо-Окамото, Н., Осуми, Ю. (2009). Знаковый белок, необходимый для митофагии: Atg32 задействует аутофагический механизм митохондрий. Аутофагия 5, 1203–1205.
PubMed Аннотация | Google Scholar
Онодера Дж. И Осуми Ю. (2005). Аутофагия необходима для поддержания уровня аминокислот и синтеза белка в условиях азотного голодания. J. Biol. Chem. 280, 31582–31586. DOI: 10.1074 / jbc.m506736200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Орентрейх, Н., Матиас, Дж. Р., ДеФеличе, А., и Циммерман, Дж. А. (1993). Низкое потребление метионина крысами увеличивает продолжительность жизни. J. Nutr. 123, 269–274.
PubMed Аннотация | Google Scholar
Орланди И., Ронзулли Р., Касатта Н. и Вай М. (2013). Этанол и ацетат, действующие как источники углерода / энергии, отрицательно влияют на хронологическое старение дрожжей. Oxid Med. Cell Longev. 2013, 802870. DOI: 10.1155 / 2013/802870
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Оцуга, Д., Киган, Б. Р., Бриш, Э., Тэтчер, Дж. У., Герман, Дж. Дж., Близард, В. и др. (1998). Связанная с динамином GTPase, Dnm1p, контролирует морфологию митохондрий у дрожжей. J. Cell Biol. 143, 333–349. DOI: 10.1083 / jcb.143.2.333
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пайва, С., Дево, Ф., Барбоза, С., Жак, К., и Касал, М. (2004). Ady2p необходим для активности ацетатпермеазы в дрожжах Saccharomyces cerevisiae . Дрожжи 21, 201–210.DOI: 10.1002 / yea.1056
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Перрон, К. Э., Мэттокс, Д. А., Джарвис-Морар, М., Пламмер, Дж. Д., и Орентрайх, Н. (2010). Эффекты ограничения метионина на биогенез митохондрий и аэробную способность в белой жировой ткани, печени и скелетных мышцах крыс F344. Метаболизм 59, 1000–1011. DOI: 10.1016 / j.metabol.2009.10.023
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пауэрс, Р.В. III, Кеберлейн, М., Колдуэлл, С. Д., Кеннеди, Б. К., и Филдс, С. (2006). Увеличение хронологической продолжительности жизни дрожжей за счет снижения передачи сигналов пути TOR. Genes Dev. 20, 174–184. DOI: 10.1101 / gad.1381406
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ревертер-Бранчат, Г., Кабискол, Э., Тамарит, Дж., И Рос, Дж. (2004). Окислительное повреждение специфических белков в репликативном и хронологическом возрасте Saccharomyces cerevisiae : общие цели и профилактика ограничением калорий. J. Biol. Chem. 279, 31983–31989. DOI: 10.1074 / jbc.m404849200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ричи, Дж. П.-младший, Лойцингер, Ю., Партасарати, С., Маллой, В., Орентрейх, Н., и Циммерман, Дж. А. (1994). Ограничение метионина увеличивает глутатион в крови и увеличивает продолжительность жизни у крыс F344. FASEB J. 8, 1302–1307. DOI: 10.1096 / fasebj.8.15.8001743
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Руккенштуль, К., Нетцбергер, К., Энтфелльнер, И., Кармона-Гутьеррес, Д., Кикенвейц, Т., Стекович, С., и др. (2014). Для увеличения продолжительности жизни за счет ограничения метионина требуется зависимое от аутофагии подкисление вакуолей. PLoS Genet. 10: e1004347. DOI: 10.1371 / journal.pgen.1004347
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Saint-Prix, F., Bonquist, L., and Dequin, S. (2004). Функциональный анализ семейства генов ALD Saccharomyces cerevisiae во время анаэробного роста на глюкозе: НАДФ + -зависимые изоформы Ald6p и Ald5p играют основную роль в образовании ацетата. Микробиология 150, 2209–2220. DOI: 10.1099 / mic.0.26999-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Санс, А., Каро, П., Айяла, В., Портеро-Отин, М., Памплона, Р., и Барджа, Г. (2006). Ограничение метионина снижает образование и утечку митохондриальных кислородных радикалов, а также окислительное повреждение митохондриальной ДНК и белков. FASEB J. 20, 1064–1073. DOI: 10.1096 / fj.05-5568com
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сёдзи-Кавата, С., Самптер, Р., Левено, М., Кэмпбелл, Г. Р., Зоу, З., Кинч, Л. и др. (2013). Идентификация потенциального терапевтического пептида, индуцирующего аутофагию. Природа 494, 201–206. DOI: 10.1038 / природа11866
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Син, Дж., Андрес, А. М., Тейлор, Д. Дж., Уэстон, Т., Хирауми, Ю., Стотланд, А., и др. (2016). Митофагия необходима для митохондриального биогенеза и миогенной дифференцировки миобластов C2C12. Аутофагия 12, 369–380.DOI: 10.1080 / 15548627.2015.1115172
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Соарес-Сильва, И., Пайва, С., Диаллинас, Г., и Касал, М. (2007). Консервативная последовательность NXX [S / T] HX [S / T] QDXXXT подсемейства лактат / пируват: H (+) симпортер определяет функцию пути транслокации субстрата. Мол. Membr. Биол. 24, 464–474. DOI: 10.1080 / 09687680701342669
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Такахаши, Х., Маккаффери, Дж. М., Иризарри, Р. А., и Боке, Дж. Д. (2006). Нуклеоцитозольная ацетил-кофермент-синтетаза необходима для ацетилирования гистонов и глобальной транскрипции. Мол. Клетка. 23, 207–217. DOI: 10.1016 / j.molcel.2006.05.040
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Такешиге, К., Баба, М., Цубои, С., Нода, Т., и Осуми, Ю. (1992). Аутофагия у дрожжей продемонстрирована с мутантами с дефицитом протеиназы и условиями для ее индукции. Дж.Cell Biol. 119, 301–311. DOI: 10.1083 / jcb.119.2.301
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Troen, A.M., French, E.E., Roberts, J.F., Selhub, J., Ordovas, J.M., Parnell, L.D., et al. (2007). Модификация продолжительности жизни глюкозой и метионином у Drosophila melanogaster, получавших химически определенный рацион. Возраст 29, 29–39. DOI: 10.1007 / s11357-006-9018-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
ван ден Берг, М.A., de Jong-Gubbels, P., Kortland, C.J., van Dijken, J.P., Pronk, J.T., и Steensma, H.Y. (1996). Две ацетил-кофермент А-синтетазы Saccharomyces cerevisiae различаются по кинетическим свойствам и регуляции транскрипции. J. Biol. Chem. 271, 28953–28959. DOI: 10.1074 / jbc.271.46.28953
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Виссер, В., ван Спронсен, Э. А., Наннинга, Н., Пронк, Дж. Т., Гийс Куэнен, Дж., И ван Дейкен, Дж.П. (1995). Влияние условий роста на морфологию митохондрий у Saccharomyces cerevisiae. Антони Ван Левенгук 67, 243–253.
PubMed Аннотация | Google Scholar
Вэнь, X., Клионски, Д. Дж. (2017). BRD4 — это недавно охарактеризованный регулятор транскрипции, который подавляет аутофагию и лизосомальную функцию. Аутофагия 13, 1801–1803. DOI: 10.1080 / 15548627.2017.1364334
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Wu, X., и Ту Б. П. (2011). Селективная регуляция аутофагии комплексом Iml1-Npr2-Npr3 в отсутствие азотного голодания. Мол. Биол. Ячейка 22, 4124–4133. DOI: 10.1091 / mbc.E11-06-0525
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ву, З., Сун, Л., Лю, С.К., и Хуанг, Д. (2013). Независимые и аддитивные эффекты глутаминовой кислоты и метионина на долголетие дрожжей. PLoS One 8: e79319. DOI: 10.1371 / journal.pone.0079319
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Янг, Э.Т. и Пилигрим Д. (1985). Выделение и последовательность ДНК ADh4, ядерного гена, кодирующего митохондриальный изофермент алкогольдегидрогеназы в Saccharomyces cerevisiae . Мол. Клетка. Биол. 5, 3024–3034. DOI: 10.1128 / mcb.5.11.3024
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Zampar, G.G., Kummel, A., Ewald, J., Jol, S., Niebel, B., Picotti, P., et al. (2013). Временная системная организация перехода от гликолитической к глюконеогенной работе дрожжей. Мол. Syst. Биол. 9: 651. DOI: 10.1038 / msb.2013.11
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Zou, K., Ouyang, Q., Li, H., and Zheng, J. (2017). Общая характеристика программ трансляции и транскрипции, индуцированных рестрикцией метионина, посредством профилирования рибосом и RNA-seq. BMC Genomics 18: 189. DOI: 10.1186 / s12864-017-3483-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Диета с ограничением метионина (MRD) для взрослых с ожирением и метаболическим синдромом — Полный текст
Было показано, что диета с дефицитом метионина увеличивает скорость метаболизма, снижает вес и увеличивает продолжительность жизни у грызунов.Диета с дефицитом метионина была протестирована в течение 17 недель на людях без побочных эффектов и со средней потерей веса 8 кг. Это исследование будет проверять способность диеты с низким содержанием метионина вызывать потерю веса и улучшать метаболический синдром. Метаболический синдром вызван инсулинорезистентностью, которая связана с абдоминальным жиром, поэтому в этом исследовании надеются снизить висцеральный жир, массу тела и улучшить инсулинорезистентность.
Двадцать четыре здоровых мужчины или женщины в возрасте от 21 до 60 лет включительно со стабильным весом и окружностью талии> 40 дюймов у мужчин и> 35 дюймов у женщин.Субъектам потребуется по крайней мере два из следующего: 1) холестерин ЛПВП <40 мг / дл у мужчин или <50 мг / дл у женщин; 2) триглицериды> 150 мг / дл, 3) артериальное давление> 130/85 мм рт. 4) глюкоза натощак 110-125 мг / дл. Исключаются пациенты, страдающие диабетом, сердечным приступом, инсультом в анамнезе, больными раком в течение последних пяти лет или принимающими хронические лекарства от серьезного заболевания.
Субъекты будут иметь медицинский анамнез, медицинский осмотр, химическую панель, общий анализ крови, электрокардиограмму, DEXA, компьютерную томографию брюшной полости для количественного определения висцерального жира, а кровь будет отправлена в Орентрейх для определения глюкозы, инсулина, С-пептида, липидов. профиль с размером частиц, свободными жирными кислотами, адипонектином, лептином, высокочувствительным С-реактивным белком и инсулиноподобным фактором роста-1.Субъекты также будут подвергаться гиперинсулинемическому, эугликемическому зажиму для количественного определения инсулинорезистентности в течение 18-часового пребывания в стационаре и будут проводить 24 часа в метаболической камере для измерения скорости метаболизма. Затем испытуемых помещают на диету из Hominex-2, напитка, который даст им белок в количестве, зависящем от их массы тела, и они будут видеть диетолога, который даст им список продуктов, которые они могут съесть, состоящий в основном из фрукты, овощи и небольшое количество злаков. Калорийность не будет ограничена, и субъекты будут получать добавку холина в дозе 500 мг / сут.Субъекты будут рандомизированы для получения капсул, содержащих метионин или плацебо, в зависимости от веса их тела. Две группы будут получать 2 или 23 мг / кг / сут метионина.
Участники будут возвращаться в PBRC каждые 2 недели в течение 16-недельного периода диеты, чтобы встретиться с диетологом, зарегистрировать вес и показатели жизненно важных функций, а также каждые 4 недели сдавать кровь натощак для отправки в Орентрейх для принятия мер по соблюдению.
Физический осмотр, мультисрезовая компьютерная томография, DEXA, госпитализация по поводу эугликемического гиперинсулинемического зажима, пребывание в метаболической камере и анализ крови, полученные при скрининге и исходном уровне, будут повторены по завершении 16-недельного периода диеты.
Нет известных рисков для диеты с низким содержанием метионина, но у некоторых людей могут возникнуть желудочно-кишечные расстройства, когда они изменят свой рацион. Риск компьютерной томографии — это воздействие рентгеновского излучения, эквивалентного рентгеновскому снимку грудной клетки спереди и сбоку. Риск DEXA — это воздействие рентгеновского излучения, эквивалентное пребыванию на солнце 12 часов. Нет никакого риска оставаться в метаболической камере. Гиперинсулинемический, эугликемический зажим может вызвать низкий уровень сахара в крови. Этого можно избежать за счет частого контроля уровня сахара в крови, и, если уровень сахара в крови будет низким, тест будет остановлен и сахар будет вводиться через внутривенную линию.Анализ крови включает в себя дискомфорт при попадании иглы в вену руки, образование синяков и, в редких случаях, обморока или инфекции. Эти риски будут сведены к минимуму обученными специалистами, использующими стерильные иглы.
Преимущества дополнительного жидкого метионина для свиноматок
Добавление жидкого метионина в рацион кормящих свиноматок приводит как к повышению концентрации жира и лактозы в молоке, так и к лучшему всасыванию питательных веществ в кишечнике поросят-сосунов. В совокупности эти факторы объясняют более высокую массу тела поросят до и после отъема.
Диетологи должны найти решения для кормления современных и сверхплодородных свиноматок и разработать новые стратегии для удовлетворения растущих потребностей в питательных веществах. Лактация является важной фазой, так как количество и качество молока свиноматок играют центральную роль в росте поросят-сосунов. Испытания, проведенные французской компанией по производству кормов для животных Adisseo, доказывают, что дополнительное добавление метионина в рацион сверх требований приводит к улучшению качества молока.
Сравнение метионина
Недавно в Китае было проведено испытание на помесных первородящих свиноматках с целью сравнить рацион кормящих свиноматок с дополнительным запасом метионина и контрольным рационом, содержащим 0.25% от общего количества метионина на уровне, соответствующем рекомендациям Национального исследовательского совета США (NRC). Для кормовой промышленности доступны три источника метионина. В этом испытании сравнивали 2 формы метионина: порошкообразную форму, DL-метионин (1,34 кг / тонну) и жидкую форму: DL-гидроксиметионин, DL-HMTBA (1,51 кг / тонну).
По сравнению с контрольной диетой и диетой с DL-метионином, диета, содержащая DL-HMTBA, приводит к значительному улучшению содержания жира и лактозы в молоке свиноматок ( Рисунок 1 ), 2 источника энергии для кормления грудью. поросята.Авторы также продемонстрировали, что лучший состав молока стимулирует экспрессию кишечных генов и увеличивает абсорбционную способность кишечника поросят-сосунков.
Вследствие более высокого содержания в питательном молоке макроэлементов и аминокислот масса тела поросят-сосунов на 14-й день после опороса в группе DL-HMTBA была значительно выше (+510 г), чем в контрольной группе, и имела тенденцию к снижению. быть выше (+310 г), чем в группе DL-метионина.
Рисунок 1 — Содержание жира и лактозы в молоке свиноматок, получавших различные источники метионина.
Увеличение массы тела
Эти новые данные подтверждают лучшую эффективность жидкой формы метионина, которая наблюдалась ранее исследователем Хао Ли и его командой из Сычуаньского сельскохозяйственного университета, Китай. В этом испытании, когда и свиноматки, и поросята получали рацион с повышенным уровнем серосодержащих аминокислот посредством DL-HMTBA или DL-метионина, ученые продемонстрировали, что масса тела 35-дневных поросят была значительно выше, когда свиноматки и поросята получали метионин в качестве DL-HMTBA по сравнению с DL-метионином, см. Также , фиг. 2 .
Рисунок 2 — Вес поросенка в 35 дней (кг).
Кроме того, у этих поросят была лучшая морфология кишечника с более высокой высотой ворсинок и соотношением высота ворсинок / глубина крипты (, рис. 3, ), что привело к лучшей абсорбционной способности. Более того, в период после отлучения от груди влияние диетического лечения на статус глутатиона тощей кишки показало, что лечение DL-HMTBA позволило улучшить статус красного быка, чем при других методах лечения (на что указывает более высокий уровень восстановленного глутатиона и более низкое соотношение окисленного глутатиона к восстановленному глутатиону). ).
Рисунок 3 — Глобальные кишечные клетки подвздошной кишки поросят. Когда свиноматки и поросята получают повышенные уровни метионина, особенно через DL-HMTBA, у поросят значительно улучшается морфология кишечника с более высокими высотой ворсинок и соотношением высота / глубина крипты, что приводит к лучшей способности усваивать питательные вещества.
Повышенное потребление корма
Еще одним интересным открытием было то, что поросята-отъемыши, получавшие источник метионина DL-HMTBA в своем полноценном корме, показывают более высокое потребление корма в дни после отъема (P
Исследователи также пришли к выводу, что повышенное потребление метионина в виде DL-HMTBA может облегчить стрессы, связанные с ранним отлучением от груди.По сравнению с контрольной группой в группе, получавшей DL-HMTBA, наблюдались более высокая высота ворсинок, соотношение высоты ворсинок и глубины крипт, а также количество бокаловидных клеток, что свидетельствует о его положительном влиянии на стресс при отлучении от груди.
Команда из Сычуаньского сельскохозяйственного университета пришла к выводу, что задержка роста, вызванная ранним отъемом, по-видимому, ослабляется за счет изменений аминокислотных профилей в плазме и повышения показателей роста и антиоксидантной способности кишечника у поросят после повышенного потребления метионина в виде DL-HMTBA.
Эти наблюдения предлагают новое понимание механизма метаболизма серных аминокислот с важными последствиями для питания и здоровья.
Ссылки доступны по запросу.
С авторами можно связаться по адресам [email protected] и [email protected].
.