диклофенак, ионизаторы воздуха, щелочная вода, иммунотерапия
Рак продолжает оставаться одной из лидирующих причин смертности во всем мире. Несмотря на многочисленные исследования в данной области, специалистам пока не известен механизм, приводящих к перерождению здоровых клеток в злокачественные. Поиски эффективных средств от рака продолжаются. Что может предложить современная медицина?
Диклофенак как средство от рака
Недавно в ecancermedicalscience были опубликованы результаты исследований, посвященных изучению ранее не известных свойств популярного обезболивающего средства. Исследования проводились по инициативе Международного проекта Repurposing Drugs in Oncology (ReDO). Полученные данные позволяют утверждать: Диклофенак можно использовать в качестве эффективного противоракового препарата.
Диклофенак относится к группе нестероидных противовоспалительных средств. Он был разработан в 70-х годах прошлого века и до настоящего времени традиционно использовался в качестве обезболивающего и противовоспалительного средства при ревматоидных заболеваниях, проблемах с опорно-двигательным аппаратом, болевом синдроме разной этиологии.
Специалисты заинтересовались Диклофенаком в качестве средства предупреждения и лечения различных видов рака более 30 лет назад. Проводились исследования на животной модели. Препарат вводили подопытным мышам с фибросаркомой. При этом фиксировалось значительное замедление роста опухоли. Исследования были продолжены. Оказалось, Диклофенак способен подавлять деление злокачественных клеток также при раке яичника, поджелудочной железы, меланоме, глиоме, раке прямой и толстой кишки, нейробластоме.
Результаты новых исследований показывают, что подобная терапия может быть достаточно эффективной. Преимуществами препарата являются его низкая токсичность, хорошо изученная фармакокинетика и невысокая стоимость.
Диклофенак часто используют как анальгетик при раковых заболеваниях и после хирургического вмешательства по удалению опухоли. Результаты анализа данных пациентов, которым проводилась подобная терапия, позволили выявить у них ряд позитивных изменений, в том числе:
- Снижение показателей смертности и риска метастазирования при опухолях груди, почек, легких.

- Уменьшение размеров опухоли при агрессивном фиброматозе.
- Замедление прогрессирования аденокарциномы поджелудочной железы.
Ученые считают, что противораковые свойства Диклофенака связаны с шестью основными факторами:
- Лекарственное средство подавляет особый фермент, синтезируемый простагландинами – ингибитор циклооксигеназы второго типа. Простагландин Е2 обнаружен в ряде опухолей. Он поддерживает хроническое воспаление, тем самым формируя микросреду опухоли.
- Диклофенак производит иммуномодулирующий эффект.
- Препарат подавляет рост сосудов, снабжающих опухоль питательными веществами.
- Он активизирует апоптоз раковых клеток (регулируемый процесс программируемой клеточной гибели).
- Средство способствует повышению чувствительности раковых клеток к химиотерапии и лучевой терапии.
Основываясь на полученных данных, ученые выражают надежду на возможность использования Диклофенака в качестве достаточно эффективного противоракового средства уже в ближайшем будущем.
Польза ионизированного воздуха при онкологических болезнях
Высокое содержание воздушных ионов (так называемых аэроионов) во вдыхаемом воздухе многократно снижает риск спонтанного рака. Подобный эффект был выявлен еще в начале 20 века французским ученым Ф. Велесом. Во время экспериментов с грызунами он заметил, что у некоторых животных после длительного нахождения в помещении с ионизированным воздухом опухоль исчезла.
В середине прошлого века ученые обнаружили, что воздух с высоким содержанием аэроионов подавляет рост трансплантированных опухолей у животных. Позднее такой же эффект был выявлен у онкологических пациентов. Например, 10-20 сеансов аэротерапии привели к существенному уменьшению размеров опухоли или ее полному исчезновению у страдавших мастопатией женщин.
Российский ученый А.Л. Чижевский в свое время выразил предположение, что между развитием злокачественных новообразований и систематическим недостатком аэроионов в воздухе существует определенная связь. Дефицит ионов воздуха создает фон для нарушения электрообмена, снижения электрического потенциала клеток, приводит к раннему старению организма и формированию новообразований.
Дефицит ионов воздуха создает фон для нарушения электрообмена, снижения электрического потенциала клеток, приводит к раннему старению организма и формированию новообразований.
Посредством ионизации воздуха в жилых и рабочих помещениях можно снизить риск развития онкологических заболеваний. Противораковый эффект ионизаторов подтверждает и
KenkoAir Purifier™ получил сертификаты нескольких престижных международных организаций в сфере защиты здоровья и окружающей среды
Щелочная вода и рак
Без воды жизнь невозможна. Это общеизвестный факт. Вода обеспечивает протекание жизненно важных процессов и способствует выведению токсичных веществ и ненужных продуктов жизнедеятельности из организма. Специалисты говорят: ежедневно нужно выпивать не менее 2,5 литров воды. Но не всякая вода полезна для организма.
Специалисты говорят: ежедневно нужно выпивать не менее 2,5 литров воды. Но не всякая вода полезна для организма.
К важнейшим характеристикам воды относятся кислотно-щелочной баланса и ОВП (окислительно-восстановительный потенциал).
Кислотно-щелочной баланс. Все жидкости человеческого тела, за исключением желудочного сока, являются нейтральными или слабощелочными. рН слюны составляет 7,4, лимфы – 7,5, крови – 7,35. При повышении кислотности возрастает вероятность развития многих болезней, в том числе онкологических. Для оздоровления организма необходимо ощелачивание системы. Для нейтрализации кислот организм постоянно ищет подходящие источники щелочи. Самым доступным при этом становится содержащийся в костях кальций. Так, повышение кислотности приводит к вымыванию кальция из костей, снижению их прочности. Кроме того, кальций часто откладывается в суставах, позвоночном столбе, почках, желчном пузыре, в результате в них начинается развитие патологических процессов.
Чтобы избежать подобного сценария, необходимо ежедневно употреблять щелочную воду. pH такой воды выше 7,0. Ученые называют ее живой. При pH ниже 7,0 вода теряет свои полезные качества, становится мертвой.
Окислительно-восстановительный потенциал, или ОВП – другой важный показатель воды. ОВП относится к самым значимым характеристикам внутренней среды, так как влияет на жизненно важные процессы. Специалисты говорят, что при сбое механизмов окислительно-восстановительных процессов организма возрастает риск развития ряда тяжелых патологий, в том числе онкологии.
Как правило, проточная и бутилированная вода не соответствуют нормам безопасности для здоровья. Чтобы очистить воду и улучшить ее качество, применяются различные бытовые приборы.
Самые эффективные разработки в этой сфере предлагает компания NIKKEN
Система фильтрации воды PiMag WaterFall обеспечивает:
Тщательную многоэтапную фильтрацию воды;
Удаление всех загрязнений, хлора, хлорамина, солей тяжелых металлов, других примесей.
Изменение кислотно-щелочного баланса (pH ) в сторону повышения щелочной составляющей.
Снижение ОВП (окислительно-восстановительного потенциала).
Изменение структуры воды, способствующее повышению ее усваиваемости организмом.
Система фильтрации воды PiMag
Благодаря уникальному фильтру NIKKEN прибор производит сверхтонкую очистку воды, удаляя из нее мельчайшие загрязнения, химические соединения, бактерии и насыщая важными минералами.
Стабилизирует рН до оптимальных для организма показателей 7,4-7,8.
Насыщает воду кислородом.
Улучшает ее структуру для лучшего проникновения в клетки.
Оптимизатор воды PiMag
Ионизирует воду.
Улучшает уровень pH
Насыщает кислородом.
Структурирует воду для лучшего усваивания организмом.
Иммунотерапия при лечении онкологических заболеваний
Сегодня специалисты акцентируют внимание на поисках безопасных методов лечения рака. Помимо традиционных (хирургическое вмешательство, химиотерапия, лучевая терапия), используются и другие техники.
Помимо традиционных (хирургическое вмешательство, химиотерапия, лучевая терапия), используются и другие техники.
К наиболее перспективным направлениям относится иммунотерапия. Современная медицина предлагает ряд мероприятий, проводимых для поддержания работы иммунной системы, укрепления иммунитета.
- Вакцинация. Применяют два типа вакцин: для предупреждения заболевания и для лечения уже развившейся болезни. Их производят на основе изъятых из организма злокачественных клеток.
- Препараты на основе цитокинов. Цитокины – особые белки, посредством которых передается информация от одних клеток другим.
- Т-клетки. Эти специфические клетки проявляют высокую активность в борьбе с раком.
- Моноклональные антитела, дезоксинат, тимоген. Перечисленные лекарственные средства активизируют иммунитет для самостоятельной борьбы организма с болезнью. Кроме того, они способствуют выведению из организма токсических веществ.

- 5. ТИЛ-клетки. Их выделяют из раковых тканей и вводят в организм после размножения в лаборатории. Методика направлена на предупреждение рецидива онкологического заболевания.
- Природные методы иммунотерапии. Ученые советуют использовать натуральные органические продукты, способствующие улучшению работы иммунной системы. Однако они предупреждают о необходимости продолжения традиционного лечения. Иными словами, обогащенные витаминами натуральные продукты, растительные средства можно применять только в рамках вспомогательной терапии.
Мы предлагаем уникальные продукты компании NIKKEN, зарекомендовавшие себя в качестве мощных иммуностимулирующих средств. На нашем сайте вы можете купить:
Изумрудные ростки Jade GreenZymes. Органический продукт на основе ячменных ростков способствует укреплению иммунитета, устраняет проблемы с пищеварением, помогает очистить организм от токсинов.
Органическую соковую смесь СIAGA V на основе соков черники, ежевики, малины, нектара асаи, экстракта косточек винограда. Антиоксидантный потенциал продукта составляет 1425 единиц по шкале ORAC.
Внимание! Онкологические пациенты должны находиться под обязательным врачебным контролем. Применение любых дополнительных средств возможно только одновременно с назначенным специалистами лечением.
У диклофенака обнаружен противораковый эффект
Наука15/01/2016
Repurposing Drugs in Oncology, или Перепрофилирование лекарств в онкологии (ReDO) – проект, целью которого является изучение противоракового эффекта хорошо известных и хорошо охарактеризованных лекарств, применяемых по другим показаниям. Ранее в проекте было заявлено, что первыми в очереди на оценку противоопухолевого потенциала стоят следующие 6 препаратов с хорошо изученной фармакокинетикой, относительно низкой токсичностью и невысокой стоимостью: мебендазол (антигельминтное средство), нитроглицерин (сосудорасширяющее средство), циметидин (блокатор Н2-гистаминовых рецепторов), кларитромицин (антибиотик), диклофенак (НПВС) и итраконазол (противогрибковое средство).![]() И вот в ecancermedicalscience вышел обзор*, посвященный противоопухолевому эффекту диклофенака – широко используемого в мире обезболивающего и противовоспалительного средства, выпускаемого в форме таблеток, мазей, суппозиториев, растворов для инъекций и др.
И вот в ecancermedicalscience вышел обзор*, посвященный противоопухолевому эффекту диклофенака – широко используемого в мире обезболивающего и противовоспалительного средства, выпускаемого в форме таблеток, мазей, суппозиториев, растворов для инъекций и др.
Проанализировав эффект диклофенака при различных онкологических заболеваниях в исследованиях с 1983 года до настоящего момента, авторы обнаружили у препарата противораковую активность. Диклофенак замедлял рост имплантированной фибросаркомы у животных, а в экспериментах in vitro и in vivo подавлял деление раковых клеток при раке толстой и прямой кишок, нейробластоме, раке яичника, глиоме, раке поджелудочной железы, меланоме и раке простаты.
Диклофенак также используют для обезболивания при онкологических заболеваниях и после операций по их поводу, что позволило провести ретроспективное сравнение результатов лечения пациентов, получавших и не получавших диклофенак. Сравнение показало, что включение диклофенака в стандартные схемы лечения статистически достоверно снижало вероятность отдаленного метастазирования и общую смертность у пациентов с раком груди, легкого и почки; замедляло прогрессирование аденокарциномы поджелудочной железы; значительно уменьшало размеры опухоли при агрессивном фиброматозе, а также показывало положительный эффект при нейробластоме.
Ученые полагают, что противораковый эффект диклофенака связан как с характерным для всех НПВС ингибированием фермента циклооксигеназы и, соответственно, синтеза простагландинов, так и с другими механизмами действия. Известно, например, что простагландин Е2 обнаруживается в опухолях, обеспечивая в них хроническое воспаление. Также известно, что воспалительный каскад, который запускается в организме после хирургических вмешательств, может приводить к усилению ангиогенеза и устойчивому угнетению иммунных реакций, что в свою очередь, способствует отдаленному метастазированию. Есть данные о том, что диклофенак, угнетая воспаление, снижает риска метастазирования после операций.
Противораковые свойства диклофенака и его комбинаций с другими препаратами в настоящее время получают подтверждение в четырех клинических испытаниях.
*Pantziarka P, Sukhatme V, Bouche G, Meheus L and SukhatmeVP. Repurposing Drugs in Oncology (ReDO)—diclofenac as an anti-cancer agent // ecancer, 2016, 10, 610. DOI: 10.3332/ecancer.2016.610
DOI: 10.3332/ecancer.2016.610
На фото: фибробластома (розовый цвет) прорастает через сеть волокон коллагена (голубой цвет), образующих соединительную ткань; сочетание изображения, полученного сканирующей электронной микроскопией с 3D-графикой; фото SASHA MESHINCHI.
Поділіться цим з друзями!
Вам також буде цікаво це:
Обезболивание в современной онкологии / Хабр
Болевой синдром при раке проявляется у 35-50% пациентов на ранних стадиях злокачественного процесса. По мере прогрессирования болезни уже до 80% чувствуют боль от умеренной до сильной. В терминальной стадии больно уже почти всем – 95% пациентов. Боль мешает спать, есть, двигаться, принимать осознанные решения, влияет на работу органов и систем.
Хорошая новость в том, что современная медицина научилась держать эту боль под контролем в 90% случаев. То есть либо купировать болевой синдром полностью, либо значительно уменьшать его интенсивность. Таким образом, на любых стадиях рака можно сохранять онкологическим пациентам нормальное качество жизни.
Мы уже писали, что в «Медицине 24/7» больше половины пациентов – именно с III-IV стадиями рака. Первое, что приходится делать при оказании паллиативной помощи таким людям – это купирование болевого синдрома. Поэтому для нашего профиля адекватное обезболивание остается одним из самых актуальных направлений работы.
В России есть специфические проблемы, связанные как с получением анальгетиков, особенно наркотических, так и с несоблюдением в некоторых медучреждениях рекомендаций ВОЗ по обезболиванию.
Хотя, судя по нашей практике, основной принцип довольно прост: «Не делать резких движений». Всегда начинать с минимальных доз, наращивать мощность обезболивания очень плавно, а не прыгать с обычного ибупрофена сразу на морфин, «отбирая» у пациента массу альтернативных более слабых вариантов, которыми можно было бы еще долго пользоваться.
Сегодня постараемся разобраться, какие же лекарства кому и когда нужны, и как еще современная медицина умеет бороться с болью.
И за какие такие грехи природа мучает людей? Официальное определение IASP (Международной ассоциации по изучению боли) таково:
«Боль – неприятное сенсорное или эмоциональное переживание, связанное с фактическим или потенциальным повреждением тканей, или описываемое в терминах такого повреждения». Переведем на человеческий.
Переведем на человеческий.
В норме, боль – это важная и полезная для выживания вещь. Это четкий сигнал мозгу от какой-то части тела или от внутреннего органа: «Эй, обрати внимание, тут серьезные неполадки, надо что-то делать. Быстро!». Эта сигнальная система позволяет человеку избегать слишком серьезных травм и повреждений: если вам неприятно – вы постараетесь дальше не взаимодействовать с причиной своих неприятностей. А значит, с большей вероятностью останетесь целы и почти невредимы. Так все происходило в ходе эволюции.
Рефлекс отдергивания – здоровая биологическая реакция на острую боль
Но в нездоровом организме онкологического пациента (а также пациента с сердечно-сосудистым заболеванием или ВИЧ, или, например, туберкулезом) боль утрачивает свою полезную сигнальную функцию и наоборот, мешает как основной терапии, так и оказанию паллиативной помощи. Пациент впадает в депрессивное состояние, теряет силы, необходимые для борьбы с болезнью. Хронический болевой синдром превращается в самостоятельную патологию, которую нужно отдельно лечить.
Именно поэтому более чем миллиону человек в России ежегодно требуется обезболивание. Причем от 400 до 800 тысяч из них (по разным подсчетам) нуждаются в опиоидных анальгетиках.
Чтобы разобраться, какой подход нужен для купирования боли, врачу-онкологу нужно понять ее причину и происхождение.
Одна из больших трудностей диагностики ЗНО (злокачественных новообразований) – у пациента часто сначала вообще ничего не болит. Опухоль банально может быть пока слишком маленькой.
Еще такое случается, если опухоль растет в неплотных тканях (таких как молочная железа) или увеличивается внутри полости органа (например, желудка). Также без боли могут развиваться те виды рака, при которых нет солидных первичных опухолей – лейкозы, злокачественные заболевания системы кроветворения.
В нашей практике были случаи, когда бессимптомно протекали даже IV стадии онкологических процессов – вплоть до появления множественных метастазов пациенту не было больно.
Во всех остальных случаях, когда боль присутствует, врачу важно знать, из-за чего она появилась. По причинам возникновения выделим три основных группы.
По причинам возникновения выделим три основных группы.
- Ноцицептивная боль. Пробуждается ноцицепторами – рецепторами боли. Эти рецепторы – сеть разветвленных окончаний периферических нервов, которыми «подключены» к спинному мозгу все наши внутренние органы, а также кости и каждая точка поверхности кожи. При повреждении (или воздействии, которое угрожает повреждением) любого участка тела ноцицепторы посылают сигнал в спинной мозг, а тот, во-первых, запускает рефлексы избегания (например, отдергивать руку при ожоге), и во-вторых, «докладывает наверх» – в головной мозг.
Схема прохождения ноцицептивного и других сигналов от внешних раздражителейИ там уже сложное взаимодействие таламуса, гипоталамуса и коры больших полушарий запускает стрессовые реакции вегетативной нервной системы: расширение зрачков, усиление пульса, повышение давления и т.д. На какой-то момент мозг «приостанавливает» все остальные нервные процессы, потому что у боли первый приоритет.
 Она важнее всего остального для выживания – считает мозг. А пациент в этот момент не может нормально думать и делать какие-то другие дела.
Она важнее всего остального для выживания – считает мозг. А пациент в этот момент не может нормально думать и делать какие-то другие дела.При онкологических заболеваниях ноцицептивная боль, чаще всего, является реакцией на саму опухоль или метастазы. Так, метастазы в позвоночнике могут давать прорывную, резкую боль при перемене положения тела пациентом.
- Нейропатическая боль. Ее причина – нарушение в работе нервных структур – нервов, спинного или головного мозга. Сочетает два фактора: с одной стороны, интенсивность – пациенту очень больно, иногда не помогают даже сильнодействующие анальгетики. С другой стороны – затруднена локализация. В отличие от острой ноцицептивной боли, пациент часто не может сказать, где именно у него болит.
Такая боль бывает вызвана ростом опухоли или метастаза, когда они давят, например, на позвоночник или защемляют нервные корешки. Также причиной, к несчастью, могут быть и побочные эффекты противоопухолевого лечения.
- Дисфункциональная боль.
 Тот случай, когда органические причины боли отсутствуют, но она не уходит: например, опухоль уже удалили, заживление после операции прошло, а боль осталась. Бывает, что боль, по оценке самого пациента, гораздо сильнее, чем должна быть при его состоянии здоровья.
Тот случай, когда органические причины боли отсутствуют, но она не уходит: например, опухоль уже удалили, заживление после операции прошло, а боль осталась. Бывает, что боль, по оценке самого пациента, гораздо сильнее, чем должна быть при его состоянии здоровья.В таких случаях необходимо учитывать психологическое состояние пациента. Сильный стресс может заметно повлиять на изменения восприятия, вплоть до полностью психогенных болей.
Наша клиническая практика показывает, насколько сильно помогает в подобных случаях знание онкопсихологии. В России далеко не все врачи уделяют ей должное внимание, хотя именно в такой ситуации она помогает стабилизировать состояние пациента и уменьшить его мучительный болевой синдром.
Дополнительными усложняющими «бонусами» к основным видам боли при раке добавляются болезненные проявления побочных эффектов от самой противоопухолевой терапии:
- боль во время заживления после операций;
- спазмы и судороги;
- изъязвление слизистых;
- суставные и мышечные боли;
- кожные воспаления, дерматиты.

Современные врачи используют все более точно дозированную лучевую терапию, все более «аккуратные», таргетные препараты, все менее травматичную хирургию, чтобы уменьшить частоту и выраженность таких неприятных побочных эффектов. Сегодня мы в клинике проводим, например, гораздо больше хирургических вмешательств эндоскопическими и лапароскопическими методами – через тонкие проколы или совсем небольшие (1-1,5 см) разрезы в коже. Методы сводятся все к тому же: продлить пациенту нормальную жизнь.
Для выбора адекватной анальгезии врач должен понимать, насколько человеку больно, постараться понять, где именно болит и как долго. От этого зависят назначения в рецепте на обезболивание. Кроме уточняющих вопросов о характере и локализации боли, врач обязательно оценивает ее интенсивность.
Во всем мире для этого используют шкалы НОШ (нумерологическая оценочная шкала) и ВАШ (визуально-аналоговая шкала), либо гибридные варианты – в зависимости от возраста и состояния пациента. Совсем маленьким детям и очень пожилым людям, а также пациентам с когнитивными нарушениями бывает сложно ответить на стандартные вопросы. Иногда приходится работать с такими только по поведению и выражению лиц.
Совсем маленьким детям и очень пожилым людям, а также пациентам с когнитивными нарушениями бывает сложно ответить на стандартные вопросы. Иногда приходится работать с такими только по поведению и выражению лиц.
Шкала оценки боли от 0 (ничего не болит) до 10 (нестерпимо больно)
Важно при этом получить как можно больше дополнительной информации: если пациент считает, что терпеть – достойное занятие, а жаловаться – недостойное, или выяснится, что у пациента были периоды злоупотребления и зависимостей, это может внести коррективы в терапию болевого синдрома.
Мы уже затронули тему работы с психологическим состоянием больного, и коснемся ее еще раз – об этом важно помнить и врачам, и близким пациента. ВОЗ даже ввела для этого специальное понятие: суммарная боль. Она охватывает не только физические раздражители, но и эмоциональные и социальные негативные аспекты жизни пациента.
Боль онкопациента куда глубже и сложнее, чем кажется со стороны. Терапия боли – тот случай, когда врач должен относиться к субъективным оценкам пациента с особым вниманием.
Терапия боли – тот случай, когда врач должен относиться к субъективным оценкам пациента с особым вниманием.
Учитывая такой многокомпонентный пул причин для усиления боли, мировое врачебное сообщество признает наиболее удачной идею «мультимодальной» терапии – когда наряду с медикаментозным лечением применяют физическую активность по силам пациенту, техники релаксации и психотерапию. Все это создает условия, при которых боль перестает занимать в жизни пациента центральное место, уступая более важным и интересным сферам.
Наверное, каждый врач считает более правильными и удачными те препараты, которые оказались наиболее действенными в его личном практическом опыте. Но любой онколог, стремясь купировать болевой синдром, должен помнить про рекомендации ВОЗ для лечения онкологических болей.
Рекомендации эти были выстроены в виде трехступенчатой «лестницы» еще в 1986 году, и с тех пор основные постулаты остались неизменными.
Первая ступень. При слабой боли начинают с ненаркотических анальгетиков и нестероидных противовоспалительных средств и препаратов (НПВС/НПВП). Это привычные безрецептурные парацетамол, ибупрофен, аспирин и др. При мышечной и суставной боли назначают диклофенак и др.
Это привычные безрецептурные парацетамол, ибупрофен, аспирин и др. При мышечной и суставной боли назначают диклофенак и др.
Схема действия НПВС – они блокируют фермент циклооксигеназу, снижая синтез простагландинов, тем самым уменьшая чувствительность болевых рецепторов.
Такие препараты не вызывают привыкания и зависимости, но в большой дозировке могут навредить ЖКТ, поэтому бесконечно и бесконтрольно дозу увеличивать нельзя, чтобы не усложнить ситуацию желудочным кровотечением.
Вторая ступень. Далее, если боль усиливается, назначают кодеин и трамадол. Это «легкие» опиаты. Они действуют за счет того, что присоединяются к опиоидным рецепторам ЦНС и замещают там эндорфины.
Эндорфины – нейромедиаторы, одна из функций которых – тормозить передачу слабых болевых импульсов из спинного мозга в головной. Это позволяет нам не плакать от боли каждый раз, когда мы ставим локти на стол или спрыгиваем с высоты полуметра. Но при интенсивной боли выработка эндорфинов уменьшается. Опиоидные рецепторы освобождаются, нервные импульсы не тормозятся, человек испытывает боль.
Опиоидные рецепторы освобождаются, нервные импульсы не тормозятся, человек испытывает боль.
Так обычно ведет себя тормозящий вставочный нейрон – выделяет эндорфины, чтобы заблокировать входящий нервный импульс, чтобы мозг «не обращал внимания»
Трамадол принимают вместе с анальгином, парацетамолом и другими медикаментами первой ступени – эффект получается комплексным: одновременное воздействие и на центральную, и на периферическую нервную систему.
Важно, что трамадол, хотя и является опиатом – относится к ненаркотическим анальгетикам. Пациенту проще его получить и не нужно бояться потенциальной зависимости.
Третья ступень. На этой ступени оказываются врач и его пациент, когда ему уже перестали помогать слабые опиаты. В дело вступают сильные опиаты, основной – морфин. Сильные опиаты связываются с опиоидными рецепторами гораздо надежнее слабых, поэтому действуют мощнее. Однако, такой эффект стоит дорого: эти препараты уже могут вызывать зависимость – но только, если употреблять их неправильно и бесконтрольно.
Поэтому на третью ступень начинают взбираться так же постепенно. Назначают бупренорфин или фентанил, эффективность которых 50% и 75% относительно морфина – и вводят их строго по расписанию, начиная с минимальной дозы. Под контролем врача, при соблюдении рекомендованных дозировок и кратности приема, при плавном повышении «мощности» вероятность развития патологической зависимости крайне мала.
Важно, что на каждой ступени может использоваться так называемая адъювантная, то есть вспомогательная, терапия. Адъювантные препараты не обезболивают самостоятельно, но в сочетании с основными анальгетиками либо усиливают их действие, либо нивелируют побочные эффекты. В эту группу входят антидепрессанты, кортикостероиды, противорвотные и противосудорожные, антигистаминные и т.д.
Таким образом, ВОЗ дает основные принципы и рекомендации для плавного перехода со ступеньки на ступеньку, которые помогают избегать тупика в терапии – когда боль усиливается, а средств борьбы с ней уже не осталось.
Такое случается, если онколог назначает опиоидные препараты раньше времени или в дозе больше необходимого. Если прыгнуть с кеторола на промедол (как, к сожалению, делают некоторые врачи – кто по неопытности, кто из-за отсутствия нужных препаратов), то сначала эффект может превзойти ожидания. Но затем получается, что боль станет требовать увеличения дозировки быстрее, чем предписано безопасным режимом. Ступеньки закончатся раньше, чем вы пройдете нужное количество шагов. В этом случае врач сам у себя отнимает средства лечения.
Со стороны же пациента главная – огромная! – ошибка – это «терпеть до последнего». Особенно на Российских пациентах это заметно. Когда к нам приезжают лечиться из Прибалтики, например, у них уже нет этого лишнего партизанского «геройства».
И это правильно – говорить врачу о боли сразу. Потому что в лечении болевого синдрома есть один неприятный парадокс: чем дольше терпишь, тем сложнее от боли избавляться. Дело в том, что длительная долгая боль означает длительное и стойкое возбуждение одних и тех же проводящих нервных путей. Ноциогенные нервные клетки, скажем, «привыкают» проводить болевые импульсы и происходит их сенситизация – повышение чувствительности. В дальнейшем они легко отвечают болевым откликом даже на слабые и безобидные воздействия. С такой болью становится гораздо сложнее справиться.
Ноциогенные нервные клетки, скажем, «привыкают» проводить болевые импульсы и происходит их сенситизация – повышение чувствительности. В дальнейшем они легко отвечают болевым откликом даже на слабые и безобидные воздействия. С такой болью становится гораздо сложнее справиться.
Строго говоря, как раз уколы, сиречь инъекции, в современном обезболивании стараются не использовать. Выбирать для обезболивания самый болезненный метод введения как-то нелогично.
Поэтому все популярнее сейчас Трансдермальный метод введения – в виде пластырей.
В отличие от инъекций – максимально удобен для пациента. У него есть свои ограничения, конечно – по температуре тела, по количеству подкожно-жировой клетчатки, но в большинстве случаев он хорош:
- препарат (обычно фентанил) высвобождается постепенно, хватает на 72 часа;
- не требует контролировать время приема таблеток или введения препаратов;
- исключает передозировку (это важно для наркотического анальгетика).

Фентаниловый пластырь – сильное, безопасное и комфортное обезболивание
Медикаментозная блокада нервов и вегетативных сплетений. Анестетик, препарат для «заморозки», вводится непосредственно в место проекции нерва, по которому передается боль от пораженного раком органа. В зависимости от вида обезболивающего и нозологии (вида опухоли) делается это с разной частотой – от раза в неделю до одного раза в 6 месяцев. Метод широко распространен, поскольку у него почти нет противопоказаний.
Спинальная анестезия. Препарат (морфин, фентанил) вводится в канал позвоночника, где пролегает спинной мозг. Через спинномозговую жидкость и с кровотоком препарат поступает в мозг и «выключает» чувствительность, мышцы расслабляются. Метод используют при очень острой и интенсивной боли.
Эпидуральная анестезия. Да, ее делают не только беременным. Те же препараты, что при спинальной анестезии, вводят в полость между твердой мозговой оболочкой и стенками позвоночного канала. Эпидуральная анестезия используется на поздних стадиях, при метастатическом поражении костей, когда боль не снимается инъекциями и препаратами перорально.
Эпидуральная анестезия используется на поздних стадиях, при метастатическом поражении костей, когда боль не снимается инъекциями и препаратами перорально.
Паллиативная химио-, таргетная и лучевая терапия. Она используется не с целью разрушить опухоль, а с целью просто сделать ее меньше, чтобы освободить сдавленные нервные узлы, вызывающие боль.
Нейрохирургические методы. Нейрохирург надрезает корешки спинномозговых или черепных нервов. Это не приводит к утрате двигательной активности (хотя может потребовать реабилитации), но мозг лишается возможности получать болевые сигналы по этому пути.
Радиочастотная абляция (РЧА). В первом нашем посте, про паллиативную медицину, мы прикрепляли видео о том, как этот метод помог пациентке избавиться от болевого синдрома на последней стадии рака. Тогда РЧА применялась для того, чтобы разрушить метастазы, давившие на нервные корешки спинного мозга.
В случаях же, когда разрушить метастазы или саму опухоль невозможно, РЧА можно использовать для разрушения проводящих нервных путей. Это похоже на предыдущий вариант, только хирург действует не скальпелем, а специальной иглой, разогретой радиочастотными колебаниями до высокой температуры.
Это похоже на предыдущий вариант, только хирург действует не скальпелем, а специальной иглой, разогретой радиочастотными колебаниями до высокой температуры.
Нейролизис при помощи эндосонографии. Нейролизис – это разрушение нервного пути, проводящего боль, с помощью специальных химических растворов. Под контролем ультразвука эндоскоп подводят точно к чревному (солнечному) нервному сплетению через ЖКТ и разрушают часть нервных волокон. Обезболивающий эффект от процедуры наступает в 90% случаев при раке желудка или, например, поджелудочной железы. Сохраняется результат процедуры от месяца до года в редких случаях. Все зависит от скорости развития опухоли. При том, что в случае с применением препаратов-анальгетиков, их пришлось бы применять еженедельно.
Вертебропластика. Этот способ можем пояснить на живом примере из собственной практики. Повреждение позвоночника метастазами приводит к разрушению тела позвонка. Костная структура позвонка деформируется, происходит компрессия (сдавливание) спинномозговых корешков. Возникает корешковый компрессионный сидром, который сопровождается сильными болями. Вертебропластика укрепляет тело пораженного позвонка, чтобы он перестал давить на нервные корешки.
Возникает корешковый компрессионный сидром, который сопровождается сильными болями. Вертебропластика укрепляет тело пораженного позвонка, чтобы он перестал давить на нервные корешки.
Операция малоинвазивная, ее проводят под местным обезболиванием и контролем компьютерной томографии. В тело позвонка вводится специальная игла-канюля, одновременно специальным инструментов восстанавливается высота позвонка. В полость позвонка вводится костный цемент. Результат вмешательства также контролируется КТ исследованием. В 98% случаев вертебропластика устраняет болевой синдром сразу же после окончания операции. Период реабилитации минимальный, через пару часов пациент может принимать вертикальное положение.
Так что, вариантов помочь пациенту с болевым синдромом у хорошего онколога сегодня много. Мы убеждены, что вне зависимости от стадии его рака, человек может максимально долго иметь нормальное качество жизни, без ограничений и страданий.
Проблема недостаточного обеспечения сильными анальгетиками больных с тяжелыми диагнозами – одна из самых, уж извините, больных проблем в российской онкологии в частности и паллиативной медицине в целом.
Да, вы скажете, что у нас-то в частной клинике все эти процессы налажены, пациентам и их близким не приходится тратить недели на то, чтобы «выбить» из врача необходимый штамп на рецепте, а потом отвоевать у аптеки бесплатную упаковку препарата. Но наши врачи по многу лет работали в государственных больницах, к нам каждую неделю поступают пациенты, которые только что оттуда, так что тяжесть ситуации нам ясна.
После самоубийства контр-адмирала Апанасенко в 2014 начались какие-то подвижки, но далеко не все так радужно, как обещалось.
Препараты из группы наркотических анальгетиков (а мы помним, на 3 ступени помогают уже только они) многие врачи просто не хотят выписывать – потому что боятся. Все помнят резонансное дело Алевтины Хориняк. Ее полностью оправдали, но многие боятся так же попасть под суд за якобы «незаконный оборот».
Пациенты, в свою очередь, боятся принимать трамадол, считая его чем-то аналогичным героину. Надеемся, часть статьи, где мы поясняем про «лестницу» ВОЗ – немного упорядочила эти сведения в головах граждан.
Чтобы страха, а значит, и потенциальной ненужной боли, не осталось, давайте разъясним, какой порядок действий, нужный для получения наркотического препарата.
Кто выписывает рецепт?
- врач-онколог,
- участковый терапевт,
- врач любой специальности, который прошел обучение работе с наркотическими и психотропными веществами.
Сколько действует рецепт?
15 дней. Хватает на любые «каникулы». Но если он нужен срочно, то его могут выписать и в праздник, и в выходной.
Нужно ли сдавать ампулы?
Нет. По закону, никто не вправе требовать от пациента или его родных сдавать использованные ампулы, пластыри и упаковки от наркотических анальгетиков.
Может кто-то из родственников получить рецепт и препарат от имени больного?
- Чтобы выписать рецепт, врач должен провести осмотр. Но если пациент не может добраться до больницы, он имеет право вызвать врача на дом.

- За печатью все же придется отправить кого-то из близких в поликлинику – печать лечебного учреждения на рецепте обязательна.
- Получить препарат в специально указанной аптеке может как сам пациент, так и его доверенное лицо (с паспортом и копией паспорта пациента)
Что делать, если возникли сложности с получением обезболивающего?
- Звонить на горячую линию Министерства здравоохранения: 8-800-200-03-89,
- Росздравнадзора: 8-800-500-18-35,
- В страховую компанию, у которой оформлен ваш полис ОМС.
В заключение хочется как-то обобщить все сказанное по этой тяжелой теме:
- Боль нельзя терпеть! Не нужно бояться слов «наркотические анальгетики», при разумном подходе и соблюдении рекомендаций грамотного врача пациент не рискует сформировать зависимость. Согласно информационным письмам Минздрава РФ, все пациенты должны быть обезболены.
- Современные обезболивающие средства в сочетании с адъювантными препаратами дают врачу массу вариантов успешно купировать болевой синдром.
 Серьезный багаж опыта «Медицины 24/7» подтверждает: даже на последних стадиях онкологического процесса, даже у неизлечимых пациентов – практически всегда остается возможность сохранить человеку ясное сознание и нормальное качество жизни без страданий.
Серьезный багаж опыта «Медицины 24/7» подтверждает: даже на последних стадиях онкологического процесса, даже у неизлечимых пациентов – практически всегда остается возможность сохранить человеку ясное сознание и нормальное качество жизни без страданий. - За последние 4 года немного упростилась процедура получения препаратов для пациентов, хотя для самих бюджетных медучреждений все по-прежнему предельно бюрократизировано. Упразднили ФСКН, что также облегчило жизнь медикам. Да, работы впереди масса. Например, сформировать, наконец, единый реестр пациентов, нуждающихся в наркотических анальгетиках, о котором говорят с 2015 года. Но сдвиги в сторону облегчения процедуры получения рецептурных обезболивающих в России есть.
Пусть у вас еще очень-очень долго ничего не болит!
общее и местное обезболивание при онкологии
Даже те, кто, к счастью, никогда не сталкивался с онкологическими заболеваниями, знают, что сильная боль — обязательный симптом рака. На поздних стадиях боли становятся настолько сильными, что никакие привычные препараты уже не помогают. Для обезболивания при онкологии разработаны особые методы и схемы купирования болевого синдрома.
На поздних стадиях боли становятся настолько сильными, что никакие привычные препараты уже не помогают. Для обезболивания при онкологии разработаны особые методы и схемы купирования болевого синдрома.
Боль — мрачный спутник рака
Боль при онкологии связана с распространением опухолей и их воздействием на расположенные рядом органы. Однако болезненные ощущения проявляются далеко не сразу. Нередко на ранних стадиях рака человека вообще ничего не беспокоит. В этом и заключается коварство и опасность онкологических заболеваний — долгое время они могут протекать бессимптомно. Боль при раке вызывают и воспалительные процессы, и операции, и сопутствующие поражения — артриты, невралгии и другие. По статистике каждый третий пациент, получающий адекватное лечение, все же страдает от болевого синдрома.
Статистические данные
Только в России диагноз «рак» поставлен более чем трем миллионам человек. И распространенность его растет — в среднем на 2–3% в год.
По мере развития рака боль проявляется и усиливается, может быть локализована в нескольких очагах, может быть хронической или периодической. В конце концов она становится нестерпимой, способна даже привести к депрессии и суицидальным мыслям. Боль трудно измерить, поэтому для оценки ее интенсивности обычно используется десятибалльная шкала, где 0 — отсутствие боли, а 10 — невыносимая боль. При оценке интенсивности болевых ощущений врач может ориентироваться только на субъективные ощущения пациента.
Кстати
От 60% до 90% онкологических больных на поздних стадиях развития болезни не получают соответствующего обезболивания.
Виды обезболивающих препаратов при онкологии
Для обезболивания при онкологии применяются различные группы лекарственных препаратов:
- Наркотические обезболивающие — сильные препараты, использующиеся при интенсивных болях. К более мягким наркотическим средствам относятся кодеин, буторфанол, трамадол и тримеперидин, к сильным — морфин и бупренорфин.

- Ненаркотические средства — легкие анальгетики, среди которых ацетилсалициловая кислота, салициламид, индометацин, парацетамол, диклофенак, ибупрофен, напроксен и фенилбутазон. Эффективны только при незначительных болях.
- Вспомогательные препараты — не являются собственно обезболивающими, но входят в комплексное лечение болевого синдрома. К таким препаратам относятся антидепрессанты, кортикостероиды, противовоспалительные, жаропонижающие и другие средства.
Выбор метода обезболивания: трехступенчатая система ВОЗ
Сегодня практически во всем мире применяется трехступенчатая система обезболивания при онкологии, рекомендованная Всемирной организацией здравоохранения.
Суть метода в том, что лечение болевого синдрома начинается с мягких препаратов, которые постепенно заменяются более сильными средствами. Терапия предполагает совместное использование обезболивающих и вспомогательных средств и должна начинаться при первом же появлении болезненных ощущений, даже если сам пациент считает, что они слишком слабые и внимания не заслуживают. Своевременное начало обезболивающей терапии — главное условие для достижения положительных результатов.
Своевременное начало обезболивающей терапии — главное условие для достижения положительных результатов.
- Первая ступень — нестероидные противовоспалительные средства, снимающие незначительную боль.
- Вторая ступень — комбинация ненаркотических обезболивающих и слабых опиатных препаратов.
- Третья ступень — наркотические опиатные обезболивающие.
Чтобы купировать болевой синдром, препараты нужно принимать регулярно, своевременно корректируя дозировку и соотношение разных средств.
Современные технологии снятия боли при раке: от местных методов обезболивания до общих
Медицина не стоит на месте, постоянно разрабатываются новые методы обезболивания при онкологии. Вот некоторые из последних разработок:
Обезболивающие пластыри . Это трансдермальное средство рекомендовано при постоянных болях, оно содержит сильные анальгетики. Время действия одного пластыря — примерно трое суток. Несмотря на кажущуюся простоту — средство выглядит как обычный пластырь — применять его нужно крайне осторожно и строго под контролем врача. Ведь пластыри хоть и способны справляться со своей задачей, при их использовании высок риск возникновения побочных эффектов.
Ведь пластыри хоть и способны справляться со своей задачей, при их использовании высок риск возникновения побочных эффектов.
Блокады нервов местными анестетиками . Метод предполагает введение анестетика в область нерва, связанного с пораженным органом.
Эпидуральная анестезия . Подразумевает установку эпидурального катетера и регулярное введение анестетика в эпидуральное пространство между твердой оболочкой и надкостницей спинного мозга. Такой тип анестезии блокирует нервные корешки на определенном участке.
Спинальная анестезия выполняется аналогичным образом, но анестетик вводится непосредственно под оболочку спинного мозга, в субарахноидальное пространство. Эта анестезия мощнее и действеннее эпидуральной, эффект проявляется быстрее и действует дольше, но у нее намного больше противопоказаний, да и риск появления осложнений выше.
Химический нейролизис . Метод предполагает химическое «уничтожение» нервов, иннервирующих пораженную область.
Введение препаратов в миофасциальные триггерные пункты помогает снять мышечную боль посредством точечных инъекций анестетиков.
Нейрохирургические вмешательства показаны в случаях, когда медикаментозная терапия оказывается недостаточно эффективной. При таких операциях разрушаются нервные пути, которые передают сигналы в мозг.
Болью можно управлять, и опытный врач способен значительно уменьшить болевой синдром, однако обезболиванию при онкологии у нас уделяется очень мало внимания. Между тем 90% пациентов, страдающих от болей, можно помочь. Увы, в государственных больницах нередко не хватает специалистов и современных медикаментов.
Управление болью — процесс очень деликатный. Недостаточно просто дать таблетку — врач должен точно знать, какой источник у боли, что стало ее причиной, какое количество препарата необходимо на данном этапе. При небрежном отношении к решению этой проблемы пациенты часто получают чрезмерные дозы препаратов — боль уходит, но очень скоро возвращается снова, а повышать дозировку уже нельзя. Именно поэтому для купирования болевого синдрома следует обращаться к специалисту, который занимается именно этим вопросом.
Именно поэтому для купирования болевого синдрома следует обращаться к специалисту, который занимается именно этим вопросом.
Диклофенак вызывает рак. Лечение рака: поиски новых средств продолжаются. Надежда есть! Сильные обезболивающие при раке: список препаратов
Соответствующие обезболивающие при раке помогают сохранить психоэмоциональное и физиологическое состояние, которое способен разрушить болевой синдром. Ведь это заболевание каждый год убивает миллионы человек, и у большей части из них на поздних стадиях недуга начинаются сильные боли.
Сильные обезболивающие при раке: список препаратов
Онкобольные в большинстве случаев страдают от боли из-за роста раковых опухолей, реже — от противоопухолевого лечения. Иногда болевой синдром никак не связан с заболеванием и его врачеванием.
Нередко достаточно трудно оценить степень болевого синдрома и встает вопрос, какие при раке способны помочь, чтобы достичь положительного эффекта. Наиболее эффективно проявил себя прием таких медикаментов, как:
- «Аспирин».

- «Седалгин».
- «Пенталгин».
- «Диклофенак».
- «Интебан».
- «Метиндол».
- «Метамизол».
- «Фенилбутазона».
На более поздних этапах боль возможно унять только более действенными средствами. Часто больному способны облегчить состояние лишь сильные обезболивающие при раке на последней стадии. Здесь наиболее эффективен прием:
- «Оксикодона».
- «Трамадола».
- «Дионина».
- «Трамала».
- «Дюрогезика».
- MST-Continus.
- «Морфия».
- «Морфина» и его производных.
Особенности применения обезболивающих препаратов
При различных стадиях болевого синдрома применяются различные группы средств. Медикаменты могут быть ненаркотическими и наркотическими. К первой группе относят анальгетики (некоторые из них отпускают только по рецепту). Ко второй группе относят опиаты, которые также имеют различную степень воздействия. Однако, чтобы лечение дало результат, при раке нужно принимать по утвержденной схеме:
- Ненаркотические препараты в сочетании с адъювантными, поддерживающими средствами.

- Слабые опиаты в тандеме с ненаркотическими и поддерживающими препаратами.
- Сильные опиаты (морфин и его аналоги) в сочетании с ненаркотическими и адъювантными средствами.
Использование такой схемы способствует правильному подбору дозировок, благодаря чему достигается положительный эффект, облегчающий страдания пациента.
Часто обезболивающие при раке вводят внутривенно или внутримышечно, поскольку при таком способе эффект достигается быстрее, чем при приеме таблетированных средств.
Боли, которые сопровождают больного онкологическими патологиями, принято разделять на слабые, средние и сильные. Поэтому и обезболивающие при ракеподразделяются на две группы: ненаркотические и наркотические препараты. Причем последние могут быть слабыми и сильными. Абсолютно все обезболивающие при раке комбинируют с адъювантами, которые включают в себя стабилизирующие компоненты, поддерживающие организм онкологического больного и способные усилить эффект основных лекарств.
Ненаркотическая группа обезболивающих средств
Обезболивающие препараты при раке на начальной стадии избавляют пациентов от болевого синдрома без выраженных побочных эффектов. Ненаркотические препараты способны подавлять факторы, влияющие на появление болей. Однако они имеют границы обезболивания и увеличение дозы не приведет к положительному результату, а также усилит воздействие побочных эффектов на организм. Поэтому при раке может назначать только врач. Все медикаменты этой группы подразделяются на легкие и сильные.
Легкие ненаркотические препараты применимы на начальной стадии развития заболевания, когда у больного еще нет ярко выраженного болевого синдрома. Обычно вначале назначают при раке, снижающие степень болевого синдрома. Рекомендуют прием:
- «Парацетамола».
- «Аспирина».
- «Седалгина».
- «Пенталгина».
- «Феназона».
- «Панадола»
- «Нурофена», «Мига» и других.
На сегодняшний день разработаны обезболивающие препараты при раке, способные облегчить страдания пациентов. Но они могут вызывать побочные эффекты, поэтому следует придерживаться определенных дозировок.
Но они могут вызывать побочные эффекты, поэтому следует придерживаться определенных дозировок.
Побочные эффекты
«Анальгин» назначается в количестве до тысячи миллиграмм каждые три-четыре часа. Дозировка других анальгетических препаратов и «Парацетамола» может быть вполовину ниже, а интервал между приемами увеличивается до пяти-шести часов.
Побочные эффекты от приема «Аспирина» выражаются в аллергических реакциях, желудочно-кишечных аномалиях, нарушениях работы системы гемостаза, которая ответственна за уровень свертываемости крови.
При передозировке «Парацетамола» и его аналогов может наблюдаться токсическое поражение печени.
Какие обезболивающие помогают при раке: средняя степень интенсивности
Сильные ненаркотические средства врач назначает, когда состояние пациента ухудшается и боли становятся сильнее. На этом этапе начинается прием:
- «Мелоксикама».
- «Теноксикама».
- «Пироксикама».
- «Индометацина».
- «Диклофенака».

- «Метиндола».
- «Интебана».
- «Метамизола».
- «Фенилбутазона».
- «Напросина»
- «Бруфена».
- «Вольтарена».
Наибольшей эффективности эти препараты достигают в сочетании с анальгетиками, особенно когда боль вызвана распространением метастазов на кости. Однако действие ненаркотических препаратов ограниченно, и они не способны снять сильную боль. Поэтому, когда неприятные ощущения усиливаются, в бой вступают более сильные обезболивающие при раке.
Наркотическая группа обезболивающих средств
Наркотические препараты относят к тяжелой артиллерии при борьбе с болью. Их назначают только в крайнем случае, поскольку они не только снимают боль, но и наносят непоправимый вред организму больного на физиологическом и психологическом уровне. При назначении наркотических препаратов необходимо соблюдать строгую последовательность, начиная с самых легких. А когда такие уже не способны помочь, переходят на более сильные обезболивающие. При раке прием опиатов должен контролировать лечащий врач, который следит за изменениями в состоянии пациента, и, в случае выявления непереносимости или передозировки, оказывать необходимую помощь.
Опиаты — это специальная группа средств, которые можно применять на различных стадиях рака. При помощи опиатов купируются сильные и умеренные болевые ощущения. Нередко прием таких препаратов запрещен на дому без присмотра ответственного медработника.
Когда приходит черед опиатов, лечение проходит по принципу: от легких к сильным. Под первой группой наркотических препаратов подразумевается назначение:
- «Оксикодона».
- «Трамадола».
- «Дионина».
- «Трамала».
- «Кодеина».
- «Дигидрокодеина».
- «Гидрокодона».
Фармакологическая форма таких препаратов может быть таблетированная, капсулированная, инъекционная. Встречаются капли и свечи. Самого быстрого эффекта достигают посредством инъекций. Средняя дозировка опиатов составляет от 50 до 100 мг с интервалом в 4-6 часов.
При особенно выраженном болевом синдроме, когда легкие опиаты уже не способны справиться, на помощь приходят сильные наркотические препараты. Распространено применение:
- «Фентанила»
- «Бупренорфина»
- «Просидола»
- «Норфина»
- «Дюрогезика»
- MST-Continus
- «Морфия»
- «Морфина» и его производных.

Применение таких препаратов неизбежно ведет к зависимости, и пациенту приходится постоянно увеличивать дозировку для поддержания эффекта.
Все наркотикосодержащие средства отпускаются исключительно по рецепту врача, их использование строго контролируется и учитывается. Для отчетности представители пациента заполняют соответствующие бумаги и предоставляют использованные ампулы. Для облегчения контроля такие препараты выдаются в ограниченном количестве, рассчитанном на определенный промежуток времени.
Если ненаркотические обезболивающие назначаются при любой онкологической патологии, то сильные наркотические препараты применяют исходя из вида рака, чтобы не усугубить ситуацию и не навредить пациенту.
Адъювантные средства
В группу адъювантных (вспомогательных) препаратов, которые имеют большое значение при применении обезболивающих средств, входит множество медикаментов различной направленности. Для комплексного лечения эффективно назначение:
- антидепрессантных или успокоительных;
- противосудорожных;
- антигистаминных;
- противовоспалительных;
- жаропонижающих.

Они призваны усилить эффективность и одновременно снизить риск возникновения побочных эффектов от применения сильных обезболивающих средств при онкологии.
Рак легких: чем снять боль?
Рак легких — одно из самых частых проявлений онкологии, которое часто диагностируется уже на поздних стадиях, когда избавить от болевого синдрома помогают только сильные обезболивающие препараты. Особой популярностью пользуется назначение таких средств, как:
- «Фентанил».
- «Морфий».
- «Омнопон».
- «Бупренорфин».
Сильные обезболивающие при раке легкихпринимают под строгим контролем врача.
Рак желудка: как облегчить страдания?
Сильные обезболивающие при раке желудка также назначает и контролирует лечащий врач. Достаточно часто рекомендуют прием:
- «Морфия».
- «Фентанила» или «Альфантанила»
- «Оксикодона» при болях в костных тканях.
- «Метадона» при болях в нервных тканях.
Сильные обезболивающие подбираются исходя из индивидуальной ситуации и локализации болевого синдрома.
Обезболивание при раке груди
Достаточно широкое распространение приобрел рак молочной железы. Обезболивающее при ракегруди также назначает врач, исходя из общего состояния пациентки. Лучший эффект с наименее выраженными побочными действиями наблюдался при приеме:
- «Метадона».
- «Фентанила».
- «Оксикодона».
- «Меперидина».
- «Кодеина».
Также было отмечено, что правильные дозировки этих препаратов при такой опухоли у некоторых женщин не вызывали зависимости и потребности в повышении дозы.
Основные правила обезболивания
Для достижения максимального эффекта от приема обезболивающих средств следует придерживаться некоторых правил:
- Обезболивающие препараты при раке нужно принимать, придерживаясь строгого графика и дозировок. Это позволяет достичь максимального эффекта при минимальном суточном количестве.
- Прием медикаментов следует начинать с легких и постепенно переходить на сильные.
- Обязательно применение вспомогательных средств, которые способны усилить эффект и ослабить проявление побочных явлений.

- Проведение профилактики побочного действия препаратов.
Обезболивающий пластырь в онкологии
Иногда онкобольным следует применять быстродействующие анальгетики. При наиболее эффективным является «Фентанил». И если по каким-то причинам пациенту невозможно сделать укол, то на помощь приходит пластырь с этим лекарством.
Из пластыря обезболивающие компоненты выделяются на протяжении трех суток. Наибольшая эффективность достигается спустя 12 часов после наложения. Дозировка препарата рассчитывается индивидуально, а важным фактором при этом является возраст.
Выручает в тех случаях, когда больному сложно глотать или есть по причине повреждения вен. Некоторым пациентам такой вид обезболивания просто удобен.
Злокачественные новообразования и метастазы вызывают необратимые изменения и деградацию здоровых тканей. При этом повреждаются нервные окончания и возникают воспалительные процессы, которые сопровождаются сильными болями. Чтобы как-то помочь пациенту поддержать его психологическое и физическое состояние, во время лечения назначаются анестетики. Какие обезболивающие можно при раке, врач определяет индивидуально в зависимости от стадии заболевания и восприимчивости к действующим веществам.
Какие обезболивающие можно при раке, врач определяет индивидуально в зависимости от стадии заболевания и восприимчивости к действующим веществам.
Международный проект Repurposing Drugs in Oncology (ReDO) обнаружил существенный противораковый эффект у известного обезболивающего и противовоспалительного препарата диклофенака. Результаты работы опубликованы в ecancermedicalscience .
Диклофенак относится к нестероидным противовоспалительным препаратам (НПВП), которые долгое время интересовали ученых как потенциальные средства профилактики онкологических заболеваний. Выяснилось, что диклофенак может найти применение в лечении уже развившихся опухолей.
Сотрудники ReDO провели метаанализ работ, посвященных противоопухолевому эффекту диклофенака, и пришли к выводу, что этот эффект можно считать несомненным. В силу хорошо изученной фармакокинетики, относительно низкой токсичности и невысокой стоимости препарата, ученые отнесли его к сильным кандидатам на применение в качестве средства химиотерапии.
Первое исследование противораковых свойств препарата на животной модели относятся еще к 1983 году, когда его испытали на крысах с имплантированной фибросаркомой — было зафиксировано замедление роста опухоли. Более поздние исследования на животных и культурах человеческих клеток показали, что диклофенак может подавлять деление раковых клеток при раке толстой и прямой кишок, нейробластоме, раке яичника, глиоме, раке поджелудочной железы, меланоме и раке простаты.
Поскольку
диклофенак используется для обезболивания при онкологических заболеваниях и
после операций по их поводу, было проведено несколько ретроспективных
исследований, в которых сравнивались результаты лечения пациентов, получавших и
не получавших диклофенак. Оказалось, что назначение препарата статистически
достоверно снижало вероятность дистанционного метастазирования и общую
смертность у пациентов с опухолями груди, легкого и почки; резко уменьшало
концентрацию CA 19-9 (биомаркера аденокарциномы
поджелудочной железы) в крови и замедляло прогрессирование заболевания, а также значительно уменьшало
размеры новообразований при агрессивном фиброматозе.
По мнению ученых, противоопухолевые эффекты диклофенака многообразны. В первую очередь они связаны с его непосредственным действием как ингибитора циклооксигеназы (ЦОГ), в частности второго ее типа. Этот фермент синтезирует простагландины. Один из них — простагландин Е2 — обнаружен во множестве новообразований, где он поддерживает хроническое воспаление, формируя микросреду опухоли. Влияние разных НПВП на ЦОГ-2 сильно различается, причем диклофенак связывается с ней особенно хорошо.
Помимо этого за противоопухолевую активность диклофенака могут отвечать такие его эффекты, как подавление роста питающих опухоль сосудов, иммуномодуляция, стимуляция апоптоза (естественной гибели клеток, нарушающейся при раке), подавление активности тромбоцитов и метаболизма глюкозы, а также повышение чувствительности раковых клеток к лучевой и химиотерапии.
Собранные данные
пробудили серьезный интерес ученых к противораковым свойствам диклофенака, и в
настоящее время идут четыре его клинических испытания по этому показанию, при
чем одно из них — уже фазы IIB (в ней исследуют эффективность лекарства в
заданной дозе).
ReDO — это международный проект, созданный с целью поиска противораковых свойств у препаратов, которые применяются или применялись по другим поазаниям. Предпочтение отдается лекарствам, которые широко доступны и недороги.
Диклофенак — «классическое» обезболивающее и противовоспалительное средство, разработанное и выведенное на рынок в 1973 году компанией Ciba-Geigy, сейчас входящей в концерн Novartis. Он широко применяется при различных болях, ревматоидных заболеваниях, поражениях опорно-двигательного аппарата и кератозах. Выпускается в таблетках, суппозиториях, инъекциях, мазях и глазных каплях, в ряде стран отпускается без рецепта.
Проект Repurposing Drugs in Oncology (ReDO), который изучает препараты в онкологии, перепрофилировался на препараты, которые уже широко используются для лечения разных заболеваний. Это связано с тем, что они являются неиспользованными источниками для лечения рака.
В исследовании, опубликованном в журнале Еcancermedicalscience, эксперты показали результаты их работы с болеутоляющим диклофенаком. Помимо того, что это недорогое и легкодоступное лекарство, оно уже зарекомендовало себя на рынке. Соответственно уже прошло тщательное тестирование на безопасность. Легкость доступа диклофенака может гарантировать, что больше больных раком получат необходимое им лечение.
Помимо того, что это недорогое и легкодоступное лекарство, оно уже зарекомендовало себя на рынке. Соответственно уже прошло тщательное тестирование на безопасность. Легкость доступа диклофенака может гарантировать, что больше больных раком получат необходимое им лечение.
Как нестероидный противовоспалительный препарат (НПВП), диклофенак используется для лечения боли при ревматоидном артрите, лихорадке, мигрени и острой подагре, а также послеоперационных болях.
НПВП показали потенциал в предотвращении рака, но недавнее исследование также намекнули на эффективность этих препаратов в самом лечении этого заболевания. Например, диклофенак может применяться вместе с таким лечением, как химио- и лучевая терапии.
Ученые полагают, что есть достаточно доказательств того, чтобы поддержать запуск клинического испытания для изучения использования диклофенака в качестве лечения рака. Пан Пантзарка (Pan Pantziarka), один из авторов исследования, говорит: «Чем больше мы узнаем, тем больше мы видим, что эти агенты с интересными и полезными эффектами могут применяться в онкологии».
Диклофенак имеет несколько механизмов действия, особенно те, которые касаются иммунной системы и кровеносных сосудов, и поэтому он имеет огромный потенциал в качестве лечения рака.
Смертельными для пациентов являются метастатические заболевания, а не первичный рак, сокращая метастазы с помощью таких лекарства, как диклофена, можно будет сделать огромный толчок в борьбе с болезнью.
Коментарии:
Оценка уровня боли при раке
Уровень боли адекватно оценить может лишь тот, кто ее испытывает. К тому же ощущения больные испытывают разные: сверление, резь, покалывание, пульсация, жжение и пр. Для того, чтобы эти переживания лучше понял врач, пользуются наглядной шкалой болевых уровней (см. рис).
Шкала болевых уровней от 0 до 10
По происхождению боли при онкологии бывают:
- Висцеральные боли . При новообразованиях в брюшной полости. Ощущения сдавливания, распирания, боль ноющая или тупая, не имеющая четкой локализации.
- Соматические боли.
 Развиваются в сосудах, суставах, костях, нервах. Продолжительная, тупая боль.
Развиваются в сосудах, суставах, костях, нервах. Продолжительная, тупая боль. - Невропатические боли . Возникают при повреждении нервной системы: центральной и периферической.
- Психогенные боли. Появляются на фоне депрессии, страха, самовнушения, без какого-либо органического повреждения, как правило обезболивающие здесь не помогают.
Причины и механизм боли при онкологическом заболевании
По мере роста и увеличения в размерах опухоль оказывает давление на близлежащие ткани и органы, раздражая периферические нервные рецепторы. При онкологии последней стадии, когда организм поражается метастазами, боли могут быть вызваны нарушением в работе головного мозга и всех жизненно важных органов.
Причины зависят от этиологии болевых ощущений:
- Соматические – образуются при поражении кровеносных сосудов, сухожилий и связок, нервов. Боль носит тупой, приглушенный, но постоянный характер.
- Психогенные – формируются на фоне эмоционального угасания, когда человек осознает неизбежность своего положения.
 Боли различной локализации и интенсивности, что невозможно устранить с помощью медикаментозной терапии.
Боли различной локализации и интенсивности, что невозможно устранить с помощью медикаментозной терапии. - Висцеральные – связаны с опухолями в грудине и брюшине. Сопровождаются чувством распирания, не имеют четкой локализации (разлитая боль).
- Невропатические – образуются при поражениях центральной и периферической нервной системы.
Механизм развития боли связан с раздражением нервных рецепторов и неправильным восприятием информации, в ответ на которую головной мозг формирует болевой приступ.
Онкобольные очень мучаются и страдают. Смерть наступает не от прогрессирования самого рака, а от невозможности терпеть мучения и истощения организма. Облегчить такое состояние помогают лекарства.
Что делать?
В случае, если онкология подтверждена гистологически, есть диагноз и пациент наблюдается онкологом:
- на стационарном этапе за обезболивание отвечает отделение, в котором человек оперируется или лечится,
- если пациент в поликлинике наблюдается терапевтом, а в онкодиспансере онкологом или передан для наблюдения врачу противоопухолевого кабинета поликлиники, ему следует вместе со всеми выписками и медкартой обратиться к врачу-анальгологу (чаще всего в онкодиспансере).
 Сделать это следует, даже если нет болей. Анальголог расписывает поэтапную схему обезболивания, которой станет придерживаться наблюдающий больного врач.
Сделать это следует, даже если нет болей. Анальголог расписывает поэтапную схему обезболивания, которой станет придерживаться наблюдающий больного врач.
Если рак еще не подтвержден — нет подтвержденного гистологией диагноза, но есть боль – также стоит обратиться к анальгологу и получить рекомендации, закрепленные письменно в меддокументации (запись в амбулаторной карте, выписку).
- Если к анальгологу еще не обращались, но есть боль – обращайтесь к участковому терапевту. В его силах назначить ненаркотические анальгетики и сопутствующие препараты, снимающие или ослабляющие болевые ощущения.
- Если ранее применялись ненаркотические анальгетики, но их эффекта недостаточно, следует незамедлительно получить рекомендации анальголога, с которыми обращаются к терапевту по месту жительства, реже – к врачу противоопухолевого кабинета поликлиники.
Без рецепта на сегодня в аптеке можно получить разве что нестероидные противовоспалительные (ниже есть инструкция как своевременно получить необходимые обезболивающие для больного раком).
Степени боли и препараты
Выбор того или иного лекарства зависит от степени неприятных ощущений. У каждого пациента имеется свой болевой порог, что является сугубо индивидуальным показателем. Поэтому доктор подбирает те препараты, которые способны купировать боль у конкретного пациента.
Назначаются анальгетики из группы НПВС, которые справляются с болью, жаром, отечностью. Самыми эффективными из них являются:
- Анальгин;
- Нимесулид;
- Парацетамол.
Нимесулид – один из видов обезболивающих препаратов при онкологии
Их употребляют в виде таблеток, начиная с минимальных дозировок. Курс приема рассчитан так, что терапевтический эффект достигается при накоплении в организме всех веществ лекарства. Выбор дозы зависит от возраста, массы тела и склонности к аллергическим реакциям.
Поскольку таблетки абсорбируются из пищеварительного тракта, их прием осуществляется после приема пищи. Метаболизм клетками печени диктует необходимость параллельно принимать гепатопротекторы.
Усилить эффективность препаратов НПВС может папаверин, который купирует спазм сосудов и способствует активному усвоение микроэлементов лекарства.
В качестве вспомогательных лекарств, которые назначаются для снижения нагрузки на все органы и системы, являются:
- Кортикостероиды – улучшают аппетит и усиливают обезболивающий эффект.
- Противосудорожные – препятствуют спазму сосудов и гладких мышц.
- Нейролептики – купируют приступы тошноты и рвоты, усиливая анальгезирующий эффект.
- Миорелаксанты центрального действия – расслабляют организм, нормализуя сон.
Необходимость использования того или иного лекарственного средства обусловлена особенностями течения онкологического заболевания.
Нестероидные противовоспалительные средства не способны обезболить до нужного состояния, поэтому назначаются слабые опиоидные препараты, содержащие наркотические вещества. Их принцип действия основан на воздействии на центры формирования боли в головном мозге, что вызывает полное отсутствие неприятных ощущений в теле.
В последнее время в терапии онкобольных использовали препарат Трамадол. Сейчас склоняются к использованию лекарства Залдиар, который содержит минимальные дозы опиоида в сочетании с Парацетамолом, что позволяет достичь комплексного терапевтического эффекта.
Трамадол может одновременно вводиться вместе с Димедролом в виде инъекции. Это ускорит процесс обезболивания и снизит нагрузку на пищеварительный тракт.
Когда пациент находится на грани, нужно максимально быстро нормализовать состояние. Для этого используют такие наркотические препараты, как:
- Пиритрамид;
- Трамадол;
- Фентонил;
- Морфин.
Последний препарат является самым быстродействующим. Его терапевтическая эффективность сохраняется в течение 5-6 часов.
Опиоидные анальгетики комбинируют с неопиоидными, что позволяет достичь максимального обезболивающего эффекта.
Ключевым недостатком всех опиоидов является привыкание. Клетки организма не могут больше существовать без лекарства, которое купирует боль. Развивается медикаментозная зависимость, которая проходит только после наступления летального исхода.
Клетки организма не могут больше существовать без лекарства, которое купирует боль. Развивается медикаментозная зависимость, которая проходит только после наступления летального исхода.
Стандартные схемы противоболевой терапии
При каждом осмотре онкологического больного лечащий врач оценивает его субъективное ощущение боли и в назначении обезболивающих движется по трехступенчатой лестнице снизу вверх. Не обязательно двигаться по ступеням последовательно. Наличие сильной нестерпимой боли сразу предполагает переход к ступени 3.
1 Ступень — слабая боль 2 ступень — сильная боль 3 ступень — нестерпимая боль
Выбор способа введения лекарства
- Таблетированные препараты при онкологии и капсулы удобны почти всегда, кроме случаев затрудненного глотания (например, при раке желудка, пищевода, языка).
- Накожные формы (пластыри) позволяют постепенно всасываться препарату без раздражения слизистых ЖКТ и наклеивании пластыря один раз в несколько дней.

- Инъекции чаще выполняются внутрикожно или (когда есть нужда в быстром устранении болевых ощущений) внутривенно (например, рак кишечника).
При любом пути введения подбор дозировок и кратности подачи лекарства ведется индивидуально с регулярным контролем качества обезболивания и наличия нежелательного действия веществ (для этого осмотр больного показан не реже, чем раз в десять суток).
- Обезболивающие уколы представлены: Трамадолом, Тримеперидином, Фентанилом, Бупренорфином, Буторфанолом, Налбуфинлм, Морфином.
- Комбинированным средством: Кодеин Морфин Носкапин Папаверина гидрохлорид Тебаин.
Неинъекционные варианты опиоидных обезболивающих:
- Трамадол в капсулах по 50 мг, таблетках по 150, 100, 200 миллиграмм, свечах ректальных по 100 миллиграмм, каплях для приема внутрь,
- Парацетамол Трамадол капсулы 325 мг 37,5 миллиграмм, таблетки, покрытые оболочкой 325 мг 37,5 миддиграмм,
- Дигидрокодеин таблетки продленного действия 60, 90, 120 мг,
- Пропионилфенилэтоксиэтилпиперидин в защечных таблетках по 20 миллиграмм,
- Бупренорфин пластырь накожный 35 мкг / час, 52,5 мкг / час, 70 мкг / час,
- Бупренорфин Налоксон подъязычные таблетки 0,2 мг/0,2 мг,
- Оксикодон Налоксон а таблетках продолжительного действия с оболочкой по 5 мг / 2,5 мг; 10 мг / 5 мг; 20 мг / 10 мг; 40 мг / 20 мг,
- Таблетки Тапентадола с пленочной оболочкой продленного высвобождения вещества по 250, 200, 150, 100 и 50 миллиграмм,
- Тримеперидин таблетки,
- Фентанил накожный пластырь 12,5; 25; 50, 75 и 100 мкг / час, таблетки подъязычные.

- Морфин капсулы длительного высвобождения 10, 30, 60, 100 миллиграмм, таблетки пролонгированные с оболочкой по 100, 60, 30 миллиграмм.
В том случае, когда нет проблем с желудочно-кишечным трактом и печенью, рекомендуют использовать таблетки для перорального приема. Для снижения раздражения слизистой оболочки желудка параллельно назначается препарат Омепразол.
Уколы позволяют снизить боль в кратчайшие сроки. Первые заметные результаты проявляются спустя 3-5 минут после введения, что эффективно при острых приступах боли.
В некоторых случаях могут назначаться пластыри с обезболивающим эффектом. Они крепятся на кожу, через которую происходит процесс медленного всасывания лекарства. Терапевтический эффект проявляется по накопительной системе, когда анальгетика в организме достаточно.
При наличии умеренных и постоянных болей таблетки могут комбинироваться с инъекциями для достижения максимального эффекта. Выбор наиболее оптимального средства и способа введения в организм зависит от рекомендаций доктора.
В том случае, когда опиоидный препарат перестал давать желаемый эффект, его могут заменять аналогом. Начальная доза должна быть несколько ниже той, которая употреблялась до этого.
Если терапевтический эффект отсутствует полностью, об этом в обязательном порядке осведомляют врача. Производится корректировка лечения и замена некоторых лекарств.
Первая ступень — слабая боль
На первой ступени обезболивания при онкологии располагаются нестероидные противовоспалительные препараты с обезболивающим эффектом (Ибупрофен, Кетопрофен, Диклофенак, Целекоксиб, Лорноксикам, Нимесулид, Эторикоксиб, Мелоксикам) или Парацетамол.
- Начинать с минимальных доз (см. в табл) с постепенным увеличением при необходимости.
- Поскольку эффект от обезболивающих накопительный, не мгновенный, несколько дней следует не превышать первоначальную дозу.
- Начинать нужно с таблетированных форм, далее переходить на инъекции. При противопоказаниях к пероральному приему или эффект от таблеток низкий, нужно вводить обезболивающие лекарства внутримышечно.

- Принимать таблетки после еды, под прикрытием Омепразола и его аналогов, можно запивать молоком, во избежании поражения слизистой желудка.
При всех видах онкологической боли, кроме костных:
- Кетанов (или более эффективный Кеторол ), в отдельном шприце.
- Папаверин для усиления эффективности. Если больной курит, то папаверин будет малоэффективным.
При костных болях:
- Ни папаверин, ни Кетанов не сравнятся по эффективности при костных болях с Пироксикамом, Мелоксикамом, Ксефокамом . Выбрать один из препаратов и вводить в отдельном шприце.
- При первичных костных опухолях или метастазами в них целесообразно обсудить с врачом применение бисфосфонатов, радиофармпреапаратов, Деносумаба. Кроме обезболивающего, они обладают и терапевтическим эффектом.
Если больной не страдает пониженным давлением и температура тела нормальная, то показаны Реланиум, Сибазол.
- противосудорожные — Карбомазепином, Прегабалином (Лирикой), Ламотриджином,
- центральные миорелаксанты — Габапентином (Тебантином),
- транквилизаторы-
Клоназепамом, Диазепамом, Имипрамином.
 Улучшают сон, оказывают успокоительное действие, усиливает действие наркотических анальгетиков.
Улучшают сон, оказывают успокоительное действие, усиливает действие наркотических анальгетиков. - кортикостероиды — Преднизолон, Дексаметазон. Повышают аппетит, в комплексе с обезболивающими дают эффект при болях в позвоночнике, костных, болях внутренних органов.
- нейролептики – Галаперидол, Дроперидол, усиливают анальгетики и являются противорвотными.
- антиконвульсанты — Клоназепам, эффективен при простреливающих болях, усиливает наркотические анальгетики.
Обезболивающие при онкологии в домашних условиях
В том случае, когда палиативное лечение осуществляется в домашних условиях, необходимо:
- Указать человека, который будет давать лекарства больному в соответствии с назначением доктора. Этот человек должен быть адекватным и ответственным за возможные негативные проявления.
- Получить лекарства и рекомендованную дозировку, согласно которой нужно вводить препарат в организм больного.
- Соблюдать все правила и нормы в отношении ухода за больным.

Категорически запрещено оставлять лекарства, особенно опиоидного типа, в непосредственной близости к онкобольному. Под воздействием паники и привыкания человек может употребить все таблетки за один прием, что спровоцирует развитие летального исхода. Медикаменты лучше всего хранить в ящике под ключом, куда имеет доступ только один человек, несущий ответственность за состояние здоровья больного.
Прием лекарств осуществляется в соответствии с рецептом доктора. Самостоятельно изменять дозировки, отменять прием лекарства или заменять его аналогом не рекомендуется, так как это может пагубно отразиться на состоянии здоровья больного.
Некоторые пациенты, которые страдают психическими расстройствами, могут имитировать прием лекарств. Это диктует необходимость использования только инъекционного способа введения лекарств в организм.
Третья ступень — сильная боль
Т.к. препараты первой ступени становятся слабоэффективными требуется Парацетамол (или нестероидные противовоспалительные) в сочетании со слабыми опиоидами (кодеинсодержащими или Трамадолом).
С такими болями чаще назначаются таблетки при онкологии:
- Трамадол — его назначают в первую очередь, именно тогда, когда ненаркотические обезболивающие уже помогают. Он применяется либо в таблетках (часто вызывает тошноту), либо в инъекциях. Совместно с НПВС (Парацетамол, Кеторол). Трамадол нельзя принимать вместе с наркотическими анальгетиками и с ингибиторами МАО (Фенелзин, Ипрониазид, Оклобемид, Селегилин).
- Залдиар — комплексный препарат Трамадола и Парацетамола.
- Трамадол Реланиум (в разных шприцах)
- Трамадол и Димедрол (в одном шприце)
- Кодеин Парацетамол (макс. суточного приема 4-5 тыс. мг.).
Чтобы добиться эффекта и в то же время снижать боль как можно меньшим количеством наркотических средств, нужно комбинировать Кодеин или Трамадол с другими НПВС (Парацетамол, Кеторол и пр.).
Далее возможно назначение Парацетамола с маленькими дозами Фентанила, Оксикодона, Бупренорфина, относящихся к сильным опиоидным анальгетикам.
Комбинацию подкрепляют и вспомогательной терапией из первой ступени.
При сильной боли или постоянных болях, например, при 4 стадии, высокие дозы Трамадола или Кодеина уже не помогают. Онкологический больной нуждается в сильных опиоидах в сочетании с Парацетамолом и вспомогательными миорелаксантами или транквилизаторами.
Морфин — наркотик, который назначается в онкологии при нестерпимых болях. Кроме обезболивающего эффекта он имеет и все побочные действия сильный наркотика (зависимость, привыкание), после его применения ничего помогать уже не будет, не останется выбора средств. Поэтому переходить от слабых (Трамадол) к более сильным следует очень взвешенно.
Список наркотических обезболивающих от более слабых, к более сильным:
- Трамадол — по некоторым источникам считается синтетическим аналогом наркотиков, по другим ненаркотическим анальгетикам.
- Тримеперидин — у таблетированных форм эффект в 2 раза ниже, чем инъекционных, меньше побочных действий в сравнении с Морфином.

- Бупренорфин — медленнее развивается привыкание и зависимость, чем у морфина.
- Пиритрамид — действие очень быстрое (1 минута), совместим с нейротропными препаратами.
- Фентонил — удобнее, безболезненно и эффективно использовать в пластыре, а не в/мышечно или в/венно.
- Морфин — эффект наступает через 5-10 мин.
Врач должен предлагать эти препараты больному, но как правило, проявлять инициативу нужно родственникам больного и обсудить с ним возможность после ненаркотических средств использовать менее сильные опиаты, чем Морфин.
Как получить обезболивающие препараты
Назначение легких опиоидов подписывает начмед однократно, потом повторная выписка может производиться самим врачом. Повторно начмед смотрит аргументацию смены дозы или переход на другой препарат (например, усиление).
На сегодняшний день если есть нормальная рекомендация алнальголога (ступенчатое усиление терапии), то движутся по ней и никто ничего долго не ждет:
- Колют Кеторол, реже Диклофенак, потом сразу переходят на Трамадол (при усилении болей).

- Трехкратный прием Трамадола в сочетании с парацетамолом и Габапентином без эффекта — переходят на Дюргезик (Фентанил).
- После увеличения дозировки до максимальной или невозможности применения пластырей — переходят на морфин.
Накожные варианты — обезболивающие пластыри Фентанила и Бупренорфина являются предпочтительной альтернативой таблетированным опиоидам. Это сильное обезболивающее с постепенным выходом лекарственного вещества. Вопрос их назначения упирается в ценник и доступность.
- Если у пациента имеется группа инвалидности, и он имеет право на льготное лекарственное обеспечение
вопрос выписки того же Фентанила (Дюргезика) осуществляется по месту жительства участковым терапевтом или хирургом противоопухолевого кабинета (при наличии рекомендаций анальголога, заполнения документации – льготного рецепта и его копии за подписью начмеда лечебного учреждения при первичной выписке препарата). В дальнейшем участковый терапевт может осуществлять выписку лекарства самостоятельно, обращаясь к помощи начмеда только при коррекции дозировок.
- В случае, когда человек с инвалидностью отказался от лекарственного обеспечения и получает за него денежную компенсацию
он может начать получать требующиеся таблетки, капсулы или пластыри бесплатно. Нужно получить от участкового врача справку произвольной формы о необходимости проведения дорогостоящей терапии с указанием препарата, его дозы и кратности применения за печатью врача и лечебного учреждения, которую необходимо предоставить в Пенсионный Фонд. Льготное лекарственное обеспечение восстанавливается с начала следующего за подачей справки месяца.
Нестероидные противовоспалительные препараты находятся в свободном доступе и приобретаются в аптеке. Опиоидные анальгетики выдаются на руки только при утверждении начальника медицинской части поликлиники. Для этого больной или его родственники пишут заявление, в котором просят выдать соответствующие лекарства.
Такая схема достаточно длительная, поэтому в некоторых случаях прибегают к помощи лечащего врача, чьи действия базируются на ступенчатом использовании медикаментов, учитывая интенсивность болевых ощущений.
Назначение лекарств осуществляется всего один раз. Вначале вводят препараты группы НПВС, после чего добавляют небольшую дозу Трамадола. Кратность приема лекарств – 3 раза в сутки.
При усилении болей Трамадол назначают 2 раза в сутки, дополняя его Парацетамолом. Запущенные формы онкологического процесса и невыносимая боль диктуют необходимость введения Фентанила и Морфина.
В дальнейшем лечащий врач вправе самостоятельно выписывать нужное количество обезболивающих лекарств, что контролируется начальником медчасти. Лекарства на руки выдаются только родственникам. Льготные очереди на получение медикаментов оформляются через Управление труда и социальной защиты населения.
Онкологические заболевания являются одной из наиболее распространенных причин смертности во всем мире. Ученые до сих пор не могут дать ответа на вопрос о механизмах злокачественного перерождения клеток. Радикальных противораковых средств на сегодняшний день не существует. Тем не менее поиски продолжаются. И есть достаточно обнадеживающие данные. Попробуем разобраться, каковы шансы человечества одержать победу над раком.
И есть достаточно обнадеживающие данные. Попробуем разобраться, каковы шансы человечества одержать победу над раком.
Международный проект Repurposing Drugs in Oncology (ReDO), созданный с целью поиска противораковых свойств у лекарственных средств, используемых по другим показаниям, выявил выраженный противораковый эффект у Диклофенака, широко применяемого в качестве обезболивающего и противовоспалительного средства. Результаты были опубликованы в ecancermedicalscience.
Диклофенак — препарат группы НПВС (нестероидных противовоспалительных средств). Это классическое обезболивающее, которое было разработано и выведено на рынок более 40 лет назад компанией Ciba-Geigy (в настоящее время входит в концерн Novartis). Назначается при болях различного происхождения, поражениях опорно-двигательного аппарата, ревматоидных болезнях.
Ученые уже давно интересовались Диклофенаком как потенциальным средством профилактики онкологических заболеваний. Данные последних исследований показывают: препарат может быть использован при лечении разных видов рака.
Данные последних исследований показывают: препарат может быть использован при лечении разных видов рака.
Специалисты ReDO считают Диклофенак достаточно перспективным противораковым средством в силу его детально изученной фармакокинетики, невысокой токсичности и доступной стоимости.
Первые исследования противоопухолевых свойств данного препарата были проведены более 30 лет назад. Эксперименты на грызунах с имплантированной фибросаркомой выявили замедление роста опухоли при применении Диклофенака. Дальнейшие исследования показали: лекарственное средство подавляет деление раковых клеток при раке простаты, толстой и прямой кишок, яичника, поджелудочной железы, глиоме, меланоме, нейробластоме.
Диклофенак применяется в качестве обезболивающего при онкологических болезнях, а также после операции по удалению опухоли. Исследователи провели ретроспективный анализ результатов лечения больных, проходившие терапию с использованием Диклофенака и не проходивших такой терапии. В первой группе пациентов было зафиксировано несколько положительны сдвигов:
- Снизилась общая смертность и вероятность дистанционного метастазирования у больных с опухолями легкого, почек, груди.

- Заметно снизилась концентрация в крови биомаркера аденокарциномы поджелудочной железы, замедлялось прогрессирование заболевания.
- Существенно сократились размеры опухолей при агрессивном фиброматозе.
По словам экспертов, противораковое действие Диклофенака обусловлено несколькими факторами:
Первый фактор . Препарат действует как ингибитор циклооксигеназы второго типа — фермента, синтезируемого простагландинами. Один из простагландинов — Е2 — присутствует во многих новообразованиях. Он формирует микросреду опухоли посредством поддержания хронического воспаления.
Второй фактор. Диклофенак подавляет рост кровеносных сосудов, питающих опухоль.
Третий фактор. Препарат оказывает иммуномодулирующее действие.
Четвертый фактор . Средство стимулирует процесс клеточной гибели — апоптоз. Известно, что у раковых клеток он нарушен.
Пятый фактор . Подавляет активность тромбоцитов и метаболизм глюкозы.
Шестой фактор . Повышает чувствительность раковых клеток к лучевой терапии и химиотерапии.
Полученные данные позволяют ученым надеяться на возможность применения Диклофенака в качестве противоракового средства. В настоящий момент проводятся клинические испытания. Одно из них находится в фазе IIB, посвященной исследованиям эффективности лекарственного средства в определенной дозе.
Онкологические заболевания и ионизация воздухаЕще в 30-х годах прошлого века французский ученый Ф. Велес заметил, что при длительном нахождении в помещениях с воздухом с высоким содержанием аэроионов (воздушных ионов) вероятность развития спонтанного рака снижается более чем в 10 раз. Помещение грызунов с раком в комнату с избыточной концентрацией аэроионов способствовало исчезновению опухоли.
Исследования были продолжены. В 1951 году ученые Г.Стрельцов, В.Соколов и В.Эдди выявили, что ионизированный воздух тормозит рост пересаженных раковых опухолей у подопытных животных. Аналогичные результаты были получены у людей. Так, курс аэроионотерапии, включавший 10-20 сеансов, способствовал значительному уменьшению опухолей у пациенток с мастопатией. У некоторых из них опухоль полностью рассосалась.
Аналогичные результаты были получены у людей. Так, курс аэроионотерапии, включавший 10-20 сеансов, способствовал значительному уменьшению опухолей у пациенток с мастопатией. У некоторых из них опухоль полностью рассосалась.
Российский биофизик А.Л. Чижевский говорил о возможной связи между развитием опухолевых новообразований и систематическим аэроионным голоданием. По его мнению, недостаток аэроионов кислорода приводит к нарушению электрообмена, снижению электрического потенциала клеток и провоцирует преждевременное старение, что создает благоприятный фон для развития злокачественных новообразований. Таким образом, в жилых и рабочих помещениях помогает значительно сократить вероятность развития онкологических заболеваний. Одной из новых разработок в данной области является от компании NIKKEN , обеспечивающая ионизацию воздуха без озона и многоэтапную фильтрацию.
Уникальный прибор получил сертификаты нескольких престижных международных организаций в сфере защиты здоровья и окружающей среды
Польза щелочной водыИзвестно, что вода является основой жизни. Она формирует в организме жизненно важную среду для протекания биохимических реакций. Вода также помогает вывести из организма вредные примеси. Врачи рекомендуют потреблять не менее 2,5-3 литров жидкости в день. Но всякая ли вода полезна? Оказывается, нет.
Она формирует в организме жизненно важную среду для протекания биохимических реакций. Вода также помогает вывести из организма вредные примеси. Врачи рекомендуют потреблять не менее 2,5-3 литров жидкости в день. Но всякая ли вода полезна? Оказывается, нет.
Важное значение имеют несколько показателей, основными из которых являются кислотно-щелочной баланс и окислительно-восстановительный потенциал.
Кислотно-щелочной баланс. Жидкости человеческого тела являются нейтральными или слабощелочными. Единственное исключение — желудочный сок, рН которого составляет 1,0. рН здоровой крови — 7,35, здоровой лимфы — 7,5, слюны — 7,4. Сдвиг в сторону повышения кислотности провоцирует развитие ряда заболеваний крови, иммунной системы, сердца, сосудов, онкологических болезней. Ощелачивание системы и восстановление нормального кислотно-щелочного баланса способствует общему оздоровлению организма. Наш организм постоянно находится в поиске источника щелочи для нейтрализации кислот. Единственным резервом в нем самом являются кости, точнее — содержащийся в них кальций. При повышении кислотности организм начинает забирать кальций из костей, что провоцирует их размягчение. Кроме того, кальций начинает откладываться в желчном пузыре, почках, суставах, позвоночнике. Поэтому употребление щелочной воды имеет очень важное значение для здоровья. Воду с pH больше 7,0 ученые называют живой. У мертвой воды реакция кислая: pH меньше 7,0.
При повышении кислотности организм начинает забирать кальций из костей, что провоцирует их размягчение. Кроме того, кальций начинает откладываться в желчном пузыре, почках, суставах, позвоночнике. Поэтому употребление щелочной воды имеет очень важное значение для здоровья. Воду с pH больше 7,0 ученые называют живой. У мертвой воды реакция кислая: pH меньше 7,0.
Окислительно-восстановительный потенциал, или ОВП — еще один значимый показатель воды. ОВП относится к важнейшим характеристикам внутренней среды, поскольку находится в непосредственной связи с жизненно важными процессами. Ученые считают, что нарушение механизмов регуляции окислительно-восстановительных процессов человеческого организма становится причиной развития многих опасных заболеваний, в том числе разных видов рака.
Вода из-под крана или бутилированная вода в большинстве случаев не соответствуют необходимым требованиям безопасности и пользы для здоровья. Для улучшения их качественных характеристик используются различные приборы. Компания NIKKEN предлагает самые передовые разработки в данной области, которые обеспечивают:
Компания NIKKEN предлагает самые передовые разработки в данной области, которые обеспечивают:
Эффективную многоэтапную фильтрацию воды;
Полное удаление загрязнений, хлора, хлорамина, солей тяжелых металлов, других примесей;
Регуляцию кислотно-щелочного баланса (pH) в сторону повышения щелочной составляющей.
Снижение ОВП (окислительно-восстановительного потенциала).
Структурирование воды, способствующее повышению ее биологической активности.
Уникальные приборы японской компании можно купить в нашем интернет-магазине. Они необходимы не только для лечения, но и для общего оздоровления организма и профилактики самых различных заболеваний.
КордицепсЭтот уникальный гриб является эффективным противораковым средством. Его даже называют «новым оружием против рака».
Эффективность кордицепса при лечении онкологических заболеваний обусловлена наличием ряда веществ с противораковыми свойствами:
Полисахарид СО-1 — основной бета-глюкан Кордицепса. Активизирует натуральные киллеры здоровых людей на 74%, больных — на 400%.Например, при лейкемии фиксируется увеличение производства макрофагов до 40 раз.
Активизирует натуральные киллеры здоровых людей на 74%, больных — на 400%.Например, при лейкемии фиксируется увеличение производства макрофагов до 40 раз.
Галактозамингликан CO-N — полисахарид, который оказывает на опухоль разрушающее действие.
SN-C, белково-углеводный комплекс — проявляет прямую и опосредованную противоопухолевую (посредством стимулирования иммунитета) активность.
Кордицепин — является основным противораковым агентом кордицепса. Имеет два механизма действия.
- Препятствует образованию ДНК раковых клеток, нарушает весь клеточный цикл и снижает скорость размножения клеток, тем самым тормозя рост опухоли.
- Восстанавливает апоптоз раковых клеток. Апоптозом называют процесс клеточной гибели. Клетка распадается на части, после чего поглощается соседними клетками или макрофагами. Известно, что у клеток рака апоптоз нарушен, что позволяет им жить гораздо дольше здоровых клеток и делиться с высокой скоростью.
 Благодаря восстановлению апоптоза происходит гибель раковых клеток, замедление роста опухоли, ее постепенное уменьшение и рассасывание.
Благодаря восстановлению апоптоза происходит гибель раковых клеток, замедление роста опухоли, ее постепенное уменьшение и рассасывание. - Тормозит производство двух веществ, принимающих участие в строительстве кровеносной системы опухоли: VECF — фактора роста эндотелия сосудов и FGF — фактора роста фибробластов. В результате кровеносная система опухоли перестает восстанавливаться, ухудшается ее снабжение питательными веществами. В конечном итоге опухоль усыхает.
- Тормозит подвижность раковых клеток и снижает их проникающую активность. Результатом становится значительное замедление метастазирования, что особенно важно при активных формах рака.
Продукты с кордицепсом от компании APL:
Продукты с кордицепсом компании FOHOW, которые можно купить в нашем интернет-магазине:
Значение иммунотерапии при лечении ракаУченые продолжают поиски безопасных способов лечения рака. Кроме классических методов (операции, лучевой терапии, химиотерапии), существуют и другие. Одним из самых перспективных направлений является иммунотерапия. На нее ученые возлагают большие надежды, поскольку данный способ является достаточно безопасным. Для повышения иммунитета против рака используют:
Одним из самых перспективных направлений является иммунотерапия. На нее ученые возлагают большие надежды, поскольку данный способ является достаточно безопасным. Для повышения иммунитета против рака используют:
- Вакцинацию . Применяют два вида вакцин: для профилактики заболевания и для лечения уже возникшей болезни. Их создают на основе изъятых из организма злокачественных клеток.
- Применение препаратов на основе цитокинов . Это особые белки, посредством которых передается информация от одних клеток другим.
- Применением моноклональных антител, дезоксината, тимогена . Эти средства стимулируют организм на борьбу с онкологическим заболеванием, ускоряют выведение токсинов.
4.Иммунотерапию при помощи ТИЛ-клеток . Их получают из удаленных во время операции раковых тканей, после чего размножают в лаборатории и вводят в организм для предупреждения рецидива болезни.
- Использование Т-клеток . Эти специфические клетки также проявляют высокую активность в борьбе с раком.

- Природные методы иммунотерапии . Онкологи рекомендуют применение натуральных органических продуктов для укрепления иммунитета, но непременно в комплексе с традиционными способами лечения. Рекомендуется прием витаминов, растительных средств, диеты.
Для укрепления иммунитета, улучшения пищеварения и очищения организма рекомендуется принимать уникальные продукты компании NIKKEN
Онкологические заболевания требуют постоянного врачебного контроля. Использование любых вспомогательных средств может проводиться только наряду с традиционным лечением.
Трамадол в сочетании с парацетамолом (ацетаминофеном) или без него при онкологической боли
Суть
Нельзя сделать однозначных выводов об эффективности или вреде трамадола, в монотерапии или в сочетании с парацетамолом, при лечении онкологической боли.
Актуальность
Один из двух или трех человек, заболевающих раком, испытывает боль, интенсивность которой доходит до умеренной или сильной. Боль имеет тенденцию ухудшаться по мере прогрессирования рака.
Боль имеет тенденцию ухудшаться по мере прогрессирования рака.
Трамадола гидрохлорид — это опиоидный анальгетик, доступный с 1977 года. В 2016 году трамадол, в монотерапии или в сочетании с парацетамолом, был доступен в виде препаратов для перорального применения и для инъекций почти у 90 фармацевтических компаний. Пероральные формы включают препараты, разработанные для немедленного высвобождения и для модифицированного высвобождения в течение более длительного периода времени. Также доступны препараты для ректального введения.
В этом обзоре мы попытались оценить, насколько хорошо трамадол действовал, у какого числа людей были побочные эффекты и насколько серьезными они были — например, были ли они настолько серьезными, что участники прекратили прием трамадола.
Характеристика исследований
В ноябре 2016 года мы нашли 10 исследований с участием 958 взрослых и ни одного исследования с участием детей. Исследования чаще всего были небольшими и в них сравнивали различные препараты трамадола с различными препаратами сравнения, и в них недостаточно хорошо сообщали о важных исходах. Это затруднило определение того, было ли действие трамадола таким же, хуже или лучше, чем любого другого лекарства, применяемого при лечении онкологической боли.
Это затруднило определение того, было ли действие трамадола таким же, хуже или лучше, чем любого другого лекарства, применяемого при лечении онкологической боли.
Основные результаты
Нельзя сделать однозначных выводов в отношении каких-либо исходов в каких-либо сравнениях. Возможно трамадол не такой же эффективный, как морфин.
Качество доказательств
Мы оценили качество всех имеющихся доказательств как очень низкое. Это значит, что исследования не дают надежного представления о возможном эффекте трамадола.
Тромбоз и гемостаз в онкологии
Авторы: С.И. Коровин, В.И. Черний, L.J. Palomares и др.
28-29 сентября 2017 года в г. Киеве состоялась I Международная конференция, посвященная проблемам гемостаза и тромбоза в онкологии. В ее работе приняли участие ведущие украинские специалисты, а также гости из Италии, Греции и Испании. В ходе конференции рассматривались вопросы профилактики тромботических и геморрагических событий у пациентов онкологического профиля при проведении основного лечения.
В ходе конференции рассматривались вопросы профилактики тромботических и геморрагических событий у пациентов онкологического профиля при проведении основного лечения.
Работу конференции открыл заместитель директора Национального института рака (НИР), доктор медицинских наук Сергей Игоревич Коровин. В приветственном слове он отметил, что кровотечение является одной из главных проблем современной хирургии, и это особенно ощутимо в онкологии. Как правило, в ходе операции у онкологических пациентов удаляется достаточно большой объем тканей, к тому же в большинстве случаев пациенты получают комплексное лечение, которое включает химио- и лучевую терапию, что в свою очередь приводит к увеличению риска возникновения кровотечений. Не менее остро стоит и проблема тромбоза в онкологии. Поиск решения этих вопросов должен заинтересовать широкий круг специалистов. Такого рода конференции – возможность получить самую новую информацию о состоянии проблем, а также найти пути их решения.
Член-корреспондент НАМН Украины, проректор по научно-педагогической работе, заведующий кафедрой анестезиологии, интенсивной терапии, медицины неотложных состояний, лабораторной диагностики и клинической физиологии факультета интернатуры и последипломного обучения Донецкого национального медицинского университета им. М. Горького, доктор медицинских наук, профессор Владимир Ильич Черний отметил, что врач в своей деятельности обязан балансировать между двумя очень сложными и серьезными состояниями – тромбозом и кровотечением. Клиническая модель «Онкология» выбрана неслучайно, поскольку она, пожалуй, самая сложная с точки зрения возникновения рецидива и связана с наибольшими рисками для пациента.
Доктор Luis Jara Palomares (Университетский госпиталь Virgen del Rocіo, Севилья, Испания) посвятил свой доклад проблеме скрытого рака у пациентов с венозной тромбоэмболией (ВТЭ). По его словам, метаанализ исследований из базы данных EPDMA показал, что рак диагностируется у 5,2% пациентов после случая ВТЭ, при этом риск выявления в 7 раз выше у пациентов старше 50 лет. То есть скрытый рак выявляется у 1 из 20 пациентов с острой ВТЭ. Несмотря на то что расширенный скрининг позволяет выявить рак на ранних стадиях в большем количестве случаев, это не способствует улучшению результатов лечения данной группы пациентов (Nick van Es et al., 2017).
То есть скрытый рак выявляется у 1 из 20 пациентов с острой ВТЭ. Несмотря на то что расширенный скрининг позволяет выявить рак на ранних стадиях в большем количестве случаев, это не способствует улучшению результатов лечения данной группы пациентов (Nick van Es et al., 2017).
Шкала RIETE, в которой учитывается возраст, наличие хронических заболеваний легкого, анемия, уровень тромбоцитов, а также оперативное вмешательство или ВТЭ в анамнезе, имеет особое значение. У пациентов, набравших ≤2 баллов, онкологические заболевания были выявлены в 5,8% случаев, а у пациентов с количеством баллов >2 – в 12% случаев (95% доверительный интервал – ДИ – 0,61-0,66). Валидация шкалы RIETE относительно прогнозирования риска рака у пациентов с неспровоцированной ВТЭ показала высокое соотношение рисков – 3,16 (ДИ 95%), что дает основание использовать ее в ранней диагностике (L. Bertoletty et al., 2017).
О рисках, факторах развития и последствиях тромбоза, ассоциированного с онкологическими заболеваниями, рассказал доктор Evangelos Dimakakos (Греция). Рак является хорошо известным и изученным фактором риска ВТЭ, и первым это отметил Труссо в далеком 1865 г. Именно ВТЭ занимает второе место среди причин смерти онкологических пациентов. При онкологических заболеваниях риск развития ВТЭ увеличивается в 7-28 раз, достигая максимума в первые 3-6 мес после постановки диагноза. Характерным является высокий риск рецидива ВТЭ: более чем у 20% пациентов повторный эпизод ВТЭ возникает в течение следующего года.
Рак является хорошо известным и изученным фактором риска ВТЭ, и первым это отметил Труссо в далеком 1865 г. Именно ВТЭ занимает второе место среди причин смерти онкологических пациентов. При онкологических заболеваниях риск развития ВТЭ увеличивается в 7-28 раз, достигая максимума в первые 3-6 мес после постановки диагноза. Характерным является высокий риск рецидива ВТЭ: более чем у 20% пациентов повторный эпизод ВТЭ возникает в течение следующего года.
Развитие гиперкоагуляции связано как с основным заболеванием, так и с проводимой терапией. Докладчик отметил, что очень важным фактором является оперативное вмешательство: риск особенно высок в первые дни после операции. Не менее важна и химиотерапия, при которой риск ВТЭ увеличивается на 200%. Риск развития ВТЭ в амбулаторных условиях получения химиотерапии изучался в масштабном исследовании с участием 17 284 пациентов, по результатам которого ВТЭ возникала у >12,6% пациентов в течение 12 мес. Кроме того, развитие ВТЭ является независимым фактором риска смерти при проведении первых 4 циклов химиотерапии.
Пожилой возраст (>65 лет), женский пол, наличие сопутствующих заболеваний или патологии, ВТЭ в анамнезе существенно увеличивают риск ВТЭ. Факторы, связанные с самим заболеванием, такие как локализация и гистологический тип опухоли, стадия заболевания, время от начала постановки диагноза, также существенно влияют на свертывающую систему крови. Риск развития ВТЭ наиболее выражен при лимфопролиферативных опухолях, раке легкого, желудочно-кишечного тракта, а также при наличии отдаленных метастазов (J.W. Blom et al., 2005). Повышение уровня D-димера, тромбоцитоз, лейкоцитоз, низкий уровень гемоглобина показали свою значимость как маркеры гиперкоагуляции и активно используются для определения риска развития ВТЭ у онкологических пациентов (A.A. Khorana, 2011; M. Righini, 2008).
Говоря о возможностях скрининга гиперкоагуляции при раке, директор Центра тромбоза и гемостаза, заведующая отделением иммуногематологии и трансфузионной медицины госпиталя Papa Giovanni XXIII Anna Falanga (г. Бергамо, Италия) отметила, что основной проблемой первичной профилактики рака является отсутствие эффективных прогностических опухолевых маркеров. Открытым остается вопрос: могут ли маркеры гиперкоагуляции быть предикторами развития рака и определять прогноз заболевания?
Бергамо, Италия) отметила, что основной проблемой первичной профилактики рака является отсутствие эффективных прогностических опухолевых маркеров. Открытым остается вопрос: могут ли маркеры гиперкоагуляции быть предикторами развития рака и определять прогноз заболевания?
Действительно, опухоль обладает способностью активировать систему гемостаза, что приводит к увеличению риска ВТЭ у онкологических больных. К тому же коагуляционные протеины (тканевой фактор, тромбин, активированный фактор Х, фибриноген/фибрин) способствуют росту опухоли и прогрессированию заболевания. В ходе исследований было установлено, что генетические механизмы, которые приводят к неопластической трансформации (активация RAS и MET, а также инактивация p53/PTEN), непосредственно влияют на экспрессию генов, ответственных за поддержание гемостаза. Опухолевые клетки во внесосудистой среде и в сосудах при клеточной эмболии усиленно адсорбируют на своей поверхности фибриноген, который быстро переходит в фибрин; фибринная пленка способна защищать злокачественные клетки от иммунных противоопухолевых факторов организма.
Даже при отсутствии клинических проявлений пациенты находятся в состоянии субклинической гиперкоагуляции. Как уже неоднократно сообщалось, гиперкоагуляция связана с прогрессированием опухоли и плохим прогнозом при различных карциномах. С другой стороны, тромботическое событие может быть первым сигналом о наличии оккультной опухоли. Эти данные свидетельствуют о том, что пути коагуляции способны играть определенную роль в доклинической фазе рака. Стойкая субклиническая активация гемостатической системы у здорового человека может быть предиктором не только тромбоза, но и наличия оккультной опухоли.
Так, масштабное исследование HYPERCAN, проводимое в настоящее время группой ученых на территории Италии, включает в себя две тесно взаимосвязанные исследовательские программы. Одна из них посвящена оценке тромботических маркеров как инструмента прогнозирования риска рака среди здорового населения (доноры крови, программа 1А). Вторая призвана оценить, могут ли тромботические маркеры и/или развитие ВТЭ (или диссеминированной внутрисосудистой коагуляции) прогнозировать исходы при онкологических заболеваниях, т. е. влиять на общую и безрецидивную выживаемость у больных с различными типами солидных опухолей (рак молочной железы, легкого и желудочно-кишечного тракта – программа 2).
е. влиять на общую и безрецидивную выживаемость у больных с различными типами солидных опухолей (рак молочной железы, легкого и желудочно-кишечного тракта – программа 2).
Промежуточные результаты исследования в программе 1А, как и предполагалось, подтвердили, что здоровый образ жизни снижает риск развития онкологических заболеваний. Согласно результатам, полученным в программе 2, эндогенный тромбиновый потенциал и D-димер являются ценными маркерами при прогнозировании ВТЭ у пациентов с метастатическим раком. Они могут помочь в выявлении субъектов высокого риска, а также оптимизировать первичную тромбопрофилактику у онкологических пациентов во время проведения химиотерапии.
Следующее выступление Anna Falanga было посвящено механизмам активации гиперкоагуляции при онкологических заболеваниях.
Особое внимание докладчица уделила феномену нейтрофильных внеклеточных ловушек.
У здорового человека в ответ на инфекцию лейкоциты из собственной ДНК способны создавать нейтрофильные внеклеточные ловушки, которые обычно захватывают и уничтожают патогены, посредством чего нейтрофилы осуществляют защитные функции. При опухолевом процессе создаются условия, которые предрасполагают к выделению нейтрофилами ловушек. Они захватывают циркулирующие опухолевые клетки, активируют их и увеличивают риск метастазирования.
При опухолевом процессе создаются условия, которые предрасполагают к выделению нейтрофилами ловушек. Они захватывают циркулирующие опухолевые клетки, активируют их и увеличивают риск метастазирования.
Выделение цитокинов приводит к миграции нейтрофилов к опухоли, в свою очередь нейтрофилы воздействуют на внеклеточный матрикс, тем самым стимулируя рост и инвазию опухоли, а также поддерживают ангиогенез (Demers et al., 2013). Нейтрофильные внеклеточные ловушки могут защищать опухолевые клетки путем адгезии тромбоцитов. С другой стороны, адгезия большого количества нейтрофильных ловушек к поверхности сосуда образует своеобразную платформу для прикрепления тромбоцитов и активации тромбина, что может спровоцировать тромбоз.
Существует несколько потенциальных вариантов подавления нетоза у онкологических пациентов. Для этого, в частности, используются: дезоксирибонуклеаза I, разрушающая внеклеточные нити ДНК; специфичные ингибиторы PAD4, направленные на белок, активирующий нетоз; а также гепарин, дестабилизирующий нейтрофильные внеклеточные ловушки путем выделения гистонов. Таким образом, нетоз позволяет объяснить высокий риск тромбоза у онкологических пациентов и в перспективе может быть изучен в качестве новой терапевтической цели.
Таким образом, нетоз позволяет объяснить высокий риск тромбоза у онкологических пациентов и в перспективе может быть изучен в качестве новой терапевтической цели.
В ходе конференции с докладом «Тромбопрофилактика у госпитализированных больных: сравнение рекомендаций» выступила заведующая Научно-исследовательским отделением химиотерапии гемобластозов НИР, доктор медицинских наук, профессор Ирина Анатольевна Крячок. Она подчеркнула актуальность этой проблемы, поскольку ВТЭ является второй по частоте причиной смерти госпитализированных больных со злокачественным новообразованием.
Ретроспективное исследование с участием 66 106 пациентов со злокачественными новообразованиями и нейтропенией показало, что ВТЭ увеличивает риск смерти у госпитализированных больных с метастатическим и неметастатическим заболеванием (р<0001). В ходе исследования были также выделены основные факторы риска, которые включали возраст >55 лет, локализацию опухоли и сопутствующие заболевания (Alok et al. , 2006).
, 2006).
Профилактика ВТЭ подразделяется на медикаментозную и немедикаментозную. Немедикаментозная включает установку кава-фильтра, эластическое бинтование, пневматическую компрессию. Фармакологическая профилактика осуществляется путем назначения оральных антикоагулянтов, низкомолекулярных гепаринов (НМГ), нефракционированного гепарина (НФГ). Профилактика в составе комплексной терапии пациентов во время прохождения ими основного медикаментозного лечения существенно снижает риск тромбообразования (A.T. Cohen et al., 2006).
Общим для рекомендаций ESMO, NCCN, ASCO, BSH является то, что всем госпитализированным больным, получающим медикаментозное лечение по поводу злокачественного новообразования, показана профилактика ВТЭ с использованием НМГ или НФГ.
Данная рекомендация имеет наивысшую степень доказательности. Некоторые рекомендации содержат особые указания в отношении профилактики: к примеру, в рекомендациях ASCO говорится, что нет достоверных данных о целесообразности тромбопрофилактики у пациентов, госпитализированных для проведения малоинвазивных процедур, короткого курса химиотерапии, трансплантации стволовых клеток костного мозга или периферической крови. Согласно рекомендациям NCCN, пациентам без факторов риска тромбоза, получающим лечение по поводу множественной миеломы талидомидом, леналидомидом и помалидомидом, показан аспирин, а пациентам с факторами риска ВТЭ – антикоагулянты.
Согласно рекомендациям NCCN, пациентам без факторов риска тромбоза, получающим лечение по поводу множественной миеломы талидомидом, леналидомидом и помалидомидом, показан аспирин, а пациентам с факторами риска ВТЭ – антикоагулянты.
Результаты исследования RISTOS показали, что у пациентов хирургического профиля риск развития ВТЭ наиболее высок в первые дни после операции, второй пик приходится на 3-ю неделю (Agnelli et al., 2006). На основании этого исследования были разработаны рекомендации относительно длительности проведения тромбопрофилактики.
Рискам развития повторной ВТЭ посвятил доклад профессор Владимир Ильич Черний. Как известно, онкологические пациенты с высоким риском ВТЭ получают НМГ в течение 3-6 мес, тем не менее риск рецидива на фоне проведения антикоагулянтной терапии достигает 10%. Современные подходы к оценке риска развития повторной ВТЭ учитывают клинические факторы и различные лабораторные маркеры тромбофилии, также австрийскими учеными была предложена модель оценки риска рецидива ВТЭ – Венская предсказательная модель (Vienna Prediction Model). Эта модель учитывает пол пациента, локализацию первичного тромбоза, а также уровень D-димера и позволяет прогнозировать риск рецидива через 12 и 60 мес (S. Eichinger, 2010). В случае рецидива ВТЭ может быть применена одна из трех тактик:
Эта модель учитывает пол пациента, локализацию первичного тромбоза, а также уровень D-димера и позволяет прогнозировать риск рецидива через 12 и 60 мес (S. Eichinger, 2010). В случае рецидива ВТЭ может быть применена одна из трех тактик:
1) переход на НМГ пациентов, получающих антагонисты витамина К;
2) увеличение дозы НМГ, если пациент уже получает препарат этой группы;
3) имплантация кава-фильтра, решение о необходимости которой должно приниматься в индивидуальном порядке (M. Nicoke et al., 2014; M. Verso et al., 2014).
Говоря о профилактике тромбоэмболии легочной артерии в эндоскопической хирургии и гинекологии, профессор кафедры акушерства и гинекологии Национальной медицинской академии последипломного образования имени П.Л. Шупика, доктор медицинских наук Руслан Афанасьевич Ткаченко отметил, что тромбопрофилактику у пациентов, которые подвергаются лапароскопическим вмешательствам, следует проводить, используя руководство Американской коллегии торакальных врачей (АССР, 2012) и оценочную шкалу Caprini (шкала оценки риска ВТЭ у больных хирургического профиля).![]() Данная шкала учитывает факторы, связанные с самим пациентом, оперативным вмешательством или основным заболеванием, а также кумуляцию факторов риска. Пациентам, набравшим 1-2 балла по шкале, проводится механическая профилактика и ранняя активизация, у пациентов, набравших 3 балла, профилактика включает применение НМГ или НФГ, а также механическую профилактику и раннюю активизацию пациента.
Данная шкала учитывает факторы, связанные с самим пациентом, оперативным вмешательством или основным заболеванием, а также кумуляцию факторов риска. Пациентам, набравшим 1-2 балла по шкале, проводится механическая профилактика и ранняя активизация, у пациентов, набравших 3 балла, профилактика включает применение НМГ или НФГ, а также механическую профилактику и раннюю активизацию пациента.
Режим начала тромбопрофилактики остается предметом дискуссии. Оптимальным вариантом является ее проведение до и через 12 ч после операции. Хорошо себя зарекомендовал и другой режим, который включает проведение профилактики ВТЭ периоперационно и через 6-8 ч после операции. В то же время метаанализ не представил убедительных доказательств, что начало профилактики перед операцией ассоциируется с более низкой частотой ВТЭ, чем ее проведение после оперативного вмешательства. Периоперацонные режимы понижают риск тромбоза, но увеличивают частоту негативных побочных эффектов в основном за счет больших послеоперационных кровотечений.
Согласно результатам рандомизированного исследования, длительное применение фармакопрофилактики (4 недели) безопасно и снижает риск ВТЭ по сравнению с 1-недельным режимом использования НМГ (M.C. Vedovati et al., 2014). Поэтому для онкологических пациентов рекомендована более длительная профилактика (4 недели) после выписки из стационара.
Профессор кафедры анестезиологии и интенсивной терапии Донецкого национального медицинского университета им. М. Горького, доктор медицинских наук Алексей Николаевич Нестеренко отметил, что патогенетически обоснованный комплекс мероприятий по профилактике и лечению нарушений коагуляционного статуса, адекватный выбор режима и объема инфузионной, а также трансфузионной терапии имеют принципиально важное значение для повышения уровня периоперационной безопасности пациентов онкохирургического профиля и предупреждения угрожающих жизни осложнений.
Следует шире использовать персонифицированный подход к тактике тромбопрофилактики и контроля гемостаза у онкологических пациентов, которым предстоят высокотравматичные операции, в том числе обширная резекция печени. Такой подход предполагает проведение адекватной периоперационной мультимодальной анестезии и аналгезии, предоперационной нормоволемической гемоделюции, выбор оптимального антикоагулянта, заготовку аутологической крови и плазмы с последующей интраоперационной трансфузией.
Такой подход предполагает проведение адекватной периоперационной мультимодальной анестезии и аналгезии, предоперационной нормоволемической гемоделюции, выбор оптимального антикоагулянта, заготовку аутологической крови и плазмы с последующей интраоперационной трансфузией.
Выступая с докладом «Антикоагулянты и рак: увеличивается ли общая выживаемость?», заведующий научно-исследовательским отделением анестезиологии и интенсивной терапии НИР, доктор медицинских наук Иван Иванович Лесной отметил, что на 8-й конференции «Тромбоз и гемостаз при онкологических заболеваниях» (2016 г.) целая секция была посвящена вопросам общей выживаемости у онкологических больных при использовании антикоагулянтов. Окончательный ответ так и не был получен ввиду гетерогенности данных в этих исследованиях: разные типы рака имеют разную чувствительность к антикоагулянтам, время введения и дозирование различались, сообщалось также о том, что противоопухолевый эффект антикоагуляции срабатывает только у больных без метастазов.
Остаются открытыми вопросы, на какой фактор должна быть направлена антикоагулянтная терапия при условии, что она окажет противоопухолевый эффект, и являются ли Xa-фактор и тромбин правильной целью.
Опухоль секретирует тканевой фактор, который влияет на экспрессию маркеров эпителиально-мезенхимальной передачи, а также индуцирует метастазирование. Факторы V и VIII и свободный тканевой фактор способствуют увеличению выработки тромбина, при раке яичника обнаружена повышенная экспрессия фактора V в сочетании с повышенной экспрессией тканевого фактора. Подобные изменения могут объяснять высокую частоту развития венозной тромбоэмболии у этих больных. При раке грудной железы торможение свертывания крови, направленное на Ха-фактор или тромбин, может оказывать только частичный эффект, а на уровне тканевого фактора его эффективность повышается: прямые пероральные антикоагулянты умеренно тормозят рост первичной опухоли (L.A. Norris et al.,2016).
Таким образом, НМГ усиливают действие противоопухолевой терапии, которое не зависит от их антикоагулянтного эффекта. Лечение с использованием НМГ значительно тормозит рост опухоли за счет индуцирования апоптоза опухолевых клеток (Carmazzi et al., 2012) и увеличивает их чувствительность к химиотерапии, подавляя резистентность к препаратам (Pan et al., 2015).
Лечение с использованием НМГ значительно тормозит рост опухоли за счет индуцирования апоптоза опухолевых клеток (Carmazzi et al., 2012) и увеличивает их чувствительность к химиотерапии, подавляя резистентность к препаратам (Pan et al., 2015).
Дальтепарин в ряде исследований показал способность тормозить ангиогенез опухоли карциномы легких Льюиса in vitro за счет подавления продукции VEGF (Takahashi et al., 2005). Бемипарин тормозит образование микротрубочек в микрососудистом эндотелии и подавляет эндотелиальную клеточную пролиферацию (Vgnoli et al., 2011). НМГ усиливают барьерную функцию эндотелия. Выявлены эндотелиально-протекторные свойства НМГ тинзапарина в субтерапевтических дозах. Введение в эндотелиальный слой НМГ значительно замедляет развитие опухоли (B. Kevane, 2017).
Механизмы противоопухолевой активности, предположительно, могут заключаться в повышении чувствительности клеток к противоопухолевой терапии, ингибировании ангиогенеза, ингибировании роста клеток и метастазирования, предотвращении адгезии, инвазии и миграции опухолевых клеток. Рандомизированное исследование ABEL продемонстрировало увеличение выживаемости при добавлении НМГ к основному лечению в адъювантом режиме (Lecumberri et al., 2013) при мелкоклеточном раке легкого, что позволило расставить необходимые акценты и ответить на некоторые спорные вопросы.
Рандомизированное исследование ABEL продемонстрировало увеличение выживаемости при добавлении НМГ к основному лечению в адъювантом режиме (Lecumberri et al., 2013) при мелкоклеточном раке легкого, что позволило расставить необходимые акценты и ответить на некоторые спорные вопросы.
В заключение следует подчеркнуть важность проведения такого рода конференций. Подобные мероприятия позволяют получить новейшую информацию, узнать о мировых тенденциях профилактики тромбозов и кровотечений в онкологии. Конференция отличалась высоким организационным уровнем, оживленные дискуссии подтверждают актуальность обсуждаемых вопросов.
Подготовила Екатерина Марушко
Тематичний номер «Онкологія» № 1 (52), лютий 2018 р.
СТАТТІ ЗА ТЕМОЮ Онкологія та гематологія
22. 12.2021
Акушерство/гінекологія
Онкологія та гематологія Сучасні стратегії профілактики раку шийки матки
12.2021
Акушерство/гінекологія
Онкологія та гематологія Сучасні стратегії профілактики раку шийки маткиРоль вірусу папіломи людини (ВПЛ) у розвитку раку шийки матки (РШМ) та інших захворювань аногенітальної ділянки доведена та загальновідома. Незважаючи на це, щорічно відзначається зростання показників захворюваності на РШМ. Специфічні методи противірусного лікування ВПЛ не розроблені, єдиним дієвим способом попередження розвитку РШМ та інших асоційованих із ним захворювань є вакцинація. Глобальна пандемія коронавірусної хвороби загрожує зірвати вакцинацію проти ВПЛ у країнах із низьким та середнім рівнем доходу, що негативно впливає на стратегію зупинення поширення захворюваності на РШМ. …
…
Одним із найпоширеніших онкологічних захворювань із високим рівнем смертності є рак легені (РЛ). Проте з розширенням уявлення вчених про особливості пухлини та її молекулярно-генетичні характеристики сьогодні відкриваються нові можливості підвищення ефективності терапії шляхом застосування таргетних препаратів при виявленні відповідних мутацій (EGFR, ALK та ін. ). За підтримки Національної асоціації онкологів України 6 листопада відбулася науково-практична конференція «Досягнення в клінічній онкології в 2021 році: прорив в терапії недрібноклітинного раку легень», у рамках якої обговорювали ефективність і профіль безпеки таргетних препаратів у хворих на недрібноклітинний рак легені. …
). За підтримки Національної асоціації онкологів України 6 листопада відбулася науково-практична конференція «Досягнення в клінічній онкології в 2021 році: прорив в терапії недрібноклітинного раку легень», у рамках якої обговорювали ефективність і профіль безпеки таргетних препаратів у хворих на недрібноклітинний рак легені. …
Дешевый диклофенак обладает противораковыми свойствами — ScienceDaily
Диклофенак, распространенное болеутоляющее, обладает значительными противораковыми свойствами, согласно исследователям из проекта «Переназначение лекарств в онкологии».
Проект перепрофилирования лекарств в онкологии (ReDO), международное сотрудничество между Фондом борьбы с раком, Бельгия, и GlobalCures, базирующейся в США, обнаруживает, что существующие и широко используемые нераковые препараты могут представлять собой относительно неиспользованный источник новых методов лечения рака.
Их исследование диклофенака было опубликовано в журнале открытого доступа ecancermedicalscience .
Как и другие лекарства, исследованные в рамках проекта ReDO, диклофенак дешев и легкодоступен — и, поскольку он уже присутствует во многих аптеках, он был тщательно протестирован.
Диклофенак — хорошо известный и широко используемый нестероидный противовоспалительный препарат (НПВП), используемый для лечения боли при таких состояниях, как ревматоидный артрит, а также мигрени, лихорадке, острой подагре и послеоперационной боли.Он доступен как непатентованный препарат и является экономически эффективным.
НПВП показали себя многообещающими в профилактике рака, но в настоящее время появляются доказательства того, что такие лекарства могут быть полезны при фактическом лечении рака. Например, диклофенак, принимаемый в сочетании с другими видами лечения, такими как химиотерапия и лучевая терапия, может повысить их эффективность.
Исследователи ReDO изучили литературу и считают, что существует достаточно доказательств для начала клинических испытаний использования диклофенака для лечения рака.
«Все еще несколько удивительно, что мы все еще не понимаем, сколько стандартных лекарств, которые мы используем каждый день, например, диклофенака, работают», — говорит автор исследования Пан Панциарка, доктор философии, член проекта ReDO и Противораковый фонд. «Но чем больше мы узнаем, тем больше мы можем видеть, что эти препараты являются многоцелевыми агентами с интересными и полезными эффектами на множество путей, представляющих интерес в онкологии».
Учитывая множественные механизмы действия диклофенака, особенно в отношении ангиогенеза и иммунной системы, вполне возможно, что это лекарство с огромным потенциалом для лечения рака, особенно при применении в периоперационном периоде.
Снижение риска послеоперационных отдаленных метастазов за счет использования таких препаратов, как диклофенак, может стать огромной победой в борьбе с раком, говорят авторы.
«В конце концов, именно метастатическое заболевание чаще всего убивает пациентов, а не исходное первичное заболевание», — объясняет Панциарка.
«Также может быть, что диклофенак может иметь синергетическое действие с ингибиторами контрольных точек последнего поколения — комбинация новейших препаратов в арсенале противоопухолевых препаратов с некоторыми из самых старых особенно впечатляет.«
Рассказ Источник:
Материалы предоставлены ecancermedicalscience . Примечание. Содержимое можно редактировать по стилю и длине.
перепрофилированных лекарств в онкологии (ReDO) — диклофенак как противораковое средство
Реферат
Диклофенак (DCF) — хорошо известный и широко используемый нестероидный противовоспалительный препарат (НПВП), обладающий рядом действий, которые представляют интерес в онкологическом контексте. Хотя уже давно существует интерес к использованию НПВП в химиопрофилактике, теперь появляются доказательства того, что такие препараты могут иметь активность в лечебных условиях.DCF, который является мощным ингибитором синтеза ЦОГ-2 и простагландина E2, оказывает ряд эффектов на иммунную систему, ангиогенный каскад, химио- и радиочувствительность и метаболизм опухоли. Оцениваются и обобщаются как доклинические, так и клинические доказательства этих эффектов при различных типах рака, а также описываются соответствующие механизмы действия. Основываясь на этих доказательствах, можно провести дальнейшее клиническое исследование противоопухолевых эффектов DCF, особенно в сочетании с другими агентами, с рядом возможных комбинаций нескольких лекарственных препаратов и различных модальностей, описанных в дополнительных материалах, сопровождающих основную статью.
Оцениваются и обобщаются как доклинические, так и клинические доказательства этих эффектов при различных типах рака, а также описываются соответствующие механизмы действия. Основываясь на этих доказательствах, можно провести дальнейшее клиническое исследование противоопухолевых эффектов DCF, особенно в сочетании с другими агентами, с рядом возможных комбинаций нескольких лекарственных препаратов и различных модальностей, описанных в дополнительных материалах, сопровождающих основную статью.
Ключевые слова: перепрофилирование лекарств, диклофенак, НПВП, периоперационное вмешательство, проект ReDO
Введение
Диклофенак (DCF) — широко используемый нестероидный противовоспалительный препарат (НПВП), используемый для лечения боли при ревматоидном артрите и другие заболевания опорно-двигательного аппарата, мигрень, лихорадка, острая подагра и послеоперационная боль. Этот препарат, впервые разработанный Ciba-Geigy (позже слился с Sandoz и стал Novartis), теперь доступен во всем мире как дженерик. DCF также широко доступен в виде геля для местного применения при локальной боли или для лечения актинического кератоза. В некоторых странах низкодозированные препараты DCF для перорального применения (обычно таблетки по 25 мг в небольших упаковках по 12–18 таблеток) доступны без рецепта (OTC) в качестве анальгетика общего назначения или жаропонижающего средства. Он также общедоступен без рецепта в гелевом формате. Распространенные торговые наименования включают Voltaren, Voltarol, Cataflam, Cambia, Zipsor и Zorvolex.
DCF также широко доступен в виде геля для местного применения при локальной боли или для лечения актинического кератоза. В некоторых странах низкодозированные препараты DCF для перорального применения (обычно таблетки по 25 мг в небольших упаковках по 12–18 таблеток) доступны без рецепта (OTC) в качестве анальгетика общего назначения или жаропонижающего средства. Он также общедоступен без рецепта в гелевом формате. Распространенные торговые наименования включают Voltaren, Voltarol, Cataflam, Cambia, Zipsor и Zorvolex.
DCF играет признанную роль в онкологической практике при лечении боли, связанной с раком, и в качестве местного лечения актинического кератоза, который обычно рассматривается как предраковое поражение.Поскольку это лицензированное и распространенное использование DCF, они выходят за рамки данной статьи, за исключением случая, когда актуальный DCF исследуется на предмет других показаний к раку.
Текущее использование
Дозировка
DCF, который доступен в виде натриевой или калиевой соли, используется в форме таблеток, геля / эмульсии, инъекций и суппозиториев. Дозировки зависят от формата и показаний. Типичные дозы при ревматических заболеваниях и заболеваниях опорно-двигательного аппарата находятся в диапазоне 75–150 мг в 2–3 приема, перорально или ректально.Послеоперационную боль можно лечить с помощью инъекций диклофенака, глубоко внутримышечно или внутривенно в дозе 75–150 мг, с максимальной дозой 150 мг в течение 24 часов. В составе геля используется 3% диклофенак натрия на основе гиалуроната натрия, и он применяется два раза в день в течение 60–90 дней при лечении актинического кератоза [1].
Дозировки зависят от формата и показаний. Типичные дозы при ревматических заболеваниях и заболеваниях опорно-двигательного аппарата находятся в диапазоне 75–150 мг в 2–3 приема, перорально или ректально.Послеоперационную боль можно лечить с помощью инъекций диклофенака, глубоко внутримышечно или внутривенно в дозе 75–150 мг, с максимальной дозой 150 мг в течение 24 часов. В составе геля используется 3% диклофенак натрия на основе гиалуроната натрия, и он применяется два раза в день в течение 60–90 дней при лечении актинического кератоза [1].
Токсичность
Хотя он является неселективным ингибитором обеих изоформ фермента циклооксигеназы (ЦОГ-1 и ЦОГ-2), DCF имеет преимущественное связывание с ЦОГ-2 [2], что может объяснить его промежуточный профиль риска. для желудочно-кишечных (GI) событий по сравнению с некоторыми другими НПВП.Общие побочные эффекты включают боль в животе, запор, диарею, диспепсию, метеоризм, изжогу, тошноту и головную боль. Менее распространенные побочные эффекты включают сыпь, зуд, вздутие живота, изъязвление желудочно-кишечного тракта, отек и головокружение. Редкие, но серьезные побочные эффекты включают желудочно-кишечное кровотечение, анемию, печеночную недостаточность, панкреатит и пневмонию. Как и в случае со всеми НПВП, длительное применение DCF также связано с небольшим увеличением риска сердечно-сосудистых событий, особенно инфаркта миокарда и инсульта. Недавний мета-анализ показал, что сосудистые риски при длительном применении DCF были аналогичны таковым у селективных ингибиторов ЦОГ-2, с соотношением скоростей, равным 1.41 для сосудистых событий для DCF, по сравнению с 1,37 для селективных ингибиторов ЦОГ-2 и 1,44 для ибупрофена [3].
Редкие, но серьезные побочные эффекты включают желудочно-кишечное кровотечение, анемию, печеночную недостаточность, панкреатит и пневмонию. Как и в случае со всеми НПВП, длительное применение DCF также связано с небольшим увеличением риска сердечно-сосудистых событий, особенно инфаркта миокарда и инсульта. Недавний мета-анализ показал, что сосудистые риски при длительном применении DCF были аналогичны таковым у селективных ингибиторов ЦОГ-2, с соотношением скоростей, равным 1.41 для сосудистых событий для DCF, по сравнению с 1,37 для селективных ингибиторов ЦОГ-2 и 1,44 для ибупрофена [3].
DCF противопоказан пациентам с гиперчувствительностью к аспирину или любому другому НПВП в анамнезе, страдающим застойной сердечной недостаточностью, язвенным колитом или другим воспалительным заболеванием кишечника, активной язвой желудочно-кишечного тракта или кровотечением. Также рекомендуется избегать DCF в последнем триместре беременности и соблюдать осторожность во время кормления грудью.
Фармакокинетика
Пероральный DCF быстро всасывается и почти полностью распределяется в плазме и тканях с небольшими доказательствами накопления препарата после повторного приема в пределах нормального терапевтического диапазона [4–6].Пиковая концентрация в плазме после приема одной таблетки диклофенака натрия 50 мг с энтеросолюбильным покрытием составляет 5,0 мкМ и достигается примерно за 2 часа. Калиевая соль DCF всасывается быстрее, и пиковая концентрация в плазме крови в таблетке 50 мг достигает 3,8 мкМ за 20–60 минут. Конечный период полувыведения составляет 1,8 часа после перорального приема. Около 60% препарата и его метаболитов выводятся с мочой, а остальная часть — с желчью с фекалиями. Более 90% пероральной дозы приходится на продукты выведения в течение 72 часов, и только 1% пероральной дозы выводится с мочой в виде неизмененного исходного соединения.
Доклинические данные по раку —
In Vitro и In Vivo В этой статье основное внимание уделяется доказательствам противоопухолевого эффекта лечения DCF, включая данные, специфичные для DCF, и другие данные, которые соответствуют DCF. эффекты как НПВП. В частности, упор делается на постдиагностическом лечении DCF, а не на доказательствах эффективности в контексте химиопрофилактики рака (см. [7] и [8] обзоры НПВП в химиопрофилактике).
эффекты как НПВП. В частности, упор делается на постдиагностическом лечении DCF, а не на доказательствах эффективности в контексте химиопрофилактики рака (см. [7] и [8] обзоры НПВП в химиопрофилактике).
Фибросаркома
Первые доказательства возможного противоопухолевого эффекта DCF были показаны в экспериментальных исследованиях имплантированных опухолей (фибросаркома и гепатома) на модели крыс в 1983 г. [9].Химически индуцированные опухоли у крыс, обработанные рядом ингибиторов простагландинсинтазы (индометацин, диклофенак и аспирин), показали снижение скорости роста и уровней васкуляризации. Последующая работа показала, что DCF увеличивает кровоток в опухоли in vivo , возможно, за счет роли простагландинов в проницаемости сосудов [10].
Эффект in vivo DCF на имплантированные опухоли фибросаркомы у мышей был подтвержден в 2002 году Хофером и его коллегами [11, 12]. G: 5: 113 мышиных клеток фибросаркомы имплантировали самцам мышей C3H / DiSn, и опухоли позволяли развиваться в течение пяти дней перед лекарственным лечением DCF, ибупрофеном или флурбипрофеном при i. п. начата доза 0,15 мг / мышь. Использовали две схемы: лекарство в течение пяти дней (режим A) и в течение четырнадцати дней (режим B) непрерывно, и за животными наблюдали в течение 15 недель. Доза была выбрана авторами, поскольку она приблизительно соответствовала типичной дозе НПВП для человека 1-2,5 мг / кг / день. Режим B превосходил режим A для всех трех испытанных препаратов. Подавление роста опухоли у животных, получавших DCF, наблюдалось через три недели после применения в режиме B (46% контрольных значений, P = 0.019). Анализ in vitro показал уменьшение количества клеток в ответ на концентрации DCF 5 мкМ, 10 мкМ и 20 мкМ.
п. начата доза 0,15 мг / мышь. Использовали две схемы: лекарство в течение пяти дней (режим A) и в течение четырнадцати дней (режим B) непрерывно, и за животными наблюдали в течение 15 недель. Доза была выбрана авторами, поскольку она приблизительно соответствовала типичной дозе НПВП для человека 1-2,5 мг / кг / день. Режим B превосходил режим A для всех трех испытанных препаратов. Подавление роста опухоли у животных, получавших DCF, наблюдалось через три недели после применения в режиме B (46% контрольных значений, P = 0.019). Анализ in vitro показал уменьшение количества клеток в ответ на концентрации DCF 5 мкМ, 10 мкМ и 20 мкМ.
Колоректальный рак
Антипролиферативные эффекты ряда НПВП, включая DCF, были оценены на трех клеточных линиях рака толстой кишки человека (HT-29, SW480 и DLD-1) in vitro в 1994 г. [13] . Было обнаружено, что DCF оказывает антипролиферативный эффект и имеет IC50 55 мкМ, 37 мкМ и 170 мкМ соответственно, что делает DCF одним из самых эффективных из группы протестированных лекарственных средств. Позже исследователи изучили эффект in vivo местного применения DCF с гиалуронаном на имплантированные опухоли аденокарциномы толстой кишки-26 на мышиной модели BALB / c [14]. Местное применение в дозе 6 мг / кг задерживало, а затем остановило рост опухоли по сравнению с контролем.
Позже исследователи изучили эффект in vivo местного применения DCF с гиалуронаном на имплантированные опухоли аденокарциномы толстой кишки-26 на мышиной модели BALB / c [14]. Местное применение в дозе 6 мг / кг задерживало, а затем остановило рост опухоли по сравнению с контролем.
Дополнительные доказательства воздействия на клеточные линии рака толстой кишки были получены в исследовании 2003 года, проведенном Фальковски и его коллегами [15]. В дополнение к результатам in vitro , которые показали, что DCF оказывает дозозависимое действие на линии клеток аденокарциномы толстой кишки мышей C-26, авторы также лечили мышей Balb / cx C57 BL / 6 с сингенными опухолями толстой кишки DCF в дозе 250 мг / л в питьевой воде.Лечение начинали через четыре дня после имплантации опухолевых клеток и продолжали в течение 12 дней. Рост опухоли был снижен по сравнению с необработанным контролем к четвертому дню лечения и продолжался до конца лечения. Простагландин E2 (PGE 2 ) и тромбоксан B2 (TBX 2 ), оба метаболита, участвующие в каскаде арахидоновой кислоты, также значительно снизились к концу лечения.
DCF является компонентом комбинации антиангиогенных комбинированных лекарственных средств TL-118, другими компонентами являются циметидин, циклофосфамид в низких дозах и сульфасалазин.Эффективность TL-118 исследовали на мышиной модели метастазов колоректального рака в печени и сравнивали с лечением рапамицином и антителом против VEGF B20 [16]. Клетки мышиной колоректальной аденокарциномы CT-26 вводили в селезенку самцов мышей CB6F1, что приводило к образованию узелков опухоли печени в течение 17 дней после инокуляции. Мышам вводили TL-118 внутрибрюшинно. Сообщается, что доза DCF составляет 30 мг / кг и включена в протокол TL-118 в первый и четвертый дни каждого шестидневного цикла лечения.Только мыши, получавшие TL-118, показали значительную задержку роста опухоли с зарегистрированной как частичной, так и полной ремиссией. Общая выживаемость как в группах с частичной, так и в полной ремиссии была значительно дольше, чем в контрольной группе, не получавшей лечения, и у животных, получавших рапамицин и B20 ( P <0,0005).
Нейробластома
DCF также тестировали на активность в клеточных линиях нейробластомы и моделях ксенотрансплантатов [17, 18]. Johnsen и др. показали, что ЦОГ-2 был сверхэкспрессирован в 27 из 28 (96%) образцов ткани от педиатрических пациентов с нейробластомой без окрашивания в окружающих тканях. In vitro DCF и селективный ингибитор ЦОГ-2 целекоксиб подавляли рост клеток в панели клеточных линий нейробластомы. IC50 варьировала от 12,5 до 50 мкМ для целекоксиба и от 100 до 600 мкМ для DCF, что свидетельствует об усилении апоптоза в ответ на DCF. In vivo голых крыс, несущих ксенотрансплантаты нейробластомы SH-SY5Y, обрабатывали DCF в питьевой воде в дозе 200 мг / л или 250 мг / л. Рост опухоли значительно подавлялся через 2 дня лечения DCF (200 мг / л, P = 0.042; 250 мг / л, P = 0,024) по сравнению с необработанными контролями. При более высокой дозе рост опухоли подавлялся на протяжении всего периода лечения (через 11 дней после появления пальпируемых опухолей), а вес опухоли при вскрытии был ниже, чем у необработанного контроля для обеих доз (средний вес опухоли 1,52 г, 0,22 г и 0,21 г для контроль, группы 200 мг / л и 250 мг / л соответственно, P = 0,009).
В своей последней работе эта же группа исследователей определила воспалительную подгруппу нейробластом высокого риска, связанную с делецией хромосомы 11q [19].В дополнение к анализу образцов пациентов использовали модель in vivo (голые мыши, инокулированные клетками SK-N-AS, несущими 11q-делецию), чтобы проверить влияние DCF на рост опухоли. Мышей лечили DCF в дозе 250 мг / л с питьевой водой. Разница в объеме опухоли у мышей, получавших DCF, и контрольных мышей была значительной к 8 дню (приблизительно на 33% меньше, P = 0,01) и 9 дню (приблизительно на 40% меньше, P = 0,008).
Комбинация препаратов TL-118 была также протестирована против нейробластомы [20].Агрессивная ортотопическая модель была создана путем имплантации человеческих клеток SK-N-BE (2) мышам NOD-SCID. TL-118 тестировался отдельно и в комбинации с гемцитабином или 13-цис-ретиноевой кислотой. Первоначальное тестирование TL-118 показало высокий уровень токсичности, поэтому была использована уменьшенная доза. Один только TL-118 снижал скорость роста опухоли и увеличивал выживаемость в 1,5 раза ( P <0,0001). Лечение одним гемцитабином также увеличивало выживаемость, но в сочетании с TL-118 эффект был значительно более выраженным, увеличивая выживаемость 2.5-кратный ( P <0,001), что предполагает синергетический эффект.
Один только TL-118 снижал скорость роста опухоли и увеличивал выживаемость в 1,5 раза ( P <0,0001). Лечение одним гемцитабином также увеличивало выживаемость, но в сочетании с TL-118 эффект был значительно более выраженным, увеличивая выживаемость 2.5-кратный ( P <0,001), что предполагает синергетический эффект.
Рак яичников
Зербини и его коллеги оценили комбинаторный эффект комбинированного лечения НПВП на клеточных линиях рака яичников и in vivo [21, 22]. Эффект панели НПВП был протестирован на четырех клеточных линиях рака яичников (SKOV-3, CAOV-3, SW626 и 36M2) и оценен по отдельности и, для наиболее эффективных, в комбинации. DCF (в диапазоне 20–200 мкМ) и сульфид сулиндака показали самую сильную активность, вызывая апоптоз и подавляя рост клеток во всех четырех клеточных линиях.Комбинации DCF плюс сульфид сулиндака, DCF плюс напроксен, сульфид сулиндака плюс напроксен и сулиндак плюс эбселен были более эффективными, чем лечение одним лекарственным средством. In vivo SCID-мышам вводили раковые клетки SKOV-3 и кормили контрольной диетой или диетой с добавлением DCF (доза 100 ppm) или сульфида сулиндака (доза 200 ppm). У всех мышей развились опухоли, но у мышей, получавших DCF или сулиндак, опухоли были на 20% или 30% меньше, чем в контроле ( P <0,05).
In vivo SCID-мышам вводили раковые клетки SKOV-3 и кормили контрольной диетой или диетой с добавлением DCF (доза 100 ppm) или сульфида сулиндака (доза 200 ppm). У всех мышей развились опухоли, но у мышей, получавших DCF или сулиндак, опухоли были на 20% или 30% меньше, чем в контроле ( P <0,05).
Более поздняя работа Валле и его коллег также исследовала использование НПВП, в частности DCF и индометацина, в клеточных линиях рака яичников и модели in vivo [23].Клеточные линии серозной аденокарциномы яичников HEY, OVCAR5 и UCI-101 обрабатывали различными концентрациями двух НПВП в диапазоне 0–500 мкМ в течение 24 часов и оценивали жизнеспособность клеток. Обработка DCF значительно ( P <0,05) снижала жизнеспособность клеток при концентрациях 50 мкМ в клетках HEY и OVCAR5 и при 250 мкМ в линии UCl-101. Клеточную линию HEY использовали в экспериментах in vivo на бестимусных голых мышах. Для группы DCF лечение начинали через 3 дня после инокуляции, DCF вводили внутрибрюшинно два раза в неделю в течение четырех недель в дозе 18 мг / кг.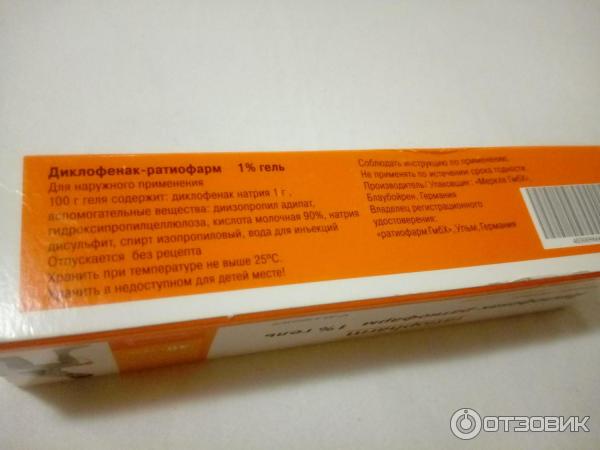 Обработка DCF снижала рост опухоли по сравнению с контролем на 33% ( P = 0,016), тогда как лечение индометацином показало снижение роста опухоли на 22% по сравнению с контрольной группой ( P = 0,031).
Обработка DCF снижала рост опухоли по сравнению с контролем на 33% ( P = 0,016), тогда как лечение индометацином показало снижение роста опухоли на 22% по сравнению с контрольной группой ( P = 0,031).
Другие виды рака
Результаты на модели ортотопического сингенного рака поджелудочной железы у мышей показали, что лечение DCF ингибировало рост опухоли по сравнению с необработанным контролем [24]. У мышей, инокулированных клетками PANC02, развились опухоли поджелудочной железы, которые легко метастазировали в перитонеальную область вокруг места разреза для инокуляции опухолевых клеток.Лечение DCF проводилось перорально с питьевой водой в дозе 30 мг / кг (вес животного), начиналось через три дня после инокуляции и продолжалось в течение 11 дней. У обработанных мышей развивались первичные опухоли со средним весом на 60% ниже, чем у необработанных контрольных ( P ≤ 0,01), в то время как средний вес метастатических опухолей также был ниже у животных DCF, но разница не достигла статистической значимости. Анализ образцов опухолей показал свидетельства увеличения апоптоза и снижения ангиогенеза по сравнению с контролем.Однако эксперименты in vitro не показали доказательств апоптотического эффекта в клетках PANC02, культивированных с DCF в концентрации 10 мкМ и 50 мкМ в течение четырех дней.
Анализ образцов опухолей показал свидетельства увеличения апоптоза и снижения ангиогенеза по сравнению с контролем.Однако эксперименты in vitro не показали доказательств апоптотического эффекта в клетках PANC02, культивированных с DCF в концентрации 10 мкМ и 50 мкМ в течение четырех дней.
также использовали в модели глиомы мышей [25]. Эффект увеличения концентрации DCF от 100 мкМ до 600 мкМ оценивали на культивируемых клетках глиомы GL261. DCF ниже 200 мкМ нарушает рост клеток, а концентрации выше 300 мкМ вызывают гибель клеток.
Продукция лактата клетками значительно снижалась при концентрации 100 мкМ. In vivo самок мышей C57BL / 6 ортотопически инокулировали клетками глиомы GL261, а затем обрабатывали DCF (в дозе 25 мг / кг). Как и в случае анализа in vitro , DCF снизил выработку лактата по сравнению с контролем, хотя и не до статистически значимого уровня. Однако у мышей, получавших DCF, была статистически значимо более высокая медиана общей выживаемости, чем у контрольных мышей (30,5 дней по сравнению с 24 днями, P = 0,0156). Одновременное лечение DCF и R848 (резиквимод, агонист TLR7 / 8) не показало улучшения выживаемости по сравнению с любым лечением отдельно.Последующая работа показала, что IC50 для лечения DCF против панели клеточных линий глиобластомы человека (HTZ-349, U87MG и A172) находится в диапазоне 50–200 мкМ, что является физиологически релевантным [26].
Одновременное лечение DCF и R848 (резиквимод, агонист TLR7 / 8) не показало улучшения выживаемости по сравнению с любым лечением отдельно.Последующая работа показала, что IC50 для лечения DCF против панели клеточных линий глиобластомы человека (HTZ-349, U87MG и A172) находится в диапазоне 50–200 мкМ, что является физиологически релевантным [26].
Комбинация DCF и сорафениба была предметом исследования in vitro с использованием панели из девяти линий клеток меланомы [27]. Комбинация была выбрана после функционального скрининга для выявления многообещающих синергических комбинаций лекарств с активностью против линий клеток меланомы, отображающих основные генетические факторы заболевания (BRAF, NRAS, CDKN2A и т. Д.).Комбинированное лечение сорафенибом и DCF было эффективным против всех клеточных линий, независимо от генотипического статуса. Другая группа исследователей также исследовала активность in vitro сорафениба и ряда ингибиторов ЦОГ, включая DCF, в клеточной линии гепатоцеллюлярной карциномы (ГЦК) HepG2 [28]. Результаты показали, что обработка DCF в концентрации 50 мкг / мл значительно снижает пролиферацию ( P <0,01).
Результаты показали, что обработка DCF в концентрации 50 мкг / мл значительно снижает пролиферацию ( P <0,01).
In vivo также были опубликованы доказательства эффекта DCF при меланоме.Gottfried и др. исследовали влияние DCF на фактор транскрипции Myc и метаболизм глюкозы в клеточных линиях лейкемии, рака простаты и меланомы [29]. Кроме того, группа изучала эффект DCF на сингенной мышиной модели (мыши C57 / BL6, инокулированные клетками меланомы B16). Через четырнадцать дней после инокуляции начинали внутрибрюшинное введение DCF в дозе 15 мг / кг. Значительный эффект ингибирования роста был очевиден в течение трех дней по сравнению с контролем ( P <0.05), а вес и объем опухоли были значительно уменьшены ( P <0,001) в конце эксперимента (через 23 дня после инокуляции опухоли).
Иноуэ и его коллеги исследовали эффект in vivo, и in vitro, местного применения DCF при раке простаты [30]. Используя две клеточные линии рака простаты, одна из которых была трансфицирована для сверхэкспрессии ЦОГ-2, исследователи обрабатывали каждую линию различными концентрациями DCF в диапазоне от 0 до 1000 мкМ в течение 72 часов. Было дозозависимое снижение жизнеспособности клеток, при этом клетки ЦОГ-2 были более чувствительны к DCF. Жизнеспособность клеток в линиях ЦОГ-2 по сравнению с клеточными линиями, не связанными с ЦОГ-2, составляла 74,0% и 95,7% ( P = 0,0094), 51,6% и 73,8% при 50 мкМ ( P <0,0001) соответственно. Рассчитанная IC50 составила 42,2 мкМ и 91,6 мкМ соответственно. Дальнейшие эксперименты in vitro показали, что клетки, сверхэкспрессирующие ЦОГ-2, были более устойчивы к лучевой терапии, чем клетки, не гиперэкспрессирующие ЦОГ-2. Добавление DCF к культурам увеличивало эффект лучевой терапии в клеточной линии COX-2, значительно снижая долю выживаемости при дозе 2 Гр с 78.От 6% до 35,5% ( P = 0,0225). Этот эффект был подтвержден на модели ксенотрансплантата с самцами мышей BALB / c nu / nu, инокулированными линией клеток со сверхэкспрессией СОХ-2, и лечили, когда опухоли достигли 0,5 см в диаметре. В дополнение к необработанному контролю использовались три группы лечения: только местная DCF, только лучевая терапия и местная DCF + лучевая терапия (в дозе 3 Гр).
Было дозозависимое снижение жизнеспособности клеток, при этом клетки ЦОГ-2 были более чувствительны к DCF. Жизнеспособность клеток в линиях ЦОГ-2 по сравнению с клеточными линиями, не связанными с ЦОГ-2, составляла 74,0% и 95,7% ( P = 0,0094), 51,6% и 73,8% при 50 мкМ ( P <0,0001) соответственно. Рассчитанная IC50 составила 42,2 мкМ и 91,6 мкМ соответственно. Дальнейшие эксперименты in vitro показали, что клетки, сверхэкспрессирующие ЦОГ-2, были более устойчивы к лучевой терапии, чем клетки, не гиперэкспрессирующие ЦОГ-2. Добавление DCF к культурам увеличивало эффект лучевой терапии в клеточной линии COX-2, значительно снижая долю выживаемости при дозе 2 Гр с 78.От 6% до 35,5% ( P = 0,0225). Этот эффект был подтвержден на модели ксенотрансплантата с самцами мышей BALB / c nu / nu, инокулированными линией клеток со сверхэкспрессией СОХ-2, и лечили, когда опухоли достигли 0,5 см в диаметре. В дополнение к необработанному контролю использовались три группы лечения: только местная DCF, только лучевая терапия и местная DCF + лучевая терапия (в дозе 3 Гр). На 36 день после лечения средний объем опухоли для группы DCF составлял 32% от контрольной группы, 44% для группы лучевой терапии и 15% для группы комбинированной терапии (все P <0.05).
На 36 день после лечения средний объем опухоли для группы DCF составлял 32% от контрольной группы, 44% для группы лучевой терапии и 15% для группы комбинированной терапии (все P <0.05).
Данные о человеке
В отличие от широкого диапазона результатов in vitro, и in vivo , клинических данных относительно использования DCF в качестве противоопухолевого средства, а не как анальгетика, относительно мало. Хотя использование НПВП в терапии рака вызывает большой клинический интерес, большая часть этого сосредоточена на селективных ингибиторах ЦОГ-2, таких как целекоксиб. Однако данные отсутствуют полностью, и они изложены ниже.
Форгет и его коллеги сообщили о ретроспективном анализе пациентов с раком груди, получавших консервативное хирургическое лечение, с интраоперационными НПВП (DCF или кеторолак) и без них [31].Пациенты, получавшие до операции кеторолак (20-30 мг) или DCF (75 мг), показали улучшение DFS (HR = 0,57, 95% доверительный интервал CI: 0,37–0,89, P = 0,01) и улучшение OS (HR = 0,35, ДИ: 0,17–0,70, P = 0,03) по сравнению с пациентами, не получавшими НПВП. Доля пациентов, получавших НПВП, которые получали DCF, составляла 29% (147/510), что было недостаточно для адекватного анализа DCF, поэтому данные для DCF и кеторолака были объединены в исследовании. Впоследствии было начато проспективное рандомизированное исследование фазы III с использованием кеторолака ({«type»: «клиническое испытание», «attrs»: {«text»: «NCT01806259», «term_id»: «NCT01806259»}} NCT01806259) для изучения влияние на отдаленный рецидив и общую выживаемость пациентов, перенесших операцию по поводу рака груди [32].Накопление для этого испытания завершено в августе 2015 года, а первичный анализ конечных результатов (выживаемость без рецидивов) должен быть проведен в сентябре 2017 года (личное сообщение, Патрис Форгет).
Доля пациентов, получавших НПВП, которые получали DCF, составляла 29% (147/510), что было недостаточно для адекватного анализа DCF, поэтому данные для DCF и кеторолака были объединены в исследовании. Впоследствии было начато проспективное рандомизированное исследование фазы III с использованием кеторолака ({«type»: «клиническое испытание», «attrs»: {«text»: «NCT01806259», «term_id»: «NCT01806259»}} NCT01806259) для изучения влияние на отдаленный рецидив и общую выживаемость пациентов, перенесших операцию по поводу рака груди [32].Накопление для этого испытания завершено в августе 2015 года, а первичный анализ конечных результатов (выживаемость без рецидивов) должен быть проведен в сентябре 2017 года (личное сообщение, Патрис Форгет).
В аналогичном ретроспективном исследовании тех же авторов изучались группы пациентов с раком груди, легких и почек, перенесших хирургическую резекцию [33]. Следует отметить, что результаты немелкоклеточного рака легкого (НМРЛ) показали статистически значимое влияние предоперационной DCF на риск отдаленных метастазов (HR = 0. 14 CI = 0,02–0,99, P = 0,05) и тенденцию к повышению риска смертности (HR = 0,61, CI: 0,35–1,06, P = 0,08) по сравнению с отсутствием использования НПВП.
14 CI = 0,02–0,99, P = 0,05) и тенденцию к повышению риска смертности (HR = 0,61, CI: 0,35–1,06, P = 0,08) по сравнению с отсутствием использования НПВП.
Как упоминалось ранее, TL-118 представляет собой комбинацию из четырех препаратов, которая включает DCF. Производится компанией Tiltan Pharma Ltd, Израиль. Был опубликован отчет о применении стандартной химиотерапии (гемцитабин) и долгосрочном применении TL-118 в случае неоперабельной аденокарциномы поджелудочной железы (не подтвержденной биопсией) [34].Первоначальное лечение было связано с устойчивым снижением онкомаркера CA 19-9 и рентгенологически подтвержденной почти полной ремиссией. Лечение TL-118 было приостановлено из-за токсичности (слабость и рвота) с последующим прекращением лечения гемцитабином, в течение которого уровень СА 19-9 в сыворотке увеличился. Гемцитабин был повторно представлен, но CA 19-9 продолжал расти. Повторное введение TL-118 снова привело к резкому снижению CA 19-9. Пациент все еще проходил комбинированное лечение гемцитабином и TL-118, и через 16 месяцев после постановки диагноза у него не наблюдалось прогрессирования заболевания. Для сравнения авторы приводят цифры 6 и 9 месяцев как средние показатели выживаемости без прогрессирования и общей выживаемости для пациентов, получавших химиотерапию первой линии по поводу рака поджелудочной железы.
Для сравнения авторы приводят цифры 6 и 9 месяцев как средние показатели выживаемости без прогрессирования и общей выживаемости для пациентов, получавших химиотерапию первой линии по поводу рака поджелудочной железы.
Десмоидные опухоли, также известные как агрессивные фиброматозы, представляют собой редкие неметастазирующие опухоли, которые возникают из фибробластических клеток. Хотя они не дают метастазов, они являются местно-инвазивными и по возможности лечат хирургической резекцией, однако рецидивы — частое явление. Лакнер и его коллеги сообщили о двух случаях неоперабельной болезни у педиатрических пациентов, получавших тамоксифен (в дозе 1 мг / кг, перорально, два раза в день) и DCF (в дозе 2 мг / кг, ректально, два раза в день). [35].Оба пациента демонстрировали длительный (четыре года и два года) контроль болезни. О токсичности не сообщалось. Те же авторы впоследствии положительно сообщили о четырех дополнительных пациентах в 11-летнем наблюдательном исследовании [36]. В дополнительном отчете о клиническом случае от Teshima et al описан случай агрессивного рецидивирующего заболевания, который лечили DCF в пероральной дозе 50 мг BID в течение двух лет [37]. Длительное лечение не имело явной токсичности и привело к значительному уменьшению размера опухоли и уменьшению симптомов.Более того, положительные эффекты сохранялись даже после прекращения лечения.
Длительное лечение не имело явной токсичности и привело к значительному уменьшению размера опухоли и уменьшению симптомов.Более того, положительные эффекты сохранялись даже после прекращения лечения.
Воспалительная миофибробластическая опухоль (IMT) — еще одна редкая опухоль мягких тканей, которая может быть местно-инвазивной и имеет признаки как доброкачественного, так и злокачественного заболевания. Стандартным лечением является хирургическая резекция, но рецидивирующее или неоперабельное заболевание является обычным явлением. Tao и его коллеги сообщили о редком случае забрюшинного IMT, который не поддавался полной резекции и поэтому успешно лечился комбинацией метотрексата, цисплатина и DCF (доза не указана) после удаления опухоли [38].
Клинические испытания
По состоянию на 21 сентября 2015 года четыре продолжающихся клинических испытания. Обратите внимание, что в этих испытаниях специально ищут противораковый эффект от DCF или комбинаций лекарств, включая DCF. Испытания по показаниям, не связанным с раком, или испытания по лечению рака, в которых DCF используется для обезболивания, не включены.
Испытания по показаниям, не связанным с раком, или испытания по лечению рака, в которых DCF используется для обезболивания, не включены.
{«type»: «клиническое испытание», «attrs»: {«text»: «NCT01935531», «term_id»: «NCT01935531»}} NCT01935531 — это открытое исследование геля DCF для местного применения в одной группе. (3% DCF в 2.5% гиалуроновой кислоты) у пациентов с актиническим кератозом с целью оценки влияния DCF на выработку лактата и метаболизм опухоли. Образцы биопсии будут сравниваться до и после трех месяцев лечения. Первичным результатом будет уровень лактата до и после лечения. Вторичные результаты включают уровни лактата в здоровой коже у подгруппы пациентов, показатели метаболических изменений (например, гликолитические белки, уровни глюкозы и т. Д.).
Существует также ряд клинических испытаний с участием DCF как компонента TL-118, упомянутых ранее.Пероральное лечение предназначено для приема в течение шести дней из семи: сульфасалазин включен в каждый день лечения, DCF и циклофосфамид — в первый и четвертый дни, а циметидин — во второй, третий, пятый и шестой дни [16].
Механизм действия
Существует множество механизмов действия, которые объясняют различные противораковые эффекты DCF. Многие из них являются общими для других НПВП, особенно для ингибиторов ЦОГ-2, таких как целекоксиб и подобные препараты. Особое значение в этом отношении имеет роль простагландинов, особенно PGE 2 .PGE 2 образуется в результате расщепления арахидоновой кислоты до простагландина H 2 под действием СОХ-1 и СОХ-2 с последующей обработкой микросомальной простагландинсинтазой 1 (mPGES-1). Повышенные уровни mPGES-1 и PGE 2 обнаруживаются при различных типах рака и связаны с хроническим воспалением, которое связано с проопухолевым микроокружением [39, 40]. DCF, как и другие ингибиторы ферментов COX, также снижает синтез PGE 2 , и поэтому многие противораковые эффекты DCF прямо или косвенно связаны со снижением уровней PGE 2 .Однако существуют значительные различия в селективности ЦОГ-1 / ЦОГ-2 между разными НПВП [2, 41], и есть некоторые свидетельства того, что DCF связывается с ЦОГ-2 по другому механизму по сравнению с другими широко используемыми препаратами [42], поэтому в Обсуждение, которое следует после конкретных доказательств DCF, упоминается там, где это возможно, но в некоторых случаях делается ссылка на общие механизмы COX-2 / PGE 2 .
Соответствующие механизмы действия включают:
Ангиогенез
Ингибирование неоангиогенеза опухоли было одним из первых противораковых механизмов, идентифицированных для DCF.Ранняя работа Петерсона и его коллег в 1983 году установила, что введение DCF на животных моделях рака (фибросаркома и гепатома) снижает скорость роста и степень васкуляризации опухолей, как и индометацин или аспирин [9]. Более ранняя работа уже показала, что индометацин и аспирин оказывают ингибирующее действие на рост при раке, хотя первоначально предполагалось, что это в первую очередь связано с обращением иммуносупрессивных эффектов PGE 2 [43]. Чисто связанное с иммунитетом объяснение ингибирования роста индометацином и аспирином было опровергнуто экспериментально, и был исследован ряд альтернативных механизмов [44].
Было обнаружено, что как местное, так и пероральное введение DCF замедляет рост имплантированной опухоли толстой кишки-26 у мышей BALB / c с соответствующим снижением ангиогенеза опухоли, которое было связано со снижением синтеза PGE 2 [14]. Одно из механистических объяснений состоит в том, что PGE 2 активирует продукцию VEGF через простаноидные рецепторы E (EP1 — EP4) [45, 46]. Действительно, генетическая делеция mPGES-1 у мышей MMTV / NDL, которые генетически предрасположены к развитию рака молочной железы HER2 / neu, показала снижение частоты опухолей молочной железы, снижение уровней экспрессии PGE 2 и VEGF-A и более низких уровней. ангиогенеза (измеряется как плотность микрососудов) [47].Аналогичным образом, анализ субпопуляций нейробластомы высокого риска, проведенный Ларссоном и др. , показал, что высокая экспрессия mPGES-1 коррелировала с плохой выживаемостью пациентов и что лечение DCF подавляющим PGE 2 , и что это коррелировало со снижением объемов роста опухоли в модель in vivo на мышах [19].
Одно из механистических объяснений состоит в том, что PGE 2 активирует продукцию VEGF через простаноидные рецепторы E (EP1 — EP4) [45, 46]. Действительно, генетическая делеция mPGES-1 у мышей MMTV / NDL, которые генетически предрасположены к развитию рака молочной железы HER2 / neu, показала снижение частоты опухолей молочной железы, снижение уровней экспрессии PGE 2 и VEGF-A и более низких уровней. ангиогенеза (измеряется как плотность микрососудов) [47].Аналогичным образом, анализ субпопуляций нейробластомы высокого риска, проведенный Ларссоном и др. , показал, что высокая экспрессия mPGES-1 коррелировала с плохой выживаемостью пациентов и что лечение DCF подавляющим PGE 2 , и что это коррелировало со снижением объемов роста опухоли в модель in vivo на мышах [19].
Эффект DCF на экспрессию VEGF также непосредственно оценивался в ряде типов опухолей. Например, после анализа экспрессии ЦОГ-1, ЦОГ-2, VEGF-A и VEGF-C в большой панели образцов опухоли карциномы пищевода ( n = 123), von Rahden и др. оценили эффект трех ЦОГ. ингибиторы, включая DCF, в трех клеточных линиях карциномы пищевода (OSC-1, OSC-2 и OE-33) [48].Обработка DCF в концентрации 10 мкМ значительно снизила экспрессию VEGF-A после 6 часов воздействия в клеточных линиях OSC-1 и OSC-2 и снизила экспрессию VEGF-C после 6 и 12 часов воздействия соответственно в Клеточные линии OSC-1 и OE-33.
оценили эффект трех ЦОГ. ингибиторы, включая DCF, в трех клеточных линиях карциномы пищевода (OSC-1, OSC-2 и OE-33) [48].Обработка DCF в концентрации 10 мкМ значительно снизила экспрессию VEGF-A после 6 часов воздействия в клеточных линиях OSC-1 и OSC-2 и снизила экспрессию VEGF-C после 6 и 12 часов воздействия соответственно в Клеточные линии OSC-1 и OE-33.
Точно так же Mayorek и его коллеги сравнили уровни VEGF у мышей с ортотопическими сингенными опухолями поджелудочной железы, получавших DCF, и необработанных контрольных [24]. У мышей, получавших DCF в дозе 30 мг / кг / день, вводимых с питьевой водой через 3 дня после инокуляции клетками PANC02, развивались опухоли на 60% меньше веса, чем у необработанных контрольных животных.Опухоли животных, получавших DCF, также показали значительно более низкие уровни экспрессии VEGF и более низкие уровни VEGF в перитонеальной жидкости, однако уровни VEGF в плазме не различались. Анализ ex-vivo с использованием колец аорты крысы, обработанных DCF в концентрации 10 мкМ, показал, что площадь прорастания подавлялась в 2,5 раза по сравнению с необработанным контролем.
Помимо VEGF, DCF может влиять на другие ангиогенные пути. Kaur и Sanyal исследовали роль DCF в модели химически индуцированного колоректального рака у мышей [49].Помимо подавления VEGF, они исследовали роль двух хемокинов, хемоаттрактантного белка моноцитов (MCP-1) и воспалительного белка макрофагов (MIP-1α) в ангиогенезе. Лечение животных известным канцерогенным агентом (1,2-диметилгидразин) с одновременным введением DCF и без него в пероральной дозе 8 мг / кг / день показало, что DCF снижает экспрессию VEGF. DCF также снижает экспрессию MCP-1, другого известного маркера ангиогенеза. Однако DCF увеличивает экспрессию MIP-1α (также известного как CCL3), который участвует как в воспалительных, так и в ангиогенных процессах.
Проангиогенные факторы VEGF и основной фактор роста фибробластов (bFGF) усиливают экспрессию хемокинового рецептора CXCR4 на эндотелиальных клетках, делая их более чувствительными к передаче сигналов CXCL12 (также известного как фактор 1α, производного от стромы), что связано с усилением ангиогенеза. и метастатический каскад [50]. Этот процесс может быть усилен с помощью PGE 2 , и было показано, что уменьшение его экспрессии с использованием ингибиторов COX-2 пироксикама и NS398, возможно, снижает экспрессию CXCR4 и последующий уровень ангиогенеза на 50-60% в in vivo эксперимент с пробкой из матригеля [51].
и метастатический каскад [50]. Этот процесс может быть усилен с помощью PGE 2 , и было показано, что уменьшение его экспрессии с использованием ингибиторов COX-2 пироксикама и NS398, возможно, снижает экспрессию CXCR4 и последующий уровень ангиогенеза на 50-60% в in vivo эксперимент с пробкой из матригеля [51].
Кроме того, Colleselli et al показали, что ЦОГ-2 оказывает влияние на эндотелиальные клетки-предшественники (EPC), которые мобилизуются из костного мозга и участвуют в ангиогенезе опухоли [52]. Из двух коферментов ингибирование COX-2 было связано с более сильным снижением пролиферации EPC и увеличением скорости апоптоза. DCF в концентрации 10 мкМ приводил к статистически значимому снижению числа EPC, что соответствовало таковому для целекоксиба, но не для ингибитора СОХ-1 ацетилсалициловой кислоты.Что касается апоптоза, DCF в концентрации 50 мкМ и целекоксиб в концентрации 25 мкМ вызывали статистически значимое увеличение апоптоза по сравнению с контролем.
Иммуномодуляция
Известно, что ассоциированный с опухолью PGE 2 помимо проангиогенных эффектов оказывает негативное влияние на противоопухолевый иммунитет [39, 53]. В дополнение к свидетельствам in vitro и in vivo об иммуносупрессивных эффектах, есть также данные из образцов пациентов, которые коррелируют экспрессию COX-2 / PGE 2 с иммуносупрессией при ряде различных видов рака [54–56].Эффекты ингибирования простагландинов были также исследованы in vitro на субпопуляциях лимфоцитов, полученных от пациентов с раком груди [57, 58]. Анализ показал, что облучение было связано с иммуносупрессией за счет снижения митогенного ответа в популяциях лимфоцитов в ответ на повышенный синтез простагландинов. Обработка in vitro рядом ингибиторов простагландинов обращала этот эффект и могла усиливать митогенные ответы, при этом DCF оказывал наиболее сильное действие.
В то время как иммуносупрессия, связанная с опухолью, представляет собой сложный и многофакторный процесс, в него особенно вовлечен ряд субпопуляций иммунных клеток, в том числе супрессорные клетки миелоидного происхождения (MDSC) и регуляторные Т-клетки (T-reg).
PGE 2 , как было показано, индуцирует дифференцировку стволовых клеток костного мозга в MDSC в ряде животных моделей рака. Например, Sinha и др. показали, что у мышей BALB / c, несущих карциномы молочной железы 4T1, замедлился рост опухоли и уменьшились популяции MDSC, когда рецептор EP2 PGE 2 был нокаутирован, по сравнению с мышами дикого типа [59, 60]. Обработка мышей дикого типа, несущих опухоли 4T1, ингибитором COX-2 (SC58236) также снижала скорость роста опухоли и уменьшала накопление клеток MDSC.Точно так же Fujita и его коллеги показали, что на мышиной модели глиомы блокада COX-2 с использованием аспирина или целекоксиба ингибировала продукцию PGE 2 и замедляла прогрессирование опухоли [61]. Это было связано с уменьшением накопления гранулоцитарных MDSC и повышенным присутствием цитотоксических Т-лимфоцитов (CTL). Следует отметить, что также сообщалось, что лечение аспирином было эффективным только в том случае, если его вводили до развития опухоли, тогда как селективный ингибитор ЦОГ-2 целекоксиб был эффективен при введении через 21 день после имплантации опухоли. Используемая доза целекоксиба составляла 30 мг / кг / день, что, по сообщениям авторов, эквивалентно дозе для человека 400 мг / день, что является клинически значимой дозой. Наконец, Велтман и др. использовали мышиную модель мезотелиомы и показали, что лечение целекоксибом с пищей снижает локальное и системное распространение субпопуляций MDSC, и что это коррелирует со снижением иммуносупрессии [62].
Используемая доза целекоксиба составляла 30 мг / кг / день, что, по сообщениям авторов, эквивалентно дозе для человека 400 мг / день, что является клинически значимой дозой. Наконец, Велтман и др. использовали мышиную модель мезотелиомы и показали, что лечение целекоксибом с пищей снижает локальное и системное распространение субпопуляций MDSC, и что это коррелирует со снижением иммуносупрессии [62].
В дополнение к животным моделям MDSC, связанных с раком, есть некоторые данные из образцов пациентов ex-vivo, представленные Мао и др. [63].Различные популяции мононуклеарных клеток были изолированы от пациентов с меланомой и протестированы на иммуносупрессивную активность. CD14 + Клетки HLADR low / — значительно ингибировали цитолитическую активность и продукцию IFNγ аутологичных неактивированных естественных киллеров (NK) с эффектом, обусловленным высвобождением TGFβ. PGE 2 усиливал продукцию TGFβ моноцитарными клетками. Используя модель на мышах, авторы показали, что прекращение экспрессии СОХ-2 в опухоли обращает вспять иммуносупрессию и увеличивает литическую активность NK-клеток.
Используя модель на мышах, авторы показали, что прекращение экспрессии СОХ-2 в опухоли обращает вспять иммуносупрессию и увеличивает литическую активность NK-клеток.
Хотя нет прямых доказательств специфического действия DCF на MDSC, нет сомнений в том, что он является мощным ингибитором PGE 2 [64, 65]. Точно так же, как мы видели выше, есть доказательства того, что ряд селективных и неселективных ингибиторов COX-2 / PGE 2 может уменьшать популяции MDSC, и поэтому мы ожидаем аналогичной активности от DCF.
Определенные популяции регуляторных Т-клеток, как известно, также связаны с опухолевой иммуносупрессией, особенно CD4 + CD25 + FOXP3 + клетки [66–68].Особый интерес представляет роль COX-2 / PGE 2 в увеличении числа клеток T-reg и иммуносупрессивном фенотипе, что было установлено в ряде моделей опухолей [53, 56, 69, 70]. Было показано, что уменьшение индуцированного опухолью PGE 2 с использованием как селективных, так и неселективных ингибиторов COX снижает популяции и активность T-reg [71–74]. Что касается DCF-специфических доказательств, Chirasani и его коллеги показали как in vitro , так и in vivo , что DCF способен снижать внутриопухолевое накопление и активацию T-reg на модели глиобластомы мыши [25].DCF в концентрации 1,5 мкМ также использовали in vitro для снижения супрессивной активности T-reg клеточных линий плоскоклеточного рака головы и шеи [70].
Что касается DCF-специфических доказательств, Chirasani и его коллеги показали как in vitro , так и in vivo , что DCF способен снижать внутриопухолевое накопление и активацию T-reg на модели глиобластомы мыши [25].DCF в концентрации 1,5 мкМ также использовали in vitro для снижения супрессивной активности T-reg клеточных линий плоскоклеточного рака головы и шеи [70].
PGE 2 также участвует в связанной с опухолью иммуносупрессии посредством ингибирования индукции и созревания антигенпрезентирующих клеток (APC) / дендритных клеток (DC). Помимо данных из первичных опухолевых культур [75], есть также доказательства того, что некоторые популяции стромальных клеток также секретируют PGE 2 и участвуют в ингибировании созревания DC [76].Eruslanov et al. показали в исследовании in vitro , что PGE 2 искажает дифференцировку Th2 APC в сторону MDSC или толерогенных M2-поляризованных макрофагов [77]. Кроме того, было показано, что совместное культивирование с ингибитором ЦОГ-2 LM-1685 частично восстанавливает экспрессию CD11c, маркера DC.
Однако есть также некоторые доказательства того, что PGE 2 необходим для миграции активированных DC в лимфоидные ткани [78, 79]. Йен и его коллеги использовали модель in vivo , чтобы показать, что DCs, созревшие в воспалительных участках, нуждаются как в CCR7, так и в PGE 2 -индуцированной MMP-9 для их направленной миграции в дренирующие лимфатические узлы [79].Следовательно, PGE 2 выполняет как иммуностимулирующую, так и иммуносупрессивную роли в полном жизненном цикле DCs [80].
Анализ Trabanelli и др. предполагает, что неутешительные клинические ответы DC-вакцин в онкологии обусловлены индукцией толерогенных ответов, опосредованных PGE 2 , и что положительные эффекты PGE 2 на DC смягчаются за счет активация иммуносупрессивного фермента индоламин 2, 3-диоксигеназа-1 (IDO1) [81].Клинические последствия этих разнообразных результатов обсуждаются в разделе «Наши выводы» этой статьи.
Апоптоз
Помимо модуляции ангиогенеза и подавления иммунитета, есть некоторые доказательства проапоптотического механизма действия DCF при раке. В одном из более ранних отчетов, описывающих противоопухолевый эффект местного применения DCF с гиалуронаном, было показано, что инкубация клеток толстой кишки-26 с DCF в концентрациях от 30 до 300 мкМ индуцировала значительное увеличение апоптоза [14].Некоторое указание на то, что этот эффект не зависит от ингибирования COX-2 / PGE 2 , был предоставлен Kusuhara и его коллегами, которые показали, что индукция апоптоза DCF в культивируемых клетках слизистой оболочки желудка крыс была связана с каспазозависимой фрагментацией ДНК [82, 83]. Этот результат согласуется с аналогичными современными сообщениями об использовании других НПВП, включая сулиндак [84], аспирин [85] и индометацин [86]. Напротив, Эштон не показал такого увеличения апоптоза в клетках слизистой оболочки желудка морской свинки, подвергнутых воздействию 250 мкМ в течение 24 часов [87].
В одном из более ранних отчетов, описывающих противоопухолевый эффект местного применения DCF с гиалуронаном, было показано, что инкубация клеток толстой кишки-26 с DCF в концентрациях от 30 до 300 мкМ индуцировала значительное увеличение апоптоза [14].Некоторое указание на то, что этот эффект не зависит от ингибирования COX-2 / PGE 2 , был предоставлен Kusuhara и его коллегами, которые показали, что индукция апоптоза DCF в культивируемых клетках слизистой оболочки желудка крыс была связана с каспазозависимой фрагментацией ДНК [82, 83]. Этот результат согласуется с аналогичными современными сообщениями об использовании других НПВП, включая сулиндак [84], аспирин [85] и индометацин [86]. Напротив, Эштон не показал такого увеличения апоптоза в клетках слизистой оболочки желудка морской свинки, подвергнутых воздействию 250 мкМ в течение 24 часов [87].
Гарднер и его коллеги дополнительно выяснили механизм действия ряда НПВП, в том числе DCF, в отношении колоректального рака человека [88]. Используя линию клеток колоректального рака человека SW480, которая не экспрессирует ЦОГ-2, они исследовали влияние индометацина, сульфида сулиндака, сульфона сулиндака, рофекоксиба и DCF на пролиферацию, апоптоз, β-катенин и циклин-D1 in vitro . DCF в концентрации 200 мкМ вызывал статистически значимый антипролиферативный эффект, но это было связано с уменьшением апоптоза.DCF также был связан со снижением уровней белка β-катенина и циклина D. В целом было показано, что DCF обладает умеренной антипролиферативной и слабой проапоптотической активностью в этой клеточной линии. Дополнительное in vitro подтверждение ингибирующего действия на β-катенин было получено из работы Lu и др. , которые подтвердили, что группа НПВП, включая DCF, подавляет β-катенин посредством высокого уровня экспрессии рецептора, активируемого пролифератором пероксисом. -γ (PPAR-γ) [89].
Используя линию клеток колоректального рака человека SW480, которая не экспрессирует ЦОГ-2, они исследовали влияние индометацина, сульфида сулиндака, сульфона сулиндака, рофекоксиба и DCF на пролиферацию, апоптоз, β-катенин и циклин-D1 in vitro . DCF в концентрации 200 мкМ вызывал статистически значимый антипролиферативный эффект, но это было связано с уменьшением апоптоза.DCF также был связан со снижением уровней белка β-катенина и циклина D. В целом было показано, что DCF обладает умеренной антипролиферативной и слабой проапоптотической активностью в этой клеточной линии. Дополнительное in vitro подтверждение ингибирующего действия на β-катенин было получено из работы Lu и др. , которые подтвердили, что группа НПВП, включая DCF, подавляет β-катенин посредством высокого уровня экспрессии рецептора, активируемого пролифератором пероксисом. -γ (PPAR-γ) [89].
Иноуэ и др. исследовали апоптотическую активность DCF в клеточной линии промиелоцитарного лейкоза человека HL-60 [90]. DCF в концентрациях выше 100 мкМ индуцировал фрагментацию ДНК и апоптоз, запускал каспазный каскад и высвобождение цитохрома c. Это было связано с увеличением количества внутриклеточных активных форм кислорода (ROS) с последующим ингибированием фосфорилирования Akt через путь киназы PI3 (PI3K). Johnsen и др. также сообщили о проапоптотическом эффекте DCF при нейробластоме, при этом анализ in vitro выявил доказательства фрагментации ДНК и каспазозависимого пути [17].Ингибирование передачи сигналов Akt / PI3K было также очевидно при колоректальном раке в работе Rana et al [91]. Аналогичным образом, Albano и др. сообщили, что апоптоз в клеточных линиях меланомы человека A2058 и SAN был связан с увеличением внутриклеточных ROS и увеличением каспазы-9 и -3, снижением соотношения Bcl-2 / Bax и высвобождением цитохрома митохондриями. c [92].
DCF в концентрациях выше 100 мкМ индуцировал фрагментацию ДНК и апоптоз, запускал каспазный каскад и высвобождение цитохрома c. Это было связано с увеличением количества внутриклеточных активных форм кислорода (ROS) с последующим ингибированием фосфорилирования Akt через путь киназы PI3 (PI3K). Johnsen и др. также сообщили о проапоптотическом эффекте DCF при нейробластоме, при этом анализ in vitro выявил доказательства фрагментации ДНК и каспазозависимого пути [17].Ингибирование передачи сигналов Akt / PI3K было также очевидно при колоректальном раке в работе Rana et al [91]. Аналогичным образом, Albano и др. сообщили, что апоптоз в клеточных линиях меланомы человека A2058 и SAN был связан с увеличением внутриклеточных ROS и увеличением каспазы-9 и -3, снижением соотношения Bcl-2 / Bax и высвобождением цитохрома митохондриями. c [92].
Singh и др. также сообщили об апоптозе в линиях лейкозных клеток HL-60 и THP-1 и в 43 образцах от пациентов с острым миелоидным лейкозом [93]. Индукция апоптоза происходила посредством активации нескольких факторов транскрипции семейства AP-1 (таких как c-Jun, JunB и Fra-2) и последующей индукции GADD45α, который, в свою очередь, активирует JNK для запуска апоптоза.
Индукция апоптоза происходила посредством активации нескольких факторов транскрипции семейства AP-1 (таких как c-Jun, JunB и Fra-2) и последующей индукции GADD45α, который, в свою очередь, активирует JNK для запуска апоптоза.
Braun и др. исследовали проапоптотические эффекты DCF, ацетилсалициловой кислоты (ASA) и салицилата натрия (NaS) на линии клеток кожной Т-клеточной лимфомы (CTCL) [94]. CTCL представляет собой гетерогенную группу неходжкинских лимфом, которая включает грибовидный микоз и синдром Сезари, а клетки CTCL, как известно, устойчивы к апоптозу, запускаемому через рецепторы смерти [95]. Обработка in vivo НПВП, включая DCF в концентрации 200 мкМ, восстанавливала чувствительность к апоптозу, индуцированному лигандом, индуцирующим апоптоз (TRAIL), вызванным фактором некроза опухоли. В дополнение к анализу in vitro , основанному на установленных клеточных линиях CTCL, анализ ex vivo Т-клеток от четырех пациентов с синдромом Сезари показал усиленный апоптотический ответ у трех из них по сравнению со здоровым контролем. В дополнение к работе Брауна и др. , другие исследователи также исследовали использование ингибирования ЦОГ-2 в CTCL, например, in vivo, работают с целекоксибом на мышиной модели грибовидного микоза [96].
В дополнение к работе Брауна и др. , другие исследователи также исследовали использование ингибирования ЦОГ-2 в CTCL, например, in vivo, работают с целекоксибом на мышиной модели грибовидного микоза [96].
Другой COX-2 / PGE 2 -независимый проапоптотический путь осуществляется через повышенную экспрессию гена 1, активируемого нестероидными противовоспалительными препаратами (NAG-1), также известного как цитокин-1, ингибирующий макрофаги. NAG-1 является членом суперсемейства трансформирующего фактора роста-бета (TGF-β) с доказательствами как про-, так и противораковой активности, возможно, связанной со стадией заболевания [97]. Сверхэкспрессия NAG-1 была связана с индукцией апоптоза в ряде типов рака, возможно, в качестве последующей мишени передачи сигналов p53 [97–100].Kim и др. протестировали относительный эффект различных НПВП на индукцию NAG-1 в линии плоскоклеточной карциномы полости рта (SCC 1483) [101]. DCF был наиболее эффективным из группы используемых NSAID, увеличивая экспрессию NAG-1 в пять раз при концентрации 100 мкМ. Экспрессия NAG-1 увеличивалась до индукции апоптоза, с чем она сильно коррелировала.
Экспрессия NAG-1 увеличивалась до индукции апоптоза, с чем она сильно коррелировала.
На модели рака поджелудочной железы PANCO2 Майорек и его коллеги показали, что лечение DCF в дозе 30 мг / кг вызывало снижение веса опухоли на 60% по сравнению с необработанными контролями, и что уменьшение веса опухоли было вызвано повышенной частотой апоптоза [24].Эффект не был очевиден in vitro , и дальнейший анализ показал как снижение скорости ангиогенеза, так и повышенный уровень активности аргиназы в строме опухоли и перитонеальных макрофагах. Повышенный уровень активности аргиназы был связан с уменьшением оксида азота (NO) и истощением аргинина в брюшной полости и сыворотке, хотя не было показано, как это может усилить апоптотический эффект лечения DCF.
Апоптоз, вызванный лечением НПВП, включая DCF, также был показан Zerbini и его коллегами на панели клеточных линий рака яичников [22].Индукция апоптоза опосредована проапоптотическим геном-7 / интерлейкином-24, ассоциированным с дифференцировкой проапоптотических цитокинов меланомы (mda-7 / IL-24), который опосредует индукцию экспрессии GADD45α и активацию пути JNK.
Функция тромбоцитов
Возрастает интерес к роли тромбоцитов в развитии рака, появляются доказательства их роли в прогрессировании опухоли и метастазировании. Известно, что ряд механизмов активен в прораковой роли тромбоцитов, включая высвобождение проангиогенных факторов, «маскировку» опухолевых клеток из NK-клеток и роль в образовании метастатических ниш [102].Тромбоцитоз, связанный с раком, является обычным клиническим явлением и связан с худшими исходами при ряде видов рака [103–105]. Следует отметить, что есть также некоторые свидетельства того, что предполагаемые противораковые эффекты аспирина могут быть связаны с его антитромбоцитарным действием через необратимое ингибирование ЦОГ-1 [106, 107]. Аналогичным образом, есть некоторые свидетельства того, что другие антитромботические методы лечения, например низкомолекулярные гепарины, также могут обладать противораковой или антиметастатической активностью [108, 109].
В качестве неселективного ингибитора ЦОГ, хотя и с предпочтением ЦОГ-2, DCF также оказывает клинически значимое действие на функцию тромбоцитов посредством ингибирования ЦОГ-1. Van Hecken и др. изучали эффекты группы НПВП на здоровых добровольцах и обнаружили, что при стабильном дозировании DCF по 50 мг три раза в день в течение шести дней ex vivo уровень ЦОГ-1 (выраженный как образование тромбоксана В2 при свертывании цельной крови) было снижено на 53% по сравнению с исходным уровнем, а также значительно снизилась агрегация тромбоцитов ( P <0,001) [64]. Этот эффект на функцию тромбоцитов был также подтвержден в клинических условиях, например, Bajaj et al. сообщили о 64% снижении агрегации тромбоцитов у пациентов, получавших однократную дозу DCF в дозе 75 мг до операции [110].
Van Hecken и др. изучали эффекты группы НПВП на здоровых добровольцах и обнаружили, что при стабильном дозировании DCF по 50 мг три раза в день в течение шести дней ex vivo уровень ЦОГ-1 (выраженный как образование тромбоксана В2 при свертывании цельной крови) было снижено на 53% по сравнению с исходным уровнем, а также значительно снизилась агрегация тромбоцитов ( P <0,001) [64]. Этот эффект на функцию тромбоцитов был также подтвержден в клинических условиях, например, Bajaj et al. сообщили о 64% снижении агрегации тромбоцитов у пациентов, получавших однократную дозу DCF в дозе 75 мг до операции [110].
Таким образом, мы можем предположить, что DCF может также оказывать антиангиогенное, иммуномодулирующее и другие противораковые эффекты посредством ингибирования функции тромбоцитов в дополнение к действиям, опосредованным COX-2 / PGE 2 .
Myc и метаболизм глюкозы
Есть также некоторые свидетельства того, что DCF оказывает влияние на метаболизм опухоли, которое не зависит от его действия как ингибитора ЦОГ. Готфрид и его коллеги показали, что DCF подавляет экспрессию гена Myc и метаболизм глюкозы в ряде клеточных линий лейкемии, рака простаты и меланомы in vitro и на модели меланомы in vivo [29].Следует отметить, что ни аспирин, ни ингибитор ЦОГ-2 NS-398 не влияли на экспрессию Myc или метаболизм глюкозы. Кроме того, DCF ингибировал отток лактата, вызывая повышение клеточных уровней лактата, которое не зависело от воздействия на экспрессию гена Myc. Увеличение клеточного лактата, ведущее к снижению скорости пролиферации, также сопровождалось уменьшением внеклеточного лактата. Точно так же ЦОГ-независимые эффекты на лактат были зарегистрированы в глиобластоме, как in vivo, [25], так и в клеточных линиях глиобластомы человека [26].
Готфрид и его коллеги показали, что DCF подавляет экспрессию гена Myc и метаболизм глюкозы в ряде клеточных линий лейкемии, рака простаты и меланомы in vitro и на модели меланомы in vivo [29].Следует отметить, что ни аспирин, ни ингибитор ЦОГ-2 NS-398 не влияли на экспрессию Myc или метаболизм глюкозы. Кроме того, DCF ингибировал отток лактата, вызывая повышение клеточных уровней лактата, которое не зависело от воздействия на экспрессию гена Myc. Увеличение клеточного лактата, ведущее к снижению скорости пролиферации, также сопровождалось уменьшением внеклеточного лактата. Точно так же ЦОГ-независимые эффекты на лактат были зарегистрированы в глиобластоме, как in vivo, [25], так и в клеточных линиях глиобластомы человека [26].
Воздействие на метаболизм глюкозы может быть связано с воздействием на гликолитические пути через ингибирование STAT3 [26], хотя есть некоторые свидетельства того, что этот эффект также может быть опосредован через связанное с гипоксией подавление переносчика глюкозы 1 (GLUT1) [ 111].
Дополнительные доказательства влияния на экспрессию Myc были также предоставлены Саредди и его коллегами, которые показали, что DCF и целекоксиб вызывают снижение экспрессии передачи сигналов Wnt / β-катенин / Tcf в двух клеточных линиях глиобластомы (U87 и U251) [112]. ].Обработка in vitro показала, что оба препарата (концентрация DCF в диапазоне 50–200 мкМ, целекоксиб в диапазоне 20–80 мкМ) значительно снижали экспрессию последующих мишеней передачи сигналов β-катенина, включая c-Myc и циклин D1. Эти эффекты были связаны с уменьшением пролиферации клеток глиобластомы, образования колоний и инвазии.
Чувствительность к лечению
Есть некоторые свидетельства того, что экспрессия ЦОГ-2 может коррелировать с чувствительностью к химиотерапии или лучевой терапии при различных типах рака.Например, анализ 104 случаев первичного инвазивного рака молочной железы показал, что повышенная экспрессия ЦОГ-2 коррелировала ( P <0,0001) с повышенной экспрессией гена множественной лекарственной устойчивости (MDR1) и P-гликопротеина (P-gp ), оба из которых механически связаны с устойчивостью к химиотерапии [113]. Кроме того, экспрессия MDR1 / P-gp имела прогностическое значение с точки зрения как PFS, так и OS в этой популяции пациентов (оба P <0,0001). При анализе распространенных случаев рака яичников также было обнаружено, что ЦОГ-2 коррелирует с резистентностью к лечению ( P = 0.0072), хотя это варьируется в зависимости от химиотерапевтического препарата, при этом устойчивость к препаратам на основе платины более чувствительна к экспрессии ЦОГ-2, чем лечение паклитакселом.
Кроме того, экспрессия MDR1 / P-gp имела прогностическое значение с точки зрения как PFS, так и OS в этой популяции пациентов (оба P <0,0001). При анализе распространенных случаев рака яичников также было обнаружено, что ЦОГ-2 коррелирует с резистентностью к лечению ( P = 0.0072), хотя это варьируется в зависимости от химиотерапевтического препарата, при этом устойчивость к препаратам на основе платины более чувствительна к экспрессии ЦОГ-2, чем лечение паклитакселом.
На основании этих и других результатов проявился интерес к использованию ингибиторов ЦОГ-2 для повышения чувствительности к химиотерапии [114, 115]. На сегодняшний день проведено ограниченное клиническое исследование этой стратегии. Испытание фазы II с участием пациентов с рецидивирующим раком яичников, подвергавшихся тяжелому предварительному лечению ( n = 45, из которых 23 были резистентными к платине), показало, что комбинация карбоплатина и низких доз целекоксиба (400 мг / день) давала ответ 28.9%, в том числе три полных регрессии. Медиана ВБП составляла в целом 5 месяцев, но среди респондентов ВБП составляла 8 месяцев и ОС 17 месяцев (статистическая значимость не показана) [116].
При хроническом миелоидном лейкозе (ХМЛ) стандартным лечением хронической фазы заболевания является целевой агент мезилат иматиниба. Транспортировка препарата в клетки CML осуществляется через человеческий переносчик органических катионов-1 (OCT-1), а низкая функциональная активность OCT-1 связана с резистентностью к лечению и плохими результатами для пациентов [117].При исследовании лекарственного взаимодействия между иматинибом и панелью распространенных НПВП было показано, что DCF и ибупрофен имеют значительные взаимодействия [118]. В частности, было показано, что DCF в клинически значимой концентрации 10 мкМ увеличивает активность OCT-1 и статистически значимо снижает IC50 иматиниба в двух клеточных линиях CML (K562 и KU812). В отличие от ибупрофена, при клинически значимой концентрации 130 мкМ снижалась активность OCT-1 и повышалось значение IC50 иматиниба.Использование DCF было также протестировано ex vivo с использованием мононуклеарных клеток (MNC) от недавно диагностированных пациентов с CML. Обработка DCF в образцах MNC с низкой исходной активностью OCT-1 увеличивала активность OCT-1 и снижала IC50 иматиниба, что явно указывает на то, что DCF может быть полезен для сенсибилизации пациентов с самым высоким риском неэффективности лечения из-за лекарственной устойчивости.
Другой механизм химиорезистентности включает репопуляцию опухолевых масс за счет ускоренного пролиферативного ответа раковых стволовых клеток после химиотерапии, как было показано Куртовой и др. при раке мочевого пузыря [119].Работа in vitro показала, что этот процесс запускается PGE 2 и что он может быть обращен ингибированием PGE 2 . In vivo моделей ксенотрансплантатов карциномы мочевого пузыря (Т24 и хеморезистентная линия, полученная от пациента), показали, что при комбинированном лечении гемцитабином и целекоксибом резистентность к лечению не возникала.
Вассерман и его коллеги исследовали отдаленные результаты лечения первичного рака груди у женщин, получавших адъювантную лучевую терапию [57].Они показали, что местная лучевая терапия рака груди (45 Гр) вызвала тяжелую лимфопению со снижением количества и реактивности как Т-, так и не-Т-лимфоцитов, и что восстановление Т-клеток все еще затруднялось через 10–11 лет после лечения. Более того, смертность была выше у женщин с нарушенной функцией Т-лимфоцитов в течение восьми лет после лечения. Однако лечение in vitro DCF показало улучшенную реактивность лимфоцитов у подвергшихся лучевой терапии женщин через три месяца после завершения лечения.
Crokart и др. исследовали влияние введения НПВП на давление кислорода на двух сингенных моделях рака у мышей (опухоли печени TLT и фибросаркомы FSaII) [120]. DCF в дозе 20 мг / кг по весу показал увеличение давления кислорода в опухоли примерно через 30 минут после введения, результаты были аналогичны результатам для пироксикама и индометацина. Дальнейший анализ с использованием ингибитора ЦОГ-2 NS-398 показал, что это повышение давления кислорода было связано с задержкой возобновления роста опухоли у мышей, получавших лучевую терапию.
Наше мнение
Доклинические и клинические данные, кратко изложенные в, показывают, что DCF обладает рядом различных противораковых эффектов, которые резюмированы в, которые требуют дальнейшего исследования в клинических условиях. Эти эффекты опосредуются как ЦОГ-зависимыми, так и независимыми механизмами действия, что позволяет предположить, что по крайней мере часть эффекта специфична для DCF, а не связана в целом с другими НПВП, такими как целекоксиб, индометацин и аспирин. DCF извлекает выгоду из мощного подавления как COX-1, так и COX-2, воздействуя как на тромбоциты, так и на PGE 2 -опосредованные прораковые пути, а также демонстрирует ряд COX-независимых путей.Эти множественные механизмы действия делают DCF одним из наиболее интересных НПВП в контексте лечения рака.
DCF механизмы действия.
Таблица 1.
Резюме доказательств по типу рака.
| Тип рака | In vitro | In vivo | Отчет о клиническом случае / испытание | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Колоректальный | [13] | [14–169] | [14–169] 905 Нейробластома | [17, 18] | [17, 18, 20] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Панкреатическая | [24] | {«тип»: «клиническое исследование», «атрибуты» : {«текст»: «NCT01509911», «term_id»: «NCT01509911»}} NCT01509911 {«тип»: «клиническое испытание», «attrs»: {«текст»: «NCT01659502», «term_id»: » NCT01659502 «}} NCT01659502 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Яичников | [22, 23] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Глиома | [112] | 555[92] | [27, 29] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Простата | [30] | {«тип»: «клиническое испытание», «attrs»: {«текст»: «NCT00684970», «term_id»: «NCT00684970»}} NCT00684970 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Грудь | [31] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Десмоидные опухоли | [35–37] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Воспалительная миофибробластическая опухоль| 3862 | 5 | Сочетание антиангиогенной активности с положительным действием на иммунитет особенно интересно в контексте хирургического вмешательства при раке.Появляется все больше доказательств того, что реакция «заживления ран», инициированная хирургическим вмешательством против опухолей, связана с отдаленным метастатическим рецидивом. Доказательства этого эффекта получены как из ретроспективного анализа результатов лечения пациентов, так и из моделей in vivo [121–123]. Предполагается, что действуют несколько механизмов, многие из которых сосредоточены на послеоперационном воспалительном каскаде, ведущем к усилению ангиогенной передачи сигналов и устойчивому подавлению иммунитета [124–126].В ответ на это было обращено внимание на те периоперационные вмешательства, которые могут повлиять на частоту послеоперационных рецидивов за счет избирательного воздействия на аспекты этой реакции заживления ран, особенно в отношении выбора анестезии [127–130]. . Был идентифицирован ряд препаратов, которые могут иметь положительный эффект при использовании в периоперационном или послеоперационном периоде, включая кеторолак [32, 131, 132], циметидин [133, 134] и DCF [31, 33] . Следовательно, дальнейшее исследование периоперационного использования DCF является оправданным при ряде видов рака, при которых часто возникают послеоперационные отдаленные метастазы, включая остеосаркому, карциному пищевода, NSCLC, рак яичников и груди. Сложная роль, которую PGE 2 играет в полном жизненном цикле ДК, может означать, что длительное использование ингибиторов DCF и COX-2 может иметь некоторые негативные эффекты на противоопухолевый иммунитет, хотя картина остается неясной, поскольку от того, являются ли эффекты в целом положительными или отрицательными. Это говорит о том, что, возможно, необходимо соблюдать осторожность при выборе схемы лечения, чтобы отрицательные эффекты были минимизированы, а положительные — максимизированы. Конечно, краткосрочное использование в периоперационных вмешательствах может быть положительным именно из-за времени лечения.Альтернативно, Trabanelli et al предполагают, что блокада IDO1 также может быть жизнеспособной стратегией для уменьшения негативных эффектов на DC [81]. Хотя есть некоторые доказательства того, что DCF обладает проапоптотической активностью, большая часть этих доказательств составляет in vitro и использует относительно высокие концентрации лекарств. Текущий уровень доказательств не поддерживает использование DCF в качестве индуктора апоптоза, и вполне вероятно, что противораковые эффекты в первую очередь связаны с другими механизмами действия. Мы также отмечаем убедительные доклинические доказательства того, что DCF имеет эффект при нейробластоме, заболевании с мрачным прогнозом для пациентов с рефрактерным или метастатическим заболеванием. Несмотря на то, что для этой крайне нуждающейся группы пациентов исследуется ряд новых таргетных агентов, есть несколько клинических испытаний, которые дошли до фазы III. Добавление DCF либо к существующему стандарту лечения, либо к новым целевым агентам имеет потенциал для клинической пользы и, следовательно, требует дальнейшего исследования. Кроме того, учитывая мощные эффекты, которые DCF оказывает на экспрессию PGE 2 , есть смысл исследовать добавление DCF к существующим стандартам лечения тех видов рака, с которыми связана повышенная регуляция PGE 2 , в том числе груди, головы. и рак шеи и колоректального рака. Например, известно, что PGE 2 способствует росту колоректального рака посредством активации передачи сигналов β-катенина [135, 136], и что DCF может ингибировать этот in vivo [137]. Наконец, несмотря на ряд интересных и положительных сообщений о случаях активности DCF в отношении как десмоидных, так и воспалительных миофибробластных опухолей, рандомизированных клинических испытаний, подтверждающих эти результаты, не проводилось. Учитывая очевидную низкую токсичность DCF и положительные результаты, о которых сообщалось, исследование DCF явно необходимо, особенно потому, что многие из агентов, испытываемых в настоящее время (например, сорафениб, иматиниб и кризотиниб), обладают большей токсичностью и затратами, связанными с их. Следующие шагиДоказательства наиболее убедительны для клинических испытаний DCF в сочетании с другими агентами при следующих типах рака:
Периоперационное использование DCF также представляет интерес для периоперационных больных. Перепрофилирование лекарственных средств в онкологии (ReDO) — диклофенак в качестве противоракового средстваРефератДиклофенак (DCF) — хорошо известный и широко используемый нестероидный противовоспалительный препарат (НПВП) с рядом действий которые представляют интерес в онкологическом контексте.Хотя уже давно существует интерес к использованию НПВП в химиопрофилактике, теперь появляются доказательства того, что такие препараты могут иметь активность в лечебных условиях. DCF, который является мощным ингибитором синтеза ЦОГ-2 и простагландина E2, оказывает ряд эффектов на иммунную систему, ангиогенный каскад, химио- и радиочувствительность и метаболизм опухоли. Оцениваются и обобщаются как доклинические, так и клинические доказательства этих эффектов при различных типах рака, а также описываются соответствующие механизмы действия.Основываясь на этих доказательствах, можно провести дальнейшее клиническое исследование противоопухолевых эффектов DCF, особенно в сочетании с другими агентами, с рядом возможных комбинаций нескольких лекарственных препаратов и различных модальностей, описанных в дополнительных материалах, сопровождающих основную статью. Ключевые слова: перепрофилирование лекарств, диклофенак, НПВП, периоперационное вмешательство, проект ReDO ВведениеДиклофенак (DCF) — широко используемый нестероидный противовоспалительный препарат (НПВП), используемый для лечения боли при ревматоидном артрите и другие заболевания опорно-двигательного аппарата, мигрень, лихорадка, острая подагра и послеоперационная боль.Этот препарат, впервые разработанный Ciba-Geigy (позже слился с Sandoz и стал Novartis), теперь доступен во всем мире как дженерик. DCF также широко доступен в виде геля для местного применения при локальной боли или для лечения актинического кератоза. В некоторых странах низкодозированные препараты DCF для перорального применения (обычно таблетки по 25 мг в небольших упаковках по 12–18 таблеток) доступны без рецепта (OTC) в качестве анальгетика общего назначения или жаропонижающего средства. Он также общедоступен без рецепта в гелевом формате.Распространенные торговые наименования включают Voltaren, Voltarol, Cataflam, Cambia, Zipsor и Zorvolex. DCF играет признанную роль в онкологической практике при лечении боли, связанной с раком, и в качестве местного лечения актинического кератоза, который обычно рассматривается как предраковое поражение. Поскольку это лицензированное и распространенное использование DCF, они выходят за рамки данной статьи, за исключением случая, когда актуальный DCF исследуется на предмет других показаний к раку. Текущее использованиеДозировкаDCF, который доступен в виде натриевой или калиевой соли, используется в форме таблеток, геля / эмульсии, инъекций и суппозиториев.Дозировки зависят от формата и показаний. Типичные дозы при ревматических заболеваниях и заболеваниях опорно-двигательного аппарата находятся в диапазоне 75–150 мг в 2–3 приема, перорально или ректально. Послеоперационную боль можно лечить с помощью инъекций диклофенака, глубоко внутримышечно или внутривенно в дозе 75–150 мг, с максимальной дозой 150 мг в течение 24 часов. В составе геля используется 3% диклофенак натрия на основе гиалуроната натрия, и он применяется два раза в день в течение 60–90 дней при лечении актинического кератоза [1]. ТоксичностьХотя он является неселективным ингибитором обеих изоформ фермента циклооксигеназы (ЦОГ-1 и ЦОГ-2), DCF имеет преимущественное связывание с ЦОГ-2 [2], что может объяснить его промежуточный профиль риска. для желудочно-кишечных (GI) событий по сравнению с некоторыми другими НПВП. Общие побочные эффекты включают боль в животе, запор, диарею, диспепсию, метеоризм, изжогу, тошноту и головную боль. Менее распространенные побочные эффекты включают сыпь, зуд, вздутие живота, изъязвление желудочно-кишечного тракта, отек и головокружение.Редкие, но серьезные побочные эффекты включают желудочно-кишечное кровотечение, анемию, печеночную недостаточность, панкреатит и пневмонию. Как и в случае со всеми НПВП, длительное применение DCF также связано с небольшим увеличением риска сердечно-сосудистых событий, особенно инфаркта миокарда и инсульта. Недавний метаанализ показал, что сосудистые риски при длительном применении DCF были аналогичны таковым для селективных ингибиторов ЦОГ-2, с соотношением частот 1,41 для сосудистых событий для DCF, по сравнению с 1,37 для селективных ингибиторов ЦОГ-2 и 1 .44 для ибупрофена [3]. DCF противопоказан пациентам с гиперчувствительностью к аспирину или любому другому НПВП в анамнезе, страдающим застойной сердечной недостаточностью, язвенным колитом или другим воспалительным заболеванием кишечника, активной язвой желудочно-кишечного тракта или кровотечением. Также рекомендуется избегать DCF в последнем триместре беременности и соблюдать осторожность во время кормления грудью. ФармакокинетикаПероральный DCF быстро всасывается и почти полностью распределяется в плазме и тканях с небольшими доказательствами накопления препарата после повторного приема в пределах нормального терапевтического диапазона [4–6].Пиковая концентрация в плазме после приема одной таблетки диклофенака натрия 50 мг с энтеросолюбильным покрытием составляет 5,0 мкМ и достигается примерно за 2 часа. Калиевая соль DCF всасывается быстрее, и пиковая концентрация в плазме крови в таблетке 50 мг достигает 3,8 мкМ за 20–60 минут. Конечный период полувыведения составляет 1,8 часа после перорального приема. Около 60% препарата и его метаболитов выводятся с мочой, а остальная часть — с желчью с фекалиями. Более 90% пероральной дозы приходится на продукты выведения в течение 72 часов, и только 1% пероральной дозы выводится с мочой в виде неизмененного исходного соединения. Доклинические данные по раку —In Vitro и In VivoВ этой статье основное внимание уделяется доказательствам противоопухолевого эффекта лечения DCF, включая данные, специфичные для DCF, и другие данные, которые соответствуют DCF. эффекты как НПВП. В частности, упор делается на постдиагностическом лечении DCF, а не на доказательствах эффективности в контексте химиопрофилактики рака (см. [7] и [8] обзоры НПВП в химиопрофилактике). ФибросаркомаПервые доказательства возможного противоопухолевого эффекта DCF были показаны в экспериментальных исследованиях имплантированных опухолей (фибросаркома и гепатома) на модели крыс в 1983 г. [9].Химически индуцированные опухоли у крыс, обработанные рядом ингибиторов простагландинсинтазы (индометацин, диклофенак и аспирин), показали снижение скорости роста и уровней васкуляризации. Последующая работа показала, что DCF увеличивает кровоток в опухоли in vivo , возможно, за счет роли простагландинов в проницаемости сосудов [10]. Эффект in vivo DCF на имплантированные опухоли фибросаркомы у мышей был подтвержден в 2002 году Хофером и его коллегами [11, 12]. G: 5: 113 мышиных клеток фибросаркомы имплантировали самцам мышей C3H / DiSn, и опухоли позволяли развиваться в течение пяти дней перед лекарственным лечением DCF, ибупрофеном или флурбипрофеном при i.п. начата доза 0,15 мг / мышь. Использовали две схемы: лекарство в течение пяти дней (режим A) и в течение четырнадцати дней (режим B) непрерывно, и за животными наблюдали в течение 15 недель. Доза была выбрана авторами, поскольку она приблизительно соответствовала типичной дозе НПВП для человека 1-2,5 мг / кг / день. Режим B превосходил режим A для всех трех испытанных препаратов. Подавление роста опухоли у животных, получавших DCF, наблюдалось через три недели после применения в режиме B (46% контрольных значений, P = 0.019). Анализ in vitro показал уменьшение количества клеток в ответ на концентрации DCF 5 мкМ, 10 мкМ и 20 мкМ. Колоректальный ракАнтипролиферативные эффекты ряда НПВП, включая DCF, были оценены на трех клеточных линиях рака толстой кишки человека (HT-29, SW480 и DLD-1) in vitro в 1994 г. [13] . Было обнаружено, что DCF оказывает антипролиферативный эффект и имеет IC50 55 мкМ, 37 мкМ и 170 мкМ соответственно, что делает DCF одним из самых эффективных из группы протестированных лекарственных средств.Позже исследователи изучили эффект in vivo местного применения DCF с гиалуронаном на имплантированные опухоли аденокарциномы толстой кишки-26 на мышиной модели BALB / c [14]. Местное применение в дозе 6 мг / кг задерживало, а затем остановило рост опухоли по сравнению с контролем. Дополнительные доказательства воздействия на клеточные линии рака толстой кишки были получены в исследовании 2003 года, проведенном Фальковски и его коллегами [15]. В дополнение к результатам in vitro , которые показали, что DCF оказывает дозозависимое действие на линии клеток аденокарциномы толстой кишки мышей C-26, авторы также лечили мышей Balb / cx C57 BL / 6 с сингенными опухолями толстой кишки DCF в дозе 250 мг / л в питьевой воде.Лечение начинали через четыре дня после имплантации опухолевых клеток и продолжали в течение 12 дней. Рост опухоли был снижен по сравнению с необработанным контролем к четвертому дню лечения и продолжался до конца лечения. Простагландин E2 (PGE 2 ) и тромбоксан B2 (TBX 2 ), оба метаболита, участвующие в каскаде арахидоновой кислоты, также значительно снизились к концу лечения. DCF является компонентом комбинации антиангиогенных комбинированных лекарственных средств TL-118, другими компонентами являются циметидин, циклофосфамид в низких дозах и сульфасалазин.Эффективность TL-118 исследовали на мышиной модели метастазов колоректального рака в печени и сравнивали с лечением рапамицином и антителом против VEGF B20 [16]. Клетки мышиной колоректальной аденокарциномы CT-26 вводили в селезенку самцов мышей CB6F1, что приводило к образованию узелков опухоли печени в течение 17 дней после инокуляции. Мышам вводили TL-118 внутрибрюшинно. Сообщается, что доза DCF составляет 30 мг / кг и включена в протокол TL-118 в первый и четвертый дни каждого шестидневного цикла лечения.Только мыши, получавшие TL-118, показали значительную задержку роста опухоли с зарегистрированной как частичной, так и полной ремиссией. Общая выживаемость как в группах с частичной, так и в полной ремиссии была значительно дольше, чем в контрольной группе, не получавшей лечения, и у животных, получавших рапамицин и B20 ( P <0,0005). НейробластомаDCF также тестировали на активность в клеточных линиях нейробластомы и моделях ксенотрансплантатов [17, 18]. Johnsen и др. показали, что ЦОГ-2 был сверхэкспрессирован в 27 из 28 (96%) образцов ткани от педиатрических пациентов с нейробластомой без окрашивания в окружающих тканях. In vitro DCF и селективный ингибитор ЦОГ-2 целекоксиб подавляли рост клеток в панели клеточных линий нейробластомы. IC50 варьировала от 12,5 до 50 мкМ для целекоксиба и от 100 до 600 мкМ для DCF, что свидетельствует об усилении апоптоза в ответ на DCF. In vivo голых крыс, несущих ксенотрансплантаты нейробластомы SH-SY5Y, обрабатывали DCF в питьевой воде в дозе 200 мг / л или 250 мг / л. Рост опухоли значительно подавлялся через 2 дня лечения DCF (200 мг / л, P = 0.042; 250 мг / л, P = 0,024) по сравнению с необработанными контролями. При более высокой дозе рост опухоли подавлялся на протяжении всего периода лечения (через 11 дней после появления пальпируемых опухолей), а вес опухоли при вскрытии был ниже, чем у необработанного контроля для обеих доз (средний вес опухоли 1,52 г, 0,22 г и 0,21 г для контроль, группы 200 мг / л и 250 мг / л соответственно, P = 0,009). В своей последней работе эта же группа исследователей определила воспалительную подгруппу нейробластом высокого риска, связанную с делецией хромосомы 11q [19].В дополнение к анализу образцов пациентов использовали модель in vivo (голые мыши, инокулированные клетками SK-N-AS, несущими 11q-делецию), чтобы проверить влияние DCF на рост опухоли. Мышей лечили DCF в дозе 250 мг / л с питьевой водой. Разница в объеме опухоли у мышей, получавших DCF, и контрольных мышей была значительной к 8 дню (приблизительно на 33% меньше, P = 0,01) и 9 дню (приблизительно на 40% меньше, P = 0,008). Комбинация препаратов TL-118 была также протестирована против нейробластомы [20].Агрессивная ортотопическая модель была создана путем имплантации человеческих клеток SK-N-BE (2) мышам NOD-SCID. TL-118 тестировался отдельно и в комбинации с гемцитабином или 13-цис-ретиноевой кислотой. Первоначальное тестирование TL-118 показало высокий уровень токсичности, поэтому была использована уменьшенная доза. Один только TL-118 снижал скорость роста опухоли и увеличивал выживаемость в 1,5 раза ( P <0,0001). Лечение одним гемцитабином также увеличивало выживаемость, но в сочетании с TL-118 эффект был значительно более выраженным, увеличивая выживаемость 2.5-кратный ( P <0,001), что предполагает синергетический эффект. Рак яичниковЗербини и его коллеги оценили комбинаторный эффект комбинированного лечения НПВП на клеточных линиях рака яичников и in vivo [21, 22]. Эффект панели НПВП был протестирован на четырех клеточных линиях рака яичников (SKOV-3, CAOV-3, SW626 и 36M2) и оценен по отдельности и, для наиболее эффективных, в комбинации. DCF (в диапазоне 20–200 мкМ) и сульфид сулиндака показали самую сильную активность, вызывая апоптоз и подавляя рост клеток во всех четырех клеточных линиях.Комбинации DCF плюс сульфид сулиндака, DCF плюс напроксен, сульфид сулиндака плюс напроксен и сулиндак плюс эбселен были более эффективными, чем лечение одним лекарственным средством. In vivo SCID-мышам вводили раковые клетки SKOV-3 и кормили контрольной диетой или диетой с добавлением DCF (доза 100 ppm) или сульфида сулиндака (доза 200 ppm). У всех мышей развились опухоли, но у мышей, получавших DCF или сулиндак, опухоли были на 20% или 30% меньше, чем в контроле ( P <0,05). Более поздняя работа Валле и его коллег также исследовала использование НПВП, в частности DCF и индометацина, в клеточных линиях рака яичников и модели in vivo [23].Клеточные линии серозной аденокарциномы яичников HEY, OVCAR5 и UCI-101 обрабатывали различными концентрациями двух НПВП в диапазоне 0–500 мкМ в течение 24 часов и оценивали жизнеспособность клеток. Обработка DCF значительно ( P <0,05) снижала жизнеспособность клеток при концентрациях 50 мкМ в клетках HEY и OVCAR5 и при 250 мкМ в линии UCl-101. Клеточную линию HEY использовали в экспериментах in vivo на бестимусных голых мышах. Для группы DCF лечение начинали через 3 дня после инокуляции, DCF вводили внутрибрюшинно два раза в неделю в течение четырех недель в дозе 18 мг / кг.Обработка DCF снижала рост опухоли по сравнению с контролем на 33% ( P = 0,016), тогда как лечение индометацином показало снижение роста опухоли на 22% по сравнению с контрольной группой ( P = 0,031). Другие виды ракаРезультаты на модели ортотопического сингенного рака поджелудочной железы у мышей показали, что лечение DCF ингибировало рост опухоли по сравнению с необработанным контролем [24]. У мышей, инокулированных клетками PANC02, развились опухоли поджелудочной железы, которые легко метастазировали в перитонеальную область вокруг места разреза для инокуляции опухолевых клеток.Лечение DCF проводилось перорально с питьевой водой в дозе 30 мг / кг (вес животного), начиналось через три дня после инокуляции и продолжалось в течение 11 дней. У обработанных мышей развивались первичные опухоли со средним весом на 60% ниже, чем у необработанных контрольных ( P ≤ 0,01), в то время как средний вес метастатических опухолей также был ниже у животных DCF, но разница не достигла статистической значимости. Анализ образцов опухолей показал свидетельства увеличения апоптоза и снижения ангиогенеза по сравнению с контролем.Однако эксперименты in vitro не показали доказательств апоптотического эффекта в клетках PANC02, культивированных с DCF в концентрации 10 мкМ и 50 мкМ в течение четырех дней. DCFтакже использовали в модели глиомы мышей [25]. Эффект увеличения концентрации DCF от 100 мкМ до 600 мкМ оценивали на культивируемых клетках глиомы GL261. DCF ниже 200 мкМ нарушает рост клеток, а концентрации выше 300 мкМ вызывают гибель клеток. Продукция лактата клетками значительно снижалась при концентрации 100 мкМ. In vivo самок мышей C57BL / 6 ортотопически инокулировали клетками глиомы GL261, а затем обрабатывали DCF (в дозе 25 мг / кг). Как и в случае анализа in vitro , DCF снизил выработку лактата по сравнению с контролем, хотя и не до статистически значимого уровня. Однако у мышей, получавших DCF, была статистически значимо более высокая медиана общей выживаемости, чем у контрольных мышей (30,5 дней по сравнению с 24 днями, P = 0,0156). Одновременное лечение DCF и R848 (резиквимод, агонист TLR7 / 8) не показало улучшения выживаемости по сравнению с любым лечением отдельно.Последующая работа показала, что IC50 для лечения DCF против панели клеточных линий глиобластомы человека (HTZ-349, U87MG и A172) находится в диапазоне 50–200 мкМ, что является физиологически релевантным [26]. Комбинация DCF и сорафениба была предметом исследования in vitro с использованием панели из девяти линий клеток меланомы [27]. Комбинация была выбрана после функционального скрининга для выявления многообещающих синергических комбинаций лекарств с активностью против линий клеток меланомы, отображающих основные генетические факторы заболевания (BRAF, NRAS, CDKN2A и т. Д.).Комбинированное лечение сорафенибом и DCF было эффективным против всех клеточных линий, независимо от генотипического статуса. Другая группа исследователей также исследовала активность in vitro сорафениба и ряда ингибиторов ЦОГ, включая DCF, в клеточной линии гепатоцеллюлярной карциномы (ГЦК) HepG2 [28]. Результаты показали, что обработка DCF в концентрации 50 мкг / мл значительно снижает пролиферацию ( P <0,01). In vivo также были опубликованы доказательства эффекта DCF при меланоме.Gottfried и др. исследовали влияние DCF на фактор транскрипции Myc и метаболизм глюкозы в клеточных линиях лейкемии, рака простаты и меланомы [29]. Кроме того, группа изучала эффект DCF на сингенной мышиной модели (мыши C57 / BL6, инокулированные клетками меланомы B16). Через четырнадцать дней после инокуляции начинали внутрибрюшинное введение DCF в дозе 15 мг / кг. Значительный эффект ингибирования роста был очевиден в течение трех дней по сравнению с контролем ( P <0.05), а вес и объем опухоли были значительно уменьшены ( P <0,001) в конце эксперимента (через 23 дня после инокуляции опухоли). Иноуэ и его коллеги исследовали эффект in vivo, и in vitro, местного применения DCF при раке простаты [30]. Используя две клеточные линии рака простаты, одна из которых была трансфицирована для сверхэкспрессии ЦОГ-2, исследователи обрабатывали каждую линию различными концентрациями DCF в диапазоне от 0 до 1000 мкМ в течение 72 часов.Было дозозависимое снижение жизнеспособности клеток, при этом клетки ЦОГ-2 были более чувствительны к DCF. Жизнеспособность клеток в линиях ЦОГ-2 по сравнению с клеточными линиями, не связанными с ЦОГ-2, составляла 74,0% и 95,7% ( P = 0,0094), 51,6% и 73,8% при 50 мкМ ( P <0,0001) соответственно. Рассчитанная IC50 составила 42,2 мкМ и 91,6 мкМ соответственно. Дальнейшие эксперименты in vitro показали, что клетки, сверхэкспрессирующие ЦОГ-2, были более устойчивы к лучевой терапии, чем клетки, не гиперэкспрессирующие ЦОГ-2. Добавление DCF к культурам увеличивало эффект лучевой терапии в клеточной линии COX-2, значительно снижая долю выживаемости при дозе 2 Гр с 78.От 6% до 35,5% ( P = 0,0225). Этот эффект был подтвержден на модели ксенотрансплантата с самцами мышей BALB / c nu / nu, инокулированными линией клеток со сверхэкспрессией СОХ-2, и лечили, когда опухоли достигли 0,5 см в диаметре. В дополнение к необработанному контролю использовались три группы лечения: только местная DCF, только лучевая терапия и местная DCF + лучевая терапия (в дозе 3 Гр). На 36 день после лечения средний объем опухоли для группы DCF составлял 32% от контрольной группы, 44% для группы лучевой терапии и 15% для группы комбинированной терапии (все P <0.05). Данные о человекеВ отличие от широкого диапазона результатов in vitro, и in vivo , клинических данных относительно использования DCF в качестве противоопухолевого средства, а не как анальгетика, относительно мало. Хотя использование НПВП в терапии рака вызывает большой клинический интерес, большая часть этого сосредоточена на селективных ингибиторах ЦОГ-2, таких как целекоксиб. Однако данные отсутствуют полностью, и они изложены ниже. Форгет и его коллеги сообщили о ретроспективном анализе пациентов с раком груди, получавших консервативное хирургическое лечение, с интраоперационными НПВП (DCF или кеторолак) и без них [31].Пациенты, получавшие до операции кеторолак (20-30 мг) или DCF (75 мг), показали улучшение DFS (HR = 0,57, 95% доверительный интервал CI: 0,37–0,89, P = 0,01) и улучшение OS (HR = 0,35, ДИ: 0,17–0,70, P = 0,03) по сравнению с пациентами, не получавшими НПВП. Доля пациентов, получавших НПВП, которые получали DCF, составляла 29% (147/510), что было недостаточно для адекватного анализа DCF, поэтому данные для DCF и кеторолака были объединены в исследовании. Впоследствии было начато проспективное рандомизированное исследование фазы III с использованием кеторолака ({«type»: «клиническое испытание», «attrs»: {«text»: «NCT01806259», «term_id»: «NCT01806259»}} NCT01806259) для изучения влияние на отдаленный рецидив и общую выживаемость пациентов, перенесших операцию по поводу рака груди [32].Накопление для этого испытания завершено в августе 2015 года, а первичный анализ конечных результатов (выживаемость без рецидивов) должен быть проведен в сентябре 2017 года (личное сообщение, Патрис Форгет). В аналогичном ретроспективном исследовании тех же авторов изучались группы пациентов с раком груди, легких и почек, перенесших хирургическую резекцию [33]. Следует отметить, что результаты немелкоклеточного рака легкого (НМРЛ) показали статистически значимое влияние предоперационной DCF на риск отдаленных метастазов (HR = 0.14 CI = 0,02–0,99, P = 0,05) и тенденцию к повышению риска смертности (HR = 0,61, CI: 0,35–1,06, P = 0,08) по сравнению с отсутствием использования НПВП. Как упоминалось ранее, TL-118 представляет собой комбинацию из четырех препаратов, которая включает DCF. Производится компанией Tiltan Pharma Ltd, Израиль. Был опубликован отчет о применении стандартной химиотерапии (гемцитабин) и долгосрочном применении TL-118 в случае неоперабельной аденокарциномы поджелудочной железы (не подтвержденной биопсией) [34].Первоначальное лечение было связано с устойчивым снижением онкомаркера CA 19-9 и рентгенологически подтвержденной почти полной ремиссией. Лечение TL-118 было приостановлено из-за токсичности (слабость и рвота) с последующим прекращением лечения гемцитабином, в течение которого уровень СА 19-9 в сыворотке увеличился. Гемцитабин был повторно представлен, но CA 19-9 продолжал расти. Повторное введение TL-118 снова привело к резкому снижению CA 19-9. Пациент все еще проходил комбинированное лечение гемцитабином и TL-118, и через 16 месяцев после постановки диагноза у него не наблюдалось прогрессирования заболевания.Для сравнения авторы приводят цифры 6 и 9 месяцев как средние показатели выживаемости без прогрессирования и общей выживаемости для пациентов, получавших химиотерапию первой линии по поводу рака поджелудочной железы. Десмоидные опухоли, также известные как агрессивные фиброматозы, представляют собой редкие неметастазирующие опухоли, которые возникают из фибробластических клеток. Хотя они не дают метастазов, они являются местно-инвазивными и по возможности лечат хирургической резекцией, однако рецидивы — частое явление. Лакнер и его коллеги сообщили о двух случаях неоперабельной болезни у педиатрических пациентов, получавших тамоксифен (в дозе 1 мг / кг, перорально, два раза в день) и DCF (в дозе 2 мг / кг, ректально, два раза в день). [35].Оба пациента демонстрировали длительный (четыре года и два года) контроль болезни. О токсичности не сообщалось. Те же авторы впоследствии положительно сообщили о четырех дополнительных пациентах в 11-летнем наблюдательном исследовании [36]. В дополнительном отчете о клиническом случае от Teshima et al описан случай агрессивного рецидивирующего заболевания, который лечили DCF в пероральной дозе 50 мг BID в течение двух лет [37]. Длительное лечение не имело явной токсичности и привело к значительному уменьшению размера опухоли и уменьшению симптомов.Более того, положительные эффекты сохранялись даже после прекращения лечения. Воспалительная миофибробластическая опухоль (IMT) — еще одна редкая опухоль мягких тканей, которая может быть местно-инвазивной и имеет признаки как доброкачественного, так и злокачественного заболевания. Стандартным лечением является хирургическая резекция, но рецидивирующее или неоперабельное заболевание является обычным явлением. Tao и его коллеги сообщили о редком случае забрюшинного IMT, который не поддавался полной резекции и поэтому успешно лечился комбинацией метотрексата, цисплатина и DCF (доза не указана) после удаления опухоли [38]. Клинические испытанияПо состоянию на 21 сентября 2015 года четыре продолжающихся клинических испытания. Обратите внимание, что в этих испытаниях специально ищут противораковый эффект от DCF или комбинаций лекарств, включая DCF. Испытания по показаниям, не связанным с раком, или испытания по лечению рака, в которых DCF используется для обезболивания, не включены. {«type»: «клиническое испытание», «attrs»: {«text»: «NCT01935531», «term_id»: «NCT01935531»}} NCT01935531 — это открытое исследование геля DCF для местного применения в одной группе. (3% DCF в 2.5% гиалуроновой кислоты) у пациентов с актиническим кератозом с целью оценки влияния DCF на выработку лактата и метаболизм опухоли. Образцы биопсии будут сравниваться до и после трех месяцев лечения. Первичным результатом будет уровень лактата до и после лечения. Вторичные результаты включают уровни лактата в здоровой коже у подгруппы пациентов, показатели метаболических изменений (например, гликолитические белки, уровни глюкозы и т. Д.). Существует также ряд клинических испытаний с участием DCF как компонента TL-118, упомянутых ранее.Пероральное лечение предназначено для приема в течение шести дней из семи: сульфасалазин включен в каждый день лечения, DCF и циклофосфамид — в первый и четвертый дни, а циметидин — во второй, третий, пятый и шестой дни [16]. Механизм действияСуществует множество механизмов действия, которые объясняют различные противораковые эффекты DCF. Многие из них являются общими для других НПВП, особенно для ингибиторов ЦОГ-2, таких как целекоксиб и подобные препараты. Особое значение в этом отношении имеет роль простагландинов, особенно PGE 2 .PGE 2 образуется в результате расщепления арахидоновой кислоты до простагландина H 2 под действием СОХ-1 и СОХ-2 с последующей обработкой микросомальной простагландинсинтазой 1 (mPGES-1). Повышенные уровни mPGES-1 и PGE 2 обнаруживаются при различных типах рака и связаны с хроническим воспалением, которое связано с проопухолевым микроокружением [39, 40]. DCF, как и другие ингибиторы ферментов COX, также снижает синтез PGE 2 , и поэтому многие противораковые эффекты DCF прямо или косвенно связаны со снижением уровней PGE 2 .Однако существуют значительные различия в селективности ЦОГ-1 / ЦОГ-2 между разными НПВП [2, 41], и есть некоторые свидетельства того, что DCF связывается с ЦОГ-2 по другому механизму по сравнению с другими широко используемыми препаратами [42], поэтому в Обсуждение, которое следует после конкретных доказательств DCF, упоминается там, где это возможно, но в некоторых случаях делается ссылка на общие механизмы COX-2 / PGE 2 . Соответствующие механизмы действия включают: АнгиогенезИнгибирование неоангиогенеза опухоли было одним из первых противораковых механизмов, идентифицированных для DCF.Ранняя работа Петерсона и его коллег в 1983 году установила, что введение DCF на животных моделях рака (фибросаркома и гепатома) снижает скорость роста и степень васкуляризации опухолей, как и индометацин или аспирин [9]. Более ранняя работа уже показала, что индометацин и аспирин оказывают ингибирующее действие на рост при раке, хотя первоначально предполагалось, что это в первую очередь связано с обращением иммуносупрессивных эффектов PGE 2 [43]. Чисто связанное с иммунитетом объяснение ингибирования роста индометацином и аспирином было опровергнуто экспериментально, и был исследован ряд альтернативных механизмов [44]. Было обнаружено, что как местное, так и пероральное введение DCF замедляет рост имплантированной опухоли толстой кишки-26 у мышей BALB / c с соответствующим снижением ангиогенеза опухоли, которое было связано со снижением синтеза PGE 2 [14]. Одно из механистических объяснений состоит в том, что PGE 2 активирует продукцию VEGF через простаноидные рецепторы E (EP1 — EP4) [45, 46]. Действительно, генетическая делеция mPGES-1 у мышей MMTV / NDL, которые генетически предрасположены к развитию рака молочной железы HER2 / neu, показала снижение частоты опухолей молочной железы, снижение уровней экспрессии PGE 2 и VEGF-A и более низких уровней. ангиогенеза (измеряется как плотность микрососудов) [47].Аналогичным образом, анализ субпопуляций нейробластомы высокого риска, проведенный Ларссоном и др. , показал, что высокая экспрессия mPGES-1 коррелировала с плохой выживаемостью пациентов и что лечение DCF подавляющим PGE 2 , и что это коррелировало со снижением объемов роста опухоли в модель in vivo на мышах [19]. Эффект DCF на экспрессию VEGF также непосредственно оценивался в ряде типов опухолей. Например, после анализа экспрессии ЦОГ-1, ЦОГ-2, VEGF-A и VEGF-C в большой панели образцов опухоли карциномы пищевода ( n = 123), von Rahden и др. оценили эффект трех ЦОГ. ингибиторы, включая DCF, в трех клеточных линиях карциномы пищевода (OSC-1, OSC-2 и OE-33) [48].Обработка DCF в концентрации 10 мкМ значительно снизила экспрессию VEGF-A после 6 часов воздействия в клеточных линиях OSC-1 и OSC-2 и снизила экспрессию VEGF-C после 6 и 12 часов воздействия соответственно в Клеточные линии OSC-1 и OE-33. Точно так же Mayorek и его коллеги сравнили уровни VEGF у мышей с ортотопическими сингенными опухолями поджелудочной железы, получавших DCF, и необработанных контрольных [24]. У мышей, получавших DCF в дозе 30 мг / кг / день, вводимых с питьевой водой через 3 дня после инокуляции клетками PANC02, развивались опухоли на 60% меньше веса, чем у необработанных контрольных животных.Опухоли животных, получавших DCF, также показали значительно более низкие уровни экспрессии VEGF и более низкие уровни VEGF в перитонеальной жидкости, однако уровни VEGF в плазме не различались. Анализ ex-vivo с использованием колец аорты крысы, обработанных DCF в концентрации 10 мкМ, показал, что площадь прорастания подавлялась в 2,5 раза по сравнению с необработанным контролем. Помимо VEGF, DCF может влиять на другие ангиогенные пути. Kaur и Sanyal исследовали роль DCF в модели химически индуцированного колоректального рака у мышей [49].Помимо подавления VEGF, они исследовали роль двух хемокинов, хемоаттрактантного белка моноцитов (MCP-1) и воспалительного белка макрофагов (MIP-1α) в ангиогенезе. Лечение животных известным канцерогенным агентом (1,2-диметилгидразин) с одновременным введением DCF и без него в пероральной дозе 8 мг / кг / день показало, что DCF снижает экспрессию VEGF. DCF также снижает экспрессию MCP-1, другого известного маркера ангиогенеза. Однако DCF увеличивает экспрессию MIP-1α (также известного как CCL3), который участвует как в воспалительных, так и в ангиогенных процессах. Проангиогенные факторы VEGF и основной фактор роста фибробластов (bFGF) усиливают экспрессию хемокинового рецептора CXCR4 на эндотелиальных клетках, делая их более чувствительными к передаче сигналов CXCL12 (также известного как фактор 1α, производного от стромы), что связано с усилением ангиогенеза. и метастатический каскад [50]. Этот процесс может быть усилен с помощью PGE 2 , и было показано, что уменьшение его экспрессии с использованием ингибиторов COX-2 пироксикама и NS398, возможно, снижает экспрессию CXCR4 и последующий уровень ангиогенеза на 50-60% в in vivo эксперимент с пробкой из матригеля [51]. Кроме того, Colleselli et al показали, что ЦОГ-2 оказывает влияние на эндотелиальные клетки-предшественники (EPC), которые мобилизуются из костного мозга и участвуют в ангиогенезе опухоли [52]. Из двух коферментов ингибирование COX-2 было связано с более сильным снижением пролиферации EPC и увеличением скорости апоптоза. DCF в концентрации 10 мкМ приводил к статистически значимому снижению числа EPC, что соответствовало таковому для целекоксиба, но не для ингибитора СОХ-1 ацетилсалициловой кислоты.Что касается апоптоза, DCF в концентрации 50 мкМ и целекоксиб в концентрации 25 мкМ вызывали статистически значимое увеличение апоптоза по сравнению с контролем. ИммуномодуляцияИзвестно, что ассоциированный с опухолью PGE 2 помимо проангиогенных эффектов оказывает негативное влияние на противоопухолевый иммунитет [39, 53]. В дополнение к свидетельствам in vitro и in vivo об иммуносупрессивных эффектах, есть также данные из образцов пациентов, которые коррелируют экспрессию COX-2 / PGE 2 с иммуносупрессией при ряде различных видов рака [54–56].Эффекты ингибирования простагландинов были также исследованы in vitro на субпопуляциях лимфоцитов, полученных от пациентов с раком груди [57, 58]. Анализ показал, что облучение было связано с иммуносупрессией за счет снижения митогенного ответа в популяциях лимфоцитов в ответ на повышенный синтез простагландинов. Обработка in vitro рядом ингибиторов простагландинов обращала этот эффект и могла усиливать митогенные ответы, при этом DCF оказывал наиболее сильное действие. В то время как иммуносупрессия, связанная с опухолью, представляет собой сложный и многофакторный процесс, в него особенно вовлечен ряд субпопуляций иммунных клеток, в том числе супрессорные клетки миелоидного происхождения (MDSC) и регуляторные Т-клетки (T-reg). PGE 2 , как было показано, индуцирует дифференцировку стволовых клеток костного мозга в MDSC в ряде животных моделей рака. Например, Sinha и др. показали, что у мышей BALB / c, несущих карциномы молочной железы 4T1, замедлился рост опухоли и уменьшились популяции MDSC, когда рецептор EP2 PGE 2 был нокаутирован, по сравнению с мышами дикого типа [59, 60]. Обработка мышей дикого типа, несущих опухоли 4T1, ингибитором COX-2 (SC58236) также снижала скорость роста опухоли и уменьшала накопление клеток MDSC.Точно так же Fujita и его коллеги показали, что на мышиной модели глиомы блокада COX-2 с использованием аспирина или целекоксиба ингибировала продукцию PGE 2 и замедляла прогрессирование опухоли [61]. Это было связано с уменьшением накопления гранулоцитарных MDSC и повышенным присутствием цитотоксических Т-лимфоцитов (CTL). Следует отметить, что также сообщалось, что лечение аспирином было эффективным только в том случае, если его вводили до развития опухоли, тогда как селективный ингибитор ЦОГ-2 целекоксиб был эффективен при введении через 21 день после имплантации опухоли.Используемая доза целекоксиба составляла 30 мг / кг / день, что, по сообщениям авторов, эквивалентно дозе для человека 400 мг / день, что является клинически значимой дозой. Наконец, Велтман и др. использовали мышиную модель мезотелиомы и показали, что лечение целекоксибом с пищей снижает локальное и системное распространение субпопуляций MDSC, и что это коррелирует со снижением иммуносупрессии [62]. В дополнение к животным моделям MDSC, связанных с раком, есть некоторые данные из образцов пациентов ex-vivo, представленные Мао и др. [63].Различные популяции мононуклеарных клеток были изолированы от пациентов с меланомой и протестированы на иммуносупрессивную активность. CD14 + Клетки HLADR low / — значительно ингибировали цитолитическую активность и продукцию IFNγ аутологичных неактивированных естественных киллеров (NK) с эффектом, обусловленным высвобождением TGFβ. PGE 2 усиливал продукцию TGFβ моноцитарными клетками. Используя модель на мышах, авторы показали, что прекращение экспрессии СОХ-2 в опухоли обращает вспять иммуносупрессию и увеличивает литическую активность NK-клеток. Хотя нет прямых доказательств специфического действия DCF на MDSC, нет сомнений в том, что он является мощным ингибитором PGE 2 [64, 65]. Точно так же, как мы видели выше, есть доказательства того, что ряд селективных и неселективных ингибиторов COX-2 / PGE 2 может уменьшать популяции MDSC, и поэтому мы ожидаем аналогичной активности от DCF. Определенные популяции регуляторных Т-клеток, как известно, также связаны с опухолевой иммуносупрессией, особенно CD4 + CD25 + FOXP3 + клетки [66–68].Особый интерес представляет роль COX-2 / PGE 2 в увеличении числа клеток T-reg и иммуносупрессивном фенотипе, что было установлено в ряде моделей опухолей [53, 56, 69, 70]. Было показано, что уменьшение индуцированного опухолью PGE 2 с использованием как селективных, так и неселективных ингибиторов COX снижает популяции и активность T-reg [71–74]. Что касается DCF-специфических доказательств, Chirasani и его коллеги показали как in vitro , так и in vivo , что DCF способен снижать внутриопухолевое накопление и активацию T-reg на модели глиобластомы мыши [25].DCF в концентрации 1,5 мкМ также использовали in vitro для снижения супрессивной активности T-reg клеточных линий плоскоклеточного рака головы и шеи [70]. PGE 2 также участвует в связанной с опухолью иммуносупрессии посредством ингибирования индукции и созревания антигенпрезентирующих клеток (APC) / дендритных клеток (DC). Помимо данных из первичных опухолевых культур [75], есть также доказательства того, что некоторые популяции стромальных клеток также секретируют PGE 2 и участвуют в ингибировании созревания DC [76].Eruslanov et al. показали в исследовании in vitro , что PGE 2 искажает дифференцировку Th2 APC в сторону MDSC или толерогенных M2-поляризованных макрофагов [77]. Кроме того, было показано, что совместное культивирование с ингибитором ЦОГ-2 LM-1685 частично восстанавливает экспрессию CD11c, маркера DC. Однако есть также некоторые доказательства того, что PGE 2 необходим для миграции активированных DC в лимфоидные ткани [78, 79]. Йен и его коллеги использовали модель in vivo , чтобы показать, что DCs, созревшие в воспалительных участках, нуждаются как в CCR7, так и в PGE 2 -индуцированной MMP-9 для их направленной миграции в дренирующие лимфатические узлы [79].Следовательно, PGE 2 выполняет как иммуностимулирующую, так и иммуносупрессивную роли в полном жизненном цикле DCs [80]. Анализ Trabanelli и др. предполагает, что неутешительные клинические ответы DC-вакцин в онкологии обусловлены индукцией толерогенных ответов, опосредованных PGE 2 , и что положительные эффекты PGE 2 на DC смягчаются за счет активация иммуносупрессивного фермента индоламин 2, 3-диоксигеназа-1 (IDO1) [81].Клинические последствия этих разнообразных результатов обсуждаются в разделе «Наши выводы» этой статьи. АпоптозПомимо модуляции ангиогенеза и подавления иммунитета, есть некоторые доказательства проапоптотического механизма действия DCF при раке. В одном из более ранних отчетов, описывающих противоопухолевый эффект местного применения DCF с гиалуронаном, было показано, что инкубация клеток толстой кишки-26 с DCF в концентрациях от 30 до 300 мкМ индуцировала значительное увеличение апоптоза [14].Некоторое указание на то, что этот эффект не зависит от ингибирования COX-2 / PGE 2 , был предоставлен Kusuhara и его коллегами, которые показали, что индукция апоптоза DCF в культивируемых клетках слизистой оболочки желудка крыс была связана с каспазозависимой фрагментацией ДНК [82, 83]. Этот результат согласуется с аналогичными современными сообщениями об использовании других НПВП, включая сулиндак [84], аспирин [85] и индометацин [86]. Напротив, Эштон не показал такого увеличения апоптоза в клетках слизистой оболочки желудка морской свинки, подвергнутых воздействию 250 мкМ в течение 24 часов [87]. Гарднер и его коллеги дополнительно выяснили механизм действия ряда НПВП, в том числе DCF, в отношении колоректального рака человека [88]. Используя линию клеток колоректального рака человека SW480, которая не экспрессирует ЦОГ-2, они исследовали влияние индометацина, сульфида сулиндака, сульфона сулиндака, рофекоксиба и DCF на пролиферацию, апоптоз, β-катенин и циклин-D1 in vitro . DCF в концентрации 200 мкМ вызывал статистически значимый антипролиферативный эффект, но это было связано с уменьшением апоптоза.DCF также был связан со снижением уровней белка β-катенина и циклина D. В целом было показано, что DCF обладает умеренной антипролиферативной и слабой проапоптотической активностью в этой клеточной линии. Дополнительное in vitro подтверждение ингибирующего действия на β-катенин было получено из работы Lu и др. , которые подтвердили, что группа НПВП, включая DCF, подавляет β-катенин посредством высокого уровня экспрессии рецептора, активируемого пролифератором пероксисом. -γ (PPAR-γ) [89]. Иноуэ и др. исследовали апоптотическую активность DCF в клеточной линии промиелоцитарного лейкоза человека HL-60 [90].DCF в концентрациях выше 100 мкМ индуцировал фрагментацию ДНК и апоптоз, запускал каспазный каскад и высвобождение цитохрома c. Это было связано с увеличением количества внутриклеточных активных форм кислорода (ROS) с последующим ингибированием фосфорилирования Akt через путь киназы PI3 (PI3K). Johnsen и др. также сообщили о проапоптотическом эффекте DCF при нейробластоме, при этом анализ in vitro выявил доказательства фрагментации ДНК и каспазозависимого пути [17].Ингибирование передачи сигналов Akt / PI3K было также очевидно при колоректальном раке в работе Rana et al [91]. Аналогичным образом, Albano и др. сообщили, что апоптоз в клеточных линиях меланомы человека A2058 и SAN был связан с увеличением внутриклеточных ROS и увеличением каспазы-9 и -3, снижением соотношения Bcl-2 / Bax и высвобождением цитохрома митохондриями. c [92]. Singh и др. также сообщили об апоптозе в линиях лейкозных клеток HL-60 и THP-1 и в 43 образцах от пациентов с острым миелоидным лейкозом [93].Индукция апоптоза происходила посредством активации нескольких факторов транскрипции семейства AP-1 (таких как c-Jun, JunB и Fra-2) и последующей индукции GADD45α, который, в свою очередь, активирует JNK для запуска апоптоза. Braun и др. исследовали проапоптотические эффекты DCF, ацетилсалициловой кислоты (ASA) и салицилата натрия (NaS) на линии клеток кожной Т-клеточной лимфомы (CTCL) [94]. CTCL представляет собой гетерогенную группу неходжкинских лимфом, которая включает грибовидный микоз и синдром Сезари, а клетки CTCL, как известно, устойчивы к апоптозу, запускаемому через рецепторы смерти [95]. Обработка in vivo НПВП, включая DCF в концентрации 200 мкМ, восстанавливала чувствительность к апоптозу, индуцированному лигандом, индуцирующим апоптоз (TRAIL), вызванным фактором некроза опухоли. В дополнение к анализу in vitro , основанному на установленных клеточных линиях CTCL, анализ ex vivo Т-клеток от четырех пациентов с синдромом Сезари показал усиленный апоптотический ответ у трех из них по сравнению со здоровым контролем. В дополнение к работе Брауна и др. , другие исследователи также исследовали использование ингибирования ЦОГ-2 в CTCL, например, in vivo, работают с целекоксибом на мышиной модели грибовидного микоза [96]. Другой COX-2 / PGE 2 -независимый проапоптотический путь осуществляется через повышенную экспрессию гена 1, активируемого нестероидными противовоспалительными препаратами (NAG-1), также известного как цитокин-1, ингибирующий макрофаги. NAG-1 является членом суперсемейства трансформирующего фактора роста-бета (TGF-β) с доказательствами как про-, так и противораковой активности, возможно, связанной со стадией заболевания [97]. Сверхэкспрессия NAG-1 была связана с индукцией апоптоза в ряде типов рака, возможно, в качестве последующей мишени передачи сигналов p53 [97–100].Kim и др. протестировали относительный эффект различных НПВП на индукцию NAG-1 в линии плоскоклеточной карциномы полости рта (SCC 1483) [101]. DCF был наиболее эффективным из группы используемых NSAID, увеличивая экспрессию NAG-1 в пять раз при концентрации 100 мкМ. Экспрессия NAG-1 увеличивалась до индукции апоптоза, с чем она сильно коррелировала. На модели рака поджелудочной железы PANCO2 Майорек и его коллеги показали, что лечение DCF в дозе 30 мг / кг вызывало снижение веса опухоли на 60% по сравнению с необработанными контролями, и что уменьшение веса опухоли было вызвано повышенной частотой апоптоза [24].Эффект не был очевиден in vitro , и дальнейший анализ показал как снижение скорости ангиогенеза, так и повышенный уровень активности аргиназы в строме опухоли и перитонеальных макрофагах. Повышенный уровень активности аргиназы был связан с уменьшением оксида азота (NO) и истощением аргинина в брюшной полости и сыворотке, хотя не было показано, как это может усилить апоптотический эффект лечения DCF. Апоптоз, вызванный лечением НПВП, включая DCF, также был показан Zerbini и его коллегами на панели клеточных линий рака яичников [22].Индукция апоптоза опосредована проапоптотическим геном-7 / интерлейкином-24, ассоциированным с дифференцировкой проапоптотических цитокинов меланомы (mda-7 / IL-24), который опосредует индукцию экспрессии GADD45α и активацию пути JNK. Функция тромбоцитовВозрастает интерес к роли тромбоцитов в развитии рака, появляются доказательства их роли в прогрессировании опухоли и метастазировании. Известно, что ряд механизмов активен в прораковой роли тромбоцитов, включая высвобождение проангиогенных факторов, «маскировку» опухолевых клеток из NK-клеток и роль в образовании метастатических ниш [102].Тромбоцитоз, связанный с раком, является обычным клиническим явлением и связан с худшими исходами при ряде видов рака [103–105]. Следует отметить, что есть также некоторые свидетельства того, что предполагаемые противораковые эффекты аспирина могут быть связаны с его антитромбоцитарным действием через необратимое ингибирование ЦОГ-1 [106, 107]. Аналогичным образом, есть некоторые свидетельства того, что другие антитромботические методы лечения, например низкомолекулярные гепарины, также могут обладать противораковой или антиметастатической активностью [108, 109]. В качестве неселективного ингибитора ЦОГ, хотя и с предпочтением ЦОГ-2, DCF также оказывает клинически значимое действие на функцию тромбоцитов посредством ингибирования ЦОГ-1.Van Hecken и др. изучали эффекты группы НПВП на здоровых добровольцах и обнаружили, что при стабильном дозировании DCF по 50 мг три раза в день в течение шести дней ex vivo уровень ЦОГ-1 (выраженный как образование тромбоксана В2 при свертывании цельной крови) было снижено на 53% по сравнению с исходным уровнем, а также значительно снизилась агрегация тромбоцитов ( P <0,001) [64]. Этот эффект на функцию тромбоцитов был также подтвержден в клинических условиях, например, Bajaj et al. сообщили о 64% снижении агрегации тромбоцитов у пациентов, получавших однократную дозу DCF в дозе 75 мг до операции [110]. Таким образом, мы можем предположить, что DCF может также оказывать антиангиогенное, иммуномодулирующее и другие противораковые эффекты посредством ингибирования функции тромбоцитов в дополнение к действиям, опосредованным COX-2 / PGE 2 . Myc и метаболизм глюкозыЕсть также некоторые свидетельства того, что DCF оказывает влияние на метаболизм опухоли, которое не зависит от его действия как ингибитора ЦОГ. Готфрид и его коллеги показали, что DCF подавляет экспрессию гена Myc и метаболизм глюкозы в ряде клеточных линий лейкемии, рака простаты и меланомы in vitro и на модели меланомы in vivo [29].Следует отметить, что ни аспирин, ни ингибитор ЦОГ-2 NS-398 не влияли на экспрессию Myc или метаболизм глюкозы. Кроме того, DCF ингибировал отток лактата, вызывая повышение клеточных уровней лактата, которое не зависело от воздействия на экспрессию гена Myc. Увеличение клеточного лактата, ведущее к снижению скорости пролиферации, также сопровождалось уменьшением внеклеточного лактата. Точно так же ЦОГ-независимые эффекты на лактат были зарегистрированы в глиобластоме, как in vivo, [25], так и в клеточных линиях глиобластомы человека [26]. Воздействие на метаболизм глюкозы может быть связано с воздействием на гликолитические пути через ингибирование STAT3 [26], хотя есть некоторые свидетельства того, что этот эффект также может быть опосредован через связанное с гипоксией подавление переносчика глюкозы 1 (GLUT1) [ 111]. Дополнительные доказательства влияния на экспрессию Myc были также предоставлены Саредди и его коллегами, которые показали, что DCF и целекоксиб вызывают снижение экспрессии передачи сигналов Wnt / β-катенин / Tcf в двух клеточных линиях глиобластомы (U87 и U251) [112]. ].Обработка in vitro показала, что оба препарата (концентрация DCF в диапазоне 50–200 мкМ, целекоксиб в диапазоне 20–80 мкМ) значительно снижали экспрессию последующих мишеней передачи сигналов β-катенина, включая c-Myc и циклин D1. Эти эффекты были связаны с уменьшением пролиферации клеток глиобластомы, образования колоний и инвазии. Чувствительность к лечениюЕсть некоторые свидетельства того, что экспрессия ЦОГ-2 может коррелировать с чувствительностью к химиотерапии или лучевой терапии при различных типах рака.Например, анализ 104 случаев первичного инвазивного рака молочной железы показал, что повышенная экспрессия ЦОГ-2 коррелировала ( P <0,0001) с повышенной экспрессией гена множественной лекарственной устойчивости (MDR1) и P-гликопротеина (P-gp ), оба из которых механически связаны с устойчивостью к химиотерапии [113]. Кроме того, экспрессия MDR1 / P-gp имела прогностическое значение с точки зрения как PFS, так и OS в этой популяции пациентов (оба P <0,0001). При анализе распространенных случаев рака яичников также было обнаружено, что ЦОГ-2 коррелирует с резистентностью к лечению ( P = 0.0072), хотя это варьируется в зависимости от химиотерапевтического препарата, при этом устойчивость к препаратам на основе платины более чувствительна к экспрессии ЦОГ-2, чем лечение паклитакселом. На основании этих и других результатов проявился интерес к использованию ингибиторов ЦОГ-2 для повышения чувствительности к химиотерапии [114, 115]. На сегодняшний день проведено ограниченное клиническое исследование этой стратегии. Испытание фазы II с участием пациентов с рецидивирующим раком яичников, подвергавшихся тяжелому предварительному лечению ( n = 45, из которых 23 были резистентными к платине), показало, что комбинация карбоплатина и низких доз целекоксиба (400 мг / день) давала ответ 28.9%, в том числе три полных регрессии. Медиана ВБП составляла в целом 5 месяцев, но среди респондентов ВБП составляла 8 месяцев и ОС 17 месяцев (статистическая значимость не показана) [116]. При хроническом миелоидном лейкозе (ХМЛ) стандартным лечением хронической фазы заболевания является целевой агент мезилат иматиниба. Транспортировка препарата в клетки CML осуществляется через человеческий переносчик органических катионов-1 (OCT-1), а низкая функциональная активность OCT-1 связана с резистентностью к лечению и плохими результатами для пациентов [117].При исследовании лекарственного взаимодействия между иматинибом и панелью распространенных НПВП было показано, что DCF и ибупрофен имеют значительные взаимодействия [118]. В частности, было показано, что DCF в клинически значимой концентрации 10 мкМ увеличивает активность OCT-1 и статистически значимо снижает IC50 иматиниба в двух клеточных линиях CML (K562 и KU812). В отличие от ибупрофена, при клинически значимой концентрации 130 мкМ снижалась активность OCT-1 и повышалось значение IC50 иматиниба.Использование DCF было также протестировано ex vivo с использованием мононуклеарных клеток (MNC) от недавно диагностированных пациентов с CML. Обработка DCF в образцах MNC с низкой исходной активностью OCT-1 увеличивала активность OCT-1 и снижала IC50 иматиниба, что явно указывает на то, что DCF может быть полезен для сенсибилизации пациентов с самым высоким риском неэффективности лечения из-за лекарственной устойчивости. Другой механизм химиорезистентности включает репопуляцию опухолевых масс за счет ускоренного пролиферативного ответа раковых стволовых клеток после химиотерапии, как было показано Куртовой и др. при раке мочевого пузыря [119].Работа in vitro показала, что этот процесс запускается PGE 2 и что он может быть обращен ингибированием PGE 2 . In vivo моделей ксенотрансплантатов карциномы мочевого пузыря (Т24 и хеморезистентная линия, полученная от пациента), показали, что при комбинированном лечении гемцитабином и целекоксибом резистентность к лечению не возникала. Вассерман и его коллеги исследовали отдаленные результаты лечения первичного рака груди у женщин, получавших адъювантную лучевую терапию [57].Они показали, что местная лучевая терапия рака груди (45 Гр) вызвала тяжелую лимфопению со снижением количества и реактивности как Т-, так и не-Т-лимфоцитов, и что восстановление Т-клеток все еще затруднялось через 10–11 лет после лечения. Более того, смертность была выше у женщин с нарушенной функцией Т-лимфоцитов в течение восьми лет после лечения. Однако лечение in vitro DCF показало улучшенную реактивность лимфоцитов у подвергшихся лучевой терапии женщин через три месяца после завершения лечения. Crokart и др. исследовали влияние введения НПВП на давление кислорода на двух сингенных моделях рака у мышей (опухоли печени TLT и фибросаркомы FSaII) [120]. DCF в дозе 20 мг / кг по весу показал увеличение давления кислорода в опухоли примерно через 30 минут после введения, результаты были аналогичны результатам для пироксикама и индометацина. Дальнейший анализ с использованием ингибитора ЦОГ-2 NS-398 показал, что это повышение давления кислорода было связано с задержкой возобновления роста опухоли у мышей, получавших лучевую терапию. Наше мнениеДоклинические и клинические данные, кратко изложенные в, показывают, что DCF обладает рядом различных противораковых эффектов, которые резюмированы в, которые требуют дальнейшего исследования в клинических условиях. Эти эффекты опосредуются как ЦОГ-зависимыми, так и независимыми механизмами действия, что позволяет предположить, что по крайней мере часть эффекта специфична для DCF, а не связана в целом с другими НПВП, такими как целекоксиб, индометацин и аспирин. DCF извлекает выгоду из мощного подавления как COX-1, так и COX-2, воздействуя как на тромбоциты, так и на PGE 2 -опосредованные прораковые пути, а также демонстрирует ряд COX-независимых путей.Эти множественные механизмы действия делают DCF одним из наиболее интересных НПВП в контексте лечения рака. DCF механизмы действия. Таблица 1.Резюме доказательств по типу рака.
|

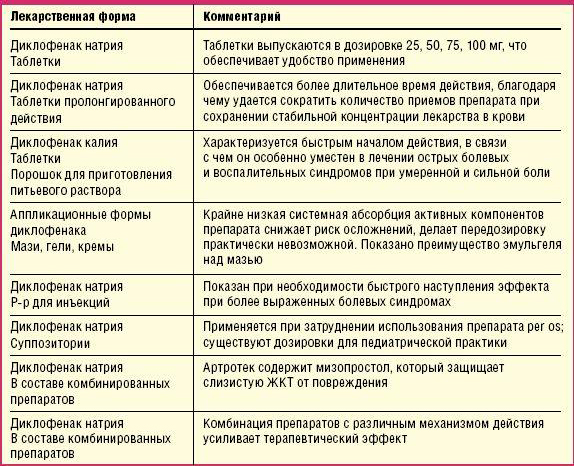

 Она важнее всего остального для выживания – считает мозг. А пациент в этот момент не может нормально думать и делать какие-то другие дела.
Она важнее всего остального для выживания – считает мозг. А пациент в этот момент не может нормально думать и делать какие-то другие дела. Тот случай, когда органические причины боли отсутствуют, но она не уходит: например, опухоль уже удалили, заживление после операции прошло, а боль осталась. Бывает, что боль, по оценке самого пациента, гораздо сильнее, чем должна быть при его состоянии здоровья.
Тот случай, когда органические причины боли отсутствуют, но она не уходит: например, опухоль уже удалили, заживление после операции прошло, а боль осталась. Бывает, что боль, по оценке самого пациента, гораздо сильнее, чем должна быть при его состоянии здоровья.


 Серьезный багаж опыта «Медицины 24/7» подтверждает: даже на последних стадиях онкологического процесса, даже у неизлечимых пациентов – практически всегда остается возможность сохранить человеку ясное сознание и нормальное качество жизни без страданий.
Серьезный багаж опыта «Медицины 24/7» подтверждает: даже на последних стадиях онкологического процесса, даже у неизлечимых пациентов – практически всегда остается возможность сохранить человеку ясное сознание и нормальное качество жизни без страданий.





 Развиваются в сосудах, суставах, костях, нервах. Продолжительная, тупая боль.
Развиваются в сосудах, суставах, костях, нервах. Продолжительная, тупая боль. Боли различной локализации и интенсивности, что невозможно устранить с помощью медикаментозной терапии.
Боли различной локализации и интенсивности, что невозможно устранить с помощью медикаментозной терапии. Сделать это следует, даже если нет болей. Анальголог расписывает поэтапную схему обезболивания, которой станет придерживаться наблюдающий больного врач.
Сделать это следует, даже если нет болей. Анальголог расписывает поэтапную схему обезболивания, которой станет придерживаться наблюдающий больного врач.


 Улучшают сон, оказывают успокоительное действие, усиливает действие наркотических анальгетиков.
Улучшают сон, оказывают успокоительное действие, усиливает действие наркотических анальгетиков.

 Комбинацию подкрепляют и вспомогательной терапией из первой ступени.
Комбинацию подкрепляют и вспомогательной терапией из первой ступени.

 Назначение лекарств осуществляется всего один раз. Вначале вводят препараты группы НПВС, после чего добавляют небольшую дозу Трамадола. Кратность приема лекарств – 3 раза в сутки.
Назначение лекарств осуществляется всего один раз. Вначале вводят препараты группы НПВС, после чего добавляют небольшую дозу Трамадола. Кратность приема лекарств – 3 раза в сутки.
 Благодаря восстановлению апоптоза происходит гибель раковых клеток, замедление роста опухоли, ее постепенное уменьшение и рассасывание.
Благодаря восстановлению апоптоза происходит гибель раковых клеток, замедление роста опухоли, ее постепенное уменьшение и рассасывание.