в «Зарядье» пройдет лекция о генетике / Новости города / Сайт Москвы
В павильоне «Заповедное посольство» парка «Зарядье» 25 апреля пройдет лекция «Генетические факторы здоровья». Она приурочена к Международному дню ДНК.
Главный внештатный специалист по медицинской генетике Департамента здравоохранения города Москвы доктор медицинских наук Наталия Демикова расскажет о том, как достижения генетики используются в современной медицине и чего ждать в обозримом будущем.
Кроме того, слушатели узнают, как наследственность влияет на качество жизни человека, как снизить риск передачи детям поврежденных генов, что такое врожденные пороки и как медицина помогает с ними бороться. После лекции все желающие смогут задать врачу вопросы.
«Мы можем наблюдать растущую роль методов медицинской генетики в ранней диагностике заболеваний.Так, в Москве уже сегодня проводится массовый скрининг новорожденных на 11 редких наследственных заболеваний — тех, для которых разработаны методы эффективного лечения и быстрой диагностики. Это болезни, которые возникают в результате мутаций в генетических структурах клетки», — отмечает Наталия Демикова.
По словам специалиста, понимание роли наследственности позволяет на ранних стадиях выявлять рак молочной железы и яичников, рак сетчатки глаза, полипоз кишечника, эндокринные опухоли и обеспечивать их лечение.
Занятие начнется в 19:00. Вход бесплатный. Необходима предварительная регистрация.
Кроме того, лекцию будут транслировать на страницах mos.ru в социальных сетях «Одноклассники» и «В контакте», а также на странице Департамента здравоохранения Москвы в «Фейсбуке».
Встреча входит в программу цикла просветительских лекций о современной медицине и здоровье «Бегу к врачу». Проект был запущен столичным Департаментом здравоохранения в 2017 году.
Проект был запущен столичным Департаментом здравоохранения в 2017 году.
Наследственные и наследственно-предрасположенные заболевания
Основной целью медицинской генетики является изучение роли генетических составляющих в этиологии и патогенезе различных заболеваний человека. Эти болезни делятся на два класса: собственно наследственные болезни, куда входят хромосомные и генные заболевания, и болезни с наследственной предрасположенностью, которые называют мультифакториальными заболеваниями.
Хромосомными являются болезни, вызванные нарушением числа, либо структуры хромосом. Генные болезни обусловлены присутствием мутаций в генах. Моногеннными называются болезни, обусловленные присутствием мутаций в одном гене. В этиологии мультифакториальных заболеваний наряду с действием неблагоприятных внешних факторов существенное влияние оказывают состояния не одного, а многих генов. Количество этих генов, формирующих наследственную предрасположенность к заболеванию, иногда исчисляется десятками или даже сотнями.
Хромосомные болезни: В настоящее время описано около 1000 нозологических форм хромосомных болезней. Все они характеризуются рядом общих признаков, таких как: маленькая масса и длина тела при рождении, пренатальная гипоплазия; отставание в умственном и физическом развитии с момента рождения, особенно выраженное при аутосомных аномалиях; задержка и аномалии полового развития: гипогонадизм, крипторхизм, аменорея, бесплодие и др., более выраженные при аномалиях половых хромосом; множественные ВПР в большей степени при аутосомных аномалиях; комплекс разнообразных по проявлениям и тяжести дизморфогенетических и диспластических признаков, одновременно затрагивающих многие системы и органы больного. Хромосомные болезни редко наследуются, и более чем в 95% случаев риск повторного рождения в семье больного ребенка с хромосомной патологией не превышает общепопуляционного уровня.
Моногенные болезни Разнообразие моногенных заболеваний достаточно велико и их количество по некоторым оценкам достигает 5000. Среди моногенных болезней значительный процент составляют ферментопатии, различные формы умственной отсталости, дефекты органов слуха, зрения, скелетные дисплазии, врожденные пороки развития, болезни нервной, эндокринной, соединительно-тканной, иммунной и других систем. Моногенные варианты течения заболевания в редких случаях встречаются среди любых нозологических форм, которые в общем случае не являются наследственными. Так, например, описаны моногенные формы гипертензии, болезней Альцгейаера и Паркинсона, эпилепсии и других больших психозов, иммунодефицитов, различных онкологических заболеваний и многих других патологических состояний. Моногенные варианты заболевания, как правило, отличаются от спорадических форм более тяжелым течением и ранним дебютом. Большинство мутаций, ассоциированных с моногенными заболеваниями, жестко детерминируют развитие болезни, и факторы окружающей среды не оказывают или оказывают небольшое влияние на развитие заболевания. Поэтому они так трудно поддаются коррекции. Однако немало примеров моногенных болезней с неполной пенетрантностью и варьирующей экспрессивностью, причины которых чаще всего остаются неизвестными. К счастью, моногенные заболевания встречаются достаточно редко. К числу наиболее известных моногенных болезней относятся фенилкетонурия, муковисцидоз, галактоземия, адреногенитальный синдром, гемофилия А и В, миодистрофия Дюшенна/Беккера, проксимальная спинальная мышечная атрофия, гепатолентикулярная дегенерация и многие другие болезни.
Моногенные варианты течения заболевания в редких случаях встречаются среди любых нозологических форм, которые в общем случае не являются наследственными. Так, например, описаны моногенные формы гипертензии, болезней Альцгейаера и Паркинсона, эпилепсии и других больших психозов, иммунодефицитов, различных онкологических заболеваний и многих других патологических состояний. Моногенные варианты заболевания, как правило, отличаются от спорадических форм более тяжелым течением и ранним дебютом. Большинство мутаций, ассоциированных с моногенными заболеваниями, жестко детерминируют развитие болезни, и факторы окружающей среды не оказывают или оказывают небольшое влияние на развитие заболевания. Поэтому они так трудно поддаются коррекции. Однако немало примеров моногенных болезней с неполной пенетрантностью и варьирующей экспрессивностью, причины которых чаще всего остаются неизвестными. К счастью, моногенные заболевания встречаются достаточно редко. К числу наиболее известных моногенных болезней относятся фенилкетонурия, муковисцидоз, галактоземия, адреногенитальный синдром, гемофилия А и В, миодистрофия Дюшенна/Беккера, проксимальная спинальная мышечная атрофия, гепатолентикулярная дегенерация и многие другие болезни.
Мультифакториальные заболевания обусловлены комбинированным действием неблагоприятных внешних и генетических факторов риска, формирующих наследственную предрасположенность к заболеванию. К мультифакториальным заболеваниям относятся подавляющее большинство хронических болезней человека, включая сердечно-сосудистые, эндокринные, иммунные, нервно-психические, онкологические и др. Генетические составляющие могут присутствовать в этиологии даже тех заболеваний, развитие которых целиком индуцируется внешними воздействиями и невозможно без их присутствия, таких, например, как инфекционные болезни. Однако и в этих случаях индивидуальная чувствительность к подобным внешним неблагоприятным воздействиям может быть генетически детерминирована. Например, на сегодняшний день известно, что в патологии бронхиальной астмы, лейкозов и их рецидивов участвуют белковые продукты таких генов системы детоксикации, как GSTM1, GSTT1, CYP1A1, GSTP1, NAT2 и др.
В настоящее время не существует единой классификации наследственных болезней, и часто их смешивают с врожденными и семейными болезнями. Причиной развития наследственных болезней являются присутствующие в половых клетках родителей мутаций в определенных генах. Эти мутации могут передаваться потомству в ряду поколений. Врожденные заболевания проявляются сразу после рождения, и они могут быть как наследственными, так и приобретенными, например, под действием тератогенных факторов или осложнений в родах. Приобретенные врожденные пороки развития не передаются по наследству.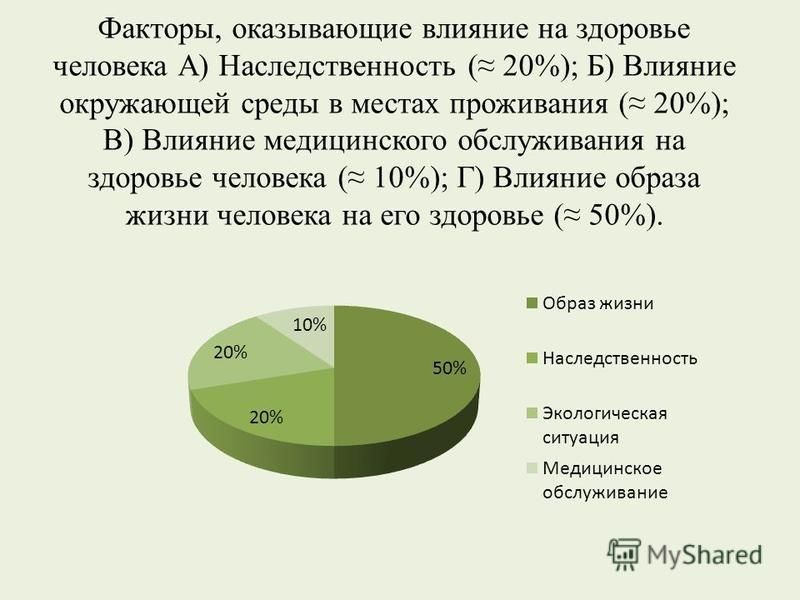
В этиологии детской инвалидности и ограничений жизнедеятельности значительная доля принадлежит наследственным факторам. Так, в Республике Саха (Якутия) среди причин детской инвалидности на первом месте (28,5%) стоят врожденные пороки развития, на втором — заболевания нервной системы (23,9%), на третьем — психические расстройства (11,9%). По данным Росстата среди причин младенческой смертности врожденные пороки развития занимают второе-третье место в Республике Саха (Якутия) и в целом по Российской Федерации. Остается значительной доля врожденных и наследственных заболеваний среди причин детской смертности (в возрасте до 5 лет), в структуре которой на долю хромосомныхболезней приходится 2-3% (Новиков, 2008).
Читать о этноспецифической наследственной патологии в РС (Я)
Генетический взгляд на феномен сочетанной патологии у человека.
«Наследственность – не оправдание!» — ФГБУ «НМИЦ ТПМ» Минздрава России
Португальские исследователи выяснили, что у многих молодых пациентов степень физической активности, курение, высокое артериальное давление, диабет и высокий уровень холестерина играют более значимую роль для здоровья, чем генетика.
Специалисты утверждают, что наследственность действительно важный фактор риска в развитии болезней сердца, но не оправдание.
Результаты исследования, представленные на совместном конгрессе Европейского общества кардиологов 2019 и Всемирного конгресса кардиологов, показывают, что здоровые привычки должны стать приоритетом для снижения риска сердечно-сосудистых заболеваний даже при «плохой наследственности».
В исследовании приняли участие 1 075 пациентов в возрасте до 50 лет, из которых 555 имели коронарную болезнь сердца. Средний возраст участников составлял 45 лет, из них 87% — мужчины. Генетику и уровни факторов риска пациентов из первой группы сравнили с контрольной группой из 520 здоровых человек (средний возраст — 44 года, мужчин – 56%).
Средний возраст участников составлял 45 лет, из них 87% — мужчины. Генетику и уровни факторов риска пациентов из первой группы сравнили с контрольной группой из 520 здоровых человек (средний возраст — 44 года, мужчин – 56%).
73% пациентов имели как минимум три фактора риска из пяти; в контрольной группе эти факторы были у 30% людей.
Вероятность развития болезни была в 3 раза выше при наличии одного фактора, в 7 раз – при наличии двух, а в 24 раза – при наличии трех.
Что касается генетики, то в группе с болезнями сердца генетическая оценка риска была выше. Однако чем больше вредных привычек было у человека, тем меньшее влияние оказала наследственность.
«Генетика вносит важный вклад в ранний старт сердечно-сосудистых заболеваний, но ее не следует использовать в качестве отговорки и говорить о неизбежности болезни. В нашей клинической практике мы часто слышим, как молодые пациенты с заболеваниями сердца находят обоснования в своей генетике, семейной истории. Но, как свидетельствуют данные исследования, эти молодые пациенты зачастую курили, были физически неактивными, имели высокий уровень холестерина и высокое артериальное давление. А все это можно изменить», — рассказал доктор Жоао А. Соуза (Joao A. Sousa), автор исследования.
А все это можно изменить», — рассказал доктор Жоао А. Соуза (Joao A. Sousa), автор исследования.
Исследователи рекомендуют людям с генетической предрасположенностью заменить вредные привычки на здоровые:
•бросить курить,
•регулярно заниматься спортом,
• правильно питаться,
• следить за артериальным давлением и уровнем холестерина.
Диагностика наследственных заболеваний методом высокопроизводительного секвенирования
В соответствии с особенностями методов и спецификой практических и научных задач в лаборатории организованы 3 направления клинической диагностики:
Запись на прием осуществляется через отдел платных услуг: 437-11-00, +7-911-766-97-70 по рабочим дням с 09-00 до 17-00.
Диагностика наследственных заболеваний методом высокопроизводительного секвенирования
Наследственные заболевания являются актуальной проблемой современного здравоохранения. По данным ВОЗ оценочное число наследственных болезней может достигать 10000, а количество больных – 10% всего населения земного шара.
Первостепенная задача, стоящая перед лечащим врачом, состоит в исключении или подтверждении генетической природы заболевания, что позволяет определить тактику лечения, дать прогноз жизни и здоровья больному и его родственникам.
Постановка клинического диагноза редкого заболевания часто бывает затруднена, особенно у новорожденных. В таких случаях молекулярная диагностика имеет определяющее значение.
В зависимости от конкретной клинической задачи требуется исследование разных по размеру участков генома – от одного нуклеотида до всего генома. Решение об объеме проводимого генетического тестирования принимается индивидуально для каждого пациента и требует комплексного подхода.
В генетической лаборатории СПб ГБУЗ ГБ№40 возможно проведение молекулярно-генетического тестирования методом высокопроизводительного секвенирования на приборе MiSeq Illumina. Данный метод дает возможность определять нуклеотидную последовательность как отдельных генов, так и все экзома (все кодирующие последовательности) или генома.
Консультация врача-генетика перед молекулярно-генетическим тестированием позволяет уточнить показания к проведению теста и объем исследования. По результатам анализа выдается письменное заключение с развернутой интерпретацией. Рекомендации и разъяснения по результатам можно получить у врача-генетика или лечащего врача.
Генетический паспорт
В будущем генетический паспорт станет самым достоверным носителем всех персональных данных человека. Сейчас петербургские ученые уже разработали методику определения генетических возможностей и рисков на основе ДНК.
Технология этого процесса проста. Практически из любого биоматериала (соскоба со щеки или капли крови) выделяют молекулу. Она содержит, по последним данным, 22 тысячи генов. Однако для наиболее точного анализа используют около 100 генов. Каждый из них несет свою информацию, по которой оценивают как вашу предрасположенность к болезням, например, патологии сердца и сосудов, так и к другим показателям: выносливости, полноте, агрессии, непереносимости молока, злаковых или алкоголя.
Затем специалисту достаточно взглянуть на «картину» и сказать, какие опасности вас ждут впереди, выдать определенные рекомендации по образу жизни и питанию. Например: при возможности возникновения диабета – уменьшить потребление сахара и жира; чтобы снизить риск инфаркта или инсульта – укреплять слабые сосуды. То есть даже при генетической предрасположенности к тому или иному заболеванию можно предотвратить его развитие или снизить риск возникновения тяжелых осложнения.
Еще один плюс – ваши гены «подскажут» наиболее эффективное лечение при случившемся недуге. Обычно для врача человек, пришедший за лечением – среднестатистический пациент, и при заболевании он рекомендует Вам стандартное лекарство. Но на кого-то оно подействует хорошо, а кому-то поможет мало – все зависит от генов. Если врач заглянет в генетический паспорт, то сможет подобрать лечение, исходя из ваших особенностей – наиболее эффективное именно для вашего организма.
Кроме того, можно предсказать, получится ли из конкретного человека хороший спортсмен, вплоть до вида спорта, гениальный ученый или музыкант.
Пока основные потребители «генетического паспорта» – будущие мамы, желающие родить и родить здорового малыша. Для них разработаны специальные генетические программы по планированию беременности, профилактике осложнений беременности, снижению осложнений при родах и др.
Генетическое тестирование до зачатия и при беременности- Каждая пятая супружеская пара в России бесплодна и более 30% женщин имеют серьезные нарушения во время беременности, с высоким риском тяжелых осложнений для матери и будущего ребенка
- Одной из причин невынашивания и бесплодия может является наличие у супругов сбалансированных хромосомных перестроек, которые никоим образом не влияют на состояние здоровья носителя. Хромосомные перестройки в кариотипе одного из родителей могут приводить к появлению несбалансированного кариотипа у плода, что является причиной остановки развития беременности и формированию пороков. Стандартное кариотипирование, проводимое в лаборатории, позволяет выявить носителей хромосомных перестроек, что даст возможность выбрать корректную и оптимальную тактику планирования и ведения беременности.

- Значительная часть нарушений связана с наследственной предрасположенностью женщины к таким частым заболеваниям как эндометриоз, гестоз, привычное невынашивание беременности, диабет, бронхиальная астма, тромбофилия и др.
Разработанная сотрудниками Лаборатории «Генетическая карта репродуктивного здоровья» позволяет еще до беременности выявить женщин высокого риска этих заболеваний и начать их своевременную профилактику. Она также предусматривает генетическое консультирование семьи, планирующей рождение ребенка, анализ кариотипа супругов и генетическое тестирование родителей для исключения носительства мутаций, приводящих к тяжелым наследственным болезням (муковисцидоз, фенилкетонурия, спинальная мышечная дистрофия, адрено-генитальный синдром и др).
Для проведения полного или выборочного генетического обследования на наследственную предрасположенность к этим болезням, на скрытое носительство мутаций и хромосомных аберраций у родителей будущего ребенка следует:
- на приеме у врача-генетика лаборатории получить направление на необходимое именно Вашей семье обследование;
- сдать кровь на генетическое тестирование;
- по результатам генетического тестирования получить заключение специалиста и рекомендации врача-генетика.

Генетические тесты и рекомендации
Генетические анализы и анализ ДНК — важная необходимость при планировании беременности
В настоящее время стал доступен генетический анализ на предрасположенность ко многим мультифакториальным заболеваниям. Различные генетические центры и лаборатории предлагают либо проведение анализа на ряд заболеваний по рекомендации врача генетика, либо проведение анализа ДНК по всем доступным лаборатории маркерам мультифакториальных заболеваний с последующим составлением генетического паспорта. Кроме информации о предрасположенности к мультифакториальным заболеваниям такой генетический паспорт может содержать данные о носительстве наследственных заболеваний, рекомендации по коррекции образа жизни и профилактике тех мультифакториальных заболеваний, к которым обнаружилась предрасположенность.
Тромбофилия наследственная и при беременности (патологическое состояние, обуславливающее повышенную склонность к внутрисосудистому тромбообразованию).
Рекомендуется проводить анализ на предрасположенность к тромбофилии всем женщинам, планирующим беременность (рекомендация ВОЗ от 8 декабря 2005 года), особенно, если были осложнения в предыдущие беременности (как тромбозы, так и акушерские кровотечения, причины которых были коагулопатии). Также рекомендуется анализ женщинам с бесплодием и женщинам, имеющим близких родственников с тромбофилиями.
Какую информацию может дать анализ на предрасположенность к тромбофилии? Данный анализ может выявить генетические причины бесплодия, выявить повышенный риск к развитию осложнений во время беременности (гестозы, привычное невынашивание, внутриутробная гибель плода, задержка внутриутробного развития, преждевременная отслойка плаценты, повторные неудачи ЭКО, акушерские кровотечения, тромбоз сосудов малого таза, варикозная болезнь и т.д. ).
Что может рекомендовать ваш врач при наличии предрасположенности к тромбофилии? Медикаментозную профилактику тромбозов и коагулопатий с целью профилактики осложнений во время беременности. Коррекцию тактики лечения бесплодия.
Коррекцию тактики лечения бесплодия.
Варикозная болезнь (паталогический процесс поражения вен, для которого характерно увеличение диаметра просвета, истончение венозной стенки, образование «узлов» и нарушение венозного кровотока).
Рекомендуется проводить анализ на предрасположенность к варикозной болезни всем женщинам, планирующим беременность, особенно, если есть случаи этого заболевания у близких родственников (особенно у матери).
Какую информацию может дать анализ на предрасположенность к варикозной болезни? Данный анализ выявляет повышенный риск развития варикозной болезни (варикозное расширение вен нижних конечностей и геммороидальных узлов). Беременность является предрасполагающим фактором для развития варикоза, поэтому при наличии генетической предрасположенности к этому заболеванию следует обратить особое внимание на его профилактику.
Что может рекомендовать ваш врач при наличии предрасположенности к варикозной болезни? Комплекс мер по профилактике данного заболевания во время беременности.
Эндометриоз (гинекологическое заболевание, при котором клетки эндометрия (внутреннего слоя стенки матки) разрастаются за пределами матки. Поскольку эндометриоидная ткань имеет рецепторы к гормонам, в ней возникают те же изменения, что и в нормальном эндометрии, проявляющиеся ежемесячными кровотечениями, болезненностью, приводик к воспалению окружающих тканей).
Рекомендуется проводить анализ на предрасположенность к эндометриозу женщинам с бесплодием, диагностированным эндометриозом, в случаях наличия близких родственниц с эндометриозом.
Какую информацию может дать анализ на предрасположенность к эндометриозу? Данный анализ позволяет выявить возможную причину бесплодия. В случае диагностированного эндометриоза, наличие генетической предрасположенности к этому заболеванию может потребовать коррекцию проводимой терапии.
Что может рекомендовать ваш врач при наличии предрасположенности к эндометриозу? Коррекцию проводимой терапии уже диагностированного эндометриоза. Лапароскопию для подтверждения или исключения эндометриоза, как причины бесплодия. Профилактические мероприятия для предупреждения развития данного заболевания (профилактические осмотры, лечение хронических очагов инфекции мочеполовой системы, контроль гормонального фона).
Лапароскопию для подтверждения или исключения эндометриоза, как причины бесплодия. Профилактические мероприятия для предупреждения развития данного заболевания (профилактические осмотры, лечение хронических очагов инфекции мочеполовой системы, контроль гормонального фона).
Привычное невынашивание беременности (патология беременности, характеризуется повторяющейся самопроизвольной остановкой развития беременности).
Рекомендуется проводить анализ на предрасположенность к привычному невынашиванию беременности женщинам планирующим беременность, особенно тем, у кого были случаи невынашивания беременности, а также имеющим близких родственниц с привычным невынашиванием беременности.
Какую информацию может дать анализ на предрасположенность к привычному невынашиванию? Данный анализ позволяет выявить генетически обусловленный риск невынашивания беременности, выявить вероятные генетические причины в случаях диагностированного привычного невынашивания беременности.
Что может рекомендовать ваш врач при наличии предрасположенности к невынашиванию беременности? Ряд профилактических мероприятий для предотвращения прерывания беременности с учетом генетических особенностей пациента.
Гестоз (осложнение второй половины беременности, характеризующиеся повышением артериального давления, отеками, наличием белка в моче, при неблагоприятном течении приводит к развитию полиорганной недостаточности).
Рекомендуется проводить анализ на предрасположенности к гестозу всем женщинам, планирующим беременности, особенно тем, кто имеет близких родственниц со случаями данного осложнения беременности, а так же с имеющимися соматическими заболеваниями (Сахарный диабет 1 и 2 типа, гипертоническая болезнь, заболевания почек, заболевания щитовидной железы).
Какую информацию может дать анализ на предрасположенность к гестозу? Данный анализ позволяет выявить генетически обусловленный риск гестоза с целью его профилактики во время беременности.
Что может рекомендовать ваш врач при наличии предрасположенности к гестозу? Комплекс мер по профилактике гестоза во время беременности, повышенное внимание к беременной.
Гипертоническая болезнь (заболевание сердечно-сосудистой системы, главным проявлением которого является повышение артериального давления).
Рекомендуется проводить анализ на предрасположенность к гипертонической болезни всем женщинам, планирующим беременность, особенно тем, кто имеет близких родственников с гипертонической болезнью.
Какую информацию может дать анализ на предрасположенность к гипертонической болезни? Генетическая предрасположенность к гипертонической болезни связана с повышенным риском развития гестоза во время беременности.
Что может рекомендовать ваш врач при наличии предрасположенности к гипертонической болезни? Комплекс мер по профилактике гестоза и гипертонии во время беременности.
Рак молочной железы и рак яичников.
Рекомендуется проводить анализ на предрасположенность к раку молочной железы и яичников всем женщинам, особенно имеющим близких родственниц с такими заболеваниями.
Какую информацию может дать анализ на предрасположенность к раку молочной железы и яичников? Риск заболеть раком молочной железы или раком яичников в течение жизни для женщин, имеющих генетическую предрасположенность к этим заболеваниям, достигает 80-90%. При этом риск заболеть в молодом возрасте (до 30 лет) достигает 10%. Для успешного лечения онкологических заболеваний очень важно обнаружение опухоли на ранней стадии, еще до появления симптомов. Поэтому наличие генетической предрасположенности к раку молочной железы и яичников очень серьезное показание для регулярного обследования (раз в полгода, минимум раз в год) с целью обнаружения заболевания на ранней стадии.
Что может рекомендовать ваш врач при наличии предрасположенности к раку молочной железы и яичников? Регулярные обследования, которые обычно включают анализ крови на наличие опухолевых маркеров, УЗИ малого таза, УЗИ молочной железы или маммография.
Предрасположенность к незарощению невральной трубки и синдрому Дауна у плода.
Рекомендуется проводить анализ на предрасположенность к незарощению невральной трубки и синдрому Дауна у плода всем женщинам, планирующим беременность.
Какую информацию может дать анализ? Некоторые генетически обусловленные особенности обмена гомоцистеина у женщины способны провоцировать врожденные патологии развития у будущего ребенка. Анализ на предрасположенность к незарощению невральной трубки и синдрому Дауна у плода выявляет наличие этих особенностей.
Что может рекомендовать ваш врач при наличии предрасположенности к незарощению невральной трубки и синдрому Дауна у плода? Прием повышенных доз фолиевой кислоты и витаминов группы В в период планирования беременности значительно уменьшают риски врожденных патологий у плода.
Носительство моногенных наследственных заболеваний (муковисцидоз, фенилкетонурия, спинальная амиотрофия, нейросенсорная тугоухость и другие).
Рекомендуется проводить анализ всем семейным парам, планирующим ребенка, особенно тем, в чьих семьях были случаи генетических заболеваний.
Какую информацию может дать анализ? Анализ позволяет выявить носительство моногенных заболеваний у будущих родителей. В случае обнаружения носительства заболевания у обоих супругов требуется консультация генетика до наступления или на самых ранних сроках беременности.
Что может рекомендовать врач генетик при обнаружении носительства заболевания у обоих супругов? Перенатальную диагностику плода на наличие заболевания.
Кариотипирование
Рекомендовано поводить анализ обоим супругам в случае невынашивания беременности.
Какую информацию дает анализ? Анализ позволяет выявлять сбалансированные хромосомные перестройки, которые могут быть причиной невынашиваемости беременности.
Что может рекомендовать ваш врач при наличии сбалансированных хромосомных перестроек? Перенатальное кариотипирование плода в I триместре беременности для коррекции тактики ведения беременности.
Общие понятия по мультифакториальным заболеваниям
Генетическая информация в сочетании с влиянием внешней среды определяют уникальность каждого человека. Под «внешней средой» мы здесь понимаем совокупность множества факторов влияющих на жизнь человека таких, как вредные привычки, воспитание, профессиональная деятельность, физическая активность и многих, многих других.
Генетическая информация + Внешняя среда = Уникальный человек
Генетическая (или наследственная) информация содержится в нуклеотидной последовательности ДНК. Нить ДНК плотно упакована (скручена) в хромосомы. Каждая клетка человеческого организма содержит 23 пары хромосом. В каждой паре одна хромосома от матери, одна от отца. Исключение составляют половые клетки (яйцеклетки и сперматозоиды), которые содержат по одной хромосоме из каждой пары. После оплодотворения яйцеклетки сперматозоидом, получается зародыш с 23 парами хромосом, из которого развивается человек с полным объемом генетической информации.
Молекула ДНК представляет собой последовательность нуклеотидов («букв»). Эта последовательность нуклеотидов кодирует наследственную информацию. В результате международной программы «Геном человека» в 2003 году была расшифрована такая последовательность для всех хромосом человека (за исключением ряда участков, чья расшифровка затруднена в связи с их структурными особенностями).
Расшифровка генома человека показала, что генетическая информация двух людей, не связанных родством, совпадает всего лишь на 99%. Оставшийся 1% в совокупности с «внешней средой» отвечает за многообразие внешности, способностей, характера, за все отличия людей друг от друга.
Кроме внешности, характера или способностей человек наследует также особенности своего здоровья – устойчивость к стрессам, способность переносить физические нагрузки, особенности обмена веществ, переносимость медикаментов. Уникальность наследственной информации проявляется в особенностях функционирования организма на молекулярном уровне. Например, у одного человека определенный фермент может быть более активен, чем у другого, а у третьего этот фермент может вообще отсутствовать. Такие вариации могут приводить к различным заболеваниям, причем эти заболевания делятся на наследственные и мультифакториальные.
Например, у одного человека определенный фермент может быть более активен, чем у другого, а у третьего этот фермент может вообще отсутствовать. Такие вариации могут приводить к различным заболеваниям, причем эти заболевания делятся на наследственные и мультифакториальные.
В случае наследственных заболеваний изменения в геноме (мутации) напрямую ведут к развитию заболевания. То есть если мутацию передал один из родителей, то человек становится носителем заболевания, если мутацию передали оба родителя, то человек заболеет. К самым распространенным генетическим (или наследственным) заболеваниям относят муковисцидоз, фенилкетонурию, гемофилию, дальтонизм и другие.
Наследственные заболевания достаточно редкое явление, в основном вариации в геноме связаны с мультифакториальными заболеваниями.
Мультифакториальные заболевания.Мультифакториальные заболевания – это заболевания, возникающие при неблагоприятном сочетании ряда факторов: генетических особенностях (генетической предрасположенности) и влияния «внешней среды» — вредных привычек, образа жизни, профессиональной деятельности и других. За генетическую предрасположенность чаще всего отвечают так называемые SNP (single nucleotide polymorphism – однонуклеотиные полиморфизмы или замены). То есть замена одной буквы в нити ДНК на другую.
За генетическую предрасположенность чаще всего отвечают так называемые SNP (single nucleotide polymorphism – однонуклеотиные полиморфизмы или замены). То есть замена одной буквы в нити ДНК на другую.
В случае наследственных заболеваний мы использовали термин «мутация», а в случае мультифакториальных заболеваний – «полиморфизм». С молекулярной точки зрения это одно и то же: количественные и качественные изменения в структуре ДНК. Основные их различия состоят в частоте встречаемости и последствиях для организма. Внутри популяции определенная мутация встречается с частотой 1-2%. Они либо не совместимы с жизнью либо обязательно приводят к развитию заболевания. Полиморфизмы встречаются с частотой больше 1-2%. Они могут быть нейтральными (никак не воздействовать на организм), предрасполагать к заболеваниям при определенных условиях либо, наоборот, в некоторой степени защищать от развития заболевания.
То есть само наличие генетической предрасположенности к заболеванию не обязательно приведет к развитию этого заболевания. Однако при наличии неблагоприятных факторов «внешней среды», человек с наследственной предрасположенностью имеет значительно большую вероятность заболеть, чем люди, не имеющие такой предрасположенности.
Однако при наличии неблагоприятных факторов «внешней среды», человек с наследственной предрасположенностью имеет значительно большую вероятность заболеть, чем люди, не имеющие такой предрасположенности.
В качестве наглядного примера можно привести предрасположенность к раку легкого и такой фактор «внешней среды», как курение. Всем известно о вреде курения и о том, что эта вредная привычка может привести к раку. Однако от курильщиков в качестве опровержения вреда курения часто можно услышать истории про то, как кто-либо курил всю жизнь по две пачки сигарет в день и прожил до 90 лет. Да, такое случается, только это не опровергает вред курения, это говорит о том, что одни люди предрасположены генетически к развитию рака легкого, а другие нет. И в сочетании с таким фактором «внешней среды», как курение, наследственная предрасположенность с большой вероятностью приведет к развитию рака.
Что же нам может дать знание о том, что мы генетически предрасположены к какому-либо заболеванию?
Часто можно услышать такое мнение, что лучше не знать о своей предрасположенности к различным заболеваниям – все равно ведь ничего не изменить, только лишний повод понервничать. Но это не так!
Но это не так!
Во-первых, давайте вспомним, что заболевание возникает при наличии неблагоприятных факторов «внешней среды». Влияние этих факторов во многих случаях можно исключить. Например, наличие предрасположенности к раку легкого – весомый довод в пользу отказа от этой вредной привычки.
Во-вторых, в ряде случаев существуют эффективные методы профилактики заболевания, к которому есть генетическая предрасположенность. Например, при предрасположенности к тромбоэмболии, регулярный прием малых доз аспирина значительно снижает риск тромбозов.
В-третьих, гораздо легче лечить болезни на ранней стадии. Но в это время заболевание зачастую протекает бессимптомно. Мало у кого хватает желания, временных и финансовых ресурсов для регулярного полного обследования своего организма. Если мы знаем особенности своего генома, знаем конкретный перечень заболеваний, к которым мы предрасположены, нам будет легче отследить эти заболевания на ранней стадии.
В-четвертых, наличие генетической предрасположенности к определенному заболеванию может повлиять на схему лечения данного заболевания. Например, регуляция кровяного давления – достаточно сложный процесс, за который отвечает большое количество генов. В зависимости от того, изменение в каком именно гене ведет к развитию артериальной гипертензии, врач может назначить наиболее эффективное лечение.
Например, регуляция кровяного давления – достаточно сложный процесс, за который отвечает большое количество генов. В зависимости от того, изменение в каком именно гене ведет к развитию артериальной гипертензии, врач может назначить наиболее эффективное лечение.
Установление (определение) отцовства, родства и идентификация личности
Генетическая экспертиза по определению отцовства всегда была и остается дорогостоящей, хлопотной и психологически травматичной процедурой: необходимо обратиться в суд, добиться решения суда о назначении экспертизы, всем членам семьи явиться в назначенный судом медико генетический центр, с соблюдением юридических процедур сдать кровь и обычно достаточно долго дожидаться результата.
Мы предлагаем Вам, используя наши возможности (основанные на достижениях научно-технического прогресса в области медицины и лабораторной диагностики), провести генетическое исследование по установлению отцовства и биологического родства.
Технологически процедура выполнения исследования, а соответственно и полученные результаты идентичны проведению экспертизы определения отцовства. Однако используя тот факт, что клетки любых тканей человека содержат абсолютно идентичную ДНК с клетками крови, мы имеем возможность упростить процедуру взятия материала, не потеряв в достоверности исследования.
Однако используя тот факт, что клетки любых тканей человека содержат абсолютно идентичную ДНК с клетками крови, мы имеем возможность упростить процедуру взятия материала, не потеряв в достоверности исследования.
Для этого всего лишь необходимо произвести отбор материала (соскоба эпителия с внутренней поверхности щеки) для исследований у ребенка и предполагаемого отца в строгом соответствии с инструкцией (забор слюны, забор крови), то есть соблюсти правила взятия материала, порядок маркировки, условия хранения и доставки в регистратуру лаборатории больницы.
Лаборатория проводит сравнительный анализ ДНК из полученных от заказчика образцов. Заказчику выдается заключение, содержащее описание методик и тест-систем, использованных в исследовании, перечень исследованных участков ДНК (локусов), генотипы («генетические портреты») ребенка и родителя, все расчеты сравнения этих генотипов, то есть достоверную объективную информацию, которая может быть воспроизведена (проверена) в любой оснащенной специализированной лаборатории с получением идентичного результата. Точность отрицательного заключения («не является отцом») – 100 %, точность положительного («является отцом») – не менее 99,99 %.
Точность отрицательного заключения («не является отцом») – 100 %, точность положительного («является отцом») – не менее 99,99 %.
Спортивная генетика и генетический паспорт
Анализируя результаты последних крупных мировых соревнований, в том числе Олимпийских игр в Пекине, становится очевидным, что успехи спортивной науки и практики во многом связаны с использованием современных научных достижений генетики.
Спортивная генетика, и связанные с ней генетические тестирования абсолютно безопасны в отличие от применения допинга и учитывает индивидуальные особенности организма человека лучше любых других существующих методов. Более того, генетическое тестирование на любом этапе спортивной подготовки может дать первичную информацию тренерам для отбора в спортивные секции и выбора индивидуального подхода к тренировкам при «занятии для себя». С другой стороны, не меньшее значение имеет индивидуальный подход к процедурам восстановления. Известно, что разные люди по-разному и с разной скоростью воспринимают тренировочные нагрузки. Кому-то свойственна быстрая адаптация, кто-то восстанавливается медленнее. Большинство из этих процессов, так или иначе, обусловлено генетическими механизмами, именно эти процесы изучаются в разделе спортивная генетика
Кому-то свойственна быстрая адаптация, кто-то восстанавливается медленнее. Большинство из этих процессов, так или иначе, обусловлено генетическими механизмами, именно эти процесы изучаются в разделе спортивная генетика
Показателен пример четкой зависимости уровня артериального давления от работы некоторых генов. Если человек, обладающий геном “повышенного давления”, получит высокую дозу нагрузки после перерыва, то резко возрастает вероятность инфаркта миокарда. С другой стороны, такие люди быстрее восстанавливаются при небольших и регулярных нагрузках. Наращивание мышечной массы также находиться в прямой зависимости от генов – некоторым из нас для «накачки мышц» достаточно нескольких тренировок, другим нужно много и долго тренироваться. Все это обусловлено Вашей генетикой.
В последнее время среди мирового Спортивного сообщества и в различных видах спорта (футбол, тяжелая атлетика, теннис, бокс и т.д.) отчетливо формируется интерес к спортивной генетике, а в частности к использованию молекулярно-генетических методов и технологий в практике подготовки спортсменов. При этом, генетические технологии применяются как для отбора наиболее перспективных по наследственным качествам кандидатов, так и в целях индивидуализации и повышения адекватности тренировочного процесса, в целом способствующих повышению результативности самого спортсмена и спорта в целом.
При этом, генетические технологии применяются как для отбора наиболее перспективных по наследственным качествам кандидатов, так и в целях индивидуализации и повышения адекватности тренировочного процесса, в целом способствующих повышению результативности самого спортсмена и спорта в целом.
Сегодня генетический паспорт спортсмена имеют уже многие футболисты и теннисисты сборной России, профессиональные боксеры и другие известные и уважаемые спортсмены.
Орфанные заболевания в РоссииВ России редкими предложено считать заболевания с «распространенностью не более 10 случаев на 100 000 человек».
В список орфанных болезней специалисты Минздравсоцразвития РФ в 2012 году внесли 230 наименований, однако в случае выявления новых болезней список будет пополняться. По данным Формулярного комитета Российской академии медицинских наук (РАМН), россиян с этими болезнями насчитывается около 300 тысяч человек.
Орфанные, или «сиротские», заболевания представляют собой группу редких болезней. На данный момент описано около 7 000 их разновидностей.
На данный момент описано около 7 000 их разновидностей.
Орфанные заболевания встречаются у небольшой части населения, их распространенность составляет около 1 : 2 000 и реже. Данная статистика весьма условна, так как одно и то же заболевание может быть редким в одном регионе и частым в другом. Например, проказа часто встречается в Индии, но редко в Европе.
Откуда берутся орфанные болезни?
Примерно половина орфанных заболеваний обусловлена генетическими отклонениями. Симптомы могут быть очевидны с рождения или проявляться в детском возрасте. В то же время более 50% редких заболеваний проявляются уже во взрослом возрасте.
Реже встречаются токсические, инфекционные или аутоиммунные «сиротские» болезни. Причинами их развития могут быть наследственность, ослабление иммунитета, плохая экология, высокий радиационный фон, вирусные инфекции у мамы и у самих детей в раннем возрасте.
Большинство орфанных заболеваний – хронические. Они в значительной мере ухудшают качество жизни человека и могут стать причиной летального исхода. Для большинства таких болезней не существует эффективного лечения. Основа терапии таких больных – улучшение качества и увеличение продолжительности жизни пациентов.
Для большинства таких болезней не существует эффективного лечения. Основа терапии таких больных – улучшение качества и увеличение продолжительности жизни пациентов.
В настоящее время в развитых странах ведется активное изучение орфанных заболеваний. Оно затрудняется малым количеством пациентов, недостаточным для проведения полноценного исследования. Однако на базе научных изысканий синтезируются новые препараты и выстраиваются схемы лечения больных.
Диагностика орфанных болезней
Единственный сегодня способ поиска причин редких заболеваний – это ДНК диагностика. В случае если заболевание хорошо изучено, то его диагностику осуществляют по разработанным протоколам обычными генетическими методами, если природа заболевания не понятна, или нет мажорных (частых) мутаций, то диагностику в таких семьях проводят методом полногеномного секвенирования с последующей верификацией другими методами.
«Нет смысла разделять влияние генетики и среды на человека»: Карл Циммер — о том, как связаны неандертальцы и коронавирус
Карл Циммер — научно-популярный писатель, журналист и известный блогер, автор книг «Паразиты. Тайный мир», «Линия прибоя» и мирового бестселлера «Она смеется, как мать. Могущество и причуды наследственности». Циммер — постоянный участник научно-популярных программ и изданий Discovery, National Geographic, Natural History, Nature и Science, лауреат премии Эверетта Кларка в области научной журналистики и премии для СМИ Американского института биологии.
Тайный мир», «Линия прибоя» и мирового бестселлера «Она смеется, как мать. Могущество и причуды наследственности». Циммер — постоянный участник научно-популярных программ и изданий Discovery, National Geographic, Natural History, Nature и Science, лауреат премии Эверетта Кларка в области научной журналистики и премии для СМИ Американского института биологии.
О неандертальцах и коронавирусе
В большинстве случаев мы не знаем, что именно делают гены. Есть отдельные случаи, когда мы это точно знаем, но все равно не понимаем, в чем разница между [одинаковым] человеческим геном и геном другого животного или нашего предка, — это все еще загадка. Возможно, если мы ее разгадаем, у нас будут новые лекарства от болезней. Я был поражен, когда увидел новые данные о генах неандертальцев, которые появилась во время пандемии (в журнале Nature опубликовали исследование, согласно которому гены, которые связаны с осложнениями при коронавирусе, встречаются у людей и у неандертальцев. — Forbes Life).
— Forbes Life).
Одна из главных загадок коронавируса — в том, что у большинства людей отсутствуют его симптомы. У них либо совсем нет симптомов, либо они очень мягкие. Порядка 20% людей, которые им заражаются, нуждаются в медицинской помощи. А есть определенный процент людей, которые просто умирают и им никак не помочь. Пока нет никакого гарантированного лечения, невозможно просто взять и избавиться от этой болезни. Ученые стараются понять, почему кто-то легко переносит болезнь, а кто-то нет. Они смотрят на факторы риска. Есть различные факторы, которые связаны с заболеваниями по расе, полу, вредным привычкам, возрасту, массе тела и так далее.
Реклама на Forbes
Интересно, что обнаружилась связь с неандертальцами. Ученые посмотрели на ДНК человека и попытались понять, есть ли варианты генов, которые можно найти у людей, тяжело переносящих эту болезнь. Они обнаружили один вариант ДНК в третьей хромосоме. В нем есть несколько генов, которые объясняют, почему именно у этих людей риск развития осложнений в три раза выше, чем у человека, у которого нет данного варианта. Такую же вариацию ДНК имел неандертальский человек. Я задался вопросом: почему у неандертальцев есть вариант генов третьей хромосомы, который будет осложнять определенные болезни? Возможно, у них развились какие-то элементы иммунной системы, когда они жили, например, в Азии, и гены мутировали и перешли в другую сторону, чтобы противостоять другим болезням. Это не просто насущный интерес, а серьезная проблема.
Такую же вариацию ДНК имел неандертальский человек. Я задался вопросом: почему у неандертальцев есть вариант генов третьей хромосомы, который будет осложнять определенные болезни? Возможно, у них развились какие-то элементы иммунной системы, когда они жили, например, в Азии, и гены мутировали и перешли в другую сторону, чтобы противостоять другим болезням. Это не просто насущный интерес, а серьезная проблема.
Здесь важно понять, что обычно нет какого-то отдельного гена, который бы отвечал за что-то конкретное. Гена, который бы полностью влиял на нас в сложном контексте нашего существования, опыта, культуры. В своей книге я использую простой пример — рост. Здесь вроде бы нет ничего сложного — просто берете линейку и измеряете рост человека. Но почему кто-то очень высокий, а кто-то совсем низкий? Постепенно, глядя на статистику о росте, ученые сделали вывод, что рост — это то, что люди наследуют. У высоких родителей обычно высокие дети, и наоборот, у невысоких родителей достаточно невысокие дети. То есть разницу в росте у разных людей можно объяснить через гены. Проблема в том, что только за последние лет 15 мы поняли, какие это гены.
То есть разницу в росте у разных людей можно объяснить через гены. Проблема в том, что только за последние лет 15 мы поняли, какие это гены.
В книге «Она смеется, как мать. Могущество и причуды наследственности» я написал о Джоэле Хиршхорне — он педиатр-эндокринолог, который работает с детьми с гормональными отклонениями. Например, он работает с детьми, которые очень, очень невысокие. Джоэль рассказал, что иногда родители приводят к нему своих [здоровых] невысоких детей и хотят, чтобы они стали повыше. Он объясняет им, что ребенок в полном порядке, его рост никак не связан с гормональными отклонениями и не оказывает негативного воздействия на здоровье. А родители спрашивают, почему же тогда ребенок такой невысокий. И Джоэль неловко молчит, глядя на не очень высоких родителей, а потом рассказывал им про гены. Раньше никто не знал, что это за гены, и Джоэль Хиршхорн понял, что их нужно найти. Что же он сделал?
Работая с большим количеством других ученых, он посмотрел на различные истории болезни большого количества пациентов, связывая это с информацией о ДНК. В итоге в 2007 году, после многих лет поиска, после обследования более 5000 различных историй болезней, наконец-то был найден тот самый генетический вариант, отвечающий за рост. Но до сих пор непонятно, почему именно он влияет на рост человека. Более того, с каждым годом по мере повышения выборки [участников исследований] обнаруживается все больше и больше вариантов ДНК, влияющих на рост человека. На 2020 год мы знаем, что 9900 генетических вариантов так или иначе влияют на рост человека. И пока никто не может сказать, как все эти варианты работают в связке и сообща влияют на наш рост, а ведь это такой простой параметр. Теперь подумайте, что у человека есть несколько триллионов клеток, эти клетки делятся весьма координированным образом, потом в какой-то момент перестают делиться. Процесс этой остановки — очень комплексный и пока непонятный. И привязывать рост человека или его интеллекта к одному гену — это подход довольно абсурдный.
В итоге в 2007 году, после многих лет поиска, после обследования более 5000 различных историй болезней, наконец-то был найден тот самый генетический вариант, отвечающий за рост. Но до сих пор непонятно, почему именно он влияет на рост человека. Более того, с каждым годом по мере повышения выборки [участников исследований] обнаруживается все больше и больше вариантов ДНК, влияющих на рост человека. На 2020 год мы знаем, что 9900 генетических вариантов так или иначе влияют на рост человека. И пока никто не может сказать, как все эти варианты работают в связке и сообща влияют на наш рост, а ведь это такой простой параметр. Теперь подумайте, что у человека есть несколько триллионов клеток, эти клетки делятся весьма координированным образом, потом в какой-то момент перестают делиться. Процесс этой остановки — очень комплексный и пока непонятный. И привязывать рост человека или его интеллекта к одному гену — это подход довольно абсурдный.
Что важнее — среда или гены
Мы можем говорить о том, что какой-то параметр в человеке является наследственным, но это не значит, что гены — единственное, что влияет на нашу наследственность. Вернемся к росту. В 1896 году средний рост женщин в Канаде и на островах Барбадос отличался на пять сантиметров — разница немаленькая. Значит, наверное, у девушек в Канаде есть какой-то ген, который делает их на пять сантиметров выше, чем на Барбадосе. Но ученые отслеживают рост людей на протяжении нескольких десятилетий. За последние 100 лет люди по всему миру стали гораздо выше по сравнению с 1896 годом. По данным 2006 года, женщины на Барбадосе стали даже выше, чем канадки. То есть на рост повлияло что-то кроме наследственности, а именно среда. Например, дети теперь как-то иначе питаются, пьют более чистую воду, получают более качественное здравоохранение. Все эти параметры помогают перенаправлять энергию от борьбы с заболеваниями и стрессом к росту. Мы наследуем не только гены, но еще и социальную среду, общественный уклад.
Вернемся к росту. В 1896 году средний рост женщин в Канаде и на островах Барбадос отличался на пять сантиметров — разница немаленькая. Значит, наверное, у девушек в Канаде есть какой-то ген, который делает их на пять сантиметров выше, чем на Барбадосе. Но ученые отслеживают рост людей на протяжении нескольких десятилетий. За последние 100 лет люди по всему миру стали гораздо выше по сравнению с 1896 годом. По данным 2006 года, женщины на Барбадосе стали даже выше, чем канадки. То есть на рост повлияло что-то кроме наследственности, а именно среда. Например, дети теперь как-то иначе питаются, пьют более чистую воду, получают более качественное здравоохранение. Все эти параметры помогают перенаправлять энергию от борьбы с заболеваниями и стрессом к росту. Мы наследуем не только гены, но еще и социальную среду, общественный уклад.
В вопросе о том, что же больше влияет на человека — гены или среда, я не думаю, что можно как-то обозначить приоритет. Здесь нужно понимать, о чем именно идет речь. Если мы говорим о группе крови, то на этот параметр среда вообще никак не влияет. Гены полностью определяют группу крови, ее нельзя определить, опираясь на условия своей жизни и жизни предков. Но если вы хотите поговорить о личностных чертах, о том, что мы описываем как характер и мировоззрение, то эта история гораздо более сложная. И даже в этих отношениях влияние генов и среды настолько переплетено, что взвешивать их отдельно на разных чашах весов практически бессмысленно.
Если мы говорим о группе крови, то на этот параметр среда вообще никак не влияет. Гены полностью определяют группу крови, ее нельзя определить, опираясь на условия своей жизни и жизни предков. Но если вы хотите поговорить о личностных чертах, о том, что мы описываем как характер и мировоззрение, то эта история гораздо более сложная. И даже в этих отношениях влияние генов и среды настолько переплетено, что взвешивать их отдельно на разных чашах весов практически бессмысленно.
Казалось бы, IQ — это такая вещь, которую можно унаследовать, но есть очень много факторов среды, которые влияют на развитие человеческого интеллекта. Например, объем свинца, появляющийся в организме человека в результате загрязнения окружающей среды. Тот, у кого большое содержание свинца или меди в организме, может страдать от интеллектуальной недостаточности. Как вы понимаете, влияние генов и среды связано друг с другом. Некоторые скажут, что важна только среда. Но даже если у ваших родителей очень много книжек в доме, которые вы с детства читаете, это не значит, что у вас будет самый высокий уровень IQ. Более того, среда, которую выстраивают ваши родители, тоже находится под влиянием генов. Я все-таки не разделял бы среду и гены как факторы, влияющие на человека. В этом нет смысла, это неинтересно, и вы таким образом можете упустить уникальную комплексность этого взаимодействия, в котором и есть вся суть.
Более того, среда, которую выстраивают ваши родители, тоже находится под влиянием генов. Я все-таки не разделял бы среду и гены как факторы, влияющие на человека. В этом нет смысла, это неинтересно, и вы таким образом можете упустить уникальную комплексность этого взаимодействия, в котором и есть вся суть.
Полную запись лекции можно посмотреть на канале non/fiction в YouTube
Профилактика заболеваний
Предупреждение жестокого обращения в медицинских учреждениях
Предупреждение жестокого обращения в специализированных медучереждениях
В Томске пройдёт Всероссийская акция по профилактике йододефицитных заболеваний «Соль + йод IQ сбережёт»
Опасно! ГРИПП
Симптомы гриппа
Важно! Прививки
О диабете
О диабете у детей
Диспансеризация
Ещё о диспансеризации
Обязательное медицинское страхование
Еще об обязательном медицинском страховании
Профилактика без вакцинации
Инсульт
ВНИМАНИЕ: профилактика коронавирусной инфекции, ОРВИ и гриппа!
Что мы знаем о здоровом образе жизни.
Многие считают, что в наше время трудно вести здоровый образ жизни, но зачастую, это всего лишь отговорки. Конечно, намного легче жаловаться на жизнь или отсутствие свободного времени, сидя перед телевизором на диване. Но если перебороть свою лень, то ваша жизнь и жизнь вашей семьи может кардинально измениться в лучшую сторону. Итак, что нужно современному городскому жителю для того, чтобы быть здоровым?
Для того чтобы определиться с тем, как вести здоровый образ жизни, нужно дать определение здоровью. За основу будет взято определение здоровью данное Всемирной Организацией Здравоохранения: здоровье человека — это объективное состояние и субъективное чувство полного физического, психического и социального комфорта. По данным этой же организации, здоровье человека зависит от следующих факторов:
10% — состояние системы здравоохранения в стране;
20% — экологическая обстановка;
20% — генетическая наследственность;
50% — образ жизни человека.
Отталкиваясь от вышеприведенных данных, можно сделать вывод, что человек сам в большей степени в ответе за состояние своего организма. Конечно, на такой фактор как наследственность оказать ощутимое влияние невозможно, но снизить нагрузку на организм от последствий плохой экологии и, изменив образ жизни, можно кардинально улучшить состояние здоровья.
Итак, 15 простых и действенных способов по улучшению здоровья и качества жизни:
1. Здоровый сон. Большинство из нас испытывает постоянный недостаток сна — вечером после работы всегда находится масса срочных дел, а с утра надо вскакивать и бежать в офис. Сон сводится к минимуму, позволяющему хоть как-то проживать день, не «отключаясь». Приучите себя засыпать и просыпаться в одно и то же время и старайтесь следовать этому графику. Помните, что полноценно функционировать может только хорошо отдохнувший организм. Желательно ложиться до полуночи — это физиологичнее, чем спать с трех часов ночи до двенадцати дня.
2. Физическая активность. Ежедневно взрослый человек должен проходить как минимум десять километров — столько необходимо для нормальной работы позвоночника, который получает питание только во время движения. Не говоря уже о прочих органах и системах, которым жизненно важна ваша активность. Помимо того, что прогулка в умеренно быстром темпе — идеальный способ сжечь жиры, такое движение еще и отлично тренирует ваше сердце, сосуды и общую выносливость. Используйте свой обеденный перерыв для того, чтобы пройтись по улице. Старайтесь не пользоваться транспортом там, где это возможно — выходите на пару остановок раньше и идите пешком, паркуйте машину за пару кварталов до места назначения и оставшийся путь проходите. Используйте любую возможность для движения.
3. Творческая реализация и комфорт. Это означает, что ваша работа должна не только раскрывать ваш внутренний потенциал, но и нравиться вам, находиться в удобном месте, вас должно устраивать ваше окружение, офис, рабочий стол. Счастливый человек утром просыпается с радостью от того, что ему предстоит весь день заниматься любимым делом. Стресс на работе, где мы проводим большую часть своего времени, — сильнейший провокатор самых различных заболеваний. Вам не нравится работа? Ищите себя! Пройдите тесты на профориентацию, задумайтесь о том, какое занятие вам по душе, ищите успешные примеры — многие люди сделали свое хобби профессией и получают за него неплохие деньги. Если же сделать ничего нельзя, хотя бы посвящайте свободное время тому, что действительно нравится вам и позволяет раскрыться вашим талантам и способностям.
Счастливый человек утром просыпается с радостью от того, что ему предстоит весь день заниматься любимым делом. Стресс на работе, где мы проводим большую часть своего времени, — сильнейший провокатор самых различных заболеваний. Вам не нравится работа? Ищите себя! Пройдите тесты на профориентацию, задумайтесь о том, какое занятие вам по душе, ищите успешные примеры — многие люди сделали свое хобби профессией и получают за него неплохие деньги. Если же сделать ничего нельзя, хотя бы посвящайте свободное время тому, что действительно нравится вам и позволяет раскрыться вашим талантам и способностям.
4. Спокойная обстановка дома. Мой дом — моя крепость. Это выражение придумано не зря. Для того чтобы сохранить здоровую нервную систему, человеку должно быть комфортно дома. Если вы не хотите вечером идти домой, с неприязнью думаете о необходимости общаться с домочадцами — надо что-то менять! Работайте над отношениями. Если у вас нелады в семейной жизни, возможно, есть смысл обратиться к психологу или просто чаще говорить по душам с любимым человеком. Высказывание своих эмоций и чувств важно, поскольку накопление переживаний ведет к самым разным болезням. Если же никак не получается сделать свой дом тихой гаванью, ищите эту гавань в чем-то другом — возможно, в любимом деле или близких друзьях. У вас должен быть уголок, куда вы всегда сможете прийти и как минимум просто побыть в состоянии покоя некоторое время. В идеале — пообщаться с кем-то, кто вас понимает или просто выслушает.
Высказывание своих эмоций и чувств важно, поскольку накопление переживаний ведет к самым разным болезням. Если же никак не получается сделать свой дом тихой гаванью, ищите эту гавань в чем-то другом — возможно, в любимом деле или близких друзьях. У вас должен быть уголок, куда вы всегда сможете прийти и как минимум просто побыть в состоянии покоя некоторое время. В идеале — пообщаться с кем-то, кто вас понимает или просто выслушает.
5. Правильная реакция на стресс. Во время стресса включаются нейрогуморальные механизмы, в частности, происходит неконтролируемый выброс адреналина и других биологически активных веществ в кровь, что, в свою очередь, вызывает спазм сосудов, и, как следствие, — ухудшение кровоснабжения всех органов. То есть, не умея справляться со стрессом, вы можете заполучить целый ряд заболеваний — от поражения органов желудочно-кишечного тракта до сердечно-сосудистых проблем. Если на вас «свалилось» потрясение, вдохните поглубже и подышите некоторое время, сосредоточившись на вдохах и выдохах. Подвигайтесь — это снимает нагрузку с нервной системы. Почитайте про себя стихотворение, молитву или спойте песенку — важно переключиться от стрессовой ситуации. Для этого также можно пообщаться с окружающими на отвлеченные темы.
Подвигайтесь — это снимает нагрузку с нервной системы. Почитайте про себя стихотворение, молитву или спойте песенку — важно переключиться от стрессовой ситуации. Для этого также можно пообщаться с окружающими на отвлеченные темы.
6. Гигиена тела и окружающей среды. Не будем подробно расписывать вам пользу контрастного душа, ежедневных гигиенических процедур, использования натуральных материалов в офисе и дома. Просто не забывайте о том, что наше тело — это именно тот сосуд, в котором наше «я» будет жить столько, сколько это тело позволит. Поэтому есть смысл заботиться о нем соответственно. Равно как и о том, что его окружает — о воздухе в вашем доме, о продуктах на вашем столе, об одежде, которую носите вы и ваши дети.
7. Отсутствие плохих привычек. Курение, алкоголизм, наркотики крайне пагубно влияют на состояние здоровья — вы об этом отлично знаете. Осталось только бросить курить и не увлекаться алкоголем и стимуляторами. Помните, что только спустя три года после выкуривания последней сигареты вы выходите из группы риска по сердечно-сосудистым заболеваниям. Есть смысл бросить курить как можно раньше! Что касается алкоголя, проследите за тем, сколько вы выпиваете каждую неделю. И если понимаете, что самостоятельно справиться тяжело — не стесняйтесь обратиться за помощью. Наркотиков это касается также.
Есть смысл бросить курить как можно раньше! Что касается алкоголя, проследите за тем, сколько вы выпиваете каждую неделю. И если понимаете, что самостоятельно справиться тяжело — не стесняйтесь обратиться за помощью. Наркотиков это касается также.
8. Забота об иммунитете. Выбирайте сами, как вы хотите поддержать свой иммунитет. Это могут быть закаливания, контрастный душ, употребление сырых овощей и фруктов, спорт. Важно понимать, что закаливание на фоне нездорового образа жизни — бессмысленная трата времени. Здесь необходим комплексный подход.
9. Рациональное питание. Каждый понимает под этим термином что-то свое. В целом же медики считают рациональным питанием такое, при котором организм получает все необходимые витамины, минералы и питательные вещества в сбалансированных пропорциях. Обычно это 50% углеводов, 20% белков и 30% жиров, но в разных теориях эти цифры различны. Суть в том, что основой такого питания должны становиться «правильные» углеводы (каши, зерновой хлеб, а не бутерброды и пирожные), маложирные белки и полезные растительные масла. В правильном рационе как минимум половину тарелки при каждом приеме пищи занимают свежие овощи или фрукты, зелень. Отсутствуют красители и консерванты, стабилизаторы и прочие вредные вещества. И, конечно, такой рацион подразумевает получение 1-1,5 литров чистой воды в день.
В правильном рационе как минимум половину тарелки при каждом приеме пищи занимают свежие овощи или фрукты, зелень. Отсутствуют красители и консерванты, стабилизаторы и прочие вредные вещества. И, конечно, такой рацион подразумевает получение 1-1,5 литров чистой воды в день.
10. Здоровые семейные традиции. Введите новое «семейное» правило: в свободное время не лежать на диване или сидеть за компьютером, а гулять на природе, кататься на велосипеде, проводить досуг активно — выезжать к морю или хотя бы прогуляться в парке, поплавать в бассейне и открытых водоемах, использовать любую возможность для активного отдыха. Благодарностью вам станет крепкое здоровье — ваше и ваших детей.
11. Сауна или баня. Как говорится в здоровом теле здоровый дух. Баня выгонит из вашего организма не только болезни, усталость, лишний вес, но и любое уныние. Можно сходить в сауну самому, с любимым человеком или целой компанией, главное, чтобы вам было комфортно. Никогда не употребляйте в сауне или после нее спиртных напитков, алкоголь притупляет чувства, нарушает терморегуляцию и создает повышенную нагрузку на сердце.
12. Занятие нейробикой — зарядка для мозга. Многие вещи мы делаем на автомате. Попробуйте одеться с закрытыми глазами, выпить чашку кофе держа её в левой руке. Это заставит кору противоположной стороны мозга выполнять незнакомую работу, оттачивая память и расширяя интеллект. Если это слишком для вас, то регулярно читайте книги, лучше классику, или разгадывайте кроссворды. Заставляя активно работать мозг, человек не только сохраняет светлую голову, но и одновременно активизирует деятельность сердца, системы кровообращения и обмен веществ.
13. Сходите на массаж. Быстрый и действенный способ снять стресс и полностью расслабиться — сходить на общий массаж, лучше всего с ароматерапией. Если нет времени на полный курс, в экстренном порядке нужно сделать хотя бы один сеанс у хорошего массажиста. В теле и в мыслях сразу же появится необыкновенная легкость, а эффекта должно хватить на несколько дней.
14. Освойте ароматерапию. С помощью ароматерапии вы можете поднять настроение, избавиться от головной боли и инфекционных заболеваний, вызвать положительные эмоции или воспоминания, создать атмосферу. Аромамасла уравновешивают жизненные процессы в организме, повышают иммунитет, улучшая циркуляцию крови и выводя продукты метаболизма.
Аромамасла уравновешивают жизненные процессы в организме, повышают иммунитет, улучшая циркуляцию крови и выводя продукты метаболизма.
15. Смейтесь каждый день. Кто говорит, что жизнь — серьезная штука? Смех уменьшает гормоны стресса и помогает расслабить мышцы. Он помогает дышать глубже, укрепляет иммунную систему, помогает забыть о боли и уменьшает кровяное давление. Как говорят, смех — лучшее лекарство.
Реферат Наследственность человека как фактор его здоровья (11 класс).
Наследственность человека как фактор его
здоровья.
Ярославль
Содержание.
Стр.
Введение………………………………………………………………3-5
Глава I. Передача признаков от родителей потомству…………6-7
Глава II. Наследственные заболевания человека.
Наследственные заболевания человека.
Заболевания связанные с нарушением обмена веществ…….8-11
Хромосомные заболевания……………………………………12-15
Многофакторные заболевания……………………………………16
Заключение ………………………………………………………..17-18
Литература …………………………………………………………..19
Человек связан с приматами и имеет с
ними ряд сходных и отличительных
признаков. Эти признаки передаются
из рода в род, наследуются потомками
от своих родителей. Каким образом
это происходит – вопрос, который
волновал и волнует до сих пор умы
ученых и каждого из нас.
Введение.
Происхождение и становление человека – одно из звеньев единой цепи эволюции разных групп растений и животных, которые начали завоевывать открытые пространства, – открытые ландшафты.
Процесс становления человека происходил на фоне резких изменений в состояние природы. Похолодание и распространение ледниковых покровов в высоких широтах, сильное иссушение в более низких, смена растительности привели к изменению образа жизни и поведения высших приматов – предков человека. Человек разумный, как еще один уникальный вид, приобрел ряд адаптаций к жизни в открытых пространствах: морфофизиологических, коммуникативных, поведенческих, определяющих его здоровье.
С древнейших времен здоровье человека является важнейшей ценностью и свидетельствует о физическом и духовном его благополучии, умении распределять энергию и внимание между разными сферами жизнедеятельности, ответственности за продление рода и благополучие будущих поколений.
В конкретных социально-экономических условиях нашей страны проблема здоровья населения является одной из важнейших экологических проблем.
Человек – биологический вид, который наиболее полно использует природную среду в своей жизнедеятельности. При этом человек не только улучшает условия жизни, но и самого себя как природное и социальное существо.
В фольклоре всех народов доминируют два ключевых понятия- здоровье человека и его природное окружение. На всех этапах исторического развития, начиная с первобытнообщинного строя, от человека требовались исключительная выносливость и сила, чтобы справиться с теми испытаниями, которые выпадали на его долю во взаимоотношениях с природой. И неслучайно древнегреческая мифология наделяет своих героев – Антея, Атланта, Ахилла, Геракла – сверхчеловеческой силой, позволяющей совершать им необыкновенные подвиги и противостоять силам природы. В фольклорном творчестве русского народа в поэтической форме воспевались чудо – богатыри: Илья Муромец, Добрыня Никитич, Микула Селянинович, Алеша Попович, обладающие сказочной силой и здоровьем.
В ХХI веке здоровье человека остается особой ценностью. В уставе Всемирной организации здравоохранения (ВОЗ) говорится о высшем уровне здоровья как об одном из основных прав человека.
Современная наука рассматривает здоровье в двух аспектах – общественно – популяционное (здоровье общественных и демографических групп населения) и индивидуальное. ВОЗ определяет здоровье как состояние полного телесного, душевного и социального благополучия, а не только отсутствие болезней и повреждений. Однако это определение недостаточно конкретно, его уточняет определение здоровья как состояние сохранения и развития биологических, физиологических и психических функций человека, оптимальной трудоспособности и социальной активности при наибольшей продолжительности активной жизни.
Организм нормально функционирует лишь во взаимодействии с окружающей средой – природной, культурной, социально-психологической, производственной, средой жилого помещения.
Окружающая человека среда есть система физических, химических, биологических, психосоциальных, культурных и техногенных факторов, которые влияют на его существование.
Видовые особенности человека – крупные размеры, прямохождение, мощная антигравитационная мускулатура, замедление темпов индивидуального развития, усиление общественных отношений являются адаптациями к среде обитания, признаками здоровья. Ослабление, отсутствие какого-либо из признаков есть свидетельство болезни.
Проблема наследственных заболеваний и целенаправленного изменения наследственности издавна занимала умы ученых. Однако долгое время единственным путем получения организмов с полезными для человека свойствами были скрещивание и селекция, применявшиеся для выведения пород домашних животных и сортов растений.
Знание причин возникновения наследственных болезней, совершенствование средств их предупреждения расширяют возможности борьбы с этими заболеваниями человека. В настоящее время созданы предпосылки направленного изменения генотипа организма на молекулярном уровне. Развивается такая отрасль как генетическая инженерия, которая позволяет в лабораторных условиях создавать организмы с новыми наследственными признаками. Ее развитие началось в 60-х годах ХХ столетия, когда был сделан ряд открытий, предоставивших в распоряжение исследователей новые чрезвычайно точные «инструменты», позволившие вносить различные изменения в молекулу ДНК.
В настоящее время созданы предпосылки направленного изменения генотипа организма на молекулярном уровне. Развивается такая отрасль как генетическая инженерия, которая позволяет в лабораторных условиях создавать организмы с новыми наследственными признаками. Ее развитие началось в 60-х годах ХХ столетия, когда был сделан ряд открытий, предоставивших в распоряжение исследователей новые чрезвычайно точные «инструменты», позволившие вносить различные изменения в молекулу ДНК.
В 1969 году И. Беквит, Дж. Шапиро, Л.Ирвин выделили из живой клетки ген, контролирующий синтез ферментов, необходимых кишечной палочке для усвоения молочного сахара – лактозы. В 1970 году Д.Балтимор и одновременно Г.Темин и С.Мидзутани обнаружили и выделили фермент, который обеспечивает процесс построения молекулы ДНК на матрице РНК. Открытие этого фермента существенно упростило работу по получению копий отдельных генов. Поэтому довольно быстро сразу в нескольких лабораториях были синтезированы гены, контролирующие синтез молекулы глобина (белка, входящего в состав гемоглобина), интерферона и других белков.
Работа в области генетической инженерии регламентируется правилами, обеспечивающими контроль, особые условия проведения эксперимента и гарантирующими безопасность экспериментаторов и окружающих. Эти правила были разработаны и утверждены многими странами, в том числе и Россией после того, как было высказано опасение, что при манипулировании с генами микроорганизмов, в ходе перетасовок генов может возникнуть молекула ДНК с опасными для человека свойствами.
Человека с незапамятных времен интересовали тайны наследственности, о ее природе высказывались самые разнообразные, порой фантастические предположения. Моей целью было познакомиться с тем, как передаются наследственные признаки от родителей к детям, и откуда берутся такие заболевания как наследственные. Наследственности человека и наследственным заболеваниям и посвящена моя работа.
ГлаваI.Передача признаков от родителей
потомству.
Здоровье человека, как и его болезнь, определяется наследственностью, состоянием окружающей среды, образом жизни и состоянием здравоохранения.
Передача признаков от родителей потомству связана с особенностями строения и деления клеток.
В ядре каждой клетки имеются хромосомы1 – структурные элементы ядра клетки. Еще в конце ХIХ века немецкий ученый Вильгельм Ру (1850-1924) предположил, что хромосомы содержат жизненно важные структуры, так как при клеточном делении они делятся вдоль пополам, и половинки отходят к полюсам клетки. Очевидно, эти структуры расположены подлине хромосом, иначе они делились бы не вдоль, а поперек.
Догадка Вильгельма Ру полностью подтвердилась, когда в хромосомах обнаружили длинные спирали молекул ДНК, основными участками которых являются гены. Химическим компонентом хромосомы является ДНК – дезоксирибонуклеиновая кислота. Изучение ее строения и свойств позволило понять механизм и закономерности записи и воспроизведения генетической информации, поэтому ДНК принято рассматривать как материальную основу наследственности. Изучение хромосомы показало, что они оказывают специфическое влияние на развитие и свойства клеток.
Изучение хромосомы показало, что они оказывают специфическое влияние на развитие и свойства клеток.
Участок хромосомы (молекулы ДНК), определяющий какой-либо признак или группу признаков организма, принято называть геном. Совокупность генов организма называют его генотипом, совокупность всех признаков организма, проявляющихся на протяжении жизни, — фенотипом. Место, занимаемое данным геном в хромосоме, получило название локуса.
О том, что в соматических клетках человека по 46 хромосом, стало известно только в 1956 году. Каждая пара – от самых длинных до коротеньких – была пронумерована от 1 до 22. Лишь самая последняя – 23-я пара потребовала особого обозначения. 22 пары хромосом назвали аутосомами, одинаковыми для обоих полов, а хромосомы 23-й пары – половыми хромосомами, обозначив большую по размеру буквой «икс» (Х), а меньшую – буквой «игрек» (Y)
Зрелые половые клетки отличаются от соматических2 клеток (аутосом) тем, что они содержат половинчатый набор хромосом – по одной из каждой пары и одну половую хромосому – X или Y. В процессе оплодотворения половые клетки сливаются, и число хромосом в оплодотворенной яйцеклетке удваивается. Этот механизм обеспечивает передачу потомству генетической информации от обоих родителей. В зависимости от того, как разные гены (отцовские и материнские) будут взаимодействовать между собой, ребенок будет больше походить на того или иного родителя.
В процессе оплодотворения половые клетки сливаются, и число хромосом в оплодотворенной яйцеклетке удваивается. Этот механизм обеспечивает передачу потомству генетической информации от обоих родителей. В зависимости от того, как разные гены (отцовские и материнские) будут взаимодействовать между собой, ребенок будет больше походить на того или иного родителя.
В каждой половой клетке при особом делении – мейозе – возникает свое сочетание генов, содержащихся в 23 хромосомах. Удалось подсчитать, что количество сочетаний генов (и, следовательно, сортов половых клеток) выражается астрономическим числом 223. Таким образом, встреча сперматозоида и яйцеклетки, содержащих какие-то конкретные, желаемые родителями гены, является примером такой же случайностью, как возможность выигрыша в спортлото наибольшего приза.
Зрелыми, т. е. способными дать потомство, и сперматозоид и яйцеклетка становятся в организме, достигшем половой зрелости. Мужские половые клетки образуются с этого момента постоянно. У женщин половые гаметы созревают лишь раз в месяц и жизнеспособны в течение 4-5 дней.
Мужские половые клетки образуются с этого момента постоянно. У женщин половые гаметы созревают лишь раз в месяц и жизнеспособны в течение 4-5 дней.
Гены отличаются высокой устойчивостью к внешним влияниям и способны оставаться неизменными на протяжении многих поколений. Однако гены, определяющие одни и те же признаки, имеют некоторые отличия у разных людей. Среди всего населения Земли трудно найти двух одинаковых людей. На самом деле, у человека около 30 тысяч полиморфных генов, различные сочетания которых при образовании гамет и зигот обеспечивают неповторимость каждого индивида.
Наследуемые признаки заложены в генах и хромосомах, количество которых в каждой соматической клетке человека равно 46. Половину из них – 23- человек получает от матери, половину – от отца. Хромосомный набор клетки состоит из аутосом и половых хромосом. Хромосомы состоят из ДНК. Разные признаки определяются разными белками. В процессе мейоза возникает непредсказуемое сочетание генов. поэтому каждый человек уникален по своим признакам и свойствам. Наследственная информация, заложенная в хромосомах и генах, по сравнению с нормой может искажаться, вызывая разнообразные наследственные болезни. Они обнаруживаются примерно у десяти из ста тысяч новорожденных.
поэтому каждый человек уникален по своим признакам и свойствам. Наследственная информация, заложенная в хромосомах и генах, по сравнению с нормой может искажаться, вызывая разнообразные наследственные болезни. Они обнаруживаются примерно у десяти из ста тысяч новорожденных.
Глава II. Наследственные заболевания человека.
Наследственные заболевания обусловлены, как правило, наследственно закрепленными изменениями генетической информации – мутациями. Мутации могут возникать как в результате действия факторов окружающей среды (ионизирующее излучение, некоторые биологически активные химические соединения), так и спонтанно, т.е. без видимых причин.
Различают три группы наследственных заболеваний:
1. Болезни связанные с нарушением обмена веществ.
2. Хромосомные заболевания.
3. Многофакторные заболевания.
1. Заболевания, связанные с нарушением обмена веществ.
Процессы обмена веществ в клетке находится под двойным контролем. С одной стороны, это нервная и эндокринная регуляция, обеспечивающая согласование обменных процессов с условиями среды, окружающей клетку, с другой – сложная система генетического контроля синтеза ферментных белков. С точки зрения медицинской генетики развитие наследственной патологии в результате мутации может быть следствием следующих возможных нарушений:
полной блокады (выключения) синтеза фермента;
снижение активности фермента;
нарушение других систем или биохимических реакций, от которых зависит активность фермента.
а). Отсутствие или низкая активность ферментов в большинстве случаев ведут к возникновению наследственных заболеваний обмена веществ – так называется энзимопатий. Многие наследственные дефекты обмена веществ сопровождаются развитием болезненных состояний, широко варьирующих по тяжести течения заболевания – от легкого до чрезвычайно тяжелого. Некоторые из них могут протекать даже бессимптомно. Первые клинические проявления наследственные заболевания обмена веществ чаще всего обнаруживаются в раннем детском возрасте. Но нередко наследственная патология клинически впервые проявляется у детей старшего возраста и даже у взрослых.
Многие наследственные дефекты обмена веществ сопровождаются развитием болезненных состояний, широко варьирующих по тяжести течения заболевания – от легкого до чрезвычайно тяжелого. Некоторые из них могут протекать даже бессимптомно. Первые клинические проявления наследственные заболевания обмена веществ чаще всего обнаруживаются в раннем детском возрасте. Но нередко наследственная патология клинически впервые проявляется у детей старшего возраста и даже у взрослых.
Одним из наиболее важных методов установления наследственной природы заболевания является генеалогический метод, основанный на составлении анализа родословных больных.
В эту группу входят заболевания, связанные с нарушением обмена аминокислот; известно большое количество наследственных болезней обмена аминокислот.
Значительное количество жировых веществ содержится в головном мозге, поэтому наследственные нарушения жирового обмена часто сопровождаются поражением центральной нервной системы. С наследственным нарушением жирового обмена, в частности связана амавротическая идиотия Тея — Сакса. Это тяжелое заболевание характеризуется прогрессирующим снижением зрения и слабоумием в сочетании с другими неврологическими симптомами. Семейный характер болезни проявляется возникновением идиотии у братьев и сестер, в то время как родители здоровы.
С наследственным нарушением жирового обмена, в частности связана амавротическая идиотия Тея — Сакса. Это тяжелое заболевание характеризуется прогрессирующим снижением зрения и слабоумием в сочетании с другими неврологическими симптомами. Семейный характер болезни проявляется возникновением идиотии у братьев и сестер, в то время как родители здоровы.
К наследственным заболеваниям, связанным с нарушением обмена углеводов, относят, например, галактезимию, при которой нарушен процесс ферментативного превращения галактозы в глюкозу. В результате галактоза и продукты ее обмена накапливаются в клетках и оказывают повреждающее действие на печень, центральную нервную систему и др. Клинически галактозимия проявляется поносом, рвотой с первых дней жизни ребенка, стойкой желтухой в связи с поражением печени. Помутнением хрусталика (катаракта), задержкой умственного и физического развития. К наследственным нарушениям обмена углеводов относят сахарный диабет и ряд других заболеваний.
Успехи иммунологии и генетики медицинской вызвали бурное развитие нового направления- иммуногенетики. Например, наследственно обусловленные дефекты синтеза специфических белков, определяющих иммунную защиту организма, — так называется, иммуноглобулинов – проявляются снижением сопротивляемости организма микробным инфекциям, что ведет к развитию септических состояний и хронических заболеваний различных органов и систем. Наиболее выражено это при болезни Брутона, которая наблюдается, только у мальчиков характеризуется снижением всех фракций иммуноглобулинов. Дети рождаются здоровыми. Повышенная чувствительность к инфекции обнаруживается на 3-4-м месяце жизни. Поражаются легкие, среднее ухо (хронический гнойный отит), желудочно-кишечный тракт. У детей старшего возраста это способствует хроническому течению заболеваний легких.
Наследственный дефицит того или иного фермента может стать причиной нарушения продукции гормонов, необходимых для нормальной деятельности организма. Так, кора надпочечников выделяет такие важные для организма гормоны, как глюкокортикоиды (гидрокортизон и др.), регулирующие углеводный обмен, минералокортикоиды – альдостерон и др., с которыми связан водно-солевой обмен, андрогенные гормоны, влияющие на формирование вторичных половых признаков. К наследственным болезням надпочечников относят так называемый адреногенитателтный синдром. Наиболее тяжело протекает этот синдром в тех случаях, когда он сопровождается выраженными нарушениями водно-солевого обмена. Ребенок отказывается от груди, у него появляется упорная рвота, он теряет в весе. У девочек могут обнаруживаться изменения наружных половых органов, у мальчиков – их пигментация (они становятся более темными).
Так, кора надпочечников выделяет такие важные для организма гормоны, как глюкокортикоиды (гидрокортизон и др.), регулирующие углеводный обмен, минералокортикоиды – альдостерон и др., с которыми связан водно-солевой обмен, андрогенные гормоны, влияющие на формирование вторичных половых признаков. К наследственным болезням надпочечников относят так называемый адреногенитателтный синдром. Наиболее тяжело протекает этот синдром в тех случаях, когда он сопровождается выраженными нарушениями водно-солевого обмена. Ребенок отказывается от груди, у него появляется упорная рвота, он теряет в весе. У девочек могут обнаруживаться изменения наружных половых органов, у мальчиков – их пигментация (они становятся более темными).
Совершенствование методов биохимического исследования позволило выделить группу заболеваний почек, в развитии которых ведущую роль играют наследственные факторы. Клинический диагноз этих заболеваний весьма затруднен, т.к. по течению они напоминают нефрит или пиелонефрит; их предложено называть нефритоподобными заболеваниями почек (нефропатиями). Важная роль при этом принадлежит тщательному изучению семейного анамнеза, составлению и анализу родословной. Данные лабораторных исследований характеризуются, отсутствием свойственных нефриту признаков – нет отеков или повышения кровяного давления. Для наследственных нефропатий характерно сочетание изменений почек с порками развития других органов и систем ребенка (глухота, отставание в умственном развитии, изменение скелета и др.).
Важная роль при этом принадлежит тщательному изучению семейного анамнеза, составлению и анализу родословной. Данные лабораторных исследований характеризуются, отсутствием свойственных нефриту признаков – нет отеков или повышения кровяного давления. Для наследственных нефропатий характерно сочетание изменений почек с порками развития других органов и систем ребенка (глухота, отставание в умственном развитии, изменение скелета и др.).
К этой группе наследственных заболеваний относят также ряд рахитоподобных заболеваний (например, фосфат-диабет), болезней, связанных с повышенным выведением с мочой аминокислот, фосфора и сахара, с нарушением обмена цистина, глицина, а также ряд заболеваний с дефектами в почечных механизмах выведения ионов водорода, что приводит к нарушению равновесия кислот и оснований в организме.
б) одной из разновидностей болезней нарушения обмена веществ являются заболевания, связанные с изменением одного гена. Как я уже говорила выше, гены обладают большой устойчивостью. Они передаются от родителей детям уже в течение тысяч поколений. Но и измененный (мутантный) ген также может быть устойчивым.
Как я уже говорила выше, гены обладают большой устойчивостью. Они передаются от родителей детям уже в течение тысяч поколений. Но и измененный (мутантный) ген также может быть устойчивым.
В настоящее время известно свыше 3 тысяч генетических нарушений, связанных с изменением одного гена. В ряде случаев причина заболевания кроется в изменении определенного фермента. Обнаруживаются также дефекты в неферментных белках. Природа многих нарушений неизвестна.
При световой слепоте (дальтонизме) человек не может отличить красный цвет от зеленого. Этим дефектом зрения страдает около 45% мужчин и менее 1 % женщин: для проявления заболевания у женщин необходимо два аномальных гена, а у мужчин – один. От одного гена зависит и наследование заболевания системы крови гемофилии; она сопровождается повышенной кровоточивостью, обусловленной наследственными дефектами в биосинтезе определенных белков крови, ответственных за ее свертывание. Гемофилией страдают чаще всего мужчины, а женщины являются носительницами мутантного гена, как и при дальтонизме.
Даже этот далеко неполный перечень указывает на многочисленность наследственных болезней, разнообразие их течения и различный прогноз, что, в свою очередь, требует кропотливой работы врача, изучения семейного анамнеза и целенаправленного, углубленного клинико-лабораторного обследования.
2. Хромосомные заболевания.
Интерес, проявляемый учеными всего мира к наследственности человека не случаен. В последние десятилетия человечество тесно соприкасается с чуждыми для него химическими веществами. Число таких веществ, применяемых в быту, сельском хозяйстве, пищевой, фармакологической, косметологической промышленности и других областях деятельности человека, в настоящее время огромно. Среди этих веществ и есть такие, которые вызывают мутации.1 Изменения наследственных признаков организма, обусловленное мутациями может носить различный характер. Если мутации затронули второстепенные участки наследственных структур, вызванные ею изменения могут не оказывать существенного влияния на жизнедеятельность организма и мутации могут вообще остаться незамеченными. В ряде случаев мутации не нарушая функции организма, тем не менее приводят к ярко выраженным изменениям его наследственных форм. Наконец, мутации могут вызывать серьезные расстройства жизнедеятельности, вплоть до гибели организма на ранних стадиях его развития. Такие мутации лежат в ряде наследственных болезней человека.
Если мутации затронули второстепенные участки наследственных структур, вызванные ею изменения могут не оказывать существенного влияния на жизнедеятельность организма и мутации могут вообще остаться незамеченными. В ряде случаев мутации не нарушая функции организма, тем не менее приводят к ярко выраженным изменениям его наследственных форм. Наконец, мутации могут вызывать серьезные расстройства жизнедеятельности, вплоть до гибели организма на ранних стадиях его развития. Такие мутации лежат в ряде наследственных болезней человека.
Частота хромосомных мутаций у человека велика и является причиной нарушений (до40%) у новорожденных. В большинстве случаев хромосомные мутации возникают в гаметах родителей заново, реже они существуют у одного из родителей и предаются потомкам.
Эти заболевания характеризуются изменением структуры или числа хромосом. Они встречаются примерно у 1% новорожденных. Грубые аномалии хромосом несовместимы с жизнью и служат частой причиной самопроизвольных абортов, выкидышей и мертво рождений. Самым серьезным следствием изменения хромосом зародыша является неправильное формирование его органов – как внутренних, так и наружных. Нарушается строение головного мозга, страдают, как правило, органы зрения и слуха. Раньше, до наступления эры антибиотиков, эти больные рано умирали из-за чрезвычайной чувствительности к инфекционным заболеваниям.
Самым серьезным следствием изменения хромосом зародыша является неправильное формирование его органов – как внутренних, так и наружных. Нарушается строение головного мозга, страдают, как правило, органы зрения и слуха. Раньше, до наступления эры антибиотиков, эти больные рано умирали из-за чрезвычайной чувствительности к инфекционным заболеваниям.
В 1959 году были известны лишь 4 хромосомные аномалии, а сейчас их насчитывается более 750. По мере совершенствования методов выявления болезни описываются новые их формы. Различают группы хромосомных болезней, обусловленных аномалиями половых и неполовых хромосом (аутосом). К аномалиям половых хромосом относят, например, синдром Шерешевского – Тернера, при котором на шее и в локтевых сгибах отмечается избыток кожи, она собирается в выраженные крыловидные складки. С возрастом обнаруживается отставание в росте. К периоду полового созревания проявляются признаки полового инфантилизма с задержкой развития вторичных половых признаков и явлениями первичной аменореи.
К наиболее распространенным аномалиям неполовых хромосом относят, например, синдром Дауна, описанный еще в 1886 году английским врачом Ленгдоном Дауном. Эта болезнь характеризуется своеобразным внешним видом больных; отмечаются неправильная форма черепа, косой разрез глаз, маленькие ушные раковины, диспропорция туловища и конечностей, пальцы короткие, мизинец укорочен и искривлен, тонус мышц снижен. У многих больных наблюдается порок сердца, нарушение функции желез внутренней секреции, отставание в психическом развитии. Две трети детей с болезнью Дауна погибают в утробе матери. Причиной болезни является лишняя 23-я хромосома, ее присутствие сказывается уже с первых делений клеток зародыша. Частота рождения ребенка с болезнью Дауна увеличивается с возрастом матери и может достигать 2% и более у 40-50-летних женщин, что, вероятно, связано с нарушением равномерного распределения хромосом при образовании женских половых клеток — яйцеклеток.
3. Многофакторные заболевания.
Многофакторные заболевания.
Еще одна группа наследственных болезней связана с состоянием окружающей среды. Это – экогенетические заболевания, которые развиваются у наследственно предрасположенных лиц под влиянием определенных внешних воздействий. Основная особенность этих недугов заключается в том, что заболевание развивается только в результате взаимодействия наследственного задатка с факторами окружающей среды. Алкоголизм1, инфаркт миокарда2,ишемическая болезнь сердца3 и ряд других заболеваний связаны с наследственной предрасположенностью. У человека есть наследственная предрасположенность, но нет болезни. Болезнь может появиться под действием определенных факторов, а может не появиться. Каждый человек должен знать свою родословную и представлять возможность возникновения заболеваний, к которым имеет наследственную предрасположенность.
Заключение.
Эмбрион человека развивается под воздействием многих факторов. Наследственные заболевания протекают тяжело, лечение их малоэффективно, они передаются из поколения в поколение, поэтому так важна профилактика – предупреждение наследственных заболеваний.
Генетики уже более ста лет задумываются об опасности наследственных заболеваний, называя ее «вырождением человеческого рода». Они делали первые шаги по защите наследственности человека или ее «улучшению», за что подвергались осмеянию или беспощадному гонению.
В настоящее время разрабатывается ряд направлений в профилактике наследственных болезней. Первое связано с контролем за состояние окружающей среды, т.е. с определением необходимых качеств и допустимых норм загрязнений и исключением мутагенов – веществ, вызывающих злокачественные новообразования; внедряется новый метод предупреждения врожденных и наследственных заболеваний – генетический мониторинг популяций. Он предусматривает регистрацию и слежение за частотой появления новых мутаций. Генетический мониторинг популяций предполагает контроль за мутагенным влиянием внешней среды. Ученые ищут способы выявления мутагенной активности химических веществ. В первую очередь речь идет о мутагенных лекарственных средствах и пищевых добавках. Необходимо также исключить рентгенологические и радиологические исследования.
Он предусматривает регистрацию и слежение за частотой появления новых мутаций. Генетический мониторинг популяций предполагает контроль за мутагенным влиянием внешней среды. Ученые ищут способы выявления мутагенной активности химических веществ. В первую очередь речь идет о мутагенных лекарственных средствах и пищевых добавках. Необходимо также исключить рентгенологические и радиологические исследования.
Второе направление связано с поиском антимутагенов – веществ, препятствующих возникновению мутаций. Такие вещества имеются в живой природе, а также среди созданных человеком химических соединений. Могут быть получены и новые вещества с требуемыми качествами. Антимутагены можно использовать в качестве пищевых добавок и лекарств. Обнаружены антимутагенные свойства у некоторых лекарственных препаратов, например, у витаминов C и E. Есть антимутагены в продуктах растительного происхождения. Например, все зеленые культуры.
Планирование семьи – третье важнейшее направление профилактики наследственных заболеваний. Трагедия больного ребенка зачастую ломает судьбу родителей, хотя часто родители сами повинны в этой трагедии. В современном обществе родственные браки (браки между двоюродными братьями и сестрами) сравнительно редки. Однако есть области, где вследствие географических, социальных, экономических или других причин небольшие контингенты населения в течение многих поколений живут изолированно. В таких популяциях частота родственных браков бывает значительно выше, чем в обычных «открытых» популяциях. Так, высокий уровень наследственных заболеваний в некоторых регионах Азии и Африки связан с допущением браков между близкими родственниками. У детей в этом случае особенно часто проявляются скрытые наследственные заболевания. Статистика свидетельствует, что у родителей, состоящих в родстве, вероятность рождения детей, пораженных теми или иными наследственными недугами, или частота ранней детской смертности в десятки раз, а иногда даже в сотни раз выше, чем в неродственных браках. Родственные браки особенно нежелательны, когда имеется вероятность гетерозиготности супругов по одному и тому же рецессивному вредному гену.
Трагедия больного ребенка зачастую ломает судьбу родителей, хотя часто родители сами повинны в этой трагедии. В современном обществе родственные браки (браки между двоюродными братьями и сестрами) сравнительно редки. Однако есть области, где вследствие географических, социальных, экономических или других причин небольшие контингенты населения в течение многих поколений живут изолированно. В таких популяциях частота родственных браков бывает значительно выше, чем в обычных «открытых» популяциях. Так, высокий уровень наследственных заболеваний в некоторых регионах Азии и Африки связан с допущением браков между близкими родственниками. У детей в этом случае особенно часто проявляются скрытые наследственные заболевания. Статистика свидетельствует, что у родителей, состоящих в родстве, вероятность рождения детей, пораженных теми или иными наследственными недугами, или частота ранней детской смертности в десятки раз, а иногда даже в сотни раз выше, чем в неродственных браках. Родственные браки особенно нежелательны, когда имеется вероятность гетерозиготности супругов по одному и тому же рецессивному вредному гену.
Планирование семьи есть система мер, соблюдение которых позволяет свести до минимума риск рождения больного ребенка. Это отказ от близкородственных браков, рождение ребенка в оптимальном возрасте целый ряд других мер.
Оптимальным для деторождения является возраст матери от 20 до 35 лет. Более ранние и поздние роды увеличивают риск рождение ребенка с наследственной или врожденной патологией. Так, уменьшение вдвое количества женщин, родивших после 35 лет, снизило число страдавших болезнью Дауна на 15 – 20%.
Дородовая диагностика – четвертое направление в работе по предупреждению наследственной патологии.
Значение генетики человека позволяет прогнозировать вероятность рождения детей, страдающих наследственными недугами, в случаях, когда один или оба супруга больны или оба здоровы, но наследственные заболевания встречались у предков супругов. В ряде случаев имеется возможность прогноза вероятности рождения второго здорового ребенка, если первый был поражен наследственным заболеванием.
По мере повышения биологической и особенно генетической образованности широких масс населения супружеские пары, еще не имеющие детей, все чаще обращаются к врачам-генетикам с вопрос о риске иметь ребенка, пораженного наследственной аномалией. Если в процессе дородовой диагностики установлена наследственная патология эмбриона или плода, то беременность можно прервать.
В настоящее время во многих странах широко применяется метод амниоцентеза.1 Благодаря этому методу на раннем этапе беременности может получить важную информацию о возможных хромосомных или генных мутациях плода и избежать рождения больного ребенка.
Особенно эффективна профилактика болезней, проявляющихся под влиянием факторов внешней среды у взрослых. Например, можно предотвратить раннюю энфизему1 легких, если бросить курить и прекратить работу в запыленной среде.
Предупреждение наследственных болезней – серьезная проблема. Человечество постоянно накапливает генетический груз. Защита окружающей среды; непримиримая борьба с загрязнениями воды, воздуха, пищевых продуктов веществами, обладающими мутагенным и канцерогенным действием (т.е. вызывающими возникновение мутации или злокачественное перерождение клеток), тщательная проверка на «генетическую» безвредность всех косметических и лекарственных средств и препаратов бытовой химии, поиск веществ — антимутагенов, планирование семьи, дородовая диагностика – все это важные условия для снижения частоты появления у людей наследственных недугов, таковы способы предупреждения наследственных заболеваний.
Человечество постоянно накапливает генетический груз. Защита окружающей среды; непримиримая борьба с загрязнениями воды, воздуха, пищевых продуктов веществами, обладающими мутагенным и канцерогенным действием (т.е. вызывающими возникновение мутации или злокачественное перерождение клеток), тщательная проверка на «генетическую» безвредность всех косметических и лекарственных средств и препаратов бытовой химии, поиск веществ — антимутагенов, планирование семьи, дородовая диагностика – все это важные условия для снижения частоты появления у людей наследственных недугов, таковы способы предупреждения наследственных заболеваний.
Литература.
Агаджанян Н.А., Шабатура Н.Н. Биоритмы, спорт, здоровье. /М.: Физкультура и спорт, 1989.
Берг Р.Л., Давиденков С.Н. Наследственность и наследственные болезни человека. / М.; 1971.
Давиденкова Е.
 Ф., Чухловин Л.Б. О наследственности. / М.; 1975.
Ф., Чухловин Л.Б. О наследственности. / М.; 1975.
Жуковский М.А. Нарушение обмена веществ: профилактика. / М.:
Знание, 1985.
Казькин В.Д. Справочник домашнего врача в двух томах. / М.; Изд-во Астрель, 2000.
Маркс К., Энгельс Ф. Соч., 2-е изд., Т.32.
Марков Ю.Г. Социальная экология. / Новосибирск: Наука, 1986.
Общая биология: Учеб.для 10-11 кл. шк. с углубл. изуч. биологии.
Под ред. Рувинского А.О. / М.: Просвещение, 1993. – 544 с.: ил.
9. Покровский В.И. Популярная медицинская энциклопедия. 3-е изд. / М.: Советская энциклопедия, 1991. – 688 с. с илл.
1 Хромосома – от греч.chroma — цвет и soma – тело.
2 Соматическая клетка – все клетки тела кроме половых.
1 Мутация – изменение носителей наследственной информации организма, не связанное с процессом нормального перераспределения (рекомбинации) генов.
1 Алкоголизм – злоупотребление спиртными напитками, оказывает пагубное влияние на здоровье и трудоспособность человека.
2 Инфаркт миокарда – острое заболевание, обусловленное развитием одного или нескольких очагов омертвления в сердечной мышце и проявляющееся нарушением сердечной деятельности.
3 Ишемическая болезнь сердца – заболевание сердечно-сосудистой системы, в основе которого лежит ухудшение кровоснабжения сердечной мышцы. Острые формы заболевания- стенокардия, инфаркт миокарда; хронические – поражение мышечной ткани сердца.
1 Амниоцентез – анализ клетки эмбриона из околоплодной жидкости.
1 Энфизема – заболевание, обусловленное расширением легочных пузырьков-альвеол и постепенным разрушением межаль-альвеолярных перегородок.
Генетика и здоровье – гены, поведение и социальная среда
Хотя существует много возможных причин заболеваний человека, семейная история часто является одним из сильнейших факторов риска для таких распространенных комплексов заболеваний, как рак, сердечно-сосудистые заболевания (ССЗ), диабет , аутоиммунные расстройства и психические заболевания. Человек наследует полный набор генов от каждого родителя, а также широкий спектр культурного и социально-экономического опыта своей семьи. Семейный анамнез считается хорошим предиктором индивидуального риска заболевания, потому что члены семьи наиболее точно представляют уникальные геномные и экологические взаимодействия, с которыми сталкивается индивидуум (Kardia et al., 2003). Унаследованная генетическая изменчивость внутри семьи явно вносит прямой и косвенный вклад в патогенез заболевания. В этой главе основное внимание уделяется тому, что известно или выдвигается в теории о прямой связи между генами и здоровьем, и тому, что еще предстоит изучить, чтобы понять взаимодействие с окружающей средой и относительную роль генов, влияющих на здоровье и болезнь.
Человек наследует полный набор генов от каждого родителя, а также широкий спектр культурного и социально-экономического опыта своей семьи. Семейный анамнез считается хорошим предиктором индивидуального риска заболевания, потому что члены семьи наиболее точно представляют уникальные геномные и экологические взаимодействия, с которыми сталкивается индивидуум (Kardia et al., 2003). Унаследованная генетическая изменчивость внутри семьи явно вносит прямой и косвенный вклад в патогенез заболевания. В этой главе основное внимание уделяется тому, что известно или выдвигается в теории о прямой связи между генами и здоровьем, и тому, что еще предстоит изучить, чтобы понять взаимодействие с окружающей средой и относительную роль генов, влияющих на здоровье и болезнь.
ГЕНЕТИЧЕСКАЯ ВОСПРИИМЧИВОСТЬ
Уже более 100 лет генетики человека изучают, как вариации генов влияют на вариации риска заболевания.Эти исследования использовали два подхода. Первый подход фокусируется на идентификации отдельных генов с вариациями, которые вызывают простые менделевские модели наследования болезни (например, аутосомно-доминантный, аутосомно-рецессивный и сцепленный с Х-хромосомой) (см. Менделевское наследование у человека). Второй подход направлен на то, чтобы понять генетическую предрасположенность к болезням как следствие совместного действия многих генов. Каждый из этих подходов будет рассмотрен ниже.
Менделевское наследование у человека). Второй подход направлен на то, чтобы понять генетическую предрасположенность к болезням как следствие совместного действия многих генов. Каждый из этих подходов будет рассмотрен ниже.
ТАБЛИЦА 3-1
Онлайн-статистика менделевского наследования у человека (OMIM) (по состоянию на 15 мая 2006 г.), количество записей.
В целом, заболевания с простым менделевским типом наследования, как правило, относительно редки или часто редки, с началом в раннем возрасте, такие как фенилкетонурия, серповидно-клеточная анемия, болезнь Тея-Сакса и муковисцидоз. Кроме того, некоторые из этих генов связаны с экстремальными формами распространенных заболеваний, таких как семейная гиперхолестеринемия, которая вызывается мутациями в рецепторе липопротеинов низкой плотности (ЛПНП), которые предрасполагают людей к раннему развитию сердечных заболеваний (Браун и Гольдштейн). , 1981).
Другим примером менделевской наследственности являются семейные формы рака молочной железы, связанные с мутациями в генах BRCA1 и BRCA2, которые предрасполагают женщин к раннему развитию рака молочной железы и часто к раку яичников. Выявленные гены имеют мутации, которые часто обладают высокой пенетрантностью, то есть вероятность развития заболевания у носителей генотипа предрасположенности к заболеванию относительно высока (более 50 процентов). Эти генетические заболевания часто демонстрируют генетическое явление, известное как аллельная гетерогенность , , при котором множественные мутации в одном и том же гене (т.e., аллели) связаны с одним и тем же заболеванием. Эта аллельная неоднородность часто специфична для популяции и может отражать уникальную демографическую и мутационную историю популяции.
Выявленные гены имеют мутации, которые часто обладают высокой пенетрантностью, то есть вероятность развития заболевания у носителей генотипа предрасположенности к заболеванию относительно высока (более 50 процентов). Эти генетические заболевания часто демонстрируют генетическое явление, известное как аллельная гетерогенность , , при котором множественные мутации в одном и том же гене (т.e., аллели) связаны с одним и тем же заболеванием. Эта аллельная неоднородность часто специфична для популяции и может отражать уникальную демографическую и мутационную историю популяции.
В некоторых случаях генетические заболевания также связаны с гетерогенностью локуса , что означает, что вредная мутация в любом из нескольких генов может привести к повышенному риску заболевания. Это открытие характерно для многих заболеваний человека, включая болезнь Альцгеймера и поликистозную болезнь почек.Как аллельная гетерогенность, так и гетерогенность локуса являются источниками изменчивости фенотипов этих заболеваний, поскольку они могут оказывать различное влияние на начало, прогрессирование и клиническую тяжесть заболевания.
Факторы окружающей среды также различаются у разных людей, и совокупный эффект неоднородности окружающей среды и генетической является этиологической неоднородностью. Этиологическая гетерогенность относится к феномену, который наблюдается в общей популяции, когда несколько групп случаев заболевания, таких как кластеры рака молочной железы, проявляют сходные клинические признаки, но на самом деле являются результатом различных событий или воздействий.Понимание этиологии конкретных заболеваний, а также идентификация возможных возбудителей облегчается путем обнаружения и изучения случаев заболевания, демонстрирующих этиологическую гетерогенность. Результаты этих исследований могут также выявить возможные взаимодействия между генами и взаимодействия между генами и окружающей средой, важные для процесса заболевания. Выявление этиологической гетерогенности может стать важным шагом на пути к анализу заболеваний с использованием методов молекулярной эпидемиологии и, в конечном итоге, может привести к улучшению стратегий профилактики заболеваний (Rebbeck et al. , 1997).
, 1997).
В отличие от менделевского подхода, второй подход к изучению того, как вариации генов влияют на вариации риска заболевания, фокусируется на понимании генетической предрасположенности к заболеваниям как следствии совместного действия многих генов, каждый из которых оказывает воздействие от небольшого до умеренного ( т. е. полигенные модели болезни) и часто взаимодействуют друг с другом и с окружающей средой, приводя к распределению риска заболевания, наблюдаемому в популяции (т. е. многофакторные модели болезни).Этот подход использовался в первую очередь для понимания генетики врожденных дефектов и распространенных заболеваний, а также их факторов риска. Как описано ниже, для развития такого понимания требуется несколько шагов.
В качестве первого шага участников исследования просят предоставить подробный семейный анамнез для оценки наличия семейной агрегации. Если у лиц с рассматриваемым заболеванием больше родственников, пораженных этим заболеванием, чем у лиц без заболевания, идентифицируется семейная агрегация. Хотя семейная агрегация может быть объяснена генетической этиологией, она также может представлять воздействие (например, пестицидов, загрязненной питьевой воды или рациона), общее для всех членов семьи из-за вероятности общей среды.
Хотя семейная агрегация может быть объяснена генетической этиологией, она также может представлять воздействие (например, пестицидов, загрязненной питьевой воды или рациона), общее для всех членов семьи из-за вероятности общей среды.
При наличии признаков семейной агрегации вторым шагом является сосредоточение научных исследований на оценке наследственности заболевания и/или его факторов риска. Наследуемость определяется как доля изменчивости риска заболевания в популяции, связанная с неизмеряемыми генетическими вариациями, выведенными на основе семейных моделей заболевания.Это широкая популяционная мера генетического влияния, которая используется для определения того, оправданы ли дальнейшие генетические исследования, поскольку она позволяет исследователям проверить всеобъемлющую нулевую гипотезу о том, что никакие гены не участвуют в определении риска заболевания. Исследования близнецов и семейные исследования часто используются для изучения наследственности.
Исследования близнецов, сравнивающие изменчивость заболеваний и факторов риска у монозиготных и дизиготных близнецов, были распространенным дизайном исследований, используемым для простой оценки как генетической, так и культурной наследственности. Исследования монозиготных близнецов, воспитанных вместе, по сравнению с близнецами, воспитанными порознь, также сыграли важную роль в оценке как генетического, так и экологического вклада в модели наследования. Моделирование источников фенотипической изменчивости с использованием семейных исследований стало довольно сложным, что позволяет включать параметры модели для представления аддитивного генетического компонента (т. е. полигенов), неаддитивного генетического компонента (т. е. и межгенные взаимодействия), общая семейная среда и индивидуальная среда.Было показано, что вклад этих факторов зависит от возраста и населения.
Исследования монозиготных близнецов, воспитанных вместе, по сравнению с близнецами, воспитанными порознь, также сыграли важную роль в оценке как генетического, так и экологического вклада в модели наследования. Моделирование источников фенотипической изменчивости с использованием семейных исследований стало довольно сложным, что позволяет включать параметры модели для представления аддитивного генетического компонента (т. е. полигенов), неаддитивного генетического компонента (т. е. и межгенные взаимодействия), общая семейная среда и индивидуальная среда.Было показано, что вклад этих факторов зависит от возраста и населения.
Когда установлены существенные доказательства генетической причастности, следующим шагом является определение ответственных генов и мутаций, связанных с повышенным или пониженным риском, с использованием либо анализа генетического сцепления, либо исследований генетической ассоциации. Например, при изучении врожденных дефектов это часто связано с поиском хромосомных делеций, вставок, дупликаций или транслокаций.
АНАЛИЗ ГЕНЕТИЧЕСКОГО СЦЕПЛЕНИЯ И ИССЛЕДОВАНИЯ ГЕНЕТИЧЕСКОЙ АССОЦИАЦИИ
Геном человека состоит из десятков тысяч генов.Имея на выбор около 30 000 генов, сопоставление конкретного гена или группы генов с соответствующим заболеванием человека требует методического подхода, состоящего из многих этапов. Традиционно процесс открытия генов начинается с анализа сцепления, который оценивает заболевание внутри семьи. За анализом сцепления обычно следуют исследования генетической ассоциации, которые оценивают заболевание в семьях или среди неродственных людей.
Генетический анализ сцепления
Термин сцепление относится к тенденции генов, проксимально расположенных на одной и той же хромосоме, наследоваться вместе.Анализ сцепления является одним из шагов в поиске гена предрасположенности к заболеванию. Цель этого анализа состоит в том, чтобы приблизить расположение гена болезни по отношению к известному генетическому маркеру, применяя понимание моделей сцепления. Традиционный анализ сцепления, который отслеживает закономерности наследственности как фенотипа заболевания, так и генетических маркеров в больших семьях с высоким риском, использовался для обнаружения генных мутаций, вызывающих заболевание, таких как ген рака молочной железы (BRCA1) на хромосоме 17 (Hall et al., 1990).
Традиционный анализ сцепления, который отслеживает закономерности наследственности как фенотипа заболевания, так и генетических маркеров в больших семьях с высоким риском, использовался для обнаружения генных мутаций, вызывающих заболевание, таких как ген рака молочной железы (BRCA1) на хромосоме 17 (Hall et al., 1990).
Поскольку тип наследования часто не ясен для распространенных заболеваний, был разработан альтернативный подход к классическому анализу сцепления, чтобы извлечь выгоду из основного генетического принципа, согласно которому братья и сестры в среднем разделяют половину своих аллелей. Изучая степень общего аллеля в их геномах, пары пораженных братьев и сестер (т. е. двух или более братьев и сестер с одним и тем же заболеванием) можно использовать для идентификации хромосомных областей, которые могут содержать гены, вариации которых связаны с изучаемым заболеванием.Если многочисленные пары братьев и сестер, пораженные интересующим заболеванием, обнаруживают большее, чем ожидалось, совместное использование известных аллелей используемого полиморфного генетического маркера, то генетический маркер, вероятно, будет сцеплен (то есть находится в непосредственной близости вдоль хромосомы) с ген восприимчивости, ответственный за изучаемое заболевание. Чтобы найти хромосомные области, демонстрирующие доказательства сцепления, с использованием этого метода пар пораженных братьев и сестер обычно требуется типирование множества пораженных родственных братьев с сотнями высокополиморфных маркеров, равномерно расположенных вдоль генома человека (Mathew, 2001).
Чтобы найти хромосомные области, демонстрирующие доказательства сцепления, с использованием этого метода пар пораженных братьев и сестер обычно требуется типирование множества пораженных родственных братьев с сотнями высокополиморфных маркеров, равномерно расположенных вдоль генома человека (Mathew, 2001).
Этот подход широко используется для выявления областей генома, которые, как считается, способствуют возникновению распространенных хронических заболеваний. Однако результаты анализа сцепления не были последовательно воспроизведены. Неспособность успешно воспроизвести данные о сцеплении может быть результатом недостаточной статистической мощности (то есть включения недостаточного количества пар братьев и сестер с интересующим заболеванием) или результатов, которые включали ложноположительные результаты в исходном исследовании. Альтернативным объяснением могло бы быть то, что разные популяции подвержены влиянию других генов восприимчивости, чем те, которые изучались первоначально (Mathew, 2001). Без последовательного повторения результатов преждевременно делать выводы о вкладе локуса гена в конкретное заболевание.
Без последовательного повторения результатов преждевременно делать выводы о вкладе локуса гена в конкретное заболевание.
После подтверждения связи исследователи могут начать поиск в регионе гена-кандидата восприимчивости. Поиск единственного гена предрасположенности к распространенным заболеваниям часто включает исследование очень больших областей сцепления, содержащих от 20 до 30 миллионов пар оснований и потенциально сотни генов (Mathew, 2001). Однако также важно отметить, что, хотя картирование сцепления является мощным инструментом для поиска генов менделевских болезней, оно часто дает слабые и иногда непоследовательные сигналы в исследованиях сложных заболеваний, которые могут быть многофакторными.Исследования сцепления наиболее эффективны при наличии единственного аллеля чувствительности в любом данном локусе болезни и, как правило, неэффективны при значительной генетической гетерогенности.
Генетические ассоциативные исследования
Технологические достижения в высокопроизводительном генотипировании позволили проводить прямое изучение специфических генетических различий среди значительного числа людей. Методы генетической ассоциации часто являются наиболее эффективным подходом для оценки того, как конкретные генетические вариации могут влиять на риск заболевания.Генетические ассоциативные исследования, которые использовались в течение десятилетий, постоянно совершенствовались с точки зрения разработки новых дизайнов исследований (таких как ассоциативные дизайны, основанные только на случаях и на основе семей), новых систем генотипирования (таких как генотипирование на основе массивов и мультиплексные тесты). ), и новые методы, используемые для устранения предубеждений, таких как население (Haines and Pericak-Vance, 1998).
Методы генетической ассоциации часто являются наиболее эффективным подходом для оценки того, как конкретные генетические вариации могут влиять на риск заболевания.Генетические ассоциативные исследования, которые использовались в течение десятилетий, постоянно совершенствовались с точки зрения разработки новых дизайнов исследований (таких как ассоциативные дизайны, основанные только на случаях и на основе семей), новых систем генотипирования (таких как генотипирование на основе массивов и мультиплексные тесты). ), и новые методы, используемые для устранения предубеждений, таких как население (Haines and Pericak-Vance, 1998).
Анализ влияния генетической изменчивости обычно включает сначала обнаружение полиморфизмов одиночных нуклеотидов (SNP) 1 , а затем анализ этих вариаций в образцах из популяций.SNP встречаются в среднем примерно через каждые 500–2000 оснований в геноме человека. Наиболее распространенный подход к обнаружению SNP заключается в секвенировании интересующего гена в репрезентативной выборке людей. В настоящее время секвенирование полных генов у небольшого числа людей (примерно от 25 до 50) может выявить полиморфизмы, встречающиеся у 1–3 процентов населения, с достоверностью примерно 95 процентов. Программа обнаружения полиморфизма ДНК человека в рамках проекта «Экологический геном» Национального института наук об окружающей среде является одним из примеров применения технологий автоматизированного секвенирования ДНК для выявления SNP в генах человека, которые могут быть связаны с восприимчивостью к болезням и реакцией на окружающую среду (Livingston et al. ., 2004). Программы Национального института сердца, легких и крови в области геномных приложений также привели к значительному расширению наших знаний о распределении SNP в ключевых генах, которые, как считается, уже биологически связаны с риском заболевания (т. е. биологические гены-кандидаты 2 ).
В настоящее время секвенирование полных генов у небольшого числа людей (примерно от 25 до 50) может выявить полиморфизмы, встречающиеся у 1–3 процентов населения, с достоверностью примерно 95 процентов. Программа обнаружения полиморфизма ДНК человека в рамках проекта «Экологический геном» Национального института наук об окружающей среде является одним из примеров применения технологий автоматизированного секвенирования ДНК для выявления SNP в генах человека, которые могут быть связаны с восприимчивостью к болезням и реакцией на окружающую среду (Livingston et al. ., 2004). Программы Национального института сердца, легких и крови в области геномных приложений также привели к значительному расширению наших знаний о распределении SNP в ключевых генах, которые, как считается, уже биологически связаны с риском заболевания (т. е. биологические гены-кандидаты 2 ).
Впечатляющие и быстрые достижения в технологии анализа SNP быстро переопределяют возможности обнаружения, картирования и генотипирования SNP. Новая технология генотипирования на основе массивов позволяет анализировать «ассоциацию всего генома» SNP между отдельными людьми или между штаммами видов лабораторных животных (Syvanen, 2005).Массивы, используемые для этих анализов, могут представлять сотни тысяч SNP, нанесенных на карту в геноме (Klein et al., 2005; Hinds et al., 2005; Gunderson et al., 2005). Этот подход позволяет быстро идентифицировать SNP, связанные с заболеванием и восприимчивостью к факторам окружающей среды. Сила этой технологии заключается в огромном количестве легко поддающихся измерению генетических вариаций, которые она предоставляет исследователям с минимальными затратами (от 500 до 1000 долларов за чип). Критерии выбора SNP для включения в эти массивы являются важным фактором, поскольку они влияют на выводы, которые можно сделать на основе этих платформ.Конечно, лучшим инструментом для обнаружения SNP и генотипирования является индивидуальное секвенирование всего генома. Несмотря на то, что в настоящее время это невозможно, быстрое развитие технологий, которое в настоящее время стимулируется проектом Национального исследовательского института генома человека «Геном стоимостью 1000 долларов», вероятно, сделает этот подход оптимальным для обнаружения SNP и генотипирования в будущем.
Новая технология генотипирования на основе массивов позволяет анализировать «ассоциацию всего генома» SNP между отдельными людьми или между штаммами видов лабораторных животных (Syvanen, 2005).Массивы, используемые для этих анализов, могут представлять сотни тысяч SNP, нанесенных на карту в геноме (Klein et al., 2005; Hinds et al., 2005; Gunderson et al., 2005). Этот подход позволяет быстро идентифицировать SNP, связанные с заболеванием и восприимчивостью к факторам окружающей среды. Сила этой технологии заключается в огромном количестве легко поддающихся измерению генетических вариаций, которые она предоставляет исследователям с минимальными затратами (от 500 до 1000 долларов за чип). Критерии выбора SNP для включения в эти массивы являются важным фактором, поскольку они влияют на выводы, которые можно сделать на основе этих платформ.Конечно, лучшим инструментом для обнаружения SNP и генотипирования является индивидуальное секвенирование всего генома. Несмотря на то, что в настоящее время это невозможно, быстрое развитие технологий, которое в настоящее время стимулируется проектом Национального исследовательского института генома человека «Геном стоимостью 1000 долларов», вероятно, сделает этот подход оптимальным для обнаружения SNP и генотипирования в будущем.
Имея возможность изучать большое количество генетических вариаций, исследователи переходят от исследования отдельных генов по одному к рассмотрению целых путей или физиологических систем, которые включают информацию с геномного, транскриптомного, протеомного и метабономического уровней, которые все они подвержены различным факторам окружающей среды (Haines and Pericak-Vance, 1998).Тем не менее, эти проекты исследований и аналитические методы, основанные на изучении генома и путей, все еще находятся на ранних стадиях разработки и потребуют совместных усилий многих дисциплин, от молекулярных биологов до клиницистов, социологов и биоинформатиков, чтобы максимально использовать их. эффективное использование этих огромных объемов данных.
ГЕН-ОКРУЖАЮЩАЯ СРЕДА И ГЕН-ГЕННЫЕ ВЗАИМОДЕЙСТВИЯ
Изучение взаимодействий ген-среда и ген-ген представляет собой широкий класс исследований генетических ассоциаций, сосредоточенных на понимании того, как генетическая изменчивость человека связана с различными реакциями на воздействия окружающей среды и с различными эффектами в зависимости от вариаций других генов. Чтобы проиллюстрировать концепцию взаимодействия генов с окружающей средой, ниже приводится обзор недавних исследований, выявляющих генетические мутации, которые, по-видимому, связаны с дифференциальной реакцией на сигаретный дым и ее связью с раком легких. Табачный дым содержит широкий спектр химических канцерогенов, которые могут вызвать повреждение ДНК. Существует несколько путей репарации ДНК, которые действуют для восстановления этого повреждения, и гены этого пути являются главными биологическими кандидатами для понимания того, почему у одних курильщиков развивается рак легких, а у других нет.В исследовании Zhou et al. (2003), вариации в двух генах, ответственных за репарацию ДНК, были исследованы на предмет их потенциального взаимодействия с уровнем курения сигарет и сопутствующей связи с раком легких. Вкратце, одна предположительно функциональная мутация в гене XRCC1 (группа 1 перекрестной комплементарности при рентгенологическом исследовании) и две предположительно функциональные мутации в гене ERCC2 (группа 2 перекрестной комплементарной репарации эксцизионной репарации) были генотипированы в 1091 случае рака легкого и 1240 контрольных больных.
Чтобы проиллюстрировать концепцию взаимодействия генов с окружающей средой, ниже приводится обзор недавних исследований, выявляющих генетические мутации, которые, по-видимому, связаны с дифференциальной реакцией на сигаретный дым и ее связью с раком легких. Табачный дым содержит широкий спектр химических канцерогенов, которые могут вызвать повреждение ДНК. Существует несколько путей репарации ДНК, которые действуют для восстановления этого повреждения, и гены этого пути являются главными биологическими кандидатами для понимания того, почему у одних курильщиков развивается рак легких, а у других нет.В исследовании Zhou et al. (2003), вариации в двух генах, ответственных за репарацию ДНК, были исследованы на предмет их потенциального взаимодействия с уровнем курения сигарет и сопутствующей связи с раком легких. Вкратце, одна предположительно функциональная мутация в гене XRCC1 (группа 1 перекрестной комплементарности при рентгенологическом исследовании) и две предположительно функциональные мутации в гене ERCC2 (группа 2 перекрестной комплементарной репарации эксцизионной репарации) были генотипированы в 1091 случае рака легкого и 1240 контрольных больных. Когда случаи и контрольные группы были разделены на заядлых курильщиков и некурящих, Zhou et al.(2003) обнаружили, что у некурящих с мутантным генотипом XRCCI риск развития рака легких в 2,4 раза выше, чем у некурящих с нормальным генотипом. Напротив, у заядлых курильщиков с мутантным генотипом XRCCI риск рака легких был снижен на 50% по сравнению с их сверстниками с более частым нормальным генотипом. Когда три мутации из этих двух генов были исследованы вместе в крайнем сочетании генотипов (индивидуум с пятью или шестью мутациями, присутствующими в его/ее генотипе), было получено число 5.В 2 раза выше риск развития рака легких у некурящих и на 70 процентов снижение риска у заядлых курильщиков по сравнению с людьми без мутаций. Защитный эффект этих генетических вариаций у заядлых курильщиков может быть вызван дифференцированным повышением активности этих защитных генов, стимулируемым заядлым курением. Подобные типы взаимодействий ген-курение также были обнаружены для других генов этого пути, таких как ERCC1.
Когда случаи и контрольные группы были разделены на заядлых курильщиков и некурящих, Zhou et al.(2003) обнаружили, что у некурящих с мутантным генотипом XRCCI риск развития рака легких в 2,4 раза выше, чем у некурящих с нормальным генотипом. Напротив, у заядлых курильщиков с мутантным генотипом XRCCI риск рака легких был снижен на 50% по сравнению с их сверстниками с более частым нормальным генотипом. Когда три мутации из этих двух генов были исследованы вместе в крайнем сочетании генотипов (индивидуум с пятью или шестью мутациями, присутствующими в его/ее генотипе), было получено число 5.В 2 раза выше риск развития рака легких у некурящих и на 70 процентов снижение риска у заядлых курильщиков по сравнению с людьми без мутаций. Защитный эффект этих генетических вариаций у заядлых курильщиков может быть вызван дифференцированным повышением активности этих защитных генов, стимулируемым заядлым курением. Подобные типы взаимодействий ген-курение также были обнаружены для других генов этого пути, таких как ERCC1. Эти исследования иллюстрируют важность выявления генетических вариаций, связанных с дифференциальным риском заболеваний, связанных с поведением человека.Обратите внимание, что этот тип исследования также поднимает множество различных этических и социальных вопросов, поскольку он определяет уязвимые подгруппы и защищенные подгруппы субъектов как по генетическим, так и по человеческим поведенческим слоям (см. главу 10).
Эти исследования иллюстрируют важность выявления генетических вариаций, связанных с дифференциальным риском заболеваний, связанных с поведением человека.Обратите внимание, что этот тип исследования также поднимает множество различных этических и социальных вопросов, поскольку он определяет уязвимые подгруппы и защищенные подгруппы субъектов как по генетическим, так и по человеческим поведенческим слоям (см. главу 10).
Исследование Zhou et al. (2003) также демонстрирует увеличение объема информации, полученной при совместном изучении влияния множественных мутаций на заболевания, связанные с токсичностью. Другие исследования мутаций в генах, участвующих в метаболизме фазы II (GSTM1, GSTT1, GSTP1), также продемонстрировали важность изучения совместных эффектов мутаций (Miller et al., 2002) о риске рака. Хотя эти два исследования были сосредоточены на аддитивных эффектах нескольких генов, межгенные взаимодействия являются еще одним важным компонентом для лучшего понимания восприимчивости человека к болезням и взаимодействиям с окружающей средой.
Чтобы адекватно понять континуум геномной восприимчивости к факторам окружающей среды, влияющим на здоровье населения, необходимо провести дополнительные исследования совместных эффектов множественных мутаций. Успехи биоинформатики могут сыграть ключевую роль в этом начинании.Например, методы скрининга баз данных SNP на наличие мутаций в регуляторных областях транскрипции могут быть использованы как для обнаружения, так и для функциональной проверки полиморфных регуляторных элементов, таких как антиоксидантный регуляторный элемент, обнаруженный в промоторных областях многих генов, кодирующих антиоксидантные ферменты и ферменты детоксикации фазы II. Ван и др., 2005). Методы сравнительного анализа последовательностей также становятся все более ценными для генетических исследований человека, поскольку они позволяют ранжировать SNP по порядку с точки зрения их потенциально вредного воздействия на функцию белка или регуляцию генов (Wang et al., 2004). Методы проведения крупномасштабного анализа несинонимичных SNP для прогнозирования того, нарушает ли конкретная мутация функцию белка (Clifford et al.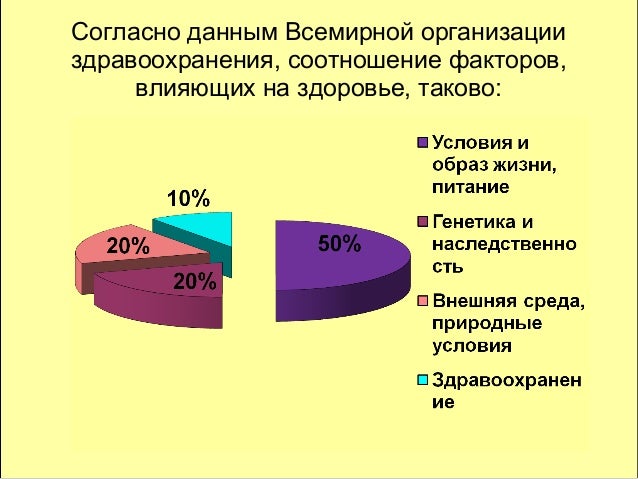 , 2004), могут помочь в выборе SNP для генетико-эпидемиологических исследований и могут быть использованы для оптимизации функционального анализа мутаций, которые, как обнаружено, быть статистически связаны с дифференциальной реакцией на факторы окружающей среды, такие как диета, стресс и социально-экономические факторы.
, 2004), могут помочь в выборе SNP для генетико-эпидемиологических исследований и могут быть использованы для оптимизации функционального анализа мутаций, которые, как обнаружено, быть статистически связаны с дифференциальной реакцией на факторы окружающей среды, такие как диета, стресс и социально-экономические факторы.
МЕХАНИЗМЫ ЭКСПРЕССИИ ГЕН
Выявление генов, вариации которых связаны с болезнью, — это только первый шаг в установлении связи между генетикой и здоровьем.Понимание механизмов экспрессии гена и того, как на него влияют другие гены, белки и окружающая среда, становится все более важным для разработки профилактических, диагностических и терапевтических стратегий.
Когда экспрессируются гены, хромосомная ДНК должна транскрибироваться в РНК, а затем РНК обрабатывается и транспортируется для трансляции в белок. Регуляция экспрессии генов является жизненно важным процессом в клетке и включает организацию хромосомной ДНК в соответствующую структуру хроматина более высокого порядка. Он также включает в себя действие множества специфических белковых факторов (поощряющих или подавляющих экспрессию генов), которые могут действовать на разных этапах пути экспрессии генов.
Он также включает в себя действие множества специфических белковых факторов (поощряющих или подавляющих экспрессию генов), которые могут действовать на разных этапах пути экспрессии генов.
Во всех организмах сети биохимических реакций и сигналов обратной связи организуют пути развития, клеточный метаболизм и продвижение по клеточному циклу. Общая координация клеточного цикла и клеточного метаболизма является результатом контроля прямой и обратной связи, возникающего из набора зависимых путей, в которых инициация событий зависит от более ранних событий.В этих сетях экспрессия генов контролируется молекулярными сигналами, которые регулируют, когда, где и как часто транскрибируется данный ген. Эти сигналы часто стимулируются влиянием окружающей среды или сигналами от других клеток, которые влияют на экспрессию многих генов посредством одного регуляторного пути. Поскольку регуляторный ген может действовать в сочетании с другими сигналами, чтобы контролировать многие другие гены, возможны сложные разветвленные сети взаимодействий (McAdams and Arkin, 1997).
Генная регуляция имеет решающее значение, поскольку, включая или выключая гены, когда это необходимо, клетки могут реагировать на изменения в окружающей среде (например,g., изменения в диете или активности) и может предотвратить растрату ресурсов. Таким образом, вариации в последовательностях ДНК, связанные с регуляцией экспрессии гена, являются вероятными кандидатами для понимания взаимодействий ген-среда на молекулярном уровне, поскольку эти вариации будут влиять на то, будет ли сигнал окружающей среды, передаваемый в ядро, успешно связываться с последовательностью промотора в генах. гена и стимулировать или подавлять экспрессию гена. Комбинация геномных технологий для генотипирования SNP с массивами экспрессии генов высокой плотности в исследованиях на людях только недавно прояснила степень, в которой может происходить этот тип взаимодействия молекулярного гена с окружающей средой.
Клетки также регулируют экспрессию генов посредством посттранскрипционной модификации; позволив только части мРНК перейти к трансляции; или путем ограничения трансляции конкретных мРНК только тогда, когда и где необходим продукт. Генетические факторы, влияющие на посттранскрипционный контроль, гораздо труднее изучить, поскольку они часто включают мультибелковые комплексы, которые нелегко извлечь или проанализировать из клеток. На других уровнях клетки регулируют экспрессию генов с помощью эпигенетических механизмов, включая фолдинг ДНК, ацетилирование гистонов и метилирование (т.д., химическая модификация) нуклеотидных оснований. На эти механизмы, вероятно, влияют генетические вариации генов-мишеней, а также вариации, проявляющиеся в транслируемых клеточных регуляторных белках. Генная регуляция происходит на протяжении всей жизни на всех уровнях развития и старения организма.
Генетические факторы, влияющие на посттранскрипционный контроль, гораздо труднее изучить, поскольку они часто включают мультибелковые комплексы, которые нелегко извлечь или проанализировать из клеток. На других уровнях клетки регулируют экспрессию генов с помощью эпигенетических механизмов, включая фолдинг ДНК, ацетилирование гистонов и метилирование (т.д., химическая модификация) нуклеотидных оснований. На эти механизмы, вероятно, влияют генетические вариации генов-мишеней, а также вариации, проявляющиеся в транслируемых клеточных регуляторных белках. Генная регуляция происходит на протяжении всей жизни на всех уровнях развития и старения организма.
Классическим примером онтогенетического контроля экспрессии генов является дифференциальная экспрессия эмбриональных, фетальных и взрослых генов гемоглобина (см. вставку 3-1). Регуляция генов эпсилон, дельта, гамма, альфа и бета происходит посредством метилирования ДНК, которое строго контролируется сигналами развития.Во время развития большое количество генов включается и выключается посредством эпигенетической регуляции. Одной из самых быстрорастущих областей генетики является изучение последствий воздействия окружающей среды на паттерны экспрессии генов и влияние генетических вариаций на эти траектории развития.
Одной из самых быстрорастущих областей генетики является изучение последствий воздействия окружающей среды на паттерны экспрессии генов и влияние генетических вариаций на эти траектории развития.
ВСТАВКА 3-1
Экспрессия генов и глобины. Производство гемоглобина регулируется рядом механизмов транскрипционного контроля, таких как переключение, которое диктует экспрессию разного набора генов глобина в разных частях тела на разных стадиях (см…)
Пример моногенного заболевания со значительной клинической вариабельностью: серповидно-клеточная анемия
3 Серповидно-клеточная анемия относится к аутосомно-рецессивному заболеванию крови, вызванному вариантом гена β-глобина, называемым серповидно-клеточным гемоглобином ( Гб С). Замена одного нуклеотида (T→A) в шестом кодоне гена β-глобина приводит к замене валина на глутаминовую кислоту (GTG→GAG), что может вызвать полимеризацию Hb S (формирование длинных цепей) при дезоксигенировании (Stuart и Нагель, 2004). Считается, что человек, унаследовавший две копии Hb S (Hb SS), страдает серповидноклеточной анемией , в то время как человек, унаследовавший одну копию Hb S плюс еще один вредный вариант β-глобина (например, Hb C или Hb β-талассемия), считается больным серповидноклеточной болезнью . Человек считается носителем серповидноклеточного признака, если у него есть одна копия нормального гена β-глобина и одна копия серповидного варианта (Hb AS) (Ashley-Koch et al., 2000).
Считается, что человек, унаследовавший две копии Hb S (Hb SS), страдает серповидноклеточной анемией , в то время как человек, унаследовавший одну копию Hb S плюс еще один вредный вариант β-глобина (например, Hb C или Hb β-талассемия), считается больным серповидноклеточной болезнью . Человек считается носителем серповидноклеточного признака, если у него есть одна копия нормального гена β-глобина и одна копия серповидного варианта (Hb AS) (Ashley-Koch et al., 2000).
Были идентифицированы четыре основных гаплотипа гена β-глобина.Три названы в честь регионов Африки, где впервые появились мутации: BEN (Бенин), SEN (Сенегал) и CAR (Центральноафриканская Республика). Четвертый гаплотип, арабо-индийский, встречается в Индии и на Аравийском полуострове (Quinn and Miller, 2004).
Тяжесть заболевания связана с несколькими генетическими факторами (Ashley-Koch et al., 2000). Самая высокая степень тяжести связана с Hb SS, за ней следуют Hb s/β0-талассемия и Hb SC. Hb S/β + -талассемия связана с более доброкачественным течением заболевания (Ashley-Koch et al.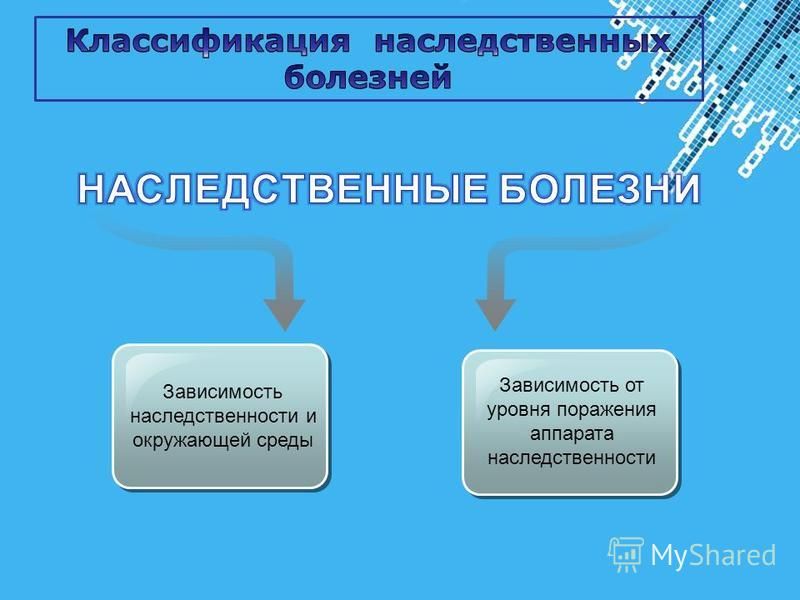 , 2000). Тяжесть заболевания также связана с гаплотипами β-глобина, вероятно, из-за различий в уровне гемоглобина и концентрации фетального гемоглобина. Гаплотип Сенегала является наиболее доброкачественной формой, за ним следует гаплотип Бенина, а гаплотип Центральноафриканской Республики является наиболее тяжелой формой (Ashley-Koch et al., 2000).
, 2000). Тяжесть заболевания также связана с гаплотипами β-глобина, вероятно, из-за различий в уровне гемоглобина и концентрации фетального гемоглобина. Гаплотип Сенегала является наиболее доброкачественной формой, за ним следует гаплотип Бенина, а гаплотип Центральноафриканской Республики является наиболее тяжелой формой (Ashley-Koch et al., 2000).
Таким образом, хотя серповидноклеточная анемия является моногенетическим заболеванием, ее фенотипическое проявление мультигенно (см. Приложение D). Существуют две кардинальные патофизиологические особенности серповидно-клеточной анемии — хроническая гемолитическая анемия и вазоокклюзия.Двумя основными последствиями гипоксии, вторичной по отношению к вазоокклюзионному кризу, являются боль и повреждение систем органов. Органы, подверженные наибольшему риску, — это органы с медленным кровотоком, такие как селезенка и костный мозг, или органы с ограниченным терминальным артериальным кровоснабжением, включая глаз, головку бедренной кости и плечевую кость, а также легкие. реципиент дезоксигенированных серповидных клеток, вышедших из селезенки или костного мозга. Основные клинические проявления серповидно-клеточной анемии включают болевые ощущения, острый грудной синдром, дисфункцию селезенки и нарушения мозгового кровообращения.
реципиент дезоксигенированных серповидных клеток, вышедших из селезенки или костного мозга. Основные клинические проявления серповидно-клеточной анемии включают болевые ощущения, острый грудной синдром, дисфункцию селезенки и нарушения мозгового кровообращения.
Усилия по совершенствованию клинической помощи сосредоточены на углублении нашего понимания патофизиологии серповидно-клеточной анемии, чтобы облегчить точный прогноз и индивидуализированное лечение. Необходимы знания о том, какие гены связаны с гемолитическими и сосудистыми осложнениями серповидно-клеточной анемии и как варианты этих генов взаимодействуют между собой и с окружающей средой (Steinberg, 2005).
АСПЕКТЫ ЗДОРОВЬЯ ПОД ВЛИЯНИЕМ ГЕНЕТИКИ
Поскольку каждая клетка в организме, за редким исключением, несет полный геном, полный вариаций, в качестве шаблона для развития своего белкового аппарата, можно утверждать, что генетическая изменчивость влияет на все клеточные, биохимические, физиологические и морфологические аспекты человеческого существа. То, как эти генетические вариации связаны с конкретным риском заболевания, находится в центре внимания многих текущих исследований. В отношении распространенных заболеваний, таких как сердечно-сосудистые заболевания, гипертония, рак, диабет и многие психические заболевания, растет понимание того, что разные гены и разные генетические вариации могут быть вовлечены в различные аспекты их естественного течения. Например, могут быть гены, вариации которых связаны с предрасположенностью к возникновению заболевания, и другие гены или вариации генов, которые участвуют в прогрессировании заболевания до клинически определенной конечной точки.Кроме того, совершенно другой набор генов может быть задействован в том, как человек реагирует на фармацевтическое лечение этого заболевания. Также, вероятно, будут гены, изменчивость которых контролирует, насколько человек может реагировать на факторы риска окружающей среды, связанные с риском заболевания. Наконец, считается, что существуют гены, влияющие на общую продолжительность жизни человека, которые могут противодействовать или взаимодействовать с генами, которые в противном случае могут предрасполагать этого человека к конкретному исходу болезни и, таким образом, могут оказывать дополнительное влияние на выживаемость.
То, как эти генетические вариации связаны с конкретным риском заболевания, находится в центре внимания многих текущих исследований. В отношении распространенных заболеваний, таких как сердечно-сосудистые заболевания, гипертония, рак, диабет и многие психические заболевания, растет понимание того, что разные гены и разные генетические вариации могут быть вовлечены в различные аспекты их естественного течения. Например, могут быть гены, вариации которых связаны с предрасположенностью к возникновению заболевания, и другие гены или вариации генов, которые участвуют в прогрессировании заболевания до клинически определенной конечной точки.Кроме того, совершенно другой набор генов может быть задействован в том, как человек реагирует на фармацевтическое лечение этого заболевания. Также, вероятно, будут гены, изменчивость которых контролирует, насколько человек может реагировать на факторы риска окружающей среды, связанные с риском заболевания. Наконец, считается, что существуют гены, влияющие на общую продолжительность жизни человека, которые могут противодействовать или взаимодействовать с генами, которые в противном случае могут предрасполагать этого человека к конкретному исходу болезни и, таким образом, могут оказывать дополнительное влияние на выживаемость.
Во многих отношениях мы только в начале пути к истинному пониманию того, как геномные вариации вызывают восприимчивость к болезням. Действительно, многие могут возразить, что без учета столь же важной роли окружающей среды мы никогда полностью не поймем роль генетики в здоровье. По мере прогресса в использовании новых технологий для измерения биологической изменчивости в геноме, транскриптоме, протеоме и метабономе нам, вероятно, придется внести большие изменения в наши концептуальные рамки о роли генов в заболевании.Глобальные паттерны геномной восприимчивости, вероятно, проявятся только тогда, когда мы рассмотрим влияние многих взаимодействующих компонентов, работающих одновременно, которые зависят от таких контекстов, как возраст, пол, диета и физическая активность, которые изменяют отношения с риском. По большей части мы все еще находимся на стадии документирования сложности, поиска примеров и типов генов генетической предрасположенности, понимания гетерогенности болезней и постулирования способов разработки моделей риска, использующих всю совокупность того, что мы знаем о биологии человека, начиная с наши геномы к нашей экологии для моделирования риска.
Сердечно-сосудистые заболевания (ССЗ)
Изучение сердечно-сосудистых заболеваний может быть использовано для иллюстрации проблем, возникающих при использовании генетической информации для понимания этиологии наиболее распространенных хронических заболеваний, а также для выявления тех, кто подвергается наибольшему риску развития эти заболевания. Большинство случаев сердечно-сосудистых заболеваний имеют сложную многофакторную этиологию, и даже полное знание генетической структуры человека не может с уверенностью предсказать начало, прогрессирование или тяжесть заболевания (Sing et al., 2003). Болезнь развивается как следствие взаимодействий между генотипом человека и воздействием факторов окружающей среды, которые влияют на сердечно-сосудистые фенотипы, начиная с зачатия и продолжаясь в течение всей взрослой жизни. Исследования сердечно-сосудистых заболеваний выявили множество агентов окружающей среды с высоким риском и сотни генов, каждый из которых имеет множество вариаций, которые, как считается, влияют на риск заболевания. По мере увеличения числа взаимодействующих агентов будет обнаруживаться меньшее число случаев заболевания, имеющих ту же этиологию и ассоциированных с определенным генотипом (Sing et al., 2003). Множество механизмов обратной связи и взаимодействия агентов из генома через промежуточные биохимические и физиологические подсистемы с воздействием агентов окружающей среды способствуют возникновению клинического фенотипа данного индивидуума. При попытке разобраться в относительном вкладе генов и окружающей среды в ССЗ необходимо учитывать большое количество факторов, от влияния генов на уровень холестерина (например, уровень ЛПНП) до психосоциальных факторов, таких как стресс и гнев. Хотя в инициацию, прогрессирование и клинические проявления ССЗ вовлечены сотни генов, относительно мало известно о том, как окружающая среда человека взаимодействует с этими генами, нарушая баланс между атерогенными и антиатерогенными процессами, которые приводят к клинически проявляющимся ССЗ. .См. главы 4 и 6 для дальнейшего обсуждения влияния социальной среды на сердечно-сосудистые заболевания.
По мере увеличения числа взаимодействующих агентов будет обнаруживаться меньшее число случаев заболевания, имеющих ту же этиологию и ассоциированных с определенным генотипом (Sing et al., 2003). Множество механизмов обратной связи и взаимодействия агентов из генома через промежуточные биохимические и физиологические подсистемы с воздействием агентов окружающей среды способствуют возникновению клинического фенотипа данного индивидуума. При попытке разобраться в относительном вкладе генов и окружающей среды в ССЗ необходимо учитывать большое количество факторов, от влияния генов на уровень холестерина (например, уровень ЛПНП) до психосоциальных факторов, таких как стресс и гнев. Хотя в инициацию, прогрессирование и клинические проявления ССЗ вовлечены сотни генов, относительно мало известно о том, как окружающая среда человека взаимодействует с этими генами, нарушая баланс между атерогенными и антиатерогенными процессами, которые приводят к клинически проявляющимся ССЗ. .См. главы 4 и 6 для дальнейшего обсуждения влияния социальной среды на сердечно-сосудистые заболевания.
Хорошо известно, что многие социальные и поведенческие факторы, от социально-экономического положения, стресса на работе и депрессии до курения, физических упражнений и диеты, влияют на риск сердечно-сосудистых заболеваний (более подробное обсуждение этих факторов см. в главах 2, 3 и 6). ). По мере того, как все больше исследований взаимодействия генов и окружающей среды рассматривают эти факторы как часть «окружающей среды», которые исследуются в сочетании с генетическими вариациями, возникает множество интеллектуальных и методологических проблем.Во-первых, как воплощены социальные факторы, так что взаимодействие с определенным генотипом может быть связано с дифференцированным риском? Во-вторых, как мы можем обрабатывать сложные взаимодействия, чтобы ответить на такие вопросы, как, например, как генотип человека влияет на его/ее поведение? Например, генетическая предрасположенность к никотиновой зависимости на самом деле является фактором риска сердечно-сосудистых заболеваний, и ее влияние на риск сердечно-сосудистых заболеваний может зависеть от взаимодействия с другими генетическими факторами.
Фармакогенетика
Хорошо известно, что люди часто по-разному реагируют на одну и ту же лекарственную терапию.Процесс утилизации лекарств представляет собой сложный набор физиологических реакций, которые начинаются сразу после введения. Лекарство всасывается и распределяется по целевым областям тела, где оно взаимодействует с клеточными компонентами, такими как рецепторы и ферменты, которые далее метаболизируют лекарство, и в конечном итоге лекарство выводится из организма (Weinshilboum, 2003). В любой момент этого процесса генетическая изменчивость может изменить терапевтический ответ человека и вызвать нежелательную лекарственную реакцию (ADR) (Evans and McLeod, 2003).Было подсчитано, что от 20 до 95 процентов вариаций в распределении лекарств, таких как НЛР, могут быть связаны с генетической изменчивостью (Kalow et al., 1998; Evans and McLeod, 2003).
Чувствительность как к дозозависимым, так и к дозонезависимым НЛР может иметь корни в генетической изменчивости. Полиморфизмы кинетических и динамических факторов, таких как цитохром P450 и специфические мишени для лекарственных средств, могут вызывать у этих людей предрасположенность к НЛР. Хотя характеристики ADR определяют истинное значение этих факторов, в большинстве случаев задействованы несколько генов (Pirmohamed and Park, 2001).Будущие анализы с использованием полногеномного профилирования SNP могут предоставить метод для оценки нескольких факторов генетической предрасположенности к ADR и установления их совместных эффектов. Одной из проблем изучения взаимосвязи между генетической изменчивостью и нежелательными реакциями является недостаточное количество образцов пациентов. Чтобы решить эту проблему, Pirmohamed and Park (2001) предложили, чтобы проспективные рандомизированные контролируемые клинические испытания стали частью стандартизированной практики, чтобы в конечном итоге доказать клиническую полезность генотипирования всех пациентов в качестве меры предотвращения побочных реакций.
Полиморфизмы кинетических и динамических факторов, таких как цитохром P450 и специфические мишени для лекарственных средств, могут вызывать у этих людей предрасположенность к НЛР. Хотя характеристики ADR определяют истинное значение этих факторов, в большинстве случаев задействованы несколько генов (Pirmohamed and Park, 2001).Будущие анализы с использованием полногеномного профилирования SNP могут предоставить метод для оценки нескольких факторов генетической предрасположенности к ADR и установления их совместных эффектов. Одной из проблем изучения взаимосвязи между генетической изменчивостью и нежелательными реакциями является недостаточное количество образцов пациентов. Чтобы решить эту проблему, Pirmohamed and Park (2001) предложили, чтобы проспективные рандомизированные контролируемые клинические испытания стали частью стандартизированной практики, чтобы в конечном итоге доказать клиническую полезность генотипирования всех пациентов в качестве меры предотвращения побочных реакций.
Здесь мы рассмотрим некоторые текущие работы в области фармакогенетики в качестве примера того, что можно ожидать от тщательного изучения взаимодействия между социальными, поведенческими и генетическими факторами.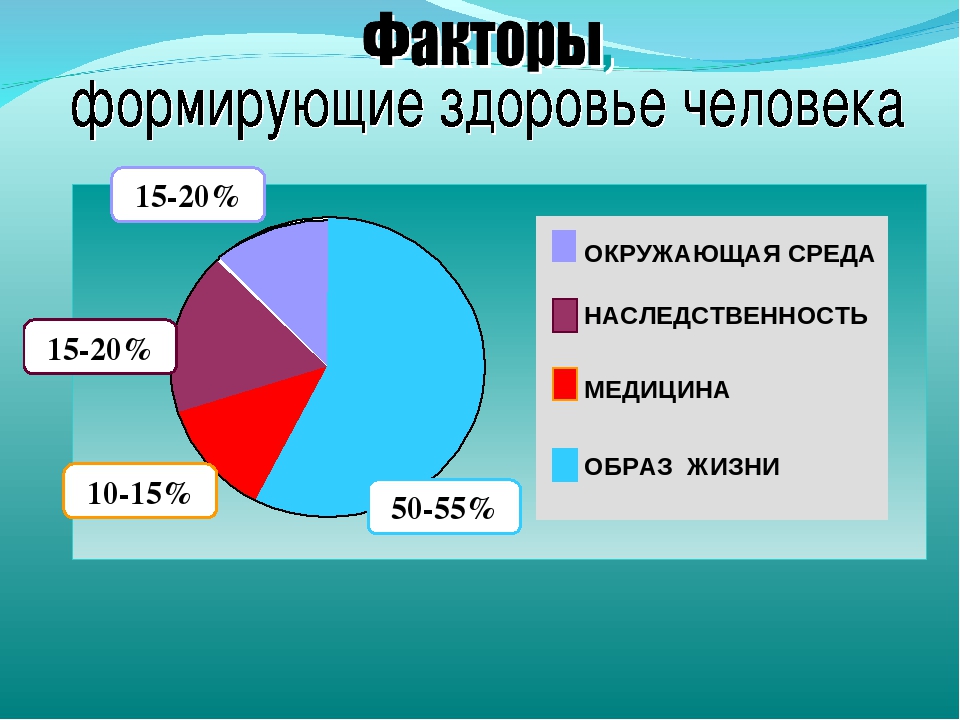 Исследователи представили несколько хорошо зарекомендовавших себя примеров различий в индивидуальном ответе на лекарство, которые объясняются генетическими вариациями различных клеточных механизмов распределения лекарств, таких как переносчики лекарств или ферменты, ответственные за метаболизм лекарств (Evans and McLeod, 2003).Например:
Исследователи представили несколько хорошо зарекомендовавших себя примеров различий в индивидуальном ответе на лекарство, которые объясняются генетическими вариациями различных клеточных механизмов распределения лекарств, таких как переносчики лекарств или ферменты, ответственные за метаболизм лекарств (Evans and McLeod, 2003).Например:
- Зная, что ген HER2 гиперэкспрессируется примерно в четверти случаев рака молочной железы, исследователи разработали гуманизированное моноклональное антитело против рецептора HER2 в надежде ингибировать рост опухоли, связанной с рецептором. Генотипирование больных раком молочной железы на поздних стадиях для выявления опухолей с повышенной экспрессией рецептора HER2 дало многообещающие результаты в улучшении клинических исходов у этих больных раком молочной железы (Cobleigh et al., 1999).
- Терапевтический класс препаратов, называемых тиопуринами, используется как часть схемы лечения острого лимфобластного лейкоза у детей. Один из 300 представителей европеоидной расы имеет генетическую вариацию, которая приводит к низким или отсутствующим уровням тиопуринметилтрансферазы (TPMT), фермента, ответственного за метаболизм тиопуриновых препаратов.
 Если пациентам с этой генетической вариацией дают тиопурины, препарат накапливается в их организме до токсического уровня, вызывая опасную для жизни миелосупрессию.Оценка фенотипа и генотипа TPMT пациента может быть использована для определения индивидуальной дозы препарата (Armstrong et al., 2004).
Если пациентам с этой генетической вариацией дают тиопурины, препарат накапливается в их организме до токсического уровня, вызывая опасную для жизни миелосупрессию.Оценка фенотипа и генотипа TPMT пациента может быть использована для определения индивидуальной дозы препарата (Armstrong et al., 2004). - Семейство ферментов печени, называемых цитохромами P450, играет важную роль в метаболизме до 40 различных типов лекарств. Генетические варианты этих ферментов могут снижать их способность эффективно расщеплять определенные лекарственные средства, что может привести к передозировке у пациентов с менее активными или неактивными формами фермента цитохрома Р450.Различные уровни сниженной активности цитохрома Р450 также вызывают беспокойство у пациентов, принимающих несколько препаратов, которые могут взаимодействовать, если они не метаболизируются должным образом хорошо функционирующими ферментами. Были разработаны стратегии для оценки уровня активности ферментов цитохрома Р450, которые полезны при планировании и мониторинге успешной медикаментозной терапии.
 Некоторые испытания фармацевтических препаратов в настоящее время включают ранние тесты, которые оценивают способность различных форм цитохрома Р450 метаболизировать новое лекарственное соединение (Obach et al., 2006).
Некоторые испытания фармацевтических препаратов в настоящее время включают ранние тесты, которые оценивают способность различных форм цитохрома Р450 метаболизировать новое лекарственное соединение (Obach et al., 2006).
Некоторые исследования в области фармакогенетики были сосредоточены на лечении психических расстройств. С появлением класса препаратов, известных как селективные ингибиторы обратного захвата серотонина (СИОЗС), фармакологическое лечение многих психических расстройств резко изменилось. СИОЗС предлагают значительные улучшения по сравнению с предыдущим поколением лечения, включая улучшенную эффективность и переносимость для многих пациентов. Однако не все пациенты положительно реагируют на лечение СИОЗС, и у многих возникают нежелательные реакции.Новые фармакогенетические исследования показали, что эти нежелательные реакции могут быть результатом генетических вариаций генов переносчиков серотонина и генов цитохрома Р450. Необходимы дальнейшие исследования и повторение этих результатов. Если характеристика генетических вариаций будет завершена и полностью понята, станет возможным скрининг и мониторинг пациентов с использованием методов генотипирования для создания индивидуальной лекарственной терапии, аналогичной тем, которые обсуждались выше (Mancama and Kerwin, 2003).
Если характеристика генетических вариаций будет завершена и полностью понята, станет возможным скрининг и мониторинг пациентов с использованием методов генотипирования для создания индивидуальной лекарственной терапии, аналогичной тем, которые обсуждались выше (Mancama and Kerwin, 2003).
Серьезной проблемой для разработки индивидуальной лекарственной терапии является часто полигенный или многофакторный наследственный компонент ответа на лекарственные средства.Выделение полигенных детерминант реакции на лекарство является серьезной задачей. Основой всех исследований должно быть хорошее понимание механизма действия препарата, путей его метаболизма и распределения. Эти знания могут помочь в проведении полногеномных поисков генных вариаций, связанных с эффектами наркотиков, и последующих подходов к исследованию генов-кандидатов. Кроме того, протеомные исследования и профилирование экспрессии генов также являются важными способами подтверждения и понимания механизмов действия интересующего гена, влияющих на индивидуальную реакцию на препарат (Evans and McLeod, 2003). Недостаточно показать ассоциацию; характеристика лежащих в основе биологических механизмов является важным компонентом перемещения генетических данных в область снижения риска. Еще одним ключевым компонентом использования генетики для улучшения профилактики и снижения заболеваемости является понимание распределения генетических вариаций в обслуживаемом населении.
Недостаточно показать ассоциацию; характеристика лежащих в основе биологических механизмов является важным компонентом перемещения генетических данных в область снижения риска. Еще одним ключевым компонентом использования генетики для улучшения профилактики и снижения заболеваемости является понимание распределения генетических вариаций в обслуживаемом населении.
ГЕНЕТИКА ПОПУЛЯЦИЙ, СВЯЗАННАЯ С ЗДОРОВЬЕМ И БОЛЕЗНЬЮ
Человеческие популяции различаются по распределению генетических вариаций.Это следствие их исторических моделей мутаций, миграции, размножения, спаривания, отбора и генетического дрейфа. Унаследованные мутации обычно возникают во время гаметогенеза у одного человека, а затем могут передаваться потомству в течение многих поколений. Станет ли эта мутация преобладающим полиморфизмом (т. е. мутацией с популяционной частотой более 1 %), определяется как эволюционными силами, так и случайными событиями. Например, это зависит от того, доживет ли первоначальный ребенок, унаследовавший мутацию, до зрелого возраста и размножится, доживут ли дети этого ребенка до размножения и так далее. Количество детей в семье также влияет на распространенность мутации, и это часто связано с факторами окружающей среды, влияющими на фертильность и модели спаривания, которые влияют на скорость, с которой частная мутация становится общедоступным полиморфизмом. Есть хорошо известные примеры так называемых мутаций-основателей, в которых эта траектория может быть задокументирована. Например, один конкретный район на территории современного Квебека (Канада) изначально был основан всего несколькими семьями из определенной французской провинции.Один из отцов-основателей имел делецию размером 10 т.п.н. в своем гене рецептора ЛПНП (LDL-R), которая быстро передавалась из поколения в поколение, и сегодня ее носит 1 из 154 французских канадцев на северо-востоке Квебека. Эта мутация связана с семейной гиперхолестеринемией, а среди французских канадцев распространенность этого заболевания одна из самых высоких в мире из-за малочисленности исходной популяции, за которой следует расширение популяции (Moorjani et al.
Количество детей в семье также влияет на распространенность мутации, и это часто связано с факторами окружающей среды, влияющими на фертильность и модели спаривания, которые влияют на скорость, с которой частная мутация становится общедоступным полиморфизмом. Есть хорошо известные примеры так называемых мутаций-основателей, в которых эта траектория может быть задокументирована. Например, один конкретный район на территории современного Квебека (Канада) изначально был основан всего несколькими семьями из определенной французской провинции.Один из отцов-основателей имел делецию размером 10 т.п.н. в своем гене рецептора ЛПНП (LDL-R), которая быстро передавалась из поколения в поколение, и сегодня ее носит 1 из 154 французских канадцев на северо-востоке Квебека. Эта мутация связана с семейной гиперхолестеринемией, а среди французских канадцев распространенность этого заболевания одна из самых высоких в мире из-за малочисленности исходной популяции, за которой следует расширение популяции (Moorjani et al. , 1989).
, 1989).
Существует также ряд примеров, когда мутации, возникающие у индивидуума, становятся более распространенными из-за избирательного преимущества, которое они придают своим носителям.Наиболее известным примером является мутация, связанная с серповидноклеточной анемией. Географический образец этой мутации точно отражает географический образец малярийной инфекции. Молекулярно было продемонстрировано, что люди, несущие серповидноклеточную мутацию, обладают устойчивостью к малярийной инфекции. Поскольку многие факторы отбора, которые могли привести к нынешнему распределению мутаций в отдельных популяциях, относятся к нашему эволюционному прошлому, трудно оценить, насколько вариации внутри популяций или между популяциями обусловлены этими типами сил отбора.
Еще одной важной силой, определяющей распространение генетических вариаций внутри и между человеческими популяциями, является их миграция и репродуктивная изоляция. Согласно нашим лучшим знаниям, один из самых важных периодов в эволюции человека произошел примерно 100 000 лет назад, когда часть людей мигрировала на другие континенты из африканского бассейна и основала новые сообщества с относительной репродуктивной изоляцией. Генетические различия между людьми в разных географических районах на протяжении сотен лет связывались с концепцией расы.Хотя раса по-прежнему используется в качестве ярлыка, первоначальная концепция расы как генетически отличного подвида людей была отвергнута современной генетической информацией. По многим причинам, обсуждаемым в разделе ниже, более уместно переосмыслить старую генетику расы в более точную генетику предков.
Генетические различия между людьми в разных географических районах на протяжении сотен лет связывались с концепцией расы.Хотя раса по-прежнему используется в качестве ярлыка, первоначальная концепция расы как генетически отличного подвида людей была отвергнута современной генетической информацией. По многим причинам, обсуждаемым в разделе ниже, более уместно переосмыслить старую генетику расы в более точную генетику предков.
Помимо отдаленных эволюционных моделей миграции, более современные модели миграции также оказали глубокое влияние на генетику популяций. Например, нынешнее население Соединенных Штатов и большей части Северной Америки генетически очень разнообразно в результате смешения многих людей из разных стран и континентов.
Основная причина изучения происхождения и природы генетической изменчивости человека заключается в том, что сходства и различия в типе и частоте генетических вариаций внутри и между популяциями могут оказать глубокое влияние на исследования, пытающиеся понять влияние генов на болезни риск. Например, некоторые генетические вариации, такие как полиморфизм белка аполипопротеина Е, встречаются в каждой популяции и имеют очень схожие частоты генотипов по всему миру (Wu et al., 2002; Дениз Наранхо и др., 2004). Связь вариации с учащением сердечных заболеваний и болезнью Альцгеймера может быть проверена и проверена во многих популяциях мира. Другие мутации, такие как делеция 10 т.п.н. в гене LDL-R, описанная выше, являются более специфичными для популяции вариациями.
Например, некоторые генетические вариации, такие как полиморфизм белка аполипопротеина Е, встречаются в каждой популяции и имеют очень схожие частоты генотипов по всему миру (Wu et al., 2002; Дениз Наранхо и др., 2004). Связь вариации с учащением сердечных заболеваний и болезнью Альцгеймера может быть проверена и проверена во многих популяциях мира. Другие мутации, такие как делеция 10 т.п.н. в гене LDL-R, описанная выше, являются более специфичными для популяции вариациями.
Более того, со статистической точки зрения влияние генетической вариации на континуум риска, обнаруживаемой в любой популяции, коррелирует с ее частотой. Например, распространенные генетические полиморфизмы с частотой около 50 процентов не могут быть связаны с большими фенотипическими эффектами в популяции, потому что каждый класс генотипа представляет собой большую часть популяции, и, поскольку большая часть риска распределяется нормально, средний риск высокораспространенного генотипа класс не может отклоняться от общего риска населения в какой-либо значительной степени.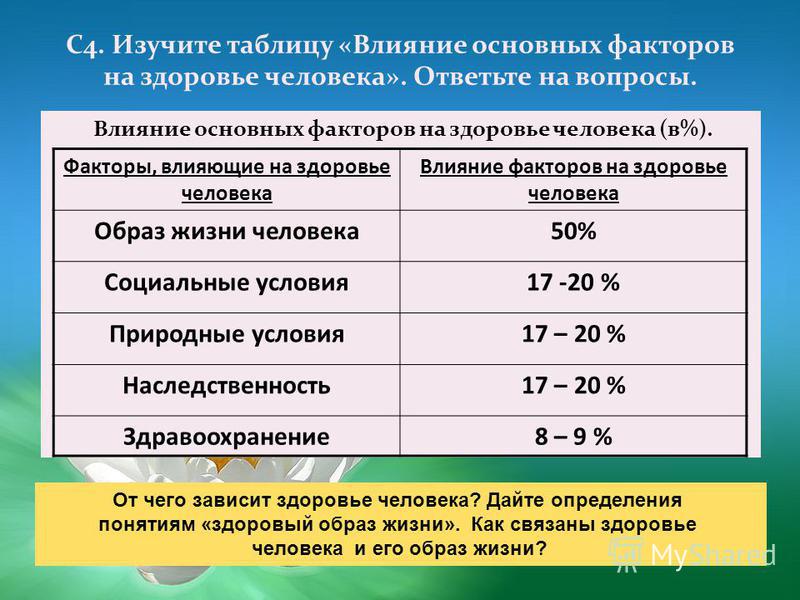 Эта корреляция между частотой генотипа и эффектом не означает, что общие вариации не могут быть значительными в их эффектах. Статистическая значимость связи между генетическим вариантом и заболеванием является совместной функцией размера выборки и размера эффекта. Кроме того, генетические исследования среди популяций, которые различаются по частоте генотипов, могут различаться в своих выводах о том, какие полиморфизмы оказывают значительное влияние, даже если абсолютный фенотипический эффект одинаков.См. Cheveud and Routman (1995) для более формального статистического объяснения этого явления и его влияния на оценку межгенных взаимодействий.
Эта корреляция между частотой генотипа и эффектом не означает, что общие вариации не могут быть значительными в их эффектах. Статистическая значимость связи между генетическим вариантом и заболеванием является совместной функцией размера выборки и размера эффекта. Кроме того, генетические исследования среди популяций, которые различаются по частоте генотипов, могут различаться в своих выводах о том, какие полиморфизмы оказывают значительное влияние, даже если абсолютный фенотипический эффект одинаков.См. Cheveud and Routman (1995) для более формального статистического объяснения этого явления и его влияния на оценку межгенных взаимодействий.
Другим ключевым моментом в понимании взаимосвязи между генетическими вариациями и мерами риска заболевания являются популяционные различия в корреляциях между частотами генотипов в разных местах SNP. Есть две распространенные причины, по которым частота аллеля или генотипа в конкретном SNP может коррелировать с частотой аллеля или генотипа в другом SNP. Во-первых, явление, известное как неравновесие по сцеплению , создает корреляции между SNP как следствие истории мутации. Когда возникают мутации, они происходят на определенном генетическом фоне, что создает корреляцию с другими SNP на хромосоме. Во-вторых, смешение популяций, известное как примесь, которое обычно происходит в результате миграции, означает, что SNP с частотами, специфичными для популяции, будут коррелировать в большей смешанной выборке. В этом случае расслоение населения является причиной корреляции, и было проведено много генетических эпидемиологических исследований этого явления и способов его контроля.Стратификация населения считается возможным источником ложных генетических ассоциаций с болезнью (см. вставку 3-2).
Во-первых, явление, известное как неравновесие по сцеплению , создает корреляции между SNP как следствие истории мутации. Когда возникают мутации, они происходят на определенном генетическом фоне, что создает корреляцию с другими SNP на хромосоме. Во-вторых, смешение популяций, известное как примесь, которое обычно происходит в результате миграции, означает, что SNP с частотами, специфичными для популяции, будут коррелировать в большей смешанной выборке. В этом случае расслоение населения является причиной корреляции, и было проведено много генетических эпидемиологических исследований этого явления и способов его контроля.Стратификация населения считается возможным источником ложных генетических ассоциаций с болезнью (см. вставку 3-2).
БЛОК 3-2
Стратификация населения (смешение). Когда риск заболевания различается между двумя этническими группами, любой генетический фактор или фактор окружающей среды, который также различается между группами, будет казаться связанным с заболеванием. Это явление называется «популяция» (подробнее…)
Это явление называется «популяция» (подробнее…)
ЗАКЛЮЧЕНИЕ
По большей части в двадцатом веке преобладали исследования здоровья и болезней человека, которые были сосредоточены на выявлении отдельных генетических и экологических агентов, которые могли бы объяснить различия в восприимчивости к болезням.Этот новый век характеризуется огромным прогрессом в нашем понимании менделевских расстройств с тяжелыми клиническими исходами. Однако менделевская парадигма не смогла объяснить генетический вклад в восприимчивость к наиболее распространенным хроническим заболеваниям, которые, как известно исследователям, имеют существенный генетический компонент из-за их семейной агрегации и исследований, демонстрирующих значительную наследуемость этих заболеваний. Точно так же экологические и социальные эпидемиологические исследования были очень успешными в освещении роли многих факторов окружающей среды, таких как диета, физические упражнения и стресс, на риск заболевания.Однако эти экологические факторы сами по себе еще не полностью объясняют различия в распространенности некоторых заболеваний в разных популяциях. Исследователи только сейчас начинают всерьез изучать потенциальные взаимодействия между генетическими факторами и факторами окружающей среды, которые, вероятно, способствуют значительной части заболеваний в большинстве групп населения. Многое можно сделать, чтобы включить измерения социальной среды в генетические исследования, а также включить генетические измерения в социальные эпидемиологические исследования.
Исследователи только сейчас начинают всерьез изучать потенциальные взаимодействия между генетическими факторами и факторами окружающей среды, которые, вероятно, способствуют значительной части заболеваний в большинстве групп населения. Многое можно сделать, чтобы включить измерения социальной среды в генетические исследования, а также включить генетические измерения в социальные эпидемиологические исследования.
За последние два десятилетия прогресс в идентификации конкретных генов и мутаций, объясняющих генетическую предрасположенность к распространенным состояниям, был относительно медленным по целому ряду причин. Во-первых, изучаемые заболевания, как правило, имеют сложную этиологию, а это означает, что у разных людей в популяции болезнь развивается по разным генетическим и/или экологическим причинам. Ожидается, что любой отдельный генетический или экологический фактор объясняет лишь очень небольшую долю риска заболевания в популяции.Более того, предполагается, что эти факторы взаимодействуют, и другие биологические процессы (например, эпигенетические модификации), вероятно, вносят свой вклад в сложную загадку восприимчивости. Точное фенотипическое определение болезни и ее подтипов имеет решающее значение для выявления и понимания сложности специфических для болезни генетических и экологических причин.
Точное фенотипическое определение болезни и ее подтипов имеет решающее значение для выявления и понимания сложности специфических для болезни генетических и экологических причин.
Во-вторых, генетики только недавно разработали базу знаний или методы, необходимые для измерения генетических вариаций и их метаболических последствий с достаточной простотой и экономической эффективностью, чтобы можно было изучить большое количество генов, которые, как считается, задействованы.После завершения проекта «Геном человека» в 2003 г. многие различные научные организации (например, Проект «Экологический геном» и Международный консорциум HapMap) работали над определением мутационных спектров в человеческих популяциях, и генетические эпидемиологи только сейчас начинают понимать обширный характер общих вариаций (частота в популяции > 1 процента) в геноме человека, которые могут влиять на риск заболевания людей. Данные SNP, полученные в результате этих инициатив, теперь централизованно размещены в ряде общедоступных баз данных, включая базу данных dbSNP Национального центра биотехнологической информации, базу данных SNP Инициативы генетической аннотации CGAP Национального института рака и базу данных генных биаллельных последовательностей человека Каролинского института. .В настоящее время крупнейший набор данных о вариациях человека создается в рамках проекта International HapMap Project, 4 , в рамках которого проводится генотипирование миллионов SNP у 270 человек из 4 географически удаленных мест по всему миру. Международный проект HapMap значительно увеличил количество проверенных SNP, доступных исследовательскому сообществу для изучения вариаций человека, и создает карту геномных гаплотипов в четырех популяциях, происходящих из частей Африки, Азии и Европы.Кроме того, только сейчас становятся доступными высокопроизводительные методы генотипирования большого количества SNP (тысячи) в больших эпидемиологических когортах (см. выше). К сожалению, высокопроизводительные методы измерения окружающей среды не выдержали таких же темпов. Для многих исследований распространенных заболеваний ограничивающим шагом к расширению нашего понимания будет по-прежнему сложное и дорогостоящее измерение факторов окружающей среды.
.В настоящее время крупнейший набор данных о вариациях человека создается в рамках проекта International HapMap Project, 4 , в рамках которого проводится генотипирование миллионов SNP у 270 человек из 4 географически удаленных мест по всему миру. Международный проект HapMap значительно увеличил количество проверенных SNP, доступных исследовательскому сообществу для изучения вариаций человека, и создает карту геномных гаплотипов в четырех популяциях, происходящих из частей Африки, Азии и Европы.Кроме того, только сейчас становятся доступными высокопроизводительные методы генотипирования большого количества SNP (тысячи) в больших эпидемиологических когортах (см. выше). К сожалению, высокопроизводительные методы измерения окружающей среды не выдержали таких же темпов. Для многих исследований распространенных заболеваний ограничивающим шагом к расширению нашего понимания будет по-прежнему сложное и дорогостоящее измерение факторов окружающей среды.
Наконец, прогресс также был затруднен из-за отсутствия адекватных инвестиций в разработку новых методов анализа, которые могут включать многомерную биологическую реальность, которую мы теперь можем измерить. Сложная генетическая и экологическая архитектура многофакторных заболеваний нелегко обнаружить или расшифровать с помощью традиционных методов статистического моделирования, ориентированных на оценку единой общей модели заболевания для населения. Например, используя традиционные методы логистической регрессии, было бы просто невозможно ввести все сотни генетических вариаций, которые, как считается, связаны с риском сердечно-сосудистых заболеваний или любыми другими изучаемыми в настоящее время комплексами распространенных заболеваний.Помимо очевидных проблем власти и сверхдетерминации в такой крупномасштабной модели, мы также не знаем, как моделировать или интерпретировать взаимодействия между многими факторами одновременно или как учитывать редкие, значительные эффекты некоторых генов по сравнению с обычными, небольшими эффектами. других. Новые стратегии моделирования, использующие достижения в распознавании образов, машинном обучении и системном анализе (например, безмасштабные сети, байесовские сети доверия, методы случайного леса), потребуются для построения более полных предиктивных моделей этих явлений.
Сложная генетическая и экологическая архитектура многофакторных заболеваний нелегко обнаружить или расшифровать с помощью традиционных методов статистического моделирования, ориентированных на оценку единой общей модели заболевания для населения. Например, используя традиционные методы логистической регрессии, было бы просто невозможно ввести все сотни генетических вариаций, которые, как считается, связаны с риском сердечно-сосудистых заболеваний или любыми другими изучаемыми в настоящее время комплексами распространенных заболеваний.Помимо очевидных проблем власти и сверхдетерминации в такой крупномасштабной модели, мы также не знаем, как моделировать или интерпретировать взаимодействия между многими факторами одновременно или как учитывать редкие, значительные эффекты некоторых генов по сравнению с обычными, небольшими эффектами. других. Новые стратегии моделирования, использующие достижения в распознавании образов, машинном обучении и системном анализе (например, безмасштабные сети, байесовские сети доверия, методы случайного леса), потребуются для построения более полных предиктивных моделей этих явлений. этиологически гетерогенные заболевания.
этиологически гетерогенные заболевания.
Область генетики человека, как и многие другие дисциплины, находится в переходном состоянии, и можно многого добиться, объединив усилия с широким спектром других дисциплин, которые сосредоточены на улучшении профилактики и снижении бремени болезней среди нашего населения.
ЛИТЕРАТУРА
- Альтшулер Д., Кругляк Л., Ландер Е. Генетические полиморфизмы и болезни. Медицинский журнал Новой Англии. 1998;338(22):1626. [PubMed: 9606122]
- Ardlie KG, Lunetta KL, Seielstad M.Тестирование подразделения населения и ассоциации в четырех исследованиях случай-контроль. Американский журнал генетики человека. 2002;71(2):304–311. [Статья бесплатно PMC: PMC379163] [PubMed: 12096349]
- Армстронг В.В., Шипкова М., фон Ахсен Н., Оллерих М. Аналитические аспекты мониторинга терапии тиопуриновыми препаратами. Терапевтический лекарственный мониторинг. 2004;26(2):220–226. [PubMed: 15228169]
- Эшли-Кох А., Ян К., Олни Р.
 Аллель серповидного гемоглобина (Hb S) и серповидно-клеточная анемия: обзор HuGE.Американский журнал эпидемиологии. 2000;151(9):839–845. [PubMed: 10791557]
Аллель серповидного гемоглобина (Hb S) и серповидно-клеточная анемия: обзор HuGE.Американский журнал эпидемиологии. 2000;151(9):839–845. [PubMed: 10791557] - Браун М.С., Гольдштейн Дж.Л. Снижение уровня холестерина в плазме за счет повышения активности рецепторов ЛПНП. Медицинский журнал Новой Англии. 1981;305(9):515–517. [PubMed: 6265781]
- Cardon LR, Bell JI. Дизайн ассоциативных исследований для комплексных заболеваний. Природа Обзоры Генетика. 2001;2(2):91–99. [PubMed: 11253062]
- Clifford RJ, Edmonson MN, Nguyen C, Buetow KH. Крупномасштабный анализ несинонимичных полиморфизмов одиночных нуклеотидов кодирующей области.Биоинформатика. 2004;20(7):1006–1014. [PubMed: 14751981]
- Кобли М.А., Фогель К.Л., Трипати Д., Роберт Н.Дж., Шолль С., Ференбахер Л., Уолтер Дж.М., Патон В., Шак С., Либерман Г., Сламон Д.Дж. Многонациональное исследование эффективности и безопасности гуманизированного моноклонального антитела против HER2 у женщин с метастатическим раком молочной железы с гиперэкспрессией HER2, который прогрессировал после химиотерапии по поводу метастатического заболевания.
 Журнал клинической онкологии. 1999;17(9):2639–2648. [PubMed: 10561337]
Журнал клинической онкологии. 1999;17(9):2639–2648. [PubMed: 10561337] - Deniz Naranjo MC, Munoz Fernandez C, Alemany Rodriguez MJ, Perez Vieitez MC, Irurita Latasa J, Suarez Armas R, Suarez Valentin MP, Sanchez Garcia F.Пол оказывает сильное модулирующее влияние на риск болезни Альцгеймера, связанный с геном аполипопротеина Е, у населения Канарских островов, Испания. Ревиста де Неврология. 2004;38(7):615–618. [PubMed: 15098180]
- Evans WE, McLeod HL. Фармакогеномика — расположение лекарств, мишени для лекарств и побочные эффекты. Медицинский журнал Новой Англии. 2003;348(6):538–549. [PubMed: 12571262]
- Гандерсон К.Л., Стимерс Ф.Дж., Ли Г., Мендоза Л.Г., Чи М.С. Масштабируемый анализ генотипирования SNP для всего генома с использованием технологии микрочипов.Генетика природы. 2005;37(5):549–554. [PubMed: 15838508]
Haines JL, Pericak-Vance MA. Подходы к картированию генов при сложных заболеваниях человека. Нью-Йорк: Уайли-Лисс; 1998.
- Холл Дж.
 М., Ли М.К., Ньюман Б., Морроу Дж.Е., Андерсон Л.А., Хьюи Б., Кинг М.С. Связь семейного рака молочной железы с ранним началом с хромосомой 17q21. Наука. 1990; 250 (4988): 1684–1689. [PubMed: 2270482]
М., Ли М.К., Ньюман Б., Морроу Дж.Е., Андерсон Л.А., Хьюи Б., Кинг М.С. Связь семейного рака молочной железы с ранним началом с хромосомой 17q21. Наука. 1990; 250 (4988): 1684–1689. [PubMed: 2270482] - Хайндс Д.А., Стюв Л.Л., Нильсен Г.Б., Гальперин Э., Эскин Э., Баллинджер Д.Г., Фрейзер К.А., Кокс Д.Р. Полногеномные паттерны общих вариаций ДНК в трех человеческих популяциях.Наука. 2005;307(5712):1072–1079. [PubMed: 15718463]
МОМ (Институт медицины). Значение геномики для общественного здравоохранения. Вашингтон, округ Колумбия: Издательство национальных академий; 2005.
- Kalow W, Tang BK, Endrenyi L. Гипотеза: сравнение меж- и внутрииндивидуальных вариаций может заменить исследования близнецов в исследованиях лекарств. Фармакогенетика. 1998;8(4):283–289. [PubMed: 9731714]
- Kardia SL, Modell SM, Peyser PA. Семейно-ориентированные подходы к пониманию и профилактике ишемической болезни сердца.Американский журнал профилактической медицины. 2003;24(2):143–151.
 [PubMed: 12568820]
[PubMed: 12568820] - Клейн Р.Дж., Цейсс С., Чу Э.Ю., Цай Дж.Ю., Саклер Р.С., Хейнс С., Хеннинг А.К., СанДжованни Д.П., Мане С.М., Мейн С.Т., Бракен М.Б., Феррис Ф.Л., Отт Дж., Барнстейбл С., Хох J. Полиморфизм фактора комплемента Н при возрастной дегенерации желтого пятна. Наука. 2005;308(5720):385–389. [Бесплатная статья PMC: PMC1512523] [PubMed: 15761122]
- Lander ES, Schork NJ. Генетическое рассечение сложных признаков. Наука. 1994;265(5181):2037–2048.[PubMed: 8091226]
- Livingston RJ, von Niederhausern A, Jegga AG, Crawford DC, Carlson CS, Rieder MJ, Gowrisankar S, Aronow BJ, Weiss RB, Nickerson DA. Характер изменения последовательности в 213 генах реакции на окружающую среду. Геномные исследования. 2004; 14 (10А): 1821–1831. [Бесплатная статья PMC: PMC524406] [PubMed: 15364900]
- Mancama D, Kerwin RW. Роль фармакогеномики в индивидуализации лечения СИОЗС. Препараты ЦНС. 2003;17(3):143–151. [PubMed: 12617694]
- МакАдамс Х.Х., Аркин А.
 Стохастические механизмы экспрессии генов. Труды Национальной академии наук Соединенных Штатов Америки. 1997; 94(3):814–819. [Бесплатная статья PMC: PMC19596] [PubMed:
Стохастические механизмы экспрессии генов. Труды Национальной академии наук Соединенных Штатов Америки. 1997; 94(3):814–819. [Бесплатная статья PMC: PMC19596] [PubMed: - 39]
- Miller DP, Liu G, De Vivo I, Lynch TJ, Wain JC, Su L, Christiani DC. Комбинации вариантных генотипов GSTP1, GSTM1 и p53 связаны с повышенным риском рака легких. Исследования рака. 2002;62(10):2819–2823. [PubMed: 12019159]
- Мурджани С., Рой М., Ганье С., Дэвиньон Дж., Брун Д., Туссен М., Ламбер М., Кампо Л., Блейхман С., Люпьен П.Гомозиготная семейная гиперхолестеринемия среди французских канадцев в провинции Квебек. Артериосклероз. 1989;9(2):211–216. [PubMed: 2923577]
- Обач Р.С., Вальски Р.Л., Венкатакришнан К., Гаман Э.А., Хьюстон Дж.Б., Тремейн Л.М. Полезность данных об ингибировании цитохрома Р450 in vitro для прогнозирования взаимодействия лекарственных средств. Журнал фармакологии и экспериментальной терапии. 2006;316(1):336–348. [PubMed: 16192315]
- Пирмохамед М., Парк Б.
 К. Генетическая предрасположенность к побочным реакциям на лекарства.Тенденции фармакологических наук. 2001;22(6):298–305. [PubMed: 11395158]
К. Генетическая предрасположенность к побочным реакциям на лекарства.Тенденции фармакологических наук. 2001;22(6):298–305. [PubMed: 11395158] - Притчард Дж. К., Розенберг Н. А. Использование несцепленных генетических маркеров для выявления стратификации населения в ассоциативных исследованиях. Американский журнал генетики человека. 1999;65(1):220–228. [Бесплатная статья PMC: PMC1378093] [PubMed: 10364535]
- Quinn CT, Miller ST. Факторы риска и прогноз исходов у детей и подростков с серповидноклеточной анемией. Клиники гематологии/онкологии Северной Америки. 2004;18(6 спец.МКС): 1339–1354. [PubMed: 15511619]
- Rebbeck TR, Walker AH, Phelan CM, Godwin AK, Buetow KH, Garber JE, Narod SA, Weber BL. Определение этиологической гетерогенности рака молочной железы с использованием генетических биомаркеров. Прогресс в клинических и биологических исследованиях. 1997; 396: 53–61. [PubMed:89]
Rimoin DL, Connor JM, Pyeritz RE, Korf BR, редакторы. Принципы и практика медицинской генетики Эмери и Римуана.
 4-е издание. Том. 2. Нью-Йорк: Черчилль Ливингстон; 2002.
4-е издание. Том. 2. Нью-Йорк: Черчилль Ливингстон; 2002.- Риш, штат Нью-Джерси.Поиски генетических детерминант в новом тысячелетии. Природа. 2000;405(6788):847–856. [PubMed: 10866211]
- Саттен Г.А., Фландерс В.Д., Ян К. Учет неизмеряемой подструктуры населения в исследованиях генетической ассоциации случай-контроль с использованием новой модели латентного класса. Американский журнал генетики человека. 2001;68(2):466–477. [Бесплатная статья PMC: PMC1235279] [PubMed: 11170894]
- Sing CF, Stengard JH, Kardia SLR. Гены, окружающая среда и сердечно-сосудистые заболевания. Артериосклероз, тромбоз и сосудистая биология.2003; 23:1190–1196. [PubMed: 12730090]
Смит Г. Эпоха геномики: как технология ДНК меняет наш образ жизни и то, кто мы есть. Нью-Йорк: АМАКОМ; 2005.
- Стейнберг М.Х. Прогнозирование клинической тяжести при серповидноклеточной анемии. Британский журнал гематологии. 2005;129(4):465–481. [PubMed: 15877729]
- Стюарт М.
 Дж., Нагель Р.Л. Серповидно-клеточная анемия. Ланцет. 2004;364(9442):1343–1360. [PubMed: 15474138]
Дж., Нагель Р.Л. Серповидно-клеточная анемия. Ланцет. 2004;364(9442):1343–1360. [PubMed: 15474138] - Сиванен А.С. На пути к полногеномному генотипированию SNP.Генетика природы. 2005; (37 Дополнение): S5–S10. [PubMed: 15920530]
Томпсон М.В., Макиннес Р.Р., Уиллард, редакторы. Генетика Томпсона и Томпсона в медицине. 5-е издание. Филадельфия, Пенсильвания: WB. Компания Сондерс; 1991.
- Wacholder S, Rothman N, Caporaso N. Стратификация населения в эпидемиологических исследованиях распространенных генетических вариантов и рака: количественная оценка смещения. Журнал Национального института рака. 2000;92(14):1151–1158. [PubMed: 10
8]
- Wang X, Tomso DJ, Liu X, Bell DA.Однонуклеотидный полиморфизм в областях регуляции транскрипции и экспрессия экологически чувствительных генов. Токсикология и прикладная фармакология. 2005; 207 (2 Приложение): 84–90. [PubMed: 16002116]
- Ван З., Фан Х., Ян Х.Х., Ху И., Бутоу К.Х., Ли М.П. Сравнительный анализ последовательности импринтированных генов человека и мыши для выявления сигнатур импринтинга.
 Геномика. 2004;83(3):395–401. [PubMed: 14962665]
Геномика. 2004;83(3):395–401. [PubMed: 14962665] - Weinshilboum R. Наследование и ответ на лекарство. Медицинский журнал Новой Англии.2003;348(6):529–537. [PubMed: 12571261]
- Wu JH, Lo SK, Wen MS, Kao JT. Характеристика генетических вариаций аполипопротеина Е в тайваньской ассоциации с ишемической болезнью сердца и уровнями липидов в плазме. Человеческая биология. 2002;74(1):25–31. [PubMed: 11931577]
- Чжоу В., Лю Г., Миллер Д.П., Терстон С.В., Сюй Л.Л., Уэйн Дж.К., Линч Т.Дж., Су Л., Кристиани Д.К. Полиморфизм генов репарации ДНК XRCC1 и ERCC2, курение и риск развития рака легких. Эпидемиология рака, биомаркеры и профилактика.2003;12(4):359–365. [PubMed: 12692111]
- 1
SNP — это изменение последовательности ДНК, возникающее при изменении одного нуклеотида (A, T, C или G) в последовательности генома (Smith, 2005).
- 2
Ген-кандидат — это ген, белковый продукт которого участвует в метаболических или физиологических путях, связанных с конкретным заболеванием (IOM, 2005).

- 3
Пример серповидно-клеточной анемии взят из заказанной статьи, подготовленной Робертом Дж.Томпсон-младший, доктор философии. (Приложение Д).
- 4
Генетика и здоровье – гены, поведение и социальная среда
Хотя существует много возможных причин болезней человека, семейный анамнез часто является одним из сильнейших факторов риска таких распространенных заболеваний, как рак , сердечно-сосудистые заболевания (ССЗ), диабет, аутоиммунные заболевания и психические заболевания. Человек наследует полный набор генов от каждого родителя, а также широкий спектр культурного и социально-экономического опыта своей семьи.Семейный анамнез считается хорошим прогностическим фактором индивидуального риска заболевания, потому что члены семьи наиболее точно представляют уникальные геномные и экологические взаимодействия, с которыми сталкивается человек (Kardia et al., 2003). Унаследованная генетическая изменчивость внутри семьи явно вносит прямой и косвенный вклад в патогенез заболевания.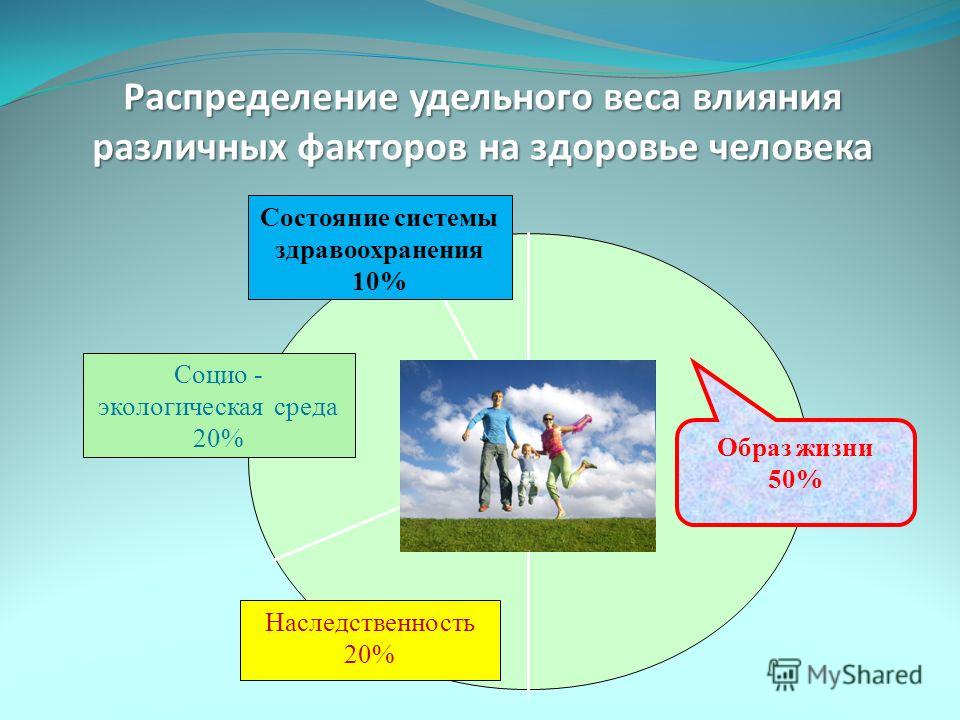 В этой главе основное внимание уделяется тому, что известно или выдвигается в теории о прямой связи между генами и здоровьем, и тому, что еще предстоит изучить, чтобы понять взаимодействие с окружающей средой и относительную роль генов, влияющих на здоровье и болезнь.
В этой главе основное внимание уделяется тому, что известно или выдвигается в теории о прямой связи между генами и здоровьем, и тому, что еще предстоит изучить, чтобы понять взаимодействие с окружающей средой и относительную роль генов, влияющих на здоровье и болезнь.
ГЕНЕТИЧЕСКАЯ ВОСПРИИМЧИВОСТЬ
Уже более 100 лет генетики человека изучают, как вариации генов влияют на вариации риска заболевания. Эти исследования использовали два подхода. Первый подход фокусируется на идентификации отдельных генов с вариациями, которые вызывают простые менделевские модели наследования болезни (например, аутосомно-доминантный, аутосомно-рецессивный и сцепленный с Х-хромосомой) (см. Менделевское наследование у человека). Второй подход направлен на то, чтобы понять генетическую предрасположенность к болезням как следствие совместного действия многих генов.Каждый из этих подходов будет рассмотрен ниже.
ТАБЛИЦА 3-1
Онлайн-статистика менделевского наследования у человека (OMIM) (по состоянию на 15 мая 2006 г. ), количество записей.
), количество записей.
В целом, заболевания с простым менделевским типом наследования, как правило, относительно редки или часто редки, с началом в раннем возрасте, такие как фенилкетонурия, серповидно-клеточная анемия, болезнь Тея-Сакса и муковисцидоз. Кроме того, некоторые из этих генов связаны с экстремальными формами распространенных заболеваний, таких как семейная гиперхолестеринемия, которая вызывается мутациями в рецепторе липопротеинов низкой плотности (ЛПНП), которые предрасполагают людей к раннему развитию сердечных заболеваний (Браун и Гольдштейн). , 1981).
Другим примером менделевской наследственности являются семейные формы рака молочной железы, связанные с мутациями в генах BRCA1 и BRCA2, которые предрасполагают женщин к раннему развитию рака молочной железы и часто к раку яичников. Выявленные гены имеют мутации, которые часто обладают высокой пенетрантностью, то есть вероятность развития заболевания у носителей генотипа предрасположенности к заболеванию относительно высока (более 50 процентов). Эти генетические заболевания часто демонстрируют генетическое явление, известное как аллельная гетерогенность , , при котором множественные мутации в одном и том же гене (т.e., аллели) связаны с одним и тем же заболеванием. Эта аллельная неоднородность часто специфична для популяции и может отражать уникальную демографическую и мутационную историю популяции.
Эти генетические заболевания часто демонстрируют генетическое явление, известное как аллельная гетерогенность , , при котором множественные мутации в одном и том же гене (т.e., аллели) связаны с одним и тем же заболеванием. Эта аллельная неоднородность часто специфична для популяции и может отражать уникальную демографическую и мутационную историю популяции.
В некоторых случаях генетические заболевания также связаны с гетерогенностью локуса , что означает, что вредная мутация в любом из нескольких генов может привести к повышенному риску заболевания. Это открытие характерно для многих заболеваний человека, включая болезнь Альцгеймера и поликистозную болезнь почек.Как аллельная гетерогенность, так и гетерогенность локуса являются источниками изменчивости фенотипов этих заболеваний, поскольку они могут оказывать различное влияние на начало, прогрессирование и клиническую тяжесть заболевания.
Факторы окружающей среды также различаются у разных людей, и совокупный эффект неоднородности окружающей среды и генетической является этиологической неоднородностью. Этиологическая гетерогенность относится к феномену, который наблюдается в общей популяции, когда несколько групп случаев заболевания, таких как кластеры рака молочной железы, проявляют сходные клинические признаки, но на самом деле являются результатом различных событий или воздействий.Понимание этиологии конкретных заболеваний, а также идентификация возможных возбудителей облегчается путем обнаружения и изучения случаев заболевания, демонстрирующих этиологическую гетерогенность. Результаты этих исследований могут также выявить возможные взаимодействия между генами и взаимодействия между генами и окружающей средой, важные для процесса заболевания. Выявление этиологической гетерогенности может стать важным шагом на пути к анализу заболеваний с использованием методов молекулярной эпидемиологии и, в конечном итоге, может привести к улучшению стратегий профилактики заболеваний (Rebbeck et al., 1997).
Этиологическая гетерогенность относится к феномену, который наблюдается в общей популяции, когда несколько групп случаев заболевания, таких как кластеры рака молочной железы, проявляют сходные клинические признаки, но на самом деле являются результатом различных событий или воздействий.Понимание этиологии конкретных заболеваний, а также идентификация возможных возбудителей облегчается путем обнаружения и изучения случаев заболевания, демонстрирующих этиологическую гетерогенность. Результаты этих исследований могут также выявить возможные взаимодействия между генами и взаимодействия между генами и окружающей средой, важные для процесса заболевания. Выявление этиологической гетерогенности может стать важным шагом на пути к анализу заболеваний с использованием методов молекулярной эпидемиологии и, в конечном итоге, может привести к улучшению стратегий профилактики заболеваний (Rebbeck et al., 1997).
В отличие от менделевского подхода, второй подход к изучению того, как вариации генов влияют на вариации риска заболевания, фокусируется на понимании генетической предрасположенности к заболеваниям как следствии совместного действия многих генов, каждый из которых оказывает воздействие от небольшого до умеренного ( т. е. полигенные модели болезни) и часто взаимодействуют друг с другом и с окружающей средой, приводя к распределению риска заболевания, наблюдаемому в популяции (т. е. многофакторные модели болезни).Этот подход использовался в первую очередь для понимания генетики врожденных дефектов и распространенных заболеваний, а также их факторов риска. Как описано ниже, для развития такого понимания требуется несколько шагов.
е. полигенные модели болезни) и часто взаимодействуют друг с другом и с окружающей средой, приводя к распределению риска заболевания, наблюдаемому в популяции (т. е. многофакторные модели болезни).Этот подход использовался в первую очередь для понимания генетики врожденных дефектов и распространенных заболеваний, а также их факторов риска. Как описано ниже, для развития такого понимания требуется несколько шагов.
В качестве первого шага участников исследования просят предоставить подробный семейный анамнез для оценки наличия семейной агрегации. Если у лиц с рассматриваемым заболеванием больше родственников, пораженных этим заболеванием, чем у лиц без заболевания, идентифицируется семейная агрегация.Хотя семейная агрегация может быть объяснена генетической этиологией, она также может представлять воздействие (например, пестицидов, загрязненной питьевой воды или рациона), общее для всех членов семьи из-за вероятности общей среды.
При наличии признаков семейной агрегации вторым шагом является сосредоточение научных исследований на оценке наследственности заболевания и/или его факторов риска. Наследуемость определяется как доля изменчивости риска заболевания в популяции, связанная с неизмеряемыми генетическими вариациями, выведенными на основе семейных моделей заболевания.Это широкая популяционная мера генетического влияния, которая используется для определения того, оправданы ли дальнейшие генетические исследования, поскольку она позволяет исследователям проверить всеобъемлющую нулевую гипотезу о том, что никакие гены не участвуют в определении риска заболевания. Исследования близнецов и семейные исследования часто используются для изучения наследственности.
Наследуемость определяется как доля изменчивости риска заболевания в популяции, связанная с неизмеряемыми генетическими вариациями, выведенными на основе семейных моделей заболевания.Это широкая популяционная мера генетического влияния, которая используется для определения того, оправданы ли дальнейшие генетические исследования, поскольку она позволяет исследователям проверить всеобъемлющую нулевую гипотезу о том, что никакие гены не участвуют в определении риска заболевания. Исследования близнецов и семейные исследования часто используются для изучения наследственности.
Исследования близнецов, сравнивающие изменчивость заболеваний и факторов риска у монозиготных и дизиготных близнецов, были распространенным дизайном исследований, используемым для простой оценки как генетической, так и культурной наследственности.Исследования монозиготных близнецов, воспитанных вместе, по сравнению с близнецами, воспитанными порознь, также сыграли важную роль в оценке как генетического, так и экологического вклада в модели наследования. Моделирование источников фенотипической изменчивости с использованием семейных исследований стало довольно сложным, что позволяет включать параметры модели для представления аддитивного генетического компонента (т. е. полигенов), неаддитивного генетического компонента (т. е. и межгенные взаимодействия), общая семейная среда и индивидуальная среда.Было показано, что вклад этих факторов зависит от возраста и населения.
Моделирование источников фенотипической изменчивости с использованием семейных исследований стало довольно сложным, что позволяет включать параметры модели для представления аддитивного генетического компонента (т. е. полигенов), неаддитивного генетического компонента (т. е. и межгенные взаимодействия), общая семейная среда и индивидуальная среда.Было показано, что вклад этих факторов зависит от возраста и населения.
Когда установлены существенные доказательства генетической причастности, следующим шагом является определение ответственных генов и мутаций, связанных с повышенным или пониженным риском, с использованием либо анализа генетического сцепления, либо исследований генетической ассоциации. Например, при изучении врожденных дефектов это часто связано с поиском хромосомных делеций, вставок, дупликаций или транслокаций.
АНАЛИЗ ГЕНЕТИЧЕСКОГО СЦЕПЛЕНИЯ И ИССЛЕДОВАНИЯ ГЕНЕТИЧЕСКОЙ АССОЦИАЦИИ
Геном человека состоит из десятков тысяч генов.Имея на выбор около 30 000 генов, сопоставление конкретного гена или группы генов с соответствующим заболеванием человека требует методического подхода, состоящего из многих этапов. Традиционно процесс открытия генов начинается с анализа сцепления, который оценивает заболевание внутри семьи. За анализом сцепления обычно следуют исследования генетической ассоциации, которые оценивают заболевание в семьях или среди неродственных людей.
Традиционно процесс открытия генов начинается с анализа сцепления, который оценивает заболевание внутри семьи. За анализом сцепления обычно следуют исследования генетической ассоциации, которые оценивают заболевание в семьях или среди неродственных людей.
Генетический анализ сцепления
Термин сцепление относится к тенденции генов, проксимально расположенных на одной и той же хромосоме, наследоваться вместе.Анализ сцепления является одним из шагов в поиске гена предрасположенности к заболеванию. Цель этого анализа состоит в том, чтобы приблизить расположение гена болезни по отношению к известному генетическому маркеру, применяя понимание моделей сцепления. Традиционный анализ сцепления, который отслеживает закономерности наследственности как фенотипа заболевания, так и генетических маркеров в больших семьях с высоким риском, использовался для обнаружения генных мутаций, вызывающих заболевание, таких как ген рака молочной железы (BRCA1) на хромосоме 17 (Hall et al. , 1990).
, 1990).
Поскольку тип наследования часто не ясен для распространенных заболеваний, был разработан альтернативный подход к классическому анализу сцепления, чтобы извлечь выгоду из основного генетического принципа, согласно которому братья и сестры в среднем разделяют половину своих аллелей. Изучая степень общего аллеля в их геномах, пары пораженных братьев и сестер (т. е. двух или более братьев и сестер с одним и тем же заболеванием) можно использовать для идентификации хромосомных областей, которые могут содержать гены, вариации которых связаны с изучаемым заболеванием.Если многочисленные пары братьев и сестер, пораженные интересующим заболеванием, обнаруживают большее, чем ожидалось, совместное использование известных аллелей используемого полиморфного генетического маркера, то генетический маркер, вероятно, будет сцеплен (то есть находится в непосредственной близости вдоль хромосомы) с ген восприимчивости, ответственный за изучаемое заболевание. Чтобы найти хромосомные области, демонстрирующие доказательства сцепления, с использованием этого метода пар пораженных братьев и сестер обычно требуется типирование множества пораженных родственных братьев с сотнями высокополиморфных маркеров, равномерно расположенных вдоль генома человека (Mathew, 2001).
Этот подход широко используется для выявления областей генома, которые, как считается, способствуют возникновению распространенных хронических заболеваний. Однако результаты анализа сцепления не были последовательно воспроизведены. Неспособность успешно воспроизвести данные о сцеплении может быть результатом недостаточной статистической мощности (то есть включения недостаточного количества пар братьев и сестер с интересующим заболеванием) или результатов, которые включали ложноположительные результаты в исходном исследовании. Альтернативным объяснением могло бы быть то, что разные популяции подвержены влиянию других генов восприимчивости, чем те, которые изучались первоначально (Mathew, 2001).Без последовательного повторения результатов преждевременно делать выводы о вкладе локуса гена в конкретное заболевание.
После подтверждения связи исследователи могут начать поиск в регионе гена-кандидата восприимчивости. Поиск единственного гена предрасположенности к распространенным заболеваниям часто включает исследование очень больших областей сцепления, содержащих от 20 до 30 миллионов пар оснований и потенциально сотни генов (Mathew, 2001). Однако также важно отметить, что, хотя картирование сцепления является мощным инструментом для поиска генов менделевских болезней, оно часто дает слабые и иногда непоследовательные сигналы в исследованиях сложных заболеваний, которые могут быть многофакторными.Исследования сцепления наиболее эффективны при наличии единственного аллеля чувствительности в любом данном локусе болезни и, как правило, неэффективны при значительной генетической гетерогенности.
Однако также важно отметить, что, хотя картирование сцепления является мощным инструментом для поиска генов менделевских болезней, оно часто дает слабые и иногда непоследовательные сигналы в исследованиях сложных заболеваний, которые могут быть многофакторными.Исследования сцепления наиболее эффективны при наличии единственного аллеля чувствительности в любом данном локусе болезни и, как правило, неэффективны при значительной генетической гетерогенности.
Генетические ассоциативные исследования
Технологические достижения в высокопроизводительном генотипировании позволили проводить прямое изучение специфических генетических различий среди значительного числа людей. Методы генетической ассоциации часто являются наиболее эффективным подходом для оценки того, как конкретные генетические вариации могут влиять на риск заболевания.Генетические ассоциативные исследования, которые использовались в течение десятилетий, постоянно совершенствовались с точки зрения разработки новых дизайнов исследований (таких как ассоциативные дизайны, основанные только на случаях и на основе семей), новых систем генотипирования (таких как генотипирование на основе массивов и мультиплексные тесты). ), и новые методы, используемые для устранения предубеждений, таких как население (Haines and Pericak-Vance, 1998).
), и новые методы, используемые для устранения предубеждений, таких как население (Haines and Pericak-Vance, 1998).
Анализ влияния генетической изменчивости обычно включает сначала обнаружение полиморфизмов одиночных нуклеотидов (SNP) 1 , а затем анализ этих вариаций в образцах из популяций.SNP встречаются в среднем примерно через каждые 500–2000 оснований в геноме человека. Наиболее распространенный подход к обнаружению SNP заключается в секвенировании интересующего гена в репрезентативной выборке людей. В настоящее время секвенирование полных генов у небольшого числа людей (примерно от 25 до 50) может выявить полиморфизмы, встречающиеся у 1–3 процентов населения, с достоверностью примерно 95 процентов. Программа обнаружения полиморфизма ДНК человека в рамках проекта «Экологический геном» Национального института наук об окружающей среде является одним из примеров применения технологий автоматизированного секвенирования ДНК для выявления SNP в генах человека, которые могут быть связаны с восприимчивостью к болезням и реакцией на окружающую среду (Livingston et al. ., 2004). Программы Национального института сердца, легких и крови в области геномных приложений также привели к значительному расширению наших знаний о распределении SNP в ключевых генах, которые, как считается, уже биологически связаны с риском заболевания (т. е. биологические гены-кандидаты 2 ).
., 2004). Программы Национального института сердца, легких и крови в области геномных приложений также привели к значительному расширению наших знаний о распределении SNP в ключевых генах, которые, как считается, уже биологически связаны с риском заболевания (т. е. биологические гены-кандидаты 2 ).
Впечатляющие и быстрые достижения в технологии анализа SNP быстро переопределяют возможности обнаружения, картирования и генотипирования SNP. Новая технология генотипирования на основе массивов позволяет анализировать «ассоциацию всего генома» SNP между отдельными людьми или между штаммами видов лабораторных животных (Syvanen, 2005).Массивы, используемые для этих анализов, могут представлять сотни тысяч SNP, нанесенных на карту в геноме (Klein et al., 2005; Hinds et al., 2005; Gunderson et al., 2005). Этот подход позволяет быстро идентифицировать SNP, связанные с заболеванием и восприимчивостью к факторам окружающей среды. Сила этой технологии заключается в огромном количестве легко поддающихся измерению генетических вариаций, которые она предоставляет исследователям с минимальными затратами (от 500 до 1000 долларов за чип). Критерии выбора SNP для включения в эти массивы являются важным фактором, поскольку они влияют на выводы, которые можно сделать на основе этих платформ.Конечно, лучшим инструментом для обнаружения SNP и генотипирования является индивидуальное секвенирование всего генома. Несмотря на то, что в настоящее время это невозможно, быстрое развитие технологий, которое в настоящее время стимулируется проектом Национального исследовательского института генома человека «Геном стоимостью 1000 долларов», вероятно, сделает этот подход оптимальным для обнаружения SNP и генотипирования в будущем.
Критерии выбора SNP для включения в эти массивы являются важным фактором, поскольку они влияют на выводы, которые можно сделать на основе этих платформ.Конечно, лучшим инструментом для обнаружения SNP и генотипирования является индивидуальное секвенирование всего генома. Несмотря на то, что в настоящее время это невозможно, быстрое развитие технологий, которое в настоящее время стимулируется проектом Национального исследовательского института генома человека «Геном стоимостью 1000 долларов», вероятно, сделает этот подход оптимальным для обнаружения SNP и генотипирования в будущем.
Имея возможность изучать большое количество генетических вариаций, исследователи переходят от исследования отдельных генов по одному к рассмотрению целых путей или физиологических систем, которые включают информацию с геномного, транскриптомного, протеомного и метабономического уровней, которые все они подвержены различным факторам окружающей среды (Haines and Pericak-Vance, 1998).Тем не менее, эти проекты исследований и аналитические методы, основанные на изучении генома и путей, все еще находятся на ранних стадиях разработки и потребуют совместных усилий многих дисциплин, от молекулярных биологов до клиницистов, социологов и биоинформатиков, чтобы максимально использовать их. эффективное использование этих огромных объемов данных.
эффективное использование этих огромных объемов данных.
ГЕН-ОКРУЖАЮЩАЯ СРЕДА И ГЕН-ГЕННЫЕ ВЗАИМОДЕЙСТВИЯ
Изучение взаимодействий ген-среда и ген-ген представляет собой широкий класс исследований генетических ассоциаций, сосредоточенных на понимании того, как генетическая изменчивость человека связана с различными реакциями на воздействия окружающей среды и с различными эффектами в зависимости от вариаций других генов.Чтобы проиллюстрировать концепцию взаимодействия генов с окружающей средой, ниже приводится обзор недавних исследований, выявляющих генетические мутации, которые, по-видимому, связаны с дифференциальной реакцией на сигаретный дым и ее связью с раком легких. Табачный дым содержит широкий спектр химических канцерогенов, которые могут вызвать повреждение ДНК. Существует несколько путей репарации ДНК, которые действуют для восстановления этого повреждения, и гены этого пути являются главными биологическими кандидатами для понимания того, почему у одних курильщиков развивается рак легких, а у других нет. В исследовании Zhou et al. (2003), вариации в двух генах, ответственных за репарацию ДНК, были исследованы на предмет их потенциального взаимодействия с уровнем курения сигарет и сопутствующей связи с раком легких. Вкратце, одна предположительно функциональная мутация в гене XRCC1 (группа 1 перекрестной комплементарности при рентгенологическом исследовании) и две предположительно функциональные мутации в гене ERCC2 (группа 2 перекрестной комплементарной репарации эксцизионной репарации) были генотипированы в 1091 случае рака легкого и 1240 контрольных больных. Когда случаи и контрольные группы были разделены на заядлых курильщиков и некурящих, Zhou et al.(2003) обнаружили, что у некурящих с мутантным генотипом XRCCI риск развития рака легких в 2,4 раза выше, чем у некурящих с нормальным генотипом. Напротив, у заядлых курильщиков с мутантным генотипом XRCCI риск рака легких был снижен на 50% по сравнению с их сверстниками с более частым нормальным генотипом. Когда три мутации из этих двух генов были исследованы вместе в крайнем сочетании генотипов (индивидуум с пятью или шестью мутациями, присутствующими в его/ее генотипе), было получено число 5.
В исследовании Zhou et al. (2003), вариации в двух генах, ответственных за репарацию ДНК, были исследованы на предмет их потенциального взаимодействия с уровнем курения сигарет и сопутствующей связи с раком легких. Вкратце, одна предположительно функциональная мутация в гене XRCC1 (группа 1 перекрестной комплементарности при рентгенологическом исследовании) и две предположительно функциональные мутации в гене ERCC2 (группа 2 перекрестной комплементарной репарации эксцизионной репарации) были генотипированы в 1091 случае рака легкого и 1240 контрольных больных. Когда случаи и контрольные группы были разделены на заядлых курильщиков и некурящих, Zhou et al.(2003) обнаружили, что у некурящих с мутантным генотипом XRCCI риск развития рака легких в 2,4 раза выше, чем у некурящих с нормальным генотипом. Напротив, у заядлых курильщиков с мутантным генотипом XRCCI риск рака легких был снижен на 50% по сравнению с их сверстниками с более частым нормальным генотипом. Когда три мутации из этих двух генов были исследованы вместе в крайнем сочетании генотипов (индивидуум с пятью или шестью мутациями, присутствующими в его/ее генотипе), было получено число 5.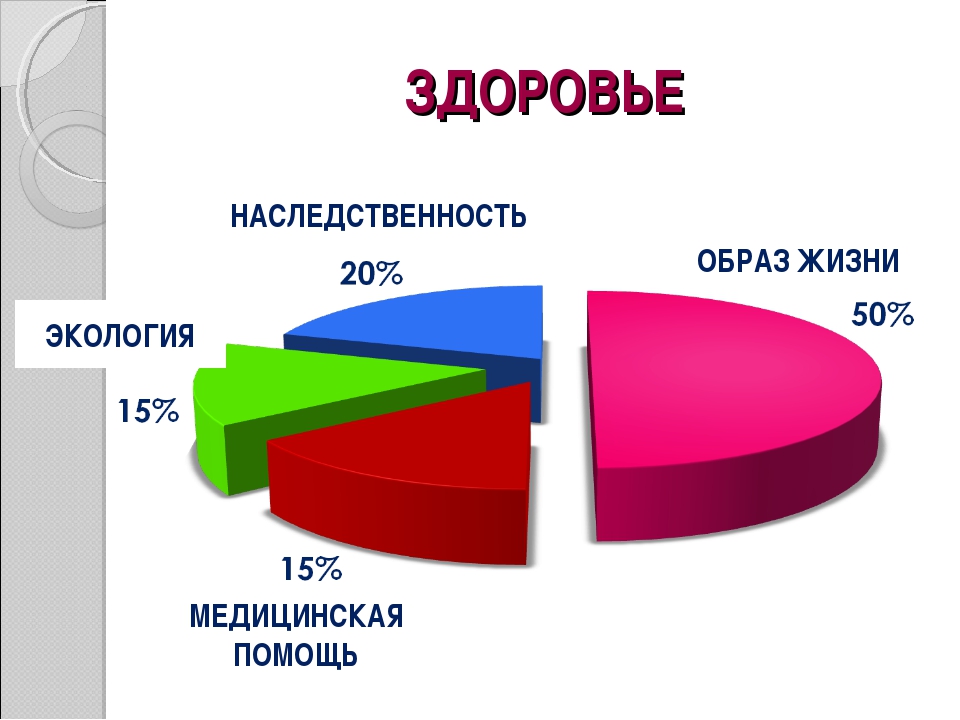 В 2 раза выше риск развития рака легких у некурящих и на 70 процентов снижение риска у заядлых курильщиков по сравнению с людьми без мутаций. Защитный эффект этих генетических вариаций у заядлых курильщиков может быть вызван дифференцированным повышением активности этих защитных генов, стимулируемым заядлым курением. Подобные типы взаимодействий ген-курение также были обнаружены для других генов этого пути, таких как ERCC1. Эти исследования иллюстрируют важность выявления генетических вариаций, связанных с дифференциальным риском заболеваний, связанных с поведением человека.Обратите внимание, что этот тип исследования также поднимает множество различных этических и социальных вопросов, поскольку он определяет уязвимые подгруппы и защищенные подгруппы субъектов как по генетическим, так и по человеческим поведенческим слоям (см. главу 10).
В 2 раза выше риск развития рака легких у некурящих и на 70 процентов снижение риска у заядлых курильщиков по сравнению с людьми без мутаций. Защитный эффект этих генетических вариаций у заядлых курильщиков может быть вызван дифференцированным повышением активности этих защитных генов, стимулируемым заядлым курением. Подобные типы взаимодействий ген-курение также были обнаружены для других генов этого пути, таких как ERCC1. Эти исследования иллюстрируют важность выявления генетических вариаций, связанных с дифференциальным риском заболеваний, связанных с поведением человека.Обратите внимание, что этот тип исследования также поднимает множество различных этических и социальных вопросов, поскольку он определяет уязвимые подгруппы и защищенные подгруппы субъектов как по генетическим, так и по человеческим поведенческим слоям (см. главу 10).
Исследование Zhou et al. (2003) также демонстрирует увеличение объема информации, полученной при совместном изучении влияния множественных мутаций на заболевания, связанные с токсичностью. Другие исследования мутаций в генах, участвующих в метаболизме фазы II (GSTM1, GSTT1, GSTP1), также продемонстрировали важность изучения совместных эффектов мутаций (Miller et al., 2002) о риске рака. Хотя эти два исследования были сосредоточены на аддитивных эффектах нескольких генов, межгенные взаимодействия являются еще одним важным компонентом для лучшего понимания восприимчивости человека к болезням и взаимодействиям с окружающей средой.
Другие исследования мутаций в генах, участвующих в метаболизме фазы II (GSTM1, GSTT1, GSTP1), также продемонстрировали важность изучения совместных эффектов мутаций (Miller et al., 2002) о риске рака. Хотя эти два исследования были сосредоточены на аддитивных эффектах нескольких генов, межгенные взаимодействия являются еще одним важным компонентом для лучшего понимания восприимчивости человека к болезням и взаимодействиям с окружающей средой.
Чтобы адекватно понять континуум геномной восприимчивости к факторам окружающей среды, влияющим на здоровье населения, необходимо провести дополнительные исследования совместных эффектов множественных мутаций. Успехи биоинформатики могут сыграть ключевую роль в этом начинании.Например, методы скрининга баз данных SNP на наличие мутаций в регуляторных областях транскрипции могут быть использованы как для обнаружения, так и для функциональной проверки полиморфных регуляторных элементов, таких как антиоксидантный регуляторный элемент, обнаруженный в промоторных областях многих генов, кодирующих антиоксидантные ферменты и ферменты детоксикации фазы II. Ван и др., 2005). Методы сравнительного анализа последовательностей также становятся все более ценными для генетических исследований человека, поскольку они позволяют ранжировать SNP по порядку с точки зрения их потенциально вредного воздействия на функцию белка или регуляцию генов (Wang et al., 2004). Методы проведения крупномасштабного анализа несинонимичных SNP для прогнозирования того, нарушает ли конкретная мутация функцию белка (Clifford et al., 2004), могут помочь в выборе SNP для генетико-эпидемиологических исследований и могут быть использованы для оптимизации функционального анализа мутаций, которые, как обнаружено, быть статистически связаны с дифференциальной реакцией на факторы окружающей среды, такие как диета, стресс и социально-экономические факторы.
Ван и др., 2005). Методы сравнительного анализа последовательностей также становятся все более ценными для генетических исследований человека, поскольку они позволяют ранжировать SNP по порядку с точки зрения их потенциально вредного воздействия на функцию белка или регуляцию генов (Wang et al., 2004). Методы проведения крупномасштабного анализа несинонимичных SNP для прогнозирования того, нарушает ли конкретная мутация функцию белка (Clifford et al., 2004), могут помочь в выборе SNP для генетико-эпидемиологических исследований и могут быть использованы для оптимизации функционального анализа мутаций, которые, как обнаружено, быть статистически связаны с дифференциальной реакцией на факторы окружающей среды, такие как диета, стресс и социально-экономические факторы.
МЕХАНИЗМЫ ЭКСПРЕССИИ ГЕН
Выявление генов, вариации которых связаны с болезнью, — это только первый шаг в установлении связи между генетикой и здоровьем.Понимание механизмов экспрессии гена и того, как на него влияют другие гены, белки и окружающая среда, становится все более важным для разработки профилактических, диагностических и терапевтических стратегий.
Когда экспрессируются гены, хромосомная ДНК должна транскрибироваться в РНК, а затем РНК обрабатывается и транспортируется для трансляции в белок. Регуляция экспрессии генов является жизненно важным процессом в клетке и включает организацию хромосомной ДНК в соответствующую структуру хроматина более высокого порядка.Он также включает в себя действие множества специфических белковых факторов (поощряющих или подавляющих экспрессию генов), которые могут действовать на разных этапах пути экспрессии генов.
Во всех организмах сети биохимических реакций и сигналов обратной связи организуют пути развития, клеточный метаболизм и продвижение по клеточному циклу. Общая координация клеточного цикла и клеточного метаболизма является результатом контроля прямой и обратной связи, возникающего из набора зависимых путей, в которых инициация событий зависит от более ранних событий.В этих сетях экспрессия генов контролируется молекулярными сигналами, которые регулируют, когда, где и как часто транскрибируется данный ген. Эти сигналы часто стимулируются влиянием окружающей среды или сигналами от других клеток, которые влияют на экспрессию многих генов посредством одного регуляторного пути. Поскольку регуляторный ген может действовать в сочетании с другими сигналами, чтобы контролировать многие другие гены, возможны сложные разветвленные сети взаимодействий (McAdams and Arkin, 1997).
Эти сигналы часто стимулируются влиянием окружающей среды или сигналами от других клеток, которые влияют на экспрессию многих генов посредством одного регуляторного пути. Поскольку регуляторный ген может действовать в сочетании с другими сигналами, чтобы контролировать многие другие гены, возможны сложные разветвленные сети взаимодействий (McAdams and Arkin, 1997).
Генная регуляция имеет решающее значение, поскольку, включая или выключая гены, когда это необходимо, клетки могут реагировать на изменения в окружающей среде (например,g., изменения в диете или активности) и может предотвратить растрату ресурсов. Таким образом, вариации в последовательностях ДНК, связанные с регуляцией экспрессии гена, являются вероятными кандидатами для понимания взаимодействий ген-среда на молекулярном уровне, поскольку эти вариации будут влиять на то, будет ли сигнал окружающей среды, передаваемый в ядро, успешно связываться с последовательностью промотора в генах. гена и стимулировать или подавлять экспрессию гена. Комбинация геномных технологий для генотипирования SNP с массивами экспрессии генов высокой плотности в исследованиях на людях только недавно прояснила степень, в которой может происходить этот тип взаимодействия молекулярного гена с окружающей средой.
Комбинация геномных технологий для генотипирования SNP с массивами экспрессии генов высокой плотности в исследованиях на людях только недавно прояснила степень, в которой может происходить этот тип взаимодействия молекулярного гена с окружающей средой.
Клетки также регулируют экспрессию генов посредством посттранскрипционной модификации; позволив только части мРНК перейти к трансляции; или путем ограничения трансляции конкретных мРНК только тогда, когда и где необходим продукт. Генетические факторы, влияющие на посттранскрипционный контроль, гораздо труднее изучить, поскольку они часто включают мультибелковые комплексы, которые нелегко извлечь или проанализировать из клеток. На других уровнях клетки регулируют экспрессию генов с помощью эпигенетических механизмов, включая фолдинг ДНК, ацетилирование гистонов и метилирование (т.д., химическая модификация) нуклеотидных оснований. На эти механизмы, вероятно, влияют генетические вариации генов-мишеней, а также вариации, проявляющиеся в транслируемых клеточных регуляторных белках. Генная регуляция происходит на протяжении всей жизни на всех уровнях развития и старения организма.
Генная регуляция происходит на протяжении всей жизни на всех уровнях развития и старения организма.
Классическим примером онтогенетического контроля экспрессии генов является дифференциальная экспрессия эмбриональных, фетальных и взрослых генов гемоглобина (см. вставку 3-1). Регуляция генов эпсилон, дельта, гамма, альфа и бета происходит посредством метилирования ДНК, которое строго контролируется сигналами развития.Во время развития большое количество генов включается и выключается посредством эпигенетической регуляции. Одной из самых быстрорастущих областей генетики является изучение последствий воздействия окружающей среды на паттерны экспрессии генов и влияние генетических вариаций на эти траектории развития.
ВСТАВКА 3-1
Экспрессия генов и глобины. Производство гемоглобина регулируется рядом механизмов транскрипционного контроля, таких как переключение, которое диктует экспрессию разного набора генов глобина в разных частях тела на разных стадиях (см… )
)
Пример моногенного заболевания со значительной клинической вариабельностью: серповидно-клеточная анемия
3 Серповидно-клеточная анемия относится к аутосомно-рецессивному заболеванию крови, вызванному вариантом гена β-глобина, называемым серповидно-клеточным гемоглобином ( Гб С). Замена одного нуклеотида (T→A) в шестом кодоне гена β-глобина приводит к замене валина на глутаминовую кислоту (GTG→GAG), что может вызвать полимеризацию Hb S (формирование длинных цепей) при дезоксигенировании (Stuart и Нагель, 2004).Считается, что человек, унаследовавший две копии Hb S (Hb SS), страдает серповидноклеточной анемией , в то время как человек, унаследовавший одну копию Hb S плюс еще один вредный вариант β-глобина (например, Hb C или Hb β-талассемия), считается больным серповидноклеточной болезнью . Человек считается носителем серповидноклеточного признака, если у него есть одна копия нормального гена β-глобина и одна копия серповидного варианта (Hb AS) (Ashley-Koch et al. , 2000).
, 2000).
Были идентифицированы четыре основных гаплотипа гена β-глобина.Три названы в честь регионов Африки, где впервые появились мутации: BEN (Бенин), SEN (Сенегал) и CAR (Центральноафриканская Республика). Четвертый гаплотип, арабо-индийский, встречается в Индии и на Аравийском полуострове (Quinn and Miller, 2004).
Тяжесть заболевания связана с несколькими генетическими факторами (Ashley-Koch et al., 2000). Самая высокая степень тяжести связана с Hb SS, за ней следуют Hb s/β0-талассемия и Hb SC. Hb S/β + -талассемия связана с более доброкачественным течением заболевания (Ashley-Koch et al., 2000). Тяжесть заболевания также связана с гаплотипами β-глобина, вероятно, из-за различий в уровне гемоглобина и концентрации фетального гемоглобина. Гаплотип Сенегала является наиболее доброкачественной формой, за ним следует гаплотип Бенина, а гаплотип Центральноафриканской Республики является наиболее тяжелой формой (Ashley-Koch et al., 2000).
Таким образом, хотя серповидноклеточная анемия является моногенетическим заболеванием, ее фенотипическое проявление мультигенно (см. Приложение D). Существуют две кардинальные патофизиологические особенности серповидно-клеточной анемии — хроническая гемолитическая анемия и вазоокклюзия.Двумя основными последствиями гипоксии, вторичной по отношению к вазоокклюзионному кризу, являются боль и повреждение систем органов. Органы, подверженные наибольшему риску, — это органы с медленным кровотоком, такие как селезенка и костный мозг, или органы с ограниченным терминальным артериальным кровоснабжением, включая глаз, головку бедренной кости и плечевую кость, а также легкие. реципиент дезоксигенированных серповидных клеток, вышедших из селезенки или костного мозга. Основные клинические проявления серповидно-клеточной анемии включают болевые ощущения, острый грудной синдром, дисфункцию селезенки и нарушения мозгового кровообращения.
Приложение D). Существуют две кардинальные патофизиологические особенности серповидно-клеточной анемии — хроническая гемолитическая анемия и вазоокклюзия.Двумя основными последствиями гипоксии, вторичной по отношению к вазоокклюзионному кризу, являются боль и повреждение систем органов. Органы, подверженные наибольшему риску, — это органы с медленным кровотоком, такие как селезенка и костный мозг, или органы с ограниченным терминальным артериальным кровоснабжением, включая глаз, головку бедренной кости и плечевую кость, а также легкие. реципиент дезоксигенированных серповидных клеток, вышедших из селезенки или костного мозга. Основные клинические проявления серповидно-клеточной анемии включают болевые ощущения, острый грудной синдром, дисфункцию селезенки и нарушения мозгового кровообращения.
Усилия по совершенствованию клинической помощи сосредоточены на углублении нашего понимания патофизиологии серповидно-клеточной анемии, чтобы облегчить точный прогноз и индивидуализированное лечение. Необходимы знания о том, какие гены связаны с гемолитическими и сосудистыми осложнениями серповидно-клеточной анемии и как варианты этих генов взаимодействуют между собой и с окружающей средой (Steinberg, 2005).
Необходимы знания о том, какие гены связаны с гемолитическими и сосудистыми осложнениями серповидно-клеточной анемии и как варианты этих генов взаимодействуют между собой и с окружающей средой (Steinberg, 2005).
АСПЕКТЫ ЗДОРОВЬЯ ПОД ВЛИЯНИЕМ ГЕНЕТИКИ
Поскольку каждая клетка в организме, за редким исключением, несет полный геном, полный вариаций, в качестве шаблона для развития своего белкового аппарата, можно утверждать, что генетическая изменчивость влияет на все клеточные, биохимические, физиологические и морфологические аспекты человеческого существа.То, как эти генетические вариации связаны с конкретным риском заболевания, находится в центре внимания многих текущих исследований. В отношении распространенных заболеваний, таких как сердечно-сосудистые заболевания, гипертония, рак, диабет и многие психические заболевания, растет понимание того, что разные гены и разные генетические вариации могут быть вовлечены в различные аспекты их естественного течения. Например, могут быть гены, вариации которых связаны с предрасположенностью к возникновению заболевания, и другие гены или вариации генов, которые участвуют в прогрессировании заболевания до клинически определенной конечной точки.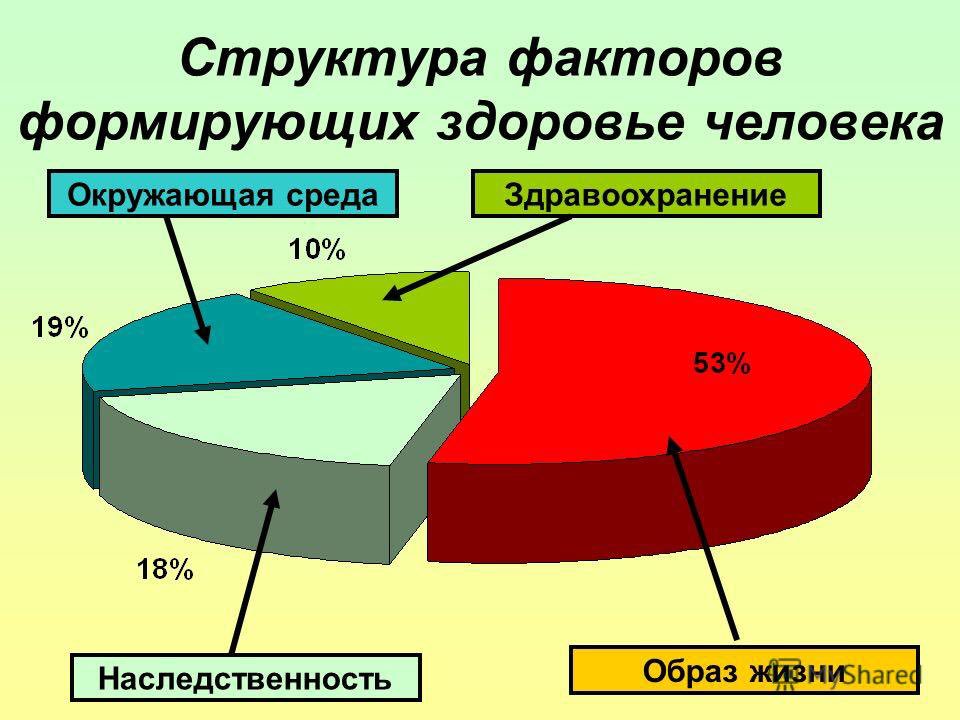 Кроме того, совершенно другой набор генов может быть задействован в том, как человек реагирует на фармацевтическое лечение этого заболевания. Также, вероятно, будут гены, изменчивость которых контролирует, насколько человек может реагировать на факторы риска окружающей среды, связанные с риском заболевания. Наконец, считается, что существуют гены, влияющие на общую продолжительность жизни человека, которые могут противодействовать или взаимодействовать с генами, которые в противном случае могут предрасполагать этого человека к конкретному исходу болезни и, таким образом, могут оказывать дополнительное влияние на выживаемость.
Кроме того, совершенно другой набор генов может быть задействован в том, как человек реагирует на фармацевтическое лечение этого заболевания. Также, вероятно, будут гены, изменчивость которых контролирует, насколько человек может реагировать на факторы риска окружающей среды, связанные с риском заболевания. Наконец, считается, что существуют гены, влияющие на общую продолжительность жизни человека, которые могут противодействовать или взаимодействовать с генами, которые в противном случае могут предрасполагать этого человека к конкретному исходу болезни и, таким образом, могут оказывать дополнительное влияние на выживаемость.
Во многих отношениях мы только в начале пути к истинному пониманию того, как геномные вариации вызывают восприимчивость к болезням. Действительно, многие могут возразить, что без учета столь же важной роли окружающей среды мы никогда полностью не поймем роль генетики в здоровье. По мере прогресса в использовании новых технологий для измерения биологической изменчивости в геноме, транскриптоме, протеоме и метабономе нам, вероятно, придется внести большие изменения в наши концептуальные рамки о роли генов в заболевании. Глобальные паттерны геномной восприимчивости, вероятно, проявятся только тогда, когда мы рассмотрим влияние многих взаимодействующих компонентов, работающих одновременно, которые зависят от таких контекстов, как возраст, пол, диета и физическая активность, которые изменяют отношения с риском. По большей части мы все еще находимся на стадии документирования сложности, поиска примеров и типов генов генетической предрасположенности, понимания гетерогенности болезней и постулирования способов разработки моделей риска, использующих всю совокупность того, что мы знаем о биологии человека, начиная с наши геномы к нашей экологии для моделирования риска.
Глобальные паттерны геномной восприимчивости, вероятно, проявятся только тогда, когда мы рассмотрим влияние многих взаимодействующих компонентов, работающих одновременно, которые зависят от таких контекстов, как возраст, пол, диета и физическая активность, которые изменяют отношения с риском. По большей части мы все еще находимся на стадии документирования сложности, поиска примеров и типов генов генетической предрасположенности, понимания гетерогенности болезней и постулирования способов разработки моделей риска, использующих всю совокупность того, что мы знаем о биологии человека, начиная с наши геномы к нашей экологии для моделирования риска.
Сердечно-сосудистые заболевания (ССЗ)
Изучение сердечно-сосудистых заболеваний может быть использовано для иллюстрации проблем, возникающих при использовании генетической информации для понимания этиологии наиболее распространенных хронических заболеваний, а также для выявления тех, кто подвергается наибольшему риску развития эти заболевания. Большинство случаев сердечно-сосудистых заболеваний имеют сложную многофакторную этиологию, и даже полное знание генетической структуры человека не может с уверенностью предсказать начало, прогрессирование или тяжесть заболевания (Sing et al., 2003). Болезнь развивается как следствие взаимодействий между генотипом человека и воздействием факторов окружающей среды, которые влияют на сердечно-сосудистые фенотипы, начиная с зачатия и продолжаясь в течение всей взрослой жизни. Исследования сердечно-сосудистых заболеваний выявили множество агентов окружающей среды с высоким риском и сотни генов, каждый из которых имеет множество вариаций, которые, как считается, влияют на риск заболевания. По мере увеличения числа взаимодействующих агентов будет обнаруживаться меньшее число случаев заболевания, имеющих ту же этиологию и ассоциированных с определенным генотипом (Sing et al., 2003). Множество механизмов обратной связи и взаимодействия агентов из генома через промежуточные биохимические и физиологические подсистемы с воздействием агентов окружающей среды способствуют возникновению клинического фенотипа данного индивидуума.
Большинство случаев сердечно-сосудистых заболеваний имеют сложную многофакторную этиологию, и даже полное знание генетической структуры человека не может с уверенностью предсказать начало, прогрессирование или тяжесть заболевания (Sing et al., 2003). Болезнь развивается как следствие взаимодействий между генотипом человека и воздействием факторов окружающей среды, которые влияют на сердечно-сосудистые фенотипы, начиная с зачатия и продолжаясь в течение всей взрослой жизни. Исследования сердечно-сосудистых заболеваний выявили множество агентов окружающей среды с высоким риском и сотни генов, каждый из которых имеет множество вариаций, которые, как считается, влияют на риск заболевания. По мере увеличения числа взаимодействующих агентов будет обнаруживаться меньшее число случаев заболевания, имеющих ту же этиологию и ассоциированных с определенным генотипом (Sing et al., 2003). Множество механизмов обратной связи и взаимодействия агентов из генома через промежуточные биохимические и физиологические подсистемы с воздействием агентов окружающей среды способствуют возникновению клинического фенотипа данного индивидуума. При попытке разобраться в относительном вкладе генов и окружающей среды в ССЗ необходимо учитывать большое количество факторов, от влияния генов на уровень холестерина (например, уровень ЛПНП) до психосоциальных факторов, таких как стресс и гнев. Хотя в инициацию, прогрессирование и клинические проявления ССЗ вовлечены сотни генов, относительно мало известно о том, как окружающая среда человека взаимодействует с этими генами, нарушая баланс между атерогенными и антиатерогенными процессами, которые приводят к клинически проявляющимся ССЗ. .См. главы 4 и 6 для дальнейшего обсуждения влияния социальной среды на сердечно-сосудистые заболевания.
При попытке разобраться в относительном вкладе генов и окружающей среды в ССЗ необходимо учитывать большое количество факторов, от влияния генов на уровень холестерина (например, уровень ЛПНП) до психосоциальных факторов, таких как стресс и гнев. Хотя в инициацию, прогрессирование и клинические проявления ССЗ вовлечены сотни генов, относительно мало известно о том, как окружающая среда человека взаимодействует с этими генами, нарушая баланс между атерогенными и антиатерогенными процессами, которые приводят к клинически проявляющимся ССЗ. .См. главы 4 и 6 для дальнейшего обсуждения влияния социальной среды на сердечно-сосудистые заболевания.
Хорошо известно, что многие социальные и поведенческие факторы, от социально-экономического положения, стресса на работе и депрессии до курения, физических упражнений и диеты, влияют на риск сердечно-сосудистых заболеваний (более подробное обсуждение этих факторов см. в главах 2, 3 и 6). ). По мере того, как все больше исследований взаимодействия генов и окружающей среды рассматривают эти факторы как часть «окружающей среды», которые исследуются в сочетании с генетическими вариациями, возникает множество интеллектуальных и методологических проблем. Во-первых, как воплощены социальные факторы, так что взаимодействие с определенным генотипом может быть связано с дифференцированным риском? Во-вторых, как мы можем обрабатывать сложные взаимодействия, чтобы ответить на такие вопросы, как, например, как генотип человека влияет на его/ее поведение? Например, генетическая предрасположенность к никотиновой зависимости на самом деле является фактором риска сердечно-сосудистых заболеваний, и ее влияние на риск сердечно-сосудистых заболеваний может зависеть от взаимодействия с другими генетическими факторами.
Во-первых, как воплощены социальные факторы, так что взаимодействие с определенным генотипом может быть связано с дифференцированным риском? Во-вторых, как мы можем обрабатывать сложные взаимодействия, чтобы ответить на такие вопросы, как, например, как генотип человека влияет на его/ее поведение? Например, генетическая предрасположенность к никотиновой зависимости на самом деле является фактором риска сердечно-сосудистых заболеваний, и ее влияние на риск сердечно-сосудистых заболеваний может зависеть от взаимодействия с другими генетическими факторами.
Фармакогенетика
Хорошо известно, что люди часто по-разному реагируют на одну и ту же лекарственную терапию.Процесс утилизации лекарств представляет собой сложный набор физиологических реакций, которые начинаются сразу после введения. Лекарство всасывается и распределяется по целевым областям тела, где оно взаимодействует с клеточными компонентами, такими как рецепторы и ферменты, которые далее метаболизируют лекарство, и в конечном итоге лекарство выводится из организма (Weinshilboum, 2003). В любой момент этого процесса генетическая изменчивость может изменить терапевтический ответ человека и вызвать нежелательную лекарственную реакцию (ADR) (Evans and McLeod, 2003).Было подсчитано, что от 20 до 95 процентов вариаций в распределении лекарств, таких как НЛР, могут быть связаны с генетической изменчивостью (Kalow et al., 1998; Evans and McLeod, 2003).
В любой момент этого процесса генетическая изменчивость может изменить терапевтический ответ человека и вызвать нежелательную лекарственную реакцию (ADR) (Evans and McLeod, 2003).Было подсчитано, что от 20 до 95 процентов вариаций в распределении лекарств, таких как НЛР, могут быть связаны с генетической изменчивостью (Kalow et al., 1998; Evans and McLeod, 2003).
Чувствительность как к дозозависимым, так и к дозонезависимым НЛР может иметь корни в генетической изменчивости. Полиморфизмы кинетических и динамических факторов, таких как цитохром P450 и специфические мишени для лекарственных средств, могут вызывать у этих людей предрасположенность к НЛР. Хотя характеристики ADR определяют истинное значение этих факторов, в большинстве случаев задействованы несколько генов (Pirmohamed and Park, 2001).Будущие анализы с использованием полногеномного профилирования SNP могут предоставить метод для оценки нескольких факторов генетической предрасположенности к ADR и установления их совместных эффектов. Одной из проблем изучения взаимосвязи между генетической изменчивостью и нежелательными реакциями является недостаточное количество образцов пациентов. Чтобы решить эту проблему, Pirmohamed and Park (2001) предложили, чтобы проспективные рандомизированные контролируемые клинические испытания стали частью стандартизированной практики, чтобы в конечном итоге доказать клиническую полезность генотипирования всех пациентов в качестве меры предотвращения побочных реакций.
Одной из проблем изучения взаимосвязи между генетической изменчивостью и нежелательными реакциями является недостаточное количество образцов пациентов. Чтобы решить эту проблему, Pirmohamed and Park (2001) предложили, чтобы проспективные рандомизированные контролируемые клинические испытания стали частью стандартизированной практики, чтобы в конечном итоге доказать клиническую полезность генотипирования всех пациентов в качестве меры предотвращения побочных реакций.
Здесь мы рассмотрим некоторые текущие работы в области фармакогенетики в качестве примера того, что можно ожидать от тщательного изучения взаимодействия между социальными, поведенческими и генетическими факторами. Исследователи представили несколько хорошо зарекомендовавших себя примеров различий в индивидуальном ответе на лекарство, которые объясняются генетическими вариациями различных клеточных механизмов распределения лекарств, таких как переносчики лекарств или ферменты, ответственные за метаболизм лекарств (Evans and McLeod, 2003). Например:
Например:
- Зная, что ген HER2 гиперэкспрессируется примерно в четверти случаев рака молочной железы, исследователи разработали гуманизированное моноклональное антитело против рецептора HER2 в надежде ингибировать рост опухоли, связанной с рецептором. Генотипирование больных раком молочной железы на поздних стадиях для выявления опухолей с повышенной экспрессией рецептора HER2 дало многообещающие результаты в улучшении клинических исходов у этих больных раком молочной железы (Cobleigh et al., 1999).
- Терапевтический класс препаратов, называемых тиопуринами, используется как часть схемы лечения острого лимфобластного лейкоза у детей. Один из 300 представителей европеоидной расы имеет генетическую вариацию, которая приводит к низким или отсутствующим уровням тиопуринметилтрансферазы (TPMT), фермента, ответственного за метаболизм тиопуриновых препаратов. Если пациентам с этой генетической вариацией дают тиопурины, препарат накапливается в их организме до токсического уровня, вызывая опасную для жизни миелосупрессию.
 Оценка фенотипа и генотипа TPMT пациента может быть использована для определения индивидуальной дозы препарата (Armstrong et al., 2004).
Оценка фенотипа и генотипа TPMT пациента может быть использована для определения индивидуальной дозы препарата (Armstrong et al., 2004). - Семейство ферментов печени, называемых цитохромами P450, играет важную роль в метаболизме до 40 различных типов лекарств. Генетические варианты этих ферментов могут снижать их способность эффективно расщеплять определенные лекарственные средства, что может привести к передозировке у пациентов с менее активными или неактивными формами фермента цитохрома Р450.Различные уровни сниженной активности цитохрома Р450 также вызывают беспокойство у пациентов, принимающих несколько препаратов, которые могут взаимодействовать, если они не метаболизируются должным образом хорошо функционирующими ферментами. Были разработаны стратегии для оценки уровня активности ферментов цитохрома Р450, которые полезны при планировании и мониторинге успешной медикаментозной терапии. Некоторые испытания фармацевтических препаратов в настоящее время включают ранние тесты, которые оценивают способность различных форм цитохрома Р450 метаболизировать новое лекарственное соединение (Obach et al., 2006).
Некоторые исследования в области фармакогенетики были сосредоточены на лечении психических расстройств. С появлением класса препаратов, известных как селективные ингибиторы обратного захвата серотонина (СИОЗС), фармакологическое лечение многих психических расстройств резко изменилось. СИОЗС предлагают значительные улучшения по сравнению с предыдущим поколением лечения, включая улучшенную эффективность и переносимость для многих пациентов. Однако не все пациенты положительно реагируют на лечение СИОЗС, и у многих возникают нежелательные реакции.Новые фармакогенетические исследования показали, что эти нежелательные реакции могут быть результатом генетических вариаций генов переносчиков серотонина и генов цитохрома Р450. Необходимы дальнейшие исследования и повторение этих результатов. Если характеристика генетических вариаций будет завершена и полностью понята, станет возможным скрининг и мониторинг пациентов с использованием методов генотипирования для создания индивидуальной лекарственной терапии, аналогичной тем, которые обсуждались выше (Mancama and Kerwin, 2003).
Серьезной проблемой для разработки индивидуальной лекарственной терапии является часто полигенный или многофакторный наследственный компонент ответа на лекарственные средства.Выделение полигенных детерминант реакции на лекарство является серьезной задачей. Основой всех исследований должно быть хорошее понимание механизма действия препарата, путей его метаболизма и распределения. Эти знания могут помочь в проведении полногеномных поисков генных вариаций, связанных с эффектами наркотиков, и последующих подходов к исследованию генов-кандидатов. Кроме того, протеомные исследования и профилирование экспрессии генов также являются важными способами подтверждения и понимания механизмов действия интересующего гена, влияющих на индивидуальную реакцию на препарат (Evans and McLeod, 2003).Недостаточно показать ассоциацию; характеристика лежащих в основе биологических механизмов является важным компонентом перемещения генетических данных в область снижения риска. Еще одним ключевым компонентом использования генетики для улучшения профилактики и снижения заболеваемости является понимание распределения генетических вариаций в обслуживаемом населении.
ГЕНЕТИКА ПОПУЛЯЦИЙ, СВЯЗАННАЯ С ЗДОРОВЬЕМ И БОЛЕЗНЬЮ
Человеческие популяции различаются по распределению генетических вариаций.Это следствие их исторических моделей мутаций, миграции, размножения, спаривания, отбора и генетического дрейфа. Унаследованные мутации обычно возникают во время гаметогенеза у одного человека, а затем могут передаваться потомству в течение многих поколений. Станет ли эта мутация преобладающим полиморфизмом (т. е. мутацией с популяционной частотой более 1 %), определяется как эволюционными силами, так и случайными событиями. Например, это зависит от того, доживет ли первоначальный ребенок, унаследовавший мутацию, до зрелого возраста и размножится, доживут ли дети этого ребенка до размножения и так далее.Количество детей в семье также влияет на распространенность мутации, и это часто связано с факторами окружающей среды, влияющими на фертильность и модели спаривания, которые влияют на скорость, с которой частная мутация становится общедоступным полиморфизмом. Есть хорошо известные примеры так называемых мутаций-основателей, в которых эта траектория может быть задокументирована. Например, один конкретный район на территории современного Квебека (Канада) изначально был основан всего несколькими семьями из определенной французской провинции.Один из отцов-основателей имел делецию размером 10 т.п.н. в своем гене рецептора ЛПНП (LDL-R), которая быстро передавалась из поколения в поколение, и сегодня ее носит 1 из 154 французских канадцев на северо-востоке Квебека. Эта мутация связана с семейной гиперхолестеринемией, а среди французских канадцев распространенность этого заболевания одна из самых высоких в мире из-за малочисленности исходной популяции, за которой следует расширение популяции (Moorjani et al., 1989).
Существует также ряд примеров, когда мутации, возникающие у индивидуума, становятся более распространенными из-за избирательного преимущества, которое они придают своим носителям.Наиболее известным примером является мутация, связанная с серповидноклеточной анемией. Географический образец этой мутации точно отражает географический образец малярийной инфекции. Молекулярно было продемонстрировано, что люди, несущие серповидноклеточную мутацию, обладают устойчивостью к малярийной инфекции. Поскольку многие факторы отбора, которые могли привести к нынешнему распределению мутаций в отдельных популяциях, относятся к нашему эволюционному прошлому, трудно оценить, насколько вариации внутри популяций или между популяциями обусловлены этими типами сил отбора.
Еще одной важной силой, определяющей распространение генетических вариаций внутри и между человеческими популяциями, является их миграция и репродуктивная изоляция. Согласно нашим лучшим знаниям, один из самых важных периодов в эволюции человека произошел примерно 100 000 лет назад, когда часть людей мигрировала на другие континенты из африканского бассейна и основала новые сообщества с относительной репродуктивной изоляцией. Генетические различия между людьми в разных географических районах на протяжении сотен лет связывались с концепцией расы.Хотя раса по-прежнему используется в качестве ярлыка, первоначальная концепция расы как генетически отличного подвида людей была отвергнута современной генетической информацией. По многим причинам, обсуждаемым в разделе ниже, более уместно переосмыслить старую генетику расы в более точную генетику предков.
Помимо отдаленных эволюционных моделей миграции, более современные модели миграции также оказали глубокое влияние на генетику популяций. Например, нынешнее население Соединенных Штатов и большей части Северной Америки генетически очень разнообразно в результате смешения многих людей из разных стран и континентов.
Основная причина изучения происхождения и природы генетической изменчивости человека заключается в том, что сходства и различия в типе и частоте генетических вариаций внутри и между популяциями могут оказать глубокое влияние на исследования, пытающиеся понять влияние генов на болезни риск. Например, некоторые генетические вариации, такие как полиморфизм белка аполипопротеина Е, встречаются в каждой популяции и имеют очень схожие частоты генотипов по всему миру (Wu et al., 2002; Дениз Наранхо и др., 2004). Связь вариации с учащением сердечных заболеваний и болезнью Альцгеймера может быть проверена и проверена во многих популяциях мира. Другие мутации, такие как делеция 10 т.п.н. в гене LDL-R, описанная выше, являются более специфичными для популяции вариациями.
Более того, со статистической точки зрения влияние генетической вариации на континуум риска, обнаруживаемой в любой популяции, коррелирует с ее частотой. Например, распространенные генетические полиморфизмы с частотой около 50 процентов не могут быть связаны с большими фенотипическими эффектами в популяции, потому что каждый класс генотипа представляет собой большую часть популяции, и, поскольку большая часть риска распределяется нормально, средний риск высокораспространенного генотипа класс не может отклоняться от общего риска населения в какой-либо значительной степени.Эта корреляция между частотой генотипа и эффектом не означает, что общие вариации не могут быть значительными в их эффектах. Статистическая значимость связи между генетическим вариантом и заболеванием является совместной функцией размера выборки и размера эффекта. Кроме того, генетические исследования среди популяций, которые различаются по частоте генотипов, могут различаться в своих выводах о том, какие полиморфизмы оказывают значительное влияние, даже если абсолютный фенотипический эффект одинаков.См. Cheveud and Routman (1995) для более формального статистического объяснения этого явления и его влияния на оценку межгенных взаимодействий.
Другим ключевым моментом в понимании взаимосвязи между генетическими вариациями и мерами риска заболевания являются популяционные различия в корреляциях между частотами генотипов в разных местах SNP. Есть две распространенные причины, по которым частота аллеля или генотипа в конкретном SNP может коррелировать с частотой аллеля или генотипа в другом SNP.Во-первых, явление, известное как неравновесие по сцеплению , создает корреляции между SNP как следствие истории мутации. Когда возникают мутации, они происходят на определенном генетическом фоне, что создает корреляцию с другими SNP на хромосоме. Во-вторых, смешение популяций, известное как примесь, которое обычно происходит в результате миграции, означает, что SNP с частотами, специфичными для популяции, будут коррелировать в большей смешанной выборке. В этом случае расслоение населения является причиной корреляции, и было проведено много генетических эпидемиологических исследований этого явления и способов его контроля.Стратификация населения считается возможным источником ложных генетических ассоциаций с болезнью (см. вставку 3-2).
БЛОК 3-2
Стратификация населения (смешение). Когда риск заболевания различается между двумя этническими группами, любой генетический фактор или фактор окружающей среды, который также различается между группами, будет казаться связанным с заболеванием. Это явление называется «популяция» (подробнее…)
ЗАКЛЮЧЕНИЕ
По большей части в двадцатом веке преобладали исследования здоровья и болезней человека, которые были сосредоточены на выявлении отдельных генетических и экологических агентов, которые могли бы объяснить различия в восприимчивости к болезням.Этот новый век характеризуется огромным прогрессом в нашем понимании менделевских расстройств с тяжелыми клиническими исходами. Однако менделевская парадигма не смогла объяснить генетический вклад в восприимчивость к наиболее распространенным хроническим заболеваниям, которые, как известно исследователям, имеют существенный генетический компонент из-за их семейной агрегации и исследований, демонстрирующих значительную наследуемость этих заболеваний. Точно так же экологические и социальные эпидемиологические исследования были очень успешными в освещении роли многих факторов окружающей среды, таких как диета, физические упражнения и стресс, на риск заболевания.Однако эти экологические факторы сами по себе еще не полностью объясняют различия в распространенности некоторых заболеваний в разных популяциях. Исследователи только сейчас начинают всерьез изучать потенциальные взаимодействия между генетическими факторами и факторами окружающей среды, которые, вероятно, способствуют значительной части заболеваний в большинстве групп населения. Многое можно сделать, чтобы включить измерения социальной среды в генетические исследования, а также включить генетические измерения в социальные эпидемиологические исследования.
За последние два десятилетия прогресс в идентификации конкретных генов и мутаций, объясняющих генетическую предрасположенность к распространенным состояниям, был относительно медленным по целому ряду причин. Во-первых, изучаемые заболевания, как правило, имеют сложную этиологию, а это означает, что у разных людей в популяции болезнь развивается по разным генетическим и/или экологическим причинам. Ожидается, что любой отдельный генетический или экологический фактор объясняет лишь очень небольшую долю риска заболевания в популяции.Более того, предполагается, что эти факторы взаимодействуют, и другие биологические процессы (например, эпигенетические модификации), вероятно, вносят свой вклад в сложную загадку восприимчивости. Точное фенотипическое определение болезни и ее подтипов имеет решающее значение для выявления и понимания сложности специфических для болезни генетических и экологических причин.
Во-вторых, генетики только недавно разработали базу знаний или методы, необходимые для измерения генетических вариаций и их метаболических последствий с достаточной простотой и экономической эффективностью, чтобы можно было изучить большое количество генов, которые, как считается, задействованы.После завершения проекта «Геном человека» в 2003 г. многие различные научные организации (например, Проект «Экологический геном» и Международный консорциум HapMap) работали над определением мутационных спектров в человеческих популяциях, и генетические эпидемиологи только сейчас начинают понимать обширный характер общих вариаций (частота в популяции > 1 процента) в геноме человека, которые могут влиять на риск заболевания людей. Данные SNP, полученные в результате этих инициатив, теперь централизованно размещены в ряде общедоступных баз данных, включая базу данных dbSNP Национального центра биотехнологической информации, базу данных SNP Инициативы генетической аннотации CGAP Национального института рака и базу данных генных биаллельных последовательностей человека Каролинского института. .В настоящее время крупнейший набор данных о вариациях человека создается в рамках проекта International HapMap Project, 4 , в рамках которого проводится генотипирование миллионов SNP у 270 человек из 4 географически удаленных мест по всему миру. Международный проект HapMap значительно увеличил количество проверенных SNP, доступных исследовательскому сообществу для изучения вариаций человека, и создает карту геномных гаплотипов в четырех популяциях, происходящих из частей Африки, Азии и Европы.Кроме того, только сейчас становятся доступными высокопроизводительные методы генотипирования большого количества SNP (тысячи) в больших эпидемиологических когортах (см. выше). К сожалению, высокопроизводительные методы измерения окружающей среды не выдержали таких же темпов. Для многих исследований распространенных заболеваний ограничивающим шагом к расширению нашего понимания будет по-прежнему сложное и дорогостоящее измерение факторов окружающей среды.
Наконец, прогресс также был затруднен из-за отсутствия адекватных инвестиций в разработку новых методов анализа, которые могут включать многомерную биологическую реальность, которую мы теперь можем измерить.Сложная генетическая и экологическая архитектура многофакторных заболеваний нелегко обнаружить или расшифровать с помощью традиционных методов статистического моделирования, ориентированных на оценку единой общей модели заболевания для населения. Например, используя традиционные методы логистической регрессии, было бы просто невозможно ввести все сотни генетических вариаций, которые, как считается, связаны с риском сердечно-сосудистых заболеваний или любыми другими изучаемыми в настоящее время комплексами распространенных заболеваний.Помимо очевидных проблем власти и сверхдетерминации в такой крупномасштабной модели, мы также не знаем, как моделировать или интерпретировать взаимодействия между многими факторами одновременно или как учитывать редкие, значительные эффекты некоторых генов по сравнению с обычными, небольшими эффектами. других. Новые стратегии моделирования, использующие достижения в распознавании образов, машинном обучении и системном анализе (например, безмасштабные сети, байесовские сети доверия, методы случайного леса), потребуются для построения более полных предиктивных моделей этих явлений. этиологически гетерогенные заболевания.
Область генетики человека, как и многие другие дисциплины, находится в переходном состоянии, и можно многого добиться, объединив усилия с широким спектром других дисциплин, которые сосредоточены на улучшении профилактики и снижении бремени болезней среди нашего населения.
ЛИТЕРАТУРА
- Альтшулер Д., Кругляк Л., Ландер Е. Генетические полиморфизмы и болезни. Медицинский журнал Новой Англии. 1998;338(22):1626. [PubMed: 9606122]
- Ardlie KG, Lunetta KL, Seielstad M.Тестирование подразделения населения и ассоциации в четырех исследованиях случай-контроль. Американский журнал генетики человека. 2002;71(2):304–311. [Статья бесплатно PMC: PMC379163] [PubMed: 12096349]
- Армстронг В.В., Шипкова М., фон Ахсен Н., Оллерих М. Аналитические аспекты мониторинга терапии тиопуриновыми препаратами. Терапевтический лекарственный мониторинг. 2004;26(2):220–226. [PubMed: 15228169]
- Эшли-Кох А., Ян К., Олни Р. Аллель серповидного гемоглобина (Hb S) и серповидно-клеточная анемия: обзор HuGE.Американский журнал эпидемиологии. 2000;151(9):839–845. [PubMed: 10791557]
- Браун М.С., Гольдштейн Дж.Л. Снижение уровня холестерина в плазме за счет повышения активности рецепторов ЛПНП. Медицинский журнал Новой Англии. 1981;305(9):515–517. [PubMed: 6265781]
- Cardon LR, Bell JI. Дизайн ассоциативных исследований для комплексных заболеваний. Природа Обзоры Генетика. 2001;2(2):91–99. [PubMed: 11253062]
- Clifford RJ, Edmonson MN, Nguyen C, Buetow KH. Крупномасштабный анализ несинонимичных полиморфизмов одиночных нуклеотидов кодирующей области.Биоинформатика. 2004;20(7):1006–1014. [PubMed: 14751981]
- Кобли М.А., Фогель К.Л., Трипати Д., Роберт Н.Дж., Шолль С., Ференбахер Л., Уолтер Дж.М., Патон В., Шак С., Либерман Г., Сламон Д.Дж. Многонациональное исследование эффективности и безопасности гуманизированного моноклонального антитела против HER2 у женщин с метастатическим раком молочной железы с гиперэкспрессией HER2, который прогрессировал после химиотерапии по поводу метастатического заболевания. Журнал клинической онкологии. 1999;17(9):2639–2648. [PubMed: 10561337]
- Deniz Naranjo MC, Munoz Fernandez C, Alemany Rodriguez MJ, Perez Vieitez MC, Irurita Latasa J, Suarez Armas R, Suarez Valentin MP, Sanchez Garcia F.Пол оказывает сильное модулирующее влияние на риск болезни Альцгеймера, связанный с геном аполипопротеина Е, у населения Канарских островов, Испания. Ревиста де Неврология. 2004;38(7):615–618. [PubMed: 15098180]
- Evans WE, McLeod HL. Фармакогеномика — расположение лекарств, мишени для лекарств и побочные эффекты. Медицинский журнал Новой Англии. 2003;348(6):538–549. [PubMed: 12571262]
- Гандерсон К.Л., Стимерс Ф.Дж., Ли Г., Мендоза Л.Г., Чи М.С. Масштабируемый анализ генотипирования SNP для всего генома с использованием технологии микрочипов.Генетика природы. 2005;37(5):549–554. [PubMed: 15838508]
Haines JL, Pericak-Vance MA. Подходы к картированию генов при сложных заболеваниях человека. Нью-Йорк: Уайли-Лисс; 1998.
- Холл Дж.М., Ли М.К., Ньюман Б., Морроу Дж.Е., Андерсон Л.А., Хьюи Б., Кинг М.С. Связь семейного рака молочной железы с ранним началом с хромосомой 17q21. Наука. 1990; 250 (4988): 1684–1689. [PubMed: 2270482]
- Хайндс Д.А., Стюв Л.Л., Нильсен Г.Б., Гальперин Э., Эскин Э., Баллинджер Д.Г., Фрейзер К.А., Кокс Д.Р. Полногеномные паттерны общих вариаций ДНК в трех человеческих популяциях.Наука. 2005;307(5712):1072–1079. [PubMed: 15718463]
МОМ (Институт медицины). Значение геномики для общественного здравоохранения. Вашингтон, округ Колумбия: Издательство национальных академий; 2005.
- Kalow W, Tang BK, Endrenyi L. Гипотеза: сравнение меж- и внутрииндивидуальных вариаций может заменить исследования близнецов в исследованиях лекарств. Фармакогенетика. 1998;8(4):283–289. [PubMed: 9731714]
- Kardia SL, Modell SM, Peyser PA. Семейно-ориентированные подходы к пониманию и профилактике ишемической болезни сердца.Американский журнал профилактической медицины. 2003;24(2):143–151. [PubMed: 12568820]
- Клейн Р.Дж., Цейсс С., Чу Э.Ю., Цай Дж.Ю., Саклер Р.С., Хейнс С., Хеннинг А.К., СанДжованни Д.П., Мане С.М., Мейн С.Т., Бракен М.Б., Феррис Ф.Л., Отт Дж., Барнстейбл С., Хох J. Полиморфизм фактора комплемента Н при возрастной дегенерации желтого пятна. Наука. 2005;308(5720):385–389. [Бесплатная статья PMC: PMC1512523] [PubMed: 15761122]
- Lander ES, Schork NJ. Генетическое рассечение сложных признаков. Наука. 1994;265(5181):2037–2048.[PubMed: 8091226]
- Livingston RJ, von Niederhausern A, Jegga AG, Crawford DC, Carlson CS, Rieder MJ, Gowrisankar S, Aronow BJ, Weiss RB, Nickerson DA. Характер изменения последовательности в 213 генах реакции на окружающую среду. Геномные исследования. 2004; 14 (10А): 1821–1831. [Бесплатная статья PMC: PMC524406] [PubMed: 15364900]
- Mancama D, Kerwin RW. Роль фармакогеномики в индивидуализации лечения СИОЗС. Препараты ЦНС. 2003;17(3):143–151. [PubMed: 12617694]
- МакАдамс Х.Х., Аркин А.Стохастические механизмы экспрессии генов. Труды Национальной академии наук Соединенных Штатов Америки. 1997; 94(3):814–819. [Бесплатная статья PMC: PMC19596] [PubMed:
- 39]
- Miller DP, Liu G, De Vivo I, Lynch TJ, Wain JC, Su L, Christiani DC. Комбинации вариантных генотипов GSTP1, GSTM1 и p53 связаны с повышенным риском рака легких. Исследования рака. 2002;62(10):2819–2823. [PubMed: 12019159]
- Мурджани С., Рой М., Ганье С., Дэвиньон Дж., Брун Д., Туссен М., Ламбер М., Кампо Л., Блейхман С., Люпьен П.Гомозиготная семейная гиперхолестеринемия среди французских канадцев в провинции Квебек. Артериосклероз. 1989;9(2):211–216. [PubMed: 2923577]
- Обач Р.С., Вальски Р.Л., Венкатакришнан К., Гаман Э.А., Хьюстон Дж.Б., Тремейн Л.М. Полезность данных об ингибировании цитохрома Р450 in vitro для прогнозирования взаимодействия лекарственных средств. Журнал фармакологии и экспериментальной терапии. 2006;316(1):336–348. [PubMed: 16192315]
- Пирмохамед М., Парк Б.К. Генетическая предрасположенность к побочным реакциям на лекарства.Тенденции фармакологических наук. 2001;22(6):298–305. [PubMed: 11395158]
- Притчард Дж. К., Розенберг Н. А. Использование несцепленных генетических маркеров для выявления стратификации населения в ассоциативных исследованиях. Американский журнал генетики человека. 1999;65(1):220–228. [Бесплатная статья PMC: PMC1378093] [PubMed: 10364535]
- Quinn CT, Miller ST. Факторы риска и прогноз исходов у детей и подростков с серповидноклеточной анемией. Клиники гематологии/онкологии Северной Америки. 2004;18(6 спец.МКС): 1339–1354. [PubMed: 15511619]
- Rebbeck TR, Walker AH, Phelan CM, Godwin AK, Buetow KH, Garber JE, Narod SA, Weber BL. Определение этиологической гетерогенности рака молочной железы с использованием генетических биомаркеров. Прогресс в клинических и биологических исследованиях. 1997; 396: 53–61. [PubMed:89]
Rimoin DL, Connor JM, Pyeritz RE, Korf BR, редакторы. Принципы и практика медицинской генетики Эмери и Римуана. 4-е издание. Том. 2. Нью-Йорк: Черчилль Ливингстон; 2002.
- Риш, штат Нью-Джерси.Поиски генетических детерминант в новом тысячелетии. Природа. 2000;405(6788):847–856. [PubMed: 10866211]
- Саттен Г.А., Фландерс В.Д., Ян К. Учет неизмеряемой подструктуры населения в исследованиях генетической ассоциации случай-контроль с использованием новой модели латентного класса. Американский журнал генетики человека. 2001;68(2):466–477. [Бесплатная статья PMC: PMC1235279] [PubMed: 11170894]
- Sing CF, Stengard JH, Kardia SLR. Гены, окружающая среда и сердечно-сосудистые заболевания. Артериосклероз, тромбоз и сосудистая биология.2003; 23:1190–1196. [PubMed: 12730090]
Смит Г. Эпоха геномики: как технология ДНК меняет наш образ жизни и то, кто мы есть. Нью-Йорк: АМАКОМ; 2005.
- Стейнберг М.Х. Прогнозирование клинической тяжести при серповидноклеточной анемии. Британский журнал гематологии. 2005;129(4):465–481. [PubMed: 15877729]
- Стюарт М.Дж., Нагель Р.Л. Серповидно-клеточная анемия. Ланцет. 2004;364(9442):1343–1360. [PubMed: 15474138]
- Сиванен А.С. На пути к полногеномному генотипированию SNP.Генетика природы. 2005; (37 Дополнение): S5–S10. [PubMed: 15920530]
Томпсон М.В., Макиннес Р.Р., Уиллард, редакторы. Генетика Томпсона и Томпсона в медицине. 5-е издание. Филадельфия, Пенсильвания: WB. Компания Сондерс; 1991.
- Wacholder S, Rothman N, Caporaso N. Стратификация населения в эпидемиологических исследованиях распространенных генетических вариантов и рака: количественная оценка смещения. Журнал Национального института рака. 2000;92(14):1151–1158. [PubMed: 10
8]
- Wang X, Tomso DJ, Liu X, Bell DA.Однонуклеотидный полиморфизм в областях регуляции транскрипции и экспрессия экологически чувствительных генов. Токсикология и прикладная фармакология. 2005; 207 (2 Приложение): 84–90. [PubMed: 16002116]
- Ван З., Фан Х., Ян Х.Х., Ху И., Бутоу К.Х., Ли М.П. Сравнительный анализ последовательности импринтированных генов человека и мыши для выявления сигнатур импринтинга. Геномика. 2004;83(3):395–401. [PubMed: 14962665]
- Weinshilboum R. Наследование и ответ на лекарство. Медицинский журнал Новой Англии.2003;348(6):529–537. [PubMed: 12571261]
- Wu JH, Lo SK, Wen MS, Kao JT. Характеристика генетических вариаций аполипопротеина Е в тайваньской ассоциации с ишемической болезнью сердца и уровнями липидов в плазме. Человеческая биология. 2002;74(1):25–31. [PubMed: 11931577]
- Чжоу В., Лю Г., Миллер Д.П., Терстон С.В., Сюй Л.Л., Уэйн Дж.К., Линч Т.Дж., Су Л., Кристиани Д.К. Полиморфизм генов репарации ДНК XRCC1 и ERCC2, курение и риск развития рака легких. Эпидемиология рака, биомаркеры и профилактика.2003;12(4):359–365. [PubMed: 12692111]
- 1
SNP — это изменение последовательности ДНК, возникающее при изменении одного нуклеотида (A, T, C или G) в последовательности генома (Smith, 2005).
- 2
Ген-кандидат — это ген, белковый продукт которого участвует в метаболических или физиологических путях, связанных с конкретным заболеванием (IOM, 2005).
- 3
Пример серповидно-клеточной анемии взят из заказанной статьи, подготовленной Робертом Дж.Томпсон-младший, доктор философии. (Приложение Д).
- 4
Генетика и здоровье – гены, поведение и социальная среда
Хотя существует много возможных причин болезней человека, семейный анамнез часто является одним из сильнейших факторов риска таких распространенных заболеваний, как рак , сердечно-сосудистые заболевания (ССЗ), диабет, аутоиммунные заболевания и психические заболевания. Человек наследует полный набор генов от каждого родителя, а также широкий спектр культурного и социально-экономического опыта своей семьи.Семейный анамнез считается хорошим прогностическим фактором индивидуального риска заболевания, потому что члены семьи наиболее точно представляют уникальные геномные и экологические взаимодействия, с которыми сталкивается человек (Kardia et al., 2003). Унаследованная генетическая изменчивость внутри семьи явно вносит прямой и косвенный вклад в патогенез заболевания. В этой главе основное внимание уделяется тому, что известно или выдвигается в теории о прямой связи между генами и здоровьем, и тому, что еще предстоит изучить, чтобы понять взаимодействие с окружающей средой и относительную роль генов, влияющих на здоровье и болезнь.
ГЕНЕТИЧЕСКАЯ ВОСПРИИМЧИВОСТЬ
Уже более 100 лет генетики человека изучают, как вариации генов влияют на вариации риска заболевания. Эти исследования использовали два подхода. Первый подход фокусируется на идентификации отдельных генов с вариациями, которые вызывают простые менделевские модели наследования болезни (например, аутосомно-доминантный, аутосомно-рецессивный и сцепленный с Х-хромосомой) (см. Менделевское наследование у человека). Второй подход направлен на то, чтобы понять генетическую предрасположенность к болезням как следствие совместного действия многих генов.Каждый из этих подходов будет рассмотрен ниже.
ТАБЛИЦА 3-1
Онлайн-статистика менделевского наследования у человека (OMIM) (по состоянию на 15 мая 2006 г.), количество записей.
В целом, заболевания с простым менделевским типом наследования, как правило, относительно редки или часто редки, с началом в раннем возрасте, такие как фенилкетонурия, серповидно-клеточная анемия, болезнь Тея-Сакса и муковисцидоз. Кроме того, некоторые из этих генов связаны с экстремальными формами распространенных заболеваний, таких как семейная гиперхолестеринемия, которая вызывается мутациями в рецепторе липопротеинов низкой плотности (ЛПНП), которые предрасполагают людей к раннему развитию сердечных заболеваний (Браун и Гольдштейн). , 1981).
Другим примером менделевской наследственности являются семейные формы рака молочной железы, связанные с мутациями в генах BRCA1 и BRCA2, которые предрасполагают женщин к раннему развитию рака молочной железы и часто к раку яичников. Выявленные гены имеют мутации, которые часто обладают высокой пенетрантностью, то есть вероятность развития заболевания у носителей генотипа предрасположенности к заболеванию относительно высока (более 50 процентов). Эти генетические заболевания часто демонстрируют генетическое явление, известное как аллельная гетерогенность , , при котором множественные мутации в одном и том же гене (т.e., аллели) связаны с одним и тем же заболеванием. Эта аллельная неоднородность часто специфична для популяции и может отражать уникальную демографическую и мутационную историю популяции.
В некоторых случаях генетические заболевания также связаны с гетерогенностью локуса , что означает, что вредная мутация в любом из нескольких генов может привести к повышенному риску заболевания. Это открытие характерно для многих заболеваний человека, включая болезнь Альцгеймера и поликистозную болезнь почек.Как аллельная гетерогенность, так и гетерогенность локуса являются источниками изменчивости фенотипов этих заболеваний, поскольку они могут оказывать различное влияние на начало, прогрессирование и клиническую тяжесть заболевания.
Факторы окружающей среды также различаются у разных людей, и совокупный эффект неоднородности окружающей среды и генетической является этиологической неоднородностью. Этиологическая гетерогенность относится к феномену, который наблюдается в общей популяции, когда несколько групп случаев заболевания, таких как кластеры рака молочной железы, проявляют сходные клинические признаки, но на самом деле являются результатом различных событий или воздействий.Понимание этиологии конкретных заболеваний, а также идентификация возможных возбудителей облегчается путем обнаружения и изучения случаев заболевания, демонстрирующих этиологическую гетерогенность. Результаты этих исследований могут также выявить возможные взаимодействия между генами и взаимодействия между генами и окружающей средой, важные для процесса заболевания. Выявление этиологической гетерогенности может стать важным шагом на пути к анализу заболеваний с использованием методов молекулярной эпидемиологии и, в конечном итоге, может привести к улучшению стратегий профилактики заболеваний (Rebbeck et al., 1997).
В отличие от менделевского подхода, второй подход к изучению того, как вариации генов влияют на вариации риска заболевания, фокусируется на понимании генетической предрасположенности к заболеваниям как следствии совместного действия многих генов, каждый из которых оказывает воздействие от небольшого до умеренного ( т. е. полигенные модели болезни) и часто взаимодействуют друг с другом и с окружающей средой, приводя к распределению риска заболевания, наблюдаемому в популяции (т. е. многофакторные модели болезни).Этот подход использовался в первую очередь для понимания генетики врожденных дефектов и распространенных заболеваний, а также их факторов риска. Как описано ниже, для развития такого понимания требуется несколько шагов.
В качестве первого шага участников исследования просят предоставить подробный семейный анамнез для оценки наличия семейной агрегации. Если у лиц с рассматриваемым заболеванием больше родственников, пораженных этим заболеванием, чем у лиц без заболевания, идентифицируется семейная агрегация.Хотя семейная агрегация может быть объяснена генетической этиологией, она также может представлять воздействие (например, пестицидов, загрязненной питьевой воды или рациона), общее для всех членов семьи из-за вероятности общей среды.
При наличии признаков семейной агрегации вторым шагом является сосредоточение научных исследований на оценке наследственности заболевания и/или его факторов риска. Наследуемость определяется как доля изменчивости риска заболевания в популяции, связанная с неизмеряемыми генетическими вариациями, выведенными на основе семейных моделей заболевания.Это широкая популяционная мера генетического влияния, которая используется для определения того, оправданы ли дальнейшие генетические исследования, поскольку она позволяет исследователям проверить всеобъемлющую нулевую гипотезу о том, что никакие гены не участвуют в определении риска заболевания. Исследования близнецов и семейные исследования часто используются для изучения наследственности.
Исследования близнецов, сравнивающие изменчивость заболеваний и факторов риска у монозиготных и дизиготных близнецов, были распространенным дизайном исследований, используемым для простой оценки как генетической, так и культурной наследственности.Исследования монозиготных близнецов, воспитанных вместе, по сравнению с близнецами, воспитанными порознь, также сыграли важную роль в оценке как генетического, так и экологического вклада в модели наследования. Моделирование источников фенотипической изменчивости с использованием семейных исследований стало довольно сложным, что позволяет включать параметры модели для представления аддитивного генетического компонента (т. е. полигенов), неаддитивного генетического компонента (т. е. и межгенные взаимодействия), общая семейная среда и индивидуальная среда.Было показано, что вклад этих факторов зависит от возраста и населения.
Когда установлены существенные доказательства генетической причастности, следующим шагом является определение ответственных генов и мутаций, связанных с повышенным или пониженным риском, с использованием либо анализа генетического сцепления, либо исследований генетической ассоциации. Например, при изучении врожденных дефектов это часто связано с поиском хромосомных делеций, вставок, дупликаций или транслокаций.
АНАЛИЗ ГЕНЕТИЧЕСКОГО СЦЕПЛЕНИЯ И ИССЛЕДОВАНИЯ ГЕНЕТИЧЕСКОЙ АССОЦИАЦИИ
Геном человека состоит из десятков тысяч генов.Имея на выбор около 30 000 генов, сопоставление конкретного гена или группы генов с соответствующим заболеванием человека требует методического подхода, состоящего из многих этапов. Традиционно процесс открытия генов начинается с анализа сцепления, который оценивает заболевание внутри семьи. За анализом сцепления обычно следуют исследования генетической ассоциации, которые оценивают заболевание в семьях или среди неродственных людей.
Генетический анализ сцепления
Термин сцепление относится к тенденции генов, проксимально расположенных на одной и той же хромосоме, наследоваться вместе.Анализ сцепления является одним из шагов в поиске гена предрасположенности к заболеванию. Цель этого анализа состоит в том, чтобы приблизить расположение гена болезни по отношению к известному генетическому маркеру, применяя понимание моделей сцепления. Традиционный анализ сцепления, который отслеживает закономерности наследственности как фенотипа заболевания, так и генетических маркеров в больших семьях с высоким риском, использовался для обнаружения генных мутаций, вызывающих заболевание, таких как ген рака молочной железы (BRCA1) на хромосоме 17 (Hall et al., 1990).
Поскольку тип наследования часто не ясен для распространенных заболеваний, был разработан альтернативный подход к классическому анализу сцепления, чтобы извлечь выгоду из основного генетического принципа, согласно которому братья и сестры в среднем разделяют половину своих аллелей. Изучая степень общего аллеля в их геномах, пары пораженных братьев и сестер (т. е. двух или более братьев и сестер с одним и тем же заболеванием) можно использовать для идентификации хромосомных областей, которые могут содержать гены, вариации которых связаны с изучаемым заболеванием.Если многочисленные пары братьев и сестер, пораженные интересующим заболеванием, обнаруживают большее, чем ожидалось, совместное использование известных аллелей используемого полиморфного генетического маркера, то генетический маркер, вероятно, будет сцеплен (то есть находится в непосредственной близости вдоль хромосомы) с ген восприимчивости, ответственный за изучаемое заболевание. Чтобы найти хромосомные области, демонстрирующие доказательства сцепления, с использованием этого метода пар пораженных братьев и сестер обычно требуется типирование множества пораженных родственных братьев с сотнями высокополиморфных маркеров, равномерно расположенных вдоль генома человека (Mathew, 2001).
Этот подход широко используется для выявления областей генома, которые, как считается, способствуют возникновению распространенных хронических заболеваний. Однако результаты анализа сцепления не были последовательно воспроизведены. Неспособность успешно воспроизвести данные о сцеплении может быть результатом недостаточной статистической мощности (то есть включения недостаточного количества пар братьев и сестер с интересующим заболеванием) или результатов, которые включали ложноположительные результаты в исходном исследовании. Альтернативным объяснением могло бы быть то, что разные популяции подвержены влиянию других генов восприимчивости, чем те, которые изучались первоначально (Mathew, 2001).Без последовательного повторения результатов преждевременно делать выводы о вкладе локуса гена в конкретное заболевание.
После подтверждения связи исследователи могут начать поиск в регионе гена-кандидата восприимчивости. Поиск единственного гена предрасположенности к распространенным заболеваниям часто включает исследование очень больших областей сцепления, содержащих от 20 до 30 миллионов пар оснований и потенциально сотни генов (Mathew, 2001). Однако также важно отметить, что, хотя картирование сцепления является мощным инструментом для поиска генов менделевских болезней, оно часто дает слабые и иногда непоследовательные сигналы в исследованиях сложных заболеваний, которые могут быть многофакторными.Исследования сцепления наиболее эффективны при наличии единственного аллеля чувствительности в любом данном локусе болезни и, как правило, неэффективны при значительной генетической гетерогенности.
Генетические ассоциативные исследования
Технологические достижения в высокопроизводительном генотипировании позволили проводить прямое изучение специфических генетических различий среди значительного числа людей. Методы генетической ассоциации часто являются наиболее эффективным подходом для оценки того, как конкретные генетические вариации могут влиять на риск заболевания.Генетические ассоциативные исследования, которые использовались в течение десятилетий, постоянно совершенствовались с точки зрения разработки новых дизайнов исследований (таких как ассоциативные дизайны, основанные только на случаях и на основе семей), новых систем генотипирования (таких как генотипирование на основе массивов и мультиплексные тесты). ), и новые методы, используемые для устранения предубеждений, таких как население (Haines and Pericak-Vance, 1998).
Анализ влияния генетической изменчивости обычно включает сначала обнаружение полиморфизмов одиночных нуклеотидов (SNP) 1 , а затем анализ этих вариаций в образцах из популяций.SNP встречаются в среднем примерно через каждые 500–2000 оснований в геноме человека. Наиболее распространенный подход к обнаружению SNP заключается в секвенировании интересующего гена в репрезентативной выборке людей. В настоящее время секвенирование полных генов у небольшого числа людей (примерно от 25 до 50) может выявить полиморфизмы, встречающиеся у 1–3 процентов населения, с достоверностью примерно 95 процентов. Программа обнаружения полиморфизма ДНК человека в рамках проекта «Экологический геном» Национального института наук об окружающей среде является одним из примеров применения технологий автоматизированного секвенирования ДНК для выявления SNP в генах человека, которые могут быть связаны с восприимчивостью к болезням и реакцией на окружающую среду (Livingston et al. ., 2004). Программы Национального института сердца, легких и крови в области геномных приложений также привели к значительному расширению наших знаний о распределении SNP в ключевых генах, которые, как считается, уже биологически связаны с риском заболевания (т. е. биологические гены-кандидаты 2 ).
Впечатляющие и быстрые достижения в технологии анализа SNP быстро переопределяют возможности обнаружения, картирования и генотипирования SNP. Новая технология генотипирования на основе массивов позволяет анализировать «ассоциацию всего генома» SNP между отдельными людьми или между штаммами видов лабораторных животных (Syvanen, 2005).Массивы, используемые для этих анализов, могут представлять сотни тысяч SNP, нанесенных на карту в геноме (Klein et al., 2005; Hinds et al., 2005; Gunderson et al., 2005). Этот подход позволяет быстро идентифицировать SNP, связанные с заболеванием и восприимчивостью к факторам окружающей среды. Сила этой технологии заключается в огромном количестве легко поддающихся измерению генетических вариаций, которые она предоставляет исследователям с минимальными затратами (от 500 до 1000 долларов за чип). Критерии выбора SNP для включения в эти массивы являются важным фактором, поскольку они влияют на выводы, которые можно сделать на основе этих платформ.Конечно, лучшим инструментом для обнаружения SNP и генотипирования является индивидуальное секвенирование всего генома. Несмотря на то, что в настоящее время это невозможно, быстрое развитие технологий, которое в настоящее время стимулируется проектом Национального исследовательского института генома человека «Геном стоимостью 1000 долларов», вероятно, сделает этот подход оптимальным для обнаружения SNP и генотипирования в будущем.
Имея возможность изучать большое количество генетических вариаций, исследователи переходят от исследования отдельных генов по одному к рассмотрению целых путей или физиологических систем, которые включают информацию с геномного, транскриптомного, протеомного и метабономического уровней, которые все они подвержены различным факторам окружающей среды (Haines and Pericak-Vance, 1998).Тем не менее, эти проекты исследований и аналитические методы, основанные на изучении генома и путей, все еще находятся на ранних стадиях разработки и потребуют совместных усилий многих дисциплин, от молекулярных биологов до клиницистов, социологов и биоинформатиков, чтобы максимально использовать их. эффективное использование этих огромных объемов данных.
ГЕН-ОКРУЖАЮЩАЯ СРЕДА И ГЕН-ГЕННЫЕ ВЗАИМОДЕЙСТВИЯ
Изучение взаимодействий ген-среда и ген-ген представляет собой широкий класс исследований генетических ассоциаций, сосредоточенных на понимании того, как генетическая изменчивость человека связана с различными реакциями на воздействия окружающей среды и с различными эффектами в зависимости от вариаций других генов.Чтобы проиллюстрировать концепцию взаимодействия генов с окружающей средой, ниже приводится обзор недавних исследований, выявляющих генетические мутации, которые, по-видимому, связаны с дифференциальной реакцией на сигаретный дым и ее связью с раком легких. Табачный дым содержит широкий спектр химических канцерогенов, которые могут вызвать повреждение ДНК. Существует несколько путей репарации ДНК, которые действуют для восстановления этого повреждения, и гены этого пути являются главными биологическими кандидатами для понимания того, почему у одних курильщиков развивается рак легких, а у других нет.В исследовании Zhou et al. (2003), вариации в двух генах, ответственных за репарацию ДНК, были исследованы на предмет их потенциального взаимодействия с уровнем курения сигарет и сопутствующей связи с раком легких. Вкратце, одна предположительно функциональная мутация в гене XRCC1 (группа 1 перекрестной комплементарности при рентгенологическом исследовании) и две предположительно функциональные мутации в гене ERCC2 (группа 2 перекрестной комплементарной репарации эксцизионной репарации) были генотипированы в 1091 случае рака легкого и 1240 контрольных больных. Когда случаи и контрольные группы были разделены на заядлых курильщиков и некурящих, Zhou et al.(2003) обнаружили, что у некурящих с мутантным генотипом XRCCI риск развития рака легких в 2,4 раза выше, чем у некурящих с нормальным генотипом. Напротив, у заядлых курильщиков с мутантным генотипом XRCCI риск рака легких был снижен на 50% по сравнению с их сверстниками с более частым нормальным генотипом. Когда три мутации из этих двух генов были исследованы вместе в крайнем сочетании генотипов (индивидуум с пятью или шестью мутациями, присутствующими в его/ее генотипе), было получено число 5.В 2 раза выше риск развития рака легких у некурящих и на 70 процентов снижение риска у заядлых курильщиков по сравнению с людьми без мутаций. Защитный эффект этих генетических вариаций у заядлых курильщиков может быть вызван дифференцированным повышением активности этих защитных генов, стимулируемым заядлым курением. Подобные типы взаимодействий ген-курение также были обнаружены для других генов этого пути, таких как ERCC1. Эти исследования иллюстрируют важность выявления генетических вариаций, связанных с дифференциальным риском заболеваний, связанных с поведением человека.Обратите внимание, что этот тип исследования также поднимает множество различных этических и социальных вопросов, поскольку он определяет уязвимые подгруппы и защищенные подгруппы субъектов как по генетическим, так и по человеческим поведенческим слоям (см. главу 10).
Исследование Zhou et al. (2003) также демонстрирует увеличение объема информации, полученной при совместном изучении влияния множественных мутаций на заболевания, связанные с токсичностью. Другие исследования мутаций в генах, участвующих в метаболизме фазы II (GSTM1, GSTT1, GSTP1), также продемонстрировали важность изучения совместных эффектов мутаций (Miller et al., 2002) о риске рака. Хотя эти два исследования были сосредоточены на аддитивных эффектах нескольких генов, межгенные взаимодействия являются еще одним важным компонентом для лучшего понимания восприимчивости человека к болезням и взаимодействиям с окружающей средой.
Чтобы адекватно понять континуум геномной восприимчивости к факторам окружающей среды, влияющим на здоровье населения, необходимо провести дополнительные исследования совместных эффектов множественных мутаций. Успехи биоинформатики могут сыграть ключевую роль в этом начинании.Например, методы скрининга баз данных SNP на наличие мутаций в регуляторных областях транскрипции могут быть использованы как для обнаружения, так и для функциональной проверки полиморфных регуляторных элементов, таких как антиоксидантный регуляторный элемент, обнаруженный в промоторных областях многих генов, кодирующих антиоксидантные ферменты и ферменты детоксикации фазы II. Ван и др., 2005). Методы сравнительного анализа последовательностей также становятся все более ценными для генетических исследований человека, поскольку они позволяют ранжировать SNP по порядку с точки зрения их потенциально вредного воздействия на функцию белка или регуляцию генов (Wang et al., 2004). Методы проведения крупномасштабного анализа несинонимичных SNP для прогнозирования того, нарушает ли конкретная мутация функцию белка (Clifford et al., 2004), могут помочь в выборе SNP для генетико-эпидемиологических исследований и могут быть использованы для оптимизации функционального анализа мутаций, которые, как обнаружено, быть статистически связаны с дифференциальной реакцией на факторы окружающей среды, такие как диета, стресс и социально-экономические факторы.
МЕХАНИЗМЫ ЭКСПРЕССИИ ГЕН
Выявление генов, вариации которых связаны с болезнью, — это только первый шаг в установлении связи между генетикой и здоровьем.Понимание механизмов экспрессии гена и того, как на него влияют другие гены, белки и окружающая среда, становится все более важным для разработки профилактических, диагностических и терапевтических стратегий.
Когда экспрессируются гены, хромосомная ДНК должна транскрибироваться в РНК, а затем РНК обрабатывается и транспортируется для трансляции в белок. Регуляция экспрессии генов является жизненно важным процессом в клетке и включает организацию хромосомной ДНК в соответствующую структуру хроматина более высокого порядка.Он также включает в себя действие множества специфических белковых факторов (поощряющих или подавляющих экспрессию генов), которые могут действовать на разных этапах пути экспрессии генов.
Во всех организмах сети биохимических реакций и сигналов обратной связи организуют пути развития, клеточный метаболизм и продвижение по клеточному циклу. Общая координация клеточного цикла и клеточного метаболизма является результатом контроля прямой и обратной связи, возникающего из набора зависимых путей, в которых инициация событий зависит от более ранних событий.В этих сетях экспрессия генов контролируется молекулярными сигналами, которые регулируют, когда, где и как часто транскрибируется данный ген. Эти сигналы часто стимулируются влиянием окружающей среды или сигналами от других клеток, которые влияют на экспрессию многих генов посредством одного регуляторного пути. Поскольку регуляторный ген может действовать в сочетании с другими сигналами, чтобы контролировать многие другие гены, возможны сложные разветвленные сети взаимодействий (McAdams and Arkin, 1997).
Генная регуляция имеет решающее значение, поскольку, включая или выключая гены, когда это необходимо, клетки могут реагировать на изменения в окружающей среде (например,g., изменения в диете или активности) и может предотвратить растрату ресурсов. Таким образом, вариации в последовательностях ДНК, связанные с регуляцией экспрессии гена, являются вероятными кандидатами для понимания взаимодействий ген-среда на молекулярном уровне, поскольку эти вариации будут влиять на то, будет ли сигнал окружающей среды, передаваемый в ядро, успешно связываться с последовательностью промотора в генах. гена и стимулировать или подавлять экспрессию гена. Комбинация геномных технологий для генотипирования SNP с массивами экспрессии генов высокой плотности в исследованиях на людях только недавно прояснила степень, в которой может происходить этот тип взаимодействия молекулярного гена с окружающей средой.
Клетки также регулируют экспрессию генов посредством посттранскрипционной модификации; позволив только части мРНК перейти к трансляции; или путем ограничения трансляции конкретных мРНК только тогда, когда и где необходим продукт. Генетические факторы, влияющие на посттранскрипционный контроль, гораздо труднее изучить, поскольку они часто включают мультибелковые комплексы, которые нелегко извлечь или проанализировать из клеток. На других уровнях клетки регулируют экспрессию генов с помощью эпигенетических механизмов, включая фолдинг ДНК, ацетилирование гистонов и метилирование (т.д., химическая модификация) нуклеотидных оснований. На эти механизмы, вероятно, влияют генетические вариации генов-мишеней, а также вариации, проявляющиеся в транслируемых клеточных регуляторных белках. Генная регуляция происходит на протяжении всей жизни на всех уровнях развития и старения организма.
Классическим примером онтогенетического контроля экспрессии генов является дифференциальная экспрессия эмбриональных, фетальных и взрослых генов гемоглобина (см. вставку 3-1). Регуляция генов эпсилон, дельта, гамма, альфа и бета происходит посредством метилирования ДНК, которое строго контролируется сигналами развития.Во время развития большое количество генов включается и выключается посредством эпигенетической регуляции. Одной из самых быстрорастущих областей генетики является изучение последствий воздействия окружающей среды на паттерны экспрессии генов и влияние генетических вариаций на эти траектории развития.
ВСТАВКА 3-1
Экспрессия генов и глобины. Производство гемоглобина регулируется рядом механизмов транскрипционного контроля, таких как переключение, которое диктует экспрессию разного набора генов глобина в разных частях тела на разных стадиях (см…)
Пример моногенного заболевания со значительной клинической вариабельностью: серповидно-клеточная анемия
3Серповидно-клеточная анемия относится к аутосомно-рецессивному заболеванию крови, вызванному вариантом гена β-глобина, называемым серповидно-клеточным гемоглобином ( Гб С). Замена одного нуклеотида (T→A) в шестом кодоне гена β-глобина приводит к замене валина на глутаминовую кислоту (GTG→GAG), что может вызвать полимеризацию Hb S (формирование длинных цепей) при дезоксигенировании (Stuart и Нагель, 2004).Считается, что человек, унаследовавший две копии Hb S (Hb SS), страдает серповидноклеточной анемией , в то время как человек, унаследовавший одну копию Hb S плюс еще один вредный вариант β-глобина (например, Hb C или Hb β-талассемия), считается больным серповидноклеточной болезнью . Человек считается носителем серповидноклеточного признака, если у него есть одна копия нормального гена β-глобина и одна копия серповидного варианта (Hb AS) (Ashley-Koch et al., 2000).
Были идентифицированы четыре основных гаплотипа гена β-глобина.Три названы в честь регионов Африки, где впервые появились мутации: BEN (Бенин), SEN (Сенегал) и CAR (Центральноафриканская Республика). Четвертый гаплотип, арабо-индийский, встречается в Индии и на Аравийском полуострове (Quinn and Miller, 2004).
Тяжесть заболевания связана с несколькими генетическими факторами (Ashley-Koch et al., 2000). Самая высокая степень тяжести связана с Hb SS, за ней следуют Hb s/β0-талассемия и Hb SC. Hb S/β + -талассемия связана с более доброкачественным течением заболевания (Ashley-Koch et al., 2000). Тяжесть заболевания также связана с гаплотипами β-глобина, вероятно, из-за различий в уровне гемоглобина и концентрации фетального гемоглобина. Гаплотип Сенегала является наиболее доброкачественной формой, за ним следует гаплотип Бенина, а гаплотип Центральноафриканской Республики является наиболее тяжелой формой (Ashley-Koch et al., 2000).
Таким образом, хотя серповидноклеточная анемия является моногенетическим заболеванием, ее фенотипическое проявление мультигенно (см. Приложение D). Существуют две кардинальные патофизиологические особенности серповидно-клеточной анемии — хроническая гемолитическая анемия и вазоокклюзия.Двумя основными последствиями гипоксии, вторичной по отношению к вазоокклюзионному кризу, являются боль и повреждение систем органов. Органы, подверженные наибольшему риску, — это органы с медленным кровотоком, такие как селезенка и костный мозг, или органы с ограниченным терминальным артериальным кровоснабжением, включая глаз, головку бедренной кости и плечевую кость, а также легкие. реципиент дезоксигенированных серповидных клеток, вышедших из селезенки или костного мозга. Основные клинические проявления серповидно-клеточной анемии включают болевые ощущения, острый грудной синдром, дисфункцию селезенки и нарушения мозгового кровообращения.
Усилия по совершенствованию клинической помощи сосредоточены на углублении нашего понимания патофизиологии серповидно-клеточной анемии, чтобы облегчить точный прогноз и индивидуализированное лечение. Необходимы знания о том, какие гены связаны с гемолитическими и сосудистыми осложнениями серповидно-клеточной анемии и как варианты этих генов взаимодействуют между собой и с окружающей средой (Steinberg, 2005).
АСПЕКТЫ ЗДОРОВЬЯ ПОД ВЛИЯНИЕМ ГЕНЕТИКИ
Поскольку каждая клетка в организме, за редким исключением, несет полный геном, полный вариаций, в качестве шаблона для развития своего белкового аппарата, можно утверждать, что генетическая изменчивость влияет на все клеточные, биохимические, физиологические и морфологические аспекты человеческого существа.То, как эти генетические вариации связаны с конкретным риском заболевания, находится в центре внимания многих текущих исследований. В отношении распространенных заболеваний, таких как сердечно-сосудистые заболевания, гипертония, рак, диабет и многие психические заболевания, растет понимание того, что разные гены и разные генетические вариации могут быть вовлечены в различные аспекты их естественного течения. Например, могут быть гены, вариации которых связаны с предрасположенностью к возникновению заболевания, и другие гены или вариации генов, которые участвуют в прогрессировании заболевания до клинически определенной конечной точки.Кроме того, совершенно другой набор генов может быть задействован в том, как человек реагирует на фармацевтическое лечение этого заболевания. Также, вероятно, будут гены, изменчивость которых контролирует, насколько человек может реагировать на факторы риска окружающей среды, связанные с риском заболевания. Наконец, считается, что существуют гены, влияющие на общую продолжительность жизни человека, которые могут противодействовать или взаимодействовать с генами, которые в противном случае могут предрасполагать этого человека к конкретному исходу болезни и, таким образом, могут оказывать дополнительное влияние на выживаемость.
Во многих отношениях мы только в начале пути к истинному пониманию того, как геномные вариации вызывают восприимчивость к болезням. Действительно, многие могут возразить, что без учета столь же важной роли окружающей среды мы никогда полностью не поймем роль генетики в здоровье. По мере прогресса в использовании новых технологий для измерения биологической изменчивости в геноме, транскриптоме, протеоме и метабономе нам, вероятно, придется внести большие изменения в наши концептуальные рамки о роли генов в заболевании.Глобальные паттерны геномной восприимчивости, вероятно, проявятся только тогда, когда мы рассмотрим влияние многих взаимодействующих компонентов, работающих одновременно, которые зависят от таких контекстов, как возраст, пол, диета и физическая активность, которые изменяют отношения с риском. По большей части мы все еще находимся на стадии документирования сложности, поиска примеров и типов генов генетической предрасположенности, понимания гетерогенности болезней и постулирования способов разработки моделей риска, использующих всю совокупность того, что мы знаем о биологии человека, начиная с наши геномы к нашей экологии для моделирования риска.
Сердечно-сосудистые заболевания (ССЗ)
Изучение сердечно-сосудистых заболеваний может быть использовано для иллюстрации проблем, возникающих при использовании генетической информации для понимания этиологии наиболее распространенных хронических заболеваний, а также для выявления тех, кто подвергается наибольшему риску развития эти заболевания. Большинство случаев сердечно-сосудистых заболеваний имеют сложную многофакторную этиологию, и даже полное знание генетической структуры человека не может с уверенностью предсказать начало, прогрессирование или тяжесть заболевания (Sing et al., 2003). Болезнь развивается как следствие взаимодействий между генотипом человека и воздействием факторов окружающей среды, которые влияют на сердечно-сосудистые фенотипы, начиная с зачатия и продолжаясь в течение всей взрослой жизни. Исследования сердечно-сосудистых заболеваний выявили множество агентов окружающей среды с высоким риском и сотни генов, каждый из которых имеет множество вариаций, которые, как считается, влияют на риск заболевания. По мере увеличения числа взаимодействующих агентов будет обнаруживаться меньшее число случаев заболевания, имеющих ту же этиологию и ассоциированных с определенным генотипом (Sing et al., 2003). Множество механизмов обратной связи и взаимодействия агентов из генома через промежуточные биохимические и физиологические подсистемы с воздействием агентов окружающей среды способствуют возникновению клинического фенотипа данного индивидуума. При попытке разобраться в относительном вкладе генов и окружающей среды в ССЗ необходимо учитывать большое количество факторов, от влияния генов на уровень холестерина (например, уровень ЛПНП) до психосоциальных факторов, таких как стресс и гнев. Хотя в инициацию, прогрессирование и клинические проявления ССЗ вовлечены сотни генов, относительно мало известно о том, как окружающая среда человека взаимодействует с этими генами, нарушая баланс между атерогенными и антиатерогенными процессами, которые приводят к клинически проявляющимся ССЗ. .См. главы 4 и 6 для дальнейшего обсуждения влияния социальной среды на сердечно-сосудистые заболевания.
Хорошо известно, что многие социальные и поведенческие факторы, от социально-экономического положения, стресса на работе и депрессии до курения, физических упражнений и диеты, влияют на риск сердечно-сосудистых заболеваний (более подробное обсуждение этих факторов см. в главах 2, 3 и 6). ). По мере того, как все больше исследований взаимодействия генов и окружающей среды рассматривают эти факторы как часть «окружающей среды», которые исследуются в сочетании с генетическими вариациями, возникает множество интеллектуальных и методологических проблем.Во-первых, как воплощены социальные факторы, так что взаимодействие с определенным генотипом может быть связано с дифференцированным риском? Во-вторых, как мы можем обрабатывать сложные взаимодействия, чтобы ответить на такие вопросы, как, например, как генотип человека влияет на его/ее поведение? Например, генетическая предрасположенность к никотиновой зависимости на самом деле является фактором риска сердечно-сосудистых заболеваний, и ее влияние на риск сердечно-сосудистых заболеваний может зависеть от взаимодействия с другими генетическими факторами.
Фармакогенетика
Хорошо известно, что люди часто по-разному реагируют на одну и ту же лекарственную терапию.Процесс утилизации лекарств представляет собой сложный набор физиологических реакций, которые начинаются сразу после введения. Лекарство всасывается и распределяется по целевым областям тела, где оно взаимодействует с клеточными компонентами, такими как рецепторы и ферменты, которые далее метаболизируют лекарство, и в конечном итоге лекарство выводится из организма (Weinshilboum, 2003). В любой момент этого процесса генетическая изменчивость может изменить терапевтический ответ человека и вызвать нежелательную лекарственную реакцию (ADR) (Evans and McLeod, 2003).Было подсчитано, что от 20 до 95 процентов вариаций в распределении лекарств, таких как НЛР, могут быть связаны с генетической изменчивостью (Kalow et al., 1998; Evans and McLeod, 2003).
Чувствительность как к дозозависимым, так и к дозонезависимым НЛР может иметь корни в генетической изменчивости. Полиморфизмы кинетических и динамических факторов, таких как цитохром P450 и специфические мишени для лекарственных средств, могут вызывать у этих людей предрасположенность к НЛР. Хотя характеристики ADR определяют истинное значение этих факторов, в большинстве случаев задействованы несколько генов (Pirmohamed and Park, 2001).Будущие анализы с использованием полногеномного профилирования SNP могут предоставить метод для оценки нескольких факторов генетической предрасположенности к ADR и установления их совместных эффектов. Одной из проблем изучения взаимосвязи между генетической изменчивостью и нежелательными реакциями является недостаточное количество образцов пациентов. Чтобы решить эту проблему, Pirmohamed and Park (2001) предложили, чтобы проспективные рандомизированные контролируемые клинические испытания стали частью стандартизированной практики, чтобы в конечном итоге доказать клиническую полезность генотипирования всех пациентов в качестве меры предотвращения побочных реакций.
Здесь мы рассмотрим некоторые текущие работы в области фармакогенетики в качестве примера того, что можно ожидать от тщательного изучения взаимодействия между социальными, поведенческими и генетическими факторами. Исследователи представили несколько хорошо зарекомендовавших себя примеров различий в индивидуальном ответе на лекарство, которые объясняются генетическими вариациями различных клеточных механизмов распределения лекарств, таких как переносчики лекарств или ферменты, ответственные за метаболизм лекарств (Evans and McLeod, 2003).Например:
- Зная, что ген HER2 гиперэкспрессируется примерно в четверти случаев рака молочной железы, исследователи разработали гуманизированное моноклональное антитело против рецептора HER2 в надежде ингибировать рост опухоли, связанной с рецептором. Генотипирование больных раком молочной железы на поздних стадиях для выявления опухолей с повышенной экспрессией рецептора HER2 дало многообещающие результаты в улучшении клинических исходов у этих больных раком молочной железы (Cobleigh et al., 1999).
- Терапевтический класс препаратов, называемых тиопуринами, используется как часть схемы лечения острого лимфобластного лейкоза у детей. Один из 300 представителей европеоидной расы имеет генетическую вариацию, которая приводит к низким или отсутствующим уровням тиопуринметилтрансферазы (TPMT), фермента, ответственного за метаболизм тиопуриновых препаратов. Если пациентам с этой генетической вариацией дают тиопурины, препарат накапливается в их организме до токсического уровня, вызывая опасную для жизни миелосупрессию.Оценка фенотипа и генотипа TPMT пациента может быть использована для определения индивидуальной дозы препарата (Armstrong et al., 2004).
- Семейство ферментов печени, называемых цитохромами P450, играет важную роль в метаболизме до 40 различных типов лекарств. Генетические варианты этих ферментов могут снижать их способность эффективно расщеплять определенные лекарственные средства, что может привести к передозировке у пациентов с менее активными или неактивными формами фермента цитохрома Р450.Различные уровни сниженной активности цитохрома Р450 также вызывают беспокойство у пациентов, принимающих несколько препаратов, которые могут взаимодействовать, если они не метаболизируются должным образом хорошо функционирующими ферментами. Были разработаны стратегии для оценки уровня активности ферментов цитохрома Р450, которые полезны при планировании и мониторинге успешной медикаментозной терапии. Некоторые испытания фармацевтических препаратов в настоящее время включают ранние тесты, которые оценивают способность различных форм цитохрома Р450 метаболизировать новое лекарственное соединение (Obach et al., 2006).
Некоторые исследования в области фармакогенетики были сосредоточены на лечении психических расстройств. С появлением класса препаратов, известных как селективные ингибиторы обратного захвата серотонина (СИОЗС), фармакологическое лечение многих психических расстройств резко изменилось. СИОЗС предлагают значительные улучшения по сравнению с предыдущим поколением лечения, включая улучшенную эффективность и переносимость для многих пациентов. Однако не все пациенты положительно реагируют на лечение СИОЗС, и у многих возникают нежелательные реакции.Новые фармакогенетические исследования показали, что эти нежелательные реакции могут быть результатом генетических вариаций генов переносчиков серотонина и генов цитохрома Р450. Необходимы дальнейшие исследования и повторение этих результатов. Если характеристика генетических вариаций будет завершена и полностью понята, станет возможным скрининг и мониторинг пациентов с использованием методов генотипирования для создания индивидуальной лекарственной терапии, аналогичной тем, которые обсуждались выше (Mancama and Kerwin, 2003).
Серьезной проблемой для разработки индивидуальной лекарственной терапии является часто полигенный или многофакторный наследственный компонент ответа на лекарственные средства.Выделение полигенных детерминант реакции на лекарство является серьезной задачей. Основой всех исследований должно быть хорошее понимание механизма действия препарата, путей его метаболизма и распределения. Эти знания могут помочь в проведении полногеномных поисков генных вариаций, связанных с эффектами наркотиков, и последующих подходов к исследованию генов-кандидатов. Кроме того, протеомные исследования и профилирование экспрессии генов также являются важными способами подтверждения и понимания механизмов действия интересующего гена, влияющих на индивидуальную реакцию на препарат (Evans and McLeod, 2003).Недостаточно показать ассоциацию; характеристика лежащих в основе биологических механизмов является важным компонентом перемещения генетических данных в область снижения риска. Еще одним ключевым компонентом использования генетики для улучшения профилактики и снижения заболеваемости является понимание распределения генетических вариаций в обслуживаемом населении.
ГЕНЕТИКА ПОПУЛЯЦИЙ, СВЯЗАННАЯ С ЗДОРОВЬЕМ И БОЛЕЗНЬЮ
Человеческие популяции различаются по распределению генетических вариаций.Это следствие их исторических моделей мутаций, миграции, размножения, спаривания, отбора и генетического дрейфа. Унаследованные мутации обычно возникают во время гаметогенеза у одного человека, а затем могут передаваться потомству в течение многих поколений. Станет ли эта мутация преобладающим полиморфизмом (т. е. мутацией с популяционной частотой более 1 %), определяется как эволюционными силами, так и случайными событиями. Например, это зависит от того, доживет ли первоначальный ребенок, унаследовавший мутацию, до зрелого возраста и размножится, доживут ли дети этого ребенка до размножения и так далее.Количество детей в семье также влияет на распространенность мутации, и это часто связано с факторами окружающей среды, влияющими на фертильность и модели спаривания, которые влияют на скорость, с которой частная мутация становится общедоступным полиморфизмом. Есть хорошо известные примеры так называемых мутаций-основателей, в которых эта траектория может быть задокументирована. Например, один конкретный район на территории современного Квебека (Канада) изначально был основан всего несколькими семьями из определенной французской провинции.Один из отцов-основателей имел делецию размером 10 т.п.н. в своем гене рецептора ЛПНП (LDL-R), которая быстро передавалась из поколения в поколение, и сегодня ее носит 1 из 154 французских канадцев на северо-востоке Квебека. Эта мутация связана с семейной гиперхолестеринемией, а среди французских канадцев распространенность этого заболевания одна из самых высоких в мире из-за малочисленности исходной популяции, за которой следует расширение популяции (Moorjani et al., 1989).
Существует также ряд примеров, когда мутации, возникающие у индивидуума, становятся более распространенными из-за избирательного преимущества, которое они придают своим носителям.Наиболее известным примером является мутация, связанная с серповидноклеточной анемией. Географический образец этой мутации точно отражает географический образец малярийной инфекции. Молекулярно было продемонстрировано, что люди, несущие серповидноклеточную мутацию, обладают устойчивостью к малярийной инфекции. Поскольку многие факторы отбора, которые могли привести к нынешнему распределению мутаций в отдельных популяциях, относятся к нашему эволюционному прошлому, трудно оценить, насколько вариации внутри популяций или между популяциями обусловлены этими типами сил отбора.
Еще одной важной силой, определяющей распространение генетических вариаций внутри и между человеческими популяциями, является их миграция и репродуктивная изоляция. Согласно нашим лучшим знаниям, один из самых важных периодов в эволюции человека произошел примерно 100 000 лет назад, когда часть людей мигрировала на другие континенты из африканского бассейна и основала новые сообщества с относительной репродуктивной изоляцией. Генетические различия между людьми в разных географических районах на протяжении сотен лет связывались с концепцией расы.Хотя раса по-прежнему используется в качестве ярлыка, первоначальная концепция расы как генетически отличного подвида людей была отвергнута современной генетической информацией. По многим причинам, обсуждаемым в разделе ниже, более уместно переосмыслить старую генетику расы в более точную генетику предков.
Помимо отдаленных эволюционных моделей миграции, более современные модели миграции также оказали глубокое влияние на генетику популяций. Например, нынешнее население Соединенных Штатов и большей части Северной Америки генетически очень разнообразно в результате смешения многих людей из разных стран и континентов.
Основная причина изучения происхождения и природы генетической изменчивости человека заключается в том, что сходства и различия в типе и частоте генетических вариаций внутри и между популяциями могут оказать глубокое влияние на исследования, пытающиеся понять влияние генов на болезни риск. Например, некоторые генетические вариации, такие как полиморфизм белка аполипопротеина Е, встречаются в каждой популяции и имеют очень схожие частоты генотипов по всему миру (Wu et al., 2002; Дениз Наранхо и др., 2004). Связь вариации с учащением сердечных заболеваний и болезнью Альцгеймера может быть проверена и проверена во многих популяциях мира. Другие мутации, такие как делеция 10 т.п.н. в гене LDL-R, описанная выше, являются более специфичными для популяции вариациями.
Более того, со статистической точки зрения влияние генетической вариации на континуум риска, обнаруживаемой в любой популяции, коррелирует с ее частотой. Например, распространенные генетические полиморфизмы с частотой около 50 процентов не могут быть связаны с большими фенотипическими эффектами в популяции, потому что каждый класс генотипа представляет собой большую часть популяции, и, поскольку большая часть риска распределяется нормально, средний риск высокораспространенного генотипа класс не может отклоняться от общего риска населения в какой-либо значительной степени.Эта корреляция между частотой генотипа и эффектом не означает, что общие вариации не могут быть значительными в их эффектах. Статистическая значимость связи между генетическим вариантом и заболеванием является совместной функцией размера выборки и размера эффекта. Кроме того, генетические исследования среди популяций, которые различаются по частоте генотипов, могут различаться в своих выводах о том, какие полиморфизмы оказывают значительное влияние, даже если абсолютный фенотипический эффект одинаков.См. Cheveud and Routman (1995) для более формального статистического объяснения этого явления и его влияния на оценку межгенных взаимодействий.
Другим ключевым моментом в понимании взаимосвязи между генетическими вариациями и мерами риска заболевания являются популяционные различия в корреляциях между частотами генотипов в разных местах SNP. Есть две распространенные причины, по которым частота аллеля или генотипа в конкретном SNP может коррелировать с частотой аллеля или генотипа в другом SNP.Во-первых, явление, известное как неравновесие по сцеплению , создает корреляции между SNP как следствие истории мутации. Когда возникают мутации, они происходят на определенном генетическом фоне, что создает корреляцию с другими SNP на хромосоме. Во-вторых, смешение популяций, известное как примесь, которое обычно происходит в результате миграции, означает, что SNP с частотами, специфичными для популяции, будут коррелировать в большей смешанной выборке. В этом случае расслоение населения является причиной корреляции, и было проведено много генетических эпидемиологических исследований этого явления и способов его контроля.Стратификация населения считается возможным источником ложных генетических ассоциаций с болезнью (см. вставку 3-2).
БЛОК 3-2
Стратификация населения (смешение). Когда риск заболевания различается между двумя этническими группами, любой генетический фактор или фактор окружающей среды, который также различается между группами, будет казаться связанным с заболеванием. Это явление называется «популяция» (подробнее…)
ЗАКЛЮЧЕНИЕ
По большей части в двадцатом веке преобладали исследования здоровья и болезней человека, которые были сосредоточены на выявлении отдельных генетических и экологических агентов, которые могли бы объяснить различия в восприимчивости к болезням.Этот новый век характеризуется огромным прогрессом в нашем понимании менделевских расстройств с тяжелыми клиническими исходами. Однако менделевская парадигма не смогла объяснить генетический вклад в восприимчивость к наиболее распространенным хроническим заболеваниям, которые, как известно исследователям, имеют существенный генетический компонент из-за их семейной агрегации и исследований, демонстрирующих значительную наследуемость этих заболеваний. Точно так же экологические и социальные эпидемиологические исследования были очень успешными в освещении роли многих факторов окружающей среды, таких как диета, физические упражнения и стресс, на риск заболевания.Однако эти экологические факторы сами по себе еще не полностью объясняют различия в распространенности некоторых заболеваний в разных популяциях. Исследователи только сейчас начинают всерьез изучать потенциальные взаимодействия между генетическими факторами и факторами окружающей среды, которые, вероятно, способствуют значительной части заболеваний в большинстве групп населения. Многое можно сделать, чтобы включить измерения социальной среды в генетические исследования, а также включить генетические измерения в социальные эпидемиологические исследования.
За последние два десятилетия прогресс в идентификации конкретных генов и мутаций, объясняющих генетическую предрасположенность к распространенным состояниям, был относительно медленным по целому ряду причин. Во-первых, изучаемые заболевания, как правило, имеют сложную этиологию, а это означает, что у разных людей в популяции болезнь развивается по разным генетическим и/или экологическим причинам. Ожидается, что любой отдельный генетический или экологический фактор объясняет лишь очень небольшую долю риска заболевания в популяции.Более того, предполагается, что эти факторы взаимодействуют, и другие биологические процессы (например, эпигенетические модификации), вероятно, вносят свой вклад в сложную загадку восприимчивости. Точное фенотипическое определение болезни и ее подтипов имеет решающее значение для выявления и понимания сложности специфических для болезни генетических и экологических причин.
Во-вторых, генетики только недавно разработали базу знаний или методы, необходимые для измерения генетических вариаций и их метаболических последствий с достаточной простотой и экономической эффективностью, чтобы можно было изучить большое количество генов, которые, как считается, задействованы.После завершения проекта «Геном человека» в 2003 г. многие различные научные организации (например, Проект «Экологический геном» и Международный консорциум HapMap) работали над определением мутационных спектров в человеческих популяциях, и генетические эпидемиологи только сейчас начинают понимать обширный характер общих вариаций (частота в популяции > 1 процента) в геноме человека, которые могут влиять на риск заболевания людей. Данные SNP, полученные в результате этих инициатив, теперь централизованно размещены в ряде общедоступных баз данных, включая базу данных dbSNP Национального центра биотехнологической информации, базу данных SNP Инициативы генетической аннотации CGAP Национального института рака и базу данных генных биаллельных последовательностей человека Каролинского института. .В настоящее время крупнейший набор данных о вариациях человека создается в рамках проекта International HapMap Project, 4 , в рамках которого проводится генотипирование миллионов SNP у 270 человек из 4 географически удаленных мест по всему миру. Международный проект HapMap значительно увеличил количество проверенных SNP, доступных исследовательскому сообществу для изучения вариаций человека, и создает карту геномных гаплотипов в четырех популяциях, происходящих из частей Африки, Азии и Европы.Кроме того, только сейчас становятся доступными высокопроизводительные методы генотипирования большого количества SNP (тысячи) в больших эпидемиологических когортах (см. выше). К сожалению, высокопроизводительные методы измерения окружающей среды не выдержали таких же темпов. Для многих исследований распространенных заболеваний ограничивающим шагом к расширению нашего понимания будет по-прежнему сложное и дорогостоящее измерение факторов окружающей среды.
Наконец, прогресс также был затруднен из-за отсутствия адекватных инвестиций в разработку новых методов анализа, которые могут включать многомерную биологическую реальность, которую мы теперь можем измерить.Сложная генетическая и экологическая архитектура многофакторных заболеваний нелегко обнаружить или расшифровать с помощью традиционных методов статистического моделирования, ориентированных на оценку единой общей модели заболевания для населения. Например, используя традиционные методы логистической регрессии, было бы просто невозможно ввести все сотни генетических вариаций, которые, как считается, связаны с риском сердечно-сосудистых заболеваний или любыми другими изучаемыми в настоящее время комплексами распространенных заболеваний.Помимо очевидных проблем власти и сверхдетерминации в такой крупномасштабной модели, мы также не знаем, как моделировать или интерпретировать взаимодействия между многими факторами одновременно или как учитывать редкие, значительные эффекты некоторых генов по сравнению с обычными, небольшими эффектами. других. Новые стратегии моделирования, использующие достижения в распознавании образов, машинном обучении и системном анализе (например, безмасштабные сети, байесовские сети доверия, методы случайного леса), потребуются для построения более полных предиктивных моделей этих явлений. этиологически гетерогенные заболевания.
Область генетики человека, как и многие другие дисциплины, находится в переходном состоянии, и можно многого добиться, объединив усилия с широким спектром других дисциплин, которые сосредоточены на улучшении профилактики и снижении бремени болезней среди нашего населения.
ЛИТЕРАТУРА
- Альтшулер Д., Кругляк Л., Ландер Е. Генетические полиморфизмы и болезни. Медицинский журнал Новой Англии. 1998;338(22):1626. [PubMed: 9606122]
- Ardlie KG, Lunetta KL, Seielstad M.Тестирование подразделения населения и ассоциации в четырех исследованиях случай-контроль. Американский журнал генетики человека. 2002;71(2):304–311. [Статья бесплатно PMC: PMC379163] [PubMed: 12096349]
- Армстронг В.В., Шипкова М., фон Ахсен Н., Оллерих М. Аналитические аспекты мониторинга терапии тиопуриновыми препаратами. Терапевтический лекарственный мониторинг. 2004;26(2):220–226. [PubMed: 15228169]
- Эшли-Кох А., Ян К., Олни Р. Аллель серповидного гемоглобина (Hb S) и серповидно-клеточная анемия: обзор HuGE.Американский журнал эпидемиологии. 2000;151(9):839–845. [PubMed: 10791557]
- Браун М.С., Гольдштейн Дж.Л. Снижение уровня холестерина в плазме за счет повышения активности рецепторов ЛПНП. Медицинский журнал Новой Англии. 1981;305(9):515–517. [PubMed: 6265781]
- Cardon LR, Bell JI. Дизайн ассоциативных исследований для комплексных заболеваний. Природа Обзоры Генетика. 2001;2(2):91–99. [PubMed: 11253062]
- Clifford RJ, Edmonson MN, Nguyen C, Buetow KH. Крупномасштабный анализ несинонимичных полиморфизмов одиночных нуклеотидов кодирующей области.Биоинформатика. 2004;20(7):1006–1014. [PubMed: 14751981]
- Кобли М.А., Фогель К.Л., Трипати Д., Роберт Н.Дж., Шолль С., Ференбахер Л., Уолтер Дж.М., Патон В., Шак С., Либерман Г., Сламон Д.Дж. Многонациональное исследование эффективности и безопасности гуманизированного моноклонального антитела против HER2 у женщин с метастатическим раком молочной железы с гиперэкспрессией HER2, который прогрессировал после химиотерапии по поводу метастатического заболевания. Журнал клинической онкологии. 1999;17(9):2639–2648. [PubMed: 10561337]
- Deniz Naranjo MC, Munoz Fernandez C, Alemany Rodriguez MJ, Perez Vieitez MC, Irurita Latasa J, Suarez Armas R, Suarez Valentin MP, Sanchez Garcia F.Пол оказывает сильное модулирующее влияние на риск болезни Альцгеймера, связанный с геном аполипопротеина Е, у населения Канарских островов, Испания. Ревиста де Неврология. 2004;38(7):615–618. [PubMed: 15098180]
- Evans WE, McLeod HL. Фармакогеномика — расположение лекарств, мишени для лекарств и побочные эффекты. Медицинский журнал Новой Англии. 2003;348(6):538–549. [PubMed: 12571262]
- Гандерсон К.Л., Стимерс Ф.Дж., Ли Г., Мендоза Л.Г., Чи М.С. Масштабируемый анализ генотипирования SNP для всего генома с использованием технологии микрочипов.Генетика природы. 2005;37(5):549–554. [PubMed: 15838508]
Haines JL, Pericak-Vance MA. Подходы к картированию генов при сложных заболеваниях человека. Нью-Йорк: Уайли-Лисс; 1998.
- Холл Дж.М., Ли М.К., Ньюман Б., Морроу Дж.Е., Андерсон Л.А., Хьюи Б., Кинг М.С. Связь семейного рака молочной железы с ранним началом с хромосомой 17q21. Наука. 1990; 250 (4988): 1684–1689. [PubMed: 2270482]
- Хайндс Д.А., Стюв Л.Л., Нильсен Г.Б., Гальперин Э., Эскин Э., Баллинджер Д.Г., Фрейзер К.А., Кокс Д.Р. Полногеномные паттерны общих вариаций ДНК в трех человеческих популяциях.Наука. 2005;307(5712):1072–1079. [PubMed: 15718463]
МОМ (Институт медицины). Значение геномики для общественного здравоохранения. Вашингтон, округ Колумбия: Издательство национальных академий; 2005.
- Kalow W, Tang BK, Endrenyi L. Гипотеза: сравнение меж- и внутрииндивидуальных вариаций может заменить исследования близнецов в исследованиях лекарств. Фармакогенетика. 1998;8(4):283–289. [PubMed: 9731714]
- Kardia SL, Modell SM, Peyser PA. Семейно-ориентированные подходы к пониманию и профилактике ишемической болезни сердца.Американский журнал профилактической медицины. 2003;24(2):143–151. [PubMed: 12568820]
- Клейн Р.Дж., Цейсс С., Чу Э.Ю., Цай Дж.Ю., Саклер Р.С., Хейнс С., Хеннинг А.К., СанДжованни Д.П., Мане С.М., Мейн С.Т., Бракен М.Б., Феррис Ф.Л., Отт Дж., Барнстейбл С., Хох J. Полиморфизм фактора комплемента Н при возрастной дегенерации желтого пятна. Наука. 2005;308(5720):385–389. [Бесплатная статья PMC: PMC1512523] [PubMed: 15761122]
- Lander ES, Schork NJ. Генетическое рассечение сложных признаков. Наука. 1994;265(5181):2037–2048.[PubMed: 8091226]
- Livingston RJ, von Niederhausern A, Jegga AG, Crawford DC, Carlson CS, Rieder MJ, Gowrisankar S, Aronow BJ, Weiss RB, Nickerson DA. Характер изменения последовательности в 213 генах реакции на окружающую среду. Геномные исследования. 2004; 14 (10А): 1821–1831. [Бесплатная статья PMC: PMC524406] [PubMed: 15364900]
- Mancama D, Kerwin RW. Роль фармакогеномики в индивидуализации лечения СИОЗС. Препараты ЦНС. 2003;17(3):143–151. [PubMed: 12617694]
- МакАдамс Х.Х., Аркин А.Стохастические механизмы экспрессии генов. Труды Национальной академии наук Соединенных Штатов Америки. 1997; 94(3):814–819. [Бесплатная статья PMC: PMC19596] [PubMed:
- 39]
- Miller DP, Liu G, De Vivo I, Lynch TJ, Wain JC, Su L, Christiani DC. Комбинации вариантных генотипов GSTP1, GSTM1 и p53 связаны с повышенным риском рака легких. Исследования рака. 2002;62(10):2819–2823. [PubMed: 12019159]
- Мурджани С., Рой М., Ганье С., Дэвиньон Дж., Брун Д., Туссен М., Ламбер М., Кампо Л., Блейхман С., Люпьен П.Гомозиготная семейная гиперхолестеринемия среди французских канадцев в провинции Квебек. Артериосклероз. 1989;9(2):211–216. [PubMed: 2923577]
- Обач Р.С., Вальски Р.Л., Венкатакришнан К., Гаман Э.А., Хьюстон Дж.Б., Тремейн Л.М. Полезность данных об ингибировании цитохрома Р450 in vitro для прогнозирования взаимодействия лекарственных средств. Журнал фармакологии и экспериментальной терапии. 2006;316(1):336–348. [PubMed: 16192315]
- Пирмохамед М., Парк Б.К. Генетическая предрасположенность к побочным реакциям на лекарства.Тенденции фармакологических наук. 2001;22(6):298–305. [PubMed: 11395158]
- Притчард Дж. К., Розенберг Н. А. Использование несцепленных генетических маркеров для выявления стратификации населения в ассоциативных исследованиях. Американский журнал генетики человека. 1999;65(1):220–228. [Бесплатная статья PMC: PMC1378093] [PubMed: 10364535]
- Quinn CT, Miller ST. Факторы риска и прогноз исходов у детей и подростков с серповидноклеточной анемией. Клиники гематологии/онкологии Северной Америки. 2004;18(6 спец.МКС): 1339–1354. [PubMed: 15511619]
- Rebbeck TR, Walker AH, Phelan CM, Godwin AK, Buetow KH, Garber JE, Narod SA, Weber BL. Определение этиологической гетерогенности рака молочной железы с использованием генетических биомаркеров. Прогресс в клинических и биологических исследованиях. 1997; 396: 53–61. [PubMed:89]
Rimoin DL, Connor JM, Pyeritz RE, Korf BR, редакторы. Принципы и практика медицинской генетики Эмери и Римуана. 4-е издание. Том. 2. Нью-Йорк: Черчилль Ливингстон; 2002.
- Риш, штат Нью-Джерси.Поиски генетических детерминант в новом тысячелетии. Природа. 2000;405(6788):847–856. [PubMed: 10866211]
- Саттен Г.А., Фландерс В.Д., Ян К. Учет неизмеряемой подструктуры населения в исследованиях генетической ассоциации случай-контроль с использованием новой модели латентного класса. Американский журнал генетики человека. 2001;68(2):466–477. [Бесплатная статья PMC: PMC1235279] [PubMed: 11170894]
- Sing CF, Stengard JH, Kardia SLR. Гены, окружающая среда и сердечно-сосудистые заболевания. Артериосклероз, тромбоз и сосудистая биология.2003; 23:1190–1196. [PubMed: 12730090]
Смит Г. Эпоха геномики: как технология ДНК меняет наш образ жизни и то, кто мы есть. Нью-Йорк: АМАКОМ; 2005.
- Стейнберг М.Х. Прогнозирование клинической тяжести при серповидноклеточной анемии. Британский журнал гематологии. 2005;129(4):465–481. [PubMed: 15877729]
- Стюарт М.Дж., Нагель Р.Л. Серповидно-клеточная анемия. Ланцет. 2004;364(9442):1343–1360. [PubMed: 15474138]
- Сиванен А.С. На пути к полногеномному генотипированию SNP.Генетика природы. 2005; (37 Дополнение): S5–S10. [PubMed: 15920530]
Томпсон М.В., Макиннес Р.Р., Уиллард, редакторы. Генетика Томпсона и Томпсона в медицине. 5-е издание. Филадельфия, Пенсильвания: WB. Компания Сондерс; 1991.
- Wacholder S, Rothman N, Caporaso N. Стратификация населения в эпидемиологических исследованиях распространенных генетических вариантов и рака: количественная оценка смещения. Журнал Национального института рака. 2000;92(14):1151–1158. [PubMed: 10
8]
- Wang X, Tomso DJ, Liu X, Bell DA.Однонуклеотидный полиморфизм в областях регуляции транскрипции и экспрессия экологически чувствительных генов. Токсикология и прикладная фармакология. 2005; 207 (2 Приложение): 84–90. [PubMed: 16002116]
- Ван З., Фан Х., Ян Х.Х., Ху И., Бутоу К.Х., Ли М.П. Сравнительный анализ последовательности импринтированных генов человека и мыши для выявления сигнатур импринтинга. Геномика. 2004;83(3):395–401. [PubMed: 14962665]
- Weinshilboum R. Наследование и ответ на лекарство. Медицинский журнал Новой Англии.2003;348(6):529–537. [PubMed: 12571261]
- Wu JH, Lo SK, Wen MS, Kao JT. Характеристика генетических вариаций аполипопротеина Е в тайваньской ассоциации с ишемической болезнью сердца и уровнями липидов в плазме. Человеческая биология. 2002;74(1):25–31. [PubMed: 11931577]
- Чжоу В., Лю Г., Миллер Д.П., Терстон С.В., Сюй Л.Л., Уэйн Дж.К., Линч Т.Дж., Су Л., Кристиани Д.К. Полиморфизм генов репарации ДНК XRCC1 и ERCC2, курение и риск развития рака легких. Эпидемиология рака, биомаркеры и профилактика.2003;12(4):359–365. [PubMed: 12692111]
- 1
SNP — это изменение последовательности ДНК, возникающее при изменении одного нуклеотида (A, T, C или G) в последовательности генома (Smith, 2005).
- 2
Ген-кандидат — это ген, белковый продукт которого участвует в метаболических или физиологических путях, связанных с конкретным заболеванием (IOM, 2005).
- 3
Пример серповидно-клеточной анемии взят из заказанной статьи, подготовленной Робертом Дж.Томпсон-младший, доктор философии. (Приложение Д).
- 4
Как гены влияют на здоровье и болезни?
У вас такой же цвет глаз и волос, как у многих членов вашей семьи? То же самое может произойти и с болезнями — они могут передаваться от одного члена семьи к другому. Это происходит через гены, генетическую информацию, которую вы получаете непосредственно от своих родителей. В большинстве случаев болезни или другие проблемы не имеют одной единственной причины. Они происходят из комбинации ваших генов, вашего выбора и вашего окружения.
Как гены вызывают проблемы?
Большинство генов, которые мы получаем от наших родителей, являются копиями, которые работают так же, как и у наших родителей. Но иногда ген не является идеальной копией. Изменения в генах называются мутациями, и они есть у всех. Некоторые мутации работают лучше оригинала, а многие вообще не имеют никакого значения. Некоторые мутации вызывают проблемы. Состояние, вызванное мутациями в одном или нескольких генах, называется генетическим заболеванием. Существует группа редких заболеваний, вызванных мутациями в одном гене.Это так называемые моногенные расстройства. Но самые распространенные заболевания вызваны сочетанием генных изменений, образа жизни и окружающей среды.
Мутации могут передаваться по наследству от родителей к ребенку («наследственные») или могут возникать в течение жизни человека («приобретенные»). Приобретенные мутации могут быть вызваны факторами окружающей среды, такими как ультрафиолетовое излучение солнца. Приобретенные мутации, которые развиваются у вас в течение жизни, находятся в клетках, называемых соматическими клетками — клетках, из которых состоит большая часть вашего тела.Они могут вызвать у вас проблемы, например, рак кожи, но вы не можете передать их своим детям.
Почему мутации вызывают болезни?
Белки выполняют работу, которая строит части вашего тела и поддерживает его движение. Когда гены, отвечающие за выработку белков, мутируют и не работают должным образом, могут возникнуть проблемы со всеми системами организма. Эти расстройства могут быть вызваны разными способами.
Новая копия ваших генов создается в каждой новой клетке, которую ваше тело создает на протяжении всей вашей жизни.Если в этих копиях есть ошибки, это может вызвать проблемы. Например, некоторые генные изменения могут повысить вероятность развития рака.
Окружающая среда также может напрямую вызывать изменения ДНК внутри ваших клеток. Например, солнце повреждает ДНК в клетках, которые подвергаются его воздействию, и если повреждение не устраняется, эти генные изменения будут копироваться по мере того, как ваше тело будет создавать новые клетки.
Возможно, вы читали о «гене» состояния. Это не совсем правильно. Когда мы описываем гены, вызывающие заболевание, мы на самом деле говорим о гене, имеющем генетическую мутацию.Ген должен помочь создать нормальное, здоровое состояние, но мутация этого гена может вызвать проблемы. Например, у всех есть ген под названием CFTR, но только люди с мутацией в гене CFTR страдают муковисцидозом, генетическим заболеванием.
Клеточная система создания копий генов очень хороша, потому что она защищает от многих ошибок, которые неизбежно произойдут по мере того, как ваше тело будет создавать миллиарды новых клеток на протяжении всей вашей жизни. Даже когда ваши гены не скопированы идеально, они обычно все еще функционируют правильно или, по крайней мере, достаточно хорошо, чтобы вы не заметили проблемы.Только небольшое количество мутаций вызывает генетическое заболевание. Иногда ваше тело может восстановить ген, чтобы защитить себя от болезней. Мутации иногда могут иметь даже положительный эффект, например устойчивость к болезням, хотя это бывает редко.
Какие еще типы мутаций существуют?
Мы уже видели, что некоторые гены могут быть скопированы неправильно — это одна из форм мутации. У нас также может быть разное количество генов.
В общем, у всех нас есть две копии каждого гена.Мы получаем по одному от каждого родителя. В некоторых случаях люди рождаются с одной, тремя или более копиями определенного гена. Также возможно, что ген полностью отсутствует. Этот тип генетического различия называется вариацией числа копий (CNV). Легко увидеть, как отсутствующий ген может вызвать проблему, но лишние копии тоже могут вызвать проблему. Думайте об этом, как о слишком большом количестве людей в маленьком пространстве, пытающихся выполнять одну и ту же работу.
Гены хранятся в хромосомах, больших группах генов, которые находятся в середине почти всех клеток вашего тела.У людей 23 пары хромосом, всего 46. У некоторых людей есть лишняя копия хромосомы или она отсутствует. Иногда хромосома ломается, и лишний фрагмент может оказаться в одной клетке (и отсутствовать в другой клетке). Это похоже на наличие лишней или отсутствующей копии гена, но это происходит с большими группами генов. Этот тип изменений может вызвать проблемы с ростом, развитием и функционированием систем вашего организма.
Многие состояния и болезни так или иначе связаны с генами.Некоторые мутации могут быть в одном гене, хотя большинство нарушений являются более сложными. Многие заболевания, такие как болезни сердца и диабет, вызваны проблемами с несколькими генами в сочетании с образом жизни и факторами окружающей среды.
Влияние генетики и геномики на общественное здоровье
Многопрофильные учреждения и платформы общественного здравоохранения Европы и США, такие как Фонд геномики общественного здравоохранения в Кембридже (Фонд PHG), Великобритания, Немецкий центр геномики общественного здравоохранения в Билефельде (DZPHG), или Национальное управление геномики общественного здравоохранения США в Центрах по контролю и профилактике заболеваний в Атланте (CDC), которые тесно сотрудничают с исследователями в области генетики и молекулярной науки («современная и системная биология»), а также в области народонаселения, гуманитарных наук. и социальных наук, гораздо более оптимистичны в отношении значимости геномики для общественного здравоохранения, чем большинство генетиков. 12, 16, 17, 18 Все они имеют тесные связи или даже являются частью соответствующих национальных проектов по исследованию генома в этих странах и транслируют геномные знания из биотехнологии через (генетическую) эпидемиологию в общественное здравоохранение («трансляционные исследования»). Используя такие методы, как сканирование горизонта, выявление фактов и мониторинг, чтобы как можно раньше определить тенденции исследований, они уже проводят проспективную оценку, основанную на фактических данных, то есть оценку, которая уже проводится в процессе фундаментальных исследований, а не только в (ретроспективном) процессе реализации стратегий и политик общественного здравоохранения, 19 , которые всегда будут отставать.
За последние 20 лет достижения в области исследований генома произвели революцию в понимании роли наследственности в здоровье и болезнях. 20 В настоящее время известно, что ДНК и РНК определяют не только причину моногенных нарушений, от которых страдают миллионы людей во всем мире, но и предрасположенности («предрасположенности»), 21 в основе которых лежат генотип и варианты гаплотипов , 22, 23 на общие заболевания. Новые технологии позволят исследователям изучать генетические мутации на уровне функциональных единиц генома 24 и лучше понимать системную биологию, эпигеномику, плейотропные эффекты, значение факторов окружающей среды, таких как химические агенты, питание или личное поведение 25 в отношении на причину таких заболеваний, как сердечно-сосудистые заболевания, аллергии 26 , рак, психические расстройства или инфекционные заболевания. 27, 28
Достижения в области общественного здравоохранения еще не соответствуют новым знаниям, которые мы наблюдали в геномике в последнее десятилетие. Консорциум Wellcome Trust Case Control недавно опубликовал предварительные результаты исследования ассоциации всего генома, которые подчеркивают многочисленные проблемы общественного здравоохранения, возникающие в результате генетических исследований. 29 Распространенные сложные расстройства требуют интеграции геномных и вторичных данных как в медицинских учреждениях, так и в учреждениях общественного здравоохранения.На концептуальном уровне общественное здравоохранение и медицина, кажется, сходятся в оценке и стратификации рисков, что становится важным для человека и общества в целом. Уровень знаний о геноме в некоторых областях, таких как диабет 30 , требует срочного изменения профилактики, но практикующие врачи, похоже, неохотно делают выводы на основе имеющихся данных. В области инфекционных заболеваний ситуация несколько иная, поскольку пандемии предупредили все заинтересованные стороны о том, что знания, основанные на геноме, необходимо использовать для предотвращения будущих инцидентов. 31
Очевидно, что эти быстрые достижения в области геномики и сопутствующих технологий вызывают сдвиг в понимании здоровья и болезни, а также в понимании новых подходов к профилактике и терапии. 32, 33, 34 Появляющиеся знания также открывают окно возможностей для других наук, таких как право или этика, для разработки нормативной базы, прежде чем геномика станет массовым приложением. 35 Какие выводы можно сделать из этих знаний и как их можно перевести в политику 19 и применять ее ответственно и своевременно?
Уточнение общих условий, при которых геномные знания могут быть применены к передовой практике в области общественного здравоохранения, уделяя особое внимание этическим, правовым и социальным последствиям 12, 17, 35 в настоящее время является наиболее актуальной задачей в области общественного здравоохранения Геномика.Стремление применять генетические и молекулярные науки к укреплению здоровья и профилактике заболеваний посредством организованных усилий общества, неотъемлемой частью его деятельности является диалог со всеми заинтересованными сторонами в обществе, включая промышленность, правительства, медицинских работников и широкую общественность. 18 Таким образом, интеграция геномики в исследования, политику и практику общественного здравоохранения является одной из основных будущих задач для наших систем здравоохранения. 36, 37 Опыт уже осуществим и может быть сгруппирован и оценен для социально ответственного использования.
Например, при таком заболевании, как ишемическая болезнь сердца, наличие гетерозиготы по гену рецептора ЛПНП повышает риск развития этого состояния. Но, как это верно и для всех других факторов риска (например, социальных факторов, диеты, курения, физической активности), которые были идентифицированы эпидемиологами в этом контексте в последние десятилетия, наличие генетического маркера не является прогностическим и у тех, у кого он есть, может не развиться болезнь, а у тех, у кого ее нет, может возникнуть болезнь. 28 Очевидно, что сценарий очень похож на сценарий ишемической болезни сердца при повышенном артериальном давлении или уровне холестерина: повышенный риск предполагает «только» (высокую или низкую) вероятность, а генетический маркер — «просто» другой модификатор в причинности болезни, и поэтому он не является ни детерминированным, ни исключительным. 12, 13, 38, 39 Тем не менее, этический и юридический вопрос заключается в том, как мы будем справляться с этой восприимчивостью. Чтобы ответить на этот вопрос, в качестве первого шага было бы полезно провести широкомасштабные эпидемиологические исследования на уровне населения для измерения связи между конкретными вариантами генов и факторами окружающей среды и риском развития ишемической болезни сердца. 40, 41 Такие исследования уже проводились, например, в рамках Национального исследования здоровья и питания США или в рамках Национальной сети исследований генома (NGFN) в Германии. 42 Для преобразования таких открытий в мероприятия необходимо количественно оценить не только влияние вариаций генов на риск заболевания, но и влияние модифицируемых факторов, которые взаимодействуют с вариациями генов. 43 На основе знаний об этих атрибутивных рисках можно разработать разумную политику и эффективное вмешательство. 12, 40
Что касается инфекционных заболеваний, исследования расширяются, чтобы включить генетические факторы хозяина, которые влияют на восприимчивость к определенным инфекционным заболеваниям или даже на тяжесть состояния и которые влияют на реакцию на вакцины и методы лечения. Идентификация нескольких ассоциаций ген-заболевание для паразитарных (например, малярия), вирусных (например, ВИЧ или гепатит) и бактериальных (например, туберкулез или холера) инфекций дает важные ключи к контролю этих инфекционных заболеваний.Благодаря этому стратегии общественного здравоохранения станут более эффективными и действенными.
Разработчики политики должны осознавать возможность улучшения защиты прав потребителей, отслеживать влияние геномики на достижение целей политики в области здравоохранения, социальной защиты и окружающей среды и гарантировать, что достижения в области геномики будут использоваться не только для лечения заболеваний, но и для предотвращения болезней и улучшить здоровье. 37 Надежная и хорошо продуманная политика и программы в области генетики требуют своевременного и скоординированного процесса разработки политики, основанной на фактических данных, которая опирается на научные исследования и постоянные консультации с общественностью. 44 Необходимо найти приемлемый и последовательный баланс между обеспечением надежной защиты интересов отдельных лиц 45, 46 и одновременно предоставлением обществу возможности пользоваться достижениями в области геномики. 12, 34, 47, 48 Геномика общественного здравоохранения может служить институциональным зонтиком для этих процессов, которые необходимы для принятия инноваций «продукта» в геномике.
Новые знания в области фундаментальных наук требуют новых исследований по переводу, ведущих к новым прикладным технологиям здравоохранения, таким как генетические тесты (не обязательно основанные на ДНК).Здесь определение потребности в генетических тестах, 47, 49 взвешивание преимуществ и рисков (например, с использованием уже хорошо зарекомендовавшего себя в большинстве европейских стран метода оценки технологий здравоохранения) прогностических генетических тестов и вмешательств генетического скрининга, 33, 50, 51, 52, 53 оценка преимуществ превентивных стратегий, а также анализ сложных новых проблем, таких как «генетическое неравенство» 38 , имеет важное значение. Наоборот, даже если с точки зрения генетической предрасположенности и полиморфизма окажется, что «все мы чем-то рискуем», существует вероятность социального неравенства в отношении здоровья, а также социального исключения: если генетические тесты не будут покрывается больничными кассами, доступ к геномным знаниям и, таким образом, к индивидуальной и стратифицированной профилактике, диагностике и терапии приведет к двухуровневой системе.Напротив, даже если генетические тесты будут возмещаться в большинстве систем здравоохранения, возникнет еще одна этическая и социальная проблема, которая может носить гораздо более дискриминационный характер: поскольку геномика вызывает сложность знаний, у специалистов общественного здравоохранения и медицинского персонала задача дать людям возможность не только понять это новое знание, но и сделать людей способными принимать обоснованные решения относительно применения генетических тестов 54 и, таким образом, обеспечить справедливое равенство возможностей.В противном случае разрыв между людьми, способными справиться с этой сложностью, и теми, кто не может, будет иметь потенциал нового вида социального неравенства. 55
В долгосрочной перспективе это поддерживает концепцию лидерства общественного здравоохранения за счет внедрения метода разработки политики, основанного на фактических данных. По этой причине в Соединенных Штатах, Великобритании и Германии политики следуют международному определению Белладжио геномики общественного здравоохранения как «ответственного и эффективного преобразования основанных на геноме знаний и технологий в государственной политике и службах здравоохранения». на благо здоровья населения» (Bellagio Statement 2005).
Для сообщества общественного здравоохранения важно подчеркнуть, что геномика общественного здравоохранения не имеет ничего общего с улучшением или модификацией генов и что «генетический детерминизм», а также «генетическая исключительность» устарели. 37 Общественное здравоохранение стремится к лучшему пониманию генетических факторов, влияющих на распространенные заболевания, поскольку общественное здравоохранение нуждается в этих знаниях для уменьшения или изменения вторичных детерминант здоровья, таких как токсические вещества, неправильное питание или поведение. Кроме того, необходимо пояснить, что геномика общественного здравоохранения не является синонимом генетической эпидемиологии в той же мере, в какой общественное здравоохранение не является синонимом эпидемиологии, а генетика сообщества 54, 55 не является синонимом генетики общественного здравоохранения, поскольку здоровье не является синонимом общественного здоровья. 56, 57, 58 Тем не менее, в очень долгосрочной перспективе мы с оптимизмом смотрим на то, что геномика в общественном здравоохранении геномика и генетика в генетической эпидемиологии устареют, поскольку не будет общественного здравоохранения без геномики и не будет эпидемиологии, которая игнорирует влияние генетических детерминант.
Что означает наличие генетической предрасположенности к заболеванию?: MedlinePlus Genetics
Генетическая предрасположенность (иногда также называемая генетической предрасположенностью) — это повышенная вероятность развития определенного заболевания, обусловленная генетической структурой человека.Генетическая предрасположенность возникает в результате специфических генетических вариаций, которые часто наследуются от родителей. Эти генетические изменения способствуют развитию заболевания, но не вызывают его напрямую. Некоторые люди с предрасполагающими генетическими вариациями никогда не заболевают, в то время как другие заболевают даже в одной семье.
Генетические вариации могут иметь большое или малое влияние на вероятность развития определенного заболевания. Например, определенные варианты (также называемые мутациями) в генах BRCA1 или BRCA2 значительно повышают риск развития рака молочной железы и рака яичников.Конкретные вариации в других генах, таких как BARD1 и BRIP1 , также увеличивают риск рака молочной железы, но вклад этих генетических изменений в общий риск человека, по-видимому, намного меньше.
Текущие исследования сосредоточены на выявлении генетических изменений, которые мало влияют на риск заболевания, но распространены среди населения в целом. Хотя каждая из этих вариаций лишь незначительно увеличивает риск для человека, наличие изменений в нескольких разных генах может в совокупности значительно увеличить риск заболевания.Изменения во многих генах, каждый из которых имеет небольшой эффект, могут лежать в основе восприимчивости ко многим распространенным заболеваниям, включая рак, ожирение, диабет, болезни сердца и психические заболевания. Исследователи работают над расчетом предполагаемого риска развития распространенного заболевания у человека на основе комбинации вариантов во многих генах в их геноме. Ожидается, что эта мера, известная как оценка полигенного риска, поможет принимать решения в области здравоохранения в будущем.
У людей с генетической предрасположенностью риск заболевания может зависеть от множества факторов в дополнение к выявленным генетическим изменениям.К ним относятся другие генетические факторы (иногда называемые модификаторами), а также образ жизни и факторы окружающей среды. Заболевания, вызванные комбинацией факторов, описываются как многофакторные. Хотя генетическая структура человека не может быть изменена, некоторые изменения образа жизни и окружающей среды (например, более частые обследования на наличие заболеваний и поддержание здорового веса) могут снизить риск заболевания у людей с генетической предрасположенностью.
Наследственность — обзор | ScienceDirect Topics
Доказательства индивидуальных различий во сне, ЭЭГ сна, продолжительности сна, дневных предпочтений и времени сна
Генетические основы фенотипов сна
Быстро накапливающиеся данные демонстрируют, что многие аспекты сна и регуляции сна и бодрствования отражают индивидуальные различия, подобные чертам.Каждый из этих аспектов, вероятно, находится под контролем нескольких генов, которые могут взаимодействовать друг с другом, а также находятся под влиянием окружающей среды и других факторов (например, возраста).
Наследуемость сна
Уже первые исследования сна у монозиготных (MZ) близнецов выявили почти полную согласованность во временной последовательности стадий сна. Последующая работа показала, что, в частности, те переменные сна, которые наиболее достоверно отражают потребность во сне, находятся под жестким генетическим контролем. Они включают продолжительность стадий медленного сна, особенно медленного сна, и плотность быстрых движений глаз в фазе быстрого сна.Например, было подсчитано, что 95% изменчивости плотности БДГ можно объяснить общими генетическими эффектами. Не только исследования близнецов, но и множественные записи одних и тех же людей демонстрируют сходную с чертами природу переменных сна. Таким образом, внутрииндивидуальное сходство и межиндивидуальные вариации в характеристиках медленного и быстрого сна стабильны, устойчивы и существенны, что позволяет предположить, что структура сна определяется генетически.
Наследуемость ЭЭГ во сне
ЭЭГ в медленном и быстром сне сильно различается у разных людей, но впечатляет своей неизменностью в нескольких записях одного и того же человека, как с точки зрения абсолютных значений мощности, так и формы спектров.Подобно отпечатку пальца, различные статистические методы показали, что несколько ночей одного человека можно отделить от ночей других членов исследуемой выборки только на основе ЭЭГ в медленном и быстром сне. Сильные вариации между субъектами и высокая стабильность внутри субъекта указывают на то, что сильные генетические влияния формируют индивидуальные профили ЭЭГ сна, в частности, в частотах δ, θ, α и σ. Это мнение подтверждается анализом спектрального состава ЭЭГ сна между MZ и дизиготными (DZ) парами близнецов.Конкордантность внутри пары по спектральной мощности в диапазоне 2–13 Гц во время медленного сна значительно выше у MZ-близнецов, чем у DZ-близнецов. Частоты α / σ, по-видимому, отражают особенно сильное генетическое влияние. Наследуемость в этом частотном диапазоне может достигать 96%.
Наследуемость привычной продолжительности сна
Достаточный сон необходим для субъективного благополучия и оптимальной дневной активности, однако даже здоровые люди сильно различаются в том, сколько сна им нужно. Обычная привычная продолжительность сна может составлять от 5 до 10 часов.Короткий или продолжительный сон часто наблюдается в разных семьях, что свидетельствует о генетическом влиянии на продолжительность сна. Действительно, исследования близнецов показывают, что около 20–40% межиндивидуальных различий в продолжительности сна вызваны генетическими факторами. Поскольку продолжительность сна в общей популяции демонстрирует совершенно нормальное распределение, можно ожидать, что помимо возможных редких мутаций с большими эффектами, множественные генетические полиморфизмы с небольшими эффектами модулируют продолжительность сна.
Наследуемость дневных предпочтений и времени сна
Время пиков и спадов дневного бодрствования и время ночного сна (т.е., суточные предпочтения) сильно варьируют среди здоровых людей. Некоторые из нас ложатся спать, когда другие просыпаются. Шкалы самооценки показывают нормальное распределение по оси «вечер-утро», что указывает на вклад аддитивных, небольших эффектов нескольких генов в сочетании с окружающей средой.




 Ф., Чухловин Л.Б. О наследственности. / М.; 1975.
Ф., Чухловин Л.Б. О наследственности. / М.; 1975. Если пациентам с этой генетической вариацией дают тиопурины, препарат накапливается в их организме до токсического уровня, вызывая опасную для жизни миелосупрессию.Оценка фенотипа и генотипа TPMT пациента может быть использована для определения индивидуальной дозы препарата (Armstrong et al., 2004).
Если пациентам с этой генетической вариацией дают тиопурины, препарат накапливается в их организме до токсического уровня, вызывая опасную для жизни миелосупрессию.Оценка фенотипа и генотипа TPMT пациента может быть использована для определения индивидуальной дозы препарата (Armstrong et al., 2004). Некоторые испытания фармацевтических препаратов в настоящее время включают ранние тесты, которые оценивают способность различных форм цитохрома Р450 метаболизировать новое лекарственное соединение (Obach et al., 2006).
Некоторые испытания фармацевтических препаратов в настоящее время включают ранние тесты, которые оценивают способность различных форм цитохрома Р450 метаболизировать новое лекарственное соединение (Obach et al., 2006). Аллель серповидного гемоглобина (Hb S) и серповидно-клеточная анемия: обзор HuGE.Американский журнал эпидемиологии. 2000;151(9):839–845. [PubMed: 10791557]
Аллель серповидного гемоглобина (Hb S) и серповидно-клеточная анемия: обзор HuGE.Американский журнал эпидемиологии. 2000;151(9):839–845. [PubMed: 10791557] Журнал клинической онкологии. 1999;17(9):2639–2648. [PubMed: 10561337]
Журнал клинической онкологии. 1999;17(9):2639–2648. [PubMed: 10561337] М., Ли М.К., Ньюман Б., Морроу Дж.Е., Андерсон Л.А., Хьюи Б., Кинг М.С. Связь семейного рака молочной железы с ранним началом с хромосомой 17q21. Наука. 1990; 250 (4988): 1684–1689. [PubMed: 2270482]
М., Ли М.К., Ньюман Б., Морроу Дж.Е., Андерсон Л.А., Хьюи Б., Кинг М.С. Связь семейного рака молочной железы с ранним началом с хромосомой 17q21. Наука. 1990; 250 (4988): 1684–1689. [PubMed: 2270482] [PubMed: 12568820]
[PubMed: 12568820] Стохастические механизмы экспрессии генов. Труды Национальной академии наук Соединенных Штатов Америки. 1997; 94(3):814–819. [Бесплатная статья PMC: PMC19596] [PubMed:
Стохастические механизмы экспрессии генов. Труды Национальной академии наук Соединенных Штатов Америки. 1997; 94(3):814–819. [Бесплатная статья PMC: PMC19596] [PubMed: К. Генетическая предрасположенность к побочным реакциям на лекарства.Тенденции фармакологических наук. 2001;22(6):298–305. [PubMed: 11395158]
К. Генетическая предрасположенность к побочным реакциям на лекарства.Тенденции фармакологических наук. 2001;22(6):298–305. [PubMed: 11395158] 4-е издание. Том. 2. Нью-Йорк: Черчилль Ливингстон; 2002.
4-е издание. Том. 2. Нью-Йорк: Черчилль Ливингстон; 2002. Дж., Нагель Р.Л. Серповидно-клеточная анемия. Ланцет. 2004;364(9442):1343–1360. [PubMed: 15474138]
Дж., Нагель Р.Л. Серповидно-клеточная анемия. Ланцет. 2004;364(9442):1343–1360. [PubMed: 15474138] Геномика. 2004;83(3):395–401. [PubMed: 14962665]
Геномика. 2004;83(3):395–401. [PubMed: 14962665]
 Оценка фенотипа и генотипа TPMT пациента может быть использована для определения индивидуальной дозы препарата (Armstrong et al., 2004).
Оценка фенотипа и генотипа TPMT пациента может быть использована для определения индивидуальной дозы препарата (Armstrong et al., 2004).