Миометрит у женщин. Диагностика и лечение в Москве — Клиника Гинеко.
Одно из наиболее часто встречающихся воспалительных заболеваний у женщин на сегодняшний день — это миометрит. Особенно подвержены ему женщины детородного возраста 25-35 лет. Данное заболевание в начальных стадиях может протекать без явных симптомов, однако если его запустить — это может привести к серьезным осложнениям вплоть до трудности с зачатием и вынашиванием ребенка.
Миометрит — это воспаление мышечного слоя в матке. Возникнуть оно по может по ряду причин или из-за наличия болезнетворных микроорганизмов.
На сегодняшний день различают следующие формы этого заболевания:
- Острая — ярко выраженные симптомы (высокая температура, слабость, головная боль, головокружение, озноб, боль внизу живота, а также в районе паха и крестца, увеличение матки).
- Подострая — на этой стадии степень болезненных ощущений снижается, однако появляются кровянистые и гнойно-слизистые выделения из влагалища.

- Хроническая — симптомы не выражены сильно, однако дальнейшее развитие метрита может привести к закупорке сосудов малого таза и бесплодию.
- А так же можно встретить еще одну форму — хронический миометрит с фиброзом. Он отличается тем, что возникает в случае постоянного травмирования, например, маточной спиралью. Протекает заболевание спокойно, боли внизу живота несильные, тянущие, выделений практически нет.
Основные симптомы заболевания
- Боль внизу живота
- Боль в поясничном отделе
- Выделения различного вида
Диагностика миометрита
Предварительный диагноз врач может поставить после осмотра пациента. Но для точного диагноза необходимо провести тщательное обследование:
- Мазки из влагалища и цервикального канала
- Клинический анализ крови
- УЗИ.
 При миометрите структура мышечного слоя матки будет неоднородной
При миометрите структура мышечного слоя матки будет неоднородной - Возможна биопсия эндометрия
- Анализ на чувствительность к антибиотикам
Причины миометрита
Наиболее часто встречается у женщин в послеродовом периоде. Это различные септические состояния при патологических родах и в случае операционного вмешательства. Возможно восходящее инфицирование родовых путей микроорганизмами, которые и являются причиной миометрита. Другая распространенная причина — хронические заболевания внутренних половых органов. Некоторые заболевания без надлежащего лечения могут перейти в хроническое состояния, очаг инфекции может спровоцировать развитие миометрита. Третья причина — наличие частых урогенитальных заболеваний И последняя причина — инфицирование за счет установления противозачаточных средств, таких как маточные спирали.
Последствия миометрита
Как уже говорилось выше, миометрит может привести к образованию спаек, а в результате их — к бесплодию.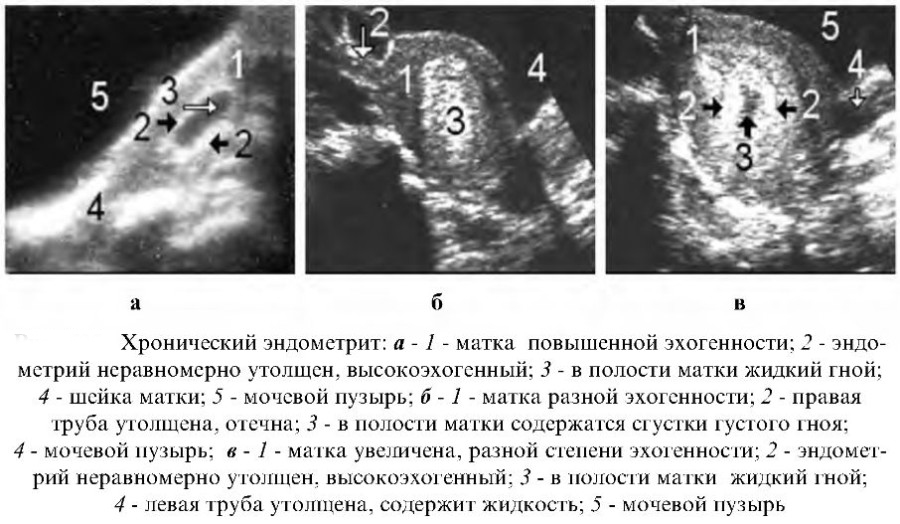 Помимо этого, из-за расположению очага заболевания, оно может распространиться на органы малого таза и брюшную полость. А так же есть опасность развития сепсиса.
Помимо этого, из-за расположению очага заболевания, оно может распространиться на органы малого таза и брюшную полость. А так же есть опасность развития сепсиса.
Лечение
Основная задача при лечении миометрита — ликвидация очага заболевания, снятие воспаления и восстановление мышечного слоя. Наиболее часто применяются антибиотики широкого спектра и противовоспалительные средства местного действия. При любых симптомах мы настоятельно рекомендуем обратиться к врачу за помощью.
Клиника Гинеко — это первоклассные специалисты, атмосфера заботы и внимания. Наши доктора проведут тщательное обследование и смогут подобрать оптимальное лечение.
Лечение эндометрита в Эс Класс Клиник Ульяновск по доступной цене
Эндометрит – воспалительный процесс, который возникает на слизистой оболочке матки. Традиционно существует две формы заболевания – острая и хроническая. Соответственно, лечение назначается с учетом формы недуга, а также общего состояния пациентки. Не нужно стесняться обратиться к гинекологу, ведь в медицинском центре врач гарантирует полную анонимность, а также сможет в короткие сроки избавить от заболевания.
Не нужно стесняться обратиться к гинекологу, ведь в медицинском центре врач гарантирует полную анонимность, а также сможет в короткие сроки избавить от заболевания.
Причины возникновения
Вы не единственны в своей проблеме, у 2% женщин, которые пришли на прием гинеколога, обнаруживается эта болезнь. Можно выделить такие факторы, которые вызывают поражение эндометрия матки:
- Роды, которые происходили с осложнениями.
- Наличие инфекционных заболеваний половых органов.
- Использование внутриматочных средств контрацепции.
- Аборты.
Таким образом, эндометрит может быть вызван множеством факторов. Его возбудители – условно-патогенные микроорганизмы, которые проникают в слизистую оболочку матки. Там они вызывают сложнейшие реакции, которые приводят к воспалению. Описанный механизм характерен для острого эндометрита. Если его надлежащим образом не лечить, то заболевание перейдет в хроническую форму и избавиться от него будет гораздо сложнее.
Симптомы воспаления матки
Симптомы любой из форм заболевания могут проявиться через 3-7 дней после заражения. В основном они выражаются следующим образом:
— сильное кровотечение, которое проявляется даже между менструациями;
— тянущая или острая боль внизу живота;
— выделения с явными вкраплениями гноя;
— сбой менструального цикла.
При обнаружении любого из этих симптомов, не нужно заниматься самолечением. Немедленно запишитесь на прием к гинекологу, для того чтобы узнать, каким будет лечение и получить рецепт врача.
Диагностика хронического и острого эндометрита
Для того, чтобы подтвердить или опровергнуть наличие у женщины заболевания, наша клиника предлагает пройти полное обследование. Изначально гинеколог, в беседе с пациенткой узнает симптомы недуга, собирает сведения о других перенесенных заболеваниях. Затем начинается гинекологический осмотр, во время которого слизь из влагалища берется на биометрический анализ. В последующем, женщина должна сдать для клинического исследования кровь и мочу. При подозрении на хронический эндометрит, пациентка направляется для прохождения ультразвукового исследования. Также у нее берется соскоб с внутренней стенки влагалища, так как гистологическое исследование измененного эндометрия позволяет поставить самый точный диагноз.
Затем начинается гинекологический осмотр, во время которого слизь из влагалища берется на биометрический анализ. В последующем, женщина должна сдать для клинического исследования кровь и мочу. При подозрении на хронический эндометрит, пациентка направляется для прохождения ультразвукового исследования. Также у нее берется соскоб с внутренней стенки влагалища, так как гистологическое исследование измененного эндометрия позволяет поставить самый точный диагноз.
Огромный плюс обращения в нашу клинику – наличие высокоточного оборудования, которое позволяет провести все необходимые клинические исследования непосредственно в медицинском центре.
Лечение эндометрита в Эс Класс Клиник
При диагностике хронической формы эндометрита, женщина проходит лечение в стационаре, так как очень высок риск развития патологий и других заболеваний. Основой медикаментозного лечения выступают антибиотики, которые сочетаются с иммуномодуляторами. Для снижения симптомов интоксикации используются солевые и белковые растворы. При наличии сильных болевых ощущений могут прописывать обезболивающие. После снятия симптомов острой формы, врачи рекомендуют поддерживать здоровый образ жизни, заниматься лечебной физкультурой.
При наличии сильных болевых ощущений могут прописывать обезболивающие. После снятия симптомов острой формы, врачи рекомендуют поддерживать здоровый образ жизни, заниматься лечебной физкультурой.
Полезное от клиники «Геном» в Томске
Эндометрит – это воспаление слизистой оболочки полости матки (эндометрия). Если в процесс вовлекается мышечный слой матки, то говорят об эндомиометрите.Эндометрием называется слой матки, выстилающий её изнутри. Он состоит из 2-х слоёв — базального и функционального. Функциональный изменяется на протяжении менструального цикла, готовясь принять оплодотворённую яйцеклетку. Если оплодотворения не произошло, то он отторгается с менструальными выделениями, а затем нарастает вновь.
От состояния эндометрия зависит успех имплантации эмбриона и ход беременности. Патологии эндометрия являются частой причиной бесплодия, невынашивания, послеродовых осложнений, безуспешных попыток ЭКО.
В норме полость матки надежно защищена от проникновения инфекции. Только при определенных условиях инфекционные возбудители могут попасть в матку и вызвать воспалительную реакцию ее внутреннего слоя. По характеру течения воспалительного процесса эндометрит разделяют на острый и хронический.
Острый эндометрит наступает после внутриматочных манипуляций и хирургических вмешательств, прерывания беременности, родов. Послеродовый эндометрит встречается после естественных родов в 20% случаев, а после кесарева сечения с ним сталкивается до 40% женщин. Развитию острого воспалительного процесса благоприятствуют неполное удаление остатков плодного яйца, плаценты, скопление жидкой крови и сгустков. Усугубляют ситуацию состояния, приводящие к снижению общего иммунитета – это могут быть гормональные или иммунные нарушения, различные заболевания.
Острый эндометрит проявляется через 3-4 дня после инфицирования такими ярко выраженными симптомами как повышение температуры, боли внизу живота, выделения с неприятным запахом, болезненное мочеиспускание, озноб. При гинекологическом обследовании в этом случае определяется умеренно увеличенная и болезненная матка, сукровичные или серозно-гнойные выделения. Острая стадия длится до 10 дней. Эффективная терапия приводит к излечению, а в противном случае острая форма переходит в хронический эндометрит.
Хронический эндометрит. Его проявления зависят от глубины изменений в структуре эндометрия. Основные симптомы — это нарушение менструального цикла, маточные кровотечения, патологические серозно-гнойные или кровянистые выделения, ноющие боли в нижних отделах живота, болезненный половой акт. Хронический эндометрит в 10% случаев является причиной бесплодия, в 60% — невынашивания беременности.
Эндометрит, в зависимости от природы происхождения, может быть:
— специфическим (инфекционным). Это вирусные, хламидийные, бактериальные, протозойные, грибковые и паразитарные эндометриты. Они могут быть вызваны вирусом простого герпеса, цитомегаловирусыом, хламидииями, микобактериями туберкулеза, токсоплазмы, микоплазмы, кандиды, лучистыми грибками, гонококками и т. д.
Это вирусные, хламидийные, бактериальные, протозойные, грибковые и паразитарные эндометриты. Они могут быть вызваны вирусом простого герпеса, цитомегаловирусыом, хламидииями, микобактериями туберкулеза, токсоплазмы, микоплазмы, кандиды, лучистыми грибками, гонококками и т. д.
— неспецифическим. При этой форме болезнетворная флора в матке не выявляется. Причиной такого эндометрита может быть бактериальный вагинозоз, ВИЧ-инфекция, наличие внутриматочной спирали, прием гормональных контрацептивов.
Диагностика острого эндометрита включает сбор анамнеза, гинекологический осмотр, клинического анализа крови и бактериоскопического исследования мазков. Лечение проводится стационарно, в связи с риском развития тяжелых септических осложнений (параметрит, пельвиоперитонит, перитонит).
Решение проблемы хронического эндометрита предполагает комплексный подход, включающий противомикробное, иммуномодулирующее, общеукрепляющее, физиотерапевтическое лечение. В ряде случаев прибегают к раздельному диагностическому выскабливанию с биопсией и последующим гистологическим исследованием, гистероскопии.
В ряде случаев прибегают к раздельному диагностическому выскабливанию с биопсией и последующим гистологическим исследованием, гистероскопии.
Эффективность лечения хронического эндометрита оценивают по следующим критериям:
— восстановление морфологической структуры эндометрия (по результатам УЗИ)
— восстановление менструального цикла.
— устранение инфекции
— исчезновение патологических симптомов (болей, кровотечений)
— восстановление детородной функции
После перенесенного эндометрита возможно формирование спаечного процесса в матке (внутриматочные синехии), образование полипов и кист эндометрия. При эндометрите в воспалительный процесс могут вовлекаться яичники и маточные трубы, может развиваться перитонит, спайки кишечника и органов малого таза (спаечная болезнь).
границ | Макрофаги, связанные с эндометриозом: происхождение, фенотип и функция
Фон
Эндометриоз определяется наличием эндометриоподобной ткани вне матки («поражения»), как правило, на слизистой оболочке тазовой полости (брюшине) или на яичниках.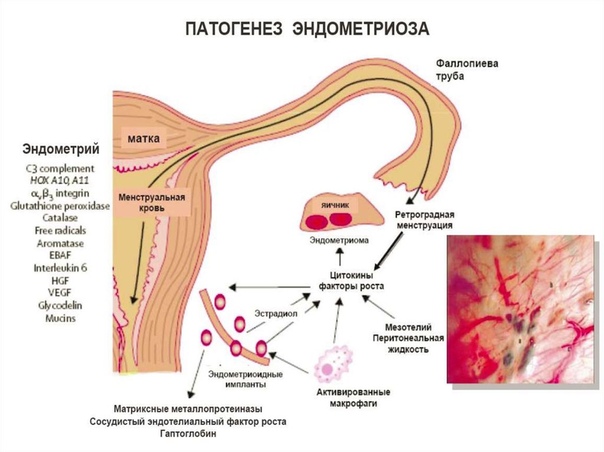 Эндометриоз является гетерогенным заболеванием, и поражения можно разделить на три подтипа: поверхностный перитонеальный, глубокий (инфильтрирующий) и яичниковый («эндометриомы»), где у одного и того же пациента может существовать более одного подтипа, и поверхностный перитонеальный эндометриоз. является наиболее распространенной формой заболевания (1, 2).Это связано с изнурительной хронической тазовой болью, бесплодием и усталостью. По оценкам, им страдают 6–10% женщин репродуктивного возраста (3), до 50% женщин с бесплодием (4) и преобладают у 71–97% женщин с хронической тазовой болью (5). Симптомы, связанные с эндометриозом, могут негативно влиять на психическое, физическое и социальное благополучие и качество жизни (6). Неблагоприятные исходы беременности также связаны с заболеванием, включая преждевременные роды, преэклампсию, внематочную беременность, выкидыш и задержку внутриутробного развития (7).Эндометриоз оказывает значительное социально-экономическое воздействие, ежегодно обходясь Великобритании примерно в 8,5 млрд фунтов стерлингов, при этом социальные издержки в основном связаны с потерей производительности (8, 9).
Эндометриоз является гетерогенным заболеванием, и поражения можно разделить на три подтипа: поверхностный перитонеальный, глубокий (инфильтрирующий) и яичниковый («эндометриомы»), где у одного и того же пациента может существовать более одного подтипа, и поверхностный перитонеальный эндометриоз. является наиболее распространенной формой заболевания (1, 2).Это связано с изнурительной хронической тазовой болью, бесплодием и усталостью. По оценкам, им страдают 6–10% женщин репродуктивного возраста (3), до 50% женщин с бесплодием (4) и преобладают у 71–97% женщин с хронической тазовой болью (5). Симптомы, связанные с эндометриозом, могут негативно влиять на психическое, физическое и социальное благополучие и качество жизни (6). Неблагоприятные исходы беременности также связаны с заболеванием, включая преждевременные роды, преэклампсию, внематочную беременность, выкидыш и задержку внутриутробного развития (7).Эндометриоз оказывает значительное социально-экономическое воздействие, ежегодно обходясь Великобритании примерно в 8,5 млрд фунтов стерлингов, при этом социальные издержки в основном связаны с потерей производительности (8, 9). Диагноз с момента появления симптомов может занять в среднем 7–8 лет. Как правило, диагноз эндометриоза ставится путем лапароскопической оценки таза, однако для диагностики глубоких поражений и эндометриом могут использоваться такие методы визуализации, как трансвагинальная сонография и магнитно-резонансная томография (10–12).
Диагноз с момента появления симптомов может занять в среднем 7–8 лет. Как правило, диагноз эндометриоза ставится путем лапароскопической оценки таза, однако для диагностики глубоких поражений и эндометриом могут использоваться такие методы визуализации, как трансвагинальная сонография и магнитно-резонансная томография (10–12).
Поражения при эндометриозе характеризуются наличием эктопической эндометриоподобной ткани, содержащей железы и строму, однако недавняя переоценка определения заболевания предполагает, что фиброз и гладкомышечные клетки являются более устойчивыми признаками поражений (13). Эндометриоз классифицируется как эстрогензависимое хроническое воспалительное состояние : симптомы модулируются гормонами яичников, а поражения вызывают интенсивное воспаление в полости таза. Поражения также васкуляризируются и инфильтрируются чувствительными нервными волокнами (рис. 1).Эктопические клетки эндометрия и локальная воспалительная среда активируют нервные волокна в очагах поражения, устанавливая диалог с центральной нервной системой и вызывая болевые ощущения. Поражения ведут себя как эутопический эндометрий и демонстрируют циклические кровотечения в полость таза в ответ на гормоны яичников, что усиливает воспаление (14). Классификация заболеваний (rAFS/rASRM) в настоящее время основывается на размере поражения, локализации, степени инфильтрации поражения в ткани и наличии спаек.Классификация варьируется от стадии I («минимальная») до стадии IV («тяжелая») (15).
Поражения ведут себя как эутопический эндометрий и демонстрируют циклические кровотечения в полость таза в ответ на гормоны яичников, что усиливает воспаление (14). Классификация заболеваний (rAFS/rASRM) в настоящее время основывается на размере поражения, локализации, степени инфильтрации поражения в ткани и наличии спаек.Классификация варьируется от стадии I («минимальная») до стадии IV («тяжелая») (15).
Рисунок 1 . Эндометриоз является хроническим воспалительным заболеванием. Эндометриоз характеризуется наличием эндометриоподобной ткани, обнаруживаемой вне матки, чаще всего в брюшной полости. Очаги эндометриоза гетерогенны, но обычно содержат эндометриальные стромальные клетки и эпителиальные железы, инфильтраты иммунных клеток, васкуляризированы и иннервированы нервами. Создано с помощью BioRender.ком.
Современные методы лечения эндометриоза направлены на облегчение боли, связанной с эндометриозом, и/или на лечение бесплодия, связанного с этим заболеванием, и включают хирургическое и медикаментозное лечение (2, 3). Подавление яичников ограничивает активность и рост поражений, что приводит к уменьшению болевых симптомов. Общие методы подавления яичников включают пероральные контрацептивы и агонисты гонадотропин-рилизинг-гормона (ГнРГ) (16) с ЗГТ прикрытия. В то время как подавление яичников может облегчить болевые симптомы, лечение также является контрацептивным и поэтому не подходит для женщин, стремящихся к зачатию.Кроме того, агонисты ГнРГ связаны с побочными эффектами, такими как потеря памяти, бессонница и приливы, в недавнем исследовании пациентов с эндометриозом при длительном применении (17). Лечение также может включать нестероидные противовоспалительные препараты, такие как ибупрофен, однако долгосрочное обезболивание у женщин с эндометриозом часто включает комбинацию методов лечения. Наряду с медикаментозной терапией лапароскопическая хирургия по удалению поражений может облегчить симптомы у некоторых пациентов, однако до 50% женщин испытывают рецидив симптомов в течение 2 лет после операции (11).
Подавление яичников ограничивает активность и рост поражений, что приводит к уменьшению болевых симптомов. Общие методы подавления яичников включают пероральные контрацептивы и агонисты гонадотропин-рилизинг-гормона (ГнРГ) (16) с ЗГТ прикрытия. В то время как подавление яичников может облегчить болевые симптомы, лечение также является контрацептивным и поэтому не подходит для женщин, стремящихся к зачатию.Кроме того, агонисты ГнРГ связаны с побочными эффектами, такими как потеря памяти, бессонница и приливы, в недавнем исследовании пациентов с эндометриозом при длительном применении (17). Лечение также может включать нестероидные противовоспалительные препараты, такие как ибупрофен, однако долгосрочное обезболивание у женщин с эндометриозом часто включает комбинацию методов лечения. Наряду с медикаментозной терапией лапароскопическая хирургия по удалению поражений может облегчить симптомы у некоторых пациентов, однако до 50% женщин испытывают рецидив симптомов в течение 2 лет после операции (11).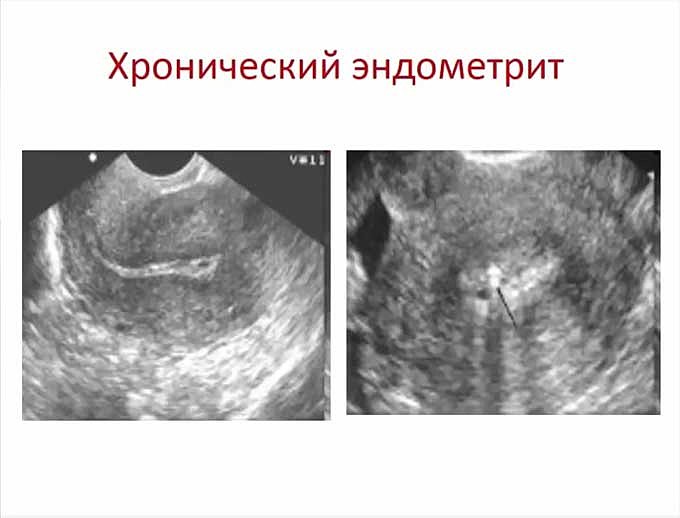 Существующие варианты лечения не имеют значительных клинически доказанных преимуществ и направлены на облегчение симптомов, а не на лечение болезни (18). Следовательно, существует острая клиническая потребность в новых негормональных методах лечения, которые имеют меньше побочных эффектов и эффективно лечат эндометриоз на протяжении всей жизни, без необходимости повторных операций или подавления фертильности.
Существующие варианты лечения не имеют значительных клинически доказанных преимуществ и направлены на облегчение симптомов, а не на лечение болезни (18). Следовательно, существует острая клиническая потребность в новых негормональных методах лечения, которые имеют меньше побочных эффектов и эффективно лечат эндометриоз на протяжении всей жизни, без необходимости повторных операций или подавления фертильности.
Этиология и естественная история
Широко признано, что эндометриоз является многофакторным заболеванием, и патофизиология эндометриоза, безусловно, может быть связана с рядом элементов, которые явно способствуют заболеванию.Имеющиеся данные свидетельствуют о том, что эндометриоз имеет наследственный компонент из-за высокой семейной заболеваемости (19–22). Метаанализ восьми полногеномных ассоциативных исследований (GWAS) выявил шесть локусов, связанных с эндометриозом (23). Гены, вовлеченные в заболевание, включали гены, участвующие в регуляции эпителиальных клеток и метаболизме гормонов, особенно гены, участвующие в регуляции гормональных ответов в тканях (24, 25). Эти результаты GWAS не удивительны, поскольку симптомы эндометриоза модулируются половыми стероидами яичников; ранний возраст наступления менархе является фактором риска развития эндометриоза, что позволяет предположить, что повышенное воздействие эстрогена может привести к повышенному риску заболевания (26).Очаги эндометриоза аберрантно экспрессируют ряд стероидогенных ферментов, включая ароматазу и 17β-гидроксистериоддегидрогеназу (17β-HSD), что приводит к увеличению синтеза и снижению метаболизма эстрогена (27–29), так что местные уровни остаются высокими. Передача сигналов эстрогена модулирует большое количество последующих болезненных процессов в очагах эндометриоза, обзор которых представлен Yilmaz and Bulun (30), Liang et al. (31) и Ризнер (32). Дисфункция иммунных клеток также неразрывно связана с патофизиологией эндометриоза.Изменения в популяциях иммунных клеток наблюдались в перитонеальной жидкости женщин с эндометриозом; в частности, у женщин с эндометриозом больше перитонеальных макрофагов (33), нейтрофилов и дендритных клеток (34).
Эти результаты GWAS не удивительны, поскольку симптомы эндометриоза модулируются половыми стероидами яичников; ранний возраст наступления менархе является фактором риска развития эндометриоза, что позволяет предположить, что повышенное воздействие эстрогена может привести к повышенному риску заболевания (26).Очаги эндометриоза аберрантно экспрессируют ряд стероидогенных ферментов, включая ароматазу и 17β-гидроксистериоддегидрогеназу (17β-HSD), что приводит к увеличению синтеза и снижению метаболизма эстрогена (27–29), так что местные уровни остаются высокими. Передача сигналов эстрогена модулирует большое количество последующих болезненных процессов в очагах эндометриоза, обзор которых представлен Yilmaz and Bulun (30), Liang et al. (31) и Ризнер (32). Дисфункция иммунных клеток также неразрывно связана с патофизиологией эндометриоза.Изменения в популяциях иммунных клеток наблюдались в перитонеальной жидкости женщин с эндометриозом; в частности, у женщин с эндометриозом больше перитонеальных макрофагов (33), нейтрофилов и дендритных клеток (34). Функция также нарушается: NK-клетки обладают сниженной цитотоксичностью (35, 36), а тяжесть заболевания положительно коррелирует со способностью NK-клеток к уничтожению (37). Перитонеальные макрофаги также демонстрируют нарушение фагоцитоза (38). Макрофаги являются наиболее многочисленными иммунными клетками, присутствующими в очагах эндометриоза, и, очевидно, играют центральную роль в патофизиологии эндометриоза.В то время как исследования выявили четкую функциональную роль макрофагов в заболевании, мало что известно о происхождении и фенотипической гетерогенности макрофагов при эндометриозе.
Функция также нарушается: NK-клетки обладают сниженной цитотоксичностью (35, 36), а тяжесть заболевания положительно коррелирует со способностью NK-клеток к уничтожению (37). Перитонеальные макрофаги также демонстрируют нарушение фагоцитоза (38). Макрофаги являются наиболее многочисленными иммунными клетками, присутствующими в очагах эндометриоза, и, очевидно, играют центральную роль в патофизиологии эндометриоза.В то время как исследования выявили четкую функциональную роль макрофагов в заболевании, мало что известно о происхождении и фенотипической гетерогенности макрофагов при эндометриозе.
Наше понимание этиологии эндометриоза остается ограниченным. Все чаще признается, что разные подтипы эндометриоза могут возникать по разным причинам, однако доказательства этого все еще ограничены (39, 40). Ниже обсуждается ряд теорий, и мы размышляем о том, как происхождение и роль макрофагов могут различаться в каждом сценарии:
Наиболее широко принятая теория была постулирована в 1927 году Джоном Сэмпсоном, который заметил, что во время менструации ткань эндометрия может рефлюксировать вверх по фаллопиевым трубам и в полость малого таза, физиологический процесс, известный как « ретроградная менструация» . «Хотя этот процесс происходит примерно у 90% женщин, только у некоторых рефлюксная ткань эндометрия образует очаги эндометриоза (41), а механизмы, лежащие в основе прикрепления ткани эндометрия и развития поражения, остаются неясными. Это можно было предсказать, и исследования на мышах показали, что макрофаги, происходящие из эндометрия, способствуют поражению перитонеального эндометриоза (42). Эти эндометриальные макрофаги могут играть ключевую роль в возникновении поражений, поскольку ранее было продемонстрировано, что макрофаги, перемещающиеся в эндометрий, наиболее распространены во время восстановления после разрыва и отторжения эндометрия с предполагаемой ролью в восстановлении оголенного функционального слоя эндометрия (43).Однако доказательства, подтверждающие эту гипотезу, до сих пор отсутствуют. Другая теория, основанная на диссеминации клеток из матки в брюшную полость, предполагает, что неонатальный ретроградный рефлюкс стволовых/прогениторных клеток эндометрия может быть ответственным за развитие поражений.
«Хотя этот процесс происходит примерно у 90% женщин, только у некоторых рефлюксная ткань эндометрия образует очаги эндометриоза (41), а механизмы, лежащие в основе прикрепления ткани эндометрия и развития поражения, остаются неясными. Это можно было предсказать, и исследования на мышах показали, что макрофаги, происходящие из эндометрия, способствуют поражению перитонеального эндометриоза (42). Эти эндометриальные макрофаги могут играть ключевую роль в возникновении поражений, поскольку ранее было продемонстрировано, что макрофаги, перемещающиеся в эндометрий, наиболее распространены во время восстановления после разрыва и отторжения эндометрия с предполагаемой ролью в восстановлении оголенного функционального слоя эндометрия (43).Однако доказательства, подтверждающие эту гипотезу, до сих пор отсутствуют. Другая теория, основанная на диссеминации клеток из матки в брюшную полость, предполагает, что неонатальный ретроградный рефлюкс стволовых/прогениторных клеток эндометрия может быть ответственным за развитие поражений. Видимое вагинальное кровотечение наблюдается у 3-5% новорожденных женского пола, тогда как скрытое кровотечение может возникать с частотой от 25 до 60% (44). Кровотечения в ближайшем послеродовом периоде сходны с менструальными кровотечениями, поскольку они возникают в ответ на отмену гормонов в результате воздействия прогестерона в период внутриутробного развития.Эта теория предполагает, что стволовые клетки/клетки-предшественники могут имплантироваться в стенку брюшины, где они могут оставаться в состоянии покоя до подросткового возраста, когда повышенный уровень эстрогена может затем способствовать пролиферации и росту засеянных клеток эндометрия. Хотя эта теория представляет правдоподобный механизм образования поражения, в настоящее время отсутствуют доказательства того, что эндометриальные стволовые/прогениторные клетки присутствуют в перитонеальной ткани девочек препубертатного возраста. Теория целомической метаплазии предполагает, что очаги эндометриоза возникают в результате метапластической дифференцировки целомического эпителия в клетки эндометрия, и подтверждается данными, свидетельствующими о том, что очаги эндометриоза могут быть обнаружены у женщин без матки (45).
Видимое вагинальное кровотечение наблюдается у 3-5% новорожденных женского пола, тогда как скрытое кровотечение может возникать с частотой от 25 до 60% (44). Кровотечения в ближайшем послеродовом периоде сходны с менструальными кровотечениями, поскольку они возникают в ответ на отмену гормонов в результате воздействия прогестерона в период внутриутробного развития.Эта теория предполагает, что стволовые клетки/клетки-предшественники могут имплантироваться в стенку брюшины, где они могут оставаться в состоянии покоя до подросткового возраста, когда повышенный уровень эстрогена может затем способствовать пролиферации и росту засеянных клеток эндометрия. Хотя эта теория представляет правдоподобный механизм образования поражения, в настоящее время отсутствуют доказательства того, что эндометриальные стволовые/прогениторные клетки присутствуют в перитонеальной ткани девочек препубертатного возраста. Теория целомической метаплазии предполагает, что очаги эндометриоза возникают в результате метапластической дифференцировки целомического эпителия в клетки эндометрия, и подтверждается данными, свидетельствующими о том, что очаги эндометриоза могут быть обнаружены у женщин без матки (45). Формирование очагов эндометриоза на участках, удаленных от брюшной полости (46, 47), а также идентификация у мужчин в редких случаях (48) подтверждают теорию. При развитии поражений в начале в подростковом возрасте (теория неонатальных стволовых клеток) или после метаплазии можно было бы ожидать, что моноциты рекрутируются в место поражения и/или что перитонеальные макрофаги могут перемещаться в развивающееся поражение и активировать процессы восстановления, которые облегчают создание новых эндометриоподобных эксплантатов.Примечательно, что известно, что стволовые клетки и макрофаги имеют взаимные отношения, при которых стволовые клетки могут способствовать активации макрофагов и фенотипу во время регенеративных процессов, а макрофаги могут диктовать накопление клеток-предшественников/стволовых клеток (49). При эндометриозе мезенхимальные стволовые клетки способствуют принятию макрофагами фенотипа, способствующего восстановлению (50), но дальнейшие исследования взаимосвязи между стволовыми клетками и макрофагами при эндометриозе в настоящее время ограничены.
Формирование очагов эндометриоза на участках, удаленных от брюшной полости (46, 47), а также идентификация у мужчин в редких случаях (48) подтверждают теорию. При развитии поражений в начале в подростковом возрасте (теория неонатальных стволовых клеток) или после метаплазии можно было бы ожидать, что моноциты рекрутируются в место поражения и/или что перитонеальные макрофаги могут перемещаться в развивающееся поражение и активировать процессы восстановления, которые облегчают создание новых эндометриоподобных эксплантатов.Примечательно, что известно, что стволовые клетки и макрофаги имеют взаимные отношения, при которых стволовые клетки могут способствовать активации макрофагов и фенотипу во время регенеративных процессов, а макрофаги могут диктовать накопление клеток-предшественников/стволовых клеток (49). При эндометриозе мезенхимальные стволовые клетки способствуют принятию макрофагами фенотипа, способствующего восстановлению (50), но дальнейшие исследования взаимосвязи между стволовыми клетками и макрофагами при эндометриозе в настоящее время ограничены. Müllerianosis (мюллеровы остатки; нормальная эндометриальная, эндосальпингеальная и эндоцервикальная ткань) предполагает, что смещенная в процессе развития ткань включается в нормальные органы во время органогенеза (51).Возникновение глубокого инфильтративного эндометриоза особенно поддается этой теории, когда ткань эндометрия находится глубоко внутри структуры органа. Предположение может свидетельствовать о роли резидентных в тканях макрофагов в поражениях, возникающих в результате смещения в процессе развития ткани, подобной эндометрию. При активации «спящего» поражения, заложенного во время органогенеза, резидентные в ткани макрофаги могут изменить фенотип и пролиферировать таким образом, что они будут способствовать воспалению, росту и инвазии поражения.Воспаление, возникающее при активации дремлющего поражения, может также приводить к рекрутированию моноцитов, которые дифференцируются в макрофаги, так что макрофаги, резидентные при эндометриозном поражении, состоят из макрофагов, резидентных в тканях и происходящих из моноцитов, подобно тому, что происходит в опухолях (52).
Müllerianosis (мюллеровы остатки; нормальная эндометриальная, эндосальпингеальная и эндоцервикальная ткань) предполагает, что смещенная в процессе развития ткань включается в нормальные органы во время органогенеза (51).Возникновение глубокого инфильтративного эндометриоза особенно поддается этой теории, когда ткань эндометрия находится глубоко внутри структуры органа. Предположение может свидетельствовать о роли резидентных в тканях макрофагов в поражениях, возникающих в результате смещения в процессе развития ткани, подобной эндометрию. При активации «спящего» поражения, заложенного во время органогенеза, резидентные в ткани макрофаги могут изменить фенотип и пролиферировать таким образом, что они будут способствовать воспалению, росту и инвазии поражения.Воспаление, возникающее при активации дремлющего поражения, может также приводить к рекрутированию моноцитов, которые дифференцируются в макрофаги, так что макрофаги, резидентные при эндометриозном поражении, состоят из макрофагов, резидентных в тканях и происходящих из моноцитов, подобно тому, что происходит в опухолях (52).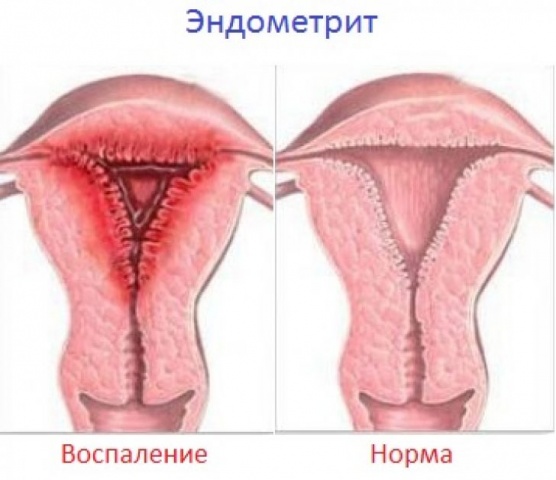 Любые различия, существующие в происхождении, фенотипе и функции макрофагов при различных подтипах поражений эндометриоза, остаются неизвестными.
Любые различия, существующие в происхождении, фенотипе и функции макрофагов при различных подтипах поражений эндометриоза, остаются неизвестными.
Макрофаг: сложная клетка в центре загадочного состояния
Воспаление и дисфункция иммунных клеток занимают центральное место в патофизиологии эндометриоза.В то время как количество и функция ряда лейкоцитов при эндометриозе изменены, очевидно, что макрофаги играют непревзойденную роль в патогенезе заболевания. Мы и другие продемонстрировали, что макрофаги имеют решающее значение для лицензирования роста поражения, стимулирования васкуляризации и иннервации, а также способствуют возникновению боли при расстройстве (53–55). Уроки из различных тканей также ставят макрофаги в центр болезненных состояний, таких как повреждение печени (56), рассеянный склероз (57) и рак (52).Тканевой контекст в конечном итоге диктует роль, которую макрофаги играют в заболевании, но повторяющаяся тема указывает на то, что онтогенез макрофагов в пораженных тканях определяет, как они реагируют и вносят свой вклад в патогенез. Ниже мы рассмотрим доступную литературу по онтогенезу, фенотипу и функциям макрофагов в норме, а затем сосредоточимся на их роли во время воспаления и болезненных состояний. В конечном счете, мы обсуждаем роль, которую макрофаги играют при эндометриозе, в свете того, что можно узнать из других болезненных состояний.
Ниже мы рассмотрим доступную литературу по онтогенезу, фенотипу и функциям макрофагов в норме, а затем сосредоточимся на их роли во время воспаления и болезненных состояний. В конечном счете, мы обсуждаем роль, которую макрофаги играют при эндометриозе, в свете того, что можно узнать из других болезненных состояний.
Макрофаги имеют разное происхождение и разные фенотипы
Онтогенез макрофагов
Макрофаги представляют собой мононуклеарные фагоциты, играющие важную роль в иммунитете (фагоцитирующие патогены, апоптотические клетки и дебрис, презентация антигена и модуляция других популяций лейкоцитов). Они присутствуют во всех тканях организма (58, 59) и играют различные тканеспецифические роли в поддержании гомеостаза. Большая часть наших знаний об онтогенезе макрофагов получена из исследований, проведенных на мышах.Макрофаги происходят из трех ключевых популяций; желточный мешок эмбриона, печень плода и постнатально, кроветворение в костном мозге (рис. 2). Самые ранние макрофаги возникают из эритромиелоидных предшественников (EMP), продуцируемых во время примитивного кроветворения во внеэмбриональном желточном мешке на 7,5 и 8,25 дня эмбрионального развития (Е). После установления кровообращения макрофаги, полученные из ЭМИ, засевают ткань плода. За исключением микроглии, эти макрофаги частично или полностью замещаются моноцитами, происходящими из печени плода, которые в тканях дифференцируются в макрофаги.Макрофаги, происходящие из моноцитов печени плода, могут сохраняться во взрослом возрасте и формировать популяцию резидентных макрофагов в тканях, подвергаясь самообновлению, например, в брюшине, селезенке, легких, коже и печени. В других органах тканевые макрофаги, полученные из моноцитов печени плода, постепенно замещаются рекрутированными моноцитами из костного мозга. Этот процесс происходит в таких тканях, как кишечник и дерма (60–64).
После установления кровообращения макрофаги, полученные из ЭМИ, засевают ткань плода. За исключением микроглии, эти макрофаги частично или полностью замещаются моноцитами, происходящими из печени плода, которые в тканях дифференцируются в макрофаги.Макрофаги, происходящие из моноцитов печени плода, могут сохраняться во взрослом возрасте и формировать популяцию резидентных макрофагов в тканях, подвергаясь самообновлению, например, в брюшине, селезенке, легких, коже и печени. В других органах тканевые макрофаги, полученные из моноцитов печени плода, постепенно замещаются рекрутированными моноцитами из костного мозга. Этот процесс происходит в таких тканях, как кишечник и дерма (60–64).
Рисунок 2 . Макрофаги — мононуклеарные фагоциты. Тканевые макрофаги высеваются во время внутриутробной жизни из печени плода и желточного мешка и подвергаются самообновлению.У взрослых предшественники моноцитов выходят из костного мозга в кровоток, где они затем могут проникать в ткани и дифференцироваться в макрофаги.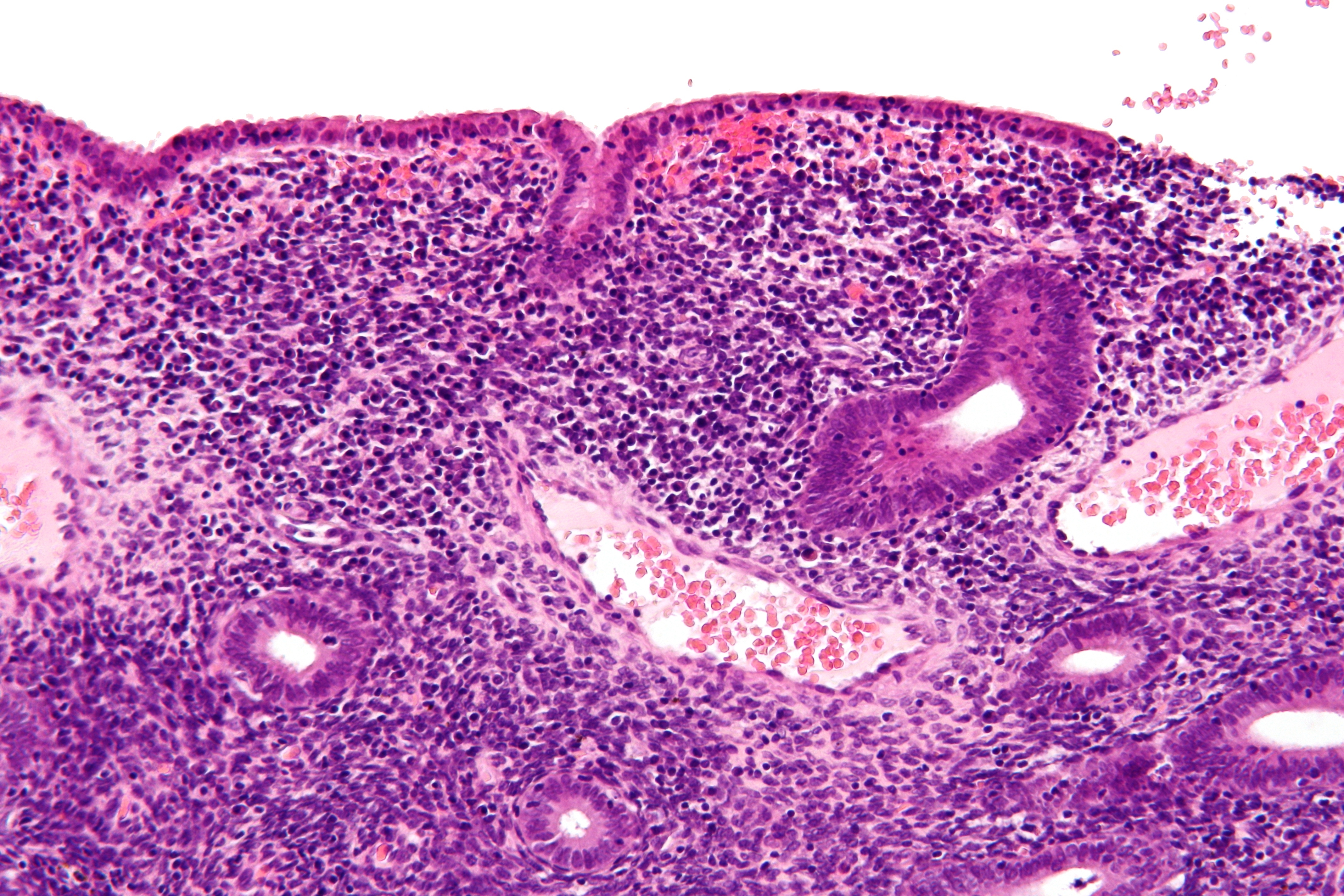 В тканях макрофаги модулируют свой фенотип в зависимости от местных цитокинов и факторов роста до специфических тканевых или ассоциированных с заболеванием фенотипов.
В тканях макрофаги модулируют свой фенотип в зависимости от местных цитокинов и факторов роста до специфических тканевых или ассоциированных с заболеванием фенотипов.
У человека моноциты периферической крови образуют две основные популяции; CD14 hi CD16 lo и CD14 lo CD16 hi , хотя можно идентифицировать промежуточную популяцию.Субпопуляция CD14 hi CD16 lo (классическая) наиболее распространена в крови. При воспалении классические моноциты проникают в ткани, дифференцируются в макрофаги или дендритные клетки (65) и выполняют такие функции, как удаление апоптотических телец, стимуляция ангиогенеза и восстановление целостности тканей (66). CD14 lo CD16 hi («неклассические») моноциты также проявляют экстравазацию в ткани во время воспаления, но они инфильтрируют ткани позже в ходе воспалительного процесса и проявляют склонность к дифференцировке в «ранозаживляющие» макрофаги (67). Ключевая роль неклассической популяции моноцитов заключается в патрулировании кровеносных сосудов вдоль слоя эндотелиальных клеток, обеспечивая иммунный надзор за сосудами и окружающими тканями (68). Классические моноциты также патрулируют ткани и играют гомеостатическую роль в стационарных условиях, не дифференцируясь в макрофаги (69). Классические и неклассические моноциты у человека аналогичны Ly6C hi классическим и Ly6C lo неклассическим моноцитам у мышей и проявляют значительную гомологию при транскрипционном анализе (70, 71).У мышей классические моноциты могут быть классифицированы как Ly6c Hi CX3CR1 Lo CD43 Lo CD43 HI и не классические моноциты Ly6C LO CX3CR1 HI CD43 HI CCR2 LO , с все популяции моноцитов представляют собой CD11b hi F4/80 int (65).
Ключевая роль неклассической популяции моноцитов заключается в патрулировании кровеносных сосудов вдоль слоя эндотелиальных клеток, обеспечивая иммунный надзор за сосудами и окружающими тканями (68). Классические моноциты также патрулируют ткани и играют гомеостатическую роль в стационарных условиях, не дифференцируясь в макрофаги (69). Классические и неклассические моноциты у человека аналогичны Ly6C hi классическим и Ly6C lo неклассическим моноцитам у мышей и проявляют значительную гомологию при транскрипционном анализе (70, 71).У мышей классические моноциты могут быть классифицированы как Ly6c Hi CX3CR1 Lo CD43 Lo CD43 HI и не классические моноциты Ly6C LO CX3CR1 HI CD43 HI CCR2 LO , с все популяции моноцитов представляют собой CD11b hi F4/80 int (65).
Фенотип макрофагов
Макрофаги реагируют на местное микроокружение и изменяют как свой транскриптом, так и фенотип в ответ на локальные сигналы (72). Исторически сложилось так, что макрофаги были разделены либо на «M1» классически, либо на «M2» альтернативно активированные клетки. Классически активированные макрофаги связаны с воспалением и экспрессируют провоспалительные маркеры. Альтернативно активированные макрофаги связаны с гомеостазом, заживлением ран и иммуномодуляцией (73). Эти экстремальные состояния поляризации действительно существуют только in vitro , где исследования обычно используют стимуляцию гранулоцитарно-макрофагальным колониестимулирующим фактором (GM-CSF) и цитокином IFN-γ (интерферон γ) для образования макрофагов M1, а также стимуляцию колонией макрофагов. -стимулирующий фактор (M-CSF) и цитокины интерлейкин-4 (IL-4) и интерлейкин-10 (IL-10) для образования M2-активированных макрофагов (74).Хотя эта классификационная система является полезным инструментом для исследования макрофагов в крайних случаях активации, в настоящее время признано, что макрофагов in vivo демонстрируют широкий спектр фенотипов, специфичных для тканей и заболеваний, и система M1/M2 не может представлять разнообразные природа и сложность фенотипа макрофагов (75, 76).
Исторически сложилось так, что макрофаги были разделены либо на «M1» классически, либо на «M2» альтернативно активированные клетки. Классически активированные макрофаги связаны с воспалением и экспрессируют провоспалительные маркеры. Альтернативно активированные макрофаги связаны с гомеостазом, заживлением ран и иммуномодуляцией (73). Эти экстремальные состояния поляризации действительно существуют только in vitro , где исследования обычно используют стимуляцию гранулоцитарно-макрофагальным колониестимулирующим фактором (GM-CSF) и цитокином IFN-γ (интерферон γ) для образования макрофагов M1, а также стимуляцию колонией макрофагов. -стимулирующий фактор (M-CSF) и цитокины интерлейкин-4 (IL-4) и интерлейкин-10 (IL-10) для образования M2-активированных макрофагов (74).Хотя эта классификационная система является полезным инструментом для исследования макрофагов в крайних случаях активации, в настоящее время признано, что макрофагов in vivo демонстрируют широкий спектр фенотипов, специфичных для тканей и заболеваний, и система M1/M2 не может представлять разнообразные природа и сложность фенотипа макрофагов (75, 76). Транскрипционный анализ популяций мышиных макрофагов из разных тканей демонстрирует минимальное перекрытие в экспрессии мРНК, что отражает расхождение в паттернах экспрессии генов (77).Эта гетерогенность отражает способность макрофагов модулировать экспрессию своих генов в ответ на локальные тканевые сигналы, становясь специализированными в своей тканевой нише, будь то в здоровом или больном состоянии. При заболевании макрофаги могут модулировать свой фенотип в зависимости от стадии или тяжести заболевания, и механизмы, лежащие в основе этого, имеют решающее значение для понимания их точной роли в патогенезе. Таким образом, определение фенотипов макрофагов при болезненных состояниях с потенциалом модуляции фенотипа макрофагов или специфического воздействия на макрофаги, специфичные для заболевания, для клинической пользы является ключевым направлением исследований (72, 78–80).
Транскрипционный анализ популяций мышиных макрофагов из разных тканей демонстрирует минимальное перекрытие в экспрессии мРНК, что отражает расхождение в паттернах экспрессии генов (77).Эта гетерогенность отражает способность макрофагов модулировать экспрессию своих генов в ответ на локальные тканевые сигналы, становясь специализированными в своей тканевой нише, будь то в здоровом или больном состоянии. При заболевании макрофаги могут модулировать свой фенотип в зависимости от стадии или тяжести заболевания, и механизмы, лежащие в основе этого, имеют решающее значение для понимания их точной роли в патогенезе. Таким образом, определение фенотипов макрофагов при болезненных состояниях с потенциалом модуляции фенотипа макрофагов или специфического воздействия на макрофаги, специфичные для заболевания, для клинической пользы является ключевым направлением исследований (72, 78–80).
Эндометриальные макрофаги
Эндометрий является уникальной и очень динамичной тканью, которая подвергается циклической пролиферации, дифференцировке, отторжению (менструации) и репарации в ответ на эстроген и прогестерон яичников во время менструального цикла. В эндометрии с нормальным циклом приток макрофагов происходит во время секреторной и менструальной фаз наряду с сопутствующим увеличением цитокинов и протеаз макрофагов (81). Данные мышиной модели разрушения и восстановления эндометрия выявили приток классических моноцитов, которые дифференцировались в макрофаги в эндометрии во время фазы восстановления менструального цикла (43).Экссудация моноцитов из кровеносных сосудов в эндометрий регулируется CCL2 (82, 83) и хемокиновым рецептором 1 CX3C (CX3CR1) (84). Приток макрофагов в эндометрий соответствует многочисленным ролям, которые они, как предполагается, играют в модуляции дифференцировки, разрушения и восстановления эндометрия. Предполагается, что во время пролиферативной фазы макрофаги играют роль в регенерации и пролиферации функционального слоя эндометрия и экспрессируют маркеры активации и адгезии CD54, CD69 и CD71 (85).Макрофаги также участвуют в регуляции ремоделирования желез (86) и ангиогенеза во время секреторной фазы посредством продукции фактора роста эндотелия сосудов (VEGF) (87).
В эндометрии с нормальным циклом приток макрофагов происходит во время секреторной и менструальной фаз наряду с сопутствующим увеличением цитокинов и протеаз макрофагов (81). Данные мышиной модели разрушения и восстановления эндометрия выявили приток классических моноцитов, которые дифференцировались в макрофаги в эндометрии во время фазы восстановления менструального цикла (43).Экссудация моноцитов из кровеносных сосудов в эндометрий регулируется CCL2 (82, 83) и хемокиновым рецептором 1 CX3C (CX3CR1) (84). Приток макрофагов в эндометрий соответствует многочисленным ролям, которые они, как предполагается, играют в модуляции дифференцировки, разрушения и восстановления эндометрия. Предполагается, что во время пролиферативной фазы макрофаги играют роль в регенерации и пролиферации функционального слоя эндометрия и экспрессируют маркеры активации и адгезии CD54, CD69 и CD71 (85).Макрофаги также участвуют в регуляции ремоделирования желез (86) и ангиогенеза во время секреторной фазы посредством продукции фактора роста эндотелия сосудов (VEGF) (87). Во время менструации макрофаги играют роль в инициации отторжения эндометрия, секретируя матриксные металлопротеиназы (ММП) (88). В частности, секреция ММП-12, ММП-9 и ММП-14 необходима для разрушения функционального слоя эндометрия во время менструации (89–91).
Во время менструации макрофаги играют роль в инициации отторжения эндометрия, секретируя матриксные металлопротеиназы (ММП) (88). В частности, секреция ММП-12, ММП-9 и ММП-14 необходима для разрушения функционального слоя эндометрия во время менструации (89–91).
В ответ на эстроген макрофаги увеличивают свою пролиферативную способность и подвергаются активации, чтобы принять фенотип, который представляет собой популяцию, более «подобную заживлению ран» (92).Таким образом, передача сигналов эстрогена может ускорить процесс заживления ран, и это частично регулируется увеличением продукции протеаз макрофагов, ММП, фактора роста фибробластов, VEGF и цитокинов, таких как резистин-подобный альфа (RELMα) (92–94). Макрофаги эндометрия не экспрессируют рецептор прогестерона (95), однако экспрессия генов макрофагов значительно изменяется в ответ на прогестерон (96), что указывает на непрямой метод регуляции. Интересно, что воздействие кортизола увеличивает экспрессию ангиогенных генов, таких как CXCL2, CXCL8 и VEGFC, в макрофагах in vitro , что позволяет предположить, что локальные уровни кортизола могут быть важны для регуляции ангиогенеза в ремоделирующемся эндометрии (97). В совокупности эти данные указывают на то, что макрофаги являются ключевыми игроками в усилении динамического ремоделирования и восстановления в эндометрии, и это регулируется воздействием местных цитокинов, факторов роста и гормонов, которые модулируют их фенотип, функцию и рекрутирование в течение менструального цикла. Однако по сравнению с другими тканевыми макрофагами фенотип и функция эндометриальных макрофагов, а также механизмы, регулирующие их привлечение и активацию, охарактеризованы значительно хуже.
В совокупности эти данные указывают на то, что макрофаги являются ключевыми игроками в усилении динамического ремоделирования и восстановления в эндометрии, и это регулируется воздействием местных цитокинов, факторов роста и гормонов, которые модулируют их фенотип, функцию и рекрутирование в течение менструального цикла. Однако по сравнению с другими тканевыми макрофагами фенотип и функция эндометриальных макрофагов, а также механизмы, регулирующие их привлечение и активацию, охарактеризованы значительно хуже.
Перитонеальные макрофаги
Мышь
Макрофаги брюшной полости являются одной из наиболее изученных популяций макрофагов у мышей, в основном из-за простоты их выделения. Две подгруппы перитонеальных макрофагов распознаются у мышей на основе дифференциальной экспрессии F4/80 и MHC II. Тканевые резиденты, так называемые «крупные» (из-за их большего размера) перитонеальные макрофаги (LpM) — это F4/80 hi , MHC II lo , а «малые» перитонеальные макрофаги (SpM) из моноцитов — F4. /80 lo MHC II привет (98).LpM представляют собой наиболее обильную популяцию макрофагов в брюшной полости в равновесном состоянии и образуют резидентную популяцию в тканях, они являются фагоцитами и выполняют функции иммунного надзора и гомеостата в брюшной полости (98), а также опосредуют рекрутирование и поддержание B1 B-клеток. Они также связаны с регуляцией кишечного иммунитета (99). LpM самообновляется, и пролиферативная способность LpM регулируется GATA-связывающим фактором 6 (Gata6), транскрипционным фактором, уникально экспрессируемым LpM в брюшной полости, который также регулирует фенотип макрофагов (100).У мышей популяция LpM состоит в основном из клеток эмбрионального происхождения, однако макрофаги моноцитарного происхождения действительно замещают LpM эмбрионального происхождения с течением времени, процесс, который сильно зависит от пола и возраста и медленнее у самок. Со временем моноциты Ly6C hi проникают в брюшную полость CCR2-зависимым образом и транзиентно дифференцируются в SpM перед переходом в резидентные в ткани LpM (101).
/80 lo MHC II привет (98).LpM представляют собой наиболее обильную популяцию макрофагов в брюшной полости в равновесном состоянии и образуют резидентную популяцию в тканях, они являются фагоцитами и выполняют функции иммунного надзора и гомеостата в брюшной полости (98), а также опосредуют рекрутирование и поддержание B1 B-клеток. Они также связаны с регуляцией кишечного иммунитета (99). LpM самообновляется, и пролиферативная способность LpM регулируется GATA-связывающим фактором 6 (Gata6), транскрипционным фактором, уникально экспрессируемым LpM в брюшной полости, который также регулирует фенотип макрофагов (100).У мышей популяция LpM состоит в основном из клеток эмбрионального происхождения, однако макрофаги моноцитарного происхождения действительно замещают LpM эмбрионального происхождения с течением времени, процесс, который сильно зависит от пола и возраста и медленнее у самок. Со временем моноциты Ly6C hi проникают в брюшную полость CCR2-зависимым образом и транзиентно дифференцируются в SpM перед переходом в резидентные в ткани LpM (101). Т.о., LpM составляют как эмбриональные клетки, так и клетки, происходящие из моноцитов, и было показано, что эти две популяции транскрипционно отличаются друг от друга (101).СпМ вовлечены в воспалительную реакцию в брюшной полости, однако их роль в стабильном состоянии брюшной полости остается неясной (102).
Т.о., LpM составляют как эмбриональные клетки, так и клетки, происходящие из моноцитов, и было показано, что эти две популяции транскрипционно отличаются друг от друга (101).СпМ вовлечены в воспалительную реакцию в брюшной полости, однако их роль в стабильном состоянии брюшной полости остается неясной (102).
Человек
У человека макрофаги составляют 50% лейкоцитов брюшной полости (103). Тканевые резидентные перитонеальные макрофаги определялись высокой экспрессией рецептора комплемента суперсемейства иммуноглобулинов (CRIg) и низкой экспрессией CCR2. Эти клетки обладают высокой фагоцитарной активностью и более многочисленны в стационарном состоянии, а также демонстрируют профили транскрипции, сходные с популяцией LpM мыши (104).Макрофаги, происходящие из моноцитов человека, в брюшной полости, аналогичные F4/80 lo MHC II hi SpM мыши, были определены как CRIg lo , CCR2 hi . Эта популяция CRIg hi , CCR2 hi у людей имеет сниженную фагоцитарную способность и меньшее количество по сравнению с тканевыми макрофагами CRIg hi CCR2 lo , что согласуется с характеристиками SpM. Однако следует отметить, что у людей было обнаружено, что Gata6 более активен в провоспалительной популяции CRIg lo CCR2 hi (104), что подчеркивает наличие ключевых различий между перитонеальными макрофагами человека и мыши, и критически необходимы дальнейшие исследования, чтобы прояснить эти различия.
Однако следует отметить, что у людей было обнаружено, что Gata6 более активен в провоспалительной популяции CRIg lo CCR2 hi (104), что подчеркивает наличие ключевых различий между перитонеальными макрофагами человека и мыши, и критически необходимы дальнейшие исследования, чтобы прояснить эти различия.
Динамика перитонеальных макрофагов во время воспаления
При воспалении LpM реагируют на раздражители в виде феномена, известного как реакция исчезновения макрофагов (MDR) (105): у мышей количество LpM резко сокращается в основном за счет миграции в сальник, опосредованной ретиноевой кислотой и Gata6 ( 106). Степень потери в популяции LpM сильно зависит от дозы воспалительных стимулов и изучалась на ряде воспалительных моделей, таких как липополисахаридный (LPS), зимозановый или тиогликолятный перитонит (107–109).Было высказано предположение, что LpM, которые сохраняются во время воспаления, играют регулирующую роль в брюшной полости за счет секреции IL-10, противовоспалительного цитокина, который, как также было показано, регулирует количество воспалительных SpM (109). LpM также играют ключевую роль в клиренсе апоптотических клеток во время воспаления (108) и демонстрируют высокую экспрессию Т-клеточного иммуноглобулина и домена муцина, содержащего 4 (Tim4), который распознает фосфатидил-серин на телах апоптотических клеток (110). После разрешения воспаления истощенная популяция LpM увеличивает свою пролиферативную способность посредством механизма, опосредованного колониестимулирующим рецептором фактора 1 (Csf-1r), для восстановления количества LpM (107).Интересно, что было показано, что LpM проникают в печень несосудистым путем в ответ на молекулу АТФ, ассоциированную с повреждением (DAMP), где они играют ключевую роль в регенерации и восстановлении ткани в печени после стерильного повреждения, модулируя их фенотип в ответ на локальные сигналы тканевого микроокружения (111). Эта миграция подразумевает, что LpM обладают способностью выполнять заживление ран и регенерацию тканей во внутренних органах. Кроме того, при снижении числа LpM наблюдается одновременное увеличение SpM и воспалительных моноцитов Ly6C hi в ряде мышиных моделей воспаления брюшины (105).
LpM также играют ключевую роль в клиренсе апоптотических клеток во время воспаления (108) и демонстрируют высокую экспрессию Т-клеточного иммуноглобулина и домена муцина, содержащего 4 (Tim4), который распознает фосфатидил-серин на телах апоптотических клеток (110). После разрешения воспаления истощенная популяция LpM увеличивает свою пролиферативную способность посредством механизма, опосредованного колониестимулирующим рецептором фактора 1 (Csf-1r), для восстановления количества LpM (107).Интересно, что было показано, что LpM проникают в печень несосудистым путем в ответ на молекулу АТФ, ассоциированную с повреждением (DAMP), где они играют ключевую роль в регенерации и восстановлении ткани в печени после стерильного повреждения, модулируя их фенотип в ответ на локальные сигналы тканевого микроокружения (111). Эта миграция подразумевает, что LpM обладают способностью выполнять заживление ран и регенерацию тканей во внутренних органах. Кроме того, при снижении числа LpM наблюдается одновременное увеличение SpM и воспалительных моноцитов Ly6C hi в ряде мышиных моделей воспаления брюшины (105). SpM проявляют провоспалительный ответ при воздействии LPS in vitro , продуцируя высокие уровни хемокинового (CC-мотив) лиганда 5 (Ccl5), хемокинового (CC-мотив) лиганда 3 (Ccl3) и фактора некроза опухоли-α (Tnf -α), в отличие от LpM, которые продуцируют G-CSF и GM-CSF под действием LPS (102). В модели перитонита in vivo SpM также продуцирует большое количество провоспалительных цитокинов, включая Tnf-α, интерлейкин-1β (IL-1β) и Ifn-γ (112), и имеет решающее значение для элиминации инфекции в брюшная полость после бактериального заражения мыши (113).Способность SpM реагировать на воспалительные стимулы, продуцируя провоспалительные цитокины, обеспечивает быстрый ответ на иммунологический вызов в брюшной полости. Было показано, что при разрешении воспаления SpM подвергаются апоптозу (108), но также могут мигрировать в локальные дренирующие лимфатические узлы (114). Однако также было показано, что SpM сохраняются в полости и могут в конечном итоге дифференцироваться в клетки F4/80 hi MHC II lo (115), что позволяет предположить, что воспаление может изменять состав популяций макрофагов брюшной полости, даже после восстановления гомеостаза.
SpM проявляют провоспалительный ответ при воздействии LPS in vitro , продуцируя высокие уровни хемокинового (CC-мотив) лиганда 5 (Ccl5), хемокинового (CC-мотив) лиганда 3 (Ccl3) и фактора некроза опухоли-α (Tnf -α), в отличие от LpM, которые продуцируют G-CSF и GM-CSF под действием LPS (102). В модели перитонита in vivo SpM также продуцирует большое количество провоспалительных цитокинов, включая Tnf-α, интерлейкин-1β (IL-1β) и Ifn-γ (112), и имеет решающее значение для элиминации инфекции в брюшная полость после бактериального заражения мыши (113).Способность SpM реагировать на воспалительные стимулы, продуцируя провоспалительные цитокины, обеспечивает быстрый ответ на иммунологический вызов в брюшной полости. Было показано, что при разрешении воспаления SpM подвергаются апоптозу (108), но также могут мигрировать в локальные дренирующие лимфатические узлы (114). Однако также было показано, что SpM сохраняются в полости и могут в конечном итоге дифференцироваться в клетки F4/80 hi MHC II lo (115), что позволяет предположить, что воспаление может изменять состав популяций макрофагов брюшной полости, даже после восстановления гомеостаза. Множественные судьбы SpM отражают гетерогенность этого клеточного компартмента, но роль субпопуляций SpM в воспалении все еще в значительной степени не определена. Таким образом, в стационарных/гомеостатических условиях LpM проявляют иммунно-надзорную и иммунорегуляторную роль и удаляют апоптотические и стареющие клетки. Роль SpM менее четко определена, но маркеры, которые они экспрессируют, предполагают роль в презентации антигена и активации Т-клеток. Воспалительная провокация тиогликолатом, зимозаном или ЛПС (липополисахаридом) вызывает потерю LpM и увеличение количества SpM за счет рекрутирования и дифференцировки моноцитов.Новые SpM являются провоспалительными, экспрессируют высокие уровни Tnfα, IL-1β и Ifnγ и лучше способны поглощать микробы по сравнению с гомеостатическими SpM. Следует отметить, что воспаление типа 2, характеризующееся повышенным уровнем IL-4, не вызывает МЛУ, а вместо этого F4/80 hi LpM накапливается в брюшной полости и проявляет фенотип, способствующий восстановлению (116).
Множественные судьбы SpM отражают гетерогенность этого клеточного компартмента, но роль субпопуляций SpM в воспалении все еще в значительной степени не определена. Таким образом, в стационарных/гомеостатических условиях LpM проявляют иммунно-надзорную и иммунорегуляторную роль и удаляют апоптотические и стареющие клетки. Роль SpM менее четко определена, но маркеры, которые они экспрессируют, предполагают роль в презентации антигена и активации Т-клеток. Воспалительная провокация тиогликолатом, зимозаном или ЛПС (липополисахаридом) вызывает потерю LpM и увеличение количества SpM за счет рекрутирования и дифференцировки моноцитов.Новые SpM являются провоспалительными, экспрессируют высокие уровни Tnfα, IL-1β и Ifnγ и лучше способны поглощать микробы по сравнению с гомеостатическими SpM. Следует отметить, что воспаление типа 2, характеризующееся повышенным уровнем IL-4, не вызывает МЛУ, а вместо этого F4/80 hi LpM накапливается в брюшной полости и проявляет фенотип, способствующий восстановлению (116). Таким образом, кажется, что при различных воспалительных воздействиях LpM склонны проявлять фенотип, способствующий восстановлению, в то время как SpM принимают фенотип, способствующий воспалению.Механистические исследования перитонеальных макрофагов у людей сложны, и поэтому знания об этом физиологическом процессе у людей минимальны.
Таким образом, кажется, что при различных воспалительных воздействиях LpM склонны проявлять фенотип, способствующий восстановлению, в то время как SpM принимают фенотип, способствующий воспалению.Механистические исследования перитонеальных макрофагов у людей сложны, и поэтому знания об этом физиологическом процессе у людей минимальны.
Макрофаги могут способствовать заболеванию
Уникальная и разнообразная роль, которую макрофаги играют в поддержании здоровых тканей, отражается в их ключевой роли в развитии, поддержании и прогрессировании ряда заболеваний (72). Возмущения макрофагов перитонеальной полости и функциональная дисрегуляция связаны с рядом неблагоприятных клинических исходов.Например, увеличение перитонеальных макрофагов было связано с негативными исходами у пациентов с перитонитом (109), а нарушение регуляции перитонеальных макрофагов было связано с острым панкреатитом, когда перитонеальные макрофаги продуцируют повышенные уровни провоспалительных цитокинов, которые усугубляют заболевание (115). . И наоборот, было показано, что макрофаги защищают от образования спаек, частого осложнения после абдоминальной хирургии (117), что указывает на то, что дисфункция макрофагов может способствовать образованию спаек.Таким образом, макрофаги неразрывно связаны с заболеванием брюшной полости у человека.
. И наоборот, было показано, что макрофаги защищают от образования спаек, частого осложнения после абдоминальной хирургии (117), что указывает на то, что дисфункция макрофагов может способствовать образованию спаек.Таким образом, макрофаги неразрывно связаны с заболеванием брюшной полости у человека.
Хотя эндометриоз является доброкачественным заболеванием, можно провести ряд параллелей между этим состоянием и раком (118). Макрофаги однозначно находятся в центре патофизиологии обоих заболеваний. Инфильтрация макрофагов в опухолях является предиктором неблагоприятных клинических исходов при злокачественных новообразованиях (119, 120), что связано с тем, что макрофаги способствуют возникновению, прогрессированию и метастазированию в большинстве случаев рака (75).В последнее десятилетие основное внимание уделялось определению популяций, которые составляют макрофаги, ассоциированные с опухолью (ТАМ). В мышиной модели рака молочной железы воспалительные моноциты Ly6C hi рекрутируются в места метастазирования посредством CCR2/CCL2-опосредованного механизма для образования ТАМ. Ингибирование передачи сигналов CCL2/CCR2 антителом против CCL2 ингибировало рекрутирование моноцитов, тем самым ингибируя метастазирование и продлевая выживаемость мышей (121). Сходным образом мышиные модели карциномы легкого Льюиса продемонстрировали, что ТАМ были получены из CCR2-управляемого рекрутирования моноцитов Ly6C hi , а блокирование CCL2 уменьшало рост опухоли (122, 123).Кроме того, резидентные в тканях макрофаги также участвуют в патофизиологии рака и могут вносить вклад в популяцию ТАМ. Например, в мышиной модели аденокарциномы протоков поджелудочной железы Zhu et al. продемонстрировали с использованием модели парабиоза, что ТАМ были получены как из эмбрионально полученных тканевых резидентных макрофагов, так и из циркулирующих моноцитов Ly6C hi . Во время развития опухоли макрофаги эмбрионального происхождения размножались за счет пролиферации in situ и играли профиброзную роль в опухолях.При использовании нейтрализующего антитела Csf-1r и липосомы клодроната для истощения макрофагов, находящихся в тканях, наблюдалось уменьшение размера опухоли и повышение выживаемости мышей.
Ингибирование передачи сигналов CCL2/CCR2 антителом против CCL2 ингибировало рекрутирование моноцитов, тем самым ингибируя метастазирование и продлевая выживаемость мышей (121). Сходным образом мышиные модели карциномы легкого Льюиса продемонстрировали, что ТАМ были получены из CCR2-управляемого рекрутирования моноцитов Ly6C hi , а блокирование CCL2 уменьшало рост опухоли (122, 123).Кроме того, резидентные в тканях макрофаги также участвуют в патофизиологии рака и могут вносить вклад в популяцию ТАМ. Например, в мышиной модели аденокарциномы протоков поджелудочной железы Zhu et al. продемонстрировали с использованием модели парабиоза, что ТАМ были получены как из эмбрионально полученных тканевых резидентных макрофагов, так и из циркулирующих моноцитов Ly6C hi . Во время развития опухоли макрофаги эмбрионального происхождения размножались за счет пролиферации in situ и играли профиброзную роль в опухолях.При использовании нейтрализующего антитела Csf-1r и липосомы клодроната для истощения макрофагов, находящихся в тканях, наблюдалось уменьшение размера опухоли и повышение выживаемости мышей. Однако макрофаги, происходящие из моноцитов, играли ключевую роль в презентации антигена. Использование мышей с нокаутом CCR2 или ингибитора CCR2 для предотвращения рекрутирования моноцитов Ly6C hi не влияло на рост опухоли (52). Это исследование подчеркивает важность определения онтогенеза ТАМ, чтобы расшифровать, какие популяции принципиально необходимы для роста опухоли, с целью улучшения клинических результатов.
Однако макрофаги, происходящие из моноцитов, играли ключевую роль в презентации антигена. Использование мышей с нокаутом CCR2 или ингибитора CCR2 для предотвращения рекрутирования моноцитов Ly6C hi не влияло на рост опухоли (52). Это исследование подчеркивает важность определения онтогенеза ТАМ, чтобы расшифровать, какие популяции принципиально необходимы для роста опухоли, с целью улучшения клинических результатов.
Хотя ТАМ могут иметь множественное происхождение, было продемонстрировано, что микроокружение опухоли может модулировать фенотип макрофагов, способствуя злокачественности, указывая на то, что происхождение не полностью определяет функцию, когда макрофаги подвергаются воздействию цитокинов и факторов роста локально в опухоли. Описан ряд различных популяций макрофагов в опухолях, которые играют разные роли и имеют разные фенотипы. Например, были описаны популяции инвазивных, периваскулярных, ассоциированных с метастазами, ангиогенных (Tie2 + ) и иммуносупрессивных макрофагов, которые секретируют высокие уровни IL-10 (75). Подробное профилирование биоптатов гепатоцеллюлярной карциномы продемонстрировало присутствие в опухолях различных подтипов макрофагов, обладающих как про-, так и противоопухолевыми свойствами (124).
Подробное профилирование биоптатов гепатоцеллюлярной карциномы продемонстрировало присутствие в опухолях различных подтипов макрофагов, обладающих как про-, так и противоопухолевыми свойствами (124).
Роль макрофагов при эндометриозе
Онтогенез макрофагов при эндометриозе
Хотя роль макрофагов в патофизиологии эндометриоза установлена (и обсуждается ниже), онтогенез макрофагов, связанных с эндометриозом, все еще плохо изучен. Гривз и др. продемонстрировано на сингенной мышиной модели эндометриоза, что резидентные макрофаги поражения происходят как из (донорского) эндометрия, так и из (реципиентных) инфильтрирующих популяций макрофагов (42) (рис. 3).Эти инфильтрирующие популяции макрофагов, вероятно, представляют собой перитонеальные или рекрутированные макрофаги, происходящие из моноцитов, однако точное происхождение этих популяций в настоящее время неизвестно. Хотя перитонеальные макрофаги способствуют воспалению при эндометриозе, остается неизвестным, инфильтрируют ли они очаги эндометриоза, и, таким образом, роль этих клеток в эктопической ткани неизвестна. Использование химер костного мозга Sekiguchi et al. продемонстрировали, что клетки CD11b + из костного мозга инфильтрируют и накапливаются в очагах эндометриоза на мышиной модели (125).Эти клетки могут представлять собой популяцию моноцитов/макрофагов, хотя клетки CD11b + могут также представлять собой нейтрофилы, эозинофилы и/или некоторые подмножества дендритных клеток (126). Капобьянко и др. продемонстрировали, что клетки Tie2 + , полученные из костного мозга, инфильтрировали очаги эндометриоза на мышиной модели, снова продемонстрировав, что клетки, происходящие из костного мозга, которые в конечном итоге экспрессируют маркеры макрофагов в поражениях, могут рекрутироваться из кровеносных сосудов (127).
Использование химер костного мозга Sekiguchi et al. продемонстрировали, что клетки CD11b + из костного мозга инфильтрируют и накапливаются в очагах эндометриоза на мышиной модели (125).Эти клетки могут представлять собой популяцию моноцитов/макрофагов, хотя клетки CD11b + могут также представлять собой нейтрофилы, эозинофилы и/или некоторые подмножества дендритных клеток (126). Капобьянко и др. продемонстрировали, что клетки Tie2 + , полученные из костного мозга, инфильтрировали очаги эндометриоза на мышиной модели, снова продемонстрировав, что клетки, происходящие из костного мозга, которые в конечном итоге экспрессируют маркеры макрофагов в поражениях, могут рекрутироваться из кровеносных сосудов (127).
Рисунок 3 .Очаги эндометриоза инфильтрированы кровеносными сосудами, нервами и макрофагами. Резидентные макрофаги поражения происходят из макрофагов, происходящих из эндометрия, и рекрутированных макрофагов. Макрофаги взаимодействуют с кровеносными сосудами и нервами, стимулируя их рост. Передача сигналов также происходит между макрофагами и стромальными клетками, что увеличивает их клональную экспансию и инвазивные свойства. Создано с помощью Biorender.com.
Передача сигналов также происходит между макрофагами и стромальными клетками, что увеличивает их клональную экспансию и инвазивные свойства. Создано с помощью Biorender.com.
Фенотип и функция макрофагов при эндометриозе
Эндометриальные макрофаги проявляют дифференциальные свойства при эндометриозе.Отражая теорию ретроградной менструации и исследования на мышах, идентифицирующие эндометриальные макрофаги в очагах поражения, присутствие макрофагов в рефлюксированной эндометриальной ткани у женщин может усиливать развитие заболевания в брюшной полости. Ряд исследований продемонстрировал возмущения в популяциях макрофагов в эутопическом эндометрии пациенток с эндометриозом. Женщины с эндометриозом имеют больше эндометриальных макрофагов, которые экспрессируют более низкие уровни «ранозаживляющего» маркера CD163 по сравнению с женщинами без заболевания, однако точные механизмы, лежащие в основе этих изменений, неизвестны (128, 129).Аналогично этому, повышенные уровни CCL2 можно наблюдать в эндометрии женщин с заболеванием, которое соответствует тяжести заболевания, что предполагает повышенный приток моноцитов при заболевании, которые затем могут дифференцироваться в макрофаги (130). Увеличение матриксной металлопротеиназы-9 (ММР-9), совместно локализованной с макрофагами CD68 + в эндометрии женщин с эндометриозом, свидетельствует об увеличении количества макрофагов, участвующих в ремоделировании ткани. Это может повысить способность эктопических отложений эндометриальной ткани имплантироваться в брюшную полость (131).Хотя существуют доказательства макрофагальных нарушений в эутопическом эндометрии женщин с эндометриозом, роль эндометриальных макрофагов в эндометриозе не определена, поскольку функциональные исследования в этой области отсутствуют.
Увеличение матриксной металлопротеиназы-9 (ММР-9), совместно локализованной с макрофагами CD68 + в эндометрии женщин с эндометриозом, свидетельствует об увеличении количества макрофагов, участвующих в ремоделировании ткани. Это может повысить способность эктопических отложений эндометриальной ткани имплантироваться в брюшную полость (131).Хотя существуют доказательства макрофагальных нарушений в эутопическом эндометрии женщин с эндометриозом, роль эндометриальных макрофагов в эндометриозе не определена, поскольку функциональные исследования в этой области отсутствуют.
Женщины с эндометриозом, очевидно, имеют повышенное количество перитонеальных макрофагов, которые проявляют дисфункциональный фенотип. Перитонеальные макрофаги, собранные у женщин с эндометриозом, имеют сниженную фагоцитарную способность из-за низкого уровня и активности матриксной металлопротеиназы 9, которая необходима для деградации внеклеточного матрикса и регулируется простагландином E2 (PGE2) (38). В системе совместного культивирования в присутствии эндометриальных стромальных клеток, выделенных из эктопических тканей эндометрия, макрофаги, происходящие из моноцитов, секретировали IL-10 и TGF-β, которые, в свою очередь, подавляли цитотоксичность и жизнеспособность NK-клеток (132), предполагая, что макрофаги являются иммуносупрессивными в присутствии эктопических эндометриальных стромальных клеток и могут подавлять NK-клетки в брюшной полости. Хотя в нескольких исследованиях изучались перитонеальные макрофаги у женщин с эндометриозом, клетки оценивались как глобальная популяция, и нет исследований, касающихся строения и функции отдельных популяций CRIg hi и CRIg lo этих клеток: Численность и поведение популяции CRIg hi у женщин с эндометриозом неизвестны, хотя воспаление и выживание ткани эндометрия с рефлюксом предполагает, что при эндометриозе эта резидентная популяция ткани может действовать, создавая пермиссивную и митогенную среду для образования поражений.
В системе совместного культивирования в присутствии эндометриальных стромальных клеток, выделенных из эктопических тканей эндометрия, макрофаги, происходящие из моноцитов, секретировали IL-10 и TGF-β, которые, в свою очередь, подавляли цитотоксичность и жизнеспособность NK-клеток (132), предполагая, что макрофаги являются иммуносупрессивными в присутствии эктопических эндометриальных стромальных клеток и могут подавлять NK-клетки в брюшной полости. Хотя в нескольких исследованиях изучались перитонеальные макрофаги у женщин с эндометриозом, клетки оценивались как глобальная популяция, и нет исследований, касающихся строения и функции отдельных популяций CRIg hi и CRIg lo этих клеток: Численность и поведение популяции CRIg hi у женщин с эндометриозом неизвестны, хотя воспаление и выживание ткани эндометрия с рефлюксом предполагает, что при эндометриозе эта резидентная популяция ткани может действовать, создавая пермиссивную и митогенную среду для образования поражений. Аналогично этому, исследование Beste et al. продемонстрировали повышенную экспрессию как про-, так и противовоспалительных цитокинов макрофагами, собранными из перитонеальной жидкости женщин с эндометриозом, это может отражать наличие смешанной популяции клеток (133). Повышенное количество перитонеальных макрофагов у женщин с эндометриозом свидетельствует о том, что в состоянии «реакции исчезновения макрофагов» (МЛУ) не возникает. Действительно, ранее было продемонстрировано, что при воспалении типа 2, характеризующемся высоким уровнем IL-4, МЛУ не происходит, и перитонеальные макрофаги накапливаются в результате пролиферации in situ (116).Концентрация ИЛ-4 повышена в перитонеальной жидкости женщин с эндометриозом (134), что позволяет предположить, что это может быть механизмом накопления макрофагов. Однако, поскольку численность различных популяций не была охарактеризована, эту гипотезу еще предстоит доказать. Модели эндометриоза на мышах предоставляют противоречивые данные о динамике перитонеальных макрофагов: Yuan et al.
Аналогично этому, исследование Beste et al. продемонстрировали повышенную экспрессию как про-, так и противовоспалительных цитокинов макрофагами, собранными из перитонеальной жидкости женщин с эндометриозом, это может отражать наличие смешанной популяции клеток (133). Повышенное количество перитонеальных макрофагов у женщин с эндометриозом свидетельствует о том, что в состоянии «реакции исчезновения макрофагов» (МЛУ) не возникает. Действительно, ранее было продемонстрировано, что при воспалении типа 2, характеризующемся высоким уровнем IL-4, МЛУ не происходит, и перитонеальные макрофаги накапливаются в результате пролиферации in situ (116).Концентрация ИЛ-4 повышена в перитонеальной жидкости женщин с эндометриозом (134), что позволяет предположить, что это может быть механизмом накопления макрофагов. Однако, поскольку численность различных популяций не была охарактеризована, эту гипотезу еще предстоит доказать. Модели эндометриоза на мышах предоставляют противоречивые данные о динамике перитонеальных макрофагов: Yuan et al. продемонстрировали, что в модели, в которой интактным мышам вводили сингенные, обработанные эстрадиолом фрагменты эндометрия, у мышей с эндометриозом наблюдались значительно более низкие количества LpM и более обильные SpM по сравнению с контрольными мышами, что согласуется с MDR.Эти нарушения в популяциях перитонеальных макрофагов проявлялись в период от 0,25 до 42 дней после инъекции ткани (135). Однако в модели с инъекцией «менструальноподобной» ткани эндометрия реципиентам после овариэктомии, получавшим эстрадиола валерат, потери LpM не наблюдалось, а у мышей с эндометриозом было больше LpM по сравнению с необработанными и ложными животными [хотя увеличение не было статистически значимым (54)]. Второе исследование, по-видимому, более точно отражает динамику макрофагов у женщин с эндометриозом, хотя данные очень ограничены.Различия, наблюдаемые в этих двух исследованиях, могут быть результатом нескольких различий в дизайне эксперимента, включая природу донорского эндометрия, введенного в брюшную полость, а также манипуляции, проводимые на мышах-реципиентах.
продемонстрировали, что в модели, в которой интактным мышам вводили сингенные, обработанные эстрадиолом фрагменты эндометрия, у мышей с эндометриозом наблюдались значительно более низкие количества LpM и более обильные SpM по сравнению с контрольными мышами, что согласуется с MDR.Эти нарушения в популяциях перитонеальных макрофагов проявлялись в период от 0,25 до 42 дней после инъекции ткани (135). Однако в модели с инъекцией «менструальноподобной» ткани эндометрия реципиентам после овариэктомии, получавшим эстрадиола валерат, потери LpM не наблюдалось, а у мышей с эндометриозом было больше LpM по сравнению с необработанными и ложными животными [хотя увеличение не было статистически значимым (54)]. Второе исследование, по-видимому, более точно отражает динамику макрофагов у женщин с эндометриозом, хотя данные очень ограничены.Различия, наблюдаемые в этих двух исследованиях, могут быть результатом нескольких различий в дизайне эксперимента, включая природу донорского эндометрия, введенного в брюшную полость, а также манипуляции, проводимые на мышах-реципиентах. Юань и др. также продемонстрировали, что у мышей с эндометриозом LpM проявляет «провоспалительное» состояние активации, а SpM по своей природе более «прорепаративный» (135). Эта интерпретация была основана на экспрессии NOS2 (воспаление) и CD206 (восстановление) и противоречит другим исследованиям, сообщающим о провоспалительном статусе SpM и статусе прорепарации LpM в ответ на различные воспалительные стимулы.
Юань и др. также продемонстрировали, что у мышей с эндометриозом LpM проявляет «провоспалительное» состояние активации, а SpM по своей природе более «прорепаративный» (135). Эта интерпретация была основана на экспрессии NOS2 (воспаление) и CD206 (восстановление) и противоречит другим исследованиям, сообщающим о провоспалительном статусе SpM и статусе прорепарации LpM в ответ на различные воспалительные стимулы.
Хотя было продемонстрировано, что моноциты рекрутируются в очаги поражения из костного мозга, существует мало данных, чтобы охарактеризовать их роль и динамику после их инфильтрации эктопической ткани. Йохан и др. исследовали фенотип инфильтрирующих макрофагов с течением времени в очагах эндометриоза на модели гетерологичных мышей и обнаружили, что фенотип макрофагов постепенно менялся с течением времени. Макрофаги первоначально экспрессировали провоспалительные маркеры iNOS и главный комплекс гистосовместимости II (MHC II), однако через 7 и 14 дней после индукции поражения более высокая доля макрофагов экспрессировала аргиназу 1 и CD204 (рецептор-мусорщик А), которые в большей степени связаны с тканью. фенотип ремоделирования (136).Таким образом, это исследование демонстрирует, что фенотип макрофагов в поражениях эндометриоза является динамичным и прогрессивно изменяется по мере развития поражений в брюшной полости. Однако, как и в других исследованиях, ограниченное количество оцениваемых маркеров затрудняет точное повторение сложного фенотипа макрофагов в ткани.
фенотип ремоделирования (136).Таким образом, это исследование демонстрирует, что фенотип макрофагов в поражениях эндометриоза является динамичным и прогрессивно изменяется по мере развития поражений в брюшной полости. Однако, как и в других исследованиях, ограниченное количество оцениваемых маркеров затрудняет точное повторение сложного фенотипа макрофагов в ткани.
Очаги эндометриоза у женщин сильно инфильтрированы макрофагами CD68+, которые присутствуют в строме ткани, а также могут быть обнаружены в непосредственной близости от желез (42, 53).Исследования на женщинах явно указывают на роль макрофагов в эндометриозе, но механистические исследования, проведенные на экспериментальных моделях, значительно улучшили наше понимание роли макрофагов в этом состоянии. На сегодняшний день исследования в основном сосредоточены на определении роли макрофагов в сингенных моделях мышей с использованием различных подходов к истощению клеток. Обычно используемый метод истощения использует липосомы, инкапсулирующие бисфосфонаты. Эти липосомы поглощаются фагоцитирующими клетками, которые разрушают липосомы, высвобождая бисфосфонат и вызывая последующую гибель клеток.Таким образом, этот метод избирательно истощает фагоцитирующие клетки и не токсичен для нефагоцитирующих клеток и обычно используется для истощения популяций фагоцитирующих макрофагов (137). В сингенной мышиной модели заболевания Bacci et al. использовали клодронатные липосомы и моноклональное анти-F4/80 антитело для истощения/ингибирования функции перитонеальных макрофагов у мышей с индуцированным эндометриозом и продемонстрировали, что оба вида лечения вызывают снижение роста и образования кровеносных сосудов в очагах поражения (53). Адаптивный перенос in vitro генерировал «провоспалительный» (стимулированный IFN-γ), «противовоспалительный» (стимулированный макрофагально-колониестимулирующим фактором и IL-10) или «неполяризованный» (стимулированный IL-10). макрофаг-колониестимулирующий фактор) макрофаги приводят к дифференцированному влиянию на развитие поражения.
Эти липосомы поглощаются фагоцитирующими клетками, которые разрушают липосомы, высвобождая бисфосфонат и вызывая последующую гибель клеток.Таким образом, этот метод избирательно истощает фагоцитирующие клетки и не токсичен для нефагоцитирующих клеток и обычно используется для истощения популяций фагоцитирующих макрофагов (137). В сингенной мышиной модели заболевания Bacci et al. использовали клодронатные липосомы и моноклональное анти-F4/80 антитело для истощения/ингибирования функции перитонеальных макрофагов у мышей с индуцированным эндометриозом и продемонстрировали, что оба вида лечения вызывают снижение роста и образования кровеносных сосудов в очагах поражения (53). Адаптивный перенос in vitro генерировал «провоспалительный» (стимулированный IFN-γ), «противовоспалительный» (стимулированный макрофагально-колониестимулирующим фактором и IL-10) или «неполяризованный» (стимулированный IL-10). макрофаг-колониестимулирующий фактор) макрофаги приводят к дифференцированному влиянию на развитие поражения. «Неполяризованные» макрофаги не влияли на количество или вес поражения, однако адоптивный перенос провоспалительных макрофагов уменьшал вес поражения. И наоборот, адоптивный перенос противовоспалительных макрофагов вызывал увеличение массы поражения. Авторы отметили, что архитектура поражения также была нарушена у мышей, которым был проведен адоптивный перенос провоспалительных макрофагов (53). В совокупности эти данные свидетельствуют о том, что противовоспалительные/восстановительные макрофаги могут быть важны для роста и развития поражений, а провоспалительные макрофаги обладают антагонистическим эффектом, очищая эктопическую ткань эндометрия и нарушая архитектуру поражения.Хотя эти данные дают важное представление о роли фенотипов макрофагов при эндометриозе, использование парадигмы M1/M2 ограничено, а точный фенотип и фенотипическая гетерогенность макрофагов при эндометриозе и их роль в заболевании в настоящее время неизвестны. Капобьянко и др. идентифицировали макрофаги, экспрессирующие Tie-2, которые проникли в очаги поражения у мышей и человека.
«Неполяризованные» макрофаги не влияли на количество или вес поражения, однако адоптивный перенос провоспалительных макрофагов уменьшал вес поражения. И наоборот, адоптивный перенос противовоспалительных макрофагов вызывал увеличение массы поражения. Авторы отметили, что архитектура поражения также была нарушена у мышей, которым был проведен адоптивный перенос провоспалительных макрофагов (53). В совокупности эти данные свидетельствуют о том, что противовоспалительные/восстановительные макрофаги могут быть важны для роста и развития поражений, а провоспалительные макрофаги обладают антагонистическим эффектом, очищая эктопическую ткань эндометрия и нарушая архитектуру поражения.Хотя эти данные дают важное представление о роли фенотипов макрофагов при эндометриозе, использование парадигмы M1/M2 ограничено, а точный фенотип и фенотипическая гетерогенность макрофагов при эндометриозе и их роль в заболевании в настоящее время неизвестны. Капобьянко и др. идентифицировали макрофаги, экспрессирующие Tie-2, которые проникли в очаги поражения у мышей и человека. Истощение макрофагов Tie-2 + было достигнуто с использованием химеры костного мозга от мышей, экспрессирующих суицидный ген (тимидинкиназа вируса простого герпеса типа 1), экспрессируемый под контролем промотора Tie2, в мышей дикого типа.После лечения ганцикловиром (противовирусным препаратом) клетки Tie2 + , полученные из костного мозга, избирательно истощались, и рост поражений эндометриоза подавлялся с потерей неоваскуляризации и железистой организации в образовавшихся поражениях (127). Секигучи и др. продемонстрировали, что мыши с нокаутом VEGFR1 имели меньшие по размеру и менее васкуляризированные поражения, чем WT, в мышиной модели, где срезы матки были пришиты к стенке брюшины. Используя химеры костного мозга, они продемонстрировали, что клетки VEGFR1 + в поражениях были макрофагами CD11b + , происходящими из костного мозга (125).Мышей WT с эндометриозом также лечили клофосомой N, которая истощала фагоцитарные клетки в брюшной полости во время индукции эндометриоза и продемонстрировала снижение роста и ангиогенеза в очагах поражения (125).
Истощение макрофагов Tie-2 + было достигнуто с использованием химеры костного мозга от мышей, экспрессирующих суицидный ген (тимидинкиназа вируса простого герпеса типа 1), экспрессируемый под контролем промотора Tie2, в мышей дикого типа.После лечения ганцикловиром (противовирусным препаратом) клетки Tie2 + , полученные из костного мозга, избирательно истощались, и рост поражений эндометриоза подавлялся с потерей неоваскуляризации и железистой организации в образовавшихся поражениях (127). Секигучи и др. продемонстрировали, что мыши с нокаутом VEGFR1 имели меньшие по размеру и менее васкуляризированные поражения, чем WT, в мышиной модели, где срезы матки были пришиты к стенке брюшины. Используя химеры костного мозга, они продемонстрировали, что клетки VEGFR1 + в поражениях были макрофагами CD11b + , происходящими из костного мозга (125).Мышей WT с эндометриозом также лечили клофосомой N, которая истощала фагоцитарные клетки в брюшной полости во время индукции эндометриоза и продемонстрировала снижение роста и ангиогенеза в очагах поражения (125). Аналогичное исследование с использованием липосомального бисфосфоната для истощения фагоцитарной перитонеальной популяции также продемонстрировало снижение роста поражений эндометриоза на крысиной модели (138). Таким образом, кажется очевидным, что в экспериментальных моделях эндометриоза истощение популяций перитонеальных фагоцитирующих макрофагов ингибирует рост и ангиогенез индуцированных поражений.
Аналогичное исследование с использованием липосомального бисфосфоната для истощения фагоцитарной перитонеальной популяции также продемонстрировало снижение роста поражений эндометриоза на крысиной модели (138). Таким образом, кажется очевидным, что в экспериментальных моделях эндометриоза истощение популяций перитонеальных фагоцитирующих макрофагов ингибирует рост и ангиогенез индуцированных поражений.
Очаги эндометриоза демонстрируют циклические кровотечения в ответ на стероиды яичников в том же контексте, что и эутопический эндометрий, таким образом, поражения могут восприниматься как раны, подвергающиеся рецидивирующему повреждению ткани и репарации (40). Было описано, что процесс в поражениях включает эпителиально-мезенхимальный переход, трансдифференцировку фибробластов-миофибробластов, метаплазию гладкомышечных клеток и фиброз (139). Макрофаги имеют решающее значение для успешного восстановления и регенерации тканей; они стимулируют дифференцировку местных фибробластов в миофибробласты, что способствует сокращению раны (140). Во время заживления раны пролиферация и экспансия локальных стромальных клеток также регулируется макрофагами, и если повреждение тяжелое, макрофаги могут активировать дополнительные популяции стволовых клеток и местных клеток-предшественников, которые участвуют в заживлении (49). В соответствии с этой установленной ролью в повреждении и восстановлении тканей исследования in vitro были направлены на оценку взаимодействия между эндометриальными стромальными клетками и макрофагами при эндометриозе. В системе совместного культивирования культивирование стромальных клеток эндометрия с аутологичными макрофагами, выделенными от женщин с эндометриозом, увеличивало инвазивную и клоногенную способность стромальных клеток (141).Также было показано, что совместное культивирование с эктопическими стромальными клетками эндометрия снижает фагоцитарную способность макрофагов и увеличивает выживаемость и пролиферацию стромальных клеток по сравнению с эутопическими стромальными клетками эндометрия в исследовании Mei et al.
Во время заживления раны пролиферация и экспансия локальных стромальных клеток также регулируется макрофагами, и если повреждение тяжелое, макрофаги могут активировать дополнительные популяции стволовых клеток и местных клеток-предшественников, которые участвуют в заживлении (49). В соответствии с этой установленной ролью в повреждении и восстановлении тканей исследования in vitro были направлены на оценку взаимодействия между эндометриальными стромальными клетками и макрофагами при эндометриозе. В системе совместного культивирования культивирование стромальных клеток эндометрия с аутологичными макрофагами, выделенными от женщин с эндометриозом, увеличивало инвазивную и клоногенную способность стромальных клеток (141).Также было показано, что совместное культивирование с эктопическими стромальными клетками эндометрия снижает фагоцитарную способность макрофагов и увеличивает выживаемость и пролиферацию стромальных клеток по сравнению с эутопическими стромальными клетками эндометрия в исследовании Mei et al.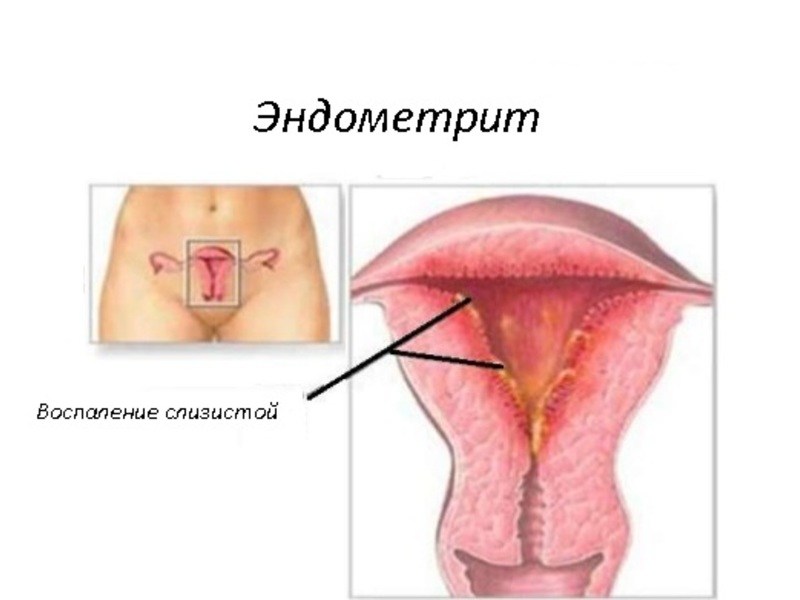 (142). Об аналогичном эффекте также сообщили Shao et al. (143). Таким образом, между эктопическими эндометриальными стромальными клетками и макрофагами, по-видимому, происходит реципрокная передача сигналов, которая может способствовать их выживанию и формированию очагов эндометриоза в брюшной полости, однако точные механизмы еще предстоит выяснить, а конкретные вовлеченные популяции макрофагов неизвестны.Было обнаружено, что стромальные клетки, полученные из эндометриомы яичника, экспрессируют маркеры мезенхимальных стромальных клеток (МСК), образуют колониеобразующие единицы и проявляют мультипотентность, что свидетельствует о характеристиках мезенхимальных стволовых клеток. МСК из эндометриом способствовали дифференцировке моноцитов в веретенообразные про-репаративные/иммуносупрессивные макрофаги in vitro (50). Результаты показывают, что МСК влияют на макрофаги таким образом, что они проявляют иммуносупрессивный фенотип и поддерживают рост поражений.Координация состояний активации моноцитов и макрофагов во время воспаления и репарации жестко и во времени контролируется.
(142). Об аналогичном эффекте также сообщили Shao et al. (143). Таким образом, между эктопическими эндометриальными стромальными клетками и макрофагами, по-видимому, происходит реципрокная передача сигналов, которая может способствовать их выживанию и формированию очагов эндометриоза в брюшной полости, однако точные механизмы еще предстоит выяснить, а конкретные вовлеченные популяции макрофагов неизвестны.Было обнаружено, что стромальные клетки, полученные из эндометриомы яичника, экспрессируют маркеры мезенхимальных стромальных клеток (МСК), образуют колониеобразующие единицы и проявляют мультипотентность, что свидетельствует о характеристиках мезенхимальных стволовых клеток. МСК из эндометриом способствовали дифференцировке моноцитов в веретенообразные про-репаративные/иммуносупрессивные макрофаги in vitro (50). Результаты показывают, что МСК влияют на макрофаги таким образом, что они проявляют иммуносупрессивный фенотип и поддерживают рост поражений.Координация состояний активации моноцитов и макрофагов во время воспаления и репарации жестко и во времени контролируется. Если в какой-либо момент процесса возникают нарушения, это может привести к аберрантному восстановлению и формированию патологического фиброза (49). Например, постоянная активация и устойчивое рекрутирование макрофагов, способствующих восстановлению, может способствовать патологическому фиброзу (144). Поскольку очаги эндометриоза подвергаются постоянным и повторяющимся эпизодам повреждения и заживления, а поражения имеют фиброзное содержимое, события, необходимые для эффективного безрубцового заживления, могут быть нарушены.Исследования истощения показали, что истощение макрофагов значительно снижает фиброз в очагах поражения. Более того, адоптивный перенос макрофагов, поляризованных in vitro для проявления фенотипа M2a (активированных IL-4), увеличивал фиброзное содержание поражений (139). Таким образом, кажется, что в отличие от физиологического процесса заживления ран, очаги эндометриоза не могут вступить в фазу разрешения воспаления и заживления, а местная воспалительная среда вызывает постоянную активацию макрофагов, способствующих восстановлению, которые способствуют фиброзу.
Если в какой-либо момент процесса возникают нарушения, это может привести к аберрантному восстановлению и формированию патологического фиброза (49). Например, постоянная активация и устойчивое рекрутирование макрофагов, способствующих восстановлению, может способствовать патологическому фиброзу (144). Поскольку очаги эндометриоза подвергаются постоянным и повторяющимся эпизодам повреждения и заживления, а поражения имеют фиброзное содержимое, события, необходимые для эффективного безрубцового заживления, могут быть нарушены.Исследования истощения показали, что истощение макрофагов значительно снижает фиброз в очагах поражения. Более того, адоптивный перенос макрофагов, поляризованных in vitro для проявления фенотипа M2a (активированных IL-4), увеличивал фиброзное содержание поражений (139). Таким образом, кажется, что в отличие от физиологического процесса заживления ран, очаги эндометриоза не могут вступить в фазу разрешения воспаления и заживления, а местная воспалительная среда вызывает постоянную активацию макрофагов, способствующих восстановлению, которые способствуют фиброзу.
В литературе установлена роль макрофагов в нейрогенезе поражений эндометриоза, что предполагает роль в возникновении боли, связанной с эндометриозом. Действительно, инфильтрация нервов в очагах поражения положительно коррелирует с более высокими показателями боли у женщин (145). Холинергические, адренергические, чувствительные нервные волокна Aδ и C были идентифицированы в поражениях (146, 147), а макрофаги густо заселены в областях с высокой плотностью нервов (55, 148). Гривз и др. сообщили, что в ответ на эстрадиол нервные волокна секретировали CCL2 и CSF-1, которые привлекали макрофаги, которые, в свою очередь, секретировали нейротрофин 3 и мозговой нейротрофиновый фактор, стимулируя нейрогенез (55).Недавно также была описана роль макрофагального инсулиноподобного фактора роста-1 (IGF-1) в качестве ключевого сигнала для роста нервов и сенсибилизации при эндометриозе (54): истощение перитонеальных макрофагов клодронатными липосомами обращало вспять аномальное болевое поведение у мышей с индуцированным эндометриозом и заметно уменьшало количество поражений в брюшной полости, обеспечивая прямую связь между макрофагами и развитием болей/поражений, связанных с эндометриозом. Макрофаги, обработанные перитонеальной жидкостью женщин с эндометриозом, демонстрируют повышающую регуляцию ИФР-1 на уровне мРНК, и механистически полученный из макрофагов ИФР-1 увеличивал рост эксплантатов ганглия задних корешков эмбрионов крысы, и это было обращено вспять ингибитором ИФР-1. .Точно так же ингибирование ИФР-1 ингибитором рецептора ИФР-1 линситинибом в мышиной модели может обратить вспять аномальное поведение при боли (54). Взятые вместе, макрофаги, очевидно, играют ключевую роль в облегчении нейрогенеза и генерации болевых симптомов, связанных с эндометриозом, и это, по крайней мере, частично опосредовано ИФР-1. Таким образом, взаимная передача сигналов между макрофагами и нервными волокнами имеет решающее значение для регуляции нейрогенеза при поражениях, а нейровоспаление является ключевым фактором патофизиологии эндометриоза.
Макрофаги, обработанные перитонеальной жидкостью женщин с эндометриозом, демонстрируют повышающую регуляцию ИФР-1 на уровне мРНК, и механистически полученный из макрофагов ИФР-1 увеличивал рост эксплантатов ганглия задних корешков эмбрионов крысы, и это было обращено вспять ингибитором ИФР-1. .Точно так же ингибирование ИФР-1 ингибитором рецептора ИФР-1 линситинибом в мышиной модели может обратить вспять аномальное поведение при боли (54). Взятые вместе, макрофаги, очевидно, играют ключевую роль в облегчении нейрогенеза и генерации болевых симптомов, связанных с эндометриозом, и это, по крайней мере, частично опосредовано ИФР-1. Таким образом, взаимная передача сигналов между макрофагами и нервными волокнами имеет решающее значение для регуляции нейрогенеза при поражениях, а нейровоспаление является ключевым фактором патофизиологии эндометриоза.
Исследования механистически показывают, что макрофаги играют ключевую роль в росте, васкуляризации и нейрогенезе при поражениях, а также в возникновении боли в состоянии, и эти эксперименты дали представление о некоторых факторах, экспрессируемых макрофагами. Однако фенотип макрофагов при эндометриозе до конца не охарактеризован. Макрофаги в очагах эндометриоза уже давно описываются как ранозаживляющие и «М2-подобные», однако в немногих исследованиях учитывались сложности фенотипа макрофагов, где провоспалительные и ранозаживляющие маркеры часто сосуществуют в ответ на сложные сигналы от местного тканевого микроокружения (76).У людей резидентные макрофаги поражения экспрессируют рецепторы-мусорщики CD163 и CD206, связанные с удалением гемоглобина и бесшумным удалением дебриса (53). Коминелли и др. также идентифицировали макрофаги CD163 + CD206 + в поверхностных поражениях у женщин, которые также экспрессировали высокие уровни матриксной металлопротеиназы-27, связанные с ремоделированием тканей (149). Дуан и др. охарактеризовали синтазы оксида азота (iNOS + ) провоспалительные и CD163 + ранозаживляющие макрофаги в очагах эндометриоза у мышей (139).В модели эндометриоза макаки-резуса очаги были сильно инфильтрированы макрофагами CD163 + (150).
Однако фенотип макрофагов при эндометриозе до конца не охарактеризован. Макрофаги в очагах эндометриоза уже давно описываются как ранозаживляющие и «М2-подобные», однако в немногих исследованиях учитывались сложности фенотипа макрофагов, где провоспалительные и ранозаживляющие маркеры часто сосуществуют в ответ на сложные сигналы от местного тканевого микроокружения (76).У людей резидентные макрофаги поражения экспрессируют рецепторы-мусорщики CD163 и CD206, связанные с удалением гемоглобина и бесшумным удалением дебриса (53). Коминелли и др. также идентифицировали макрофаги CD163 + CD206 + в поверхностных поражениях у женщин, которые также экспрессировали высокие уровни матриксной металлопротеиназы-27, связанные с ремоделированием тканей (149). Дуан и др. охарактеризовали синтазы оксида азота (iNOS + ) провоспалительные и CD163 + ранозаживляющие макрофаги в очагах эндометриоза у мышей (139).В модели эндометриоза макаки-резуса очаги были сильно инфильтрированы макрофагами CD163 + (150). В то время как макрофаги в поражениях эндометриоза, обладающие фенотипом «заживления ран», синергичны с их ролью в росте и ангиогенезе в поражениях, требуется более полный анализ фенотипа макрофагов в поражениях эндометриоза. Также неизвестно, существуют ли различные фенотипы в очагах эндометриоза, которые могут играть разную роль в патологии, и идентификация этих популяций является ключом к пониманию того, какие популяции макрофагов вызывают патологию.
В то время как макрофаги в поражениях эндометриоза, обладающие фенотипом «заживления ран», синергичны с их ролью в росте и ангиогенезе в поражениях, требуется более полный анализ фенотипа макрофагов в поражениях эндометриоза. Также неизвестно, существуют ли различные фенотипы в очагах эндометриоза, которые могут играть разную роль в патологии, и идентификация этих популяций является ключом к пониманию того, какие популяции макрофагов вызывают патологию.
Идентификация макрофагов эндометрия и макрофагов, происходящих из моноцитов костного мозга, в поражениях эндометриоза демонстрирует, что макрофаги, связанные с эндометриозом, имеют различное происхождение, однако дифференциальная роль этих популяций еще не исследована. Возможно, эндометриальные макрофаги в очагах поражения происходят из моноцитов, поскольку во время восстановления эндометрия наблюдается быстрый приток классических моноцитов в эндометрий. Доказательства эмбрионального происхождения резидентных в тканях макрофагов в поражениях еще предстоит продемонстрировать. Предыдущие исследования показали, что истощение перитонеальных макрофагов оказывает выраженное влияние на размер поражения и васкуляризацию (53), истощение этой популяции приводит к уменьшению количества макрофагов в поражениях и ослаблению боли у мышей (54). Остается неизвестным, как эндометрий и рекрутированные моноциты способствуют возникновению и поддержанию поражения. Истощение различных популяций макрофагов до индуцирования эндометриоза у мышей и в разные моменты времени в течение жизни поражения даст важные сведения о роли этих ключевых клеток в заболевании.Хотя были описаны макрофаги 3-х источников, истинная гетерогенность фенотипа макрофагов в очагах поражения и в перитонеальной жидкости при эндометриозе неизвестна. Применение методов обнаружения отдельных клеток и цифровой молекулярной патологии может предоставить жизненно важную информацию о сложностях фенотипа макрофагов, связанных с эндометриозом, а в сочетании с функциональными исследованиями in vivo выявление популяции, способствующей заболеванию, которая демонстрирует уникальные маркеры, которые отличаются от здоровых макрофагов, может быть возможным.
Предыдущие исследования показали, что истощение перитонеальных макрофагов оказывает выраженное влияние на размер поражения и васкуляризацию (53), истощение этой популяции приводит к уменьшению количества макрофагов в поражениях и ослаблению боли у мышей (54). Остается неизвестным, как эндометрий и рекрутированные моноциты способствуют возникновению и поддержанию поражения. Истощение различных популяций макрофагов до индуцирования эндометриоза у мышей и в разные моменты времени в течение жизни поражения даст важные сведения о роли этих ключевых клеток в заболевании.Хотя были описаны макрофаги 3-х источников, истинная гетерогенность фенотипа макрофагов в очагах поражения и в перитонеальной жидкости при эндометриозе неизвестна. Применение методов обнаружения отдельных клеток и цифровой молекулярной патологии может предоставить жизненно важную информацию о сложностях фенотипа макрофагов, связанных с эндометриозом, а в сочетании с функциональными исследованиями in vivo выявление популяции, способствующей заболеванию, которая демонстрирует уникальные маркеры, которые отличаются от здоровых макрофагов, может быть возможным.
Будущее: таргетная терапия макрофагов
Макрофаги представляют собой привлекательную терапевтическую мишень из-за их инструментальной роли при ряде патологий (79). Ингибирование передачи сигналов или рекрутирования макрофагов, а также переобучение ассоциированных с заболеванием макрофагов в «здоровый» фенотип может иметь клиническую пользу для пациентов, у которых макрофаги вовлечены в патофизиологию заболевания. Идентификация популяций макрофагов, способствующих заболеванию, и детальное понимание их регуляции, рекрутирования и фенотипа является фундаментальным шагом до того, как станет возможной разработка терапевтических средств, специально нацеленных на ассоциированные с заболеванием макрофаги.Из-за ключевой роли, которую макрофаги играют во многих видах рака, терапия, направленная на макрофаги, получила большое внимание в литературе, и ряд исследований in vivo и клинических испытаний продемонстрировали эффективность использования опосредованной макрофагами терапии для улучшения клинических исходов (79). ). Подмножество исследований направлено на распространение ТАМ с целью облегчения опухолевой нагрузки и улучшения клинических результатов. Страчан и др. продемонстрировали, что нацеливание на рецептор Csf-1 низкомолекулярным ингибитором ослабляло скорость оборота ТАМ и уменьшало рост опухоли в мышиных моделях рака молочной железы и шейки матки (151).Исследование фазы I продемонстрировало значительное снижение количества макрофагов в солидных опухолях после лечения анти-Csf-1r (152), а ингибирование Csf-1r показало улучшение клинических исходов, включая улучшение симптомов у пациентов с гигантоклеточными опухолями диффузного типа (152). 153). Таким образом, ингибирование пролиферации макрофагов, по-видимому, приносит клиническую пользу в моделях рака и подгруппах больных раком. Будущие методы лечения должны быть нацелены конкретно на популяции макрофагов, ассоциированных с заболеванием; Csf-1 является ключевым регулятором пролиферации и выживания макрофагов в большинстве тканей, и нейтрализация или ингибирование могут повлиять на здоровые популяции макрофагов и, как таковые, не являются идеальной терапией (154).
). Подмножество исследований направлено на распространение ТАМ с целью облегчения опухолевой нагрузки и улучшения клинических результатов. Страчан и др. продемонстрировали, что нацеливание на рецептор Csf-1 низкомолекулярным ингибитором ослабляло скорость оборота ТАМ и уменьшало рост опухоли в мышиных моделях рака молочной железы и шейки матки (151).Исследование фазы I продемонстрировало значительное снижение количества макрофагов в солидных опухолях после лечения анти-Csf-1r (152), а ингибирование Csf-1r показало улучшение клинических исходов, включая улучшение симптомов у пациентов с гигантоклеточными опухолями диффузного типа (152). 153). Таким образом, ингибирование пролиферации макрофагов, по-видимому, приносит клиническую пользу в моделях рака и подгруппах больных раком. Будущие методы лечения должны быть нацелены конкретно на популяции макрофагов, ассоциированных с заболеванием; Csf-1 является ключевым регулятором пролиферации и выживания макрофагов в большинстве тканей, и нейтрализация или ингибирование могут повлиять на здоровые популяции макрофагов и, как таковые, не являются идеальной терапией (154). Пролиферативная способность макрофагов, резидентных в поражении эндометриоза, в настоящее время неизвестна, поэтому необходимы дальнейшие исследования, чтобы определить, будет ли эта стратегия лечения полезна для женщин с эндометриозом.
Пролиферативная способность макрофагов, резидентных в поражении эндометриоза, в настоящее время неизвестна, поэтому необходимы дальнейшие исследования, чтобы определить, будет ли эта стратегия лечения полезна для женщин с эндометриозом.
Другим потенциальным механизмом терапевтического вмешательства может быть блокирование рекрутирования популяций макрофагов, способствующих заболеванию. Механизм рекрутирования CCL2/CCR2 вовлечен в ряд онкологических заболеваний, и ингибитор CCR2, который следует вводить вместе с химиотерапией, в настоящее время находится на стадии испытаний 1b (155).Ингибирование рекрутирования может быть полезным для блокирования инфильтрации макрофагов в очаги эндометриоза, однако механизмы, которые регулируют рекрутирование в очаги поражения, в настоящее время плохо изучены.
Несмотря на то, что исследования в области терапии, нацеленной на макрофаги, обнадеживают, современные методы лечения не нацелены конкретно на макрофаги, способствующие развитию болезни, но могут воздействовать на популяции макрофагов по всему телу. Однако по мере того, как наше понимание макрофагов, измененных болезнью, улучшается, становится очевидным, что установление происхождения макрофагов и гетерогенности фенотипа при заболевании является важнейшей областью исследований, прежде чем можно будет разработать конкретные целевые методы лечения (72).Поэтому крайне необходима будущая работа, описывающая субпопуляции макрофагов, активные механизмы рекрутирования и фенотип макрофагов при эндометриозе, прежде чем лечение, нацеленное на макрофаги, станет возможным для женщин с эндометриозом.
Однако по мере того, как наше понимание макрофагов, измененных болезнью, улучшается, становится очевидным, что установление происхождения макрофагов и гетерогенности фенотипа при заболевании является важнейшей областью исследований, прежде чем можно будет разработать конкретные целевые методы лечения (72).Поэтому крайне необходима будущая работа, описывающая субпопуляции макрофагов, активные механизмы рекрутирования и фенотип макрофагов при эндометриозе, прежде чем лечение, нацеленное на макрофаги, станет возможным для женщин с эндометриозом.
Вклад авторов
CH выполнил поиск литературы и написал рукопись. AH предоставил обратную связь. EG разработала концепцию рукописи, предоставила обратную связь и написала рукопись.
Финансирование
EG финансировалась Премией за развитие карьеры Совета медицинских исследований (MRC) (MR/M009238/1).CH был поддержан MRC Ph.D. стипендия в рамках гранта Центра MRC (MR/N022556/1).
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Благодарности
Спасибо Ронни Гранту за графический дизайн. Некоторые рисунки были созданы с помощью BioRender.com.
Ссылки
2. Джонсон Н.П., Хуммельшой Л., Адамсон Г.Д., Кекштейн Дж., Тейлор Х.С., Абрао М.С. и соавт.Консенсус Всемирного общества эндометриоза по классификации эндометриоза. Hum Репрод. (2017) 32:315–24. doi: 10.1093/humrep/dew293
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
4. Meuleman C, Vandenabeele B, Fieuws S, Spiessens C, Timmerman D, D’Hooghe T. Высокая распространенность эндометриоза у бесплодных женщин с нормальной овуляцией и нормоспермическими партнерами. Fertil Стерил. (2009) 92:68–74. doi: 10.1016/j.fertnstert.2008.04.056
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
6.Кляйн С., Д’Хуге Т., Меулеман С., Дирксен С., Дунсельман Г., Симоенс С. Каково социальное бремя симптомов, связанных с эндометриозом? проспективное бельгийское исследование. Reprod Biomed Online. (2014) 28:116–24. doi: 10.1016/j.rbmo.2013.09.020
Reprod Biomed Online. (2014) 28:116–24. doi: 10.1016/j.rbmo.2013.09.020
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
7. Сарасват Л., Аянсина Д.Т., Купер К.Г., Бхаттачарья С., Милигкос Д., Хорн А.В. и соавт. Исходы беременности у женщин с эндометриозом: национальное исследование сцепления. БЖОГ. (2017) 124:444–52. дои: 10.1111/1471-0528.13920
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
8. Simoens S, Dunselman G, Dirksen C, Hummelshoj L, Bokor A, Brandes I, et al. Бремя эндометриоза: затраты и качество жизни женщин с эндометриозом, получающих лечение в специализированных центрах. Hum Репрод. (2012) 27:1292–9. doi: 10.1093/humrep/des073
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
9. Nnoaham KE, Hummelshoj L, Webster P, d’Hooghe T, de Cicco Nardone F, de Cicco Nardone C, et al.Перепечатка: влияние эндометриоза на качество жизни и производительность труда: многоцентровое исследование в десяти странах. Fertil Стерил. (2019) 112:e137–52. doi: 10.1016/j.fertnstert.2019.08.082
Fertil Стерил. (2019) 112:e137–52. doi: 10.1016/j.fertnstert.2019.08.082
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
10. Базот М., Дараи Э. Диагностика глубокого эндометриоза: клиническое обследование, УЗИ, магнитно-резонансная томография и другие методы. Fertil Стерил. (2017) 108:886–94. doi: 10.1016/j.fertnstert.2017.10.026
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
12. Агарвал С.К., Фостер В.Г., Грусл Э.Дж. Переосмысление ухода за эндометриозом: применение модели ухода за хроническими заболеваниями через междисциплинарную программу ухода за женщинами с эндометриозом. Int J Женское здоровье. (2019) 11: 405–10. doi: 10.2147/IJWH.S207373
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
13. Вигано П., Кандиани М., Монно А., Джакомини Э., Верчеллини П., Сомильяна Э.Время пересмотреть определение эндометриоза, включая его профиброзную природу. Hum Репрод. (2018) 33:347–52. doi: 10.1093/humrep/dex354
Hum Репрод. (2018) 33:347–52. doi: 10.1093/humrep/dex354
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
14. Laux-Biehlmann A, d’Hooghe T, Zollner TM. Менструация провоцирует воспаление и боль при эндометриозе. Trends Pharmacol Sci. (2015) 36: 270–6. doi: 10.1016/j.tips.2015.03.004
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
16.Аль Кадри Х., Хассан С., Аль-Фозан Х.М., Хаджир А. Гормональная терапия эндометриоза и хирургической менопаузы. Кокрановская система базы данных, версия (2009 г.) CD005997. doi: 10.1002/14651858.CD005997.pub2
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
17. Gallagher JS, Missmer SA, Hornstein MD, Laufer MR, Gordon CM, DiVasta AD. Долгосрочные эффекты агонистов гонадотропин-рилизинг-гормона и прибавления при подростковом эндометриозе. J Pediatr Adolesc Gynecol. (2018) 31: 376–81.doi: 10.1016/j.jpag.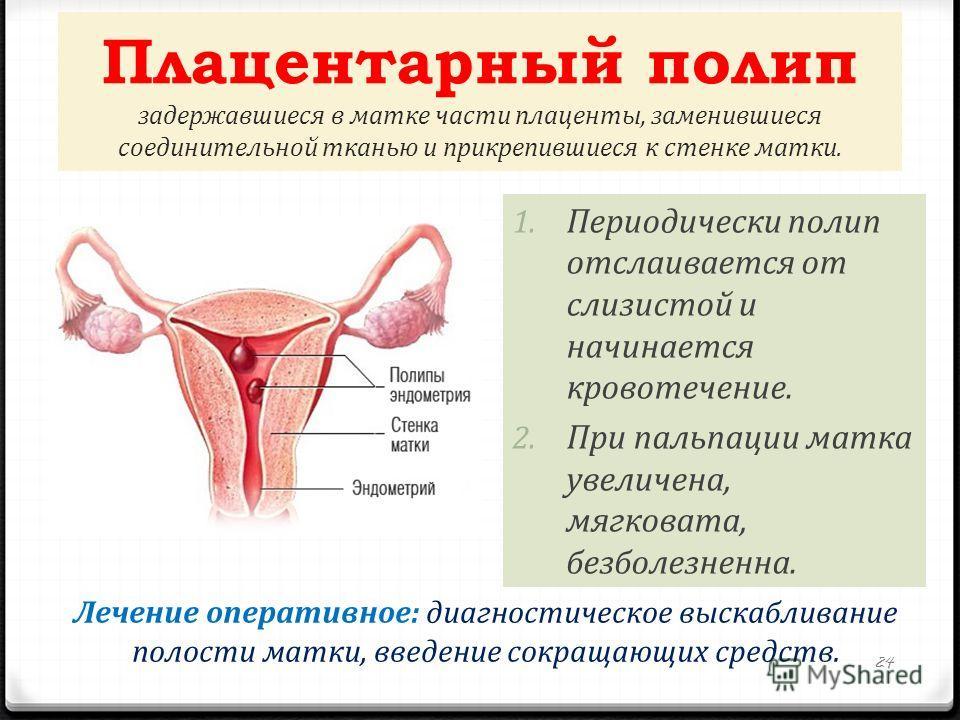 2018.03.004
2018.03.004
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
18. Dunselman GA, Vermeulen N, Becker C, Calhaz-Jorge C, D’Hooghe T, De Bie B, et al. Руководство ESHRE: ведение женщин с эндометриозом. Hum Репрод. (2014) 29:400–12. doi: 10.1093/humrep/det457
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
19. Малинак Л.Р., Баттрам В.К. младший, Элиас С., Симпсон Дж.Л. Наследственные аспекты эндометриоза.II. Клиническая характеристика семейного эндометриоза. Am J Акушер-гинеколог. (1980) 137:332–7. дои: 10.1016/0002-9378(80)-7
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
20. Симпсон Дж.Л., Элиас С., Малинак Л.Р., Баттрам В.К. мл. Наследственные аспекты эндометриоза. I. Генетические исследования. Am J Акушер-гинеколог. (1980) 137:327–31. дои: 10.1016/0002-9378(80)-5
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
21. Трелоар С.А., О’Коннор Д.Т., О’Коннор В.М., Мартин Н.Г. Генетическое влияние на эндометриоз в образце австралийских близнецов. [email protected]. Fertil Стерил. (1999) 71:701–10. doi: 10.1016/S0015-0282(98)00540-8
Трелоар С.А., О’Коннор Д.Т., О’Коннор В.М., Мартин Н.Г. Генетическое влияние на эндометриоз в образце австралийских близнецов. [email protected]. Fertil Стерил. (1999) 71:701–10. doi: 10.1016/S0015-0282(98)00540-8
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
22. Nouri K, Ott J, Krupitz B, Huber JC, Wenzl R. Семейная заболеваемость эндометриозом у родственников первой, второй и третьей степени родства: исследование случай-контроль. Репрод Биол Эндокринол. (2010) 8:85.дои: 10.1186/1477-7827-8-85
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
23. Рахмиоглу Н., Нихолт Д.Р., Моррис А.П., Миссмер С.А., Монтгомери Г.В., Зондерван К.Т. Генетические варианты, лежащие в основе риска эндометриоза: результаты метаанализа восьми полногеномных наборов данных об ассоциации и репликации. Обновление воспроизведения шума. (2014) 20:702–16. doi: 10.1093/humupd/dmu015
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
24. Nyholt DR, Low SK, Anderson CA, Painter JN, Uno S, Morris AP, et al.Мета-анализ ассоциаций по всему геному выявляет новые локусы риска эндометриоза. Нат Жене. (2012) 44:1355–9. doi: 10.1038/ng.2445
Nyholt DR, Low SK, Anderson CA, Painter JN, Uno S, Morris AP, et al.Мета-анализ ассоциаций по всему геному выявляет новые локусы риска эндометриоза. Нат Жене. (2012) 44:1355–9. doi: 10.1038/ng.2445
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
25. Сапкота Ю., Стейнторсдоттир В., Моррис А.П., Фассбендер А., Рахмиоглу Н., Де Виво И. и соавт. Мета-анализ идентифицирует пять новых локусов, связанных с эндометриозом, выделяя ключевые гены, участвующие в метаболизме гормонов. Нац.коммун. (2017) 8:15539. doi: 10.1038/ncomms15539
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
26.Нноахам К.Е., Вебстер П., Кумбанг Дж., Кеннеди С.Х., Зондерван К.Т. Является ли раннее начало менархе фактором риска эндометриоза? Систематический обзор и метаанализ исследований случай-контроль. Fertil Стерил. (2012) 98: 702–12.e6. doi: 10.1016/j.fertnstert.2012.05.035
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
27. Zeitoun K, Takayama K, Michael MD, Bulun SE. Стимуляция активности промотора (II) ароматазы Р450 (II) при эндометриозе и ее ингибирование в эндометрии регулируются конкурентным связыванием стероидогенного фактора-1 и фактора транскрипции перед промотором куриного овальбумина с одним и тем же цис-действующим элементом. Мол Эндокринол. (1999) 13:239–53. doi: 10.1210/исправление 13.2.0229
Zeitoun K, Takayama K, Michael MD, Bulun SE. Стимуляция активности промотора (II) ароматазы Р450 (II) при эндометриозе и ее ингибирование в эндометрии регулируются конкурентным связыванием стероидогенного фактора-1 и фактора транскрипции перед промотором куриного овальбумина с одним и тем же цис-действующим элементом. Мол Эндокринол. (1999) 13:239–53. doi: 10.1210/исправление 13.2.0229
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
28. Zeitoun K, Takayama K, Sasano H, Suzuki T, Moghrabi N, Andersson S, et al. Недостаточная экспрессия 17бета-гидроксистероиддегидрогеназы 2 типа при эндометриозе: неспособность метаболизировать 17бета-эстрадиол. J Clin Endocrinol Metab. (1998) 83:4474–80. doi: 10.1210/jcem.83.12.5301
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
29.Osinski M, Wirstlein P, Wender-Ozegowska E, Mikolajczyk M, Jagodzinski PP, Szczepanska M. Экспрессия HSD3B2, HSD17B1, HSD17B2, ESR1, ESR2 и AR у бесплодных женщин с эндометриозом. Гинекол Пол. (2018) 89: 125–34. doi: 10.5603/GP.a2018.0022
Гинекол Пол. (2018) 89: 125–34. doi: 10.5603/GP.a2018.0022
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
31. Liang Y, Xie X, Wu J, Liu D, Yao S. Злодейская роль эстрогена во взаимодействии макрофагов и нервов при эндометриозе. Репрод Биол Эндокринол. (2018) 16:122.doi: 10.1186/s12958-018-0441-z
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
33. Halme J, Becker S, Haskill S. Измененное созревание и функция перитонеальных макрофагов: возможная роль в патогенезе эндометриоза. Am J Акушер-гинеколог. (1987) 156:783–9. дои: 10.1016/0002-9378(87)
-4Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
34. Tariverdian N, Siedentopf F, Rucke M, Blois SM, Klapp BF, Kentenich H, et al.Статус внутрибрюшинных иммунных клеток у бесплодных женщин с эндометриозом и без него. J Reprod Immunol. (2009) 80:80–90. doi: 10.1016/j.jri.2008.12.005
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
35. Oosterlynck DJ, Cornillie FJ, Waer M, Vandeputte M, Koninckx PR. У женщин с эндометриозом наблюдается дефект естественной киллерной активности, что приводит к снижению цитотоксичности в отношении аутологичного эндометрия. Fertil Стерил. (1991) 56:45–51. дои: 10.1016/S0015-0282(16)54414-8
Oosterlynck DJ, Cornillie FJ, Waer M, Vandeputte M, Koninckx PR. У женщин с эндометриозом наблюдается дефект естественной киллерной активности, что приводит к снижению цитотоксичности в отношении аутологичного эндометрия. Fertil Стерил. (1991) 56:45–51. дои: 10.1016/S0015-0282(16)54414-8
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
36. Чон И., Чеон К., Ким М.Р. Снижение цитотоксичности периферических и перитонеальных естественных киллеров при эндометриозе. BioMed Res Int. (2016) 2016:2916070. дои: 10.1155/2016/2916070
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
37. Хо Х.Н., Чао К.Х., Чен Х.Ф., Ву М.Ю., Ян Ю.С., Ли Т.И. Перитонеальная цитотоксичность натуральных киллеров и субпопуляция CD25+ CD3+ лимфоцитов снижены у женщин с III-IV стадией эндометриоза. Hum Репрод. (1995) 10:2671–5. doi: 10.1093/oxfordjournals.humrep.a135765
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
38. Wu MH, Shoji Y, Wu MC, Chuang PC, Lin CC, Huang MF, et al. Подавление матриксной металлопротеиназы-9 простагландином Е(2) в перитонеальных макрофагах связано с тяжестью эндометриоза. Ам Дж. Патол. (2005) 167:1061–9. doi: 10.1016/S0002-9440(10)61195-9
Wu MH, Shoji Y, Wu MC, Chuang PC, Lin CC, Huang MF, et al. Подавление матриксной металлопротеиназы-9 простагландином Е(2) в перитонеальных макрофагах связано с тяжестью эндометриоза. Ам Дж. Патол. (2005) 167:1061–9. doi: 10.1016/S0002-9440(10)61195-9
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
41.Сэмпсон Дж.А. Метастатический или эмболический эндометриоз, обусловленный менструальной диссеминацией эндометриальной ткани в венозный кровоток. Ам Дж. Патол. (1927) 3: 93–110.43.
Академия Google
42. Greaves E, Cousins FL, Murray A, Esnal-Zufiaurre A, Fassbender A, Horne AW, et al. Новая мышиная модель эндометриоза имитирует человеческий фенотип и раскрывает информацию о воспалительном вкладе отслоившегося эндометрия. Ам Дж. Патол. (2014) 184:1930–9. дои: 10.1016/j.ajpath.2014.03.011
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
43. Казинс Ф.Л., Кирквуд П. М., Сондерс П.Т., Гибсон Д.А. Доказательства динамической роли мононуклеарных фагоцитов во время восстановления и ремоделирования эндометрия. Научный представитель (2016) 6:36748. дои: 10.1038/srep36748
М., Сондерс П.Т., Гибсон Д.А. Доказательства динамической роли мононуклеарных фагоцитов во время восстановления и ремоделирования эндометрия. Научный представитель (2016) 6:36748. дои: 10.1038/srep36748
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
44. Brosens I, Benagiano G. Участвуют ли неонатальные маточные кровотечения в патогенезе эндометриоза как источник стволовых клеток? Fertil Стерил. (2013) 100:622–3. doi: 10.1016/j.fertnstert.2013.04.046
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
45. Troncon JK, Zani AC, Vieira AD, Poli-Neto OB, Nogueira AA, Rosa ESJC. Эндометриоз у пациентки с синдромом Майера-Рокитанского-Кюстера-Хаузера. Представитель акушерства и гинекологии. (2014) 2014:376231. дои: 10.1155/2014/376231
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
46. Яблонски С., Алифано М., Регнард Дж. Ф., Гомпель А.Пневмоперитонеум, связанный с менструальным пневмотораксом у женщин с торакальным эндометриозом. Fertil Стерил. (2009) 91:930.e19–22. doi: 10.1016/j.fertnstert.2008.09.071
Fertil Стерил. (2009) 91:930.e19–22. doi: 10.1016/j.fertnstert.2008.09.071
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
47. Rousset-Jablonski C, Alifano M, Plu-Bureau G, Camilleri-Broet S, Rousset P, Regnard JF, et al. Катамениальный пневмоторакс и пневмоторакс, связанный с эндометриозом: клинические особенности и факторы риска. Hum Репрод. (2011) 26:2322–9.doi: 10.1093/humrep/der189
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
50. Abomaray F, Gidlof S, Gotherstrom C. Мезенхимальные стромальные клетки более иммунодепрессивны in vitro , если они получены из эндометриоидных поражений, чем из эутопического эндометрия. Стволовые клетки, международный (2017) 2017:3215962. дои: 10.1155/2017/3215962
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
52. Zhu Y, Herndon JM, Sojka DK, Kim KW, Knolhoff BL, Zuo C, et al.Резидентные в ткани макрофаги при аденокарциноме протоков поджелудочной железы происходят из эмбрионального кроветворения и способствуют прогрессированию опухоли. Иммунитет. (2017) 47:597. doi: 10.1016/j.immuni.2017.08.018
Иммунитет. (2017) 47:597. doi: 10.1016/j.immuni.2017.08.018
Полнотекстовая перекрестная ссылка | Академия Google
53. Bacci M, Capobianco A, Monno A, Cottone L, Di Puppo F, Camisa B, et al. Макрофаги альтернативно активируются у пациентов с эндометриозом и необходимы для роста и васкуляризации поражений в мышиной модели заболевания. Ам Дж. Патол. (2009) 175:547–56. doi: 10.2353/ajpath.2009.081011
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
54. Форстер Р., Саргинсон А., Величкова А., Хогг С., Дорнинг А., Хорн А.В. и соавт. Инсулиноподобный фактор роста-1, полученный из макрофагов, является ключевым нейротрофическим и нервно-сенсибилизирующим фактором боли, связанной с эндометриозом. FASEB J. (2019) 33:11210–22. дои: 10.1096/fj.2017R
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
55.Гривз Э., Темп Дж., Эснал-Зуфиурре А., Мехснер С., Хорн А.В., Сондерс П. Т. Эстрадиол является важным медиатором перекрестных помех макрофагов и нервов при перитонеальном эндометриозе. Ам Дж. Патол. (2015) 185:2286–97. doi: 10.1016/j.ajpath.2015.04.012
Т. Эстрадиол является важным медиатором перекрестных помех макрофагов и нервов при перитонеальном эндометриозе. Ам Дж. Патол. (2015) 185:2286–97. doi: 10.1016/j.ajpath.2015.04.012
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
56. Ju C, Tacke F. Печеночные макрофаги в гомеостазе и заболеваниях печени: от патогенеза к новым терапевтическим стратегиям. Селл Мол Иммунол. (2016) 13:316–27.doi: 10.1038/cmi.2015.104
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
57. Ллойд А.Ф., Дэвис К.Л., Холлоуэй Р.К., Лабрак Ю., Айрленд Г., Каррадори Д. и соавт. Регенерация центральной нервной системы обусловлена некроптозом и репопуляцией микроглии. Нац Нейроци. (2019) 22:1046–52. doi: 10.1038/s41593-019-0418-z
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
60. Schulz C, Gomez Perdiguero E, Chorro L, Szabo-Rogers H, Cagnard N, Kierdorf K, et al.Линия миелоидных клеток, независимая от Myb и гемопоэтических стволовых клеток. Наука. (2012) 336:86–90. doi: 10.1126/science.1219179
Наука. (2012) 336:86–90. doi: 10.1126/science.1219179
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
61. Hashimoto D, Chow A, Noizat C, Teo P, Beasley MB, Leboeuf M, et al. Резидентные в тканях макрофаги локально самоподдерживаются на протяжении всей взрослой жизни с минимальным вкладом циркулирующих моноцитов. Иммунитет. (2013) 38:792–804. doi: 10.1016/j.immuni.2013.04.004
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
62. Gomez Perdiguero E, Klapproth K, Schulz C, Busch K, Azzoni E, Crozet L, et al. Резидентные в тканях макрофаги происходят из эритромиелоидных клеток-предшественников желточного мешка. Природа. (2015) 518:547–51. doi: 10.1038/nature13989
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
63. Hoeffel G, Chen J, Lavin Y, Low D, Almeida FF, See P, et al. C-Myb(+) эритромиелоидные предшественники фетальных моноцитов дают начало макрофагам, резидентным в тканях взрослых. Иммунитет. (2015) 42:665–78. doi: 10.1016/j.immuni.2015.03.011
Иммунитет. (2015) 42:665–78. doi: 10.1016/j.immuni.2015.03.011
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
64. Mass E, Ballesteros I, Farlik M, Halbritter F, Gunther P, Crozet L, et al. Спецификация резидентных в тканях макрофагов во время органогенеза. Наука. (2016) 353:aaf4238. doi: 10.1126/science.aaf4238
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
67. Olingy CE, San Emeterio CL, Ogle ME, Krieger JR, Bruce AC, Pfau DD, et al.Неклассические моноциты являются предвзятыми предшественниками ранозаживляющих макрофагов при повреждении мягких тканей. Научный представитель (2017) 7:447. doi: 10.1038/s41598-017-00477-1
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
68. Auffray C, Fogg D, Garfa M, Elain G, Join-Lambert O, Kayal S, et al. Мониторинг сосудов и тканей популяцией моноцитов с патрулирующим поведением. Наука. (2007) 317: 666–70. doi: 10.1126/science.1142883
doi: 10.1126/science.1142883
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
69.Якубзик С., Готье Э.Л., Гиббингс С.Л., Сойка Д.К., Шлитцер А., Джонсон Т.Э. и соавт. Минимальная дифференциация классических моноцитов, поскольку они исследуют стационарные ткани и транспортируют антиген в лимфатические узлы. Иммунитет. (2013) 39: 599–610. doi: 10.1016/j.immuni.2013.08.007
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
71. Ingersoll MA, Spanbroek R, Lottaz C, Gautier EL, Frankenberger M, Hoffmann R, et al. Сравнение профилей экспрессии генов между подмножествами моноцитов человека и мыши. Кровь. (2010) 115: e10–9. doi: 10.1182/blood-2009-07-235028
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
73. Mantovani A, Sica A, Sozzani S, Allavena P, Vecchi A, Locati M. Система хемокинов в различных формах активации и поляризации макрофагов. Тренды Иммунол. (2004) 25:677–86. doi: 10.1016/j.it.2004.09.015
(2004) 25:677–86. doi: 10.1016/j.it.2004.09.015
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
74. Rey-Giraud F, Hafner M, Ries CH. Получение in vitro макрофагов, полученных из моноцитов, в бессывороточных условиях улучшает их функции, способствующие развитию опухолей. ПЛОС ОДИН. (2012) 7:e42656. doi: 10.1371/journal.pone.0042656
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
77. Gautier EL, Shay T, Miller J, Greter M, Jakubzick C, Ivanov S, et al. Профили экспрессии генов и пути регуляции транскрипции, лежащие в основе идентичности и разнообразия макрофагов тканей мыши. Нат Иммунол. (2012) 13:1118–28. doi: 10.1038/ni.2419
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
81. Кричли Х.О., Келли Р.В., Бреннер Р.М., Бэрд Д.Т. Эндокринология менструации – роль иммунной системы. Клин Эндокринол. (2001) 55:701–10. doi: 10.1046/j. 1365-2265.2001.01432.x
1365-2265.2001.01432.x
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
82. Аричи А., Макдональд П.С., Кейси М.Л. Регуляция экспрессии гена хемотаксического белка-1 моноцитов в клетках эндометрия человека в культурах. Мол клеточный эндокринол. (1995) 107:189–97. doi: 10.1016/0303-7207(94)03442-V
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
83. Джонс Р.Л., Келли Р.В., Кричли Х.О. Экспрессия хемокина и циклооксигеназы-2 в эндометрии человека совпадает с накоплением лейкоцитов. Hum Репрод. (1997) 12:1300–6. doi: 10.1093/humrep/12.6.1300
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
84. Китайя К., Накаяма Т., Дайкоку Н., Фусики С., Хондзё Х.Пространственная и временная экспрессия лигандов CXCR3 и CXCR4 в эндометрии человека. J Clin Endocrinol Metab. (2004) 89:2470–6. doi: 10.1210/jc.2003-031293
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
85. Эйдукайте А., Тамосюнас В. Эндометриальные и перитонеальные макрофаги: экспрессия молекул активации и адгезии. Am J Reprod Immunol. (2004) 52:113–7. doi: 10.1111/j.1600-0897.2004.00201.x
Эйдукайте А., Тамосюнас В. Эндометриальные и перитонеальные макрофаги: экспрессия молекул активации и адгезии. Am J Reprod Immunol. (2004) 52:113–7. doi: 10.1111/j.1600-0897.2004.00201.x
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
87.Шарки А.М., Дэй К., Макферсон А., Малик С., Лицензия Д., Смит С.К. и др. Экспрессия сосудистого эндотелиального фактора роста в эндометрии человека регулируется гипоксией. J Clin Endocrinol Metab. (2000) 85:402–9. doi: 10.1210/jc.85.1.402
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
88. Чжан X, Нотник В.Б. Роль и регуляция матриксной металлопротеиназной системы матки у менструирующих и неменструирующих видов. Front Biosci. (2005) 10:353–66.дои: 10.2741/1533
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
90. Карри Т.Е. младший, Остин К.Г. Матриксная металлопротеиназная система: изменения, регуляция и влияние на репродуктивный цикл яичников и матки. Endocr Rev. (2003) 24:428–65. doi: 10.1210/er.2002-0005
Endocr Rev. (2003) 24:428–65. doi: 10.1210/er.2002-0005
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
91. Jeziorska M, Nagase H, Salamonsen LA, Woolley DE. Иммунолокализация матриксных металлопротеиназ желатиназы В и стромелизина 1 в эндометрии человека на протяжении менструального цикла. J Reprod Fertil. (1996) 107:43–51. doi: 10.1530/jrf.0.1070043
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
92. Pepe G, Braga D, Renzi TA, Villa A, Bolego C, D’Avila F, et al. Самообновление и фенотипическая конверсия являются основными физиологическими реакциями макрофагов на всплеск эндогенного эстрогена. Научный представитель (2017) 7:44270. дои: 10.1038/srep44270
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
93.Макларен Дж., Прентис А., Чарнок-Джонс Д.С., Милликан С.А., Мюллер К.Х., Шарки А.М. и др. Фактор роста эндотелия сосудов продуцируется макрофагами перитонеальной жидкости при эндометриозе и регулируется стероидами яичников. Дж Клин Инвест. (1996) 98:482–9. дои: 10.1172/JCI118815
Дж Клин Инвест. (1996) 98:482–9. дои: 10.1172/JCI118815
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
94. Rochefort H, Chalbos D, Cunat S, Lucas A, Platet N, Garcia M. Регулируемые эстрогеном протеазы и антипротеазы в клетках рака яичников и молочной железы. J Стероиды Biochem Mol Biol. (2001) 76:119–24. doi: 10.1016/S0960-0760(00)00142-4
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
96. Cheng CW, Bielby H, License D, Smith SK, Print CG, Charnock-Jones DS. Количественный клеточный и молекулярный анализ эффекта отмены прогестерона в мышиной модели децидуализации. Биол Репрод. (2007) 76:871–83. doi: 10.1095/biolreprod.106.057950
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
97.Тиручельвам У., Мэйбин Дж.А., Армстронг Г.М., Гривз Э., Сондерс П.Т., Кричли Х.О. Кортизол регулирует паракринное действие макрофагов, индуцируя вазоактивную экспрессию генов в клетках эндометрия. J Leukoc Biol. (2016) 99:1165–71. doi: 10.1189/jlb.5A0215-061RR
J Leukoc Biol. (2016) 99:1165–71. doi: 10.1189/jlb.5A0215-061RR
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
98. Ghosn EE, Cassado AA, Govoni GR, Fukuhara T, Yang Y, Monack DM, et al. Два физически, функционально и эволюционно различных подмножества перитонеальных макрофагов. Proc Natl Acad Sci USA. (2010) 107:2568–73. doi: 10.1073/pnas.0915000107
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
100. Rosas M, Davies LC, Giles PJ, Liao CT, Kharfan B, Stone TC, et al. Транскрипционный фактор Gata6 связывает фенотип тканевых макрофагов и пролиферативное обновление. Наука. (2014) 344:645–8. doi: 10.1126/science.1251414
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
101. Bain CC, Hawley CA, Garner H, Scott CL, Schridde A, Steers NJ, et al.Долгоживущие самообновляющиеся макрофаги костного мозга вытесняют клетки эмбрионального происхождения и заселяют серозные полости взрослых особей. Нац.коммун. (2016) 7:ncomms11852. doi: 10.1038/ncomms11852
Нац.коммун. (2016) 7:ncomms11852. doi: 10.1038/ncomms11852
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
102. Кассадо Адос А., Д’Империо Лима М.Р., Бортолучи К.Р. Пересмотр перитонеальных макрофагов мыши: гетерогенность, развитие и функция. Фронт Иммунол. (2015) 6:225. doi: 10.3389/fimmu.2015.00225
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
103.Kubicka U, Olszewski WL, Tarnowski W, Bielecki K, Ziolkowska A, Wierzbicki Z. Нормальные иммунные клетки брюшины человека: субпопуляции и функциональные характеристики. Scand J Immunol. (1996) 44:157–63. doi: 10.1046/j.1365-3083.1996.d01-297.x
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
104. Irvine KM, Banh X, Gadd VL, Wojcik KK, Ariffin JK, Jose S, et al. CRIg-экспрессирующие перитонеальные макрофаги связаны с тяжестью заболевания у пациентов с циррозом печени и асцитом. JCI Insight. (2016) 1:e86914. doi: 10.1172/jci.insight.86914
(2016) 1:e86914. doi: 10.1172/jci.insight.86914
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
106. Окабе Ю., Меджитов Р. Тканеспецифические сигналы контролируют обратимую программу локализации и функциональной поляризации макрофагов. Сотовый. (2014) 157:832–44. doi: 10.1016/j.cell.2014.04.016
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
107. Дэвис Л.С., Росас М., Смит П.Дж., Фрейзер Д.Дж., Джонс С.А., Тейлор П.Р.Поддающийся количественной оценке пролиферативный всплеск тканевых макрофагов восстанавливает гомеостатические популяции макрофагов после острого воспаления. Евро J Иммунол. (2011) 41:2155–64. doi: 10.1002/eji.201141817
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
108. Готье Э.Л., Иванов С., Лесник П., Рэндольф Г.Дж. Локальный апоптоз опосредует очистку макрофагов от разрешения воспаления у мышей. Кровь. (2013) 122:2714–22. doi: 10.1182/blood-2013-01-478206
doi: 10.1182/blood-2013-01-478206
Реферат PubMed | Полнотекстовая перекрестная ссылка
109.Ляо К.Т., Росас М., Дэвис Л.С., Джайлз П.Дж., Тиррелл В.Дж., О’Доннелл В.Б. и другие. IL-10 по-разному контролирует инфильтрацию воспалительных макрофагов и антигенпрезентирующих клеток во время воспаления. Евро J Иммунол. (2016) 46:2222–32. дои: 10.1002/eji.201646528
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
110. Wong K, Valdez PA, Tan C, Yeh S, Hongo JA, Ouyang W. Фосфатидилсериновый рецептор Tim-4 необходим для поддержания гомеостатического состояния резидентных перитонеальных макрофагов. Proc Natl Acad Sci USA. (2010) 107:8712–7. doi: 10.1073/pnas.09107
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
111. Wang J, Kubes P. Резервуар зрелых полостных макрофагов, которые могут быстро проникать во внутренние органы, чтобы повлиять на восстановление тканей. Сотовый.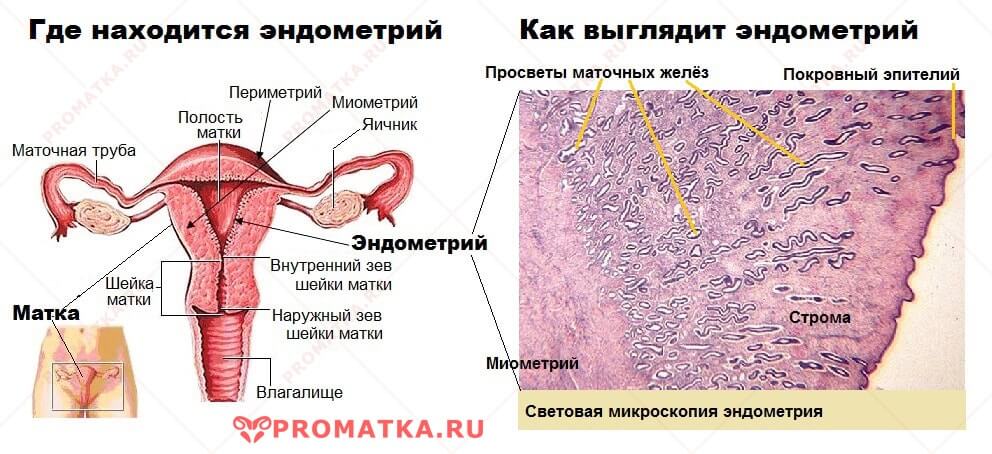 (2016) 165: 668–78. doi: 10.1016/j.cell.2016.03.009
(2016) 165: 668–78. doi: 10.1016/j.cell.2016.03.009
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
112. Ruckerl D, Campbell SM, Duncan S, Sutherland TE, Jenkins SJ, Hewitson JP, et al.Макрофагальное происхождение ограничивает функциональную пластичность при гельминто-бактериальной коинфекции. PLoS Патог. (2017) 13:e1006233. doi: 10.1371/journal.ppat.1006233
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
113. Cassado Ados A, de Albuquerque JA, Sardinha LR, Buzzo Cde L, Faustino L, Nascimento R, et al. Клеточное обновление и улучшение локальной эффекторной активности клеток в брюшной полости в ответ на инфекционные стимулы. ПЛОС ОДИН. (2011) 6:e22141.doi: 10.1371/journal.pone.0022141
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
114. Bellingan GJ, Caldwell H, Howie SE, Dransfield I, Haslett C. In vivo Судьба воспалительных макрофагов во время разрешения воспаления: воспалительные макрофаги не погибают локально, а мигрируют в дренирующие лимфатические узлы. Дж Иммунол. (1996) 157:2577–85.
Дж Иммунол. (1996) 157:2577–85.
Академия Google
115. Yona S, Kim KW, Wolf Y, Mildner A, Varol D, Breker M, et al.Картирование судьбы выявляет происхождение и динамику моноцитов и тканевых макрофагов в условиях гомеостаза. Иммунитет. (2013) 38:79–91. doi: 10.1016/j.immuni.2013.05.008
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
117. Бернетт С.Х., Беус Б.Дж., Авдюшко Р., Куоллс Дж., Каплан А.М., Коэн Д.А. Развитие спаек брюшины у мышей с истощением макрофагов. J Surg Res. (2006) 131: 296–301. doi: 10.1016/j.jss.2005.08.026
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
119.Zhang QW, Liu L, Gong CY, Shi HS, Zeng YH, Wang XZ и другие. Прогностическое значение опухолеассоциированных макрофагов в солидной опухоли: метаанализ литературы. ПЛОС ОДИН. (2012) 7:e50946. doi: 10.1371/journal.pone.0050946
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
121. Qian BZ, Li J, Zhang H, Kitamura T, Zhang J, Campion LR, et al. CCL2 рекрутирует воспалительные моноциты, чтобы облегчить метастазирование опухоли молочной железы. Природа. (2011) 475: 222–5.doi: 10.1038/nature10138
Qian BZ, Li J, Zhang H, Kitamura T, Zhang J, Campion LR, et al. CCL2 рекрутирует воспалительные моноциты, чтобы облегчить метастазирование опухоли молочной железы. Природа. (2011) 475: 222–5.doi: 10.1038/nature10138
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
122. Sawanobori Y, Ueha S, Kurachi M, Shimaoka T, Talmadge JE, Abe J, et al. Опосредованный хемокинами быстрый оборот супрессорных клеток миелоидного происхождения у мышей с опухолями. Кровь. (2008) 111:5457–66. doi: 10.1182/blood-2008-01-136895
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
123. Cortez-Retamozo V, Etzrodt M, Newton A, Rauch PJ, Chudnovskiy A, Berger C, et al.Происхождение опухолеассоциированных макрофагов и нейтрофилов. Proc Natl Acad Sci USA. (2012) 109:2491–6. doi: 10.1073/pnas.1113744109
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
124. Yang W, Lu Y, Xu Y, Xu L, Zheng W, Wu Y, et al. Эстроген подавляет рост гепатоцеллюлярной карциномы (ГЦК) путем ингибирования альтернативной активации опухолеассоциированных макрофагов (ТАМ). J Biol Chem. (2012) 287:40140–9. doi: 10.1074/jbc.M112.348763
Эстроген подавляет рост гепатоцеллюлярной карциномы (ГЦК) путем ингибирования альтернативной активации опухолеассоциированных макрофагов (ТАМ). J Biol Chem. (2012) 287:40140–9. doi: 10.1074/jbc.M112.348763
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
125.Секигучи К., Ито Ю., Хаттори К., Иноуэ Т., Хосоно К., Хонда М. и др. Макрофаги, экспрессирующие рецептор VEGF 1, рекрутированные из костного мозга, усиливают ангиогенез в тканях эндометрия. Научный представитель (2019) 9:7037. doi: 10.1038/s41598-019-43185-8
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
127. Capobianco A, Monno A, Cottone L, Venneri MA, Biziato D, Di Puppo F, et al. Проангиогенные макрофаги Tie2(+) инфильтрируют эндометриоидные очаги у человека и мыши и определяют их рост в мышиной модели заболевания. Ам Дж. Патол. (2011) 179:2651–9. doi: 10.1016/j.ajpath.2011.07.029
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
128. Бербич М., Шульке Л., Маркхэм Р., Токушиге Н., Рассел П., Фрейзер И.С. Экспрессия макрофагов в эндометрии женщин с эндометриозом и без него. Hum Репрод. (2009) 24:325–32. doi: 10.1093/humrep/den393
Бербич М., Шульке Л., Маркхэм Р., Токушиге Н., Рассел П., Фрейзер И.С. Экспрессия макрофагов в эндометрии женщин с эндометриозом и без него. Hum Репрод. (2009) 24:325–32. doi: 10.1093/humrep/den393
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
129. Takebayashi A, Kimura F, Kishi Y, Ishida M, Takahashi A, Yamanaka A, et al.Субпопуляции макрофагов в эутопическом эндометрии больных эндометриозом. Am J Reprod Immunol. (2015) 73: 221–31. doi: 10.1111/aji.12331
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
130. Jolicoeur C, Boutouil M, Drouin R, Paradis I, Lemay A, Akoum A. Повышенная экспрессия хемотаксического белка-1 моноцитов в эндометрии женщин с эндометриозом. Ам Дж. Патол. (1998) 152:125–33.
Реферат PubMed | Академия Google
131.Collette T, Maheux R, Mailloux J, Akoum A. Повышенная экспрессия матриксной металлопротеиназы-9 в эутопической ткани эндометрия женщин с эндометриозом.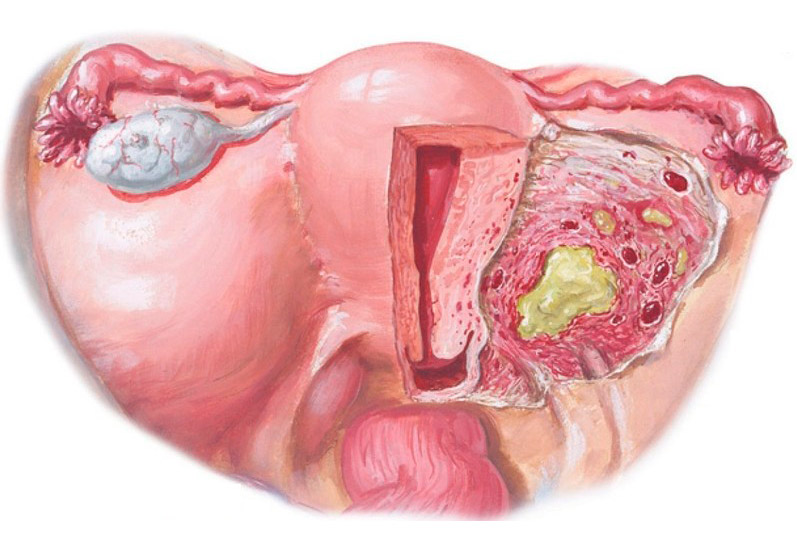 Hum Репрод. (2006) 21:3059–67. doi: 10.1093/humrep/del297
Hum Репрод. (2006) 21:3059–67. doi: 10.1093/humrep/del297
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
132. Yang HL, Zhou WJ, Chang KK, Mei J, Huang LQ, Wang MY, et al. Взаимодействие между эндометриальными стромальными клетками и макрофагами снижает цитотоксичность NK-клеток при эндометриозе за счет секреции IL-10 и TGF-бета. Репродукция. (2017) 154:815–25. doi: 10.1530/REP-17-0342
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
133. Beste MT, Pfaffle-Doyle N, Prentice EA, Morris SN, Lauffenburger DA, Isaacson KB, et al. Молекулярно-сетевой анализ эндометриоза показывает роль активации макрофагов, регулируемой c-Jun. Sci Transl Med. (2014) 6:222ra16. doi: 10.1126/scitranslmed.3007988
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
134.Fan YY, Chen HY, Chen W, Liu YN, Fu Y, Wang LN. Экспрессия воспалительных цитокинов в сыворотке крови и перитонеальной жидкости больных с разными стадиями эндометриоза. Гинекол Эндокринол. (2018) 34: 507–12. дои: 10.1080/09513590.2017.1409717
Гинекол Эндокринол. (2018) 34: 507–12. дои: 10.1080/09513590.2017.1409717
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
136. Йохан М.З., Ингман В.В., Робертсон С.А., Халл М.Л. Макрофаги, инфильтрирующие очаги, подобные эндометриозу, демонстрируют прогрессивные изменения фенотипа в модели гетерологичных мышей. J Reprod Immunol. (2019) 132:1–8. doi: 10.1016/j.jri.2019.01.002
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
137. Van Rooijen N, Sanders A. Опосредованное липосомами истощение макрофагов: механизм действия, подготовка липосом и применение. J Immunol Methods. (1994) 174:83–93. дои: 10.1016/0022-1759(94)-4
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
138. Хабер Э., Даненберг Х.Д., Короухов Н., Рон-Эл Р., Голомб Г., Шахтер М.Истощение перитонеальных макрофагов липосомальным бисфосфонатом ослабляет эндометриоз в модели крыс. Hum Репрод. (2009) 24:398–407. doi: 10.1093/humrep/den375
Hum Репрод. (2009) 24:398–407. doi: 10.1093/humrep/den375
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
139. Дуань Дж., Лю С., Ван Х., Го С.В. Субпопуляция макрофагов M2a может играть решающую роль в фиброгенезе эндометриоза у мышей. Reprod Biomed Online. (2018) 37: 254–68. doi: 10.1016/j.rbmo.2018.05.017
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
141.Чан Р.В.С., Ли К.Л., Нг ЭХИ, Юнг В.С.Б. Совместное культивирование с макрофагами усиливает клоногенную и инвазионную активность эндометриоидных стромальных клеток. Клеточный пролиф. (2017) 50:e12330. doi: 10.1111/cpr.12330
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
142. Мэй Дж., Чанг К.К., Сун Х.С. Иммуносупрессивные макрофаги, индуцируемые IDO1, способствуют росту стромальных клеток эндометрия при эндометриозе. Mol Med Rep. (2017) 15:2255–60. doi: 10.3892/ммр.2017.6242
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
143. Shao J, Zhang B, Yu JJ, Wei CY, Zhou WJ, Chang KK, et al. Макрофаги способствуют росту и инвазии эндометриальных стромальных клеток путем подавления IL-24 при эндометриозе. Репродукция. (2016) 152: 673–82. doi: 10.1530/REP-16-0278
Shao J, Zhang B, Yu JJ, Wei CY, Zhou WJ, Chang KK, et al. Макрофаги способствуют росту и инвазии эндометриальных стромальных клеток путем подавления IL-24 при эндометриозе. Репродукция. (2016) 152: 673–82. doi: 10.1530/REP-16-0278
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
145. McKinnon B, Bersinger NA, Wotzkow C, Mueller MD. Нервные волокна, связанные с эндометриозом, концентрация цитокинов в перитонеальной жидкости и боль при очагах эндометриоза различной локализации. Fertil Стерил. (2012) 97:373–80. doi: 10.1016/j.fertnstert.2011.11.011
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
147. Арнольд Дж., Барсена де Арельяно М.Л., Растер С., Верчеллино Г.Ф., Чиантера В., Шнайдер А. и соавт. Дисбаланс между симпатической и сенсорной иннервацией при перитонеальном эндометриозе. Мозг Поведение Иммун. (2012) 26:132–41. doi: 10.1016/j.bbi.2011.08.004
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
149. Cominelli A, Gaide Chevronnay HP, Lemoine P, Courtoy PJ, Marbaix E, Henriet P. Матриксная металлопротеиназа-27 экспрессируется в макрофагах CD163+/CD206+ M2 в циклическом эндометрии человека и в поверхностных эндометриоидных поражениях. Моль Гум Репрод. (2014) 20:767–75. doi: 10.1093/моль-час/gau034
Cominelli A, Gaide Chevronnay HP, Lemoine P, Courtoy PJ, Marbaix E, Henriet P. Матриксная металлопротеиназа-27 экспрессируется в макрофагах CD163+/CD206+ M2 в циклическом эндометрии человека и в поверхностных эндометриоидных поражениях. Моль Гум Репрод. (2014) 20:767–75. doi: 10.1093/моль-час/gau034
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
150. Smith KA, Pearson CB, Hachey AM, Xia DL, Wachtman LM. Альтернативная активация макрофагов у макак-резусов ( Macaca mulatta ) с эндометриозом. Комп Мед. (2012) 62:303–10.
Реферат PubMed | Академия Google
151. Strachan DC, Ruffell B, Oei Y, Bissell MJ, Coussens LM, Pryer N, et al. Ингибирование CSF1R задерживает рост опухоли шейки матки и молочной железы в мышиных моделях за счет ослабления оборота ассоциированных с опухолью макрофагов и усиления инфильтрации CD8(+) Т-клетками. Онкоиммунология. (2013) 2:e26968. doi: 10.4161/onci.26968
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
152. Гомес-Рока К.А., Итальяно А., Ле Турно К., Кассир П.А., Тулмонд М., Д’Анджело С.П. и др. Исследование фазы I монотерапии эмактузумабом или в комбинации с паклитакселом у пациентов с распространенными/метастатическими солидными опухолями выявило истощение иммуносупрессивных М2-подобных макрофагов. Энн Онкол. (2019) 30:1381–92. doi: 10.1093/annonc/mdz163
Гомес-Рока К.А., Итальяно А., Ле Турно К., Кассир П.А., Тулмонд М., Д’Анджело С.П. и др. Исследование фазы I монотерапии эмактузумабом или в комбинации с паклитакселом у пациентов с распространенными/метастатическими солидными опухолями выявило истощение иммуносупрессивных М2-подобных макрофагов. Энн Онкол. (2019) 30:1381–92. doi: 10.1093/annonc/mdz163
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
153. Ries CH, Cannarile MA, Hoves S, Benz J, Wartha K, Runza V, et al. Нацеливание на ассоциированные с опухолью макрофаги с помощью антител против CSF-1R раскрывает стратегию терапии рака. Раковая клетка. (2014) 25:846–59. doi: 10.1016/j.ccr.2014.05.016
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
155. Nywening TM, Wang-Gillam A, Sanford DE, Belt BA, Panni RZ, Cusworth BM, et al. Нацеливание на ассоциированные с опухолью макрофаги с ингибированием CCR2 в сочетании с FOLFIRINOX у пациентов с погранично операбельным и местнораспространенным раком поджелудочной железы: одноцентровое, открытое, нерандомизированное исследование с определением дозы, фаза 1b. Ланцет Онкол. (2016) 17: 651–62. doi: 10.1016/S1470-2045(16)00078-4
Ланцет Онкол. (2016) 17: 651–62. doi: 10.1016/S1470-2045(16)00078-4
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Воспалительные заболевания органов малого таза — Причины
Воспалительное заболевание органов малого таза (ВЗОМТ) вызывается инфекцией, развивающейся в верхних половых путях у женщин.
В большинстве случаев это состояние вызвано бактериальной инфекцией, распространяющейся из влагалища или шейки матки (вход в матку) в матку, фаллопиевы трубы и яичники.
ВЗОМТ часто вызывается более чем одним типом бактерий, и врачам иногда бывает трудно точно определить, какие из них ответственны.
Это означает, что будет назначена комбинация антибиотиков, чтобы можно было лечить различные бактерии.
Инфекции, передающиеся половым путем (ИППП)
Примерно в 1 из 4 случаев ВЗОМТ вызывается инфекциями, передающимися половым путем (ИППП), такими как хламидиоз, гонорея или генитальная микоплазма.
Эти бактерии обычно поражают только шейку матки, где их можно легко вылечить с помощью одной дозы антибиотика.
Но если их не лечить, есть риск, что бактерии могут попасть в верхние отделы половых путей.
По оценкам, у 1 из 10 женщин с невылеченным хламидиозом может развиться ВЗОМТ в течение года.
Другие причины
Во многих случаях причина инфекции, которая приводит к ВЗОМТ, неизвестна.
Иногда обычно безвредные бактерии, находящиеся во влагалище, могут проникнуть через шейку матки в репродуктивные органы.
Хотя эти типы бактерий безвредны для влагалища, они могут вызывать инфекцию в других частях тела.
Скорее всего, это произойдет, если:
Какие области могут заразиться?
Если инфекция распространяется вверх из влагалища и шейки матки, это может вызвать воспаление:
- слизистая оболочка матки (эндометрий)
- фаллопиевы трубы
- ткани вокруг матки
- яичники
- выстилка внутренней части живота (брюшины)
Очаги инфицированной жидкости, называемые абсцессами, также могут образовываться в яичниках и фаллопиевых трубах.
Кто подвергается наибольшему риску?
Заразиться ВЗОМТ может любая женщина, но у вас больше шансов заболеть, если вы:
- иметь более 1 полового партнера
- есть новый сексуальный партнер
- имеют историю ИППП
- имели PID в прошлом
- моложе 25 лет
- начал заниматься сексом в молодом возрасте
Последняя проверка страницы: 23 декабря 2021 г.
Дата следующей проверки: 23 декабря 2024 г.
Факты и вымыслы об эндометриозе
Эта статья также доступна на: português
Эндометриоз — сложное заболевание.Те, у кого она есть, часто также сталкиваются с запоздалыми диагнозами, случайным лечением и общим отсутствием осведомленности о самой болезни. Вот несколько ответов на распространенные вопросы об эндометриозе.
Является ли эндометриоз просто сильной менструальной болью?
№
Эндометриоз — это состояние, при котором эндометриоподобная ткань (похожая на слизистую оболочку матки или эндометрий) находится вне матки, где она вызывает хроническую воспалительную реакцию, которая может привести к боли и образованию рубцов. У некоторых людей с эндометриозом боли нет, но многие испытывают сильную боль до, во время и после менструации. Эндометриоз может вызывать болезненные менструации (дисменорея), хронические боли в области таза, болезненные ощущения при половом акте (диспареуния), болезненные движения кишечника (дисхезия), болезненное мочеиспускание (дизурия), боли в спине, боли в ногах и плечах. Эта боль может быть настолько интенсивной, что мешает нормальной повседневной деятельности, такой как сидение или ходьба.
У некоторых людей с эндометриозом боли нет, но многие испытывают сильную боль до, во время и после менструации. Эндометриоз может вызывать болезненные менструации (дисменорея), хронические боли в области таза, болезненные ощущения при половом акте (диспареуния), болезненные движения кишечника (дисхезия), болезненное мочеиспускание (дизурия), боли в спине, боли в ногах и плечах. Эта боль может быть настолько интенсивной, что мешает нормальной повседневной деятельности, такой как сидение или ходьба.
Разве эндометриоз не очень редкое явление?
№
Эндометриоз является одним из наиболее распространенных гинекологических заболеваний, которым страдают около 176 миллионов человек во всем мире (1). Это состояние может быть трудно диагностировать на ранней стадии, потому что некоторые люди не испытывают симптомов, а для подтверждения диагноза требуется хирургическая процедура. Другие люди могут иметь симптомы в течение многих лет и посещать нескольких врачей, прежде чем им будет поставлен диагноз (2).
Поражает ли эндометриоз только женщин в возрасте от 30 до 40 лет?
№
Глобальное исследование женского здоровья 2011 года, проведенное в десяти странах, показало, что две трети женщин с диагнозом эндометриоз обращались за помощью по поводу своих симптомов в возрасте до 30 лет, причем у многих симптомы проявлялись с самого начала их первой менструации. (3).
Можно ли заразиться эндометриозом?
№
Вы не можете заразиться эндометриозом. Это не болезнь, которая «заражается» или «вызывается» чем-то, что сделал человек, и она не заразна. В настоящее время неизвестна причина эндометриоза, но весьма вероятно, что он является генетическим (4). Иногда люди путают эндометриоз и эндометрит , что совсем другое. Эндометрит — это воспаление эндометрия, которое может быть вызвано инфекцией, передающейся половым путем, или другими видами бактерий.
Могут ли гормональные препараты вылечить эндометриоз?
№
Синтетические гормональные препараты, такие как таблетки, прогестины, даназол и аналоги ГнРГ, уже много лет используются для «лечения» эндометриоза. Однако эти гормональные методы лечения не оказывают долгосрочного воздействия на саму болезнь. Они временно уменьшают симптомы, но только во время приема лекарств. Как только использование лекарств прекращается, симптомы часто возвращаются.
Беременность лечит эндометриоз?
№
Беременность, как и гормональная терапия, может временно подавлять симптомы эндометриоза, но не устраняет его. Симптомы обычно возвращаются после родов. Иногда грудное вскармливание может отсрочить возвращение симптомов, но только если оно достаточно частое и интенсивное, чтобы подавить менструальный цикл. Одно исследование 345 женщин с эндометриозом показало, что симптомы на самом деле усилились после рождения у первородящих матерей (5).
Является ли гистерэктомия лекарством от эндометриоза?
Не обязательно.
Эндометриоз может быть и без матки, поскольку ткань, подобная эндометрию, может разрастаться во многих местах таза (например, в слизистой оболочке брюшной полости или кишечнике), вызывая эндометриоз. Удаление матки (а иногда и яичников) обычно рассматривается как крайняя мера, после того, как были опробованы другие лекарства и консервативные операции. Гистерэктомия сопряжена с большим риском, чем консервативная лапароскопическая операция, поскольку могут возникнуть осложнения, а также потеря фертильности и немедленная преждевременная менопауза, если также будут удалены яичники.Преимущество гистерэктомии (особенно с удалением яичников) заключается в снижении вероятности повторных операций в будущем (6, 7). Хотя гистерэктомия может облегчить боль, это не гарантируется навсегда.
Могу ли я забеременеть, если у меня эндометриоз?
Возможно.
Бесплодие или недостаточная фертильность — распространенный симптом эндометриоза. От 2 до 5 человек из 10 с эндометриозом страдают бесплодием или недостаточной фертильностью (8, 9, 10).Если посмотреть на проблему с другой точки зрения, до 2 из 5 женщин, которые борются с бесплодием, страдают эндометриозом (11). Эндометриоз может вызывать бесплодие из-за усиления воспаления, вызывающего повреждение яйцеклеток и сперматозоидов, или из-за анатомических изменений и образования рубцов (11). Однако это не означает, что люди с эндометриозом не могут забеременеть, поскольку некоторые методы лечения бесплодия могут повысить шансы на зачатие (12, 13, 14).
Хотите знать, есть ли у вас эндометриоз?
Если у вас трудные или болезненные менструации, обратитесь к своему лечащему врачу и сообщите ему, что вы думаете, что что-то не так.Для получения дополнительной информации читайте подробно о симптомах, диагностике и лечении эндометриоза.
Вы можете использовать Подсказку для отслеживания боли, кровотечения и других симптомов. Если вы считаете, что у вас может быть эндометриоз, эта запись может предоставить вашему лечащему врачу информацию, которая может помочь в диагностике и формировании плана лечения. Раннее лечение может снизить риск осложнений.
Эндометриоз | Эдинбургский университет
Эндометриоз является распространенным хроническим воспалительным заболеванием.Его причина, сопутствующие симптомы, диагностика и лечение исследуются здесь.
Эндометриоз — это хроническое воспалительное заболевание, вызываемое гормонами эстрогеном и прогестероном.
У женщин с эндометриозом клетки слизистой оболочки матки (эндометрия) обнаруживаются в других частях тела, чаще всего в малом тазу (например, на слизистой оболочке стенки таза или в яичниках, фаллопиевых трубах, мочевом пузыре). , кишечник или связки, поддерживающие матку). Клетки также можно найти между маткой и прямой кишкой или между прямой кишкой и влагалищем.
Эти клетки прикрепляются к слизистой оболочке таза и подвергаются циклическим изменениям (связанным с менструальным циклом), когда участки эндометриоза утолщаются и отпадают, но не могут покинуть тело. Это вызывает воспаление и может привести к образованию рубцовой ткани.
Реакцией организма на воспаление и рубцовую ткань являются боль и дискомфорт.
Посетите Vimeo для просмотра информационного видео Endometriosis.org об эндометриозе.
Насколько распространен эндометриоз?
1.В Великобритании от эндометриоза страдают 5 миллионов женщин, что составляет 1 из 10 женщин репродуктивного возраста. Это равно количеству женщин с диабетом.
Каковы симптомы?
- Тазовая боль, циклическая (связанная с менструальным циклом) или нециклическая (не связанная)
- Чрезмерная боль до/во время/после менструации
- Боль при сексе
- Проблемы с фертильностью
- Постоянная усталость
- Боль при мочеиспускании
- Аномальное кровотечение
- Боль при дефекации
У некоторых пациенток эти симптомы проявляются редко или вообще отсутствуют, поэтому диагностика эндометриоза может быть затруднена.Это может быть очень неприятно для пациентов, которые могут ждать несколько лет без объяснения причин своей боли.
Типы эндометриоза
Эндометриоз яичников: Узелки имплантируются в слизистую оболочку яичников. Когда ткань вокруг этих областей затвердевает, она может развиваться и распространяться в фаллопиевы трубы и кишечник.
Глубокий (инфильтрирующий) эндометриоз: Узелки имплантируются не менее чем на 5 мм ниже брюшины. Проникающие структуры могут включать маточно-крестцовые связки (связки, поддерживающие матку), кишечник, мочевой пузырь и мочеточники.
Перитонеальный эндометриоз: Брюшина представляет собой выстилку таза. Перитонеальный эндометриоз возникает, когда клетки эндометрия перемещаются в стенку брюшины и имплантируются в нее.
Что считается причиной эндометриоза?
Ретроградная менструация: Происходит во время менструального цикла, когда клетки движутся в направлении, противоположном кровотоку. Кровь переносит клетки в области за пределами матки, где они имплантируются и вызывают воспаление, приводящее к боли.После гистерэктомии все еще возможно развитие эндометриоза, что ставит под сомнение эту теорию.
Генетическое наследование: Некоторые гены могут повышать вероятность того, что человек страдает эндометриозом.
Аутоиммунная реакция: Заболевание может сохраняться из-за неспособности организма бороться с клетками.
Распространение через кровеносные или лимфатические сосуды: Объясняет появление эндометриоза в органах за пределами таза, включая легкие и глаза.
Как диагностируется эндометриоз?
Эндометриоз может быть по-настоящему диагностирован только с помощью диагностической лапароскопии (хирургии замочной скважины), которая включает в себя небольшой телескоп, который вводят через небольшой разрез в пупке, подключенный к видеокамере и телевизору, чтобы можно было увидеть внутреннюю часть таза. . Эта процедура требует общей анестезии.
Как лечится эндометриоз?
Эндометриоз лечится медикаментозными или хирургическими методами.
Медицинские методы лечения включают:
A) Обезболивающие (парацетамол, ибупрофен) и/или препараты, которые изменяют то, как наш организм справляется с болью (амитриптилин, габапентин, прегабалин)
B) Гормональные препараты, которые вводят организм в ложное состояние беременности (комбинированные оральные противозачаточные таблетки, мини-таблетки прогестерона, инъекция Депо-Провера™, имплантат Nexplanon™ и спираль Мирена™) или вводят тело в ложное состояние менопаузы (Золадекс ™, Декапептил™)
Хирургическое лечение включает удаление или разрушение отложений.Обычно это делается лапароскопически (под общей анестезией).
Эндометриоз – Гинекология и акушерство
Большинство женщин с умеренным и тяжелым эндометриозом наиболее эффективно лечатся путем удаления или удаления как можно большего количества имплантатов с одновременным восстановлением анатомии таза и сохранением фертильности в максимально возможной степени. Поверхностные эндометриоидные имплантаты можно удалить. Глубокие, обширные имплантаты следует удалить.
Конкретные показания для лапароскопической хирургии включают
Умеренный до сильной тазовой боли, которая не отвечает на наркотики
значимых тазовых адгезионов
Fallopian Tube Обструкция
для поддержания фертильности
7
наличие эндометриомас
Очаги обычно удаляются с помощью лапароскопа; поражения брюшины или яичников иногда можно подвергать электрокоагуляции, иссечению или, что редко, выпариванию с помощью лазера.Эндометриомы следует удалять, потому что удаление предотвращает рецидив более эффективно, чем дренирование. После такого лечения показатели фертильности обратно пропорциональны тяжести эндометриоза. Если резекция неполная, агонисты ГнРГ иногда назначают в периоперационный период, но неясно, повышают ли эти препараты показатели фертильности. Лапароскопическая резекция крестцово-маточных связок с помощью электрокоагуляции или лазера может уменьшить тазовую боль по средней линии.
Ректовагинальный эндометриоз, наиболее тяжелая форма заболевания, поддается лечению обычными методами лечения эндометриоза; однако может потребоваться колоноскопическая резекция или хирургическое вмешательство для предотвращения непроходимости толстой кишки.
Гистерэктомия с сохранением яичников или без него обычно должна быть зарезервирована для пациенток с умеренными или сильными тазовыми болями, которые завершили деторождение и предпочитают радикальное вмешательство. Гистерэктомия проводится для удаления спаек или имплантатов, которые прилипают к матке или тупиковому мешку. Женщинам часто рекомендуется ацетат медроксипрогестерона 2,5 мг перорально один раз в день, потому что, если эстроген вводится отдельно, остаточная ткань может расти, что приводит к рецидиву. Если симптомы сохраняются после сальпингоофорэктомии у женщин старше 50 лет, следует проводить непрерывную монотерапию прогестинами (норэтиндрона ацетат 2.5–5 мг, медроксипрогестерона ацетат 5 мг перорально один раз в день, микронизированный прогестерон 100–200 мг перорально перед сном).
Диагностика хронического эндометрита в эндометриальной жидкости с использованием молекулярных методов для улучшения результатов вспомогательных репродуктивных технологий — полный текст
На 5-й день заместительной гормональной терапии (после 5-дневного введения прогестерона), совпадающий с указанным днем гистероскопии врачом в соответствии с обычной клинической практикой будут получены образцы эндометриальной жидкости (ЭФ) и биопсия эндометрия (ЭБ) пациенток с РИФ.Эти образцы будут использоваться для диагностики ХЭ как классическими, так и молекулярными методами. В частности, образец EF будет проанализирован с помощью молекулярных методов с использованием секвенирования нового поколения (NGS) для обнаружения инфекционных агентов. Образец ЭТ будет разделен на три части, одна из которых будет использоваться для молекулярного анализа (как контроль содержания бактерий, присутствующих в ЭФ), другая часть будет подвергнута микробиологическому анализу, а третья часть будет проанализирована с использованием гистологических методов.Таким образом, будут проведены сравнения между различными методами диагностики CE в двух типах образцов (EF и EB) и значениями эффективности нового диагностического теста (чувствительность, специфичность, положительные и отрицательные прогностические значения и получение кривых рабочих характеристик). будут получены с использованием микробиологического диагноза в качестве эталона (метод золотого стандарта).
Пациенты с отрицательным результатом КЭ (примерно 40%) продолжат ожидаемое вспомогательное репродукционное лечение (ВРТ) в соответствии со стандартным протоколом клиники, а пациенты с положительным результатом КЭ (приблизительно60%) будут получать лечение антибиотиками в соответствии с обычной клинической практикой (время и тип антибиотика будут различаться в зависимости от микробиологического диагноза). Как только это лечение будет завершено, улучшение этих пациентов будет подтверждено получением второго образца EF и EB. Вспомогательное репродуктивное лечение (ВРТ) будет проведено, как только специалист сочтет его целесообразным.
Наконец, репродуктивные показатели будут коррелировать с диагнозом CE. Поэтому будет проведено обсервационное аналитическое исследование, в котором будет проведено сравнение результатов ВРТ до и после постановки диагноза ХЭ.Репродуктивное влияние измененной микробиоты эндометрия будет оцениваться с помощью анализа частоты имплантации, беременности и текущей беременности.
Рецептор нейропептида S 1 является мишенью негормонального лечения эндометриоза
ОБСУЖДЕНИЕ
Эндометриоз представляет собой неудовлетворенную клиническую потребность ( 1 ), с ежегодными прямыми затратами на здравоохранение, аналогичными расходам при диабете 2 типа. Лечение эндометриоза ограничивается хирургическим удалением эндометриоидной ткани или приемом гормональных препаратов, в основном направленных на подавление эстрогенов.Срочно требуются альтернативные методы лечения с меньшим количеством побочных эффектов. Несмотря на генетические исследования, предполагающие, что патогенез АСРМ стадии I/II генетически отличается от стадии III/IV ( 27 ), не было разработано никаких методов лечения, направленных на конкретные подтипы заболевания. Наше исследование объединило данные генетического анализа эндометриоза у людей. и макаки-резусы, чтобы идентифицировать негормональную мишень для терапевтического вмешательства: рецептор NPSR1, связанный с G-белком.Естественные генетические модели заболеваний человека у приматов были описаны для нарушений одного гена человека ( 28 , 29 ), но, насколько нам известно, это первый пример параллельных исследований, в которых использовались данные как человека, так и нечеловекообразных приматов. вместе, чтобы идентифицировать генетически проверенную терапевтическую мишень. Следуя нашему ранее сообщенному сигналу сцепления для эндометриоза на хромосоме 7p13-15 ( 10 ), мы использовали подходы точного картирования, гаплотипирования и секвенирования следующего поколения в семьях, вносящих свой вклад в сигнал сцепления и дополнительный анализ сцепления и секвенирования у макак-резусов с самопроизвольное заболевание.Эти анализы выявили связь низкочастотных вариантов кодирования миссенс в NPSR1 с семейным, преимущественно ASRM стадии III/IV, эндометриозом. Целевой анализ крупномасштабных данных GWAS для хирургически подтвержденных случаев ( 11 ) также выявил связь распространенных некодирующих вариантов NPSR1 с эндометриозом стадии III/IV в общей популяции. Генетические варианты NPSR1 были связаны с целый ряд воспалительных и нейропсихиатрических фенотипов, включая астму ( 30 , 31 ), аллергию ( 32 , 33 ), воспалительное заболевание кишечника (ВЗК) ( 16 , 070007 34), артрит 35
), панические расстройства ( 36 ), психологический стресс ( 37 ), реакции страха ( 38 ) и периодические боли в животе ( 39 ).Обычный вариант вставки/делеции, связанный с эндометриозом в NPSR1 , rs142885915, является интронным, имеет частоту 11,3% в популяциях европейского происхождения и не зависит от распространенных вариантов, ранее связанных с ВЗК, астмой и психоневрологическими фенотипами (неравновесие по сцеплению между варианты r 2 NPSR1 , связанные с болью в животе, rs2530566G ( 39 ) и ВЗК, rs2530547 ( 40 ), показывают точно такой же паттерн экспрессии GTex (по состоянию на январь 2021 г.) NPSR1.Обе области мозга, но в особенности лобная кора, активируются при восприятии боли ( 41 ). Тканеспецифические эффекты этой делеции после продолжительного воспалительного инсульта, как при эндометриозе, требуют дальнейшей функциональной работы. Одна из низкочастотных миссенс-мутаций, ассоциированных с семейным эндометриозом, rs34705969 (p.Cys197Phe), была описана как приводящая к снижению способности индуцировать изменения экспрессии нижестоящих генов или цАМФ-опосредованную передачу сигналов (40).Эффекты двух других миссенс-вариантов rs116825950 (p.Gly358Asp) и ранее неизвестного варианта C7_34698148 (p.Gly42Cys) на структуру или функцию NPSR1 неизвестны. Генетическая проверка потенциальной роли NPSR1 в эндометриозе важна, поскольку она значительно увеличивает вероятность того, что модулятор-мишень лекарственного средства будет одобрен для клинического применения ( 42 ). NPS кодируется на хромосоме 10p26.2, сообщается во второй области сцепления. при эндометриозе ( 14 ). Будущие исследования могут выиграть от изучения роли редких вариантов NPS в клеточно-специфической функции NPS при эндометриозе.После наших генетических анализов мы продемонстрировали функциональные эффекты NPSR1 на провоспалительные процессы как в экспериментах in vitro, так и in vivo. Мы идентифицировали популяцию инфильтрирующих моноцитов с высокой положительной реакцией на NPSR1 у женщин с эндометриозом и показали, что ингибирование NPSR1 с помощью селективного ингибитора SHA 68R приводит к снижению миграции NPS-индуцированных моноцитов in vitro. Кроме того, мы продемонстрировали противовоспалительный эффект и уменьшение поведения, вызванного болью в животе, после введения SHA 68R у мышей, как в мышиной модели ZIP ( 25 ), так и в модели эндометриоза с инокуляцией ( 43 ), с сопутствующим снижением количество инфильтрирующих моноцитов и снижение концентрации цитокинов в крови.Модель ZIP включает все стадии воспаления, включая фазу разрешения, что позволяет изучать различные типы иммунных клеток, задействованных на разных стадиях, тогда как модель эндометриоза включает наличие спаек эндометрия в брюшной полости, что имитирует наличие поражений. хронический воспалительный фенотип, связанный с эндометриозом, вероятно, поддерживается иммунными клетками при ПФ ( 1 ). Считается, что воспаление и боль вызываются отложением клеточного материала эндометрия в брюшине ( 5 ), хотя механизмы боли могут иметь воспалительную и невропатическую природу ( 1 ).Стержнем патологии является аберрантная реакция заживления ран на клеточный дебрис ( 44 ). Повышенные уровни NPS у пациенток с эндометриозом во время секреторной и менструальной фаз могут усилить этот аберрантный ответ за счет увеличения рекрутирования моноцитов. Экспрессия NPSR1 на воспалительных клетках, обычно индуцируемая воспалительными цитокинами, такими как TNF-α и интерферон-γ ( 16 ) , активируется во время воспаления при астме ( 30 ) и ВЗК ( 34 ). Макрофаги, выделенные от мышей в моделях астмы, экспрессировали NPSR1 после заражения антигеном ( 45 ), и стимуляция этих макрофагов с помощью NPS приводила к провоспалительной поляризации M1 и усилению миграции.Система NPS/NPSR1, в свою очередь, повышала уровень IL-8, одного из наиболее известных аттрактантов моноцитов и провоспалительных цитокинов ( 46 ) и ключевого элемента воспалительной патофизиологии эндометриоза ( 1 ). Таким образом, NPS-индуцированная передача сигналов через NPSR1 может вызывать хроническое воспаление с постоянной петлей обратной связи посредством IL-8-зависимого рекрутирования воспалительных моноцитов, TNF-α-индуцированной повышающей регуляции NPSR1 и дальнейшей продукции TNF-α новыми клетками. Прибытие. Это повышает перспективу нацеливания на NPSR1 для прерывания развивающегося хронического воспаления при эндометриозе и облегчения боли как его основного симптома.Мы показали на животных моделях, что ингибирование NPSR1 дает надежду на достижение этой цели.Мы признаем, что наше исследование имеет некоторые ограничения. При эндометриозе мы обращаемся к сложному состоянию неизвестной этиологии. Некоторые из наших исследований не позволили провести более подробный анализ, который был бы желателен. Наши исследования in vitro включали относительно небольшое количество пациентов и не включали исследования функциональных эффектов вариантов NPSR1 , которые мы идентифицировали как связанные с эндометриозом.Во-вторых, мы сосредоточились на воспалительных эффектах, связанных с NPSR1/NPS, и не исследовали его эффекты, связанные с тревогой, которые могут иметь дополнительное отношение к болевым симптомам, связанным с эндометриозом. И наконец, хотя мышиные модели имитируют элементы процесса заболевания эндометриозом, они не могут отображать весь спектр заболевания, в частности, патологические нюансы, связанные со стадиями заболевания, наблюдаемые у женщин. Желательны дальнейшие исследования влияния ингибирования NPSR1/NPS на связанное с эндометриозом воспаление и болевые симптомы у макак-резусов.
Таким образом, эндометриоз является распространенным заболеванием, для которого срочно необходимы лучшие варианты лечения. Наши результаты свидетельствуют о том, что система NPSR1/NPS является генетически подтвержденной негормональной мишенью для лечения эндометриоза, которая, вероятно, имеет повышенное значение для терапии эндометриоза стадии III/IV.
МАТЕРИАЛЫ И МЕТОДЫ
Подробные методы доступны в дополнительных материалах и методах.
Дизайн исследования
Цель этого исследования состояла в том, чтобы (i) идентифицировать генетическую мишень(и) из семей с множественными случаями эндометриоза и (ii) изучить роль гена-кандидата, полученного в результате этих анализов, NPSR1, в качестве негормонального лечения мишень для болезни.Анализы точного картирования сцепления, гаплотипов и секвенирования были проведены с использованием 52 семей с тремя или более женщинами с эндометриозом из Соединенного Королевства и Австралии и большой родословной из 849 макак-резус со спонтанным заболеванием. Отбор семейств или животных в пределах родословной не применялся, использовались все доступные данные о генотипах. Для последующих экспериментов по описанию и проверке NPSR1/NPS in vitro мы использовали образцы ткани и PF, собранные в соответствии со стандартизированными протоколами проекта Endometriosis Phenome and Biobanking Harmonization Project (EPHect) Всемирного фонда исследований эндометриоза (WERF) ( 47 ).Мы проверили ингибирование передачи сигналов NPSR1 в моноцитах больных и здоровых людей в идентичных экспериментальных условиях, а также in vivo ингибирование показателей воспаления и боли на мышиной модели перитонита ( 25 ) и мышиной модели эндометриоза ( 26 ). . Размеры выборки не были заранее определены с помощью статистических методов. Исследователи не были слепы к экспериментальным условиям во время экспериментов и анализов.Точное картирование области сцепления 7p13-15 у людей
Ранее мы идентифицировали сцепление с хромосомой 7 (D7S493-D7S502) с использованием 23 полиморфных маркеров на основе 52 семей с тремя или более затронутыми женщинами из исследования OXEGENE (этическое одобрение: MREC /99/5/11) ( 10 ).Мы генотипировали дополнительно 31 маркер (таблица S2) в области сцепления в 32 семьях, положительно влияющих на сигнал сцепления (LOD > 0,1). Анализы сцепления и построение гаплотипов максимального правдоподобия проводились с использованием Merlin ( 48 ).Анализ сцепления у макак-резусов
Четырнадцать микросателлитных маркеров (таблица S3) в двух областях, ортологичных человеческим областям, которые ранее демонстрировали сцепление в человеческих семьях [7p13-15 и 10q26 ( 10 )] были генотипированы (семь маркеров на область) в 418 макак-резус из родословной Национального исследовательского центра приматов штата Висконсин, включая 135 самок со спонтанным эндометриозом ( 13 ).Анализ непараметрической связи на основе моделирования был выполнен с использованием SimWalk2 ( 49 ).Секвенирование у людей и макак-резусов
Геномный фрагмент размером 5 млн. п.н. с центром в D7S2251 (рис. 1А) был секвенирован у восьми неродственных больных женщин из восьми семей, вносящих наибольший вклад в сигнал сцепления 7p13-15. Для захвата интересующей области использовался специальный массив NimbleGen с последующим секвенированием нового поколения Roche 454 GS-FLX. Пять из 28 генов были выбраны в качестве приоритетных для дальнейшего анализа, поскольку они содержали ≥1 несинонимичный низкочастотный кодирующий вариант у ≥50% секвенированных женщин.Пять генов были секвенированы (парные концы) на Illumina HiSeq после пользовательского захвата NimbleGen в 100 оставшихся случаях и 5 контролях из 32 семейств и 100 неродственных контролях (см. Дополнительные материалы и методы) ( 10 ). Секвенирование по Сэнгеру использовалось для анализа области макаки-резуса, ортологичной человеческому NPSR1 , у 62 пораженных животных и 49 здоровых контролей с ДНК достаточного качества (таблица S4; см. также Дополнительные материалы и методы).Образцы ткани и PF
Эутопический и эктопический эндометрий, а также PF были собраны у женщин, включенных в исследование ENDOX ( 50 ) (ссылка REC 09/H0604/58, South Central—Oxford B Research Ethic Committee) в соответствии с WERF EPHect стандартизированные протоколы ( 47 ).Иммуногистохимия
Образцы собирали в ледяном фосфатно-солевом буфере (PBS), фиксировали в параформальдегиде (4%, 1 час) и этаноле (100%, в течение ночи) и заключали в парафиновые блоки. Серийные срезы (5 мкм) использовали для окрашивания гематоксилином и эозином (H&E) и антиген-специфического окрашивания. Использовали антитела против NPSR1 (1:1500), анти-NPS (1:1000) (Abcam) и вторичное антитело против кролика, а для визуализации с контрастным окрашиванием гематоксилином использовали 3,3′-диаминобензидин (DAB).
Количественная полимеразная цепная реакция с обратной транскрипцией
РНК экстрагировали из быстрозамороженных образцов ткани, и 1 мкг РНК на образец подвергали обратной транскрипции. Комплементарную ДНК (кДНК) (100 нг) использовали в анализе ПЦР в реальном времени SYBR Green. Праймеры и условия были опубликованы ранее ( 40 ), с кривой плавления для определения специфической амплификации. Относительную экспрессию NPSR1 по сравнению с GAPDH рассчитывали с использованием метода ΔΔ C t ( 51 ).Проточная цитометрия
Чистые образцы ПФ промывали и окрашивали (дополнительные материалы и методы) и инкубировали с анти-NPSR1–AF488 (поликлональный кролик) или изотипическим контролем (оба Bioss Inc.) и анти-CD45 BV605 (BD Biosciences) при в разведении 1:320 на 1 час на льду в темноте. Клетки дважды промывали смесью PBS/бычий сывороточный альбумин (1%), ресуспендировали в 100 мкл и измеряли в проточном цитометре Fortessa (Beckton Dickinson).
Цитометрия по времени пролета
Очищенные антитела (таблица S5) были помечены металлическими метками с использованием наборов для мечения антител Maxpar (DVS Sciences) в соответствии с инструкциями производителя.Меченые антитела титровали до определения рабочей концентрации. Подробная информация о образцах пациентов, использованных для анализа CyTOF, представлена в таблице S6.
Иммуноферментный анализ
NPS в супернатантах PF определяли с помощью твердофазного иммуноферментного анализа (ELISA) (CEA796Hu, Cloud Clone Corp.) в соответствии с инструкциями производителя.
SHA 68R
Соединение-ингибитор синтезировали, как описано ранее ( 52 ).Моноциты
Первичные моноциты человека выделяли из образцов крови здоровых доноров с помощью центрифугирования Ficoll-Paque PLUS/Percoll (GE Healthcare Life Sciences) в соответствии с инструкциями производителя (подробное описание метода см. в дополнительных материалах и методах).
Эксперименты на мышах
Все эксперименты проводились в Bayer AG в соответствии с местными политиками и директивами (Landesamt für Gesundheit und Soziales Berlin, Германия) и в Оксфорде в соответствии с Законом о животных (научные процедуры) 1986 г. с поправками к Положениям 2012 г. (ASPA 2012 г.) ), СОЕДИНЕННОЕ КОРОЛЕВСТВО.
Модель ZIP
Модель ZIP была выполнена, как описано ранее ( 25 ). Самкам мышей C57BL/6 (в возрасте от 8 до 12 недель) подкожно вводили SHA 68R (40 мг/кг в циклодекстрине, 10%, 50 мкл) или носитель.Через час вводили зимозан (0,1 мг в 200 мкл PBS, внутрибрюшинно). Через четыре часа после введения зимозана образцы крови из хвостовой вены собирали под терминальной анестезией, мышей умерщвляли, кожу брюшной полости вскрывали и брюшину промывали 3 мл охлажденного льдом PBS с 5 мМ ЭДТА для получения клеток перитонеального экссудата ( УИК). PEC подсчитывали и окрашивали с использованием анти-CD45 аллофикоцианина (APC)–Cy7 (530-F11, BioLegend), анти-F4/80 BV421 (BM8, BioLegend) и анти-7/4 фикоэритрина (PE) (AbD Serotec).Популяции миелоидных клеток гейтировали по экспрессии CD45 и наносили на график как F4/80 по сравнению с 7/4 в FlowJo (V10, Tree Star Inc.).Модель эндометриоза
Самкам мышей BALB/c (в возрасте от 8 до 12 недель) внутрибрюшинно вводили кусочки эндометрия от сингенных мышей-доноров (от 8 до 10 кусочков на мышь). Эти кусочки были извлечены в виде поражений брюшины через 2 дня. SHA 68R (40 мг/кг, подкожно) вводили два раза в день в день прививки и на протяжении всего эксперимента. PECs и кровь собирали, как описано выше.Тест DWB был выполнен, как описано ранее ( 26 ).Статистический анализ
Если не указано иное, для сравнения средних значений внутри групп использовался непараметрический критерий Краскела-Уоллиса с критерием Данна для множественных сравнений; P < 0,05 считалось значимым. Из-за дополнительных или отсутствующих точек данных данные о цитокинах анализировали с использованием модели смешанных эффектов с поправкой Холма-Сидака для множественных сравнений. Расчеты проводились в программе Prism V8.1.1 (GraphPad Software Inc.) и SPSS V23 (IBM Corp.).
Благодарности
Мы хотим поблагодарить всех женщин, принимавших участие в наших исследованиях и предоставивших образцы для нашего исследования. Мы хотели бы поблагодарить C. Hubbard, K. Barrett, M. Dale и C. Dew из Оксфордского центра лечения эндометриоза, Оксфордский университет, Великобритания. Мы также благодарим Р. Гиббса, Д. Музны и сотрудников Бейлорского центра секвенирования генома человека Медицинского колледжа Бейлора, США, а также клинических ветеринаров и сотрудников патологии Висконсинского национального центра исследований приматов. Финансирование: Генетический анализ был поддержан несколькими грантами Wellcome Trust для K.T.Z. (084766/Z/08/Z, 085235/Z/08/Z и 085235/Z/08/A). Микросателлит макаки-резус и работа по секвенированию ДНК финансировались за счет грантов NIH R29-RR08781 и R24-OD011173 для J.R., а также за счет внутренних средств Медицинского колледжа Бейлора. Работа in vitro и in vivo поддерживалась Альянсом Оксфордского университета и Bayer AG Pharmaceuticals по новым мишеням для гинекологической терапии. Вклад авторов: Концептуализация: Т.Т.Т., Н.Р., Дж.Л., К.М.Б., У.О., Т.М.З., Ш.Х.К., Дж.В.К., Дж.Р. и К.Т.З.; курирование данных: Т.Т.Т., Н.Р., Дж.Л., Б.Д.Л., М.О., К.Б., Д.Б., М.Г., Р.А.Х., Э.Л., Г.Л., Дж.М., С. Манек, Н.Г.М., Г.В.М., Х.А.С., С.Т., Г.В., Ш.Х.К. и К.Т.З.; формальный анализ: Т.Т.Т., Н.Р., Дж.Л., Д.Б., Р.А.Х. и К.Т.З.; приобретение финансирования: HH-S, CMB, UO, TMZ, SHK, JWK, JR и KTZ; расследование: Т.Т.Т., Н.Р., Дж.Л., Б.Д.Л., М.О., М.Р., К.Б., М.Г., Р.А.Х., А.Л.-Б., Дж.М., Н.Г.М., Ф.О.М., С. Меш, Г.В.М., Х.А.С., С.Т. и Г.В.; методология: Т.Т.Т., Н.Р., Дж.Л., Б.Д.Л., Р.А.Х., Э.Л., Г.Л., Ф.О.М., А.П.М., Дж.Н. и Дж.Р.; администрирование проекта: Т.Т.Т., О.М.Ф., Х.Х.-С., К.С., К.М.Б., У.О., Т.М.З. и К.Т.З.; ресурсы: M.R., GWM, H.A.S., C.M.B., U.O., T.M.Z., S.H.K., J.W.K., J.R. и K.T.Z.; программное обеспечение: Т.Т.


 При миометрите структура мышечного слоя матки будет неоднородной
При миометрите структура мышечного слоя матки будет неоднородной От состояния эндометрия зависит успех имплантации эмбриона и ход беременности. Патологии эндометрия являются частой причиной бесплодия, невынашивания, послеродовых осложнений, безуспешных попыток ЭКО.
От состояния эндометрия зависит успех имплантации эмбриона и ход беременности. Патологии эндометрия являются частой причиной бесплодия, невынашивания, послеродовых осложнений, безуспешных попыток ЭКО.