Ранние симптомы и признаки болезни Паркинсона / Топ-клиника Фридрихсхафен, Германия
Болезнь Паркинсона – заболевание, характеризующееся разрушительными процессами в подкорковом слое нейронов головного мозга. Чаще всего болезнь развивается у людей старше 60 лет. Стимулом становится уменьшение уровня дофамина – вещества, ответственного за передачу импульсов. На ранней стадии диагностировать заболевание трудно: симптомы напоминают признаки других болезней, на них не обращают внимания, списывая их на возраст. Внимание к ранним симптомам болезни позволит ее предупредить.
Что происходит на ранней стадии?
Иногда ранние симптомы болезни Паркинсона вовсе незаметны. Больной может почувствовать трудности в выполнении бытовых задач, его состояние ухудшается. Выделяют группу симптомов, которые с течением времени начинают прогрессировать:
- Гипокинезия. Это сложности в осуществлении произвольных движений. Под ними подразумевается целая группа действий. Пациент двигается медленно, амплитуда движений ограничена.

- Ригидность мышц. Означает повышение мышечного тонуса. На ранней стадии этот симптом болезни Паркинсона проявляется неравномерно по телу. Ригидность мышц проявляется в изменении позы: голова наклонена, руки согнуты в локтях и прижаты к туловищу, спина полусогнута, суставы нижних конечностей тоже слегка согнуты.
 Врач пытается разогнуть конечности пациента: движения происходят словно рывками.
Врач пытается разогнуть конечности пациента: движения происходят словно рывками. - Неустойчивость. Центр тяжести тела не поддается удержанию со стороны больного. Ходьба превращается в мелкие шаги. При толчке пациент семенит, что позволяет удержаться на ногах. Гипокинезия заключается в том, что симптомом болезни Паркинсона становится затруднение в начале движения и невозможность завершить его. Мышечный тонус не успевает распределяться равномерно по телу, поэтому пораженные заболеванием Паркинсона склонны к падениям.
- Тремор в состоянии покоя. Ранний симптом болезни Паркинсона, когда дрожание конечностей сначала незаметно, но постепенно этот симптом нарастает. Частота колебаний – до 8 движений в секунду. Колебания учащаются, если человек волнуется, движется, выполняет умственные задачи. При треморе кажется, как будто пальцы перекатывают монету: большой палец передвигается вдоль всех остальных. Но тремор может проявляться не только в конечностях, но и в подбородке, языке, губах.

Это основные симптомы болезни Паркинсона, которые можно заметить на ранней стадии. Наряду с ними могут развиваться и дополнительные симптомы.
Дополнительные признаки
К сопутствующей симптоматике относятся:
- Вегетативные изменения. Проявляются ранние симптомы болезни Паркинсона в чрезмерном отделении слюны, кожа становится жирной, сальной, на волосах появляется перхоть, нарушается мочеиспускание, половая активность.
- Нарушения психики. Ранний симптом болезни Паркинсона, когда личность постепенно деградирует. Это выражается в постоянной ворчливости, придирчивости к другим людям, айкарии (больной словно «прилипает» к другим людям), брадифрении (мышление становится вязким), кругозор и восприятие жизни в целом сужается, развивается депрессивное состояние. Симптомом болезни Паркинсона становится ухудшение памяти. Некоторые медикаменты, прописываемые при этом заболевании.
 Могут спровоцировать галлюцинации, психозы.
Могут спровоцировать галлюцинации, психозы. - Нарушается сон. Пациент часто просыпается, не может уснуть. Ухудшается ситуация еще из-за того, что он не может произвольно изменить положение тела.
- В ногах ощущается боль, онемение, «муращки». В ногах чувствуется скованность во время ходьбы.
Если наблюдать за человеком и вовремя заметить раннее проявление этих симптомов, то можно вовремя приостановить развитие болезни. Случается это редко, и пациенты обращаются в клинику уже на поздней стадии, когда медикаментозное лечение становится малоэффективным.
В клинике реабилитации в Германии представлены методики лечения больных Паркинсоном. Здесь пациенты обретут комфорт и внимание.
Причины, симптомы и стадии болезни Паркинсона
Болезнь Паркинсона — одно из самых грозных и загадочных заболеваний нервной системы. У современной медицины до сих пор нет ответа на вопрос, почему развивается болезнь Паркинсона и можно ли разработать эффективную систему профилактики.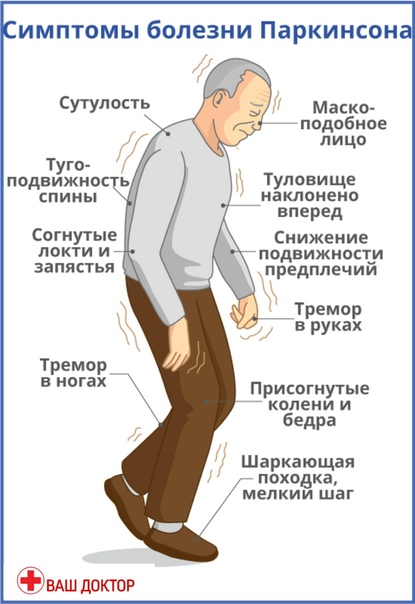 Все, что касается причин паркинсонизма, для ученых пока является загадкой, однако течение болезни изучено хорошо и в настоящее время ведется активная работа по поиску лекарств, а также средств, способных продлить больным жизнь и улучшить ее качество.
Все, что касается причин паркинсонизма, для ученых пока является загадкой, однако течение болезни изучено хорошо и в настоящее время ведется активная работа по поиску лекарств, а также средств, способных продлить больным жизнь и улучшить ее качество.
Болезнь Паркинсона: что означает диагноз
Речь идет о заболевании нервной системы, при котором постепенно разрушаются нейроны, вырабатывающие один из важнейших нейромедиаторов — дофамин. Чаще всего болезнь Паркинсона поражает людей в возрасте — в 55–65 лет. Однако известны случаи, когда болезнь диагностировалась у молодых людей в возрасте 30–40 лет. Существует и так называемая ювенильная форма, при которой заболевание поражает подростков в возрасте до 20 лет.
Стоит сказать, что мужчины страдают от болезни Паркинсона чаще, чем женщины, хотя объективных причин этого факта наука еще не выявила.
Интересный факт
По статистике сегодня во всем мире болезнью Паркинсона страдает около 4 миллионов человек.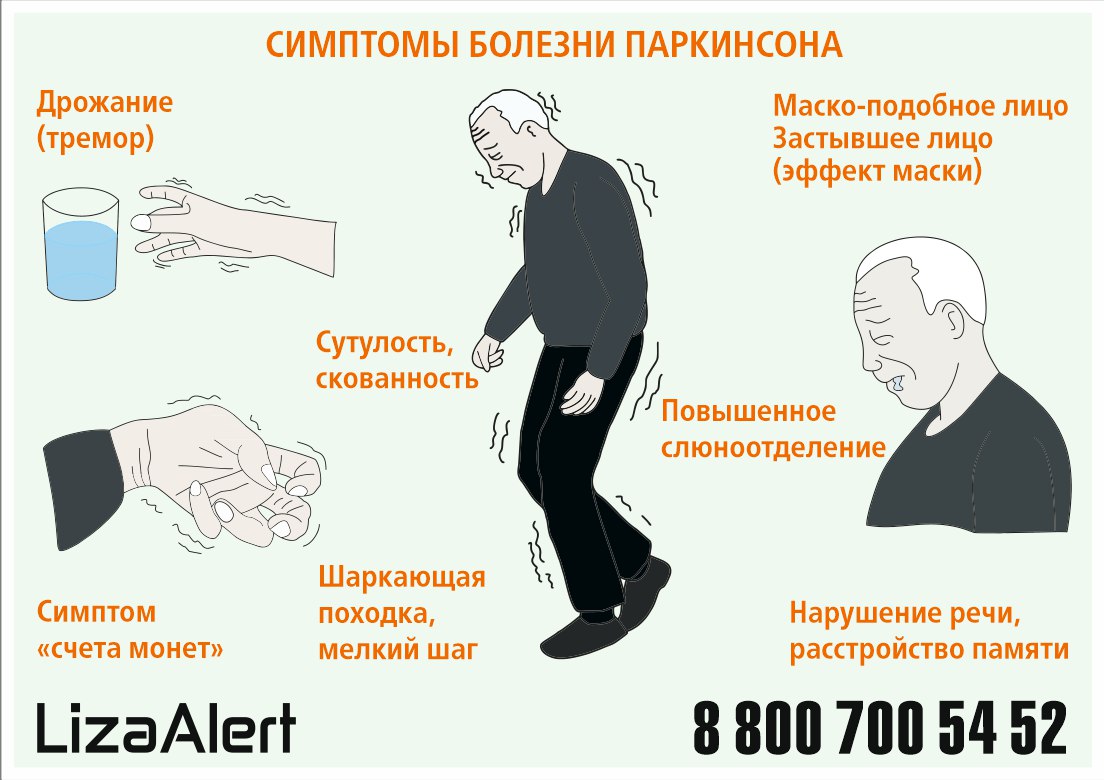
Причины развития заболевания
Как уже было сказано, причины болезни Паркинсона неясны. Все, что есть у науки, — это догадки и теории. К причинам развития этого заболевания относят в первую очередь генетику. Если у вас в семье были случаи паркинсонизма, особенно среди близких родственников, то ваши шансы заболеть несколько выше. Примерно у 15% всех больных есть родня, которая также страдала болезнью Паркинсона.
Играет свою роль и экологическая обстановка — известно, что некоторые гербициды, пестициды и соли тяжелых металлов могут усугубить симптомы болезни Паркинсона или спровоцировать ее развитие.
Интересный факт
Болезнь Паркинсона — второе по распространенности нейродегенеративное заболевание. Первое место занимает болезнь Альцгеймера.
В 80% случаев болезнь Паркинсона развивается без каких-либо предпосылок, но в оставшихся 20% паркинсонизм является осложнением других заболеваний, таких как энцефалит, опухоли мозга, инсульт, черепно-мозговые травмы и некоторые другие.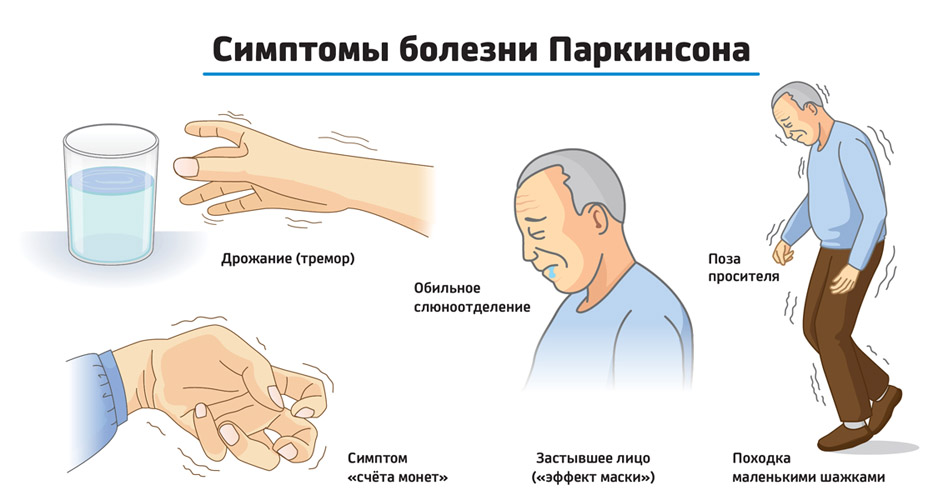 Иногда к паркинсонизму приводит отравление некоторыми токсичными веществами (угарным газом, этанолом), а также прием наркотических веществ и некоторых медикаментов, в частности нейролептиков.
Иногда к паркинсонизму приводит отравление некоторыми токсичными веществами (угарным газом, этанолом), а также прием наркотических веществ и некоторых медикаментов, в частности нейролептиков.
Симптомы и признаки болезни Паркинсона
Одним из первых признаков болезни Паркинсона является тремор одной руки в состоянии покоя. По мере развития заболевания дрожать начинают обе руки и голова. Если человек взволнован или обеспокоен, тремор усиливается, но при сознательных действиях, например при завязывании шнурков или работе с клавиатурой компьютера, он уменьшается. Иногда, на поздних стадиях болезни, к тремору рук и головы добавляется дрожание век или нижней челюсти и языка.
Основные же признаки болезни Паркинсона — скованность и замедленность движений. Больные с таким диагнозом могут надолго замирать в одной позе, даже если она кажется неудобной. Развивается характерная шаркающая походка — человек ходит мелкими шажками, как будто передвигается по скользкому льду.
Еще один симптом болезни Паркинсона — мышечная ригидность, или повышение тонуса мышц. Постоянное напряжение побуждает человека принимать определенную позу — руки сгибаются в локтях, появляется сутулость, голова наклонена вперед, ноги слегка согнуты.
На поздних стадиях болезни развивается так называемая постуральная неустойчивость. Человеку трудно начать двигаться, а потом очень трудно остановиться. Больной постепенно теряет контроль над своим телом, ему становится сложно удерживать равновесие.
Двигательные нарушения — не единственный признак болезни Паркинсона. Параллельно, а порой и до проявления тремора, наблюдаются нарушения в работе вегетативной нервной системы. Кожа становится жирной, наблюдается обильное слюноотделение и потливость, которая никак не зависит от окружающей температуры и физических усилий.
Справочная информация
Болезнь Паркинсона названа по имени британского доктора Джеймса Паркинсона, который описал ее симптомы в своей статье «Эссе о дрожательном параличе» в 1817 году. Сегодня термин «дрожательный паралич» устарел. Тем более что тремор конечностей далеко не единственный симптом болезни Паркинсона.
Болезнь Паркинсона редко затрагивает интеллектуальную сферу — большинство больных на ранних и средних стадиях развития заболевания сохраняют остроту ума. Однако болезнь Паркинсона часто сопровождается замедлением всех мыслительных процессов, ухудшением памяти и проблемой с формулированием мыслей, равнодушием к миру и к себе, пониженным настроением и депрессией.
Обычно для постановки диагноза достаточно визуального осмотра, сбора анамнеза и проверки симптомов. При подозрении на болезнь Паркинсона используют такие методы обследования, как ультразвуковое исследование черной субстанции, КТ или МРТ головного мозга.
Формы заболевания
На сегодняшний день врачи выделяют три формы болезни Паркинсона, которые различаются проявлением той или иной симптоматики:
- акинетико-ригидная. При этой форме наиболее ярко проявляется повышение тонуса мышц, движения больного замедляются, возможна полная обездвиженность;
- дрожательная. Эта форма проявляется дрожью рук, языка, нижней челюсти;
- смешанная. Обычно эта форма проявляется дрожью рук, но позднее к ней присоединяется и скованность движений.
Кстати
Диагноз «болезнь Паркинсона» был поставлен многим известным людям — Папе Римскому Иоанну Павлу II, актерам Майклу Джею Фоксу (он же в 2000 году организовал фонд для изучения этого недуга) и Валентину Гафту, боксерам Мохаммеду Али и Фредди Роучу, музыканту Оззи Осборну, художнику Сальвадору Дали, гонщику Филу Хиллу, политику Эриху Хоннекеру. Паркинсонизмом страдает также основатель Microsoft Билл Гейтс и баскетболист Брайан Грант.
Стадии болезни
Существует 5 стадий болезни Паркинсона. Эта классификация была разработана в 1960 годах и используется до сих пор:
- 0 стадия — отсутствие двигательных нарушений;
- I стадия — двигательные нарушения с одной стороны тела;
- II стадия — двусторонние двигательные нарушения, при которых пациент ходит без ограничений, поддерживает равновесие;
- III стадия — появляется умеренная постуральная неустойчивость, но пациент еще не нуждается в посторонней помощи;
- IV стадия — существенные нарушения в двигательной активности, больной не может совершать сложных движений, но не нуждается в поддержке для того, чтобы стоять и ходить;
- V стадия — больной не может передвигаться без посторонней помощи.
Несмотря на то, что болезнь Паркинсона нельзя полностью вылечить, можно свести к минимуму проявления ее симптомов. Это поможет облегчить жизнь пациента, а возможно, и продлить ее. Как и при любых заболеваниях, поддерживающую терапию лучше начинать на самых ранних стадиях. К ней относится не только регулярный прием лекарств, но и профессиональный уход, предоставить который могут современные гериатрические центры.
К ней относится не только регулярный прием лекарств, но и профессиональный уход, предоставить который могут современные гериатрические центры.
Обнаружены самые ранние признаки болезни Паркинсона
Болезнь Паркинсона является вторым наиболее распространенным нейродегенеративным заболеванием после болезни Альцгеймера. Заболевание пока остается неизлечимым и сегодня чаще всего диагностируется только при появлении первых явных симптомов — когнитивных нарушений и проблем с моторными функциями. Ученым из Великобритании удалось обнаружить зачатки болезни, которые происходят в мозге пациента задолго до внешних признаков, пишет EurekAlert.
Теперь команда предоставила первые доказательства центральной роли серотонина в мозге на самых ранних стадиях. Результаты показали, что изменения в системе серотонина происходят значительно раньше, чем в системе дофамина, которые обычно принято связывать с ранними этапами болезни.
«Болезнь Паркинсона традиционно ассоциируют с повреждениями в системе дофамина, но мы показываем, что сначала происходят нарушения в регуляции серотонина и это ключ к ранней диагностике и лечению», — заявил старший автор исследования Мариос Политис.
Чтобы прийти к этим выводам, команда изучила данные 14 пациентов с наследственными мутациями гена SNCA. Эта редкая мутация почти наверняка спровоцирует развитие болезни Паркинсона, поэтому у исследователей появился уникальный шанс сравнить этих пациентов с людьми с негенетической формой болезни, а также здоровыми участниками. Визуализация мозга проводилась с помощью ПЭТ-сканирования.
Наблюдения показали, что сбой в системе серотонина происходит задолго до первых симптомов болезни, влияющих на двигательную функцию, а также раньше первых нарушений в системе дофамина.
Оценка функций серотонина должна стать эффективным маркером развития и прогрессирования болезни, считают авторы. Кроме того, выводы открывают новые возможности для разработки новых методов лечения болезни, которые позволят замедлить, а, возможно, и предотвратить дальнейшее развитие нейродегенерации.
По прогнозам, распространение болезни Паркинсона будет лишь усиливаться в ближайшие годы. Главными причинами повышенного риска остается пожилой возраст, неправильный образ жизни и загрязненная окружающая среда. Тем временем в Японии стартовал эксперимент, где пациентов с болезнью Паркинсона будут лечить стволовыми клетками.
Главными причинами повышенного риска остается пожилой возраст, неправильный образ жизни и загрязненная окружающая среда. Тем временем в Японии стартовал эксперимент, где пациентов с болезнью Паркинсона будут лечить стволовыми клетками.
Найден способ выявить болезнь Паркинсона до появления первых симптомов
Ученые нашли маркеры развития болезни Паркинсона, с помощью которых можно выявить недуг до появления его первых явных признаков.
Исследование на эту тему опубликовано в журнале Nature Communications.
Болезнь Паркинсона диагностируют лишь при возникновении нарушений двигательных функций. Еще раньше ее можно заметить по другим признакам: у человека начинаются запоры, снижается обоняния, часто меняется настроение и возникают проблемы со сном. Но такие симптомы могут свидетельствовать и о многих других заболеваниях.
А вот T-клетки, специфичные к белку альфа-синуклеину, действительно могут стать хорошим маркером для доклинического выявления болезни Паркинсона.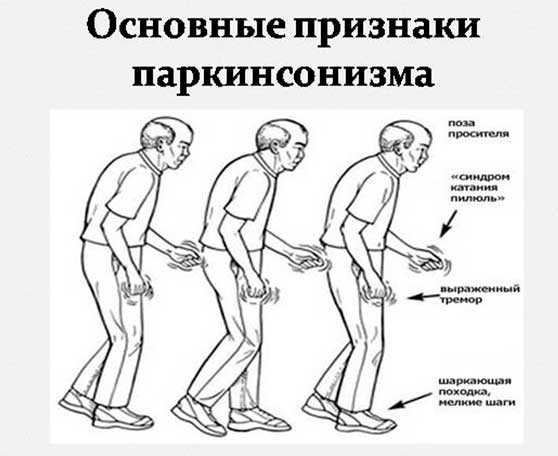 Т-клеточный иммунитет — реакция организма, с помощью которой наша иммунная система распознает чужеродного захватчика, называемого антигеном, и реагирует, разрушая его.
Т-клеточный иммунитет — реакция организма, с помощью которой наша иммунная система распознает чужеродного захватчика, называемого антигеном, и реагирует, разрушая его.
Ученые изучили образцы крови пациента, страдающего заболеванием, которые хранились в течение двух десятилетий в замороженном виде, и анализы группы людей с таким же недугом. Кроме того, в исследовании использовались анализы 67 здоровых людей.
Известно, что паркинсонизм разрушает дофаминергические нейроны области среднего мозга. В первые четыре года их число снижается на 50-90 процентов, а потом не меняется. Чтобы лечение было более эффективным, необходимо выявить болезнь на самых ранних стадиях.
Исследователи узнали, что клетки, специфичные к альфа-синуклеину, который накапливается в нейронах при болезни Паркинсона, чаще всего встречались у первого пациента за годы до диагноза, а у других больных в первые несколько лет лечения. У первого пациента, кровь которого брали из «заморозки», реакция T-клеток на альфа-синуклеин была значительно выше до 2006 года, чем после диагностирования недуга. Самой сильной реакция T-клеток была в первые годы после постановки диагноза.
Самой сильной реакция T-клеток была в первые годы после постановки диагноза.
Ученые сделали вывод, что присутствие специфичных к альфа-синуклеину T-клеток характерно для доклинической и ранней моторной стадии болезни Паркинсона. Мониторинг показателя у людей, находящихся в группе риска, поможет в профилактике заболевания, в том числе вовремя начать иммунотерапию.
Методы диагностики болезни Паркинсона на ранних стадиях
Содержание номера-
Методы диагностики болезни Паркинсона на ранних стадиях
Е.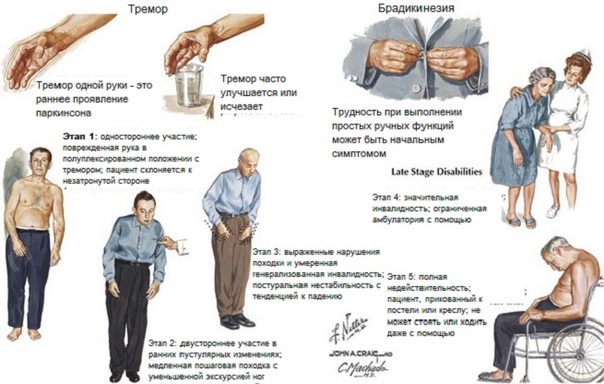 А. Катунина, Н.В. Титова, Г.Н. Авакян, Российский государственный медицинский университет, г. Москва
А. Катунина, Н.В. Титова, Г.Н. Авакян, Российский государственный медицинский университет, г. Москва
 По данным исследования, проведенного в США, 25% больным диагноз БП не был поставлен в течение 2 лет с момента появления первых симптомов, при этом 46% из них обратились к врачу в течение 6 месяцев после развития клинических проявлений [121]. Второй важнейший фактор несвоевременной диагностики – несовершенство диагностических критериев.
На сегодняшний день диагноз БП основывается исключительно на клинической картине заболевания. Для постановки диагноза БП используются критерии Общества болезни Паркинсона Великобритании [73], которые включают диагностику синдрома паркинсонизма, а также критерии, исключающие и подтверждающие БП. Однако их использование дает до 24% неправильных диагнозов БП [74]. Поэтому встает вопрос о поиске дополнительных критериев (биохимических, нейровизуализационных, нейрофизиологических, генетических), способных повысить точность диагностики. Методы функциональной нейровизуализации Поскольку при БП речь идет о гибели нейронов в определенной структуре — черной субстанции, то методы нейровизуализации обоснованно рассматриваются как единственные дополнительные методы, которые могут прижизненно выявить наличие патологического процесса, характерного для БП.
По данным исследования, проведенного в США, 25% больным диагноз БП не был поставлен в течение 2 лет с момента появления первых симптомов, при этом 46% из них обратились к врачу в течение 6 месяцев после развития клинических проявлений [121]. Второй важнейший фактор несвоевременной диагностики – несовершенство диагностических критериев.
На сегодняшний день диагноз БП основывается исключительно на клинической картине заболевания. Для постановки диагноза БП используются критерии Общества болезни Паркинсона Великобритании [73], которые включают диагностику синдрома паркинсонизма, а также критерии, исключающие и подтверждающие БП. Однако их использование дает до 24% неправильных диагнозов БП [74]. Поэтому встает вопрос о поиске дополнительных критериев (биохимических, нейровизуализационных, нейрофизиологических, генетических), способных повысить точность диагностики. Методы функциональной нейровизуализации Поскольку при БП речь идет о гибели нейронов в определенной структуре — черной субстанции, то методы нейровизуализации обоснованно рассматриваются как единственные дополнительные методы, которые могут прижизненно выявить наличие патологического процесса, характерного для БП. К таким методам относят позитронно-эмиссионную томографию (ПЭТ), однофотонную эмиссионную компьютерную томографию (ОФЭКТ), протонную магнитно-резонансную спектроскопию ((1Н)-МРС).
При помощи ПЭТ с 18F-флюородопой можно метить пресинаптические дофаминергические терминали, количество которых при БП прогрессирующе уменьшается [52]. Для БП характерно уменьшение захвата 18F-флюродопы нейронами скорлупы на стороне, противоположной двигательным симптомам. Аналогичные изменения отмечаются и на другой стороне, но в меньшей степени, отражая асимметричность нейродегенеративного процесса [50, 90]. Скорость аккумуляции 18F-флюородопы в стриатуме отражает процесс транспорта флюородопы в стриатные везикулы и ее последующее декарбоксилирование [91]. Критерием БП является снижение захвата этого радиолиганда на 30% и более [52]. При обследовании близнецов, один из которых страдал БП, снижение захвата меченой флюородопы в стриатуме обнаружено у 44% клинически здоровых монозиготных и 11% дизиготных близнецов [82, 97].
К таким методам относят позитронно-эмиссионную томографию (ПЭТ), однофотонную эмиссионную компьютерную томографию (ОФЭКТ), протонную магнитно-резонансную спектроскопию ((1Н)-МРС).
При помощи ПЭТ с 18F-флюородопой можно метить пресинаптические дофаминергические терминали, количество которых при БП прогрессирующе уменьшается [52]. Для БП характерно уменьшение захвата 18F-флюродопы нейронами скорлупы на стороне, противоположной двигательным симптомам. Аналогичные изменения отмечаются и на другой стороне, но в меньшей степени, отражая асимметричность нейродегенеративного процесса [50, 90]. Скорость аккумуляции 18F-флюородопы в стриатуме отражает процесс транспорта флюородопы в стриатные везикулы и ее последующее декарбоксилирование [91]. Критерием БП является снижение захвата этого радиолиганда на 30% и более [52]. При обследовании близнецов, один из которых страдал БП, снижение захвата меченой флюородопы в стриатуме обнаружено у 44% клинически здоровых монозиготных и 11% дизиготных близнецов [82, 97]. При обследовании здоровых родственников больных БП в 7 семьях выявлены случаи бессимптомного заболевания. ПЭТ-индекс прогнозирования показал вероятность клинического дебюта БП на IV-VII декаде жизни у 34% обследованных. Уже через 1 год этот прогноз подтвердился в 36% случаев [50].
Использование ПЭТ позволило рассчитать скорость потери дофаминергических нейронов в год. Это количество, по данным разных авторов, составляет от 2 до 9% ежегодно, а соответственно рассчитанная продолжительность доклинической стадии БП – 6,0 ± 3,0 года [51, 52, 90].
Оценить состояние пресинаптических структур мож-но, используя другие радиофармакологичес-кие препараты – 11С-дигидротетрабеназин. Этот радиолиганд позволяет метить переносчиков везикулярного моноамина [80]. Более доступная методика – ПЭТ с F18-дезоксиглюкозой, однако ее информативность невысока. Ожидаемой редукции локальной скорости утилизации глюкозы в полосатом теле не выявлено. У пациентов на начальных стадиях БП наблюдаются мелкоочаговый незначительный гипометаболизм в различных структурах коры головного мозга мозаичного характера или отсутствие патологических изменений метаболизма [18].
При обследовании здоровых родственников больных БП в 7 семьях выявлены случаи бессимптомного заболевания. ПЭТ-индекс прогнозирования показал вероятность клинического дебюта БП на IV-VII декаде жизни у 34% обследованных. Уже через 1 год этот прогноз подтвердился в 36% случаев [50].
Использование ПЭТ позволило рассчитать скорость потери дофаминергических нейронов в год. Это количество, по данным разных авторов, составляет от 2 до 9% ежегодно, а соответственно рассчитанная продолжительность доклинической стадии БП – 6,0 ± 3,0 года [51, 52, 90].
Оценить состояние пресинаптических структур мож-но, используя другие радиофармакологичес-кие препараты – 11С-дигидротетрабеназин. Этот радиолиганд позволяет метить переносчиков везикулярного моноамина [80]. Более доступная методика – ПЭТ с F18-дезоксиглюкозой, однако ее информативность невысока. Ожидаемой редукции локальной скорости утилизации глюкозы в полосатом теле не выявлено. У пациентов на начальных стадиях БП наблюдаются мелкоочаговый незначительный гипометаболизм в различных структурах коры головного мозга мозаичного характера или отсутствие патологических изменений метаболизма [18]. Выполнение ОФЭКТ с препаратами на основе тропана ([123I]-b-CIT, [123I]-FP-СIT или [11С]-CFT) позволяет определить количество переносчика дофамина в синаптической щели. Эти радиолиганды связываются в окончаниях нигростриарных нейронов с мембранным дофаминовым транспортером, обеспечивающим обратный захват дофамина [47]. Для БП характерно асимметричное снижение захвата в скорлупе [104]. Связывание с мембранным переносчиком дофамина является более чувствительным маркером раннего периода болезни с большим снижением захвата в начале заболевания по сравнению с дигидротетрабеназином и флюородопой [111]. Менее выраженное снижение захвата 18F-флюородопы в ранний период, возможно, отражает компенсаторное повышение активности декарбоксилазы. Когда же эта компенсация становится недостаточной, появляется симптоматика [84].
Оценить состояние дофаминовых рецепторов можно, выполнив ПЭТ или ОФЭКТ с лигандом дофаминовых D2-рецепторов 11С-раклопридом [89]. Установлено, что на начальных стадиях болезни отмечается увеличение плотности D2-рецепторов (плотность постсинаптических D1-рецепторов при этом не меняется) [99].
Выполнение ОФЭКТ с препаратами на основе тропана ([123I]-b-CIT, [123I]-FP-СIT или [11С]-CFT) позволяет определить количество переносчика дофамина в синаптической щели. Эти радиолиганды связываются в окончаниях нигростриарных нейронов с мембранным дофаминовым транспортером, обеспечивающим обратный захват дофамина [47]. Для БП характерно асимметричное снижение захвата в скорлупе [104]. Связывание с мембранным переносчиком дофамина является более чувствительным маркером раннего периода болезни с большим снижением захвата в начале заболевания по сравнению с дигидротетрабеназином и флюородопой [111]. Менее выраженное снижение захвата 18F-флюородопы в ранний период, возможно, отражает компенсаторное повышение активности декарбоксилазы. Когда же эта компенсация становится недостаточной, появляется симптоматика [84].
Оценить состояние дофаминовых рецепторов можно, выполнив ПЭТ или ОФЭКТ с лигандом дофаминовых D2-рецепторов 11С-раклопридом [89]. Установлено, что на начальных стадиях болезни отмечается увеличение плотности D2-рецепторов (плотность постсинаптических D1-рецепторов при этом не меняется) [99]. Считают, что такого рода сдвиги отражают механизмы компенсации в условиях дефицита дофамина. На поздних стадиях в большей степени уменьшается плотность D1-рецепторов, при относительной сохранности D2-рецепторов. Эти изменения происходят в контралатеральном по отношению к стороне проявления симптомов стриатуме [115].
Метод (1Н)-МРС позволяет оценить метаболизм практически в любой зоне головного мозга. По данным И.В. Литвиненко, при БП в первую очередь в проекции компактной части черной субстанции выявляются снижение уровня N-ацетиласпартата (NAA) и повышение концентрации холина (Cho), что приводит к достоверному снижению соотношения NAA/Cho [18]. У больных на ранних стадиях БП (I-II стадии по шкале Хена и Яра) эти метаболические сдвиги были единственными изменениями по данным (1Н)-МРС. В проекции скорлупы и бледного шара изменения на начальных стадиях БП не выявлены.
Несмотря на высокую информативность методов функциональной нейровизуализации, они, к сожалению, не могут быть использованы в практической медицине из-за технологически сложного оборудования, которое может быть доступно лишь крупным медицинским центрам.
Считают, что такого рода сдвиги отражают механизмы компенсации в условиях дефицита дофамина. На поздних стадиях в большей степени уменьшается плотность D1-рецепторов, при относительной сохранности D2-рецепторов. Эти изменения происходят в контралатеральном по отношению к стороне проявления симптомов стриатуме [115].
Метод (1Н)-МРС позволяет оценить метаболизм практически в любой зоне головного мозга. По данным И.В. Литвиненко, при БП в первую очередь в проекции компактной части черной субстанции выявляются снижение уровня N-ацетиласпартата (NAA) и повышение концентрации холина (Cho), что приводит к достоверному снижению соотношения NAA/Cho [18]. У больных на ранних стадиях БП (I-II стадии по шкале Хена и Яра) эти метаболические сдвиги были единственными изменениями по данным (1Н)-МРС. В проекции скорлупы и бледного шара изменения на начальных стадиях БП не выявлены.
Несмотря на высокую информативность методов функциональной нейровизуализации, они, к сожалению, не могут быть использованы в практической медицине из-за технологически сложного оборудования, которое может быть доступно лишь крупным медицинским центрам. Поэтому во всем мире эти исследования используют преимущественно с научной целью. Методы структурной нейровизуализации В этом случае речь идет о рентгеновской компьютерной (КТ) и магнитно-резонансной томографии (МРТ). Следует признать, что эти методы являются малоинформативными в плане подтверждения диагноза БП, но могут быть важны для исключения вторичного паркинсонизма, вызванного черепно-мозговыми травмами, опухолевыми образованиями, сосудистым поражением и др. [24].
Основным структурным изменением у лиц с БП является церебральная атрофия в виде расширения корковых борозд и желудочковой системы мозга. Выраженность атрофии нарастает параллельно увеличению тяжести и продолжительности заболевания [27, 37, 110]. Так, при I-III стадии заболевания церебральная атрофия выявляется в 23,5% случаев, при IV-V стадии – в 100% [2]. Выраженность атрофического процесса при акинетико-ригидной форме БП выше, чем при дрожательной [36].
Попытки использовать морфометрическую оценку ширины зоны, соответствующей компактной части черной субстанции, как диагностический критерий БП не увенчались успехом — происходит «перекрытие» по этому показателю между пациентами с БП и контрольной группой [17].
Поэтому во всем мире эти исследования используют преимущественно с научной целью. Методы структурной нейровизуализации В этом случае речь идет о рентгеновской компьютерной (КТ) и магнитно-резонансной томографии (МРТ). Следует признать, что эти методы являются малоинформативными в плане подтверждения диагноза БП, но могут быть важны для исключения вторичного паркинсонизма, вызванного черепно-мозговыми травмами, опухолевыми образованиями, сосудистым поражением и др. [24].
Основным структурным изменением у лиц с БП является церебральная атрофия в виде расширения корковых борозд и желудочковой системы мозга. Выраженность атрофии нарастает параллельно увеличению тяжести и продолжительности заболевания [27, 37, 110]. Так, при I-III стадии заболевания церебральная атрофия выявляется в 23,5% случаев, при IV-V стадии – в 100% [2]. Выраженность атрофического процесса при акинетико-ригидной форме БП выше, чем при дрожательной [36].
Попытки использовать морфометрическую оценку ширины зоны, соответствующей компактной части черной субстанции, как диагностический критерий БП не увенчались успехом — происходит «перекрытие» по этому показателю между пациентами с БП и контрольной группой [17]. По данным F. Lallement et al., на МРТ при БП может обнаруживаться двустороннее снижение интенсивности сигнала в задней части скорлупы. Однако этот признак неспецифичен и может выявляться при других нейродегенеративных заболеваниях [83]. Биохимические маркеры БП В качестве биохимического маркера может выступать снижение активности митохондриального комплекса I, которое выявляется не только в черной субстанции, но и в тромбоцитах и клетках скелетной мускулатуры [64, 96]. Предпринимаются попытки определять уровень тирозингидроксилазы, дофамина и рецепторов дофамина в лимфоцитах периферической крови, количество которых может снижаться уже при начальных проявлениях БП [55, 56].
В последние годы повышенное внимание уделяется механизмам оксидантного стресса в патогенезе БП. В качестве маркера оксидантного стресса в периферической крови выявляют повышение активности фермента супроксиддисмутазы в эритроцитах, относящегося к естественным антиоксидантам [118]. Согласно другим исследованиям, в сыворотке крови и моче повышается содержание 8-гидрокси-2-дезоксигуанозина, являющегося одним из продуктов окислительного повреждения ДНК [79].
По данным F. Lallement et al., на МРТ при БП может обнаруживаться двустороннее снижение интенсивности сигнала в задней части скорлупы. Однако этот признак неспецифичен и может выявляться при других нейродегенеративных заболеваниях [83]. Биохимические маркеры БП В качестве биохимического маркера может выступать снижение активности митохондриального комплекса I, которое выявляется не только в черной субстанции, но и в тромбоцитах и клетках скелетной мускулатуры [64, 96]. Предпринимаются попытки определять уровень тирозингидроксилазы, дофамина и рецепторов дофамина в лимфоцитах периферической крови, количество которых может снижаться уже при начальных проявлениях БП [55, 56].
В последние годы повышенное внимание уделяется механизмам оксидантного стресса в патогенезе БП. В качестве маркера оксидантного стресса в периферической крови выявляют повышение активности фермента супроксиддисмутазы в эритроцитах, относящегося к естественным антиоксидантам [118]. Согласно другим исследованиям, в сыворотке крови и моче повышается содержание 8-гидрокси-2-дезоксигуанозина, являющегося одним из продуктов окислительного повреждения ДНК [79]. При БП показано повышение уровня глицина, глутамата и аспартата в плазме крови, что объясняют механизмами эксайтотоксичности, вовлеченными в процесс дегенерации нейронов [76]. Также выявлено снижение уровня глутамата (в том числе и на ранних стадиях), аспартата, ГАМК в ликворе [63, 114]. Для БП считается характерным снижение в спинномозговой жидкости изолейцина, аланина, лизина и умеренное повышение глутамина [85]. У пациентов с БП нередко отмечается увеличение концентрации пирувата в плазме крови, связанное с изменением активности пируватдегидрогиназы [106]. Об усилении дофаминового катаболизма свидетельствует достоверное снижение соотношения дофамин/ДОФУК (3,4-диоксифенилуксусной кислоты) в моче и уменьшение экскреции дофамина, 3,4-диоксифенилаланина (ДОФА), норадреналина, что коррелирует со степенью тяжести симптоматики [28]. Недавние экспериментальные исследования подтвердили, что снижение содержания в моче ДОФА, особенно ДОФУК, прямо коррелирует со степенью разрушения дофаминергических нейронов в мозге крыс [33].
При БП показано повышение уровня глицина, глутамата и аспартата в плазме крови, что объясняют механизмами эксайтотоксичности, вовлеченными в процесс дегенерации нейронов [76]. Также выявлено снижение уровня глутамата (в том числе и на ранних стадиях), аспартата, ГАМК в ликворе [63, 114]. Для БП считается характерным снижение в спинномозговой жидкости изолейцина, аланина, лизина и умеренное повышение глутамина [85]. У пациентов с БП нередко отмечается увеличение концентрации пирувата в плазме крови, связанное с изменением активности пируватдегидрогиназы [106]. Об усилении дофаминового катаболизма свидетельствует достоверное снижение соотношения дофамин/ДОФУК (3,4-диоксифенилуксусной кислоты) в моче и уменьшение экскреции дофамина, 3,4-диоксифенилаланина (ДОФА), норадреналина, что коррелирует со степенью тяжести симптоматики [28]. Недавние экспериментальные исследования подтвердили, что снижение содержания в моче ДОФА, особенно ДОФУК, прямо коррелирует со степенью разрушения дофаминергических нейронов в мозге крыс [33]. Таким образом, на сегодняшний день нельзя говорить о каком-то специфическом биохимическом маркере заболевания. Выявлен ряд характерных изменений, специфичных не только для БП, но и ряда других патологий. Работа в этом направлении продолжится, и, возможно, через какое-то время удастся отобрать маркеры, обнаружение которых позволит включить пациента в группу риска по БП. Транскраниальное ультразвуковое сканирование головного мозга Применение транскраниальной сонографии (TКС) при БП основано на получении гиперэхогенного сигнала от черной субстанции за счет увеличенного в ней содержания железа. Гиперэхогенность на начальных стадиях БП выявляется на стороне, контралатеральной двигательным нарушениям, более чем у 90% больных [43, 44, 116]. Приблизительно у 40% родственников первой степени пациентов с БП обнаруживаются изменения при ТКС. Гиперэхогенность черной субстанции может быть также выявлена и у 9% клинически здоровых людей. Дополнительно заметим, что у здоровых лиц с усиленной эхогенностью черной субстанции при ПЭТ было обнаружено значительное снижение накопления 18F-флюородопы в полосатом теле в 60% случаев по сравнению с контролем.
Таким образом, на сегодняшний день нельзя говорить о каком-то специфическом биохимическом маркере заболевания. Выявлен ряд характерных изменений, специфичных не только для БП, но и ряда других патологий. Работа в этом направлении продолжится, и, возможно, через какое-то время удастся отобрать маркеры, обнаружение которых позволит включить пациента в группу риска по БП. Транскраниальное ультразвуковое сканирование головного мозга Применение транскраниальной сонографии (TКС) при БП основано на получении гиперэхогенного сигнала от черной субстанции за счет увеличенного в ней содержания железа. Гиперэхогенность на начальных стадиях БП выявляется на стороне, контралатеральной двигательным нарушениям, более чем у 90% больных [43, 44, 116]. Приблизительно у 40% родственников первой степени пациентов с БП обнаруживаются изменения при ТКС. Гиперэхогенность черной субстанции может быть также выявлена и у 9% клинически здоровых людей. Дополнительно заметим, что у здоровых лиц с усиленной эхогенностью черной субстанции при ПЭТ было обнаружено значительное снижение накопления 18F-флюородопы в полосатом теле в 60% случаев по сравнению с контролем. Несмотря на небольшой опыт применения ТКС в диагностике БП, в литературе уже описано 8 случаев обнаружения гиперэхогенности черной субстанции с последующей манифестацией симптомов БП в течение нескольких лет [42]. Несомненными преимуществами метода являются низкая стоимость, неинвазивность, короткое время проведения исследования, возможность многократного повторения исследования в динамике. Возможно, при накоплении достаточного опыта этот метод может быть использован в качестве скрининг-обследования, однако его результаты нуждаются в подтверждении другими методиками. Исследование обоняния Согласно концепции H. Braak et al., нейродегенеративный процесс при БП первоначально захватывает обонятельную луковицу, переднее ольфакторное ядро, дорсальное ядро вагусного нерва (I стадия), затем он распространяется по мозговому стволу, вовлекая голубое пятно, ядра шва, зоны, ответственные за REM-сон (II стадия), и только потом переходит на черную субстанцию полосатого тела (III стадия) [49].
Несмотря на небольшой опыт применения ТКС в диагностике БП, в литературе уже описано 8 случаев обнаружения гиперэхогенности черной субстанции с последующей манифестацией симптомов БП в течение нескольких лет [42]. Несомненными преимуществами метода являются низкая стоимость, неинвазивность, короткое время проведения исследования, возможность многократного повторения исследования в динамике. Возможно, при накоплении достаточного опыта этот метод может быть использован в качестве скрининг-обследования, однако его результаты нуждаются в подтверждении другими методиками. Исследование обоняния Согласно концепции H. Braak et al., нейродегенеративный процесс при БП первоначально захватывает обонятельную луковицу, переднее ольфакторное ядро, дорсальное ядро вагусного нерва (I стадия), затем он распространяется по мозговому стволу, вовлекая голубое пятно, ядра шва, зоны, ответственные за REM-сон (II стадия), и только потом переходит на черную субстанцию полосатого тела (III стадия) [49]. Поэтому обонятельная дисфункция (гипосмия, аносмия) является одним из первых признаков БП. Для диагностики проводят оценку обонятельного порога, способности к различению и отождествлению запахов. При исследовании типа «случай — контроль» были выявлены изменения у 68% пациентов с начальными стадиями БП, тогда как в контроле потеря обоняния наблюдалась только у 3% [70]. При обследовании 30 человек с идиопатической потерей обоняния с помощью ТКС и ОФЭКТ у 11 был выявлен усиленный эхо-сигнал от черной субстанции, а у 5 из этих 11 пациентов показано снижение захвата радиолиганда при ОФЭКТ [108]. Обонятельная дисфункция также наблюдалась у 10-23% здоровых родственников пациентов с БП [98]. При наблюдении за близнецами, один из которых страдал БП, описаны случаи развития симптомов паркинсонизма [86]. Транскраниальная магнитная стимуляция В ряде исследований было показано уменьшение времени центрального моторного поведения и повышение амплитуды вызванного моторного ответа (ВМО) [59,78].
Поэтому обонятельная дисфункция (гипосмия, аносмия) является одним из первых признаков БП. Для диагностики проводят оценку обонятельного порога, способности к различению и отождествлению запахов. При исследовании типа «случай — контроль» были выявлены изменения у 68% пациентов с начальными стадиями БП, тогда как в контроле потеря обоняния наблюдалась только у 3% [70]. При обследовании 30 человек с идиопатической потерей обоняния с помощью ТКС и ОФЭКТ у 11 был выявлен усиленный эхо-сигнал от черной субстанции, а у 5 из этих 11 пациентов показано снижение захвата радиолиганда при ОФЭКТ [108]. Обонятельная дисфункция также наблюдалась у 10-23% здоровых родственников пациентов с БП [98]. При наблюдении за близнецами, один из которых страдал БП, описаны случаи развития симптомов паркинсонизма [86]. Транскраниальная магнитная стимуляция В ряде исследований было показано уменьшение времени центрального моторного поведения и повышение амплитуды вызванного моторного ответа (ВМО) [59,78].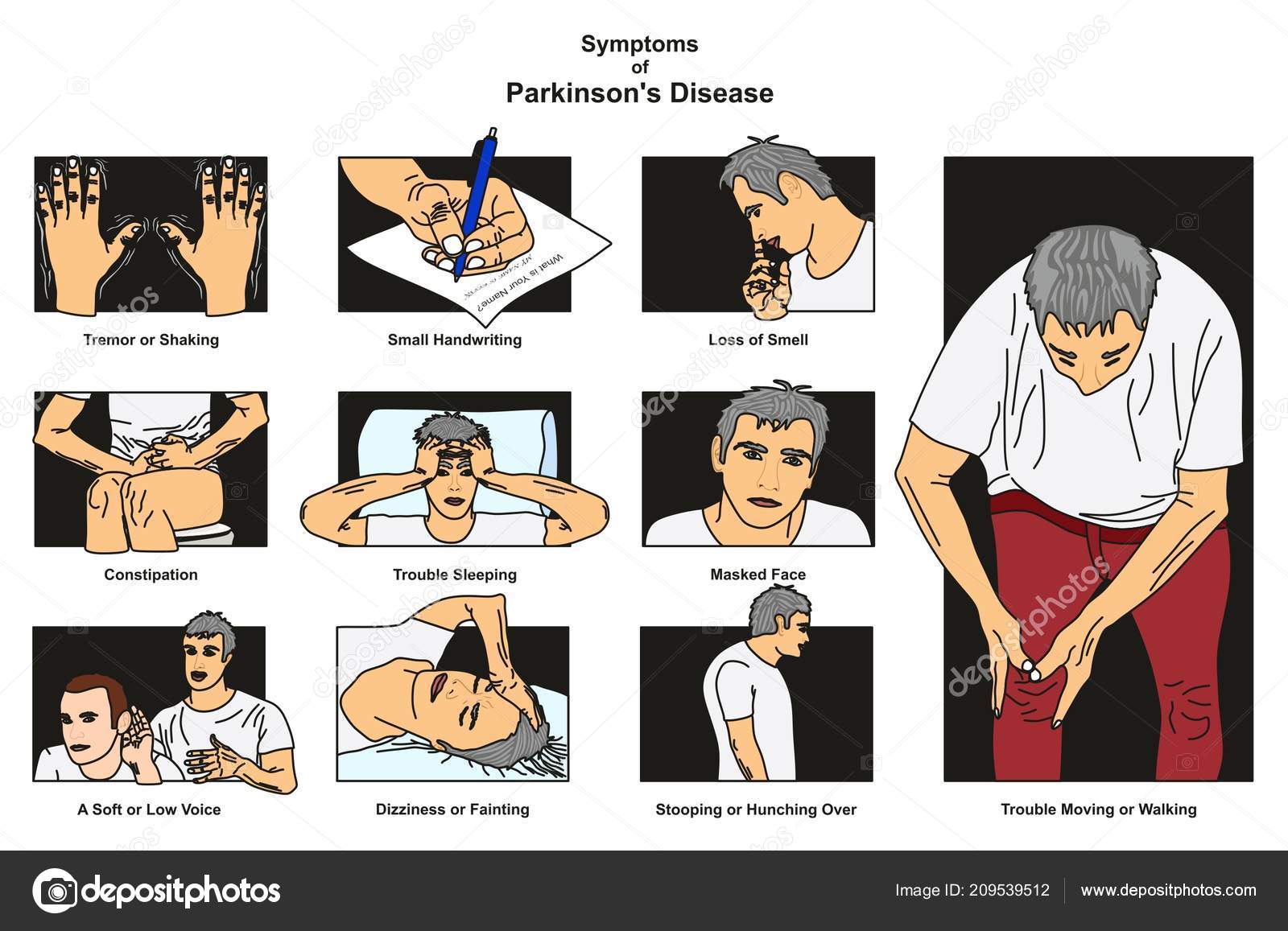 Увеличение амплитуды было тем значительнее, чем более выраженными были симптомы заболевания. Укорочение времени центрального моторного поведения связывали с возможной активацией наиболее быстро проводящих мотонейронов, а инкримент амплитуды ВМО – с повышенной возбудимостью корковых и/или спинальных мотонейронов [61]. В основе этих изменений, вероятно, лежит дисбаланс возбуждающих и тормозных влияний с преобладанием возбуждающих холин- и глутаматергических систем. Электроэнцефалография На электроэнцефалографии (ЭЭГ) у пациентов с БП наблюдается снижение a-активности и увеличение мощности медленных ритмов (q- и d-) в обоих полушариях [10, 11, 34, 49, 92]. Наибольшую представленность в спектре имеет q-ритм [103]. Замедление электрической активности головного мозга выявляется уже на ранних стадиях заболевания, более выражено при акинетико-ригидной форме и усиливается по мере прогрессирования БП и усугубления двигательного дефекта у больных [9, 27, 36, 41, 107]. Главной особенностью a-ритма при БП является его приближение к нижней границе спектра [31, 92].
Увеличение амплитуды было тем значительнее, чем более выраженными были симптомы заболевания. Укорочение времени центрального моторного поведения связывали с возможной активацией наиболее быстро проводящих мотонейронов, а инкримент амплитуды ВМО – с повышенной возбудимостью корковых и/или спинальных мотонейронов [61]. В основе этих изменений, вероятно, лежит дисбаланс возбуждающих и тормозных влияний с преобладанием возбуждающих холин- и глутаматергических систем. Электроэнцефалография На электроэнцефалографии (ЭЭГ) у пациентов с БП наблюдается снижение a-активности и увеличение мощности медленных ритмов (q- и d-) в обоих полушариях [10, 11, 34, 49, 92]. Наибольшую представленность в спектре имеет q-ритм [103]. Замедление электрической активности головного мозга выявляется уже на ранних стадиях заболевания, более выражено при акинетико-ригидной форме и усиливается по мере прогрессирования БП и усугубления двигательного дефекта у больных [9, 27, 36, 41, 107]. Главной особенностью a-ритма при БП является его приближение к нижней границе спектра [31, 92]. Обнаруживается корреляция между выраженностью акинезии и замедлением a-ритма в состоянии бодрствования [105]. Напротив, ряд авторов [8, 117] при паркинсонизме указывали на тенденцию к десинхронизации фоновой ЭЭГ с появлением быстрых ритмов с частотой до 100 в 1 секунду. У пациентов на легкой и умеренной стадии заболевания обнаружено снижение мощности b- и g-активности наряду с ее повышением в q- и
a1-диапазонах частот [109], на поздней стадии – усиление b-активности [65]. Вызванные потенциалы При обследовании пациентов с помощью зрительных вызванных потенциалов на стадии гемипаркинсонизма показано снижение максимальной амплитуды поздних компонентов и увеличение латентности раннего позитивного компонента ответа P100 по сравнению с «интактным» полушарием. Асимметрия амплитуд и латентностей исчезала по мере прогрессирования заболевания [45, 88]. При БП увеличивается латентость не только компонента Р100, но и N75 и N145, при этом ее значения коррелируют с тяжестью моторных проявлений и длительностью заболевания [53, 94].
Обнаруживается корреляция между выраженностью акинезии и замедлением a-ритма в состоянии бодрствования [105]. Напротив, ряд авторов [8, 117] при паркинсонизме указывали на тенденцию к десинхронизации фоновой ЭЭГ с появлением быстрых ритмов с частотой до 100 в 1 секунду. У пациентов на легкой и умеренной стадии заболевания обнаружено снижение мощности b- и g-активности наряду с ее повышением в q- и
a1-диапазонах частот [109], на поздней стадии – усиление b-активности [65]. Вызванные потенциалы При обследовании пациентов с помощью зрительных вызванных потенциалов на стадии гемипаркинсонизма показано снижение максимальной амплитуды поздних компонентов и увеличение латентности раннего позитивного компонента ответа P100 по сравнению с «интактным» полушарием. Асимметрия амплитуд и латентностей исчезала по мере прогрессирования заболевания [45, 88]. При БП увеличивается латентость не только компонента Р100, но и N75 и N145, при этом ее значения коррелируют с тяжестью моторных проявлений и длительностью заболевания [53, 94]. Изменения зрительных вызванных потенциалов объясняют биохимическими и электрофизиологическими изменениями в сетчатке, нейроны которой богаты дофамином, что подтверждается данными электроретинографии [93]. В то же время другое исследование зрительных вызванных потенциалов на реверсивный шахматный паттерн у пациентов с БП, проведенное S. Ozden et al., не обнаружило значимой амплитудно-временной асимметрии компонентов между более и менее пораженной сторонами при стимуляции соответствующего глаза [95]. Также не было выявлено и корреляций между этими показателями и клиническими проявлениями БП за исключением брадикинезии. При анализе результатов исследования зрительных вызванных потенциалов на вспышку света отмечено отсутствие разницы показателей у пациентов в зависимости от стадии заболевания. Электромиография и электронейромиография Проведение электромиографического исследования с помощью накожных электродов позволяет выявить ряд изменений на электромиографии (ЭМГ) у лиц с БП [48].
Изменения зрительных вызванных потенциалов объясняют биохимическими и электрофизиологическими изменениями в сетчатке, нейроны которой богаты дофамином, что подтверждается данными электроретинографии [93]. В то же время другое исследование зрительных вызванных потенциалов на реверсивный шахматный паттерн у пациентов с БП, проведенное S. Ozden et al., не обнаружило значимой амплитудно-временной асимметрии компонентов между более и менее пораженной сторонами при стимуляции соответствующего глаза [95]. Также не было выявлено и корреляций между этими показателями и клиническими проявлениями БП за исключением брадикинезии. При анализе результатов исследования зрительных вызванных потенциалов на вспышку света отмечено отсутствие разницы показателей у пациентов в зависимости от стадии заболевания. Электромиография и электронейромиография Проведение электромиографического исследования с помощью накожных электродов позволяет выявить ряд изменений на электромиографии (ЭМГ) у лиц с БП [48]. У пациентов с дрожательной формой заболевания регистрируется залповая активность с высоковольтными колебаниями биопотенциала мышц в покое по типу залпов с частотой 4-8 в 1 секунду, что отражает ритм тремора. Электромиографическая регистрация тремора показала, что залповая активность носит реципрокный характер, то есть на момент паузы в агонисте приходится залповый разряд в антагонисте [30, 31]. При акинетико-ригидной форме заболевания ЭМГ носит стационарный тип и формируется на основе ритмической асинхронной стационарной активности двигательных единиц [19]. При прогрессировании БП амплитуда тремора увеличивается, а частота залпов снижается [39, 87]. Считается, что низкочастотный тремор имеет более высокую амплитуду и большую продолжительность залпа [46, 101, 119]. По мере нарастания мышечного тонуса в поздних стадиях заболевания происходит подавление залповой активности [26].
Изменения на ЭМГ могут выявляться на субклинических и ранних стадиях БП [72]. Они могут также обнаруживаться у 17,3% здоровых людей среднего и 26,2% пожилого возраста, что отражает наличие скрытой экстрапирамидной недостаточности и ослабление тормозных надсегментарных влияний с возрастом [16, 23].
У пациентов с дрожательной формой заболевания регистрируется залповая активность с высоковольтными колебаниями биопотенциала мышц в покое по типу залпов с частотой 4-8 в 1 секунду, что отражает ритм тремора. Электромиографическая регистрация тремора показала, что залповая активность носит реципрокный характер, то есть на момент паузы в агонисте приходится залповый разряд в антагонисте [30, 31]. При акинетико-ригидной форме заболевания ЭМГ носит стационарный тип и формируется на основе ритмической асинхронной стационарной активности двигательных единиц [19]. При прогрессировании БП амплитуда тремора увеличивается, а частота залпов снижается [39, 87]. Считается, что низкочастотный тремор имеет более высокую амплитуду и большую продолжительность залпа [46, 101, 119]. По мере нарастания мышечного тонуса в поздних стадиях заболевания происходит подавление залповой активности [26].
Изменения на ЭМГ могут выявляться на субклинических и ранних стадиях БП [72]. Они могут также обнаруживаться у 17,3% здоровых людей среднего и 26,2% пожилого возраста, что отражает наличие скрытой экстрапирамидной недостаточности и ослабление тормозных надсегментарных влияний с возрастом [16, 23]. У здоровых родственников лиц с БП в 45% случаев обнаруживается наличие залповой активности на ЭМГ [13, 22]. Обследование клинически интактных конечностей у пациентов с I стадией БП с помощью ЭМГ со спектральным анализом выявило изменения в 71% случаев в верхних и 58% – в нижних конечностях [6]. Эти данные представляют определенный интерес в качестве перспективной возможности применения данной методики как инструмента, облегчающего раннюю диагностику БП.
Результаты применения стимуляционной миографии – электронейромиографии – у лиц с БП противоречивы. Некоторые авторы отмечали снижение амплитуды М-ответа на элекронейромиографии [3, 81]. По результатам наших исследований, для ранних стадий БП характерно увеличение амплитуды М-ответа в мышцах кистей и стоп на стороне дебюта двигательных нарушений, что подтверждается результатами других исследований [1, 29, 66]. У пациентов с БП амплитуда М-ответа в мышцах кисти выше, чем у лиц с сосудистым паркинсонизмом [7]. Скорость проведения импульса (СПИ) по периферическим нервам у больных БП также претерпевает изменения: имеется снижение СПИ при БП, связанное, вероятно, с ослаблением нисходящих супраспинальных и внутрисегментарных тонических импульсаций и облегчением функции a-мотонейронов [3].
У здоровых родственников лиц с БП в 45% случаев обнаруживается наличие залповой активности на ЭМГ [13, 22]. Обследование клинически интактных конечностей у пациентов с I стадией БП с помощью ЭМГ со спектральным анализом выявило изменения в 71% случаев в верхних и 58% – в нижних конечностях [6]. Эти данные представляют определенный интерес в качестве перспективной возможности применения данной методики как инструмента, облегчающего раннюю диагностику БП.
Результаты применения стимуляционной миографии – электронейромиографии – у лиц с БП противоречивы. Некоторые авторы отмечали снижение амплитуды М-ответа на элекронейромиографии [3, 81]. По результатам наших исследований, для ранних стадий БП характерно увеличение амплитуды М-ответа в мышцах кистей и стоп на стороне дебюта двигательных нарушений, что подтверждается результатами других исследований [1, 29, 66]. У пациентов с БП амплитуда М-ответа в мышцах кисти выше, чем у лиц с сосудистым паркинсонизмом [7]. Скорость проведения импульса (СПИ) по периферическим нервам у больных БП также претерпевает изменения: имеется снижение СПИ при БП, связанное, вероятно, с ослаблением нисходящих супраспинальных и внутрисегментарных тонических импульсаций и облегчением функции a-мотонейронов [3]. Описано повышение СПИ при БП [7]. По нашим данным, у пациентов с начальными стадиями БП происходит усиление проведения по двигательным волокнам периферических нервов, что проявляется в увеличении СПИ и уменьшении показателей латентности М-ответа. Высокие значения СПИ, по-видимому, объясняются уменьшением нисходящих тормозных влияний со стороны нигроспинального тракта на интернейроны тонического рефлекса растяжения и повышением возбудимости спинальных мотонейронов [23, 81]. Для оценки функционального состояния мотонейронного аппарата спинного мозга используют и моносинаптическое тестирование (Н-рефлекс), исследование которого, как правило, указывает на повышенную возбудимость спинального a-мотонейронального аппарата [14, 20, 21, 25 ,32, 77]. При БП отмечаются снижение латентного периода, уменьшение порога вызывания и увеличение амплитуды Н-ответа [1, 100]. Выводы Приведенный обзор показывает, что на сегодняшний день не существует ни одного метода (за исключением малодоступных вариантов ПЭТ и ОФЭКТ), который позволил бы выявлять определенные признаки (критерии) заболевания.
Описано повышение СПИ при БП [7]. По нашим данным, у пациентов с начальными стадиями БП происходит усиление проведения по двигательным волокнам периферических нервов, что проявляется в увеличении СПИ и уменьшении показателей латентности М-ответа. Высокие значения СПИ, по-видимому, объясняются уменьшением нисходящих тормозных влияний со стороны нигроспинального тракта на интернейроны тонического рефлекса растяжения и повышением возбудимости спинальных мотонейронов [23, 81]. Для оценки функционального состояния мотонейронного аппарата спинного мозга используют и моносинаптическое тестирование (Н-рефлекс), исследование которого, как правило, указывает на повышенную возбудимость спинального a-мотонейронального аппарата [14, 20, 21, 25 ,32, 77]. При БП отмечаются снижение латентного периода, уменьшение порога вызывания и увеличение амплитуды Н-ответа [1, 100]. Выводы Приведенный обзор показывает, что на сегодняшний день не существует ни одного метода (за исключением малодоступных вариантов ПЭТ и ОФЭКТ), который позволил бы выявлять определенные признаки (критерии) заболевания. Возможно, в ближайшее десятилетие удастся определить круг дополнительных исследований, которые будут обладать достаточным уровнем доказательности, чтобы рекомендовать их в список необходимых методов диагностики БП. Вероятно, это будут несколько биомаркеров, легкодоступных для анализа. В настоящее время в перечень медицинских услуг при БП включены лишь сбор анамнеза и неврологический осмотр. МРТ и КТ рекомендовано проводить при наличии симптомов, не характерных для БП, с целью исключения других заболеваний. Разработка биомаркеров значительно повысит точность диагностики на ранних стадиях болезни и позволит выделить группу риска по данной патологии при выявлении изменений у клинически здоровых людей.
Возможно, в ближайшее десятилетие удастся определить круг дополнительных исследований, которые будут обладать достаточным уровнем доказательности, чтобы рекомендовать их в список необходимых методов диагностики БП. Вероятно, это будут несколько биомаркеров, легкодоступных для анализа. В настоящее время в перечень медицинских услуг при БП включены лишь сбор анамнеза и неврологический осмотр. МРТ и КТ рекомендовано проводить при наличии симптомов, не характерных для БП, с целью исключения других заболеваний. Разработка биомаркеров значительно повысит точность диагностики на ранних стадиях болезни и позволит выделить группу риска по данной патологии при выявлении изменений у клинически здоровых людей.Список литературы находится в редакции.
Статья печатается в сокращении.
Журнал неврологии и психиатрии имени С.С. Корсакова. – 2010. – № 12. – С. 112-118.
Диагностика болезни Паркинсона на ранних стадиях заболевания Текст научной статьи по специальности «Клиническая медицина»
Диагностика болезни Паркинсона на ранних стадиях заболевания
Пономарёв В. В., доктор медицинских наук,
В., доктор медицинских наук,
зав. кафедрой неврологии и нейрохирургии Белорусской медицинской академии последипломного образования, Минск
Мазуренко Е.В., аспирант Белорусской медицинской академии последипломного образования, врач-невролог РКМЦ Управления делами Президента Республики Беларусь
Ponomarev V.V., Mazurenka K.V.
Belarusian Medical Academy of Post-Graduate Education, Minsk,
Republican Clinical Medical Center of the Presidential Administration of the Republic of Belarus, Minsk
The diagnostic process at early stage of Parkinson’s disease
Резюме. Болезнь Паркинсона является прогрессирующим мультисистемным заболеванием, вовлекающим дофаминергическую, норадре-нергическую, серотонинергическую и холинергическую системы с широким спектром как двигательных, так и недвигательных(вегетативных, диссомнических, сенсорных, нервно-психических) проявлений. Некоторые из немоторных симптомов предшествуют моторной манифестации заболевания за 5-20 лет. Выявление биомаркеров премоторной фазы заболевания важно для ранней диагностики и лечения. Ключевые слова: болезнь Паркинсона, премоторная фаза, немоторные симптомы.
Некоторые из немоторных симптомов предшествуют моторной манифестации заболевания за 5-20 лет. Выявление биомаркеров премоторной фазы заболевания важно для ранней диагностики и лечения. Ключевые слова: болезнь Паркинсона, премоторная фаза, немоторные симптомы.
Summary. Parkinson’ disease is considered a progressive multisystem disorder involving dopaminergic, noradrenergic, serotoninergic and cholinergic systems, characterized by motor and non-motor (autonomic, sleep, sensory and neuropsychiatry) symptoms. These symptoms may precede motor manifestation by 5-20 years. The recognttion of these biomarkers in the premotor phase of the disease is important to early diagnosis and treatment. Keywords: Parkinson’ disease, premotor phase, non-motor symptoms.
Болезнь Паркинсона (БП) — одно из самых распространенных возраст-зависимых нейродегенеративных заболеваний. Встречается с частотой 150-250 случаев на 100 тысяч населения, заметно увеличиваясь с возрастом, достигая 1700 случаев на 100 тысяч населения у лиц старше 65 лет [43].
Традиционные ранее сложившиеся представления о бП как исключительно двигательном расстройстве, обусловленном дегенерацией дофаминергических нейронов нигростриарной системы, которое характеризуется сочетанием тремора покоя, экстрапирамидной ригидности, акинезии и постуральной неустойчивости, в последние годы были существенно пересмотрены [45]. Более того, установлено, что появление основных двигательных симптомов БП указывает на поражение 60% дофаминергических нейронов [17]. В связи с этим обнаружение ранних (немоторных) проявлений заболевания имеет не только академическое, но в большей степени практическое значение.
Согласно современным представлениям, БП признается прогрессирующим мультисистемным заболеванием, во-
влекающим дофаминергическую, норад-ренергическую, серотонинергическую и холинергическую системы с широким спектром как двигательных, так и недвигательных (вегетативных, диссомни-ческих, сенсорных, нервно-психических) проявлений [45]. Немоторные проявления не только сопровождают все стадии заболевания, от ранней до финальной, но в значительной степени определяют качество жизни пациентов и нередко становятся причиной их инвалидизации [3, 20]. Основные немоторные нарушения БП представлены в табл.1.
Немоторные проявления не только сопровождают все стадии заболевания, от ранней до финальной, но в значительной степени определяют качество жизни пациентов и нередко становятся причиной их инвалидизации [3, 20]. Основные немоторные нарушения БП представлены в табл.1.
Исследованиями последнего десятилетия было доказано, что некоторые из немоторных симптомов (гипосмия, ортоста-тическая гипотензия, запоры, нарушение поведения в REM-фазу сна, депрессия и др.) предшествуют манифестации моторных проявлений заболевания за 5-20 лет [39]. К ранним немоторным симптомам БП относят также легкие когнитивные нарушения, которые, по нашим данным, отмечаются у 30 % больных с впервые выявленной БП. Наличие премоторной и продромальной фазы заболевания подтверждают данные патоморфологических и нейровизуализационных исследований
[9-12, 15, 33]. Морфологическую основу недвигательных нарушений БП на премоторной фазе заболевания объясняет современная концепция Н. Braak и соавт. [11]. В основе патобиохимического каскада БП лежит нарушение конформации белка альфа-синуклеина, в норме присутствующего только в пресинаптических терминалях головного мозга. При БП этот белок накапливается и формирует внутри нейронов нитевидные структуры диаметром 20-40 нм, что представляет собой первый этап образования специфических внутриклеточных включений — телец Леви [4, 6].
Braak и соавт. [11]. В основе патобиохимического каскада БП лежит нарушение конформации белка альфа-синуклеина, в норме присутствующего только в пресинаптических терминалях головного мозга. При БП этот белок накапливается и формирует внутри нейронов нитевидные структуры диаметром 20-40 нм, что представляет собой первый этап образования специфических внутриклеточных включений — телец Леви [4, 6].
На основании иммуногистохимичес-кого выявления в аутопсийных образцах обширного банка мозга альфа-синук-леина и телец Леви Н. Braak выдвинул 6-стадийную теорию развития патологического нейродегенеративного процесса при БП [11]. По мнению автора, на I стадии происходит поражение обонятельной луковицы, переднего обонятельного ядра и дорсального моторного ядра блуждающего нерва, периферических ганглиев вегетативной нервной системы, пре- и постганглионарных симпатических и парасимпатических структур кишечного,
Таблица 1| Немоторные нарушения при болезни Паркинсона
Поражение систем Клинические симптомы
Нарушения обоняния Гипосмия, аносмия
Нарушения сна Трудность засыпания, поверхностный сон с частыми ночными пробуждениями, раннее пробуждение, чрезмерная дневная сонливость, ночные кошмары, расстройство поведения во сне с быстрыми движениями глаз, синдром беспокойных ног
Гастроэнтерологические нарушения Дисфагия, сиалорея, запоры, потеря веса, гастропарез с увеличением времени транзита пищи из желудка в кишечник
Кардиоваскулярная дисфункция Ортостатическая гипотензия, артериальная гипотензия после еды, артериальная гипер-тензия в положении лежа, снижение вариабельности сердечного ритма, аритмии, синкопы, сетчатое ливедо
Урогенитальная дисфункция Увеличение частоты мочеиспускания, императивные мочеиспускания, недержание мочи, никтурия, задержка мочеиспускания, импотенция
Респираторные нарушения Диспноэ, стридор
Кожные изменения Себорея, гипергидроз
Соматосенсорные расстройства Болевые синдромы различной локализации (чаще дорсопатии), парестезии, синдром хронической усталости
Нарушения зрения Диплопия, ухудшение цветового зрения, нечеткость зрения
Нервно-психические расстройства Депрессия, тревожность, ангедония, апатия, агрессивность, поведенческие нарушения, панические атаки, когнитивные нарушения, психозы, галлюцинации
сердечного и тазового сплетений [12]. Согласно разрабатываемой в настоящее время H.Braak гипотезе двойного удара, провоцирующим фактором, запускающим каскад нейродегенеративных изменений в мозге, является медленный вирус, попадающий в нервную систему через слизистую носовой полости и слизистую кишечника. На II стадии процесс распространяется на ядра продолговатого мозга и моста, в том числе ядро шва, голубоватое пятно, ретикулярную формацию. III стадия характеризуется поражением среднего мозга, включая черную субстанцию, миндалину, базальные отделы переднего мозга. На IV стадии вовлекается височный мезокортекс и гиппокамп. В финальных (V и VI) стадиях тельца Леви появляются в коре головного мозга, сначала в ассоциативных зонах префрон-тальной, височной и теменной коры, затем в моторных и сенсорных зонах коры [11]. Установлено, что немоторные проявления в большинстве своем относительно фар-макорезистентны к прапаратам леводопы, поскольку в основе их развития лежит дисфункция главным образом недофами-нергических систем: норадренергических, серотонинергических, холинергических и др.
Согласно разрабатываемой в настоящее время H.Braak гипотезе двойного удара, провоцирующим фактором, запускающим каскад нейродегенеративных изменений в мозге, является медленный вирус, попадающий в нервную систему через слизистую носовой полости и слизистую кишечника. На II стадии процесс распространяется на ядра продолговатого мозга и моста, в том числе ядро шва, голубоватое пятно, ретикулярную формацию. III стадия характеризуется поражением среднего мозга, включая черную субстанцию, миндалину, базальные отделы переднего мозга. На IV стадии вовлекается височный мезокортекс и гиппокамп. В финальных (V и VI) стадиях тельца Леви появляются в коре головного мозга, сначала в ассоциативных зонах префрон-тальной, височной и теменной коры, затем в моторных и сенсорных зонах коры [11]. Установлено, что немоторные проявления в большинстве своем относительно фар-макорезистентны к прапаратам леводопы, поскольку в основе их развития лежит дисфункция главным образом недофами-нергических систем: норадренергических, серотонинергических, холинергических и др. [13, 20]. Последовательность возникновения клинических проявлений БП в соответствии со стадийностью патологического процесса по Н. Braak представлена в табл. 2.
[13, 20]. Последовательность возникновения клинических проявлений БП в соответствии со стадийностью патологического процесса по Н. Braak представлена в табл. 2.
Скорость нейродегенерации на ранних стадиях не известна, но к моменту
манифестации моторных симптомов (стадия III-IV по Braak) количество погибших нигростриарных нейронов драматически снижается и достигает 60% от исходного уровня, при этом количество стриарного допамина снижается на 80% [17]. Попыт-
ки нейропротекции на поздних стадиях БП не могут быть успешными, вот почему возможность выявления заболевания на премоторной и продромальной стадиях столь важна. Исследования современной неврологии направлены на поиск потен-
Таблица Стадийность появления клинических симптомов при болезни
| Паркинсона (Н. Braak, 2005) 1
Braak, 2005) 1
Клинические симптомы:
гипосмия
запоры
нарушение симпатической иннервации миокарда
ортостатическая гипотензия
ухудшение цветового зрения CK S
нарушения поведения в REM-фазу сна 1— О
депрессия
гипергидроз к S 3
гипофония 1— о
сиалорея
себорея
дизартрия
нарушения мочеиспускания со ее S
тонкие нарушения моторики S 1— О
легкие когнитивные нарушения
ахейрокинез
брадикинезия
тремор, ригидность
Транскраниальная сонография в плоскости сканирования среднего мозга
Белой пунктирной линией обведены границы среднего мозга, стрелками показано анатомическое положение черной субстанции: а — гиперэхогенность черной субстанции отсутствует; б — двусторонняя гиперэхогенность черной субстанции.
циальных маркеров премоторной фазы заболевания.
Поскольку обонятельная дисфункция (гипосмия, аносмия) — одно из первых клинических проявлений БП, она может использоваться (в комбинации с другими методами) в качестве биомаркера премоторной фазы БП [19, 33]. Для диагностики оценивают обонятельный порог; способность к различению и идентификации запахов с помощью 16 специальных карандашей с различными запахами. В проведенных J. Henderson et al. исследованиях гипосмия была выявлена у 68% больных с начальными стадиями БП, в группе контроля она отмечалась только у 3% обследуемых [19]. Обонятельная дисфункция была выявлена у 10-23% здоровых родственников пациентов с БП [33, 28]. Особенно специфичен тест на идентификацию запахов. В то же время при других нейродегенеративных заболеваниях [16, 44], сосудистом паркинсонизме и «паркинсонизм-плюс» синдромах ольфакторная функция не нарушается [23, 24]. Риск равития БП считается повышенным в течение 4 лет после выявления гипосмии; при увеличении срока от 4 до 8 лет этот фактор теряет свою предикативную ценность [37]. Имеются исследования, доказывающие также роль гипосмии как важного преклинического маркера деменции [31].
Риск равития БП считается повышенным в течение 4 лет после выявления гипосмии; при увеличении срока от 4 до 8 лет этот фактор теряет свою предикативную ценность [37]. Имеются исследования, доказывающие также роль гипосмии как важного преклинического маркера деменции [31].
В качестве потенциальных биомаркеров заболевания рассматривались разнообразные вегетативные нарушения, предшествующие манифестации моторных симптомов БП. Для выявления постган-глионарной симпатической денервации сердца, сопровождающейся вазодила-
тацией, снижением силы сердечных сокращений, нарушением вариабельности сердечного ритма и ортостатической гипотензией, используется сцинтиграфия адреноактивности миокарда с МИБГ [32]. Введение метайодобензилгуани-дина с использованием однофотонной эмиссионной компьютерной томографии позволяет визуально оценить снижение симпатической иннервации сердца у больных БП даже на начальных стадиях заболевания [41]. МИБГ-сцинтиграфия выявляет нарушения и у пациентов с демен-цией с тельцами Леви, это обследование позволяет провести дифференциальную диагностику с болезнью Альцгеймера, при которой изменения на МИБГ-сцинти-графии отсутствуют [41]. Значение других вегетативных нарушений в качестве биомаркеров БП низкое в силу их небольшой специфичности.
МИБГ-сцинтиграфия выявляет нарушения и у пациентов с демен-цией с тельцами Леви, это обследование позволяет провести дифференциальную диагностику с болезнью Альцгеймера, при которой изменения на МИБГ-сцинти-графии отсутствуют [41]. Значение других вегетативных нарушений в качестве биомаркеров БП низкое в силу их небольшой специфичности.
Наибольшее предикативное значение из обширного круга диссомнических расстройств, встречающихся при БП, имеют нарушения поведения в REM-фазу сна (от англ. rapid eye movement, син. — фаза быстрого сна, БДГ-фаза — сон с быстрыми движениями глаз). Они характеризуются отсутствием нормальной мышечной атонии в REM-фазе сна с двигательным беспокойством, иногда существенно выраженным, падением, выкриками соответственно содержанию ночного сновидения. Полисомнографические исследования выявляют нарушения поведения в REM-фазу сна у 1/3 пациентов с БП, еще 1/3 имеют асимптоматическую потерю мышечной атонии в этой фазе сна. Нарушения поведения в REM-фазу сна очень распространены и при мультисис-
Нарушения поведения в REM-фазу сна очень распространены и при мультисис-
темной атрофии и деменции с тельцами Леви [18]. В нескольких проспективных исследованиях показано, что риск развития нейродегенеративного заболевания у лиц с нарушениями поведения в REM-фазу сна составляет от 19 до 38% в течение 5 лет наблюдения и от 40 до 65% после 10 лет [21, 34, 40]. Почти у половины из них развивается БП, у 50-60% развивается деменция (преимущественно деменция с тельцами Леви). Таким образом, высокий риск развития заболевания и длительный латентный период делают нарушения поведения в REM-фазу сна идеальным маркером для прогнозирования БП. Единственным ограничением является то, что для постановки диагноза требуется проведение полисомнографии, трудоемкой и дорогостоящей процедуры. Разработан опросник для обнаружения расстройств поведения в REM-фазу сна с сенситивностью 96% и чувствительностью 92% [42]. Необходимо отметить, что у пациентов с нарушениями поведения в REM-фазу сна выявляются разной степени когнитивные нарушения [29].
К убедительным маркерам риска БП относят также депрессивные расстройства. Депрессия выявляется у 27,6% больных с ранними стадиями БП [36]. Депрессия предшествует манифестации моторных нарушений в 20% случаев [22, 26, 30]. Депрессивные расстройства могут отмечаться в течение 20 лет до развития двигательных нарушений при БП, но частота их значительно повышается в течение 3-6 лет до постановки диагноза БП [26, 38]. Пациенты с депрессией имеют риск развития БП в 2,24-3,22 раза выше, чем в контрольной группе без депрессивных расстройств [22,26,30].
В качестве дополнительных маркеров диагностики ранних проявлений БП могут рассматриваться ухудшение цветового зрения [35] и нарушение саккадических движений глаз [5].
Определенную роль играют тонкие нарушения моторики, однако предикативная ценность этого фактора невысокая, поскольку тонкие нарушения моторики обнаруживаются у 40 % людей пожилого возраста [8]. Кроме того, эти нарушения являются маркером III стадии по Braak, соответственно, период для нейропро-тективных мер ограничен.
Кроме того, эти нарушения являются маркером III стадии по Braak, соответственно, период для нейропро-тективных мер ограничен.
Генетические маркеры БП гетероген-ны, поскольку известно минимум 13 самостоятельных хромосомных локусов и 9 генов, идентифицированных в семьях с наследуемым паркинсонизмом [14, 27]. С ними связывают формирование БП с ранним началом (до 45 лет)
и в первую очередь аутосомно-рецес-сивного ювенильного паркинсонизма (развивающегося у лиц моложе 20 лет) [1, 7]. Основное значение в развитии ювенильной формы БП играет ген, кодирующий белок паркин, участвующий в механизмах клеточной защиты и в деградации альфа-синуклеина. В настоящее время диагностическая значимость генетических маркеров БП остается крайне низкой.
В качестве биохимических маркеров заболевания могут также рассматриваться снижение активности мито-хондриального комплекса I (выявляется не только в клетках черной субстанции, но и в тромбоцитах, клетках скелетной мускулатуры), снижение уровня тирозин-гидроксилазы, дофамина, рецепторов к дофамину в лимфоцитах и цистеиндеок-сигеназы в плазме крови. Однако пока эти тесты только разрабатываются и не имеют достаточного уровня доказательности [2].
Однако пока эти тесты только разрабатываются и не имеют достаточного уровня доказательности [2].
К достоверным методам диагностики доклинической и ранней клинической стадии относят методы функциональной нейровизуализации: позитронно-эмисси-онную томографию (ПЭТ), однофотонно-эмиссионную компьютерную томографию (ОФЭКТ), протонную магнитно-резонансную спектроскопию, которые позволяют оценить темп дегенеративного процесса и выявить снижение активности дофами-нергической системы на доклиническом уровне [25].
При помощи транскраниальной со-нографии возможна визуализация недавно установленного маркера БП — ги-перэхогенности черной субстанции. Этой методике посвящены пока немногочисленные работы, обсуждается ее чувствительность и специфичность при БП и других нейродегенеративных заболеваниях. Это направление современной неврологии стремительно развивается, поскольку транскраниальная сонография неинвазивна, безопасна для пациента, недорогая, быстро выполняется, что выгодно отличает ее от других нейровизуа-лизационных методов обследования. По нашим данным, у 80-90 % пациентов с БП выявляется гиперэхогенность черной
По нашим данным, у 80-90 % пациентов с БП выявляется гиперэхогенность черной
субстанции (рисунок). Несколько ограничивает использование метода наличие плохого акустического окна доступа у 10-15% пациентов.
Таким образом, обзор методов доклинической и ранней клинической диагностики БП показывает, что, кроме дорогостоящих и малодоступных методик ПЭТ и ОФЭКТ, не существует однозначных биомаркеров премоторной фазы заболевания. Однако круг этих показателей определен и критерии премоторной фазы БП продолжают разрабатываться, что, возможно, позволит в будущем существенно изменить ход заболевания, используя ней-ропротективную терапию на этапе, предшествующем гибели значительного числа дофаминергических нейронов черной субстанции. Для практикующих врачей важно, с нашей точки зрения, понимание того, что БП начинается не с известных клинических симптомов поражения черной субстанции, а с немоторных проявлений заболевания.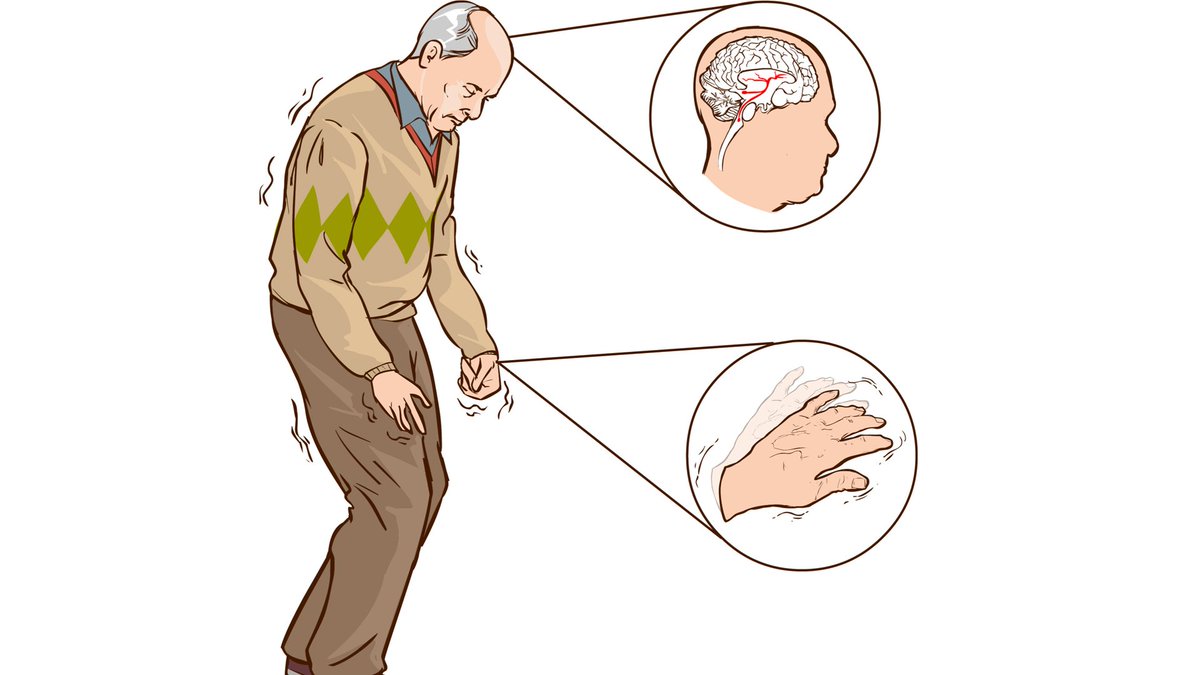 Их обнаружение позволит правильно определять стратегию лечения и тем самым обеспечит повышение качества жизни пациентов с БП.
Их обнаружение позволит правильно определять стратегию лечения и тем самым обеспечит повышение качества жизни пациентов с БП.
Л И Т Е Р А Т У Р А
1. Иллариошкин С.Н. // Атмосфера. Нервные болезни. — 2006. — № 3. — С.14-19.
2. Копишинская С.В., Густов А.В., Макушина С.В. и др. // Ремедиум Приволжье. — 2010. — № 2.
3. Нодель М.Р., Яхно Н.Н. // Болезнь Паркинсона и расстройства движений: рук. для врачей; по м-лам I Нац. конгр. — М.,2008. — С. 92-94.
4. Пономарев В.В. // Мед. новости. — 2007. — №5. -С. 23-28.
5. Ратманова П.О., Евина Е.И., Напалков Д.А. // Альманах клин. медицины. — 2006. — Т. XIII. -С. 90-93.
6. Федулов А. С. // Неврология и нейрохирургия. -2009. — № 2. — С. 80-115.
С. // Неврология и нейрохирургия. -2009. — № 2. — С. 80-115.
7. Якуц О.А., Моссэ К.А., Лихачев С.А., Плешко И.В. // Здравоохранение. — 2011. — № 3. — С. 68-71.
8. Bennett D.A., Beckett L.A., Murray A.M. et al. // N. Engl. J. Med. — 1996. — Vol. 334. — P. 71-76.
9. Berendse H.W., Booij J, Francot C.M. et al. // Ann. Neurol. — 2001. — Vol. 50 (1). — P. 34-41.
10. Booij J, Tissingh G, Winogrodzka A., van Royen E.A. // Eur. J. Nucl. Med. — 1999. — Vol. 26. — P. 171-182.
11. Braak H., Del Tredici K., Rub U. // Neurobiol. Aging. — 2003. — Vol. 24. — P. 197-211.
12. Braak H., Sastre M., Bohl J.R. et al. // Acta Neuropathol. — 2007. — Vol. 113. — P. 421-429.
13. ChaudhuriK.R., SchapiraA.H.V. // Lancet Neurol. —
ChaudhuriK.R., SchapiraA.H.V. // Lancet Neurol. —
2009. — Vol. 8. — P. 464-474.
14. Dawson T.M, Ko H.S., Dawson VL. // Neuron. —
2010. — Vol. 66. — P. 646-661.
15. Dickson D.W., Fujshiro H, Delledonna A. et al. // Acta Neuropathol. — 2008. — Vol. 116. — P. 125-128.
16. Doty R.L., Golbe L.I., McKeown D.A. et al. // Neurology. — 1993. — Vol. 43. — P. 962-965.
17. Fearnley J.M, Lees A.J. // Brain. — 1991. — Vol. 114. -P. 2283-2301.
18. Gagnon J.F, Postuma R.B., Mazza . et al. // Lancet Neurol. — 2006. — Vol. 5. — P. 424-432.
19. Henderson J.M, Lu Y, Wang S. et al. // J. Neurol. Neurosurg. Psychiatry. — 2003. — Vol. 74 (7). — P. 956958.
Neurol. Neurosurg. Psychiatry. — 2003. — Vol. 74 (7). — P. 956958.
20. Honig H., Antonini A, Martinez-Martin P. et al. // Mov Disord. — 2009. — Vol. 24 (10). -P. 1468-1474.
21. Iranzo A: Molinuevo JL, Santamaiia J. et al. // Lancet Neurol. — 2006. — Vol. 5. — P. 572-577.
22. Ishihara L., Brayne C. // Acta Neurol Scand. -2006. — Vol. 113 (4). — P. 211-220.
23. Katzenschlager R., Zijlmans J., Evans A. et al. // J. Neurol. Neurosurg. Psychiatry. — 2004. -Vol. 75. — P. 1749-1752.
24. Khan N.L., Katzenschlager R, Watt H. et al. // Neurology. — 2004. — Vol. 62. — P. 1224-1226.
25. Laihinen A, Ruottinen H., Rinne J.O. et al. // J. Neurol. — 2000. — Vol. 247, suppl. 2. — P. 110-113.
26. Leentjens A.F, Van den Akker M., Metsemakers J.F et al. // Mov. Disord. — 2003. — Vol. 18 (4). -P. 414-418.
27. Lesage S., Brice A . // Hum. Mol. Genet. -2009. — Vol. 18. — P. 48-59.
28. Markopoulou K., Larsen K.W., Wszolek E.K. et al. // Neurology. — 1997. — Vol. 49(5). — P. 12621267.
29. Massicotte-Marquez J., Decary A, Gagnon J.F et al. // Neurology. — 2008. — Vol. 70. — P. 12501257.
30. Nilsson FM., Kessing L.V., Bolwig T.G. // Acta Psychiatr. Scand . — 2001. — Vol. 104 (5). — P. 380386.
31. Olichney J.M, Murphy C., Hofstetter C.R. et al. // J. Neurol. Neurosurg Psychiatry. — 2005. — Vol. 76. -P. 1342-1347.
32. Orimo S., TakahashiA, Uchihara T. et al. // Brain Pathol. — 2007. — Vol. 17. — P. 24-30.
Orimo S., TakahashiA, Uchihara T. et al. // Brain Pathol. — 2007. — Vol. 17. — P. 24-30.
33. Ponsen M.M., Stoffers D., Booij J. // Ann. Neurol. — 2004. — Vol. 56. — P. 173-181.
34. Postuma R.B., Gagnon J.F., Vendette M. et al. // Neurology. — 2009. — Vol. 72. — P. 1296-1300.
35. Price M.J., Feldman R.G., Adelberg D., Kay-ne H. // Neurology. — 1992. — Vol. 42. — P. 887-890.
36. Ravina B., Camicioli R., Como P.G. et al. // Neurology. — 2007. — Vol. 69(4). — P. 342-347.
37. Ross G.W., Petrovitch H., Abbott R.D. et al. // Ann. Neurol. — 2008. — Vol. 63(2). — P. 167-173.
38. Santamaria J, Tolosa E., VallesA. // Neurology. -1986. — Vol. 36(8). — P. 1130-1133.
39. Savica R., Rocca W.A., Ahlskog J.E. // Arch. Neurol. — 2010. — Vol. 67. — P. 798-801.
Savica R., Rocca W.A., Ahlskog J.E. // Arch. Neurol. — 2010. — Vol. 67. — P. 798-801.
40. Schenck C.H., Bundlie S.R., Mahowald M.W. // Neurology. — 1996. — Vol. 46. — P. 388-393.
41. Spiegel J., Hellwig D., Farmakis G. et al. // Mov. Disord. — 2007. — Vol. 22. — P. 1004-1008.
42. Stiasny-Kolster K., Mayer G., Schafer S. et al. // Mov. Disord. — 2007. — Vol. 22. — P. 2386-2393.
43. Walters E.C., van Laar T., Berendse H.W. // Parkinsonism and related disorders. — Amsterdam: VU University Press, 2007.
44. Wenning G.K., Shephard B., Hawkes C. et al. // Acta Neurol. Scand. — 1995. — Vol. 91. — P. 247250.
45. Wolter Erik Ch. s. // J. Neurol. Sciences. — 2008. -Vol. 266. — P.![]() 197-203.
197-203.
Поступила 08.12.2011 г.
Page not found – МЕДИЦИНСКИЙ ЦЕНТР ГАЛИЛЕЯ
Dropdown *выберите странуАвстралияАвстрияАзербайджанАлбанияАлжирАнгильяАнголаАндорраАнтигуаАргентинаАрменияАрубаАфганистанБагамские о-ваБангладешБарбадосБахрейнБеларусьБелизБельгияБенинБермудские о-ваБолгарияБоливияБосния и ГерцеговинаБотсванаБразилияБрунейБуркина-ФасоБурундиБутанВануатуВатиканВеликобританияВенгрияВенесуэлаВиргинские о-ва (Великобритания)Виргинские о-ва (США)Восточное — Самоа (США)Восточный ТиморВьетнамГабонГавайские о-ваГаитиГайанаГамбияГанаГваделупаГватемалаГвиана – французскаяГвинеяГвинея-БисауГерманияГернсиГибралтарГондурасГонконгГренадаГренландияГрецияГрузияГуамДанияДжерсиДжибутиДиего Гарсия о-ваДоминикаДоминиканская РеспубликаЕгипетЗамбияЗанзибар о-вЗападное СамоаЗимбабвеИзраильИндияИндонезияИорданияИракИранИрландияИсландияИспанияИталияЙеменКабо-ВердеКазахстанКайманКамбоджаКамерунКанадаКатарКенияКипрКиргизияКирибатиКитайКокосовы (Килинг) о-ваКолумбияКоморские о-ваКонгоКонго (Демократическая республика)Корея СевернаяКорея ЮжнаяКоста-РикаКот-д’ИвуарКубаКувейтКука о-ваЛаосЛатвияЛесотоЛиберияЛиванЛивияЛитваЛихтенштейнЛюксембургМаврикийМавританияМадагаскарМайоттаМакаоМакедонияМалавиМалайзияМалиМальдивыМальтаМарианские о-ваМароккоМартиникаМаршалловы о-ваМексикаМидуэйМикронезияМозамбикМолдавияМонакоМонголияМонтсерратМьянмаМэнНамибияНауруНепалНигерНигерияНидерландыНикарагуаНиуэ о-вНовая ЗеландияНовая КаледонияНорвегияНормандские о-ваНорфолкОбъединённые Арабские ЭмиратыОлдерниОльстерОманПакистанПалауПалестинаПанамаПапуа Новая ГвинеяПарагвайПеруПольшаПортугалияПуэрто-РикоРеюньонРоссийская ФедерацияРуандаРумынияСальвадорСамоаСан-МариноСан-Томе и ПринсипиСаудовская АравияСвазилендСвятой Елены о-ваСейшельские о-ваСенегалСент-Винсент и ГренадиныСент-Кристофер и НевисСент-ЛюсияСент-Пьер и МиелокСербия и ЧерногорияСеута и МелильяСингапурСирияСловакияСловенияСоединенные Штаты АмерикиСоломоновы о-ваСомалиСуданСуринамСьерра-ЛеонеТаджикистанТаиландТайваньТанзанияТеркс и Кайкос о-ваТогоТокелауТонгаТринидад и ТобагоТристан-Да-Кунья ос-вТувалуТунисТуркменияТурцияУгандаУзбекистанУкраинаУоллис и Футуна о-ваУругвайУэйкФарерские о-ваФиджиФилиппиныФинляндияФолклендские (Мальвинские) о-ваФранцияФранцузская ПолинезияХорватияЦентральноафриканская РеспубликаЧадЧехияЧилиШвейцарияШвецияШпицбергенШри-ЛанкаЭквадорЭкваториальная ГвинеяЭритреяЭстонияЭфиопияЮжно-Африканская РеспубликаЯмайкаЯпония
Single Line Text
Ваши симптомы уникальны для вас
Статья написана Джеки Хант Кристенсен.
С того поворотного момента, когда вам поставили диагноз, вы, вероятно, узнали о симптомах болезни Паркинсона и вариантах лечения. Но вам также следует знать, что ваша болезнь Паркинсона и то, как вы с ней справляетесь, столь же уникальны, как и вы сами.
Некоторым людям может помочь новая деятельность, которая перенаправляет их внимание с тревожных симптомов на вещи, которые по сути своей приносят удовлетворение.По ее словам, главное — найти способы приносить радость и счастье в свою жизнь каждый день.
Как справиться с симптомами болезни Паркинсона
Единственное, что можно предсказать в этой болезни, — это то, что она непредсказуема.
— Ричард, диагноз: 36
Тремор — первый признак, отмечаемый примерно у половины всех людей с болезнью Паркинсона. Но, возможно, как и 15 процентов людей с этим заболеванием, вы никогда не испытывали этого симптома. Это потому, что болезнь Паркинсона поражает всех по-разному.
Как вы обнаружите, ваши симптомы будут продолжать меняться, часто изо дня в день и на протяжении всей вашей жизни. Но даже несмотря на то, что от болезни Паркинсона нет лекарства, чем раньше вы примете меры по устранению симптомов, когда они возникнут, тем больше у вас будет шансов сохранить хорошее качество жизни.
Вот почему первый шаг в борьбе с изменениями, сопровождающими диагноз Паркинсона, — это просто повысить осведомленность, заметить новые симптомы, а также то, как ваше тело реагирует на определенные действия, стрессы и методы лечения.Полезный способ сделать это — записывать свои паттерны симптомов в ежедневный журнал. Нужно просто записывать небольшие изменения, которые вы замечаете в своем физическом и эмоциональном здоровье каждый день. Таким образом, вы сможете оперативно обсудить эти вопросы со своим врачом и получить лечение.
Как вы можете справиться с изменениями, которые приносит болезнь Паркинсона
Делай, что можешь, пока можешь
Я болею болезнью Паркинсона почти 20 лет.
Моя жена — учитель, поэтому мы путешествуем каждое лето, когда она не работает.После постановки диагноза я был в Китае, Непале, Праге, Париже и многих других местах. Приходит и болезнь Паркинсона, поэтому наши поездки требуют большего планирования, чем раньше, и мы привлекаем мою команду по уходу. Мы учитываем ежедневный сон и принимаем его медленно. У меня не так хорошее равновесие, как раньше, и слишком много ходьбы меня утомляет, поэтому мы берем с собой складное кресло-каталку или проверяем, есть ли оно в наличии. Еще я использую трость. Я не знаю, сколько еще мест мы сможем посетить по мере того, как моя болезнь будет прогрессировать, но у нас остались прекрасные воспоминания, которых у нас не было бы, если бы мы позволили моей болезни Паркинсона определять все аспекты нашей жизни.
— Николай, диагноз поставлен в 52 года, все еще путешествует по номеру 72
Многие люди с болезнью Паркинсона не позволяют этому заболеванию взять верх над своей жизнью. Несмотря на повседневные неудачи, с которыми они сталкиваются, они по-прежнему создают для себя полноценную жизнь, перенаправляя свое внимание на людей и занятия, которые приносят им радость. Вы можете сделать то же самое. Попробуйте включить в свой распорядок несколько хобби, которые позволят вам отдохнуть от размышлений о болезни. Найдите занятия, которые помогут вам на время забыть о болезни Паркинсона.Это может быть живопись, письмо, работа в саду или чтение вашим внукам.
Вы можете сделать то же самое. Попробуйте включить в свой распорядок несколько хобби, которые позволят вам отдохнуть от размышлений о болезни. Найдите занятия, которые помогут вам на время забыть о болезни Паркинсона.Это может быть живопись, письмо, работа в саду или чтение вашим внукам.
Обратиться за помощью
Вне зависимости от того, поставили ли вы диагноз на ранней стадии болезни или у вас есть симптомы в течение длительного времени, наступит день, когда вы больше не сможете что-то делать. Это может включать в себя чашку кофе или возможность записать номер телефона во время разговора по телефону.
Хотя просить о помощи в повседневной жизни (ADL) может быть очень сложно, особенно если вы никогда не полагались на других, вам нужно будет научиться запрашивать и принимать помощь по мере прогрессирования вашего заболевания.Опираясь на заботу и общение с близкими друзьями и семьей, вы сможете лучше справиться с болезнью.
Примите то, что больше не можете делать
Со временем может показаться, что вы теряете независимость, потому что больше не можете делать все то, что делали раньше. По мере того, как происходят эти потери, вы, вероятно, пройдете через пять этапов горя, определенных доктором Элизабет Кюблер-Росс. К ним относятся отрицание, гнев, торг, депрессия и принятие. Осознание проблемы или потери, на которые вы реагируете, поможет вам легче переходить от одного этапа к другому.
По мере того, как происходят эти потери, вы, вероятно, пройдете через пять этапов горя, определенных доктором Элизабет Кюблер-Росс. К ним относятся отрицание, гнев, торг, депрессия и принятие. Осознание проблемы или потери, на которые вы реагируете, поможет вам легче переходить от одного этапа к другому.
Независимо от того, какие у вас симптомы, двигательные или немоторные, не позволяйте болезни Паркинсона победить вас!
Усталость при болезни Паркинсона | Американская ассоциация болезни Паркинсона.
Усталость при болезни Паркинсона
Усталость — распространенная, но недостаточно известная проблема для людей с болезнью Паркинсона (БП). Усталость можно определить как неприятное ощущение недостатка энергии, из-за которого выполнение рутинных действий, физического или умственного, становится напряжением. Люди с БП могут испытывать физическую усталость, умственную усталость или и то, и другое.Усталость при болезни Паркинсона — это не то же самое, что чувство, которое может возникнуть в конце тяжелого рабочего дня. Это не обязательно что-то, что уходит с отдыхом. Когда людей с БП спрашивают об утомляемости, они используют такие фразы, как: «Я чувствую себя подавленным, у меня нет энергии, я не могу ничего делать, я не могу получить мотивацию».
Это не обязательно что-то, что уходит с отдыхом. Когда людей с БП спрашивают об утомляемости, они используют такие фразы, как: «Я чувствую себя подавленным, у меня нет энергии, я не могу ничего делать, я не могу получить мотивацию».
Усталость при болезни Паркинсона Брошюра
Нет времени закончить статью? Загрузите брошюру в формате PDF, чтобы взять эту информацию с собой или поделиться с кем-то из своих знакомых.
Скачать PDF
Усталость — обычное явление для PD
Многочисленные исследования, проведенные в Соединенных Штатах и Европе, показывают, что около трети людей с БП считают утомляемость своим единственным наиболее беспокоящим симптомом, даже больше, чем двигательные симптомы БП, такие как тремор, медлительность, скованность и трудности с ходьбой и равновесием. Кроме того, около половины людей считают усталость одним из трех самых неприятных симптомов.
Утомляемость при БП имеет тенденцию развиваться на ранних стадиях болезни, обычно в первые несколько лет, если она вообще собирается развиваться. Оно может появиться до появления двигательных симптомов и обычно не проходит. Это не коррелирует с серьезностью других симптомов — человек с легкими двигательными симптомами может иметь значительную усталость, а человек со значительными двигательными симптомами может испытывать небольшую усталость.
Оно может появиться до появления двигательных симптомов и обычно не проходит. Это не коррелирует с серьезностью других симптомов — человек с легкими двигательными симптомами может иметь значительную усталость, а человек со значительными двигательными симптомами может испытывать небольшую усталость.
Усталость и депрессия
Существует большое совпадение между усталостью и другими проблемами при БП, особенно депрессией и нарушениями сна. Люди с усталостью более склонны к депрессии, а люди, находящиеся в депрессии, более склонны к утомлению, но, тем не менее, существует большая группа пациентов с БП, которые утомлены, но не находятся в депрессии.Депрессия при БП обычно поддается лечению антидепрессантами, и усталость, связанная с депрессией, может уменьшиться с помощью такого лечения.
Утомляемость и нарушения сна
Расстройства сна часто встречаются при БП и могут способствовать утомлению. Однако сонливость обычно улучшается сном, тогда как утомляемость может уменьшаться или не уменьшаться сном или отдыхом. Усталость снижает желание и способность выполнять повседневную деятельность, общаться с друзьями и семьей и участвовать в общественной деятельности.
Причины усталости
Исследователи до сих пор не знают, что вызывает утомляемость при БП. Вероятно, это комбинация взаимодействующих причин, только некоторые из которых мы понимаем и можем изменить. У многих людей лекарства, принимаемые при двигательных симптомах болезни Паркинсона, могут усилить утомляемость. Поэтому иногда может помочь изменение режима приема лекарств от БП. Плохое физическое состояние может усилить утомляемость, а для некоторых людей упражнения могут уменьшить утомляемость. Из-за наложения усталости на депрессию и нарушения сна, лечение этих других немоторных симптомов БП также может быть полезным.
Некоторые люди находят пользу от лекарств, таких как модафнил и метилфенидат, хотя исследования не подтверждают их истинную пользу. В клинике обязательно регулярно обсуждайте с врачом свою усталость, точно так же, как вы сообщаете о серьезности других симптомов.
Диагностика болезни Паркинсона | Американская ассоциация болезни Паркинсона.
Как диагностируют болезнь Паркинсона
Болезнь Паркинсона обычно диагностируется клинически, что означает, что врач проверяет наличие или отсутствие возможных симптомов болезни Паркинсона, опрашивая пациента и выполняя подробное неврологическое обследование.
Хотя в настоящее время нет окончательного теста на болезнь Паркинсона, его часто может определить невролог общего профиля, обученный диагностике и лечению неврологических расстройств. Чтобы избежать ошибочного диагноза, рекомендуется проконсультироваться со специалистом по двигательным расстройствам (МДС). Специалист по двигательным расстройствам — это врач, который прошел дополнительную специализированную подготовку по диагностике и лечению двигательных расстройств, таких как болезнь Паркинсона, после обучения по общей неврологии.
Чего ожидать во время посещения врача
Контрольный список для диагностики
Когда вы или кто-то из ваших знакомых впервые посещаете врача для оценки потенциальных ранних симптомов болезни Паркинсона, полезно знать, чего ожидать.Во время первого визита врач должен провести следующие анализы:
- Составьте полную и тщательную историю болезни
- Измерьте артериальное давление, сидя и стоя
- Оцените свои мыслительные (или когнитивные) навыки
- Изучите выражение лица
- Обратите внимание на тремор на лице, руках или ногах
- Проверьте, нет ли скованности в ваших руках, ногах, туловище или плечах
- Определите, можете ли вы легко вставать со стула, особенно без использования рук
- Изучите свою схему ходьбы
- Оцените свой баланс на ногах
Обычно квалифицированный врач рассматривает диагноз болезни Паркинсона только в том случае, если обследуемый имеет по крайней мере два основных моторных симптома болезни Паркинсона, включая тремор, характерную брадикинезию (медлительность движений) или ригидность.В конце вашего визита врач должен обсудить с вами, почему у вас может быть или нет болезнь Паркинсона, и уровень уверенности в диагнозе. Это решение основано на вашей истории болезни и обследовании во время этого визита.
Визуализация головного мозга и другие инструменты для диагностики болезни Паркинсона
Помимо сбора анамнеза и проведения подробного неврологического обследования, врачи иногда используют томографию головного мозга для подтверждения конкретного диагноза. Однако эти исследования имеют свои ограничения в диагностике болезни Паркинсона и обычно используются только у избранных пациентов.Визуализация головного мозга обычно не выполняется неврологами или специалистами по двигательным расстройствам, когда они рассматривают диагноз, особенно если симптомы человека убедительно указывают врачу, что идиопатическая болезнь Паркинсона является правильным диагнозом.
Помощь в диагностике болезни Паркинсона с помощью DaTscan и других тестов
Скорее всего, использование изображений наиболее полезно, когда диагноз не определен, или когда врачи ищут изменения в мозге, которые более типичны для одного из нескольких синдромов Паркинсона (а не идиопатической болезни Паркинсона) и других состояний, которые могут имитировать болезнь Паркинсона.Визуализирующие исследования для оценки болезни Паркинсона и паркинсонических синдромов включают магнитно-резонансную томографию (МРТ), которая исследует структуру мозга, и DaTscan, визуализационный тест, одобренный Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) для определения функции дофамина в головном мозге. DaTscan может помочь дифференцировать идиопатическую болезнь Паркинсона от некоторых других неврологических расстройств. Большинство кабинетов врачей будут иметь доступ к МРТ; однако получение изображений DaTscan может быть доступно только в крупных больницах или медицинских центрах.
Другие визуализационные исследования, которые можно сделать, но которые обычно не используются в клинике, включают функциональную МРТ (фМРТ), специализированную форму визуализации мозга, которая исследует функции мозга, и позитронно-эмиссионную томографию (ПЭТ), с помощью которой можно измерить определенный мозг. функции.
Установление диагноза с помощью лекарств от болезни Паркинсона
Если симптомы человека и неврологическое обследование указывают только на болезнь Паркинсона или если диагноз вызывает сомнения, врач может, тем не менее, прописать лекарство, предназначенное для лечения болезни Паркинсона, чтобы предоставить дополнительную информацию.В случае идиопатической болезни Паркинсона обычно наблюдается положительный, предсказуемый ответ на лекарства от болезни Паркинсона; в случае некоторых родственных синдромов Паркинсона реакция на лекарства может быть не особенно устойчивой или может отсутствовать полностью.
К сожалению, не существует стандартных биологических тестов на болезнь, например, анализа крови. Однако исследователи активно пытаются найти биомаркеры в крови и других жидкостях организма, которые могли бы помочь подтвердить диагноз.
Если это не болезнь Паркинсона, что это может быть еще?
Есть несколько других состояний, которые могут вызывать симптомы, которые можно принять за болезнь Паркинсона. Вот несколько возможностей:
- Побочные эффекты лекарств: Некоторые лекарства могут вызывать или усугублять симптомы. Прочтите, каких лекарств следует избегать.
- Эссенциальный, или семейный, тремор: это относительно распространенная и доброкачественная причина рецидивирующего тремора, которую часто путают с тремором идиопатической болезни Паркинсона.Общий невролог или специалист по двигательным расстройствам — лучший врач, который поможет различить эти два состояния.
- Паркинсонический синдром: симптомы нескольких неврологических состояний сходны с симптомами идиопатической болезни Паркинсона, но они часто управляются по-разному и часто не поддаются лечению типичными лекарствами.
Помните: только невролог или специалист по двигательным расстройствам может сказать вам с достаточной уверенностью, если у вас идиопатическая болезнь Паркинсона.Если по какой-то причине вас не устраивают результаты вашего первого визита к врачу, всегда можно получить второе мнение другого невролога или специалиста по двигательным расстройствам. Важно, чтобы вы чувствовали себя комфортно со своим врачом, чтобы обеспечить вам наилучший результат.
Когда вам или вашему близкому поставлен диагноз болезни Паркинсона, пора обсудить варианты лечения с вашим врачом.
Прочтите истории людей с диагнозом 40, 50 и 60 лет.
Подробнее о болезни Паркинсона
Болезнь Паркинсона и изменения личности | APDA
Изменения в личности
Мысль о том, что болезнь может вызвать даже скромные изменения в том, кто мы есть, заставляет многих из нас чувствовать себя некомфортно. Однако нет никаких сомнений в том, что мозг меняется из-за болезни Паркинсона.
На протяжении многих лет было много дискуссий о «личности Паркинсона». Хотя это вызывает споры, некоторые исследователи попытались вернуться в прошлое, чтобы найти общий набор личностных черт среди людей, у которых позже развивается болезнь Паркинсона.Здесь есть ряд проблем, не последней из которых является предвзятость, которая неизбежно возникает, когда кто-то смотрит в прошлое, зная, как выглядит настоящее. Более разумно предположить, что неврологические эффекты болезни Паркинсона вызывают большое сходство в личности людей с этим заболеванием. Поэтому я думаю, что более важно учитывать вероятность изменения личности при БП.
Поговорите с любым членом семьи человека, страдающего болезнью Паркинсона, и вы часто услышите, как они говорят: «Болезнь Паркинсона изменила моего супруга / партнера / родителя / брата / сестру.«Они сообщают, что что-то заметно изменилось в том, кем является их любимый человек как личность. Это может быть незаметно или довольно вопиюще, но человек уже не тот, каким был когда-то. Недавно я выступил с докладом о болезни Паркинсона и изменении личности для группы членов семьи и был поражен количеством людей, у которых эта идея нашла отклик.
На самом деле мы не привыкли говорить о болезни Паркинсона как о средстве изменения личности, потому что в большинстве наших дискуссий мы фокусируемся на болезни как на двигательном расстройстве.Это позволяет нам говорить об изменениях в мозге с точки зрения деменции или исполнительной дисфункции. Но оба эти состояния проявляются как фундаментальное изменение в личности человека. Мысль о том, что болезнь может вызвать даже скромные изменения в том, кто мы есть, заставляет многих из нас чувствовать себя неуютно. Однако нет никаких сомнений в том, что мозг меняется из-за болезни Паркинсона. Поскольку значительная часть нашей личности зависит от функции нашего мозга, вопрос о том, порождает ли изменяющийся мозг изменяющуюся личность, не является логичным.
Один из самых тяжелых симптомов неврологического расстройства, вызванного болезнью Паркинсона.
Почему это может быть важно для семей, столкнувшихся с проблемой PD? Потому что самый большой источник конфликта в семьях возникает, когда близкие не понимают, что человек с изменениями мозга — это не тот человек, который существовал в более ранний период жизни. Люди очень ценят преемственность личности, но, ожидая, что человек будет таким же, каким были когда-то, близкие несправедливы по отношению к человеку с оскорблением мозга.Этот человек не мог больше вернуться к более раннему состоянию личности, чем он или она может избавиться от тремора или ригидности. Энергия, потраченная любым другим способом, кроме как прийти к соглашению с этим «новым» человеком, бесполезна. На самом деле в этой области есть интересные исследования, и, вероятно, это станет темой для гораздо большего обсуждения в будущих блогах.
Американская психологическая ассоциация (APA) определяет личность как «организацию индивидуальных особенностей, черт или привычек». Согласно Энциклопедии психологии АПА, эта индивидуализированная организация включает четыре области: мышление, чувства, поведение, восприятие окружающей среды.Такие слова, как черты характера и привычки, подразумевают, что личность — это постоянная функция человека. Основываясь на нашем восприятии личности человека, мы можем делать разумные прогнозы о том, как человек функционирует в этих четырех сферах. Мы делаем это с помощью народных терминов, которые использовались в нашем языке на протяжении веков, потому что они не только обеспечивают общее понимание, но и позволяют нам делать прогнозы о том, как человек может действовать в данных обстоятельствах. Важно помнить, что иногда это может означать более / менее активную форму характеристик, которые уже присутствовали (например,грамм. контролируемый и непостоянный в зависимости от того, как человек реагирует на гнев).
Из-за большей вероятности исполнительной дисфункции и деменции изменение личности легче увидеть среди людей с более продвинутой стадией болезни Паркинсона. Мотивация (характеристика личности, которую мы могли бы назвать вовлеченностью) часто нарушается, что приводит к апатии (интроверсии), которая снижает, насколько активно человек взаимодействует с другими людьми (отчужденность) и с миром (замкнутость). Изменения мышления или познания могут заставить человека обрабатывать информацию медленнее и с меньшим вниманием и концентрацией (невнимательность, рассеянность).Ранее методичный, последовательный (сознательный) человек часто становится все более хаотичным (дезорганизованным) в своей реакции на окружающую среду (недисциплинированной). Человек легко теряет интерес (скучает) и надеется на будущее (пессимист).
Даже среди людей с молодым дебютом болезни Паркинсона могут наблюдаться незначительные изменения личности. Таким образом, человек может начать испытывать больше отрицательных эмоций (невротизм), стать более тревожным (боязливым) или подавленным (замкнутым или капризным).Им может быть трудно отказаться от идей / убеждений (упрямство) или они могут быть чрезмерно тянутыми к деталям (навязчивые). Они могут испытывать трудности с выполнением рабочих заданий (непродуктивно), потому что у них проблемы с организацией (небрежность). Они могут снова и снова пробовать ранее безуспешные методы (безрезультатно).
Многие читатели могут спросить, зачем нужно усложнять и без того сложное заболевание, говоря о нем с точки зрения личности. Простой ответ заключается в том, что в наших семьях используются личностные термины при описании поведения профессионалам («Он очень компульсивен по поводу того, что он ест вовремя») и при попытке сформулировать свои чувства, что человек изменился («Она никогда не была такой упрямой до PD. »).Неопытные с медицинской точки зрения люди обычно используют термины личности как своего рода стенографию, чтобы сообщить о том, что они видят или переживают, потому что существует определенная степень культурного согласия относительно того, что означают эти термины. Наконец, врачи, которые пытаются лечить стабильные состояния, возникающие при болезни Паркинсона (такие как апатия), с медицинской точки зрения, могут быть менее склонны к этому, если они признают эти опасения как выражение личности, устойчивое к изменениям. В конце концов, не существует одобренных FDA методов лечения, которые заставляли бы человека заботиться о том, о чем он конституционно не склонен заботиться.
Важно осознавать, что наша личность относительно стабильна с течением времени, хотя старение, жизненный опыт и другие факторы (включая болезни) могут привести по крайней мере к некоторым скромным изменениям. Учитывая хронический и прогрессирующий характер БП, нет смысла полагать, что изменения личности исчезнут волшебным образом. Они, вероятно, станут более заметными, и могут появиться новые черты характера. Хотя нам может быть неудобно смотреть на болезнь Паркинсона как на состояние, которое меняет нас, имеет смысл поступить так.Мы уже признаем, что болезнь меняет жизнь, но, возможно, пожелаем принять во внимание, что отчасти причина в том, что она может изменить то, кем мы являемся.
Симптомы, причины, факторы риска и многое другое
Общие сведения о болезни Паркинсона
Болезнь Паркинсона — прогрессирующее заболевание центральной нервной системы. Состояние вызвано потерей клеток в области мозга, производящей дофамин. Обычно это диагностируется у людей в возрасте от 60 лет. Люди, которым поставлен диагноз до 50 лет, имеют раннее начало болезни Паркинсона.
Около 4 процентов из примерно 1 миллиона американцев, страдающих болезнью Паркинсона, имеют диагноз до 50 лет. Это число может быть выше, потому что болезнь часто не диагностируется у молодых людей.
Симптомы болезни Паркинсона часто одинаковы, независимо от возраста постановки диагноза. Тем не менее, симптомы действительно различаются от человека к человеку.
Недавние исследования показывают, что немоторные симптомы часто возникают первыми у более молодых пациентов. Сюда входят:
- потеря обоняния
- запор
- Расстройство быстрого сна
- расстройства настроения, такие как депрессия или тревога
- ортостатическая гипотензия или низкое кровяное давление при вставании
Другие немоторные симптомы включают:
- проблемы со сном, в том числе слишком много сна днем или слишком мало ночью
- проблемы с мочевым пузырем
- изменение полового влечения
- повышенное производство слюны
- колебания веса
- нарушения зрения
- усталость
- когнитивные проблемы, такие как проблемы запоминание вещей или частое замешательство
Двигательные симптомы — общие первые симптомы у людей любого возраста.К ним могут относиться:
- тремор покоя или постоянное дрожание, даже если ваши мышцы расслаблены
- замедленное движение (брадикинезия)
- жесткие мышцы
- наклонная осанка
- проблемы с равновесием
Неясно, что именно вызывает болезнь Паркинсона в любом случае возраст. Генетические факторы, факторы окружающей среды или их комбинация могут иметь значение. Это состояние возникает, когда клетки теряются в той части мозга, которая производит дофамин.Дофамин отвечает за отправку мозговых сигналов, управляющих движением.
Определенные гены связаны с ранним началом болезни Паркинсона.
По данным Национального фонда Паркинсона, исследования показывают, что 65 процентов людей с болезнью Паркинсона, у которых заболевание возникает до 20 лет, могут сделать это из-за генетической мутации. Эта организация также предполагает, что эта мутация затрагивает 32 процента людей, у которых заболевание проявляется в возрасте от 20 до 30 лет.
Экологические причины состояния могут включать воздействие химических токсинов, таких как определенные инсектициды, фунгициды и гербициды.
Департамент по делам ветеранов США признает болезнь Паркинсона болезнью, вызванной воздействием агента Orange. Agent Orange — синтетический химический гербицид, который использовался для опрыскивания растений и деревьев во время войны во Вьетнаме.
У вас может быть более высокий риск развития болезни Паркинсона, если вы:
- — мужчина
- живете в районе, где присутствуют определенные органические или промышленные загрязнители
- , у вас есть работа, которая подвергает вас воздействию токсичных химикатов, таких как марганец или свинец
- получил травму головы
- подвергся воздействию Agent Orange или других гербицидов
- имеет работу, которая подвергает вас воздействию химических растворителей или полихлорированных дифенилов
Не существует единого теста для выявления болезни Паркинсона.Диагноз может быть трудным и занять некоторое время. Состояние обычно диагностирует невролог на основе анализа ваших симптомов и физического осмотра.
DaTscan для визуализации дофаминовой системы вашего мозга может помочь подтвердить диагноз. Анализы крови и другие методы визуализации, такие как МРТ, не диагностируют болезнь Паркинсона. Однако их можно использовать для исключения других условий.
Лечение болезни Паркинсона направлено на замедление прогрессирования болезни. Варианты медикаментозного лечения могут включать следующее:
- Леводопа — это химическое вещество, которое в головном мозге превращается в дофамин.Люди с ранним началом болезни Паркинсона могут испытывать больше негативных побочных эффектов, таких как непроизвольные движения.
- Ингибиторы MAO-B могут помочь уменьшить распад дофамина в головном мозге.
- Ингибиторы катехол-O-метилтрансферазы могут помочь продлить действие леводопы на мозг.
- Антихолинергические средства могут помочь уменьшить тремор.
- Амантадин может использоваться для улучшения мышечного контроля и уменьшения скованности.
Глубокая стимуляция мозга
Глубокая стимуляция мозга (DBS) также считается хорошим вариантом для людей с ранним началом болезни Паркинсона.Это связано с тем, что люди с ранним началом болезни Паркинсона менее подвержены другим заболеваниям, которые могут вызвать осложнения.
DBS — это хирургическая процедура, при которой электроды помещаются в определенные области вашего мозга. Эти электроды подключены к генератору. Генератор запрограммирован на посылку электрических импульсов в ваш мозг.
Процедура может помочь облегчить следующие симптомы:
- тремор
- жесткость
- жесткость
- замедленное движение
- трудности при ходьбе
Уход за близким человеком с ранним началом болезни Паркинсона может быть затруднительным.Если вы ухаживаете за человеком с этим заболеванием, важно помнить о собственном эмоциональном и физическом здоровье.
Вы не только сталкиваетесь со сложным диагнозом, но и выполняете все больше обязанностей. Психологическое выгорание часто встречается у лиц, осуществляющих уход, поэтому убедитесь, что учитываете собственные потребности.
Центр исследований болезни Паркинсона Фонда Майкла Дж. Фокса рекомендует следующие советы лицам, осуществляющим уход:
Присоединяйтесь к группе поддержки
Участие в группе поддержки может дать вам выход для ваших страхов, опасений и разочарований.Вы также можете узнать о новых лекарствах, исследованиях и советах по преодолению трудностей.
Расширьте свою медицинскую бригаду
Добавьте в свою медицинскую бригаду столько специалистов, сколько вам нужно, чтобы поддержать вас и вашего близкого. Сюда входят терапевты, диетологи и специалисты по движению.
Будьте организованы
Ведите календарь для отслеживания посещений врача, приема лекарств и ваших собственных обязательств.
Будьте в курсе
Развивайте себя, чтобы знать, чего ожидать. Это поможет вам спланировать ситуацию заранее, чтобы не застать вас врасплох новыми симптомами.
Часы для депрессии
Следите за настроением любимого человека. Следите за первыми признаками депрессии и при необходимости обратитесь за помощью. Признаки включают:
- вспышки гнева
- изменения аппетита
- проблемы со сном
- беспокойство
- возбуждение
- когнитивные проблемы
Не упускайте из виду свои собственные потребности
Вы не сможете позаботиться о других, если не сделаете этого. не заботиться о себе. Соблюдайте здоровую диету и регулярно занимайтесь спортом (даже если это просто прогулка).Выясните, что помогает вам снять стресс. Вы можете вести дневник, медитировать или заниматься йогой. Определите членов семьи или друзей, которые вмешаются, когда вам понадобится перерыв.
Не существует однозначного способа предотвратить болезнь Паркинсона в любом возрасте. Однако есть шаги, которые могут помочь снизить риск:
- Пейте кофеин. Исследование, опубликованное в Journal of Alzheimer’s Disease, показало, что кофеин может помочь восстановить ранние моторные и немоторные симптомы, связанные с болезнью Паркинсона.
- Принимайте противовоспалительные препараты. Обзор исследований, опубликованных Американской академией неврологии, показал, что противовоспалительные препараты, известные как НПВП, могут помочь предотвратить болезнь Паркинсона.
- Следите за уровнем витамина D. Многие люди с болезнью Паркинсона не получают достаточного количества витамина D. Добавки витамина D могут помочь снизить риск.
- Оставайтесь активными. Упражнения улучшают жесткость мышц, подвижность и депрессию у пациентов с болезнью Паркинсона. Это также может помочь снизить риск заражения.
Болезнь Паркинсона с ранним началом — серьезное хроническое заболевание. Прием лекарств и изменение образа жизни часто облегчают симптомы. Они также могут замедлить развитие болезни.
Исследование болезни Паркинсона продолжается. Есть надежда, что будут разработаны более эффективные лекарства и что в конечном итоге будет лекарство.
Болезнь Паркинсона 101 | Болезнь Паркинсона
Ни один анализ крови, сканирование мозга или другой анализ не могут использоваться для постановки окончательного диагноза болезни Паркинсона. Врачи диагностируют болезнь Паркинсона «клинически» — диагноз основывается на истории болезни человека, ответах на определенные вопросы и медицинском осмотре.
Любой клинический диагноз во многом зависит от опыта и суждения врача. Если вы подозреваете, что у вас болезнь Паркинсона, вам следует обратиться к специалисту по двигательным расстройствам , который является неврологом со специальной подготовкой в области болезни Паркинсона и других двигательных нарушений. При осмотре врач ищет медлительность, скованность и тремор покоя — двигательные симптомы болезни Паркинсона.(Подробнее о симптомах.) Лечение у специалиста по двигательным расстройствам остается критически важным по мере прогрессирования болезни.
Хотя ни одна лаборатория (кровь, моча или спинномозговая жидкость) или визуализирующие исследования не могут подтвердить диагноз БП, врачи могут назначить эти тесты, чтобы исключить другие состояния, которые могут выглядеть как болезнь Паркинсона. DaT-сканирование — это тест с визуализацией мозга, который позволяет получить подробные изображения дофаминовой системы в головном мозге. Сканирование DaT не может диагностировать болезнь Паркинсона самостоятельно, и не всем с подозрением на болезнь Паркинсона этот тест нужен.Однако в некоторых случаях, например, когда трудно отличить тремор Паркинсона от эссенциального тремора (еще одно распространенное двигательное расстройство), это может быть полезным дополнением.
Более быстрая и ранняя диагностика болезни Паркинсона станет возможной, когда исследование обнаружит объективный тест, основанный на так называемом «биомаркере» , который выявляет риск, наличие или прогрессирование заболевания. (Холестерин, который помогает врачам диагностировать и контролировать прогрессирование сердечных заболеваний, является примером биомаркера.Исследование «Инициатива по маркерам прогрессирования болезни Паркинсона», спонсируемое Фондом Майкла Дж. Фокса, собирает данные за несколько лет от 1400 человек с болезнью Паркинсона и без него, чтобы найти биомаркер.
Спросите у доктора: Диагностика Паркинсона и биомаркерыФонд Майкла Дж. Фокса (MJFF) сделал поиск теста на болезнь Паркинсона одним из наших главных приоритетов.
Симптомы и ранние предупреждающие знаки PD
Апрель — месяц осведомленности о болезни Паркинсона.В поддержку повышения осведомленности об этом хроническом заболевании в этом посте рассматриваются симптомы, диагностика и лечение болезни Паркинсона. Мы также изучаем ранние признаки болезни Паркинсона (БП), чтобы помочь в ранней диагностике.
Что такое болезнь Паркинсона?
Болезнь Паркинсона — это двигательное расстройство, которое поражает нервную систему, превращая ее в нейродегенеративное состояние . Он развивается медленно, на протяжении многих лет. Хотя болезнь Паркинсона неизлечима, к счастью, она не смертельна.Однако это прогрессирующее заболевание, а значит, со временем оно ухудшается.
Хотя лекарства от болезни Паркинсона нет, существуют методы лечения, помогающие справиться с симптомами. К ним относятся лекарства, хирургические вмешательства (относительно редко) и комплексные средства, помогающие улучшить функции и качество жизни.
Сколько людей болеют болезнью Паркинсона?
Во всем мире насчитывается более 10 миллионов пациентов с болезнью Паркинсона, и, по прогнозам Фонда Паркинсона, к 2020 году почти у 1 миллиона американцев будет болезнь Паркинсона.Каждый год в США ставится около 60 000 новых диагнозов. Возраст и пол — самые большие факторы риска. Около 96 процентов пациентов старше 50 лет, а вероятность развития БП у мужчин примерно в 1,5 раза выше.
Общие симптомы болезни Паркинсона
БолезньПаркинсона в основном известна своими симптомами, связанными с движением (поэтому она известна как расстройство движения ). У каждого человека с болезнью Паркинсона есть первый симптом, брадикинезия . Термин буквально означает медлительность движения .Исследователи считают, что это связано с изменениями в двигательных областях мозга (вызванными БП). Эти изменения мешают мозгу «выполнять команды для движения».
Само по себе переживание брадикинезии не приводит к диагностике болезни Паркинсона. У пациента также должен быть хотя бы один из следующих симптомов движения:
- Постуральная нестабильность
- Жесткость
- Тремор
Из трех тремор является наиболее распространенным — и чаще всего ассоциируется с этим заболеванием.Это проявляется в виде легкого тряски в руке или подбородке. Ригидность — это когда пациент испытывает скованность в руках или ногах, не вызванную артритом. Наконец, постуральная нестабильность просто означает, что у пациента проблемы с равновесием или он склонен к падению.
Другие двигательные симптомы включают:
- Наклонная осанка
- Непроизвольные, беспорядочные движения лица, конечностей или тела
- Спазмы в мышцах
- Короткие быстрые шаги во время ходьбы
- Временная неспособность ходить или двигаться
- Проблемы с речью, например, при разговоре тихим или хриплым голосом
- Серьезное, подавленное или злое выражение лица, даже если оно не в плохом настроении
- Изменения почерка, особенно мелкий, скудный или неаккуратный.
- Избыток слюны или слюнотечение
Симптомы движения вызваны снижением выработки нейромедиатора дофамина .
Отсутствие движения
Хотя БП чаще всего ассоциируется с изменениями двигательных движений, у большинства пациентов также развиваются не двигательные симптомы. К ним относятся:
- Хроническая или повторяющаяся боль
- Запор, недержание мочи или учащение позывов / учащение мочеиспусканий
- Перхоть
- Бред или галлюцинации
- Деменция, языковые проблемы, память, непродолжительное внимание, планирование и другие когнитивные проблемы
- Проблемы с чтением вблизи
- Эректильная дисфункция или другие сексуальные проблемы
- Чрезмерное потоотделение
- Усталость
- Чувство сытости даже после небольшого количества еды, что часто приводит к непреднамеренной потере веса
- Чувство головокружения при стоянии
- Бессонница, чрезмерная дневная сонливость, синдром беспокойных ног, яркие сны и другие нарушения сна
- Потеря обоняния или вкуса
- Расстройства настроения, такие как тревога, депрессия и апатия
Некоторые симптомы отсутствия движения не проявляются до тех пор, пока пациент не болеет болезнью Паркинсона в течение многих лет.
Ранние предупреждающие признаки болезни Паркинсона
Ниже приведены 10 ранних признаков болезни Паркинсона. Если у вас есть два или более из этих симптомов, вы можете поговорить со своим врачом.
Диагностика болезни Паркинсона
Прежде чем ваш врач начнет тестирование на болезнь Паркинсона, у вас должны быть по крайней мере два общих симптома движения, перечисленных выше. Кроме того, они должны присутствовать с течением времени или повторяться. Многие двигательные симптомы являются общими для других состояний или даже при простом старении.Например, тремор часто возникает после тренировки, в ответ на стресс или как побочный эффект некоторых лекарств.
Если основной врач пациента подозревает БП, он или она обычно направляет пациента к неврологу, предпочтительно к специалисту по двигательным расстройствам.
Лечение болезни Паркинсона
Лечение широко варьируется в зависимости от симптомов пациента. Это потому, что от болезни Паркинсона нет лекарства. Все виды лечения предназначены для облегчения симптомов и замедления прогрессирования заболевания.
Лекарства для лечения болезни Паркинсона, отпускаемые по рецепту
Большинство двигательных симптомов возникают из-за недостатка дофамина. Таким образом, для лечения БП назначаются дофаминергические препараты ; они либо восполняют дофамин, либо имитируют его воздействие на мозг. Самый распространенный — леводопа . Организм превращает это лекарство в дофамин, чтобы помочь контролировать симптомы движения.
Убедитесь, что ваш врач знает все лекарства, которые вы принимаете, включая безрецептурные и пищевые добавки.Это помогает снизить риск лекарственного взаимодействия, которое часто встречается у пациентов с болезнью Паркинсона.
Варианты хирургического лечения болезни Паркинсона
По состоянию на 2019 год для лечения болезни Паркинсона назначены две операции. Их назначают только в том случае, если лекарства ранее помогали контролировать симптомы движения, но больше не эффективны.
Первый называется глубокая стимуляция мозга . Хирург вставляет провод или провод в субталамическое ядро , которое является частью мозга, контролирующей движение.Провод идет к внешнему устройству, называемому нейростимулятором . Это посылает электрические импульсы через провод, чтобы стимулировать субталамическое ядро.
Вторая операция назначается в случаях, когда у пациента слишком много побочных эффектов от леводопы или требуется слишком сильная доза. Хирург вставляет трубку в тонкий кишечник, через которую пациент получает дозы карбидопа . Это усиливает действие леводопы, позволяя пациенту получать меньшую дозу.
Физические упражнения и болезнь Паркинсона
Исследования, проведенные Фондом Паркинсона, показывают, что физические упражнения не менее 2,5 часов в неделю улучшают симптомы и замедляют прогрессирование болезни. Группа также обнаружила, что чем раньше пациенты начали тренироваться, тем больше польза была от них.
Для поддержания равновесия и подвижности Фонд рекомендует заниматься аэробикой, силовыми тренировками и упражнениями на гибкость. Популярные варианты:
- Велосипед
- танец
- Бег трусцой
- Пилатес
- Ци гун
- Тай-чи
- Тяжелая атлетика
- Йога
Однако настоящий секрет лучшей программы упражнений заключается в том, чтобы делать то, что вам нравится.Некоторые идеи можно найти в наших предыдущих статьях о силовых упражнениях и о том, как начать программу упражнений. И помните, никогда не начинайте новый режим упражнений, не посоветовавшись с врачом.
Альтернативные методы лечения болезни Паркинсона
Хотя FDA не одобрило никаких трав или добавок для лечения болезни Паркинсона, в настоящее время изучаются различные альтернативные методы лечения.
- Добавки кальция часто назначают, потому что молочные продукты затрудняют усвоение леводопы организмом.
- Коэнзим Q10 — это антиоксидант, который, как считается, улучшает здоровье митохондрий. Некоторые исследователи полагают, что аномальная функция митохондрий может играть роль в болезни Паркинсона.
- Креатин может помочь повысить уровень фосфокреатина , вещества, которое обеспечивает мозг энергией.
- Фолиевая кислота , также известная как витамин B9, жизненно важна как для здоровья мозга, так и для нервной системы.
- Имбирь часто рекомендуется для уменьшения тошноты, вызванной лекарствами.
- Средиземноморская диета может помочь справиться с симптомами и снизить кровяное давление.
- Добавки витамина D могут потребоваться, чтобы помочь вашему организму усваивать кальций, особенно если вы не получаете достаточно солнечного света.
- Витамин E может помочь бороться с повреждением клеток мозга, вызванным свободными радикалами, хотя исследования показали, что он не помогает справиться с симптомами после постановки диагноза.


 Врач пытается разогнуть конечности пациента: движения происходят словно рывками.
Врач пытается разогнуть конечности пациента: движения происходят словно рывками.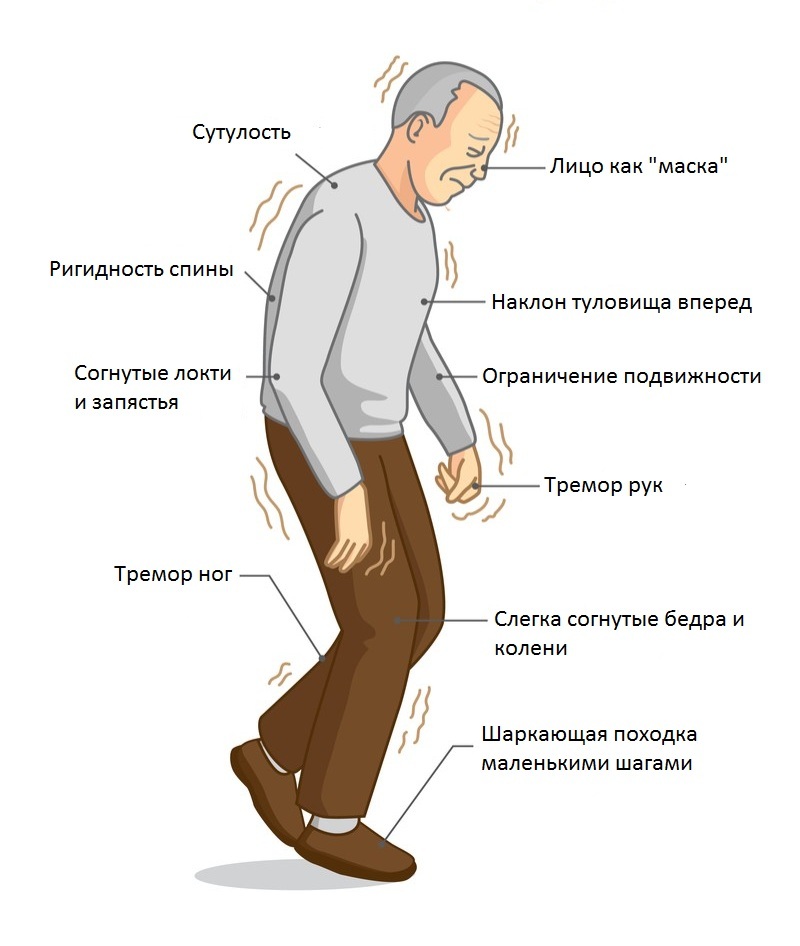
 Могут спровоцировать галлюцинации, психозы.
Могут спровоцировать галлюцинации, психозы.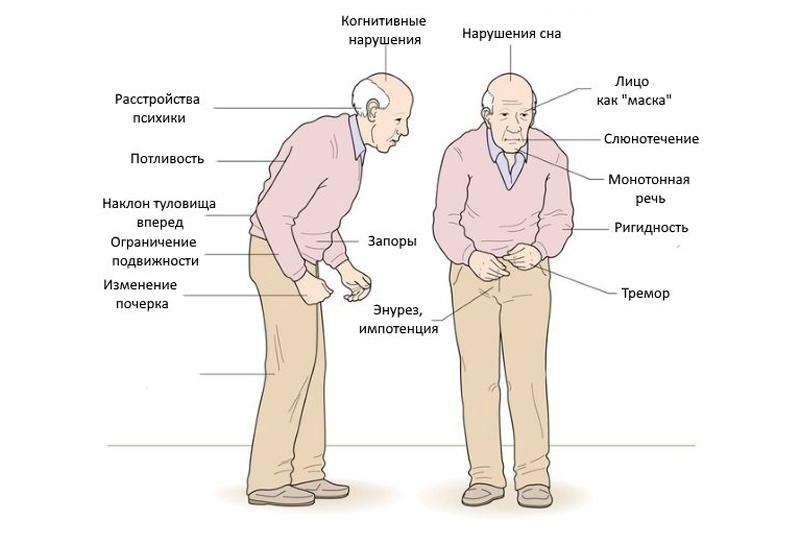
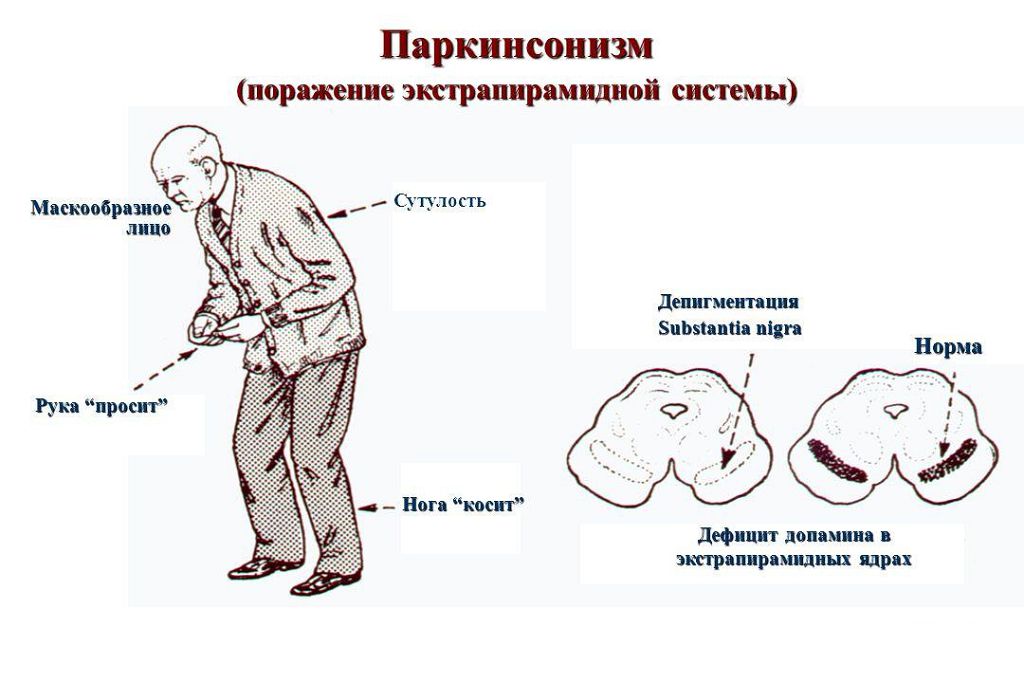 Моя жена — учитель, поэтому мы путешествуем каждое лето, когда она не работает.После постановки диагноза я был в Китае, Непале, Праге, Париже и многих других местах. Приходит и болезнь Паркинсона, поэтому наши поездки требуют большего планирования, чем раньше, и мы привлекаем мою команду по уходу. Мы учитываем ежедневный сон и принимаем его медленно. У меня не так хорошее равновесие, как раньше, и слишком много ходьбы меня утомляет, поэтому мы берем с собой складное кресло-каталку или проверяем, есть ли оно в наличии. Еще я использую трость. Я не знаю, сколько еще мест мы сможем посетить по мере того, как моя болезнь будет прогрессировать, но у нас остались прекрасные воспоминания, которых у нас не было бы, если бы мы позволили моей болезни Паркинсона определять все аспекты нашей жизни.
Моя жена — учитель, поэтому мы путешествуем каждое лето, когда она не работает.После постановки диагноза я был в Китае, Непале, Праге, Париже и многих других местах. Приходит и болезнь Паркинсона, поэтому наши поездки требуют большего планирования, чем раньше, и мы привлекаем мою команду по уходу. Мы учитываем ежедневный сон и принимаем его медленно. У меня не так хорошее равновесие, как раньше, и слишком много ходьбы меня утомляет, поэтому мы берем с собой складное кресло-каталку или проверяем, есть ли оно в наличии. Еще я использую трость. Я не знаю, сколько еще мест мы сможем посетить по мере того, как моя болезнь будет прогрессировать, но у нас остались прекрасные воспоминания, которых у нас не было бы, если бы мы позволили моей болезни Паркинсона определять все аспекты нашей жизни.