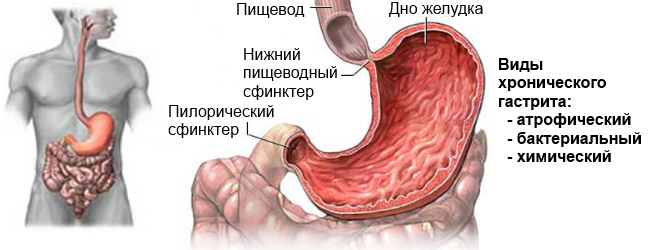
Что такое аутоиммунный гастрит?
Что такое аутоиммунный гастрит?
Патологический процесс, характеризующийся разрушением слизистой оболочки желудка вследствие иммунных процессов в организме, называется аутоиммунным гастритом. Аутоиммунный гастрит относится к разряду заболеваний хронического типа. С долей сожаления приходится констатировать факт малой изученности заболевания.
На сегодняшний день причины развития патологического процесса остаются неустановленными, однако учёные мужи едины во мнении, что основным провоцирующим развитие аутоиммунного гепатита фактором является генетическая предрасположенность. Помимо генетической предрасположенности, к числу провоцирующих развитие заболевания факторов следует отнести алкоголизм, активное курение, неполноценное и нерегулярное питание, нервное перенапряжение и частые стрессовые ситуации, последствия перенесённых ранее тяжелых заболеваний инфекционного характера, нарушения в работе иммунной системы организма.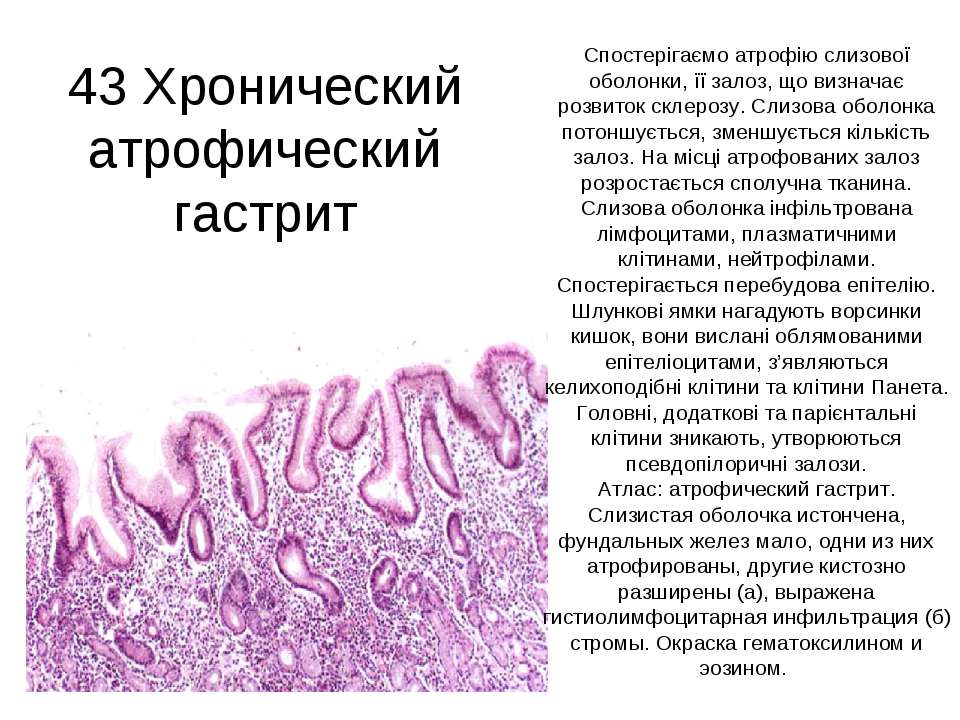
В гастроэнтерологии выделяют два основных типа патологического процесса: аутоиммунный атрофический гастрит и аутоиммунный хронический гастрит. Характерной особенностью атрофической формы патологического процесса является уничтожение клеток слизистой оболочки желудка иммунной системой, что зачастую ведёт к развитию онкологической опухоли. Хроническая форма аутоиммунного гастрита характеризуется выработкой антител к гастромукопротеин — белку, отвечающему за создание защитной плёнки стенок желудка. В процессе активной выработки антител происходит постепенное разрушение защитного слоя и атрофия клеток слизистой оболочки. Аутоиммунный гастрит сопровождается довольно быстрым нарастанием симптоматики.
Симптомы аутоиммунного гастрита
В качестве начальных проявлений патологического процесса необходимо указать тяжесть и чувство распирания в желудке, расстройство стула, тошноту, изжогу и отрыжку, сопровождаемую неприятным запахом, метеоризм, характерный гнилостный запах изо рта, являющийся следствием нарушения процесса переваривания пищи. В процессе развития патологии может появиться характерный светлый налёт на языке, чрезмерное потоотделение, бессонница, повышенная раздражительность, снижение артериального давления, выраженная сухость кожи. В силу неспецифичности симптоматики утверждать о наличии аутоиммунного гастрита можно только после проведения развёрнутой диагностики.
В процессе развития патологии может появиться характерный светлый налёт на языке, чрезмерное потоотделение, бессонница, повышенная раздражительность, снижение артериального давления, выраженная сухость кожи. В силу неспецифичности симптоматики утверждать о наличии аутоиммунного гастрита можно только после проведения развёрнутой диагностики.
Диагностика аутоиммунного гастрита
Диагностика заболевания начинается с предварительного осмотра и ознакомления с историей болезней пациента. Основываясь на результатах проведённого осмотра, специалист назначает проведение ряда инструментальных и лабораторных исследований. В качестве наиболее информативных методов инструментальной диагностики стоит указать фиброгастроскопическое и ультразвуковое исследования. В процессе фиброгастроскопии получают фрагменты поражённых тканей методом биопсии, необходимые для проведения гистологического исследования. В качестве лабораторных исследований стоит выделить общий и биохимический анализ крови, иммуноферментный анализ, гистологическое исследование, полимеразную цепную реакцию.
Лечение аутоиммунного гастрита
Основываясь на результатах проведённых исследований и индивидуальных особенностях организма пациента, врач-гастроэнтеролог назначает максимально эффективное в конкретном случае лечение. Основным методом лечения аутоиммунного гастрита является консервативная терапия, включающая спазмолитики, обезболивающие препараты, средства, ускоряющие регенерацию клеток слизистой, лекарства, улучшающие перестальтику, и поливитаминные комплексы. В качестве сопутствующего медикаментозной терапии лечения необходимо указать диетотерапию и отдельные методы народной медицины. Применение способов лечения народной медицины требует обязательного согласования с лечащим врачом.
В качестве профилактических мероприятий следует порекомендовать правильное и регулярное питание, отказ от пагубных пристрастий и ведение здорового образа жизни.
Как вылечить гастрит : полезные новости на panoramamed.
 ru
ruГастрит – самое распространенное заболевание, которое диагностируется практически у каждого взрослого человека. Но это не значит, что оно безобидное, ведь гастрит гастриту рознь. Какие бывают гастриты и как их лечить, рассказывает гастроэнтеролог медцентра «Панорама Мед» Ольга Сапрыкина.
— Ольга Борисовна, гастрит опасен?
— Смотря о каком гастрите идет речь. Большинство людей знакомы с легкой формой острого гастрита – как правило, это простой катаральный гастрит, который возникает при погрешностях в питании — например, за обедом человек съел слишком много острой или грубой пищи, а потом у него появились боли и тяжесть в желудке. Другая причина возникновения катарального гастрита – пищевая инфекция. Однако все это быстро проходящие явления и, как правило, не вызывающие тяжелых последствий.
Хронические гастриты имеют другой характер и другую причину. В большинстве случаев это инфекция хеликобактер пилори, которая поражает слизистую желудка и вызывает воспаление и атрофию слизистой.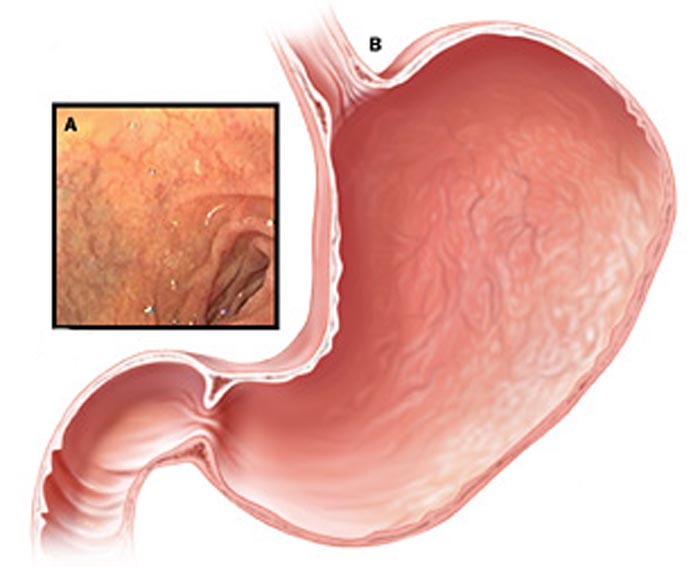 Поэтому такой гастрит называют атрофический. Лечится заболевание антибактериальными препаратами, если наличие хеликобактер пилори установлено. Определить инфекцию можно экспресс-тестомпри ФГДС, дыхательным уреазным хелик-тестом, путем определения антигена НР в кале и антител Ig G к НР в крови. Если гастрит не лечить, атрофия слизистой усиливается. А поскольку слизистая продуцирует все необходимые для пищеварения ферменты, то в результате гастрита снижается секреция и нарушается обмен веществ.
Поэтому такой гастрит называют атрофический. Лечится заболевание антибактериальными препаратами, если наличие хеликобактер пилори установлено. Определить инфекцию можно экспресс-тестомпри ФГДС, дыхательным уреазным хелик-тестом, путем определения антигена НР в кале и антител Ig G к НР в крови. Если гастрит не лечить, атрофия слизистой усиливается. А поскольку слизистая продуцирует все необходимые для пищеварения ферменты, то в результате гастрита снижается секреция и нарушается обмен веществ.
— А какое отношение к гастриту имеет кислотность желудка?
— Атрофический гастрит, как правило, сопровождается пониженной кислотностью желудочного сока, а если кислотность повышена, мы имеем дело с гиперацидном гастритом. Эти два вида гастрита характеризуются разными симптомами. Если атрофический гастрит может вызывать тяжесть в желудке, то гиперацидный – изжогу и отрыжку.
Кислотность влияет и на осложнения гастрита, если его не лечить. Повышенная кислотность может вызывать образование эрозии или язвы, а пониженная имеет риск возникновения рака.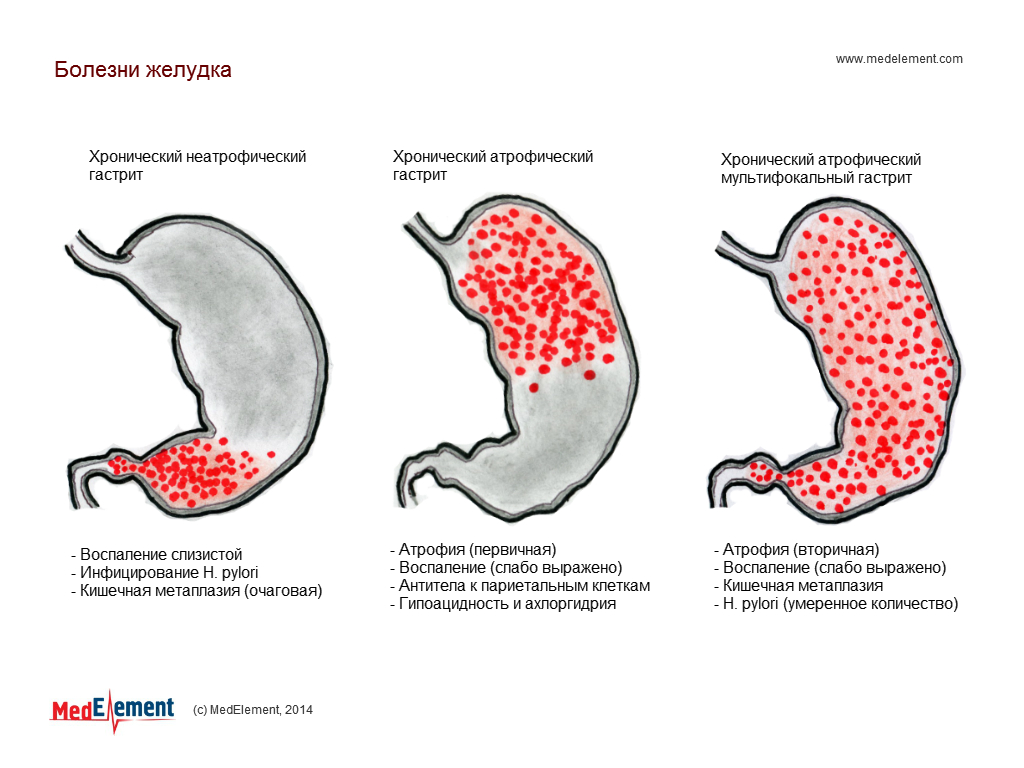
— Какие исследования позволяют определить характер гастрита?
— Состояние желудка определяется в процессе эндоскопического исследования, а кислотность — по экспресс-диагностики во время эндоскопии, а также по уровню пепсиногенов и гастрина в анализе крови. Причем при атрофическом гастрите необходим ежегодно делать эндоскопию.
— Можно ли вылечить атрофический гастрит?
— Атрофия гастрита бывает разной. У человека может быть поражена только часть слизистой стенки желудка, а может — весь желудок, либо слизистая покрыта мелкими очагами атрофии. Однако измененная слизистая уже не восстанавливается, поэтому лечение нацелено на поддержание состояния оставшейся здоровой ткани. Как правило, оно состоит в приеме таблетированных препаратов. Но еще большее значение имеет диета и здоровый образ жизни.
— Что можно есть при гастрите, а что — категорически запрещено?
— При простом остром гастрите в первый день показана строгая диета – чай и вода, во второй – жидкие супы и слизистые каши, а потом можно постепенно переходить к нормальной пище. Надо помнить, что при неправильном питании острый гастрит часто переходит в хронический.
Надо помнить, что при неправильном питании острый гастрит часто переходит в хронический.
При гиперацидном гастрите с повышенной кислотностью нельзя употреблять острого, жирного и соленого, крепких бульонов. Разрешаются только овощные бульоны на воде, а при атрофическом гастрите, наоборот, надо стимулировать пищеварение, поэтому разрешаются мясные некрепкие бульоны.
При любом гастрите пища должна быть химически, термически и механически щадящая. Это значит, что она должна быть измельченная, не горячая и не холодная (не более 60 градусов, не меньше 15 градусов), не кислая, не острая, не пряная и не соленая. Питаться надо в одно и то же время и не менее пяти-шести раз в день, то есть съедать за один присест небольшой объем пищи.
— Какие еще бывают гастриты?
— Есть еще несколько видов гастритов, вызывающих более сильные и неприятные симптомы и имеющих серьезные последствия. К ним относится некротический гастрит, который возникает при попадании в желудок кислот или щелочей, вызывающих острое поражение желудка. В таких случаях народные рекомендации вызвать рвоту, чтобы очистить желудок, могут быть опасными, поскольку так можно еще больше травмировать воспаленные стенки желудка и вызвать кровотечение. При химическом отравлении сразу вызывают скорую помощь, а уже в больнице врачи промоют желудок водой и выполнят другие лечебные мероприятия.
В таких случаях народные рекомендации вызвать рвоту, чтобы очистить желудок, могут быть опасными, поскольку так можно еще больше травмировать воспаленные стенки желудка и вызвать кровотечение. При химическом отравлении сразу вызывают скорую помощь, а уже в больнице врачи промоют желудок водой и выполнят другие лечебные мероприятия.
симптомы, причины, лечение, профилактика, осложнения
Причины
Существует две основных причины возникновения атрофического гастрита у ребёнка. В зависимости от них, выделяют две основных формы заболевания. В частности:
- Мультифокальный атрофический гастрит, вызванный патогенным микроорганизмом Нelicobacter pylori. Он проникает в слизистую желудка и сначала вызывает поверхностный гастрит хронического характера, который, в свою очередь, оказывает влияние на атрофию клеток слизистой. Такой тип патологии встречается наиболее часто у пациентов с атрофическим гастритом.
- Аутоимунный атрофический гастрит.
 Он возникает из-за образования антител, которые повреждают клетки слизистой желудка. Данный тип патологии встречается гораздо реже у пациентов с атрофическим гастритом, в соотношении примерно 1:10.
Он возникает из-за образования антител, которые повреждают клетки слизистой желудка. Данный тип патологии встречается гораздо реже у пациентов с атрофическим гастритом, в соотношении примерно 1:10.
В детском возрасте обычно преобладает поверхностный гастрит. Атрофический встречается гораздо реже и, как правило, с умеренной степенью атрофии. Кроме того, у детей не бывает отсутствия секреции желудочного сока, которая не восстанавливается с помощью медикаментов.
Предрасполагающими факторами для развития атрофического гастрита у детей являются:
- переутомление в школе или в спортивной секции;
- отсутствие нормального отдыха;
- генетические причины;
- заболевания, которые были перенесены ранее.
Симптомы
Как правило, клинические проявления атрофического гастрита у детей отсутствуют. Симптомы начинают проявляться только тогда, когда патология затрагивает всю поверхность желудка ребёнка. К ним относятся:
К ним относятся:
- симптомы, свойственные анемии, которые проявляются из-за дефицита витамина В12, фолиевой кислоты или железа в детском организме. Это постоянная слабость и сонливость, бледная кожа, боль во рту, нарушенная чувствительность конечностей;
- симптомы нарушенного пищеварения, в частности, отрыжка и изжога, тошнота и рвота, плохой аппетит, обильное слюнотечение, боли вверху живота, появление сероватого налёта на языке.
Также к симптомам атрофического гастрита у детей относится неприятный запах изо рта и диарея.
Диагностика атрофического гастрита у ребёнка
Атрофический гастрит у ребёнка диагностируется посредством различных методов. В первую очередь, врач осматривает пациента, узнаёт о симптомах заболевания, о том, как давно они появились. Также доктор беседует с родителями и выясняет, есть ли у ребёнка какие-либо заболевания хронического или наследственного характера, принимал ли он какие-либо препараты в течение долгого времени. После этого детям назначают лабораторную диагностику, в ходе которой проводят биохимический анализ крови, а также анализ кала и мочи, бактериологический посев для выявления хеликобактерии. При необходимости ребёнку могут быть назначены инструментальные методы диагностики. В частности, ФЭГДС, биопсия, рентгенография желудка, УЗИ брюшной полости и другие.
После этого детям назначают лабораторную диагностику, в ходе которой проводят биохимический анализ крови, а также анализ кала и мочи, бактериологический посев для выявления хеликобактерии. При необходимости ребёнку могут быть назначены инструментальные методы диагностики. В частности, ФЭГДС, биопсия, рентгенография желудка, УЗИ брюшной полости и другие.
Осложнения
Осложнением атрофического гастрита у детей может стать рак желудка. Отрицательные последствия заболевания могут отсутствовать, если его лечение начато своевременно.
Таким образом, при обнаружении симптомов атрофического гастрита детей нужно сразу же показывать врачу для проведения диагностики и назначения грамотного лечения заболевания.
Лечение
Что можете сделать вы
Если у ребёнка появились признаки атрофического гастрита, медлить нельзя.
Что делает врач
В первую очередь, доктор назначает ребёнку диетотерапию. Она представляет собой 5-6-разовое питание, причём небольшими порциями. В период обострения атрофического гастрита следует употреблять протёртые супы, нежирные бульоны, каши. По мере того, как воспаление уменьшается, диета становится более щадящей. Из рациона исключаются острые, жирные, жареные продукты, еда с консервантами, напитки с газом. Пища должна употребляться либо в отварном виде, либо тушёной или запечённой. Кушать нужно еду со средней температурой: чересчур горячие или чрезмерно холодные блюда запрещены. Пережёвывать продукты нужно тщательно, переедать или перекусывать на ходу запрещено.
Лечится атрофический гастрит у детей консервативными методами. Если симптомы отсутствуют, терапия не проводится.
В целом, в комплекс лечения заболевания входит:
- этиотропная терапия, которая устраняет причину развития патологии.
 В зависимости от фактора, спровоцировавшего гастрит, ребёнку прописывают антибиотики, ингибиторы протонной помпы, глкокортикоиды;
В зависимости от фактора, спровоцировавшего гастрит, ребёнку прописывают антибиотики, ингибиторы протонной помпы, глкокортикоиды; - патогенетическая терапия, которая направлена непосредственно на механизмы развития заболевания. Она включает в себя приём препаратов, восполняющих недостаток определённых веществ в организме ребёнка, а также средств, стимулирующих выработку соляной кислоты, прокинетиков, гастропротекторов и блокаторов болезненных ощущений.
Также ребёнку могут быть назначены физиотерапевтические процедуры, которые уменьшают симптоматику патологии, и лечение в бальнеологических санаториях. Оперативное вмешательство при данном типе гастрита, как правило, не требуется.
Профилактика
Чтобы предупредить развитие атрофического гастрита у ребёнка необходимо проводить ряд профилактических мероприятий. Главное, это приучить ребёнка правильно питаться. Сбалансированный рацион – лучшее средство, помогающее исключить возможное развитие гастрита. Питаться ребёнок должен часто, небольшими порциями. Важно, чтобы его пища была обогащена различными витаминами и полезными для организма элементами. Категорически запрещены перекусы на ходу, питание всухомятку, употребление чрезмерно горячей пищи.
Питаться ребёнок должен часто, небольшими порциями. Важно, чтобы его пища была обогащена различными витаминами и полезными для организма элементами. Категорически запрещены перекусы на ходу, питание всухомятку, употребление чрезмерно горячей пищи.
Также важно, чтобы ребёнок соблюдал правила гигиены. У него должна быть индивидуальная посуда, перед едой он должен мыть руки, так же как и после улицы или общественного туалета. Это поможет предотвратить заражение инфекцией, передающейся хеликобактерией.
Подросткам необходимо отказаться от курения и алкоголя. Эти вредные привычки являются одними из главных факторов, провоцирующих развитие гастрита.
И, конечно, важно, чтобы ребенок занимался спортом и был ограждён от стрессов. Физическое развитие и отсутствие стрессовых ситуаций положительно сказываются на здоровье детей.
Оцените материал:
спасибо, ваш голос принят
Также смотрят
Вооружайтесь знаниями и читайте полезную информативную статью о заболевании атрофический гастрит у детей. Ведь быть родителями – значит, изучать всё то, что поможет сохранять градус здоровья в семье на отметке «36,6».
Ведь быть родителями – значит, изучать всё то, что поможет сохранять градус здоровья в семье на отметке «36,6».
Узнайте, что может вызвать недуг , как его своевременно распознать. Найдите информацию о том, каковы признаки, по которым можно определить недомогание. И какие анализы помогут выявить болезнь и поставить верный диагноз.
В статье вы прочтёте всё о методах лечения такого заболевания, как атрофический гастрит у детей. Уточните, какой должна быть эффективная первая помощь. Чем лечить: выбрать лекарственные препараты или народные методы?
Также вы узнаете, чем может быть опасно несвоевременное лечение недуга атрофический гастрит у детей, и почему так важно избежать последствий. Всё о том, как предупредить атрофический гастрит у детей и не допустить осложнений.
А заботливые родители найдут на страницах сервиса полную информацию о симптомах заболевания атрофический гастрит у детей. Чем отличаются признаки болезни у детей в 1,2 и 3 года от проявлений недуга у деток в 4, 5, 6 и 7 лет? Как лучше лечить заболевание атрофический гастрит у детей?
Берегите здоровье близких и будьте в тонусе!
Нейроэндокринные опухоли желудка
Нейроэндокринные опухоли (НЭО) развиваются в клетках периферической нейроэндокринной системы, рассеянной в различных органах, и наблюдаются довольно редко [1]. Отмечена тенденция к значительному увеличению частоты встречаемости НЭО, что может быть связано, с одной стороны, с совершенствованием и широким внедрением эндоскопической диагностики, с другой — с повышением информированности клиницистов и патоморфологов. Исходя из вышеизложенного, обзор литературы, посвященный патогенезу, диагностике и лечению НЭО желудка (НЭОЖ), весьма актуален.
Отмечена тенденция к значительному увеличению частоты встречаемости НЭО, что может быть связано, с одной стороны, с совершенствованием и широким внедрением эндоскопической диагностики, с другой — с повышением информированности клиницистов и патоморфологов. Исходя из вышеизложенного, обзор литературы, посвященный патогенезу, диагностике и лечению НЭО желудка (НЭОЖ), весьма актуален.
Классификация НЭО по стадиям имеет практическое значение в прогнозировании и выборе лечебной тактики. Европейским обществом нейроэндокринных новообразований (ENETS) предложена классификация (2006), основанная на величине митотического индекса и Ki-67 — маркера НЭО [2]. В дальнейшем (2010) эти протоколы были поддержаны классификацией ВОЗ [3], согласно которой НЭО группируют следующим образом: НЭО G1, НЭО G2, нейроэндокринная карцинома (НЭК), смешанная адено-НЭК, а также гиперпластические и предопухолевые образования (табл.
Опухоли класса G3 по критериям ENETS соответствуют НЭК в классификации нейроэндокринных образований ВОЗ (2010).
ЭпидемиологияСреди всех первично выявленных НЭО 11—12% их локализуются в желудке. В последнее время прослеживается тенденция к увеличению доли НЭОЖ среди общего числа гастроинтестинальных НЭО [4—9]. Более чем 60-летние наблюдения позволяют предположить, что частота встречаемости НЭОЖ увеличилась с 0,3 до 1,8% среди всех злокачественных новообразований желудка, при этом у женщин европеоидной расы она возросла в 800 раз [8]. В некоторых наблюдениях отмечен 6—9-кратный рост встречаемости НЭОЖ за 1981—2000 гг. [10].
Эпидемиологические показатели НЭОЖ с 2000 по 2006 г. в Великобритании среди мужчин и женщин составили соответственно 0,16 и 0,15 на 100 000 человек, что по сравнению с показателями 1995 г.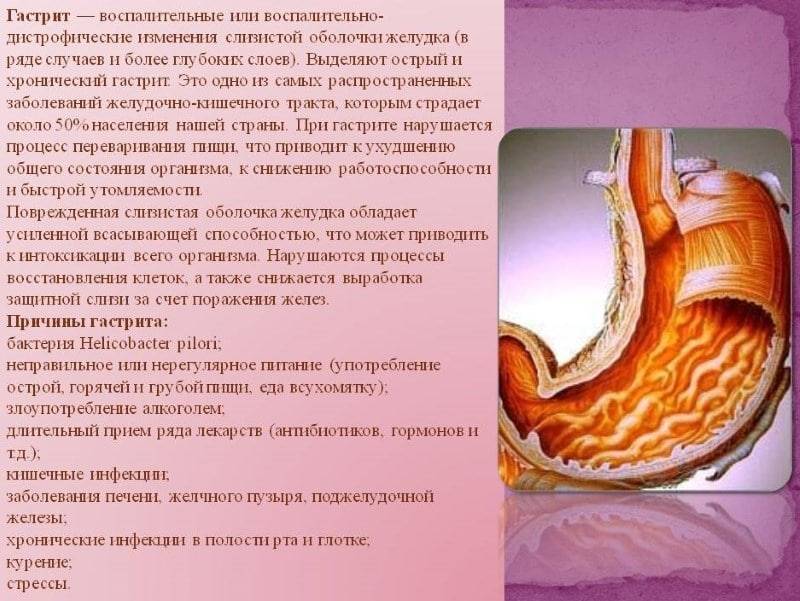 демонстрирует 23-кратное увеличение заболеваемости среди мужчин и 47-кратное — среди женщин [6]. Подобное увеличение частоты встречаемости НЭОЖ наблюдалось и в США: с 0,03 (1973—1977) до 0,33 (2003—2007) на 100 000 человек [11].
демонстрирует 23-кратное увеличение заболеваемости среди мужчин и 47-кратное — среди женщин [6]. Подобное увеличение частоты встречаемости НЭОЖ наблюдалось и в США: с 0,03 (1973—1977) до 0,33 (2003—2007) на 100 000 человек [11].
Данные японских исследователей также подтверждают увеличение встречаемости НЭО, локализованных в области передней кишки (желудка и двенадцатиперстной кишки) с 1,05 (2005) до 1,67 (2010) на 100 000 человек [7, 12]. Это связывают с ростом частоты развития хронического атрофического гастрита (ХАГ) на фоне систематического приема ингибиторов протонной помпы (ИПП) [13], с улучшением эндоскопической диагностики, стандартизацией морфологических исследований и возросшей публикационной активностью.
Гистологическая классификация и клиническая картинаНЭОЖ можно подразделить на хорошо и плохо дифференцированные. Хорошо дифференцированные НЭОЖ развиваются из энтерохромаффиноподобных (ЭХП) клеток тела и дна желудка, которые в норме продуцируют гистамин и участвуют в регуляции желудочной секреции.
В настоящее время НЭОЖ подразделяют на три типа [14]. В табл. 2 представлены Таблица 2. Характеристика нейроэндокринных опухолей желудка Примечание. ХАГ — хронический атрофический гастрит, МЭН — множественная эндокринная неоплазия, СЗЭ — синдром Золлингера—Эллисона. клинические особенности типов НЭОЖ [15—26].
Самым распространенным считают I тип — около 70—80% всех НЭОЖ, встречается преимущественно у женщин (60—70%) в возрасте старше 60—65 лет [27]. Распространенность поражения в популяции составляет 0,2 случая на 100 000 населения, при этом считают, что в последние годы она достигла 1,8 случая на 100 000 населения [10, 27].
Гистологически опухоли I типа состоят из ЭХП-клеток и обычно обнаруживаются у больных ХАГ типа А, включая аутоиммунный гастрит и атрофический гастрит, ассоциированный с Helicobacter pylori [23]. Известно, что ахлоргидрия, вызванная атрофией желез дна желудка при ХАГ, приводит к гипергастринемии и повышению внутрижелудочного рН с развитием гиперплазии G-клеток антрального отдела желудка. Гастрин взаимодействует с ССК2-рецепторами на мембране ЭХП-клеток и приводит к их гиперплазии. Перманентная стимуляция гастрином ССК2-рецепторов, а также протеинкиназы С и митоген-активируемой протеиновой киназы индуцирует постоянную экспрессию клеток mcl-1, синтезирующих белок, обладающий способностью подавлять апоптоз [28].
Гастрин взаимодействует с ССК2-рецепторами на мембране ЭХП-клеток и приводит к их гиперплазии. Перманентная стимуляция гастрином ССК2-рецепторов, а также протеинкиназы С и митоген-активируемой протеиновой киназы индуцирует постоянную экспрессию клеток mcl-1, синтезирующих белок, обладающий способностью подавлять апоптоз [28].
Предполагают, что прием ИПП, а также ваготомия вкупе с генетическими, диетическими, гормональными и бактериальными факторами играют роль ко-факторов в развитии гипергастринемии и НЭОЖ. Мутация Reg-гена, контролирующего в норме ответ ЭХП-клеток на гастрин, приводит к его бесконтрольному стимулирующему воздействию на ЭХП-клетки, их пролиферации и увеличению риска развития НЭОЖ I типа. В эксперименте показана вероятная роль инфекции Helicobacter pylori в развитии ХАГ, гипергастринемии и НЭОЖ [29—31].
При иммуногистохимическом окрашивании клетки НЭО определяются как положительные по наличию хромогранина A (CgA), синаптофизина, везикулярного моноаминного транспортера 2 и рецептора соматостатина 2А [32]. В частности, окрашивание CgA позволяет увидеть изменения в ЭХП-клетках по типу гиперплазии и дисплазии. Для гиперплазии характерно наличие более 6 рядов линейной гиперплазии на 1 мм. Дисплазия, присутствующая главным образом в микроинфильтративных образованиях, ассоциируется с повышенным риском НЭОЖ [33].
В частности, окрашивание CgA позволяет увидеть изменения в ЭХП-клетках по типу гиперплазии и дисплазии. Для гиперплазии характерно наличие более 6 рядов линейной гиперплазии на 1 мм. Дисплазия, присутствующая главным образом в микроинфильтративных образованиях, ассоциируется с повышенным риском НЭОЖ [33].
Как правило, опухоли I типа не злокачественные, часто множественные, размером менее 2 см. Локальное поражение наблюдается в 90—95%, а отдаленные метастазы — у 1—2% больных. Злокачественный потенциал напрямую зависит от размеров опухоли и глубины ее инвазии, но при этом мультицентричность напрямую не коррелирует с вероятностью появления метастазов. Выживаемость таких больных не отличается от сроков жизни в популяции людей соответствующего возраста [34—36]. При наличии метастазов 5-летняя выживаемость составляет обычно 50—60% и не превышает 75% [8]. В связи с этими особенностями развития опухоли возникает вопрос о допустимости локальных методов лечения при очевидном операционно-анестезиологическом риске.
НЭОЖ II типа встречается реже — в 5—6%, имеет промежуточный малигнизационный потенциал и может быть ассоциирована с синдромом МЭН I типа — 10—15% и синдромом Золлингера—Эллисона (СЗЭ) — около 1%. Приблизительно у 30% больных с этим типом опухоли обнаруживают метастазы. Если опухоль I типа локализуется, как правило, в теле и фундальном отделе желудка, то новообразования II типа могут встречаться и в антральном отделе [37]. Опухоли типа II, как и типа I, ассоциированы с гипергастринемией и развиваются из ЭХП-клеток.
НЭОЖ III типа — самый агрессивный тип, на долю которого приходится около 15—20%. Это спорадические опухоли, развитие которых не связано с желудочной секрецией и гиперплазией ЭХП-клеток. Отдаленные метастазы диагностируют у 50—100% больных. Эта опухоль обычно продуцирует 5-гидрокситриптофан и не связана с гипергастринемией [38, 39].
Технология микрочипов позволила выявить различия в экспрессии генов при различных вариантах опухоли. Так, из 270 исследованных генов статистически значимое различие установлено для мутаций CagA, MAGE — D2, MTAI, CCN2, что позволяет дифференцировать III и I типы.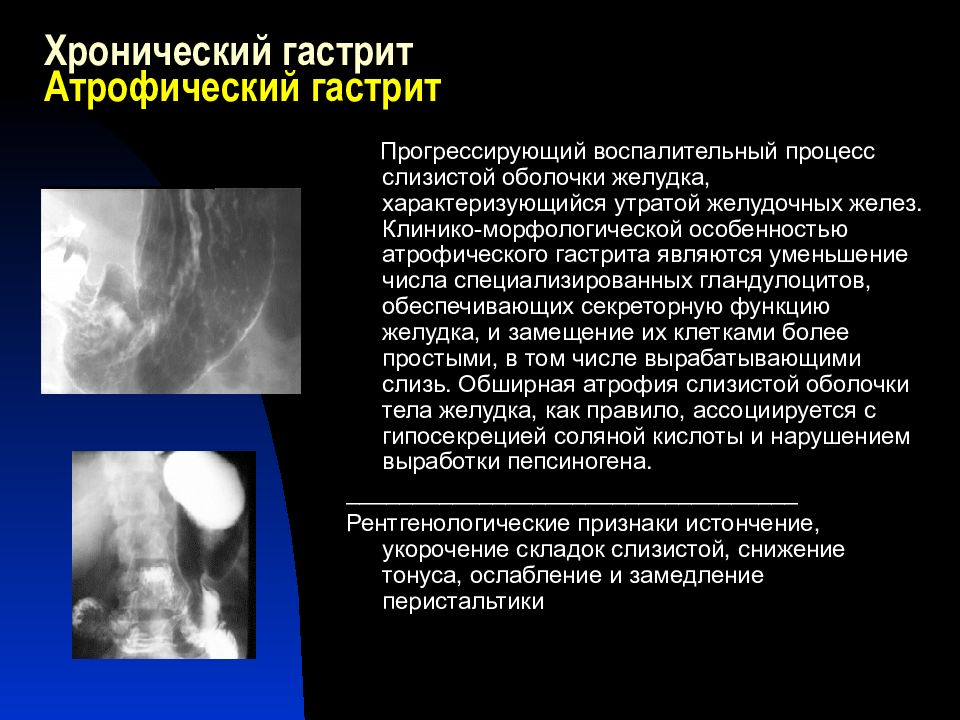 Доказано, что мутация гена супрессора опухоли р53 прямо коррелирует с НЭОЖ III типа и обусловливает стимуляцию пролиферации клеток [38, 39].
Доказано, что мутация гена супрессора опухоли р53 прямо коррелирует с НЭОЖ III типа и обусловливает стимуляцию пролиферации клеток [38, 39].
Большинство НЭОЖ I типа представляют собой небольшие, множественные опухоли, расположенные в теле или дне желудка и ограниченные слизистым или подслизистым слоем желудочной стенки. Поскольку большинство НЭОЖ I типа — это опухоли класса G1, метастатический риск является крайне низким, а прогноз — благоприятным. У пациентов с НЭОЖ I типа, ассоциированными с аутоиммунным гастритом, могут наблюдаться и другие аутоиммунные заболевания (сахарный диабет 1-го типа, аутоиммунный тиреоидит и первичный билиарный цирроз печени) или пернициозная анемия [24].
НЭОЖ I типа обычно протекают бессимптомно и случайно выявляются при скрининговом эндоскопическом исследовании верхних отделов желудочно-кишечного тракта. Опухоли I и II типа обнаруживают эндоскопически как полипы фундального отдела (часто множественные).
НЭОЖ II типа также небольшого размера, множественные и относительно доброкачественные.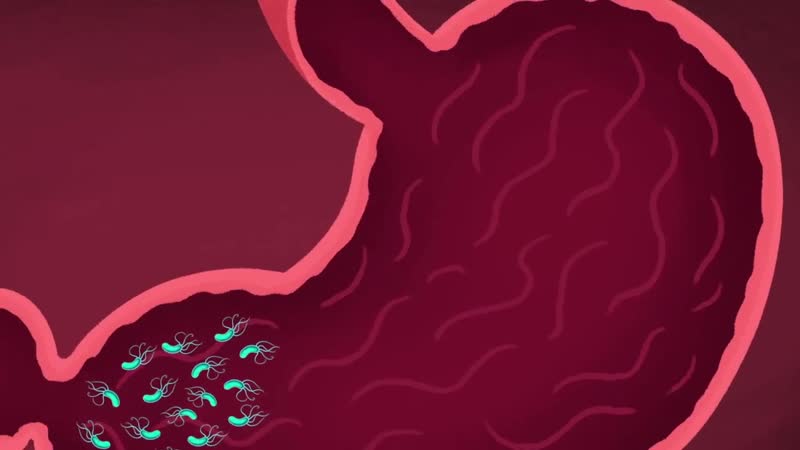 Однако в отличие от типа I они встречаются у мужчин и женщин одинаково часто. Приблизительно 30% НЭОЖ II типа на момент клинических проявлений имеют метастатическое распространение [19], а показатели выживаемости пациентов с такими НЭОЖ ниже, чем при типе I [40]. Течение большинства НЭОЖ II типа асимптомное, однако повышенная секреция желудочного сока, отмечаемая у больных с типом II, может привести к образованию пептической язвы, поэтому у таких пациентов могут наблюдаться клинические признаки язвенной болезни [41].
Однако в отличие от типа I они встречаются у мужчин и женщин одинаково часто. Приблизительно 30% НЭОЖ II типа на момент клинических проявлений имеют метастатическое распространение [19], а показатели выживаемости пациентов с такими НЭОЖ ниже, чем при типе I [40]. Течение большинства НЭОЖ II типа асимптомное, однако повышенная секреция желудочного сока, отмечаемая у больных с типом II, может привести к образованию пептической язвы, поэтому у таких пациентов могут наблюдаться клинические признаки язвенной болезни [41].
НЭОЖ III типа обычно изолированные, размером более 10 мм [25]. Тип III чаще всего относится к классу G3 с тенденцией к инфильтративному прорастанию в мышечный слой слизистой оболочки. Опухоли такого типа также демонстрируют более высокую способность к ангиоинвазивному росту. На момент диагностирования опухолей III типа, как правило, уже есть метастазы с поражением регионарных лимфатических узлов или печени. Опухоль III типа обычно функционально активна и может вырабатывать кинины, простагландины, соматостатин, инсулин, кортикотропин и нейрон-специфическую энолазу [2, 38, 42]. Опухоль III типа часто сопровождается анорексией, диспепсией (у 70%), пернициозной или железодефицитной анемией (у 60—70%), желудочно-кишечным кровотечением и потерей массы тела. Типичные проявления карциноидного синдрома, включая приливы крови, тахикардию и диарею, у больных с НЭОЖ встречаются редко (<1%) и почти всегда связаны с опухолями III типа, особенно если есть метастазы в печени [43]. Классический карциноидный синдром (синдром Бьёрка—Торнсона), обусловленный выбросом пептидов в системный кровоток, характерен именно для НЭОЖ III типа и обычно не связан ни с одним из остальных типов НЭОЖ.
Опухоль III типа часто сопровождается анорексией, диспепсией (у 70%), пернициозной или железодефицитной анемией (у 60—70%), желудочно-кишечным кровотечением и потерей массы тела. Типичные проявления карциноидного синдрома, включая приливы крови, тахикардию и диарею, у больных с НЭОЖ встречаются редко (<1%) и почти всегда связаны с опухолями III типа, особенно если есть метастазы в печени [43]. Классический карциноидный синдром (синдром Бьёрка—Торнсона), обусловленный выбросом пептидов в системный кровоток, характерен именно для НЭОЖ III типа и обычно не связан ни с одним из остальных типов НЭОЖ.
В диагностике НЭОЖ основное место занимает эндоскопия, в том числе в комбинации с ультрасонографией (эндосонография). Из дополнительных методов инструментального исследования применяют компьютерную томографию (КТ), магнитно-резонансную томографию (МРТ), позитронно-эмиссионную томографию (ПЭТ) с фтордеоксиглюкозой, сцинтиграфию с меченным радиоизотопом к рецепторам соматостатина (октреоскан) и др.
Необходимо учитывать эндоскопические особенности НЭОЖ. Опухоли I типа представляют собой либо небольшие (<10 мм) полиповидные выросты, либо, что наблюдают чаще, сглаженные полусферические подслизистые образования желтого или красного цвета [24]. Каждая опухоль визуализируется в виде полусферического красноватого полипа с участком истончения в центре, который виден при эндоскопии с источником белого света. Наличие очага истончения в центре указывает на субэпителиальный рост опухоли. Эндоскопия с высоким разрешением (ME) и технологией узкой спектральной визуализации (NBI) позволяет визуализировать кратероподобные структуры на поверхности опухоли. Поскольку НЭОЖ обычно покрыты нормальной слизистой, подобная детализация может не определяться при стандартной эндоскопии. Есть данные о том, что кратероподобные структуры могут отсутствовать в области центрального углубления, где вместо этого визуализируются черно-коричневые субэпителиальные сосуды с извитыми капиллярами [24, 44]. НЭОЖ III типа обычно являются изолированными новообразованиями, больших размеров и с признаками изъязвления, указывающими на более глубокую инвазию.
Эндосонография необходима для уточнения глубины инвазии опухоли диаметром 1 см и более и прицельной тонкоигольной биопсии с целью морфологической диагностики при подслизистой локализации. Она позволяет оценить степень прорастания опухоли и ее локализацию в толще слоев стенки желудка [45]. НЭОЖ обычно располагаются во втором (глубокий слизистый) или третьем (подслизистый) эхографических слоях и идентифицируются как гипоэхогенные интрамуральные структуры.
КТ или МРТ предоставляют дополнительную информацию относительно локального распространения и отдаленного метастазирования, а также помогают определить стадию опухоли. Важно отметить, что КТ выявляет полиповидные опухоли слизистой оболочки, но не визуализирует подслизистое новообразование. Селективная ангиография ветвей чревного ствола и верхней брыжеечной артерии обнаруживает вновь образованные опухолевые сосуды, но ее лучше использовать для диагностики инвазии опухоли, а не для поиска первичной локализации поражения. Забор крови в разных отделах сосудистого русла в ходе ангиографии с последующим исследованием содержания гастрина может потребоваться для определения первичной локализации опухоли (желудок, поджелудочная железа или двенадцатиперстная кишка) при отсутствии результата других методов лучевой диагностики. Диагностическая значимость ПЭТ с фтордеоксиглюкозой у больных НЭОЖ остается неясной [46]. Экспрессия соматостатиновых рецепторов (в 90% наблюдений) в клетках НЭО позволяет с успехом проводить их сцинтиграфическую диагностику по сравнению с рутинной ПЭТ, которая имеет низкую чувствительность. Октреоскан рекомендуется для выявления метастазов в печени, костях и лимфатических узлах [47]. В то же время в ходе последних исследований по диагностике НОЭЖ с помощью ПЭТ с DOTA-конъюгированным аналогом соматостатина, меченным изотопом 68Ga (68Ga-DOTATOC, 68Ga-DOTANOC и 68Ga-DOTATATE), получены многообещающие результаты с более высокой частотой выявления опухолей при более низких финансовых затратах по сравнению с октреосканом, особенно при выявлении небольших НЭО [48, 49].
Забор крови в разных отделах сосудистого русла в ходе ангиографии с последующим исследованием содержания гастрина может потребоваться для определения первичной локализации опухоли (желудок, поджелудочная железа или двенадцатиперстная кишка) при отсутствии результата других методов лучевой диагностики. Диагностическая значимость ПЭТ с фтордеоксиглюкозой у больных НЭОЖ остается неясной [46]. Экспрессия соматостатиновых рецепторов (в 90% наблюдений) в клетках НЭО позволяет с успехом проводить их сцинтиграфическую диагностику по сравнению с рутинной ПЭТ, которая имеет низкую чувствительность. Октреоскан рекомендуется для выявления метастазов в печени, костях и лимфатических узлах [47]. В то же время в ходе последних исследований по диагностике НОЭЖ с помощью ПЭТ с DOTA-конъюгированным аналогом соматостатина, меченным изотопом 68Ga (68Ga-DOTATOC, 68Ga-DOTANOC и 68Ga-DOTATATE), получены многообещающие результаты с более высокой частотой выявления опухолей при более низких финансовых затратах по сравнению с октреосканом, особенно при выявлении небольших НЭО [48, 49]. Однако эти публикации единичные, и требуется дальнейшее исследование.
Однако эти публикации единичные, и требуется дальнейшее исследование.
В диагностике НЭОЖ немаловажное значение имеют лабораторные исследования. Для оценки эффективности лечения и диагностики вероятного рецидива рекомендуют определять уровни 5-гидроксииндолуксусной кислоты (5-ОИУК) и CgA. При бессимптомном течении НЭОЖ после радикального лечения обязательное ежегодное исследование уровня CgA является частью мониторинга состояния здоровья больного. При выявлении функционально активной опухоли исследуют уровни и 5-ОИУК, и CgA. Однако лечение больного блокатором соматостатиновых рецепторов закономерно снижает уровень CgA и отражает, скорее, снижение продукции гормонов, чем уменьшение массива опухоли, что объясняет появление возможного ложноположительного результата [50].
Карциноидную опухоль, как тип НЭО, характеризует способность синтезировать 5-гидрокситриптамин из поступающего с пищей триптофана. Обычно 99% триптофана конвертируется в никотиновую кислоту, минимальный остаток — в 5-гидрокситриптамин. Однако у больного с карциноидной опухолью его продуцируется значительно больше, что приводит к увеличению продукции и конечного продукта метаболизма 5-ОИУК. Измерение содержания этого вещества в суточной пробе мочи — высокоспецифичный (100%), но малочувствительный (75%) тест для диагностики дифференцированной функционирующей НЭО [51]. Поэтому его используют прежде всего для выявления серотонин-продуцирующей НЭО и для мониторирования эффективности лечения больных с карциноидным синдромом.
Однако у больного с карциноидной опухолью его продуцируется значительно больше, что приводит к увеличению продукции и конечного продукта метаболизма 5-ОИУК. Измерение содержания этого вещества в суточной пробе мочи — высокоспецифичный (100%), но малочувствительный (75%) тест для диагностики дифференцированной функционирующей НЭО [51]. Поэтому его используют прежде всего для выявления серотонин-продуцирующей НЭО и для мониторирования эффективности лечения больных с карциноидным синдромом.
У больных нефункционирующей опухолью уровень 5-ОИУК не повышается. При НЭОЖ уровень 5-ОИУК в моче чаще остается нормальным, по сравнению с ее содержанием у больных с опухолью в поджелудочной железе. Нормальный уровень 5-ОИУК прогностически более благоприятен, чем повышенный [52]. Ложноположительному результату способствует (из-за повышения уровня 5-ОИУК) прием некоторых фруктов (бананы, авокадо) и медикаментов (леводопа, аспирин, фенотиазины).
Концентрация CgA в крови возрастает у 80% больных НЭО и коррелирует с пулом клеток опухоли.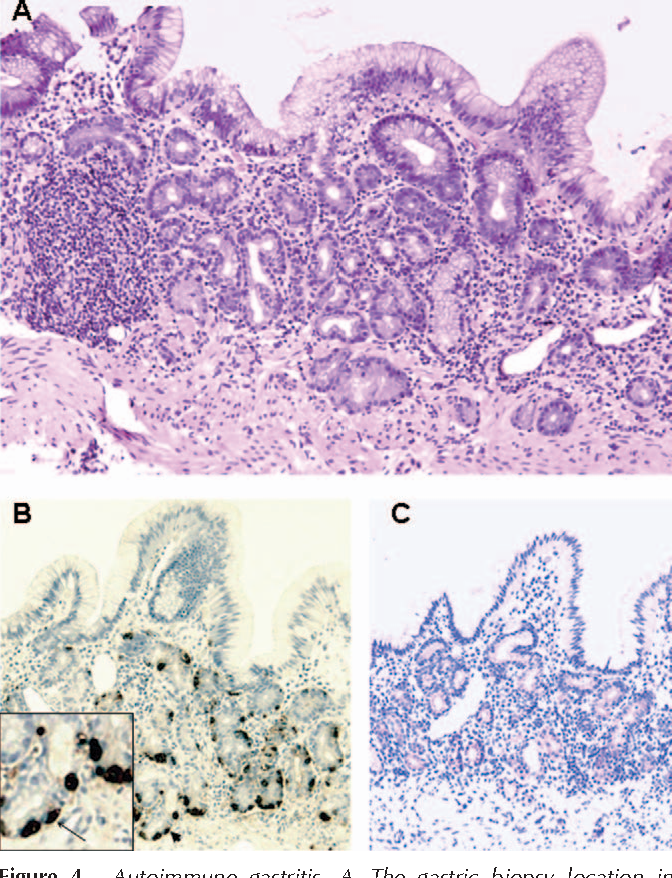 В отличие от 5-ОИУК этот белок обнаруживают и при нефункционирующей опухоли. Диагностика НЭО с помощью CgA имеет специфичность 98—99% и чувствительность 60—65%. Ложноотрицательные результаты зарегистрированы при почечной недостаточности, ХАГ типа А, на фоне лечения ИПП. Не следует применять этот тест и при поиске НЭО у больных с СЗЭ [53, 54].
В отличие от 5-ОИУК этот белок обнаруживают и при нефункционирующей опухоли. Диагностика НЭО с помощью CgA имеет специфичность 98—99% и чувствительность 60—65%. Ложноотрицательные результаты зарегистрированы при почечной недостаточности, ХАГ типа А, на фоне лечения ИПП. Не следует применять этот тест и при поиске НЭО у больных с СЗЭ [53, 54].
Измерение содержания базального гастрина в крови позволяет дифференцировать I и II типы НЭОЖ от III типа. Биопсия слизистой оболочки желудка при ее атрофии необходима для диагностики аутоиммунного гастрита. Гипергастринемия при отсутствии ХАГ позволяет заподозрить синдром множественных эндокринных неоплазий I типа (МЭН-I) в сочетании с СЗЭ. Для него характерны низкий внутрижелудочный рН (менее 2) и гипергастринемия (более 1000 пг/мл). Тест с секретином проводят для исключения гастриномы: внутривенное введение секретина провоцирует пародоксальный выброс гастрина при гастриноме, но в норме снижает его концентрацию в крови. Содержание гистамина в моче повышено у 30% больных с НЭОЖ I типа и у 80% больных с НЭОЖ III типа.
Лечение НЭОЖ проводят в зависимости от типа опухоли, ее размеров и наличия факторов риска, таких как инвазия в мышечную пластинку, степень пролиферации клеток опухоли и наличие метастазирования. При I типе возможно миниинвазивное лечение. Критериями его исключения являются размеры опухоли более 2 см, выраженная множественность и экспрессия маркера пролиферации Ki-67 более 2%. При возможности выполняют антрумэктомию с анастомозом по Roux (открытым или лапароскопическим доступом). При небольшой (менее 1 см) доброкачественной опухоли I или II типа или отсутствии глубокой инвазии допустимы эндоскопическая абляция, полипэктомия или резекция слизистой оболочки с обязательным регулярным контролем в отдаленные сроки каждые 6 мес [55].
При опухоли диаметром более 1 см возможен рецидив после экономного лечения (в среднем за 8 мес у 60—65% больных, а повторный рецидив — у 65—70% больных). Рецидив опухоли I типа после миниинвазивного лечения патогенетически обоснован, поскольку сохраняют свое значение и гиперплазия G-клеток антрального отдела желудка, и гипергастринемия. Его возникновение допускают и ожидают, обследуя больного каждые 6 мес, но не страшатся из-за доброкачественного потенциала опухоли и борются с ним повторной эндоскопической манипуляцией.
Его возникновение допускают и ожидают, обследуя больного каждые 6 мес, но не страшатся из-за доброкачественного потенциала опухоли и борются с ним повторной эндоскопической манипуляцией.
В то же время при наличии 5 опухолей и более, диаметре хотя бы одной из них более 2 см и индексе пролиферации более 2% или при повторном рецидиве после эндоскопического лечения выполняют антрумэктомию с целью устранения источника продукции гастрина. Резидуальные опухоли после такой операции чаще всего регрессируют. Для того чтобы убедиться в чувствительности клеток опухоли к гастрину и исключить другие факторы стимуляции ее роста, перед операцией используют тест с октреотидом. В случае рецидива опухоли после экономной резекции желудка следует выполнить экстирпацию его культи [34, 56].
При НЭОЖ I типа размером менее 20 мм, без признаков инвазивного роста в мышечную пластинку и при отсутствии метастазов независимо от количества образований в протоколах Национальной сети многопрофильных онкологических учреждений (NCCN) рекомендованы простое наблюдение или эндоскопическая резекция (ЭР) [57]. Хирургическая резекция или ЭР возможны при образованиях размером более 20 мм, единичных или множественных. В то же время, согласно протоколам ENETS, рекомендовано выполнять ЭР при НЭОЖ I типа, а возможность хирургической резекции рассматривать только тогда, когда опухоль вышла за пределы подслизистого слоя, если поражен лимфатический узел или есть отдаленный метастаз. Хирургическая резекция также рекомендована при низкодифференцированных новообразованиях [47].
Хирургическая резекция или ЭР возможны при образованиях размером более 20 мм, единичных или множественных. В то же время, согласно протоколам ENETS, рекомендовано выполнять ЭР при НЭОЖ I типа, а возможность хирургической резекции рассматривать только тогда, когда опухоль вышла за пределы подслизистого слоя, если поражен лимфатический узел или есть отдаленный метастаз. Хирургическая резекция также рекомендована при низкодифференцированных новообразованиях [47].
Ранее ЭР слизистой оболочки была рекомендована при НЭОЖ I типа с ограниченной локализацией. Однако в связи с тем, что опухоль I типа часто прорастает в подслизистый слой, радикальное удаление при помощи петли или в ходе стандартной ЭР слизистой оболочки представляется затруднительным. Эндоскопическая подслизистая диссекция эффективна при удалении подслизистых опухолей, включая опухоли I типа. В исследованиях приведены превосходные результаты радикального удаления НЭОЖ при помощи эндоскопической подслизистой диссекциии по сравнению с ЭР слизистой оболочки [58, 59].
Сообщается об отсутствии летальных исходов среди пациентов с НЭОЖ I типа, находившихся под эндоскопическим контролем без лечения [22, 60, 61]. Поэтому эндоскопический контроль — разумное решение для определенных больных с НЭОЖ I типа, например для пожилых пациентов с опухолями малых размеров или тяжелыми сопутствующими заболеваниями. В [52] приводятся данные о 4 пациентах с НЭОЖ I типа небольшого размера (<1 см), которые осложнились капиллярной инвазией в лимфатические (2 случая) и венозные (2 случая) капилляры. Таким образом, решение об эндоскопическом наблюдении без лечения необходимо принимать после тщательного анализа.
Резекция антрального отдела желудка является одним из вариантов хирургического лечения рецидивирующей НЭОЖ I типа. Антрумэктомия снижает проявления гипергастринемии G-клеток, приводящей к гипертрофии ЭХП-клеток. Однако вмешательство может оказаться неэффективным с точки зрения профилактики рецидива или метастазирования [35]. Кроме того, оно является более инвазивным и связано с повышенными рисками осложнений [62]. Вместе с тем пациенты после антрумэктомии имеют более низкую степень риска рецидива и нуждаются в меньшем количестве контрольных ЭГДС по сравнению с больными после ЭР [63].
Вместе с тем пациенты после антрумэктомии имеют более низкую степень риска рецидива и нуждаются в меньшем количестве контрольных ЭГДС по сравнению с больными после ЭР [63].
Лапароскопическая антрумэктомия — малоинвазивная альтернатива хирургического лечения при НЭОЖ I типа [63, 64]. Поэтому в случаях рецидива или персистирования НЭОЖ после ЭР или локальной резекции необходимо выполнять антрумэктомию или субтотальную резекцию желудка с лимфодиссекцией.
Аналоги соматостатина, которые ингибируют желудочную секрецию G-клеток и уменьшают гиперплазию ЭХП-клеток, эффективно сокращают количество и размеры НЭОЖ I и II типов [65—68]. Однако регулярный прием аналогов соматостатина не рекомендован из-за краткосрочного эффекта, рецидива после отмены терапии [69] и высоких затрат на лечение. По этим причинам терапию аналогами соматостатина следует проводить только у пациентов с рецидивирующими или множественными мультифокальными НЭОЖ I типа [70]. По последним данным, прием с перерывами аналогов соматостатина у пациентов с НЭОЖ I типа, которым не производили ЭР, может быть безопасным и эффективным методом лечения [71].
Нетазепид (YF476) — мощный антагонист гастрин/холецистокинин В-рецепторов, подавляет выработку желудочного сока и снижает сывороточные уровни CgA независимо от размеров и числа НЭОЖ I типа [72, 73]. Это позволяет считать нетазепид потенциально применимым препаратом для лечения подобных опухолей. Однако уровни мРНК CgA восстанавливаются до исходных значений после прекращения его приема [73]. Таким образом, долгосрочное применение нетазепида в контексте НЭОЖ I типа нуждается в дальнейшей оценке.
При гастриноме желудка (опухоль II типа) рекомендуют прибегать к трансиллюминации двенадцатиперстной кишки и дуоденотомии, поскольку именно там может находиться вторая опухоль диаметром менее 1 см [55]. Такую опухоль удаляют по принципу энуклеации или локальной резекции. Эндоскопическое удаление дуоденальной гастриномы размером более 1 см считают неприемлемым, поскольку она в 50% случаев сочетается с локорегионарными метастазами в лимфатические узлы, для нее характерна мультифокальность поражения, в том числе с аденоматозом поджелудочной железы при синдроме МЭН-I [56]. Поэтому при гастриноме двенадцатиперстной кишки размером более 1 см самым надежным способом лечения является панкреатодуоденальная резекция [74, 75].
Поэтому при гастриноме двенадцатиперстной кишки размером более 1 см самым надежным способом лечения является панкреатодуоденальная резекция [74, 75].
Согласно рекомендациям NCCN, лечение НЭОЖ типов II и III практически одинаково [57]. Между тем в протоколах ENETS четко обозначено, что из-за более высоких рисков метастазирования по сравнению с I типом при НЭОЖ II типа показана хирургическая резекция [47]. Кроме того, несмотря на то что частота встречаемости различных гистологических вариантов гиперплазии ЭХП-клеток (диффузная, линейная, микроузловая) в околоопухолевой слизистой оболочке желудка у пациентов с МЭН-I-ассоциированной и спорадической гастриномой приблизительно равна, дисплазия ЭХП-клеток и нейроэндокринные опухоли из ЭХП-клеток диагностированы только у больных с МЭН-I [76]. Резекцию сопутствующей гастриномы следует выполнять в максимально возможном радикальном объеме. Для пациентов с клиническими проявлениями НЭОЖ II типа терапия аналогами соматостатина часто является вполне достаточной [57].
При НЭОЖ III типа, особенно при распространении опухоли на подслизистый слой, показана радикальная субтотальная резекция желудка (или гастрэктомия) с лимфодиссекцией (как при аденокарциноме) [77].
Согласно протоколам ENETS, НЭОЖ III типа следует вести так же, как аденокарциному желудка. Поэтому рекомендованы хирургическая резекция (субтотальная или гастрэктомия) с лимфодиссекцией и химиотерапия [47]. То же предписывают и протоколы NCCN: радикальная субтотальная резекция желудка с иссечением перигастральных лимфатических узлов при локализованном III типе НЭОЖ [57]. При этом NCCN указывает, что эндоскопическая или клиновидная резекция может рассматриваться в качестве варианта лечения при НЭОЖ III типа менее 2 см. В [25] предлагается небольшие высокодифференцированные (G1) опухоли III типа лечить консервативно при помощи ЭР. В [78] также утверждается, что если опухоль меньше 2 см и ограничена подслизистым слоем без прорастания лимфатических сосудов, эндоскопическое лечение нужно рассматривать в качестве терапии первого выбора.
Мы наблюдали 3 пациентов с НЭОЖ III типа без клинических проявлений карциноидного синдрома. Двум из них с дистальной локализацией опухоли выполнили дистальную субтотальную резекцию (R0) желудка с D2-лимфодиссекцией, 1 больному с локализацией опухоли в теле желудка и стадией заболевания T3N1M0 произвели гастрэктомию (R0) с D2-лимфодиссекцией. Больных после субтотальной резекции наблюдали в течение 5 лет. Больной после гастрэктомии скончался через 2 года после операции от прогрессирования основного заболевания.
Альтернативы хирургического леченияАльтернативой хирургическим вмешательствам при неметастазирующей опухоли I или II типа может быть лечение аналогами соматостатина (октреотид или препарат пролонгированного действия «Ланкреотид» (соматулин). Продемонстрирована их эффективность при лечении множественных (более 5) высокодифференцированных образований диаметром менее 1 см в теле и фундальном отделе желудка. Однако гормонотерапия не гарантирует успех и не всегда приводит к снижению уровня гастрина, поэтому ее применяют у больных с высоким риском хирургического вмешательства. При НЭОЖ III типа методом выбора является только хирургическое лечение [65, 67, 69, 79].
Однако гормонотерапия не гарантирует успех и не всегда приводит к снижению уровня гастрина, поэтому ее применяют у больных с высоким риском хирургического вмешательства. При НЭОЖ III типа методом выбора является только хирургическое лечение [65, 67, 69, 79].
Для симптоматического лечения IV стадии НЭОЖ с успехом применяют синтетические аналоги соматостатина: они купируют ощущение «приливов» у 70%, диарею у 60% больных с карциноидным синдромом. При метастазах НЭО в печень возможны циторедуктивные операции. Так, обширная резекция печени увеличивает 5-летнюю выживаемость до 76—81% против 20—30% при отказе от операции.
К хирургическому лечению не прибегают при билобарной локализации метастазов, печеночной недостаточности и метастазах в другие (кроме печени) органы. Очень редко удаляют одновременно и первичную опухоль, и ее метастазы. Паллиативная хирургия осложнений НЭО тонкой кишки увеличивает медиану выживаемости почти в 2 раза (с 4 лет до 7,4 года). Экстраполяция этих данных для НЭОЖ возможна, но не зеркальна, так как биологические характеристики опухоли, по-видимому, различаются [80].
Эмболизацию ветвей печеночной артерии выполняют у больных в случае отказа от хирургического лечения. Клинический ответ наблюдается в 80% случаев продолжительностью от 4 до 20 мес. Небольшие немногочисленные метастазы в печень можно редуцировать радиочастотной абляцией или криоабляцией чрескожным или лапароскопическим доступом, которые следует сочетать с обязательным хирургическим удалением первичного очага [81].
При отсутствии ответа на гормонотерапию у больных с НЭОЖ III типа показана химиотерапия. Однако НЭО характеризуются низкой или умеренной чувствительностью к химиопрепаратам, поэтому стандартных схем пока не существует. Чаще всего используют комбинацию стрептозотоцина, 5-фторурацила, доксирубицина или циклофосфамида. Только у 1/3 таких больных зарегистрирован положительный эффект — медиана выживаемости не превысила 11 мес.
При низкодифференцированной опухоли возможно назначение этопозида в сочетании с цисплатином. Терапия октреотидом, дополненная введением α-интерферона, увеличивает вероятность биологического ответа на лечение до 50%, но регрессия опухоли и в этом случае наблюдается лишь в 10—20% случаев [82, 83].
Достижение прогресса в лечении связывают с вероятным использованием таргетной терапии: бевацизумаба (ингибирование рецепторов фактора роста эндотелия), иматиниба или сунитиниба (ИПП), эверолимуса (ингибитор пролиферативного сигнала). Так, эверолимус увеличивает медиану выживаемости без прогрессирования заболевания до 11 мес (по сравнению с 4,6 мес при назначении плацебо) и демонстрирует 65% снижение риска прогрессирования заболевания [84]. Дальнейшие исследования должны указать их место в адъювантной или неоадъювантной терапии НЭОЖ (самостоятельно или в комбинации с химиопрепаратами).
Эффективность лучевой терапии аналогами соматостатина, меченными источником β-частиц Y90 или Lu177, может достигать 9—30%. Так, в группе из 310 больных НЭО у 2% достигнут полный клинический эффект, а у 28% — частичный с медианой выживаемости без прогрессирования заболевания 40 мес. Однако самые лучшие результаты установлены в группе больных с функционирующей НЭО поджелудочной железы, но не желудка [85].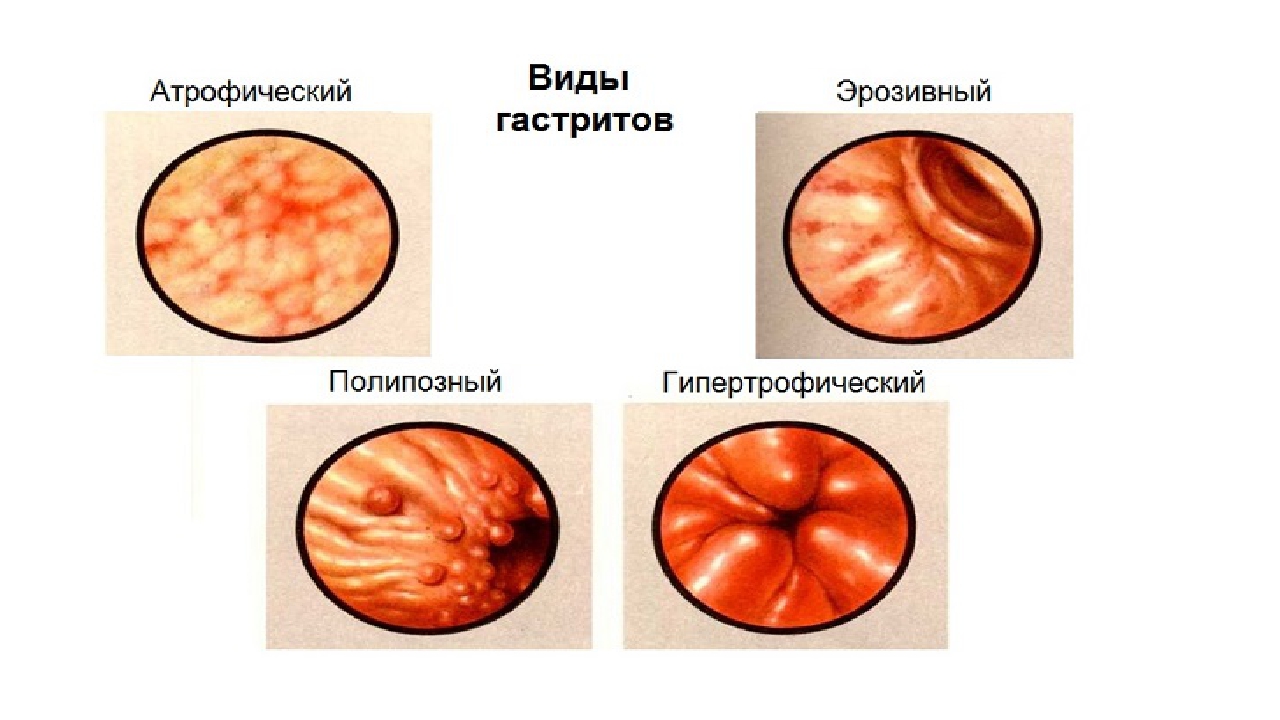
Программы контрольного обследования составляют в зависимости от типа и размеров опухоли, характера проведенного лечения, наличия рецидива. Контрольное обследование включает сбор анамнеза, осмотр, инструментальные исследования: ЭГДС, по показанию — КТ и МРТ в зависимости от клинических проявлений.
Прогноз при НЭОЖ зависит от ее локализации, гистологического строения и стадии заболевания. Высокий риск рецидива наблюдается при размере опухоли более 2 см, метастазах в лимфатические узлы или индексе пролиферации более 2%. Таким пациентам необходимо каждые 3—6 мес исследовать уровень 5-ОИУК и CgA, ежегодно проводить КТ и сцинтиграфию аналогом соматостатина с метайодбензилгуанидином, меченным слаборадиоактивным I123.
При опухоли I типа весь комплекс исследований повторяют 1 раз в 2 года, при опухоли II типа — ежегодно. В ходе ЭГДС необходима биопсия слизистой оболочки в зоне фонового ХАГ (для исключения развития аденокарциномы). Уровень гастрина исследуют у больных опухолью I и II типа.
В ходе ЭГДС необходима биопсия слизистой оболочки в зоне фонового ХАГ (для исключения развития аденокарциномы). Уровень гастрина исследуют у больных опухолью I и II типа.
Больным с высокодифференцированной опухолью III типа показана радикальная операция. В послеоперационном периоде проводят сцинтиграфию и исследование уровня CgA каждые 6 мес в течение 2 лет, а затем ежегодно в течение 3 лет. При метастазах опухоли контроль эффективности лечения осуществляют каждые 6 мес.
При опухоли I типа, как правило, указывают на 100% 5-летнюю выживаемость и крайне редкие летальные исходы, при опухоли II типа выживаемость составляет 60—75%, отражает уровень смертности при синдроме МЭН-I и более высокий потенциал малигнизации. При НЭОЖ III типа после радикального хирургического лечения 5-летняя выживаемость достигает 75%, а при злокачественной гастриноме IV стадии не превышает 20—38% [86].
Согласно рекомендациям NCCN [57], пациенты с небольшими (<20 мм) НЭОЖ I и II типов должны проходить контрольное обследование каждые 6—12 мес после лечения в течение первых 3 лет, включая сбор анамнеза, осмотр и ЭГДС.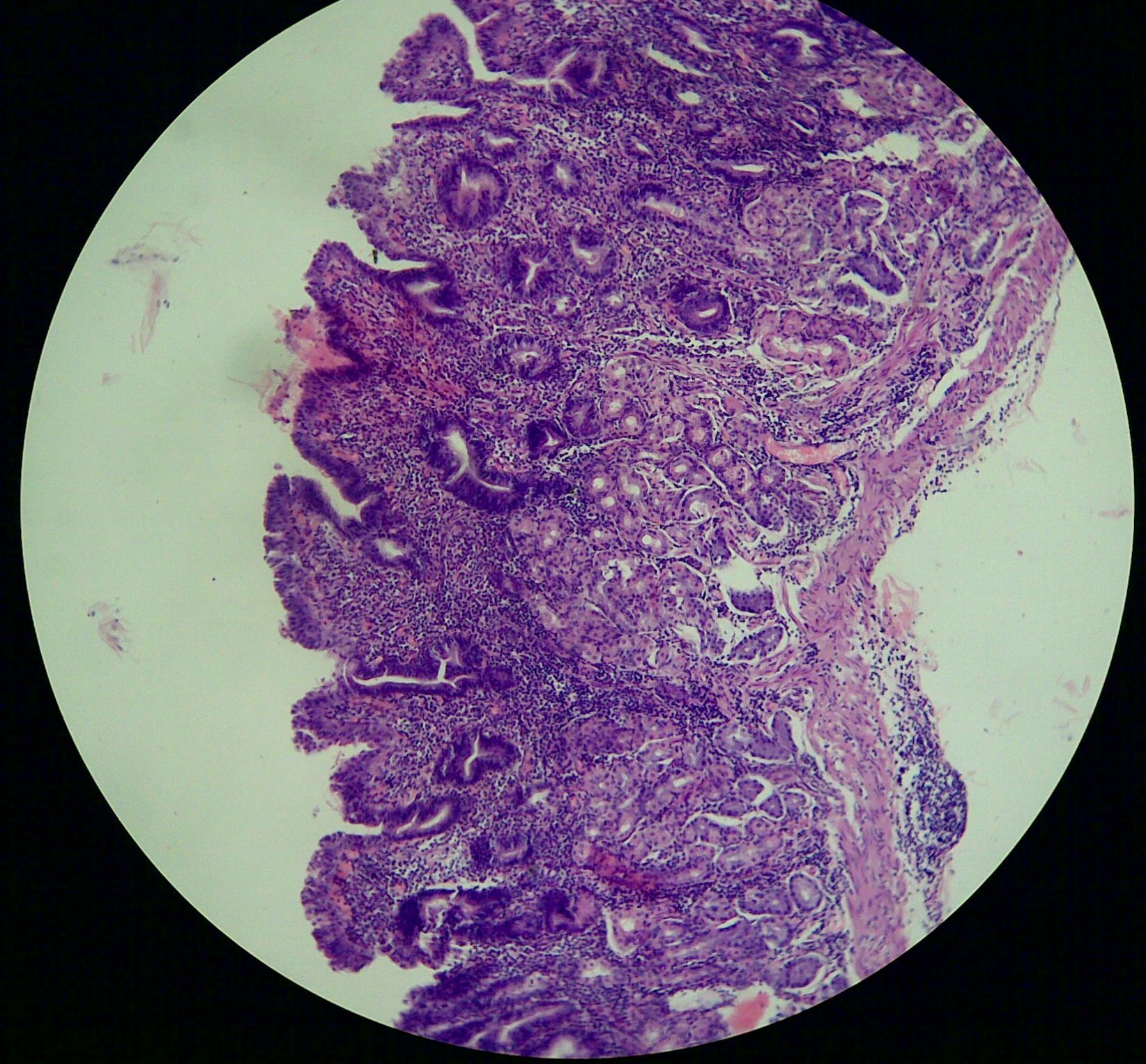 По истечении 3 лет ЭГДС можно выполнять ежегодно. Пациенты с НЭОЖ III типа или НЭОЖ типа I и II больших размеров (>20 мм) должны обследоваться каждые 3—12 мес после резекции и каждые 6—12 мес в дальнейшем.
По истечении 3 лет ЭГДС можно выполнять ежегодно. Пациенты с НЭОЖ III типа или НЭОЖ типа I и II больших размеров (>20 мм) должны обследоваться каждые 3—12 мес после резекции и каждые 6—12 мес в дальнейшем.
ENETS [47] рекомендует эндоскопический контроль пациентам с рецидивирующими НЭОЖ I типа каждые 12 мес, пациентам без рецидива каждые 24 мес. Ежегодная ЭГДС рекомендована больным с НЭОЖ II типа. Дальнейшее обследование пациентов с НЭОЖ III типа, перенесших гастрэктомию, проводят так же, как и после аналогичной операции при аденокарциноме желудка.
Таким образом, НЭОЖ представлены широким спектром новообразований, включающих и очень медленно прогрессирующие, и рано метастазирующие. Наблюдается значительное увеличение частоты встречаемости НЭОЖ. В соответствии с гистологическими критериями НЭОЖ делятся на 3 типа. Лечение каждого больного должно быть строго индивидуальным и проводиться командой специалистов разного профиля. При выборе способа лечения НЭОЖ следует исходить из типа опухоли, ее гистологических характеристик, локализации и степени выраженности местной инвазии, а также наличия метастазов.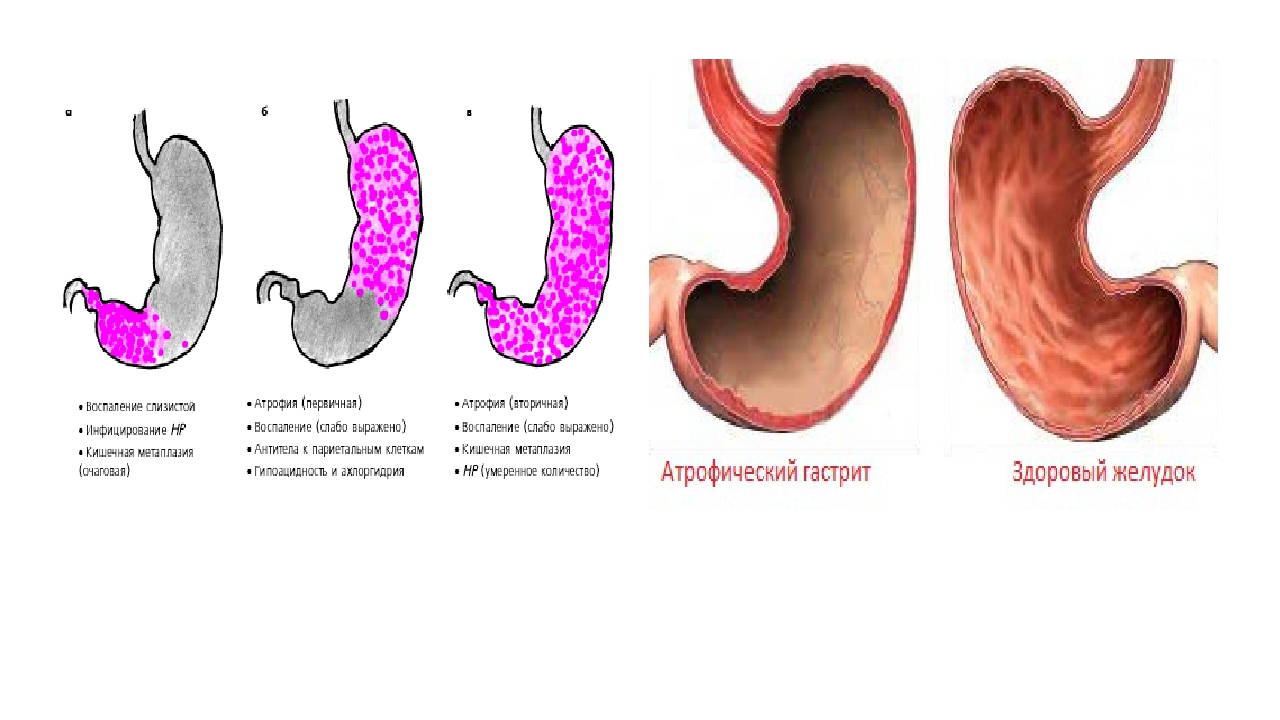 Личный опыт большинства хирургов ограничен небольшой группой больных, поэтому для выбора оптимального лечения необходимо опираться на результаты опубликованных исследований. Для определения оптимального способа диагностики и лечения НЭОЖ требуются дальнейшие исследования.
Личный опыт большинства хирургов ограничен небольшой группой больных, поэтому для выбора оптимального лечения необходимо опираться на результаты опубликованных исследований. Для определения оптимального способа диагностики и лечения НЭОЖ требуются дальнейшие исследования.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflict of interest.
Сведения об авторах
Алекберзаде А.В. — https://orcid.org/0000-0002-2895-8478
Крылов Н.Н. — https://orcid.org/0000-0003-0078-9171
Липницкий Е.М. — https://orcid.org/0000-0002-2650-4181
Шахбазов Р.О. — https://orcid.org/0000-0003-1450-6398
Азари Ф. — https://orcid.org/0000-0002-5907-8158
Автор, ответственный за переписку: Крылов Н.Н. — e-mail: [email protected]
Алекберзаде А.В., Крылов Н.Н., Липницкий Е.М., Шахбазов Р.О., Азари Ф. Нейроэндокринные опухоли желудка. Хирургия. Журнал им. Н.И. Пирогова. 2019;12:111-120. https://doi.org/10.17116/hirurgia2019121
Журнал им. Н.И. Пирогова. 2019;12:111-120. https://doi.org/10.17116/hirurgia2019121
Медицинское обслуживание, профилактика, долгосрочный мониторинг
Crafa P, Russo M, Miraglia C, et al. От Сиднея до ОЛЬГИ: обзор атрофического гастрита. Акта Биомед . 2018 17 декабря. 89 (8-S): 93-9. [Медлайн].
Родригес-Кастро К.И., Франчески М., Миралья С. и др. Аутоиммунные заболевания при аутоиммунном атрофическом гастрите. Акта Биомед . 2018 17 декабря. 89(8-S):100-3. [Медлайн].
Янаока К., Ока М., Охата Х. и др.Эрадикация Helicobacter pylori предотвращает развитие рака у пациентов с легкой атрофией желудка, определяемой по уровню пепсиногена в сыворотке крови. Int J Рак . 2009 1 декабря. 125(11):2697-703. [Медлайн].
Vannella L, Lahner E, Annibale B. Риск неоплазии желудка у пациентов с хроническим атрофическим гастритом: критическая переоценка. Мир J Гастроэнтерол . 2012 28 марта. 18(12):1279-85. [Медлайн]. [Полный текст].
Риск неоплазии желудка у пациентов с хроническим атрофическим гастритом: критическая переоценка. Мир J Гастроэнтерол . 2012 28 марта. 18(12):1279-85. [Медлайн]. [Полный текст].
Weck MN, Gao L, Brenner H.Инфекция Helicobacter pylori и хронический атрофический гастрит: ассоциации в зависимости от тяжести заболевания. Эпидемиология . 2009 г. 20 июля (4): 569-74. [Медлайн].
Тахара Т., Шибата Т., Ван Ф.Ю. и др. Аллель маннан-связывающего лектина B связан с риском развития более тяжелой атрофии слизистой оболочки желудка у японских пациентов, инфицированных Helicobacter pylori. Eur J Гастроэнтерол Гепатол . 2009 г. 21 июля (7): 781-6. [Медлайн].
Гао Л., Век М.Н., Нитерс А., Бреннер Х.Обратная связь между провоспалительным генетическим профилем и серопозитивностью к Helicobacter pylori у пациентов с хроническим атрофическим гастритом: усиление элиминации инфекции при прогрессировании заболевания? Евро J Рак . 2009 ноябрь 45 (16): 2860-6. [Медлайн].
2009 ноябрь 45 (16): 2860-6. [Медлайн].
Родригес-Кастро К.И., Франчески М., Ното А. и др. Клинические проявления хронического атрофического гастрита. Акта Биомед . 2018 17 декабря. 89(8-S):88-92. [Медлайн].
Гао Л., Век М.Н., Штегмайер С., Ротенбахер Д., Бреннер Х.Потребление алкоголя и хронический атрофический гастрит: популяционное исследование среди 9 444 пожилых людей из Германии. Int J Рак . 2009 2 июня. 125(12):2918-22. [Медлайн]. [Полный текст].
Палладино М., Кьюзоло П., Реддиконто Г. и др. Полиморфизмы MTHFR, вовлеченные в дефицит витамина B12, связанный с атрофическим гастритом. Биохим Жене . 2009 47 октября (9-10): 645-50. [Медлайн].
Ланер Э., Норман Г.Л., Севери С. и др.Переоценка внутреннего фактора и аутоантител к париетальным клеткам при атрофическом гастрите в связи с дефицитом кобаламина. Am J Гастроэнтерол . 2009 авг. 104(8):2071-9. [Медлайн].
Am J Гастроэнтерол . 2009 авг. 104(8):2071-9. [Медлайн].
Stummvoll GH, DiPaolo RJ, Huter EN, et al. Аутоиммунный гастрит, индуцированный эффекторными Т-клетками Th2, Th3 и Th27, отличается патологией и восприимчивостью к подавлению регуляторными Т-клетками. Дж Иммунол . 2008 1 августа. 181(3):1908-16. [Медлайн]. [Полный текст].
Huter EN, Stummvoll GH, DiPaolo RJ, Glass DD, Shevach EM. Предифференцированные эффекторные Т-клетки Th2 и Th27 при аутоиммунном гастрите: антиген-специфические регуляторные Т-клетки являются более мощными супрессорами, чем поликлональные регуляторные Т-клетки. Int Immunopharmacol . 2009 май. 9(5):540-5. [Медлайн].
Yagi K, Nakamura A, Sekine A, Graham D. Особенности атрофии слизистой оболочки тела в трех случаях аутоиммунного гастрита, выявленные при эндоскопии с увеличением. История болезни Med . 2012. 2012:368160. [Медлайн]. [Полный текст].
История болезни Med . 2012. 2012:368160. [Медлайн]. [Полный текст].
Zhang Y, Weck MN, Schottker B, et al. Антитела к париетальным клеткам желудка, инфекция Helicobacter pylori и хронический атрофический гастрит: данные крупного популяционного исследования в Германии. Эпидемиологические биомаркеры рака Предыдущая . 2013 май. 22(5):821-6. [Медлайн].
Chen WC, Warner RRP, Harpaz N, Zhu H, Roayaie S, Kim MK. Нейроэндокринная опухоль желудка и гастринома двенадцатиперстной кишки с хроническим аутоиммунным атрофическим гастритом. Поджелудочная железа . 2019 янв. 48 (1): 131-4. [Медлайн].
Массирони С., Кавальколи Ф., Росси Р.Э. и др. Хронический аутоиммунный атрофический гастрит, ассоциированный с первичным гиперпаратиреозом: поперечное проспективное исследование. Евро J Эндокринол . 2013 май. 168(5):755-61. [Медлайн].
2013 май. 168(5):755-61. [Медлайн].
[Руководство] Early DS, Lightdale JR, Vargo JJ 2nd и др. для Комитета по стандартам практики ASGE. Рекомендации по седации и анестезии при эндоскопии желудочно-кишечного тракта. Гастроинтест Эндоск . 2018 фев. 87(2):327-37. [Медлайн].
Зоальфагари А., Алетаха Н., Рушан Н., Таслими Р., Форутан Х., Фаридния Б. Точность пепсиногенов для ранней диагностики атрофического гастрита и рака желудка у населения Ирана. Med J Islamic Repub Иран . 2014. 28:150. [Медлайн].
Zagari RM, Rabitti S, Greenwood DC, Eusebi LH, Vestito A, Bazzoli F. Систематический обзор с метаанализом: диагностическая эффективность комбинации пепсиногена, гастрина-17 и анализов сыворотки антител против Helicobacter pylori для диагностики атрофический гастрит. Алимент Фармакол Тер . 2017 Октябрь 46 (7): 657-67. [Медлайн].
2017 Октябрь 46 (7): 657-67. [Медлайн].
Питтман М.Э., Вольтаджио Л., Бхайджи Ф., Робертсон С.А., Монтгомери Э.А. Аутоиммунный метапластический атрофический гастрит: распознавание предшествующих поражений для соответствующей оценки состояния пациента. Ам Дж. Сург Патол . 2015 Декабрь 39 (12): 1611-20. [Медлайн].
Capella C, Fiocca R, Cornaggia M. Аутоиммунный гастрит. Грэм Д.Ю., Гента Р.М., Диксон М.Ф., ред. Гастрит .Филадельфия, Пенсильвания: Липпинкотт Уильямс; 1999. 79-96.
Корреа П. Канцерогенез желудка человека: многоэтапный и многофакторный процесс — Первая лекция премии Американского онкологического общества по эпидемиологии и профилактике рака. Рак Res . 1992, 15 декабря. 52(24):6735-40. [Медлайн].
Диксон М.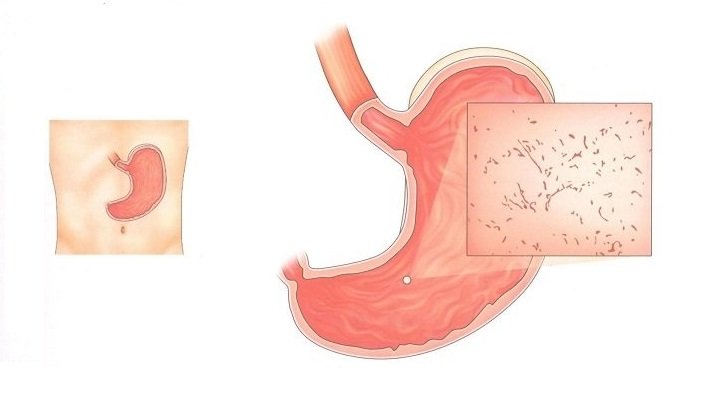 Ф., Джента Р.М., Ярдли Д.Х. Классификация и градация гастрита. Обновленная Сиднейская система. Международный семинар по гистопатологии гастрита, Хьюстон, 1994 г. Ам Дж. Сург Патол . 1996 20 октября (10): 1161-81. [Медлайн].
Ф., Джента Р.М., Ярдли Д.Х. Классификация и градация гастрита. Обновленная Сиднейская система. Международный семинар по гистопатологии гастрита, Хьюстон, 1994 г. Ам Дж. Сург Патол . 1996 20 октября (10): 1161-81. [Медлайн].
Доре М.П., Леандро Г., Реалди Г., Сепульведа А.Р., Грэм Д.Ю. Влияние предлечебной антибиотикорезистентности к метронидазолу и кларитромицину на исход терапии Helicobacter pylori: метааналитический подход. Научные раскопки . 2000 янв. 45(1):68-76. [Медлайн].
Franceschi F, Genta RM, Sepulveda AR. Слизистая оболочка желудка: отдаленные результаты лечения инфекции Helicobacter pylori. J Гастроэнтерол . 2002. 37 Приложение 13:17-23. [Медлайн].
Гао Л., Век М.Н., Раум Э. и др. Размер родства, инфекция Helicobacter pylori и хронический атрофический гастрит: популяционное исследование среди 9444 пожилых людей из Германии. Int J Epidemiol . 2010 Февраль 39 (1): 129-34. [Медлайн].
Int J Epidemiol . 2010 Февраль 39 (1): 129-34. [Медлайн].
Грэм Д.Ю. Терапия Helicobacter pylori: современное состояние и проблемы. Гастроэнтерология . 2000 г., февраль 118 (2 Дополнение 1): S2-8.[Медлайн].
Грэм Д.Ю., Белсон Г., Абудайе С. и др. Четырехкомпонентная терапия дважды в день (в середине дня и вечером) для лечения инфекции H. pylori в Соединенных Штатах. Раскопки печени Dis . 2004 г. 36 июня (6): 384-7. [Медлайн].
Гершко С., Хоффбранд А.В., Керет Д. и др. Роль аутоиммунного гастрита, Helicobacter pylori и целиакии в рефрактерной или необъяснимой железодефицитной анемии. Гематологические . 2005 май. 90(5):585-95.[Медлайн].
Иноуэ Т., Уэдо Н., Исихара Р. и др. Аутофлуоресцентная визуализирующая видеоэндоскопия в диагностике хронического атрофического фундального гастрита. J Гастроэнтерол . 2010 янв. 45(1):45-51. [Медлайн].
J Гастроэнтерол . 2010 янв. 45(1):45-51. [Медлайн].
Konturek PC, Konturek SJ, Brzozowski T. Инфекция Helicobacter pylori в канцерогенезе желудка. J Физиол Фармакол . 2009 сен. 60(3):3-21. [Медлайн].
Красинскас А.М., Абрахам С.К., Мец, округ Колумбия, и др.Оксинтические псевдополипы слизистой оболочки: проявление атрофического аутоиммунного гастрита. Ам Дж. Сург Патол . 2003 г. 27 февраля (2): 236-41. [Медлайн].
Лайемо А.О., Камангар Ф., Маркус П.М. и др. Атрофический гастрит и риск возникновения колоректального рака. Контроль над причинами рака . 2010 21 января (1): 163-70. [Медлайн].
Люн В.К., Ким Дж.Дж., Ким Дж.Г. Микросателлитная нестабильность при желудочно-кишечной метаплазии у больных с раком желудка и без него. Ам Дж. Патол . 2000 фев. 156(2):537-43. [Медлайн].
Ам Дж. Патол . 2000 фев. 156(2):537-43. [Медлайн].
Malfertheiner P, Megraud F, O’Morain C, et al. Современные концепции лечения инфекции Helicobacter pylori — Консенсусный отчет Маастрихта 2-2000. Алимент Фармакол Тер . 2002 г. 16 февраля (2): 167-80. [Медлайн].
Ругге М., Гента РМ. Стадия и классификация хронического гастрита. Хум Патол . 2005 г. 36 марта (3): 228-33. [Медлайн].
Шин С.М., Ким Н., Ли Х.С. и др.Валидация диагностических тестов на Helicobacter pylori в отношении степени атрофического гастрита и/или кишечной метаплазии. Хеликобактер . 2009 г. 14 (6): 512-9 декабря. [Медлайн].
Сиппонен П., Харконен М., Аланко А. и др. Диагностика атрофического гастрита по образцу сыворотки. Лаборатория Клин .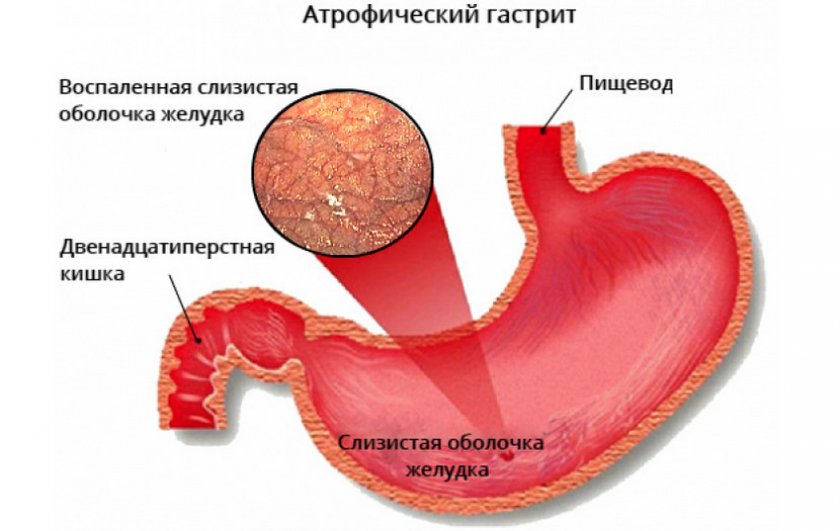 2002. 48(9-10):505-15. [Медлайн].
2002. 48(9-10):505-15. [Медлайн].
Ваананен Х., Ваухконен М., Хельске Т. и др. Неэндоскопическая диагностика атрофического гастрита с помощью анализа крови.Корреляция между гистологией желудка и уровнями гастрина-17 и пепсиногена I в сыворотке: многоцентровое исследование. Eur J Гастроэнтерол Гепатол . 2003 г. 15 августа (8): 885-91. [Медлайн].
Whittingham S, Mackay IR. Аутоиммунный гастрит: исторические предпосылки, выдающиеся открытия и нерешенные проблемы. Int Rev Immunol . 2005 янв.-апрель. 24(1-2):1-29. [Медлайн].
Парсонс Б.Н., Иджаз УЗ, Д’Амор Р. и др. Сравнение микробиоты желудка человека в гипохлоргидрических состояниях, возникающих в результате Helicobacter pylori-индуцированного атрофического гастрита, аутоиммунного атрофического гастрита и применения ингибиторов протонной помпы. ПЛОС Патог . 13 ноября 2017 г. (11): e1006653. [Медлайн].
ПЛОС Патог . 13 ноября 2017 г. (11): e1006653. [Медлайн].
Мосс С.Ф. Клинические данные, связывающие Helicobacter pylori с раком желудка. Селл Мол Гастроэнтерол Гепатол . 2017 3 марта (2): 183-91. [Медлайн].
Икеда Ф., Шиката К., Хата Дж. и др. Комбинация антител против Helicobacter pylori и сывороточного пепсиногена как хороший прогностический инструмент заболеваемости раком желудка: 20-летние проспективные данные исследования Хисаяма. J Эпидемиол . 2016 5 декабря. 26(12):629-36. [Медлайн].
Коно С., Готода Т., Йошида С. и др. Может ли эндоскопическая атрофия предсказать гистологическую атрофию? Историческое исследование в Великобритании и Японии. Мир J Гастроэнтерол . 2015 14 декабря. 21(46):13113-23. [Медлайн].
состояние
Что такое гастрит?
Гастрит – это когда слизистая оболочка желудка краснеет и опухает (воспаляется).
Слизистая оболочка вашего желудка крепкая.В большинстве случаев кислота ему не повредит. Но она может воспаляться и раздражаться, если вы пьете слишком много алкоголя, едите острую пищу, страдаете от болеутоляющих средств, называемых НПВП, или курите.
Что вызывает гастрит?
Гастрит может быть вызван многими причинами. Это может быть вызвано диетой и привычками образа жизни, такими как:
Чрезмерное употребление алкоголя
Употребление острой пищи
Курение
Экстремальный стресс.Это может быть связано с серьезными или опасными для жизни проблемами со здоровьем.
Длительное употребление аспирина и безрецептурных обезболивающих и жаропонижающих средств
Проблемы со здоровьем, которые могут привести к гастриту, включают:
Некоторые заболевания также могут вызывать гастрит. К ним относятся:
Аутоиммунные заболевания. Это когда ваша иммунная система по ошибке атакует здоровые клетки вашего тела.

Хронический желчный рефлюкс. Это когда желчь забрасывается в желудок и пищевод. Желчь — это жидкость, которая помогает переваривать пищу.
Пернициозная анемия . Это форма анемии, которая возникает, когда ваш желудок не может переваривать витамин B-12.
Каковы симптомы гастрита?
Симптомы у каждого человека могут различаться. Наиболее распространенные симптомы гастрита включают в себя:
расстройство желудка или боль
- 78
- 78
животных (брюшное) кровотечение
тошнота и рвота
чувство полноты или горения в вашем желудок
Потеря аппетита
Кровь в рвоте или стуле.Это признак того, что слизистая желудка может кровоточить.
Симптомы гастрита могут быть похожи на другие проблемы со здоровьем. Всегда обращайтесь к своему лечащему врачу для постановки диагноза.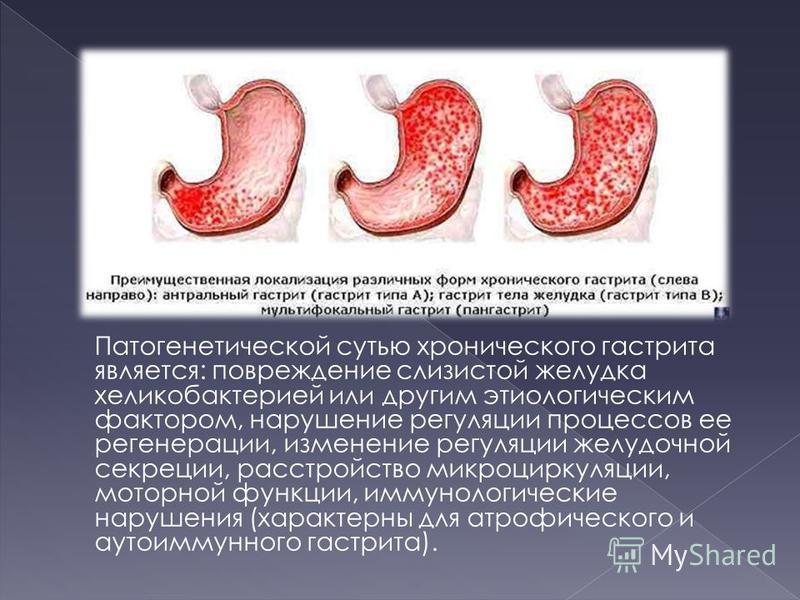
Как диагностируется гастрит?
Ваш лечащий врач проведет медицинский осмотр и спросит о вашем здоровье в прошлом. Вы также можете пройти тесты, в том числе:
Серия анализов верхних отделов ЖКТ (желудочно-кишечный тракт) или глотание бария. Этот рентген проверяет органы верхней части пищеварительной системы.Он проверяет пищевод, желудок и первую часть тонкой кишки (двенадцатиперстную кишку). Вы проглотите металлическую жидкость под названием барий. Барий покрывает органы так, что их можно увидеть на рентгеновском снимке.
Эндоскопия верхних отделов кишечника (ЭГДС). В ходе этого исследования исследуется внутренняя часть пищевода, желудка и двенадцатиперстной кишки. При этом используется тонкая трубка с подсветкой, называемая эндоскопом. На одном конце трубки имеется камера. Ваш лечащий врач вводит трубку в рот и горло, а затем врач вводит ее в пищевод, желудок и двенадцатиперстную кишку.Ваш врач может увидеть внутреннюю часть этих органов.
 Он или она также может взять небольшой образец ткани (биопсию), если это необходимо.
Он или она также может взять небольшой образец ткани (биопсию), если это необходимо.Анализы крови. Вам сделают анализ на H. pylori, тип бактерий, которые могут быть в вашем желудке. Другой тест проверит наличие анемии. Вы можете заболеть анемией, когда у вас недостаточно эритроцитов. Иногда у вас может быть низкий уровень определенных витаминов, и вам необходимо принимать пищевые добавки.
Образец кала. Этот тест проверяет, есть ли у вас желудочные бактерии, которые могут вызывать гастрит.Небольшой образец вашего стула собирается и отправляется в лабораторию. Другой тест стула может проверить наличие крови в вашем стуле. Это может быть признаком гастрита, если у вас есть кровотечение.
Дыхательный тест. Вам может быть назначен тест, при котором воздух собирается и анализируется на наличие желудочных бактерий.
Как лечится гастрит?
Лечение будет зависеть от ваших симптомов, возраста и общего состояния здоровья. Это также будет зависеть от того, насколько тяжелым является состояние.
Это также будет зависеть от того, насколько тяжелым является состояние.
В большинстве случаев вам будут давать антациды и другие лекарства для снижения кислотности желудка.Это поможет облегчить ваши симптомы и вылечить слизистую оболочку желудка.
Если ваш гастрит вызван болезнью или инфекцией, ваш врач также будет лечить эту проблему со здоровьем.
Если ваш гастрит вызван бактериями H. pylori, вам дадут лекарства, помогающие уничтожить бактерии. В большинстве случаев вы будете принимать более 1 антибиотика и ингибитора протонной помпы. ИПП — это лекарство, которое снижает количество кислоты в желудке. Вам также могут дать лекарство от диареи.
Не принимайте никаких продуктов, напитков или лекарств, которые вызывают симптомы или раздражают желудок. Если вы курите, то лучше бросить. Если вы часто принимаете аспирин или НПВП, поговорите со своим лечащим врачом о других вариантах.
Какие возможны осложнения гастрита?
Хронический гастрит поражает слизистую оболочку желудка. Это может повысить риск возникновения других проблем со здоровьем. К ним относятся:
Это может повысить риск возникновения других проблем со здоровьем. К ним относятся:
Язвенная болезнь. Это вызывает болезненные язвы в верхних отделах пищеварительного тракта.
Полипы желудка. Это небольшие массы клеток, которые образуются на внутренней оболочке желудка.
Опухоли желудка. Они могут быть раком или не раком (доброкачественными).
Вы также можете заболеть атрофическим гастритом. Это может произойти, если ваш гастрит вызван бактериями H. pylori или аутоиммунным заболеванием. Атрофический гастрит разрушает клетки слизистой оболочки желудка, которые вырабатывают пищеварительные соки. Это повышает риск заболеть раком желудка.Это также может привести к снижению уровня определенных витаминов в крови.
Можно ли предотвратить гастрит?
Эксперты не знают, как остановить гастрит. Но вы можете снизить риск заражения этим заболеванием, если:
Соблюдайте правила гигиены, особенно мытье рук.
 Это может уберечь вас от заражения бактериями H. pylori.
Это может уберечь вас от заражения бактериями H. pylori.Не есть и не пить продукты, которые могут раздражать слизистую оболочку желудка. Сюда входят алкоголь, кофеин и острая пища.
Не принимать такие лекарства, как аспирин и отпускаемые без рецепта обезболивающие и лихорадочные препараты. К ним относятся НПВП (нестероидные противовоспалительные препараты).
Когда мне следует позвонить своему лечащему врачу?
Позвоните своему лечащему врачу, если ваши симптомы ухудшатся или появятся новые симптомы. в стуле или черный, дегтеобразный стул
Основные сведения о гастрите
Гастрит — это покраснение и отек (воспаление) слизистой оболочки желудка.
Это может быть вызвано употреблением слишком большого количества алкоголя, острой пищи или курением.
Некоторые заболевания и другие проблемы со здоровьем также могут вызывать гастрит.
Симптомы могут включать боль в желудке, отрыжку, тошноту, рвоту, брюшное кровотечение, чувство сытости и кровь в рвотных массах или стуле.

В большинстве случаев вам будут давать антациды и другие лекарства для снижения кислотности желудка.
Не употребляйте продукты и напитки, которые раздражают слизистую оболочку желудка.
Бросьте курить.
Дальнейшие действия
Советы, которые помогут вам получить максимальную отдачу от посещения вашего поставщика медицинских услуг:
Знайте причину вашего визита и то, что вы хотите, чтобы произошло.
Перед посещением запишите вопросы, на которые вы хотите получить ответы.
Возьмите с собой кого-нибудь, кто поможет вам задавать вопросы и помнить, что говорит вам ваш врач.
При посещении запишите название нового диагноза и любые новые лекарства, методы лечения или тесты.Также запишите все новые инструкции, которые дает вам ваш врач.
Знайте, почему назначено новое лекарство или лечение и как оно вам поможет. Также знайте, каковы побочные эффекты.

Спросите, можно ли лечить ваше заболевание другими способами.
Узнайте, почему рекомендуется тест или процедура и что могут означать результаты.
Знайте, чего ожидать, если вы не примете лекарство или не пройдете тест или процедуру.
Если у вас запланирована повторная встреча, запишите дату, время и цель визита.
Знайте, как вы можете связаться со своим врачом, если у вас есть вопросы.
Аутоиммунный атрофический гастрит – критерии хирургической патологии
Определение
- Атрофический гастрит, сопровождающийся антителами к париетальным клеткам и внутреннему фактору
Альтернативные/исторические названия
- Аутоиммунный метапластический атрофический гастрит
- Гастрит типа А
Диагностические критерии
- Требуется биопсия тела для диагностики
- Атрофический гастрит, преимущественно ограниченный телом желудка
- Антральный отдел обычно нормальный, но может обнаруживать очаговое воспаление и атрофию
- В активной фазе имеется инфильтрат из лимфоцитов и плазматических клеток
- В центре глубокой собственной пластинки тела
- Обычно редкие в случаях выраженной атрофии
- В хронической фазе заметно истонченная слизистая оболочка, состоящая в основном из ямок
- Атрофия пищеводных желез
- Разрушение и потеря как париетальных, так и главных клеток
- Обычно обширный, но не обязательно полный
- Результаты псевдопилорической метаплазии
- Кишечная метаплазия обычно обширная
- Часто ассоциированная пролиферация эндокринных клеток желудка
- Возникает в теле, а не в антральном отделе
- Может начаться на ранней стадии заболевания
- (гиперплазия G-клеток происходит в антральном отделе)
- (В организме нет G-клеток)
- Антитела к париетальным клеткам и внутреннему фактору
- Пернициозная анемия может развиться в длительных случаях
- Могут потребоваться годы, чтобы запасы витамина B12 в организме истощились
- Пернициозная анемия может развиться в длительных случаях
- Низкая распространенность Helicobacter
Роберт В. Роуз, доктор медицины
Роуз, доктор медицины
Кафедра патологии
Медицинский факультет Стэнфордского университета
Стэнфорд, Калифорния 94305-5342
Исходное сообщение: 9 сентября 2009 г.
Gastritis – Albany Gastroenterology Consultants
Желудок, как всем известно из телевизионной рекламы, имеет J-образную форму и собирает проглоченную пищу и жидкость.Затем он методично измельчает пищу на мелкие кусочки и выбрасывает ее крошечными струйками жидкости в двенадцатиперстную кишку, которая является первой частью тонкой кишки.
Существует несколько типов клеток, выстилающих желудок. Один производит соляную кислоту, а другой — пепсин, пищеварительный гормон. Наряду с перемалыванием желудка эти химические вещества расщепляют пищу и подготавливают ее к перевариванию и всасыванию.
Что такое гастрит
Гастрит означает воспаление желудка.Это означает, что лейкоциты перемещаются в стенку желудка в ответ на какую-либо травму. Гастрит не означает, что есть язва или рак. Это просто воспаление – острое или хроническое. Каковы причины гастрита?
Это просто воспаление – острое или хроническое. Каковы причины гастрита?
Helicobacter Pylori
Это название бактерии, которая научилась жить в толстой слизистой оболочке желудка. Хотя на самом деле он не поражает подлежащие ткани, он приводит к острому и хроническому воспалению.Вероятно, это происходит в раннем детстве и остается на всю жизнь, если его не вылечить антибиотиками. Инфекция может привести к язве, а в более позднем возрасте у некоторых людей даже к раку желудка. К счастью, теперь есть способы поставить диагноз и лечить это расстройство.
Аутоиммунный гастрит – пернициозная анемия
Иммунная система вырабатывает антитела и другие белки, которые борются с инфекцией и поддерживают здоровье организма. При некоторых заболеваниях организм ошибочно воспринимает один из своих органов как чужеродный белок или инфекцию.Он вырабатывает антитела против него и может серьезно повредить орган. Примерами являются такие заболевания, как волчанка, гипотиреоз, ревматоидный артрит и тип диабета, требующий инсулина. Слизистая оболочка желудка также может быть атакована иммунной системой, что приводит к потере клеток желудка. Это вызывает острое и хроническое воспаление, которое может привести к состоянию, называемому пернициозной анемией. Анемия возникает из-за того, что организм больше не может усваивать витамин B12 из-за отсутствия ключевого фактора желудка, разрушенного хроническим воспалением.Рак желудка может возникнуть даже в более позднем возрасте. Люди с пернициозной анемией нуждаются в регулярных добавках витамина B12.
Слизистая оболочка желудка также может быть атакована иммунной системой, что приводит к потере клеток желудка. Это вызывает острое и хроническое воспаление, которое может привести к состоянию, называемому пернициозной анемией. Анемия возникает из-за того, что организм больше не может усваивать витамин B12 из-за отсутствия ключевого фактора желудка, разрушенного хроническим воспалением.Рак желудка может возникнуть даже в более позднем возрасте. Люди с пернициозной анемией нуждаются в регулярных добавках витамина B12.
Аспирин и НПВП Гастрит
НПВП — нестероидный противовоспалительный препарат. Это препараты для лечения артрита и болеутоляющие средства, отпускаемые без рецепта, в том числе препараты ибупрофена, такие как Advil и Motrin, и препараты напроксена, такие как Aleve. Некоторые отпускаемые по рецепту НПВП включают Целебрекс, Мобик и Индометацин. Наряду с аспирином НПВП снижают уровень защитного вещества в желудке, называемого простагландином.Эти препараты обычно не вызывают проблем при кратковременном приеме. Однако регулярное употребление может привести к гастриту, а также к более серьезной язве.
Однако регулярное употребление может привести к гастриту, а также к более серьезной язве.
Алкоголь
Алкоголь и некоторые другие химические вещества могут вызвать воспаление и повреждение желудка. Это строго зависит от дозы, поскольку обычно требуется много алкоголя, чтобы вызвать гастрит. Социальное или периодическое употребление алкоголя не вредит желудку, хотя алкоголь стимулирует желудок вырабатывать кислоту.
Гипертрофический гастрит
Иногда складки в желудке увеличиваются и опухают вместе с воспалением.Не так много известно о том, почему это происходит. Разновидность этого типа гастрита называется болезнью Менетрие, при которой желудочные складки становятся гигантскими. При этом заболевании часто происходит потеря белка в желудке из этих мокнущих складок.
Разное
Существуют и другие, но более редкие типы гастрита, такие как эозинофильный, флегмонозный (тяжелая бактериальная инфекция) и гранулематозный гастрит.
Симптомы
Симптомы гастрита зависят от того, насколько он острый и как давно он присутствует. В острой фазе могут быть боль или ощущение жжения в верхней части живота, а также тошнота и рвота. иногда небольшое количество пищи приносит кратковременное облегчение за счет буферизации желудочного сока. В хронической фазе боль может быть тупой, может наблюдаться потеря аппетита с чувством сытости после нескольких приемов пищи. Очень часто симптомы вообще отсутствуют. Если боль сильная, может быть язва, а также гастрит.
В острой фазе могут быть боль или ощущение жжения в верхней части живота, а также тошнота и рвота. иногда небольшое количество пищи приносит кратковременное облегчение за счет буферизации желудочного сока. В хронической фазе боль может быть тупой, может наблюдаться потеря аппетита с чувством сытости после нескольких приемов пищи. Очень часто симптомы вообще отсутствуют. Если боль сильная, может быть язва, а также гастрит.
Диагностика
Врач может заподозрить гастрит, выслушав историю болезни.Однако единственный верный способ поставить диагноз — эндоскопия и биопсия слизистой оболочки желудка. Эндоскопия — это обследование, при котором под легкой седацией в желудок вводят гибкий эндоскоп с подсветкой. Можно делать снимки, но, что более важно, можно получить биопсию для анализа под микроскопом. Рентгенологическое исследование верхних отделов желудочно-кишечного тракта и определенные исследования крови также могут быть полезными.
Лечение
Лечение гастрита зависит от его причины. Для большинства типов гастрита часто помогает снижение желудочной кислоты с помощью лекарств.Кроме того, необходимо установить конкретный диагноз. Антибиотики используются для инфекции. Отмена аспирина, НПВП или алкоголя показана, когда проблема связана с одним из них. Для более необычных типов гастрита могут потребоваться другие методы лечения. Гастрит сам по себе редко является серьезной проблемой.
Для большинства типов гастрита часто помогает снижение желудочной кислоты с помощью лекарств.Кроме того, необходимо установить конкретный диагноз. Антибиотики используются для инфекции. Отмена аспирина, НПВП или алкоголя показана, когда проблема связана с одним из них. Для более необычных типов гастрита могут потребоваться другие методы лечения. Гастрит сам по себе редко является серьезной проблемой.
Осложнения
Причина большинства видов гастрита известна, и существуют эффективные методы лечения и профилактики, поэтому серьезные осложнения встречаются редко. Единственным исключением является H.pylori, которая, если присутствует в течение длительного времени, может привести к раку желудка у некоторых людей. Эта инфекция также может привести к злокачественному новообразованию лимфатической системы, называемому лимфомой. Одна такая лимфома низкой степени называется MALT-лимфомой. Устранение инфекции из желудка часто излечивает этот тип лимфомы.
Резюме
Причины гастрита разнообразны.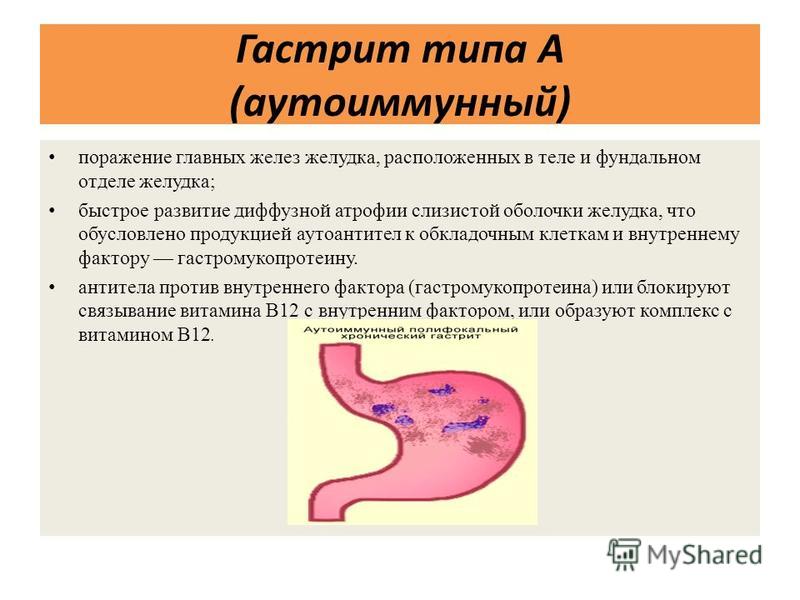

 Он возникает из-за образования антител, которые повреждают клетки слизистой желудка. Данный тип патологии встречается гораздо реже у пациентов с атрофическим гастритом, в соотношении примерно 1:10.
Он возникает из-за образования антител, которые повреждают клетки слизистой желудка. Данный тип патологии встречается гораздо реже у пациентов с атрофическим гастритом, в соотношении примерно 1:10.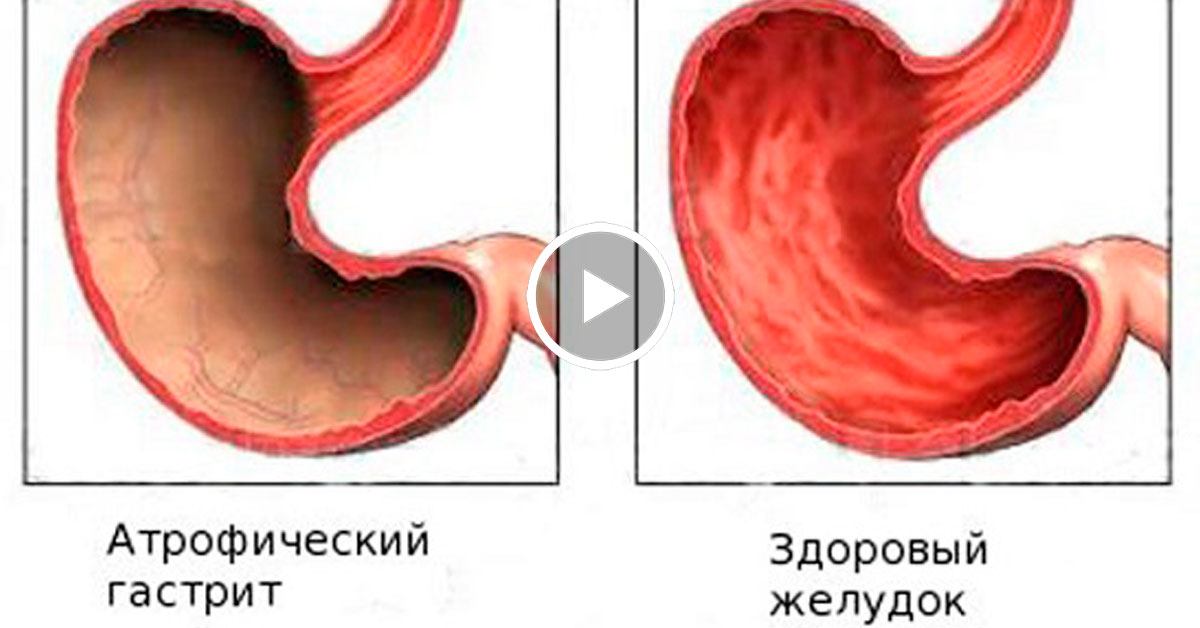 В зависимости от фактора, спровоцировавшего гастрит, ребёнку прописывают антибиотики, ингибиторы протонной помпы, глкокортикоиды;
В зависимости от фактора, спровоцировавшего гастрит, ребёнку прописывают антибиотики, ингибиторы протонной помпы, глкокортикоиды;
 Он или она также может взять небольшой образец ткани (биопсию), если это необходимо.
Он или она также может взять небольшой образец ткани (биопсию), если это необходимо. Это может уберечь вас от заражения бактериями H. pylori.
Это может уберечь вас от заражения бактериями H. pylori.