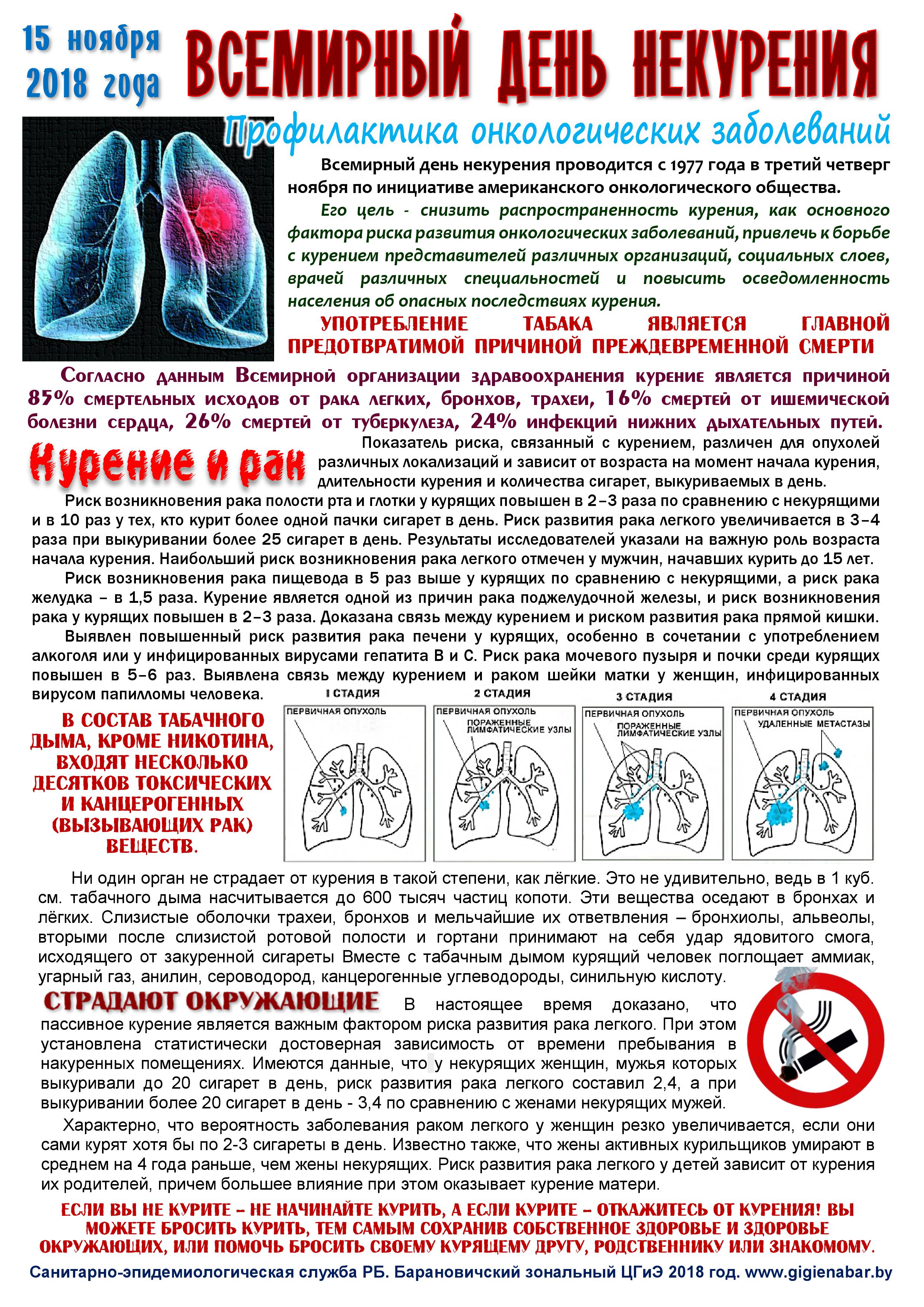
РАК ЛЕГКИХ | Лечение рака легких | Опухоль лёгких
К основным симптомам заболевания относятся: кашель, одышка, боль в грудной клетке, кровохарканье, потеря массы тела. Выявление большей части этих признаков должно насторожить и заставить срочно обратиться к врачу. Следует отметить, что рак легких, признаки которого являются неспецифическими, т.е. характерными для многих заболеваний органов дыхания. По этой причине, к сожалению, многие пациенты не спешат бить тревогу.
Кроме того, необходимо обращать внимание на такие косвенные признаки, как вялость, апатия, утрата должной активности, небольшое беспричинное повышение температуры тела. Последнее может маскировать рак легкого под вялотекущий бронхит или пневмонию.
В самом начале заболевания рак легкого чаще всего скрывается под «маской» утраты жизненного тонуса, что характеризуется небольшим снижением работоспособности, повышенной утомляемостью, ослаблением интереса и апатией.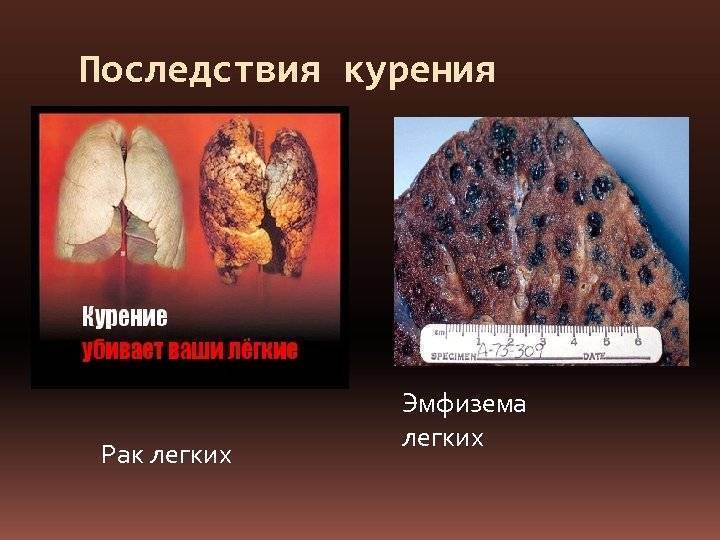 В последующем у большинства больных рак легких проявляет признаки под «маской» различных респираторных заболеваний: катара дыхательных путей, повторных эпизодов гриппа, бронхита, пневмонии и т. п. Чаще всего, это уже третий период развития болезни, и в это время удается установить явления сопутствующей пневмонии. У больных периодически повышается температура тела, возникает, затем проходит и может вновь повторяться легкое недомогание. Как правило, прием жаропонижающих и противовоспалительных средств, а также так называемые «домашние методы», быстро устраняют (на некоторое время) эти явления. Только повторные приступы недомогания, повторяющиеся на протяжении 1-2 месяцев, наводят больных на мысль о необходимости обратиться за медицинской помощью.
В последующем у большинства больных рак легких проявляет признаки под «маской» различных респираторных заболеваний: катара дыхательных путей, повторных эпизодов гриппа, бронхита, пневмонии и т. п. Чаще всего, это уже третий период развития болезни, и в это время удается установить явления сопутствующей пневмонии. У больных периодически повышается температура тела, возникает, затем проходит и может вновь повторяться легкое недомогание. Как правило, прием жаропонижающих и противовоспалительных средств, а также так называемые «домашние методы», быстро устраняют (на некоторое время) эти явления. Только повторные приступы недомогания, повторяющиеся на протяжении 1-2 месяцев, наводят больных на мысль о необходимости обратиться за медицинской помощью.
Симптомы рака легкого могут отличаться в зависимости от ряда факторов, главными из которых являются следующие: место, где возникает первичная опухоль – в бронхе (центральный рак) или в ткани легкого (периферический рак), степень сдавливания соседствующих с опухолью органов, наличие метастазов.
Мясников – о раке легких у некурящих
В программе «Доктор Мясников» зритель рассказал врачу и ведущему о несчастье, которое произошло в его семье. У родственницы Михаила Павлова из Краснодара выявили рак легких, хотя она никогда в своей жизни не курила и никогда не работала на вредных производствах.
Он спросил Александра Мясникова, откуда в таком случае у нее могло появиться это страшное заболевание.
«Да, действительно, в определенных количествах случаев некоторые разновидности рака легкого не связаны с курением», – ответил врач.
Есть виды этого заболевания, которые на сто процентов связаны с курением, но есть и одна разновидность, которая с с ним связана меньше.
Перечисляя факторы риска, «очень большим» Мясников назвал вдыхание микрочастиц сгорания. По его словам, это «вторичное курение», когда сам человек не курит, но курят при нем. «Вторичное курение сегодня – официальный канцероген», – сообщил ведущий.
Он также отметил, что, например, Китай, где топят углем, – «номер один по раку легкого».
«Мало того, что там курильщики, там еще атмосфера. Вы видели, какой там смог?» – говорит Мясников.
Фактором риска он называет и дизельное топливо, солярку, которая сильно чадит и оседает в легких.
Это, по словам врача, может быть и фоновая радиация, и воздействие строительного материала асбест, который уже давно запрещен, но построенные из него здания стоят.
«Многие вирусы тоже обвиняют в стимулировании рака легких у людей, которые никогда не курят. Равно как ожирение, резистентность к инсулину», – продолжает перечислять врач и вновь напоминает о необходимости делать противовирусные прививки.
Поэтому, по его словам, нужно не только не курить, но и помнить о других факторах риска и страховаться, где возможно.
«И еще: человек предполагает, а Господь располагает. Вы можете снизить риски, но решает все равно Он», – такими словами завершил эту тему доктор Мясников.
Еще больше интересных новостей – в нашем Instagram и Telegram-канале @smotrim_ru.
Рак лёгких | Заболевание. Факторы риска. Симптомы рака лёгких
Рак лёгкого – это злокачественная опухоль. Злокачественная – потому, что она мешает организму правильно работать и может быть опасна для жизни. Различают два основных вида заболевания: мелкоклеточный и немелкоклеточный рак лёгкого. Свои названия они получили из-за различий в строении опухоли.
Клетки мелкоклеточного рака лёгкого меньше здоровых клеток. Врачам важно отличить именно этот вид рака от остальных, потому что его лечение отличается. А остальные раки – плоскоклеточный, аденокарцинома – объединяют под единым термином:
Рак лёгких занимает второе место по распространённости среди злокачественных опухолей (на первом месте – рак молочной железы). А для мужчин рак лёгкого на по распространённости первом месте. Заболевание редко встречается до 40 лет, чаще всего его обнаруживают в возрасте около 70.
А для мужчин рак лёгкого на по распространённости первом месте. Заболевание редко встречается до 40 лет, чаще всего его обнаруживают в возрасте около 70.
Причина рака лёгкого
Как и любой другой рак, рак лёгких вызван «поломкой» в нормальном процессе роста и развития клеток. В конкретном случае нарушается процесс образования клеток, которые выстилают бронхи и лёгкие.
Точная причина «поломок» неизвестна. Однако известны факторы, которые увеличивают риск развития рака легкого.
Вот факторы риска:
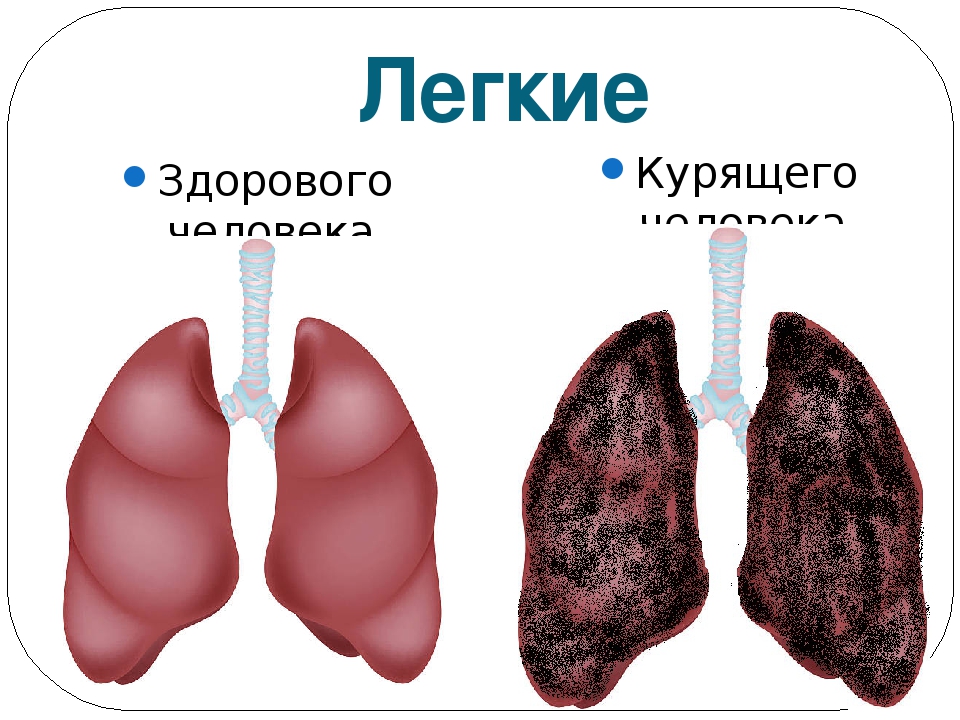
- курение (активное и пассивное) – увеличивает вероятность рака легких в 15 раз по сравнению с никогда не курившими людьми! 72% рака легкого вызвана курением
- работа с асбестом и другими химикатами (мышьяк, хром, никель, сажа, смола), длительное воздействие ионизирующего излучения (радона в шахтах). Вредная работа вызывает 13% рака легкого.
- загрязнение атмосферного воздуха. Вызывает 8% рака легкого
- радиолучевая терапия на область груди в прошлом
- наличие рака лёгких в прошлом (это риск рецидива)
- возраст старше 65 лет
Как снизить риск рака легких.
Важнее всего – отказаться от курения и постараться снизить воздействие других факторов, если они есть.
Табак и здоровье легких — Новости
Каждый год 31 мая Всемирная организация здравоохранения (ВОЗ) и ее партнеры по всему миру отмечают Всемирный день без табака. Ежегодная кампания служит поводом для широкого информирования о вредных и смертельных последствиях употребления табака и пассивного курения, а также содействия сокращению употребления табака в любой форме.
пагубных последствиях употребления табака для легких человека, от рака до хронических респираторных заболеваний;
важнейшей роли легких для здоровья и благополучия каждого человека.
Еще одна задача кампании — призвать заинтересованные стороны из различных секторов к практическим действиям, убедить их в необходимости эффективных мер по сокращению употребления табака и привлечь к борьбе за победу над табаком.

Как табак угрожает здоровью легких людей по всему миру
Особое внимание во Всемирный день без табака 2019 г. будет уделено многообразию негативных последствий воздействия табака для здоровья человека во всем мире.
К ним относятся:
Рак легких. Табакокурение является ведущей причиной развития рака легких, и на его долю приходится более двух третей случаев смерти от этой болезни в мире. Воздействие вторичного табачного дыма в домашней обстановке и на работе также повышает риск рака легких. Отказ от курения может снизить риск заболевания раком легких: через 10 лет после прекращения курения риск развития рака легких сокращается примерно в половину по сравнению с риском для курильщика.
Хронические респираторные заболевания. Курение табака является ведущей причиной хронической обструктивной болезни легких (ХОБЛ) — заболевания, при котором накопление гнойной слизи в легких вызывает болезненный кашель и мучительное затруднение дыхания. Риск развития ХОБЛ особенно высок среди лиц, начинающих курить в молодом возрасте, поскольку табачный дым значительно замедляет развитие легких.
 Табак также усугубляет астму, которая ограничивает активность и способствует утрате трудоспособности. Скорейшее прекращение курения — наиболее эффективный способ замедлить развитие ХОБЛ и облегчить симптомы астмы.
Табак также усугубляет астму, которая ограничивает активность и способствует утрате трудоспособности. Скорейшее прекращение курения — наиболее эффективный способ замедлить развитие ХОБЛ и облегчить симптомы астмы.Согласно оценкам, от инфекций нижних дыхательных путей, вызванных пассивным курением, в мире умирают 165 000 детей, не достигших 5 лет. Те, кто доживают до взрослого возраста, продолжают ощущать воздействие вторичного табачного дыма на свое здоровье, поскольку частые инфекции нижних дыхательных путей в раннем детстве значительно повышают риск развития ХОБЛ во взрослом возрасте.

Туберкулез. Туберкулез (ТБ) поражает легкие и ослабляет легочную функцию, которая еще больше страдает от курения табака. Химические компоненты табачного дыма могут провоцировать латентную инфекцию ТБ, которая имеется примерно у каждого четвертого человека. Активная форма ТБ, осложненная пагубным воздействием табакокурения на состояние легких, значительно повышает риск инвалидности и смерти от дыхательной недостаточности.
Загрязнение воздуха. Табачный дым представляет собой крайне опасную форму загрязнения воздуха: в нем содержится более 7 000 химических веществ, из которых 69 веществ входят в число известных канцерогенов. Каким бы незаметным и лишенным запаха ни был табачный дым, он может задерживаться в воздухе в течение почти пяти часов, подвергая присутствующих риску развития рака легких, хронических респираторных заболеваний и снижения легочной функции.
Наиболее действенной мерой по улучшению состояния легких является сокращение потребления табака и вдыхания вторичного табачного дыма.
 Однако в некоторых странах широкие слои населения, и особенно курильщики, мало знают о последствиях курения табака и пассивного курения для здоровья легких человека. Несмотря на убедительные доказательства того, что табак наносит вред здоровью легких, потенциальная эффективность мер против табака в плане улучшения здоровья легких до сих пор недооценивается.
Однако в некоторых странах широкие слои населения, и особенно курильщики, мало знают о последствиях курения табака и пассивного курения для здоровья легких человека. Несмотря на убедительные доказательства того, что табак наносит вред здоровью легких, потенциальная эффективность мер против табака в плане улучшения здоровья легких до сих пор недооценивается.Кампания по случаю Всемирного дня без табака 2019 г. призвана повысить осведомленность в следующих вопросах:
риски, связанные с курением табака и воздействием вторичного табачного дыма;
информация о конкретных опасностях табакокурения для здоровья легких;
глобальные масштабы смертности и заболеваемости от болезней легких, вызванных табаком, включая хронические респираторные заболевания и рак легких;
новые фактические данные о связи между курением табака и смертностью от туберкулеза;
последствия воздействия вторичного дыма для здоровья легких людей различного возраста;
важная роль здоровья легких для достижения общего здоровья и благополучия;
возможные действия и меры, которые могут быть приняты ключевыми сторонами, включая общественность и государственные органы, для уменьшения связанных с табаком рисков для здоровья легких.
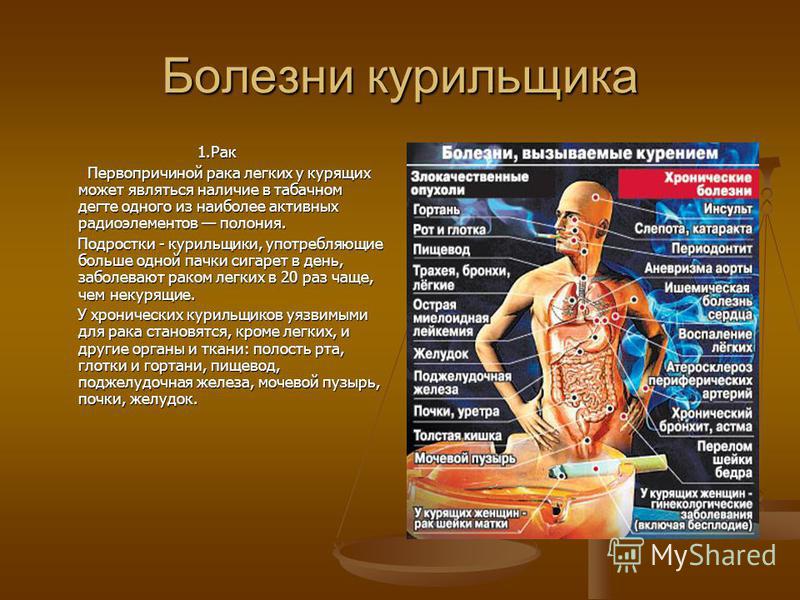
Центральная тема «Табак и здоровье легких» имеет значение и для других глобальных процессов, включая международные усилия по борьбе с неинфекционными заболеваниями (НИЗ), туберкулезом и загрязнением воздуха в целях укрепления здоровья. Она служит поводом привлечь заинтересованные стороны из различных секторов и расширить возможности стран для более активного осуществления доказавших свою эффективность мер по борьбе против табака MPOWER, предусмотренных в Рамочной конвенции ВОЗ по борьбе против табака (РКБТ ВОЗ).
Курение и рак легких
Proc Am Thorac Soc. 1 декабря 2008 г .; 5 (8): 811–815.
Роль воспаления
, 1 , 1 , 1 , 2 , 3 , 4 , 1 , 5 , 1 , 2 , 5 и 1 , 2 , 4 , 51 Отделение легочной медицины и реанимации, Медицинское отделение; 2 Программа исследований рака легких Универсального онкологического центра Йонссона; 3 Отделение кардиоторакальной хирургии, Отделение хирургии; и 4 Департамент патологии и лабораторной медицины и Медицинская школа Дэвида Геффена в Калифорнийском университете в Лос-Анджелесе, Калифорния; и 5 Veterans ‘Affairs Greater Los Angeles Healthcare System, Лос-Анджелес, Калифорния
Переписка и запросы на перепечатку следует направлять Стивену М. Дубинетт, доктор медицины, Программа исследования рака легких, Отделение легочной медицины и реанимации, 37-131 CHS, 10833 Le Conte Avenue, Медицинская школа Дэвида Геффена в Калифорнийском университете в Лос-Анджелесе, Калифорния-1690. Электронная почта: ude.alcu.tendem@ttenibuds
Дубинетт, доктор медицины, Программа исследования рака легких, Отделение легочной медицины и реанимации, 37-131 CHS, 10833 Le Conte Avenue, Медицинская школа Дэвида Геффена в Калифорнийском университете в Лос-Анджелесе, Калифорния-1690. Электронная почта: ude.alcu.tendem@ttenibudsПолучено 3 сентября 2008 г .; Принято 5 сентября 2008 г.
© Американское торакальное общество, 2008 г. Эта статья цитируется в других статьях в PMC.Abstract
Ежегодно во всем мире от рака легких умирает более 1 миллиона человек. Подсчитано, что курение сигарет объясняет почти 90% риска рака легких у мужчин и от 70 до 80% у женщин.Клинически очевидный рак легких имеет множественные генетические и эпигенетические аномалии. Эти отклонения могут привести к активации онкогенов и инактивации генов-супрессоров опухолей. Хроническое воспаление, которое, как известно, способствует развитию рака, может быть результатом как курения, так и генетических аномалий. Эти медиаторы, в свою очередь, могут быть ответственны за увеличение рекрутирования макрофагов, задержку клиренса нейтрофилов и увеличение количества активных форм кислорода (АФК). Таким образом, легочная среда представляет собой уникальную среду, в которой канцерогенез легких протекает совместно с клеточной сетью хозяина.Заболевания легких, связанные с наибольшим риском рака легких, характеризуются обильным и нерегулируемым воспалением. Легочные заболевания, такие как хроническая обструктивная болезнь легких (ХОБЛ) / эмфизема, характеризуются глубокими нарушениями воспалительных и фиброзных путей. Было обнаружено, что цитокины и факторы роста, аберрантно продуцируемые при ХОБЛ и развивающемся микроокружении опухоли, обладают вредными свойствами, которые одновременно открывают путь как для эпителиально-мезенхимального перехода (EMT), так и для разрушения специфических иммунных ответов, опосредованных клетками-хозяевами.Полное определение этих путей даст возможность вмешиваться в специфические воспалительные процессы, опосредующие онкогенез легких и резистентность к терапии.
Таким образом, легочная среда представляет собой уникальную среду, в которой канцерогенез легких протекает совместно с клеточной сетью хозяина.Заболевания легких, связанные с наибольшим риском рака легких, характеризуются обильным и нерегулируемым воспалением. Легочные заболевания, такие как хроническая обструктивная болезнь легких (ХОБЛ) / эмфизема, характеризуются глубокими нарушениями воспалительных и фиброзных путей. Было обнаружено, что цитокины и факторы роста, аберрантно продуцируемые при ХОБЛ и развивающемся микроокружении опухоли, обладают вредными свойствами, которые одновременно открывают путь как для эпителиально-мезенхимального перехода (EMT), так и для разрушения специфических иммунных ответов, опосредованных клетками-хозяевами.Полное определение этих путей даст возможность вмешиваться в специфические воспалительные процессы, опосредующие онкогенез легких и резистентность к терапии.
Ключевые слова: курение, воспаление, рак легких, ХОБЛ; EMT
Рак легких — основная причина смерти от рака как в Соединенных Штатах, так и во всем мире. По оценкам, в 2007 году рак легких станет причиной более 160 000 смертей в Соединенных Штатах и более миллиона смертей во всем мире. Самым важным фактором риска рака легких является курение табака, и данные, подтверждающие эту взаимосвязь, убедительны (1).По сравнению с некурящими, у курильщиков риск развития рака в 30 раз выше (1–3). Тридцать один процент и 26% всех случаев смерти от рака у мужчин и женщин, соответственно, являются результатом рака легких в Соединенных Штатах. Общая 5-летняя выживаемость составляет всего 15%, а 1-летняя выживаемость составляет примерно 42%. В целом, рак легких вызывает больше смертей, чем рак простаты, толстой кишки, поджелудочной железы и груди вместе взятые. Волошин с соавторами недавно сформулировали риски для здоровья, связанные с курением, в другом контексте (4).Для мужчин в возрасте 60 лет и старше, которые в настоящее время курят, шанс умереть от рака легких имеет тот же порядок величины, что и шанс умереть от сердечного заболевания. После 50 лет это в 10 раз больше, чем шанс умереть от рака простаты или толстой кишки.
По оценкам, в 2007 году рак легких станет причиной более 160 000 смертей в Соединенных Штатах и более миллиона смертей во всем мире. Самым важным фактором риска рака легких является курение табака, и данные, подтверждающие эту взаимосвязь, убедительны (1).По сравнению с некурящими, у курильщиков риск развития рака в 30 раз выше (1–3). Тридцать один процент и 26% всех случаев смерти от рака у мужчин и женщин, соответственно, являются результатом рака легких в Соединенных Штатах. Общая 5-летняя выживаемость составляет всего 15%, а 1-летняя выживаемость составляет примерно 42%. В целом, рак легких вызывает больше смертей, чем рак простаты, толстой кишки, поджелудочной железы и груди вместе взятые. Волошин с соавторами недавно сформулировали риски для здоровья, связанные с курением, в другом контексте (4).Для мужчин в возрасте 60 лет и старше, которые в настоящее время курят, шанс умереть от рака легких имеет тот же порядок величины, что и шанс умереть от сердечного заболевания. После 50 лет это в 10 раз больше, чем шанс умереть от рака простаты или толстой кишки. Для курящих женщин шанс смерти от рака легких превышает шанс умереть от рака груди с 40 лет и старше (4). Воспалительная реакция, вызванная курением табака, дает набор нерегулируемых клеток, цитокинов и факторов роста, которые способствуют развитию как хронической обструктивной болезни легких (ХОБЛ), так и рака легких.Было высказано предположение, что воспаление способствует развитию рака легких несколькими возможными путями. Например, реактивные формы азота или кислорода, полученные из воспалительных клеток, могут связываться с ДНК и, таким образом, приводить к геномным изменениям (5, 6).
Для курящих женщин шанс смерти от рака легких превышает шанс умереть от рака груди с 40 лет и старше (4). Воспалительная реакция, вызванная курением табака, дает набор нерегулируемых клеток, цитокинов и факторов роста, которые способствуют развитию как хронической обструктивной болезни легких (ХОБЛ), так и рака легких.Было высказано предположение, что воспаление способствует развитию рака легких несколькими возможными путями. Например, реактивные формы азота или кислорода, полученные из воспалительных клеток, могут связываться с ДНК и, таким образом, приводить к геномным изменениям (5, 6).
Таким образом, воспаление легких может играть роль в инициации или развитии рака. Легочная среда при ХОБЛ, включая продолжающееся восстановление тканей с усиленной клеточной пролиферацией, может способствовать как мутации ДНК, так и ангиогенезу (6). Кроме того, провоспалительные цитокины, высвобождаемые в этой среде, повышают устойчивость эпителия к апоптозу.
КУРЕНИЕ, ВОСПАЛЕНИЕ И РАК ЛЕГКОГО
Рак легкого развивается в результате серии мутационных событий, которые были подробно изучены многочисленными исследователями (7). Однако молекулярный патогенез рака легких остается не полностью определенным. Поскольку воспаление, по-видимому, играет важную роль в патогенезе рака легких, глубокое понимание патогенеза рака легких требует рассмотрения микроокружения опухоли (TME) и воспалительных путей, действующих в канцерогенезе (8).
Однако молекулярный патогенез рака легких остается не полностью определенным. Поскольку воспаление, по-видимому, играет важную роль в патогенезе рака легких, глубокое понимание патогенеза рака легких требует рассмотрения микроокружения опухоли (TME) и воспалительных путей, действующих в канцерогенезе (8).
Вызванная табаком легочная клеточная сеть представляет собой уникальную среду, в которой канцерогенез протекает совместно с окружающими легкими воспалительными, структурными и стромальными клетками. Заболевания легких, связанные с наибольшим риском рака легких, характеризуются обильным и нерегулируемым воспалением (9–11). Легочные заболевания, такие как ХОБЛ, характеризуются глубокими нарушениями воспалительных путей (12–14). Например, среди цитокинов, факторов роста и медиаторов, высвобождаемых при этих заболеваниях легких и развивающихся TME, были обнаружены интерлейкин (IL) -1β, простагландин (PG) E 2 и трансформирующий фактор роста (TGF) -β. обладать вредными свойствами, которые одновременно открывают путь как для эпителиально-мезенхимального перехода (EMT), так и для разрушения специфических опосредованных клетками-хозяевами иммунных ответов против опухолевых антигенов (15-19).
Общие черты курения, ХОБЛ и рака легких начинаются с глубоких изменений, вызванных сигаретным дымом, который содержит известные канцерогены, а также высокий уровень активных форм кислорода (АФК). Быстрая индукция АФК после воздействия табачного дыма приводит к нарушению функции эпителиальных и эндотелиальных клеток, а также к воспалению. Текущие воспалительные процессы при ХОБЛ могут сохраняться даже после отказа от курения и были количественно определены и связаны с прогрессированием заболевания (20).По мере прогрессирования ХОБЛ увеличивается процент дыхательных путей, содержащих макрофаги, нейтрофилы, Т-клетки, В-клетки и лимфоидные агрегаты, содержащие фолликулы (20).
ПОЛЕВЫЙ ЭФФЕКТ РАКА
Начиная с новаторских исследований Ауэрбаха и его коллег (21), обширная литература документально подтверждает, что респираторный эпителий курильщиков табака часто содержит многоочаговые предраковые поражения, которые могут возникать по всему бронхиальному дереву. Эти результаты были названы эффектом полевой канцеризации и подразумевают способность канцерогенов табака широко мутагенизировать респираторный эпителий (22). При анализе предракового и злокачественного эпителия пациентов с плоскоклеточной карциномой Вистуба с соавторами обнаружили множественные, последовательно возникающие аллель-специфические хромосомные делеции (потеря гетерозиготности) в широко рассредоточенных, очевидно клонально независимых очагах, на ранних этапах многоступенчатого патогенеза плоскоклеточного рака легких. (23–25). Эпителий бронхов у нынешних и бывших курильщиков также демонстрирует множественные очаги генетических изменений, как это наблюдается у пациентов с раком легких.Важно отметить, что эти изменения могут сохраняться в течение многих лет после отказа от курения (26–28). Эти стойкие аномалии служат движущей силой повышенного риска для растущего населения; в Соединенных Штатах Америки более 45 миллионов бывших курильщиков, и большинство новых диагнозов рака легких в настоящее время диагностируется у бывших курильщиков.
При анализе предракового и злокачественного эпителия пациентов с плоскоклеточной карциномой Вистуба с соавторами обнаружили множественные, последовательно возникающие аллель-специфические хромосомные делеции (потеря гетерозиготности) в широко рассредоточенных, очевидно клонально независимых очагах, на ранних этапах многоступенчатого патогенеза плоскоклеточного рака легких. (23–25). Эпителий бронхов у нынешних и бывших курильщиков также демонстрирует множественные очаги генетических изменений, как это наблюдается у пациентов с раком легких.Важно отметить, что эти изменения могут сохраняться в течение многих лет после отказа от курения (26–28). Эти стойкие аномалии служат движущей силой повышенного риска для растущего населения; в Соединенных Штатах Америки более 45 миллионов бывших курильщиков, и большинство новых диагнозов рака легких в настоящее время диагностируется у бывших курильщиков.
Помимо предраковых поражений, видимых при гистологическом исследовании, исследования подтверждают, что курение вызывает аномалии полевого эффекта даже в гистологически нормальном эпителии легких (26, 29, 30). Массивы экспрессии генов высокой плотности использовались для определения генов в эпителиальных клетках дыхательных путей человека, которые изменяются при курении сигарет (31–35). Ожидается, что данные, полученные в этих исследованиях, дадут представление о риске рака легких у курильщиков с ХОБЛ или без нее. Спира и его коллеги недавно сообщили, что профили экспрессии генов в гистологически нормальных эпителиальных клетках крупных дыхательных путей могут служить биомаркером наличия рака легких (36). Эти результаты являются убедительным доказательством наличия диффузной реакции дыхательных путей на табачный дым, которая не обязательно подтверждается обычными гистологическими исследованиями.Поскольку профили экспрессии генов в дыхательных путях предоставляют важную информацию о возможном развитии рака легких, которое не может быть адекватно предсказано только клинически определенным риском, Бин и его коллеги недавно предложили клинико-геномную модель, которая имеет более высокую точность прогноза (37).
Массивы экспрессии генов высокой плотности использовались для определения генов в эпителиальных клетках дыхательных путей человека, которые изменяются при курении сигарет (31–35). Ожидается, что данные, полученные в этих исследованиях, дадут представление о риске рака легких у курильщиков с ХОБЛ или без нее. Спира и его коллеги недавно сообщили, что профили экспрессии генов в гистологически нормальных эпителиальных клетках крупных дыхательных путей могут служить биомаркером наличия рака легких (36). Эти результаты являются убедительным доказательством наличия диффузной реакции дыхательных путей на табачный дым, которая не обязательно подтверждается обычными гистологическими исследованиями.Поскольку профили экспрессии генов в дыхательных путях предоставляют важную информацию о возможном развитии рака легких, которое не может быть адекватно предсказано только клинически определенным риском, Бин и его коллеги недавно предложили клинико-геномную модель, которая имеет более высокую точность прогноза (37).
Изменения экспрессии генов и клеточных функций, вызванные курением табака, не ограничиваются эпителием легочных дыхательных путей, но также наблюдались в носовом и буккальном эпителии (38, 39), альвеолярных макрофагах (40, 41) и периферической крови. (42).Эти данные согласуются с ранее представленными гипотезами о системном воспалительном процессе, действующем у пациентов с ХОБЛ, а также у пациентов с раком легких.
ЭПИТЕЛИАЛЬНО-МЕСЕНХИМАЛЬНЫЙ ПЕРЕХОД
EMT был первоначально описан как процесс в эмбриональном развитии. EMT состоит из сдвига в развитии от поляризованного эпителиального фенотипа к высокоподвижному фибробластоидному или мезенхимальному фенотипу (43). Помимо эмбрионального развития, EMT участвует в хроническом воспалении, фиброзе и развитии рака (44–47).В нормальном развитии ЭМП — это строго регулируемый процесс (47). Напротив, при развитии и прогрессировании рака EMT не регулируется, при этом отдельные элементы процесса усиливаются, а другие аспекты игнорируются (48). В настоящее время признано, что различные пути воздействия на EMT при раке. Например, путь TGF-β, PI3K / Akt, ROS, передача сигналов рецепторной тирозинкиназы / Ras и пути Wnt были среди тех, кто вовлечен (43, 44, 49). Таким образом, EMT применяется при различных злокачественных новообразованиях (50), включая рак легкого (48).
В настоящее время признано, что различные пути воздействия на EMT при раке. Например, путь TGF-β, PI3K / Akt, ROS, передача сигналов рецепторной тирозинкиназы / Ras и пути Wnt были среди тех, кто вовлечен (43, 44, 49). Таким образом, EMT применяется при различных злокачественных новообразованиях (50), включая рак легкого (48).
Недавно была подчеркнута связь между воспалением и прогрессированием ЭМП при развитии рака легкого и резистентностью к терапии (15, 51). Например, IL-1β и PGE 2 обладают способностью снижать экспрессию E-кадгерина и способствовать ЕМТ. Эти медиаторы воспаления обладают способностью активировать репрессоры транскрипции E-cadherin, связывающие E-box с цинковыми пальцами, включая Zeb1, Snail и Slug, что приводит к прогрессированию EMT (15, 52). Недавняя работа лаборатории Роберта Вайнберга предполагает прямую связь между ЭМП и усилением свойств эпителиальных стволовых клеток (53).Таким образом, воспаление может влиять на свойства стволовых клеток через EMT-зависимые события в патогенезе рака легких. В то время как изменения, вызванные EMT, широко участвуют в метастатическом процессе эпителиального злокачественного новообразования, работа Мани и его коллег предполагает, что генетическая программа EMT может также регулировать ранние события в канцерогенезе, таким образом, участвуя в воспалительной легочной среде как в инициации, так и в прогрессировании рака легких. Тот факт, что табак и специфические для табака канцерогены могут быть вовлечены в прямую или косвенную пропаганду ЕМТ, придает этим взаимоотношениям дополнительное значение.Например, Yoshino и соавторы (54) обнаружили, что бензо [a] пирен индуцирует связанные с EMT гены в клетках рака легких; в то время как фибронектин и Twist были индуцированы, экспрессия E-кадгерина прекратилась. В подтверждение этих результатов и в контексте другого злокачественного новообразования, вызванного табаком, Фондревель и его коллеги (55) обнаружили, что на экспрессию Twist влияет статус курения у пациентов с раком мочевого пузыря. Специфический для табака канцероген 4- (н-метил-н-нитрозамино) -1- (3-пиридил) -1-бутанон (NNK) также способствует ЕМТ посредством индукции репрессоров транскрипции Е-кадгерина в эпителиальных клетках бронхов человека.
В то время как изменения, вызванные EMT, широко участвуют в метастатическом процессе эпителиального злокачественного новообразования, работа Мани и его коллег предполагает, что генетическая программа EMT может также регулировать ранние события в канцерогенезе, таким образом, участвуя в воспалительной легочной среде как в инициации, так и в прогрессировании рака легких. Тот факт, что табак и специфические для табака канцерогены могут быть вовлечены в прямую или косвенную пропаганду ЕМТ, придает этим взаимоотношениям дополнительное значение.Например, Yoshino и соавторы (54) обнаружили, что бензо [a] пирен индуцирует связанные с EMT гены в клетках рака легких; в то время как фибронектин и Twist были индуцированы, экспрессия E-кадгерина прекратилась. В подтверждение этих результатов и в контексте другого злокачественного новообразования, вызванного табаком, Фондревель и его коллеги (55) обнаружили, что на экспрессию Twist влияет статус курения у пациентов с раком мочевого пузыря. Специфический для табака канцероген 4- (н-метил-н-нитрозамино) -1- (3-пиридил) -1-бутанон (NNK) также способствует ЕМТ посредством индукции репрессоров транскрипции Е-кадгерина в эпителиальных клетках бронхов человека. (56).
(56).
ЛЕГКИЕ ЭПИТЕЛИАЛЬНЫЕ КЛЕТКИ МОГУТ СЛУЖИТЬ МИШЕНЬ ДЛЯ ВОСПАЛЕНИЯ, А ТАКЖЕ ИНДУКТОРЫ АНОМАЛЬНЫХ ВОСПАЛИТЕЛЬНЫХ ОТВЕТОВ
Эпителиальные аномалии, вызванные курением, могут служить как мишенями для аномальных воспалительных реакций, так и инициаторами дерегулируемого воспаления. Цитокины, хемокины и факторы роста, выделяемые альвеолярными макрофагами, лимфоцитами, нейтрофилами, эндотелиальными клетками и фибробластами, могут способствовать эпителиальной дисфункции и злокачественному прогрессированию.Некоторые из этих взаимоотношений наиболее четко демонстрируются на генно-инженерных моделях мышей (57). Например, Вислез с соавторами использовали мышей Kras LA1 , у которых развивается аденокарцинома легких из-за соматической активации онкогена KRAS, для изучения важности лигандов хемокинового рецептора CXCR2 в патогенезе рака легких (58). Эндотелиальные клетки сосудов и нейтрофилы с высокой экспрессией лигандов CXCR2 и CXCR2 были обнаружены в предраковых альвеолярных поражениях мышей Kras LA1 . Важно отметить, что ингибирование CXCR2 блокирует распространение ранних альвеолярных неопластических поражений. Эти исследования согласуются с другими недавними открытиями, указывающими на то, что лиганд CXCR2 CXCL8 играет критическую роль в индуцированном Kras онкогенезе (59). Причастность CXCL8 указывает на другой общий путь в патогенезе ХОБЛ и рака легких.
Важно отметить, что ингибирование CXCR2 блокирует распространение ранних альвеолярных неопластических поражений. Эти исследования согласуются с другими недавними открытиями, указывающими на то, что лиганд CXCR2 CXCL8 играет критическую роль в индуцированном Kras онкогенезе (59). Причастность CXCL8 указывает на другой общий путь в патогенезе ХОБЛ и рака легких.
Эпителиальные клетки могут также служить местом дерегуляции воспалительных реакций при онкогенезе легких. Например, хроническое воздействие табачных соединений может привести к потере мутации p53 и Kras.Это, в свою очередь, может привести к нарушению регуляции воспаления и ангиогенеза. Комарова обнаружила, что p53, подавляя активность NF-κB, может служить «буфером» для воспалительных реакций (60). Это согласуется с функцией супрессора опухоли p53. Как отмечалось выше, мутации Kras могут служить движущей силой для генерации проангиогенных хемокинов CXC, таких как CXCL8. Кроме того, мутации Kras являются одним из стимулов, которые, как известно, вызывают конститутивное повышение уровня cyclooxygenase-2 (COX-2) в эпителиальных клетках, что приводит к высокому уровню продукции PGE 2 .
В нескольких исследованиях задокументирована высокая конститутивная экспрессия ЦОГ-2 в предшественниках поражений, а также подтвержденный рак легких у человека (61–66). В первоначальном отчете об экспрессии ЦОГ-2 при раке легких человека Хуанг и его коллеги оценили экспрессию ЦОГ-2 с помощью иммуногистохимии в опухолях и прилегающих нормальных тканях легких (61). И аденокарциномы, и плоскоклеточная карцинома показали цитоплазматическое окрашивание на ЦОГ-2 в опухолевых клетках. В последующих отчетах повышенная экспрессия ЦОГ-2 была показана при более сильном окрашивании метастазов в лимфатических узлах, чем в первичной опухоли (62, 63), а экспрессия ЦОГ-2 в опухоли оказалась плохим прогностическим индикатором (64, 65, 67).Эти результаты, наряду с исследованиями, документально подтверждающими повышенную экспрессию ЦОГ-2 в предшествующих поражениях (67–69), связь между общим полиморфизмом в гене ЦОГ-2 и повышенным риском рака легких (70), а также эпидемиологические исследования, указывающие на снижение заболеваемости.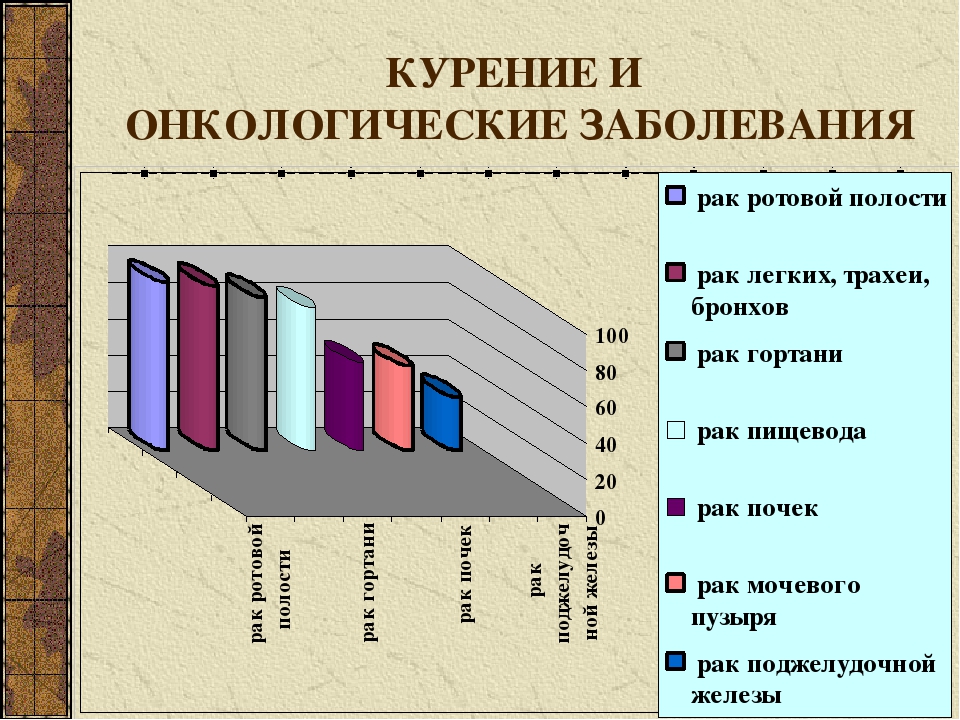 рака легких у людей, регулярно принимающих аспирин, подтверждают участие ЦОГ-2 и его ферментных продуктов в патогенезе рака легких (71). Таким образом, при развитии и прогрессировании рака легких повышение уровня ЦОГ-2 и PGE 2 является движущей силой для признаков злокачественности, включая устойчивость к апоптозу (72), пролиферацию (73), иммуносупрессию (74), ангиогенез (75), инвазию. (76) и EMT (15).Текущие исследования химиопрофилактики у пациентов с риском рака легких в настоящее время оценивают блокаду эйкозаноидного пути.
рака легких у людей, регулярно принимающих аспирин, подтверждают участие ЦОГ-2 и его ферментных продуктов в патогенезе рака легких (71). Таким образом, при развитии и прогрессировании рака легких повышение уровня ЦОГ-2 и PGE 2 является движущей силой для признаков злокачественности, включая устойчивость к апоптозу (72), пролиферацию (73), иммуносупрессию (74), ангиогенез (75), инвазию. (76) и EMT (15).Текущие исследования химиопрофилактики у пациентов с риском рака легких в настоящее время оценивают блокаду эйкозаноидного пути.
В то время как ферменты ЦОГ экспрессируются на низких конститутивных уровнях в нормальном легком, различные факторы могут способствовать усилению регуляции ЦОГ-2 в среде развивающегося рака легких. Это повышение COX-2 приводит к усиленному продуцированию вредных продуктов PG, включая PGE 2 , который обладает хорошо установленными про-онкогенными эффектами. В число факторов, способствующих стойкому увеличению COX-2 в эпителиальных стромальных клетках и клетках рака легких, входят цитокины, такие как IL-1β и TGF-β, факторы роста, включая эпидермальный фактор роста, онкогенные явления, такие как мутантный Kras или потеря p53, гипоксия и табак. специфические канцерогены (61, 77–79).Как только COX-2 активируется в клетках рака легких, его повышение может поддерживаться аномалиями в сигнальных путях, необходимых для подавления COX-2. Двумя такими аномалиями являются потеря экспрессии рецептора IL-10 и конститутивная ядерная локализация STAT-6 (80, 81). Химиотерапия, включая таксаны, также может стабилизировать мРНК ЦОГ-2, что приводит к ее пролонгированной и нерегулируемой экспрессии (82).
специфические канцерогены (61, 77–79).Как только COX-2 активируется в клетках рака легких, его повышение может поддерживаться аномалиями в сигнальных путях, необходимых для подавления COX-2. Двумя такими аномалиями являются потеря экспрессии рецептора IL-10 и конститутивная ядерная локализация STAT-6 (80, 81). Химиотерапия, включая таксаны, также может стабилизировать мРНК ЦОГ-2, что приводит к ее пролонгированной и нерегулируемой экспрессии (82).
ВЫВОДЫ
Рак легких часто тесно связан с курением табака и воспалением.Изучение этих взаимосвязей приведет к более полной картине легочной среды, подверженной риску развития рака легких. Новые исследования будут пересматривать оригинальные открытия Ауэрбаха и его коллег с применением мощных инструментов современной геномики, протеомики и визуализации. Уточненные определения воспаления легких и предзлокачественных новообразований откроют новые возможности для достижений в оценке и профилактике рисков.
Примечания
Заявление о конфликте интересов : T. W. не имеет финансовых отношений с коммерческой организацией, которая заинтересована в предмете данной рукописи. X.C. не имеет финансовых отношений с коммерческой организацией, которая заинтересована в предмете данной рукописи. J.Y. не имеет финансовых отношений с коммерческой организацией, которая заинтересована в предмете данной рукописи. J.M.L. не имеет финансовых отношений с коммерческой организацией, которая заинтересована в предмете данной рукописи. Э.H. не имеет финансовых отношений с коммерческой организацией, которая заинтересована в предмете данной рукописи. G.L. не имеет финансовых отношений с коммерческой организацией, которая заинтересована в предмете данной рукописи. S.S. не имеет финансовых отношений с коммерческой организацией, которая заинтересована в предмете данной рукописи. S.M.D. получил поддержку для поездки на встречу, спонсируемую AstraZeneca. Он также является членом Научно-консультативного совета Tragara Pharmaceuticals.
W. не имеет финансовых отношений с коммерческой организацией, которая заинтересована в предмете данной рукописи. X.C. не имеет финансовых отношений с коммерческой организацией, которая заинтересована в предмете данной рукописи. J.Y. не имеет финансовых отношений с коммерческой организацией, которая заинтересована в предмете данной рукописи. J.M.L. не имеет финансовых отношений с коммерческой организацией, которая заинтересована в предмете данной рукописи. Э.H. не имеет финансовых отношений с коммерческой организацией, которая заинтересована в предмете данной рукописи. G.L. не имеет финансовых отношений с коммерческой организацией, которая заинтересована в предмете данной рукописи. S.S. не имеет финансовых отношений с коммерческой организацией, которая заинтересована в предмете данной рукописи. S.M.D. получил поддержку для поездки на встречу, спонсируемую AstraZeneca. Он также является членом Научно-консультативного совета Tragara Pharmaceuticals.
Ссылки
1. Youlden DR, Cramb SM, Baade PD. Международная эпидемиология рака легких: географическое распространение и вековые тенденции. J Thorac Oncol 2008; 3: 819–831. [PubMed] [Google Scholar] 2. Sasco AJ, Secretan MB, Straif K. Табакокурение и рак: краткий обзор последних эпидемиологических данных. Рак легких 2004; 45: S3 – S9. [PubMed] [Google Scholar] 3. Проктор Р.Н. Табак и глобальная эпидемия рака легких. Nat Rev Cancer 2001; 1: 82–86.[PubMed] [Google Scholar] 4. Волошин С, Шварц Л.М., Велч Х.Г. Риск смерти в зависимости от возраста, пола и статуса курения в США: рассмотрение рисков для здоровья в контексте. J Natl Cancer Inst 2008; 100: 845–853. [Бесплатная статья PMC] [PubMed] [Google Scholar] 5. Вайцман С.А., Гордон Л.И. Воспаление и рак: роль оксидантов фагоцитов в канцерогенезе. Кровь 1990; 76: 655–663. [PubMed] [Google Scholar] 6. Энгельс Е.А. Воспаление в развитии рака легкого: эпидемиологические данные. Expert Rev Anticancer Ther 2008; 8: 605–615. [PubMed] [Google Scholar] 7.
Международная эпидемиология рака легких: географическое распространение и вековые тенденции. J Thorac Oncol 2008; 3: 819–831. [PubMed] [Google Scholar] 2. Sasco AJ, Secretan MB, Straif K. Табакокурение и рак: краткий обзор последних эпидемиологических данных. Рак легких 2004; 45: S3 – S9. [PubMed] [Google Scholar] 3. Проктор Р.Н. Табак и глобальная эпидемия рака легких. Nat Rev Cancer 2001; 1: 82–86.[PubMed] [Google Scholar] 4. Волошин С, Шварц Л.М., Велч Х.Г. Риск смерти в зависимости от возраста, пола и статуса курения в США: рассмотрение рисков для здоровья в контексте. J Natl Cancer Inst 2008; 100: 845–853. [Бесплатная статья PMC] [PubMed] [Google Scholar] 5. Вайцман С.А., Гордон Л.И. Воспаление и рак: роль оксидантов фагоцитов в канцерогенезе. Кровь 1990; 76: 655–663. [PubMed] [Google Scholar] 6. Энгельс Е.А. Воспаление в развитии рака легкого: эпидемиологические данные. Expert Rev Anticancer Ther 2008; 8: 605–615. [PubMed] [Google Scholar] 7. Сато М., Шамес Д.С., Газдар А.Ф., Минна Дж.Д. Трансляционный взгляд на молекулярный патогенез рака легких. J Thorac Oncol 2007; 2: 327–343. [PubMed] [Google Scholar] 8. Prendergast GC. Медиаторы воспаления в этиологии рака и мишени для терапии и профилактики. Cancer Reviews Online 2008; 9: 17–18. [Google Scholar] 11. Севеноукс М.Дж., Стокли Р.А. Хроническая обструктивная болезнь легких, воспаление и сопутствующие заболевания: общий воспалительный фенотип? Respir Res 2006; 7: 70.[Бесплатная статья PMC] [PubMed] [Google Scholar] 12. Рейнольдс PR, Cosio MG, Hoidal JR. Вызванный сигаретным дымом Egr-1 активирует провоспалительные цитокины в легочных эпителиальных клетках. Am J Respir Cell Mol Biol 2006; 35: 314–319. [Бесплатная статья PMC] [PubMed] [Google Scholar] 13. Смит CJ, Perfetti TA, King JA. Перспективы воспаления легких и риска рака легких у курильщиков сигарет. Inhal Toxicol 2006; 18: 667–677. [PubMed] [Google Scholar] 14. Ким В.
Сато М., Шамес Д.С., Газдар А.Ф., Минна Дж.Д. Трансляционный взгляд на молекулярный патогенез рака легких. J Thorac Oncol 2007; 2: 327–343. [PubMed] [Google Scholar] 8. Prendergast GC. Медиаторы воспаления в этиологии рака и мишени для терапии и профилактики. Cancer Reviews Online 2008; 9: 17–18. [Google Scholar] 11. Севеноукс М.Дж., Стокли Р.А. Хроническая обструктивная болезнь легких, воспаление и сопутствующие заболевания: общий воспалительный фенотип? Respir Res 2006; 7: 70.[Бесплатная статья PMC] [PubMed] [Google Scholar] 12. Рейнольдс PR, Cosio MG, Hoidal JR. Вызванный сигаретным дымом Egr-1 активирует провоспалительные цитокины в легочных эпителиальных клетках. Am J Respir Cell Mol Biol 2006; 35: 314–319. [Бесплатная статья PMC] [PubMed] [Google Scholar] 13. Смит CJ, Perfetti TA, King JA. Перспективы воспаления легких и риска рака легких у курильщиков сигарет. Inhal Toxicol 2006; 18: 667–677. [PubMed] [Google Scholar] 14. Ким В. , Роджерс Т.Дж., Крайнер Г.Дж.Новые концепции в патобиологии хронической обструктивной болезни легких. Proc Am Thorac Soc 2008; 5: 478–485. [Бесплатная статья PMC] [PubMed] [Google Scholar] 15. Dohadwala M, Yang SC, Luo J, Sharma S, Batra RK, Huang M, Lin Y, Goodglick L, Krysan K, Fishbein MC, et al. Циклооксигеназа-2-зависимая регуляция E-кадгерина: простагландин E (2) индуцирует репрессоры транскрипции ZEB1 и улитку при немелкоклеточном раке легкого. Cancer Res 2006; 66: 5338–5345. [PubMed] [Google Scholar] 16.Чаруворн Б., Дохадвала М., Крысан К., Шарма С., Эскуадро Б., Дубинетт С.М. Опосредованное воспалением продвижение ЕМТ при НМРЛ: IL-1b опосредует MEK / Erk- и JNK / SAPK-зависимую регуляцию E-кадгерина [аннотация]. Proc Am Thorac Soc 2006; 3: D96 [Google Scholar] 17. Барателли Ф, Линь И, Чжу Л., Ян С.К., Хеузе-Вурч Н, Зенг Г., Реккамп К., Дохадвала М., Шарма С., Дубинетт С.М. Простагландин E 2 индуцирует экспрессию гена FOXP3 и функцию Т-регуляторных клеток в человеческих CD4 + Т-клетках.
, Роджерс Т.Дж., Крайнер Г.Дж.Новые концепции в патобиологии хронической обструктивной болезни легких. Proc Am Thorac Soc 2008; 5: 478–485. [Бесплатная статья PMC] [PubMed] [Google Scholar] 15. Dohadwala M, Yang SC, Luo J, Sharma S, Batra RK, Huang M, Lin Y, Goodglick L, Krysan K, Fishbein MC, et al. Циклооксигеназа-2-зависимая регуляция E-кадгерина: простагландин E (2) индуцирует репрессоры транскрипции ZEB1 и улитку при немелкоклеточном раке легкого. Cancer Res 2006; 66: 5338–5345. [PubMed] [Google Scholar] 16.Чаруворн Б., Дохадвала М., Крысан К., Шарма С., Эскуадро Б., Дубинетт С.М. Опосредованное воспалением продвижение ЕМТ при НМРЛ: IL-1b опосредует MEK / Erk- и JNK / SAPK-зависимую регуляцию E-кадгерина [аннотация]. Proc Am Thorac Soc 2006; 3: D96 [Google Scholar] 17. Барателли Ф, Линь И, Чжу Л., Ян С.К., Хеузе-Вурч Н, Зенг Г., Реккамп К., Дохадвала М., Шарма С., Дубинетт С.М. Простагландин E 2 индуцирует экспрессию гена FOXP3 и функцию Т-регуляторных клеток в человеческих CD4 + Т-клетках. J Immunol 2005; 175: 1483–1490. [PubMed] [Google Scholar] 18. Кешамуни В.Г., Михайлидис Г., Грассо С.С., Антвал С., Стралер Дж.Р., Уокер А., Аренберг Д.А., Редди Р.К., Акулапалли С., Танникал В.Дж., и другие. Профилирование дифференциальной экспрессии белков с помощью iTRAQ-2DLC-MS / MS клеток рака легкого, претерпевающих эпителиально-мезенхимальный переход, выявляет мигрирующий / инвазивный фенотип. J Proteome Res 2006; 5: 1143–1154. [PubMed] [Google Scholar] 19. Ленг К., Бентвич З., Боркоу Г. Повышенные уровни TGF-β, Cbl-b и CTLA-4 и иммуносупрессия в сочетании с хронической иммунной активацией. Int Immunol 2006; 18: 637–644. [PubMed] [Google Scholar] 20. Hogg JC, Chu F, Utokaparch S, Woods R, Elliott WM, Buzatu L, Cherniack RM, Rogers RM, Sciurba FC, Coxson HO, et al. Природа обструкции мелких дыхательных путей при хронической обструктивной болезни легких. N Engl J Med 2004; 350: 2645–2653. [PubMed] [Google Scholar] 21.
J Immunol 2005; 175: 1483–1490. [PubMed] [Google Scholar] 18. Кешамуни В.Г., Михайлидис Г., Грассо С.С., Антвал С., Стралер Дж.Р., Уокер А., Аренберг Д.А., Редди Р.К., Акулапалли С., Танникал В.Дж., и другие. Профилирование дифференциальной экспрессии белков с помощью iTRAQ-2DLC-MS / MS клеток рака легкого, претерпевающих эпителиально-мезенхимальный переход, выявляет мигрирующий / инвазивный фенотип. J Proteome Res 2006; 5: 1143–1154. [PubMed] [Google Scholar] 19. Ленг К., Бентвич З., Боркоу Г. Повышенные уровни TGF-β, Cbl-b и CTLA-4 и иммуносупрессия в сочетании с хронической иммунной активацией. Int Immunol 2006; 18: 637–644. [PubMed] [Google Scholar] 20. Hogg JC, Chu F, Utokaparch S, Woods R, Elliott WM, Buzatu L, Cherniack RM, Rogers RM, Sciurba FC, Coxson HO, et al. Природа обструкции мелких дыхательных путей при хронической обструктивной болезни легких. N Engl J Med 2004; 350: 2645–2653. [PubMed] [Google Scholar] 21. Auerbach O, Stout AP, Hammond EC, Garfinkel L. Изменения в эпителии бронхов в связи с курением сигарет и в отношении рака легких. N Engl J Med 1961; 265: 253–267. [PubMed] [Google Scholar] 22. Вистуба II. Генетика пренеоплазии: уроки рака легкого. Curr Mol Med 2007; 7: 3–14. [PubMed] [Google Scholar] 23. Вистуба II, Беренс С., Милчгруб С., Брайант Д., Хунг Дж., Минна Дж. Д., Газдар А.Ф. Последовательные молекулярные аномалии вовлечены в многоэтапное развитие плоскоклеточного рака легкого. Онкоген 1999; 18: 643–650. [PubMed] [Google Scholar] 24. Wistuba II, Behrens C, Virmani AK, Mele G, Milchgrub S, Girard L, Fondon JW III, Garner HR, McKay B., Latif F, et al. Аллелотипирование хромосомы 3p с высоким разрешением при раке легких человека и пренеопластическом / преинвазивном бронхиальном эпителии выявляет множественные прерывистые участки потери аллеля 3p и три области с частыми точками разрыва. Cancer Res 2000; 60: 1949–1960. [PubMed] [Google Scholar] 25.
Auerbach O, Stout AP, Hammond EC, Garfinkel L. Изменения в эпителии бронхов в связи с курением сигарет и в отношении рака легких. N Engl J Med 1961; 265: 253–267. [PubMed] [Google Scholar] 22. Вистуба II. Генетика пренеоплазии: уроки рака легкого. Curr Mol Med 2007; 7: 3–14. [PubMed] [Google Scholar] 23. Вистуба II, Беренс С., Милчгруб С., Брайант Д., Хунг Дж., Минна Дж. Д., Газдар А.Ф. Последовательные молекулярные аномалии вовлечены в многоэтапное развитие плоскоклеточного рака легкого. Онкоген 1999; 18: 643–650. [PubMed] [Google Scholar] 24. Wistuba II, Behrens C, Virmani AK, Mele G, Milchgrub S, Girard L, Fondon JW III, Garner HR, McKay B., Latif F, et al. Аллелотипирование хромосомы 3p с высоким разрешением при раке легких человека и пренеопластическом / преинвазивном бронхиальном эпителии выявляет множественные прерывистые участки потери аллеля 3p и три области с частыми точками разрыва. Cancer Res 2000; 60: 1949–1960. [PubMed] [Google Scholar] 25. Вистуба II, Берри Дж., Беренс С., Майтра А., Шивапуркар Н., Милчгруб С., Маккай Б., Минна Дж. Д., Газдар А.Ф. Молекулярные изменения бронхиального эпителия у больных мелкоклеточным раком легкого. Clin Cancer Res 2000; 6: 2604–2610.[Бесплатная статья PMC] [PubMed] [Google Scholar] 26. Вистуба II, Лам С., Беренс С., Вирмани А. К., Фонг К. М., Лериш Дж., Самет Дж. М., Шривастава С., Минна Д. Д., Газдар А.Ф. Молекулярные повреждения эпителия бронхов у курящих и бывших курильщиков. J Natl Cancer Inst 1997; 89: 1366–1373. [Бесплатная статья PMC] [PubMed] [Google Scholar] 27. Франклин В.А., Газдар А.Ф., Хейни Дж., Вистуба II, Ла Роса Ф.Г., Кеннеди Т., Ричи Д.М., Миллер Ю.Э. Широко распространенная мутация p53 в респираторном эпителии: новый механизм полевого канцерогенеза. Дж. Клин Инвест 1997; 100: 2133–2137. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28. Яшима К., Литцки Л.А., Кайзер Л., Роджерс Т., Лам С., Вистуба II, Милчгруб С., Шривастава С., Пятышек М.
Вистуба II, Берри Дж., Беренс С., Майтра А., Шивапуркар Н., Милчгруб С., Маккай Б., Минна Дж. Д., Газдар А.Ф. Молекулярные изменения бронхиального эпителия у больных мелкоклеточным раком легкого. Clin Cancer Res 2000; 6: 2604–2610.[Бесплатная статья PMC] [PubMed] [Google Scholar] 26. Вистуба II, Лам С., Беренс С., Вирмани А. К., Фонг К. М., Лериш Дж., Самет Дж. М., Шривастава С., Минна Д. Д., Газдар А.Ф. Молекулярные повреждения эпителия бронхов у курящих и бывших курильщиков. J Natl Cancer Inst 1997; 89: 1366–1373. [Бесплатная статья PMC] [PubMed] [Google Scholar] 27. Франклин В.А., Газдар А.Ф., Хейни Дж., Вистуба II, Ла Роса Ф.Г., Кеннеди Т., Ричи Д.М., Миллер Ю.Э. Широко распространенная мутация p53 в респираторном эпителии: новый механизм полевого канцерогенеза. Дж. Клин Инвест 1997; 100: 2133–2137. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28. Яшима К., Литцки Л.А., Кайзер Л., Роджерс Т., Лам С., Вистуба II, Милчгруб С., Шривастава С., Пятышек М. А., Шай Дж.В., и др. Экспрессия теломеразы в респираторном эпителии во время многоэтапного патогенеза карциномы легких. Cancer Res 1997; 57: 2373–2377. [PubMed] [Google Scholar] 29. Мао Л., Ли Дж. С., Кури Дж. М., Фан Й. Х., Липпман С. М., Ли Дж. Дж., Ро Дж. Й., Броксон А., Ю Р., Морис Р. К., и др. Клональные генетические изменения в легких нынешних и бывших курильщиков. J Natl Cancer Inst 1997; 89: 857–862. [PubMed] [Google Scholar] 30. Park IW, Wistuba II, Maitra A, Milchgrub S, Virmani AK, Minna JD, Gazdar AF. Множественные клональные аномалии бронхиального эпителия у больных раком легкого. J Natl Cancer Inst 1999; 91: 1863–1868. [PubMed] [Google Scholar] 31. Спира А., Бин Дж., Шах В., Лю Дж., Шембри Ф., Ян Х, Пальма Дж., Броди Дж. С.. Влияние сигаретного дыма на транскриптом эпителиальных клеток дыхательных путей человека. Proc Natl Acad Sci USA 2004; 101: 10143–10148. [Бесплатная статья PMC] [PubMed] [Google Scholar] 32.
А., Шай Дж.В., и др. Экспрессия теломеразы в респираторном эпителии во время многоэтапного патогенеза карциномы легких. Cancer Res 1997; 57: 2373–2377. [PubMed] [Google Scholar] 29. Мао Л., Ли Дж. С., Кури Дж. М., Фан Й. Х., Липпман С. М., Ли Дж. Дж., Ро Дж. Й., Броксон А., Ю Р., Морис Р. К., и др. Клональные генетические изменения в легких нынешних и бывших курильщиков. J Natl Cancer Inst 1997; 89: 857–862. [PubMed] [Google Scholar] 30. Park IW, Wistuba II, Maitra A, Milchgrub S, Virmani AK, Minna JD, Gazdar AF. Множественные клональные аномалии бронхиального эпителия у больных раком легкого. J Natl Cancer Inst 1999; 91: 1863–1868. [PubMed] [Google Scholar] 31. Спира А., Бин Дж., Шах В., Лю Дж., Шембри Ф., Ян Х, Пальма Дж., Броди Дж. С.. Влияние сигаретного дыма на транскриптом эпителиальных клеток дыхательных путей человека. Proc Natl Acad Sci USA 2004; 101: 10143–10148. [Бесплатная статья PMC] [PubMed] [Google Scholar] 32. Аммоус З, Хакетт Н.Р., Батлер М.В., Раман Т., Долгалев И., О’Коннор Т.П., Харви Б.Г., Кристал Р.Г. Вариабельность экспрессии эпителиальных генов малых дыхательных путей среди нормальных курильщиков. Сундук 2008; 133: 1344–1353. [Бесплатная статья PMC] [PubMed] [Google Scholar] 33. Ланди М.Т., Драчева Т., Ротунно М., Фигероа Дж. Д., Лю Х., Дасгупта А., Манн Ф. Е., Фукуока Дж., Хамес М., Берген А. В., и др. Сигнатура экспрессии генов курения сигарет и ее роль в развитии и выживании аденокарциномы легких. PLoS ONE 2008; 3: e1651. [Бесплатная статья PMC] [PubMed] [Google Scholar] 34. Ван И.М., Степанянц С., Бои И., Мортимер Дж. Р., Кеннеди Б., Эллиотт М., Хаяши С., Лой Л., Колтер С., Червино С. и др. Профили экспрессии генов у пациентов с хронической обструктивной болезнью легких и раком легких. Am J Respir Crit Care Med 2008; 177: 402–411. [PubMed] [Google Scholar] 35. Чой И.Г., Квон Дж., Ким Ш. Частотный профиль локальных признаков: метод измерения структурного сходства белков.
Аммоус З, Хакетт Н.Р., Батлер М.В., Раман Т., Долгалев И., О’Коннор Т.П., Харви Б.Г., Кристал Р.Г. Вариабельность экспрессии эпителиальных генов малых дыхательных путей среди нормальных курильщиков. Сундук 2008; 133: 1344–1353. [Бесплатная статья PMC] [PubMed] [Google Scholar] 33. Ланди М.Т., Драчева Т., Ротунно М., Фигероа Дж. Д., Лю Х., Дасгупта А., Манн Ф. Е., Фукуока Дж., Хамес М., Берген А. В., и др. Сигнатура экспрессии генов курения сигарет и ее роль в развитии и выживании аденокарциномы легких. PLoS ONE 2008; 3: e1651. [Бесплатная статья PMC] [PubMed] [Google Scholar] 34. Ван И.М., Степанянц С., Бои И., Мортимер Дж. Р., Кеннеди Б., Эллиотт М., Хаяши С., Лой Л., Колтер С., Червино С. и др. Профили экспрессии генов у пациентов с хронической обструктивной болезнью легких и раком легких. Am J Respir Crit Care Med 2008; 177: 402–411. [PubMed] [Google Scholar] 35. Чой И.Г., Квон Дж., Ким Ш. Частотный профиль локальных признаков: метод измерения структурного сходства белков. Proc Natl Acad Sci USA 2004; 101: 3797–3802. [Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Spira A, Beane JE, Shah V, Steiling K, Liu G, Schembri F, Gilman S, Dumas YM, Calner P, Sebastiani P, et al. Экспрессия гена эпителия дыхательных путей в диагностической оценке курильщиков с подозрением на рак легкого. Nat Med 2007; 13: 361–366. [PubMed] [Google Scholar] 37. Бин Дж., Себастьяни П., Уитфилд Т.Х., Стейлинг К., Дюма Ю.М., Ленбург М.Э., Спира А. Прогнозирующая модель для диагностики рака легких, которая объединяет геномные и клинические особенности. Исследования по профилактике рака 2008; 1: 56–64. [Бесплатная статья PMC] [PubMed] [Google Scholar] 38. Sridhar S, Schembri F, Zeskind J, Shah V, Gustafson AM, Steiling K, Liu G, Dumas YM, Zhang X, Brody JS, et al. Вызванные курением изменения экспрессии генов в дыхательных путях бронхов отражаются на носовом и буккальном эпителии. BMC Genomics 2008; 9: 259. [Бесплатная статья PMC] [PubMed] [Google Scholar] 40.
Proc Natl Acad Sci USA 2004; 101: 3797–3802. [Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Spira A, Beane JE, Shah V, Steiling K, Liu G, Schembri F, Gilman S, Dumas YM, Calner P, Sebastiani P, et al. Экспрессия гена эпителия дыхательных путей в диагностической оценке курильщиков с подозрением на рак легкого. Nat Med 2007; 13: 361–366. [PubMed] [Google Scholar] 37. Бин Дж., Себастьяни П., Уитфилд Т.Х., Стейлинг К., Дюма Ю.М., Ленбург М.Э., Спира А. Прогнозирующая модель для диагностики рака легких, которая объединяет геномные и клинические особенности. Исследования по профилактике рака 2008; 1: 56–64. [Бесплатная статья PMC] [PubMed] [Google Scholar] 38. Sridhar S, Schembri F, Zeskind J, Shah V, Gustafson AM, Steiling K, Liu G, Dumas YM, Zhang X, Brody JS, et al. Вызванные курением изменения экспрессии генов в дыхательных путях бронхов отражаются на носовом и буккальном эпителии. BMC Genomics 2008; 9: 259. [Бесплатная статья PMC] [PubMed] [Google Scholar] 40.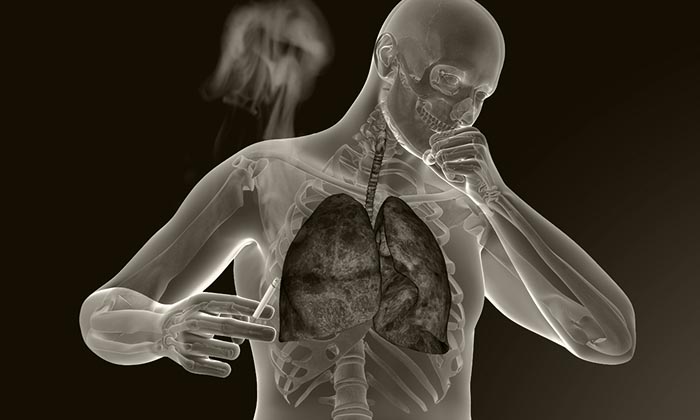 Стирман Р.С., Дуайер-Нилд Л., Грейди М.С., Малкинсон А.М., Джерачи М.В. Сигнатура экспрессии гена макрофага определяет полевой эффект в микросреде опухоли легкого. Cancer Res 2008; 68: 34–43. [PubMed] [Google Scholar] 41. Ходж С., Ходж Г., Ахерн Дж, Джерсманн Х., Холмс М., Рейнольдс П.Н. Курение изменяет распознавание альвеолярных макрофагов и фагоцитарную способность: последствия для хронической обструктивной болезни легких. Am J Respir Cell Mol Biol 2007; 37: 748–755. [PubMed] [Google Scholar] 42. Charles PC, Alder BD, Hilliard EG, Schisler JC, Lineberger RE, Parker JS, Mapara S, Wu SS, Portbury A, Patterson C, et al. Употребление табака вызывает антиапоптотические пролиферативные паттерны экспрессии генов в циркулирующих лейкоцитах мужчин европеоидной расы. BMC Med Genomics 2008; 1: 38. [Бесплатная статья PMC] [PubMed] [Google Scholar] 43. Huber MA, Kraut N, Beug H. Молекулярные требования для эпителиально-мезенхимального перехода во время прогрессирования опухоли.
Стирман Р.С., Дуайер-Нилд Л., Грейди М.С., Малкинсон А.М., Джерачи М.В. Сигнатура экспрессии гена макрофага определяет полевой эффект в микросреде опухоли легкого. Cancer Res 2008; 68: 34–43. [PubMed] [Google Scholar] 41. Ходж С., Ходж Г., Ахерн Дж, Джерсманн Х., Холмс М., Рейнольдс П.Н. Курение изменяет распознавание альвеолярных макрофагов и фагоцитарную способность: последствия для хронической обструктивной болезни легких. Am J Respir Cell Mol Biol 2007; 37: 748–755. [PubMed] [Google Scholar] 42. Charles PC, Alder BD, Hilliard EG, Schisler JC, Lineberger RE, Parker JS, Mapara S, Wu SS, Portbury A, Patterson C, et al. Употребление табака вызывает антиапоптотические пролиферативные паттерны экспрессии генов в циркулирующих лейкоцитах мужчин европеоидной расы. BMC Med Genomics 2008; 1: 38. [Бесплатная статья PMC] [PubMed] [Google Scholar] 43. Huber MA, Kraut N, Beug H. Молекулярные требования для эпителиально-мезенхимального перехода во время прогрессирования опухоли.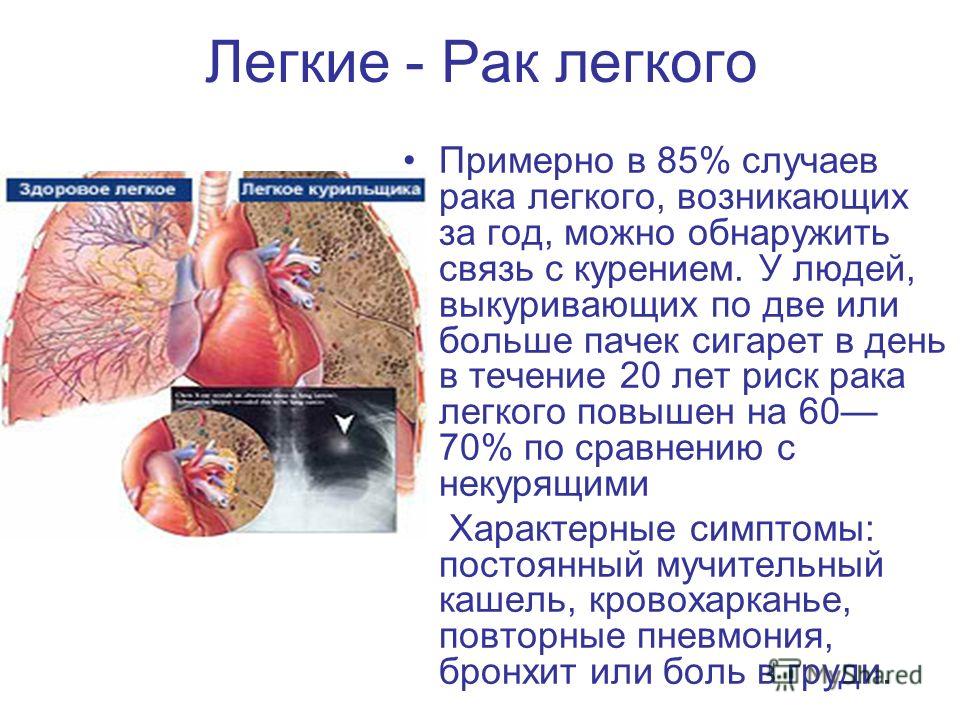 Curr Opin Cell Biol 2005; 17: 548–558. [PubMed] [Google Scholar] 44. Готцманн Дж., Микула М., Эгер А., Шульте-Херманн Р., Фойснер Р., Бьюг Х., Микулитс В. Молекулярные аспекты пластичности эпителиальных клеток: последствия для местной инвазии и метастазирования опухоли. Mutat Res 2004; 566: 9–20.[PubMed] [Google Scholar] 46. Grunert S, Jechlinger M, Beug H. Разнообразные клеточные и молекулярные механизмы способствуют пластичности эпителия и метастазированию. Nat Rev Mol Cell Biol 2003; 4: 657–665. [PubMed] [Google Scholar] 47. Thiery JP. Эпителиально-мезенхимальные переходы в развитии и патологиях. Curr Opin Cell Biol 2003; 15: 740–746. [PubMed] [Google Scholar] 48. Дасари В., Гэллап М., Лемджаббар Х., Мальцева И., Макнамара Н. Эпителиально-мезенхимальный переход при раке легких: табак — «дымящееся ружье»? Am J Respir Cell Mol Biol 2006; 35: 3–9.[PubMed] [Google Scholar] 49. Радиски Д.К., Леви Д.Д., Литтлпейдж Л.Е., Лю Х., Нельсон С.
Curr Opin Cell Biol 2005; 17: 548–558. [PubMed] [Google Scholar] 44. Готцманн Дж., Микула М., Эгер А., Шульте-Херманн Р., Фойснер Р., Бьюг Х., Микулитс В. Молекулярные аспекты пластичности эпителиальных клеток: последствия для местной инвазии и метастазирования опухоли. Mutat Res 2004; 566: 9–20.[PubMed] [Google Scholar] 46. Grunert S, Jechlinger M, Beug H. Разнообразные клеточные и молекулярные механизмы способствуют пластичности эпителия и метастазированию. Nat Rev Mol Cell Biol 2003; 4: 657–665. [PubMed] [Google Scholar] 47. Thiery JP. Эпителиально-мезенхимальные переходы в развитии и патологиях. Curr Opin Cell Biol 2003; 15: 740–746. [PubMed] [Google Scholar] 48. Дасари В., Гэллап М., Лемджаббар Х., Мальцева И., Макнамара Н. Эпителиально-мезенхимальный переход при раке легких: табак — «дымящееся ружье»? Am J Respir Cell Mol Biol 2006; 35: 3–9.[PubMed] [Google Scholar] 49. Радиски Д.К., Леви Д.Д., Литтлпейдж Л.Е., Лю Х., Нельсон С. М., Фата Дж.Э., Лик Д., Годден Е.Л., Альбертсон Д.Г., Ньето М.А., и др. Rac1b и активные формы кислорода опосредуют MMP-3-индуцированную EMT и геномную нестабильность. Nature 2005; 436: 123–127. [Бесплатная статья PMC] [PubMed] [Google Scholar] 50. Томсон С., Бак Е., Петти Ф., Гриффин Дж., Браун Е., Рамнарин Н., Ивата К. К., Гибсон Н., Хейли Дж. Д. Переход от эпителия к мезенхиме является определяющим фактором чувствительности клеточных линий немелкоклеточной карциномы легкого и ксенотрансплантатов к ингибированию рецептора эпидермального фактора роста. Cancer Res 2005; 65: 9455–9462. [PubMed] [Google Scholar] 51. Krysan K, Lee JM, Dohadwala M, Gardner BK, Reckamp KL, Garon E, St John M, Sharma S, Dubinett SM. Воспаление, переход эпителия в мезенхиму и резистентность к ингибиторам тирозинкиназы рецептора эпидермального фактора роста. J Thorac Oncol 2008; 3: 107–110. [PubMed] [Google Scholar]
М., Фата Дж.Э., Лик Д., Годден Е.Л., Альбертсон Д.Г., Ньето М.А., и др. Rac1b и активные формы кислорода опосредуют MMP-3-индуцированную EMT и геномную нестабильность. Nature 2005; 436: 123–127. [Бесплатная статья PMC] [PubMed] [Google Scholar] 50. Томсон С., Бак Е., Петти Ф., Гриффин Дж., Браун Е., Рамнарин Н., Ивата К. К., Гибсон Н., Хейли Дж. Д. Переход от эпителия к мезенхиме является определяющим фактором чувствительности клеточных линий немелкоклеточной карциномы легкого и ксенотрансплантатов к ингибированию рецептора эпидермального фактора роста. Cancer Res 2005; 65: 9455–9462. [PubMed] [Google Scholar] 51. Krysan K, Lee JM, Dohadwala M, Gardner BK, Reckamp KL, Garon E, St John M, Sharma S, Dubinett SM. Воспаление, переход эпителия в мезенхиму и резистентность к ингибиторам тирозинкиназы рецептора эпидермального фактора роста. J Thorac Oncol 2008; 3: 107–110. [PubMed] [Google Scholar] 52. Генрих Э., Дохадвала М., Чаруворн Б., Дубинетт С. Зависимая от воспаления регуляция эпителиально-мезенхимального перехода при немелкоклеточном раке легкого: роль интерлейкина-1b [аннотация 5366].В: Proceedings of the 99th Annual Meeting of the American Association for Cancer Research ; 12–16 апреля 2008 г .; Сан-Диего, Калифорния: AACR; 2008.
Зависимая от воспаления регуляция эпителиально-мезенхимального перехода при немелкоклеточном раке легкого: роль интерлейкина-1b [аннотация 5366].В: Proceedings of the 99th Annual Meeting of the American Association for Cancer Research ; 12–16 апреля 2008 г .; Сан-Диего, Калифорния: AACR; 2008.
 Урол Онкол (В печати) [PubMed] 56. Lee G, Dohadwala M, Dubinett S. Хроническое воздействие табачного специфического 4- (N-метил-N-нитрозамино) -1- (3-пиридил) -1-бутанона (NNK) индуцирует переход эпителия в мезенхиму в немелких клеточный рак легкого [аннотация]. Am J Respir Crit Care Med 2008; 177: A543 [Google Scholar] 57. Abate-Shen C, Brown PH, Colburn NH, Gerner EW, Green JE, Lipkin M, Nelson WG, Threadgill D. Неиспользованный потенциал генно-инженерных моделей мышей в исследованиях химиопрофилактики: возможности и проблемы. Исследования по профилактике рака 2008; 1: 161–166. [Бесплатная статья PMC] [PubMed] [Google Scholar] 58. Wislez M, Fujimoto N, Izzo JG, Hanna AE, Cody DD, Langley RR, Tang H, Burdick MD, Sato M, Minna JD, et al. Высокая экспрессия лигандов хемокинового рецептора CXCR2 при неоплазии альвеолярного эпителия, индуцированной онкогенным Kras. Cancer Res 2006; 66: 4198–4207. [PubMed] [Google Scholar] 59. Спарманн А.
Урол Онкол (В печати) [PubMed] 56. Lee G, Dohadwala M, Dubinett S. Хроническое воздействие табачного специфического 4- (N-метил-N-нитрозамино) -1- (3-пиридил) -1-бутанона (NNK) индуцирует переход эпителия в мезенхиму в немелких клеточный рак легкого [аннотация]. Am J Respir Crit Care Med 2008; 177: A543 [Google Scholar] 57. Abate-Shen C, Brown PH, Colburn NH, Gerner EW, Green JE, Lipkin M, Nelson WG, Threadgill D. Неиспользованный потенциал генно-инженерных моделей мышей в исследованиях химиопрофилактики: возможности и проблемы. Исследования по профилактике рака 2008; 1: 161–166. [Бесплатная статья PMC] [PubMed] [Google Scholar] 58. Wislez M, Fujimoto N, Izzo JG, Hanna AE, Cody DD, Langley RR, Tang H, Burdick MD, Sato M, Minna JD, et al. Высокая экспрессия лигандов хемокинового рецептора CXCR2 при неоплазии альвеолярного эпителия, индуцированной онкогенным Kras. Cancer Res 2006; 66: 4198–4207. [PubMed] [Google Scholar] 59. Спарманн А.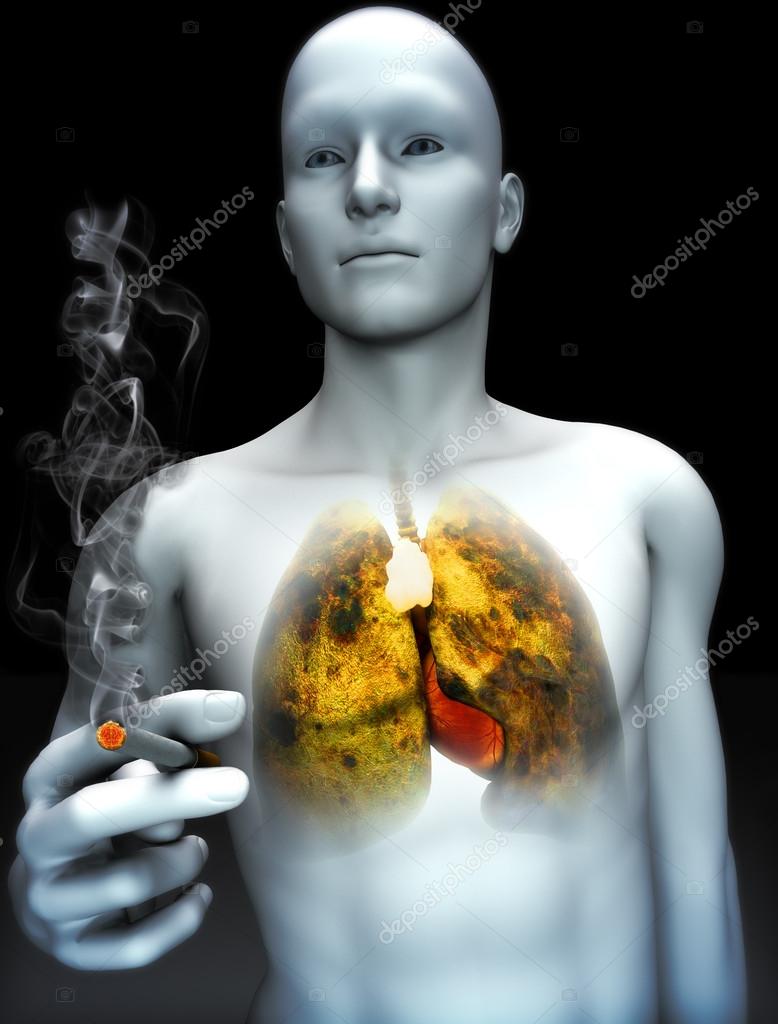 , Бар-Саги Д. Ras-индуцированная экспрессия интерлейкина-8 играет решающую роль в росте опухоли и ангиогенезе. Cancer Cell 2004; 6: 447–458. [PubMed] [Google Scholar] 60. Комарова Е.А., Кривокрысенко В., Ван К., Незнанов Н., Чернов М.В., Комаров П.Г., Бреннан М.Л., Головкина Т.В., Рохлин О.В., Купраш Д.В., и др. p53 является супрессором воспалительной реакции у мышей. FASEB J 2005; 19: 1030–1032. [PubMed] [Google Scholar] 61. Хуанг М., Столина М., Шарма С., Мао Дж. Т., Чжу Л., Миллер П. В., Уоллман Дж., Хершман Н., Дубинетт С. М.. Немелкоклеточный рак легких Циклооксигеназа-2-зависимая регуляция баланса цитокинов в лимфоцитах и макрофагах: повышающая регуляция интерлейкина 10 и понижающая регуляция продукции интерлейкина 12. Cancer Res 1998; 58: 1208–1216. [PubMed] [Google Scholar] 62. Вольф Х., Саукконен К., Анттила С., Карьялайнен А., Вайнио Х., Ристимаки А.Экспрессия циклооксигеназы-2 в карциноме легких человека. Cancer Res 1998; 58: 4997–5001.
, Бар-Саги Д. Ras-индуцированная экспрессия интерлейкина-8 играет решающую роль в росте опухоли и ангиогенезе. Cancer Cell 2004; 6: 447–458. [PubMed] [Google Scholar] 60. Комарова Е.А., Кривокрысенко В., Ван К., Незнанов Н., Чернов М.В., Комаров П.Г., Бреннан М.Л., Головкина Т.В., Рохлин О.В., Купраш Д.В., и др. p53 является супрессором воспалительной реакции у мышей. FASEB J 2005; 19: 1030–1032. [PubMed] [Google Scholar] 61. Хуанг М., Столина М., Шарма С., Мао Дж. Т., Чжу Л., Миллер П. В., Уоллман Дж., Хершман Н., Дубинетт С. М.. Немелкоклеточный рак легких Циклооксигеназа-2-зависимая регуляция баланса цитокинов в лимфоцитах и макрофагах: повышающая регуляция интерлейкина 10 и понижающая регуляция продукции интерлейкина 12. Cancer Res 1998; 58: 1208–1216. [PubMed] [Google Scholar] 62. Вольф Х., Саукконен К., Анттила С., Карьялайнен А., Вайнио Х., Ристимаки А.Экспрессия циклооксигеназы-2 в карциноме легких человека. Cancer Res 1998; 58: 4997–5001. [PubMed] [Google Scholar] 63. Хида Т., Ятабэ Й., Ачива Х., Мурамацу Х., Козаки К., Накамура С., Огава М., Мицудоми Т., Сугиура Т., Такахаши Т. Повышенная экспрессия циклооксигеназы 2 часто встречается при раке легких человека, особенно в аденокарциномах. Cancer Res 1998; 58: 3761–3764. [PubMed] [Google Scholar] 64. Брабендер Дж., Парк Дж., Мецгер Р., Шнайдер П.М., Лорд Р.В., Хольшер А.Х., Даненберг К.Д., Даненберг П.В.Прогностическое значение экспрессии мРНК циклооксигеназы 2 при немелкоклеточном раке легкого. Ann Surg 2002; 235: 440–443. [Бесплатная статья PMC] [PubMed] [Google Scholar] 65. Achiwa H, Yatabe Y, Hida T, Kuroishi T, Kozaki K, Nakamura S, Ogawa M, Sugiura T, Mitsudomi T, Takahashi T. Прогностическое значение повышенной экспрессии циклооксигеназы 2 при первичных резецированных аденокарциномах легких. Clin Cancer Res 1999; 5: 1001–1005. [PubMed] [Google Scholar] 66. Хосоми Й., Йокосе Т., Хиросе Й., Накадзима Р., Нагаи К., Нишиваки Ю., Очиай А.
[PubMed] [Google Scholar] 63. Хида Т., Ятабэ Й., Ачива Х., Мурамацу Х., Козаки К., Накамура С., Огава М., Мицудоми Т., Сугиура Т., Такахаши Т. Повышенная экспрессия циклооксигеназы 2 часто встречается при раке легких человека, особенно в аденокарциномах. Cancer Res 1998; 58: 3761–3764. [PubMed] [Google Scholar] 64. Брабендер Дж., Парк Дж., Мецгер Р., Шнайдер П.М., Лорд Р.В., Хольшер А.Х., Даненберг К.Д., Даненберг П.В.Прогностическое значение экспрессии мРНК циклооксигеназы 2 при немелкоклеточном раке легкого. Ann Surg 2002; 235: 440–443. [Бесплатная статья PMC] [PubMed] [Google Scholar] 65. Achiwa H, Yatabe Y, Hida T, Kuroishi T, Kozaki K, Nakamura S, Ogawa M, Sugiura T, Mitsudomi T, Takahashi T. Прогностическое значение повышенной экспрессии циклооксигеназы 2 при первичных резецированных аденокарциномах легких. Clin Cancer Res 1999; 5: 1001–1005. [PubMed] [Google Scholar] 66. Хосоми Й., Йокосе Т., Хиросе Й., Накадзима Р., Нагаи К., Нишиваки Ю., Очиай А. Повышенная экспрессия циклооксигеназы 2 (ЦОГ-2) часто возникает в предшественниках аденокарциномы легких человека. Рак легких 2000; 30: 73–81. [PubMed] [Google Scholar] 67. Хури Ф.Р., Ву Х., Ли Дж.Дж., Кемп Б.Л., Лотан Р., Липпман С.М., Фэн Л., Хонг В.К., Сюй XC. Сверхэкспрессия циклооксигеназы-2 является маркером плохого прогноза немелкоклеточного рака легкого I стадии. Clin Cancer Res 2001; 7: 861–867. [PubMed] [Google Scholar] 68. Ким Х.С., Юм Х.С., Ли Дж.С., Мин К.В., Чанг Дж.Х., Пак С.С. Корреляция между циклооксигеназой-2 и ангиогенезом опухоли при немелкоклеточном раке легкого. Рак легких 2003; 42: 163–170. [PubMed] [Google Scholar] 69. Tsubochi H, Sato N, Hiyama M, Kaimori M, Endo S, Sohara Y, Imai T. Комбинированный анализ экспрессии циклооксигеназы-2 с p53 и Ki-67 при немелкоклеточном раке легкого. Ann Thorac Surg 2006; 82: 1198–1204. [PubMed] [Google Scholar] 70. Campa D, Zienolddiny S, Maggini V, Skaug V, Haugen A, Canzian F. Ассоциация общего полиморфизма в гене циклооксигеназы 2 с риском немелкоклеточного рака легких.
Повышенная экспрессия циклооксигеназы 2 (ЦОГ-2) часто возникает в предшественниках аденокарциномы легких человека. Рак легких 2000; 30: 73–81. [PubMed] [Google Scholar] 67. Хури Ф.Р., Ву Х., Ли Дж.Дж., Кемп Б.Л., Лотан Р., Липпман С.М., Фэн Л., Хонг В.К., Сюй XC. Сверхэкспрессия циклооксигеназы-2 является маркером плохого прогноза немелкоклеточного рака легкого I стадии. Clin Cancer Res 2001; 7: 861–867. [PubMed] [Google Scholar] 68. Ким Х.С., Юм Х.С., Ли Дж.С., Мин К.В., Чанг Дж.Х., Пак С.С. Корреляция между циклооксигеназой-2 и ангиогенезом опухоли при немелкоклеточном раке легкого. Рак легких 2003; 42: 163–170. [PubMed] [Google Scholar] 69. Tsubochi H, Sato N, Hiyama M, Kaimori M, Endo S, Sohara Y, Imai T. Комбинированный анализ экспрессии циклооксигеназы-2 с p53 и Ki-67 при немелкоклеточном раке легкого. Ann Thorac Surg 2006; 82: 1198–1204. [PubMed] [Google Scholar] 70. Campa D, Zienolddiny S, Maggini V, Skaug V, Haugen A, Canzian F. Ассоциация общего полиморфизма в гене циклооксигеназы 2 с риском немелкоклеточного рака легких. Канцерогенез 2004; 25: 229–235.[PubMed] [Google Scholar] 71. Schreinemachers DM, Everson RB. Использование аспирина и заболеваемость раком легких, толстой кишки и груди в проспективном исследовании. Эпидемиология 1994; 5: 138–146. [PubMed] [Google Scholar] 72. Krysan K, Merchant FH, Zhu L, Dohadwala M, Luo J, Lin Y, Heuze-Vourc’h N, Pold M, Seligson D, Chia D, et al. ЦОГ-2-зависимая стабилизация сурвивина при немелкоклеточном раке легкого. FASEB J 2004; 18: 206–208. [PubMed] [Google Scholar] 73. Pold M, Krysan K, Pold A, Dohadwala M, Heuze-Vourc’h N, Mao JT, Riedl KL, Sharma S, Dubinett SM.Циклооксигеназа-2 модулирует ось инсулиноподобного фактора роста при немелкоклеточном раке легкого. Cancer Res 2004; 64: 6549–6555. [PubMed] [Google Scholar] 74. Шарма С., Столина М., Янг С.К., Барателли Ф., Лин Дж.Ф., Атианзар К., Ло Дж., Чжу Л., Линь И, Хуанг М., и др. Опухоль, зависимая от циклооксигеназы 2, подавление функции дендритных клеток.
Канцерогенез 2004; 25: 229–235.[PubMed] [Google Scholar] 71. Schreinemachers DM, Everson RB. Использование аспирина и заболеваемость раком легких, толстой кишки и груди в проспективном исследовании. Эпидемиология 1994; 5: 138–146. [PubMed] [Google Scholar] 72. Krysan K, Merchant FH, Zhu L, Dohadwala M, Luo J, Lin Y, Heuze-Vourc’h N, Pold M, Seligson D, Chia D, et al. ЦОГ-2-зависимая стабилизация сурвивина при немелкоклеточном раке легкого. FASEB J 2004; 18: 206–208. [PubMed] [Google Scholar] 73. Pold M, Krysan K, Pold A, Dohadwala M, Heuze-Vourc’h N, Mao JT, Riedl KL, Sharma S, Dubinett SM.Циклооксигеназа-2 модулирует ось инсулиноподобного фактора роста при немелкоклеточном раке легкого. Cancer Res 2004; 64: 6549–6555. [PubMed] [Google Scholar] 74. Шарма С., Столина М., Янг С.К., Барателли Ф., Лин Дж.Ф., Атианзар К., Ло Дж., Чжу Л., Линь И, Хуанг М., и др. Опухоль, зависимая от циклооксигеназы 2, подавление функции дендритных клеток. Clin Cancer Res 2003; 9: 961–968. [PubMed] [Google Scholar] 75. Pold M, Zhu LX, Sharma S, Burdick MD, Lin Y, Lee PP, Pold A, Luo J, Krysan K, Dohadwala M, et al. Циклооксигеназа-2-зависимая экспрессия ангиогенных хемокинов CXC, ENA-78 / CXC Ligand (CXCL) 5 и интерлейкина-8 / CXCL8 при немелкоклеточном раке легкого человека. Cancer Res 2004; 64: 1853–1860. [PubMed] [Google Scholar] 76. Дохадвала М., Батра Р.К., Луо Дж., Линь Й., Крысан К., Полд М., Шарма С., Дубинетт С.М. Производство аутокринного / паракринного простагландина E2 клетками немелкоклеточного рака легкого регулирует матриксную металлопротеиназу-2 и CD44 в циклооксигеназе-2-зависимой инвазии. J Biol Chem 2002; 277: 50828-50833.[Бесплатная статья PMC] [PubMed] [Google Scholar] 77. Суббарамайя К., Алторки Н., Чунг В.Дж., Местре Дж.Р., Сампат А., Данненберг А.Дж. Ингибирование экспрессии гена циклооксигеназы-2 с помощью p53. J Biol Chem 1999; 274: 10911-10915. [PubMed] [Google Scholar] 78.
Clin Cancer Res 2003; 9: 961–968. [PubMed] [Google Scholar] 75. Pold M, Zhu LX, Sharma S, Burdick MD, Lin Y, Lee PP, Pold A, Luo J, Krysan K, Dohadwala M, et al. Циклооксигеназа-2-зависимая экспрессия ангиогенных хемокинов CXC, ENA-78 / CXC Ligand (CXCL) 5 и интерлейкина-8 / CXCL8 при немелкоклеточном раке легкого человека. Cancer Res 2004; 64: 1853–1860. [PubMed] [Google Scholar] 76. Дохадвала М., Батра Р.К., Луо Дж., Линь Й., Крысан К., Полд М., Шарма С., Дубинетт С.М. Производство аутокринного / паракринного простагландина E2 клетками немелкоклеточного рака легкого регулирует матриксную металлопротеиназу-2 и CD44 в циклооксигеназе-2-зависимой инвазии. J Biol Chem 2002; 277: 50828-50833.[Бесплатная статья PMC] [PubMed] [Google Scholar] 77. Суббарамайя К., Алторки Н., Чунг В.Дж., Местре Дж.Р., Сампат А., Данненберг А.Дж. Ингибирование экспрессии гена циклооксигеназы-2 с помощью p53. J Biol Chem 1999; 274: 10911-10915. [PubMed] [Google Scholar] 78. Csiki I., Yanagisawa K, Haruki N, Nadaf S, Morrow JD, Johnson DH, Carbone DP. Тиоредоксин-1 модулирует транскрипцию циклооксигеназы-2 посредством индуцируемого гипоксией фактора-1альфа при немелкоклеточном раке легкого. Cancer Res 2006; 66: 143–150. [PubMed] [Google Scholar] 79.Мао Дж. Т., Цуй Х, Реккамп К., Лю М., Крысан К., Далвади Х., Шарма С., Хазра С., Стритер Р., Гарднер Б., и др. Стратегии химиопрофилактики рака легких с помощью ингибиторов циклооксигеназы-2. Clin рака легких 2005; 7: 30–39. [PubMed] [Google Scholar] 80. Heuze-Vourc’h N, Zhu L, Krysan K, Batra RK, Sharma S, Dubinett SM. Аномальная экспрессия интерлейкина 10Ralpha способствует поддержанию повышенного уровня циклооксигеназы-2 в клетках немелкоклеточного рака легкого. Cancer Res 2003; 63: 766–770.[PubMed] [Google Scholar] 81. Цуй X, Чжан Л., Ло Дж., Раджасекаран А., Хазра С., Какалано Н., Дубинетт С. М.. Нефосфорилированный STAT6 способствует конститутивной экспрессии циклооксигеназы-2 при немелкоклеточном раке легкого человека.
Csiki I., Yanagisawa K, Haruki N, Nadaf S, Morrow JD, Johnson DH, Carbone DP. Тиоредоксин-1 модулирует транскрипцию циклооксигеназы-2 посредством индуцируемого гипоксией фактора-1альфа при немелкоклеточном раке легкого. Cancer Res 2006; 66: 143–150. [PubMed] [Google Scholar] 79.Мао Дж. Т., Цуй Х, Реккамп К., Лю М., Крысан К., Далвади Х., Шарма С., Хазра С., Стритер Р., Гарднер Б., и др. Стратегии химиопрофилактики рака легких с помощью ингибиторов циклооксигеназы-2. Clin рака легких 2005; 7: 30–39. [PubMed] [Google Scholar] 80. Heuze-Vourc’h N, Zhu L, Krysan K, Batra RK, Sharma S, Dubinett SM. Аномальная экспрессия интерлейкина 10Ralpha способствует поддержанию повышенного уровня циклооксигеназы-2 в клетках немелкоклеточного рака легкого. Cancer Res 2003; 63: 766–770.[PubMed] [Google Scholar] 81. Цуй X, Чжан Л., Ло Дж., Раджасекаран А., Хазра С., Какалано Н., Дубинетт С. М.. Нефосфорилированный STAT6 способствует конститутивной экспрессии циклооксигеназы-2 при немелкоклеточном раке легкого человека. Онкоген 2007; 26: 4253–4260. [PubMed] [Google Scholar] 82. Суббарамайя К., Мармо Т.П., Диксон Д.А., Данненберг А.Дж. Регулирование стабильности мРНК циклооксгеназы-2 с помощью таксанов: доказательства участия p38, MAPKAPK-2 и HuR. J Biol Chem 2003; 278: 37637–37647. [PubMed] [Google Scholar]
Онкоген 2007; 26: 4253–4260. [PubMed] [Google Scholar] 82. Суббарамайя К., Мармо Т.П., Диксон Д.А., Данненберг А.Дж. Регулирование стабильности мРНК циклооксгеназы-2 с помощью таксанов: доказательства участия p38, MAPKAPK-2 и HuR. J Biol Chem 2003; 278: 37637–37647. [PubMed] [Google Scholar]Пассивное курение повышает риск рака легких
Если вы никогда не закурите, шансы на то, что вы заболеете раком легких, значительно снизятся.Но вы все равно можете получить его, если будете тусоваться с курящими людьми.
Пассивное курение — это то, чем вы вдыхаете, когда люди вокруг курят сигареты, сигары, кальяны или трубки. Вы также можете услышать, что это называется табачным дымом из окружающей среды.
Что такое пассивное курение?
Это смесь двух видов дыма:
- Основной дым — то, что другие люди выпускают после затяжки
- Побочный дым — дым, исходящий от горящей сигареты или сигары
Когда вы дышите им в России это называется пассивным или непроизвольным курением. Вы принимаете те же токсичные химические вещества, что и курильщик, только в меньших количествах. Даже если вы находитесь дома или на рабочем месте с воздушным фильтром или открытыми окнами, если люди курят, вы можете дышать им и заболеть.
Вы принимаете те же токсичные химические вещества, что и курильщик, только в меньших количествах. Даже если вы находитесь дома или на рабочем месте с воздушным фильтром или открытыми окнами, если люди курят, вы можете дышать им и заболеть.
Никакое пассивное курение не является безопасным. Достаточно одной сигареты, чтобы навредить. Большая сигара выделяет примерно столько же, сколько и вся пачка сигарет.
Где найти?
Если вы живете с курильщиком, легко вдохнуть его пассивный дым.Особенно опасно, если они курят в доме.
Вы также можете подвергнуться риску заражения, если работаете в местах, где разрешено курение, например в барах, ресторанах или общественном транспорте.
Если вы живете в здании с большим количеством квартир, вы можете даже вдохнуть его через воздуховоды, лазейки или шахты лифтов.
Вы также можете принять это, если вы едете в машине с кем-то, кто курит, даже если кондиционер включен или окна открыты.
Насколько это рискованно?
Около 7 330 случаев смерти от рака легких ежегодно являются результатом пассивного курения.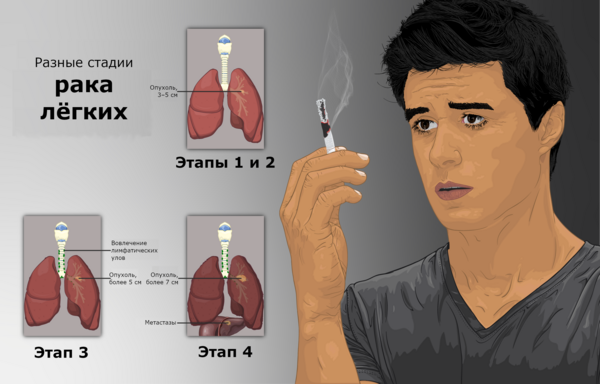 Это означает, что умершие люди были некурящими.
Это означает, что умершие люди были некурящими.
Рак легких — самый смертоносный вид рака как для мужчин, так и для женщин в США. За последнее десятилетие уровень смертности снизился, но он все еще убивает до 158 000 мужчин и женщин в год.
Что такое пассивное курение?
Он содержит 7000 различных химикатов. Из них сотни токсичны. Около 70 могут вызвать рак. К ним относятся яды, радиоактивные элементы и металлы:
- Мышьяк (широко известный яд)
- Бензол
- Бериллий
- 1,3-бутадиен
- Кадмий
- Хром Оксид этилена
- 335 Никель
- 335 Никель
- 635
- Винилхлорид
- Формальдегид
- Бензо [α] пирен
- Толуол
Как это вызывает рак?
Когда вы вдыхаете его, дым и его токсичные химические вещества проникают глубоко в легкие и повреждают подкладку.Дым раздражает дыхательные пути каждый раз, когда вы вдыхаете его. И он начинает действовать, как только вы вдыхаете.
Сначала ваше тело может восстановить повреждение. Но если вы долгое время находитесь в среде пассивного курения, ваше тело, возможно, больше не сможет справиться с этим. Клетки в легочной ткани начинают действовать ненормально, а затем образуют опухоли или рак.
Чем дольше вы находитесь рядом, тем выше вероятность заболевания раком. Трудно сказать, сколько именно. Многие вещи, такие как смесь химических веществ, которые вы вдыхаете, и их сила имеют значение.Но если вы живете с курильщиком, ваши шансы на рак легких возрастают на 20% -30%
Приводит ли он к другим проблемам со здоровьем?
Рак легких — не единственный риск. Пассивное курение может вызвать другие виды рака:
У вас также больше шансов получить сердечно-сосудистые заболевания и инсульт. А если у вас уже есть астма, может стать хуже.
Это опасно для детей и домашних животных
Младенцы и дети, живущие с курильщиками, могут заболеть детскими раковыми заболеваниями, такими как лейкемия, лимфома, рак печени и опухоли головного мозга. Пассивное курение также связано с синдромом внезапной детской смерти, или СВДС, у младенцев. Беременные мамы, подвергшиеся воздействию пассивного курения, могут иметь детей с низкой массой тела при рождении.
Пассивное курение также связано с синдромом внезапной детской смерти, или СВДС, у младенцев. Беременные мамы, подвергшиеся воздействию пассивного курения, могут иметь детей с низкой массой тела при рождении.
Это плохо для растущих детей, которые проводят много времени в доме. Это может замедлить развитие легких и привести к инфекциям уха или легких. У них могут быть проблемы с дыханием, хронический кашель или они могут просто болеть чаще, чем их друзья.
У собак больше шансов заболеть раком легких и носа. У кошек больше шансов заболеть лимфомой и раком полости рта.Даже домашние птицы также могут заболеть раком легких, если кто-то курит в доме.
Может ли запах повредить вам?
Пока не знаем. Ни одно исследование не связывало запах дыма с раковыми заболеваниями у людей. Но мы знаем, что части табачного дыма, вызывающие рак, будут прилипать к пыли, коврам, диванам и одежде.
Врачи называют это пассивным курением. Вероятно, это влияет на вас гораздо меньше, чем зажженная сигарета или трубка, но может скрываться в вашем доме в течение нескольких месяцев. Это особая проблема для младенцев и малышей, которые любят класть вещи в рот.
Это особая проблема для младенцев и малышей, которые любят класть вещи в рот.
Как защитить себя
Лучше всего избегать курения. Не позволяйте никому курить в вашем доме или машине. Если гость хочет курить, попросите его вынести это на улицу. Выберите рестораны для некурящих и попросите номера для некурящих в отелях и мотелях.
Вы не можете избавиться от остатков дыма в доме или машине, открыв окна или используя вентиляторы. Часто чистите или стирайте шторы, мебельную ткань, коврики, стены и прилавки.
Не навреди: почему нельзя курить больным раком легких
Пассивное курение небезопасно для всех, но знаете ли вы, что это может быть особенно опасно для людей с раком легких? Мы сели с Оладимеджи Акинборо, М.D., M.P.H., научный сотрудник по гематологии / онкологии в Медицинском центре Бостонского университета, чтобы обсудить, что известно о воздействии пассивного курения на пациентов с раком легких и что еще предстоит выяснить.
Ассоциация легких: Каковы некоторые из вреда пассивного курения для людей с раком легких?
OA: Хорошо известно, что воздействие SHS может вызвать рак легких. Поэтому людям лучше по возможности избегать курения и находиться рядом с курением. Что касается вреда для людей, у которых уже есть рак легких, опубликованные данные относятся к числу пациентов с немелкоклеточным раком легких (НМРЛ).НМРЛ — наиболее распространенный тип рака легких, на который приходится около 85 процентов всех случаев рака легких. Среди пациентов с НМРЛ, подвергшихся воздействию SHS после постановки диагноза, их общая выживаемость и выживаемость без прогрессирования снижены. Это означает, что у них больше шансов прогрессировать от рака легких и у них больше шансов умереть от болезни, чем у тех, кто не подвергался воздействию пассивного курения на постоянной основе.
Ассоциация легких: Какое влияние оказывает пассивное курение на лечение рака легких?
OA: Несмотря на то, что прямых доказательств воздействия пассивного курения на лечение рака легких пока нет, есть доказательства того, что курение во время лечения рака легких снижает эффективность лечения и может сделать лучевую и химиотерапию более токсичными. По сути, табачный дым содержит множество вредных химических веществ, и один из лучших способов сохранить здоровье легких — максимально избегать его.
По сути, табачный дым содержит множество вредных химических веществ, и один из лучших способов сохранить здоровье легких — максимально избегать его.
Ассоциация легких: Какие проблемы возникают при изучении результатов пассивного курения и рака легких?
OA: Обычно во время посещения врача врачи и онкологи спрашивают, курит ли пациент, но не спрашивают о SHS. Такие вещи, как пассивное курение, никогда не обсуждаются, и это проблема и одна из причин, почему трудно уловить влияние пассивного курения на исходы рака легких.Измерение — тоже проблема. У нас нет конкретных данных о зависимости от дозы, которую мы установили при курении сигарет. Это означает, что мы не знаем точно, как ухудшаются исходы рака при воздействии разного количества SHS.
Lung Association: Какие наиболее важные моменты, которые пациенты с раком легких должны знать о SHS?
OA:
- SHS отрицательно скажется на результатах вашей выживаемости, если у вас рак легких.

- Пациенты с раком легких должны сказать своим близким, кто курит: «Мне нужна ваша поддержка, пока я прохожу курс лечения, и я хотел бы попросить вас не курить рядом со мной».
- Точно так же, как несоблюдение схемы лечения, воздействие пассивного курения отрицательно влияет на результаты лечения.
- Участие в пропаганде политики чистого внутреннего и наружного воздуха также является отличным способом помочь снизить воздействие пассивного курения на широкую публику.
Присоединяйтесь к нашей борьбе за бездымный воздух и здоровье легких, став членом нашей сети Lung Action Network.
Пациентам и лицам, осуществляющим уход за ними, требуется дополнительная информация о раке легких, посетите сайт Lung.org/lung-cancer.
Ассоциация типов сигарет с заболеваемостью и смертностью от рака легких: вторичный анализ национального исследования по скринингу легких | Рак легких | JAMA Internal Medicine
В ответ на растущее количество данных о том, что курение сигарет является причиной рака легких в 1950-х годах, производители табака ввели сигареты с фильтром и «с низким содержанием смол», чтобы развеять опасения потребителей, зная, что они на самом деле не снижают риски для здоровья. Прокалывание вентиляционных отверстий разного размера и количества в фильтре для разбавления вдыхаемого дыма стало оптимальным способом снизить выход смол. 1
Прокалывание вентиляционных отверстий разного размера и количества в фильтре для разбавления вдыхаемого дыма стало оптимальным способом снизить выход смол. 1
Несмотря на эти изменения, курение остается причиной от 80% до 90% диагнозов рака легких, а 5-летняя выживаемость составляет 18%, что подчеркивает важность профилактики. 2 Доказано, что скрининг рака легких с помощью компьютерной томографии с низкой дозой снижает смертность, и лечение табаком является необходимым компонентом эффективного скрининга.Мы исследовали связь статуса фильтра, уровня смол и вкуса ментола с исходами рака легких в Национальном испытании по скринингу легких.
Это вторичный анализ данных 14123 участников Национального исследования легких, заполнивших подробные анкеты по курению. 3 Мы исследовали исходный уровень смолы в сигаретах (обычный, легкий или сверхлегкий), вкус (без ароматизатора или ментола) и статус фильтра (с фильтром или без фильтра) и их связь с диагнозом рака легких, смертностью и смертностью от всех причин. Модели регрессии Кокса использовались для изучения влияния уровня смолы в сигаретах, вкуса и фильтра на клинические результаты, с учетом пола, возраста, расы, количества лет в упаковке, никотиновой зависимости (измеряемой с помощью теста Фагерстрёма на никотиновую зависимость) и группы лечения. . Это исследование было одобрено наблюдательным советом Медицинского университета Южной Каролины. Согласие пациента было отклонено, поскольку использовались неидентифицированные данные. Двустороннее испытание t было проведено, как указано, со значением P меньше, чем.05 считается значительным.
Модели регрессии Кокса использовались для изучения влияния уровня смолы в сигаретах, вкуса и фильтра на клинические результаты, с учетом пола, возраста, расы, количества лет в упаковке, никотиновой зависимости (измеряемой с помощью теста Фагерстрёма на никотиновую зависимость) и группы лечения. . Это исследование было одобрено наблюдательным советом Медицинского университета Южной Каролины. Согласие пациента было отклонено, поскольку использовались неидентифицированные данные. Двустороннее испытание t было проведено, как указано, со значением P меньше, чем.05 считается значительным.
Из 14123 участников 7056 (50%) были курильщиками, 13038 (92%) были белыми и курили в среднем 60 пачек сигарет в год (Таблица 1). Большинство людей (12488 [88%]) курили сигареты с фильтром и почти половина курили легкие (4660 [33,0%]) или сверхлегкие (1562 [11,1%]) сигареты. После корректировки количество курильщиков сигарет без фильтра составило почти 40% (отношение рисков 1,37; 95% ДИ 1. 10-1.17) с большей вероятностью разовьется рак легких и почти в два раза (отношение рисков, 1,96; 95% ДИ, 1,46-2,64) вероятность смерти от рака легких по сравнению с теми, кто курил сигареты с фильтром. Кроме того, смертность от всех причин была почти на 30% (отношение рисков 1,28; 95% ДИ 1,09–1,50) выше (таблица 2). Не было различий в показателях смертности между курильщиками легких / сверхлегких или ароматизированных сигарет по сравнению с обычными курильщиками.
10-1.17) с большей вероятностью разовьется рак легких и почти в два раза (отношение рисков, 1,96; 95% ДИ, 1,46-2,64) вероятность смерти от рака легких по сравнению с теми, кто курил сигареты с фильтром. Кроме того, смертность от всех причин была почти на 30% (отношение рисков 1,28; 95% ДИ 1,09–1,50) выше (таблица 2). Не было различий в показателях смертности между курильщиками легких / сверхлегких или ароматизированных сигарет по сравнению с обычными курильщиками.
В этом исследовании оценивалась смертность при скрининге рака легких на основе типа выкуриваемой сигареты и было обнаружено, что курение сигарет без фильтра связано со значительно более высокой заболеваемостью и смертностью от рака легких.При сравнении курильщиков легких / сверхлегких сигарет или курильщиков ментола с курильщиками обычных сигарет различий в исходах рака легких не наблюдалось.
Это исследование подтверждает, что курение сигарет с фильтром и без фильтра связано с повышенным риском заболеваемости и смертности от рака легких и согласуется с другими исследованиями в литературе. 4 Выявление лиц, которые курят сигареты без фильтра, очень важно, поскольку они могут получить большую пользу от агрессивного обращения с табаком.Хотя сигареты с фильтром показали себя лучше, чем сигареты без фильтра, это исследование показало, что смертность от рака легких у курильщиков сигарет с фильтром составила 1600 на 100000 человек по сравнению с когортой никогда не курящих с 34 случаями смерти от рака легких на 100000 человек. 5 Разница в результатах при курении сигарет с фильтром и без фильтра, наблюдаемая в этом и других исследованиях, вероятно, отражает особенности конструкции сигарет с фильтром, включая количество, плотность и смеси табака в колонке, добавки и пористость фильтровальной бумаги. 5 , 6 Кроме того, данные свидетельствуют о том, что, несмотря на принятие новых дизайнов сигарет, курение сигарет по-прежнему представляет огромный риск для здоровья. 1 , 5
4 Выявление лиц, которые курят сигареты без фильтра, очень важно, поскольку они могут получить большую пользу от агрессивного обращения с табаком.Хотя сигареты с фильтром показали себя лучше, чем сигареты без фильтра, это исследование показало, что смертность от рака легких у курильщиков сигарет с фильтром составила 1600 на 100000 человек по сравнению с когортой никогда не курящих с 34 случаями смерти от рака легких на 100000 человек. 5 Разница в результатах при курении сигарет с фильтром и без фильтра, наблюдаемая в этом и других исследованиях, вероятно, отражает особенности конструкции сигарет с фильтром, включая количество, плотность и смеси табака в колонке, добавки и пористость фильтровальной бумаги. 5 , 6 Кроме того, данные свидетельствуют о том, что, несмотря на принятие новых дизайнов сигарет, курение сигарет по-прежнему представляет огромный риск для здоровья. 1 , 5
У курильщиков легких / сверхлегких сигарет уровень смертности был примерно таким же, как у курильщиков обычных сигарет. Этот результат можно объяснить концепцией компенсирующего курения, при которой курильщики достигают более высоких уровней никотина, изменяя свое курение. 6 Табачные компании продавали потребителям сигареты с низким содержанием смол в качестве альтернативы отказу от курения, предполагая, что это снижает риски для здоровья.К сожалению, большинство курильщиков считают, что легкие / сверхлегкие сигареты снижают риск, и это заблуждение может убедить их отказаться от курения. 7
Этот результат можно объяснить концепцией компенсирующего курения, при которой курильщики достигают более высоких уровней никотина, изменяя свое курение. 6 Табачные компании продавали потребителям сигареты с низким содержанием смол в качестве альтернативы отказу от курения, предполагая, что это снижает риски для здоровья.К сожалению, большинство курильщиков считают, что легкие / сверхлегкие сигареты снижают риск, и это заблуждение может убедить их отказаться от курения. 7
Это исследование подтверждает, что курение любого типа сигарет несет серьезный риск для здоровья. В контексте данного исследования сигареты без фильтра являются наиболее опасными, и курильщики их должны подвергаться агрессивным вмешательствам по лечению табака. Некоторые курильщики могут переключиться на легкие или сверхлегкие сигареты, полагая, что они безопаснее; Тем не менее, это не так.Скрининг на рак легких считается поучительным моментом, и полученные здесь результаты должны привести к разработке индивидуальных мероприятий по лечению табака в этом контексте. Важно отметить, что это исследование дополняет неопровержимые доказательства риска развития и смерти от рака легких, вызванного курением сигарет с фильтром и без фильтра.
Важно отметить, что это исследование дополняет неопровержимые доказательства риска развития и смерти от рака легких, вызванного курением сигарет с фильтром и без фильтра.
Принята к публикации: 21 июня 2019 г.
Автор для корреспонденции: Николь Т.Таннер, доктор медицины, MSCR, Инновационный центр по вопросам справедливости в области здравоохранения и сельских районов (HEROIC), Госпиталь по делам ветеранов Ральфа Х. Джонсона, 109 Bee St, Charleston, SC 29425 ([email protected]).
Опубликовано онлайн: 21 октября 2019 г. doi: 10.1001 / jamainternmed.2019.3487
Вклад авторов: Доктор Таннер имел полный доступ ко всем данным в исследовании и берет на себя ответственность за целостность данных и точность анализа данных.
Концепция и дизайн: Таннер, Томас, Роевски, Толл, Сильвестри.
Сбор, анализ или интерпретация данных: Все авторы.
Составление рукописи: Таннер, Томас, Уорд, Роевски, Гебрегзиабер, Сильвестри.
Критический пересмотр рукописи на предмет важного интеллектуального содержания: Все авторы.
Статистический анализ: Уорд, Гебрегзиабер, Сильвестри.
Получено финансирование : платный.
Надзор: Плата, Сильвестри.
Раскрытие информации о конфликте интересов: Д-р Таннер сообщает о грантах Американского института рака во время проведения исследования; гранты от Cook Medical, Exact Sciences, Olympus America и Veracyte помимо представленных работ; а также консультации от Cook Medical, Exact Sciences, Biodesix и Olympus America помимо представленных работ. Доктор Роевски сообщает о грантах Национального института рака во время проведения исследования. Д-р Толл сообщил о личных гонорарах от Pfizer и провел консультации с консультативным советом по поводу электронных сигарет и дал свидетельские показания от имени истцов, подавших иски против табачных компаний. О других раскрытиях информации не сообщалось.
О других раскрытиях информации не сообщалось.
Финансирование / поддержка: Это исследование было частично поддержано исследовательским финансированием онкологического центра Холлингса при Медицинском университете Южной Каролины.
Роль спонсора / спонсора: Спонсор не участвовал в разработке и проведении исследования; сбор, управление, анализ и интерпретация данных; подготовка, рецензирование или утверждение рукописи; и решение представить рукопись для публикации.
Дополнительные материалы: Мы благодарим К. Майкла Каммингса, доктора философии, магистра здравоохранения (Медицинский университет Южной Каролины) за его вдумчивый обзор и комментарии к этой статье. Он не получил компенсации за свою помощь.
1. песня Массачусетс, Беновиц NL, Берман М, и другие. Вентиляция с сигаретным фильтром и ее связь с увеличением заболеваемости аденокарциномой легких. Национальный институт рака . 2017; 109 (12). DOI: 10.1093 / jnci / djx075PubMedGoogle Scholar6.
2017; 109 (12). DOI: 10.1093 / jnci / djx075PubMedGoogle Scholar6.Ожоги D, Беновиц N, Амахер R, ред. Риски, связанные с курением сигарет с низким уровнем содержания смолы и никотина, измеренным машинами . Монография № 13. Бетезда, доктор медицины: Министерство здравоохранения и социальных служб США, Служба общественного здравоохранения, Национальные институты здравоохранения, Национальный институт рака, публикация NIH № 02-5074. 2001.
7. Шиффман. S, Пиллиттери JL, Бертон SL, Рохай JM, Гитчелл JG.Представления курильщиков о «легких» и «сверхлегких» сигаретах. Тоб Контроль . 2001; 10 (приложение 1): i17-i23.PubMedGoogle ScholarБольшинство случаев рака легких у некурящих, поддающихся лечению лекарствами, направленными на мутации, — Медицинская школа Вашингтонского университета в Сент-Луисе
Посетите новостной центрДоступные, одобренные FDA препараты могут быть эффективны при лечении примерно 80% опухолей легких у никогда не куривших
Медицинская школа Вашингтонского университета На фото выше рентгенографическое изображение опухоли легкого у пациента, который никогда не курил, но все же заболел раком легких. .Новое исследование Медицинской школы Вашингтонского университета в Сент-Луисе оценивает, что от 78% до 92% случаев рака легких у никогда не куривших пациентов можно лечить с помощью точных лекарств, уже одобренных Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов для борьбы с конкретными мутациями в организме пациента. опухоль.
.Новое исследование Медицинской школы Вашингтонского университета в Сент-Луисе оценивает, что от 78% до 92% случаев рака легких у никогда не куривших пациентов можно лечить с помощью точных лекарств, уже одобренных Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов для борьбы с конкретными мутациями в организме пациента. опухоль.
Несмотря на хорошо известную роль курения в возникновении рака легких, значительное число пациентов, у которых развиваются опухоли легких, никогда не курили. Хотя ученые все еще работают над тем, чтобы понять, что вызывает рак у так называемых «никогда не курильщиков», исследование, проведенное учеными из Медицинской школы Вашингтонского университета в Санкт-Петербурге.Луи демонстрирует новые возможности лечения этих непонятных опухолей.
Новый анализ показывает, что от 78% до 92% случаев рака легких у никогда не куривших пациентов можно лечить с помощью точных лекарств, уже одобренных Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов для борьбы с конкретными мутациями в опухоли пациента. Исследователи обнаружили, что опухоли легких у большинства никогда не курильщиков имеют так называемые драйверные мутации, специфические ошибки в ДНК, которые способствуют росту опухоли и которые можно заблокировать с помощью различных лекарств.Напротив, только около половины опухолей у курящих людей имеют мутации-драйверы.
Исследователи обнаружили, что опухоли легких у большинства никогда не курильщиков имеют так называемые драйверные мутации, специфические ошибки в ДНК, которые способствуют росту опухоли и которые можно заблокировать с помощью различных лекарств.Напротив, только около половины опухолей у курящих людей имеют мутации-драйверы.
Исследование появилось 30 сентября в Журнале клинической онкологии.
«Большинство геномных исследований рака легких сосредоточено на пациентах, которые курили табак в анамнезе», — сказал старший автор Рамасвами Говиндан, доктор медицины, профессор медицины. «И даже исследования, изучающие болезнь у никогда не куривших пациентов, систематически не искали конкретных, действенных мутаций в этих опухолях.Мы обнаружили, что у подавляющего большинства этих пациентов есть генетические изменения, которые сегодня врачи могут лечить с помощью лекарств, уже одобренных для использования. Пациенту необходимо пройти качественную биопсию, чтобы убедиться, что генетического материала достаточно для выявления ключевых мутаций. Но тестирование этих пациентов имеет решающее значение. Существует высокая вероятность того, что у таких пациентов будет значимая мутация, которую мы сможем устранить с помощью специальных методов лечения ».
Но тестирование этих пациентов имеет решающее значение. Существует высокая вероятность того, что у таких пациентов будет значимая мутация, которую мы сможем устранить с помощью специальных методов лечения ».
В США от 10% до 15% случаев рака легких диагностируется у людей, которые никогда не курили, а в некоторых частях Азии эта доля может достигать 40%.
Исследователи проанализировали опухоли легких у 160 пациентов с аденокарциномой легких, но не куривших табак в анамнезе. Они также сравнили данные этих пациентов с данными о курильщиках и никогда не куривших из Атласа генома рака и Консорциума клинического протеомного анализа опухолей, проектов под руководством Национальных институтов здравоохранения (NIH) по характеристике различных типов рака. Ученые подтвердили, что они никогда не курили, изучив паттерны мутаций у этих пациентов и сравнив их с паттернами мутаций при раке легких у курильщиков.Предыдущие исследования, проведенные Говинданом и его коллегами, показали, что опухоли легких курильщиков имеют примерно в 10 раз больше мутаций, чем опухоли легких никогда не куривших.
«Табакокурение приводит к характерным изменениям в опухолевых клетках, поэтому мы можем искать явные признаки курения или, например, признаки сильного воздействия вторичного табачного дыма», — сказал Говиндан, который лечит пациентов в онкологическом центре Siteman при Еврейской больнице Барнс. и Медицинский факультет Вашингтонского университета. «Но очень немногие из опухолей этих пациентов имели такие признаки, поэтому мы могли убедиться, что это действительно образец опухоли рака легких у пациентов, которые никогда не курили или подвергались сильному воздействию табачного дыма.”
Исследователи также обнаружили, что только около 7% этих пациентов продемонстрировали доказательства наличия мутаций при рождении, которые повышали риск рака — либо наследственного, либо случайного, — что еще больше раскрывает тайну того, что вызывает рак легких у никогда не куривших.
«Кажется, есть что-то уникальное в отношении рака легких у людей, которые никогда не курили, — сказал Говиндан. «Мы не обнаружили основную роль унаследованных мутаций, и мы не видим доказательств большого количества мутаций, которые предполагали бы воздействие пассивного курения.Около 60% этих опухолей обнаруживаются у женщин и 40% у мужчин. Рак в целом чаще встречается у мужчин, но рак легких у никогда не курящих по некоторым необъяснимым причинам чаще встречается у женщин. Возможно, дополнительные гены связаны с предрасположенностью к этому виду рака, но мы пока не знаем, что это такое ».
«Мы не обнаружили основную роль унаследованных мутаций, и мы не видим доказательств большого количества мутаций, которые предполагали бы воздействие пассивного курения.Около 60% этих опухолей обнаруживаются у женщин и 40% у мужчин. Рак в целом чаще встречается у мужчин, но рак легких у никогда не курящих по некоторым необъяснимым причинам чаще встречается у женщин. Возможно, дополнительные гены связаны с предрасположенностью к этому виду рака, но мы пока не знаем, что это такое ».
Исследование также пролило свет на иммунные профили этих опухолей, что могло помочь объяснить, почему большинство из них плохо реагируют на тип иммунотерапии, называемый ингибиторами контрольных точек.В отличие от изученных опухолей легких у курильщиков, очень немногие из опухолей, которые никогда не курили, содержали иммунные клетки или молекулы иммунных контрольных точек, которые эти препараты запускают для борьбы с раком.
«Самым важным открытием является то, что мы идентифицировали действенные мутации у подавляющего большинства этих пациентов — от 80% до 90%», — сказал Говиндан. «Наше исследование подчеркивает необходимость получения высококачественных биопсий опухоли для клинического геномного тестирования у этих пациентов, чтобы мы могли определить наилучшие целевые методы лечения их индивидуальных опухолей.”
«Наше исследование подчеркивает необходимость получения высококачественных биопсий опухоли для клинического геномного тестирования у этих пациентов, чтобы мы могли определить наилучшие целевые методы лечения их индивидуальных опухолей.”
Эта работа была поддержана Национальными институтами здравоохранения (NIH), номера грантов 2U54HG00307910 и U01CA214195; и Лаборатория открытия биомаркеров мезотелиомы.
Devarakonda S, et al. Геномное профилирование аденокарциномы легких у некурящих. Журнал клинической онкологии. 30 сентября 2021 г.
Медицинский факультет Вашингтонского университета состоит из 1 700 врачей-факультетов, которые также входят в состав детских больниц Барнс-Еврей и Сент-Луис. Медицинский факультет является лидером в области медицинских исследований, обучения и ухода за пациентами, неизменно входящий в число лучших медицинских школ страны по версии У.S. News & World Report. Медицинская школа связана с больницей Barnes-Jewish и детскими больницами Сент-Луиса и связана с BJC HealthCare.
Почему некурящие заболевают раком легких
Эта стигма также означает, что на рак легких приходится лишь небольшая часть миллиардов долларов во всем мире, которые вкладываются в исследования рака. Например, в Канаде, которая занимает второе место по уровню заболеваемости раком легких в мире, на это заболевание выделяется всего 7% финансирования исследований, несмотря на то, что оно является причиной 25% смертей от рака.Об обратном сообщалось о раке груди.
Тем не менее, есть основания для надежды. Например, в последние несколько лет расходы Великобритании на исследования рака легких растут, составив 11,5% от общих денег, потраченных на исследования рака в 2016-17 финансовом году.
Между тем, Swanton возглавляет исследование TRACERx стоимостью 14 миллионов фунтов стерлингов, в котором будет изучено, как рак легких со временем меняется у 850 пациентов. Подобные исследования дают исследователям возможность глубже изучить различия между пациентами, курильщиками и некурящими, мужчинами и женщинами. Понимание этих различий позволяет разрабатывать более эффективные методы лечения для отдельных пациентов.
Понимание этих различий позволяет разрабатывать более эффективные методы лечения для отдельных пациентов.
Будущее рака легких выглядит более обнадеживающим. Но крылатая фраза, используемая теми, кто выступает за увеличение финансирования исследований рака легких, должна служить напоминанием всем нам о том, что поставлено на карту.
«Рак легких не различает, и вы тоже».
Эта история является частью Health Gap , специальной серии о том, как мужчины и женщины воспринимают медицинскую систему — и свое собственное здоровье — совершенно по-разному.
Есть ли у вас опыт, которым можно поделиться? Или вы просто хотите поделиться информацией о здоровье и благополучии женщин? Присоединяйтесь к нашей группе в Facebook Future Woman и участвуйте в разговоре о повседневных проблемах, влияющих на жизнь женщин.
Присоединяйтесь к 800 000+ будущих поклонников, поставив нам лайк на Facebook или подписавшись на нас в Twitter .
Если вам понравилась эта история, подпишитесь на еженедельник BBC.com предлагает информационный бюллетень под названием «Если вы прочитаете только 6 статей на этой неделе». Тщательно подобранная подборка историй из BBC Future, Culture, Capital и Travel, которые доставляются на ваш почтовый ящик каждую пятницу.
КТ для выявления рака легких у курильщиков
Когда они вам нужны, а когда нет
Спиральная компьютерная томография с низкой дозой облучения — это разновидность медицинского обследования. Его используют для выявления ранних признаков рака легких.Если тест обнаруживает рак, лечение можно начинать раньше.
Но тест бесполезен для заядлых курильщиков или людей, бросивших курить более 15 лет назад. И обычно это не рекомендуется людям моложе 55 и старше 80 лет.
Даже заядлые курильщики получают от теста лишь небольшую пользу. Так что вам следует дважды подумать, прежде чем пройти тест. Вот почему:
Так что вам следует дважды подумать, прежде чем пройти тест. Вот почему:
Тест может помочь людям из группы высокого риска.
Исследования показывают небольшую пользу от компьютерной томографии для:
- Люди в возрасте от 55 до 80, которые много курят (примерно одна пачка в день в течение минимум 30 лет или 2 пачки в день в течение минимум 15 лет) И либо продолжают курить, либо бросили курить в течение последних 15 лет.
Если 1000 курильщиков из группы высокого риска пройдут обследование, около трех из них обнаружат рак легких достаточно рано, чтобы получить лечение, и не умрут от рака легких. Восемнадцать других также обнаружат рак легких и умрут, даже если они прошли скрининговый тест.
Тест не помогает людям из группы низкого риска.
КТне имеет преимуществ для людей с низким риском. Исследования не показали, что тест помогает спасти жизни в группах низкого риска.
Тест создает ложные срабатывания.
Сканирование КТ вызывает множество ложных срабатываний даже у людей из группы высокого риска. Если 100 курильщиков из группы высокого риска пройдут тест, около 40 покажут что-то, что может вызвать беспокойство. Но только двое или трое действительно болеют раком легких.
Если 100 курильщиков из группы высокого риска пройдут тест, около 40 покажут что-то, что может вызвать беспокойство. Но только двое или трое действительно болеют раком легких.
Ложные тревоги часто приводят к повторным тестам. Обычно требуется еще несколько снимков компьютерной томографии. Или вам может потребоваться биопсия или даже операция. Иногда это может вызвать осложнения, такие как кровотечение или коллапс легкого.
Если ваш риск невелик, ложная тревога вызывает ненужные опасения.
Компьютерная томография подвергает вас воздействию радиации.
При спиральной компьютерной томографии с низкой дозой облучения используется примерно в 20 раз больше радиации, чем при стандартной рентгенографии грудной клетки.Чем больше радиации вы получите, тем выше риск заболевания раком. Так что по возможности лучше избегать радиации, даже если разовая доза мала.
Тест дорогой.
Спиральная компьютерная томография стоит 300 долларов и более. Страховка обычно оплачивает тест на выявление рака легких только в том случае, если у вас очень высокий риск развития рака легких.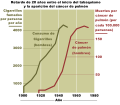 И тест часто приводит к другим расходам. У многих людей возникают ложные срабатывания, которые приводят к дополнительным тестам и процедурам.
И тест часто приводит к другим расходам. У многих людей возникают ложные срабатывания, которые приводят к дополнительным тестам и процедурам.
Когда компьютерная томография стоит рисков?
Вам следует подумать о том, чтобы сделать компьютерную томографию, если:
- Вам от 55 до 80 лет И
- Вы много лет курили (примерно одна пачка в день в течение как минимум 30 лет или две пачки в день как минимум 15 лет) И
- Вы все еще курите или бросили курить менее 15 лет назад.
У курильщиков из группы высокого риска преимущества компьютерной томографии могут быть больше, чем риски.
Лучший способ предотвратить рак легких.
Если вы хотите предотвратить рак легких, бросьте курить. Отказ от курения значительно снижает риск рака легких. Ваш врач может помочь вам бросить курить, или вы можете позвонить по телефону 1-800-QUIT-NOW. Избегайте пассивного курения, которое также увеличивает ваш риск.
Этот отчет предназначен для использования во время разговора со своим врачом.