Понятие иммунитета. Справка — РИА Новости, 27.09.2010
Специфический и неспецифический иммунитет
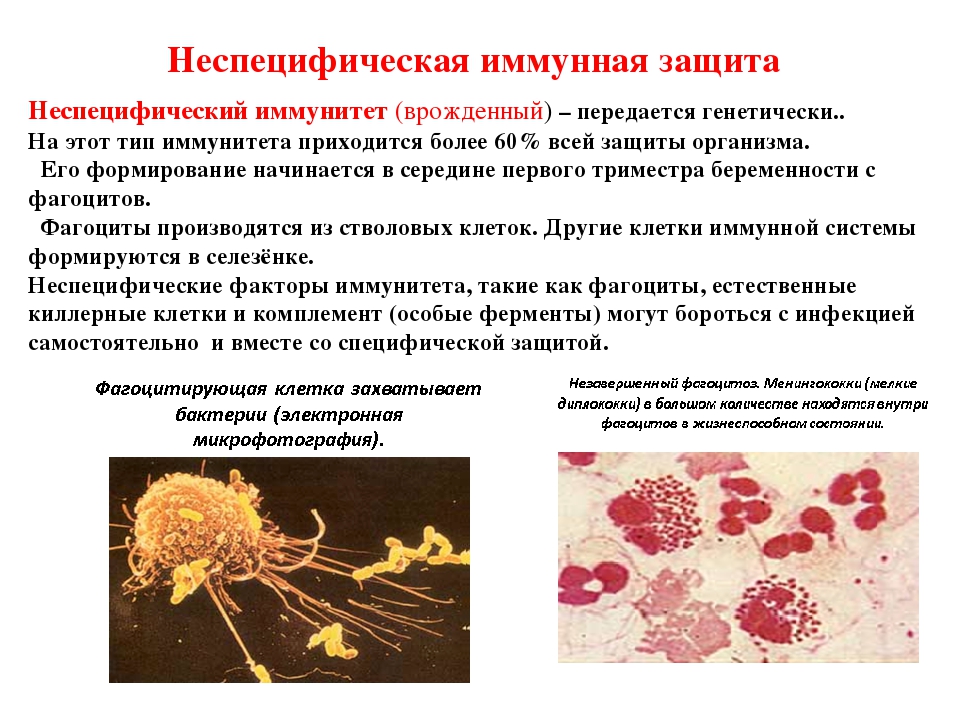
Неспецифический (врожденный) иммунитет – это однотипные реакции организма на любые чужеродные антигены.
Главным клеточным компонентом системы неспецифического иммунитета служат фагоциты, основная функция которых — захватывать и переваривать проникающие извне агенты.
Для возникновения подобной реакции чужеродный агент должен иметь поверхность, т.е. быть частицей (например, заноза).
Если же вещество молекулярно-дисперсное (например, белок, полисахарид, вирус), не токсичное и не обладает физиологической активностью, оно не может быть нейтрализовано и выведено организмом по вышеописанной схеме.
В этом случае срабатывает специфический иммунитет. Он приобретается в результате контакта организма с антигеном и характеризуется формированием иммунологической памяти. Его клеточными носителями служат лимфоциты, а растворимыми — иммуноглобулины (
Первичный и вторичный иммунный ответ
Специфические антитела продуцируются специальными клетками — лимфоцитами.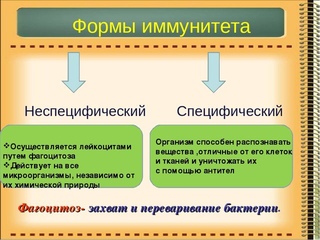 Причем для каждого вида антител существует свой тип лимфоцитов (клон).
Причем для каждого вида антител существует свой тип лимфоцитов (клон).
Первое взаимодействие антигена (бактерии или вируса) с лимфоцитом вызывает реакцию, названную первичным иммунным ответом, в ходе которого лимфоциты начинают развиваться в виде клонов. Затем некоторые из них становятся клетками памяти, другие превращаются в зрелые клетки, продуцирующие антитела. Главные особенности первичного иммунного ответа — существование латентного периода до появления антител, затем выработка их лишь в небольшом количестве.
Вторичный иммунный ответ развивается при последующем контакте с тем же самым антигеном. Основная особенность – быстрое развитие лимфоцитов с дифференцировкой их в зрелые клетки и быстрая выработка большого количества антител, которые высвобождаются в кровь и тканевую жидкость, где могут встретиться с антигеном и эффективно побороть болезнь.
Естественный и искусственный иммунитет
К факторам естественного иммунитета относят иммунные (система комплемента, лизоцим и др. белки) и неиммунные механизмы (кожа, слизистая, секрет потовых, сальных, слюнных желез, желез желудка, нормальная микрофлора).
белки) и неиммунные механизмы (кожа, слизистая, секрет потовых, сальных, слюнных желез, желез желудка, нормальная микрофлора).
Искусственный иммунитет вырабатывается при введении в организм вакцины или иммуноглобулина.
Активный и пассивный иммунитет
Активная иммунизация стимулирует собственный иммунитет человека, вызывая выработку собственных антител. После инфекции в организме остаются «клетки памяти», и в случае последующих столкновений с возбудителем они начинают снова (уже быстрее) продуцировать антитела.
При пассивной иммунизации в организм вводятся уже готовые антитела (гаммаглобулин). Введенные антитела при столкновении с возбудителем «расходуются» (связываются с возбудителем в комплекс «антиген-антитело»).
Пассивная иммунизация показана, когда необходимо в короткие сроки создать иммунитет на непродолжительное время (например, после контакта с больным).
Стерильный и нестерильный иммунитет
После некоторых заболеваний иммунитет сохраняется пожизненно, например, при кори или ветряной оспе.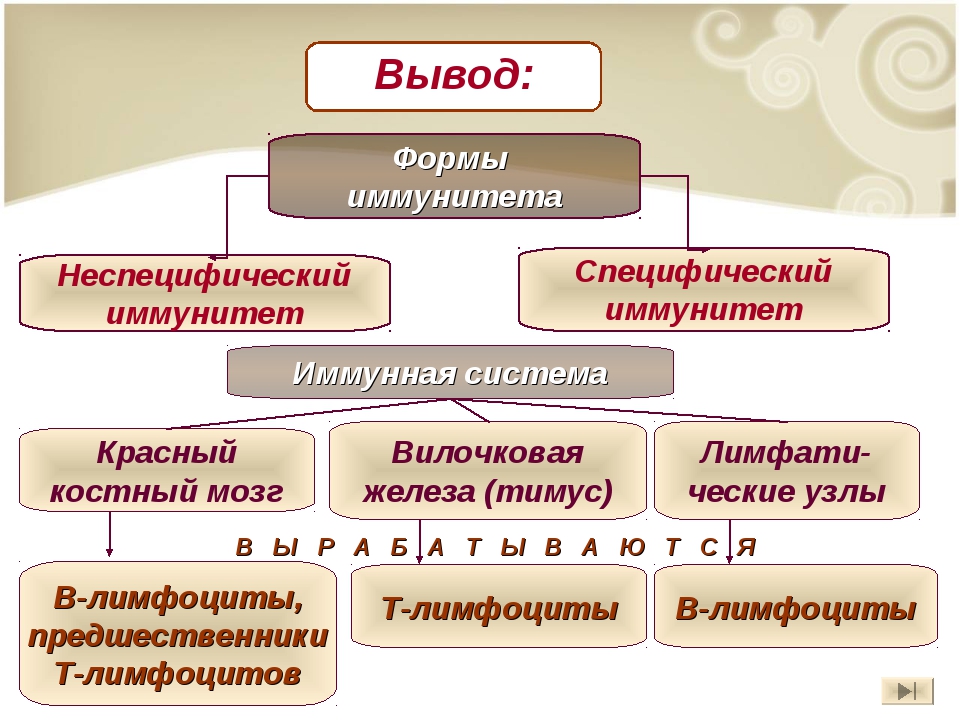 Это так называемый стерильный иммунитет. А в некоторых случаях он сохраняется только до тех пор, пока в организме есть возбудитель (туберкулез, сифилис) — это нестерильный иммунитет.
Это так называемый стерильный иммунитет. А в некоторых случаях он сохраняется только до тех пор, пока в организме есть возбудитель (туберкулез, сифилис) — это нестерильный иммунитет.
Регуляция иммунитета
Работа иммунитета во многом определяется состоянием нервной и эндокринной систем организма. Стресс, депрессии угнетают иммунитет, что сопровождается не только повышенной восприимчивостью к различным заболеваниям, но и создает благоприятные условия для развития злокачественных новообразований.
Материал подготовлен на основе информации открытых источников
Иммунитет — урок. Биология, Человек (8 класс).
Фагоцитоз и выработка антител лейкоцитами — единый защитный механизм, названный иммунитетом.
Иммунитет — система защиты организма от чужеродных веществ и других организмов.
Иммунные механизмы обеспечивают защиту от болезнетворных вирусов и бактерий, уничтожают погибшие и переродившиеся клетки.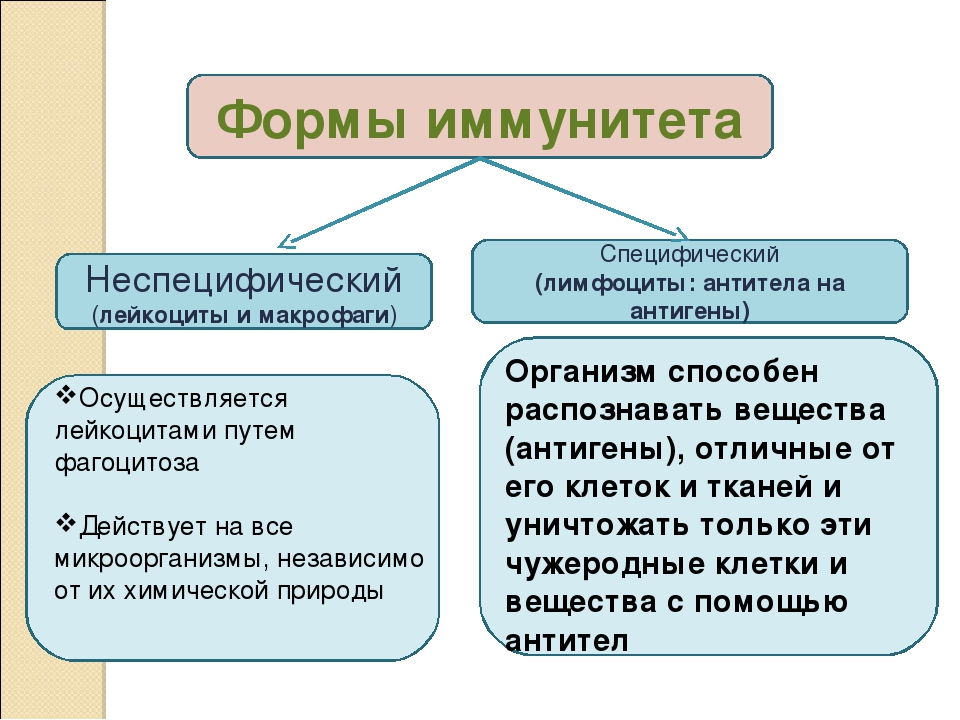
Иммунные реакции могут оказывать и отрицательное влияние. Так, они могут быть причиной осложнений при переливании крови и трансплантации органов.
Очень важную роль в формировании иммунитета играет тимус, или вилочковая железа. Эта железа находится за грудиной и хорошо функционирует только у детей.
Рис. \(1\). Тимус
Виды иммунитета
Защитные механизмы различаются по происхождению, способам воздействия на антиген и продолжительности действия.
Рис. \(2\). Схема «Виды иммунитета»
Естественный иммунитет
У людей есть врождённый иммунитет ко многим заболеваниям. Врождённый иммунитет передаётся по наследству от родителей.
Пример:
человек не болеет чумой собак, так у него с рождения имеется иммунитет к возбудителю этой болезни.
Если человека перенес инфекционную болезнь, то в его организме тоже формируется иммунитет (сохраняются клетки памяти, способные распознавать возбудителя болезни). Такой иммунитет получил название приобретённого. Если этот же микроб через некоторое время снова окажется в организме, он тут же уничтожается.
Такой иммунитет получил название приобретённого. Если этот же микроб через некоторое время снова окажется в организме, он тут же уничтожается.Пример:
переболев в детстве ветрянкой, человек уже повторно не болеет этой болезнью.
Врождённый иммунитет и иммунитет, приобретённый после болезни, называют естественным.
Естественным является также иммунитет, полученный новорожденным ребёнком от матери. Через плаценту во время беременности, а после рождения с грудным молоком к ребёнку попадают антитела, которые защищают его в первый год жизни от инфекционных заболеваний.
Искусственный иммунитет
Для защиты от многих инфекционных заболеваний (оспы, коклюша, полиомиелита, дифтерии, гриппа и др.), человеку делают прививки — вводят вакцину (убитых или сильно ослабленных возбудителей болезни) и таким образом создают искусственный иммунитет.
При введении вакцины у человека возникает лёгкая реакция на возбудителя болезни и вырабатываются клетки памяти. При следующем попадании этого возбудителя клетки памяти быстро распознают его и выделяют антитела, которые препятствуют развитию заболевания. Это — активный иммунитет. Прививки спасли жизни многим людям.
При следующем попадании этого возбудителя клетки памяти быстро распознают его и выделяют антитела, которые препятствуют развитию заболевания. Это — активный иммунитет. Прививки спасли жизни многим людям.
Первую прививку провёл в \(1769\) г. английский врач Эдуард Дженнер. Это была прививка от оспы — тяжёлой вирусной болезни, оставляющей на коже многочисленные рубцы. Дженнер обратил внимание, что во время эпидемий оспы практически не заболевают крестьянки, которые часто заражались от животных «коровьей оспой». Дженнер ввёл восьмилетнему мальчику «коровью оспу», а через \(1,5\) месяца заразил его человеческой оспой. Ребёнок не заболел. Так появились прививки.
Если человек уже заболел, то используют лечебные сыворотки, содержащие готовые антитела. Для получения лечебной сыворотки берут плазму крови переболевших людей или животных. В этом случае говорят о пассивном иммунитете.
Пример:
лечебные сыворотки используют для спасения людей от смертельно опасных болезней, например ботулизма, дифтерии. Их используют также при укусах змей (кобры, гюрзы, эфы).
Их используют также при укусах змей (кобры, гюрзы, эфы).
Лечебная сыворотка — это препарат плазмы крови без фибриногена, содержащий готовые антитела, которые образовались в крови животного (или человека), ранее заражённого данным возбудителем (перенёсшего данное заболевание).
Неспецифический и специфический иммунитет
Неспецифический иммунитет практически одинаков у всех представителей одного вида. Он направлен против любых чужеродных веществ и обеспечивает борьбу с инфекцией на ранних этапах её развития, когда специфический иммунитет ещё не сформировался.
Неспецифический иммунитет врождённый. Он обеспечивается кожным покровом и слизистыми оболочками.
Специфический иммунитет основан на распознавании конкретного антигена лимфоцитами и его уничтожении. У каждого человека этот тип иммунитета индивидуален.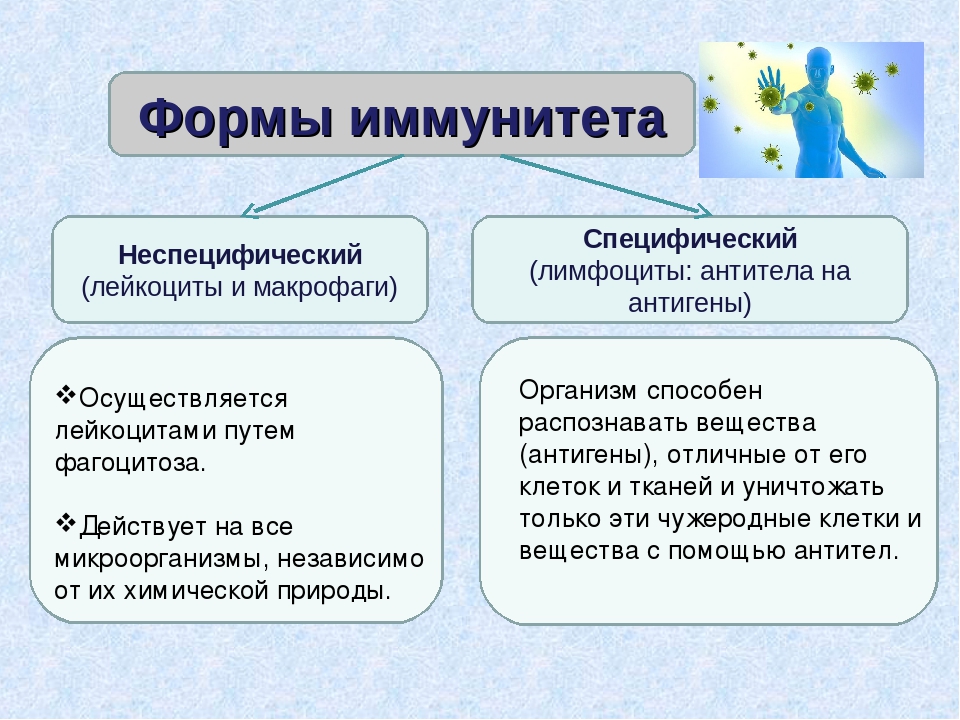 Он формируется постепенно в результате реакции иммунной системы на различные антигены, с которыми контактирует организм.
Он формируется постепенно в результате реакции иммунной системы на различные антигены, с которыми контактирует организм.
Специфический иммунитет обеспечивается клетками памяти (особыми лимфоцитами), которые сохраняются в организме после перенесённой инфекции или после прививки на долгое время. Эти клетки распознают возбудителя болезни при его повторном попадании в организм и быстро начинают вырабатывать антитела, препятствуя развитию болезни.
Источники:
Рис. 1. Тимус: https://www.shutterstock.com/da/image-illustration/male-anatomy-human-thymus-xray-view-83549896
Рис. 2. Схема «Виды иммунитета»: https://image.shutterstock.com/image-vector/illustration-biology-medical-acquired-immunity-600w-1663099516.jpg
Иммунитет: виды, разновидности иммунитета — клеточный и гуморальный, врожденный и приобретенный — 4 февраля 2021
Сильный иммунитет защищает от инфекций, сохраняет кожу упругой, десны, кости и нервы — крепкими, а настроение — бодрым. Иммунитет бывает активный, пассивный, врожденный, специфический, гуморальный, клеточный, приобретенный, но многие люди не понимают, в чем различия.
Иммунитет бывает активный, пассивный, врожденный, специфический, гуморальный, клеточный, приобретенный, но многие люди не понимают, в чем различия.
Чем отличаются виды иммунитета и как его нужно укреплять, рассказывает врач-иммунолог Борисова Татьяна Сергеевна, эксперт маркетплейса витаминов и натуральных товаров для здорового образа жизни iHerb.
Какой бывает иммунитет: врожденный и приобретенный
Существует две основных «категории» иммунитета — врожденный и приобретенный. У животных и растений первый считается ключевым, у людей эти виды примерно равны по значимости.
Врожденный, или неспецифический иммунитет — первая линия обороны организма. Он защищает организм с помощью различных видов фагоцитов, лейкоцитов, макрофагов и тучных клеток, которые участвуют в развитии аллергической реакции. Врожденный иммунитет срабатывает при первом проникновении микроба или бактерии. Но он не становится крепче или слабее: это своеобразная настройка, которая каждый раз работает одинаково.
Приобретенный иммунитет, он же адаптивный или специфический, появился позже. Он активируется после врожденного, если возбудитель инфекции преодолел первую линию обороны. Основной механизм приобретенного иммунитета — выработка антител, которую обеспечивают лимфоциты. Этот иммунитет действует более избирательно и за счет иммунной памяти может стать крепче со временем. При первой встрече с антигеном часть лимфоцитов сохраняет информацию, и в следующий раз организм распознает его и реагирует быстрее, не позволяя болезни развиться. По такому принципу работает вакцинация.
shutterstock.comАктивный иммунитет вырабатывается после перенесенного заболевания или введения вакцины. Пассивный — с молоком матери, а во взрослом возрасте после введения сыворотки с готовыми антителами. Клеточный иммунный ответ происходит за счет фагоцитов и лимфоцитов, а гуморальный — за счет антител.
Врожденный и приобретенный иммунитет работают в тандеме, поэтому укрепить один из них нельзя. Не совсем правильно говорить «укрепить иммунитет», это как сказать «починить машину». Ведь ломается не машина, а конкретные детали и механизмы. То же самое с организмом: укрепить можно состояние органов иммунной системы и работу конкретных реакций.
Не совсем правильно говорить «укрепить иммунитет», это как сказать «починить машину». Ведь ломается не машина, а конкретные детали и механизмы. То же самое с организмом: укрепить можно состояние органов иммунной системы и работу конкретных реакций.
Виды иммунитета: клеточный и гуморальный
Еще есть клеточный иммунитет, который связан с клетками организма. В его случае иммунный ответ организма происходит без участия антител и системы комплемента.
Т-лимфоциты в составе этого иммунитета вырабатывают рецепторы в мембранах клетки, которые реагируют на инородный раздражитель. Клеточный иммунитет «специализируется» на вирусах, грибах, опухолях различной этиологии, различных микроорганизмах, проникших в клетку.
Многие также слышали про гуморальный иммунитет. Главное отличие от клеточного — в местонахождении объектов воздействия. Гуморальному иммунитету помогают В-лимфоциты, которые образуются у взрослых людей в костном мозге. Активируют В-лимфоциты чужеродные агенты или Т-клетки, когда они встречаются с бактериями и патогенными агентами в кровяном или лимфатическом русле.
Как укрепить иммунитет
Поддерживайте уровень витаминов
Дефицит любого полезного вещества приводит к неполадкам разной степени в работе иммунной системы. Особенно она зависит от нескольких витаминов и микроэлементов.
Витамин С — участвует в выработке лимфоцитов, стимулирует активность макрофагов, выработку антител и интерферона, белка, который препятствует размножению вируса. Это мощный антиоксидант, который обеспечивает общую защиту клеток от внешних раздражителей.
Витамин D — стимулирует работу лимфоцитов, моноцитов, макрофагов. В этих клетках находятся рецепторы к витамину D. Стимулирует выработку антимикробных белков на слизистых в верхних дыхательных путях, защищая организм от заражения воздушно-капельным путем.
Витамин А — помогает формировать местный иммунитет, на коже и слизистых которые считаются первым и главным барьером на пути инфекции.
shutterstock.comЦинк, селен, медь и железо — ключевые микроэлементы для нормальной работы иммунной системы.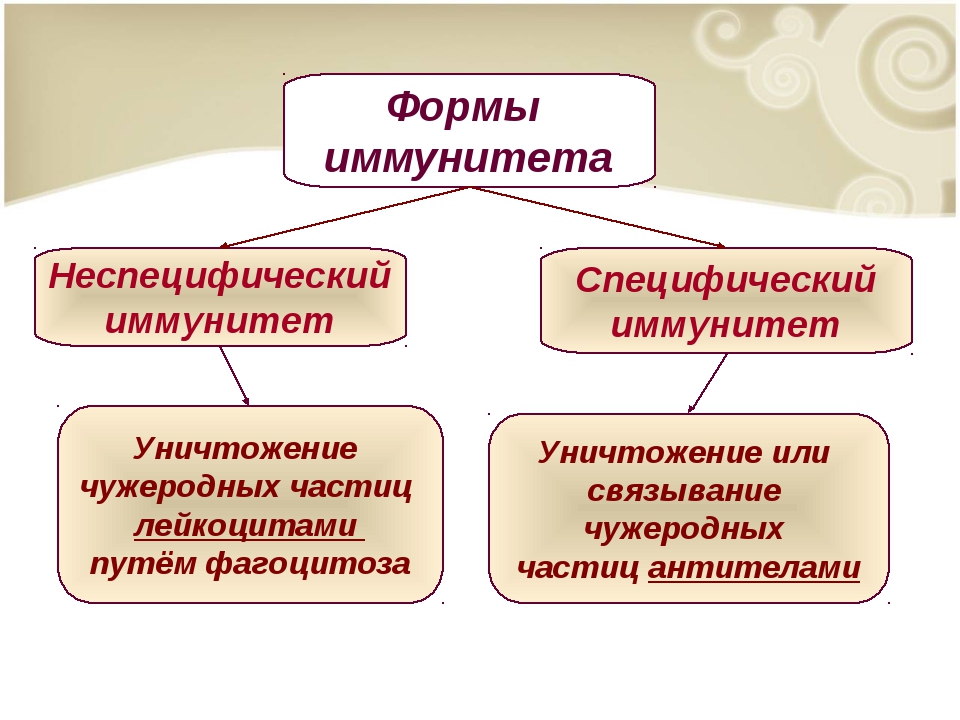 Цинк препятствует воспалительным процессам в дыхательных путях и стимулирует активность лимфоцитов. Селен ускоряет распространение лимфоцитов и препятствует возникновению опухолей. Медь необходима для выработки и распределения в тканях нейтрофилов, а также для усвоения железа. Железо стимулирует активность нейтрофилов и макрофагов, участвует в созревании лимфоцитов. Важно контролировать уровень железа в организме. Если принимать препараты железа в период инфекции, состояние организма ухудшится.
Цинк препятствует воспалительным процессам в дыхательных путях и стимулирует активность лимфоцитов. Селен ускоряет распространение лимфоцитов и препятствует возникновению опухолей. Медь необходима для выработки и распределения в тканях нейтрофилов, а также для усвоения железа. Железо стимулирует активность нейтрофилов и макрофагов, участвует в созревании лимфоцитов. Важно контролировать уровень железа в организме. Если принимать препараты железа в период инфекции, состояние организма ухудшится.
Чтобы точно узнать, каких именно веществ не хватает в вашем организме, рекомендуется сдать анализы на уровень содержания основных витаминов и микроэлементов, а витаминные комплексы подбирать вместе с врачом.
Добавляйте в рацион больше клетчатки
В нашей стране большинство фруктов и овощей мы можем купить вне сезона, но это не очень полезно для здоровья. Зимой фрукты и овощи до того, как попасть на прилавки, долго лежат на складе или едут в контейнерах, выращиваются на почвах со стимуляторами. В результате в них содержится менее 50% полезных веществ. Мы получаем переизбыток сахара и фруктозы, к которой организм зимой не готов. Также образуется избыток лептинов, которые содержатся в свежих овощах. Организм способен нейтрализовать этот избыток около трех месяцев, но не весь год. Поэтому важно добавлять в рацион сезонные продукты, характерные для климата, где вы родились, заготовки, квашеные и маринованные овощи: лептины в их составе переработаны бактериями.
В результате в них содержится менее 50% полезных веществ. Мы получаем переизбыток сахара и фруктозы, к которой организм зимой не готов. Также образуется избыток лептинов, которые содержатся в свежих овощах. Организм способен нейтрализовать этот избыток около трех месяцев, но не весь год. Поэтому важно добавлять в рацион сезонные продукты, характерные для климата, где вы родились, заготовки, квашеные и маринованные овощи: лептины в их составе переработаны бактериями.
Сокращайте сладкие продукты. Сахар — питательная среда для роста патогенных бактерий и грибов. Также сахар поддерживает воспалительный процесс посредством работы инсулина. Хронические кандидозы часто выглядят как рецидивирующая молочница, перхоть, аллергия, насморк, усталость, туман в голове, колиты, панкреатиты и прочие воспалительные процессы. Выход: ограничить употребление сладкого. Особенно в сезон простуд.
Занимайтесь спортом
Кровь и лимфа застаиваются, если человек много сидит и ведет малоподвижный образ жизни. Застои нарушают циркуляцию лимфы и крови: иммунные клетки медленнее добираются до точки, куда проник возбудитель инфекции. Токсины, бактерии и вирусы остаются в организме, если лимфатическая система прекращает циркулировать и очищаться. Это может провоцировать синдром интоксикации, в более тяжелых случаях — реакцию Герксгеймера (среди симптомов — повышение температуры, озноб, снижение давления, тахикардия, тошнота, головная боль, боль в мышцах).
Застои нарушают циркуляцию лимфы и крови: иммунные клетки медленнее добираются до точки, куда проник возбудитель инфекции. Токсины, бактерии и вирусы остаются в организме, если лимфатическая система прекращает циркулировать и очищаться. Это может провоцировать синдром интоксикации, в более тяжелых случаях — реакцию Герксгеймера (среди симптомов — повышение температуры, озноб, снижение давления, тахикардия, тошнота, головная боль, боль в мышцах).
Регулярные упражнения обеспечивают нормальное кровообращение и вентиляцию легких. Тренировки не должны быть высокоинтенсивными, считается и получасовая прогулка в среднем темпе, и утренняя разминка. Признаком достаточности физической нагрузки считается легкий пот.
shutterstock.comСледите за качеством сна
Сон не только необходим для полноценного восстановления организма и нормальной работы нервной системы. Пока мы спим, лимфоциты обрабатывают информацию о вредоносных клетках и веществах и при следующей встрече быстрее их распознают.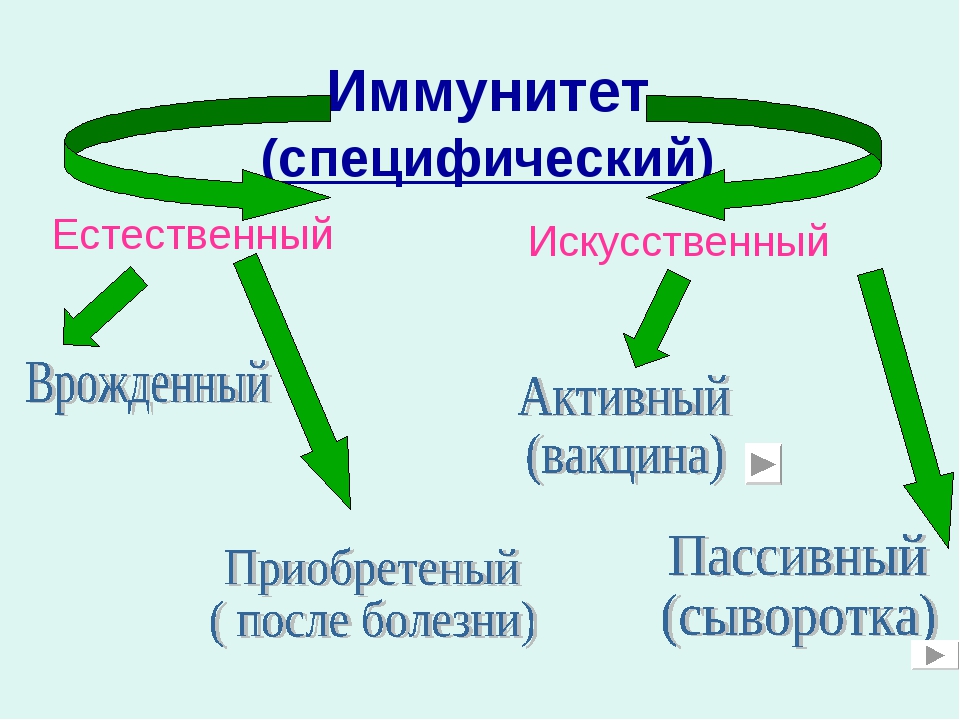 Во сне формируется иммунная память, без которой все, что иммунная система познала днем, пройдет мимо.
Во сне формируется иммунная память, без которой все, что иммунная система познала днем, пройдет мимо.
Это основные факторы нормальной работы иммунной системы. Чтобы организм был устойчив перед инфекциями и внешними раздражителями, недостаточно разобраться только со сном. Нужно учитывать все факторы сразу, и образ жизни будет здоровым.
Канал про ЗОЖ в телеграме! Подписывайся
ФГБНУ НЦПЗ. ‹‹Общая психиатрия››
Развитие иммунологического направления в биологических исследованиях психических заболеваний всегда было тесно связано с прогрессом в фундаментальной иммунологии. Оно отражало все этапы развития иммунологии — от первых концепций гуморального иммунитета до современных теорий клеточно-гуморальных взаимодействий при формировании иммунного ответа в организме человека. Здесь мы кратко изложим основные положения современной иммунологии.
СТРОЕНИЕ И ПРИНЦИПЫ ФУНКЦИОНИРОВАНИЯ ИММУННОЙ СИСТЕМЫ ЧЕЛОВЕКА
Иммунологическая функция осуществляется специализированной системой клеток, тканей и органов, которая называется иммунной (рис.
Иммунную систему в морфологическом аспекте можно рассматривать как совокупность лимфоцитов, макрофагов, ряда сходных с макрофагами клеток, включая дендритные клетки и эпителиальные клетки Лангерганса (эпидермоциты белые отростчатые). Клеточные элементы иммунной системы организованы в тканевые и органные структуры, к которым относятся селезенка, лимфатические узлы, групповые лимфатические фолликулы (пейеровы бляшки) кишечника, миндалины, вилочковая железа (тимус) и костный мозг.
Лимфоциты представляют собой клетки, специализированные в отношении способности отвечать лишь на ограниченную группу структурно сходных антигенов, т.е. быть коммитированными в отношении этих антигенов. Эта коммитированность определяется наличием у лимфоцита соответствующих мембранных рецепторов, специфических для детерминант того или иного антигена. Предполагают, что каждый лимфоцит обладает популяцией рецепторов с одинаковыми антигенсвязывающими центрами, а отдельная группа, или клон, лимфоцитов будет отличаться от другого клона структурой антигенсвязывающего центра рецепторов, способных реагировать только на определенный набор антигенов. Способность же организма отвечать практически на любой антиген обеспечивается наличием большого числа различных групп лимфоцитов. Это означает, что лимфоциты человека составляют неоднородную популяцию клеток.
Иммунная реакция может быть неспецифической (неспецифический иммунитет) и специфической (специфический иммунитет).
Неспецифический иммунитет обеспечивает первую линию зашиты от чужеродных частиц и организмов и осуществляется несколькими типами клеток. Например, фагоциты — моноциты крови и тканевые Макрофаги — поглощают и разрушают многие чужеродные частицы. Полиморфно-ядерные лейкоциты вместе с тучными клетками участвуют в защите от микроорганизмов, являясь важнейшими компонентами реакции острого воспаления. Кроме того, еще один класс клеток, названный естественными киллерами (от англ., kill — убивать), обеспечивает первую линию защиты организма, поражая инфицированные вирусами или неопластическим процессом клетки собственного организма. В формировании реакций неспецифического иммунитета важную роль играют так называемые белки острой фазы воспаления и система комплемента.
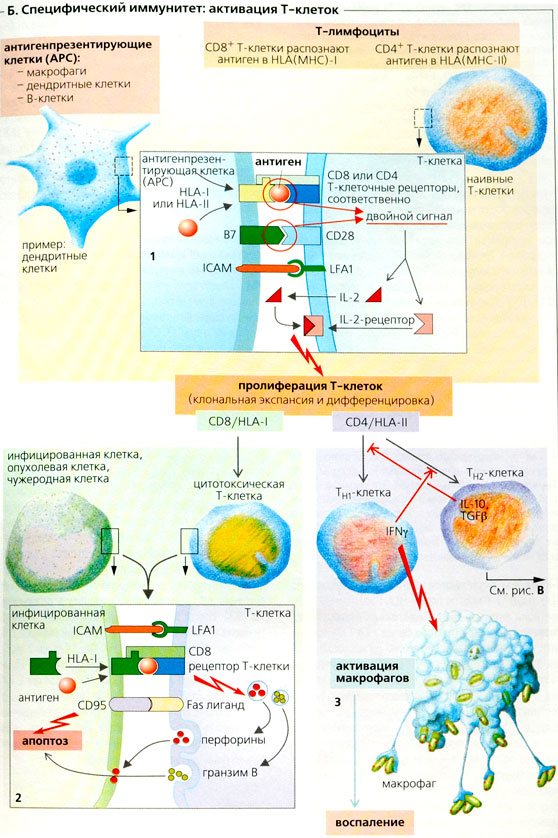
Специфический иммунитет отличается от неспецифического наличием специфичности, обучаемости и памяти. Как уже говорилось, отдельный лимфоцит имеет на своей поверхности только один тип рецептора (антигенсвязывающего центра) и поэтому отвечает только на один или несколько родственных антигенных структур выработкой антител. Если однажды индивидуум встречался со специфическим антигеном, то соответствующие лимфоциты запоминают его структуру. Повторная встреча с этим же антигеном ведет к тому, что иммунная система вспоминает его и ответ на него бывает более быстрым и сильным. Феномены обучения и памяти осуществляются по законам так называемой клональной селекции. Лимфоцит, который распознает антиген, пролиферирует в клон идентичных клеток, каждая из которых несет на себе рецепторы той же специфичности, т.е. способна продуцировать соответствующие этой специфичности антитела. В последнем случае лимфоциты дифференцируются в антителопродуцирующие плазматические клетки, другие же лимфоциты остаются длительно живущими клетками памяти.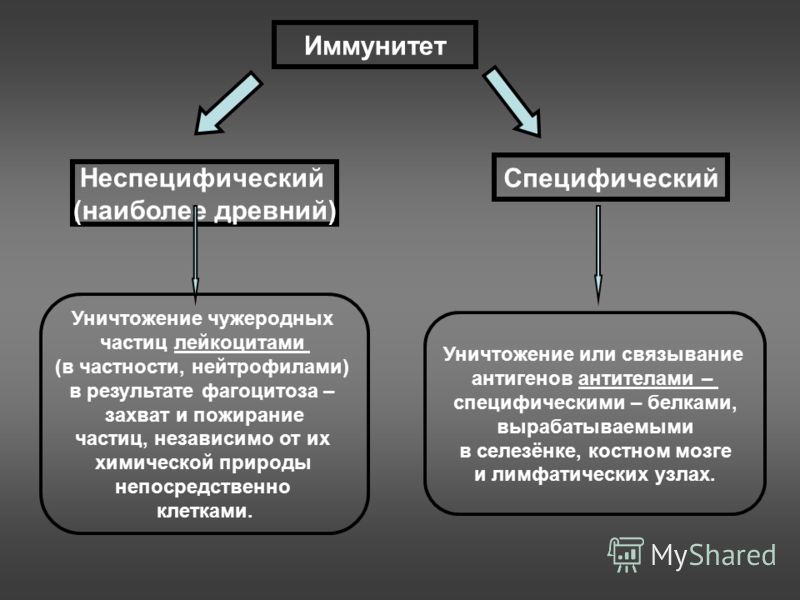
Лимфоциты различаются между собой не только по специфичности своих рецепторов, но и по их функциональным свойствам. Согласно последним, различают два основных класса лимфоцитов: В-лимфоциты и Т-лимфоциты. В соответствии с этим различают Т- и В-системы иммунитета. Формирование их происходит по путям, изображенным на рис.19: стволовая кроветворная клетка (СКК), или клетка-предшественник лимфопоэза, мигрируя из костного мозга (КМ) в тимус, или вилочковую железу (ВЖ), дифференцируется под влиянием микроокружения этого органа в Т-клетку. При миграции СКК в сумку Фабрициуса (СФ) у птиц или неизвестный аналог данного органа у млекопитающих происходит дифференцировка в клетки В-ряда. Из центральных органов иммунитета клетки расселяются в периферические органы иммунной системы — селезенку (С), лимфатические узлы (ЛУ) и др., где они приобретают функциональные особенности, свойственные зрелым Т- и В-лимфоцитам (Т,В). Т-лимфоциты представлены киллерами (Тк), Т-супрессорами (Тс) и Т-хелперами (Тх). К зрелым клеточным популяциям относятся также плазмоциты (ПЦ). Конечная клетка В-клеточного пути дифференцировки активно синтезирует и секретирует антитела.
При миграции СКК в сумку Фабрициуса (СФ) у птиц или неизвестный аналог данного органа у млекопитающих происходит дифференцировка в клетки В-ряда. Из центральных органов иммунитета клетки расселяются в периферические органы иммунной системы — селезенку (С), лимфатические узлы (ЛУ) и др., где они приобретают функциональные особенности, свойственные зрелым Т- и В-лимфоцитам (Т,В). Т-лимфоциты представлены киллерами (Тк), Т-супрессорами (Тс) и Т-хелперами (Тх). К зрелым клеточным популяциям относятся также плазмоциты (ПЦ). Конечная клетка В-клеточного пути дифференцировки активно синтезирует и секретирует антитела.
В-лимфоциты происходят из клеток-предшественников костного мозга (bone marrow). Место их созревания у человека остается неизвестным. В-лимфоциты являются антителообразующими клетками. Т-лимфоциты, или тимусзависимые лимфоциты, также происходят из клеток-предшественников костного мозга, но затем созревают и дифференцируются в вилочковой железе — тимусе (thymus).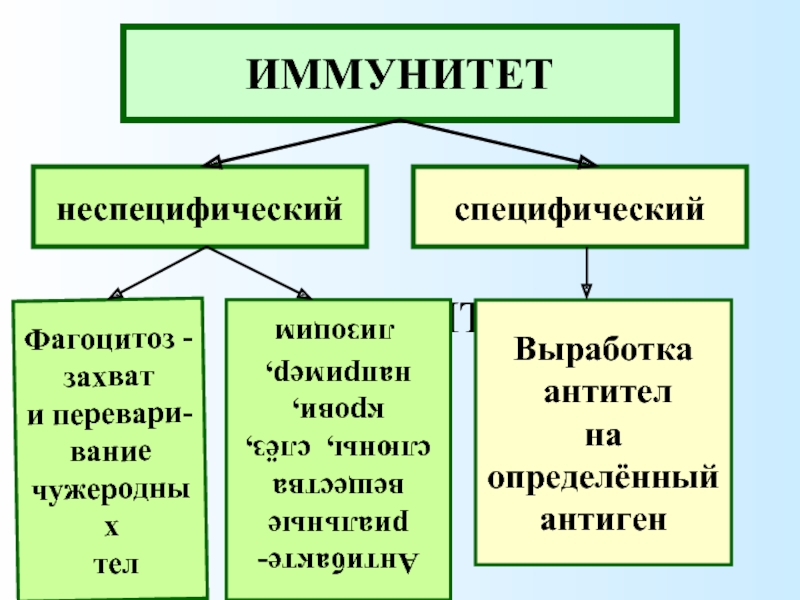 Т-лимфоциты подразделяются на ряд подклассов. Часть из них опосредуют важные регуляторные функции: «помогают» — хелперы (от англ., help) или «подавляют» — супрессоры (от англ., supress) развитие иммунного ответа, в том числе и образование антител. Т-лимфоциты выполняют также эффекторные функции, например вырабатывают растворимые вещества, запускающие разнообразные воспалительные реакции, или осуществляют прямое разрушение клеток, несущих на себе антигены (киллерная функция). В соответствии с этим различают следующие подклассы Т-лимфоцитов: Т-хелперы, Т-супрессоры, Т-киллеры и Т-клетки, участвующие в реакции замедленной гиперчувствительности и связанных с нею иммунологических явлениях.
Т-лимфоциты подразделяются на ряд подклассов. Часть из них опосредуют важные регуляторные функции: «помогают» — хелперы (от англ., help) или «подавляют» — супрессоры (от англ., supress) развитие иммунного ответа, в том числе и образование антител. Т-лимфоциты выполняют также эффекторные функции, например вырабатывают растворимые вещества, запускающие разнообразные воспалительные реакции, или осуществляют прямое разрушение клеток, несущих на себе антигены (киллерная функция). В соответствии с этим различают следующие подклассы Т-лимфоцитов: Т-хелперы, Т-супрессоры, Т-киллеры и Т-клетки, участвующие в реакции замедленной гиперчувствительности и связанных с нею иммунологических явлениях.
На мембранах зрелой В-клетки имеются рецепторы для антигена. При связывании антигена с этими рецепторами клетка активируется. Для такой активации обычно нужно, чтобы В-клетка одновременно со связыванием антигена вступила во взаимодействие со специфической хелперной Т-клеткой или чтобы последняя синтезировала растворимые факторы роста и дифференцировки. В противном случае, когда связывание антигена не сопровождается поступлением сигналов от растворимых факторов роста или от хелперных Т-клеток, может произойти инактивация В-лимфоцита, т.е. может развиться состояние иммунологической толерантности.
В противном случае, когда связывание антигена не сопровождается поступлением сигналов от растворимых факторов роста или от хелперных Т-клеток, может произойти инактивация В-лимфоцита, т.е. может развиться состояние иммунологической толерантности.
Иммунологическая толерантность представляет собой явление, обратное иммунному ответу. Она является, в частности, основой для понимания того, почему иммунная система в норме не развивает иммунный ответ против антигенов собственного организма (аутоантигенов): иммунная система находится в состоянии толерантности по отношению к антигенам клеток и тканей данного организма («своих» антигенов). Вместе с тем малые количества антител против многих аутоантигенов обнаруживаются в крови практически у всех людей. Последнее дает основание предполагать, что клетки, способные вырабатывать аутоантитела, в организме все же существуют, но их или очень мало, или их активность супрессирована.
Существуют две гипотезы, объясняющие сущность иммунологической толерантности. В соответствии с первой гипотезой, предложенной F.Buraet (1957), иммунологическая толерантность — это отсутствие клона клеток, способных распознавать данный антиген (если подобные клетки возникают, они элиминируются избытком циркулирующего в организме аутоантигена). В соответствии со второй гипотезой лимфоциты, способные развивать иммунный ответ против собственных антигенов, есть в организме, но они блокированы избытком аутоантигена или их реакцию сдерживают Т-супрессоры. «Срыв» толерантности по отношению к тому или иному аутоантигену приводит к развитию аутоиммунного заболевания.
В соответствии с первой гипотезой, предложенной F.Buraet (1957), иммунологическая толерантность — это отсутствие клона клеток, способных распознавать данный антиген (если подобные клетки возникают, они элиминируются избытком циркулирующего в организме аутоантигена). В соответствии со второй гипотезой лимфоциты, способные развивать иммунный ответ против собственных антигенов, есть в организме, но они блокированы избытком аутоантигена или их реакцию сдерживают Т-супрессоры. «Срыв» толерантности по отношению к тому или иному аутоантигену приводит к развитию аутоиммунного заболевания.
Аутоиммунными заболеваниями называют такие состояния, при которых в организме появляются антитела или сенсибилизированные лимфоциты против нормальных антигенов собственного организма. Одна из первых гипотез аутоиммунизации была основана на том, что нормальная иммунная система реагирует на измененные антигены собственного организма. Причиной изменения тканевых антигенов могут быть химические, в том числе лекарственные, воздействия, влияние физических (например, радиационных или термических) факторов, а также микробные или вирусные агенты. В этих случаях предполагается следующее: возникновение измененного тканевого антигена приводит к реакции иммунной системы на этот аутоантиген и выработке аутоантител или появлению сенсибилизированных лимфоцитов, которые оказывают деструктивное влияние последних на те или иные ткани. Эта гипотеза, несмотря на ее логичность и простоту, не могла объяснить два момента. Во-первых, каким образом антитела против модифицированного антигена могут повреждать нормальные ткани? Антитела ведь строго специфичны и следовало бы ожидать, что они должны взаимодействовать только с модифицированным антигеном, вступать с ним в связь и играть не деструктивную, а защитную роль. Во-вторых, выполнив защитную роль и обеспечив таким образом элиминацию из организма модифицированного антигена, иммунный ответ должен привести к быстрому самоизлечению организма от аутоиммунного заболевания. В действительности эти заболевания имеют длительный само поддерживающий характер.
В этих случаях предполагается следующее: возникновение измененного тканевого антигена приводит к реакции иммунной системы на этот аутоантиген и выработке аутоантител или появлению сенсибилизированных лимфоцитов, которые оказывают деструктивное влияние последних на те или иные ткани. Эта гипотеза, несмотря на ее логичность и простоту, не могла объяснить два момента. Во-первых, каким образом антитела против модифицированного антигена могут повреждать нормальные ткани? Антитела ведь строго специфичны и следовало бы ожидать, что они должны взаимодействовать только с модифицированным антигеном, вступать с ним в связь и играть не деструктивную, а защитную роль. Во-вторых, выполнив защитную роль и обеспечив таким образом элиминацию из организма модифицированного антигена, иммунный ответ должен привести к быстрому самоизлечению организма от аутоиммунного заболевания. В действительности эти заболевания имеют длительный само поддерживающий характер.
На смену этому представлению пришла гипотеза, основанная на идее F. Burnet о запрещенных клонах лимфоидных клеток. Принципиальное отличие этой и всех последующих гипотез от предыдущей состоит в том, что аутоиммунные расстройства рассматриваются как патология иммунной системы, в результате чего появляется реакция не на модифицированные, а на нормальные тканевые антигены, т.е. на истинные аутоантигены.
Burnet о запрещенных клонах лимфоидных клеток. Принципиальное отличие этой и всех последующих гипотез от предыдущей состоит в том, что аутоиммунные расстройства рассматриваются как патология иммунной системы, в результате чего появляется реакция не на модифицированные, а на нормальные тканевые антигены, т.е. на истинные аутоантигены.
В соответствии с гипотезой запрещенных клонов предполагается следующее: возникновение генетически измененных лимфоидных клеток, способных реагировать на нормальные антигены организма, приводит к накоплению запрещенного клона клеток и иммунной реакции этого клона против тех или иных тканевых антигенов с появлением аутоантител или сенсибилизированных лимфоцитов, оказывающих деструктивное влияние на соответствующие ткани. Концепция запрещенных клонов произвела аутоиммунные расстройства в ранг болезней иммунной системы. Таким образом, впервые был поставлен вопрос о том, что для эффективной борьбы с аутоиммунными заболеваниями необходимо искать способы лечения не пораженных аутоантителами тканей, а иммунной системы в целом. В последние годы идея о запрещенных клонах обогатилась фактами, установившими возможность поликлональной активации В-клеток. Было показано, что ряд веществ может вызвать пролиферацию и дифференцировку всех В-клонов отдельных клеточных популяций. Предполагается, что процесс такого типа может привести к активации и аутоагрессивного клона. Эта гипотеза хорошо объясняет провоцирующую роль инфекционных и других экзогенных воздействий при наследственной предрасположенности к аутоиммунным расстройствам.
В последние годы идея о запрещенных клонах обогатилась фактами, установившими возможность поликлональной активации В-клеток. Было показано, что ряд веществ может вызвать пролиферацию и дифференцировку всех В-клонов отдельных клеточных популяций. Предполагается, что процесс такого типа может привести к активации и аутоагрессивного клона. Эта гипотеза хорошо объясняет провоцирующую роль инфекционных и других экзогенных воздействий при наследственной предрасположенности к аутоиммунным расстройствам.
Одна из последних гипотез, объясняющих механизмы аутоиммунизации, возникла после открытия Т-супрессоров. Речь идет об иммунодефиците по Т-супрессорам, которые подавляют функцию В-лимфоцитов. При дефиците Т-супрессоров В-клетки начинают реагировать на тканевые аутоантигены, вырабатывают аутоантитела, которые и обеспечивают развитие аутоиммунного заболевания.
Активация В-лимфоцита состоит из двух фаз — пролиферации и дифференцировки. В результате пролиферации увеличивается число В-клеток, способных реагировать с введенным в организм чужеродным антигеном. Процесс пролиферации необходим, поскольку в спокойном состоянии в организме специфичных для одного антигена В-лимфоцитов мало. В результате пролиферации увеличивается число клеток, способных немедленно дифференцироваться в антителообразующие лимфоциты, а также накапливаются В-лимфоциты памяти, способные активироваться при повторной иммунизации.
Процесс пролиферации необходим, поскольку в спокойном состоянии в организме специфичных для одного антигена В-лимфоцитов мало. В результате пролиферации увеличивается число клеток, способных немедленно дифференцироваться в антителообразующие лимфоциты, а также накапливаются В-лимфоциты памяти, способные активироваться при повторной иммунизации.
Антителообразующие клетки продуцируют антитела, представляющие собой молекулы иммуноглобулинов (Ig), т.е. белков, способных взаимодействовать с соответствующими антигенами. Ig могут быть мономерами или построенными из нескольких субъединиц полимерами. Каждая субъединица состоит из 2 тяжелых — Н (от англ., heavy — тяжелый) и 2 легких — L (от англ., light — легкий) полипептидных цепей (рис. 20), которые объединены в 4-цепочечную молекулу посредством ковалентных дисульфидных связей (—S—S). Каждая цепь содержит вариабельную V-область (variable — изменчивый) и константную область С (constant — постоянный), подразделяющуюся на участки СН1, СН2, СН3. L-цепь имеет один константный участок CL, от которого зависит специфичность Ig. Запрограммировано, что каждая В-клетка в течение клеточного онтогенеза может продуцировать, нести на себе и секретировать антитело только одной специфичности. Существует 5 классов Ig — IgG, IgM, IgA, IgD, IgE, каждый из которых обладает определенными эффекторными функциями. IgE-антитела играют основную роль в формировании реакции гиперчувствительности немедленного типа, примером которой является анафилаксия.
L-цепь имеет один константный участок CL, от которого зависит специфичность Ig. Запрограммировано, что каждая В-клетка в течение клеточного онтогенеза может продуцировать, нести на себе и секретировать антитело только одной специфичности. Существует 5 классов Ig — IgG, IgM, IgA, IgD, IgE, каждый из которых обладает определенными эффекторными функциями. IgE-антитела играют основную роль в формировании реакции гиперчувствительности немедленного типа, примером которой является анафилаксия.
Новорожденный ребенок практически не имеет собственных Ig и уровень их в сыворотке в основном обусловлен наличием Ig, полученных от матери (они способны проходить через плацентарный барьер). Со временем в зависимости от полупериода жизни каждого Ig уровень его в сыворотке крови ребенка падает до минимума. Это обычно происходит в возрасте 12—14 нед. постнатальной жизни. Этим объясняется тяжелое течение многих инфекций у детей этого возраста в отличие от новорожденных, которые более или менее защищены Ig, полученными от матери.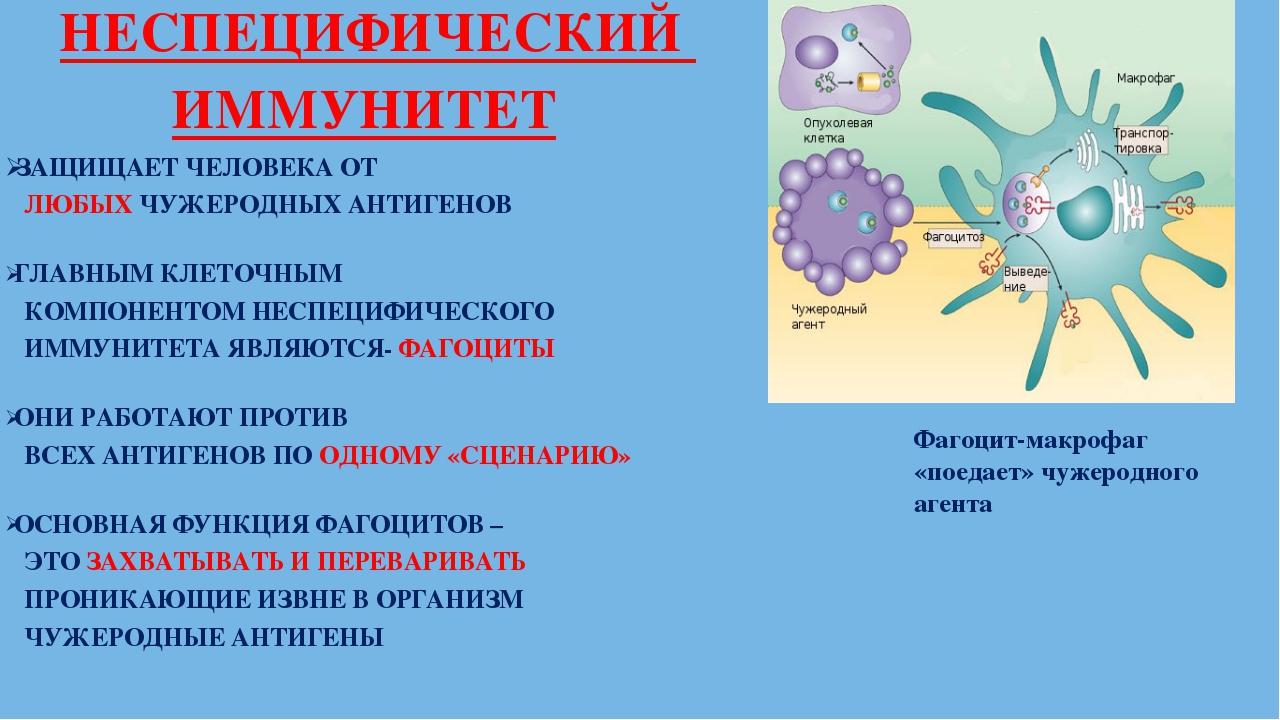 С возрастом уровень Ig нарастает: IgG достигают характерного для взрослых уровня к 3 годам, IgM — к 6 мес., IgE и IgA — только к 10-летнему возрасту.
С возрастом уровень Ig нарастает: IgG достигают характерного для взрослых уровня к 3 годам, IgM — к 6 мес., IgE и IgA — только к 10-летнему возрасту.
Обладающие различными функциями Т-лимфоциты продуцируют много различных растворимых медиаторов, известных под названием цитокины. К ним можно отнести интерлейкины, интерфероны, факторы роста и дифференцировки Т- и В-клеток, хемотаксические и цитотоксические факторы — лимфотоксин и фактор, некротизирующий опухоль. Клетки различных подклассов обладают различными эффекторными функциями. Цитолитические Т-лимфоциты способны разрушить тканевый трансплантат, инфицированные вирусом и внутриклеточными паразитами собственные клетки организма; кроме того, они могут разрушать и опухолевые клетки. Регуляторные функции Т-клеток проявляются в активации иммунной реакции (Т-хелперы) и в ее подавлении (Т-супрессоры).
В 1958 г. J.Dausset были открыты у человека антигены тканевой совместимости (human leukocyte antigen system) — система HLA, существенно расширившая представления о системе гистосовместимости, которая до этого была известна лишь у животных. Речь вдет о так называемом большом комплексе гистосовместимости (major histocompatibility complex, MHC) на уровне генов и появлении современной иммуногенетики, в том числе клинической генетики.
Речь вдет о так называемом большом комплексе гистосовместимости (major histocompatibility complex, MHC) на уровне генов и появлении современной иммуногенетики, в том числе клинической генетики.
Проблема HLA человека в клиническом отношении первоначально разрабатывалась исключительно в рамках трансплантологии. Дальнейшие исследования показали, что гены, кодирующие антигены гистосовместимости, являются многофункциональными; клиническое значение их не ограничивается рамками трансплантологии, а связано также с предрасположенностью к определенным заболеваниям.
Основная генетическая информация, детерминирующая наиболее значительные антигены гистосовместимости у человека, заключена в одном локусе, расположенном соответственно на одной паре аутосомных хромосом. Локус, как уже указывалось, получил наименование HLA. За последние годы представления о генетическом строении локуса HLA уточнены и расширены. Методом хромосомной гибридизации доказано, что он локализуется на 6-й аутосомной хромосоме человека (рис. 21). Генетическая карта HLA человека представляет набор локусов, расположенных на коротком плече хромосомы 6 (Хр.6). Три локуса HLA-A, HLA-B и HLA-C кодируют 3 вида аллоантигенов клеточной поверхности, что определяет широкий полиморфизм людей по этим признакам. Локус HLA-D/DR несет ответственность за синтез белков клеточной поверхности. Одна из функций этого локуса — контроль силы иммунного ответа.
21). Генетическая карта HLA человека представляет набор локусов, расположенных на коротком плече хромосомы 6 (Хр.6). Три локуса HLA-A, HLA-B и HLA-C кодируют 3 вида аллоантигенов клеточной поверхности, что определяет широкий полиморфизм людей по этим признакам. Локус HLA-D/DR несет ответственность за синтез белков клеточной поверхности. Одна из функций этого локуса — контроль силы иммунного ответа.
Таким образом в комплексе HLA выделяют 5 генетических структурных единиц — сублокусы А, В, С, D и DR. Антигены, принадлежащие первым 3 и последнему сублокусам, выявляются серологическим путем. Антигены сублокуса HLA-D выявляются посредством реакции смешанной культуры лимфоцитов. Для клинического рутинного типирования до последнего времени особое значение имело выявление антигенов сублокусов HLA-A и HLA-B как наиболее изученных, для которых получены значимые клинические ассоциации. К 1980 г. почти полностью были выявлены антигены, входящие в сублокус HLA-A (20 детерминант) и HLA-B (40 детерминант). Замечено, что носительство определенных HLA-антигенов при некоторых болезнях встречается с повышенной частотой, что свидетельствует о генетически детерминированной предрасположенности, «запрограммированном риске» поражаемости человека соответствующим заболеванием. Самой демонстративной, абсолютно достоверной для всех расовых групп является ассоциация HLA-B27 с анкилозирующим спондилитом: среди больных 81—97 % являются носителями HIA-В27, тогда как среди здоровых — только 4—12 %. Показатель относительного риска при этой патологии чрезвычайно высок — приближается к 100 %. Уже проведено огромное количество работ по изучению связи между HLA-антигенами и различными заболеваниями, однако ни в одном случае не было выявлено столь четкой связи, как при упомянутом заболевании. В литературе очень много противоречивых результатов, которые могут быть обусловлены разными факторами (в том числе этническими). Тем не менее исследования в этом направлении продолжаются.
Замечено, что носительство определенных HLA-антигенов при некоторых болезнях встречается с повышенной частотой, что свидетельствует о генетически детерминированной предрасположенности, «запрограммированном риске» поражаемости человека соответствующим заболеванием. Самой демонстративной, абсолютно достоверной для всех расовых групп является ассоциация HLA-B27 с анкилозирующим спондилитом: среди больных 81—97 % являются носителями HIA-В27, тогда как среди здоровых — только 4—12 %. Показатель относительного риска при этой патологии чрезвычайно высок — приближается к 100 %. Уже проведено огромное количество работ по изучению связи между HLA-антигенами и различными заболеваниями, однако ни в одном случае не было выявлено столь четкой связи, как при упомянутом заболевании. В литературе очень много противоречивых результатов, которые могут быть обусловлены разными факторами (в том числе этническими). Тем не менее исследования в этом направлении продолжаются.
Взаимодействие иммунной, нервной и эндокринной систем.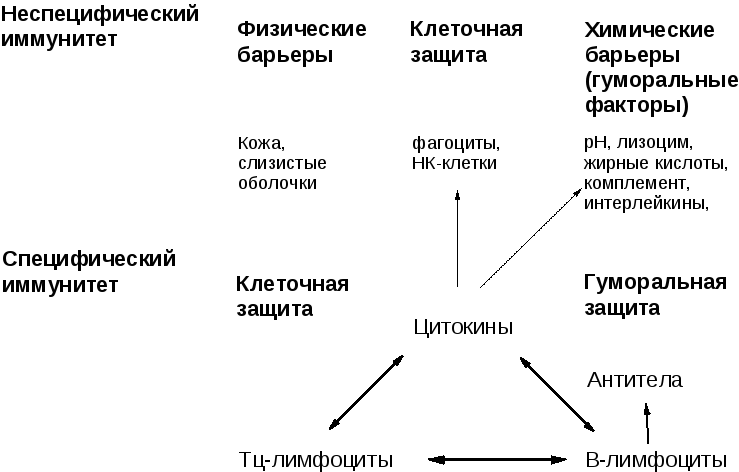 В последние годы значительное развитие получило направление исследований, связанное с изучением взаимодействия и взаимообусловленности функционирования иммунной, нервной и эндокринной систем. До недавнего времени считалось, что основная роль в реализации взаимодействия между нейроэндокринной и иммунной системами принадлежит катехоламинам, ацетилхолину и глюкокортикоидным гормонам. В дальнейшем появилось достаточное количество экспериментальных данных о модулирующем влиянии на иммунный ответ таких пептидных гормонов, как АКТГ, соматотропин, аргинин-вазопрессин, окситоцин, тиреотропин, вещество P, вазоактивный интестинальный пептид и др. Доказано, что в иммунорегуляции принимают участие эндорфины и энкефалины.
В последние годы значительное развитие получило направление исследований, связанное с изучением взаимодействия и взаимообусловленности функционирования иммунной, нервной и эндокринной систем. До недавнего времени считалось, что основная роль в реализации взаимодействия между нейроэндокринной и иммунной системами принадлежит катехоламинам, ацетилхолину и глюкокортикоидным гормонам. В дальнейшем появилось достаточное количество экспериментальных данных о модулирующем влиянии на иммунный ответ таких пептидных гормонов, как АКТГ, соматотропин, аргинин-вазопрессин, окситоцин, тиреотропин, вещество P, вазоактивный интестинальный пептид и др. Доказано, что в иммунорегуляции принимают участие эндорфины и энкефалины.
Установлено, что функция иммунной системы регулируется такими мозговыми структурами, как гипоталамус, гипофиз, миндалина, вентральное поле покрышки и др., а также нейрохимическими системами мозга — дофаминергической, серотонинергической и др. На основе соответствующих данных возникло предположение о существовании иммунных расстройств, обусловленных нарушением нервной регуляции [Крыжановский Г. Н., Магаева С.М., 1998].
Н., Магаева С.М., 1998].
Ключевым звеном аппарата регуляции является гипоталамус. Он связан со всеми звеньями аппарата и дает начало сложному эфферентному пути передачи центральных нейрорегуляторных влияний на иммунокомпетентные клетки, которые обладают соответствующими рецепторами к нейро-трансмиттерам, нейропептидам, а также к гормонам эндокринных желез [Говырин Н.В., Ложкина А.Н., 1991; Шхинек Э.К., 1993].
Выявлены конкретные медиаторы, с помощью которых реализуется взаимосвязь между иммунокомпетентными и нервными клетками. Как уже упоминалось, большое значение имело открытие в мозге эндогенных морфиноподобных соединений и рецепторов к ним. Речь идет о группе нейропептидов — опиоидных пептидов.
Были открыты иммуномодулирующие свойства нейропептидов, что позволило существенно дополнить представления о механизмах передачи сигналов от нервной системы к иммунной. На иммунокомпетентных клетках обнаружены рецепторы ко многим известным нейропептидам, что доказывает их участие в реализации эфферентного звена нейроиммунного взаимодействия. В то же время долго оставался неясным вопрос о механизмах обратной связи — от иммунной системы к нервной. Лишь в 80-е годы была обнаружена продукция ряда гормонов и опиоидных пептидов иммунокомпетентными клетками, доказана возможность действия медиаторов иммунитета на нервные клетки [Петров P.В. и др., 1986; Михайлова А.А. и др., 1987; Hall N. et al., 1986; Smith E. et al., 1987]. Группа опиоидных пептидов была впервые обнаружена среди костномозговых медиаторов — миелопептидов; в костном мозге выявлен предшественник эндорфинов — проопиомеланокортин. Опиоидные пептиды и их предшественник были затем найдены и в вилочковой железе (тимусе).
В то же время долго оставался неясным вопрос о механизмах обратной связи — от иммунной системы к нервной. Лишь в 80-е годы была обнаружена продукция ряда гормонов и опиоидных пептидов иммунокомпетентными клетками, доказана возможность действия медиаторов иммунитета на нервные клетки [Петров P.В. и др., 1986; Михайлова А.А. и др., 1987; Hall N. et al., 1986; Smith E. et al., 1987]. Группа опиоидных пептидов была впервые обнаружена среди костномозговых медиаторов — миелопептидов; в костном мозге выявлен предшественник эндорфинов — проопиомеланокортин. Опиоидные пептиды и их предшественник были затем найдены и в вилочковой железе (тимусе).
Принципиально важными явились также работы по изучению нейротропной активности медиаторов иммунитета. Показано, что такие медиаторы, как интерлейкин 1 (ИЛ-1), интерлейкин 2 (ИЛ-2), интерферон (ИФ), тимозин, фактор некроза опухоли (ФНО) обладают способностью регулировать функции ЦНС.
Пептидные лиганды, осуществляющие нейроиммунное взаимодействие, имеют общие для обеих систем рецепторы.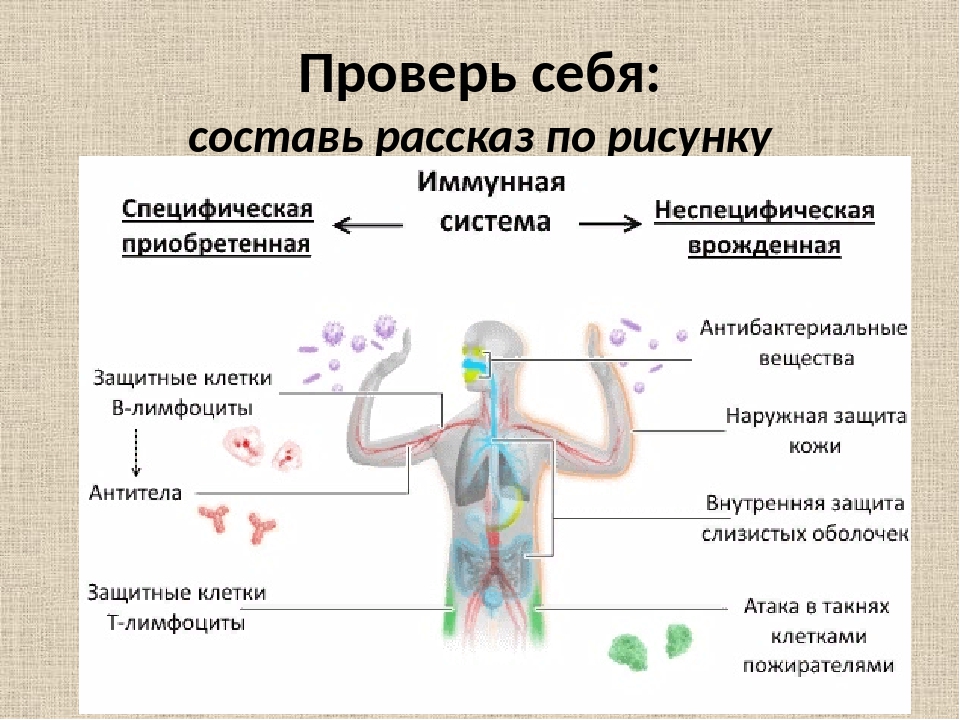 Так, иммунокомпетентные клетки могут синтезировать нейропептиды и отвечать на большинство, если не на все, соединения этой группы. Клетки нейроэндокринной системы продуцируют некоторые лимфокины и монокины и отвечают на них. Структурная родственность рецепторов показана, например, для АКТГ, эндорфинов, ИЛ-1 и ИЛ-2.
Так, иммунокомпетентные клетки могут синтезировать нейропептиды и отвечать на большинство, если не на все, соединения этой группы. Клетки нейроэндокринной системы продуцируют некоторые лимфокины и монокины и отвечают на них. Структурная родственность рецепторов показана, например, для АКТГ, эндорфинов, ИЛ-1 и ИЛ-2.
Итак, можно сказать, что эти системы имеют и используют одинаковый набор сигнальных молекул в виде физиологически активных субстанций, таких как лимфокины и монокины для внутрисистемной и межсистемной связи. Кроме того, они обладают одинаковым спектром рецепторов для общих лигандов.
Эксперты оценили связь сильного иммунитета и риска заразиться COVID-19 — РБК
«Если брать общую картинку, то те люди, которые имеют достаточный ответ иммунной системы, так называемый Т-клеточный иммунитет, устойчивый, могут быть длительное время не подвержены заболеваниям от каких-то инфекционных агентов», — сообщил в разговоре с РБК профессор кафедры фтизиатрии и пульмонологии лечебного факультета МГМСУ Сергей Бабак.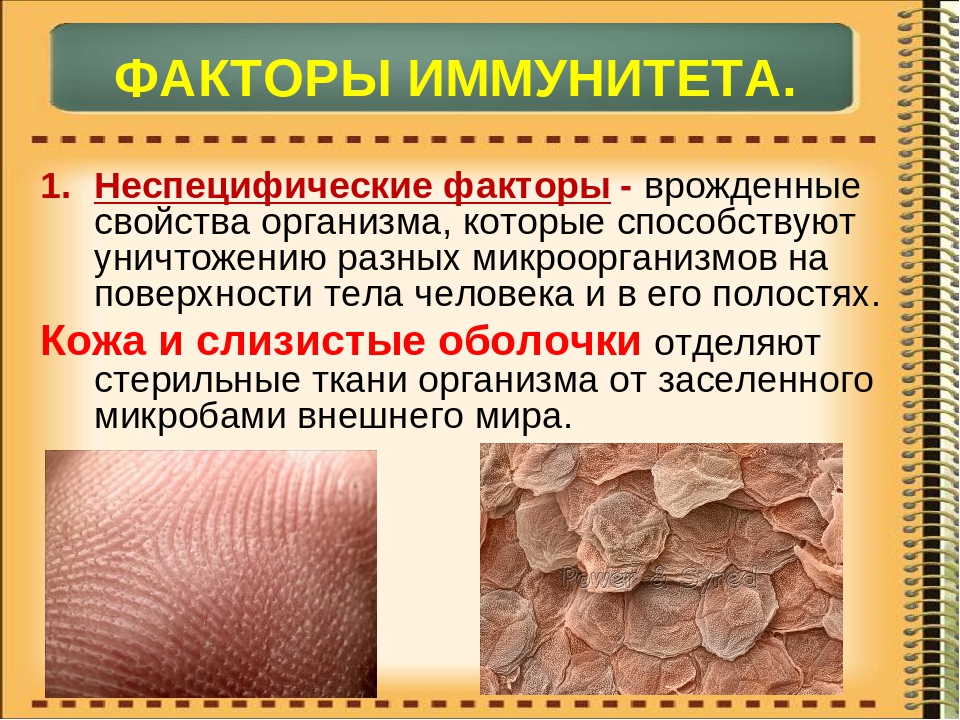
Бабак указал, что Т-иммунитет может быть, в частности, сформирован при вакцинации.
Читайте на РБК Pro
«Я могу привести пример пневмококка (вид бактерии, является возбудителем менингита, синусита, внебольничной пневмонии. — РБК), есть такая вакцина от него — «Превенар», — сказал Бабак. По его словам, эта вакцина активирует Т-иммунитет, который после одной вакцинации может существовать до 20 лет.
Смертность растет третий день. Актуальное о COVID на 17 февраля«Может быть, он (Крючков. — РБК) говорил именно об этом, что те люди, которые имеют внутри себя устойчивый Т-ответ, они менее подвержены заболеваниям коронавируса», — отметил Бабак.
При этом следует разделять общий и специфический иммунитет, указал Бабак.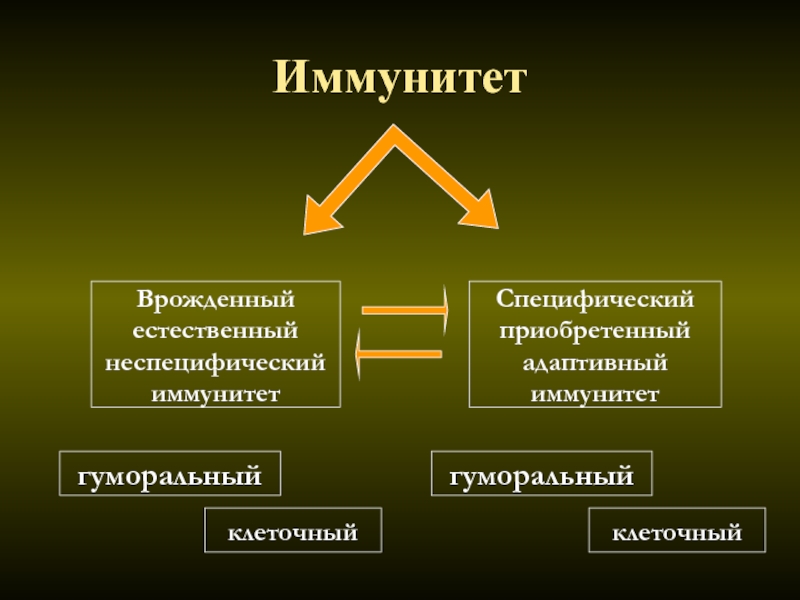 По его словам, общий иммунитет зависит от питания, солнца и движения, однако эти факторы не влияют на специфический ответ против конкретного инфекционного агента. «Вот за конкретный ответ иммунной системы отвечает Т-клеточный иммунитет», — заключил Бабак.
По его словам, общий иммунитет зависит от питания, солнца и движения, однако эти факторы не влияют на специфический ответ против конкретного инфекционного агента. «Вот за конкретный ответ иммунной системы отвечает Т-клеточный иммунитет», — заключил Бабак.
Как пояснял ресурсу «Стопкоронавирус.рф» заместитель директора по научной работе Центрального НИИ эпидемиологии Роспотребнадзора Александр Горелов, у человека есть два вида иммунного ответа на любой вирус: выработка вируснейтрализующих антител и Т-клеточный ответ. Во втором случае у человека вырабатываются Т-лимфоциты, или клетки памяти, которые уничтожают вирусные клетки.
При этом, по его словам, пока точно неизвестно, на какой период сохраняются Т-клеточный ответ и Т-клеточная иммунная память.
Кроме того, в России пока нет тест-систем, позволяющих судить о Т-клеточном ответе против COVID-19, указал он. По его словам, в мире такие тесты единичны и крайне дороги. «Никто с уверенностью не может сказать, что у такого-то количества людей есть Т-клеточный иммунитет», — заключил вирусолог.
Скорость распространения коронавируса в мире Случаев за сутки Источник: JHU Данные по миру i
Конспект учебного занятия по биологии 11 класс Тема. ИММУННАЯ СИСТЕМА. ИММУНИТЕТ. СПЕЦИФИЧЕСКИЙ И НЕСПЕЦИФИЧЕСКИЙ ИММУНИТЕТ.
Конспект учебного занятия по биологии 11 класс
Тема. ИММУННАЯ СИСТЕМА. ИММУНИТЕТ. СПЕЦИФИЧЕСКИЙ И НЕСПЕЦИФИЧЕСКИЙ ИММУНИТЕТ.
создать комфортные условия для обучения, при которых каждый ученик чувствует свою успешность, интеллектуальную состоятельность, самостоятельность.
Цели:
учебная: ознакомить учащихся с понятиями «иммунная система», «иммунитет», «специфический» и «неспецифический», «клеточный» и «гуморальный иммунитет; сформировать представление об иммунную регуляцию функций организма, органы, участвующие в обеспечении иммунитета, иммунные реакции организма;
развивающая: развивать внимание, память, мышление, умение сравнивать, анализировать, систематизировать и обобщать информацию;
воспитательная: воспитывать бережное отношение к собственному здоровью, стремление вести здоровый образ жизни, интерес к предмету, формировать уважение к жизни как высшей ценности.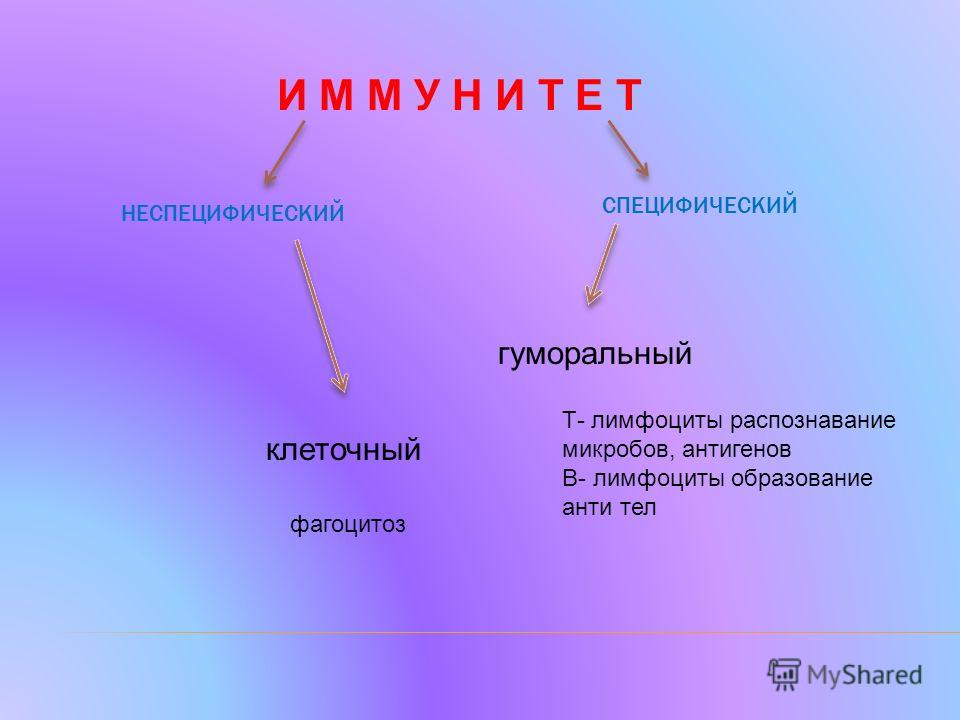
Оборудование: рисунки «Внутренняя среда организма», «Состав крови».
Понятия и термины: иммунитет, иммунная система, специфический, неспецифический, клеточный, гуморальный, иммунный ответ, антиген, антитело, прививки, Т-лимфоциты, В-лимфоциты, лейкоциты, тимус (вилочковая железа), селезенка.
Ожидаемые результаты: учащиеся называют виды иммунитета (клеточный, гуморальный), органы, участвующие в обеспечении иммунитета; учащиеся характеризуют иммунитет, его значение, регуляцию, иммунные реакции организма; учащиеся обосновывают необходимость применения вакцин и лечебных сывороток; ученики объясняют роль иммунной системы в регуляции физиологических функций, развития человека, регенерации тканей.
Ход урока
И. Организационный момент.
Приветствие учеников, проверка их готовности к уроку.
ИИ. Мотивация учебной деятельности.
На протяжении всей истории существования человечества его поражали многочисленные эпидемии, которые опустошали деревни, города. Однако даже в самый разгар эпидемии не все люди болели. Почему?
Однако даже в самый разгар эпидемии не все люди болели. Почему?
III. Сообщение темы, цели и задач урока.
IV. Актуализация опорных знаний.
1. Упражнение «Ассоциативный куст».
Предлагается детям вспомнить то, что им известно об иммунитете.
2. Среди ассоциаций мы с вами выделили такие слова как здоровье, болезни. Давайте обратим внимание на рисунок на стр. 259. Что влияет на здоровье человека.
А иммунитет призван защищать организм от таких воздействий.
Итак, иммунитет-способность организма защищать собственную целостность и биологическую индивидуальность.
Дети
Или (из учебника стр. 263) иммунитет – способность организма распознавать чужеродный материал и мобилизовать клетки и вещества на быстрое его удаление.
3. А теперь помогите мне пожалуйста. У меня есть схема. Какими словами мы ее можем заполнить (стр. 263).
4. Я очень люблю биологию и поэтому стала учителем биологии. Кто эту науку любит так как я? У меня к вам просьба быть моими помощниками. Вы прорабатываете материал вместе со всеми и даете оценку.
Вы прорабатываете материал вместе со всеми и даете оценку.
Последние: одна группа изучает неспецифический иммунитет,а другая специфический( стр. 263-264). Обращаем внимание на определения, проявления и обязательно примеры.
Составляем план рассказа.
— Неспецифический иммунитет — это форма иммунитета, который осуществляется различными веществами, которые выделяют специальные железы кожи, пищеварительной, дыхательной системы; слизистые оболочки;
— барьер, который задерживает инородные тела и не допускает их во внутреннюю среду организма;
— к неспецифическим факторам относятся и клетки-пожиратели — фагоциты, которые содержатся в крови, а также в различных органах. Они действуют на все микроорганизмы, независимо от их природы.
Дополнение учителя
Здоровая и неповрежденная кожа препятствует проникновению внутрь организма большинству микроорганизмов. Особая роль здесь принадлежит поту. Молочная кислота пота и секрет сальных желез обладают бактерицидным действием. Слизистые оболочки активно защищают организм от проникновения внутрь патогенных микроорганизмов. Выделения слизистых оболочек также обладают бактерицидными свойствами. Слезы защищают глаза; слюна (лизоцим) защищает слизистую рта; соляная кислота защищает стенки желудка; кислая среда и особый слизь защищают влагалище. Нормальная микрофлора желудочно-кишечного тракта (особенно толстого кишечника) уничтожает болезнетворные микробы попадающие внутрь организма с пищей. Моча защищает слизистую мочеточника от проникновения через нее бактерий. Она обладает повышенной кислотностью в которой выживают лишь редкие микроорганизмы.
Слизистые оболочки активно защищают организм от проникновения внутрь патогенных микроорганизмов. Выделения слизистых оболочек также обладают бактерицидными свойствами. Слезы защищают глаза; слюна (лизоцим) защищает слизистую рта; соляная кислота защищает стенки желудка; кислая среда и особый слизь защищают влагалище. Нормальная микрофлора желудочно-кишечного тракта (особенно толстого кишечника) уничтожает болезнетворные микробы попадающие внутрь организма с пищей. Моча защищает слизистую мочеточника от проникновения через нее бактерий. Она обладает повышенной кислотностью в которой выживают лишь редкие микроорганизмы.
Специфический иммунитет
— Решающим фактором в борьбе с инфекциями является специфический иммунитет. Это форма иммунитета, когда организм способен распознавать и уничтожать только определенный вид микроорганизмов.
— Эту форму иммунитета обеспечивают антитела и Т-лимфоциты. Т-лимфоциты образуются в вилочковой железе (тимусе). Поэтому их назвали тимус-зависимыми или Т-лимфоцитами.
— Встретившись с микроорганизмом, они «запоминают» его строение и передают информацию об этом типе микроорганизмов следующим поколениям Т-лимфоцитов.
— Итак, Т-лимфоциты защищают организм от тех микроорганизмов, которые они запомнили.
Антигены-вещества, которые воспринимаются организмом как посторонние и вызывают специфический иммунный ответ.
Антитела – особые белки, обладающие способностью специфически связываться с антигенами и нейтрализовать их.
Вывод.
В осуществлении неспецифического и специфического иммунитета участвуют вещества (антитела В-лимфоцитов), обеспечивая гуморальный иммунитет, и клетки, осуществляющие клеточный иммунитет (Т-лимфоциты).
5. Двигаемся дальше.
Когда в организм попадает чужеродный материал, организм что делает……. Отвечает. Стр. 264
Иммунный ответ – совокупность реакций, возникающих в организме в ответ на чужеродный материал.
6. Иммунные ответы свойственны иммунным органам, за счет которых осуществляется иммунная регуляция.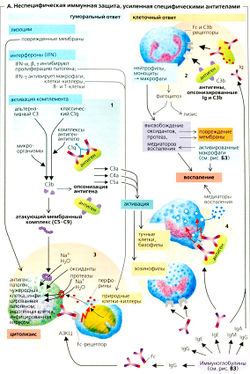
Стр. 260.
Иммунная регуляция-это регуляция с помощью химических соединений и клеток, распространяющихся в организме жидкостями внутренней среды для обеспечения защитного воздействия на клетки, ткани и органы.
Самостоятельная работа.
Название Функции
1 – костный мозг Кроветворный орган, развитие лейкоцитов.
2-миндалины уничтожают микроорганизмы, образуют антитела и в-лимфоциты.
3-тимус дифференциация Т-лимфоцитов.
4, 6, 8-лимфатические узлы обогащают лимфу лимфоцитами и лишают инородных частиц.
5 — селезенка Удаляет устаревшие форменные элементы крови, вырабатывает антитела, захватывает и уничтожает вирусы, бактерии.
7 — аппендикс Защищает кишечник от инфекции и онкологических заболеваний, специализация В-лимфоцитов.
V. Восприятие и первичное осознание нового материала. Стр. 265-266
1.Н.
VI. Осмысление новых знаний, умений. Стр. 266
VII. Закрепление, обобщение и систематизация знаний.
1. Иммунитет – способность организма распознавать чужеродный материал и мобилизовать клетки и вещества на быстрое его удаление. ДА
2. К неспецифическим факторам относятся и клетки-пожиратели — фагоциты. ДА
3. Антигены – это белки. Нет (вещества, которые воспринимаются организмом как посторонние и вызывают специфический иммунный ответ).
4. Пассивный иммунитет длительный. НЕТ
5. Естественный врожденный передается ребенку от матери. ДА
Ответ на проблемный вопрос. «Так почему же некоторые люди во время эпидемий не болели?»
Поисковая работа с учебником
• Почему во время болезни необходимо не спешить снижать температуру, если она составляет до 38 °С?
Ожидаемый ответ учеников
При такой температуре разрушается большинство микроорганизмов.
VIII. Подведение итогов. Домашнее задание.
Вывод
Иммунитет образуется не против всех болезней. Поэтому нужно внимательнее относиться к своему здоровью – бесценному дару человека.
Тема. ИММУННАЯ СИСТЕМА. ИММУНИТЕТ. СПЕЦИФИЧЕСКИЙ И НЕСПЕЦИФИЧЕСКИЙ ИММУНИТЕТ.
(Раздаточный материал для детей)
Цели:
учебная: познакомиться с понятиями «иммунная система», «иммунитет», «специфический» и «неспецифический», «клеточный» и «гуморальный иммунитет; сформировать представление об иммунную регуляцию функций организма, органы, участвующие в обеспечении иммунитета, иммунные реакции организма;
Понятия и термины: иммунитет, иммунная система, специфический, неспецифический, клеточный, гуморальный, иммунный ответ, антиген, антитело, прививки, Т-лимфоциты, В-лимфоциты, лейкоциты, тимус (вилочковая железа), селезенка.
1. Упражнение «Ассоциативный куст».
Предлагается детям вспомнить то, что им известно об иммунитете.
3. Заполнить схему (стр. 263).
Иммунный ответ – совокупность реакций, возникающих в организме в ответ на чужеродный материал.
6. Иммунные ответы свойственны иммунным органам, за счет которых осуществляется иммунная регуляция.
Стр. 260.
Иммунная регуляция-это регуляция с помощью химических соединений и клеток, распространяющихся в организме жидкостями внутренней среды для обеспечения защитного воздействия на клетки, ткани и органы.
Самостоятельная работа. Стр. 260-262.
Название Функции
1 –
2 —
3 —
4, 6, 8 –
5 —
7 —
Соедините части схемы.
V. Стр. 265-266
VI.
VII. Закрепление, обобщение и систематизация знаний.
1. Иммунитет – способность организма распознавать чужеродный материал и мобилизовать клетки и вещества на быстрое его удаление.
2. К неспецифическим факторам относятся и клетки-пожиратели — фагоциты.
3. Антигены – это белки.
4. Пассивный иммунитет длительный.
5. Естественный врожденный передается ребенку от матери.
Неспецифический, специфический иммунитет — презентация онлайн
1. Спецефический и неспецифический иммунитет
Выполнила Звягина А.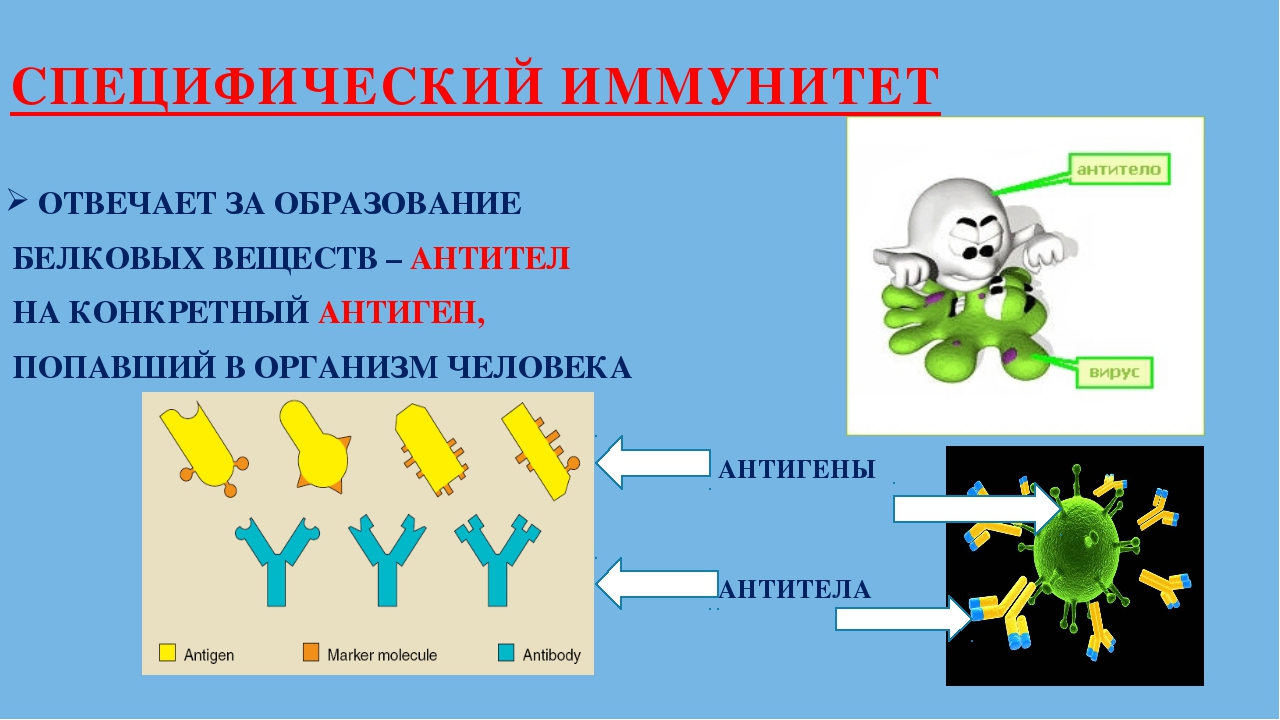 И
И2. План:
1. Виды иммунитета2. Врожденный (неспецифический) иммунитет
— факторы врожденного иммунитета
— воспаление
— система комплемента
— интерфероны
3. Адаптивный (специфический) иммунитет
— Классификации
— Клеточное звено адаптивного иммунитета
— Гуморальное звено адаптивного иммунитета
4. Антитела
3. Иммунитет
• Иммунитет (от лат. «IMMUNITAS» освобождение, избавление от чеголибо) — особое биологическоесвойство организма, направленное
на защиту от генетически
чужеродных факторов:
микроорганизмов (бактерий,
вирусов, простейших, грибов),
инородных молекул и др.
Иммунитет также обеспечивает
невосприимчивость организма к
инфекции при повторной встрече с
патогенном.
• Совокупность органных, тканевых,
клеточных и молекулярных
компонентов, функцией которых
является осуществление иммунной
защиты, называется иммунной
системой.
4.
 Виды иммунитета Защитные механизмы организма условно подразделяются на:
Виды иммунитета Защитные механизмы организма условно подразделяются на:Конститутивные (врожденные) – анатомические, физиологические, клеточные и
молекулярные факторы, которые являются естественными свойствами организма данного
вида.
Индуцибельные (приобретенные) — все формы иммунного ответа, основанные на
специфическом распознавании чужеродных антигенов.
Врожденный иммунитет
6. Врожденный (неспецифический) иммунитет
Неспецифический иммунитет — генетически закрепленная система защитымногоклеточных организмов от любых патогенных и непатогенных
микроорганизмов, а также эндогенных продуктов тканевой деструкции. Главный
клеточный компонент системы неспецифического иммунитета – фагоциты,
основная функция которых — захватывать и переваривать проникающие извне
агенты.
Обусловлен конститутивными факторами
защиты.
Отличительные черты:
Постоянно присутствуют в организме вне
зависимости от действия
дестабилизирующих факторов;
Отсутствие выраженной специфичности;
Способны одновременно защищать
организм от целого ряда факторов
практически сразу после рождения.

7. Факторы неспецефической защиты:
1. Анатомические факторы защиты – внешниепокровы, эпителиальные покровы, безусловные
рефлексы (чихание, кашель, рвота и т.д.).
2. Физиологические факторы защиты – температура
тела, рН и напряженность кислорода, секреты
потовых и сальных желез.
3. Биохимические (гуморальные) факторы защиты –
лизоцим, интерферон, комплемент.
4. Клеточные факторы защиты – способность к
эндоцитозу (пино- и фагоцитозу), цитотоксичность.
8. Анатомические факторы защиты
Многослойный эпителий(эпидермис)
Выполняет
механическую,
барьерную
функцию за счет:
Рогового
вещества,
состоящего
преимущественно из кератина, который
придает механическую устойчивость и
крайне
медленно
разлагается
большинством микроорганизмов.
Слущивания
поверхностного
слоя,
которое
обеспечивает
частичное
механическое удаление микроорганизмов и
продуктов их жизнедеятельности.

Собственно кожа (дерма)
Создает прочный плотный и в то
же время растяжимый
механический барьер на пути
стремящихся проникнуть внутрь
микроорганизмов. Преодолеть
этот барьер способны только
микроорганизмы, продуцирующие
коллагеназы и гиалорунидазы.
Физиологические факторы защиты
Секреты потовых и сальных желез
Потовые железы. Присутствующие в составе потовой жидкости низкомолекулярные
органические соединения (молочная кислота, некоторые аминокислоты, мочевая
кислота и мочевина) и ее кислотность (рН 5,5) являются неблагоприятным для
бактерий и грибов фактором.
В составе секретов сальных желез кожи также присутствуют неблагоприятно
действующие на микроорганизмы вещества – триглицериды, другие многоатомные
спирты, свободные жирные кислоты.
Естественная микрофлора
Естественная микрофлора кишечника, мочеполовых и дыхательных путей
воздействует на чужеродные микроорганизмы специально выделяемыми
антибиотиками и бактериоцинами.

Этот защитный эффект выражен только при нормальном физиологическом
состоянии человека. При каких-либо нарушениях в функционировании
защитных механизмов организма часть представителей нормальной
микрофлоры могут вызывать заболевания – аутоинфекция.
Биохимические факторы защиты
Секреты слизистых оболочек
Полисахаридные активные вещества, присутствующие в слизи носа,
обладают некоторым противовирусным действием.
Выраженным
бактерицидным
действием
также
обладают
пищеварительные ферменты, соляная кислота и некоторые компоненты
желчи.
Лизоцим – ацетилмурамидаза, образуется клетками крови и присутствует
во всех жидкостях организма: в слезах, слюне, сыворотке крови. Это
фермент, субстратом для которого является один из основных компонентов
клеточной стенки бактерий – пептидогликан муреин. При воздействии на
бактерии лизоциму необходима поддержка еще одного фактора
естественного иммунитета – системы комплемента.

Гидролиз (3(1->4) гликозидной
связи в муреине ферментом
лизоцимом
11. Воспаление
Воспаление — выработанная в процессе эволюции защитноприспособительная реакция организма, направленная наустранение воздействия патогенного раздражителя и
восстановление целостности и функции повреждённой ткани
или органа.
Этапы:
1. Фаза воспалительной реакции (альтерация) – стадия
повреждения.
Воздействие патогенных организмов
Повреждение и некроз клеток
Высвобождение из лизосом погибших клеток различных
ферментов, нарушение обмена веществ соединительной
ткани и сосудов
Появление в тканевой жидкости веществ, называемых
медиаторами воспаления.
12. Медиаторы воспаления
ПроисхождениеОсновные
группы
Основные
медиаторы
Основные
источники
Основные эффекты
Гуморальные
Производные
комплемента
C5b-C9
C5a des Arg
C5a
C3a
Плазма
Тканевая
жидкость
•Тканевая деструкция (C5b-C9)
•Активация лейкоцитов
•Повышение проницаемости
сосудов (C5a, C3a)
•Дегрануляция тучных клеток (C5a,
C3a)
•Спазм гладкой мускулатуры (C5a)
Кинины
Брадикинин
Каллидин
Плазма
Тканевая
жидкость
•Вазодилатация
•Повышение проницаемости
сосудов
•Спазм гладкой мускулатуры
•Угнетение гранулоцитов
•Стимуляция лимфоцитов и
фибробластов
•Боль
Факторы
свертывающей
системы крови
Фибринопептиды и
продукты деградации
фибрина
Плазма
Активация лекоцитов
Усиление фагоцитоза
Вазоактивные
амины
Гистомин
Базофилы
Тучные клетки
Тромбоциты
Вазодилатация
Повышение проницаемости
сосудов
Спазм гладкой мускулатуры
Серотонин
Тромбоциты
Зуд
Угнетение гранулоцитов
Стимуляция моноцитов/
макрофагов и фибробластов
Клеточные
Предсуществующие
Происхождение
Основные
группы
Основные
медиаторы
Основные
источники
Основные эффекты
Тромбоксаны
Моноциты
Макрофаги
Гранулоциты
Тромбоциты
Агрегация тромбоцитов
Спазм гладкой мускулатуры
Активация гранулоцитов
Лейкотрисны
Гидроокси- и
гидропероксиэйкозатетрановые
кислоты
Липоксины
Моноциты
Макрофаги
Гранулоциты
Тромбоциты
Активация лейкоцитов
Повышение проницаемости
сосудов
Вазодилатация
Спазм гладкой мускулатуры
Фосфолипиды
Фактор,
активирующий
тромбоциты
Гранулоциты
Тучные клетки
Моноциты
Макрофаги
Спазм гладкой мускулатуры
Вазодилатация
Повышение проницаемости
сосудов
Активация лейкоцитов
Агрегация тромбоцитов
Монокины
Интерлейкин-1
Фактор некроза
опухоли
Моноциты
Макрофаги
Активация лейкоцитов и других
клеток
Пролиферация и активация
лимфоцитов и фибробластов
Стимуляция тканевой деструкции
Лимфокины
Фактор,
активирующий/
угнетающий
макрофаги
Интерлейкин-2
Т-лимфоциты
Активация и угнетение
макрофагов
Стимуляция гранулоцитов и
лимфоцитов
Активация естественных киллеров
Происхождение
Клеточные
Вновь
образующиеся
Основные группы
Основные
медиаторы
Основные
источники
Основные эффекты
Лизосомальные
ферменты
Протеиназы
Гранулоциты
Моноциты
Макрофаги
Тканевая деструкция
Усиление эмиграции и фагоцитоза
Стимуляция моноцитов/
макрофагов и фибробластов
Пролиферация и активация
лимфоцитов
Неферментные
катионные белки
Гранулоциты
Повышение проницаемости
сосудов
Дегрануляция тучных клеток
Адгезия и эмиграция лейкоцитов
Микробицидность
Нейропептиды
Вещество Р
Кальцитонингенродственный
пептид
Нейрокинин А
С-волокна
афферентных
нейронов
Вазодилатация
Повышение проницаемости
сосудов
Дегрануляция тучных клеток
Спазм гладкой мускулатуры
Нейромедиаторы
Ацетилхолин
Холинергичес
кие нейроны
Вазодилатация
Спазм гладкой мускулатуры
Стимуляция лейкоцитов
Производные
арахидоновой
кислоты
(эйкозаноиды)
Простагландины
Моноциты
Макрофаги
Гранулоциты
Тромбоциты
Активация лейкоцитов
Вазодилатация
Боль
Происхождение
Основные группы
Основные
медиаторы
Основные
источники
Основные эффекты
Активные формы
кислорода
Супероксид-анион
Гидроксил-анион
Пергидроксил- анион
Синглетный кислород
Пероксид водорода
Гипохлорид
Гранулоциты
Макрофаги
Моноциты
Тканевая деструкция
Активация гранулоцитов
Стимуляция фагоцитоза
Угнетение моноцитов
Другие малые
молекулы
Оксид азота
Гранулоциты
Моноциты
Макрофаги
Тканевая деструкция
Активация гранулоцитов
В районе формирующегося очага воспаления изменяется
просвет кровеносных сосудов.
Увеличивает количество притекающей к месту воспаления
крови (воспаление и отечность).
Изменяется проницаемость стенок капилляров
Из кровотока в тканевую жидкость проникает гораздо больше,
чем в норме, воды, ионов солей и белков плазмы крови
(экссудат).
Воспаление
2.Фаза воспалительной реакции (экссудация).
Поскольку некоторые из медиаторов воспаления являются хемоаттрактантами для
лейкоцитов, через стенки капилляров в очаг воспаления активно мигрируют
фагоцитирующие клетки, главным образом нейтрофилы и моноциты.
+ Белки острой фазы (продуцируются гепатоцитами):
С-реактивный протеин, сывороточный амилоидный протеин – Обуславливают
взаимодействие C3b системы комплемента с фосфорилхолином в оболочке
грамположительных бактерий. Хемоаттрактанты для нейтрофилов. Активируют
макрофаги и стимулируют их на продукцию цитокинов.
Маннозосвязывающий белок – Связывается с полисахаридами клеточных стенок
бактерий и запускает лектиновый путь активации системы комплемента.

Опсонизация – процесс адсорбции опсонинов (белки системы комплемента и
иммуноглобулины) на поверхности микроорганизмов и других инородных частиц,
который стимулирует фагоцитоз.
Фагоцитоз
Приводит к уменьшению количества кислорода (гипоксии) и сдвигу рН в кислую
сторону (ацидозу) в воспаленной ткани. Такие изменения в тканевой жидкости
совместно с активно осуществляемым фагоцитозом должны приводить к элиминации
вызвавшего воспаление агента.
3. Фаза восстановления (пролифирации).
Исчезновение симптомов воспаления, активная пролиферация и эмиграция
фибробластов, рост сосудов, биосинтез и фибрилогенез коллагена и восстановление
нарушенных воспалением функций.
17. Фагоцитоз
Основные фагоцитирующие клетки организма — макрофагиПроцесс фагоцитоза условно делится на этапы:
Хемотаксическое перемещение
фагоцитирующей клетки к объекту
фагоцитирования.
Связывание фагоцита и чужеродного
объекта (адсорбция/адгезия) за счет
специализированных рецепторов на
поверхности мембраны (CD-рецепторы).

Формирование фагосомы.
Формирование фаголизосомы происходят реакции расщепления
поглощённого материала
гидролитическими ферментами.
Разновидности макрофагов, в
зависимости от локализации:
Альвеолярные
Купферовские клетки
Гистоциты
Селезеночные макрофаги
Дендритные клетки
Перитонеальные макрофаги
Макрофаги лимфатических
узлов
18. Последствия фагоцитоза Кислородный (дыхательный) взрыв
В основе кислородного взрыва лежит ряд последовательно происходящих реакций,начинающийся с накопления значительных количеств восстановленного НАДФ в процессе
гликолиза.
НАДФН-оксидаза содержащаяся в
мембране фагосомы катализирует
превращение
молекулярного
кислорода в супероксид-анион.
Под действием супероксидисмутазы
(СОД), из двух молекул супероксидного
аниона
формируется
перекись
водорода.
Окисление хлоридов перекисью
водорода
в
присутствии
миелопероксидазы (МПО) приводит к
образованию
мощного
цитотоксического агента — гипохлорной
кислоты HOCl.

Ее
дальнейшие
окисление
различными агентами приводит к
образованию бактерицидных веществ.
19. Система комплемента
Комплемент – группа сывороточных специфических белков, циркулирующих внеактивной проэнзимной форме (фактора D,В). Эти белки могут быть активированы
различными специфическими и неспецифическими иммунологическими
механизмами. Активированные компоненты комплемента принимают участие в
контролируемом энзиматическом каскаде, результатом действия которого является
повреждение мембраны бактерий или их опсонизация.
Опсонизация — процесс адсорбции опсонинов на поверхности микроорганизмов и
других инородных частиц, который стимулирует и облегчает фагоцитоз данных
частиц.
В систему комплемента включают 19 белков, условно разделенных на группы:
Белки классического пути активации (С1q, C1r, C1s, C2, C4, C3)
Белки альтернативного пути активации (фактор В, фактор D и фактор Р)
Белки атакующего мембрану комплекса (С5, С6, С7, С8 и С9).

Регуляторные белки – обладают выраженной ферментативной активностью по
отношению к образующимся комплексам (С4-связывающий белок, витронектин, фактор
Н, мембранный кофакторный белок) .
Сутью каскадной активации системы комплемента является то, что каждый из первых
пяти компонентов в результате активации превращается в фермент, который
расщепляет следующий компонент и предоставляет ему свойства фермента.
Различные пути активации системы комплемента:
Классический путь запускается
активацией комплекса С1, за счет
связывания с комплексом антигенантитело. Действует более точно,
поскольку так уничтожается любая
чужеродная клетка.
Альтернативный путь запускается
гидролизом C3 прямо на поверхности
патогена. Не требует образования
комплекса антиген-антитело,
происходит без участия первых
компонентов комплемента (С1, С2, С4),
срабатывает сразу же после появления
антигенов — его активаторами могут
быть бактериальные полисахариды и
липополисахариды, вирусные
частицы, опухолевые клетки.
Лектиновый путь использует лектин,
связывающий маннозу (MBL-белок)
который связывается с маннозными
остатками и другими сахарами на
мембране и активирует каскад
комплемента.
21. Интерфероны
Интерфероны – группа белков, которые обладают противовирусной активностью.Синтезируются в инфицированных вирусом клетках. Индуктором синтеза
интерферонов служат молекулы двуспиральной РНК вирусов.
Выделяют 3 типа интерферонов:
К I типу относят ИФНα, ИФНβ, ИФНκ, ИФНω, ИФНε
II тип – ИФНγ
III тип – интерфероноподобные цитокины ИФН-λ1 (ИЛ-29), ИФН-λ2 (ИЛ-28A) и ИФНλ3 (ИЛ-28B)
Интерфероны типа I связываются со специфическими рецепторами на поверхности
многих типов клеток иммунной системы и стимулируют противовирусный и в
некоторых случаях противоопухолевый иммунный ответ.
NK-клетки (натуральные киллеры) – особая
субпопуляция лимфоцитов. Они способны
спонтанно
(без
предворительной
иммунизации) оказывать цитотоксическое
действие на некоторые опухолевые, а также
инфицированные вирусами клетки.

Содержат в цитоплазме азурофильные
гранулы,
где
депонированы
цитотоксические белки перфорин, гранзимы
и гранулизин.
22. Адаптивный иммунитет
23. Адаптивный (специфический) иммунитет
Адаптивный иммунный ответ развивается только в ответ на контакт с конкретнымантигеном.
Иммунный ответ – многоэтапный процесс с обязательным участием лимфоцитов и
других клеток иммунной системы.
Обусловлен индуцибельными
факторами защиты
Отличительные черты:
Для их реализации требуется гораздо
больше времени, чем для проявления
конститутивных факторов защиты;
Обязательным является участие
иммунокомпетентных клеток;
Отсутствуют в организме изначально,
возникают в течение жизни в результате
контакта с конкретным
дестабилизирующим фактором;
Обладают ярко выраженной
специфичностью, т. е. защищают только
от того фактора, который и вызвал
проявление этого механизма.
24.
 Классификации адаптивного иммунитета: По области действия:
Классификации адаптивного иммунитета: По области действия:Местный —комплекс факторов, которые обеспечивают защиту кожи и слизистых
оболочек. Обеспечивается за счёт скопления лимфоидной ткани в органах, отвечающей за
местный гуморальный иммунитет (IgA, IgG) и клеточной иммунной защиты.
Общий —комплекс факторов, которые обеспечивают защиту внутренней среды
организма от чужеродных антигенов. Чаще формируется при проникновении возбудителя
в кровь. Характеризуется образованием антител — IgM и IgG, активизацией специфичных
против данного возбудителя лимфоцитов, выполняющих клеточную защиту.
Естественный (постинфекционный) иммунитет формируется после контакта с
антигеном в естественных условиях (перенесённые инфекционные болезни,
паразитарные инвазии и др.).
Активный обусловлен развитием иммунного ответа, приводящего к формированию и
длительному сохранению в организме соответствующих клеток иммунной памяти.
Пассивный формируется при передаче готовых антител новорожденному
внутриутробно или с молозивом матери.

Искусственный иммунитет формируется после вмешательства со стороны человека.
Активный развивается после иммунизации ослабленными или убитыми
микроорганизмами либо их антигенами. Организм активно участвует в создании
невосприимчивости. Такая невосприимчивость по наследству не передается. Создается
с помощью вакцин.
Пассивный достигается введением готовых антител. Иммунная система не участвует в
развитии соответствующих иммунных реакций. Такая невосприимчивость исчезает по
мере удаления донорских антител из кровотока. Создается с помощью сывороток.
Активный адаптивный иммунитет
Пассивный адаптивный иммунитет
Предусматривает введение
специфической вакцины с
ослабленными или убитыми
микроорганизмами или их антигены
Предусматривает введение
специфических готовых
иммуноглобулинов (антител). Также
может быть передан в виде готовых
иммунных факторов от матери к
ребёнку внутриутробно или с молоком
В организме активно реализуются все
этапы иммунных реакций:
формируются специфические антитела
и антиген-специфические Т-лимфоциты
Не может быть реализован в условиях
иммунодефицита.
 Требует здоровья
Требует здоровьясобственной иммунной системы
человека
Развивается минимум через 5 дней
после вакцинации
Реализации полноценные реакции
активного иммунитета не реализуются,
т.к. в организм попадают уже готовые
специфические антитела
Эффективен в условиях иммунодефицита
Развивается мгновенно
Формируется длительный или
пожизненный иммунитет
Формируется кратковременный
иммунитет
Высокая эффективность
Эффективность более низкая
Формируется иммунная память
Иммунная память отсутствует
26. Классификации адаптивного иммунитета:
По направленности действия:Противоинфекционный – иммунный ответ на антигены микроорганизмов
и их токсины (антибактериальный, противовирусный, противогрибковый,
антигельминтный, антипротозойный).
Неинфекционный иммунитет— направлен на неинфекционные
биологические антигены.
– Аутоиммунитет — реакции иммунной системы на собственные
антигены (белки, липопротеиды, гликопротеиды).
 В его основе лежит
В его основе лежитнарушение распознавания «своих» тканей, они воспринимаются как
«чужие» и разрушаются.
– Противоопухолевый иммунитет —реакции иммунной системы на
антигены опухолевых клеток.
– Трансплантационный иммунитет — возникает при переливании крови
и пересадке донорских органов и тканей.
– Репродуктивный иммунитет «мать-плод». Выражается в реакции
иммунной системы матери на антигены плода.
По механизму действия:
Клеточный– реализуется при участии иммунокомпетентных клеток,
обеспечивающих иммунный ответ (Т- и В-лимфоциты, естественные киллеры,
фагоцитирующие клетки – нейтрофилы, эозинофилы, базофилы, моноциты,
макрофаги, дендритные клетки).
Гуморальный– реализуется циркулирующими в организме антителами.
27. Клеточное звено спецефического иммунтитета
Формирование иммуноцитов происходит в красном костном мозге итимусе (вилочковой желизе).
Выделяют 5 типов иммуноцитов:
1. А-клетки (вспомогательные) – перерабатывают
чужеродные антигены, представляют их для
распознования другими клетками иммуной
системы, секретируют ИНТЕРЛЕЙКИН1 для
активации Т- и В- лимфоцитов (макрофаги).

2. NK-клетки (естественные киллеры)
3. Т-лимфоциты
4. В-лимфоциты
Медиаторы взаимного влияния
иммуноцитов:
Гликопротеиды (интерлейкины)
Простогландины
Кинины
Гистамин
ИМУННЫЙ ОТВЕТ
28. Клеточное звено специфического иммунитета
Т-лимфоциты –Большая субпопуляция
лимфоцитов, как по количеству,
так и по составу.
способны распознавать
антиген в комплексе с
собственными белками-MHC –
главного комплекса
гистосовместимости.
Функции Т-лимфоцитов:
1.Узнают чужеродный антиген и дают сигнал к началу иммунного ответа.
2.Функция иммунологической памяти.
3.Обеспечивают иммунологическую толерантность собственных тканей.
4.Участвуют в запуске иммунного ответа.
5.Обеспечивают клеточный механизм иммунного ответа.
29. Субпопуляции Т-лимфоцитов:
Т-киллеры (маркер – CD8) – вид лимфоцитов, которыеосуществляют лизис повреждённых клеток собственного
организма.

Т-хелперы (маркер — СD4) – распознают антигены при
взаимодействии их Т-клеточного рецептора (TCR) с антигеном,
связанным с молекулами главного комплекса гистосовместимости
2 класса (MHC-II).
Т-супрессоры – контролируют силу и продолжительность
иммунного ответа через регуляцию функции Т-эффекторных
клеток (Т-хелперов и Т-цитотоксических клеток).
Клетки памяти – участвуют в иммунном ответе при вторичном
попадании антигена.
30. Гуморальное звено специфического иммунитета
В-лимфоциты –После взаимодействия рецептора с
антигеном
В-клетки превращаются в
плазмоциты,
способные синтезировать
иммуноглобулин определенного
класса и клетки памяти.
Воздействие антигенного раздражителя
пролиферация и дифференцировка В-клеток
плазмобласты (незрелые плазматические
клетки)
5 дней Активное деление
Активный синтез антител
Колония зрелых плазматических клеток
(хорошо выражена гранулярная ЭПС)
31.
 Антигены и их характеристика Антиген – это биополимер органической природы, генетически чужеродный для макроорганизма,
Антигены и их характеристика Антиген – это биополимер органической природы, генетически чужеродный для макроорганизма,который при попадании в последний распознаётся его иммунной системой и вызывает иммунные
реакции, направленные на его устранение.
Свойства антигенов:
Антигенность – потенциальная способность молекулы антигена активировать компоненты
иммунной системы и специфически взаимодействовать с факторми иммунитета.
Иммуногенность — потенциальная способность антигена вызывать по отношению к себе в
макроорганизме специфическую защитную реакцию.
Специфичность – способность
антигена индуцировать
иммунный ответ к строго
определенному эпитопу.
ГАПТЕНЫ – низкомолекулярные
антигенные вещества
Организм вырабатывает антитела на
данный тип вируса или раковой
клетки не потому, что узнал в них
возбудителя болезни, а потому, что
это чужеродные объекты,
подлежащие удалению из организма.
32.
 Антитела (иммуноглобулины) Антитела (иммуноглобулины/Ig) — это белки плазмы крови, вырабатываемые в
Антитела (иммуноглобулины) Антитела (иммуноглобулины/Ig) — это белки плазмы крови, вырабатываемые вответ на введение антигена и способные специфически взаимодействовать с этим
же антигеном.
типы иммуноглобулинов:
Иммуноглобулины типа А (IgA) синтезируются клетками иммунной системы и выводятся
на поверхность кожи и слизистых оболочек. В больших количествах IgA содержатся во всех
физиологических жидкостях (слюна, молоко, моча). Иммуноглобулины типа А
обеспечивают местный иммунитет, препятствуя проникновению микробов через покровы
тела и слизистые оболочки.
Иммуноглобулины типа M (IgM) выделяются в первое время после контакта с
инфекцией. Эти антитела представляют собой большие комплексы способные связывать
сразу несколько микробов одновременно. Определение IgM в крови является признаком
развития в организме острого инфекционного процесса.
Антитела типа G (IgG) появляются вслед за IgM и представляют собой основной фактор
гуморального иммунитета.
 Этот тип антител защищает организм на протяжении
Этот тип антител защищает организм на протяжениидлительного времени от различных микроорганизмов.
Иммуноглобулины типа Е (IgE) участвуют в развитии аллергических реакций
немедленного типа, тем самым защищая организм от проникновения микробов и ядов
через кожу.
Иммуноглобулины класса В (IgD) – мембранный рецептор зрелых лимфоцитов.
Спецефическая функция пока не обнаружена.
33. Суперсемейство иммуноглобулинов
Структура белков суперсемействаиммуноглобулинов
В структуре всех этих молекул есть по меньшей мере один консервативный
иммуноглобулиновый домен. Молекулы экспрессируются на поверхности
эндотелиоцитов, лейкоцитов и лимфоцитов,
и являются рецепторами
иммунокомпетентных клеток.
Функции:
распознавания и презентации антигенов
рецепции цитокинов, факторов роста, молекул сывороточных иммуноглобулинов
участвуют в процессах миграции и межклеточных взаимодействиях лейкоцитов
34. Структура и функции молекулы IgG
Молекулярный вес около150000 кДа
1 молекула АГ способна
связывать 2 сходных АТ
Комплекс антиген/антитело
маркировка
Специфичность антител определяется
строением тяжелой цепи!
Фагоцитоз
Ферментативное
разрушение
Антитела обладают двумя свойствами:
специфичность, т.
 е. способность вступать во взаимодействие с антигеном,
е. способность вступать во взаимодействие с антигеном,аналогичным тому, который индуцировал (вызвал) их образование;
гетерогенность по физико-химическому строению, по специфичности, по
генетической детерминированности образования (по происхождению).
35. Спасибо за внимание!
Врожденный и адаптивный иммунный ответ
Первой линией защиты от чужеродных патогенов является врожденный или неспецифический иммунный ответ. Врожденный иммунный ответ состоит из физической, химической и клеточной защиты от патогенов. Основной целью врожденного иммунного ответа является немедленное предотвращение распространения и перемещения чужеродных патогенов по всему организму.
Вторая линия защиты от чужеродных патогенов называется адаптивным иммунным ответом.Адаптивный иммунитет также называется приобретенным иммунитетом или специфическим иммунитетом и встречается только у позвоночных. Адаптивный иммунный ответ специфичен для представленного возбудителя. Адаптивный иммунный ответ предназначен для атаки на чужеродные патогены, но иногда он может совершать ошибки и атаковать сам себя. В этом случае могут развиться аутоиммунные заболевания (например, волчанка, ревматоидный артрит).
Адаптивный иммунный ответ предназначен для атаки на чужеродные патогены, но иногда он может совершать ошибки и атаковать сам себя. В этом случае могут развиться аутоиммунные заболевания (например, волчанка, ревматоидный артрит).
Отличительной чертой адаптивной иммунной системы является клональная экспансия лимфоцитов. Клональная экспансия — это быстрое увеличение количества Т- и В-лимфоцитов от одной или нескольких клеток до миллионов.Каждый клон, происходящий из исходного Т- или В-лимфоцита, имеет тот же антигенный рецептор, что и исходный, и борется с тем же патогеном.
Хотя врожденный иммунный ответ является немедленным, адаптивный иммунный ответ — нет. Однако эффект адаптивного иммунного ответа является длительным, высокоспецифичным и долговременно поддерживается Т-клетками памяти.
| Линия обороны | Хронология | Ячейки | Зависимость от антигена | Примеры |
Врожденный | Первый | Немедленный ответ (0–96 часов) | Натуральные киллеры, макрофаги, нейтрофилы, дендритные клетки, тучные клетки, базофилы, эозинофилы | Независимый | Кожа, волосы, кашель, слизистые оболочки, фагоциты, гранулоциты |
Адаптивный | Второй | Долгосрочные (>96 часов) | Т- и В-лимфоциты | Зависимый | Гной, отек, покраснение, боль, реакция Т- и В-лимфоцитов |
Спасибо за участие в этом модуле. Нажмите ниже, чтобы загрузить сертификат.
Нажмите ниже, чтобы загрузить сертификат.
Кожа и слизистые оболочки, противомикробные химические вещества, естественные клетки-киллеры, фагоцитоз, воспаление и лихорадка
НЕСПЕЦИФИЧЕСКИЕ ЗАЩИТЫ: Кожа и слизистые оболочки, противомикробные химические вещества, естественные клетки-киллеры, фагоцитоз, воспаление и лихорадка НЕТ СПЕЦИАЛЬНАЯ ЗАЩИТА : Кожа и слизистые оболочки, противомикробные химические вещества, естественные клетки-киллеры, фагоцитоз, воспаление и лихорадкаI Поверхностные мембранные барьеры – кожа и слизистые оболочки
А.Кожа (эпидермис)B. Мембраны выделяют защитные химические вещества 1. Вагинальные выделения1. Кератин устойчив к физическим нагрузкам, стойкий к слабым кислотам и основаниям
2. «Кислотная мантия» pH 3-5
2. Соляная кислота в желудке
3. В слюне и слезной жидкости лизоцим, бактерии разрушающий фермент
4.
 Слизистая – липкая ловушка для микроорганизмовII. Сотовый и химический
А. Фагоциты – поглощают частицы, но иногда
этого не достаточно. Иногда они также выделяют химические вещества, разрушающие
клетки, которые они собираются фагоцитировать.2 основных типа
1. Макрофаги
Слизистая – липкая ловушка для микроорганизмовII. Сотовый и химический
А. Фагоциты – поглощают частицы, но иногда
этого не достаточно. Иногда они также выделяют химические вещества, разрушающие
клетки, которые они собираются фагоцитировать.2 основных типа
1. Макрофаги 2. НейтрофилыB. Естественные клетки-киллеры — тип лимфоцитов (WBC) 1. обнаружены в крови и лимфе
2. убить раковые клетки и инфицированные вирусом клетки
3. неспецифический
4. нефагоцитарныйC. Воспаление – препятствует распространению повреждающих агентов. Удаляет клеточный мусор и болезнетворные микроорганизмы. Готовится к ремонту. Четыре кардинала признаки: покраснение, жар, отек, боль 1. Расширение сосудов и повышение проницаемости сосудов а. Воспалительные химические вещества из поврежденных клеток способствовать расширению сосудов.это приводит к покраснению и жару
б. Эти химические вещества также вызывают местные капилляры. к утечке жидкости (в т.ч. vasc. perm) 1.) Жидкости содержат факторы свертывания крови и антитела
2.
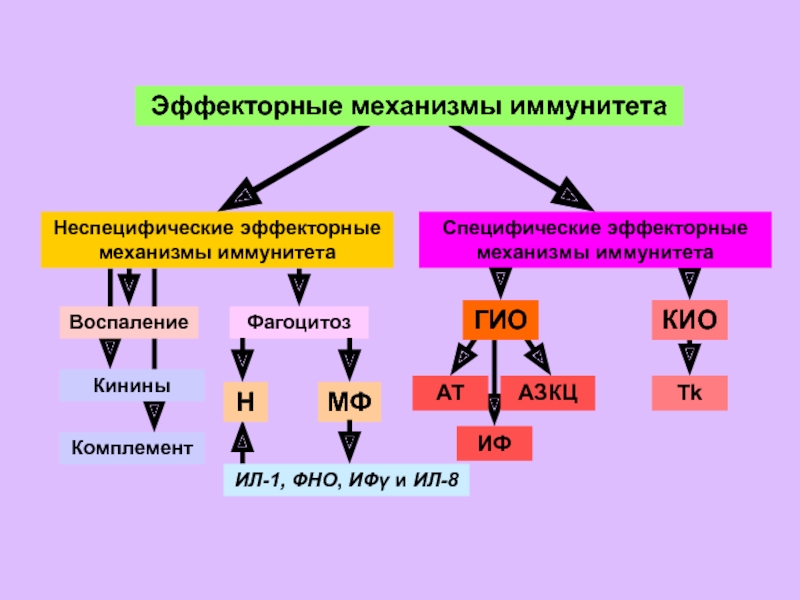 ) Этот «экссудат» вызывает отек (припухлость)
а) Разбавляет вредные вещества
) Этот «экссудат» вызывает отек (припухлость)
а) Разбавляет вредные вещества b.) Приносит O2 и питательные вещества
c.) Белки свертывания окружают сайт 2. Мобилизация фагоцитов – вскоре после воспаления начинается. Воспалительные химические вещества привлекают различные фогцитарные клетки к площадь.Д. Антимикробные белки – комплемент и интерферон. 1.Система комплемента. 20 белков плазмы. Его Основной механизм уничтожения чужеродных клеток
2. Интерферон. куча неспецифических антивирусных белки.Е. Лихорадка – системная реакция (т. е. бывает по всему вашему телу) 1. Преимущества: а. увеличить скорость метаболизма клеток, ускоряя ремонт
б. печень и селезенка секвестрируют железо и необходимый цинк бактериями 2. Недостаток: денатурация белков (ферментов) при высоких температурах. ИММУНИТЕТ — два типа: гуморальный иммунитет, или иммунитет, опосредованный антителами, и клеточный иммунитет
И.Антигены – вещества, вызывающие иммунную отклик
II. Гуморальный иммунный ответ
А. Клональная селекция и дифференцировка В-клеток
1. В-клетка активируется, когда антиген связывается с
его поверхность
Клональная селекция и дифференцировка В-клеток
1. В-клетка активируется, когда антиген связывается с
его поверхность 2. В-клетка быстро растет и размножается (все идентичные = клон) а.) Большинство клеток превращаются в плазматические клетки антитела, которые связываются с этим антигеном, помечая его для уничтожения
б.) некоторые клетки клона становятся готовыми ячейками памяти действовать быстро при повторном воздействии. B. Иммунологическая память 1.»Первичный ответ» — имеет лаг 3-6 дней, уровни антител в плазме достигают пика примерно через 10 дней
2. Повторное воздействие приводит к «вторичной реакции». Через 2-3 дня уровень антител в крови даже выше, чем при первичном. Оставайтесь на высоте для недели в месяцы
3. Это похоже на то, что происходит с Т-клетками. тоже.С. Активный и пассивный гуморальный иммунитет 1. Активные антитела, вырабатываемые после воздействия к антигену а. естественно
б. искусственно 2. Пассивные – антитела образуются из сыворотки иммунного индивидуальный (не всегда человек) а.
 немедленная защита
немедленная защита б. кратковременная защита
с. мать/плод D. Антитела, также известные как «Ig» (для иммуноглобулинов). Секретируется плазматическими клетками или активированными В-клетками. 1. Базовая структура — а. «вариабельная» область — сайт связывания антигена
б. «постоянная» область (стебель) — определяет клетки и химические вещества, с которыми может связываться антитело, и как этот класс антител будет функционировать.2. Цели и функции антител. Антиген-антитело комплекс является первой частью 4 различных защитных механизмов.а. нейтрализация — блокировка антител сайты на вирусах или экзотоксинах (бактериальных токсинах), то они не могут связываться к клеткам тканей и наносят им вред.
б. фиксация и активация комплемента — основная защита от клеточных антигенов. После связывания антител к антигену область С изменяется, обнажая сайты связывания комплемента. Это способствует фиксации комплемента и последующему лизису клетки.
с. антитела могут связываться более чем с одним антигеном определитель.
 Это может привести к тому, что многие иностранные
клетки.Эта агглютинация похожа на
Это может привести к тому, что многие иностранные
клетки.Эта агглютинация похожа на д. осадки , только осадки когда молекулы (в отличие от клеток) слипаются вместе. В обеих агглютинациях и преципитация, скопления легче фагоцитируются. IV Иммунная система, опосредованная клетками Ответ.
Некоторые патогены размножаются внутри ваших клеток, в В этом случае антитела не эффективны (в отличие от четырех шагов, описанных выше). Клеточный иммунный ответ начинается с активации небольшого числа Т-клеток определенным антигеном.После активации Т-клетки могут подвергаться пролиферация и дифференцировка в клон эффекторных клеток, распознающих один и тот же антиген и осуществляют некоторый аспект иммунной атаки.
3 основные популяции Т-клеток
цитотоксических Т-клеток (эффекторные клетки для уничтожения)Т-хелперы (регуляторные клетки)
Супрессорные Т-клетки (регуляторные клетки)
Т-клетки не распознают свободные антигены. Они только распознавать обработанные белковые фрагменты и реагировать на них самостоятельно клетки. Таким образом они атакуют поврежденные клетки. Следовательно, одним из первых
что мы рассмотрим, так это распознавание антигена.
А. Клональная селекция и дифференцировка Т-клеток
1. Распознавание антигена. Т-клетки ищут двоих
вещи снаружи клетки: «я» и «не-я» до того, как они подействуют.
Они обнаружены в «MHC», что белки сигнализируют клеткам иммунной системы, что
инфекционные организмы прячутся внутри клеток.
а) Белки MHC содержат фрагменты антигена
Таким образом они атакуют поврежденные клетки. Следовательно, одним из первых
что мы рассмотрим, так это распознавание антигена.
А. Клональная селекция и дифференцировка Т-клеток
1. Распознавание антигена. Т-клетки ищут двоих
вещи снаружи клетки: «я» и «не-я» до того, как они подействуют.
Они обнаружены в «MHC», что белки сигнализируют клеткам иммунной системы, что
инфекционные организмы прячутся внутри клеток.
а) Белки MHC содержат фрагменты антигена б) у них тоже есть какое-то «я», что необходимо активировать Т-клетки2.Активация Т-клеток. Т-клеточные антигенные рецепторы (подобно рецепторам В-клеток) связываются с комплексом антиген-белок MHC. В большинстве случаев требуется «костимулятор», прежде чем Т-клетки смогут сформировать клоны. Т-клетки увеличиваются и пролиферируют. Многие из клонов становятся клетками памяти. Конкретные роли Т-клеток 1. Хелперные Т-клетки: стимулируют пролиферацию другие Т-клетки а. без них нет иммунитета
б. большинство антигенов не могут запускать В-клетки без вспомогательные Т-клетки
с.
 они выделяют химические вещества, которые усиливают неспецифический
защита2.Цитотоксические Т-клетки: непосредственно атакуют и убивают другие
клетки
а. связывается с клеткой-мишенью, вводит цитотоксические химические вещества
они выделяют химические вещества, которые усиливают неспецифический
защита2.Цитотоксические Т-клетки: непосредственно атакуют и убивают другие
клетки
а. связывается с клеткой-мишенью, вводит цитотоксические химические вещества б. высвобождает и движется дальше в поисках большего количества антигена-MHC комплексы3. Супрессоры Т-клеток: подавляют активность Т-клеток и В-клетки. Полезно, когда антиген уничтожен.
| х | х | ||||||||||||||||||||||||||||||||||||||
ИНФЕКЦИОННЫЙ БОЛЕЗНЬ | БАКТЕРИОЛОГИЯ | ИММУНОЛОГИЯ | МИКОЛОГИЯ | ПАРАЗИТОЛОГИЯ | ВИРУСОЛОГИЯ | ||||||||||||||||||||||||||||||||||
СЛОВАЦКИЙ |
Джин Майер, доктор философии. | ||||||||||||||||||||||||||||||||||||||
ВЬЕТНАМСКАЯ | |||||||||||||||||||||||||||||||||||||||
ФРАНЦУЗСКИЙ | |||||||||||||||||||||||||||||||||||||||
ИСПАНСКИЙ | |||||||||||||||||||||||||||||||||||||||
ПОРТУГАЛЬСКИЙ | |||||||||||||||||||||||||||||||||||||||
АЛБАНСКИЙ | |||||||||||||||||||||||||||||||||||||||
ТУРЕЦКИЙ | |||||||||||||||||||||||||||||||||||||||
Дайте нам знать, что вы думаете | |||||||||||||||||||||||||||||||||||||||
ПОИСК | |||||||||||||||||||||||||||||||||||||||
Изображение логотипа Джеффри Нельсон, Университет Раша, Чикаго, Иллинойс и Микробиблиотека | |||||||||||||||||||||||||||||||||||||||
Знать значение иммунной системы в борьба с инфекциями и болезнями Различают неспецифические (врожденные) и специфические (адаптивные) иммунные системы Понимать механизмы борьбы с инфекцией/болезнью (убийство возбудителей) Знать гуморальный и клеточный компоненты неспецифический иммунитет Понимать механизм действия гуморальный и клеточные компоненты неспецифического иммунитета
Рисунок 1 Рисунок 2 Рисунок 3 | Мы постоянно подвергаемся воздействию инфекционных
случаев, мы в состоянии сопротивляться этим инфекциям. Хотя и врожденная, и адаптивная иммунная система защищают
против вторгшихся организмов они различаются по ряду признаков. Все клетки иммунной системы происходят из костного мозга и
они включают
миелоидные (нейтрофилы, базофилы, эозинофилы, макрофаги)
и дендритные клетки) и лимфоидные (В-лимфоциты, Т-лимфоциты и
Естественные киллеры) (рис. 2), которые дифференцируются по различным
путей (рис. Основной функцией иммунной системы является различение себя/чужого.Эта способность различать «я» и «не-я» необходима для того, чтобы
защитить организм от вторжения патогенов и устранить модифицированные
или измененные клетки (например, злокачественные клетки). Поскольку возбудители могут размножаться
внутриклеточно (вирусы и некоторые бактерии и паразиты) или
внеклеточно (большинство бактерий, грибов и паразитов), различные
компоненты иммунной системы эволюционировали для защиты от этих
различные виды возбудителей.
| ||||||||||||||||||||||||||||||||||||||
Элементы врожденной (неспецифической) иммунной системы (таблица 2) включают
анатомические барьеры, секреторные молекулы и клеточные компоненты.
| |||||||||||||||||||||||||||||||||||||||
| Рисунок 4А
Два нейтрофила в мазке крови Bristol Biomedical Image Archive
Используется с разрешения Фигура 4В. Гистопатология лимфаденопатии вследствие инфицирования ВИЧ-1.Подкапсульный синус. То sinus содержит повышенное количество нейтрофилов. CDC/д-р. Эдвин П. Юинг-младший [email protected] Фигура 4C Рисунок 4D Мазок крови, показывающий моноцит (слева) и два нейтрофила Архив биомедицинских изображений Bristol Используется с разрешения |
| ||||||||||||||||||||||||||||||||||||||
| Рисунок 5 Макрофаг атакует E.  coli (SEM x8800) Др.
Деннис Кункель (используется с разрешения) coli (SEM x8800) Др.
Деннис Кункель (используется с разрешения) Рисунок 6. Рисунок 6A Эозинофилы в мазке крови Архив биомедицинских изображений Бристоля Используется с разрешения Рисунок 6B. Рисунок 7. Рисунок 8. Моноцит с проглоченным малярийным паразитом. CDC/д-р. Мелвин Фигура 9 Хемотаксический ответ на воспалительный стимул | Клеточные барьеры для инфекции ФАГОЦИТОЗ И ВНУТРИКЛЕТОЧНОЕ КИЛЛИНГ
| ||||||||||||||||||||||||||||||||||||||
| Рисунок 10 Адгезия бактерий через рецепторы |
| ||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||
| Рисунок 11
B. Дыхательный взрыв: кислородозависимый, миелопероксидазозависимые реакции |
| ||||||||||||||||||||||||||||||||||||||
| Фигура 12 Уничтожение, зависимое от оксида азота | АЗОТОЗАВИСИМОЕ УНИЧТОЖЕНИЕ
| ||||||||||||||||||||||||||||||||||||||
| Рисунок 13 NK-клетки и их активация
Рисунок 14 | НЕСПЕЦИФИЧЕСКИЕ КЛЕТКИ-КИЛЛЕРЫ Несколько различных клеток, включая NK- и LAK-клетки, K-клетки, активированные макрофаги и эозинофилы способны убивать чужеродные и измененные клетки-мишени неспецифическим образом.Эти клетки играют важную роль в врожденная иммунная система.
| ||||||||||||||||||||||||||||||||||||||
| Модулируются все компоненты неспецифической иммунной системы побочные продукты специфической иммунной системы, такие как интерлейкины, интерферон- гамма , антитело и др. | |||||||||||||||||||||||||||||||||||||||
В настоящее время вы должны знать следующее: 1.Различия между неспецифическим и специфическим иммунные функции 2. Гуморальные компоненты системы неспецифического иммунитета и их действие 3. Клеточные компоненты неспецифического иммунитета и их действие 4. Пути внутриклеточного киллинга бактерий фагоциты и их характерные признаки 5. |
| ||||||||||||||||||||||||||||||||||||||
Вернуться в раздел иммунологии микробиологии и иммунологии онлайн Пожалуйста, сообщайте обо всех проблемах Ричарду[email protected]
| |||||||||||||||||||||||||||||||||||||||
Введение в иммунологию и иммунопатологию | Аллергия, астма и клиническая иммунология
Иммунная система представляет собой совокупность клеток, химических веществ и процессов, которые защищают кожу, дыхательные пути, кишечный тракт и другие области от чужеродных антигенов, таких как микробы (организмы, такие как бактерии, грибки). и паразиты), вирусы, раковые клетки и токсины.Помимо структурных и химических барьеров, которые защищают нас от инфекции, иммунную систему можно упрощенно рассматривать как имеющую две «линии защиты»: врожденный иммунитет и адаптивный иммунитет. Врожденный иммунитет представляет собой первую линию защиты от вторжения патогена. Это антиген-независимый (неспецифический) защитный механизм, который используется хозяином сразу или в течение нескольких часов после встречи с антигеном. Врожденный иммунный ответ не имеет иммунологической памяти и, следовательно, не способен распознавать или «запоминать» тот же патоген, если организм подвергнется его воздействию в будущем.Адаптивный иммунитет, с другой стороны, является антиген-зависимым и антиген-специфическим и, следовательно, включает время задержки между воздействием антигена и максимальным ответом. Отличительной чертой адаптивного иммунитета является способность к памяти, которая позволяет хозяину вызывать более быстрый и эффективный иммунный ответ при последующем воздействии антигена. Врожденный и адаптивный иммунитет не являются взаимоисключающими механизмами защиты хозяина, а скорее дополняют друг друга, при этом дефекты в любой системе приводят к уязвимости хозяина или неадекватным реакциям [1,2,3].
Врожденный иммунитет
Врожденный иммунитет можно рассматривать как включающий четыре типа защитных барьеров: анатомические (кожа и слизистые оболочки), физиологические (температура, низкий рН и химические медиаторы), эндоцитарные и фагоцитарные и воспалительные. В таблице 1 приведены неспецифические механизмы защиты хозяина для каждого из этих барьеров. Клетки и процессы, имеющие решающее значение для эффективного врожденного иммунитета к патогенам, преодолевающим анатомические барьеры, широко изучались. Врожденный иммунитет к патогенам зависит от рецепторов распознавания образов (PRR), которые позволяют ограниченному кругу иммунных клеток обнаруживать и быстро реагировать на широкий спектр патогенов, имеющих общие структуры, известные как молекулярные узоры, ассоциированные с патогенами (PAMP).Их примеры включают компоненты клеточной стенки бактерий, такие как липополисахариды (LPS) и двухцепочечная рибонуклеиновая кислота (РНК), продуцируемые во время вирусной инфекции.
Таблица 1. Краткий обзор неспецифических механизмов защиты хозяина от барьеров врожденного иммунитета [1]Важной функцией врожденного иммунитета является быстрое рекрутирование иммунных клеток в очаги инфекции и воспаления за счет продукции цитокинов и хемокинов (небольших белков, участвующих в межклеточных коммуникациях и рекрутировании).Производство цитокинов во время врожденного иммунитета мобилизует многие защитные механизмы по всему телу, а также активирует локальные клеточные реакции на инфекцию или повреждение. Ключевыми воспалительными цитокинами, высвобождаемыми во время раннего ответа на бактериальную инфекцию, являются: фактор некроза опухоли (ФНО), интерлейкин 1 (ИЛ-1) и интерлейкин 6 (ИЛ-6). Эти цитокины имеют решающее значение для инициации рекрутирования клеток и локального воспаления, которое необходимо для уничтожения многих патогенов. Они также способствуют развитию лихорадки.Нарушенная продукция таких воспалительных цитокинов часто связана с воспалительными или аутоиммунными заболеваниями, что делает их важными терапевтическими мишенями.
Система комплемента представляет собой биохимический каскад, функционирующий для идентификации и опсонизации (оболочки) бактерий и других патогенов. Он делает патогены восприимчивыми к фагоцитозу, процессу, при котором иммунные клетки поглощают микробы и удаляют клеточный мусор, а также непосредственно убивает некоторые патогены и инфицированные клетки. Фагоцитарное действие врожденного иммунного ответа способствует удалению мертвых клеток или комплексов антител и удалению чужеродных веществ, присутствующих в органах, тканях, крови и лимфе.Он также может активировать адаптивный иммунный ответ посредством мобилизации и активации антигенпрезентирующих клеток (АПК) (обсуждается позже) [1, 3].
Во врожденном иммунном ответе участвуют многочисленные клетки, такие как фагоциты (макрофаги и нейтрофилы), дендритные клетки, тучные клетки, базофилы, эозинофилы, естественные киллеры (NK) и врожденные лимфоидные клетки. Фагоциты подразделяются на два основных типа клеток: нейтрофилы и макрофаги. Обе эти клетки выполняют сходную функцию: поглощать (фагоцитировать) микробы и убивать их несколькими бактерицидными путями.В дополнение к своим фагоцитарным свойствам нейтрофилы содержат гранулы и ферментативные пути, которые способствуют элиминации патогенных микробов. В отличие от нейтрофилов (которые являются короткоживущими клетками), макрофаги являются долгоживущими клетками, которые не только играют роль в фагоцитозе, но также участвуют в презентации антигена Т-клеткам (см. рис. 1) [1].
Рис. 1Характеристики и функции клеток, участвующих во врожденном иммунитете [1, 3, 4]. * Пылевые клетки (в легочных альвеолах), гистиоциты (соединительная ткань), клетки Купфера (печень), клетки микроглии (нервная ткань), эпителиоидные клетки (гранулемы), остеокласты (кость), мезангиальные клетки (почки)
Дендритные клетки также фагоцитируют и функционируют как АПК, инициируя приобретенный иммунный ответ и выступая в качестве важных посредников между врожденным и адаптивным иммунитетом.Тучные клетки и базофилы имеют много общего друг с другом, и оба играют важную роль в инициации острых воспалительных реакций, например, наблюдаемых при аллергии и астме. Тучные клетки также выполняют важные функции в качестве иммунных «сигнальных клеток» и являются ранними производителями цитокинов в ответ на инфекцию или повреждение. В отличие от тучных клеток, которые обычно находятся в соединительной ткани, окружающей кровеносные сосуды, и особенно распространены на поверхности слизистых оболочек, базофилы находятся в кровотоке.Эозинофилы представляют собой гранулоциты, обладающие фагоцитарными свойствами и играющие важную роль в уничтожении паразитов, которые часто слишком велики для фагоцитоза. Наряду с тучными клетками и базофилами они также контролируют механизмы, связанные с аллергией и астмой. Естественные клетки-киллеры (NK) играют главную роль в отторжении опухолей и разрушении клеток, инфицированных вирусами. Разрушение инфицированных клеток достигается за счет высвобождения перфоринов и гранзимов (белков, вызывающих лизис клеток-мишеней) из гранул NK-клеток, которые индуцируют апоптоз (запрограммированную гибель клеток) [4].NK-клетки также являются важным источником другого цитокина, интерферона-гамма (IFN-γ), который помогает мобилизовать APC и способствует развитию эффективного противовирусного иммунитета. Врожденные лимфоидные клетки (ILC) играют более регулирующую роль. В зависимости от их типа (например, ILC-1, ILC-2, ILC-3) они избирательно продуцируют цитокины, такие как IL-4, IFN-γ и IL-17, которые помогают направлять соответствующий иммунный ответ на определенные патогены и способствуют к иммунной регуляции в этой ткани.
Основные характеристики и функции клеток, участвующих в врожденном иммунном ответе, суммированы на рис.1.
Адаптивный иммунитет
Развитию адаптивного иммунитета способствуют действия врожденной иммунной системы, и он имеет решающее значение, когда врожденный иммунитет неэффективен в элиминации инфекционных агентов. Первичными функциями адаптивного иммунного ответа являются: распознавание специфических «чужих» антигенов, отличие их от «своих» антигенов; образование патоген-специфических иммунологических эффекторных путей, которые элиминируют специфические патогены или инфицированные патогенами клетки; и развитие иммунологической памяти, которая может быстро устранить конкретный патоген в случае возникновения последующих инфекций [2].Адаптивные иммунные реакции являются основой эффективной иммунизации против инфекционных заболеваний. К клеткам адаптивной иммунной системы относятся: антигенспецифические Т-клетки, которые активируются для пролиферации под действием АПК, и В-клетки, которые дифференцируются в плазматические клетки с образованием антител.
Т-клетки и АПК
Т-клетки происходят из гемопоэтических стволовых клеток в костном мозге и после миграции созревают в тимусе. Эти клетки экспрессируют на своей мембране ряд уникальных антигенсвязывающих рецепторов, известных как Т-клеточный рецептор (TCR).Каждая Т-клетка экспрессирует один тип TCR и способна быстро размножаться и дифференцироваться, если она получает соответствующие сигналы. Как упоминалось ранее, Т-клеткам требуется действие АПК (обычно дендритных клеток, но также макрофагов, В-клеток, фибробластов и эпителиальных клеток) для распознавания специфического антигена.
Поверхности APC экспрессируют группу белков, известную как главный комплекс гистосовместимости (MHC). MHC классифицируются либо как класс I (также называемый человеческим лейкоцитарным антигеном [HLA] A, B и C), который обнаруживается во всех ядерных клетках, либо как класс II (также называемый HLA DP, DQ и DR), который обнаруживается только в определенных клетках. иммунной системы, включая макрофаги, дендритные клетки и В-клетки.Молекулы MHC класса I представляют эндогенные (внутриклеточные) пептиды, в то время как молекулы класса II на APC представляют экзогенные (внеклеточные) пептиды Т-клеткам. Белок MHC отображает фрагменты антигенов (пептидов) при заражении клетки внутриклеточным патогеном, например вирусом, или при фагоцитозе чужеродных белков или организмов [2, 3].
Т-клетки имеют широкий спектр уникальных TCR, которые могут связываться со специфическими чужеродными пептидами. Во время развития иммунной системы Т-клетки, которые реагировали бы на антигены, обычно присутствующие в нашем организме, в значительной степени элиминируются.Т-клетки активируются, когда они сталкиваются с APC, которые переварили антиген и отображают правильные фрагменты антигена (пептиды), связанные с его молекулами MHC. Возможности контакта нужных Т-клеток с АПК, несущими соответствующий пептидный комплекс МНС, увеличиваются за счет циркуляции Т-клеток по всему организму (через лимфатическую систему и кровоток) и их накопления (вместе с АПК) в лимфе. узлы. Комплекс MHC-антиген активирует TCR, а Т-клетка секретирует цитокины, которые дополнительно контролируют иммунный ответ.Этот процесс презентации антигена стимулирует дифференцировку Т-клеток в первую очередь либо в цитотоксические Т-клетки (клетки CD8+), либо в Т-хелперные (Th) клетки (клетки CD4+) (см. рис. 2). CD8+ цитотоксические Т-клетки в первую очередь участвуют в разрушении клеток, инфицированных чужеродными агентами, такими как вирусы, и уничтожении опухолевых клеток, экспрессирующих соответствующие антигены. Они активируются взаимодействием их TCR с пептидом, связанным с молекулами MHC класса I. Клональная экспансия цитотоксических Т-клеток продуцирует эффекторные клетки, которые высвобождают вещества, индуцирующие апоптоз клеток-мишеней.После разрешения инфекции большинство эффекторных клеток погибают и очищаются фагоцитами. Однако некоторые из этих клеток сохраняются как клетки памяти, способные быстро дифференцироваться в эффекторные клетки при последующих встречах с тем же антигеном [2, 3].
Рис. 2Адаптивный иммунитет: активация и функция Т- и В-клеток. APC антигенпрезентирующая клетка, TCR Т-клеточный рецептор, MHC главный комплекс гистосовместимости
CD4+ Th-клетки играют важную роль в установлении и усилении иммунного ответа.Эти клетки не обладают цитотоксической или фагоцитарной активностью и не могут напрямую уничтожать инфицированные клетки или уничтожать патогены. Однако они «опосредуют» иммунный ответ, направляя другие клетки на выполнение этих задач и регулируя тип развивающегося иммунного ответа. Th-клетки активируются за счет распознавания TCR антигена, связанного с молекулами MHC класса II. После активации Th-клетки выделяют цитокины, которые влияют на активность многих типов клеток, включая APC, которые их активируют.
APC может индуцировать несколько типов ответов Th-клеток, наиболее частыми из которых являются Th2, Th3 и Th27.Ответ Th2 характеризуется продукцией IFN-γ, который активирует бактерицидную активность макрофагов и усиливает противовирусный иммунитет, а также иммунитет к другим внутриклеточным патогенам. Цитокины, производные Th2, также способствуют дифференцировке В-клеток с образованием опсонизирующих антител, повышающих эффективность фагоцитов. Неправильный ответ Th2 связан с некоторыми аутоиммунными заболеваниями.
Ответ Th3 характеризуется высвобождением цитокинов (IL-4, 5 и 13), которые участвуют в развитии B-клеток, продуцирующих антитела к иммуноглобулину E (IgE), а также в развитии и рекрутировании тучных клеток и эозинофилов, которые необходимы для эффективного ответа против многих паразитов.Кроме того, они усиливают выработку определенных форм IgG, которые помогают бороться с бактериальной инфекцией. Как упоминалось ранее, тучные клетки и эозинофилы играют важную роль в инициации острых воспалительных реакций, например, наблюдаемых при аллергии и астме. Антитела IgE также связаны с аллергическими реакциями (см. Таблицу 2). Следовательно, дисбаланс продукции цитокинов Th3 связан с развитием атопических (аллергических) состояний. Клетки Th27 были описаны совсем недавно.Они характеризуются продукцией цитокинов семейства IL-17 и связаны с текущими воспалительными реакциями, особенно при хронических инфекциях и заболеваниях. Подобно цитотоксическим Т-клеткам, большинство Th-клеток погибает после разрешения инфекции, а некоторые остаются в виде Th-клеток памяти [2, 3].
Таблица 2 Основные функции антител Ig человека [5]Подмножество Т-клеток CD4+, известное как регуляторные Т-клетки (T reg), также играет роль в иммунном ответе. Т-reg-клетки ограничивают и подавляют иммунные реакции и, таким образом, могут контролировать аберрантные реакции на аутоантигены и развитие аутоиммунных заболеваний.T-reg-клетки также могут помочь в разрешении нормальных иммунных ответов, поскольку патогены или антигены устраняются. Эти клетки также играют критическую роль в развитии «иммунной толерантности» к определенным чужеродным антигенам, например, содержащимся в пище.
В-клетки
В-клетки возникают из гемопоэтических стволовых клеток в костном мозге и после созревания покидают костный мозг, экспрессируя на своей мембране уникальный антигенсвязывающий рецептор. В отличие от Т-клеток, В-клетки могут распознавать антигены напрямую, без необходимости использования АПК, благодаря уникальным антителам, экспрессируемым на их клеточной поверхности.Основная функция В-клеток – выработка антител против чужеродных антигенов, что требует их дальнейшей дифференцировки [2, 3]. При определенных обстоятельствах В-клетки также могут действовать как АПК.
При активации чужеродными антигенами, к которым они имеют соответствующий антиген-специфический рецептор, В-клетки подвергаются пролиферации и дифференцируются в секретирующие антитела плазматические клетки или В-клетки памяти (см. рис. 2). В-клетки памяти являются «долгоживущими» пережившими инфекцию и продолжают экспрессировать антигенсвязывающие рецепторы.Эти клетки можно заставить реагировать быстро, вырабатывая антитела и удаляя антиген при повторном воздействии. Плазматические клетки, с другой стороны, являются относительно короткоживущими клетками, которые часто подвергаются апоптозу при устранении провоцирующего агента, вызвавшего иммунный ответ. Однако эти клетки продуцируют большое количество антител, которые поступают в кровоток и в ткани, обеспечивая эффективную защиту от патогенов.
Учитывая их функцию в продукции антител, В-клетки играют важную роль в гуморальном или антитело-опосредованном иммунном ответе (в отличие от клеточно-опосредованного иммунного ответа, который регулируется в основном Т-клетками) [2, 3].
Определение тренированного иммунитета и его роли в здоровье и болезни
Меджитов Р. и Джейнвей К. Распознавание врожденным иммунитетом: механизмы и пути. Иммунол. 173 , 89–97 (2000).
КАС пабмед Статья Google ученый
Lanier, L.L. Распознавание NK-клеток. год. Преподобный Иммунол. 23 , 225–274 (2005).
КАС пабмед Статья Google ученый
Бонилья, Ф.A. & Oettgen, HC Адаптивный иммунитет. J. Аллергическая клиника. Иммунол. 125 , С33–С40 (2010 г.).
ПабМед Статья Google ученый
Bowdish, D.M.E., Loffredo, M.S., Mukhopadhyay, S., Mantovani, A. & Gordon, S. Рецепторы макрофагов, участвующие в «адаптивной» форме врожденного иммунитета. Заражение микробами. 9 , 1680–1687 (2007 г.).
КАС пабмед Статья Google ученый
Нетеа, М.Г., Куинтин Дж. и Ван Дер Меер, Дж. В. М. Тренированный иммунитет: память о врожденной защите хозяина. Микроб-хозяин клетки 9 , 355–361 (2011). В этой статье описываются особенности памяти врожденной иммунной системы и впервые предлагается термин «тренированный иммунитет» .
КАС пабмед Статья Google ученый
Найк, С. и др. Воспалительная память повышает чувствительность эпителиальных стволовых клеток кожи к повреждению тканей. Природа 550 , 475–480 (2017). Это исследование показывает, что эпителиальные стволовые клетки сохраняют хромосомную доступность в ключевых генах ответа на стресс, которые активируются первичным стимулом .
КАС пабмед ПабМед Центральный Статья Google ученый
Лэй, К. и др. Стволовые клетки перенаправляют пролиферацию, чтобы сдержать брешь в их нишевом барьере. eLife 7 , e41661 (2018).
ПабМед ПабМед Центральный Статья Google ученый
Christ, A. et al. Западная диета запускает NLRP3-зависимое перепрограммирование врожденного иммунитета. Cell 172 , 162–175 (2018). Это исследование показало, что диета с высоким содержанием жиров вызывает длительное функциональное перепрограммирование иммунитета в миелоидных клетках, которое сохраняется после того, как мышей возвращают на диету .
КАС пабмед ПабМед Центральный Статья Google ученый
Курц, Дж.Специфическая память в системе врожденного иммунитета. Тренды Иммунол. 26 , 186–192 (2005).
КАС пабмед Статья Google ученый
Конрат У., Беккерс Г. Дж. М., Лангенбах С. Дж. Г. и Яскевич М. Р. Подготовка к усиленной защите. год. Преподобный Фитопат. 53 , 97–119 (2015).
КАС пабмед Статья Google ученый
Гурбал Б.и другие. Врожденная иммунная память: эволюционная перспектива. Иммунол. 283 , 21–40 (2018).
КАС пабмед Статья Google ученый
Netea, M.G. et al. Тренированный иммунитет: программа врожденной иммунной памяти в норме и при болезни. Наука 352 , aaf1098 (2016).
ПабМед ПабМед Центральный Статья КАС Google ученый
Новакович Б.и другие. β-глюкан изменяет эпигенетическое состояние иммунологической толерантности, индуцированной липополисахаридами. Cell 167 , 1354–1368.e14 (2016). Это исследование детализирует эпигенетическую и транскрипционную картину ЛПС-индуцированной толерантности макрофагов человека и характеризует потенциал β-глюкана для ее устранения .
КАС пабмед ПабМед Центральный Статья Google ученый
Нанкабирва, В. и др. Выживание детей и вакцинация БЦЖ: проспективное когортное исследование на базе сообщества в Уганде. BMC Public Health 15 , 175 (2015 г.).
ПабМед ПабМед Центральный Статья Google ученый
Домингес-Андрес, Дж. и Нетеа, М. Г. Долгосрочное перепрограммирование врожденной иммунной системы. Дж. Лейкок. Биол . 105 , 329–338 (2018).
ПабМед Статья КАС Google ученый
Берендсен, М.Л. Т. и др. Подготовка матери: рубцевание вакцины бациллы Кальметта-Герена (БЦЖ) у матерей повышает выживаемость их ребенка с рубцом вакцины БЦЖ. J. Детская инфекция. Дис. соц. https://doi.org/10.1093/jpids/piy142 (2019).
Артикул Google ученый
Moore, R. S., Kaletsky, R. & Murphy, C. T. Piwi/PRG-1 argonaute и TGF-β опосредуют трансгенерационное усвоенное предотвращение патогенов. Cell 177 , 1827–1841 (2019).
КАС пабмед Статья Google ученый
Хирано М., Дас С., Го П. и Купер М. Д. Эволюция адаптивного иммунитета у позвоночных. в. Доп. Иммунол. 109 , 125–157 (2011).
КАС пабмед Статья Google ученый
Купер, М. Д. и Алдер, М. Н. Эволюция адаптивных иммунных систем. Cell 124 , 815–822 (2006).
КАС пабмед Статья Google ученый
Первис, А. и Гектор, А. Измерение биоразнообразия. Природа 405 , 212–219 (2000).
КАС пабмед Статья Google ученый
Милутинович Б. и Курц Дж. Иммунная память у беспозвоночных. Семин. Иммунол. 28 , 328–342 (2016).
ПабМед Статья КАС Google ученый
Реймер-Михальский, Э.-М. & Конрат, У. Врожденная иммунная память у растений. Семин. Иммунол. 28 , 319–327 (2016).
КАС пабмед Статья Google ученый
Kleinnijenhuis, J. et al. Бацилла Кальметта-Герена индуцирует NOD2-зависимую неспецифическую защиту от повторного заражения путем эпигенетического перепрограммирования моноцитов. Проц. Натл акад. науч. США 109 , 17537–17542 (2012).
КАС пабмед Статья Google ученый
Di Luzio, N. R. & Williams, D. L. Защитный эффект глюкана против системной септицемии Staphylococcus aureus у нормальных и лейкозных мышей. Заразить. Иммун. 20 , 804–810 (1978).
ПабМед ПабМед Центральный Статья Google ученый
Маракалала, М.Дж. и др. Дектин-1 играет избыточную роль в иммуномодулирующей активности лигандов, богатых β-глюканом, in vivo. Заражение микробами. 15 , 511–515 (2013).
КАС пабмед ПабМед Центральный Статья Google ученый
Krahenbuhl, J.L., Sharma, S.D., Ferraresi, R.W. & Remington, J.S. Влияние лечения мурамилдипептидом на устойчивость к инфекции Toxoplasma gondii у мышей. Заразить. Иммун. 31 , 716–722 (1981).
КАС пабмед ПабМед Центральный Статья Google ученый
Ribes, S. et al. Внутрибрюшинная профилактика олигодезоксинуклеотидами CpG защищает мышей с нейтропенией от внутримозговой инфекции Escherichia coli K1. J. Neuroinflammation 11 , 14 (2014).
ПабМед ПабМед Центральный Статья КАС Google ученый
Муньос, Н.и другие. Введение флагеллина через слизистую защищает мышей от легочной инфекции Streptococcus pneumoniae . Заразить. Иммун. 78 , 4226–4233 (2010).
ПабМед ПабМед Центральный Статья КАС Google ученый
Чжан, Б. и др. Вирусная инфекция. Профилактика и лечение ротавирусной инфекции посредством опосредованной TLR5/NLRC4 продукции IL-22 и IL-18. Наука 346 , 861–865 (2014).
КАС пабмед ПабМед Центральный Статья Google ученый
van’t Wout, J. W., Poell, R. & van Furth, R. Роль макрофагов, активированных БЦЖ/ППД, в устойчивости к системному кандидозу у мышей. Сканд. Дж. Иммунол. 36 , 713–719 (1992).
Артикул Google ученый
Трибулей, Дж., Трибулей-Дюре, Дж. и Апприоу, М.Влияние бациллы Callmette Guerin (BCG) на восприимчивость голых мышей к Schistosoma mansoni . CR Seances Soc. биол. Фил. 172 , 902–904 (1978).
КАС пабмед Google ученый
Kaufmann, E. et al. БЦЖ обучает гемопоэтические стволовые клетки вырабатывать защитный врожденный иммунитет против туберкулеза. Cell 172 , 176–190.e19 (2018). В этой статье показано, что доступ BCG к костному мозгу изменяет ландшафт транскрипции HSCs и мультипотентных предшественников, приводя к локальной экспансии клеток и усилению миелопоэза .
КАС пабмед Статья Google ученый
Bromuro, C. et al. Взаимодействие между защитными и ингибирующими антителами определяет исход экспериментально диссеминированного кандидоза у реципиентов вакцины Candida albicans . Заразить. Иммун. 70 , 5462–5470 (2002).
КАС пабмед ПабМед Центральный Статья Google ученый
Полонелли, Л.и другие. Терапевтическая активность сконструированного синтетического фрагмента антиидиотипического антитела-киллера против экспериментального слизистого и системного кандидоза. Заразить. Иммун. 71 , 6205–6212 (2003 г.).
КАС пабмед ПабМед Центральный Статья Google ученый
Бистони, Ф. и др. Доказательства опосредованной макрофагами защиты от летальной инфекции Candida albicans . Заразить. Иммун. 51 , 668–674 (1986).
КАС пабмед ПабМед Центральный Статья Google ученый
Бистони, Ф. и др. Иммуномодуляция низковирулентным герминативным вариантом Candida albicans . Еще одно доказательство активации макрофагов как одного из эффекторных механизмов неспецифической противоинфекционной защиты. J. Med. Вет. Микол. 26 , 285–299 (1988).
КАС пабмед Статья Google ученый
Квинтин Дж.и другие. Инфекция Candida albicans обеспечивает защиту от повторного заражения за счет функционального перепрограммирования моноцитов. Микроб-хозяин клетки 12 , 223–232 (2012).
КАС пабмед Статья Google ученый
Веккиарелли, А. и др. Защитный иммунитет, индуцированный низковирулентным Candida albicans : продукция цитокинов при развитии противоинфекционного состояния. Сотовый.Иммунол. 124 , 334–344 (1989).
КАС пабмед Статья Google ученый
Tso, G. H. W. et al. Экспериментальная эволюция грибкового патогена в кишечный симбионт. Наука 362 , 589–595 (2018).
КАС пабмед Статья Google ученый
Biering-Sørensen, S. et al. Раннее БЦЖ-Дания и неонатальная смертность среди детей с массой тела <2500 г: рандомизированное контролируемое исследование. клин. Заразить. Дис. 65 , 1183–1190 (2017).
ПабМед ПабМед Центральный Статья Google ученый
Rieckmann, A. et al. Вакцинация против оспы и туберкулеза связана с лучшей долгосрочной выживаемостью: датское когортное исследование, 1971–2010 гг. Междунар. Дж. Эпидемиол. 46 , 695–705 (2017). Это исследование показало, что прививки от коровьей оспы и БЦЖ связаны с большей долгосрочной выживаемостью, что не объясняется патоген-специфической иммунной защитой, которую эти вакцины обеспечивают .
ПабМед Google ученый
Ааби, П. и др. Рубцы от коровьей оспы связаны с лучшей выживаемостью взрослых. Обсервационное исследование из Гвинеи-Бисау. Вакцина 24 , 5718–5725 (2006 г.).
ПабМед Статья Google ученый
Ааби, П. и др. Рандомизированное исследование вакцинации БЦЖ при рождении детей с низкой массой тела при рождении: положительный неспецифический эффект в неонатальном периоде? Дж.Заразить. Дис. 204 , 245–252 (2011).
КАС пабмед Статья Google ученый
Ааби, П. и др. Неспецифический положительный эффект иммунизации против кори: анализ исследований смертности в развивающихся странах. BMJ 311 , 481–485 (1995). В этом исследовании сообщается, что вакцина против кори со стандартным титром может давать положительный эффект, не связанный со специфической защитой от коревой инфекции .
КАС пабмед ПабМед Центральный Статья Google ученый
Ааби, П. и др. Неспецифические эффекты стандартной вакцины против кори в возрасте 4,5 и 9 месяцев на детскую смертность: рандомизированное контролируемое исследование. БМЖ 341 , c6495 (2010).
ПабМед ПабМед Центральный Статья Google ученый
Лунд, Н. и др. Влияние оральной вакцины против полиомиелита при рождении на младенческую смертность: рандомизированное исследование. клин. Заразить. Дис. 61 , 1504–1511 (2015).
ПабМед ПабМед Центральный Статья Google ученый
Andersen, A. et al. Национальные кампании иммунизации пероральной вакциной против полиомиелита снижают смертность от всех причин: естественный эксперимент в рамках семи рандомизированных испытаний. Перед. Общественное здравоохранение 6 , 13 (2018).
ПабМед ПабМед Центральный Статья Google ученый
Бенн, К.С., Нетеа М.Г., Селин Л.К. и Ааби П. Небольшой укол — большой эффект: неспецифическая иммуномодуляция вакцинами. Тренды Иммунол. 34 , 431–439 (2013).
КАС пабмед Статья Google ученый
Kleinnijenhuis, J. et al. Индуцированный БЦЖ тренированный иммунитет в NK-клетках: роль неспецифической защиты от инфекции. клин. Иммунол. 155 , 213–219 (2014).
КАС пабмед ПабМед Центральный Статья Google ученый
Дженсен, К.Дж. и др. Гетерологичные иммунологические эффекты ранней вакцинации БЦЖ у детей с низким весом при рождении в Гвинее-Бисау: рандомизированное контролируемое исследование. Дж. Заражение. Дис. 211 , 956–967 (2015).
КАС пабмед Статья Google ученый
Freyne, B. et al. Неонатальная вакцинация БЦЖ влияет на цитокиновый ответ на лиганды толл-подобных рецепторов и гетерологичные антигены. Дж. Заражение. Дис. 217 , 1798–1808 (2018).
КАС пабмед Статья Google ученый
Ааби, П. и др. Различия в женской и мужской смертности после вакцины против кори с высоким титром и связь с последующей вакцинацией дифтерийно-столбнячным коклюшем и инактивированным полиовирусом: повторный анализ западноафриканских исследований. Ланцет 361 , 2183–2188 (2003 г.).
ПабМед Статья Google ученый
Блок Б.А. и др. Взаимодействующие неспецифические иммунологические эффекты прививок БЦЖ и TDAPF: исследовательское рандомизированное исследование. клин. Заразить. Дис. 70 , 455–463 (2019).
Google ученый
Arts, R.J.W. et al. Вакцинация БЦЖ защищает человека от экспериментальной вирусной инфекции за счет индукции цитокинов, связанных с тренированным иммунитетом. Микроб-хозяин клетки 23 , 89–100 (2018).
КАС пабмед Статья Google ученый
Уолк, Дж. и др. Исходы контролируемой инфекции малярии человека после вакцинации БЦЖ. Нац. коммун. 10 , 874 (2019).
ПабМед ПабМед Центральный Статья Google ученый
McCall, M.B.B. et al. Инфекция Plasmodium falciparum вызывает провоспалительное праймирование реакций TLR человека. Дж. Иммунол. 179 , 162–171 (2007).
КАС пабмед Статья Google ученый
Атаиде М.А. и др. Индуцированная малярией NLRP12/NLRP3-зависимая активация каспазы-1 опосредует воспаление и гиперчувствительность к бактериальной суперинфекции. Патог PLoS. 10 , e1003885 (2014).
ПабМед ПабМед Центральный Статья КАС Google ученый
Фицджеральд, К.А. и др. Передовой опыт: Plasmodium falciparum индуцирует тренированный врожденный иммунитет. Дж. Иммунол. 6 , 1243–1248 (2018).
Google ученый
Редельман-Сиди Г., Гликман М. С. и Бохнер Б. Х. Механизм действия терапии БЦЖ при раке мочевого пузыря — современная перспектива. Нац. Преподобный Урол. 11 , 153–162 (2014).
КАС пабмед Статья Google ученый
Стюарт, Дж.H. & Levine, EA Роль бациллы Кальметта-Герена в лечении запущенной меланомы. Эксперт. Преподобный Антирак. тер. 11 , 1671–1676 (2011).
ПабМед Статья Google ученый
Powles, R.L. et al. Поддержание ремиссии при остром миелогенном лейкозе смесью БЦЖ. и облученных лейкозных клеток. Ланцет 2 , 1107–1110 (1977).
КАС пабмед Статья Google ученый
Виллумсен, М.и другие. Риск лимфомы и лейкемии после вакцинации против бациллы Кальметта-Герена и оспы: датское когортное исследование. Вакцина 27 , 6950–6958 (2009 г.).
ПабМед Статья Google ученый
Buffen, K. et al. Аутофагия контролирует индуцированный БЦЖ тренированный иммунитет и ответ на внутрипузырную терапию БЦЖ при раке мочевого пузыря. Патог PLoS. 10 , e1004485 (2014).
ПабМед ПабМед Центральный Статья КАС Google ученый
Фостер, С.Л., Харгривз, Д.К. и Меджитов, Р. Геноспецифический контроль воспаления с помощью модификаций хроматина, индуцированных TLR. Природа 447 , 972–978 (2007).
КАС пабмед Статья Google ученый
Саид, С. и др. Эпигенетическое программирование дифференцировки моноцитов в макрофаги и тренированный врожденный иммунитет. Наука 345 , 1251086 (2014). В этой статье показано, что изменение эпигенетического ландшафта лежит в основе эффектов тренированного иммунитета в человеческих моноцитах .
ПабМед ПабМед Центральный Статья КАС Google ученый
Чен, Ф. и др. Нейтрофилы запускают фенотип долгоживущих эффекторных макрофагов, который обеспечивает ускоренное изгнание гельминтов. Нац. Иммунол. 15 , 938–946 (2014).
КАС пабмед ПабМед Центральный Статья Google ученый
Hole, C. R. et al. Индукция ответов дендритных клеток, подобных памяти, in vivo. Нац. коммун. 10 , 2955 (2019).
ПабМед ПабМед Центральный Статья КАС Google ученый
Barton, E. S. et al. Латентность герпесвируса обеспечивает симбиотическую защиту от бактериальной инфекции. Природа 447 , 326–329 (2007).
КАС пабмед Статья Google ученый
Сан, Дж. К., Бейлке, Дж.Н. и Ланье, Л. Л. Адаптивные иммунные свойства естественных клеток-киллеров. Природа 457 , 557–561 (2009).
КАС пабмед ПабМед Центральный Статья Google ученый
Sun, J.C. et al. Передача сигналов провоспалительных цитокинов необходима для создания памяти естественных клеток-киллеров. Дж. Экспл. Мед. 209 , 947–954 (2012).
КАС пабмед ПабМед Центральный Статья Google ученый
Бьоркстрём, Н.К. и др. Быстрое распространение и длительное сохранение повышенного числа NK-клеток у людей, инфицированных хантавирусом. Дж. Экспл. Мед. 208 , 13–21 (2011).
ПабМед ПабМед Центральный Статья КАС Google ученый
Делла Кьеза, М. и др. Фенотипическая и функциональная гетерогенность NK-клеток человека, развивающихся после трансплантации пуповинной крови: роль цитомегаловируса человека? Кровь 119 , 399–410 (2012).
ПабМед Статья КАС Google ученый
Foley, B. et al. NKG2C + NK-клетки, индуцированные цитомегаловирусом человека (CMV), являются трансплантируемыми и размножаются in vivo в ответ на антиген CMV реципиента. Дж. Иммунол. 189 , 5082–5088 (2012).
КАС пабмед ПабМед Центральный Статья Google ученый
Арасе Х., Mocarski, E.S., Campbell, A.E., Hill, A.B. & Lanier, L.L. Прямое распознавание цитомегаловируса путем активации и ингибирования рецепторов NK-клеток. Наука 296 , 1323–1326 (2002).
КАС пабмед Статья Google ученый
Браун, М. Г. и др. Жизненно важное участие рецептора активации естественных клеток-киллеров в устойчивости к вирусной инфекции. Наука 292 , 934–937 (2001).
КАС пабмед Статья Google ученый
Адамс Н.М. и др. Цитомегаловирусная инфекция стимулирует авидный отбор естественных клеток-киллеров. Иммунитет 50 , 1381–1390.e5 (2019).
КАС пабмед Статья ПабМед Центральный Google ученый
Grassmann, S. et al. Отличительная поверхностная экспрессия активирующего рецептора Ly49H вызывает дифференциальную экспансию клонов NK-клеток при мышиной цитомегаловирусной инфекции. Иммунитет 50 , 1391–1400.e4 (2019).
КАС пабмед Статья Google ученый
Sun, J.C. & Lanier, L.L. Развитие, гомеостаз и функция NK-клеток: параллели с CD8 + Т-клетками. Нац. Преподобный Иммунол. 11 , 645–657 (2011).
КАС пабмед ПабМед Центральный Статья Google ученый
Мин-Оо, Г.& Lanier, L.L. Цитомегаловирус продуцирует долгоживущие антиген-специфические NK-клетки с пониженной активацией свидетелей при гетерологичной инфекции. Дж. Экспл. Мед. 211 , 2669–2680 (2014).
КАС пабмед ПабМед Центральный Статья Google ученый
Рёлле, А. и др. Моноциты, продуцирующие IL-12, и HLA-E контролируют размножение NKG2C + NK-клеток, управляемое HCMV. Дж. Клин. Вкладывать деньги. 124 , 5305–5316 (2014).
ПабМед ПабМед Центральный Статья Google ученый
Hammer, Q. et al. Пептид-специфическое распознавание штаммов цитомегаловируса человека контролирует адаптивные естественные клетки-киллеры. Нац. Иммунол. 19 , 453–463 (2018).
КАС пабмед Статья Google ученый
Каро, Дж. М., Шац, Д. Г. и Сан, Дж. К. Рекомбиназа RAG определяет функциональную гетерогенность и клеточную приспособленность естественных клеток-киллеров. Cell 159 , 94–107 (2014).
КАС пабмед ПабМед Центральный Статья Google ученый
Vivier, E. et al. Врожденный или адаптивный иммунитет? Пример естественных клеток-киллеров. Наука 331 , 44–49 (2011).
КАС пабмед ПабМед Центральный Статья Google ученый
Купер, Массачусетси другие. Цитокин-индуцированные естественные клетки-киллеры, подобные памяти. Проц. Натл акад. науч. США 106 , 1915–1919 (2009 г.).
КАС пабмед Статья Google ученый
Romee, R. et al. Активация цитокинов индуцирует NK-клетки, подобные памяти человека. Кровь 120 , 4751–4760 (2012).
КАС пабмед ПабМед Центральный Статья Google ученый
Роми Р.и другие. Индуцированные цитокинами клетки-естественные киллеры, подобные памяти, проявляют усиленный ответ против миелоидного лейкоза. Науч. Перевод мед. 8 , 357ra123 (2016).
ПабМед ПабМед Центральный Статья КАС Google ученый
Мадера, С. и др. IFN типа I способствует размножению NK-клеток во время вирусной инфекции, защищая NK-клетки от братоубийства. Дж. Экспл. Мед. 213 , 225–233 (2016).
КАС пабмед ПабМед Центральный Статья Google ученый
Мадера, С. и Сан, Дж. К. Новейшие достижения: потребность в IL-18 для конкретных стадий для размножения противовирусных NK-клеток. Дж. Иммунол. 194 , 1408–1412 (2015).
КАС пабмед ПабМед Центральный Статья Google ученый
Набекура Т., Жирар Ж.-П. и Ланье, Л.L. Рецептор IL-33 ST2 усиливает размножение NK-клеток и усиливает защиту хозяина во время мышиной цитомегаловирусной инфекции. Дж. Иммунол. 194 , 5948–5952 (2015).
КАС пабмед ПабМед Центральный Статья Google ученый
Вейцман О.-Э. и другие. ILC1, перенесшие мышиный цитомегаловирус, приобретают реакцию памяти, зависящую от вирусного гликопротеина m12. Нац. Иммунол. 20 , 1004–1011 (2019).
КАС пабмед ПабМед Центральный Статья Google ученый
Martinez-Gonzalez, I. et al. Врожденные лимфоидные клетки группы 2, подвергшиеся воздействию аллергена, приобретают свойства, подобные памяти, и усиливают аллергическое воспаление легких. Иммунитет 45 , 198–208 (2016).
КАС пабмед Статья Google ученый
Пауст, С. и др.Критическая роль хемокинового рецептора CXCR6 в опосредованной NK-клетками антиген-специфической памяти гаптенов и вирусов. Нац. Иммунол. 11 , 1127–1135 (2010).
КАС пабмед ПабМед Центральный Статья Google ученый
Gamliel, M. et al. Тренированная память NK-клеток матки человека усиливает их функцию при последующих беременностях. Иммунитет 48 , 951–962 (2018). Это исследование показало, что маточные NK-клетки адаптируются к беременности и могут лучше поддерживать последующие беременности .
КАС пабмед Статья Google ученый
Гонсалес, К.А.У. и Фукс, Э. Кожа и ее регенеративные способности: союз между стволовыми клетками и их нишей. Дев. Ячейка 43 , 387–401 (2017).
КАС пабмед Статья Google ученый
Найк С., Ларсен С. Б., Коули С. Дж. и Фукс Э. Два в танго: диалог между иммунитетом и стволовыми клетками в норме и болезни. Cell 175 , 908–920 (2018).
КАС пабмед ПабМед Центральный Статья Google ученый
Битон, М. и др. Цитокины Т-хелперов модулируют обновление и дифференцировку стволовых клеток кишечника. Cell 175 , 1307–1320 (2018).
КАС пабмед ПабМед Центральный Статья Google ученый
Линдеманс, К.А. и др. Интерлейкин-22 способствует регенерации эпителия, опосредованной стволовыми клетками кишечника. Природа 528 , 560–564 (2015).
КАС пабмед ПабМед Центральный Статья Google ученый
фон Мольтке Дж., Цзи М., Лян Х.-Э. и Локсли, Р. М. IL-25, полученный из клеток пучка, регулирует цепь кишечного ILC2-эпителиального ответа. Природа 529 , 221–225 (2016).
Артикул КАС Google ученый
Камада, Р.и другие. Стимуляция интерфероном создает хроматиновые метки и устанавливает транскрипционную память. Проц. Натл акад. науч. США 115 , E9162–E9171 (2018 г.).
КАС пабмед Статья Google ученый
Мерад, М., Сате, П., Хелфт, Дж., Миллер, Дж. и Морта, А. Линия дендритных клеток: онтогенез и функция дендритных клеток и их подмножеств в стационарном состоянии и при воспалении . год.Преподобный Иммунол. 31 , 563–604 (2013).
КАС пабмед Статья Google ученый
Йона, С. и др. Картирование судьбы выявляет происхождение и динамику моноцитов и тканевых макрофагов в условиях гомеостаза. Иммунитет 38 , 79–91 (2013).
КАС пабмед Статья Google ученый
Патель, А. А. и др. Судьба и продолжительность жизни субпопуляций моноцитов человека в устойчивом состоянии и при системном воспалении. Дж. Экспл. Мед. 214 , 1913–1923 (2017).
КАС пабмед ПабМед Центральный Статья Google ученый
Chavakis, T., Mitroulis, I. & Hajishengallis, G. Гематопоэтические клетки-предшественники как интегративные центры для адаптации и точной настройки воспаления. Нац. Иммунол. 20 , 802–811 (2019).
КАС пабмед ПабМед Центральный Статья Google ученый
Митрулис И.и другие. Модуляция предшественников миелопоэза является неотъемлемым компонентом тренированного иммунитета. Cell 172 , 147–161 (2018). Это исследование показывает, что индукция тренированного иммунитета модулирует метаболизм гемопоэтических клеток-предшественников в костном мозге и увеличивает миелопоэз .
КАС пабмед ПабМед Центральный Статья Google ученый
Ордовас-Монтанес, Дж. и др. Аллергическая воспалительная память в клетках-предшественниках респираторного эпителия человека. Природа 560 , 649–654 (2018). В этой статье показано, что эпителиальные стволовые клетки вносят вклад в персистенцию болезней человека, выступая в качестве хранилищ аллергических воспоминаний .
КАС пабмед ПабМед Центральный Статья Google ученый
Machiels, B. et al. Гаммагерпесвирус обеспечивает защиту от аллергической астмы, индуцируя замену резидентных альвеолярных макрофагов регуляторными моноцитами. Нац. Иммунол. 18 , 1310–1320 (2017).
КАС пабмед Статья Google ученый
Yao, Y. et al. Индукция автономных альвеолярных макрофагов памяти требует помощи Т-клеток и имеет решающее значение для тренированного иммунитета. Cell 175 , 1634–1650.e17 (2018). Это исследование показало, что формирование и поддержание альвеолярных макрофагов, демонстрирующих особенности памяти, происходит независимо от моноцитов или предшественников костного мозга .
КАС пабмед Статья Google ученый
Смейл С.Т., Тараховский А. и Натоли Г. Вклад хроматина в регуляцию врожденного иммунитета. год. Преподобный Иммунол. 32 , 489–511 (2014).
КАС пабмед Статья Google ученый
Гислетти, С. и др. Идентификация и характеристика энхансеров, контролирующих программу экспрессии воспалительных генов в макрофагах. Иммунитет 32 , 317–328 (2010).
КАС пабмед Статья Google ученый
Fanucchi, S. et al. Иммунные гены праймируются для надежной транскрипции проксимальными длинными некодирующими РНК, расположенными в ядерных компартментах. Нац. Жене. 51 , 138–150 (2019). Это исследование показало, что lncRNA-опосредованная регуляция играет центральную роль в создании тренированного иммунитета .
КАС пабмед Статья Google ученый
Натоли Г.и Остуни, Р. Адаптация и память в иммунных реакциях. Нац. Иммунол. 20 , 783–792 (2019).
КАС пабмед Статья Google ученый
Luetke-Eversloh, M. et al. Цитомегаловирус человека управляет эпигенетическим импринтингом локуса IFNG в естественных клетках-киллерах NKG2Chi. Патог PLoS. 10 , e1004441 (2014).
ПабМед ПабМед Центральный Статья КАС Google ученый
Лау, К.М. и др. Эпигенетический контроль врожденной и адаптивной иммунной памяти. Нац. Иммунол. 19 , 963–972 (2018).
КАС пабмед ПабМед Центральный Статья Google ученый
Рапп, М. и др. Кор-связывающий фактор β и факторы транскрипции Runx способствуют адаптивным ответам естественных клеток-киллеров. Науч. Иммунол. 2 , eaan3796 (2017).
ПабМед ПабМед Центральный Статья Google ученый
Гири, К.Д. и др. Недублирующие компоненты ISGF3 способствуют выживанию NK-клеток ауторегулирующим образом во время вирусной инфекции. Cell Rep. 24 , 1949–1957.e6 (2018).
КАС пабмед ПабМед Центральный Статья Google ученый
Lam, V.C., Folkersen, L., Aguilar, O.A. & Lanier, L.L. KLF12 регулирует пролиферацию NK-клеток мыши. Дж. Иммунол. 203 , 981–989 (2019).
КАС пабмед Статья Google ученый
Адамс, Н.М. и др. Фактор транскрипции IRF8 управляет адаптивным ответом естественных клеток-киллеров. Иммунитет 48 , 1172–1182.e6 (2018).
КАС пабмед ПабМед Центральный Статья Google ученый
Мадера, С. и др. Передний край: расходящиеся потребности в факторах транскрипции T-box в эффекторных клетках и NK-клетках памяти. Дж. Иммунол. 200 , 1977–1981 (2018).
КАС пабмед ПабМед Центральный Статья Google ученый
Зависляк, г.Л. и др. Стадийно-специфическая регуляция гомеостаза естественных клеток-киллеров и ответ на вирусную инфекцию с помощью микроРНК-155. Проц. Натл акад. науч. США 110 , 6967–6972 (2013).
КАС пабмед Статья Google ученый
Лу, Л.-Ф. и другие. Одно взаимодействие miRNA-mRNA влияет на иммунный ответ в зависимости от контекста и типа клеток. Иммунитет 43 , 52–64 (2015).
КАС пабмед ПабМед Центральный Статья Google ученый
О’Коннелл Р. М., Чаудхури А. А., Рао Д. С. и Балтимор Д. Инозитолфосфатаза SHIP1 является основной мишенью миР-155. Проц. Натл акад. науч. США 106 , 7113–7118 (2009 г.).
ПабМед Статья Google ученый
Саз-Леал, П. и др. Нацеливание на SHIP-1 в миелоидных клетках повышает тренированный иммунитет и усиливает реакцию на инфекцию. Cell Rep. 25 , 1118–1126 (2018).
КАС пабмед ПабМед Центральный Статья Google ученый
Verma, D. et al. Антимикобактериальная активность коррелирует с измененным паттерном метилирования ДНК в иммунных клетках у лиц, вакцинированных БЦЖ. Науч. Респ. 7 , 12305 (2017).
ПабМед ПабМед Центральный Статья КАС Google ученый
Дас, Дж., Верма, Д., Густафссон, М. и Лерм, М. Идентификация паттернов метилирования ДНК, предрасполагающих к эффективному ответу на вакцинацию БЦЖ у здоровых субъектов, ранее не получавших БЦЖ. Эпигенетика 14 , 589–601 (2019).
ПабМед ПабМед Центральный Статья Google ученый
Пеньков С., Митрулис И., Хаджишенгаллис Г. и Чавакис Т. Иммунометаболические перекрестные помехи: родовой принцип тренированного иммунитета? Тренды Иммунол. 40 , 1–11 (2019).
КАС пабмед Статья Google ученый
Нората, Г. Д. и др. Клеточные и молекулярные основы трансляционного иммунометаболизма. Иммунитет 43 , 421–434 (2015).
КАС пабмед Статья Google ученый
Домингес-Андрес, Дж., Джустен, Л. А. и Нетеа, М. Г. Индукция врожденной иммунной памяти: роль клеточного метаболизма. Курс. мнение Иммунол. 56 , 10–16 (2019).
ПабМед Статья КАС Google ученый
Донохью, Д. Р. и Бультман, С. Дж. Метаболоэпигенетика: взаимосвязь между энергетическим метаболизмом и эпигенетическим контролем экспрессии генов. Дж. Сотовый. Физиол. 227 , 3169–3177 (2012).
КАС пабмед ПабМед Центральный Статья Google ученый
Ченг С.-С. и другие. mTOR- и HIF-1-опосредованный аэробный гликолиз как метаболическая основа тренированного иммунитета. Наука 345 , 1250684–1250684 (2014). В этом исследовании сообщается, что метаболическая перестройка клеток имеет решающее значение для индукции тренированного иммунитета .
ПабМед ПабМед Центральный Статья КАС Google ученый
Arts, R.J.W. et al. Иммунометаболические пути в тренированном иммунитете, индуцированном БЦЖ. Cell Rep. 17 , 2562–2571 (2016).
КАС пабмед ПабМед Центральный Статья Google ученый
Arts, R.J.W. et al. Глутаминолиз и накопление фумарата интегрируют иммунометаболические и эпигенетические программы в тренированном иммунитете. Сотовый метаб. https://doi.org/10.1016/j.cmet.2016.10.008 (2016 г.).
Артикул пабмед ПабМед Центральный Google ученый
Лю П.-С. и другие. α-кетоглутарат управляет активацией макрофагов посредством метаболического и эпигенетического перепрограммирования. Нац. Иммунол. 18 , 985–994 (2017).
КАС пабмед Статья Google ученый
Tannahill, G.M. et al. Сукцинат является воспалительным сигналом, который индуцирует IL-1β через HIF-1α. Природа 496 , 238–242 (2013).
КАС пабмед ПабМед Центральный Статья Google ученый
Лампропулу, В.и другие. Итаконат связывает ингибирование сукцинатдегидрогеназы с метаболическим ремоделированием макрофагов и регуляцией воспаления. Сотовый метаб. 24 , 158–166 (2016).
КАС пабмед ПабМед Центральный Статья Google ученый
Cordes, T. et al. Иммуночувствительный ген 1 и итаконат ингибируют сукцинатдегидрогеназу, модулируя внутриклеточные уровни сукцината. J. Biol. хим. 291 , 14274–14284 (2016).
КАС пабмед ПабМед Центральный Статья Google ученый
Миллс, Э. Л. и др. Итаконат является противовоспалительным метаболитом, который активирует Nrf2 посредством алкилирования KEAP1. Природа 556 , 113–117 (2018).
КАС пабмед ПабМед Центральный Статья Google ученый
Бамбоускова М. и др. Электрофильные свойства итаконата и его производных регулируют воспалительную ось IκBζ–ATF3. Природа 556 , 501–504 (2018).
КАС пабмед ПабМед Центральный Статья Google ученый
Домингес-Андрес, Дж. и др. Путь итаконата является центральным регуляторным узлом, связывающим врожденную иммунную толерантность и тренированный иммунитет. Сотовый метаб . 29 , 211–220 (2018).
ПабМед Статья КАС Google ученый
Беккеринг С.и другие. Метаболическая индукция тренированного иммунитета через мевалонатный путь. Cell 172 , 135–146.e9 (2018).
КАС пабмед Статья Google ученый
Иван-Шарве, Л. и др. АТФ-связывающие кассетные переносчики и ЛПВП подавляют пролиферацию гемопоэтических стволовых клеток. Наука 328 , 1689–1693 (2010).
КАС пабмед ПабМед Центральный Статья Google ученый
Мерфи, А.Дж. и др. ApoE регулирует пролиферацию гемопоэтических стволовых клеток, моноцитоз и накопление моноцитов при атеросклеротических поражениях у мышей. Дж. Клин. Вкладывать деньги. 121 , 4138–4149 (2011).
КАС пабмед ПабМед Центральный Статья Google ученый
Christ, A. & Latz, E. Западный образ жизни оказывает долгосрочное влияние на метавоспламенение. Нац. Преподобный Иммунол. 19 , 267–268 (2019).
КАС пабмед Статья Google ученый
Мушер, Д. М., Аберс, М. С. и Корралес-Медина, В. Ф. Острая инфекция и инфаркт миокарда. Н. англ. Дж. Мед. 380 , 171–176 (2019).
КАС пабмед Статья Google ученый
Leentjens, J. et al. Тренированный врожденный иммунитет как новый механизм, связывающий инфекцию и развитие атеросклероза. Обр. Рез. 122 , 664–669 (2018).
КАС пабмед Статья Google ученый
Беккеринг, С. и др. Окисленный липопротеин низкой плотности индуцирует долговременную продукцию провоспалительных цитокинов и образование пенистых клеток посредством эпигенетического перепрограммирования моноцитов. Артериосклероз. тромб. Васк. биол. 34 , 1731–1738 (2014).
КАС пабмед Статья Google ученый
Браза, М.С. и др. Подавление воспаления с помощью нанобиологических препаратов, специфичных для миелоидных клеток, способствует принятию трансплантата органов. Иммунитет 49 , 819–828 (2018).
КАС пабмед ПабМед Центральный Статья Google ученый
van der Valk, F. M. et al. Окисленные фосфолипиды на липопротеине (а) вызывают воспаление артериальной стенки и воспалительную реакцию моноцитов у людей. Тираж 134 , 611–624 (2016).
ПабМед ПабМед Центральный Статья КАС Google ученый
Беккеринг, С. и др. Лечение статинами не восстанавливает тренированный иммунитет у пациентов с семейной гиперхолестеринемией. Сотовый метаб. 30 , 1–2 (2019).
КАС пабмед Статья Google ученый
Беккеринг, С. и др. Активация врожденных иммунных клеток и эпигенетическое ремоделирование при симптоматическом и бессимптомном атеросклерозе у людей in vivo. Атеросклероз 254 , 228–236 (2016).
КАС пабмед Статья Google ученый
Шираи, Т. и др. Гликолитический фермент РКМ2 связывает метаболическую и воспалительную дисфункцию при ишемической болезни сердца. Дж. Экспл. Мед. 213 , 337–354 (2016).
КАС пабмед ПабМед Центральный Статья Google ученый
Циммерманн, П., Финн А. и Кертис Н. Защищает ли вакцинация БЦЖ от нетуберкулезной микобактериальной инфекции? Систематический обзор и метаанализ. Дж. Заражение. Дис. 218 , 679–687 (2018).
КАС пабмед Статья Google ученый
Leentjens, J. et al. Вакцинация БЦЖ повышает иммуногенность последующей вакцинации против гриппа у здоровых добровольцев: рандомизированное плацебо-контролируемое пилотное исследование. Дж. Заражение. Дис. 212 , 1930–1938 (2015).
КАС пабмед Статья Google ученый
Ransohoff, R. M. Как нейровоспаление способствует нейродегенерации. Наука 353 , 777–783 (2016).
КАС пабмед ПабМед Центральный Статья Google ученый
Вендельн, А.-К. и другие. Врожденная иммунная память мозга формирует признаки неврологических заболеваний. Природа 556 , 332–338 (2018).
КАС пабмед ПабМед Центральный Статья Google ученый
Фрост, П. С. и др. Неонатальная инфекция приводит к повышенной восприимчивости к воспалению головного мозга, вызванному олигомером Aβ, потере синапсов и когнитивным нарушениям у мышей. Раствор клеточной смерти. 10 , 323 (2019).
ПабМед ПабМед Центральный Статья КАС Google ученый
Лоу, А., Мак Э., Роу Дж. Б., Маркус Х. С. и О’Брайен Дж. Т. Воспаление и заболевание мелких сосудов головного мозга: систематический обзор. Старение Res. Ред. 53 , 100916 (2019 г.).
КАС пабмед Статья Google ученый
Ноз, М. П. и др. Характеристики тренированного иммунитета связаны с прогрессирующим заболеванием мелких сосудов головного мозга. Инсульт 49 , 2910–2917 (2018).
ПабМед Статья Google ученый
Франчески, К.и другие. Иммунобиография и гетерогенность иммунных реакций у пожилых людей: акцент на воспалении и тренированном иммунитете. Перед. Иммунол. 8 , 982 (2017).
ПабМед ПабМед Центральный Статья КАС Google ученый
Qian, F. et al. Связанное с возрастом повышение уровня TLR5 приводит к усилению воспалительных реакций у пожилых людей. Стареющая ячейка 11 , 104–110 (2012).
КАС пабмед Статья Google ученый
Меткалф, Т.У. и др. Общий анализ выявил возрастные изменения врожденных иммунных ответов после стимуляции рецепторов распознавания патогенов. Стареющая ячейка 14 , 421–432 (2015).
КАС пабмед ПабМед Центральный Статья Google ученый
Hoogeboom, R. et al. Подтип хронического лимфоцитарного лейкоза с мутантными В-клетками, который распознает грибы и реагирует на них. Дж. Экспл. Мед. 210 , 59–70 (2013).
КАС пабмед ПабМед Центральный Статья Google ученый
Хурадо-Камино, Т. и др. Хронический лимфоцитарный лейкоз: парадигма врожденной иммунной перекрестной толерантности. Дж. Иммунол. 194 , 719–727 (2015).
КАС пабмед Статья Google ученый
Паукен, К. Э. и др. Эпигенетическая стабильность истощенных Т-лимфоцитов ограничивает продолжительность реактивации блокадой PD-1. Наука 354 , 1160–1165 (2016).
КАС пабмед ПабМед Центральный Статья Google ученый
Lee, S.H. et al. TNFα усиливает фенотип, подобный раковым стволовым клеткам, посредством активации Notch-Hes1 в клетках плоскоклеточной карциномы полости рта. Биохим. Биофиз. Рез. коммун. 424 , 58–64 (2012).
КАС пабмед ПабМед Центральный Статья Google ученый
Ходж, Д.Р., Хёрт, Э. М. и Фаррар, В. Л. Роль IL-6 и STAT3 в воспалении и раке. евро. J. Рак 41 , 2502–2512 (2005).
КАС пабмед Статья Google ученый
Rabold, K., Netea, M.G., Adema, G.J. & Netea-Maier, R.T. Клеточный метаболизм макрофагов, ассоциированных с опухолью – функциональное влияние и последствия. ФЭБС Письмо. 591 , 3022–3041 (2017).
КАС пабмед Статья Google ученый
Кубас, П., Винсент К. и Коэн Э. Эпигенетическая мутация, ответственная за естественные вариации симметрии цветков. Природа 401 , 157–161 (1999).
КАС пабмед Статья Google ученый
Грир, Э. Л. и др. Сеть метилирования гистонов регулирует трансгенерационную эпигенетическую память у C. elegans. Cell Rep. 7 , 113–126 (2014).
КАС пабмед ПабМед Центральный Статья Google ученый
Тейт, А.Т., Андольфатто, П., Демут, Дж. П. и Грэм, А. Л. Динамика инфекции внутри хозяина у мучных жуков, привитых из поколения в поколение. Мол. Экол. 26 , 3794–3807 (2017).
КАС пабмед ПабМед Центральный Статья Google ученый
Авторы не указаны. Совещание Стратегической консультативной группы экспертов по иммунизации, апрель 2014 г. – выводы и рекомендации. Wkly Эпидемиол.Рек . 89 , 221–236 (2014).
Google ученый
Shann, F. Гетерологичные (неспецифические) эффекты вакцин: последствия для политики в странах с высокой смертностью. Пер. Р. Соц. Троп. Мед. Гиг. 109 , 5–8 (2015).
КАС пабмед Статья Google ученый
Бенн, К.С., Фискер, А.Б., Уиттл, Х.К.и Aaby, P. Ревакцинация живыми аттенуированными вакцинами оказывает дополнительное благотворное неспецифическое воздействие на общую выживаемость: обзор. EBioMedicine 10 , 312–317 (2016).
ПабМед ПабМед Центральный Статья Google ученый
Locht, C. & Mielcarek, N. Живые аттенуированные вакцины против коклюша. Эксперт. Rev. Vaccines 13 , 1147–1158 (2014 г.).
КАС пабмед Статья Google ученый
Мейерс, П.А. и др. Остеосаркома: добавление мурамилтрипептида к химиотерапии улучшает общую выживаемость — отчет Группы детской онкологии. Дж. Клин. Онкол. 26 , 633–638 (2008).
КАС пабмед Статья Google ученый
Мурамацу, Д. и др. Бета-глюкан, полученный из Aureobasidium pullulans, эффективен для профилактики гриппа у мышей. PLoS One 7 , e41399 (2012 г.).
КАС пабмед ПабМед Центральный Статья Google ученый
Малдер, В. Дж. М., Очандо, Дж., Джустен, Л. А. Б., Файад, З. А. и Нетеа, М. Г. Терапевтическое воздействие на тренированный иммунитет. Нац. Преподобный Лекарство. Дисков. 18 , 553–566 (2019).
КАС пабмед ПабМед Центральный Статья Google ученый
Левин Д.B. Больница для разорванных и искалеченных: Уильям Брэдли Коли, третий главный хирург 1925–1933 гг. HSS J. 4 , 1–9 (2008).
ПабМед Статья Google ученый
Coley, W. B. II. Вклад в познание саркомы. Энн. Surg. 14 , 199–220 (1891).
КАС пабмед ПабМед Центральный Статья Google ученый
Старый, Л.Дж., Кларк, Д. А. и Бенасерраф, Б. Влияние инфекции бациллы Кальметта-Герена на трансплантированные опухоли у мышей. Природа 184 , 291–292 (1959).
ПабМед Статья Google ученый
Остадрахими, А. и др. Влияние бета-глюкана на количество лейкоцитов и уровни ИЛ-4 и ИЛ-12 в сыворотке у женщин с раком молочной железы, проходящих химиотерапию: рандомизированное двойное слепое плацебо-контролируемое клиническое исследование. Азиатский пакет. J. Рак Prev. 15 , 5733–5739 (2014).
ПабМед Статья Google ученый
Башир К.М.И. и Чой Дж.-С. Клинические и физиологические перспективы β-глюканов: прошлое, настоящее и будущее. Междунар. Дж. Мол. Наука . 18 , 1906 (2017).
Центральный пабмед Статья КАС Google ученый
Ветвицкая, В., Vannucci, L., Sima, P. & Richter, J. Бета-глюкан: добавка или лекарство? от лабораторных до клинических испытаний. Молекулы 24 , 1251 (2019).
Центральный пабмед Статья КАС Google ученый
Лим, В. А. и Джун, К. Х. Принципы создания иммунных клеток для лечения. Раковая клетка 168 , 724–740 (2017).
КАС Google ученый
Шарма, П.и Эллисон, Дж. П. Будущее терапии контрольных точек иммунитета. Наука 348 , 56–61 (2015).
КАС Статья пабмед Google ученый
Routy, B. et al. Микробиота кишечника влияет на противораковый иммунологический надзор и общее состояние здоровья. Нац. Преподобный Клин. Онкол. 15 , 382–396 (2018).
КАС пабмед Статья Google ученый
Ламейер, М.и другие. Оценка эффективности и безопасности наноиммунотерапии, направленной на TRAF6, у мышей с атеросклерозом и нечеловеческих приматов. Нац. Биомед. Eng . 2 , 279–292 (2018).
КАС пабмед ПабМед Центральный Статья Google ученый
Нетеа, М. Г., Шлитцер, А., Пласек, К., Йостен, Л. А. Б. и Шульце, Дж. Л. Врожденная и адаптивная иммунная память: эволюционный континуум в реакции хозяина на патогены. Микроб-хозяин клетки 25 , 13–26 (2019).
КАС пабмед Статья Google ученый
Ridker, P. M. et al. Противовоспалительная терапия канакинумабом при атеросклеротическом заболевании. Н. англ. Дж. Мед. 377 , 1119–1131 (2017).
КАС пабмед Статья Google ученый
Домингес-Андрес, Х.и другие. Ингибитор бромодомена I-BET151 подавляет иммунные ответы при грибково-иммунном взаимодействии. евро. Дж. Иммунол. 49 , 2044–2050 (2019).
ПабМед ПабМед Центральный Статья КАС Google ученый
Alqahtani, A. et al. Ингибиторы бромодомена и экстратерминального мотива: обзор доклинических и клинических достижений в терапии рака. Будущая наука. ОА 5 , ФСО372 (2019).
ПабМед ПабМед Центральный Статья КАС Google ученый
Врожденный и адаптивный иммунитет | Технологические сети
Организмы должны постоянно защищать себя от вреда, причиняемого патогенами, такими как вирусы и бактерии. Иммунная система обеспечивает эту защиту многочисленными путями. Иммунный ответ подразделяется на врожденный иммунитет, с которым организм рождается, и адаптивный иммунитет, который организм приобретает после воздействия болезни.
Определение иммунитета
Иммунитет определяется как способность организма защищать себя от патогена или токсина.
Что такое врожденный иммунитет?
Врожденный иммунитет, также известный как генетический или естественный иммунитет, — это иммунитет, с которым человек рождается. Этот тип иммунитета заложен в генах и обеспечивает пожизненную защиту. Врожденный иммунный ответ является быстродействующим и неспецифическим, что означает, что он не реагирует по-разному в зависимости от конкретного вируса или бактерии, которые он обнаруживает.
Врожденная иммунная система включает физические барьеры, а также химическую и клеточную защиту.
- Физические барьеры защищают тело от вторжения. К ним относятся такие вещи, как кожа и ресницы.
- Химические барьеры представляют собой защитные механизмы, способные уничтожить вредоносные агенты. Примеры включают слезы, слизь и желудочную кислоту.
- Клеточная защита врожденного иммунного ответа неспецифична. Эта клеточная защита идентифицирует патогены и вещества, которые потенциально опасны, и предпринимает шаги для их нейтрализации или уничтожения.
Другой способ классифицировать компоненты врожденной реакции — это внешние защитные механизмы , такие как кожа и слезы, и внутренние защитные механизмы , такие как желудочная кислота и клеточные защитные механизмы. Внешняя защита обеспечивает первую линию защиты от патогенов, а внутренняя защита обеспечивает вторую линию защиты.
Сравнение врожденного и адаптивного иммунитета
Что такое адаптивный иммунитет?
Адаптивный иммунитет – приобретенный иммунитет организма к определенному патогену.Таким образом, его также называют приобретенным иммунитетом. Адаптивный иммунитет не является мгновенным и не всегда сохраняется на протяжении всей жизни организма, хотя и может. Адаптивный иммунный ответ характеризуется клональной экспансией Т- и В-лимфоцитов, высвобождающей множество копий антител для нейтрализации или уничтожения антигена-мишени.
Когда организм впервые сталкивается с новым возбудителем болезни, его ответ известен как первичный иммунный ответ. Когда В-лимфоциты или В-клетки сталкиваются с новым антигеном, они создают антитела, специфичные к этому антигену, предназначенные для его уничтожения или нейтрализации.
Одновременно В-клетки создают клетки памяти, представляющие собой тип В-клеток, которые выживают десятилетиями и могут обнаруживать патоген при последующем воздействии.
В первый раз организму требуется время для выработки антиген-специфических антител, поэтому этот ответ длится дольше, чем последующие ответы. Если организм сталкивается с одним и тем же патогеном во второй раз, ответ иммунной системы будет быстрее и сильнее, чем первичный иммунный ответ. Эта повышенная скорость достигается благодаря ячейкам памяти.
Приведенное выше описание адаптивного иммунитета описывает активный иммунитет, то есть иммунитет, возникающий после воздействия патогена. Другой тип адаптивного иммунитета — пассивный иммунитет. Пассивный иммунитет возникает, когда организм получает внешние антитела, защищающие от болезни. Эта защита может передаваться от матери к ребенку через плаценту или через грудное молоко, или путем инъекции для защиты от определенного заболевания.
Таблица врожденного и адаптивного иммунитета
В следующей таблице приведены основные различия между врожденным и адаптивным иммунитетом.
| | ||
| сразу | со временем | |
| не специфический | Удельное | |
| Типы |
|
|
| Также известен как | Естественный иммунитет; Генетический иммунитет | приобретенный иммунитет |
| LifeLong | Краткосрочный, долгосрочный, LifeLong |
Какие клетки участвуют в врожденном и адаптивном иммунитете?
Существует много типов клеток, участвующих в иммунитете.Во врожденном иммунном ответе к ним относятся макрофаги, нейтрофилы, эозинофилы, базофилы, тучные клетки и дендритные клетки. Клетки, участвующие в адаптивном иммунном ответе, включают В-клетки (или В-лимфоциты) и различные Т-клетки (или Т-лимфоциты), включая Т-хелперы и Т-супрессоры. Т-клетки естественных киллеров и гамма-дельта Т-клетки являются частью как врожденного, так и адаптивного иммунного ответа.
Роль иммунологической памяти
Иммунологическая память определяется как «способность иммунной системы более быстро и эффективно реагировать на ранее встречавшийся патоген.Клетки памяти должны благодарить организм за способность распознавать болезнетворные агенты, с которыми организм ранее контактировал.
Именно благодаря иммунологической памяти мы можем делать прививки от инфекционных заболеваний. Как только организм вырабатывает антитела, необходимые для подавления патогена, он может сделать это быстрее, когда снова столкнется с патогеном в будущем. Это верно независимо от того, заразились ли вы болезнью или получили ослабленную или мертвую форму болезни с помощью вакцины.
Разница между специфическим и неспецифическим иммунитетом
Специфический иммунитет — это иммунный ответ, генерируемый против определенного антигена с использованием продукции антител, в то время как неспецифический иммунитет — это начальный иммунный ответ против широкого спектра чужеродных антигенов с использованием неспецифических антител и иммунных клеток. В этом ключевое различие между специфическим и неспецифическим иммунитетом.
Иммунный ответ представляет собой сложную серию механизмов, которые действуют против инвазий вредоносных микроорганизмов.Без этой защиты организм уязвим для целого ряда инфекций. Кроме того, иммунитет можно разделить на две части: специфический и неспецифический иммунитет.
СОДЕРЖАНИЕ
1. Обзор и ключевые отличия
2. Что такое неспецифический иммунитет
3. Что такое специфический иммунитет
4. Сходства между специфическим и неспецифическим иммунитетом
5. Прямые сравнения – специфический и неспецифический иммунитет в табличной форме
6. Резюме
Что такое неспецифический иммунитет?
Неспецифический иммунитет, как следует из названия, не специфичен для определенной группы микроорганизмов.Эти защитные механизмы действуют против каждого захватчика тела. Очень важно понимать, что этот неспецифический иммунный ответ настолько силен, что лишь незначительное количество инфекций проникает через эту первую линию защиты.
Кожа – первый барьер и первый механизм неспецифической защиты. Кожа представляет собой многослойную структуру, которая содержит мертвые клетки на внешней поверхности и живые клетки в более глубоких слоях. Таким образом, многие организмы не могут преодолеть этот физический барьер.Клетки кожи образуются путем деления клеток в глубоком базальном слое. Когда клетки достигают внешней поверхности, они теряют свою жизненную силу и, наконец, отделяются и осыпаются. Эта внешняя миграция клеток действует против притока инвазивных организмов. Кожа содержит различные железы. Сальные железы выделяют кожное сало, обладающее антибактериальными свойствами. Кроме того, пот смывает инфекции, поскольку высокое содержание солей в поте высушивает микроорганизмы.
Рисунок 01: Неспецифический иммунитет – кожа
Слезы и слюна — это выделения, которые постоянно омывают роговицу и полость рта.Многие эпителиальные поверхности тела содержат реснички. Эти реснички ритмично бьются, транспортируя вещество из тела (респираторный эпителий). Слюна обладает антибактериальными свойствами благодаря лизоцимам. Некоторые эпителии выделяют слизь, которая также действует как барьер против инфекций. Если и когда микроорганизмы проникают в эти защитные системы, они встречаются с лимфоцитами, макрофагами, которые неспецифически фагоцитируют инородные тела. Это может привести или не привести к возникновению специфического иммунного ответа.
Что такое специфический иммунитет?
Когда инородное вещество фагоцитируется макрофагом, лейкоцитом или антигенпрезентирующей клеткой, оно обрабатывается внутри клетки-хозяина. Существуют антигенсвязывающие рецепторы, называемые главными комплексами гистосовместимости (MHC типа 1 и 2). MHC 1 сшивается с лимфоцитами типа CD8, тогда как MHC 2 сшивается с лимфоцитами типа CD4. Существуют огромные различия между антигенными рецепторами как в Т-клетках, так и в В-клетках. CD4 Т-лимфоциты активируются этой перекрестной связью с рецепторами и продуцируют цитокины, которые способствуют пролиферации выбранных лимфоцитов, образованию новых лимфоцитов с выбранными типами рецепторов и активации В-клеток с образованием антител.Кульминацией этих механизмов является уничтожение ранее фагоцитированных чужеродных организмов.
Рисунок 02: Специфический иммунитет
CD8 Т-лимфоциты активируются за счет перекрестного связывания рецепторов и продуцируют вещества, высокотоксичные для чужеродных микроорганизмов. Чтобы быть конкретным, специфический иммунный ответ возникает в двух отдельных случаях. Когда микроорганизм впервые попадает в организм, реакция немного задерживается до тех пор, пока все эти вышеупомянутые процессы не пройдут до такой степени, что какой-либо эффект будет заметен.Это называется основным ответом . Образующийся иммуноглобулин представляет собой IgM. Первичная реакция имеет меньшую величину, чем вторичная реакция. После первичного ответа некоторые Т- и В-клетки превращаются в клетки памяти. Эти ячейки действуют как ярлык; при повторном попадании антигена в организм все начальные этапы пропускаются. Этот вторичный ответ намного больше и намного быстрее. Основным иммуноглобулином является IgG.
Каковы сходства между специфическим и неспецифическим иммунитетом?
- Специфический и неспецифический иммунитет представляют собой два типа иммунных реакций.
- Оба действуют против чужеродных антигенов.
- Обе системы защищают организм от чужеродных микроорганизмов.
В чем разница между специфическим и неспецифическим иммунитетом?
Неспецифический иммунитет представляет собой набор защит, эффективных против всех захватчиков, в то время как специфический иммунитет представляет собой высоко сфокусированный и целенаправленный ответ. Неспецифический иммунитет является первой линией защиты, тогда как специфический иммунитет является второй линией защиты. Более того, неспецифический иммунитет включает эффекторные клетки, такие как лейкоциты и макрофаги, в то время как специфический иммунный ответ включает такие клетки, как лимфоциты, антигенпрезентирующие клетки и клетки памяти.Самое главное, что неспецифический иммунитет не формирует защитную память, в отличие от специфического иммунитета.
Резюме— Специфический и неспецифический иммунитет
Иммунитетподразделяется на два типа; Специфический или неспецифический иммунитет. Специфический иммунитет – это выработка антител против определенного антигена. Неспецифический иммунитет, с другой стороны, представляет собой иммунитет, направленный против всех типов антигенов без выбора определенного типа. Специфический иммунитет возникает через лимфоциты; Т-клетки и В-клетки, антитела, в то время как неспецифический иммунитет возникает во многих отношениях, таких как воспаление, лихорадка, кожа, слизистая оболочка, фагоцитирующие лейкоциты, антимикробные вещества и т.

 D
D 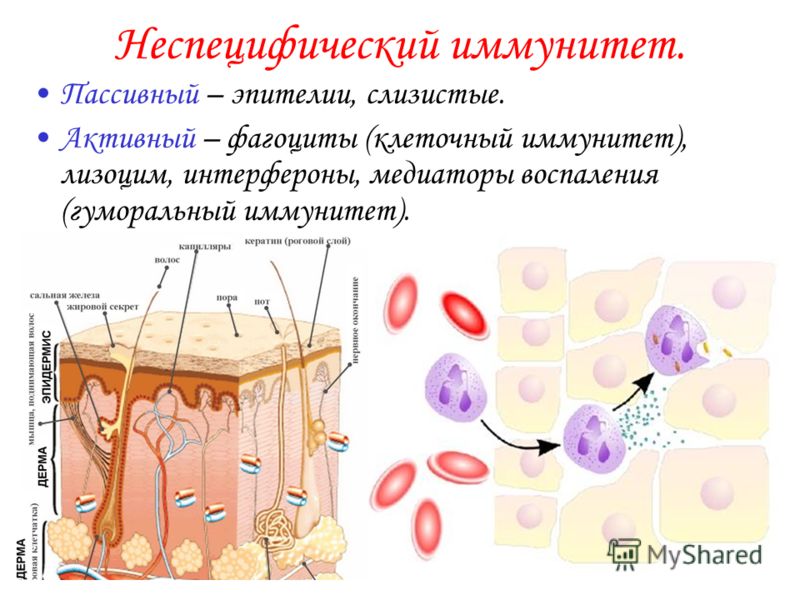 Это наша иммунная система
что позволяет нам противостоять инфекциям. Иммунная система состоит из
два основных подразделения: врожденная или неспецифическая иммунная система и
адаптивная или специфическая иммунная система (рис. 1). Врожденная иммунная система
наша первая линия защиты от вторжения организмов, в то время как
адаптивная иммунная система действует как вторая линия защиты, а также обеспечивает
защита от повторного контакта с тем же возбудителем. Каждый из основных
Подразделения иммунной системы представлены как клеточными, так и
гуморальный
компоненты, с помощью которых они выполняют свою защитную функцию (рис. 1).Кроме того, врожденная иммунная система также имеет анатомические особенности, которые
выполняют функцию барьера для инфекции. Хотя эти два плеча иммунной
системы имеют разные функции, между этими системами существует взаимодействие
(т.е. компоненты врожденной иммунной системы влияют на адаптивную
иммунной системы и наоборот).
Это наша иммунная система
что позволяет нам противостоять инфекциям. Иммунная система состоит из
два основных подразделения: врожденная или неспецифическая иммунная система и
адаптивная или специфическая иммунная система (рис. 1). Врожденная иммунная система
наша первая линия защиты от вторжения организмов, в то время как
адаптивная иммунная система действует как вторая линия защиты, а также обеспечивает
защита от повторного контакта с тем же возбудителем. Каждый из основных
Подразделения иммунной системы представлены как клеточными, так и
гуморальный
компоненты, с помощью которых они выполняют свою защитную функцию (рис. 1).Кроме того, врожденная иммунная система также имеет анатомические особенности, которые
выполняют функцию барьера для инфекции. Хотя эти два плеча иммунной
системы имеют разные функции, между этими системами существует взаимодействие
(т.е. компоненты врожденной иммунной системы влияют на адаптивную
иммунной системы и наоборот). То
адаптивной иммунной системе требуется некоторое время, чтобы отреагировать на вторжение
организма, тогда как врожденная иммунная система включает защитные механизмы,
большая часть постоянно присутствуют и готовы к мобилизации
инфекционное заболевание.Во-вторых, адаптивная иммунная система является антигенспецифичной и
реагирует только с организмом, вызвавшим реакцию. Напротив,
врожденная система не является антигенспецифичной и одинаково хорошо реагирует на
разнообразие организмов. Наконец, адаптивная иммунная система демонстрирует
иммунологическая память. Он помнит, что столкнулся с вторжением
организма и быстрее реагирует на последующее воздействие того же
организм. Напротив, врожденная иммунная система не демонстрирует
иммунологическая память.
То
адаптивной иммунной системе требуется некоторое время, чтобы отреагировать на вторжение
организма, тогда как врожденная иммунная система включает защитные механизмы,
большая часть постоянно присутствуют и готовы к мобилизации
инфекционное заболевание.Во-вторых, адаптивная иммунная система является антигенспецифичной и
реагирует только с организмом, вызвавшим реакцию. Напротив,
врожденная система не является антигенспецифичной и одинаково хорошо реагирует на
разнообразие организмов. Наконец, адаптивная иммунная система демонстрирует
иммунологическая память. Он помнит, что столкнулся с вторжением
организма и быстрее реагирует на последующее воздействие того же
организм. Напротив, врожденная иммунная система не демонстрирует
иммунологическая память.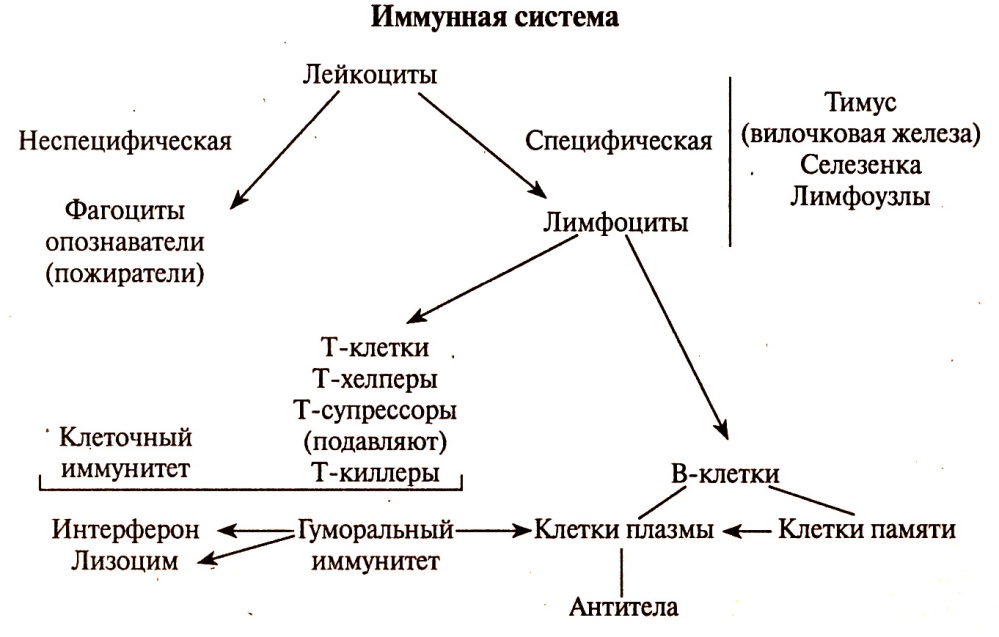 3). Миелоидная клетка-предшественник (стволовая) в кости
костный мозг дает эритроциты, тромбоциты, нейтрофилы, моноциты/макрофаги
и дендритные клетки, тогда как лимфоидная клетка-предшественник (стволовая) дает
поднимаются до NK, Т-клеток и В-клеток.Для развития Т-клеток
Т-клетки-предшественники должны мигрировать в тимус, где они подвергаются
дифференцировка на два различных типа Т-клеток, CD4+ Т-хелперы
клетка и прецитотоксическая Т-клетка CD8+. Два типа Т-хелперов
продуцируются в тимусе клетками Th2, которые помогают прецитотоксическим CD8+
клетки дифференцироваться в цитотоксические Т-клетки и клетки Th3, которые помогают
В-клетки дифференцируются в плазматические клетки, которые секретируют антитела.
3). Миелоидная клетка-предшественник (стволовая) в кости
костный мозг дает эритроциты, тромбоциты, нейтрофилы, моноциты/макрофаги
и дендритные клетки, тогда как лимфоидная клетка-предшественник (стволовая) дает
поднимаются до NK, Т-клеток и В-клеток.Для развития Т-клеток
Т-клетки-предшественники должны мигрировать в тимус, где они подвергаются
дифференцировка на два различных типа Т-клеток, CD4+ Т-хелперы
клетка и прецитотоксическая Т-клетка CD8+. Два типа Т-хелперов
продуцируются в тимусе клетками Th2, которые помогают прецитотоксическим CD8+
клетки дифференцироваться в цитотоксические Т-клетки и клетки Th3, которые помогают
В-клетки дифференцируются в плазматические клетки, которые секретируют антитела. Важно помнить, что инфекция
с организмом не обязательно означает болезни, так как иммунная
система в большинстве случаев сможет ликвидировать инфекцию раньше
возникает болезнь.Заболевание возникает только тогда, когда болюс инфекции высок,
когда вирулентность инвазивного организма велика или когда иммунитет
скомпрометирован. Хотя иммунная система, по большей части,
положительные эффекты, могут быть и вредные. В течение
воспаление, которое является ответом на вторжение организма, может
быть локальным дискомфортом и побочным повреждением здоровых тканей в результате
токсических продуктов, образующихся в результате иммунного ответа. Кроме того, в
в некоторых случаях иммунный ответ может быть направлен на собственные ткани
приводит к аутоиммунным заболеваниям.
Важно помнить, что инфекция
с организмом не обязательно означает болезни, так как иммунная
система в большинстве случаев сможет ликвидировать инфекцию раньше
возникает болезнь.Заболевание возникает только тогда, когда болюс инфекции высок,
когда вирулентность инвазивного организма велика или когда иммунитет
скомпрометирован. Хотя иммунная система, по большей части,
положительные эффекты, могут быть и вредные. В течение
воспаление, которое является ответом на вторжение организма, может
быть локальным дискомфортом и побочным повреждением здоровых тканей в результате
токсических продуктов, образующихся в результате иммунного ответа. Кроме того, в
в некоторых случаях иммунный ответ может быть направлен на собственные ткани
приводит к аутоиммунным заболеваниям. Среди
механические анатомические барьеры — это кожа и внутренние эпителиальные слои,
движения кишечника и осцилляции
бронхолегочного
реснички. С этими защитными поверхностями связаны
химические и биологические агенты.
Среди
механические анатомические барьеры — это кожа и внутренние эпителиальные слои,
движения кишечника и осцилляции
бронхолегочного
реснички. С этими защитными поверхностями связаны
химические и биологические агенты.

 Некоторые продукты компании
система свертывания может способствовать неспецифической защите из-за
их способность повышать проницаемость сосудов и действовать как
хемотаксические агенты для фагоцитирующих клеток.Кроме того, некоторые из
продукты свертывающей системы являются непосредственно антимикробными. Например,
бета-лизин, белок, вырабатываемый тромбоцитами во время коагуляции, может лизировать многие
Грамположительные бактерии, действуя как катионный детергент.
Некоторые продукты компании
система свертывания может способствовать неспецифической защите из-за
их способность повышать проницаемость сосудов и действовать как
хемотаксические агенты для фагоцитирующих клеток.Кроме того, некоторые из
продукты свертывающей системы являются непосредственно антимикробными. Например,
бета-лизин, белок, вырабатываемый тромбоцитами во время коагуляции, может лизировать многие
Грамположительные бактерии, действуя как катионный детергент.
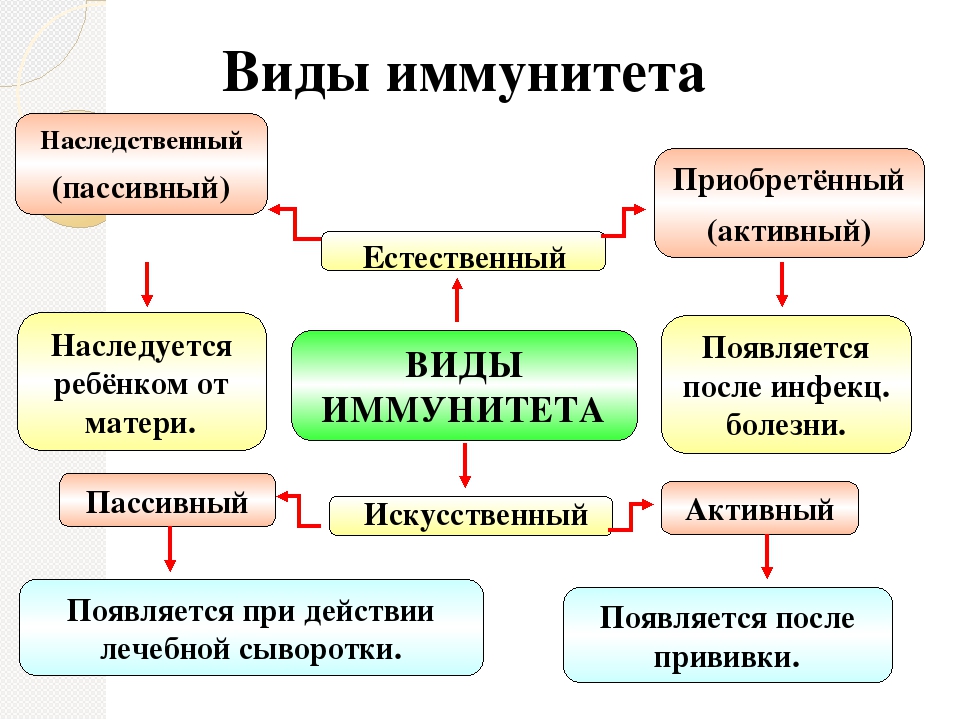 Физико-химические барьеры для инфекций
Физико-химические барьеры для инфекций  Эти клетки являются основной линией защиты в
система неспецифического иммунитета.
Эти клетки являются основной линией защиты в
система неспецифического иммунитета. Эти клетки
не являются частью воспалительной реакции, но важны при неспецифических
иммунитет к вирусным инфекциям и надзор за опухолями.
Эти клетки
не являются частью воспалительной реакции, но важны при неспецифических
иммунитет к вирусным инфекциям и надзор за опухолями.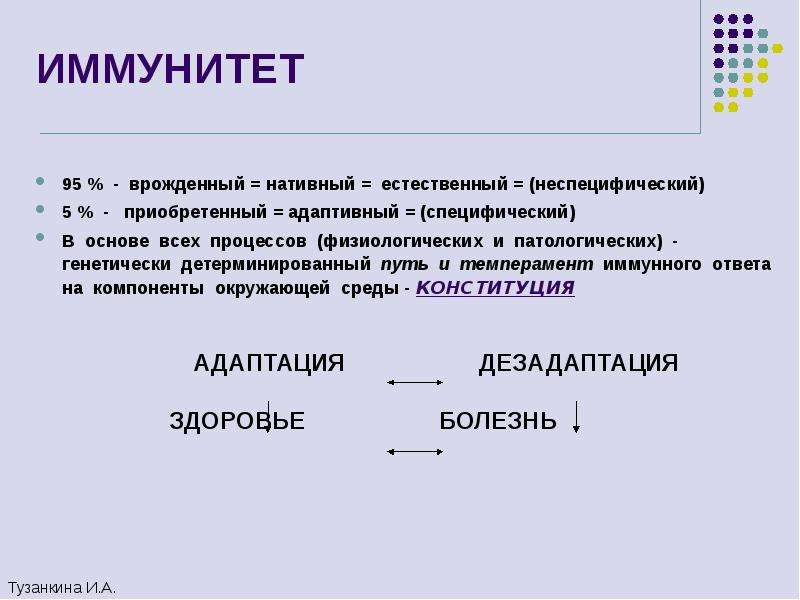 Второй тип гранул, обнаруживаемый в более зрелых PMN, представляет собой
вторичная или специфическая гранула.Они содержат лизоцим, НАДФН-оксидазу.
компоненты, участвующие в образовании токсичных продуктов кислорода, и
характерен лактоферрин, белок, хелатирующий железо и связывающий B12
белок.
Второй тип гранул, обнаруживаемый в более зрелых PMN, представляет собой
вторичная или специфическая гранула.Они содержат лизоцим, НАДФН-оксидазу.
компоненты, участвующие в образовании токсичных продуктов кислорода, и
характерен лактоферрин, белок, хелатирующий железо и связывающий B12
белок. Некоторые сигналы SOS
стимулировать эндотелиальные клетки вблизи места инфекции для экспрессии клеток
молекулы адгезии, такие как ICAM-1 и селектины, которые связываются с компонентами на
поверхности фагоцитирующих клеток и заставляют фагоциты прикрепляться к
эндотелий.Вазодилататоры, вырабатываемые в очаге инфекции, вызывают
между эндотелиальными клетками разрыхляется, и фагоциты затем пересекают
эндотелиальный барьер путем сдавливания между эндотелиальными клетками в процессе
называется
диапедез (рис. 9). Попадая в тканевые пространства, некоторые сигналы SOS
привлекать фагоциты к очагу инфекции путем хемотаксиса (движения к
увеличивающийся химический градиент). Сигналы SOS также активируют фагоциты,
что приводит к усилению фагоцитоза и внутриклеточной гибели
вторгающиеся организмы.
Некоторые сигналы SOS
стимулировать эндотелиальные клетки вблизи места инфекции для экспрессии клеток
молекулы адгезии, такие как ICAM-1 и селектины, которые связываются с компонентами на
поверхности фагоцитирующих клеток и заставляют фагоциты прикрепляться к
эндотелий.Вазодилататоры, вырабатываемые в очаге инфекции, вызывают
между эндотелиальными клетками разрыхляется, и фагоциты затем пересекают
эндотелиальный барьер путем сдавливания между эндотелиальными клетками в процессе
называется
диапедез (рис. 9). Попадая в тканевые пространства, некоторые сигналы SOS
привлекать фагоциты к очагу инфекции путем хемотаксиса (движения к
увеличивающийся химический градиент). Сигналы SOS также активируют фагоциты,
что приводит к усилению фагоцитоза и внутриклеточной гибели
вторгающиеся организмы.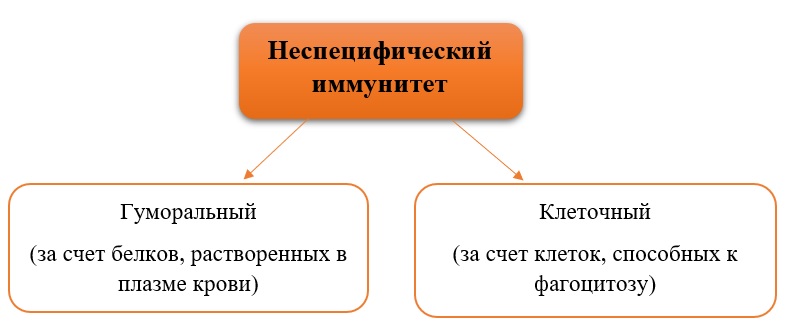 10)
10)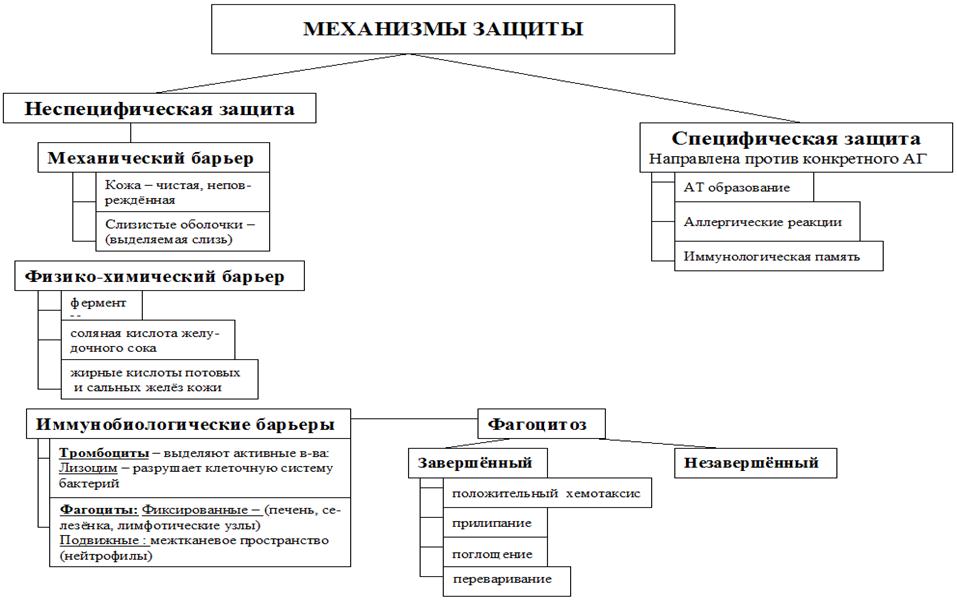 Связывание инфекционных агентов через Toll-like
рецепторов приводит к фагоцитозу и высвобождению воспалительных
цитокины (ИЛ-1, ФНО-альфа и ИЛ-6) фагоцитами.
Связывание инфекционных агентов через Toll-like
рецепторов приводит к фагоцитозу и высвобождению воспалительных
цитокины (ИЛ-1, ФНО-альфа и ИЛ-6) фагоцитами. Респираторный взрыв: кислородозависимый,
миелопероксидазонезависимый
реакции
Респираторный взрыв: кислородозависимый,
миелопероксидазонезависимый
реакции Цитохром В, который
часть специфической гранулы соединяется с НАДФН-оксидазой плазматической мембраны
и активирует его. Активированная НАДФН-оксидаза использует кислород для окисления
НАДФН. В результате образуется супероксид-анион. Несколько из
супероксид-анион превращается в h3O2 и синглетный кислород с помощью супероксида
дисмутаза. Кроме того, супероксид-анион может реагировать с h3O2, приводя к
образование гидроксильного радикала и большего количества синглетного кислорода. Результат всего
одной из этих реакций является образование токсичных соединений кислорода
супероксид-анион (O 2 -), H 2 O 2 , синглет
кислород ( 1 O2) и гидроксильный радикал (ОН).
Цитохром В, который
часть специфической гранулы соединяется с НАДФН-оксидазой плазматической мембраны
и активирует его. Активированная НАДФН-оксидаза использует кислород для окисления
НАДФН. В результате образуется супероксид-анион. Несколько из
супероксид-анион превращается в h3O2 и синглетный кислород с помощью супероксида
дисмутаза. Кроме того, супероксид-анион может реагировать с h3O2, приводя к
образование гидроксильного радикала и большего количества синглетного кислорода. Результат всего
одной из этих реакций является образование токсичных соединений кислорода
супероксид-анион (O 2 -), H 2 O 2 , синглет
кислород ( 1 O2) и гидроксильный радикал (ОН). Некоторые гипохлориты могут
самопроизвольно распадаются с образованием синглетного кислорода. Результат этих
реакциями является образование токсичного гипохлорита (OCl-) и синглетного кислорода
( 1 О2).
Некоторые гипохлориты могут
самопроизвольно распадаются с образованием синглетного кислорода. Результат этих
реакциями является образование токсичного гипохлорита (OCl-) и синглетного кислорода
( 1 О2). Таким образом, даже пациенты с дефектами
кислородозависимые пути уничтожения способны убивать бактерии. Однако, поскольку
кислородозависимые механизмы намного эффективнее убивают пациентов
с дефектами в этих путях более восприимчивы и становятся более серьезными
инфекции.
Таким образом, даже пациенты с дефектами
кислородозависимые пути уничтожения способны убивать бактерии. Однако, поскольку
кислородозависимые механизмы намного эффективнее убивают пациентов
с дефектами в этих путях более восприимчивы и становятся более серьезными
инфекции.  12).Если клетка также подвергается воздействию гамма-интерферона (ИФН-гамма)
будет производиться дополнительный оксид азота (рис. 12). Оксид азота
высвобождаемый клеткой токсичен и может убить находящиеся поблизости микроорганизмы.
макрофага.
12).Если клетка также подвергается воздействию гамма-интерферона (ИФН-гамма)
будет производиться дополнительный оксид азота (рис. 12). Оксид азота
высвобождаемый клеткой токсичен и может убить находящиеся поблизости микроорганизмы.
макрофага. NK-клетки можно идентифицировать по
наличие CD56 и CD16 и отсутствие маркеров клеточной поверхности CD3. NK-клетки
способны убивать инфицированные вирусом и злокачественные клетки-мишени, но они
относительно неэффективен в этом.Однако при воздействии ИЛ-2 и ИФН-гамма
NK-клетки становятся лимфокин-активируемыми киллерами (LAK), которые способны
убивают злокачественные клетки. Продолжительное воздействие ИЛ-2 и ИФН-гамма позволяет
LAK-клетки для уничтожения трансформированных, а также злокачественных клеток. LAK-клеточная терапия
один из подходов к лечению злокачественных новообразований.
NK-клетки можно идентифицировать по
наличие CD56 и CD16 и отсутствие маркеров клеточной поверхности CD3. NK-клетки
способны убивать инфицированные вирусом и злокачественные клетки-мишени, но они
относительно неэффективен в этом.Однако при воздействии ИЛ-2 и ИФН-гамма
NK-клетки становятся лимфокин-активируемыми киллерами (LAK), которые способны
убивают злокачественные клетки. Продолжительное воздействие ИЛ-2 и ИФН-гамма позволяет
LAK-клетки для уничтожения трансформированных, а также злокачественных клеток. LAK-клеточная терапия
один из подходов к лечению злокачественных новообразований. То
лиганды для KIR представляют собой молекулы MHC класса I. Таким образом, если клетка-мишень экспрессирует
Молекулы MHC класса I не будут уничтожены клетками NK или LAK, даже если
target также имеет KAL, который может связываться с KAR. Нормальные клетки конститутивно
экспрессируют молекулы MHC класса I на своей поверхности, однако инфицированные вирусом и
злокачественные клетки снижают экспрессию MHC класса I.Таким образом, NK- и LAK-клетки
избирательно уничтожают инфицированные вирусом и злокачественные клетки, сохраняя при этом нормальные клетки.
То
лиганды для KIR представляют собой молекулы MHC класса I. Таким образом, если клетка-мишень экспрессирует
Молекулы MHC класса I не будут уничтожены клетками NK или LAK, даже если
target также имеет KAL, который может связываться с KAR. Нормальные клетки конститутивно
экспрессируют молекулы MHC класса I на своей поверхности, однако инфицированные вирусом и
злокачественные клетки снижают экспрессию MHC класса I.Таким образом, NK- и LAK-клетки
избирательно уничтожают инфицированные вирусом и злокачественные клетки, сохраняя при этом нормальные клетки. Клетки-киллеры, имеющие Fc-рецепторы, включают NK, LAK и макрофаги.
которые имеют Fc-рецептор для антител IgG и эозинофилов, которые имеют Fc
рецептор для антител IgE.
Клетки-киллеры, имеющие Fc-рецепторы, включают NK, LAK и макрофаги.
которые имеют Fc-рецептор для антител IgG и эозинофилов, которые имеют Fc
рецептор для антител IgE. Влияние гуморальных компонентов, таких как интерферон,
ФНО,
Ил-2, комплектация и т.д.на клеточные компоненты неспецифического иммунитета
система
Влияние гуморальных компонентов, таких как интерферон,
ФНО,
Ил-2, комплектация и т.д.на клеточные компоненты неспецифического иммунитета
система