Гликозилированные белки | Про Анализы
Гликозилирование (гликирование) белков — это процесс неферментативного присоединения углеводной молекулы (обычно глюкозы) к белку. В отличие от гликопротеидов, которые образуются ферментативным путем в ходе биосинтеза сложного протеида, гликозилированные белки формируются посттранслюционно, в процессе биологической жизни белка.
Наибольшее внимание в последние годы уделяется изучению процессов гликозилирования белков эритроцитов (гемоглобин — гликированный гемоглобина) и плазмы крови, которые начали использоваться как специфические маркеры в диагностике сахарного диабета.
Исследование процессов гликозилирования белков позволило также более глубоко осмыслить патогенез тяжелых метаболических нарушений, сопровождающих сахарный диабет.
У здоровых людей процент гликозилированных белков плазмы и эритроцитов невысокий. Гликозилирование гамма-глобулинов и гемоглобина чуть больше 5%, альбумина — не выше 2%, других белков плазмы — практически не определяется.
По химической природе процесс гликозилирования представляет собой неферментативное присоединение моносахарида преимущественно к аминогруппе лизиновых остатков или первичным аминогруппам N-терминальных аминокислот белка. Этот процесс является многостадийным. На первом этапе, так называемой «быстрой стадии», происходит быстрое и обратимое формирование лабильного промежуточного Шиффова основания, содержащего альдиминовую группировку. В дальнейшем, в ходе «медленной стадии» необратимой перегруппировки Амадори образуется стабильное кетаминовое соединение.
Степень гликозилирования зависит от суммарной концентрации глюкозы и других моносахаридов в определенный промежуток времени, от периода полужизни белка, наличия собственных углеводных остатков в его структуре и основности белка. Стойкая гипергликемия — повышенный уровень глюкозы в крови, приводит к увеличению количества гликозилированных белков в несколько раз по сравнению с нормой.
Белки с большим периодом полужизни больше гликозилированы. Чем больше в составе протеида структурных углеводов, тем меньше они подвержены гликозилированию. Более основные белки (гамма-глобулины) сильнее гликозилированы, а более кислые (альфа-1-глобулины) — слабо. Исключением является кислый альбумин, который, тем не менее, наиболее интенсивно подвергается гликозилированию.
Первым из обнаруженных у человека, гликозилированных белков был гемоглобин (1955 г.). В эритроцитах взрослого здорового человека функционируют несколько типов гемоглобина. Более 90% от их количества представлено гемоглобином А (HbА). Его белковая часть состоит из двух альфа- и двух бета-полипептидных цепей.
Гликозилирование происходит по выше приведенной схеме за счет неферментативного присоединения глюкозы к аминогруппе концевой аминокислоты валина бета-цепей. При этом образующиеся формы гликозилированного гемоглобина (HbА1а + HbА1b + HbА1c) составляют в совокупности
Следующим по счету из обнаруженных гликозилированных белков был «фруктозамин». Этим термином обозначается группа гликозилированных белков плазмы крови, большую часть среди которых составляет альбумин (60%). По данным исследователей фруктозамин циркулирует в кровяном русле 2-3 недели, что соответствует времени жизни плазменного альбумина. Также как и гликированный гемоглобин, фруктозамин служит интегральным показателем для характеристики гипергликемии, но за более короткий период — до 3 недель.
Концентрация в крови гликированного гемоглобина и фруктозамина не подвержена в отличие от глюкозы случайным и суточным колебаниям.
Гликозилирование белков приводит к структурным изменениям их молекул. В следствие чего могут изменяться их функции. Гликозилированные формы гемоглобина приобретают большее сродство к кислороду и труднее отдают его тканям, что приводит к состояниям гипоксии и нарушению метаболизма в тканях.
Гликозилирование структурных и транспортных белков ведет к функциональным и морфологическим поражениям (клубочкового аппарата нефрона почек и приводит к развитию диабетической нефропатии; изменениям в сетчатке глаза с развитием ретинопатии; помутнению хрусталика глаза и развитию катаракты). Гликозилирование апо-белков липопротеидов вызывает ускорение атеросклетротического поражения сосудов. Гликозилирование фибриногена и антитромбина III ведет к активированию процессов тромбообразования у больных сахарным диабетом.
SENS-Диагностика. Биомаркеры гликирования белков / Хабр
Разработка терапии старения невозможна без достоверной диагностики старения. Не представляется разумным ожидание смерти человека или наступление смертельно опасного заболевания, чтобы понять: замедлили мы старение или нет, той или иной, терапией. Мы должны сразу видеть объективную картину, вызванными нашими интервенциями против старения.В клинической практике пока не существует «большой диагностики старения». То есть, нет возможности у пациента и лечащего врача детектировать возрастные изменения на молекулярном уровне, предшествующие наступлению заболеваний. Мы хотим устранить этот пробел, прежде всего описав все основные маркеры возрастных изменения и доступный технологический уровень для их измерения.
Мы продолжим изложение концепции SENS-диагностики старения, исходя из того, что на сегодняшний день программа SENS (достижение пренебрежимого старения инженерными методами) наиболее полно описывает подходы по увеличению продолжительности жизни человека.
Многие слышали о гликозилировании белков, конечных продуктах гликирования (КПГ, AGE) и о вреде, который они наносят организму. Но, следует отметить, что присоединение сахаров к другим молекулам – это далеко не всегда патология. Само гликозилирование является очень распространённым и важным физиологичным процессом в живых организмах. Так, значительная часть всех белков, синтезируемых в клетках, подвергаются ферментативному гликозилированию, что необходимо для их нормального функционирования.
В основном в гликозилировании участвуют два гликана (углеводной части связки углевод-органическая молекула): N-гликаны (связанные с амидной группой аспарагина) и О-гликаны (связанные с гидроксильной группой серина или треонина). В связи со старением нас больше интересуют N-гликаны. Описано, что при старении меняется спектр сахарных цепочек, которые присоединяются к иммунным белкам при N-гликозилировании. И такое изменение играет одну из ключевых ролей в возрастном повышении общего воспаления в организме. Так, уровень гликозилированных антител IgG может предсказывать биологический возраст человека даже более точно, чем длина теломер [1].
Кроме этого, ещё два гликана, NGA2F и N2AF, показали себя перспективными биомаркерами старения. В рамках программы европейского исследования биомаркеров старения MARK–AGE, завершившейся в 2013 году, был разработан тест GlycoAgeTest, определяющий биологический возраст человека. В его основе – соотношение количества гликанов NGA2F (повышающихся с возрастом) и N2AF (уровень которых с возрастом понижается). Ещё одним потенциальным биомаркером старения и возраст-зависимых заболеваний (сердечно-сосудистых и диабета), описанным в рамках исследования MARK–AGE, стал гликопротеин кластерин, который участвует в стабилизации белковых структур [2].
Перейдём теперь к рассмотрению патологической части этого явления. Кроме регулируемого организмом ферментативного гликозилирования существует неферментативная форма этого процесса, т.н. реакция Майяра, результатом которой становится появление в организме разнообразных продуктов гликирования. Следует отметить, что процесс неферментатиивного гликозилирования практически не регулируется. Хотя есть возможность «сдерживания» гликозилирования через трансгликацию, при которой в «расход» идут глутатион, полиамины, тиолы, свободные аминокислоты, например, таурин, лизин. А также через инактивацию метилглиоксаля глиоксалазной системой: глиоксалаза I превращает метилглиоксаль и восстановленный глутатион в лактоилглутатион, который далее метаболизируется в D-лактат под действием глиоксалазы II.
Структура метилглиоксаля
Среди продуктов гликирования выделяют ранние (продукты Амадори) и поздние (или конечные) продукты гликирования. Неферментативное гликозилирование происходит в несколько этапов. Начинается этот процесс с того, что глюкоза и другие простые сахара соединяются с аминогруппой и запускают цепь дальнейших реакций. В начале в ходе реакции между альдегидной группой сахаров и аминогруппой образуется нестабильная альдиминовая группировка (основания Шиффа), которая может превращаться в ряд других, более стабильных соединений, ранних продуктов гликозилирования, т.н. продуктов Амадори. Одним из ранних продуктов присоединения глюкозы к белку является Nе–фруктозил–лизин, который, деградируя, в свою очередь, образует различные конечные продукты гликирования (КПГ). В наибольшем количестве в качестве КПГ образуются гидроимидазолоны, производные остатков аргинина, подвергшихся модификации глиоксалем, метилглиоксалем и 3–дезоксиглюкозоном (3–DG). Ещё одни хорошо изученные КПГ – Nδ–карбоксиметил–лизин (КМЛ) и Nδ–карбоксиэтил–лизин (КЭЛ), а также глюкозепан и пентозидин, характерные для перекрестных сшивок белков [3]. Одним из наиболее легко определяемых видов КПГ является пентозидин, который накапливается, например, в сухожилиях больших мышц человека (то есть там, где скорость оборота коллагена замедлена) начиная с 20 лет и его концентрация линейно увеличивается к старости.
До недавнего времени считалось, что глюкоза – это основное вещество для образования КПГ. Но точное установление различной скорости внутри- и внеклеточного образования КПГ показало, что это не так. Более высокой скоростью внутриклеточного образования КПГ обладают такие сахара, как фруктоза, глюкозо-6-фосфат и глицералальдегид-3-фосфат. Описано негативное воздействие глицеральдегида на молекулу основного сократительного и цитоскелетного белка актина, приводящее к образованию пентозидиновых и битирозиновых сшивок и потери функциональности актина [4].
Сшивание молекул коллагена глюкозепаном.
Как сегодня предполагается, неферментативное гликозилирование и КПГ тесно связаны с целым рядом возраст-зависимых заболеваний, таких, как диабет, ревматоидный артрит, атеросклероз, болезнь Паркинсона и Альцгеймера, боковой амиотрофический склероз, катаракта и онкологические болезни [5]. Белки, подвергшиеся гликированию в реакции Майяра, становятся афизиологично поперечно-сшитыми, теряя при этом свои свойства. Особенно большую проблему это представляет для долгоживущих белков (например, молекулы коллагена кожи, согласно ряду исследований, имеют период полужизни 15 лет, а хрящей — более 100 лет) которые составляют значительную часть всех белков в организме – около одной трети. Образовавшиеся дополнительные сшивки между молекулами нарушают функции этих белков, что приводит к потере эластичности тканей и часто наблюдается при старении и патологиях. Гликирование также становится причиной того, что и так медленно обновляемый белок коллаген становится еще более долгоживущим – после гликирования он приобретает резистентность к физиологическому действию эндогенных коллагеназ, которые обеспечивают обновление тканей.
На иллюстрации (а) показана схема коллагеновой фибриллы и образование глюкозепана, который ковалентно связывает боковые цепи лизина и аргинина. (б) Показана химическая структура глюкозопана, которая сшивает лизин (синий) с аргинином (красный). (с) Показана молекулярная модель глюкозопана.
Описано участие гликированного фактора роста фибробластов β-FGF в образовании фиброзов. Гликирование последовательности арг-гли-асп белка фибронектина приводит к нарушению восстановительной способности сосудов и прогрессированию сосудистых патологий. КПГ накапливаются в линзе и сетчатке глаза с возрастом. Кристаллины, основные структурные белки хрусталика глаза, восприимчивы к гликированию и поперечному сшиванию. Гликирование белков хрусталика приводит к возникновению катаракты. Гликированный гемоглобин, который используют для определения среднего уровня гликемии за последние 3 месяца, теряет способность переносить кислород в ткани, что негативно сказывается на многих химических процессах.
Также известно, что гликирование белков и образование КПГ сопровождается увеличением свободнорадикальной активности и перекисного окисления липидов, что вносит свой вклад в развитие возрастных болезней. Связано это с тем, что в процессе гликирования белков запускаются процессы автоокисления сахаров, сопровождающиеся повышением продукции активных форм кислорода (АФК). Кроме этого, связывание КПГ с рецептором КПГ (RAGE) также приводит к образованию реактивных АФК и последующей активацией чувствительного к окислительному стрессу фактора транскрипции NF-kB, связанного с воспалением и атерогенезом.
В свою очередь, активация NF-κB увеличивает экспрессию RAGE, создавая цикл положительной обратной связи, который усиливает продуцирование промоторов воспаления. Кроме того, взаимодействие КПГ-RAGE активирует NADPH-оксидазу (комплекс ферментов, который продуцирует супероксид), что увеличивает внутриклеточный окислительный стресс. А увеличение окислительного стресса NADPH-оксидазой в ответ на взаимодействие AGE-RAGE активирует, в свою очередь, NF-κB. И здесь мы можем наблюдать целый ряд «порочных кругов» — циклов с положительной обратной связью.
Гликирование белков дыхательной цепи митохондрий тоже вносит свой вклад в этот процесс: нарушение в работе дыхательной цепи служит постоянным источником супероксидных радикалов. Кроме этого, формирование в митохондриях и в других структурах под воздействием гликирования неразлагаемых КПГ может быть ответственно за реализацию такого феномена, как «метаболическая память». Когда у больных диабетом 2 типа строгий контроль гликемии уже не предотвращает развитие осложнений, связанных с сердечно-сосудистыми заболеваниями. Предполагается, что неразлагаемые КПГ играют в этом феномене основную роль [6].
Также при гликировании происходит увеличение воспалительных процессов. Так, при гликозилировании коллагена происходит накопление во внесосудистом матриксе конечных продуктов этого процесса, которые организм воспринимает как чужеродные. Из-за этого возникнет иммунный ответ, в ходе которого иммунные клетки – макрофаги – увеличат секрецию провоспалительных цитокинов (TNF-α, интерлейкина-6 и др.), которые известны своей способностью негативно влиять на резистентность к инсулину и атерогенез [7].
Кроме этого, «сшитые» белки меняют структуру (нанотопографию) и увеличивают жесткость внеклеточного матрикса и через механорецепторы мембраны и цитоскелет клеток совместно с сигнальными молекулами оказывают влияние на экспрессию генов, функцию клеток, тканей и организма в целом. Более того, благодаря пролину молекулы коллагена проводят слабые электромагнитные волны, генерируемые клетками и тканями, и, возможно, в дополнение к механическим и химическим сигналам, формируют единую биоэлектрическую сигнальную систему организма. Интересно отметить, что, меняя топографию среды или электромагнитное излучение, можно не только управлять клеточным циклом, но и превращать взрослые соматические клеток в стволовые без помощи вирусов с вектором факторов Яманака.
Даже незначительные изменения модуля сдвига и вязкоупругости межклеточной среды оказывают сильное влияние на клетки – «старый» внеклеточный матрикс может существенно ограничивать эффективность применения сенолитиков и терапии стволовыми клетками. Так, «молодые» фибробласты стремительно стареют в старом матриксе и наоборот – «старые» клетки утрачивают признаки связанного со старением секреторного фенотипа в «молодом» матриксе.
Какие есть причины возникновения гликированных белков и КПГ? Считается, что главная из них для современного человека сегодня – это нездоровая пища. Поджаренная коричнево-чёрная корочка на продуктах как раз и представляет собрание КПГ, образовавшихся из-за термической обработки продуктов (жарки мяса, картофеля и т.п.) при высоких температурах. Рекордсменом по количеству образованных КПГ считается поджаренный бекон. Кроме этого, потребление содержащих много быстрых углеводов продуктов (кондитерских изделий, сладких газированных напитков и пр.) также может способствовать гликированию белков и образованию КПГ. Известны продукты, которые, напротив, помогают противостоять накоплению КПГ – черная редька, редис, капуста брокколи, благодаря содержащемуся в них веществу сульфорафану. Как это не удивительно, но вместе с гурманами регулярно снабжают себя повышенными дозами КПГ и курильщики. Табачный дым содержит гликотоксины, которые реагируют с остатками лизина и аргинина, формируя КПГ. Вероятно, поэтому у курильщиков наблюдается хроническое воспаление дыхательных органов [8].
Как было уже сказано, кроме воздействия внешних факторов, образование КПГ в норме также происходит эндогенно (то есть внутри организма) в физиологических условиях. Хотя этот процесс медленный и незначительный, но существенно усиливается при повышенной концентрации свободных радикалов, при резистентности к инсулину, сахарном диабете и повышении уровня глюкозы в крови. Накапливаясь в организме, КПГ затягивают человека в «болото» патологических процессов, из которого потом не так просто выбраться.
По образному выражению авторов SENS, белковые сшивки действуют как молекулярные «наручники», связывающие молекулы белков, нарушая этим их функцию. Решением этой проблемы авторы SENS видят в разработке лекарств, которые смогут реагировать с поперечными сшивками и разрывать их, не разрушая других структурных особенностей молекул. По их мнению благоприятным обстоятельством в этом процессе является то, что сшивки, которые происходят как химические аварии в структурах наших белковых молекул, имеют очень необычное химическое строение, которое в норме не встречается в веществах, производимых организмом. Что должно облегчить поиск и создание терапевтических средств.
Кроме этого, авторы SENS определяют ещё ряд перспективных подходов для решения данной проблемы. Такие, как поиск или разработка ферментов, вместо лекарств, для разрушения сшивок. А также разработка «одноразовых» белков, которые разрушали бы сшивку, и потом сами были бы уничтожены в процессе. Известно, что такие белки существуют для других целей, например, регенерирующий ДНК белок MGMT [9]. В пользу подхода по поиску ферментов, говорит тот факт, что у живых организмов описаны дегликирующие ферменты. Так у грибов и бактерий найдены противостоящие гликированию ферменты амадориаза, фруктозолизин-6-киназа frlD и фруктозолизин-6-фосфат-дегликаза frlB, действующие на низкомолекулярные соединения аминокислот с сахарами [10]. У позвоночных обнаружены ферменты фруктозамин-3-киназа (FN3K) и родственный ей белок FN3K-RP, которые в состоянии расщеплять продукты гликирования внутриклеточно, в АТФ-зависимых процессах [11].
Считается, что глюкезепан, оказывает наибольшее влияние на течение болезней пожилого возраста человека и поэтому является приоритетной мишенью для противовозрастной терапии.
К сожалению, глюкозепан не был выбран целью для ранее разработанных препаратов против поперечных сшивок, таких как Alagebrium/ALT-711 (Wolffenbuttel et al., 1998), C36 (Cheng et al., 2007), TRC4149 (Pathal et al., 2008), и ему только предстоит доказать свою роль в механизмах старения. Эти вещества были нацелены на нейтрализацию карбоксиметиллизина – самого распространённого позднего продукта реакции Майяра, накапливающемся в организме при диабете.
На данный момент группа Дэвида Шпигель из Йельского университета работает над синтезом антител против содержащих глюкозепан белков. Обри де Грей подтверждает важность исследований по глюкезепану и недавно сообщил о регистрации компании Revel, на базе которой, возможно, будут продолжены начатые в университете исследования.
Однако, есть вероятность, что ни антитела, ни энзимы, по причине своих размеров, не смогут проникнуть между фибриллами коллагена. Более того, разорванные поперечные сшивки коллагена восстанавливаются после окончания приема препарата, что будет требовать повторный курс терапии.
Поэтому искусственные энзимонтоподобные катализаторы, размеры которых может быть в несколько раз меньше размеров оригинальных энзимов – видятся более интересной альтернативой. Подобные молекулы с заданной каталитической активностью – спиролигомеры (spiroligomeres) разрабатывает группа Христиана Шафмейстер из Темпльского университета.
Как было замечено ранее, поскольку конечные продукты гликирования накапливаются во время старения, их количественное определение может быть точным и надежным биомаркером старения. Однако, как детектирование КПГ в организме, так и ранняя диагностика изменений состава и структуры межклеточного матрикса затруднены по причине ограниченного органами и системами характера изменений и необходимостью проведения множественной биопсии. Даже в одном организме результаты сильно отличаются в зависимости от места взятия биопсии и исследуемого вида конечных продуктов гликирования.
Доступные методы определения конечных продуктов гликирования в коже, такой как аутофлуоресценция, то есть без применения специальных красителей (прибор «AGE-READER», изготавливаемый голландской компанией DiagnOptics BV) не дают точных данных и на результаты измерений могут влиять многие факторы, например, изменения водно-солевого баланса организма.
Основным и наиболее точным методом количественной оценки КПГ в организме сегодня считается метод хроматографии в сочетании с масс–спектрометрической детекцией. Масс-спектрометрия позволяет идентифицировать белки с высокой степенью достоверности и определять их количества в сложных белковых смесях.
Также для определения уровня КПГ используется иммуноферментный анализ. Но этот метод имеет ряд качественных ограничений (недостаточная специфичность антител, влияние свободных продуктов гликирования и пр.). Поэтому считается, что целесообразно проводить его в сочетании с масс–спектрометрией. КПГ также можно идентифицировать по общей интенсивности их флуоресценции. Что тоже имеет свои ограничения (большинство КПГ количественно не флуоресцируют, поэтому не могут быть определены) и позволяет более точно определять низкомолекулярные пептиды КПГ и свободные продукты гликирования.
Одним из перспективных биомаркеров, показывающих не только накопление КПГ, но и увеличение риска смертности от всех причин, является плазменный карбоксиметил-лизин (КМЛ). КМЛ является одним из доминирующих КПГ в организме, как циркулирующих, так и тканевых. Кроме этого, КМЛ является единственным КПГ, который выступает лигандом для рецепторов КПГ (RAGEs). Связывание RAGE с КМЛ приводит к увеличению генерации свободных радикалов, активации пути ядерного фактора Nf-κB и повышению уровня медиаторов воспаления (таких, как фактор некроза опухоли-альфа, интерлейкин-6 и C-реактивный белок). Известно, что КМЛ накапливается в больших кровеносных сосудах с возрастом. И высокие концентрации этого КПГ в сыворотке связаны с большей артериальной жесткостью, мощным фактором риска развития сердечно-сосудистых патологий и смертности от них, что было показано в ходе Балтиморского продольного исследования старения [12].
Также известно, что пожилых людей с церебрально-сосудистыми заболеваниями повышенный уровень КМЛ обнаруживается в кортикальных нейронах и сосудах головного мозга, что связано с тяжестью когнитивных нарушений. В рамках 6-летнего исследования Invecchiare in Chianti, в котором приняли участие 1.013 человека старше 65 лет, было показано, что средняя концентрация КМЛ в плазме, которую измеряли иммуноферментным анализом, была значительно выше у тех людей, которые умерли от всех причин, чем у выживших [13]. В 2018 году группа датских и шведских учёных описала новое моноклональное антитело, D1-B2, нацеленное на КМЛ, которое имеет хороший потенциал при иммуноферментном анализе для обнаружения данного КПГ. [14]
Ранее при помощи метода связанной жидкостной хроматографии вместе с масс-спектрометрией были идентифицированы ряд КПГ (глюкозепан, DOGDIC, MODIC и GODIC), которые накапливаются в тканях при старении и патологиях и могут использоваться в качестве маркеров для патофизиологических процессов [15]. Метод высокоэффективной жидкостной хроматографии позволяет детектировать ещё два класса КПГ, связанных со старением и диабетом – GOLD и MOLD [16].
Авторы обзора: Денис Одиноков, Алексей Ржешевский.
Список литературы:- Krištić J, Vučković F, Menni C, Klarić L, Keser T, Beceheli I, Pučić-Baković M. et al. Glycans are a novel biomarker of chronological and biological ages.Gerontol A Biol Sci Med Sci. 2014 Jul;69(7):779-89.
- Bürkle A, Moreno-Villanueva M, Bernhard J, Blasco M, Zondag G, Hoeijmakers JH6, Toussaint O, Grubeck-Loebenstein B, Mocchegiani E, Collino S, Gonos ES, Sikora E. et al. MARK-AGE biomarkers of ageing. Mech Ageing Dev. 2015 Nov;151:2-12.
- Ahmed N., Thornalley P.J. Роль конечных продуктов гликирования в патогенезе осложнений сахарного диабета. Российский медицинский журнал. 2009. №9, стр. 642-51.
- Федорова М. А., Благовещенский И. Ю., Филимонов В. Б., Кулева Н. В. Неэнзиматическая модификация актина in vitro под влиянием факторов окислительного, гликоокислительного и нитрозактивного стрессов. Вестник СПбГУ. 2006, №2, с. 51-59.
- Ансари Н.А., Рашид З. Неферментативное гликирование белков: от диабета до рака. Биомедицинская химия, 2010, том: 56(2), 168-178.
- Герасименко О.А. Конечные продукты избыточного гликозилирования как потенциальная мишень «выключения» метаболической памяти. Эффективная фармакотерапия. Эндокринология. 2011. № 4.
- Bernheim J, Rashid G, Gavrieli R, Korzets Z, Wolach B. In vitro effect of advanced glycation end-products on human polymorphonuclear superoxide production. Eur J Clin Invest. 2001. Dec;31(12):1064-9.
- Mullick AE, McDonald JM, Melkonian G, Talbot P, Pinkerton KE, Rutledge JC. Reactive carbonyls from tobacco smoke increase arterial endothelial layer injury. Am J Physiol Heart Circ Physiol. 2002 Aug;283(2):H591-7.
- GlycoSENS: Breaking extracellular crosslinks.
- Monnier VM, Sell DR. Prevention and repair of protein damage by the Maillard reactionin vivo. Rejuvenation Res. 2006;9(2):264–273.
- Szwergold BS1, Bunker RD, Loomes KM. The physiological substrates of fructosamine-3-kinase-related-protein (FN3KRP) are intermediates of nonenzymatic reactions between biological amines and ketose sugars (fructation products). Med Hypotheses. 2011 Nov;77(5):739-44.
- Semba RD, Najjar SS, Sun K, et al. Serum carboxymethyl-lysine, an advanced glycation end product, is associated with increased aortic pulse wave velocity in adults. Am J Hypertens. 2009;22:74–79
- Semba, R. D., Bandinelli, S., Sun, K., Guralnik, J. M., & Ferrucci, L. (2009). Plasma Carboxymethyl-Lysine, an Advanced Glycation End Product, and All-Cause and Cardiovascular Disease Mortality in Older Community-Dwelling Adults. Journal of the American Geriatrics Society, 57(10), 1874–1880.
- Wendel U, Persson N, Risinger C, Bengtsson E, Nodin B, Danielsson L, Welinder C, Nordin Fredrikson G, Jansson B, Blixt O. A novel monoclonal antibody targeting carboxymethyllysine, an advanced glycation end product in atherosclerosis and pancreatic cancer. PLoS One. 2018 Feb 8;13(2):e0191872.
- Biemel KM, Fried DA, Lederer MO. Identification and quantification of major maillard cross-links in human serum albumin and lens protein. Evidence for glucosepane as the dominant compound. J Biol Chem. 2002 Jul 12;277(28):24907-15. Epub 2002 Apr 26.
- Chellan P, Nagaraj RH. Protein crosslinking by the Maillard reaction: dicarbonyl-derived imidazolium crosslinks in aging and diabetes. Arch Biochem Biophys. 1999 Aug 1;368(1):98-104.
Гликозилирование типов белков, процессов и функций / биология | Thpanorama
гликозилирование белка представляет собой посттрансляционную модификацию, состоящую в добавлении линейных или разветвленных олигосахаридных цепей к белку. Получающиеся гликопротеины обычно представляют собой поверхностные белки и белки секреторного пути..
Гликозилирование является одной из наиболее распространенных пептидных модификаций среди эукариотических организмов, но было показано, что оно также встречается у некоторых видов архей и бактерий..
У эукариот этот механизм происходит между эндоплазматическим ретикулумом (ER) и комплексом Гольджи, с вмешательством различных ферментов, участвующих как в регуляторных процессах, так и в образовании ковалентных связей белок + олигосахарид.
индекс
- 1 Виды гликолизации
- 1.1 N-гликозилирование
- 1.2 O-гликозилирование
- 1.3 C-маннозилирование
- 1.4 Glipiation (от англ. «Glypiation»)
- 2 Процесс
- 2.1 у эукариот
- 2.2 у прокариот
- 3 функции
- 4 Ссылки
Типы гликолизации
В зависимости от сайта связывания олигосахарида с белком гликозилирование можно разделить на 4 типа:
N-гликозилирование
Он является наиболее распространенным из всех и происходит, когда олигосахариды связываются с азотом амидной группы остатков аспарагина в мотиве Asn-X-Ser / Thr, где X может быть любой аминокислотой, кроме пролина.
О-гликозилирование
Когда углеводы связываются с гидроксильной группой серина, треонина, гидроксилизина или тирозина. Это менее распространенная модификация, и примерами являются такие белки, как коллаген, гликофорин и муцины..
С-mannosylation
Он заключается в добавлении остатка маннозы, который связан с белком связью С-С с С2 индольной группы в остатках триптофана.
Glipiación (с английского «Глипиация «)
Полисахарид действует как мост для связывания белка с якорем гликозилфосфатидилинозитола (GPI) в мембране..
процесс
У эукариот
N-гликозилирование — это то, что было изучено более подробно. В клетках млекопитающих процесс начинается в грубой ER, где предварительно образованный полисахарид связывается с белками, когда они выходят из рибосом.
Указанный предшественник полисахарида состоит из 14 остатков сахара, а именно: 3 остатка глюкозы (Glc), 9 маннозы (Man) и 2 N-ацетилглюкозамина (GlcNAc).
Этот предшественник распространен у растений, животных и одноклеточных эукариотических организмов. Он связан с мембраной благодаря связи с молекулой долихола, изопреноидным липидом, встроенным в мембрану ER..
После его синтеза олигосахарид переносится ферментным комплексом олигосакарилтрансферазы в остаток аспарагина, включенный в трипептидную последовательность белка Asn-X-Ser / Thr, во время его трансляции..
Три остатка Glc на конце олигосахарида служат сигналом для правильного синтеза этого, и они иссекаются вместе с одним из остатков Man, прежде чем белок поступает в аппарат Гольджи для дальнейшей обработки..
Попадая в аппарат Гольджи, части олигосахаридов, связанные с гликопротеинами, можно модифицировать путем добавления остатков галактозы, сиаловой кислоты, фукозы и многих других, что дает цепи гораздо большего разнообразия и сложности..
Ферментативный механизм, необходимый для осуществления процессов гликозилирования, включает многочисленные гликозилтрансферазы для добавления сахаров, гликозидазы для их удаления и различные переносчики нуклеотидных сахаров для вклада отходов, используемых в качестве субстратов..
У прокариот
Бактерии не имеют внутриклеточных мембранных систем, поэтому образование исходного олигосахарида (всего из 7 остатков) происходит на цитозольной стороне плазматической мембраны..
Этот предшественник синтезируется на липиде, который затем транслоцируется АТФ-зависимой флипазой в периплазматическое пространство, где происходит гликозилирование.
Другое важное различие между гликозилированием эукариот и прокариот заключается в том, что бактериальный фермент олигосахарид (олигосакарилтрансфераза) трансфераза может переносить остатки сахара к свободным частям уже свернутых белков, а не так, как они транслируются рибосомами..
Кроме того, пептидный мотив, который распознает этот фермент, не является той же самой эукариотической трипептидной последовательностью.
функции
N-Олигосахариды, связанные с гликопротеинами, служат нескольким целям. Например, некоторые белки требуют этой посттрансляционной модификации для достижения адекватного сворачивания своей структуры.
Другим это обеспечивает стабильность, либо избегая протеолитической деградации, либо потому, что эта часть необходима для выполнения своей биологической функции..
Поскольку олигосахариды имеют сильную гидрофильную природу, их ковалентное добавление к белку обязательно изменяет их полярность и растворимость, что может быть функционально значимым.
После прикрепления к мембранным белкам олигосахариды являются ценными носителями информации. Они участвуют в процессах передачи сигналов, связи, распознавания, миграции и клеточной адгезии..
Они играют важную роль в свертывании крови, заживлении и иммунном ответе, а также в обработке контроля качества белка, который зависит от гликанов и незаменим для клетки..
важность
По меньшей мере 18 генетических заболеваний были связаны с гликозилированием белков у людей, некоторые из которых связаны с плохим физическим и умственным развитием, тогда как другие могут быть смертельными..
Растет число открытий, связанных с заболеваниями гликозилирования, особенно у детей. Многие из этих нарушений являются врожденными и связаны с дефектами, связанными с начальными стадиями образования олигосахаридов или с регуляцией ферментов, участвующих в этих процессах..
Поскольку большая часть гликозилированных белков составляет гликокаликс, возрастает интерес к проверке того, могут ли мутации или изменения в процессах глико
Гликозилирование — это… Что такое Гликозилирование?
Гликозилирование (англ. Glycosylation) — ферментативный процесс, в ходе которого происходит присоединение остатков сахаров к органическим молекулам. В процессе гликозилирования образуются гликозиды, или, в случае белков и липидов, гликопротеиды и гликолипиды, соответственно. Гликозилирование является одной из форм котрансляционной и посттрансляционной модификации белков. Гликозилирование имеет большое значение для структуры и функций мембранных и секретируемых белков.[1]
Преобладающая часть белков, синтезируемых в шероховатом эндоплазматическом ретикулюме, подвергается гликозилированию. Гликозилирование представляет собой ферментативный специфический процесс. В цитоплазме и ядре гликозилирование осуществляется в форме O-GlcNAc модификации. Известны пять классов гликанов: в случае N-связанных гликанов сахар присоединен к атому азота боковой цепи остатка аспарагина или аргинина; в O-связанных гликанах сахар присоединен к гидроксилам боковых цепей остатков серина, треонина, тирозина или гидроксилизина или к атомам кислорода липидов, например, церамидов; фосфогликаны содержат остаток сахара, соединенный через фосфат с серином; C-связанные гликаны представляют собой редкую форму гликозилирования, в которой сахар соединяется с атомом углерода боковой цепи триптофана.[2]
 |
Примечания
- ↑ edited by Ajit Varki … Essentials of Glycobiology. — 2nd. — Cold Spring Harbor Laboratories Press. — ISBN 978-087969770-9
- ↑ Bruce Alberts, Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts, Peter Walter Molecular Biology of the Cell. — 5. — Garland Science, 2008. — 1392 с. — ISBN 0815341059
Внешние ссылки
Гликация, гликозилирование, гликирование и реакция Майяра : SaxarVNorme
Приветствую всех! Мое личное убеждение, что человек не должен умирать от болезней. Техногенные катастрофы, стихийные бедствия, смерть по неосторожности, травмы еще можно допустить, но со смертью от заболеваний, особенно социальных, я не могу смириться.
Сегодня поговорим о том, что нас старит и медленно убивает с самого рождения – гликация (гликозилирование, гликирование) белков следствие реакции Майяра и феномен метаболической памяти.
Современная жизнь и прогресс дает нам огромные шансы жить долго и здорово, но они же создают массу препятствий (соблазнов), которые все время уводят человека с намеченной цели – плодотворному здоровому долгожительству.
Что такое старение
В начале XX века средняя продолжительность жизни составляла всего 40-45 лет. Сейчас же цифры переваливают за 70 летний рубеж.
В связи с увеличением продолжительности жизни и другим факторами, начали появляться болезни, которые были неведомы в прошлые столетия. Многие тогда просто не доживали до рака, старческого слабоумия, диабета, инфарктов и других социально значимых заболеваний.
Проблема вечной молодости всегда стояла остро, в любые времена, и только сейчас ученым удалось приблизиться к началу разгадки этой соблазнительной и манящей тайны.
Существует множество гипотез и доказанных механизмов старения человеческого организма. Одним из таких механизмов является теория гликации белковых структур организма. Обратите внимание, что под словом старение я не имею в виду только внешний вид (морщины, обвисание кожи и прочие повреждения кожных покровов с возрастом).
Старение организма происходит на всех уровнях строения любой ткани и внутренних органов: начиная с ДНК, заканчивая целыми системами. И данный механизм гликозилирования или гликирования, как еще называют гликацию белков, подходит для каждого органа и системы человека. Давайте поподробнее рассмотрим, что это за губительный процесс.
Что такое гликозилирование, гликирование и гликация
По своей сути все три термина обозначают одно и то же – сложная цепная биохимическая реакция между аминокислотами (читай белками), жирами, ДНК и свободных моносахаридов (глюкоза, фруктоза, рибоза, галактоза и другие), приводящая к формированию конечных продуктов гликирования – карбоксиметиллизин, метилглиоксаль, глиоксаль, 1-, 3-деоксигликазон, А-Р дион и другие. Этот процесс называется реакцией Майяра.
Конечные продукты гликирования обладают колоссальным разрушающим действием, а в английской интерпретации звучит, как Advanced Glycosylation End-products или сокращенно AGE. Удивительно, но в переводе на русский слово AGE означает ВОЗРАСТ. Интересно, намеренно ученые придумали такое название или нет?
К слову сказать, данный процесс происходит и в норме, но в небольшом количестве и организм может быстро исправить нарушения. Как это происходит с раковыми клетками, которые каждый день у нас появляются, но иммунная система не дает им переродиться в опухоль.
А вот когда простых углеводов становится очень много, то повреждения накапливаются, накапливается количество AGE и старение организма ускоряется, а также приобретаются сопутствующие заболевания.
ВНИМАНИЕ! Если вы думаете, что виноваты только сладости и выпечка, то вы ошибаетесь. Сложные углеводы (олиго- и полисахариды), которые находятся в крупах, зерновых, макаронах, крахмалистых овощах, фруктах при всасывании в ЖКТ расщепляются на мономеры (глюкозы, фруктоза и прочие). Поэтому скушав тарелку гречки, будьте уверены, что уровень моносахаридов через час-другой у вас будет достаточно высок.
Я не призываю полностью исключать углеводистые продукты, но осмысленно подходить к выбору продуктов и не питать иллюзий, что раз вы не едите сладкое, то у вас все в порядке.
Сахар имеет много названий. Вот некоторые из них: глюкозно-фруктозный сироп, «сироп фруктозы», ГФС, HFCS, GFS, сахароза, мальтоза, кукурузный сироп, патока, сахарный тростник, кукурузный сахар, сахар-сырец, мед, фруктовый концентрат, мед, кленовый сироп, измельченный солод, кукуруза и ее производные, рисовый и кукурузный сироп, патока, черная патока, сырец, сироп сушеного тростника, инвертный сахар, сироп коричневого риса, сок белого винограда или другие фруктовые концентраты.
AGE приводят:
- к эндотелиальной дисфункции, а она в свою очередь к атеросклерозу
- к митохондриальной дисфункции и поражению нервной ткани (полинейропатии, болезнь Альцгеймера, рассеянный склероз и другие когнитивные нарушения)
- склеивание молекул коллагена и эластина соединительной ткани (морщины, поражение стенок сосудов, нарушение клубочковой фильтрации почек, поражение суставных связок, костей, а также других тканей)
- к поражению ДНК
- к стимуляции оксидативного стресса, т. е. процессов окисления
Где встречается реакция Майяра
Данная реакция встречается не только в живом организме, но и в кулинарии. Коричневая хрустящая ароматная корочка на хлебе, вареная сгущенка, жаренная картошечка, подрумяненный стейк – всех их объединяет высокий уровень AGE.
Эту реакцию можно сравнить с реакцией карамелизации, в результате продукт приобретает коричневый цвет за счет образования меланоидиновых пигментов. Поэтому данные вещества не только образуются в нашем организме, но и попадают к нам с пищей. Кому еще жареной картошечки?
Процесс образования конечных токсичных продуктов многоступенчатый, отчасти необратимый и всегда универсален будь то кусок мяса или сосудистая стенка человека. AGE из организма не выводятся. Они могут вывестись только со сменой клеток, т. е. когда поврежденные ткани полностью обновятся. А если структурный элемент меняется раз в 100 лет, как например, коллаген?
Страшно то, что процесс гликации полностью автономный процесс, для него не нужны специальные ферменты, которые можно заблокировать лекарствами. Для того, чтобы реакция шла нужны только температурный режим и субстрат, т. е. простые сахара в кровеносном русле. Чем больше сахар крови, тем больше образуется конечных продуктов гликозилирования. Вспомните об анализе на гликированный гемоглобин.
Это не что иное, как повреждение молекулы гемоглобина путем присоединения молекулы глюкозы. В таком виде гемоглобин не может выполнять свои функции. Хорошо, что эритроциты живут всего 3 месяца, а потом на их место встают новые, девственно чистые!
Гликирование коллагена
Доля коллагена в организме составляет 20-30 % всей массы тела. Он встречается в каждом органе. Основные органы, включающие в себя коллагеновые молекулы: кожа, сухожилия, связки, межпозвоночные диски, клубочки почек, кости, стенка сосудов. Именно коллаген придает органу его форму.
Молекула этого белка состоит из трех цепочек аминокислот, скрученных в правостороннюю спираль. Спиральки удерживаются между собой поперечными сшивками, которые представляют собой боковые цепи остатков аминокислоты лизин. Именно к этим остаткам прикрепляется глюкоза, образуя AGE.
Чем старше человек, тем больше поперечных связей. Чем больше поперечных связей (сшивок), тем менее эластичной становится молекула коллагена. Чем выше и длительно держится высокий уровень сахара в крови, тем больше образуется AGE, а значит поперечных связей в молекуле коллагена. Цепочки коллагена как бы склеиваются между собой, нарушая нормальную работу элемента, и это необратимый процесс.
При гликации коллагена происходит:
- нарушается эластичность сосудов, возникает повышенная хрупкость, возникновение воспаления в их стенке, утолщение ее и сужение просвета, вследствие этого нарушение кровоснабжения органов и тканей, а также предпосылки для атерогенеза
- снижается эластичность и упругость кожи лица и тела, появляются морщины, обвисание контура лица, мешки под глазами, второй подбородок, ухудшается общий цвет лица (и все это без учета возрастного снижения синтеза коллагена)
- уменьшается подвижность суставов и растяжимость связок
- возникают дегенеративные процессы в межпозвоночных дисках
- повышение хрупкости костей, остепороз и остеопения
- утолщение базальной мембраны почек, что приводит к снижению их функции (механизм нефропатии при диабете)
- помутнение хрусталика и катаракта
К сожалению, никакими средствами очистить молекулы коллагена от вредных конечных продуктов гликации нельзя. Хотя в настоящее время ученые работают над поиском таких средств, чтобы разрывать эти крепкие опасные связи.
ВНИМАНИЕ! Если вы думаете, что все, что я здесь пишу касается только людей с высокими уровнями сахара, то вам придется прочесть статью еще раз, поскольку вы так и не поняли, что речь идет об обычных условно здоровых людях тоже, у которых пока нет диабета и возможно даже не будет, но процессы гликолизирования у них уже идут.
Просто у диабетиков этот процесс выражен еще сильнее и мощнее. И чем выше общий уровень сахара в крови, чем чаще случаются скачки сахара от неумеренного потребления углеводов, даже если сахар крови при этом в нормальном диапазоне, тем быстрее начинают тикать часы, неотвратимо приближая старение.
Обязательно расскажите об этом всем своим знакомым, родным, пересмотрите образ жизни своих детей, поскольку чем раньше, вы начнете следить за степенью гликации белков, тем медленнее будут двигаться стрелки биологических часов. Жаль, что всю сознательную жизнь я провела в углеводном пьянстве. Всего 7 лет, как я в завязке.
Гликолизирование ДНК и нуклеотидов
Как оказалось, процесс гликации затрагивает не только белковые структуры, но проникает гораздо глубже. Это процесс поражает структуры, которые являются хранителем информации всего организма – ДНК и нуклеиновые кислоты.
В результате происходят различного рода мутации и поломки генома, укорачиваются хромосомы. А если гены будут неправильными, аномальными, то в результате будут синтезироваться неправильные белки, которые не будут полностью выполнять свою функцию.
Окисление (образование свободных радикалов), воспаление и гликация – вот три основных причины меняющих нашу ДНК и не в лучшую сторону.
Связывание аминокислот
Моносахара связываются абсолютно с любой аминокислотой в том числе и с незаменимыми. Самые важные из них, которых всегда бывает мало – это лизин, треонин, аргинин и метионин. Если произошло гликирование этих веществ, то этот комплекс создается навсегда и аминокислота уже не может выполнять свою важную роль. Поэтому часто при сахарном диабете имеется дефицит по этим аминокислотам.
Дефицит треонина приводит к уменьшению общего уровня энергии, снижению мышечной массы, задержкой роста у детей.
Недостаток аргинина приводит к снижению синтеза окиси азота, который является вазодилататором, т. е. расширяет сосуды.
Нехватка лизина приводит к нарушению синтеза коллагена и других белков.
Метионин участвует в липидном обмене в печени и оказывает антихолестерическое действие. При его нехватке ухудшаются показатели липидного профиля.
Что такое метаболическая память
Феномен метаболической памяти (гипергликемическая память, сосудистая память) означает, что высокий уровень гликемии запоминается клетками и тканями, а именно сетчаткой, сосудами, почками, периферическими нервами. И несмотря на последующую нормализацию уровня гликемии в этих тканях продолжаются патологические процессы, вызывающие осложнение.
Если период гипергликемии длился долго, то эта память становится только крепче. Данный феномен связан непосредственно с AGE, о которых я говорила выше, а также с оксидативным стрессом. Ученые полагают, что гликация ДНК, а также митохондриальных белков могут вызывать такой феномен и поддерживать его длительное время.
И требуется значительное время, чтобы этот генетический материал восстановился. А в этом я абсолютно уверена и не я одна. Зарубежные авторы считают (например, Джек Круз), что гены предопределяют только 30 % нашего состояния здоровья, за остальные 70 % ответственны мы сами.
Человек в силе сам влиять на экспрессию генов путем изменения образа жизни, стиля питания, восполнения питательных веществ, физической нагрузкой и даже тем, о чем он думает, т. е. силой мысли. Наука, изучающая такие способности называется ЭПИгенетика, т. е. дословно “НАДгенетикой”.
Впервые о феномене метаболической памяти заговорили после одного исследования, о котором я сейчас расскажу.
Изучались сетчатки собак. Собак разделили на 4 группы. У первой группы нормализовали уровень сахара через 2 месяца стимулированной гипергликемии, у второй сахар крови нормализовали через 2,5 года, в третьей группе все время был нормальный сахар крови, а в четвертой все время исследования был высокий сахар крови. Через 5 лет от начала эксперимента сравнили изменения на сетчатках собак из всех групп.
Оказалось, что у собак, у которых быстро нормализовали сахар (через 2 месяца) наблюдались незначительные признаки ретинопатии, такие же, как у собак из третьей группы.
В то время у собак, которым нормализовали уровень сахара только через 2,5 года, частота и выраженность ретинопатии была сопоставима с собаками из 4 группы, где все 5 лет был декомпенсированный сахарный диабет.
Позже существование данного феномена подтвердилось в исследованиях на людях, в частности исследование ADVANCE не показало существенного снижения осложнений при строгом контроле гликемии. А в исследовании UKPDS не было замечено снижение частоты инфарктов у людей с последующей нормализацией гликемии. Более подробно смотрите в видео, которое я подготовила ниже.
Другими словами, после длительной гипергликемии патологические процессы останавливаются не сразу. Это невозможно, как невозможно быстро остановить поезд, движущийся на всех парах. На восстановление требуется время, возможно даже больше, чем период декомпенсации. Именно поэтому о нормализации уровня сахара нужно думать уже сейчас! Если вам действительно ценно свое здоровье, то отложите все свои “не могу”, “не хочу”, “не время” и прочие отговорки.
Все ждут, когда придет время, но время почему-то только уходит…
Сейчас ученые ищут лекарства, средства и методы, способные “выключать” эту метаболическую память. И самым первым шагом будет снижение образования конечных продуктов гликирования (AGE). Этой статьей я хотела показать еще раз важность быстрой нормализации сахара в крови при первичном выявлении диабета или нарушения толерантности к глюкозе.
Главным является уменьшение потребления углеводов, как способ уменьшить уровень гликации структурных белков организма и продлить молодость, отодвигая старение.
Для пациентов с сахарным диабетом 1 типа нужно стремиться быстрее разобраться с премудростями инсулинотерапии, не жалеть денег, сил и времени на хорошую компенсацию в первые годы, а может первые 10-15 лет после выявления заболевания. Эта рекомендация провомочна и для людей со 2 типом.
Если вы не позаботитесь сейчас, пожалеете ресурсов, то дальше будет еще хуже, придется платить за свое бездействие.
С теплотой и заботой, эндокринолог Лебедева Диляра Ильгизовна
P.S. Уникальное видео о метаболической памяти при нарушении углеводного обмена (диабете 1 и 2 типа). Смотреть всем до конца!
С теплотой и заботой, эндокринолог Лебедева Диляра Ильгизовна 
Гликозилирование белка S: shvarz — LiveJournal
Site-specific glycan analysis of the SARS-CoV-2 spikeЯ уже писал про белок оболочки S (и продолжение). Это белок, которым вирус собственно «цепляется» за белок ACE2 на поверхности клеток которые он заражает. В процессе формирования новых вирусных частиц в зараженной клетке вирус выходит захватывая с собой кусок клеточной мембраны. Вот иллюстрация этого процесса для ВИЧ, но коронавирус это делает очень похожим образом:
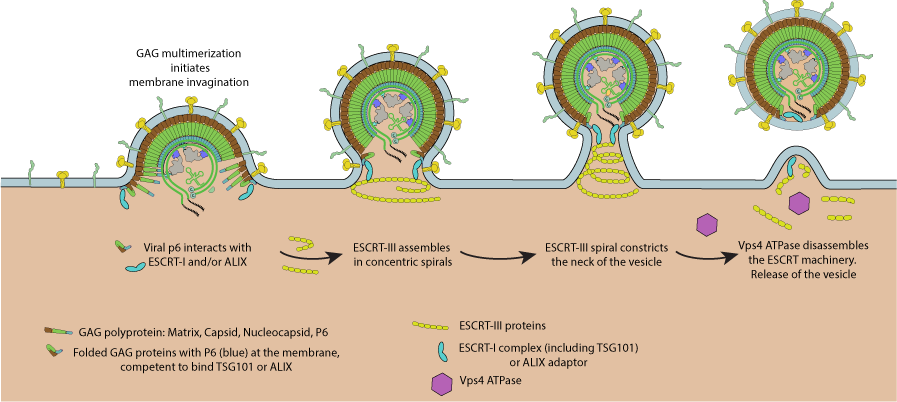
На картинке снизу — клеточное пространство, сверху — «противная наружа», а разделяет их липидная мембрана в которой полно обычных клеточных белков (они тут очень схематично изображены несколькими зеленоватыми червячками), а также вирусных белков оболочки (желтые грибки). Таким образом, внешняя часть вирусной частицы выглядит почти неотличимо от поверхности обычных клеток. Отличает ее лишь присутствие вирусных белков, в том числе и интересного нам белка S на поверхности коронавируса.
Вирусу, естественно, невыгодно отличаться от клеточных мембран, поэтому он эволюционирует так, чтобы сделать свой белок S менее заметным для антител. Один из способов это делать — это иметь на белке сайты гликозилирования. Большая часть белков на поверхности клеток несет на себе так называемые гликаны. Это такие поли-сахара, которые одним сахаром присоединяются к белку, а потом разветвляются как кусты или деревья.
Вот пример: 
Тут показаны два гликана, у обоих справа схематично изображено место присоединения гликана к белку — аминокислота аспарагин, а влево уходят сами гликаны. Каждый кружочек или квадратик это разный сахар, причем тут показаны всего два вида гликанов, но вообще они бывают очень и очень разные с разными сахарами и разными структурами.
Что важно, несмотря на то, что гликаны бывают очень разные, все они начинают свою жизнь как гликан показанный на картинке справа — он почти целиком состоит из маннозы и поэтому называется олигоманнозным. Специальные ферменты в клетке постепенно обрезают эту маннозу, а другие довешивают разные сахара и когда белок готов к переносу на поверхность клетки, его гликаны выглядят так как на картинке слева. Их называют сложными.
К чему я все это рассказываю. Вирусы тоже обвешивают свои белки оболочки подобными гликанами, так что для антител они во-первых, выглядят «своими», а во-вторых, даже если иммунная система их распознает как чужеродные, то на них очень трудно вырабатывать антитела. Таким образом вирусы защищаются гликанами от иммунного ответа.
Собственно из статьи я хочу привести всего одну картинку:
Это сравнение количества и типа гликанов на белках оболочки от разных вирусов, названия которых написаны внизу. Верхний ряд — это вид на эти белки сверху, как если бы вы взяли вирусную частицу и повернули ее белком оболочки прямо к себе. Видно, что все эти белки оболочки являются тримерами — они состоят из трех идентичных частей соединенных вокруг общей оси симметрии. Нижний ряд — это те же самые белки что и сверху, но теперь мы смотрим на них сбоку и снизу у них «ножка» которой они прикрепляются к вирусной частице. Серые формы — это собственно белки. А фигурки показанные градиентом от белого к зеленому — это собственно гликаны о которых я выше и рассказывал. Чем более зеленый гликан — тем ближе он к начальной форме, к олигоманнозе, а чем белее — тем он более сложный.
Сравним белок S (второй на картинке) с белком Env от ВИЧ (пятый). Видим, что у ВИЧ белок оболочки очень густо покрыт гликанами, к самому белку практически невозможно подобраться за исключением небольших карманов которые вирус использует для связывания с рецептором на поверхности CD4 клетки. Поэтому против ВИЧ очень трудно сделать вакцину — нужны очень необычные антитела которые либо могут проникнуть сквозь этот защитный слой гликанов, либо связаться с ними. Такие антитела у людей образуются, но на их образование обычно уходят годы инфекции.
А вот белок S у коронавируса достаточно открыт. Это довольно хорошие новости, потому что это означает что к нему должно быть довольно легко выработать антитела и у него должно быть много уязвимых мест. Естественно, нет гарантий что в ходе разработки вакцины у коронавируса не обнаружится каких-либо своих способов уходить от иммунного ответа, но это маловероятно. Жизненная стратегия таких вирусов — успеть размножиться и перескочить к следующему хозяину до того как организм успеет среагировать.
Гликозилирование — Карта знаний
- Гликозили́рование (англ. Glycosylation) — ферментативный процесс, в ходе которого происходит присоединение остатков сахаров к органическим молекулам. В процессе гликозилирования образуются гликозиды или, в случае белков и липидов, гликопротеины и гликолипиды соответственно. Гликозилирование является одной из форм котрансляционной и посттрансляционной модификации белков. Гликозилирование имеет большое значение для структуры и функций мембранных и секретируемых белков.Преобладающая часть белков, синтезируемых в шероховатом эндоплазматическом ретикулюме, подвергается гликозилированию. Гликозилирование представляет собой ферментативный специфический процесс. В цитоплазме и ядре гликозилирование осуществляется в форме O-GlcNAc модификации. Известны пять классов гликанов: в случае N-связанных гликанов сахар присоединен к атому азота боковой цепи остатка аспарагина или аргинина; в O-связанных гликанах сахар присоединен к гидроксилам боковых цепей остатков серина, треонина, тирозина или гидроксилизина или к атомам кислорода липидов, например, церамидов; фосфогликаны содержат остаток сахара, соединенный через фосфат с серином; C-связанные гликаны представляют собой редкую форму гликозилирования, в которой сахар соединяется с атомом углерода боковой цепи триптофана.
Источник: Википедия
Связанные понятия
Дезамидирование — это химическая реакция, в которой амидная функциональная группа удаляется из органического соединения. В биохимии реакция играет важную роль в деградации белков, так как повреждает амидосодержащие боковые цепи аминокислот аспарагина и глутамина. Фосфорилирование — процесс переноса остатка фосфорной кислоты от фосфорилирующего агента-донора к субстрату, как правило, катализируемый ферментами и ведущий к образованию сложных эфиров фосфорной кислоты… Биополиме́ры — класс полимеров, встречающихся в природе в естественном виде, входящие в состав живых организмов: белки, нуклеиновые кислоты, полисахариды, лигнин. Биополимеры состоят из одинаковых (или схожих) звеньев — мономеров. Мономеры белков — аминокислоты, нуклеиновых кислот — нуклеотиды, в полисахаридах — моносахариды. Биомолекулы — это органические вещества, которые синтезируются живыми организмами. В состав биомолекул включают белки, полисахариды, нуклеиновые кислоты, а также более мелкие компоненты обмена веществ. Биомолекулы состоят из атомов углерода, водорода, азота, кислорода, а также фосфора и серы. Другие атомы входят в состав биологически значимых веществ значительно реже. Пури́новый обме́н (пури́новый метаболи́зм) — совокупность протекающих в живых организмах процессов синтеза и распада пуринов и пуриновых нуклеотидов. Аминокисло́ты (аминокарбо́новые кисло́ты; АМК) — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы. Основные химические элементы аминокислот — это углерод (C), водород (H), кислород (O), и азот (N), хотя другие элементы также встречаются в радикале определенных аминокислот. Известны около 500 встречающихся в природе аминокислот (хотя только 20 используются в генетическом коде). Окисли́тельное декарбоксили́рование пирува́та — биохимический процесс, заключающийся в отщеплении одной молекулы углекислого газа (СО2) от молекулы пирувата и присоединения к декарбоксилированному пирувату кофермента А (КоА) с образованием ацетил-КоА; является промежуточным этапом между гликолизом и циклом трикарбоновых кислот. Декарбоксилирование пирувата осуществляет сложный пируватдегидрогеназный комплекс (ПДК), включающий в себя 3 фермента и 2 вспомогательных белка, а для его функционирования… Пластоцианин — медьсодержащий белок, вовлечённый в транспорт электронов от фотосистемы II к фотосистеме I. Этот мономерный белок, состоящий у большинства сосудистых растений из 99 аминокислот, имеет молекулярную массу около 10,5 кДа. Он является представителем пластоцианинового семейства медьсвязывающих белков. Сери́н (англ. Serine; α-амино-β-оксипропионовая кислота; 2-амино-3-гидроксипропановая кислота) — гидроксиаминокислота, существует в виде двух оптических изомеров — L и D. L-аспарагина́за (КФ 3.5.1.1), L-Аспарагин амидогидролаза — фермент класса гидролаз, катализирующий гидролиз преимущественно L-аспарагина. Применяется как противоопухолевое цитостатическое средство в терапии некоторых лейкозов, а также при приготовлении пищи.Подробнее: Аспарагиназа
Фосфатаза — фермент, который катализирует дефосфорилирование субстрата (как правило другого белка) в результате гидролиза сложноэфирной связи фосфорной кислоты. При этом образуется фосфатный анион и молекула продукта с гидроксильной группой. По своему каталитическому и физиологическому действию фосфатаза является антагонистом фосфорилазы и киназы, которые присоединяют фосфатную группу к субстрату. Тейхоевые кислоты (от греч. τειχος, «стена») — линейные углеводные фосфатсодержащие гетерополимеры, состоящие из повторяющихся остатков полиолов либо гликозилполиолов, связанных фосфодиэфирными связями.В зависимости от полиолов, образующих основную цепь, выделяют глицерин-, рибит- и манниттехойевые кислоты. Нуклеи́новая кислота (от лат. nucleus — ядро) — высокомолекулярное органическое соединение, биополимер (полинуклеотид), образованный остатками нуклеотидов. Нуклеиновые кислоты ДНК и РНК присутствуют в клетках всех живых организмов и выполняют важнейшие функции по хранению, передаче и реализации наследственной информации. Аспараги́н (англ. Asparagine; принятые сокращения: Асн, Asn, N) — амид аспарагиновой кислоты (2-амино-бутанамид-4-овая кислота, Asx или B). Одна из 20 наиболее распространённых аминокислот природного происхождения. Их кодоны AAU и AAC. Ферме́нты (от лат. fermentum) — обычно достаточно сложные молекулы белка, рибосом или их комплексы, ускоряющие химические реакции в живых системах. Каждый фермент, свернутый в определённую структуру, ускоряет соответствующую химическую реакцию: реагенты в такой реакции называются субстратами, а получающиеся вещества — продуктами. Ферменты специфичны к субстратам: АТФ-аза катализирует расщепление только АТФ, а киназа фосфорилазы фосфорилирует только фосфорилазу.Ферментативная активность может регулироваться… Аминосахара́ — производные углеводов, образованные замещением одной или нескольких гидроксильных групп на аминогруппу. Ци́кл трикарбо́новых кисло́т (сокр. ЦТК, цикл Кре́бса, цитра́тный цикл, цикл лимо́нной кислоты́) — центральная часть общего пути катаболизма, циклический биохимический процесс, в ходе которого ацетильные остатки (СН3СО-) окисляются до диоксида углерода (CO2). При этом за один цикл образуется 2 молекулы CO2, 3 НАДН, 1 ФАДh3 и 1 ГТФ (или АТФ). Электроны, находящиеся на НАДН и ФАДh3, в дальнейшем переносятся на дыхательную цепь, где в ходе реакций окислительного фосфорилирования образуется АТФ. Гликозилфосфатидилинозитол (ГФИ-якорь, GPI anchor) — это гликолипид, который может присоединяться к C-концу белка в процессе посттрансляционной модификации. Он состоит из фосфатидилинозитольной группы, соединенный углеводным связующим звеном (глюкозамин и манноза, гликозидно связанным с остатком инозитола) с C-концевой аминокислотой зрелого белка. Две жирные кислоты, составляющие фосфатидил-инозитоловую группу, заякоривают белок в клеточной мембране. Углево́ды — органические вещества, содержащие карбонильную группу и несколько гидроксильных групп. Название класса соединений происходит от слов «гидраты углерода», оно было впервые предложено К. Шмидтом в 1844 году. Появление такого названия связано с тем, что первые из известных науке углеводов описывались брутто-формулой Cx(h3O)y, формально являясь соединениями углерода и воды. Никотинамидадениндинуклеоти́д (англ. Nicotinamide adenine dinucleotide, сокр. NAD, НАД, устар. diphosphopyridine nucleotide, DPN, ДПН) — кофермент, имеющийся во всех живых клетках. NAD представляет собой динуклеотид и состоит из двух нуклеотидов, соединённых своими фосфатными группами. Один из нуклеотидов в качестве азотистого основания содержит аденин, другой — никотинамид. Никотинамидадениндинуклеотид существует в двух формах: окисленной (NAD+, NADox) и восстановленной (NADH, NADred). Липоксигеназы (англ. Lipoxygenases) — железо-содержащие ферменты, катализирующие реакцию диоксигенации (присоединение двух атомов кислорода) к полиненасыщенным жирным кислотам. Различные типы липоксигеназ найдены в растениях, животных и грибах. Они вовлечены в различные клеточные функции. Моносахариды (от др.-греч. μόνος ‘единственный’, лат. saccharum ‘сахар’ и суффикса -ид), — органические соединения, одна из основных групп углеводов; самая простая форма сахара; являются обычно бесцветными, растворимыми в воде, прозрачными твердыми веществами. Некоторые моносахариды обладают сладким вкусом. Моносахариды — стандартные блоки, из которых синтезируются дисахариды (такие, как сахароза, мальтоза, лактоза), олигосахариды и полисахариды (такие, как целлюлоза и крахмал), содержат гидроксильные… Метаболи́зм (от греч. «превращение», «изменение») или обме́н веще́ств — набор химических реакций, которые возникают в живом организме для поддержания жизни. Эти процессы позволяют организмам расти и размножаться, сохранять свои структуры и отвечать на воздействия окружающей среды.Подробнее: Обмен веществ
Фенилалани́н (α-амино-β-фенилпропионовая кислота, сокр.: Фен, Phe, F) — ароматическая альфа-аминокислота. Существует в двух оптически изомерных формах l и d и в виде рацемата (dl). По химическому строению соединение можно представить как аминокислоту аланин, в которой один из атомов водорода замещён фенильной группой. Триозофосфатный транслокатор (ТФТ) — интегральный белок-переносчик внутренней мембраны хлоропластов. Он осуществляет экспорт триозофосфатов, образовавшихся в цикле Кальвина, в цитоплазму в обмен на неорганический фосфат (действует как антипорт). Белок ТФТ — димер, состоящий из двух идентичных субъединиц и содержит от шести до восьми гидрофобных доменов, которые образуют трансмембранные α-спирали. В качестве субстратов ТФТ использует дигидроксиацетонфосфат, глицеральдегид-3-фосфат а также 3-фосфоглицериновую… Проли́н (пирролидин-α-карбоновая кислота) — гетероциклическая аминокислота, в которую атом азота входит в составе вторичного, а не первичного, амина (в связи с чем пролин правильнее называть иминокислотой). Существует в двух оптически изомерных формах — L и D, а также в виде рацемата. Белки́ (протеи́ны, полипепти́ды) — высокомолекулярные органические вещества, состоящие из альфа-аминокислот, соединённых в цепочку пептидной связью. В живых организмах аминокислотный состав белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20 стандартных аминокислот. Множество их комбинаций создают молекулы белков с большим разнообразием свойств. Кроме того, аминокислотные остатки в составе белка часто подвергаются посттрансляционным модификациям, которые могут… Пероксисо́ма — клеточная органелла, окружённая единственной мембраной и не содержащая ДНК или рибосом (в отличие от митохондрий и хлоропластов). Пероксисомы присутствуют во всех эукариотических клетках. Они содержат ферменты, которые при помощи молекулярного кислорода окисляют некоторые органические вещества. В пероксисомах также происходит β-окисление жирных кислот. В них также протекают первые этапы образования плазмалогенов. У растений пероксисомы клеток листьев участвуют в процессе фотодыхания… Цереброзиды (гликосфинголипиды) (от лат. cerebrum — мозг) — природные органические соединения из группы сложных липидов. Компоненты клеточных мембран. Впервые были обнаружены в составе мозга (отсюда название). Гетероцисты — дифференцированные клетки нитчатых цианобактерий, осуществляющие азотфиксацию. При недостатке соединений азота в среде они появляются регулярно вдоль трихомы из вегетативных клеток и акинет. Цианобактерии — фототрофы, осуществляющие оксигенный фотосинтез, однако кислород, атмосферный и выделяемый при фотосинтезе, ингибирует фермент нитрогеназу, необходимую для азотфиксации, поэтому у нитчатых цианобактерий в процессе эволюции возникли специализированные клетки для азотфиксации. Пептидная связь — вид амидной связи, возникающей при образовании белков и пептидов в результате взаимодействия α-аминогруппы (—Nh3) одной аминокислоты с α-карбоксильной группой (—СООН) другой аминокислоты. Фумаратредуктаза — фермент, катализирующий реакцию превращения фумарата в сукцинат. Является важным ферментом для метаболизма микроорганизмов, поскольку участвует в процессе анаэробного дыхания. Про́инсули́н — полипептид, прогормон, производимый бета-клетками островков Лангерганса поджелудочной железы. Глико́лиз, или путь Эмбдена — Мейергофа — Парнаса (от греч. γλυκός — сладкий и греч. λύσης — расщепление) — процесс окисления глюкозы, при котором из одной молекулы глюкозы образуются две молекулы пировиноградной кислоты. Гликолиз состоит из цепи последовательных ферментативных реакций и сопровождается запасанием энергии в форме АТФ и НАДH. Гликолиз является универсальным путём катаболизма глюкозы и одним из трёх (наряду с пентозофосфатным путём и путём Энтнера — Дудорова) путей окисления глюкозы… Гистиди́н (L-α-амино-β-имидазолилпропионовая кислота) — гетероциклическая альфа-аминокислота, одна из 20 протеиногенных аминокислот. Является одной из двух условно-незаменимых аминокислот (наряду с аргинином). Незаменимой является только для детей. Сиаловые кислоты (от др.-греч. σίαλον «слюна») — общее название N- и O-замещённых производных нейраминовой кислоты, моносахарида с девятиатомной углеродной цепью. Наиболее распространённого представителя этого класса — N-ацетилнейраминовую кислоту (НАНК, Neu5Ac) — также часто называют сиаловой кислотой. Широко распространены в тканях животных, однако встречаются также у растений, грибов и бактерий. Впервые были обнаружены в 1930-е годы Гуннаром Бликсом, Эрнстом Кленком и другими в качестве преобладающих… Гликопептиды — пептиды, содержащие углеводные фрагменты (гликаны), ковалентно связанные с боковыми цепями аминокислотных остатков, составляющих пептид. Различают несколько классов гликопептидов в зависимости от типа связи с аминокислотными остатками: N-связанные (связь с остатками аспарагина), например β-N-Ацетилглюкозаминиласпарагин(GlcNAc-)Asn, O-связанные(связь через гидроксильную группу), например α-N-Ацетилгалактозаминилсерин (GalNAe-)Ser или треонин (GalNAc-)Thr, C-связанные (ковалентная связь… В биохимии, димер — макромолекулярный комплекс, образованный двумя, как правило, не ковалентносвязаными макромолекулами, такими как белки или нуклеиновые кислоты. Белковый димер — это четвертичная структура белка. ФАД — флавинадениндинуклеотид — кофермент, принимающий участие во многих окислительно-восстановительных биохимических процессах. ФАД существует в двух формах — окисленной и восстановленной, его биохимическая функция, как правило, заключается в переходе между этими формами. Малатдегидрогеназа (Дегидрогеназа яблочной кислоты, англ. MDH, EC 1.1.1.37 — фермент, катализирующий окисление S-малата (L-яблочная кислота) до оксалоацетата (щавелевоуксусной к-ты). Тетрáсахариды (от др. греч. τέσσερις — четыре — два и ζάχαροη — сахар) — органические соединения, одна из групп углеводов; являются частным случаем олигосахаридов.Подробнее: Тетрасахариды
Бактериохлорофи́ллы — гетерогенная группа фотосинтетических тетрапиррольных пигментов, которые синтезируются различными аноксигенными фототрофными бактериями, осуществляющими фотосинтез без выделения кислорода. Цитозо́ль (англ. cytosol, происходит от греч. κύτος — клетка и англ. sol от лат. solutio — раствор) — жидкое содержимое клетки. Большую часть цитозоля занимает внутриклеточная жидкость. Цитозоль разбивается на компартменты при помощи разнообразных мембран. У эукариот цитозоль располагается под плазматической мембраной и является частью цитоплазмы, в которую, помимо цитозоля, входят митохондрии, пластиды и другие органеллы, но не содержащаяся в них жидкость и внутренние структуры. Таким образом, цитозоль… Бе́та-окисле́ние (β-окисление), также цикл Кноопа — Линена, — метаболический процесс деградации жирных кислот. Своё название процесс получил по 2-му углеродному атому (С-3 или β-положение) от карбоксильной группы (-СООН) жирной кислоты, который подвергается окислению и последовательному отделению от молекулы. Продуктами каждого цикла β-окисления являются ФАДh3, НАДH и ацетил-КоА. Реакции β-окисления и последующего окисления ацетил-КоА в цикле Кребса служат одним из основных источников энергии для… Просты́е белки́ — белки, которые построены из остатков α-аминокислот и при гидролизе распадаются только на аминокислоты. Дипепти́ды (от греч. peptós — сваренный, переваренный) — органические соединения, состоящие из двух аминокислотных остатков, связанных пептидной связью. Дипептиды — соединения, промежуточные между полипептидами и аминокислотами. Глюконеогене́з — метаболический путь, приводящий к образованию глюкозы из неуглеводных соединений (в частности, пирувата). Наряду с гликогенолизом, этот путь поддерживает в крови уровень глюкозы, необходимый для работы многих тканей и органов, в первую очередь, нервной ткани и эритроцитов. Он служит важным источником глюкозы в условиях недостаточного количества гликогена, например, после длительного голодания или тяжёлой физической работы. Глюконеогенез является обязательной частью цикла Кори, кроме… Терминальная оксидаза, или альтернативная оксидаза пластид, — фермент, который находится на стромальной стороне тилакоидной мембраны в хлоропластах растений и водорослей и внутриклеточных впячиваниях цитоплазматической мембраны цианобактерий. Впервые гипотеза о его существовании была высказан в 1982 году, и подтвердилась годами позже, после открытия в мембране тилакоида фермента, аминокислотная последовательность которого была сходной с таковой у альтернативной оксидазы митохондрий. Обе оксидазы…Идентификация и количественная оценка гликозилирования белков
Гликозилирование — одна из наиболее распространенных посттрансляционных модификаций белков, и накопленные данные указывают на то, что подавляющее большинство белков в эукариотах гликозилировано. Гликозилирование играет роль во фолдинге, взаимодействии, стабильности и подвижности белков, а также в передаче сигнала. Таким образом, регулируя активность белка, гликозилирование участвует в нормальном функционировании клетки и в развитии заболеваний.Действительно, в последние несколько десятилетий растет осознание важности гликозилирования белков, поскольку аберрантное гликозилирование причастно к метаболическим, нейродегенеративным и неопластическим заболеваниям. Таким образом, идентификация и количественная оценка белковых олигосахаридов становятся все более важными как в фундаментальных науках биохимии и гликобиологии, так и в прикладных науках, особенно в биомедицине и биотехнологии. Здесь мы рассматриваем современные методологии идентификации и количественного определения олигосахаридов, в частности N, — и O -гликозилированных белков.
1. Гликозилирование белков
Углеводы необходимы для клеточного метаболизма и производства энергии и являются строительными блоками внеклеточного матрикса. Углеводы также играют роль во множестве биологических процессов, таких как внутри- и межклеточная передача сигналов и опосредование межклеточных взаимодействий. Как у растений, так и у животных они могут быть найдены в различных формах и структурах — моносахариды, олигосахариды или длинные и сложные полисахариды. Сахариды могут присутствовать в своих свободных формах или могут быть связаны с другими молекулами, такими как белки и липиды.В протеогликанах сахарид является доминирующим компонентом, тогда как в гликопротеинах сахарид составляет лишь небольшую часть всей молекулы.
Гликозилирование белка, то есть присоединение сахаридной части к белку, представляет собой модификацию, которая происходит либо котрансляционно, либо посттрансляционно. Два основных типа гликозилирования, N, -связанное и O -связанное, оба участвуют в поддержании конформации и активности белка, в защите белка от протеолитической деградации и во внутриклеточном перемещении и секреции белка [1]. N -гликановые фрагменты также играют ключевую роль в сворачивании, процессинге и секреции белков из эндоплазматического ретикулума (ER) и аппарата Гольджи [1]. В последние несколько десятилетий растущее внимание было направлено на гликозилирование белков в биомедицинской области, поскольку аберрантное гликозилирование было связано с различными врожденными [2], метаболическими, нейродегенеративными [3] и иммунными заболеваниями [4], а также с раком [5]. ]. Таким образом, изучение гликанов, их локализации и структурного образца прольет свет на их роль в регуляции и функции белков как в нормальных условиях, так и при патологиях.В биотехнологии также существует потребность в более глубоком понимании гликозилирования, поскольку эффективное производство рекомбинантных белков, включая гликопротеины [6], становится все более важным. Таким образом, существует большой интерес к использованию и развитию инструментов для гликобиологических исследований. Эта статья посвящена гликозилированию белков и новейшим методам идентификации и количественного определения гликопротеинов.
1.1. N -Гликаны
В белках олигосахарид, связанный с N-, присоединен к амидной группе остатка аспарагина в пределах консенсусной пептидной последовательности NXS / T, где X представляет собой любую аминокислоту, кроме пролина. N -гликозилирование происходит исключительно на белках, которые перемещаются по секреторному пути [7]. Сборка олигосахарида N -гликана начинается на цитозольной стороне ER, а затем он переворачивается на сторону просвета, где сборка завершается, и прикрепляется к транслированному белку. Присоединенный комплекс олигосахарид-белок имеет форму Glc 3 Man 9 GlcNAc 2 в ER, но после правильного фолдинга белка он переносится в аппарат Гольджи как Man 8 GlcNAc 2 [8].В аппарате Гольджи гликановая составляющая может оставаться в высокоманнозной форме или может подвергаться дальнейшей переработке — с удалением некоторых гликанов и добавлением множества других гликанов — с образованием гибридной и сложной структуры. Это гликановое «дерево» может быть двух-, трех- или четырехантенным, а также может быть разделено пополам за счет присоединения GlcNAc к сердцевине маннозы (рис. 1 (а)).
1.2. O -Гликаны
Наиболее распространенными O -гликозилированиями являются O -ацетилгалактозамин ( O -GalNAc) и O -ацетилглюкозамин ( O -GlcNAc). O -GalNAc присоединяется к гидроксильной группе белковых остатков серина или треонина через α -связь, тогда как O -GlcNAc присоединяется через β -связь. В отличие от N -связанного гликозилирования, консенсусная последовательность для O -связанного гликозилирования не была обнаружена [9], и это может происходить в различных внутриклеточных сайтах. Структурно гликозилирование O может включать моносахариды и / или олигосахаридные комплексы нескольких различных моносахаридов [9]. O -GalNAцилирование, которое происходит в Golgi и, следовательно, на секретируемых белках, является обычным O -гликозилированием, при этом более 10% белков человека являются O -GalNAцилированными. Существует восемь типов структур ядра O -GalNAc (рис. 1 (b)), которые могут быть удлинены. Часто это сложный процесс, поскольку один и тот же белок может нести разные структуры O -гликана. Наиболее распространенными O -GalNAцилированными белками являются муцины, сильно гликозилированные белки слизи, которые секретируются в основном эпителием желудочно-кишечного тракта и дыхательных путей, а также слюнными железами [9].Ряд врожденных, связанных с развитием и иммунных заболеваний связывают с изменениями гликана типа O муцина [10].
В отличие от N — и O — α -гликозилирование, β — O -GlcNAцилирование, которое происходит на цитозольных и ядерных белках, является динамической модификацией, напоминающей фосфорилирование белков [11]. Более того, существует динамическое перекрестное взаимодействие между O -GlcNAcylation и фосфорилированием: две модификации могут взаимно происходить на одном и том же остатке Ser / Thr или занимать соседние остатки [12–14].С момента открытия O -GlcNAc [15] у эукариот было обнаружено множество O -GlcNAцилированных цитозольных и ядерных белков, включая факторы транскрипции и трансляции, метаболические и сигнальные компоненты, цитоскелетные белки, онкогенные продукты и опухоли. белки-супрессоры [12, 16–21]. Известно, что белок O -GlcNAцилирование жизненно важно для жизни клеток и связано с регуляцией клеточного цикла и клеточного роста, пролиферации и апоптоза.
2.Анализ гликозилирования белков
Анализ белковых гликанов осложняется их огромным разнообразием и большим количеством возможных комбинаций гликозилирования: даже один белок может подвергаться нескольким гликозилированиям N — и O -гликозилирований. Более того, один и тот же сайт гликозилирования может быть занят разными гликанами в разных копиях белка, это явление называется микрогетерогенностью. Таким образом, надежная и подробная характеристика гликанов часто требует использования нескольких методов, как описано ниже.
2.1. Обнаружение гликопротеинов
Для обнаружения гликозилированных белков обычно используются два типа методов: окрашивание и методы, основанные на аффинности.
2.1.1. Процедуры окрашивания
Основным и простым методом определения гликозилированности белка является его разрешение на SDS-PAGE и окрашивание геля на гликопротеины. Большинство процедур окрашивания геля основаны на реакции периодической кислоты-Шиффа (PAS), в которой периодическая кислота окисляет две вицинальные диольные группы с образованием альдегида, который реагирует с реагентом Шиффа, давая пурпурный цвет [22].Такое хромогенное окрашивание геля чаще всего выполняется кислым фуксином [23], который может быть обнаружен флуоресцентно при 535 нм и, таким образом, в два-четыре раза более чувствителен, чем метод видимого окрашивания [24]. Некоторые коммерчески доступные флуоресцентные красители используют окисление периодатом для присоединения флуоресцентного гидразида без необходимости дальнейшего восстановления. Эти флуоресцентные красители очень чувствительны, обнаруживая <18 нг гликопротеинов [25]. Однако эти способы окисления периодатом могут быть проблематичными, поскольку могут происходить неспецифические реакции с белками, которые имеют эндогенные окисляемые фрагменты, например, альдегиды или кетоны.Кроме того, интенсивность окрашивания ниже для белков с меньшим количеством сайтов гликозилирования и «более бедных» гликановых деревьев, чем для сильно гликозилированных белков.
Два других гелевых красителя, о которых следует упомянуть, это альциановый синий и Stains-All [26, 27], которые используются для обнаружения протеогликанов, гликозаминогликанов и отрицательно заряженных гликопротеинов. Однако следует иметь в виду, что и для этих красителей возможны неспецифические реакции с фосфопротеинами и другими отрицательно заряженными белками.
2.1.2. Процедуры, основанные на аффинности
Следующие ниже методы более специфичны и облегчают определение типа гликозилирования.
(a) Сахарид-связывающие белки
Лектины — это белки (обнаруженные у животных, растений и микроорганизмов), которые специфически связывают моно- или олигосахариды [28]. За прошедшие годы было разработано множество приложений на основе лектинов для обнаружения и характеристики гликопротеинов (Таблица 1). В широко используемом лектиновом блоте образец белка разделяется на SDS-PAGE и переносится на мембрану из нитроцеллюлозы или поливинилиденфторида (PVDF).Затем мембрану инкубируют со специфическим лектином и метят группой, такой как дигоксигенин (DIG) или биотин, которая в дальнейшем будет связываться с вторичным антителом или с авидином, соответственно [29, 30]. Некоторые лектины коммерчески доступны от таких компаний, как Roche Applied Science и Sigma. Антитело или авидин конъюгированы с ферментом, который катализирует реакцию окрашивания (щелочная фосфатаза) или более чувствительную реакцию, вызывающую люминесценцию (пероксидаза хрена).
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(b) Методы на основе ферментов 9000 химия, использующая определенные ферменты, может быть использована для мечения и выделения гликозилированных белков.Например, белок, который является O — β -GlcNAцилированным или несущий O — α — и / или N -гликаны с концевым GlcNAc (очищенным или в смеси белков), инкубируется. с GALT ( β -1,4-галактозилтрансфераза), который специально добавляет азидогалактозу к GlcNAc. Затем модифицированному O -GlcNAc дают возможность реагировать с флуоресцентным алкином, образец разделяют на SDS-PAGE, и модифицированный белок визуализируют с помощью УФ-излучения с использованием гелевого имидж-сканера [24].Точно так же O -GlcNAцилированные пептиды можно пометить и дополнительно проанализировать с помощью масс-спектрометрии (МС).
(c) Методы на основе антител
O — β -GlcNAc может быть проанализирован методом, специфичным для этого уникального гликанового фрагмента, поскольку первичные антитела, например коммерчески доступные CTD 110.1 и RL2, были разработаны против него. Перекрестная реакция этих антител с вторичными антителами, конъюгированными с ферментами, которые катализируют реакцию, вызывающую цвет или люминесценцию, может быть использована в таких процедурах, как блоттинг, для обнаружения O -GlcNAцилированных белков [31–33].
2.2. Анализ структуры гликана
После подтверждения гликозилирования белка структура гликанового фрагмента может быть выяснена с помощью хроматографии и масс-спектрометрии. Гликан можно анализировать, когда он присоединен к белку или после его высвобождения. Мы остановимся на втором подходе, поскольку он более надежен.
2.2.1. Высвобождение гликана из белков
В зависимости от природы гликановый фрагмент может быть удален из белка ферментативными или химическими способами.
(a) Ферментативное расщепление гликанов
Большинство коммерчески доступных ферментов, расщепляющих гликаны, специфичны для N -гликанов, и меньшее количество доступно для O -гликанов. Большое разнообразие O -гликанов диктует, что для анализа одного образца может потребоваться несколько ферментов, и, таким образом, их применение ограничено. Таким образом, химическое удаление более применимо для O -гликанов.
Наиболее эффективным ферментом, расщепляющим N -гликановый фрагмент, могла бы быть гликоамидаза, в частности гликоамидаза F (PNGase F), которая расщепляет связь между GlcNAc и остатком Asn, тем самым превращая Asn в Asp.PNGase F расщепляет большинство типов N -связанных олигосахаридов, включая сложные структуры (например, высокоманнозную, гибридную и мультисиалилированную структуру), вплоть до тетраантенных деревьев и олигосахаридов, содержащих сульфатзамещенные остатки [34]. Однако для нативных белков могут потребоваться высокие концентрации PNGase F. Если олигосахарид содержит α -1,3-ядерное фукозилирование или отдельный N -ацетилглюкозамин, присоединенный к аспарагину, PNGase F не будет расщеплять фрагмент N -гликана, и в этом случае должна быть другая гликоамидаза, PNGase A. использован [35].Однако использование PNGase A может быть проблематичным для отщепления гликана от интактного белка или больших пептидов, вероятно, из-за его высокой молекулярной массы (80 кДа), которая ограничивает его доступность для сайта расщепления [34]. Кроме того, активность PNGase F и A снижается, когда гликан N- находится близко к N- или C-концу белка. Таким образом, для нативных гликопротеинов или известных гликановых фрагментов предпочтительны эндогликозидазы, которые расщепляют гликановое дерево N -гликанов между двумя основными GlcNAc (GlcNAc1-4GlcNAc).Следует помнить, что эндогликозидазы довольно специфичны: эндо-H расщепляет большинство олигосахаридов гибридного типа и высокоманнозные, сердцевинные фукозы и биссекционирующие гликаны; endo F 1 расщепляет гликаны высокоманнозного и гибридного типов [36]; endo F 2 расщепляет высокоманнозные и двухантенарные гликаны; endo F 3 расщепляет би- и трехантенные гликаны [34].
(b) Химическое удаление гликанов
Двумя основными химическими методами удаления O — и N -связанных олигосахаридов являются β -элиминирование и гидразинолиз.При β -элиминировании воздействие на гликопротеин щелочной среды (например, гидроксида натрия) приводит к высвобождению гликана. Свободный гликановый фрагмент может быть далее разложен на моносахариды дополнительными реакциями β -элиминирования до полной деградации, что называется «реакцией отслаивания». Тем не менее, разложение гликана можно предотвратить, проведя реакцию в присутствии боргидрида натрия, который восстанавливает оставшиеся альдегиды [37]. Несмотря на эффективность, этот метод имеет серьезный недостаток в том, что олигосахариды содержат только одну группу, доступную для мечения, — восстановленный концевой альдегид.Эта группа удаляется во время реакции, поэтому мечение после высвобождения гликана невозможно.
При гидразинолизе безводный гидразин добавляют к бессолевому лиофилизированному гликопротеину, чтобы начать реакцию гидролиза. Этот метод может использоваться как для углеводов, связанных как с N, , так и с O , которые могут даже выделяться отдельно при смешивании друг с другом, изменяя условия реакции, в частности температуру; O -связанных олигосахаридов высвобождаются при 60 ° C, тогда как N -связанных олигосахаридов высвобождаются при 95 ° C [38].Высвобожденный гликановый фрагмент остается неповрежденным, тогда как белок может разрушаться.
2.2.2. Обессоливание и очистка гликанов
После их высвобождения из гликопротеина свободные гликаны обычно находятся в растворе, который содержит соли, детергенты, белки, пептиды, аминокислоты и т. Д. Перед дальнейшим анализом эти загрязнения необходимо удалить. Существует несколько методов обессоливания и очистки гликанов. Метод обессоливания с графитированным углеродом основан на способности олигосахаридов связываться с углеродными шариками, в то время как несвязанные простые моносахариды, соли и детергенты могут смываться водой [39].Гликановый фрагмент элюируется с гранул ацетонитрилом (ACN), в то время как прочно связанные белки и пептиды остаются прикрепленными. Полярные олигосахариды обычно элюируются 25% ACN, в то время как заряженные олигосахариды требуют добавления 0,05% трифторуксусной кислоты (TFA) [39]. В другом методе обессоливания капля образца гликана загружается на катионообменную мембрану Nafion, которая плавает на воде. Белки, пептиды и соли в образце будут связываться с Nafion, и очищенный образец гликана может быть извлечен [40].Аналогично методу с мембраной Nafion, можно использовать катионообменную смолу AG-50. Соли и некоторые детергенты также могут быть удалены диализом [41].
2.2.3. Анализ структуры гликанов
После очистки можно использовать два подхода для анализа структуры гликанов: хроматография и МС.
(a) Анализ гликанов с помощью хроматографии
В хроматографии флуоресцентное мечение гликанового фрагмента обычно улучшает обнаружение. Флуоресцентная молекула конъюгирована с концом, восстанавливающим гликан, посредством восстановительного аминирования [42].Наиболее часто используемые флуорофоры — это 2-аминобензойная кислота (2-AA), 2-аминобензамид (2-AB) и 2-аминопиридин (2-AP). Однако флуорофоры на основе аминопиридина могут препятствовать специфической характеристике гликанов, поскольку их конъюгация может вызывать десиалилирование [42], тогда как два других флуорофора, 2-AA и 2-AB, могут вызывать только легкое десиалирование. Отрицательный заряд 2-AA делает его менее подходящим для хроматографии и МС, но более подходящим для электрофореза [42]. Флуорофор 2-AB неселективно маркирует гликаны в соотношении 1: 1, что позволяет детектировать субпикомолярно, сохраняя правильные молярные пропорции [43].
Наиболее широко используемые хроматографические методы разделения гликанов — это слабый анионообмен (WAX) [44], гель-фильтрация (на Bio-Gel P4) (Ashford, 1987), высокоэффективная анионообменная хроматография с импульсным амперометрическим детектированием (HPAEC- PAD) [45], и нормально-фазовая высокоэффективная жидкостная хроматография (NP-HPLC) [43]. Хотя все методы эффективны, следует тщательно выбирать подходящий метод с учетом конкретных требований и конкретных свойств конкретных анализируемых гликанов.Для восковой и гель-фильтрационной хроматографии требуются большие количества олигосахаридов. Для HPAEC-PAD требуются буферы с высоким pH и высоким содержанием соли (которые необходимо удалить перед дальнейшим анализом отделенных гликанов, например, в случае секвенирования экзогликозидазы). NP-HPLC, имеющий высокое разрешение и воспроизводимость, является наиболее эффективным методом анализа гликанов. В этом методе частично гидролизованный 2-AB-меченый декстран используется в качестве внешнего стандарта, а время удерживания неизвестного гликана (относительно стандарта) переводится в единицы глюкозы (GU) [43].Это значение GU сравнивается с базой данных экспериментальных значений для получения предварительного определения структуры гликана [46, 47]. Тем не менее, разрешение NP-HPLC может быть слишком низким для некоторых гликанов; таким образом, требуется дополнительный метод, такой как ВЭЖХ с обращенной фазой (ОФ-ВЭЖХ) [48]. Поскольку стандарт декстрана плохо растворяется при ОФ-ВЭЖХ, альтернативным стандартом является арабиноза [48].
Дальнейшая проверка гликановой последовательности может быть выполнена с помощью массива экзогликозидаз, то есть последовательного применения специфических экзогликозидаз для отщепления концевых моносахаридов от невосстанавливающего конца гликопротеина [49].Этот хроматографический метод также позволяет относительное количественное определение гликанов: вычисляя площадь пика, можно оценить процентное содержание олигосахарида определенного типа в общем репертуаре гликанов. Кроме того, может быть достигнута относительная количественная оценка одного и того же олигосахарида в нескольких образцах [43].
(b) Анализ гликанов с помощью MS
Анализ MS основан на ионизации гликанов, фрагментации и массовой идентификации фрагментов. Двумя основными методами МС для анализа олигосахаридов являются ионизация электрораспылением (ESI) и матричная лазерная десорбция / ионизация (MALDI).Перед анализом образец гликана необходимо обессолить, чтобы предотвратить ионизационную маскировку при анализе ESI и MALDI. В анализе MALDI аналит ионизируется через матрицу, обычно до одного оксидированного иона, [M + Na] + . Для гликанов применимо несколько матриц, из которых наиболее широко используется 2,5-дигидроксибензойная кислота (DHB). Тем не менее, в свете разнообразия гликанов и их различной полярности 2,4,6-тригидроксиацетофенон (THAP) является более подходящей матрицей [50]. В ESI и нано-спрее аналит в растворе преобразуется в аэрозоль с помощью электроспрея.Здесь ионы обычно многозарядные, что может усложнить анализ гликанов [51].
В МС следует учитывать режим полярности ионизации. Хотя большинство протеомных и гликомических анализов проводят в режиме положительных ионов, состав гликановых фрагментов разнообразен, и если конкретный фрагмент содержит N -ацетилирование и кислотные остатки, такие как сиаловая кислота, ионизация может быть предотвращена. В этом случае можно использовать режим отрицательных ионов, но дальнейший анализ МС / МС и фрагментации (выполняемый в положительном режиме) обычно не применим.Несмотря на вышесказанное, положительную ионизацию можно улучшить, приняв одну из следующих двух стратегий. Фрагмент гликана может быть десиалилирован сиалидазой, которая расщепляет концевую сиаловую кислоту [50]. Хотя десиалилирование обеспечивает лучшую ионизацию, некоторая информация теряется: в пуле высвободившихся олигосахаридов практически невозможно определить, какой олигосахарид обладал сиаловой кислотой. Альтернативно, перметилирование, при котором все группы OH, не содержащие гликанов, метилированы [52, 53], будет стабилизировать олигосахариды, содержащие остатки сиаловой кислоты.Более того, перметилирование маскирует высокополярные группы и придает небольшую гидрофобность; таким образом, олигосахариды легче отделяются от примесей (например, солей), которые могут мешать анализу, а также они становятся более равномерно и эффективно ионизированными [54]. Действительно, фрагментные ионы, полученные из перметилированных производных, легко соотносятся с последовательностями гликанов [55].
Фрагментация гликанов достигается за счет разрыва гликозидных связей между моносахаридами или связей внутри моносахаридного кольца (так называемое расщепление перекрестного кольца).Ионы, полученные на восстанавливающей стороне, обозначены X при расщеплении поперечного кольца и Y и Z при расщеплении гликозидов. Невосстанавливающиеся боковые ионы обозначаются A при расщеплении перекрестного кольца и B и C при гликозидном расщеплении (рис. 2) [41]. При диссоциации, вызванной столкновениями (CID), ионы попадают в ячейку столкновений, заполненную газом (обычно аргоном), и подвергаются столкновениям с высокой или низкой энергией. Когда выполняется с высокой энергией столкновения, CID приводит в основном к расщеплениям перекрестного кольца, предоставляя данные о моносахаридных связях, в то время как низкая энергия столкновения дает гликозидные расщепления, обеспечивая данные о последовательности моносахаридов и ветвлении [56].Недавно для анализа гликанов и гликопротеинов была применена высокоэнергетическая диссоциация с помощью C-ловушки (HCD) [57]. Разрешение этого метода в спектре малых масс выше, чем у CID, что позволяет идентифицировать массы моносахаридов. Таким образом, все ионы фрагментов, полученные с помощью комбинации методов, назначаются, обеспечивая полную последовательность гликана [57, 58]. Для детальной структурной характеристики необходимы несколько циклов изоляции и фрагментации ионов. Для этого анализа с ионной ловушкой с тандемной MS-фрагментацией является методом выбора, как описано Prien et al.[59].
Хотя спектры MALDI и ESI могут использоваться для выяснения состава и структуры гликанов, полная характеристика гликанов с помощью МС довольно сложна: ограничения количества гликанов являются обычными, и, что более важно, изобарная структура многих моносахаридов (т. Е. Имеющих одинаковую молекулярную веса) затрудняет их конкретную идентификацию, основанную исключительно на количестве атомов углерода. Хотя фрагментация гликанов может дать некоторую информацию о последовательности гликанов, ветвлении и связывании, для получения высоконадежной картины обычно требуется сочетание нескольких методов.Например, данные, полученные с помощью MS и массива экзогликозидаз, дадут почти полную характеристику гликановой последовательности, ветвления и сцепления [60]. Точно так же гидролиз олигосахарида после перметилирования с последующим анализом масс-спектрометрии с использованием газовой хроматографии (ГХ-МС) позволил бы идентифицировать неметилированные атомы углерода моносахарида. Более того, структурные характеристики и разветвленность могут быть лучше всего определены с помощью ЯМР-анализа, если доступно достаточно материала достаточной чистоты. Таким образом, может быть получена информация о разветвлении и внутренних олигосахаридных связях [53].
2.3. Картирование сайтов гликанов
Идентификация сайта гликозилирования важна, поскольку такие знания могут предоставить указание на функцию этого гликана. Более того, отнесение определенной структуры к конкретному сайту также может пролить свет на профиль гликозилирования белка и микрогетерогенность и, следовательно, вероятно, на его активность. Как упоминалось выше, удаление всего фрагмента N -гликана с помощью PNGase F или A приводит к превращению Asn в Asp и сдвигу на одну единицу массы для каждого сайта N -гликозилирования.Таким образом, когда дегликозилированный белок дополнительно переваривается трипсином, пептиды, которые связаны с гликановым фрагментом, будут на 1 Да тяжелее ожидаемой теоретической массы. Подвергая эти пептиды MS / MS, каждый пептид, который содержит Asp (вместо Asn), идентифицируется как ранее присоединенный к фрагменту гликана [61]. Аналогичный подход включает удаление гликанов с помощью PNGase F в присутствии
.Роль гликозилирования в передаче сигналов рецепторами
5.1. Гонадотропины
В настоящее время хорошо задокументировано, что большинство GPCR обладают способностью передавать через множественных путей в данном типе клеток. В течение многих лет эта гипотеза плохо понималась и считалась артефактом рекомбинантных клеточных систем. С недавней разработкой аллостерических агонистов, антагонистов и модуляторов GPCRs пролилось больше света на эту концепцию; например, прямое нацеливание на определенные сигнальные пути было продемонстрировано для различных лигандов [4, 44].Это явление недавно было названо предвзятой сигнализацией. Проще говоря, концепция смещенной передачи сигналов описывает способность лигандов направлять специфические и различные биологические ответы через активацию избранных сигнальных путей лиганд-специфическим образом [4]. Известно, что существует множество рецепторов, которые связаны с множеством встречающихся в природе лигандов. Гонадотропины, ЛГ и ФСГ являются прекрасными примерами этого явления. Поскольку известно, что различное гликозилирование изоформ гонадотропина изменяет их физико-химические свойства, можно рассматривать изоформы гонадотропина как разные лиганды с потенциально тонкой, но уникальной ассоциацией с родственными им рецепторами [4, 24 ].Кроме того, взаимодействие этих разнообразных лигандов с рецептором может приводить к множественным конформациям лиганд-рецептор, что, в свою очередь, приводит к наблюдаемой активации различных биологических путей передачи сигналов для ЛГ, ХГЧ и ФСГ [13, 45, 46]. Таким образом, было высказано предположение, что изформы гонадотропина являются естественными предвзятыми агонистами своих рецепторов [4, 24].
Молекулярная основа предвзятого агонизма лежит в стабилизации конформации (ов) рецептора, которая увеличивает сродство предвзятого комплекса агонист-рецептор к отдельному и специфическому пути передачи сигнала по сравнению с другим [44].Поскольку GPCR в основном используют G-белки в качестве передатчиков сигналов, предвзятый агонизм будет означать лиганд-зависимое предпочтение комплекса лиганд-рецептор для конкретного G-белка над другим. Поскольку передача сигналов GPCR не является исключительной для через G-белков, предвзятый агонизм не ограничивается передачей сигналов G-белков, и появились недавние описания предвзятой опосредованной лигандом активации не-G-протеин-зависимой передачи сигналов GPCR, например случай с передачей сигналов β-аррестина.
Рисунок 2.
Гликозилированные варианты гонадотропинов являются предвзятыми агонистами своих рецепторов. Гонадотропины секретируются в кровь в виде изоформ, которые различаются по степени сложности гликозилирования. Было показано, что вариации гликозилирования важны для периода полужизни в плазме и связывания рецепторов. Теперь понятно, что эти изоформы также влияют на биологическую активность гонадотропинов [4]. В случае ФСГ (изображен) гликозилированные варианты стабилизируют различные конформации комплекса рецептор-лиганд.Это приводит к различному сродству комплекса рецептор-лиганд к ассоциации с G-белками. Сильно сложный, терминально сиалированный ФСГ индуцирует активацию сигнальных путей Gs. Менее сложное гликозилирование, связанное с терминальной маннозой, приводит к активации сигнальных путей Gs и Gi. Дегликозилированный ФСГ активирует сигнальный путь Gi. Поскольку известно, что FSHR влияет на другие пути передачи сигналов, такие как Gq, эти изоформы также могут дифференциально активировать передачу сигналов Gq.
В течение многих лет ФСГ использовался в качестве модели для понимания роли гликозилирования в определении функции гликопротеинового гормона. Несколько лет назад мы отметили, что по-разному гликозилированные варианты чФСГ могут индуцировать активацию как сигнальных путей Gs, так и Gi [24, 47]. Это явление проявляется в виде колоколообразной кривой концентрация-ответ в in vitro системах анализа для менее гликозилированных клеток насекомых, экспрессирующих hFSH (BV-hFSH). Было обнаружено, что коклюшный токсин блокирует нисходящий поворот зависимости доза-ответ, указывая на то, что нисходящая фаза кривой BV-hFSH была обусловлена активацией Gi при более высоких концентрациях гормона.Эти фармакологические отношения были описаны ранее для других рецепторов, таких как рецепторы катахоламинов и аденозина [48, 49]. В случае клеток насекомых, экспрессирующих hFSH (BV-hFSH), гликозилирование прекращалось по коротким разветвленным остаткам маннозы, и белок демонстрировал более простой паттерн миграции при хроматофокусировании (Arey, неопубликованные данные). Последующие эксперименты с использованием анализа ADP-рибозилирования, наряду с иммунопреципитацией и вестерн-блоттингом специфических G-белков, показали, что эти фармакологические реакции были однозначно связаны с активацией специфических G-белков [50].Взятые вместе с in vivo и эффектами различных препаратов ФСГ [4], эти данные демонстрируют, что активности, наблюдаемые в передаче сигналов, непосредственно транслируются в ответные реакции роста органов и демонстрируют способность смещенного лиганда (например, BV-hFSH) вызывать паттерн ответа, отличный от нативного лиганда (phFSH) (рис. 2). Интересно, что подобное зависящее от гликозилирования смещение сигнала было отмечено для других секретируемых гликопротеинов (например, IL22 и BMP6, [51, 52]), включая LH / hCG [53, 54].Было высказано предположение, что гликозилирование лигандов необходимо для димеризации рецептора LH / hCG [53, 55]. В случае BMP6 подробный мутагенез вокруг ключевых остатков аспарагина выявил важность гликозилирования во взаимодействиях с его рецептором [52]. В случае IL22 было показано, что один остаток фукозы на Asn54 необходим для полной эффективности цитокина на его рецепторе. Стоит отметить, что кинетика связывания рецептора была изменена более сложным гликозилированием в этом сайте [51].Подобные, но более драматические эффекты гликозилирования на кинетику связывания были отмечены и для эритропоэтина [56]. Эти примеры закладывают основу для концепции, согласно которой различные родственные природные лиганды взаимодействуют с рецептором, индуцируя определенные конформации рецептора, и что гликозилирование играет роль в содействии этой стабилизации, таким образом передавая специфические сигналы, уникальные для данного физиологического состояния. Сходные активности в конечном итоге были обнаружены для других GPCR [57]. Следовательно, с механистической точки зрения существует сильная поддержка идеи, что изменение паттерна гликозилирования гликопротеиновых гормонов приводит к смещению лигандов, которые направляют активацию одного сигнального пути над другим.Эти данные подтверждают мнение о том, что более основные изоформы гонадотропинов связываются с более высоким сродством, но являются «менее» биоактивными. Следовательно, различные гликозилированные варианты могут взаимодействовать с рецептором тонкими, но уникальными способами, приводя к различным сигнальным и биологическим ответам. В целом, данные показывают, что передача сигналов рецепторами эволюционировала, чтобы передавать сложные регуляторные сигналы в ответ на различные лиганды, которые динамически регулируются, чтобы приспособиться к внешним / внутренним воздействиям и, в конечном итоге, поддерживать гомеостаз.
.значений гликозилированного белка — Большая химическая энциклопедия
Процедуры анализа гликозилированных белков включают в себя различные методики (A1) и адаптированы для соответствия определенным требованиям. Идентификация и количественное определение кетоаминовой связи в различных белках основывались в основном на спектрофотометрическом анализе тиобар-битуровой кислоты. Подчеркивается точка зрения, что короткие лабораторные анализы для белков, аддуктированных кетоамином, имеют преимущество перед быстрым сообщением значений Hb Aj как представления гликогемоглобина, если не уделяется строгого внимания контролю источников вариации.Исключение свободной глюкозы и лабильного аддукта альдимина является обязательным во всех анализах гликозилпротеина. [Стр.16]Желательно усовершенствовать эукариотическую трансфекцию по ряду причин. К некоторым протеинам, имеющим терапевтическую ценность, прикреплены остатки сахара. Такие белки известны как гликозилированные белки. Как и в случае с продуцированием инсуна, было бы полезно использовать процессы на основе клеточных культур для получения специфических гликозилированных белков с терапевтическим потенциалом. Однако гликозилированные белки — нет… [Стр.59]
Хотя электроспрей используется для молекул всех молекулярных масс, он оказал особенно заметное влияние на точное измерение молекулярной массы белков. Традиционно прямое измерение молекулярной массы белков было затруднительным, поскольку точность получаемых значений составляла всего десятки или даже сотни дальтон. Появление электроспрея означает, что молекулярные массы 20 000 Да и более могут быть измерены с беспрецедентной точностью (рис. 40.6). Такой уровень точности означает, что также возможно идентифицировать посттрансляционные модификации белков (например,g., гликозилирование, ацетилирование, метилирование, гидроксилирование и т. д.) и для обнаружения массовых изменений, связанных с заменой или делецией отдельной аминокислоты. [Pg.291]
Гликозидирование AChE и BChE несут 3 и 9, соответственно, консенсусных последовательностей N-гликозилирования, присоединяющих углеводные остатки к коровому белку через аспарагины. Различные молекулярные формы ферментов в разных тканях показывают разное количество и состав углеводных остатков. Было показано, что N-гликозилирование на всех участках важно для эффективного биосинтеза, секреции и выведения ХЭ из кровотока.Измененные паттерны гликозилирования AChE наблюдались в головном мозге и спинномозговой жидкости пациентов с болезнью Альцгеймера (БА), что имеет потенциальную диагностическую ценность. [Pg.359]
Верхняя панель Показан профиль гидропатии всего белка-предшественника 69 кДа. По оси абсцисс отложены аминокислотные остатки, а по оси ординат положительные значения указывают на гидрофильность. Черные и заштрихованные прямоугольники в нижней части рисунка обозначают рассчитанную сигнальную последовательность и аминоконцевые пропептидные домены соответственно.Помечены зрелый и карбоксиконцевой домены. Консенсусные сайты гликозилирования N-связанного ядра изображены разветвленными структурами. [Pg.253]
Этот метод также используется в биофармацевтической промышленности для определения однородности продукта. На гомогенность лучше всего указывает появление в геле единственной полосы белка, имеющей предсказанное значение пи. Однако интерпретация значений нескольких полос менее прямолинейна, особенно если белок гликозилирован (полосы также можно окрашивать… [Pg.181]
Не было обнаружено изменения периода полужизни белка с гликозилированным альбумином (39) и ферритином (51). Однако Джонс и Петерсон (45) обнаружили, что выживаемость фибриногена, которая была снижена у пациентов с диабетом с повышенной гликемией, может быть увеличена до нормального значения вскоре после инсулинотерапии. Это предполагает, что лабильное основание Шиффа может играть роль в регуляции обмена фибриногена. [Pg.440]
,
Минутку …
Пожалуйста, включите куки и перезагрузите страницу.
Этот процесс автоматический. Ваш браузер в ближайшее время перенаправит вас на запрошенный контент.
Подождите до 5 секунд…
+ ((! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + []) + (! + [] + (!! []) + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [ ] + !! [] + !! []) + (+ [] — (!! [])) + (! + [] + (!! []) + !! [] + !! []) + (+ !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! []) + (! + [] + ( !! []) + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [])) / + ((! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + []) + (! + [ ] + (!! []) + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! []) + ( ! + [] — (!! [])) + (! + [] + (!! []) + !! [] + !! []) + (+ [] + (!! [!]) — []) + (! + [] + (!! []) + !! [] + !! []) + (! + [] + (!! []) + !! []) + (! + [] + (!! []) + !! [] + !! []))
+ ((! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + []) + (+ [] + (!! [!]) — []) + (+ [] — (!! [])) + (! + [] + (!! []) + !! [] + !! []) + (+ !! []) + (! + [] + (!! [ ]) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! [] ) + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (+ [] + (!! []) — []) + (! + [] + (!! []) + !! [])) / + ((! + [] + (!! []) + !! [] + !! [] + !! [] + []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + ( !! []) + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! []) + (+ [] — (!! [])) + (+ [] — (!! []!)) + (+ [] + (!! []) + !! [] + !! [ ]) + (! + [] + (!! []) + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! []))
+ ((! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + []) + (! + [] + (!! []) + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [ ] + !! [] + !! []) + (+ [] — (!! [])) + (! + [] + (!! []) + !! [] + !! []) + (+ !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! []) + (! + [] + ( !! []) + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [])) / + ((! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [ ] + []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] +! ! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! []) + (+ !! [] ) + (! + [] + (!! []) + !! []) + (! + [] + (!! []) + !! [] + !! []) + (! + [] + (!! []) + !! []) + (+ !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! []))
+ ((! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + []) + (! + [] + (!! []) + !! []) + (! + [] + (!! []) + !! [] +! ! [] + !! [] + !! [] + !! [] + !! []) + (+ [] — (!! []!)) + (+ [] + (!! [] ) + !! [] + !! []) + (+ !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] +! ! []) + (! + [] + (!! []) + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [ ] + !! [] + !! [] + !! [])) / + ((! + [] + (!! []) + !! [] + !! [] + !! [] +! ! [] + !! [] + []) + (+ !! []) + (! + [] + (!! []) + !! [] + !! []) + (+ !! [ ]) + (+ [] — (!! []) (! + [] + (!! [])!) + + !! [] + !! []) + (+ [] + (!! []) + !! [] + !! [] + !! []) + (+ [] + (!! []) -! []) + (+ [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + !! []))
+ ((! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + ( ! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! []) + (+ [] — (!! []) (! + [] — (!! [])) +) + (! + [] + (!! []) + !! []) + (! + [] + (!! []) + !! [] + !! []) + (! + [] + (!! []) + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [])) / + ((! + [] + (!! []) + !! [] + []) + (! + [] + (! ! []) + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] +! ! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [ ] + !! []) + (+ [] + (!! [!]) + !! [] + !! []) + (+ [] + (!! [!]) — []) + ( ! + [] + (!! []) + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + !! []))
+ ((! + [] + (!! []) + !! [] +! ! [] + !! [] + !! [] + !! [] + !! [] + []) + (+ !! []) + (! + [] + (!! []) +! ! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! []) + (+ [] — (!! [])) + (! + [] + (!! []) + !! [] + !! []) + (+ [] + (! ! []) -! []) + (+ [] + (!! []) + !! [] + !! []) + (+ [] + (!! []) + !! [] )) / + ((! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + [] ) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) +! ! [] + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (! ! []) + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! []) + (! + [] + (!! [ ]) + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! []))
+ ((! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + []) + ( + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [ ] + (!! []) + !! [] + !! [] + !! []) + (+ [] — (!! []!)) + (+ [] + (!! [] ) + !! [] + !! []) + (+ [] + (!! []) -! []) + (+ [] + (!! []) + !! [] + !! []) + (! + [] + (!! []) + !! [])) / + ((! + [] + (!! []) + !! [] + !! [] +! ! [] + !! [] + !! [] + !! [] + !! [] + []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! []) + (+ [] — (!! []) (! + [] + (!! [])) + + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! []) + (+ !! []))
+ ((! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! [] + []) + (! + [] + (!! []) + !! []) + (! + [] + (!! []) + !! [ ] + !! [] + !! [] + !! [] + !! [] + !! []) + (+ [] — (!! []!)) + (+ [] + (! ! []) + !! [] + !! []) + (+ !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [ ] + !! []) + (! + [] + (!! []) + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [])) / + ((! + [] + (!! []) + !! [] + !! [] + !! [ ] + !! [] + !! [] + []) + (! + [] + (!! [ ]) + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [ ] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [+ !! [] + !!] [] + !! [] + !! [] + !! [] + !! []) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! []) + (+ [] — (!! [])) + (! + [] + (!! []) + !! [] + !! [] + !! [] + !! [] + !! [] + !! []) + (+ !! []) + (! + [] + (!! []) + !! [] + !! [] + !! []) )
.