Гликирование белков — преграда для долголетия
Глюкоза необходима для нормального функционирования нашего тела. Головной мозг работает исключительно на глюкозе. Но ее избыток дает побочное действие, при котором сахар крови вступает в реакцию с белками, нарушая функцию последних. В этом состоит суть процесса гликирования белков организма, который ведет к скорейшему старению, образованию морщин, сердечно — сосудистым и другим заболеваниям.
Белки становятся не работоспособными, поскольку нарушается их структура. Вследствие гликирования эластина и коллагена, — основных белков сосудистых стенок, развивается фиброз и атеросклероз. Стенки сосудов становятся хрупкими, теряется их эластичность, в них образуются трещины, которые заполняются холестериновыми бляшками.
Глюкоза содержится в любой ткани. С процессом гликирования белка мы сталкиваемся часто в повседневной жизни, когда поджариваем что-либо до хрустящей корочки. При воздействии высокой температуры глюкоза вступает в реакцию с белком ткани.
Схожие процессы запекания белков происходят и в организме человека, с той лишь разницей, что протекают они медленнее. Наиболее опасны конечные продукты гликирования для сетчатки глаза и хрусталика, коронарных артерий и почек.
Возникают различные воспалительные процессы, развиваются остеоартрит, ревматоидый артрит, рак предстательной железы. Повышается свертываемость крови, что увеличивает риск тромбозов и гипертонии.
Гликирование вызывает инсулиннезависимый диабет второго типа. Это приводит к высокому содержанию глюкозы в крови, а это в свою очередь к еще большему накоплению конечных продуктов гликирования. Эта взаимосвязь и является основной причиной осложнений, которые дает диабет.
Таким образом, для предотвращения гликирования белка в нашем организме, а следовательно и для замедления старения, нам необходимо устранить причины, ведущие к нарушению функций белков и являющиеся преградой для здоровья и долголетия. Таких причин две.
1. Излишнее потребление быстрых углеводов, продуктов имеющих высокий гликемический индекс.
Гликемический индекс того или иного продукта — это показатель его влияния на уровень сахара крови после его употребления. Он показывает быстроту усвоения источника сахара по сравнению с глюкозой, индекс которой принят за 100 процентов. Значения гликемического индекса выше семидесяти, считаются высокими.
2. Потребление гликированного белка в пищу. Вся жареная пища, приготовленная нами, содержит гликированный белок.
Особенно опасны в этом плане готовые блюда общепита, в особенности еда в ресторанах, или так называемая «высокая кухня» где основное значение придается внешнему виду подаваемых блюд. Они содержат многократно больше продуктов гликирования, чем пища домашнего приготовления.
Чтобы не разрушать себя изнутри, нужно отказаться от жарки, как способа приготовления пищи. Еда приготовленная при температуре ниже 120 градусов, не ведет к образованию продуктов гликирования.
Пищу можно готовить в микроволновке, варить, готовить на пару, тушить, бланшировать, мариновать в натуральном уксусе или лимонном соке и т.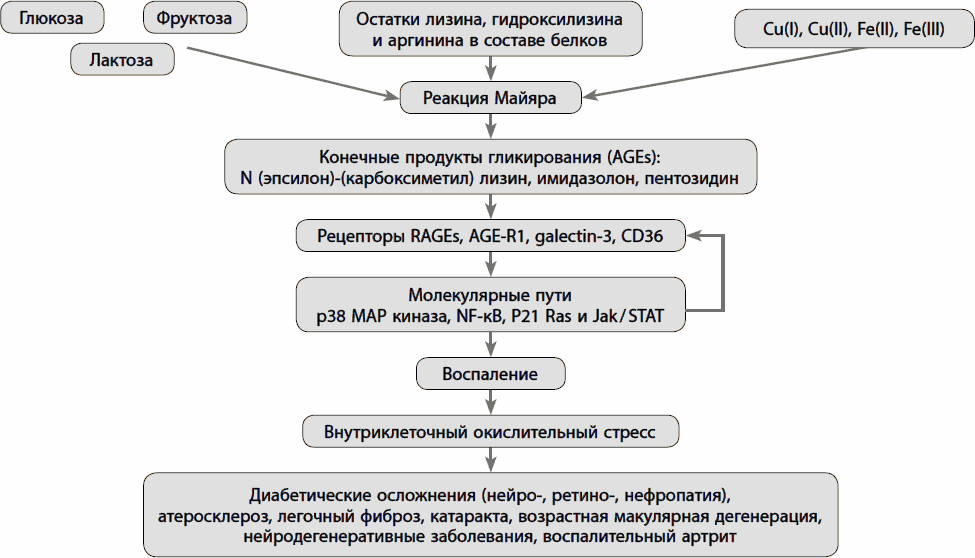 д. Многие продукты можно и нужно употреблять в сыром виде.
д. Многие продукты можно и нужно употреблять в сыром виде.
Получается замкнутый круг. Углеводы нам жизненно необходимы, как источник энергии. А употребление углеводов ведет к старению. Где же выход?
Наука пока не дала окончательного ответа на этот вопрос, но исследования в этом направлении ведутся. Возможно, скоро будет найдено средство, полностью предотвращающее гликирование белков в организме.
На сегодняшний день уже существует такой препарат, — это Метформин, который довольно хорошо изучен и рекомендован как средство для продления жизни, понижающее уровень сахара крови, то есть имитирующее низкокалорийное питание. Метформин противопоказан людям с почечной недостаточностью, и назначается только врачем.
Уровень гликирования определяет скорость старения. Определить этот уровень можно, сдав анализ крови на гликированный гемоглобин (HbA1C). Анализ не обязательно проводить натощак. Оценить результаты анализа можно так. Ниже 7.6% — хорошо. От 7.6 до 9% — удовлетворительно. Выше 9% — плохо.
Выше 9% — плохо.
Для успешной борьбы со старением следует привести в порядок свой образ питания. Для этого необходимо придерживаться принципов калорийно ограниченного питания, при помощи которого снижается уровень сахара крови, а соответственно снижается и вероятность реакции глюкозы крови с белками тела.
Кроме этого, калорийно ограниченное питание увеличивает аутофагию — процесс, обеспечивающий переваривание поврежденных белков и клеточного мусора. Структуры клеток обновляются и улучшаются их функции.
Очень хорошо способствует аутофагии проведение разгрузочных овощных дней 2-4 раза в месяц, когда вы в течение суток пьете воду и едите неограниченно только овощи и никакой другой пищи.
При обычном, традиционном питании основным фактором риска является высокий гликемический индекс продуктов. Избежать высоких концентраций глюкозы в крови можно, употребляя продукты с невысокими значениями гликемического индекса, которые более медленно отдают глюкозу в кровь.
Некоторые продукты обладают небольшим гликемическим индексом, но содержат другие моносахара, которые еще более вредны, чем глюкоза, — это фруктоза, содержащаяся в мёде и сладких фруктах, которая в десять раз активнее производит гликирование белков, а также лактоза — молочный сахар, содержащийся в молоке. Поэтому, ни мёд, ни молоко не могут быть рекомендованы как продукты для здоровья и долголетия, в связи с тем, что они способствуют только лишь ускоренному старению.
Поэтому, ни мёд, ни молоко не могут быть рекомендованы как продукты для здоровья и долголетия, в связи с тем, что они способствуют только лишь ускоренному старению.
В образе здорового питания должно быть сведено к минимуму или вовсе исключено из рациона питания употребление быстрых углеводов, которые в избытке содержатся в выпечке, конфетах, сладких напитках (сладкий чай, фруктовые соки, сладкая газировка и т.д.
Калорийно ограниченное питание следует строить в основном на употреблении большого количества овощей, бобовых, каш из различных круп, включая в меню не жареные рыбу и морепродукты, мясо птицы и немного нежирного мяса. То есть питание должно строиться в основном на медленных углеводах, полисахаридах, которые медленно без скачков, повышают уровень сахара крови, не усиливая процесс гликирования, а значит и старения, и надолго сохраняя чувство сытости.
Я сам поступаю так и рекомендую всем добавлять в углеводные блюда (например в каши) и в напитки (например в кофе) молотую корицу.
Корица понижает уровень сахара крови и действует по типу препаратов бигуанидов. Научно установлено, что куркума также эффективно снижает образование конечных продуктов гликирования. Две этих специи должны всегда присутствовать в рационе для профилактики старения.
С одной стороны, контроль над своим питанием дело довольно хлопотное. С другой стороны — чрезвычайно полезное. Как с точки зрения здоровья и долголетия, так и с точки зрения материальных затрат. Основные компоненты такого питания — крупы для каш и свежие овощи — это самое малозатратное питание, какое только может быть.
Гликирование белков — старение организма
Гликирование белков — одна из главных причин, вызывающих старение организма, провоцирующих атеросклероз, инсульт, инфаркт, морщины и т.д.
Гликирование белков — старение организма
Гликирование белков приводит к таким последствиям как:
- повреждение коллагена кожи, в результате которого происходит появление морщин
- повреждение кристаллина хрусталика глаза, в результате — катаракта глаза и потеря зрения
- конечные продукты гликирования вызывают системное воспаление, приводящее к старению всего организма и атеросклерозу сосудов.
 Атеросклероз сосудов — это основная причина инсульта и инфаркта сердца.
Атеросклероз сосудов — это основная причина инсульта и инфаркта сердца.
Ссылка на исследование:
- http://www.ncbi.nlm.nih.gov/pubmed/14568004/
- http://www.ncbi.nlm.nih.gov/pubmed/20349184
- http://www.ncbi.nlm.nih.gov/pubmed/14641062
Причины, вызывающие гликирование белков
- потребление в пищу быстрых сахаров (глюкоза, фруктоза, лактоза и галактоза из молочных продуктов), которые вызывают процессы гликирования
- потребление в пищу конечных продуктов гликирования (КПГ). КПГ образуются во время термической обработки продуктов питания при температуре свыше 120 градусов по Цельсию: жарка (жареный картофель и мясо), выпекание (пироги из духовки и яблоки), жарка на огне (шашлык). Золотистая корочка, образующаяся во время жарки и выпекания — это и есть КПГ.
Как защитить себя от гликирования белков
- Современная наука ещё не научилась разрушать поперечные сшивки молекул белка (хотя уже скоро это станет возможным).
 Но мы знаем, как можно существенно замедлить скорость гликирования. Например, свойством замедлять гликирование белков обладают такие средства как аспирин, метформин, витамин B1 (тиамин), витамин В6, глюкозамин сульфат. Ссылка на исследование способности метформина препятствовать гликированию белков >> http://www.ncbi.nlm.nih.gov/pubmed/14502106 Самый эффективный препарат для торможения процесса гликирования белков — это Пиридоксамин (одна из форм витамина B6) >> http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3762829/
Но мы знаем, как можно существенно замедлить скорость гликирования. Например, свойством замедлять гликирование белков обладают такие средства как аспирин, метформин, витамин B1 (тиамин), витамин В6, глюкозамин сульфат. Ссылка на исследование способности метформина препятствовать гликированию белков >> http://www.ncbi.nlm.nih.gov/pubmed/14502106 Самый эффективный препарат для торможения процесса гликирования белков — это Пиридоксамин (одна из форм витамина B6) >> http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3762829/ - Также, для замедления скорости гликирования белков, следует резко сократить потребление быстрых сахаров и продуктов с высоким гликемическим индексом (сладости, мёд, многие видов фруктов, мучные изделия и др.). Продукты термической обработки при температуре свыше 120 градусов по Цельсию (жареное и печёное, хлеб, картофель-фри, чипсы, жареный картофель, а также любые виды шашлыка — любая гарь и копоть) следует полностью исключить из своего рациона питания.

Ссылка на исследование:
- www.ncbi.nlm.nih.gov/pmc/articles/PMC3704564/
Каждую неделю появляются публикации новых научных исследований, и становятся известны новые средства, позволяющие продлевать жизнь человеку и улучшать качество жизни. Наука очень быстро развивается. Предлагаем Вам стать постоянным подписчиком на свежие статьи этого научного блога, чтобы не упустить все самые передовые новости.
Уважаемый читатель. Если Вы находите материал данного блога полезным и имеете желание, чтобы данная информация была доступна всем, то можете помочь в раскрутке блога, уделив этому всего пару минут Вашего времени. Для этого пройдите по ссылке.
Рекомендуем также прочитать:
- Витамин B1 (тиамин) тормозит старение организма, блокируя гликирование белков
- Витамин D тормозит старение организма
- Глюкозамин сульфат тормозит старение организма
- Никотинамид рибозид или Витамин B3 от старости
- Витамины и продолжительность жизни
- Препарат метформин — лекарство от старости №1 в Мире
- Аспирин кардио — замедляет старение организма
- Как остановить старение человека https://nestarenie.
 ru/
ru/
Борьба с гликированием — основной причиной старения кожи
Гликирование это химическая реакция соединения сахаров с белками. Гликирование идет в организме постоянно и повсеместно, приводя к образованию Конечных Продуктов Гликирования — КПГ (по английски: Advanced Glycation Endproducts — AGE) — одой из основных причин старения.
В коже наиболее подвержены гликированию эластин и коллаген. В результате накопления продуктов гликирования волокна матрикса становятся более жесткими, хрупкими, теряя эластичность.
Гликирование напрямую является причиной появления большинства признаков старения кожи (дряблость кожи, неравномерность пигментации, проблемы заживления…).
Гликирование идет непрерывно в течение всей жизни, ускоряясь и усиливаясь с годами. Оно приводит к преждевременному старению и возрастным недугам.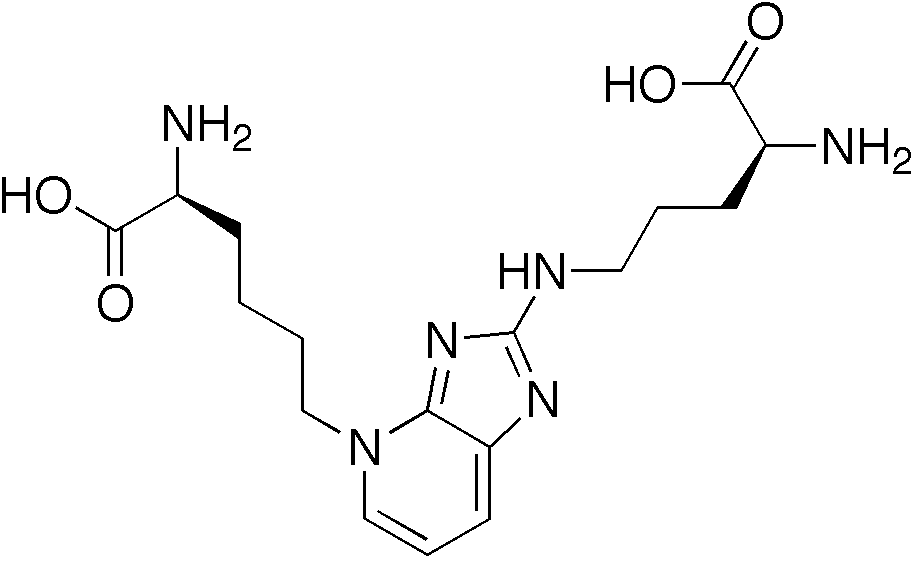
Организм не имеет системы самозащиты для борьбы с гликированим.
Последствия гликирования можно контроллировать, придерживаясь здорового образа жизни, избегая чрезмерного загара, табака, алкоголя, жаренных продуктов и сладостей.
Использование ингибиторов гликирования может замедлить реакцию гликирования. Однако их эффективность на медленно обновляемых белках, таких как белки кожи, весьма низка, если не использовать их длительное время в высоких дозах.
Открытые в начале 2000-х дегликирующие молекулы — основное достижение в контроле над признаками старения, вызванными гликированием. Они возвращают белкам утраченные свойства, разрушая порожденные возрастным гликированием поперечные сшивки в белковых структурах.
Средства Nacriderm AGE BREAKER содержат молекулярную фракцию Розмариновой кислоты. Это первая доступная антивозрастная программа, которая использует дегликирующую молекулу, обращая вспять реакцию гликирования. Продолжение следует…
Продолжение следует…
Роль конечных продуктов гликирования и их рецепторов в развитии осложнений сахарного диабета
В развитии осложнений сахарного диабета (СД) участвует огромное количество факторов. Однако ключевую роль играет гликирование белков, характерное для хронической гипергликемии, активации воспаления и окислительного стресса.
Установлено, что образование и накопление конечных продуктов гликирования (КПГ) негативно воздействует на функции внутри- и внеклеточных структур. В частности, КПГ нарушают образование поперечных связей между своими рецепторами и молекулами базальной мембраны внеклеточного матрикса. Подобные изменения приводят к прогрессированию атеросклероза, ускоренному росту атеросклеротических бляшек, патологическому фиброзу миокарда с последующим развитием сердечной недостаточности.
В статье рассматривается участие КПГ и их рецепторов в развитии сердечно-сосудистых заболеваний при сахарном диабете.
Участие конечных продуктов гликирования в формировании атеросклеротической бляшки
Конечные продукты гликирования (КПГ) – гетерогенная группа молекул, которые образуются в результате неферментативного гликирования и окисления белков, липидов и нуклеиновых кислот. К ним также относятся карбонильные соединения – продукты их деградации [1, 2]. Хорошо изученными КПГ являются пентосидин – производное перекрестного связывания белков и N-карбоксиметил-лизин (N-carboxymethyllysine – CML). Необходимо отметить, что именно флуоресценция пентосидина лежит в основе неинвазивных методов исследования уровня КПГ [3]. Однако чаще для определения уровня CML и КПГ используют иммуноферментный анализ.
В процессе образования КПГ выделяют несколько этапов. Сначала глюкоза связывается со свободными аминогруппами с формированием оснований Шиффа. Затем основания переходят в более стабильные продукты Амадори и в конечном итоге в разные по структуре КПГ – конечные продукты реакции Майяра. Образование КПГ в белках происходит в течение нескольких месяцев, поэтому их накопление больше характерно для медленно обменивающихся белков.
Образование КПГ в белках происходит в течение нескольких месяцев, поэтому их накопление больше характерно для медленно обменивающихся белков.
КПГ труднорастворимы, устойчивы к протеолитическому расщеплению, активны химически.
Данные молекулы способны менять функции и свойства тканей. Это достигается патологической сшивкой белков внутриклеточного и межклеточного матрикса [3, 4] путем связывания с рецептором КПГ (рКПГ).
С возрастом накопление КПГ в организме повышается. На это влияют как эндогенные, так и экзогенные факторы. Так, табачный дым и длительная термическая обработка стимулируют генерацию продуктов гликоокисления и липоокисления [5, 6]. Кроме того, при наличии определенных патологических состояний, например сахарного диабета (СД) или почечной недостаточности, скорость гликирования значительно увеличивается и количество КПГ достигает критических значений [7, 8].
Известно, что КПГ приводят к декомпенсации СД 2 типа.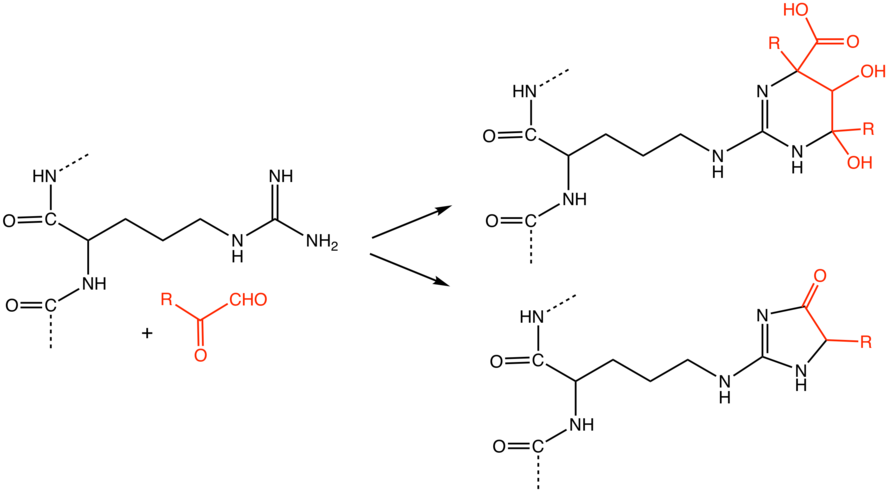 Кроме того, они признаны предикторами риска развития сердечно-сосудистых заболеваний. Избыток КПГ отвечает за такой феномен, как метаболическая память.
Кроме того, они признаны предикторами риска развития сердечно-сосудистых заболеваний. Избыток КПГ отвечает за такой феномен, как метаболическая память.
Образование КПГ – один из процессов, ассоциированных со старением клетки. Их воздействие преимущественно направлено на долгоживущие белки. Именно поэтому в настоящее время КПГ также рассматриваются как один из возможных биомаркеров старения.
Таким образом, изучение свойств и роли КПГ в патофизиологических процессах имеет важное значение, в том числе для разработки методов снижения риска развития сердечно-сосудистых заболеваний как основной причины смерти у пациентов с СД 2 типа [9].
Механизм действия конечных продуктов гликирования на ткани
Интерес к реакции Майяра, или взаимодействию глюкозы с белками, появился в середине 1990-х гг., после того как в условиях in vivo было установлено, что глюкоза способна модифицировать белки без участия ферментов [8]. Эффекты КПГ на ткани реализуются посредством трех основных механизмов:
Эффекты КПГ на ткани реализуются посредством трех основных механизмов:
- скрещивание внеклеточных (матричных) белков, влияющих на механические свойства тканей [7, 9];
- образование измененных поперечных межмолекулярных связей внутриклеточных белков, что приводит к их патологической функции [10, 11];
- связывание с рКПГ на клеточной поверхности для индуцирования множества внутриклеточных сигнальных каскадов [8, 9].
В большей степени неферментативному гликированию подвергаются белки внеклеточного матрикса (ВМ) (особенно коллаген 4-го типа) [8–10]. Коллаген относится к долгоживущим белкам и является основным компонентом внеклеточного матрикса [11]. Коллагеновые нити образуют каркас для кожи, сухожилий, кровеносных сосудов, костной ткани, роговицы и стекловидного тела, а также являются основой большинства паренхиматозных органов. Гликирование белков внеклеточного матрикса – коллагена и эластина делает их более жесткими и менее восприимчивыми к протеолитическому расщеплению [5]. Это может способствовать увеличению жесткости сосудов, наблюдающейся у пациентов старшей возрастной группы и с хронической гипергликемией [8, 9].
Это может способствовать увеличению жесткости сосудов, наблюдающейся у пациентов старшей возрастной группы и с хронической гипергликемией [8, 9].
Коллаген 1-го типа – основной органический компонент костной матрицы подвергается серии посттрансляционных модификаций, больше характерных для процессов старения. Это приводит к миграции миофибробластов и формированию фиброза [7]. Согласно результатам последних исследований, артериосклероз является следствием гликирования коллагеновых цепей в артериолах мышечного типа, вызванного образованием поперечных связей между коллагеновыми волокнами [11]. Ключевая роль КПГ в старении кожи подтверждена H. Pageon и соавт., проводивших эксперимент на модели восстановленной кожи, модифицированной гликированием коллагена [6]. S. Zeiman и соавт., а также R. Candido и соавт. показали, что под воздействием КПГ изменяются свойства миокардиального коллагена, что приводит к развитию диастолической дисфункции [5, 12]. Подобные изменения обусловливают утолщение базальной мембраны, например в мезангиальном матриксе почек, что вызывает развитие почечной недостаточности при СД [13].
Гликирование влияет и на структуру липопротеинов низкой плотности (ЛПНП). Наиболее интенсивное разрушение ЛПНП и продуктов реакции Майяра происходит в макрофагах. При этом наблюдается активация эндоцитоза и синтеза многих регуляторных молекул, в том числе инсулиноподобного фактора роста 1 и фактора роста тромбоцитов, являющихся стимуляторами деления фибробластов, гладкомышечных и мезангиальных клеток [13]. Таким образом, создаются условия для образования большого количества пенистых клеток и последующего запуска атеросклеротических изменений в сосудистой стенке (рисунок) [14, 15].
Накопление КПГ приводит к бесконтрольному синтезу провоспалительных цитокинов и молекул адгезии, которые влияют на рост атеросклеротических бляшек [16, 17]. Речь, в частности, идет об интерлейкине (IL) 1α, IL-6, факторе некроза опухоли (Tumor Necrosis Factor – TNF) α, молекулах межклеточной адгезии 1, молекулах адгезии сосудистых клеток 1, факторах роста эндотелия сосудов, эндотелине 1, тканевом факторе, E-селектине, тромбомодулине [18, 19].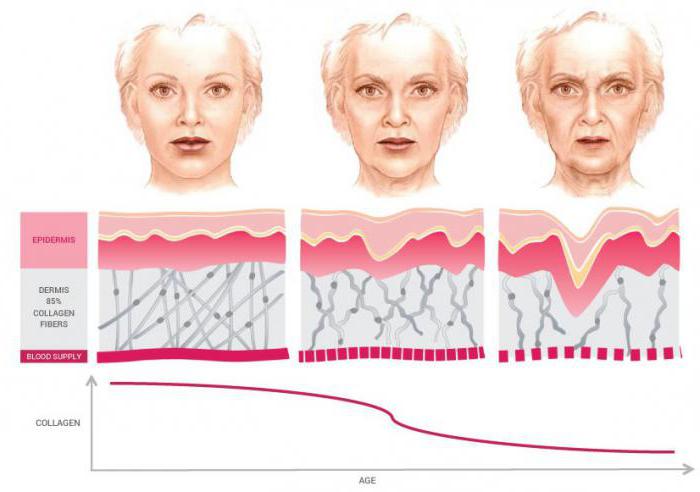
Запуск патогенетического каскада осуществляется при взаимодействии КПГ с их рецепторами и последующем фосфорилировании p21ras, митоген-активированных протеинкиназ, внеклеточной сигнально-регулируемой киназы 1/2, p38 и активации GTPases Cdc42 и Rac. Это в конечном итоге стимулирует миграцию транскрипционного фактора NF-κB к ядру, где он начинает транскрибировать собственный целевой набор генов [20].
Рецепторы конечных продуктов гликирования и их роль
В качестве специфических рКПГ рассматриваются различные мембранные белки. Это белки, принадлежащие к суперсемейству иммуноглобулинов, которые выполняют функцию рецепторов для гликозилированных молекул КПГ [21]. Однако были обнаружены и другие лиганды к рКПГ, включая семейство белков S100 [22], амилоид b [23, 24] и агрегаты фибриллярных белков [25, 26].
Рецепторы КПГ играют важную роль в развитии состояний, ассоциированных с участием перечисленных лигандов, например в повреждении сосудистой стенки, канцерогенезе, нейродегенерации и амилоидозах [25, 27–29]. Сообщалось, что ген рКПГ расположен на шестой хромосоме между генами, кодирующими основные комплексы гистосовместимости второго и третьего классов [30].
Сообщалось, что ген рКПГ расположен на шестой хромосоме между генами, кодирующими основные комплексы гистосовместимости второго и третьего классов [30].
Связывание КПГ с их рецепторами приводит к эндотелиальной дисфункции вследствие активации ряда сигнальных путей, например никотинамидадениндинуклеотидфосфатоксидазы, которая усиливает образование активных форм кислорода (АФК) [31]. Последние образуются в результате митохондриального дыхания и клеточного метаболизма. В малых количествах, считающихся физиологичными, АФК задействованы в таких процессах, как индукция стрессорных белков и ферментов, синтез и распад цитокинов, рост, деление и дифференцировка клеток, антимикробный, противовирусный, противоопухолевый эффекты, старение и гибель клеток, разрушение поврежденных молекул, межклеточного вещества, регуляция репаративных процессов, продукция коллагена [32]. Необходимо отметить, что АФК, столь опасные согласно свободнорадикальной теории старения, вырабатываются организмом целенаправленно [33].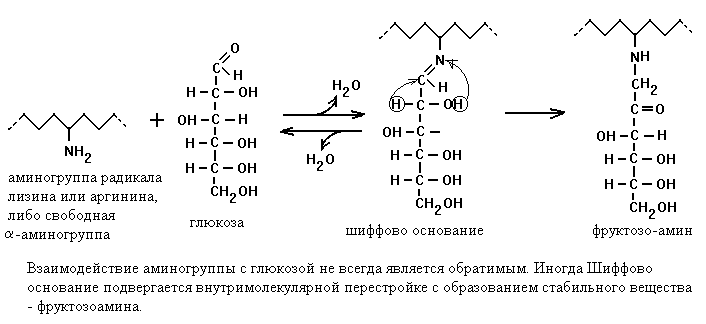 Было показано, что АФК играют ключевую роль в развитии сердечно-сосудистых осложнений за счет изменения структуры клеточных белков, липидов и нуклеиновых кислот и, следовательно, их физиологических функций [34].
Было показано, что АФК играют ключевую роль в развитии сердечно-сосудистых осложнений за счет изменения структуры клеточных белков, липидов и нуклеиновых кислот и, следовательно, их физиологических функций [34].
В настоящее время известно несколько типов рКПГ. В частности, рКПГ-1 при связывании с КПГ инактивируется, что приводит к деградации лиганда. Снижение экспрессии рКПГ-1 ассоциируется с ускорением гломерулярной дисфункции при СД 2 типа [34] и активацией циркулирующих мононуклеарных клеток при высоких значениях КПГ у лиц с тяжелыми осложнениями СД 2 типа [35]. Функция рКПГ-3 (семейство углевод-связывающих белков) напрямую зависит от длительности и степени гипергликемии. При инактивированном рКПГ-3 достоверно чаще развивается диабетическая нефропатия [36].
Сердечно-сосудистая система
Образование КПГ в тканях ускоряет иммуновоспалительные реакции и перекисное окисление липидов, что в условиях хронической гипергликемии приводит к декомпенсации СД.
Кроме того, накопление КПГ связано не только с ранним развитием сердечно-сосудистых осложнений, но и с более негативным прогнозом в отношении выживаемости.
Так, E.Y. Choi и соавт., изучавшие в течение пяти лет уровень КПГ в сыворотке крови 203 пациентов, перенесших чрескожное коронарное вмешательство, установили, что высокие значения КПГ являются независимым фактором риска развития рестеноза при СД 2 типа (отношение шансов – 2,659 при 95%-ном доверительном интервале (ДИ) 1,431–4,940, p = 0,002) [37]. Уже через шесть месяцев у пациентов с высокими значениями КПГ (> 170 Ед/мл) частота рестенозирования была значительно выше (р
Увеличение уровня КПГ у пациентов с СД 1 типа влияло на частоту развития сердечно-сосудистых событий, независимо от наличия других факторов риска, таких как возраст, индекс массы тела, курение, артериальная гипертензия и гиперлипидемия [43].
Согласно результатам проспективного исследования EURODIAB, у больных СД 1 типа увеличение артериального давления было напрямую связано с высокими значениями КПГ [44]. У больных СД уровень рКПГ коррелировал с толщиной комплекса «интима – медиа» брахиоцефальных артерий [45]. В нескольких экспериментальных исследованиях установлено, что КПГ могут участвовать в образовании неоинтимы в месте повреждения. Z. Zhou и соавт. отметили, что у крыс, больных СД, при значительном увеличении уровня КПГ повышалась иммунореактивность рКПГ и S100/calgranulins в ответ на травматическое воздействие баллона в сонной артерии [46].
У больных СД уровень рКПГ коррелировал с толщиной комплекса «интима – медиа» брахиоцефальных артерий [45]. В нескольких экспериментальных исследованиях установлено, что КПГ могут участвовать в образовании неоинтимы в месте повреждения. Z. Zhou и соавт. отметили, что у крыс, больных СД, при значительном увеличении уровня КПГ повышалась иммунореактивность рКПГ и S100/calgranulins в ответ на травматическое воздействие баллона в сонной артерии [46].
В условиях in vitro и in vivo предотвращение связывания рКПГ с лигандом снижало пролиферацию эндотелиоцитов.
КПГ также могут оказывать влияние на целостность структуры сосудистой стенки. В частности, чрезмерное гликирование молекул ВМ, таких как коллаген, может нарушать как клеточно-мембранные, так и межмембранные взаимодействия [47].
Для диабетической кардиомиопатии характерны гипертрофия и формирование патологического фиброза миокарда, что в конечном итоге приводит к диастолической дисфункции. Доказано, что эти процессы напрямую зависят от степени компенсации углеводного обмена, скорости снижения уровня гликированного гемоглобина. Однако в настоящее время в качестве основной причины ее развития рассматривают накопление КПГ [48]. Взаимодействие КПГ с внутриклеточными белками, в частности с основным фактором роста фибробластов (Basic Fibroblast Growth Factor – β-FGF), значительно стимулирует фиброзирование миокарда [49]. β-FGF – мощный модулятор клеточной дифференцировки, пролиферации и подвижности клеток [50].
Доказано, что эти процессы напрямую зависят от степени компенсации углеводного обмена, скорости снижения уровня гликированного гемоглобина. Однако в настоящее время в качестве основной причины ее развития рассматривают накопление КПГ [48]. Взаимодействие КПГ с внутриклеточными белками, в частности с основным фактором роста фибробластов (Basic Fibroblast Growth Factor – β-FGF), значительно стимулирует фиброзирование миокарда [49]. β-FGF – мощный модулятор клеточной дифференцировки, пролиферации и подвижности клеток [50].
Активация фибробластов в условиях гипергликемии обусловлена ускорением полиолового шунта, значительным повышением концентрации глюкозо-6-фосфата, фруктозы и фруктозо-3-фосфата, активацией С-протеинкиназы, окислительного стресса и гликирования факторов роста фибробластов [51, 52]. При неферментативном анаэробном гликолизе внутри клетки накапливаются дикарбонилы, которые признаются одними из основных участников сшивания белков [53]. Это приводит к патологической, бесконтрольной работе фибробластов. Они начинают активно пролиферировать, разрушать старый и синтезировать новый коллаген. Это приводит к перестройке стенки сосудов и, как следствие, к фиброзу.
Они начинают активно пролиферировать, разрушать старый и синтезировать новый коллаген. Это приводит к перестройке стенки сосудов и, как следствие, к фиброзу.
На индукцию фиброза также влияют рКПГ – регулируют трансформирующий фактор роста β (Transforming Growth Factor β – TGF-β) [53]. Гликирование TGF-β увеличивает синтез коллагена 3, 4 (α-3), 5 и 6-го типов, а также ламинина и фибронектина в ВМ [54]. R. Petrova и соавт. обнаружили, что чрезмерная экспрессия рКПГ у трансгенных особей снижала внутриклеточную концентрацию кальция как во время систолы, так и во время диастолы [55]. Была также выявлена обратная связь между уровнем КПГ в перикардиальной жидкости и фракцией выброса левого желудочка [56, 57].
Метилгексилированные производные КПГ активируют мРНК кардиальных рКПГ, что стимулирует развитие сократительной дисфункции кардиомиоцитов. Накопление метилгексилированных производных КПГ приводит к деполяризации митохондриального мембранного потенциала, снижению инактивации гликоген синтазы киназы 3β в миокарде, что вызывает замедление регенерации (TR90) [58]. Стимуляция рецепторов γ, активируемых пероксисомными пролифераторами (Peroxisome Proliferator-Activated Receptors γ – PPAR-γ), способствует снижению уровня рКПГ.
Стимуляция рецепторов γ, активируемых пероксисомными пролифераторами (Peroxisome Proliferator-Activated Receptors γ – PPAR-γ), способствует снижению уровня рКПГ.
В ряде работ были проанализированы эффекты агониста PPAR-γ (росиглитазон) у животных. Полученные данные свидетельствовали о важной роли рКПГ в инициации фиброза [59].
В исследовании, проведенном R.D. Semba и соавт., было подтверждено участие КПГ и их рецепторов в развитии сердечно-сосудистых заболеваний в период постменопаузы [60]. Высокий уровень КПГ (95% ДИ 1,08–3,48, р = 0,026) и рКПГ (95% ДИ 0,98–1,65, р = 0,07) также ассоциировался с высокой смертностью среди женщин старшей возрастной группы, имевших нарушения углеводного обмена. В другом исследовании, проведенном Y. Koyama и соавт., установлено, что сывороточные уровни рКПГ коррелировали с классами Функциональной классификации хронической сердечной недостаточности Нью-Йоркской ассоциации кардиологов и низкой фракцией выброса [61]. Выдвинуто предположение, что рКПГ являются независимым фактором развития диастолической дисфункции.
Выдвинуто предположение, что рКПГ являются независимым фактором развития диастолической дисфункции.
K. Sugaya и соавт. подтвердили участие КПГ в воспалительных процессах. В частности, в исследовании (длительность наблюдения – 18 лет) выявлена связь между высокими значениями сывороточного КПГ и увеличением количества летальных случаев у пациенток с СД 2 типа в исходе ишемической болезни сердца [30].
Особый интерес представляют результаты иммуногистохимического анализа и вестерн-блоттинга 60 атеросклеротических бляшек, полученных в результате каротидной эндартерэктомии. Так, при СД 2 типа уровень макрофагов, рКПГ, Т-лимфоцитов, HLA-DR+, NF-κB, COX-2/mPGES-1, липидов и MMP был достоверно выше (р
В исследовании in vivo дезактивирование рКПГ ассоциировалось со снижением степени повреждения миоцитов, о чем свидетельствовало уменьшение уровня ЛПНП, продуктов с низким содержанием гликозидов – CML и пентосидина, улучшение скорости функционального восстановления и синтеза аденозинтрифосфата [63].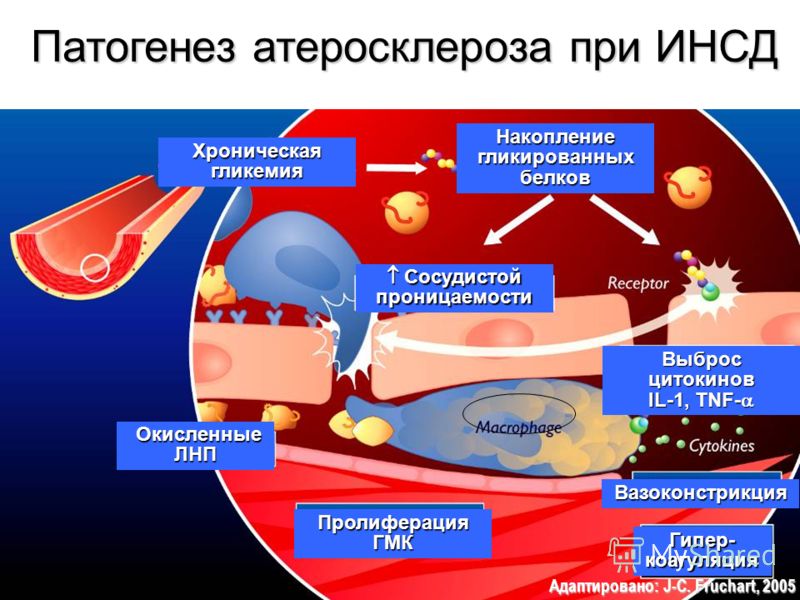 Более того, согласно результатам иммуногистохимического исследования, у мышей с модифицированным рКПН, несмотря на наличие СД 2 типа, активность ключевых маркеров апоптоза, таких как каспаза-3 и цитохром С, была снижена.
Более того, согласно результатам иммуногистохимического исследования, у мышей с модифицированным рКПН, несмотря на наличие СД 2 типа, активность ключевых маркеров апоптоза, таких как каспаза-3 и цитохром С, была снижена.
Отмечено негативное влияние КПГ на рецепторы рианодина [4] и SER-CA2a [5] в кардиомиоцитах. Нарушение их функции приводит к изменениям гомеостаза кальция и последующему развитию диабетической кардиомиопатии [35, 36]. Фибриноген состоит из трех пар неидентичных цепей, стабилизированных несколькими дисульфидными связями. Известно, что концентрация фибриногена и скорость образования сгустка не зависят от наличия нарушений углеводного обмена [58], однако при диабете высокие уровни КПГ обусловливают нарушение гомеостаза и активацию атеросклеротических процессов. Гликирование фибриногена, активного участника свертывающей системы крови, приводит к замедлению фибринолиза и образованию в дальнейшем тромбогенной фибриновой сети [57].
Заключение
Ускоренное гликирование белков и накопление КПГ играют важную роль в патогенезе сердечно-сосудистых заболеваний у пациентов с СД. КПГ следует рассматривать в качестве маркеров развития воспалительных процессов и окислительного стресса.
КПГ следует рассматривать в качестве маркеров развития воспалительных процессов и окислительного стресса.
Изучение механизмов регуляции взаимодействия КПГ и их рецепторов позволит разработать методы предотвращения развития осложнений, связанных с хронической гипергликемией.
Гликацию сосудов не остановить!
Польза от гликации сосудов.
Тема старения уже многие годы вызывает интерес. Это естественно и легко объяснимо, ведь женщины хотят всегда оставаться красивыми, а мужчины — в хорошей форме. Никому из нас не приносят радости появившиеся на лице морщины или дряблая кожа. Но время идет, и у нас растет убеждение, что старение неизбежно. Однако японцы могут с вами на эту тему поспорить, а нас они даже смогли переубедить.
Уходящие годы забирают с собой красивый, молодой вид и оставляют неприятные следы во всем организме.Почему люди стареют?
Основные теории, которые отвечают на этот вопрос, связаны с воздействием свободных радикалов и фотостарением. Но недавно ученые выясняли еще одну причину, почему люди находят у себя признаки надвигающейся старости – гликация.
Но недавно ученые выясняли еще одну причину, почему люди находят у себя признаки надвигающейся старости – гликация.
Мы хотим более подробно рассказать об этом процессе, а также о том, как избежать процесса взаимодействия сахара с белками, то есть образования конечных продуктов гликирования (КПГ).
Совсем недавно ученые начали обращать внимание на это явление, хотя о реакции фиксации молекул простых сахаров на белках было известно с тех пор, как появилась химия. Но задавались ли вы вопросом, почему японцы жили по 100 лет и больше, в то время, как европейцы и русские люди прощались с жизнью в 40 лет? Японцы — очень закрытые люди и то, чем они живут, как лечатся, какие препараты создают, нам не доступно. Было. До недавнего времени, когда наша компания проявила огромный интерес к антистарению.
Действие наших препаратов, которые являются уникальными японскими разработками, направлено на то, чтобы жизнь людей становилась здоровее и продолжительнее. Например, альфа-липоевая кислота является ключом, приводящим в действие механизм антистарения.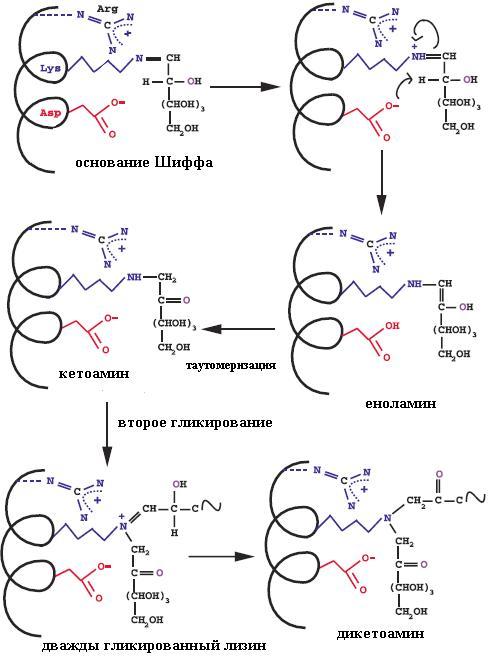
Для полноты понимания действия альфа-липоевой кислоты давайте разберемся, что представляют собой конечные продукты гликирования (КПГ). В англоязычной литературе этот термин обозначается аббревиатурой AGE (Advanced Glycation End Product), что является удачной игрой слов, ведь “Age” переводится с английского как «возраст». Суть процесса заключается в том, что углеводы, которые мы получаем с пищей, расщепляются до простых сахаров, попадают в кровоток и соединяются с молекулами белков, меняя их структуру на более жесткую и в то же время более хрупкую. Этот процесс называется «гликация». Как мы знаем, все ткани тела, в том числе и кожа, по большей части состоят из белков. Гликация приводит к тому, что кожа теряет тонус, образуются морщины, мышцы ослабевают, а стенки сосудов становятся хрупкими. К сожалению, эти продукты жизнедеятельности и возраста под названием AGE никаким образом не выводятся ни из клетки, ни из организма.
Чтобы предотвратить их появление, японцы придумали «скорую помощь» для нашего тела, незаменимую для сохранения молодости. «Альфа-липоевая кислота с витаминами группы В» марки Файн снижает концентрацию сахаров в крови, оказывая инсулиноподобное действие. Таким образом сокращается вероятность прикрепления сахаров к белковым молекулам. Кроме того, альфа-липоевая кислота служит для нейтрализации жиров в печени, а также сдерживает расходование глутатиона, который является самым мощным антиоксидантом, вырабатываемым организмом.
«Альфа-липоевая кислота с витаминами группы В» марки Файн снижает концентрацию сахаров в крови, оказывая инсулиноподобное действие. Таким образом сокращается вероятность прикрепления сахаров к белковым молекулам. Кроме того, альфа-липоевая кислота служит для нейтрализации жиров в печени, а также сдерживает расходование глутатиона, который является самым мощным антиоксидантом, вырабатываемым организмом.
Когда речь идет о предотвращении образования КПГ, необходимо упомянуть еще одну японскую разработку, вошедшую в состав продукта «Инфинити-контроль аппетита».
Это запатентованный ингредиент UNIFINE, изготовленный на основе экстракта соевых бобов. Его действие заключается в том, чтобы, с одной стороны, уменьшить концентрацию сахаров в крови, с другой – предотвратить процесс «сцепки» этих сахаров с белками.
Стоит учитывать еще один фактор, заставляющий нас задуматься о дополнительном приеме витаминов и других микронутриентов. Организм на физическом и эмоциональном уровне требует простых углеводов.

Это самый простой и наименее энергозатратный способ получения калорий. Любовь к мучному и сладкому выработана в нас эволюцией. Однако в ряде случаев эта любовь переходит в манию. Многие сочтут это просто дурной пищевой привычкой и скажут, что человек – сладкоежка, но, к сожалению, такое пристрастие может быть сигналом о том, что организм болен и необходимо принимать меры. Установлено, что чрезмерная тяга к сладкому может говорить о проблемах с желудочно-кишечным трактом и недостаточной выработке ферментов, необходимых для усвоения пищи. В этих условиях даже при сбалансированном и правильном питании организм буквально испытывает голод и стремится утолить его наиболее быстрым способом – при помощи сладкого. Но избыточное потребление сладкого запускает другие опасные процессы, недаром говорят, что сахар – это белая смерть. Он пагубно влияет на поджелудочную железу, подавляет тестостерон, травмирует печень.
Как избавиться от навязчивой тяги?
Японцы не забыли и здесь все продумать, что очень для них характерно. Они помнят про полезные свойства растений и легко сочетают традиционное лечение и современные технологии. Препарат «Шелковица-Плюс» на основе листьев и стеблей шелковицы – это незаменимое средство для того, чтобы привести уровень сахара крови в норму, уменьшить чувство голода, служить профилактикой сахарного диабета, а также понизить степень усвояемости жиров в организме.
Они помнят про полезные свойства растений и легко сочетают традиционное лечение и современные технологии. Препарат «Шелковица-Плюс» на основе листьев и стеблей шелковицы – это незаменимое средство для того, чтобы привести уровень сахара крови в норму, уменьшить чувство голода, служить профилактикой сахарного диабета, а также понизить степень усвояемости жиров в организме.

Гликационный стресс и фотостарение кожи Текст научной статьи по специальности «Фундаментальная медицина»
© КОЛЛЕКТИВ АВТОРОВ, 2017 УДК 616.5-007.23-053.9-02
Вавилова А.А., Губанова Е.И., Гладько В.В.
ГЛИКАЦИОННЫЙ СТРЕСС И ФОТОСТАРЕНИЕ КОЖИ
ФГБОУ ВО «Московский государственный университет пищевых производств» Мин-обрнауки России, Институт медико-социальных технологий, 125080, г. Москва, Россия
В обзоре проанализированы работы зарубежных исследователей по изучению механизмов гликации и влияния этой неферментативной реакции на фотоповрежденную кожу. Детально рассматриваются конечные продукты усиленной гликации (advanced glycation end products — AGEs) и их патогенетическая роль в старении кожи. Описаны вещества, ингибирующие AGEs, с акцентированием внимания на профилактике процесса гликации.
Ключевые слова: фотостарение; конечные (поздние) продукты усиленной гликации; реакция Майяра; аутофлюоресценция; ультрафиолетовое излучение; маркеры; ингибиторы.
Для цитирования: Вавилова А.А., Губанова Е.И., Гладько В.В. Гликационный стресс и фотостарение кожи. Российский журнал кожных и венерических болезней. 2017; 20(4): 243-248. DOI: http://dx.doi.org/10.18821/1560-9588-2017-20-4-243-248
Vavilova A.A., Gubanova E.I., Gladko V.V. GLYCATION STRESS AND PHOTOAGING OF THE SKIN
Department of skin and venereal diseases with the course of cosmetology of the Institute of Medical and Social Technologies of the Moscow State University of Food Production, Moscow, 125080, Russian Federation
The study offoreign researchers on glycation mechanisms and the effect of this non-enzymatic reaction on photodamaged skin are presented. The final products of enhanced glycation — AGEs and their pathogenetic role in skin aging are described. AGEs inhibiting substances, focusing on the prevention of the glycation process, are described.
The final products of enhanced glycation — AGEs and their pathogenetic role in skin aging are described. AGEs inhibiting substances, focusing on the prevention of the glycation process, are described.
Keywords: photoaging; final (late) products of enhanced glycation; Maillard reaction; autofluorescence; ultraviolet radiation; markers; inhibitors.
For citation: Vavilova A.A., Gubanova E.I., Gladko VV Glycation stress and photoaging of the skin. Russian Journal of Skin and Venereal Diseases (Rossiyskii Zhurnal Kozhnykh i Venericheskikh Boleznei. 2017; 20(4): 243-248. (in Russian). DOI: http://dx.doi.org/10.18821/1560-9588-2017-20-4-243-248
Conflict of interest. The authors declare no conflict of interest. Acknowledgments. The study had no sponsorship. Received 13 April 2017 Accepted 26 June 2017
1ГОГМЕТОПОГЫЯ
В последние годы отмечается постоянный рост интереса к изучению механизмов старения кожи. Проведено большое количество исследований, направленных на изучение патофизиологии старения и поиск методов борьбы с возрастными патологиями [1]. Возрос интерес к конечным продуктам усиленной гликации (advanced glycation end products — AGEs), которые образуются в больших количествах в организме при сахарном диабете и в процессе старения [2].
Проведено большое количество исследований, направленных на изучение патофизиологии старения и поиск методов борьбы с возрастными патологиями [1]. Возрос интерес к конечным продуктам усиленной гликации (advanced glycation end products — AGEs), которые образуются в больших количествах в организме при сахарном диабете и в процессе старения [2].
Кожа подвергается не только негативному воздействию эндогенных процессов старения, но и различным внешним воздействиям, которые приводят к структурным изменениям, тем самым влияя не
Для корреспонденции:
Вавилова Ада Анатольевна, аспирант кафедры кожных и венерических болезней с курсом косметологии Института медико-социальных технологий ФГБОУ ВО «Московский государственный университет пищевых производств» Минобрнауки России, 125080, г. Москва, Россия. E-mail: [email protected]
For correspondence:
Vavilova Ada A. , postgraduate at the Department of skin and venereal
, postgraduate at the Department of skin and venereal
diseases with the course of cosmetology of the Institute of Medical and
Social Technologies of the Moscow State University of Food Production,
Moscow, 125080, Russian Federation. E-mail: [email protected]
Information about authors:
Vavilova A.A., http://orcid.org/0000-0001-5221-1027;
Gubanova E.I., http://orcid.org/0000-0002-0441-9752;
Gladko V.V., http://orcid.org/0000-0002-2173-4383.
только на внешний вид, но и на физиологические функции кожи. Существует более 300 теорий старения. Среди них теории клеточного старения, снижения пролиферативного потенциала и укорочения теломер. Ведущую роль в процессе старения отводят продуктам гликации при создании антивозрастных препаратов.
Ведущую роль в процессе старения отводят продуктам гликации при создании антивозрастных препаратов.
Фотостарение и гликационный стресс являются основными причинами деструктивных изменений кожного покрова [3]. Процессу фотостарения сопутствуют такие проявления как морщины, лентиго, опухоли, часто развивающиеся в коже после длительного воздействия ультрафиолетового (УФА, УФВ) или инфракрасного излучения. После 40 лет гиперпигментированные пятна могут образовываться на тыльной поверхности рук, и их количество может увеличиваться с возрастом. Гиперпигментированные пятна также образуются у больных пигментной ксеродермой, редким наследственным заболеванием кожи, вызванным дефектом в ферментах, устраняющих повреждающий эффект от УФ-излучения на клетки кожи. В результате мутации становятся неактивными белки, ре-парирующие ДНК больного, и при всяком повреждении, например при УФ-облучении, дефектных молекул ДНК становится все больше. Пигментная ксеродерма проявляется через несколько месяцев после рождения. Результаты предыдущих исследований показывают, что образование пятен при этом заболевании может быть обусловлено мутацией гена, участвующего в формировании меланина в эпидермальных кератиноцитах и меланоцитах. УФ-индуцированная мутация гена, контролирующего транскрипционный фактор, такого например, как фактор стволовых клеток (SCF), может изменить экспрессию гена в кератиноцитах. Возможны
Результаты предыдущих исследований показывают, что образование пятен при этом заболевании может быть обусловлено мутацией гена, участвующего в формировании меланина в эпидермальных кератиноцитах и меланоцитах. УФ-индуцированная мутация гена, контролирующего транскрипционный фактор, такого например, как фактор стволовых клеток (SCF), может изменить экспрессию гена в кератиноцитах. Возможны
Характеристика конечных продуктов усиленной гликации (AGEs) [23]
Название конечного продукта усиленной гликации (AGE) Слой кожи, в котором находится AGE Мишень гликации Методы обнаружения
Карбоксиметиллизин (CML) Эпидермис, возрастная дерма, дерма больных сахарным диабетом, кожа с признаками фотостарения и солнечного эластоза Эпидермис, коллаген, виментин, эластин Иммуноферментный анализ, ELISA
Пентозидин Дерма больных сахарным диабетом Коллаген Высокоэффективная жидкостная хроматография, HPLC
Глиоксаль (GO) Возрастная дерма Коллаген Хромато-масс-спектрометрия, LC/MS
Метилглиоксаль (MGO) Возрастная дерма Коллаген Хромато-масс-спектрометрия, LC/MS
Глюкозепан Возрастная дерма Коллаген Хромато-масс-спектрометрия, LC/MS
Фруктозолизин Возрастная дерма Коллаген Хромато-масс-спектрометрия, LC/MS
Карбоксиэтиллизин (CEL) Возрастная дерма Коллаген Хромато-масс-спектрометрия, LC/MS
Глиоксалялизин-димер (GOLD) Возрастная дерма Коллаген Хромато-масс-спектрометрия, LC/MS
Метилглиоксальлизин-димер (MOLD) Возрастная дерма Коллаген Хромато-масс-спектрометрия, LC/MS
Примечание. CML — carboxymethyllysine; ELISA — enzyme-linked immunosorbent assay; HPLC — high performance liquid chromatography; GO — glyoxal; LC/MS — liquid chromatography-mass spectrometry; MGO — methylglyoxal; CEL — carboxyethyllysine; GOLD — methylglyoxal lysine dimmer; MOLD — glyoxal lysine dimer.
CML — carboxymethyllysine; ELISA — enzyme-linked immunosorbent assay; HPLC — high performance liquid chromatography; GO — glyoxal; LC/MS — liquid chromatography-mass spectrometry; MGO — methylglyoxal; CEL — carboxyethyllysine; GOLD — methylglyoxal lysine dimmer; MOLD — glyoxal lysine dimer.
рецептор к SCF, обнаруженный в меланоцитах, — это c-Kit. Он участвует в образовании пигментных пятен [4]. Одной из причин гиперпигментации может быть задержка обмена веществ в эпидермисе. УФ-свет может изменять обмен веществ в эпидермисе путем инактивации ферментов и способствовать отрыву керати-ноцитов и шелушению рогового слоя, хотя этот механизм также полностью не изучен. Все эти изменения индуцируют процесс фотостарения и активизируют накопление поздних продуктов усиленной гликации [5, 6].
Гликация представляет собой неферментативную реакцию связывания глюкозы и белков, липидов или нуклеиновой кислоты. Гликацию следует отличать от гликозилирования, которое является ферментативной реакцией. Впервые гликацию описал Луи Камилл Майяр (L. Maillard) в 1912 г., когда в результате этой реакции обнаружил потемнение пищи во время термической обработки (образование коричневой поджаристой корочки) [7]. Спустя 50 лет ученые доказали участие гликации в различных патологиях человеческого организма. Такими патологиями являются старение и сахарный диабет. Реакция Майяра способствует медленной продукции высокореактивных токсичных соединений, называемых «конечными продуктами усиленной гликации» — AGEs [8].
Гликацию следует отличать от гликозилирования, которое является ферментативной реакцией. Впервые гликацию описал Луи Камилл Майяр (L. Maillard) в 1912 г., когда в результате этой реакции обнаружил потемнение пищи во время термической обработки (образование коричневой поджаристой корочки) [7]. Спустя 50 лет ученые доказали участие гликации в различных патологиях человеческого организма. Такими патологиями являются старение и сахарный диабет. Реакция Майяра способствует медленной продукции высокореактивных токсичных соединений, называемых «конечными продуктами усиленной гликации» — AGEs [8].
При изучении стареющего организма обращает на себя внимание явление аккумуляции поврежденных продуктов (белков), недоступных для действия деградации, формирующих перекрестные сшивки с липидами. Происходит накопление продуктов, поврежденных липидными перекисями. Одним из основных маркеров старения является липофусцин, внутриклеточные скопления которого могут составлять до 50% от содержимого клетки. Липофусцин — желто-коричневый пигмент, содержащий каротиноиды, которые придают ему окраску, и белки, модифицированные липидами. Его образование инициируется железом и является прямым следствием липидной пероксидации. Стабильной модификации подвергаются в основном долгоживущие экстрацеллюлярные белки, такие как коллаген, кристаллин и эластин. В этом случае модифицирующим агентом являются не продукты перекисного окисления липидов, а глюкоза. Глюкоза взаимодействует с белками, аминокислотами и нуклеиновыми кислотами. При взаимодействии глюкозы с аминогруппами образуются продукты Амадори. Продуктом Амадори является также пентозидин, соединение, образующееся в результате перекрестных сшивок между аргинином, лизином и пентозой.
Внеклеточные скопления амилоидного Р-пептида (АР) ассоциированы с нейродегенеративным процессом, характерным для старческого возраста (болезнь Альцгеймера). Образование Ар сопряжено с возрастными изменениями обмена глюкозы. Ней-рофибриллярные сплетения и сенильные бляшки в тканях мозга пациентов с болезнью Альцгеймера содержат такие AGEs, как пир-рамин и пентозидин, которых нет у здоровых людей. В мононукле-арных клетках и в микроглии мозга найден рецептор к AGEs и Ар (receptor AGE-RAGE). Связывание AGEs и Ар с рецептором индуцирует генерацию оксидантов.
Формирование и накопление модифицированных продуктов -длительный процесс. Характерная черта этих продуктов состоит в том, что они лишены деградации и являются активными индукторами окисления, т.е. интенсифицируют свое собственное воспроизводство. Такие соединения, как AGEs, Ар и липофусцин, могут быть не только продуктами, но и факторами возрастного окислительного стресса.
Формирование конечных продуктов усиленной гликации (AGEs) является сложным молекулярным процессом, включающим в себя простые и более сложные многоэтапные реакции. Конечные продукты образуются в зависимости от характера гликации. Активные формы кислорода и переходные металлы ускоряют процесс старения. Когда в процесс вовлекаются окислительные реакции, продукты называют конечными продуктами усиленной гликации (AGEs) [7, 8].
Накопление поздних продуктов реакции Майяра так же, как и продуктов окисления, происходит в процессе старения и приводит к деструктивным изменениям в тканях. Некоторые агенты (аминогуа-нидин) существенно снижают реакцию Майяра in vitro.
Наиболее распространенным поздним продуктом реакции является карбоксиметиллизин — производное лизина. Карбоксиметиллизин в составе белков служит биомаркером общего оксидативного стресса в организме. Он накапливается с возрастом в тканях, например в коллагене кожи, и его уровень значительно повышен при диабете.
AGEs являются очень гетерогенной группой молекул. С момента открытия первого гликозилированного белка — гликозилирован-ного гемоглобина у больных сахарным диабетом были обнаружены многочисленные AGEs. Некоторые из них имеют характерные свойства аутофлюоресценции, что упрощает их идентификацию на месте или in vivo. В настоящее время идентифцированы и изучены наиболее распространенные AGEs в коже человека (см. таблицу).
AGEs, образующиеся в естественных условиях, например кар-боксиметилкрахмалгидроксилизин, карбоксиэтиллизин, фруктозо-лизин и метилглиоксаль, не содержат флюоресцентного компонента (protein-AGE). Глиоксаллизиновый и метилглиоксаллизиновый ди-меры, наоборот, образуют флюоресцентные соединения с поперечными связями, состоящими из белка и AGEs (AGE-protein-AGE).
В силу своей реактивности метилглиоксаль играет большую роль в образовании поздних продуктов гликации в процессе реакции Майяра. Более того, он считается важнейшим из гликирующих реагентов, ковалентно связывающихся с аминогруппами белков и приводящих к нарушению функций белков при диабете.
AGEs могут образовываться за счет экзогенных факторов (за счет потребления продуктов питания) или формироваться эндогенным путем. Формирование эндогенных AGEs повышается при сахарном диабете, однако они образуются и при более низких показателях глюкозы, т.е. у людей, не страдающих сахарным диабетом и не имеющих метаболических нарушений в организме. На скорость старения данных пациентов оказывают влияние факторы окружающей среды, такие как диета, курение и УФ-излучение. Кроме того, уровень циркулирующих AGEs генетически детерминирован, это доказано при групповом исследовании здоровых монозиготных и гетерозиготных близнецов.
Рис. 1. Образование AGEs снаружи и внутри клеток кожи [3]
Продукты гликирования как биомаркеры старения кожи. Роль гликационного стресса в развитии фотостарения
Кожа из-за ее легкой доступности дает ученым прекрасную возможность для неинвазивного исследования процесса гликации путем использования характерных аутофлюоресцентных свойств AGEs [9-11]. Накопление AGEs в коже тщательно изучено и обнаружено не только при диабете, но и при хронологическом старении. Участки кожи, где проходил процесс гликации, демонстрировали явление аутофлюоресценции и имели признаки наибольшего хронологического старения у здоровых людей, не имевших такой патологии, как сахарный диабет.
М. Ichihashi и соавт. [9] рассматривают гликационный стресс как фактор, влияющий на возрастные изменения в коже и обусловленный определенными функциональными и структурными перестройками.
Фотостарение и гликационный стресс являются основными причинами деструктивных изменений кожного покрова. Процесс гликации происходит в тот момент, когда сахара, такие как глюкоза или фруктоза, вступают с белком в неферментативную реакцию, образуя гликированный белок. Затем образуются конечные продукты гликации (AGEs), которые могут накапливаться в тканях. AGEs могут связываться с рецепторами (RAGE), тем самым вызывая воспалительные изменения в коже и других тканях. Гликационный стресс может быть вызван многими факторами, в том числе воздействием УФ-света, который резко усиливает накопление AGEs. AGEs изменяют коллаген, уменьшают эластичность кожи, способствуя формированию морщин.
AGEs накапливаются в коже и могут быть обнаружены с помощью метода аутофлюоресценции (AF). Исследования под руковод-
ством проф. Т Yonei на 136 здоровых японских женщинах, показали, что уровень АР значительно увеличивается с возрастом [9, 11].
Гликационный стресс включает в себя ряд различных химических реакций, например, реакцию Майяра, представляющую собой неферментативную необратимую реакцию сахара и белка. В результате этой реакции может образовываться большое количество конечных продуктов усиленной гликации. Промежуточными продуктами являются основания Шиффа и продукты Амадори. Модифицированные белки, образуя Шиффовы основания (азометины) -^замещенные имины, органические соединения с общей формулой: Я’^С = МЯ3, где Я3 — алкил или арил, а не Н), в которых азот связан с арильной или алкильной группой, но не с водородом.
Шиффовы основания — обратимые соединения, генерируемые в результате взаимодействия сахара, такого как глюкоза, и лизина или аргинина (аминокислоты) или М-концевой аминокислоты в белке. Шиффовы основания формируют более стабильные гликозилирован-ные продукты, называемые продуктами Амадори. Например, соединение гликированного гемоглобина (НЬА1с) является необратимым кетоамином, формирующимся в результате гликации гемоглобина.
Общая реакция разделена на три части: начальная реакция, образование промежуточных продуктов и расширенная реакция.
Промежуточными продуктами являются 3-дезоксиглюкозон, глиоксаль, метилглиоксаль, гликолевый альдегид, глицеральдегид.
При увеличении внутриклеточной концентрации глюкозы происходит негативное влияние на митохондрии, проявляющееся избыточным образованием фумаровой кислоты (это химическое соединение с формулой И02ССн=СИС02И). Фумаровая кислота является транс-изомером. В свою очередь, фумаровая кислота быстро реагирует с цистеином — аминокислотой в белках, образуя S-(2-сукцинил) цистеина ДОС).
мг»
t % л- v.í
4
Рис. 2. Распределение CML в коже человека. Флюоресцентный иммуно-гистохимический анализ с использованием анти-CML-поликлональных антител кролика. Зеленый флюоресцентный цвет указывает на наличие карбоксиметиллизина в эпидермальном слое [9].
Гликационный стресс также включает в себя вторичные, или производные, реакции. Результатом этих реакций являются три основных диабетических осложнения: невропатия, нефропатия и ретинопатия. Эти заболевания характеризуются накоплением AGEs в ткани. Гликационный стресс экстремально возрастает у пациентов с гипергликемией, когда концентрация глюкозы в плазме крови превышает 9 ммоль/л, и также может возрастать в ответ на альдегидное разрушение вследствие чрезмерного потребления алкоголя, гипер-триглицеридемии или гиперлипидемии (накопления липопротеинов низкой плотности — ЛПНП) и холистеринемии.6)-карбоксиметиллизин (CML), пентозидин, пирролин, GA-пиридин, Ne-карбоксиэтил-лизин (CEL), Nrn-карбоксиметил-аргинин (СМА) и 2-(2-фуроил)-4(5)-(2-фуранил)-1 H-имидазол.
Карбоксиметиллизин не является флюоресцентным белком и может наблюдаться у больных диабетом, а также у пациентов с сильным окислительным стрессом. Он образуется в результате окислительного разложения продуктов Амадори или непосредственного добавления глиоксаля к лизину. Карбоксиметиллизин вступает в реакцию с коллагеном. В свою очередь коллаген, измененный под воздействием CML в коже человека, индуцирует апоптоз. CML присутствует в коже, в том числе в эпидермальном слое, в котором метаболизм выше, нежели в более глубоких слоях. CML с помощью флюоресцентных анти-CML-поликлональных антител кролика может быть обнаружен при флюоресцентной микроскопии [12].
Пентозидин также является распространенным поздним продуктом гликации, он обладает флюоресцентными свойствами.
В дополнение к нарушению функции клеток с помощью белковых модификаций, AGEs могут также связываться со специфическими рецепторами для поздних продуктов усиленной гликации (RAGE) [10, 13, 14]. Рецептор для AGEs (RAGE) может играть патогенетическую роль, изменяя внутриклеточные сигналы и ответы. Происходит активация клеточных сигналов, генерирующих цитокины при воспалении. Однако множество других рецепторов клеточной поверхности, помимо RAGE, распознают AGEs в качестве лиганда (агента, соединяющегося с рецептором).
Одним из таких внутриклеточных показателей передачи сигнала, усиливающего окислительный стресс и активацию транскрипции, является универсальный фактор транскрипции (NF-kB), контролирующий экспрессию генов иммунного ответа, апоптоза и клеточного цикла. Нарушение его регуляции вызывает воспаление, аутоиммунные заболевания, а также развитие вирусных инфекций и рака, который непосредственно влияет на MAP-киназный путь передачи сигнала. Стимулирующий агент активизирует сигнальный путь NF-kB, при этом IkB (ингибиторный белок) фосфорилируется под действием киназы IKK (IkB-киназы), что приводит к деградации IkB под действием 26S протеасомы. При этом NF-kB высвобождается от ингибирующего комплекса, транслоцируется в ядро и активирует
транскрипцию контролируемых генов. В эндотелиальных клетках сосудов поздние продукты усиленной гликации (AGEs) стимулируют рецепторно-индуцированный сигнал, который запускает экспрессию гена, в ходе которой наследственная информация от гена преобразуется в функциональный продукт — РНК или белок, а именно в фактор роста эндотелия сосудов — VEGF (vascular endothelial growth factor), являющийся сигнальным белком, вырабатываемым клетками для стимулирования васкулогенеза (образование эмбриональной сосудистой системы) и ангиогенеза (роста новых сосудов в уже существующей сосудистой системе).
Хотя RAGE, как правило, связаны с клеточной мембраной, некоторые рецепторы могут быть расположены вне клетки (растворимые RAGE). Растворимый рецептор RAGE может связываться с AGE, действуя в качестве приманки, тем самым ингибируя активацию RAGE на клеточных мембранах. Следовательно, наличие растворимого RAGE может указывать на сопротивление или устойчивость к гликационному стрессу.
Накопление поздних продуктов AGEs, таких как CML (карбо-ксиметиллизин), в кожном покрове в значительной степени провоцирует гликационный стресс в коже. Последние исследования показали, что карбонилированный белок, находящийся в наружном слое эпидермиса, меняет оптические характеристики кожных клеток за счет уменьшения их прозрачности и пожелтения кожи. В слое кожи, где клетки быстро обновляются, белок K10 образуется путем дифференцировки кератиноцитов, которые восприимчивы к образованию AGEs [12, 15, 16].
Морщины появляются на лице после 30 лет, в тот момент, когда меняется состав белков, эластиновых волокон, волокон коллагена и фибробластов, генерируемых в дерме, в результате воздействия солнечного излучения. Малая доза солнечного излучения повышает концентрацию металлопротеиназ (внеклеточных цинкзависимых эндопептидаз, способных разрушать все типы белков внеклеточного матрикса), в результате происходит изменение регуляции NF-kB и AP-1 и, как следствие, разрушение коллагена и эластина и уменьшение образования проколлагена типа I [17, 18].
NF-kB активируется УФ-излучением. В цитоплазме клетки NF-kB находится в неактивном состоянии в комплексе с ингибиторным белком IkB. Стимулирующий агент активизирует сигнальный путь NF-kB, при этом IkB фосфорилируется под действием киназы IKK (IkB-киназа), что приводит к деградации IkB в результате действия 26S-протеасомы.
В ромбовидной коже шеи антитела к AGEs откладываются в сгустки в средних и верхних слоях дермы. Такие изменения характерны при солнечном эластозе. Глыбы могут быть выявлены при окрашивании эластина с помощью метода Ван Гизона. УФВ-излучение стимулирует производство и выброс воспалительных цитокинов, таких как IL-1a, IL-6, TNFa, из кератиноцитов в эпидермисе. В свою очередь цитокины стимулируют фибробласты в дерме. Увеличивается образование мРНК и синтез матриксных металло-протеиназ ММР-1, ММР-3 или ММР-9 — ферментов, разрушающих коллаген и эластиновые волокна. MMP-1, как известно, расщепляет на части фибриллярный белок, следовательно, играет решающую роль при формировании морщин. Эластаза — это ещё один фермент, быстро гидролизирующий, т.е. разрушающий, эластин. При инги-бировании эластазы уменьшается образование УФ-индуцированных морщин у экспериментальных животных.
С учетом сигнальных путей MAPK (митоген-активируемой про-теинкиназы), т.е. учитывая группы мультифункциональных внутриклеточных сигнальных путей, содержащих одну из митоген-акти-вируемых протеинкиназ и контролирующих транскрипцию генов, метаболизм, пролиферацию и подвижность клеток, а также апоптоз и другие процессы, антиоксиданты могут эффективно предотвращать образование морщин.
Антигликационные стратегии для предотвращения старения кожи
Поскольку AGEs — важный патогенетический фактор при диабете и старении, разработка стратегий против данных продуктов остается в центре научных интересов [18]. Вещества, способные препятствовать накоплению AGEs, частично изучены. Некоторые из них уже проходят апробацию в клинических испытаниях. Они включают в себя как вещества, ингибирующие образование AGEs, так и вещества, нарушающие структуру AGEs. Немаловажную роль в борьбе с AGEs имеет снижение калорийности потребляемой пищи и увеличение физических нагрузок. У мышей уменьшение калорийности потребляемой пищи увеличивает продолжительность жизни и замедляет течение многих возрастных дисфункций.
Аминогуанидин был открыт одним из первых в качестве вещества, ограничивающего образование AGEs [19]. Это соединение не имеет никакого влияния на AGEs на поздних стадиях гликации. Пи-ридоксамин — еще один инструмент в борьбе с AGEs. Пиридоксамин представляет собой изоформу естественного витамина В6. Это соединение участвует в декарбоксилировании и трансаминировании, тормозит образование продуктов Амадори. В клинических испытаниях пиридоксамин показал многообещающие результаты при диабетической нефропатии. Пероральный прием пиридоксамина привел к мощному ингибированию повреждения коллагена кожи у крыс-диабетиков. Однако его потенциал при старении кожи человека требует глубокого изучения.
Установлены химические вещества и ферменты, способные распознавать и разрывать сшивки в реакции Майяра. Такими химическими «AGE-выключателями» являются диметил-3-фенил-тиазолиновый хлорид (ALT-711), N-фенацилтиазолин и N-фенацил-4,5-диметилтиазолин. Зарегистрированы достаточно перспективные результаты в борьбе с сердечно-сосудистыми осложнениями при старении и сахарном диабете, но их реальная способность расщеплять существующие белковые сшивки в тканях человека остается под вопросом.
Фруктозамин-3-киназа (FN3K) является относительно новым ферментом и в настоящее время изучается [20, 21]. Ученые ищут способ компенсации недостатка FN3K. После 7 лет исследований в лабораториях «Chanel» найдено вещество, стимулирующее выработку этого энзима. «Активный ингредиент из листьев сурианы приморской позволяет оптимизировать реакции дегликации коллагена, т.е. в буквальном смысле сохранить упругость и эластичность кожи», — объяснила глава лаборатории Кристель Лассер. Издавна отваром из этих листьев местные жители Индонезии лечили сахарный диабет, а теперь этот уникальный инградиент стал ключевым для создания антивозрастных средств [20].
Питание является важным фактором при старении кожи. Диетическое уменьшение калорийности играет большую роль в профилактике накопления AGEs в организме человека. Диетические ограничения могут существенно снизить содержание AGEs у крыс и мышей в коллагене кожи. Соблюдение диеты представляет собой не всегда выполнимое требование для пациента, однако ограничение потребления «глюкозотоксинов» и улучшение качества потребляемой пищи является более реалистичной и выполнимой задачей. «Глюкозотоксины», поступающие в организм с пищей, значительно увеличивают концентрацию системных медиаторов воспаления: IL-6 и С-реактивного белка, т.е. имеют диабетогенный, нефроток-сичный и атерогенный эффект [22-24]. К сожалению, нет достоверных клинических исследований, доказывающих влияние диетических ограничений на старение кожи человека.
Питание может влиять на процесс старения путем изменения экспрессии гена. Точный механизм влияния ограничения калорийности на процесс старения по-прежнему является предметом исследований. Возможно, происходит снижение регуляции передачи сигналов mTOR (mammalian target of rapamycin) и повышение регуляции экспрессии гена СИР-1. Внутриклеточный протеин mTOR является сигнальным элементом, регулирующим развитие и гипертрофию мышечных волокон.
Эти методы лечения представляют собой применение таких веществ, как ингибиторы AGEs, — веществ, разрушающихAGEs, которые увеличивают обмен веществ AGEs и антагонистов AGE-рецепторов. Одним из таких ингибиторов AGEs является аминогуанидин, но применение этого препарата влечет высокую частоту побочных эффектов. Смесь растительных экстрактов ромашки, боярышника, хауттюйнии сердцелистной и листьев винограда является весьма эффективной для ингибирования образования AGEs in vitro, у экспериментальных животных, а также в клинических исследованиях.
Экстракты розмарина, расторопшы, шалфея, майорана, имбиря, душистого перца, корицы, зеленого чая, куркумы, граната, яблока, черники и бурых водорослей являются ингибиторами AGEs при местном применении на коже человека [24, 25].
В сравнительном исследовании протестированы экстракты 24 трав и специй в связи с их способностью ингибировать гликацию альбумина in vitro. В результате экстракты специй зарекомендовали себя как более сильные ингибиторы гликозилирования, чем растительные экстракты. Экстракты имбиря, корицы, душистого перца и гвоздики являются мощным оружием в борьбе с гликацией. Экстракты шалфея, майорана и розмарина также эффективны, но в меньшей степени. Экстракт розмарина обладает мощными антиоксидантными и бактерицидными свойствами, он подавляет УФ-индуцированные металлопротеиназы. Спиртовой экстракт из листьев розмарина ингибирует окислительные изменения в поверх-
ностном слое кожи и защищает кожу от повреждения свободными радикалами. Исследования показали, что куркумин обладает противовоспалительными свойствами, является мощным антиоксидантом и препятствует выработке конечных продуктов глубокого гликиро-вания. При местном применении геля с куркумином на фотоповреж-денной коже в течение 3-6 мес произошло клиническое улучшение многих параметров фотостарения: уменьшение кератоза, осветление лентигинозных пятен, улучшение текстуры кожи и уменьшение мелких морщин [26].
Другим важным ингибитором гликации является а-липоевая кислота (ALA), которая является естественным антиоксидантом. В рандомизированном плацебо-контролируемом двойном слепом исследовании с участием 33 женщин, которые использовали в течение 12 нед 5% крем с ALA на одной половине лица и 0,3% ко-фермент Q10 с 0,03% ацетил-Ь-карнитином на другой стороне лица, выявилось статистически значимое уменьшение периорбитальных морщин на стороне, где использовали крем с ALA.
Карнозин (Р-аланил-Ь-гистидин) — дипептид, состоящий из остатков аминокислот Р-аланина и гистидина. Обнаружен в высоких концентрациях в мышцах и тканях мозга. Исследования показали, что карнозин имеет свойства антиоксиданта. Доказана активность карнозина в удалении активных форм кислорода, а также аР-ненасыщенных альдегидов, образующихся из суперокисленых жирных кислот клеточных мембран в процессе окислительного стресса. Он является ингибитором гликации. В результате исследований установлено, что пероральный прием пищевых добавок с кар-нозином может улучшить внешний вид кожи, включая уменьшение мелких морщин [26].
Астрагалозид, выделенный из корня астрагала, значительно подавляет генерацию карбоксиметиллизина (CML), образующегося в процессе реакции Майяра и являющегося самым распространенным поздним продуктом гликации, а также пентозидина, флюоресцентного продукта гликации. К веществам, приводящим к нарушению образования AGEs, относятся производные тиазола, такие как N-фенацилтиазолин (фенилтиазолий) и ^фенацил-4,5-диметилтиазолин.
Таким образом, существует достаточно доказательств того, что AGEs играют важную роль в процессе старения кожи. Процесс гли-кации наблюдается при старении кожи и сопровождается сшиванием волокон коллагена и эластина, что приводит к потере эластичности кожи и способствует старению. Процесс осаждения в тканях гликозилированного коллагена и эластина необратим, поэтому профилактика гликации, включающая в себя снижение потребления сахаров и жесткий контроль гликемии, является лучшей стратегией. Внешние факторы, такие как пребывание на солнце, ускоряют осаждение AGEs в тканях, следовательно, ограничение чрезмерного воздействия солнечного излучения на кожу является также профилактикой старения. Есть многочисленные исследования веществ, уменьшающих чрезмерное накопление AGEs в тканях [24-27]. Некоторые из этих исследований уже показали положительный эффект в терапии диабетических осложнений, однако четких клинических исследований этих анти-AGEs-стратегий в борьбе со старением кожи человека пока нет, поэтому перед нами огромное поле деятельности для будущих научных открытий. Финансирование. Исследование не имело спонсорской поддержки. Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
ЛИТЕРАТУРА
5. Олисова О.Ю., Андреева Е.В. Еще раз о проблеме гиперпигментации. Российский журнал кожных и венерических болезней. 2014; 17(2): 20-4.
6. Круглова Л.С., Иконникова Е.В. Гиперпигментация кожи: современные взгляды на этиологию и патогенез (часть 1). Российский журнал кожных и венерических болезней. 2017; 20(3): 178-83.
26. Анисимов В.Н. Молекулярные и физиологические механизмы старения. СПб.: Наука; 2008.
27. Емельянов В. В., Максимова Н. Е., Мочульская Н. Н., Черешнев В. А. Неферментативное гликозилирование белков: химия, патофизиология, перспективы коррекции. Вопросы биологической, медицинской и фармацевтической химии. 2010; 1: 3-15.
Остальные источники литературы см. в References.
REFERENCES
1. Ichihashi M., Ueda M., Budiyanto A., Bito T., Oka M., Fukunaga M., Tsuru K., Horikawa T. UV-induced skin damage. Toxicology. 2003; 189(1-2): 2139. Available at: https://www.ncbi.nlm.nih.gov/pubmed/12821280
2. Zouboulis C.C., Makrantonaki E. Clinical aspects and molecular diagnostics of skin aging. Clin. Dermatol. 2011; 29(1): 3-14. DOI: 10.1016/j.clinderma-tol.2010.07.001.
3. Gkogkolou P., Bohm M. Advanced glycation end products. Key players in skin aging? Dermatoendocrinol. 2012; 4(3): 259-70.
4. Ohshima H., Oyobikawa M., Tada A. Melanin and facial skin fluorescence as markers of yellowish discoloration with aging. Skin Res. Technol. 2009; 15(4): 496-502.
5. Olisova O.Yu., Andreeva E.V. Once again on the problem of hyperpigmen-tation. Russian Journal of Skin and Venereal Diseases (Rossiyskii Zhurnal Kozhnykh i Venericheskikh Boleznei). 2014; 17(2): 20-4. (in Russian)
6. Kruglova L.S., Ikonnikova E.V. Hyperpigmentation of the skin: modern views on the etiology and pathogenesis (part 1). Russian Journal oof Skin and Venereal Diseases (Rossiyskii Zhurnal Kozhnykh i Venericheskikh Boleznei). 2017; 20(3): 178-83. (in Russian)
7. Monnier V.M. Intervention against the Maillard reaction in vivo. Arch. Bio-chem. Biophys. 2003; 419(1): 1-15.
8. Ott C., Jacobs K., Haucke E., Navarrete Santos A., Grune T., Simm A. Role of advanced glycation end products in cellular signaling. Redox Biol. 2014; 2(1): 411-29. DOI: 1016/j.redox.2013.12.016.
9. Ichihashi M., Yagi M., Nomoto K., Yonei Y. Glycation stress and photo-aging in skin. J. Anti-Aging Med. 2011; 8(3): 23-9. Available at: http://www.anti-aging.gr.jp/english/pdf/2011/8%283%292329en.pdf
10. Loughlin D.T., Artlett C.M. Precursor of advanced glycation end products mediates ER-stress-induced caspase-3 activation of human dermal fibroblasts through NAD(P) H oxidase 4. PLoS_ One. 2010; 5(6): e11093.
11. Corstjens H., Dicanio D., Muizzuddin N., Neven A., Sparacio R., Declercq L., et al. Glycation associated skin autofluorescence and skin elasticity are related to chronological age and body mass index of healthy subjects. Exp. Gerontol. 2008; 43(7): 663-7. DOI: 10.1016/j.exger.2008.01.012.
12. Kawabata K., Yoshikawa H., Saruwatari K.3. DOI: 10.1159/000322087..
14. Ramasamy R., Yan S.F., Schmidt A.M. RAGE: therapeutic target and bio-marker of the inflammatory response-the evidence mounts. J. Leukoc. Biol. 2009; 86(3): 505-12. DOI: 10.1189/jlb.0409230.
15. Fan X., Sell D.R., Zhang J., Nemet I., Theves M., Lu J., et al. Anaerobic vs aerobic pathways of carbonyl and oxidant stress in human lens and skin during aging and in diabetes: A comparative analysis. Free Radic. Biol. Med. 2010; 49(5): 847-56. DOI: 10.1016/j.freeradbiomed.2010.06.003.
16. Nagai R., Fujiwara Y., Mera K., Yamagata K., Sakashita N., Takeya M. Immunochemical detection of Nepsilon-(carboxyethyl)lysine using a specific antibody. J. Immunol. Methods. 2008; 332(1-2): 112-20. DOI: 10.1016/j. jim.2007.12.020.
17. Xue M., Rabbani N., Thornalley P.J. Glyoxalase in ageing. Semin. Cell. Dev. Biol. 2011; 22(3): 293-301. DOI: 10.1016/j.semcdb.2011.02.013.
18. Ichihashi M., Ando H. The maximal cumulative solar UVB dose allowed to maintain healthy and young skin and prevent premature photoaging. Exp. Dermatol. 2014; 23(Suppl. 1): 43-6. DOI: 10.1111/exd.12393.
19. Van Schaftingen E., Collard F., Wiame E., Veiga-da-Cunha M. Enzymatic repair of Amadori products. Amino Acids. 2012; 42(4): 1143-50. DOI: 10.1007/ s00726-010-0780-3.
20. Farris P.K. Innovative cosmeceuticals: sirtuin activators and anti-glycation compounds. Semin. Cutan. Med. Surg. 2011; 30(3): 163-6. DOI: 10.1016/j. sder.2011.05.004.
21. Wu X., Monnier V.M. Enzymatic deglycation of proteins. Arch. Biochem. Biophys. 2003; 419(1): 16-24.
22. Hori M., Kishimoto S., Tezuka Y., Nishigori H., Nomoto K., Hamada U., Yonei Y. Double-blind study on effects of glucosyl ceramide in beet extract on skin elasticity and fibronectin production in human dermal fibroblasts. J. Anti-Aging Med. 2010; 7(11): 129-42. Available at: http://www.anti-aging.gr.jp/ english/pdf/2010/7(11)129-142.pdf
23. Yonei Y., Yagi M., Hibino S., Matsuura N. Herbal extracts inhibit Maillard reaction, and reduce chronic diabetic complications risk in streptozotocin-in-duced diabetic rats. J. Anti-Aging Med. 2008; 5(10): 93-8. Available at: http:// www.anti-aging.gr.jp/english/pdf/2008/5(10)93-98.pdf
24. Yonei Y., Miyazaki R., Takahashi Y., Takahashi H., Nomoto K., Yagi M., et al. Anti-glycation effect of mixed herbal extract in individuals with pre-diabetes mellitus: a double-blind, placebo-controlled, parallel group study. J. Anti-Ag-ingMed. 2010; 7(5): 26-35.
25. Gkogkolou P., Bohm M. Advanced glycation end products: Key players in skin aging? Dermatoendocrinol. 2012; 4(3): 259-70. DOI: 10.4161/derm.22028.
26. Anisimov V.N. Molecular and physiological mechanisms of aging (2 tons). St.Petersburg: Science; 2008. (in Russian)
27. Emelyanov V.V., Maksimova N.E., Mochulskaya N.N., Chereshnev V.A. Non-enzymatic glycosylation of proteins: chemistry, pathophysiology, correction prospects. Problems of Biological, Medical and Pharmaceutical Chemistry. Russian Journal (Voprosy biologicheskoy, meditsinskoy i farmatsevticheskoy khimii). 2010; 1: 3-15. (in Russian)
Поступила 13.04.17 Принята к печати 26.07.17
© КРУГЛОВА Л.С., ИКОННИКОВА Е.В., 2017 УДК 616.5-003.829-085.849.19
Круглова Л.С., Иконникова Е.В.
ГИПЕРПИГМЕНТАЦИЯ КОЖИ: СОВРЕМЕННЫЙ ВЗГЛЯД НА МЕТОДЫ КОРРЕКЦИИ (часть 2)
ФГБУ ДПО «Центральная государственная медицинская академия» Управления делами Президента РФ, 121359, г. Москва, Россия
Представлен краткий обзор литературы основных методов терапии гиперпигментации на основе современных научных публикаций. В обзоре отражены основные тенденции применения наружных средств, лазерной и светотерапии, а также возможности комбинации некоторых методов лечения.
Ключевые слова: обзор литературы; гиперпигментация; мелазма; лазер; лазерная терапия; меланин; лентиго.
Для цитирования: Круглова Л.С., Иконникова Е.В. Гиперпигментация кожи: современный взгляд на методы коррекции (часть 2). Российский журнал кожных и венерических болезней. 2017; 20(4): 248-251. DOI: http://dx.doi.Org/:10.18821/1560-9588-2017-20-4-248-251
Kruglova L.S., Ikonnikova E.V.
NONNEOPLASTIC HYPERPIGMENTATION OF THE SKIN: MODERN VIEWS ON METHODS OF CORRECTION
Central State Medical Academy General Management Department of the President of the Russian Federation, Moscow, 121359, Russian Federation
A brief literature review of the main methods of treatment of hyperpigmentation on the basis of modern scientific publications is presented. The overview reflects the main trends in the use of external treatment, laser and light therapy, and the possibility of a combination of some methods of treatment.
Keywords: hyperpigmentation; melasma; laser; laser therapy; melanin; lentigines.
For citation: Kruglova L.S., Ikonnikova E.V Hyperpigmentation of the skin: modern views on methods of correction. Russian
Journal of Skin and Venereal Diseases (Rossiyskii Zhurnal Kozhnykh i Venericheskikh Boleznei). 2017; 20(4): 248-251. (in Russian).
DOI: http://dx.doi.org/:10.18821/1560-9588-2017-20-4-248-251
Conflict of interest. The authors declare no conflict of interest.
Acknowledgments. The study had no sponsorship.
Received 09 March 2017
Accepted 15 May 2017
Гликирование белков — преждевременное быстрое старение
16.05.2018
Гликирование =
(неферментативное гликозилирование) =
(реакция Майяра) — это реакция между углеводами (глюкоза, фруктоза, сахароза и т.д.) и аминогруппами белков, липидов (жиров) и нуклеиновых кислот живых организмов, которая протекает без участия ферментов.
Глюкоза — это необходимый продукт для нормального функционирования организма. Но ее избыток, оказывает негативное влияние на организм, при котором сахар в крови вступает в реакцию с белками, соединяется с ними и нарушает их нормальное функционирование. Этот процесс и называется — гликированием.
Иными словами, углеводы присоединяются к белкам и гликируют их, в результате чего образуется новое соединение, состоящее из белков и углеводов. Иными словами, происходит — «карамелизация» белков, при котором белки, оказываясь не свободными, как бы связанными «по рукам и ногам» этими углеводами и уже не могут свободно исполнять отведенную им роль в организме. Эти белки становятся не работоспособными, так как их структура нарушена, вследствие чего нарушена и их функция, что неукоснительно ведет к ускоренному старению организма, старению органов, старению кожи — к ее сухости и образованию морщин. Из-за нарушения структуры белков: коллагена и эластина — основных белков стенок кровеносных сосудов — эти сосуды становятся хрупкими, теряют элластичность, в них образуются трещины, мгновенно заполняемые холестериновыми бляшками, что в итоге — неизбежно ведет к риску развития фиброза, атеросклероза и других сердечно-сосудистых заболеваний.
Эти новые соединения, образующиеся в результате гликирования (неферментативного гликозилирования или реакции Майяра), в результате — взаимодействия сахара в крови (углеводов) и белков называюся:
Конечными продуктами гликирования (Advanced Glycation End Products — сокращенно AGEs)
Гликирование белков приводит к следующим негативным процессам в организме:
значительное повреждение коллагена кожи. что приводит к появлению множества морщин, кожа увядает, стареет.
повреждение хрусталика глаза, что неизбежно приводит к риску возникновения катаракты и, в дальнейшем, чревато полной потерей зрения.
AGEs (конечные продукты гликирования) вызывают системное воспаление, которое приводит к старению всего организма в целом , а так же атеросклерозу сосудов — основной причиной возникновения инсультов и инфарктов.
* Системное воспаление — это процесс, который истощает пул стволовых клеток, в результате чего органы и ткани утрачивают способность к регенерации (воссозданию / восстановлению). Все это стремительно ускоряет процессы старения организма.
Следует отметить, что системное воспаление сосудов приводит к их закупорке холестериновыми бляшками (в итоге получаем — инсульты и инфаркты).
Системное воспаление значительно истощает имунную систему, которая при данном процессе работает на пределе своих возможностей ( в итоге получаем — многочисленные аутоимунные заболевания не только средней тяжести, такие как, например, аллергия, псориаз, но и более тяжелые, приводящие, даже, к летальному исходу: красная волчанка или аутоимунная анемия).
Гликация и старение кожи
Старение определяется как постепенное ухудшение физиологических функций организма, важных для выживания. Накопление продуктов, поврежденных клетками, с течением времени — основная причина старения. Кожа, являющаяся самым внешним защитным покровом тела, часто подвергается как внутренним, так и внешним факторам старения.
Характерными чертами стареющей кожи являются морщины, сухость кожи, уменьшение толщины кожи, потеря эластичности, атрофия дермы и эпидермиса, снижение скорости пролиферации эпидермальных клеток и клеточного старения.К внешним факторам, которые в основном способствуют старению кожи, относятся солнечный свет, ультрафиолетовое излучение, химические вещества, загрязнители и курение.
Помимо внешних стимулов, к эндогенным процессам, запускающим процесс старения, относятся чрезмерное производство свободных радикалов, мутации ядер / митохондриальных генов, клеточное старение, укорочение теломер, снижение пролиферации клеток и нарушение иммунной функции. В последние годы многие научные исследования показали, что передовые конечные продукты гликирования (AGE) также являются одними из важнейших факторов старения кожи.
Диаграмма более молодой кожи и стареющей кожи. Кредит изображения: Designua / Shutterstock
Конечные продукты с улучшенным гликированием
Образование AGE — очень сложный процесс, который включает спонтанную неферментативную реакцию, называемую гликированием. Гликирование — это реакция между восстанавливающим сахаром и белками, липидами и нуклеиновыми кислотами, при которой реактивные карбонильные группы восстанавливающего сахара реагируют со свободными аминогруппами белков с образованием нестабильного основания Шиффа. Дополнительная перегруппировка основания Шиффа приводит к образованию более стабильных продуктов Амадори, которые в основном являются кетоаминами или фруктозаминами.Эти обратимые продукты реакции впоследствии подвергаются необратимым реакциям окисления, полимеризации, дегидратации и сшивки с образованием AGE.
Постепенное накопление этих AGE в организме является признаком процесса старения у людей, животных и других организмов. Наиболее часто встречающиеся в коже AGE включают карбоксиметил-лизин, карбоксиэтил-лизин, пентозидин, метилглиоксаль и глиоксаль, глюкозепан и фруктозолизин. Рецепторы AGE обычно экспрессируются в эпидермисе и дерме, и было замечено, что экспрессия выше на участках кожи, подверженных воздействию солнца, по сравнению с участками, защищенными от солнца.
Возраст и старение кожи
Накопление AGE в коже наблюдается как при диабете, так и во время хронологического старения. Белки с низкой скоростью обновления, такие как коллаген I и IV, а также долгоживущие белки, такие как фибронектин, являются основными мишенями реакции гликирования в коже. Более того, чрезмерное отложение AGE на участках кожи, подвергшихся воздействию солнца, предполагает, что солнечное излучение, особенно УФ-излучение, может играть важную роль в формировании AGE.
Помимо солнечного света, к другим внешним факторам, которые ответственны за повышенное образование и отложение AGE в коже, относятся курение и диета.Количество AGE в пище в основном зависит от метода приготовления. Например, жареные продукты содержат большее количество AGE по сравнению с вареными продуктами. Около 10-30% попавших в организм AGE абсорбируются в организме и могут участвовать в старении кожи.
Механически AGE могут реагировать с белками, липидами и нуклеиновыми кислотами и изменять их нормальное физиологическое функционирование. Связываясь со своими рецепторами, AGE также могут запускать каскад сигнальных путей, что приводит к снижению пролиферации клеток, увеличению клеточного старения и апоптозу, снижению синтеза внеклеточного матрикса, увеличению образования свободных радикалов и провоспалительных медиаторов и т. Д.Все эти процессы потенциально могут способствовать старению кожи.
Стратегии контроля возраста
Поскольку автофлуоресценция является неотъемлемым свойством AGE, измерение флуоресценции кожи является эффективным методом обнаружения отложений AGE на коже. Исследования показали, что флюоресценция кожи положительно коррелирует со многими возрастными расстройствами, такими как сердечно-сосудистые заболевания, почечная недостаточность, дегенерация желтого пятна и общая смертность. Учитывая огромное участие AGE в возрастных расстройствах, включая старение кожи, необходимы эффективные стратегии / вмешательства для предотвращения или, по крайней мере, контроля их накопления в организме.В этом отношении наиболее эффективные стратегии включают удаление уже сформированных AGE из организма путем разложения гликозилированных белков; ингибирование образования AGE; и противодействие AGE-опосредованному сигнальному каскаду.
Ингибирование образования AGE — Аминогуанидин, нуклеофильный гидразин, как известно, предотвращает образование AGE за счет секвестирования продуктов раннего гликирования, таких как промежуточные карбонильные соединения. Однако он имеет множество побочных эффектов и не влияет на продукты гликирования.Другим таким соединением является пиридоксамин, который показал хорошие результаты в клинических испытаниях фазы II с участием пациентов с диабетической невропатией. Известно, что это соединение ингибирует продвинутые продукты гликирования.
Деградация гликированных белков
Было показано, что химические соединения, такие как ALT-711, N-фенацилтиазолий и N-фенацил-4,5-диметилтиазолий, нарушают аномальное сшивание белков, вызванное AGE. Из этих соединений ALT-711 показал многообещающий результат в повышении гидратации кожи у старых крыс.
Антагонизм AGE-опосредованного сигнального каскада
Подходы, которые используются для ингибирования управляемых AGE сигнальных путей, включают опосредованное siRNA нокдаун или опосредованное низкомолекулярным ингибитором блокирование рецепторов AGE.
Дополнительная литература
Конечные продукты усовершенствованного гликирования (AGE) способствуют меланогенезу через рецептор для AGE
Сингх Р., Барден А., Мори Т. и Бейлин Л. Конечные продукты усовершенствованного гликирования: обзор. Diabetologia 44 , 129–146 (2001).
CAS Статья PubMed Google ученый
Мизутари, К., Оно, Т., Икеда, К., Каяшима, К. и Хориучи, С. Фотоусиленная модификация эластина кожи человека в актиническом эластозе с помощью N (эпсилон) — (карбоксиметил) лизина , один из продуктов гликоксидации реакции Майяра. J Invest Dermatol 108 , 797–802 (1997).
CAS Статья PubMed Google ученый
Мори, Ю.и другие. УФ-B-облучение усиливает рацемизацию и изомеризацию аспартильных остатков и образование N ε -карбоксиметиллизина (CML) в кератине кожи. J Chromatorgr B Analyt Technol Biomed Life Sci 879 , 3303–3309 (2011).
CAS Статья Google ученый
Баста, Г., Шмидт, А. М. и Де Катерина, Р. Д. Конечные продукты гликозилирования и воспаление сосудов: последствия для ускоренного развития атеросклероза при диабете. Cardiovasc Res 63 , 582–592 (2004).
CAS Статья PubMed PubMed Central Google ученый
Vitek, M. P. et al. Конечные продукты улучшенного гликирования способствуют возникновению амилоидоза при болезни Альцгеймера. Proc Natl Acad Sci USA 91 , 4766–4770 (1994).
ADS CAS Статья PubMed Google ученый
Мията, Т.и другие. Влияние повышенного окислительного стресса на образование конечных продуктов гликирования у пациентов с терминальной почечной недостаточностью. Kidney Int 51 , 1170–1181 (1997).
CAS Статья PubMed Google ученый
Lohwasser, C., Neureiter, D., Weigle, B., Kichner, T. & Schuppan, D. Рецептор конечных продуктов гликирования сильно экспрессируется в коже и активируется конечными продуктами улучшенного гликирования и фактор некроза опухоли-альфа. J Invest Dermatol 126 , 291–299 (2006).
CAS Статья PubMed Google ученый
Jeanmaire, C., Danoux, L. & Pauly, G. Гликация во время естественного и актинического старения кожи человека: модельное исследование in vivo, и in vitro, . Br J Dermatol. 145 , 10–18 (2001).
CAS Статья PubMed Google ученый
Продам, Д.R. et al. Продолжительность жизни и генетическая детерминация кинетики гликоксидирования коллагена при старении млекопитающих. Proc Natl Acad Sci USA 93 , 485–490 (1996).
ADS CAS Статья PubMed Google ученый
Kawabata, K. et al. Присутствие N (ε) — (карбоксиметил) лизина в эпидермисе человека. Biochim biophys Acta 1814 , 1246–1252 (2011).
CAS Статья PubMed Google ученый
Купер Т.и другие. Виментин является специфической мишенью для гликирования кожи. Структурные предпосылки, функциональные последствия и роль в старении кожи. J Biol Chem 282 , 23427–23436 (2007).
CAS Статья PubMed Google ученый
Dyer, D. G. et al. Накопление продуктов реакции Майяра в коллагене кожи при диабете и старении. J Clin Invest 91 , 2463–2469 (1993).
CAS Статья PubMed PubMed Central Google ученый
Хашими, Ф., Мэлоун-Ли, Дж. И Хаунселл, E. Кожа подошв при диабете II типа: исследование гликирования белков и биохимических свойств подошвенного эпидермиса. Eur J Dermatol 16 , 23–32 (2006).
Google ученый
Bucala, R. & Cerami, A. Продвинутое гликозилирование: химия, биология и последствия для диабета и старения. Adv. Pharmacol 23 , 1–34 (1992).
CAS Статья PubMed Google ученый
Каспер, М.И Функ, Р. Х. Возрастные изменения в клетках и тканях из-за продвинутых конечных продуктов гликирования (AGE). Arch Gerontol Geriatr 32 , 233–243 (2001).
CAS Статья PubMed Google ученый
Масаки, Х., Окано, Ю. и Сакураи, Х. Получение активных форм кислорода из конечных продуктов гликирования (AGE) при облучении ультрафиолетовым светом A (UVA). Biochem Biophys Res Commun 235 , 306–310 (1997).
CAS Статья PubMed Google ученый
Crisan, M. et al. Экспрессия конечных продуктов гликирования на открытых и открытых участках кожи в процессе старения у людей. PLoS One 8 , e75003 (2013).
ADS CAS Статья PubMed PubMed Central Google ученый
Рамасами Р.и другие. Конечные продукты продвинутого гликирования и RAGE: общие черты старения, диабета, нейродегенерации и воспаления. Гликобиология 15 , 16R – 28R (2005).
CAS Статья PubMed Google ученый
Wautier, M. P. et al. Активация НАДФН-оксидазы конечными продуктами продвинутого гликирования (AGE) связывает оксидантный стресс с измененной экспрессией генов через RAGE. Am J Physiol Endocrinol Metab 280 , E685–694 (2001).
CAS Статья PubMed Google ученый
Hofmann, M.A. et al. RAGE опосредует новую провоспалительную ось: рецептор центральной поверхности клетки для полипептидов S100 / кальгранулина. Cell 97 , 889–901 (1999).
CAS Статья Google ученый
Li, J. H. et al. Конечные продукты продвинутого гликирования индуцируют переход канальцевого эпителия и миофибробластов через сигнальный путь киназы RAGE-ERK1 / 2 MAP. AM J Pathol 164 , 1389–1397 (2004).
CAS Статья PubMed PubMed Central Google ученый
Ян С.С. и др. Подавление экспериментального аутоиммунного энцефаломиелита селективной блокадой энцефалитогенной Т-клеточной инфильтрации центральной системы. Nat Med 9 , 287–293 (2003).
CAS Статья PubMed Google ученый
Хатчинсон, К.Р., Лорд, К. К., Вест, Т. А. и Стюарт, Дж. А. Младший. Зависимое от фибробластов накопление внеклеточного матрикса связано с диастолической жесткостью при диабете 2 типа. PLoS One 8 , e72080 (2013).
ADS CAS Статья PubMed PubMed Central Google ученый
Zhu, P. et al. Участие путей RAGE, MAPK и NF-κB в вызванной AGE активацией MMP-9 в кератиноцитах HaCaT. Exp Dermatol 2 , 123–129 (2011).
Google ученый
Tanikawa, T., Okada, Y., Tanikawa, R. & Tanaka, Y. Конечные продукты улучшенного гликирования вызывают кальцификацию гладкомышечных клеток сосудов посредством RAGE / p38 MAPK. J Vasc Res 46 , 572–580 (2009).
CAS Статья PubMed Google ученый
Купер, М.E. Взаимодействие метаболических и гемодинамических факторов в опосредовании экспериментальной диабетической нефропатии. Diabetologia 44 , 1957–1972 (2001).
CAS Статья PubMed Google ученый
Гилберт Р. Э. и Купер М. Э. Тубулоинтерстиций при прогрессирующем диабетическом заболевании почек: больше, чем последствия повреждения клубочков? Kidney Int 56 , 1627–1637 (1999).
CAS Статья PubMed Google ученый
Makita, Z.и другие. Конечные продукты продвинутого гликозилирования у пациентов с диабетической нефропатией. N Engl J Med 325 , 836–842 (1991).
CAS Статья PubMed Google ученый
Влассара, Х., Букала, Р. и Страйкер, Л. Патогенные эффекты расширенного гликозилирования: биохимические, биологические и клинические последствия для диабета и старения. Lab Invest 70 , 138–151 (1994).
CAS PubMed Google ученый
Гольдин, А., Бечман, Дж. А., Шмидт, А. М. и Крегер, М. А. Конечные продукты с улучшенным гликированием. Тираж 114 , 597–605 (2006).
CAS Статья PubMed Google ученый
van Heijst, J. W. et al. Модифицированный аргпиримидином белок теплового шока 27 при немелкоклеточном раке легкого человека: возможный механизм уклонения от апоптоза. Cancer Lett 241 , 309–319 (2006).
CAS Статья PubMed Google ученый
Семба, Р.Д., Никлетт, Э. Дж. И Ферруччи, Л. Способствует ли накопление конечных продуктов гликирования фенотипу старения? J Gerontol A Biol Sci Med Sci 65 , 963–975 (2010).
Артикул PubMed Google ученый
Gkogkolou, P. & Böhm, M. Конечные продукты с улучшенным гликированием: ключевые игроки в старении кожи? Дерматоэндокринол 4 , 259–270 (2012).
CAS Статья PubMed PubMed Central Google ученый
Вондрак, Г.Т., Робертс, М. Дж., Якобсон, М. К. и Якобсон, Е. Л. Фотосенсибилизированное ингибирование роста культивируемых клеток кожи человека: механизм и подавление окислительного стресса от солнечного облучения гликированных белков. J Invest Dermatol 119 , 489–498 (2002).
CAS Статья PubMed Google ученый
Абдель-Малек, З. А., Кадекаро, А. Л. и Свуп, В. Б. Повышение уровня меланоцитов в борьбе с воздействием УФ-излучения. Pigment Cell Melanoma Res 23 , 171–186 (2010).
CAS Статья PubMed Google ученый
Hodis, E. et al. Пейзаж драйверных мутаций при меланоме. Cell 150 , 251–263 (2012).
CAS Статья PubMed PubMed Central Google ученый
Иммокава Г. и Исида К. Ингибиторы внутриклеточных сигнальных путей, которые приводят к стимулированию эпидермальной пигментации: перспектива антипигментирующих агентов. Int J Mol Sci 15 , 8293–8315 (2014).
Артикул Google ученый
Ван С.К., Балагула Ю. и Остервальдер У. Фотозащита: обзор современных и будущих технологий. Dermatol Ther 23 , 31–47 (2010).
CAS Статья PubMed Google ученый
Ullrich, S. E. Роль эпидермальных цитокинов в генерации кожных иммунных реакций и подавления иммунитета, вызванного ультрафиолетовым излучением. Photochem Photobiol 62 , 389–401 (1995).
CAS Статья PubMed Google ученый
Newton, R.A. et al. Активация пути цАМФ вариантными аллелями MC1R человека, экспрессируемыми в НЕК и в клетках меланомы. Пептиды 26 , 1818–1824 (2005).
CAS Статья PubMed Google ученый
Инь, К., Штурм Р. А. и Смит А. Г. Рецепторы MC1R и NR4A в клеточном стрессе и репарации ДНК: значение для защиты от УФИ. Exp Dermatol 23 , 449–452 (2014).
CAS Статья PubMed Google ученый
Corre, S. et al. Индуцированная УФ-излучением экспрессия ключевого компонента процесса загара, генов POMC и MC1R, зависит от активированного p-38 стимулирующего фактора-1 (USF-1). J Biol Chem 279 , 51226–51233 (2004).
CAS Статья PubMed Google ученый
Navaratna, D., McGuire, P. G., Menicucci, G. & Das, A. Протеолитическая деградация VE-кадгерина изменяет гемато-ретинальный барьер при диабете. Диабет 56 , 2380–2387 (2007).
CAS Статья PubMed Google ученый
Баста Г. и др. Конечные продукты продвинутого гликирования активируют эндотелий через рецептор передачи сигнала RAGE: механизм усиления воспалительных реакций. Тираж 105 , 816–822 (2002).
CAS Статья PubMed Google ученый
Abe, R. et al. Регулирование роста и метастазирования меланомы человека посредством взаимодействий рецепторов AGE-AGE. J Invest Dermatol 122 , 461–467 (2004).
CAS Статья PubMed Google ученый
Fritz, G. RAGE: один рецептор соответствует множеству лигандов. Trends Biochem Sci. 36 , 625–632 (2011).
CAS Статья PubMed Google ученый
Huttunen, H.J., Kuja-Panula, J. & Rauvala, H. Рецептор передачи сигналов конечных продуктов гликирования (RAGE) индуцирует CREB-зависимую экспрессию хромогранина во время дифференцировки нейронов. J Biol Chem 277 , 38635–38646 (2002).
CAS Статья PubMed Google ученый
Buscà, R.И Баллотти, Р. Циклический АМФ — ключевой посредник в регулировании пигментации кожи. Pigment Cell Res 13 , 60–69 (2000).
Артикул PubMed Google ученый
Lee, C. S. et al. Новое производное адамантилбензилбензамида, AP736, подавляет меланогенез за счет ингибирования cAMP-PKA-CREB-активированного фактора транскрипции, связанного с микрофтальмией, и экспрессии тирозиназы. Exp Dermatol 22 , 762–764 (2013).
CAS Статья PubMed Google ученый
Saha, B. et al. Активация промотора Mitf стимулированной липидами активации передачи сигнала стресса p38 к CREB. Pigment Cell Res 19 , 595–605 (2006).
CAS Статья PubMed Google ученый
Li, Y. et al. RAGE опосредует ускоренный диабетический атеросклероз венозного трансплантата, вызванный комбинированным механическим стрессом и AGE, посредством синергической активации ERK. PLoS One 7 , e35016 (2012).
ADS CAS Статья PubMed PubMed Central Google ученый
Молл И., Хоудек П., Шмидт Х. и Молл Р. Характеристика заживления эпидермальных ран на модели культуры органов кожи человека: ускорение за счет трансплантированных кератиноцитов. J Invest Dermatol. 111 , 251–258 (1998).
CAS Статья PubMed Google ученый
Лю, З.и другие. На пути к разработке упрощенного метода долгосрочной органной культуры кожи головы человека и ее придатков в бессывороточных условиях. Exp. Дерматол. 16 , 37–44 (2007).
CAS Статья Google ученый
Flori, E. et al. 2,4,6-Октатриеновая кислота является новым промотором меланогенеза и антиоксидантной защиты в нормальных меланоцитах человека посредством активации PPAR-γ. Pigment Cell Res 24 , 618–630 (2011).
CAS Статья Google ученый
Гутьеррес, М. Л., Гевара, Дж. И Баррерра, Л. А. Полуавтоматическая система классификации в гистологическом и иммуногистохимическом анализе для оценки in vitro хондрогенеза. Universtias Scientiarum 17 , 167–178 (2012).
Артикул Google ученый
Lin, V.C. et al. In vitro и in vivo Ингибирование меланогенеза биоханином А из Trifolium pratense. Biosci Biotechnol Biochem 75 , 914–918 (2011).
CAS Статья PubMed Google ученый
Глюкоза, гликирование и старение | SpringerLink
MU Ахмед SR Торп JW Baynes (1986) Статья Название Идентификация N-эпсилон-карбоксиметиллизина как продукта разложения фруктозелизина в гликозилированном белке Дж Biol Chem 261 4889–4894
Google ученый
VN Анисимов средний Семенченко AI Яшин (2003) СтатьяНазваниеИнсулин и долголетие: антидиабетические бигуаниды как геропротекторы Биогеронтология 4 297–307
Google ученый
ЧАС Бакала E Делаваль M Hamelin J Висмут C Борот-Лалой B Корман B Фриге (2003) ArticleTitleИзменения в митохондриях печени крыс с возрастом: активность Lon-протеазы и накопление N-карбоксиметиллизина в матриксе евро J Biochem 270 2295–2302
Google ученый
JW Baynes (2000) ArticleTitleОт жизни к смерти — борьба между химией и биологией в процессе старения: реакция Майяра как усилитель повреждений генома Биогеронтология 1 235–246
Google ученый
КБ Бекман BN Эймс (1998) ArticleTitleСвободно-радикальная теория старения созревает Physiol Rev 78 547–581
Google ученый
NF Бенце RM Сампат RR Копито (2001) ArticleTitle Нарушение убиквитин-протеасомной системы из-за агрегации белков Наука 292 1552–1555
Google ученый
J Боратынский А Горский (2002) ArticleTitleBSE: Последствия кормления крупного рогатого скота гликированными молекулами неизвестный хозяин? Мед. Гипотез 58 276–278
Google ученый
р Букала (2002) Новые горизонты в исследованиях AGE N Танигучи S Хориучи F Hayase Т Курата Т Осава (Ред.) Материалы седьмого Международного симпозиума по реакции Майяра, 29 октября — 1 ноября 2001 г. Elsevier Science Кумамото, Япония 113–117
Google ученый
A-L Bulteau п Вербеке я Петропулос A-F Chaffotte B Фриге (2001) ArticleTitleИнгибирование протеасом в фибробластах, обработанных глиоксалем, и устойчивость гликированной глюкозо-6-фосфатдегидрогеназы к деградации 20S протеасом in vitro Дж Biol Chem 276 45662–45668
Google ученый
Hf Банн Пижама Хиггинс (1981) ArticleTitleРеакция моносахаридов с белками: возможное эволюционное значение Наука 213 222–224
Google ученый
J Кампизи (2000) ArticleTitle Старение, хроматин и ограничения в пище — соединяющие точки Наука 289 2062–2063 гг.
Google ученый
WT Чефалу ОБЪЯВЛЕНИЕ Белл-Фэрроу ZQ Ван МЫ Sonntag MX Фу JW Baynes SR Торп (1995) ArticleTitle Ограничение калорийности снижает возрастное накопление продуктов гликоксидации. N ɛ — (карбоксиметил) лизин и пентозидин. Дж Геронтол 50 337–341
Google ученый
C Керами ЧАС Фонды я Николл Т Мицухаси D Джордано S Vanpatten А Ли Y Аль-Абед ЧАС Влассара р Букала А Керами (1997) ArticleTitle Табачный дым — источник токсичных продуктов реактивного гликирования Proc Natl Acad Sci USA 94 13915–13920
Google ученый
BH Чен DY Цзян LS Тан (2003) ArticleTitle Конечные продукты усовершенствованного гликирования вызывают апоптоз и экспрессию апоптотических генов в культивируемых перицитах капилляров сетчатки крупного рогатого скота Чжунхуа Ян Кэ За Чжи 39 224–227
Google ученый
M Конкони LI Szweda RL Левин ER Stadtman B Фриге (1996) Снижение активности мультикаталитических протеиназ печени крыс и защита от окислительной инактивации белком теплового шока, связанное с возрастом 90 Arch Biochem Biophys 331 232–240
Google ученый
BK Derham JJ Harding (1997) ArticleTitle Влияние старения на шапероноподобную функцию человеческого альфа-кристаллина оценивается тремя методами Biochem J 328 763–768
Google ученый
BK Derham JJ Harding (1999) Статья НазваниеАльфа-кристаллин как молекулярный шаперон Prog Retin Eye Res , коррекция зрения 18 463–509
Google ученый
DG Красильщик JA Блэкледж SR Торп JW Baynes (1991) ArticleTitleОбразование пентозидина при неферментативном потемнении белков глюкозой.Идентификация глюкозы и других углеводов как возможных предшественников пентозидина in vivo. Дж Biol Chem 266 11654–11660
Google ученый
DG Красильщик JA Данн SR Торп KE Бальи TJ Лион DR McCance JW Baynes (1993) ArticleTitle Накопление продуктов реакции Майяра в кожном коллагене при диабете и старении J Clin Invest 91 2463–2469
Google ученый
IJ Эдвардс LL Рудель JG Терри JW Кемниц р Weindruch WT Чефалу (1998) ArticleTitle Ограничение калорийности у макак-резусов снижает взаимодействие липопротеинов низкой плотности с артериальными протеогликанами J Gerontol A Biol Sci Med Sci 53 443–448
Google ученый
B Фриге ER Stadtman LI Szweda (1994) ArticleTitle Модификация глюкозо-6-фосфатдегидрогеназы 4-гидрокси-2-ноненалом.Образование сшитого белка, ингибирующего мультикаталитическую протеазу. Дж Biol Chem 269 21639–21643
Google ученый
Т Fulop А Ларби N Douziech (2003) ArticleTitleИнсулиновые рецепторы и старение Патол Биол (Париж) 51 574–580
Google ученый
ПУ Джакомони грамм Рейн (2001) ArticleTitleФакторы старения кожи имеют общие механизмы Биогеронтология 2 219–229
Google ученый
р Gredilla А Санс M Лопес-Торрес грамм Barja (2001) ArticleTitle Ограничение калорий снижает образование митохондриальных свободных радикалов в комплексе I и снижает окислительное повреждение митохондриальной ДНК в сердце крысы FASEB J 15 1589–1591
Google ученый
B Холливелл (1997) Статья НазваниеАнтиоксиданты и болезни человека: общее введение Nutr Ред. 55 S44 – S52
Google ученый
B Холливелл (1999) Свободные радикалы в биологии и медицине EditionNumber3 Oxford University Press Оксфорд, Англия
Google ученый
B Холливелл (2000) СтатьяНазваниеПарадокс антиоксидантов Ланцет 355 1179–1180
Google ученый
Y Хамада N Араки N Ко J Накамура S Хориучи N Хотта (1996) ArticleTitleБыстрое образование конечных продуктов продвинутого гликирования промежуточными метаболитами гликолитического пути и пути полиола Biochem Biophys Res Commun 228 539–543
Google ученый
JJ Harding HT Beswick р Аджибойе р Huby р Блэкытный KC Риксон (1989) ArticleTitleНеферментативная посттрансляционная модификация белков при старении: обзор Механический разработчик старения 50 7–16
Google ученый
D Харман (1965) ArticleTitle Свободнорадикальная теория старения: влияние возраста на уровень меди в сыворотке Дж Геронтол 20 151–153
Google ученый
D Харман (1981) Статья НазваниеПроцесс старения Proc Natl Acad Sci USA 78 7124–7128
Google ученый
ММ Хит KC Риксон JJ Harding (1996) ArticleTitle Инактивация защиты малатдегидрогеназы, вызванная гликированием, аспирином и молекулярным шапероном хрусталика, альфа-кристаллином Biochim Biophys Acta 1315 176–184
Google ученый
Y Хигами я Симокава (2000) ArticleTitleАпоптоз в процессе старения Клеточная ткань Res 301 125–132
Google ученый
JW Кемниц EB Roecker р Weindruch DF Элсон ST Баум RN Бергман (1994) ArticleTitle Ограничение диеты повышает чувствительность к инсулину и снижает уровень глюкозы в крови у макак-резусов Am J Physiol Endocrinol Metab 266 540–547
Google ученый
MJ Кент ND Свет AJ Бейли (1985) ArticleTitleДоказательства опосредованного глюкозой ковалентного поперечного сшивания коллагена после гликозилирования in vitro Biochem J 225 745–752
Google ученый
S Кикучи K Синпо M Такеучи S Ямагиши Z Макита N Сасаки K Таширо (2003) ArticleTitleГликация — сладкий искуситель смерти нейронов Brain Res Rev 41 306–323
Google ученый
Т Кимура J Такамацу Т Мията Т Миякава S Хориучи (1998) ArticleTitleЛокализация идентифицированных структур конечных продуктов гликирования, N-эпсилон (карбоксиметил) лизина и пентозидина, в возрастных включениях в мозге человека Патол Инт 48 575–579
Google ученый
Т Кощинский ОН Ци-Цзян Т Мицухаси р Букала C Лю C Buenting K Heitmann ЧАС Влассара (1997) ArticleTitle Всасываемые перорально продукты реактивного гликирования (гликотоксины): фактор риска окружающей среды при диабетической нефропатии Proc Natl Acad Sci USA 94 6474–6479
Google ученый
E Кутсильери C Шеллер E Grunblatt K Нара J Ли п Ридерер (2002) СтатьяНазваниеСвободные радикалы при болезни Паркинсона Дж Нейрол 249 1–5
Google ученый
M Крайцовичова-Кудлацкова K Себекова р Шинцель J Клванова (2002) ArticleTitle Конечные продукты и питание для усовершенствованного гликирования Physiol Res 51 313–316
Google ученый
В Ли А Керами (1987) ArticleTitleПовышенные уровни глюкозо-6-фосфата связаны с плазмидными мутациями in vivo Proc Natl Acad Sci USA 84 8311–8314
Google ученый
B Леви MJ Верман (2001) ArticleTitleФруктоза вызывает модификацию и повреждение ДНК в плазмиде Escherichia coli Дж Nutr Biochem 12 235–241
Google ученый
ВМ Монье (1989) СтатьяНазваниеК теории старения, основанной на реакции Майяра Программа Clin Biol Res 304 1–22
Google ученый
ВМ Монье DR Продавать Икс Ву K Раттер (2002) Перспективы здоровья и долголетия от ингибирования реакции Майяра in vivo.S Хориучи N Танигучи F Hayase Т Курата Т Осава (Ред.) Материалы седьмого Международного симпозиума по реакции Майяра, 29 октября — 1 ноября 2001 г. Elsevier Science Кумамото, Япония 9–19
Google ученый
Я БЫ Николл AW Stitt JE Мур AJ Ричи БД Лучник р Букала (1998) СтатьяTitleПовышенные уровни конечных продуктов гликирования в линзах и кровеносных сосудах у курильщиков сигарет Мол Мед 4 594–601
Google ученый
Т Нива Т Кацудзаки Y Ишизаки F Hayase Т Миядзаки Т Уэмацу N Татемичи Y Takei (1997) ArticleTitle Имидазолон, новый конечный продукт с улучшенным гликированием, присутствует в больших количествах в почках крыс с диабетом, индуцированным стрептозотоцином. FEBS Lett 407 297–302
Google ученый
FG Ньороге LM Sayre ВМ Монье (1987) ArticleTitleОбнаружение пиррольных соединений, производных d -глюкозы, во время реакции Майяра в физиологических условиях Углеводородное сопротивление 167 211–220
Google ученый
ЧАС Обаяси K Накано ЧАС Шигета M Ямагути K Ёсимори M Фукуи M Fujii Y Китагава N Накамура K Накамура Y Накадзава K Йенага M Охта M Нисимура я Фукуи M Кондо (1996) ArticleTitleФормирование кросслайна как конечного продукта флуоресцентного улучшенного гликирования in vitro и in vivo Biochem Biophys Res Commun 226 37–41
Google ученый
PR Одетти А Боргольо р Роланди (1992) ArticleTitle Возрастное увеличение флуоресценции коллагена в подкожной клетчатке человека Метаболизм 41 655–658
Google ученый
A de La Рошетт я Бирлуэс-Арагон E Сильва п Морлиер (2003) ArticleTitleУсовершенствованные конечные продукты гликирования, такие как фотосенсибилизаторы UVA триптофана и аскорбиновой кислоты: последствия для хрусталика Biochim Biophys Acta 1621 235–241
Google ученый
J Родригес-Гарсия JR Рекена S Родригес-Сегаде (1998) СтатьяНаименованиеПовышенные концентрации пентозидина в сыворотке крови при ревматоидном артрите Clin Chem 44 250–255
Google ученый
DR Продавать NR Клейнман ВМ Монье (2000) ArticleTitleПродольное определение уровней гликирования и гликоксидирования кожного коллагена позволяет прогнозировать раннюю смерть мышей C57BL / 6NNIA FASEB 14 145–156
Google ученый
FA Шамси E Шарки D Creighton RH Нагарадж (2000) ArticleTitleРеакции Майяра в белках хрусталика: опосредованные метилглиоксалом модификации хрусталика крысы Exp Eye Res 70 369–380
Google ученый
SD Шарма BN Панди КП Мишра S Сиваками (2002) ArticleTitle Продукт Amadori и формирование возраста при неферментативном гликозилировании бычьего сывороточного альбумина in vitro Дж Биохим Мол Биол Биофиз 6 233–242
Google ученый
AW Stitt (2001) ArticleTitle Расширенное гликирование: важное патологическое событие при диабетических и возрастных заболеваниях глаз Br J Офтальмол 85 746–753
Google ученый
PA Szweda M Camouse KC Лундберг TD Оберли LI Szweda (2003) Статья Название: Старение, образование липофусцина и опосредованное свободными радикалами ингибирование клеточных протеолитических систем Aging Res Rev 2 383–405
Google ученый
M Танака J Гонг J Чжан Y Ямада HJ Боргельд K Яги (2000) ArticleTitleМитохондриальный генотип, связанный с долголетием, и его ингибирующее влияние на мутагенез Механический разработчик старения 116 65–76
Google ученый
Пижама Thornalley SP Вольф MJ Crabbe А Штерн (1984) ArticleTitleОкисление оксигемоглобина глицеральдегидом и другими простыми моносахаридами Biochem J 217 615–622
Google ученый
Пижама Thornalley А Лангборг HS Минхас (1999) ArticleTitleФормирование глиоксаля, метилглиоксаля и 3-дезоксиглюкозона при гликировании белков глюкозой Biochem J 344 109–116
Google ученый
SR Торп JW Baynes (1996) ArticleTitleРоль реакции Майяра при сахарном диабете и болезнях старения Препараты старения 9 69–77
Google ученый
ЧАС Влассара (1996) ArticleTitleГликирование белков в почках: роль в диабете и старении Почки Int 49 1795–1804
Google ученый
р Weindruch КП Кинан JM Карни грамм Фернандес RJ Feuerse РА Floydf JB Halterg JJ Рамсей А Ричардсони GS Ротдж SR Шпиндлерк (2001) ArticleTitleМиметики ограничения калорийности: метаболические вмешательства J Gerontol A Biol Sci Med Sci 56 20–33
Google ученый
МБ Yim H-S Yim C Ли ТАК Канг PB Чурка (2001) ArticleTitleГликирование белков, создание каталитических центров для образования свободных радикалов Ann N Y Acad Sci 928 48–53
Google ученый
Гликация белков, диабет и старение
II Резюме В текущее исследование было включено пятьдесят шесть молодых самцов крыс-альбиносов (возраст 4 месяца, вес 280-290 г) и 24 стареющих самцов крыс-альбиносов (возраст 24 месяца, вес 420-450 г).Исследование проводилось на кафедре биологии Научного колледжа Мосульского университета и в Медицинском исследовательском центре медицинского университета Хавлер. Лечение животных и оценка биомаркеров в эксперименте длились с января 2013 г. по декабрь 2014 г. Настоящее исследование было направлено на изучение антивозрастных свойств экстракта виноградных косточек (GSE), экстракта зеленого чая (GTE), экстракта косточек граната (PSE). ), экстракт гинкго билоба (GBE), α-липоевая кислота (LA) и центрофеноксин (CPH) у нормальных и индуцированных D-галактозой (D-gal) старых самцов крыс-альбиносов, а также их предотвращающие и улучшающие эффекты в отношении некоторых биомолекулярных и физиологических биомаркеров. старения в результате окислительного повреждения клеток у естественных и индуцированных D-галлонов старых крыс.Молодые крысы-самцы четырехмесячного возраста были случайным образом разделены на восемь групп (по 7 крыс в каждой группе): группу I (контроль), группу II (D-гал.), Группу III (D-гал. + CPH), группу IV ( D-гал. + GSE), группа V (D-гал. + GTE), группа VI (D-гал. + LA), группа VII (D-гал. + PSE) и группа VIII (D-гал. + GBE). ). Старые самцы крыс в возрасте 24 месяцев случайным образом были разделены на четыре группы (по 7 крыс в каждой группе): группу I (контроль), группу II (CPH), группу III (GSE) и группу IV (GTE). В конце девятинедельного периода экспериментального лечения были собраны образцы крови и полученная сыворотка хранилась при -80 ° C, а затем использовалась для биохимического анализа.Вскрытые печень и мозг каждого животного во всех группах были гомогенизированы, и супернатант печени и мозга был собран и сохранен при -80 ° C, затем использован для анализа биомаркеров окислительного стресса, также были взяты небольшие кусочки из печени и мозга каждого. животное, которое будет использоваться в биомолекулярных исследованиях. Результаты показали, что митохондриальная делеция дезоксирибонуклеиновой кислоты (мтДНК) 4834 п.н., 8-гидрокси-2′-дезоксигуанозин (8-OHdG), малоновый диальдегид Резюме III (MDA) и изопростан (IsoP) значительно (P <0.01) увеличился в печени и мозг естественного возраста и D-гал. индуцированное старение крыс. Клеточная копия мтДНК число значительно (P <0,01) увеличивается также в печени и головном мозге естественного старение и индуцированное D-галактозой старение крыс в ответ на окислительный стресс с помощью старение. Введение антивозрастных биосоединений; GSE, GTE, PSE, GBE, Лос-Анджелес и CPH значительно (P <0,01) снижали делецию мтДНК 4834 п.н. и 8- OHdG, число копий мтДНК, MDA и IsoP в печени и мозге нормального возраста крысы и группы, вызывающие старение, вызванное D-галактозой.Данные этого исследования показали достоверное (P <0,01) снижение общего антиоксидантная способность (TCA), общий глутатион (T.GSH), супероксиддисмутаза (SOD) и каталаза (CAT) печени и мозга крыс и указывает на то, что это снижение может быть вовлечено в механизмы вызванного свободными радикалами повреждения липиды, белки и ДНК при нормальном старении и хроническом приеме Dгалактозы. Введение антивозрастных биосоединений; GSE, GTE, PSE, GBE, LA и CPH достоверно (P <0,01) увеличивали TCA, T.ГШ, СОД, КПП печень и мозг в естественных и D-галлонах. индуцированное старение крыс. Общая концентрация негемового железа и ферритина в печени и головном мозге была значительно (P <0,01) увеличился у естественных и индуцированных старых крыс. Уход с GSE, GTE, PSE, GBE, LA и CPH значительно (P <0,01) вызывали снижение негемового железа в печени и головном мозге при нормальном и индуцированном старении крысы. Значительное (P <0,05) повышение сывороточной аспартатаминотрансферазы (AST), аланинаминотрансфераза (АЛТ), щелочной фосфат (ЩФ), гамма-глутамил трансфераза (GGT) и значимая (P <0.05) пониженное содержание альбумина (ALB) и общее билирубин (TBI) в качестве биомаркера функции печени был показан в натуральном и D-галлонах. индуцированное старение крыс. Крысы, получавшие GSE, GTE, PSE, GBE, LA и CPH показали защитную роль в значительном снижении (P <0,05) сывороточных уровней AST ALT, ALP, GGT со значительным (P <0,05) повышением сывороточного ALB и ЧМТ как биомаркеры функции печени в естественных и D-галлонах. индуцированное старение крыс. Резюме IV Уровни сывороточной лактатдегидрогеназы (ЛДГ) и креатинфосфокиназы (КФК) в качестве биомаркеров функции печени значительно (P <0.05) увеличился в натуральный и D-гал. индуцированное старение крыс. Лечение GSE, GTE, GSE, GBE, LA и CPH показали защитную роль в значительном снижении сывороточные уровни ЛДГ и КФК в натуральном и D-гал. индуцированное старение крыс. Уровни мочевины, креатинина и мочевой кислоты в сыворотке крови как биомаркеры функции почек. значительно (P <0,05) увеличилось в натуральном и D-гал. индуцированное старение крыс. В крысы, получавшие GSE, GTE, GPE, GBE, LA и CPH, показали защитную роль в значительном уменьшении (P <0.05) сывороточные уровни мочевой кислоты, мочевины и креатинин в натуральном виде и D-гал. индуцированное старение крыс. Масса тела и масса органов (печени, сердца и мозга) были незначительно уменьшилось в D-галлонах. индуцированных модельных крыс, но введение антиоксидантов улучшает их. В заключение, это исследование демонстрирует, что старение вызывает значительную Биомаркеры окислительного повреждения мтДНК и окислительного стресса у крыс. Хронический администрация D-gal. ускоряет старение за счет увеличения производства реактивных формы кислорода и конечные продукты гликирования (AGE), эта последовательность события приводят к окислительному стрессу и повреждению клеток.9-недельное добавление добавок GSE, GTE, PSE, GBE, LA и CPH подавляет старение биомаркеры и подавляет окислительный стресс в печени, сердце, ткани почек и мозга нормальных стареющих крыс и стареющих D-галлонов.
Гликация и роль диеты в старении кожи
Харрисон П. Нгуен, BA и Раджани Катта, Мэриленд
Отделение дерматологии, Медицинский колледж Бейлора, Хьюстон, Техас, США
Конфликт интересов:
Не сообщалось.
РЕФЕРАТ
Впервые описанные в контексте диабета, конечные продукты продвинутого гликирования (AGE) образуются в результате неферментативной реакции, называемой гликированием. Повышенное накопление AGE в тканях человека теперь связывают с терминальной стадией почечной недостаточности, хронической обструктивной болезнью легких и, в последнее время, со старением кожи. Характерные признаки старения кожи, включая снижение устойчивости к механическим воздействиям, нарушение заживления ран и деформацию сосудистой сети дермы, частично могут быть связаны с гликированием.Старение кожи опосредуется множеством факторов, и эти факторы обычно характеризуются как эндогенные (например, укорочение теломер) или экзогенные (например, воздействие ультрафиолетового излучения). Интересно, что AGE проявляют свои патофизиологические эффекты как эндогенными, так и экзогенными путями. Первый влечет за собой потребление сахара с пищей, который затем ковалентно связывает электрон от молекулы-донора с образованием AGE. Последний процесс в основном относится к образованию AGE при варке. Недавние исследования показали, что некоторые методы приготовления пищи (т.е., гриль, жарка и запекание) дают гораздо более высокие уровни AGE, чем методы приготовления на водной основе, такие как кипячение и приготовление на пару. Более того, несколько пищевых соединений оказались многообещающими кандидатами на ингибирование старения, опосредованного гликированием. В этом обзоре мы обобщаем данные, подтверждающие критическую роль гликирования в старении кожи, и выделяем предварительные исследования диетических стратегий, которые могут помочь в борьбе с этим процессом.
Ключевые слова:
Возраст, конечные продукты гликирования, коллаген, диетическая сахароза, фибробласты, питание, старение кожи
Предпосылки: гликация и стареющая кожа
Общественная одержимость процессом старения восходит к древней истории, и мифы, связанные с сохранением молодости — от купального фонтана, дающего вечную молодость, до философского камня, который можно использовать для создания эликсира жизни, — населяют и то, и другое. и современный фольклор.Однако только в последние годы старение стало исследоваться на основе эмпирического подхода, поскольку оно продолжает привлекать все большее внимание научного сообщества. Хотя было предложено несколько гипотез для объяснения патофизиологии, ответственной за старение, ни одна теория не объясняет наблюдаемые различные явления. Скорее, старение представляется многофакторным процессом, который является результатом сложного взаимодействия нескольких факторов и механизмов.
Тем не менее, стратификация факторов и механизмов, способствующих старению, имеет решающее значение для разработки начальных стратегий борьбы с процессом старения.Кожа — отличная парадигма для изучения старения, во многом из-за ее легкого доступа. Более того, помимо своей уязвимости к внутренним процессам старения из-за своей разнообразной роли в клеточных процессах, таких как метаболизм и иммунитет, кожа подвержена множеству внешних стрессоров, являясь главным барьером между телом и окружающей средой.
Факторы старения обычно можно разделить на экзогенные и эндогенные. Поскольку воздействие ультрафиолетового (УФ) излучения так сильно связано с множеством возрастных кожных заболеваний, эндогенные и экзогенные факторы теоретически можно изучать в коже в некоторой степени независимо, дифференцируя участки, защищенные от УФ-излучения и подверженные УФ-облучению. 1 Эндогенно состарившаяся кожа имеет характерные морфологические особенности, которые приводят к изменению функциональности. К ним относятся атрофия эпидермального, дермального и внеклеточного матрикса, приводящая к повышенной хрупкости, уменьшению количества коллагена и эластина, что приводит к образованию мелких морщин, и заметным сосудистым изменениям, нарушающим терморегуляцию и снабжение питательными веществами. Эндогенно стареющая кожа также демонстрирует снижение митотической активности, что приводит к замедленному заживлению ран, а также к снижению функции желез, что приводит к нарушенной реэпителизации
глубоких кожных ран.Также наблюдается уменьшение количества меланоцитов и клеток Лангерганса, что проявляется в поседении волос и более высокой частоте инфицирования, соответственно. 2-10 Экзогенно состарившаяся кожа, в которой факторы окружающей среды, такие как УФ-излучение, действуют совместно с эндогенными процессами, имеет много общих характеристик эндогенно стареющей кожи. Кроме того, экзогенно стареющая кожа демонстрирует утолщенный эпидермис и скопление аномальных эластических волокон в дерме (т. Е. Солнечный эластоз). 1
Среди множества механизмов, лежащих в основе старения, в последние годы гликирование стало одним из наиболее широко изученных процессов.Беглый поиск литературы свидетельствует о быстро растущем внимании научного сообщества, и в результате можно найти тысячи статей, связанных с гликированием, большинство из которых опубликовано за последнее десятилетие. Гликирование относится к неферментативному процессу ковалентного связывания белков, липидов или нуклеиновых кислот с молекулами сахара, обычно глюкозы или фруктозы. Отсутствие ферментативного посредничества — ключевое различие между гликированием и гликозилированием. Гликозилирование происходит в определенных сайтах молекулы-мишени и обычно имеет решающее значение для функции молекулы-мишени.Напротив, гликирование, по-видимому, происходит в случайных молекулярных участках и обычно приводит к ингибированию способности целевой молекулы функционировать. Продукты гликирования называются конечными продуктами продвинутого гликирования (AGE).
Повышенное накопление AGE было впервые напрямую связано с развитием диабетических осложнений. С тех пор AGE вовлечены во множество других патологий, включая атеросклероз, терминальную стадию почечной недостаточности и хроническую обструктивную болезнь легких. 11 (Следует отметить, что уровни ВОЗРАСТА различаются в зависимости от расы и пола, и до тех пор, пока не будут проведены более масштабные исследования для создания эталонных значений с учетом этнической и гендерной специфики, повышенное накопление AGE следует определять как повышенные для всех демографических групп 12 ) Не случайно многие патологии, связанные с AGE, включая диабетические последствия, тесно связаны со старением.
Это распространяется на стареющую кожу, поскольку методы определения возраста, такие как иммуноокрашивание, продемонстрировали преобладание гликирования в стареющей коже.Гликация приводит к характерным структурным, морфологическим и функциональным изменениям кожи — процессу, который в просторечии известен как «сахарный провисание». Поскольку глюкоза и фруктоза играют такую важную роль в этом механизме, неудивительно, что диета играет решающую роль в гликировании и, следовательно, старении кожи.
Возможно, более удивительно то, что исследования показали, что потребление AGE не только связано с содержанием сахара в пище, но также зависит от способа приготовления. Кроме того, поскольку связь
между диетой и старением более четко охарактеризована, множество пищевых соединений появилось в качестве потенциальных терапевтических кандидатов для ингибирования изменений, опосредованных AGE.В этом обзоре мы исследуем гликирование, связанное со старением кожи, и выделяем доказательства, демонстрирующие ключевую роль диеты в изменении степени, в которой процессы, связанные с AGE, могут изменять самый большой орган человеческого тела.
Биохимические процессы в образовании AGE
Впервые описанный более века назад, гликирование влечет за собой серию простых и сложных неферментативных реакций. На ключевом этапе, известном как реакция Майяра, электрофильные карбонильные группы молекулы сахара реагируют со свободными аминогруппами белков, липидов или нуклеиновых кислот, что приводит к образованию основания Шиффа.Это нестабильное основание Шиффа содержит двойную связь углерод-азот, при этом атом азота связан с арильной или алкильной группой. Основание Шиффа быстро перестраивается с образованием более стабильного кетоамина, называемого продуктом Амадори. На этом этапе продукт Амадори может: (1) подвергаться обратной реакции; (2) необратимо реагирует с функциональными группами лизина или аргинина с образованием стабильных AGE в форме белковых аддуктов или поперечных сшивок белков; или (3) подвергаться дальнейшим реакциям разложения, таким как окисление, дегидратация и полимеризация, с образованием множества других AGE. 13 Образование AGE ускоряется за счет увеличения скорости оборота белка, гипергликемии, температуры выше 120 ° C (248 ° F) и присутствия кислорода, активных форм кислорода или активных переходных металлов. 14
AGE составляют очень гетерогенную группу молекул. Первым и, возможно, наиболее известным физиологическим AGE, который был описан, был гликированный гемоглобин (гемоглобин A1C), который в настоящее время широко используется для измерения гликемического контроля при диабете. Однако наиболее распространенным AGE в организме человека, включая кожу, является карбоксиметил-лизин (CML), который образуется в результате окислительной дегенерации продуктов Amadori или путем прямого добавления глиоксаля к лизину.В коже ХМЛ обнаруживается в нормальном эпидермисе, старческой и диабетической дерме, а также при фотостарении-актиническом эластозе. 15-17 Другие AGE, обнаруженные в коже, включают пентозидин, глиоксаль, метилглиоксаль, глюкозепан, фруктозелизин, карбоксиэтил-лизин, димер глиоксаль-лизина и димер метилглиоксаль-лизина. 18
ВОЗРАСТ и кожа
AGE накапливаются в различных тканях как функция, а также
как маркер хронологического возраста. 19 Белки с низкой скоростью оборота, такие как коллаген, особенно чувствительны к модификации путем гликирования.Фактически, коллаген в коже имеет период полураспада примерно 15 лет и, таким образом, может подвергаться повышению гликирования до 50% в течение жизни человека. 20
Коллаген имеет решающее значение не только для механического каркаса кожи, но и для нескольких клеточных процессов, и его гликозилирование различными способами нарушается. Во-первых, межмолекулярное поперечное сшивание изменяет биомеханические свойства коллагена, что приводит к увеличению жесткости и уязвимости к механическим воздействиям. 21 Во-вторых, образование AGE на боковых цепях коллагена изменяет заряд белка и нарушает его активные центры, тем самым искажая способность белка правильно взаимодействовать с окружающими клетками и матриксными белками. 22 В-третьих, нарушается способность превращать L-аргинин в оксид азота, критический кофактор сшивки коллагеновых волокон. 23 Наконец, гликированный коллаген обладает высокой устойчивостью к разрушению матриксными металлопротеиназами (ММП).Это еще больше замедляет процесс обновления коллагена и его замены функциональными белками. 24
Другие белки кожного внеклеточного матрикса функционально подвержены гликированию, включая эластин и фибронектин. Это дополнительно усугубляет кожную дисфункцию, 18,25 , поскольку сшитый гликированием коллаген, эластин и фибронектин не могут быть восстановлены, как их нормальные аналоги.
Интересно, что эластин, модифицированный ХМЛ, в основном обнаруживается в местах солнечного эластоза и почти отсутствует на защищенной от солнца коже.Это говорит о том, что УФ-излучение может опосредовать образование AGE в некоторой степени или, по крайней мере, делать клетки более чувствительными к внешним раздражителям. 26 Предполагается, что УФ-излучение достигает этого за счет образования супероксидных анион-радикалов, перекиси водорода и гидроксильных радикалов. Это вызывает окислительный стресс и ускоряет производство AGE. 27 AGE сами по себе являются очень реактивными молекулами и могут действовать как доноры электронов при образовании свободных радикалов.Происходя в сочетании с упадком ферментативной системы, которая устраняет свободные радикалы в процессе старения, эти свойства приводят к «порочному кругу» образования AGE в условиях воздействия ультрафиолета.
Образованные как внутриклеточно, так и внеклеточно, AGE также могут влиять на внутриклеточную молекулярную функцию. Было показано, что в коже промежуточные волокна фибробластов (виментин) и кератиноцитов (цитокератин 10) чувствительны к модификации гликирования. 28 Аналогично разнообразной роли коллагена в коже, промежуточные филаменты необходимы как для поддержания стабильности цитоскелета, так и для координации многочисленных клеточных функций. Фибробласты с гликированным виментином демонстрируют пониженную сократительную способность, и обнаружено, что эти модифицированные фибробласты накапливаются в биоптатах кожи пожилых доноров. 28
Фактически, общая клеточная функция может быть нарушена в присутствии высоких концентраций AGE. In vitro дермальные фибробласты человека демонстрируют более высокую скорость преждевременного старения и апоптоза, что, вероятно, объясняет снижение синтеза белка коллагена и внеклеточного матрикса, наблюдаемое как в культуре клеток, так и в биоптатах старой кожи. 29,30 Точно так же кератиноциты, подвергшиеся воздействию AGE, экспрессируют повышенные уровни провоспалительных медиаторов, страдают от пониженной подвижности, а также претерпевают преждевременное старение в присутствии AGE. 31
Помимо промежуточных филаментов, протеасомный аппарат и ДНК могут подвергаться гликированию.Протеасомный аппарат, который функционирует для удаления измененных внутриклеточных белков, снижает
функционально на in vitro на при обработке глиоксалем. 32 Аналогичные результаты in vitro наблюдались при обработке эпидермальных кератиноцитов и фибробластов человека глиоксалем, что приводило к накоплению ХМЛ в гистонах, расщеплению ДНК и, в конечном итоге, к остановке клеточного роста. 33
Помимо модификации молекулярной физико-химии хозяина, AGE также оказывают пагубное воздействие посредством связывания со специализированными рецепторами клеточной поверхности, называемыми рецепторами для
AGE (RAGE).RAGE — это полигандный белок, который при активации может запускать несколько клеточных сигнальных путей, включая митоген-активируемые протеинкиназы (MAPK), внеклеточные киназы, регулируемые сигналом (ERK), фосфатидилинозитол-3-киназу (PI3K) и ядерный фактор каппа. -бета (NFκ-β) пути. 34 Известно, что эти пути опосредуют различные патогенные механизмы через изменение регуляторов клеточного цикла, экспрессию генов, воспаление и синтез внеклеточного белка. 34 Неудивительно, что RAGE высоко экспрессируется в коже и присутствует в еще более высоких концентрациях как на анатомических участках, подверженных УФ-излучению, так и в стареющей коже. 35
Борьба с возрастом с помощью диеты
Почти 70 лет назад Урбах и Ленц сообщили, что уровень сахара в крови и коже снижается при диете с низким содержанием сахара. 36 Хотя в то время его значение не было оценено, это открытие продемонстрировало квинтэссенцию связи между диетой и здоровьем кожи. Теперь мы понимаем, что пища является источником как моносахаридов, которые в больших количествах катализируют производство AGE в организме, так и предварительно сформированных AGE. 37
Предварительно сформованные AGE абсорбируются в кишечнике примерно с 30% эффективностью. Затем они могут попасть в кровоток, где они могут вызвать перекрестное связывание белков, воспаление и внутриклеточный окислительный стресс. Конечным результатом является усиление подобного «порочного круга», который может быть столь же пагубным, как и потребление избыточного диетического сахара. 38 Интересно, что предварительно сформированные AGE в значительной степени являются результатом экзогенного синтеза, опосредованного процессом приготовления пищи. Известно, что методы жарки, жарки, жарки во фритюре и обжарки приводят к более высокому уровню AGE в продуктах питания.Напротив, методы приготовления на водной основе, такие как кипячение и приготовление на пару, дают логарифмически меньшее количество AGE. 39
Диета с низким содержанием AGE коррелировала со снижением воспалительных биомаркеров (например, фактора некроза опухоли альфа, интерлейкина-6 и С-реактивного белка) у пациентов с диабетом, а также с улучшением заживления ран и других связанных с диабетом последствия у мышей. 40,41 Другие авторы ссылаются на относительно молодую внешность, которая часто ассоциируется с пожилым азиатским населением, как доказательство долгосрочного воздействия использования методов приготовления пищи на водной основе, которые характерны для азиатской кухни. 37
Жесткий гликемический контроль в течение 4-месячного периода может привести к снижению образования гликозилированного коллагена на 25%. 37,38 Потребление диеты с низким содержанием сахара, приготовленной с использованием методов приготовления на водной основе, ограничит как потребление предварительно сформированных экзогенных AGES, так и эндогенное производство посредством физиологического гликирования. Избегание продуктов, которые приводят к более высокому уровню AGE, таких как пончики, мясо на гриле и безалкогольные напитки темного цвета, может быть эффективной стратегией для замедления «проседания сахара».” 39
Диета с низким содержанием AGE коррелировала со снижением воспалительных биомаркеров (например, фактора некроза опухоли альфа, интерлейкина-6 и С-реактивного белка) у пациентов с диабетом, а также с улучшением заживления ран и других связанных с диабетом последствия у мышей. 40,41 Другие авторы ссылаются на относительно молодую внешность, которая часто ассоциируется с пожилым азиатским населением, как доказательство долгосрочного воздействия использования методов приготовления пищи на водной основе, которые характерны для азиатской кухни. 37
Жесткий гликемический контроль в течение 4-месячного периода может привести к снижению образования гликозилированного коллагена на 25%. 37,38 Потребление диеты с низким содержанием сахара, приготовленной с использованием методов приготовления на водной основе, ограничит как потребление предварительно сформированных экзогенных AGES, так и эндогенное производство посредством физиологического гликирования. Избегание продуктов, которые приводят к более высокому уровню AGE, таких как пончики, мясо на гриле и безалкогольные напитки темного цвета, может быть эффективной стратегией для замедления «проседания сахара».” 39
Интересно, что некоторые кулинарные травы и специи, как полагают, способны ингибировать эндогенное производство AGE (в частности, вызванное фруктозой гликирование). К ним относятся
корица, гвоздика, орегано и душистый перец. 42 Другие пищевые соединения, которые были связаны с ингибированием образования AGE на основании данных in vitro и предварительных моделей на животных, включают имбирь, чеснок, α-липоевую кислоту, карнитин, таурин, карнозин, флавоноиды (например, катехины зеленого чая), бенфотиамин. , α-токоферол, ниацинамид, пиридоксаль, селенит натрия, селеновые дрожжи, рибофлавин, цинк и марганец. 42-44 Космецевтическая промышленность приняла к сведению эти данные, и некоторые из них недавно выпустили продукты для местного применения, содержащие карнозин и α-липоевую кислоту, с заявлениями, относящимися к образованию анти-AGE. 38 Однако отсутствуют данные о том, является ли местное введение этих соединений столь же эффективным в замедлении процесса старения, как доставка с пищей.
Поскольку гликирование ускоряется в присутствии активных форм кислорода, антиоксиданты теоретически должны быть эффективными в ограничении производства новых AGE.Они также могут влиять на повреждение тканей, вызванное AGE. В одном интересном исследовании изучалось действие антиоксиданта ресвератрола. Ресвератрол, широко известный своим изобилием в красном вине, представляет собой натуральный фенол, который вырабатывается несколькими растениями в ответ на травмы и содержится в кожуре винограда, черники, малины и шелковицы. В одном исследовании ресвератрол ингибировал вызванную AGE активность пролиферации и синтеза коллагена в гладкомышечных клетках сосудов, принадлежащих крысам, склонным к инсульту. 45 Другое исследование показало, что он снижает частоту разрывов ДНК в обработанных метилглиоксалом ооцитах мышей.Хотя ресвератрол, по-видимому, не обращает вспять сам процесс гликирования, эти исследования показывают, что он может уменьшить повреждение тканей, вызванное AGE. 46 Хотя эти результаты обнадеживают, насколько нам известно, эти лабораторные результаты еще не были продемонстрированы в исследованиях на людях.
В одном из немногих исследований на людях, успешно проведенных в отношении терапевтических средств против АГЭ, добавление L-карнитина в течение 6 месяцев у пациентов, находящихся на гемодиализе, значительно снизило уровни AGE в коже. 47 L-карнитин, которого в природе много в мясе, птице, рыбе и молочных продуктах, является антиоксидантом. Кроме того, он может действовать синергетически, нейтрализуя окислительный стресс при введении с α-липоевой кислотой. 48
Следует упомянуть, что ограничение калорийности пищи, наиболее эффективная стратегия замедления общего процесса старения, известная на сегодняшний день, может в некоторой степени действовать, предотвращая накопление AGE в организме человека. Ограничение калорийности способно снизить уровни AGE, обнаруженных в коллагене кожи крыс и мышей, и привело к увеличению продолжительности жизни на моделях мышей. 49,50
Заключение: препятствия и направления на будущее
Совершенно очевидно, что существует множество данных in vitro и несколько исследований на животных in vivo, которые подтверждают различные варианты диетической терапии, направленной против «сахарного проседания». Однако исследования на людях ограничены логистическими, этическими и внутренними проблемами дизайна исследования. В стимулирующем комментарии в рамках обзорной статьи о противоречиях в вопросах старения и питания Драелос пишет о неприятных препятствиях, с которыми она столкнулась, когда пыталась изучить влияние добавок витамина С на здоровье кожи. 38 Примеры проблем, с которыми она столкнулась, включали: определение учреждения, которое предлагало доступные измерения уровней витамина С не только в сыворотке, но и в коже; разработка этического исследования, которое будет включать контрольную группу, требующую от субъектов придерживаться диеты, бедной витамином С, без каких-либо добавок; и обеспечение соблюдения участниками диеты и протокола приема добавок, а также минимизация мешающих факторов. Большинство этих проблем также существует в исследованиях на людях, необходимых для выявления и / или проверки научно обоснованных диетических стратегий в борьбе со старением кожи, опосредованным гликированием.
Тем не менее, роль диеты в старении кожи неоспорима. По мере нашего понимания того, как накопление AGE влияет на быстро растущее число патологий, неизбежно, что наши методы исследования будут развиваться, чтобы лучше решать проблемы, которые в настоящее время кажутся такими обескураживающими. Например, в начале 2014 года исследовательская группа сообщила, что им удалось успешно создать модель реконструированной кожи, модифицированной гликированным коллагеном, для выявления биологических модификаций как эпидермальных, так и дермальных маркеров. 51 Возможно, создание модели in vitro , которая всесторонне и точно представляет старую человеческую кожу, послужит следующей ступенькой в переводе терапевтических результатов с кабинета на место у постели больного.
Между тем, осознание критического воздействия AGEformation как на диабетиков, так и на недиабетиков должно быть распространено на всех пациентов, независимо от их текущего состояния здоровья. Эта задача начинается с врачей. Консультации по вопросам питания должны быть включены в наше регулярное общение с пациентами, наряду с важными обсуждениями защиты от ультрафиолета и отказа от табака.В конце концов, это три наиболее важных известных внешних фактора старения. Их общая группировка отражает их взаимосвязанную природу и их совместное действие, направленное на нарушение гомеостаза.
Список литературы
- Zouboulis CC, Makrantonaki E. Клинические аспекты и молекулярная диагностика старения кожи. Clin Dermatol. , январь-февраль 2011 г .; 29 (1): 3-14.
- Элиас П.М., Гадиалли Р. Возрастной барьер проницаемости эпидермиса: основа функциональных нарушений. Clin Geriatr Med. 2002 Февраль; 18 (1): 103-20, vii.
- Йе Дж, Гарг А., Калхун С. и др. Изменения в регуляции цитокинов в старом эпидермисе: последствия для гомеостаза проницаемого барьера и воспаления. I. Семейство генов IL-1. Exp Dermatol. Июнь 2002; 11 (3): 209-16.
- Цуцуми М., Денда М. Парадоксальные эффекты бета-эстрадиола на гомеостаз эпидермального барьера проницаемости. Br J Dermatol. Октябрь 2007 г .; 157 (4): 776-9.
- Fimmel S, Kurfurst R, Bonte F и др. Чувствительность к андрогенам и эффективность антисмысловых олигонуклеотидов против рецептора андрогенов на эпидермальных кератиноцитах человека зависит от возраста донора и места происхождения клеток. Horm Metab Res. Февраль 2007; 39 (2): 157-65.
- Макрантонаки Э., Фогель К., Фиммель С. и др. Взаимодействие IGF-I и 17-бетаэстрадиола на возрастных уровнях в себоцитах и фибробластах человека in vitro. Exp Gerontol. Октябрь 2008 г .; 43 (10): 939-46.
- Эшкрофт Г.С., Хоран Массачусетс, Фергюсон МВ. Влияние старения на заживление ран: иммунолокализация факторов роста и их рецепторов в мышиной послеоперационной модели. J Anat. , апрель 1997 г .; 190 (часть 3): 351-65.
- Бхушан М., Камбербэтч М., Дирман Р.Дж. и др.Миграция клеток Лангерганса человека, индуцированная фактором некроза опухоли: влияние старения. Br J Dermatol. Январь 2002 г .; 146 (1): 32-40.
- Zouboulis CC, Boschnakow A. Хронологическое старение и фотостарение сальных желез человека. Clin Exp Dermatol. Октябрь 2001 г .; 26 (7): 600-7.
- Чунг Дж. Х., Яно К., Ли М. К. и др. Дифференциальные эффекты фотостарения и естественного старения на васкуляризацию кожи человека. Arch Dermatol. , ноябрь 2002 г .; 138 (11): 1437-42.
- Ван Пуйвелде К., Мец Т., Нджемини Р. и др. Влияние потребления конечного продукта продвинутого гликирования на воспаление и старение: систематический обзор. Nutr Ред. , октябрь 2014 г .; 72 (10): 638-50.
- Мук-Канамори М.Дж., Селим М.М., Такиддин А.Х. и др. Этнические и гендерные различия в конечных продуктах гликирования, измеренные по аутофлуоресценции кожи. Дерматоэндокринол. 2013 Апрель 1; 5 (2): 325-30.
- Ахмед Н. Конечные продукты гликирования — роль в патологии диабетических осложнений. Diabetes Res Clin Pract. 2005 Янв; 67 (1): 3-21.
- Thorpe SR, Baynes JW. Продукты реакции Майяра в тканевых белках: новые продукты и новые перспективы. аминокислот. декабрь 2003 г .; 25 (3-4): 275-81.
- Кавабата К., Йошикава Х., Саруватари К. и др. Присутствие N (эпсилон) — (карбоксиметил) лизина в эпидермисе человека. Biochim Biophys Acta. Октябрь 2011 г .; 1814 (10): 1246-52.
- Дайер Д.Г., Данн Дж. А., Торп С.Р. и др. Накопление продуктов реакции Майяра в коллагене кожи при диабете и старении. J Clin Invest. июнь 1993 г .; 91 (6): 2463-9.
- Jeanmaire C, Danoux L, Pauly G. Гликация во время естественного и актинического старения кожи человека: модельное исследование in vivo и in vitro. Br J Dermatol. Июль 2001 г .; 145 (1): 10-8.
- Gkogkolou P, Bohm M. Передовые конечные продукты гликирования: ключевые игроки в старении кожи? Дерматоэндокринол. 1 июля 2012 г.; 4 (3): 259-70
- Hipkiss AR. Накопление измененных белков и старение: причины и следствия. Exp Gerontol. Май 2006 г .; 41 (5): 464-73.
- Данн Дж. А., Макканс Д. Р., Торп С. Р. и др. Возрастное накопление N-эпсилон- (карбоксиметил) лизина и N-эпсилон- (карбоксиметил) гидроксилизина в коллагене кожи человека. Биохимия. 1991 5 февраля; 30 (5): 1205-10.
- Эйвери, Северная Каролина, Бейли, AJ. Влияние реакции Майяра на физические свойства и клеточные взаимодействия коллагена. Pathol Biol (Париж). сентябрь 2006 г .; 54 (7): 387-95.
- Haitoglou CS, Tsilibary EC, Brownlee M, et al.Измененные клеточные взаимодействия между эндотелиальными клетками и неферментативно глюкозилированным ламинином / коллагеном IV типа. J Biol Chem. , 25 июня 1992 г .; 267 (18): 12404-7.
- Голдин А., Бекман Дж. А., Шмидт А. М. и др. Конечные продукты с улучшенным гликированием: вызывают развитие диабетических сосудистых повреждений. Тираж. , 8 августа 2006 г .; 114 (6): 597-605.
- DeGroot J, Verzijl N, Wenting-Van Wijk MJ, et al. Связанное с возрастом снижение восприимчивости суставного хряща человека к деградации, опосредованной матриксной металлопротеиназой: роль конечных продуктов гликирования. Arthritis Rheum. Ноябрь 2001; 44 (11): 2562-71.
- Новотны К., Грюн Т. Деградация окисленного и гликоксидированного коллагена: роль перекрестного связывания коллагена. Arch Biochem Biophys. , 15 января 2014 г .; 542: 56-64.
- Йошинага Е., Кавада А., Оно К. и др. Модификация эластина N (варепсилон) — (карбоксиметил) лизином изменяет его биологические свойства: последствия для накопления аномальных эластических волокон в актиническом эластозе. J Invest Dermatol. , февраль 2012 г .; 132 (2): 315-23.
- Масаки Х., Окано Й., Сакураи Х. Генерация активных форм кислорода из конечных продуктов гликирования (AGE) во время облучения ультрафиолетовым светом A (UVA) и возможный механизм повреждения клеток. Biochim Biophys Acta. 1999, 28 июня; 1428 (1): 45-56.
- Купер Т., Грюн Т., Прахл С. и др. Виментин является специфической мишенью для гликирования кожи. Структурные предпосылки, функциональные последствия и роль в старении кожи. J Biol Chem. , 10 августа 2007 г .; 282 (32): 23427-36.
- Алихани З., Алихани М., Бойд С.М. и др. Конечные продукты улучшенного гликирования усиливают экспрессию проапоптотических генов и стимулируют апоптоз фибробластов через цитоплазматические и митохондриальные пути. J Biol Chem. 1 апреля 2005 г .; 280 (13): 12087-95.
- Zhu P, Ren M, Yang C и др. Участие путей RAGE, MAPK и NF-kappaB в вызванной AGE активацией MMP-9 в кератиноцитах HaCaT. Exp Dermatol. Февраль 2012; 21 (2): 123-9.
- Zhu P, Yang C, Chen LH, et al.Нарушение подвижности и пролиферации кератиноцитов человека из-за БСА, модифицированного конечными продуктами гликирования. Arch Dermatol Res. Июль 2011 г .; 303 (5): 339-50.
- Bulteau AL, Verbeke P, Petropoulos I, et al. Ингибирование протеасом в обработанных глиоксалем фибробластах и устойчивость гликированной глюкозо-6-фосфатдегидрогеназы к деградации 20S протеасом in vitro. J Biol Chem. , 7 декабря 2001 г .; 276 (49): 45662-8.
- Робертс MJ, Wondrak GT, Laurean DC, et al. Повреждение ДНК карбонильным стрессом в клетках кожи человека. Mutat Res. , 28 января 2003 г .; 522 (1-2): 45-56.
- Bierhaus A, Humpert PM, Morcos M, et al. Понимание RAGE, рецептора конечных продуктов гликирования. Дж Мол Мед (Берл). Ноябрь 2005 г .; 83 (11): 876-86.
- Lohwasser C, Neureiter D, Weigle B и др. Рецептор конечных продуктов продвинутого гликирования сильно экспрессируется в коже и активируется конечными продуктами продвинутого гликирования и альфа-фактором некроза опухоли. J Invest Dermatol. Февраль 2006; 126 (2): 291-9.
- Urbach E, Lentz JW. Углеводный обмен и кожа. Arch Derm Syphilol. 1945 ноябрь-декабрь; 52: 301-16.
- Danby FW. Питание и старение кожи: сахар и гликирование. Clin Dermatol. 2010 июль-август; 28 (4): 409-11.
- Draelos ZD. Старение кожи: роль диеты: факты и противоречия. Clin Dermatol. , ноябрь-декабрь 2013 г .; 31 (6): 701-6.
- О’Брайен Дж., Моррисси, Пенсильвания. Пищевые и токсикологические аспекты реакции потемнения Майяра в пищевых продуктах. Crit Rev Food Sci Nutr.1989 28 (3): 211-48.
- Влассара Х, нападающий GE. Ограничение ВОЗРАСТА при сахарном диабете: смена парадигмы. Nat Rev Endocrinol. сентябрь 2011 г .; 7 (9): 526-39.
- Пеппа М., Брем Н., Эрлих П. и др. Неблагоприятные эффекты пищевых гликотоксинов на заживление ран у мышей с генетическим диабетом. Диабет. Ноябрь 2003 г .; 52 (11): 2805-13.
- Уважаемый Р.П., Гринспен П., Хартл Д.К. и др. Подавление гликирования белков экстрактами кулинарных трав и специй. J Med Food. Июнь 2008; 11 (2): 275-81.
- Thirunavukkarasu V, Nandhini AT, Anuradha CV. Вызванные фруктозной диетой аномалии коллагена кожи предотвращаются липоевой кислотой. Exp Diabesity Res. , октябрь-декабрь 2004 г .; 5 (4): 237-44.
- Tarwadi KV, Agte VV. Влияние питательных микроэлементов на метилглиоксаль-опосредованное гликирование альбумина in vitro. Biol Trace Elem Res. ноябрь 2011 г .; 143 (2): 717-25.
- Mizutani K, Ikeda K, Yamori Y. Ресвератрол ингибирует вызванную AGE пролиферацию и активность синтеза коллагена в гладкомышечных клетках сосудов у склонных к инсульту крыс со спонтанной гипертензией. Biochem Biophys Res Commun. 21 июля 2000 г .; 274 (1): 61-7.
- Лю Y, He XQ, Huang X и др. Ресвератрол защищает ооциты мышей от окислительного повреждения, вызванного метилглиоксалем. PLoS One. 2013 8 (10): e77960.
- Фуками К., Ямагиши С., Сакаи К. и др. Возможные ингибирующие эффекты L-карнитина на конечные продукты гликирования тканей у пациентов, находящихся на гемодиализе. Rejuvenation Res. 2013 декабрь; 16 (6): 460-6.
- Hagen TM, Лю Дж., Ликкесфельдт Дж. И др.Кормление старых крыс ацетил-L-карнитином и липоевой кислотой значительно улучшает метаболические функции и снижает окислительный стресс. Proc Natl Acad Sci USA. 2002 19 февраля; 99 (4): 1870-5.
- Cefalu WT, Bell-Farrow AD, Wang ZQ и др. Ограничение калорийности снижает зависящее от возраста накопление продуктов гликоксидации, N-эпсилон- (карбоксиметил) лизина и пентозидина, в коллагене кожи крысы. J Gerontol A Biol Sci Med Sci. , ноябрь 1995 г .; 50 (6): B337-41.
- Продам DR, Kleinman NR, Monnier VM.Продольное определение уровней гликирования и гликоксидации кожного коллагена позволяет прогнозировать раннюю смерть мышей C57BL / 6NNIA. FASEB J. 2000 января; 14 (1): 145-56.
- Пейджон Х., Цукки Х., Руссет Ф. и др. Старение кожи за счет гликирования: уроки реконструированной модели кожи. Clin Chem Lab Med. , 1 января 2014 г .; 52 (1): 169-74.
Окислительный стресс и конечные продукты повышенного липоксидации и гликирования (ALEs и AGE) при старении и возрастных заболеваниях
Окислительный стресс является следствием использования кислорода живыми организмами в аэробном дыхании и обозначается как постоянное состояние дисбаланс между образованием активных форм кислорода (АФК) и способностью эндогенной антиоксидантной системы (АОС) выводить их токсины.Теория окислительного стресса была подтверждена во многих исследованиях на животных, которые продемонстрировали, что поддержание клеточного гомеостаза, биомолекулярной стабильности и целостности имеет решающее значение для клеточного долголетия и успешного старения. Дисфункция митохондрий, нарушение сети гомеостаза белков (протеостаз), изменение активности факторов транскрипции, таких как Nrf2 и NF- κ B, и нарушения в механизме контроля качества белка, который включает молекулярные шапероны, убиквитин-протеасомную систему (UPS), аутофагия / лизосомный путь наблюдались при старении и возрастных хронических заболеваниях.Накопление АФК в условиях окислительного стресса приводит к индукции реакций перекисного окисления липидов и гликоксидирования, что приводит к повышенному эндогенному производству реакционноспособных альдегидов и их производных, таких как глиоксаль, метилглиоксаль (MG), малоновый диальдегид (MDA) и 4- гидрокси-2-ноненаль (HNE), дающий начало конечным продуктам липоксидации и гликирования (ALE и AGE соответственно). И ALE, и AGE играют ключевую роль в клеточном ответе на стимулы окислительного стресса посредством регуляции множества клеточных сигнальных путей.Однако повышенная продукция ALE и AGE приводит к перекрестному связыванию и агрегации белков, что приводит к изменению передачи сигналов и функционирования клеток, что вызывает повреждение и гибель клеток. Это связано со старением и различными возрастными хроническими патологиями, такими как воспаление, нейродегенеративные заболевания, атеросклероз и сосудистые осложнения сахарного диабета. В настоящем обзоре мы обсуждаем экспериментальные данные, свидетельствующие о нарушении клеточных функций, вызванном накоплением AGE / ALE в условиях окислительного стресса.Мы сосредоточились на влиянии ALE / AGE на старение и возрастные заболевания, чтобы продемонстрировать, что идентификация клеточных дисфункций, участвующих в инициации и прогрессировании заболевания, может служить основой для открытия соответствующих терапевтических агентов.
1. Введение
Живые клетки производят различные виды активных форм кислорода (ROS), такие как супероксид-анион-радикал (O 2 • — ), пероксид водорода (H 2 O 2 ) и гидроксил радикал (HO • ) [1, 2].Основные эндогенные источники ROS включают комплексы I и III митохондриальной электрон-транспортной цепи (ETC) и NADPH-оксидазы ферментов семейства NOX [3–5]. Кроме того, АФК могут продуцироваться ксантиноксидазой, циклооксигеназами (ЦОГ, простагландин G / H-синтазы), липоксигеназами и системой монооксигеназы, содержащей цитохром P450- (CYP-) [6–9]. Генерация АФК может быть вызвана экзогенными факторами, такими как УФ-свет, рентгеновское излучение и облучение γ -лучами, загрязнители воздуха, табачный дым, тяжелые металлы и некоторые лекарства [10, 11].
В физиологических условиях живые клетки поддерживают низкие внутриклеточные концентрации АФК из-за активности эндогенной антиоксидантной системы (АОС), состоящей как из ферментативных, так и из неферментативных компонентов, способных улавливать АФК и, таким образом, защищая клетки от вредного воздействия высоких АФК. концентрации (обзор в [12–14]). Ферментные компоненты включают супероксиддисмутазы (SOD), каталазу, пероксиредоксины (Prxs), глутатионпероксидазы (GPx) и глутатионредуктазу (GR), в то время как неферментативные компоненты включают аскорбиновую кислоту, альфа-токоферол, ретинол и различные молекулы с тиоловыми группами, такими как глутатион, липоевая кислота, тиоредоксин малых белков, а также ионы переходных металлов, таких как Fe, Cu, Zn и Mn [15–20].
В низких концентрациях АФК оказывают регуляторные эффекты на клеточные функции, включая пролиферацию, дифференцировку, миграцию и выживаемость [21, 22]. Это обеспечивается их участием в обратимых посттрансляционных модификациях ключевых редокс-чувствительных аминокислотных остатков в ферментах, внутриклеточных эффекторах путей передачи сигналов (протеинкиназы и протеинфосфатазы), факторах транскрипции, цитоскелетных белках и молекулярных шаперонах [23–26]. Благодаря этому окислительные модификации белков могут быть вызваны либо непосредственно самими АФК, либо косвенно вторичными продуктами реакций окисления, индуцированных АФК, происходящих как в основной цепи белка, так и в боковых цепях аминокислот [27, 28].
Однако недостаточная активность AOS вызывает накопление ROS, что приводит к окислительному стрессу, который обозначается как постоянное состояние дисбаланса между генерацией ROS и способностью биологической системы их детоксифицировать, что приводит к нарушению окислительно-восстановительной сигнализации / контроля и / или молекулярное повреждение [29]. Окислительный стресс вызывает реакции перекисного окисления липидов и гликоксидации, которые приводят к образованию высокореактивных и электрофильных соединений, которые атакуют свободные аминогруппы в белках, вызывая их ковалентные модификации и приводя к образованию конечных продуктов продвинутого липоксидации (ALE) и продвинутых конечных продуктов гликирования ( ВОЗРАСТ) [30].
Образование ALE и AGE вызывает нарушение структуры белка из-за ковалентного сшивания, что приводит к олигомеризации и агрегации белка. Это приводит к изменениям клеточных функций, повреждению и гибели клеток. Например, нарушение митохондриальных белков, белков эндоплазматического ретикулума (ER) и внеклеточного матрикса (ECM), а также белков, участвующих в клеточном цикле и контроле экспрессии генов, наблюдалось в различных исследованиях [31, 32]. Окислительный стресс и индуцированное окислительным стрессом образование ALE и AGE участвуют в старении и в различных возрастных хронических заболеваниях [33–37].
Настоящий обзор посвящен недавним достижениям в исследовании последствий накопления ALE / AGE, вызванного окислительным стрессом, для клеточных функций и влияния образования ALE / AGE на старение и возрастные заболевания человека, такие как хроническое / острое воспаление, нейродегенеративные расстройства. , атеросклероз и сосудистые осложнения сахарного диабета (СД).
2. Влияние ООВ и ВОЗРАСТА на старение
2.1. Окислительный стресс и старение
Старение — это прогрессирующее, зависящее от времени функциональное снижение физиологической целостности и приспособляемости организма, за которым следует необратимое снижение его фертильности и повышение риска заболеваемости и смертности [38].В 1959 году Денхэм Харман постулировал свободнорадикальную теорию старения, которая указывает на накопление АФК как на основную причину биомолекулярного окисления и клеточного повреждения и как объяснение изменений клеточных функций во время старения [39]. С тех пор теория старения, связанная с окислительным стрессом, получила широкое признание, несмотря на множество других предложенных теорий биологического старения и старения [40].
Снижение окислительного стресса поглотителями АФК с последующим замедлением возрастного снижения физиологических процессов и заметным увеличением средней продолжительности жизни можно рассматривать как подтверждение теории старения, связанной с окислительным стрессом [41].Эта теория также была подтверждена на многих моделях животных, включая S. cerevisiae , трансгенных мышей и долгоживущих видов, таких как C. elegans , птиц и голого землекопа [42–44]. Среди них голый землекоп (ЯМР, Heterocephalus glaber ) — самый долгоживущий из известных грызунов с максимальной продолжительностью жизни более 28,3 года, что в 9 раз дольше, чем у лабораторных мышей аналогичного размера. Состав тела, физиологические функции, включая репродуктивную функцию, и морфология тканей по ЯМР могут сохраняться от 2 до 24 лет почти без изменений, при этом наблюдается незначительное старение и отсутствие спонтанных новообразований [45].
Perez et al. [46] показали, что количество и активность как АФК, так и антиоксидантной системы в ЯМР аналогичны таковым у более короткоживущих мышей; однако ЯМР демонстрируют более высокие уровни окислительного биомолекулярного повреждения (повреждение ДНК, перекисное окисление липидов и образование карбонила белка) даже в раннем возрасте. Однако ЯМР продемонстрировали большее количество свободных тиоловых групп и более низкие уровни индуцированного мочевиной разворачивания белка и убиквитинирования белка, а также более высокую протеасомную активность по сравнению с молодыми мышами C57BL / 6 [46].Интересно, что ни один из этих параметров не претерпел значительных изменений в течение двух десятилетий жизни ЯМР. Эти данные показывают, что существование молекулярных механизмов, лежащих в основе поддержания клеточного гомеостаза, биомолекулярной стабильности и целостности, имеет решающее значение для клеточного долголетия и успешного старения.
Действительно, изменения в структуре, функциях и степени окисления мышечных белков наблюдались у старых мышей F344BN [47]. У мышей с возрастом содержание регуляторных белков снижалось до 75%, а каталитическая активность ферментов снижалась до 50%.Кроме того, у старых животных наблюдались мышечная атрофия Дюшенна и потеря нервного питания наряду с повышенной экспрессией субъединиц иммунопротеасом [48]. Сообщалось, что увеличение продолжительности жизни мышей Tq связано со стимуляцией окислительно-восстановительной передачи сигналов, опосредованной митоген-активируемой протеинкиназой (MAPK-), повышенной экспрессией защищающего от стресса белка теплового шока 25 (HSP25) и активацией антиоксидантных ферментов. , каталаза и СОД, предполагая, что вызванная окислительным стрессом стимуляция эндогенных защитных механизмов играет ключевую роль в обеспечении здоровья и долголетия [49].
Протеостаз — это общий гомеостаз клеточного белка, обеспечиваемый комплексными путями контроля качества белка, включая биосинтез, фолдинг, транспорт и элиминацию / деградацию поврежденных белков [50, 51]. Поддержание протеостаза является важным компонентом успешного старения, поскольку было показано, что у большинства многоклеточных животных старение сопровождается снижением активности механизмов контроля качества белков, включая молекулярные шапероны, убиквитин-протеасомную систему (UPS) и аутофагию / активность лизосом, которая приводит к накоплению поврежденных и самоагрегированных белков [52].Во время старения было показано окислительное повреждение белков и ковалентное сшивание с последующим накоплением так называемых «агресом», токсичных для клеток [53, 54]. Было обнаружено, что долгоживущие виды обладают улучшенным протеостазом по сравнению с короткоживущими видами, о чем свидетельствуют повышенные уровни HSP, усиленная макроаутофагия и активность UPS [55]. Кроме того, восстановление протеостаза из-за активации лизосом с последующим метаболическим сдвигом, который мобилизует деградацию белковых агрегатов, наблюдалось у бессмертных C.elegans зародышевые линии [43].
Одним из наиболее изученных признаков старения является проявление митохондриальной дисфункции [56, 57]. Митохондрии рассматриваются как основное место генерации АФК и основная цель атаки АФК. Связанное с возрастом увеличение продукции митохондриальных АФК комплексом I, индуцированные окислительным стрессом мутации в митохондриальной ДНК (мтДНК) и накопление фрагментов мтДНК внутри ядра наблюдались в печени мышей [58]. Эти изменения сопровождались окислительным повреждением и липокислением митохондриальных белков, включая ферментные компоненты ETC, и накоплением липофусцина, продуцируемого ковалентно сшитыми и агрегированными белками; все эти изменения были отменены лечением рапамицином.Кроме того, сообщалось о меньшей выработке митохондриальных АФК и более высоком содержании кардиолипина в эритроцитах долгоживущих видов по сравнению с короткоживущими [44]. Таким образом, возрастное накопление окисленных белков может быть вызвано как увеличением продукции митохондриальных АФК, так и снижением протеолитической способности убиквитинового / протеасомного или лизосомного пути [59].
Фактор транскрипции Nrf2 служит главным регулятором клеточного ответа на окислительный стресс, при этом дисфункция Nrf2 наблюдается в различных типах клеток во время старения.Сверхэкспрессия генов-мишеней Nrf2, НАДФН-хинон оксидоредуктазы 1 (NQO1), глутамат-цистеинлигазы (GCLM) и гемоксигеназы 1 (HO1) была показана в клетках пигментного эпителия сетчатки (RPE) старых мышей по сравнению с более молодыми мышами при окислительном стрессе условия [60]. У старых мышей также были более высокие уровни O 2 • — и MDA, чем у более молодых мышей. Те же гены были сверхэкспрессированы в условиях индукции Nrf2 в клетках бронхиального эпителия старых людей по сравнению с молодыми людьми [61].Нарушение передачи сигналов Nrf2 вызывает снижение миграции клеток и нарушение способности эндотелиальных клеток коронарных артерий формировать капиллярно-подобные структуры [62].
Было показано, что антиоксидантная система, включая систему глутатиона (GSH / GSSG) и SOD, участвует в успешном старении за счет поддержания внутриклеточного окислительно-восстановительного баланса. Действительно, изменение соотношения между восстановленным, GSH и окисленным, GSSG, формами глутатиона при старении было продемонстрировано измерениями концентрации GSH в эритроцитах и уровней биомаркеров окислительного стресса в плазме, таких как F2-изопростаны, у молодых и пожилых людей [ 63].У пожилых людей были заметно более низкие концентрации глицина, цистеина и GSH наряду со сниженным биосинтезом GSH в эритроцитах по сравнению с таковыми у более молодых людей. Однако добавление глицина и цистеина привело к увеличению концентрации GSH и скорости его биосинтеза, а также к значительному снижению уровней биомаркеров окислительного стресса в плазме крови.
Сообщалось о снижении уровня ROS из-за активации другого компонента AOS, Mn-супероксиддисмутазы (SOD2), посредством его деацетилирования по эволюционно консервативному остатку Lys122 консервативным семейством NAD + -зависимых деацетилаз, сиртуинов. как фактор, участвующий в контроле продолжительности жизни [64, 65].Было показано, что сиртуины 1 и 3 млекопитающих, SIRT1 и SIRT3, регулируют активность SOD2 для защиты мышечных клеток от окислительного стресса [66]. Они могут способствовать биогенезу митохондрий, активируя PGC-1 α , который является транскрипционным коактиватором, активирующим антиоксидантные ферменты, такие как GPx, каталаза и SOD2 [67].
2.2. ALE и AGE при старении
Окислительный стресс вызывает эндогенное образование и накопление как ALE, так и AGE, которые могут быть получены из одних и тех же предшественников, таких как глиоксаль и метилглиоксаль, и через те же промежуточные продукты, как N — (карбоксиметил) -лизин ( CML) и N — (карбоксиметил) -цистеин (CMC).ALE образуются в результате реакций перекисного окисления липидов, в то время как AGE возникают в результате реакций гликоксидации; оба пути приводят к чрезвычайно сложной смеси взаимосвязанных соединений [30]. Эти соединения включают высокореактивные электрофильные альдегиды и их производные, такие как 4-гидрокси-2-ноненаль (HNE), 4-оксо-2-ноненаль (ONE), 4-гидроксигексаналь (HHE), акролеин (ACR) и малоновую кислоту. диальдегид (МДА) [68, 69]. Они взаимодействуют со свободными аминогруппами в белке, вызывая их ковалентную модификацию, сшивание, олигомеризацию и агрегацию.Эти процессы вызывают внутриклеточное повреждение, нарушение функций клеток и, в конечном итоге, гибель клеток, которые участвуют в старении и различных возрастных хронических заболеваниях [70, 71].
2.2.1. Роль ALE в старении
Сообщается, что изменения количества продуктов перекисного окисления липидов и активности COX-2 и CYP2JA в мозге человека зависят от возраста [72]. Значительное увеличение уровней перекисного окисления липидов и окислительной модификации белков, сопровождающееся потерей тиоловых групп, накоплением дитирозина и образованием ALE, наблюдалось в митохондриях и синаптосомах при старении мозга у крыс [73].Интересно, что более высокая мембранная резистентность к перекисному окислению липидов и более низкое молекулярное повреждение, вызванное липоксидацией белков, связаны со значительным снижением активности десатуразы и пероксисомного бета-окисления в головном мозге и селезенке исключительно старых () и взрослых () самок мышей по сравнению с старые () животные [74].
Было показано, что альдегиды, образующиеся в результате перекисного окисления полиненасыщенных жирных кислот (ПНЖК), таких как HNE, MDA и ACR, образуют белковые аддукты, которые накапливаются в интиме, средах и адвентициальных слоях аорты человека, что приводит к прогрессирующей клеточной дисфункции и способствует процесс старения [75].Было показано, что HNE, наиболее реактивный и обильно генерируемый эндогенно α , β -ненасыщенный гидроксилальдегид, способствует ингибированию репарации эластина путем антагонизма эластогенной передачи сигналов трансформирующего фактора роста- β (TGF- β ) через ингибирование транслокации Smad2 в ядро фибробластов кожи человека и мыши [76].
Кроме того, накопление HNE-модифицированных аддуктов, снижение содержания эластина и модификация рецептора эпидермального фактора роста (EGF) под действием NHE наблюдались в аорте старых мышей C57BL / 6.С возрастом содержание эластина в соединительной ткани уменьшилось, а структура эластиновых волокон значительно изменилась; однако уровень окислительной модификации белка был очень низким, что указывает на сложную роль ALE в ремоделировании сосудистой стенки во время старения [76].
2.2.2. Возраст и ось AGE-RAGE в старении
Проявление AGE, особенно в соединительной ткани, которое приводит к возрастному повреждению и ковалентному перекрестному сшиванию адгезионных белков ECM, таких как коллаген, ламинин и эластин, способствует потере эластичности кожи и сосудов и дегенерации хрящей, связок и хрусталика глаза [77, 78].Было показано, что накопление AGE и флюоресцентного пигмента старения, липофусцина, оба из которых обычно имеют коричневый цвет, связано со старением и возрастными хроническими заболеваниями, чему способствует возрастное ингибирование как протеасомных, так и лизосомных путей деградации белков [79 , 80].
Различные возрастные заболевания возникают из-за изменений клеточных сигнальных путей, которые происходят с участием рецепторов AGE (RAGE) и оси AGE-RAGE. Например, совместная локализация CML и RAGE вместе с активацией ядерного фактора- κ B (NF- κ B) наблюдалась у пациентов с возрастной дегенерацией желтого пятна, что указывает на возможную роль оси AGE-RAGE. и фактор транскрипции NF- κ B в патогенезе заболевания [81].Накопление как AGE, так и RAGE в РПЭ и фоторецепторных клетках сопровождается ядерной транслокацией NF- κ B и апоптозом клеток [82]. Эти данные позволили предположить, что накопление AGE индуцирует активацию клеток RPE / фоторецепторов при нормальном старении и способствует возрастным патологиям сетчатки глаза человека.
Кроме того, сообщалось, что полученные из диеты AGE и липофусцин нарушают общий гомеостаз белка и сокращают продолжительность жизни D. melanogaster [83].Пероральное введение альбумина, модифицированного глюкозой, фруктозой и рибозой, или искусственного липофусцина вызывало накопление AGE в соматических тканях и гемолимфе мух, что сопровождалось окислительным стрессом и повышением активности лизосомального катепсина B. Интересно, что снижение уровня глюкозы, наблюдаемое при ограничении калорийности в условиях отсутствия недоедания, привело к ингибированию активности ферментов и снижению концентраций метаболитов полиольного пути, сорбита и фруктозы.Это способствовало положительному эффекту ограничения калорийности, включая повышение уровня НАДФН, необходимого для других реакций восстановления, таких как GSH и другие формы регенерации компонентов AOS, и противодействовало возрастным изменениям, связанным с активностью пути полиола [84].
Таким образом, экспериментальные данные подтверждают ключевую роль как ALE, так и AGE в процессе старения, которые рассматриваются как биомаркеры окислительного стресса и митохондриальной дисфункции, а также как факторы старения и возрастных хронических патологий [85].
3. Роль ALE и AGE в возрастных хронических заболеваниях
3.1. Нейродегенеративные заболевания
Окислительный стресс и окислительное повреждение белков могут ускорить образование токсичных белковых олигомеров и агрегатов в ядре и цитоплазме нервных клеток, что способствует патогенезу нейродегенеративных заболеваний, таких как болезнь Альцгеймера (БА), болезнь Паркинсона (БП). , Болезнь Хантингтона (HD) и боковой амиотрофический склероз (ALS) [86–88]. Несмотря на различные причинные факторы и клинические симптомы, эти заболевания имеют общие патогенетические особенности, такие как митохондриальная дисфункция и стресс ER, связанный с чрезмерным накоплением ROS, нарушением сети протеостаза и нейровоспалением [89].
Нормальное старение и нейродегенерацию можно отличить путем измерения концентрации AGE в ткани мозга и спинномозговой жидкости. Проявление AGE / RAGE указывает на нейропатологические и биохимические изменения, такие как чрезмерное сшивание белков, воспаление и гибель нейрональных клеток. Например, ускоренное накопление AGE в патологических отложениях, таких как амилоидные фибриллы и сенильные бляшки, наблюдалось при AD (рис. 1 (a)), наиболее распространенном возрастном деменционном расстройстве [90].Измерение различных AGE и ALE в коре головного мозга пациентов с AD продемонстрировало значительное, хотя и неоднородное увеличение концентраций CML, N (эпсилон) -малоновый диальдегид-лизин, N (эпсилон) -карбоксиэтил-лизин и другие аддукты окисления белков [91]. Было высказано предположение, что метилглиоксаль является одним из основных видов карбонила, ответственных за образование AGE при БА [92].
AGE могут стимулировать экспрессию индуцибельной синтазы оксида азота (iNOS), а совместная локализация AGE и iNOS была продемонстрирована в астроцитах и микроглии пациентов с БА (рис. 1 (а)), как показал иммунохимический анализ [93].Кроме того, сообщалось об увеличении образования оксида азота, вызванном черепно-мозговой травмой, катализируемой iNOS, и постоянном нитровании тирозина рядом с местом повреждения [94]. Эти эффекты сопровождались вызванной окислительным стрессом гибелью клеток из-за индукции апоптоза и некрозом, опосредованным рецепторами серин / треониновых протеинкиназ.
Дисфункция митохондрий и мутации в генах мтДНК, кодирующих субъединицы комплекса I ETC с последующим нарушением продукции АТФ и повышенным образованием АФК, наряду с нарушением как путей деградации UPS, так и аутофагии-лизосомного белка, наблюдались при всех типах нейродегенерации [95].Поврежденные митохондрии накапливают гомолог тензина, удаленный из хромосомы 10- (PTEN-) индуцированной киназы 1 (PINK1), которая рекрутирует паркин, белок лигазного комплекса убиквитин E3, как показано у пациентов с БП (рис. 1 (b)) [96, 97] . Это вызывает убиквитинирование митохондриальных белков, которые могут далее связываться с аутофагическими белками, p62 / SQSTM1 и lc3, что приводит к деградации митохондрий посредством пути аутофагии, процесса, обозначенного как митофагия [98]. Значительное увеличение экспрессии p62 / SQSTM1 как на уровне мРНК, так и на уровне белка наряду с активацией митохондриального / лизосомного биогенеза после PINK1 / паркин-опосредованной митофагии наблюдалось при семейной AD [99].
Было продемонстрировано, что Nrf2 и фактор транскрипции EB (TFEB), которые играют ключевую роль в митохондриальном и лизосомном биогенезе, соответственно, перемещаются в ядро после индукции митофагии. Кроме того, сообщалось о многогранном защитном потенциале передачи сигналов Nrf2 у пациентов с нейродегенеративными заболеваниями и в первичных мышах HD и WT микроглии и астроцитах [100, 101]. Вызванная окислительным стрессом ковалентная модификация Cys151 в Kelch-подобном ECH-ассоциированном белке 1 (Keap1), адапторном белке субстрата лигазы E3 и первичном негативном регуляторе Nrf2, была показана на HD [100].Экспрессия Nrf2 управляется и усиливается за счет совместной экспрессии антиоксидантных и противовоспалительных генов, как показано, например, в первичных моноцитах пациентов с HD, у которых подавленная экспрессия провоспалительных цитокинов, таких как IL-1, IL-6, IL- 8, и фактор некроза опухоли — α (TNF- α ) (рис. 1 (а)).
Окислительная модификация Cys111 в Cu / Zn SOD (SOD1) участвует в патогенезе различных заболеваний, в то время как мутации в SOD1 (рис. 1 (c)) обнаруживаются в 20% семейных ALS [102].В отличие от природного SOD1, цистеинилированный SOD1 не окисляется, что позволяет предположить, что цистеинилирование защищает этот антиоксидантный фермент от окисления, вызванного перекисью водорода, как показано на культуре нервных клеток. Существование перекрестной связи между сверхэкспрессией SOD1 и регуляцией митохондриального ответа на развернутый белок (UPR) было постулировано [103].
В нервной системе протеасомы играют ключевую роль в поддержании гомеостаза нейрональных белков, а изменение их активности вносит вклад в патогенез нейродегенеративных заболеваний [104, 105].Накопление крупноупорядоченных фибрилл, образованных белками, обогащенными β -листами, обозначаемых как амилоидные фибриллы, в нейрональных клетках характерно для всех типов нейродегенеративных заболеваний, являясь результатом дисфункции UPS и, как следствие, накопления полиубиквитинилированных белков в нервной ткани. [106, 107]. Снижение способности удалять окисленные белки и накопление поврежденных и неправильно свернутых белков вызывает метаболическую дисфункцию и инициирует гибель клеток через апоптоз или некроз.Эти нарушения приводят к прогрессирующему образованию амилоидных бляшек, потере нейронов, атрофии головного мозга, цереброваскулярной амилоидной ангиопатии и минерализации сосудов в зависимости от возраста [108].
ER стресс также вовлечен во многие хронические нейродегенеративные заболевания, включая AD и HD, в то время как продление ER стресса приводит к гибели клеток. Важная роль в этом процессе принадлежит ER-локализованным чувствительным к стрессу и запускающим стресс белкам, таким как IRE1 α , ATF6 и PERK (Рисунок 1).Во время UPR они активируют апоптотический сигнальный путь, в то время как фортилин, молекула для выживания, ингибирует апоптоз, напрямую связываясь с IRE1 α и снижая его киназную и РНКазную активности [109].
3.2. Атеросклероз
Накопление как ALE, так и AGE постепенно приводит к клеточной дисфункции и повреждению тканей, участвующим в прогрессировании других хронических заболеваний, вызванных окислительным стрессом, таких как атеросклероз и сахарный диабет. Гипергликемия может вызывать окислительный стресс и повреждение тканей либо из-за повторяющихся резких изменений метаболизма глюкозы, либо из-за длительного биомолекулярного гликирования и образования AGE [110].Это может дополнительно вызвать воспаление и пролиферацию клеток, способствующих развитию атеросклероза и сосудистой дисфункции за счет инициирования окисления липопротеинов низкой плотности (ЛПНП) и их взаимодействия с мононуклеарными клетками, эндотелиальными клетками и клетками гладких мышц [111–113]. Гликирование ЛПНП увеличивает их атерогенность, в то время как липопротеины высокой плотности (ЛПВП), как сообщается, препятствуют гликированию аполипопротеина В (апоВ) ЛПНП [114].
При атеросклеротическом поражении макрофаги экспрессируют акцепторные рецепторы на поверхности своей клеточной мембраны, чтобы связывать окисленные ЛПНП со стенок кровеносных сосудов и превращаться в пенистые клетки.Окисление LDLs вызывает образование аддуктов HNE-apoB, которые вносят вклад в атерогенность LDLs и их способность связываться с рецепторами скавенджеров [110]. Кроме того, транспортировка окисленных липидов в липопротеиновых комплексах, как предполагается, играет роль в патогенезе атеросклероза, при этом те, которые транспортируются с помощью ЛПНП, связаны с высоким риском, а те, которые транспортируются с помощью ЛПВП, являются показательными для защиты от прогрессирования заболевания [115].
Рецептор ЛПНП имеет высокое сродство к апоЕ, которое у человека существует в трех изоформах: апоЕ2, апоЕ3 и апоЕ4, последний является основным фактором риска сердечно-сосудистых заболеваний и болезни Альцгеймера (рисунок 1 (а)).Было показано, что окислительно-восстановительный статус различных изоформ апоЕ в сыворотке, определяемый окислительной модификацией их окислительно-восстановительных остатков цистеина, различается. Количественные соотношения невосстановленного апоЕ к общему сывороточному апоЕ у пациентов с апоЕ4 / Е3 были выше, чем у пациентов с апоЕ3 / Е3; это может быть использовано как индикатор заболевания [116].
3.3. Сахарный диабет
Ключевая роль окислительного стресса в возникновении сахарного диабета и развитии его осложнений была продемонстрирована на различных моделях животных.Например, в условиях нарушенного окислительно-восстановительного баланса повышенные уровни Nrf2 и нитротирозина наряду со сниженными уровнями SOD2, GPx, HO1 и эндотелиальной синтазы оксида азота (eNOS) были продемонстрированы в диабетической коже мышей [117]. Нарушение метаболизма липидов и глюкозы, окислительного фосфорилирования и фосфо-5-AMP-активируемой протеинкиназы- α — (AMPK α -), опосредованной передачи сигналов, наряду с подавлением eNOS, HO1 и кальций-АТФаз саркоплазматического ретикулума 1 и 2 (SERCA 1 и SERCA 2) наблюдались в скелетных мышцах крыс с диабетом [118].
Реактивные альдегиды, такие как HNE, когда их чрезмерно продуцируют в условиях окислительного стресса, проявляют цитотоксические эффекты и играют ключевую роль в патофизиологии сахарного диабета, участвуя как в развитии, так и в прогрессировании заболевания [119]. Например, повышенное содержание карбонила белка наблюдалось у пациентов с СД 2 типа, ассоциированным с нейропатией [120]. У мышей с диабетом были зарегистрированы повышенные уровни биомаркеров окислительного стресса наряду с накоплением окисленных липидов и гликоксидированием сывороточного альбумина [121].AGE-модифицированный альбумин вызывает индуцированное диабетом повреждение печени и нарушение активности протеолитических ферментов и носителей ETC. И экспериментальный, и клинический сахарный диабет характеризуются нарушением заживления ран и дефектом экспрессии фактора роста эндотелия сосудов (VEGF). Было показано, что реакции перекисного окисления липидов участвуют в патогенезе измененной регуляции VEGF и ангиогенезе, чтобы стимулировать заживление ран у мышей с диабетом [122].
Высокая концентрация глюкозы, наблюдаемая при сахарном диабете, активирует путь полиола (сорбитол-альдозоредуктазы), что приводит к накоплению внутриклеточного сорбита.Неспособность сорбита проходить через клеточную мембрану в инсулиннезависимых тканях (сетчатке, почках и нервной системе) вызывает повышение внутриклеточного осмотического давления и, как следствие, повреждение клеток. В условиях окислительного стресса все промежуточные продукты полиольного пути (сорбит, фруктоза и фруктозо-1-фосфат) могут гликировать белки, что приводит к образованию AGE, что связано с микрососудистыми осложнениями сахарного диабета [123]. Интересно, что повышение уровней глюкозы и гликогена, наблюдаемое в условиях ограничения калорийности, вызывает значительное снижение активности ферментов пути полиола, наряду с активацией гексокиназы, глюкозо-6-фосфат-дегидрогеназы (фермент пентозофосфатного пути. ) и глюкозо-6-фосфатаза (фермент деградации гликогена) как у диабетических, так и у недиабетических крыс [124].Следовательно, ограничение калорийности способствует ослаблению гипергликемии, наблюдаемой при сахарном диабете.
Кроме того, было показано, что гликоксидирование IgG метилглиоксалем, генерируемым перекисью водорода, создает новые эпитопы и изменяет иммуногенность IgG у пациентов с СД 2 типа [125]. Связываясь со своими рецепторами, RAGE, AGE могут значительно ускорить прогрессирование заболевания и развитие его микрососудистых осложнений, таких как диабетическая нефропатия, ретинопатия и невропатия [126–128].Ось AGE-RAGE участвует в потере клеточных капилляров, утолщении базальной мембраны капилляров, повышенной проницаемости сосудов и нарушении гемато-тканевого барьера, наряду с повышенной адгезией лейкоцитов к эндотелиальным клеткам и неоваскуляризацией, наблюдаемой в экспериментальных моделях животных с СД. [129].
Диабет 2 типа характеризуется образованием гликированного гемоглобина наряду с повышенными уровнями сывороточных AGE и полноразмерного RAGE [130, 131]. Более того, у пациентов с сосудистыми осложнениями уровень растворимой формы RAGE (sRAGE), рецептора AGE-приманки, был значительно выше, чем у пациентов без осложнений, в то время как уровень sRAGE был связан с тяжестью нефропатии [132].Было показано, что пациенты с диабетом 1 типа демонстрируют более высокие уровни sRAGE и эндогенного секреторного RAGE (esRAGE) по сравнению со здоровыми донорами [133, 134].
Было продемонстрировано, что блокада RAGE с использованием внеклеточного лиганд-связывающего домена sRAGE вызывает заживление ран и подавляет экспрессию цитокинов TNF- α и IL-6 и матриксной металлопротеиназы-2, -3 и -9 у больных диабетом. мыши [135]. Это сопровождалось повышенными уровнями фактора роста тромбоцитов (PDGF) и VEGF наряду с усилением хорошо васкуляризованной грануляционной ткани.Нарушение ангиогенного ответа у мышей с диабетом зависело от RAGE-опосредованной регуляции, тогда как sRAGE восстанавливал связанное с диабетом нарушение ангиогенного ответа in vivo [136].
Сообщалось, что образование AGE коррелирует с гликемическим контролем. Например, уровни AGE-модифицированного сывороточного альбумина и аполипопротеина A-II наиболее высоки у пациентов с СД 2 типа с плохим гликемическим контролем; Всего с помощью высокочувствительного протеомного подхода с применением обращенно-фазовой ВЭЖХ и масс-спектрометрии идентифицировано 19 сайтов модификации, соответствующих 11 белкам [137].Кроме того, фибриноген и белок 1, связывающий инсулиноподобный фактор роста (IGF-), тесно связаны с метаболическими изменениями и сосудистыми осложнениями у пациентов с сахарным диабетом. Было показано, что комплексы этих двух белков подвергаются гликоксидации, что снижает их стабильность и, возможно, участвует в гиперкоагуляции, наблюдаемой при СД 2 типа [138].
Все вышеупомянутые метаболические и структурные изменения, вызванные окислительным стрессом, могут лежать в основе так называемой «метаболической памяти», феномена, заключающегося в развитии микро- и макрососудистых осложнений сахарного диабета даже после повышения уровня глюкозы [139].Ранний интенсивный гликемический контроль может снизить риск диабетических сосудистых осложнений, как показано на диабетических крысах, у которых уровни окислительного стресса и оксида азота в моче и коре почек вскоре после установления хорошего гликемического контроля не отличались от таковых у здоровых животных [ 140]. Однако, когда гликемический контроль был отложен до 6 месяцев, у диабетических крыс развивалась диабетическая нефропатия. Гипергликемия вызывает окислительный стресс, который при продолжении вызывает митохондриальную дисфункцию, активацию пути полиола, продукцию ALE, стимуляцию оси AGE-RAGE и последующие диабетические сосудистые осложнения.
4. Заключение
Накопленные данные свидетельствуют о том, что индуцированное окислительным стрессом избыточное образование реактивных альдегидов, образующихся в результате реакций перекисного окисления липидов и гликоксидации с последующим сшиванием белков, олигомеризацией, а также агрегацией и образованием аддуктов окисления белков, участвуют в старении и различных хронические возрастные заболевания. В настоящем обзоре мы сосредоточили внимание на нейродегенеративных заболеваниях и сердечно-сосудистых заболеваниях, осложнениях сахарного диабета и атеросклерозе, частота и распространенность которых увеличивается с возрастом.Эти возрастные хронические заболевания становятся серьезной проблемой для медицины и общественного здравоохранения во всем мире, поскольку число людей, страдающих от них, увеличивается, вызывая демографические изменения во всем мире. Это требует дополнительных исследований в этой области для выяснения метаболических и структурных изменений, которые приводят к изменениям в сигнальных событиях клеток с участием ALE и AGE в возникновении и прогрессировании возрастных заболеваний. Открытие новых биомаркеров окислительного стресса и лекарственных мишеней, а также новых подходов к их клиническому применению наряду с пересмотром политики здравоохранения имеют решающее значение.
Аббревиатуры
| ROS: | Активные формы кислорода | ||||
| AOS: | Антиоксидантная система | ||||
| ETC: | Электронно-транспортная цепь | NOSSHa | ALE: | Конечный продукт улучшенного липоксидации | |
| ВОЗРАСТ: | Конечный продукт улучшенного гликозилирования | ||||
| GSH: | Глутатион | ||||
| RAGE: | Рецептор | 918E PUFA: полиуретан 918 жирная кислота | |||
| PL: | Фосфолипид | ||||
| RCS: | Реакционноспособные карбонильные формы | ||||
| MDA: | Малоновый диальдегид | ||||
| 918NE | 918EN 918EN | 918NE | 918NE48 -Гидрокси-2-ноненаль | ||
| HHE: | 4-гидрокси-гексаналь | ||||
| ONE: | 4-оксо-2-ноненаль | ||||
| CML : | N — (Карбоксиметил) -лизин | ||||
| C1851 | |||||
| C1847 | — (Карбоксиметил) -цистеин | ||||
| ЦОГ: | Циклооксигеназа | ||||
| NF- κ B: | Ядерный фактор- κ B- | ||||
| Ядерный фактор Nrf2 родственный фактор 2 | |||||
| TNF- α : | Фактор некроза опухоли α | ||||
| EGF: | Фактор эпидермального роста | ||||
| Фактор роста TGF- β | : | Трансформирующий фактор роста β: 918 β | |||
| VEGF: | Фактор роста эндотелия сосудов | ||||
| IGF: | Инсулиноподобный фактор роста | ||||
| PDGF: | Тромбоцитарный фактор роста | ||||
| MAPK: | Митоген-активированная протеинкиназа | ||||
| PTEN: | Гомолог тензина фосфатазы, удаленный с хромосомы 10 | ||||
| PINK1: | PTEN47 918 918 918 918 918 918 | PTEN47 918-индуцированная кина | Убиквитин-протеасомная система | ||
| HSP: | Белок теплового шока | ||||
| SOD: | Супероксиддисмутаза | ||||
| GPx: | Глутатионпероксидаза 1848 | Внеклеточный матрикс | |||
| ER: | Эндоплазматический ретикулум | ||||
| UPR: | Развернутый белковый ответ | ||||
| AD: | Болезнь Альцгеймера 1848 | 918 918 918 9184 | HD: | Болезнь Хантингтона | |
| ALS: | Боковой амиотрофический склероз | ||||
| ЛПНП: | Липопротеин низкой плотности | ||||
| ЛПВП: | Липопротеин высокой плотности | Апо-47 | Апо-48 | Голый землекоп | |
| RPE: | Пигментный эпителий сетчатки. |
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов в отношении публикации этой статьи.
Благодарности
Работа выполнена при поддержке Программы стратегического развития Первого Московского государственного медицинского университета им. И.М. Сеченова в рамках проекта Russian Academic Excellence 5-100 Project.
Накопление AGE
Накопление AGE
AGE накапливаются в течение жизни человека, но этот процесс происходит быстрее у пациентов с такими состояниями, как сахарный диабет, почечная недостаточность и сердечно-сосудистые заболевания.Накопление AGE является важным фактором развития хронических осложнений этих состояний. Возраст тканей тесно коррелирует с ранним заболеванием почек, глаз и нервов у пациентов с сахарным диабетом. Более того, они являются ценными предикторами будущих сердечно-сосудистых заболеваний и смертности.
Накопленные AGE остаются в тканях в течение длительного времени. Это в значительной степени определяется временем жизни белка, с которым связаны AGE. Время жизни белков в ткани легко достигает нескольких лет, что означает, что накопленные AGE, как ожидается, будут оставаться в ткани в течение многих лет.В связи с этим новые препараты, направленные на предотвращение разрушения и образования AGE, в настоящее время находятся в (поздней) клинической разработке.
Запрашивать информацию
Хотите узнать больше о наших продуктах? Запросите любую информацию, которую вы хотите получить здесь.
AGE Reader mu — подключи
Неинвазивная оценка сердечно-сосудистого риска
AGE Reader обеспечивает немедленный прогноз сердечно-сосудистого риска. вашего пациента.Неинвазивный и тщательно проверенный AGE Reader — это и идеальный инструмент для тестирования на месте. Результат измерения доступен в 12 секунд и может быть экспортирован напрямую.Прочитайте больше » .

 Атеросклероз сосудов — это основная причина инсульта и инфаркта сердца.
Атеросклероз сосудов — это основная причина инсульта и инфаркта сердца.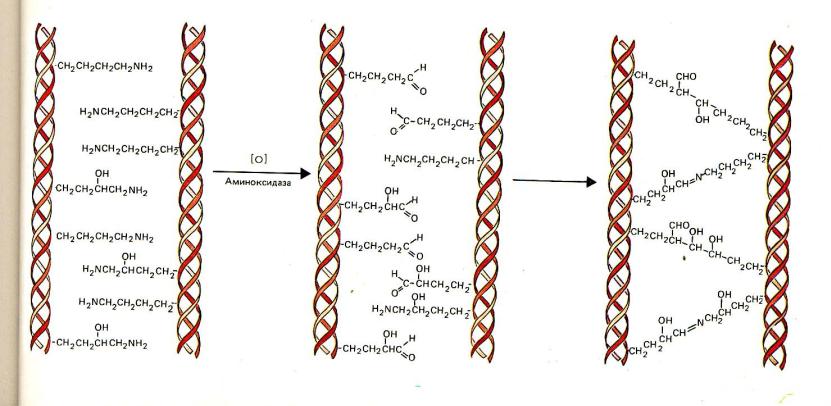 Но мы знаем, как можно существенно замедлить скорость гликирования. Например, свойством замедлять гликирование белков обладают такие средства как аспирин, метформин, витамин B1 (тиамин), витамин В6, глюкозамин сульфат. Ссылка на исследование способности метформина препятствовать гликированию белков >> http://www.ncbi.nlm.nih.gov/pubmed/14502106 Самый эффективный препарат для торможения процесса гликирования белков — это Пиридоксамин (одна из форм витамина B6) >> http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3762829/
Но мы знаем, как можно существенно замедлить скорость гликирования. Например, свойством замедлять гликирование белков обладают такие средства как аспирин, метформин, витамин B1 (тиамин), витамин В6, глюкозамин сульфат. Ссылка на исследование способности метформина препятствовать гликированию белков >> http://www.ncbi.nlm.nih.gov/pubmed/14502106 Самый эффективный препарат для торможения процесса гликирования белков — это Пиридоксамин (одна из форм витамина B6) >> http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3762829/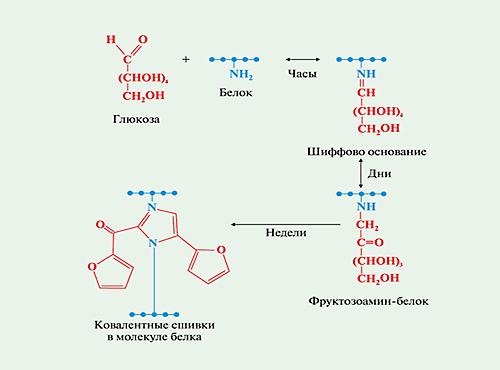
 ru/
ru/