Роль орексинергической системы мозга в регуляции бодрствования и сна uMEDp
Открытая в 1998–1999 гг. орексин/гипокретиновая система является важнейшим регуляторным механизмом головного мозга. Она представляет собой ключевой фактор в иерархии нейронных скоплений, участвующих в активации новой и древней коры и тонической деполяризации мотонейронов. Орексинергические нейроны интегрируют метаболические, эмоциональные и циркадианные сигналы для «подгонки» уровня бодрствования под текущие факторы внешней среды. Избыточная активность орексин/гипокретинергической системы связана с бессонницей и панической тревожностью, а недостаточная – с нарколепсией, ожирением, болезнями Альцгеймера и Паркинсона.
Рис. 1. Костантин фон Экономо (1876–1931). Рисунок К. фон Экономо 1917 г. Поражение мозга. Горизонтальной штриховкой выделены области, поражение которых вызывает бессонницу, косой – сонливость
Рис.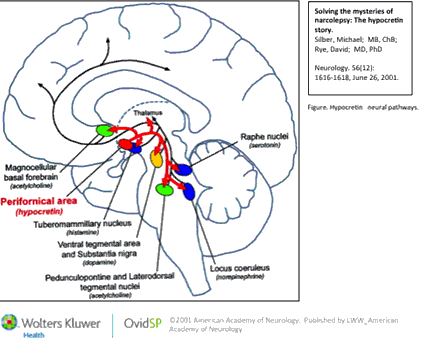
Рис. 3. Орексины и их рецепторы
Рис. 4. Центральная роль орексинергической передачи в регуляции бодрствования. Фиолетовым отмечены «центры бодрствования» в стволе мозга, выделяющие ацетилхолин, дофамин, серотонин или норадреналин и активирующие таламус, гипоталамус, мотонейроны спинного
Рис. 5. Орексин/гипокретинергические нейроны получают активирующие и тормозные проекции со стороны многих «центров» головного мозга, регулирующих бодрствование, циркадианную ритмику, энергетический баланс и эмоции
Рис. 6. Нейроанатомическое расположение проекций систем орексина/гипокретина и МКГ. Схематическое изображение сагиттального среза мозга крысы. Точки показывают распределение и относительную насыщенность клеточных тел, экспрессирующих орексин/гипокретин
Рис. 7. Проводящие пути, по которым атония запускает катаплексию (сплошные линии от закрашенных ядер – активация, пунктирные от незакрашенных – инактивация)
7. Проводящие пути, по которым атония запускает катаплексию (сплошные линии от закрашенных ядер – активация, пунктирные от незакрашенных – инактивация)
В начале XX в., несмотря на блестящие работы М.М. Манасеиной [1], мнение о сне как о важном процессе, заслуживающем изучения ничуть не меньшего, чем бодрствование, все еще не было признанным. Однако события Первой мировой войны привлекли внимание к проблеме сна, и его пассивная природа была поставлена под сомнение. В конце этой войны мир поразила невиданная эпидемия таинственной болезни, с которой человечество не сталкивалось ни до, ни, к счастью, после того.
В 1917 г. в одной из венских психиатрических клиник, переполненной ранеными военнослужащими, работал врач – специалист по ранениям и травмам головы Костантин фон Экономо (Konstantin von Economo). Это был выдающийся невролог и нейроанатом, греческий аристократ по происхождению, родившийся в Румынии, но проживший большую часть жизни в Вене (рис.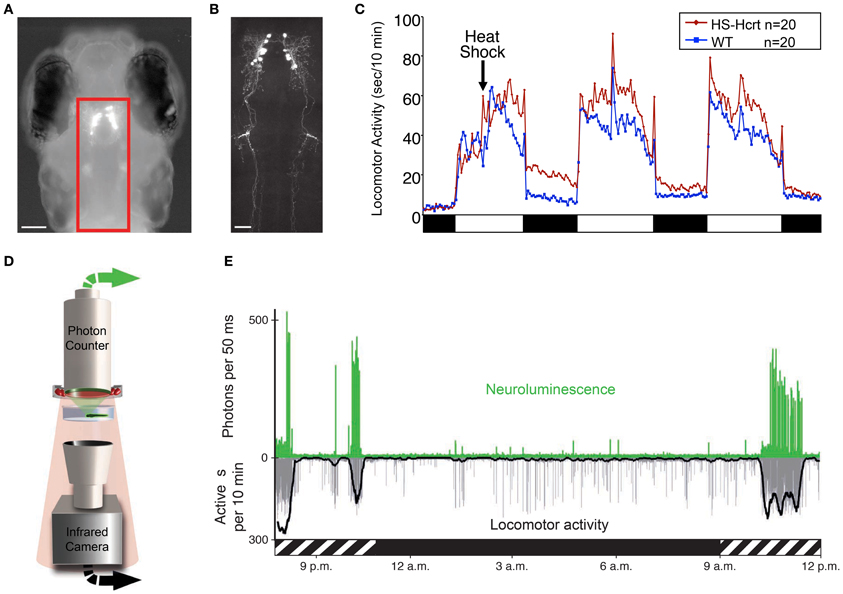 1) [1].
1) [1].
В клинику поступило несколько гражданских лиц с различными неврологическими нарушениями, на которых персонал не обратил никакого внимания. Однако К. фон Экономо заметил у семи из них общую черту в симптоматике – неудержимую сонливость и заключил, что, несмотря на различия в симптомах, все они страдают от одного и того же ранее не известного заболевания, которое он назвал encephalitis letargica. Эта «сонная болезнь» развивалась в результате проникновения в мозг некоего вируса, природа которого осталась неизвестной.
В дальнейшем К. фон Экономо описал еще 13 таких случаев. Болезнь возникала как эпидемическая, порой в ограниченных коллективах. Для нее были характерны высокая температура, нарушение сознания, зрительные расстройства, конвульсии и другие неврологические симптомы. Бóльшая часть больных, исследованных К. фон Экономо, страдала от непреодолимой сонливости, меньшая – от бессонницы, невозможности уснуть.
Тщательное изучив патологоанатомический материал, К.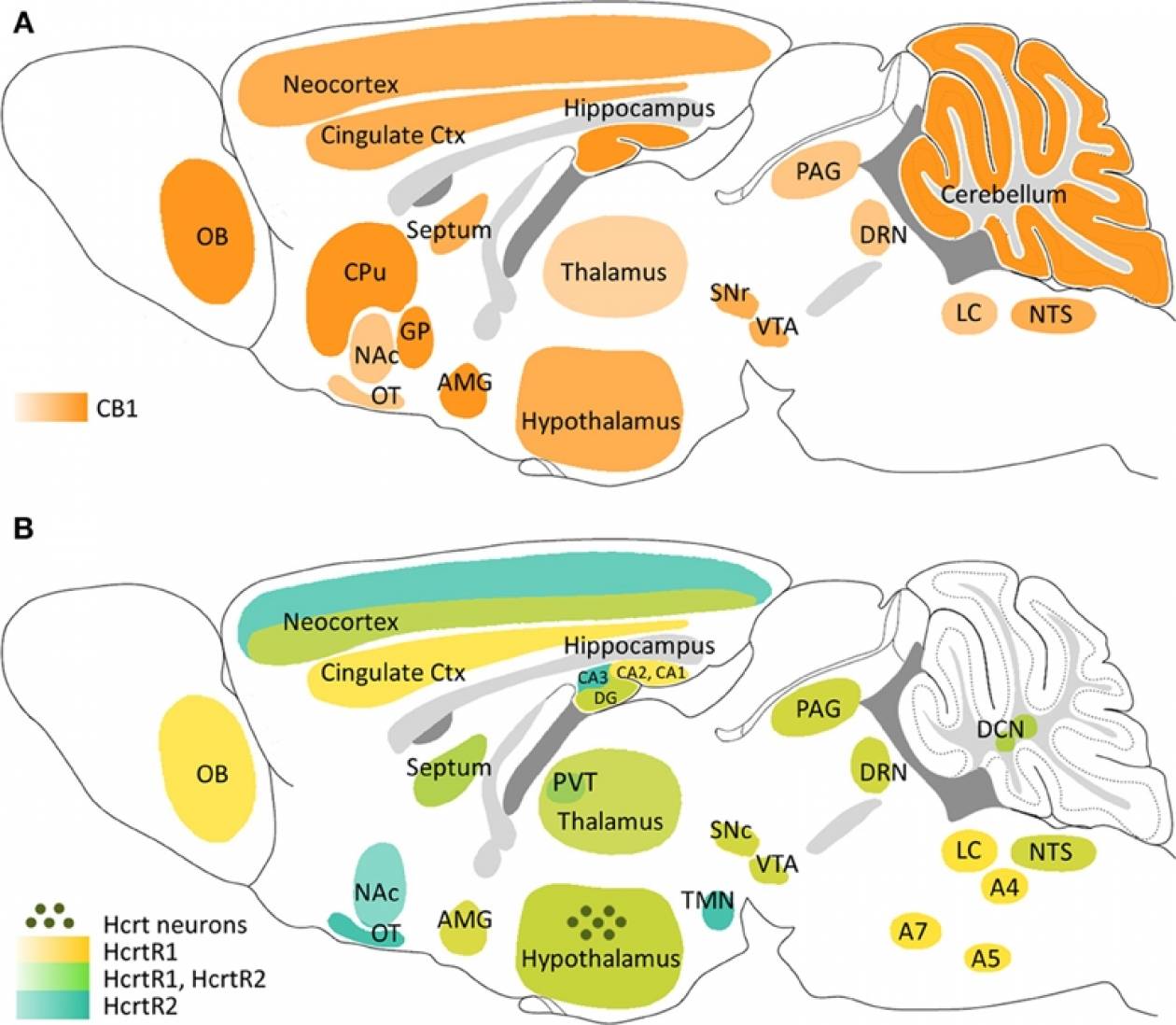 фон Экономо пришел к выводу, что «центр бодрствования», разрушение которого вирусом вызывало «сонную болезнь», расположен где-то на уровне соединения ствола и межуточного мозга, а «центр сна», поражение которого вызывало инсомнию, – в переднем гипоталамусе. В дальнейшем он описал и промежуточную область в дорсолатеральном гипоталамусе, разрушение которой, по его мнению, вызывало симптомы нарколепсии/катаплексии (рис. 1).
фон Экономо пришел к выводу, что «центр бодрствования», разрушение которого вирусом вызывало «сонную болезнь», расположен где-то на уровне соединения ствола и межуточного мозга, а «центр сна», поражение которого вызывало инсомнию, – в переднем гипоталамусе. В дальнейшем он описал и промежуточную область в дорсолатеральном гипоталамусе, разрушение которой, по его мнению, вызывало симптомы нарколепсии/катаплексии (рис. 1).
Выводы К. фон Экономо были встречены с недоверием, но через 80 лет, в самом конце ХХ в., все три его открытия были блестяще подтверждены. Теперь мы знаем, что через ростральную часть ствола проходят оба потока активирующих кору импульсов. В переднем гипоталамусе локализуется ГАМКергический «центр медленного сна», а в срединной его части расположены орексинергические нейроны, ответственные за «правильное» включение «центра быстрого сна» [1].
В 1998 г. группа авторов из США опубликовала статью о том, что им удалось обнаружить в гипоталамусе крыс матричную РНК, кодирующую белок, в состав которого входили ранее не известные аминокислотные последовательности двух сходных пептидов. Эти пептиды сначала были приняты за представителей кишечных гормонов секретинов и поэтому получили название «гипокретины» («гипо» – от hypothalamus, «кретин» – от secretin), в дальнейшем это сходство было опровергнуто. Одновременно группа японских ученых, работавшая в Техасском университете в США и занимавшаяся поиском лигандов к «сиротским» рецепторам, то есть «подбором ключей к найденным замкам», обнаружила в гипоталамусе два близких по строению пептида, названных ими орексином А и B (от греч. orexis – аппетит) (рис. 2) [1–5].
Эти пептиды сначала были приняты за представителей кишечных гормонов секретинов и поэтому получили название «гипокретины» («гипо» – от hypothalamus, «кретин» – от secretin), в дальнейшем это сходство было опровергнуто. Одновременно группа японских ученых, работавшая в Техасском университете в США и занимавшаяся поиском лигандов к «сиротским» рецепторам, то есть «подбором ключей к найденным замкам», обнаружила в гипоталамусе два близких по строению пептида, названных ими орексином А и B (от греч. orexis – аппетит) (рис. 2) [1–5].
Вскоре стало ясно, что гипокретины 1 и 2 и орексины А и B – одни и те же субстанции, олигопептиды: орексин А содержит 33 аминокислотных остатка, а B – 28. Орексин А имеет свернутую (петлеобразную) конформацию, удерживаемую дисульфидными мостиками. У орексина B – линейная структура. Молекула орексина А довольно стабильна, тогда как орексин В при введении извне быстро распадается [1, 2, 4–6].
Орексины А и В являются результатом расщепления белка-предшественника, препроорексина (прерогипокретина), из которого выщепляется более короткий полипептид проорексин (рис.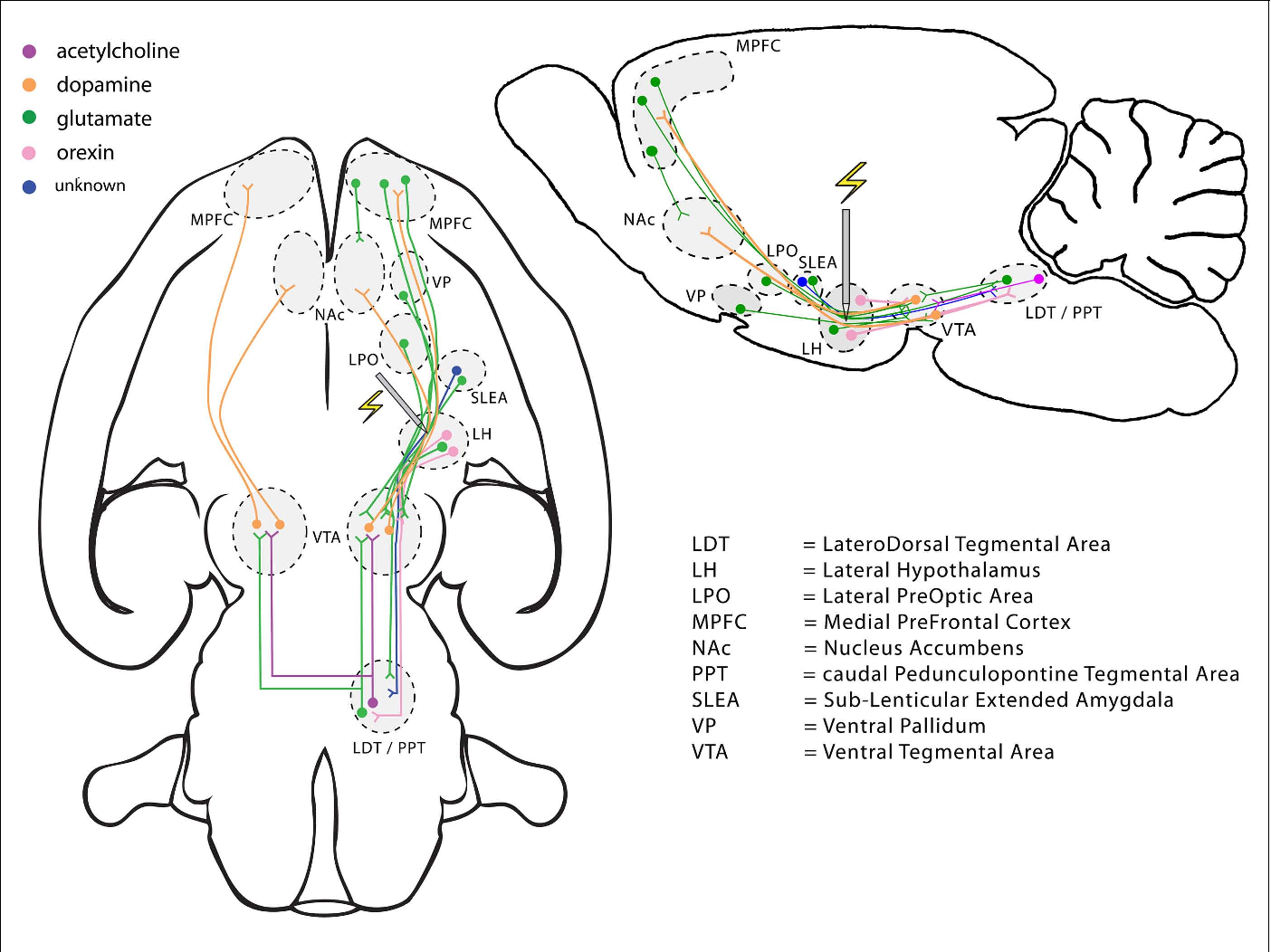
Сразу было высказано предположение, что эти пептиды играют важную роль в регуляции пищевого поведения. Тела нейронов, концевые пластинки аксонов которых выделяют орексин/гипокретин, локализуются в глубине головного мозга, у самого его основания, в дорсолатеральной и дорсомедиальной области гипоталамуса, вблизи так называемого пищевого центра, где находятся клетки, участвующие в регуляции голода и насыщения.
Подобно аминергическим нейронам, орексинергические клетки весьма немногочисленны (в полутораграммовом мозге крысы их всего 3200, а в 1000 раз большем по весу мозге человека – не более 80 тыс. ). Однако их аксоны сильно ветвятся, иннервируя множество клеток в коре и активирующих системах мозга, выделяющих все основные медиаторы: ацетилхолин, глутамат, ГАМК, мозговые амины (рис. 4) [1, 5, 7–10]. Интересно, что клетки «центра сна» вентролатеральной преоптической области не содержат орексиновых рецепторов, что, по-видимому, повышает надежность гипоталамического триггера [1, 4].
). Однако их аксоны сильно ветвятся, иннервируя множество клеток в коре и активирующих системах мозга, выделяющих все основные медиаторы: ацетилхолин, глутамат, ГАМК, мозговые амины (рис. 4) [1, 5, 7–10]. Интересно, что клетки «центра сна» вентролатеральной преоптической области не содержат орексиновых рецепторов, что, по-видимому, повышает надежность гипоталамического триггера [1, 4].
В большинстве нейронов орексин локализуется вместе с другим пептидом – динорфином. Многие орексиновые нейроны содержат также глутамат. Во всех орексиновых клетках гипоталамуса присутствует особый секретируемый нейрональный белок пентраксин, регулирующий нейронную активность. Этот белок связан с регуляцией синапсов и образуется одним из «немедленных ранних генов» – представителем группы генов, которые быстро экспрессируются (активируются) в нейронах при повышении метаболической активности последних. Орексинергические нейроны проецируются, в частности, и на норадренергические клетки синего пятна, вызывая их деполяризацию – активацию, «подбуживание».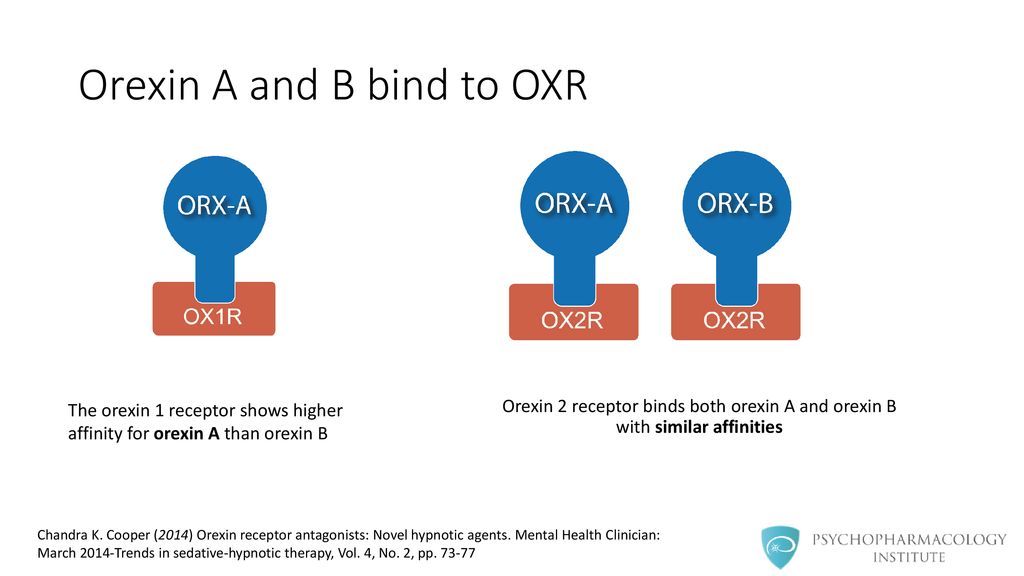
Орексинергическая система получает мощные активирующие афференты со стороны глутаматергической системы: precoeruleus/parabrachialis (PC/PB) и дорсомедиального ядра – высшего гипоталамического командного центра. Активирующие холинергические импульсы поступают на орексинергические нейроны со стороны рострально расположенных ядер базальной области переднего мозга (безымянная субстанция и др.). Кроме того, ряд модулирующих пептидов: аргинин, вазопрессин, холецистокинин 8, нейротензин, окситоцин – также стимулируют орексинергическую передачу. Активируют ее и возникновение голода (снижение уровня глюкозы) и появление грелина в крови (рис. 5) [4, 9].
На орексинергическую систему оказывается и тормозное влияние. Оно несколько слабее, но присутствует со стороны серотонинергической системы ядер шва (по-видимому, прямое), норадренергической системы синего пятна (по-видимому, опосредуемое ГАМКергическими нейронами), ноцицептивных элементов миндалины и, что особенно важно, ГАМК/галанинергического «центра сна» в преоптической области. Снижают активность орексинергических нейронов повышение уровня глюкозы и появление лептина в крови (см. рис. 5) [4, 11].
Оно несколько слабее, но присутствует со стороны серотонинергической системы ядер шва (по-видимому, прямое), норадренергической системы синего пятна (по-видимому, опосредуемое ГАМКергическими нейронами), ноцицептивных элементов миндалины и, что особенно важно, ГАМК/галанинергического «центра сна» в преоптической области. Снижают активность орексинергических нейронов повышение уровня глюкозы и появление лептина в крови (см. рис. 5) [4, 11].
Однако сильнее всего подавляет орексинергическую систему так называемая меланинергическая система. Орексиновые нейроны гипоталамуса тесно переплетаются и взаимодействуют с морфологически очень схожими клетками, содержащими другой нейропептид, называемый меланинконцентрирующим гормоном – МКГ. Это вещество, первоначально выделенное из гипофиза лосося, было затем обнаружено в гипоталамусе лабораторных крыс. Разумеется, присутствует оно и в головном мозге человека. Описан белок-предшественник МКГ и кодирующий его ген. МКГ представляет собой 19-членный циклический пептид, близкий по строению к семейству соматостатина. В мозге крысы имеется около 12 тыс. нейронов, содержащих МКГ, расположенных главным образом в латеральном гипоталамусе и zona incerta. В меньшем количестве этот пептид присутствует в ретикулярной формации моста и каудальной части латеродорсальной покрышки. В головном мозге млекопитающих нейроны, содержащие орексин и МКГ, образуют взаимоперекрывающиеся проекции:
В мозге крысы имеется около 12 тыс. нейронов, содержащих МКГ, расположенных главным образом в латеральном гипоталамусе и zona incerta. В меньшем количестве этот пептид присутствует в ретикулярной формации моста и каудальной части латеродорсальной покрышки. В головном мозге млекопитающих нейроны, содержащие орексин и МКГ, образуют взаимоперекрывающиеся проекции:
- в кору больших полушарий;
- гиппокамп;
- миндалину;
- nucleus accumbens перегородки;
- гипоталамус, включая гистаминергические нейроны его задней части;
- таламус;
- холинергические клетки базальной области переднего мозга;
- дофаминергические клетки вентральной области покрышки;
- норадренергические нейроны синего пятна;
- серотонинергические клетки ядер шва (рис. 6) [7].
Как видно из рисунка 6, обе системы проецируются на главные «центры бодрствования» головного мозга, в том числе на норадренергические клетки синего пятна, гистаминергические нейроны заднего гипоталамуса, холинергические клетки базальной области переднего мозга, выделяющие серотонин клетки ядер шва и дофаминергические нейроны вентральной покрышки [12, 13].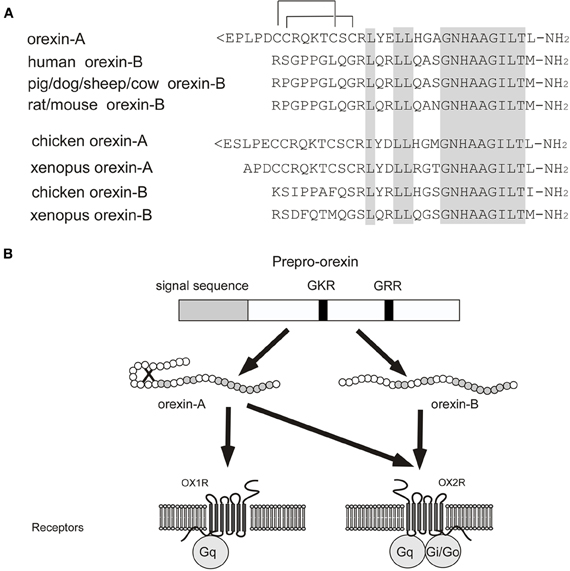
Большинство МКГ-нейронов содержат также семейства пептидов, транскрипта, регулируемого кокаином и амфетамином, и некоторые – ГАМК.
Обнаружен рецептор МКГ, распределение которого в мозге соответствует распределению обоих рецепторов орексина. Система МКГ является тормозной, реципрокной по отношению к нейронам орексина: МКГ-нейроны «молчат» в бодрствовании, слабо разряжаются в медленном сне, но весьма активны в быстром. Внутрижелудочковое введение МКГ крысам в дозах 0,2, 1 и 5 мкг вызывает дозозависимое увеличение периодов быстрого сна без изменения средней длительности каждого периода, а также небольшое увеличение представленности медленного сна. Эти эффекты реализуются посредством комбинированного воздействия МКГ и ГАМК, по-видимому, через торможение орексинергических, аминергических и ГАМКергических нейронов, которые сами тормозят быстрый сон (так называемые REM-off). У больных нарколепсией система МКГ остается нетронутой. В настоящее время разрушение содержащих МКГ нейронов рассматривается в качестве одной из возможных причин развития болезни Паркинсона.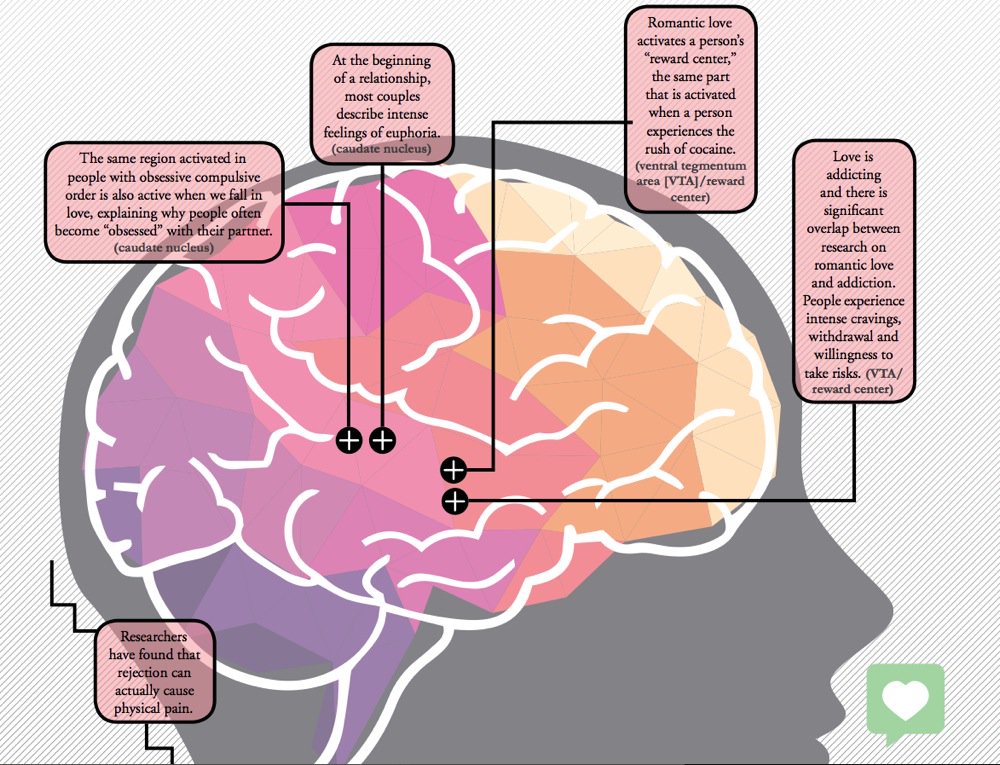 Считается, что система МКГ ответственна, в частности, за торможение механизмов пробуждения и регуляцию быстрого сна [12–14].
Считается, что система МКГ ответственна, в частности, за торможение механизмов пробуждения и регуляцию быстрого сна [12–14].
Орексинергическая система, наоборот, является одной из важнейших в регуляции бодрствования. До недавнего времени ее считали своеобразным «дирижером стройного оркестра» систем поддержания бодрствования головного мозга, первой скрипкой в котором является расположенная рядом и частично перекрывающаяся гистаминергическая система [1, 2, 15, 16]. Однако полученные за последние пять лет экспериментальные данные свидетельствуют в пользу предположения о том, что главную роль в системе регуляции цикла «сон – бодрствование» играет все же глутаматергическая arousal-система PC/PB, проецирующаяся непосредственно в базальной области, и реципрокная ей ГАМКергическая система парафациальной зоны [9, 10]. Именно поражение глутаматергической PC/PB системы ответственно за наиболее выраженные коматозные состояния как в экспериментальных, так и в клинических условиях. Тем не менее важность участия в процессах бодрствования орексинергической передачи не вызывает сомнений [13].
Тем не менее важность участия в процессах бодрствования орексинергической передачи не вызывает сомнений [13].
Орексиновые нейроны весьма активны в бодрствовании, особенно при ориентировочно-исследовательском поведении подопытных животных, очень слабо разряжаются в медленном и практически «молчат» в быстром сне. Введение орексина в желудочки мозга крыс дозозависимо удлиняет бодрствование и подавляет сон. Роль орексиновых нейронов в регуляции цикла «сон – бодрствование» заключается, видимо, в некоторой критически важной дополнительной активации пробуждающих систем головного мозга, их «подбуживании», «активации активаторов», которая придает надежность и устойчивость всей этой системе. Орексиновую нейронную сеть образно сравнивают с прижимающей пружиной (или давящим на кнопку пальцем), которой непременно снабжается всякий электрический переключатель – триггер, чтобы его контакты были всегда зафиксированы и кнопка произвольно не «болталась». Соответственно недостаточность орексиновой системы приводит к формированию нарколептического фенотипа со свойственными ему нарушениями строгой координации между механизмами бодрствования, медленного и быстрого сна, в то время как сами эти механизмы остаются неповрежденными [1, 7].
Вспоминая об исследовании К. фон Экономо, важно отметить появление новых случаев детской нарколепсии в Китае, Норвегии и некоторых других странах после пандемии вирусного гриппа H1N1 в 2009 г. Оказалось, что противогриппозная вакцина содержит фрагменты вируса, который запускает аутоиммунную реакцию, приводящую к апоптозу орексиновых нейронов [8].
Кроме проекций на кору и компоненты системы восходящей активации, орексиновые нейроны перифорникальной области латерального гипоталамуса посылают свои проекции и к «центру сна» вентролатеральной преоптической области. Однако, как уже отмечалось выше, «центр сна» не содержит орексиновых рецепторов. Следовательно, орексиновые нейроны латерального гипоталамуса активно участвуют в поддержании бодрствования, но не имеют реципрокных связей с ГАМКергическими нейронами вентролатеральной преоптической области и соответственно являются «внешними» по отношению к триггерному механизму сна – бодрствования.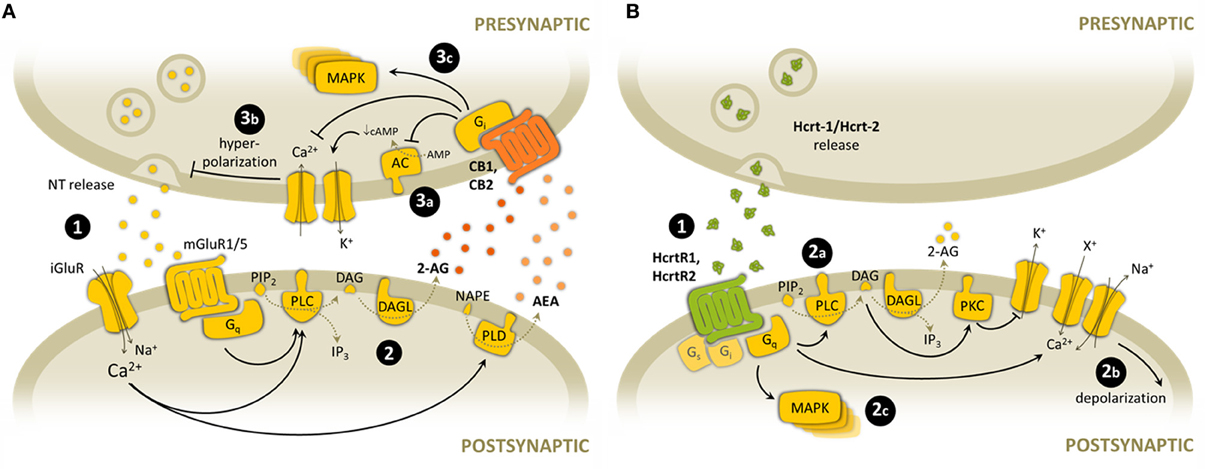 Именно такое положение орексиновой системы позволяет ей выполнять функцию стабилизатора поведенческих состояний, минимизируя переходы от бодрствования ко сну и обратно. В то время как у людей и животных с признаками нарколепсии число таких переходов резко увеличено. Несмотря на то что орексиновый «центр бодрствования» не управляет «центром сна» вентролатеральной преоптической области, последний проецируется на латеральный гипоталамус и тормозит орексиновые нейроны, не давая им разряжаться во сне [1, 7, 13].
Именно такое положение орексиновой системы позволяет ей выполнять функцию стабилизатора поведенческих состояний, минимизируя переходы от бодрствования ко сну и обратно. В то время как у людей и животных с признаками нарколепсии число таких переходов резко увеличено. Несмотря на то что орексиновый «центр бодрствования» не управляет «центром сна» вентролатеральной преоптической области, последний проецируется на латеральный гипоталамус и тормозит орексиновые нейроны, не давая им разряжаться во сне [1, 7, 13].
Орексиновые нейроны играют важнейшую роль в координации активности аминергических систем головного мозга, интегрируя поступающие циркадианно-оптические импульсы, с одной стороны, и нутриционно-метаболические – с другой. Максимальная частота разрядов орексиновых так же, как и аминергических, нейронов наблюдается в состоянии активного бодрствования, а минимальная (нулевая) – в быстром сне. Исключительно важны взаимосвязи между орексин/гипокретинергической и гистаминергической системами мозга, расположенными в туберомамиллярных ядрах заднего гипоталамуса. Наиболее мощные активирующие проекции на туберомамиллярные ядра исходят именно от содержащих орексин/гипокретин нейронов. Активация гистаминовых нейронов – одна из важнейших функций орексинергической системы. Это впервые было показано уже вскоре после открытия орексин/гипокретинергической системы, когда в опытах с непосредственным введением орексина в желудочки мозга крыс последующее повышение поведенческой активности исчезало, если блокировалась гистаминергическая передача. Кроме того, было установлено, что содержание гистамина в мозге мутантных собак-«нарколептиков» и ликворе больных нарколепсией отличается от нормы [17, 18].
Наиболее мощные активирующие проекции на туберомамиллярные ядра исходят именно от содержащих орексин/гипокретин нейронов. Активация гистаминовых нейронов – одна из важнейших функций орексинергической системы. Это впервые было показано уже вскоре после открытия орексин/гипокретинергической системы, когда в опытах с непосредственным введением орексина в желудочки мозга крыс последующее повышение поведенческой активности исчезало, если блокировалась гистаминергическая передача. Кроме того, было установлено, что содержание гистамина в мозге мутантных собак-«нарколептиков» и ликворе больных нарколепсией отличается от нормы [17, 18].
Оба медиатора – орексин и гистамин действуют синергично, играя уникальную роль в поддержании бодрствования. Орексин/гипокретинергические нейроны располагаются в заднелатеральном гипоталамусе и перифорникальной области, в непосредственной близости от гистаминергических нейронов туберомамиллярных ядер. Оба ядра частично перекрываются и образуют функциональное единство.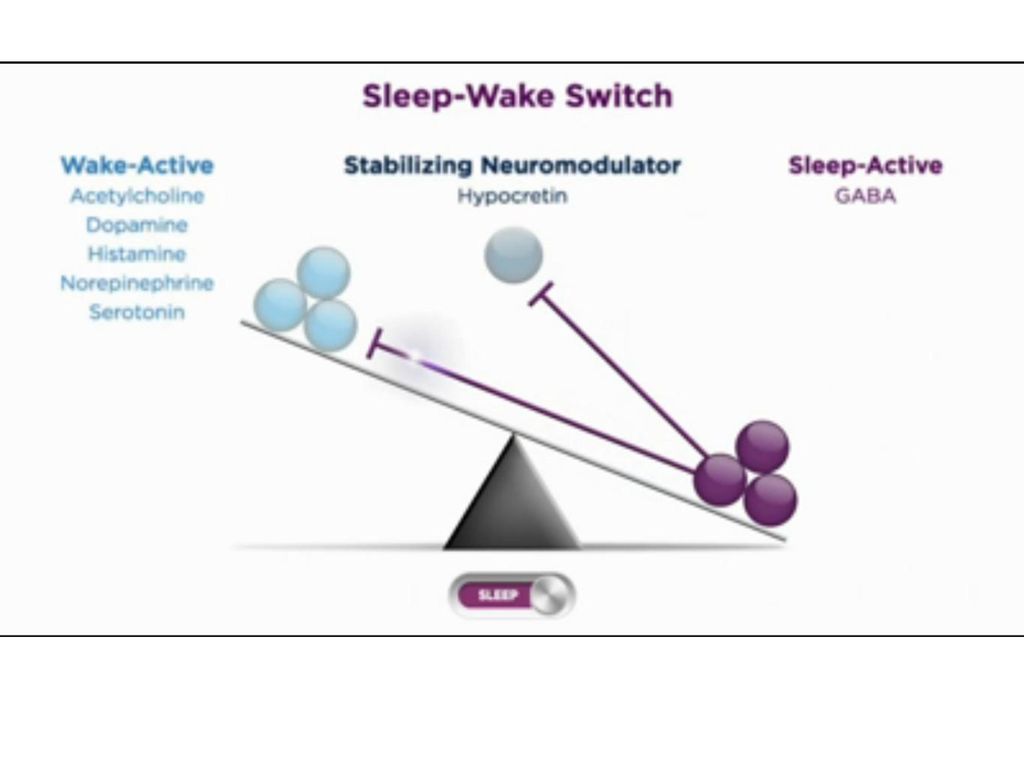 Оба орексина/гипокретина непосредственно возбуждают гистаминовые нейроны через рецепторы второго типа и активацию натрий-кальциевого ионного обмена. Орексин часто солокализуется с динорфином, который также может участвовать в возбуждении гистаминергических нейронов путем подавления ГАМКергического тормозного пути. Однако гистаминовые нейроны, по-видимому, не влияют непосредственно на возбудимость орексиновых нейронов, так что прямое взаимодействие этих двух систем носит односторонний характер. Подобно гистаминовым, орексиновые нейроны могут вовлекаться в реакцию пробуждения, вызываемую гиперкапнией: они активируются при кратковременной гипоксии и умеренном ацидозе [17, 18].
Оба орексина/гипокретина непосредственно возбуждают гистаминовые нейроны через рецепторы второго типа и активацию натрий-кальциевого ионного обмена. Орексин часто солокализуется с динорфином, который также может участвовать в возбуждении гистаминергических нейронов путем подавления ГАМКергического тормозного пути. Однако гистаминовые нейроны, по-видимому, не влияют непосредственно на возбудимость орексиновых нейронов, так что прямое взаимодействие этих двух систем носит односторонний характер. Подобно гистаминовым, орексиновые нейроны могут вовлекаться в реакцию пробуждения, вызываемую гиперкапнией: они активируются при кратковременной гипоксии и умеренном ацидозе [17, 18].
До недавнего времени считалось, что гистаминергическая система является нисходящей по отношению к орексинергической, которая ею управляет, используя мощные древовидные ветвления своих аксонов, проецирующихся на нейроны туберомамиллярных ядер. Однако недавние опыты показали, что фенотип гомозиготных мышей, нокаутных по гену гистидиндекарбоксилазы, ключевого фермента синтеза гистамина, лишь частично сходен с таковым у гомозиготных орексиннокаутных животных. Обе мутантные линии демонстрируют избыточную фрагментацию сна и увеличение представленности быстрого сна. Отличия заключаются в следующем:
Обе мутантные линии демонстрируют избыточную фрагментацию сна и увеличение представленности быстрого сна. Отличия заключаются в следующем:
у мышей, лишенных гистамина, повышенный процент быстрого сна наблюдается в светлый, менее активный период суток, а у мышей без орексина – в темный, более активный;
в отличие от мышей, лишенных гистамина, у животных, лишенных орексина, отсутствуют снижение бодрствования в «сумеречный» период (непосредственно предшествующий и следующий сразу за выключением света), нарушения на электроэнцефалограмме, они нормально реагируют увеличением бодрствования на помещение в новую обстановку;
у животных, лишенных орексина, в отличие от лишенных гистамина, имеют место нарколептоподобные приступы, а при помещении на вращающееся колесо у них отсутствует двигательная активность [17, 18].
Орексинергическая система, тесно связанная с гистаминовой, в большей степени ответственна за поведенческие проявления пробуждения и бодрствования, такие как мышечный тонус, постуральные и локомоторные функции, потребление пищи и эмоциональное реагирование. Орексиновая недостаточность у человека ведет к возникновению нарколептических приступов [17, 18].
Орексиновая недостаточность у человека ведет к возникновению нарколептических приступов [17, 18].
Скопления орексиновых нейронов перекрываются с меланинергической, гистаминергической и другими нейронными системами, поэтому только новейшие генно-инженерные методы позволяют проводить с ними избирательные манипуляции. Оказалось, что оптогенетическая активация орексиновых нейронов вызывает реакцию arousal, а их торможение методом DREDD (Designer Receptors Exclusively Activated by Designer Drugs) – сон. Это подтверждает ранее полученные традиционными методами данные об участии орексинергической системы в регуляции бодрствования. И вся совокупность данных за 18 лет, прошедших с момента открытия орексина: клинических (нарколепсия), нейроанатомических, электрофизиологических, фармакологических, нейрогенетических (мыши, нокаутные по гену препроорексина или по генам его рецепторов), DREDD/оптогенетических – не оставляет сомнений в справедливости гипотезы о роли орексиновых нейронов в регуляции бодрствования (восходящая активация) и мышечного тонуса (нисходящая активация) в качестве «активатора активаторов» [8, 19].
Если агонисты рецепторов орексина вызывают пробуждение и бодрствование, то антагонисты, как и следует ожидать, – сон. Однако относительная роль каждого из рецепторов остается неясной. Так, мыши, нокаутные по рецептору орексина 1, не демонстрируют нарколептико-катаплектического фенотипа. Вместе с тем у мышей, нокаутных по обоим рецепторам орексина, симптомы нарколепсии/катаплексии более выражены, чем у мышей, нокаутных по гену рецептора орексина 2. Поскольку приступы нарколепсии/катаплексии провоцируются эмоциональным возбуждением, очевидно участие в этих процессах также и нейронных систем миндалины. И действительно, эксперименты с орексиннокаутными мышами показали, что эксайтотоксическое разрушение миндалины у них снижает частоту и выраженность катаплектических припадков [8].
Интересно, что орексиновая система – это эволюционно древняя система активации. Она присутствует в головном мозге холоднокровных позвоночных, у которых никаких признаков быстрого сна, как известно, не наблюдается. Однако и у рыбки-зебры, нокаутной по гену препроорексина, отмечается «нарколептический» фенотип. Он проявляется в виде учащенных переходов из состояния активности в состояние покоя и обратно, а это является одним из симптомов этого заболевания и у человека. Соответственно гиперэкспрессия гена препроорексина у рыбки-зебры вызывает удлинение и учащение периодов активности и подавляет состояние покоя. У человека, как теперь хорошо известно, пониженный уровень орексина 1 в ликворе коррелирует с выраженностью нарколептической симптоматики и признан важнейшим диагностическим критерием [8].
Однако и у рыбки-зебры, нокаутной по гену препроорексина, отмечается «нарколептический» фенотип. Он проявляется в виде учащенных переходов из состояния активности в состояние покоя и обратно, а это является одним из симптомов этого заболевания и у человека. Соответственно гиперэкспрессия гена препроорексина у рыбки-зебры вызывает удлинение и учащение периодов активности и подавляет состояние покоя. У человека, как теперь хорошо известно, пониженный уровень орексина 1 в ликворе коррелирует с выраженностью нарколептической симптоматики и признан важнейшим диагностическим критерием [8].
Несмотря на то что орексин не проникает через гематоэнцефалический барьер, интраназальное введение орексина 1 весьма эффективно для лечения нарколепсии с катаплексией. Суворексант – мощный селективный антагонист обоих рецепторов орексина – разрешен к применению в США как эффективное, безопасное и хорошо переносимое снотворное. В отличие от большинства традиционных снотворных, действие которых основано на активации тем или иным способом ГАМКергической системы, во сне, возникающем под действием суворексанта, значительную долю занимает быстрая фаза. Сейчас ряд исследовательских лабораторий проводит эксперименты с селективными антагонистами рецептора орексина 2. Предполагается, что такие вещества продемонстрируют не меньшую эффективность в борьбе с инсомнией, чем антагонисты обоих рецепторов. При этом они будут вызывать структурно более «естественный» сон и, таким образом, окажутся предпочтительными в лечении первичной инсомнии и коморбидных расстройств. При панических расстройствах отмечен повышенный уровень обоих орексинов, а антагонисты их рецепторов эффективно устраняют резкие скачки артериального давления на крысиной модели панических атак. Таким образом, кроме лечения инсомнии орексиновые антагонисты могут быть также использованы для борьбы с такими эмоциональными расстройствами, как посттравматический стресс, тревожность и панические атаки [8]. В целом, избыточная активность орексин/гипокретинергической системы связана с бессонницей и панической тревожностью, а недостаточная – с нарколепсией, болезнями Альцгеймера и Паркинсона и ожирением [20].
Сейчас ряд исследовательских лабораторий проводит эксперименты с селективными антагонистами рецептора орексина 2. Предполагается, что такие вещества продемонстрируют не меньшую эффективность в борьбе с инсомнией, чем антагонисты обоих рецепторов. При этом они будут вызывать структурно более «естественный» сон и, таким образом, окажутся предпочтительными в лечении первичной инсомнии и коморбидных расстройств. При панических расстройствах отмечен повышенный уровень обоих орексинов, а антагонисты их рецепторов эффективно устраняют резкие скачки артериального давления на крысиной модели панических атак. Таким образом, кроме лечения инсомнии орексиновые антагонисты могут быть также использованы для борьбы с такими эмоциональными расстройствами, как посттравматический стресс, тревожность и панические атаки [8]. В целом, избыточная активность орексин/гипокретинергической системы связана с бессонницей и панической тревожностью, а недостаточная – с нарколепсией, болезнями Альцгеймера и Паркинсона и ожирением [20].
Как уже говорилось, нисходящие орексинергические проекции играют ключевую роль в возникновении катаплектических приступов при нарколепсии. Как видно из рисунка 7А, существуют несколько проводящих путей, которые при нормальном бодрствовании исключают возможность возникновения атонии [21]. Орексин/гипокретиновые нейроны активны во время бодрствования и помогают поддерживать нормальный мышечный тонус путем возбуждения ГАМКергических нейронов в области вентролатерального околоводопроводного серого вещества/латеральной части покрышки моста, норадренергических нейронов NA/LC, серотонинергических нейронов 5-HT/DR и мотонейронов. Кроме этого, они блокируют активность ГАМКергических нейронов субдорсолатерального ядра. На рисунке 7B показано, что происходит при нарколепсии, когда орексин/гипокретиновые нейроны разрушены. В этом случае сильные положительные эмоции вызывают усиление амигдалярного и холинергического притоков, которые возбуждают ГАМКергические нейроны субдорсолатерального ядра и тормозят ГАМКергические нейроны вентролатерального околоводопроводного серого вещества/латеральной части покрышки моста. Тогда субдорсолатеральное ядро возбуждает нейроны в медиальной части продолговатого мозга и спинном мозге, которые сильно гиперполяризуют мотонейроны, что и приводит к катаплексии. Иными словами, в норме мощная активность орексин/гипокретиновой системы, а также постоянный нисходящий моноаминергический приток импульсов на каудальную область моста, продолговатый мозг и непосредственно мотонейроны спинного мозга, поддерживаемый все той же орексинергической импульсацией, противодействуют возникновению атонии. Однако в отсутствие орексина/гипокретина этот активирующий поток импульсов исчезает, что приводит к возникновению приступов катаплексии [21].
Тогда субдорсолатеральное ядро возбуждает нейроны в медиальной части продолговатого мозга и спинном мозге, которые сильно гиперполяризуют мотонейроны, что и приводит к катаплексии. Иными словами, в норме мощная активность орексин/гипокретиновой системы, а также постоянный нисходящий моноаминергический приток импульсов на каудальную область моста, продолговатый мозг и непосредственно мотонейроны спинного мозга, поддерживаемый все той же орексинергической импульсацией, противодействуют возникновению атонии. Однако в отсутствие орексина/гипокретина этот активирующий поток импульсов исчезает, что приводит к возникновению приступов катаплексии [21].
Участие орексина в эмоциональных реакциях связано с его воздействием на дофаминовую систему. Специальные исследования показали, что при аппликации на дофаминергическую область вентральной покрышки орексин усиливает реакцию поощрения, блокируя выброс динорфина, с которым он солокализуется в одних и тех же везикулах. А на мышиной модели, нокаутной по генам обоих орексиновых рецепторов, каталептоподобные приступы устраняются при селективном восстановлении этих рецепторов на серотонинергических нейронах дорзальных ядер шва. Аналогичным образом избирательная активация этих нейронов хемогенетическим методом устраняет нарколептический фенотип, демонстрируемый мышами без орексиновых нейронов [22].
Аналогичным образом избирательная активация этих нейронов хемогенетическим методом устраняет нарколептический фенотип, демонстрируемый мышами без орексиновых нейронов [22].
Норадренергическая область синего пятна (locus coeruleus – LC) получает наиболее насыщенные афференты из гипоталамуса. Манипулируя активацией и торможением нейронов этой области с помощью оптогенетических методов, можно управлять состоянием и уровнем бодрствования подопытной мыши in vivo. Это подтверждает, что стабилизация бодрствования является одной из важнейших функций орексиновой системы, а норадренергическая система синего пятна – ее главный эфферент. Показано, что одновременное торможение норадренергических нейронов синего пятна и активация орексиновых нейронов снижают количество переходов от сна к бодрствованию, которое возрастает при активации последних. Наоборот, повышение возбудимости нейронов синего пятна снижает латентность бодрствования, вызванного оптогенетической стимуляцией орексиновых нейронов. Эти опыты с оптогенетическим манипулированием нейронами Orx/LH и NA/LC подтверждают, что система Orx/LH→NA/LC критически важна в тонкой настройке регуляции переходов от сна к бодрствованию и обратно. Недавно было показано, что длительная оптогенетическая активация орексиновых нейронов повышает активность оси «гипоталамус – гипофиз – кора надпочечников» и вызывает стрессорное поведение. Эти данные говорят о том, что орексиновые нейроны участвуют и в регуляции выброса кортикостерона, и их активность в ответ на стресс модулируется периферическими метаболическими сигналами. Стало ясно, что нейронные системы 5-HT/DR и NA/LC демонстрируют различные стороны нарколептического синдрома [22].
Эти опыты с оптогенетическим манипулированием нейронами Orx/LH и NA/LC подтверждают, что система Orx/LH→NA/LC критически важна в тонкой настройке регуляции переходов от сна к бодрствованию и обратно. Недавно было показано, что длительная оптогенетическая активация орексиновых нейронов повышает активность оси «гипоталамус – гипофиз – кора надпочечников» и вызывает стрессорное поведение. Эти данные говорят о том, что орексиновые нейроны участвуют и в регуляции выброса кортикостерона, и их активность в ответ на стресс модулируется периферическими метаболическими сигналами. Стало ясно, что нейронные системы 5-HT/DR и NA/LC демонстрируют различные стороны нарколептического синдрома [22].
Можно заключить, что орексинергические нейроны интегрируют метаболические, эмоциональные и циркадианные сигналы для «подгонки» уровня бодрствования под текущие факторы внешней среды. Возможно, что именно орексин – это ключевой фактор реализации известного в экспериментальной психологии
закона Йеркса – Додсона. В соответствии с этим законом для успешного взаимодействия с окружающей средой животному (и человеку) необходим некий оптимальный уровень эмоционально-мотивационного возбуждения (бодрствования). Как снижение, так и чрезмерное повышение уровня бодрствования приводит к ухудшению поведенческих и когнитивных процессов [22].
В соответствии с этим законом для успешного взаимодействия с окружающей средой животному (и человеку) необходим некий оптимальный уровень эмоционально-мотивационного возбуждения (бодрствования). Как снижение, так и чрезмерное повышение уровня бодрствования приводит к ухудшению поведенческих и когнитивных процессов [22].
» Почему плохой сон усиливает атеросклероз
Почему плохой сон усиливает атеросклероз
Недостаток сна заставляет костный мозг производить больше лейкоцитов, которые ускоряют образование атеросклеротических бляшек в сосудах.Атеросклеротические бляшки, которые появляются на внутренних стенках кровеносных сосудов, состоят не только из жиров-липидов. В формировании бляшек участвуют и белки соединительной ткани, и клетки сосудистой стенки, и, что особенно важно, иммунные клетки – они стараются поглотить избыток липидов и разный клеточный мусор, но с задачей этой справиться не могут, и в конце концов начинают выделять воспалительные сигналы. А воспаление, в свою очередь, стимулирует дальнейшее разрастание бляшки.
А воспаление, в свою очередь, стимулирует дальнейшее разрастание бляшки.
Филип Свирски (Filip K. Swirski) и его коллеги экспериментировали с мышами: животным не давали спать, регулярно толкая их палочкой, которая двигалась над полом клетки – мыши постоянно должны были просыпаться и перешагивать через неё. Хотя все подопытные мыши изначально были предрасположены к атеросклерозу, у тех, которым пришлось спать урывками, дела с сосудами обстояли хуже, чем у тех, которые спали нормально. Одновременно у них активнее образовывались лейкоциты в костном мозге, а в крови было особенно много двух видов лейкоцитов – моноцитов и нейтрофилов.
Оказалось, что у мышей, которым спать не давали, в гипоталамусе образуется мало белка гипокретина (или орексина). Гипокретин регулирует, во-первых, аппетит и энергетический баланс, а во-вторых – сон: он заставляет больше есть и помогает бодрствовать. Если гипокретина в гипоталамусе синтезируется мало, то мозг начинает клонить в сон; известно, что неполадки с гипокретином нередко приводят к нарколепсии.
Если гипокретина в гипоталамусе синтезируется мало, то мозг начинает клонить в сон; известно, что неполадки с гипокретином нередко приводят к нарколепсии.
Дальнейшие эксперименты показали, что если у мышей отключить синтез гипокретина, у них тоже будет появляться много лейкоцитов и будет усиливаться атеросклероз – как у тех мышей, которым не давали спать. Но почему у животных, которым не давали спать, гипокретина оказывалось мало? Потому, что нейроны, которые его синтезировали, не справлялись с таким режимом и из-за перегрузки переставали его синтезировать. Стволовые клетки в костном мозге, из которых должны получаться лейкоциты, чувствовали, что гипокретина становится мало (у этих клеток есть к нему специальные рецепторы), и в ответ начинали активно производить нейтрофилы с моноцитами. А те, в свою очередь, выйдя в кровоток, включались в атеросклеротический процесс: чем больше становилось лейкоцитов в крови, тем активнее росли атеросклеротические бляшки.
Скорее всего, это не единственный механизм, который связывает сон, иммунитет и атеросклероз.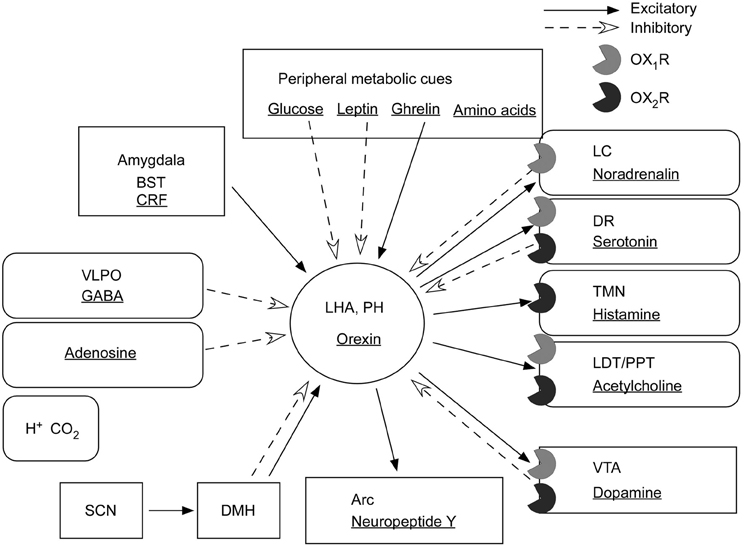 Некоторые результаты, полученные исследователями, говорят о том, что тут задействованы ещё какие-то метаболические реакции (не будем забывать, что гипокретин управляет и энергетическим балансом) с участием других гормонов. В то же время некоторые белки из клеток костного мозга могут непосредственно влиять на состояние сосудов и тех уже зрелых иммунных клеток, которые находятся в сосудистой стенке. Но в любом случае, если думать о каких-то новых антиатеросклеротических средствах, то такие средства, вероятно, должны как-то учитывать иммунную связь между плохим сном и атеросклерозом.
Некоторые результаты, полученные исследователями, говорят о том, что тут задействованы ещё какие-то метаболические реакции (не будем забывать, что гипокретин управляет и энергетическим балансом) с участием других гормонов. В то же время некоторые белки из клеток костного мозга могут непосредственно влиять на состояние сосудов и тех уже зрелых иммунных клеток, которые находятся в сосудистой стенке. Но в любом случае, если думать о каких-то новых антиатеросклеротических средствах, то такие средства, вероятно, должны как-то учитывать иммунную связь между плохим сном и атеросклерозом.
Иммунитет вгоняет в сон | Наука и жизнь
Нарколепсия развивается из-за аутоиммунной атаки на нейроны, управляющие сном и бодрствованием.
Человеческий Т-лимфоцит. (Фото NASA’s Marshall Space Flight Center / Flickr.com)‹
›
Нарколепсией называют приступы дневной сонливости, но не просто сонливости – у кого ее нет! – а непреодолимой. Это значит, что можно просто внезапно заснуть посередине дня, как ни старайся оставаться бодрствующим (а вот ночной сон при нарколепсии ухудшается).
Это значит, что можно просто внезапно заснуть посередине дня, как ни старайся оставаться бодрствующим (а вот ночной сон при нарколепсии ухудшается).
Различают нарколепсию 2, когда есть просто дневная сонливость, и нарколепсию 1, в которую прогрессирует нарколепсия 2, когда к сонливости добавляется катаплексия – внезапная утрата мышечного тонуса при ясном сознании, так что человек буквально валится с ног.
Причины нарколепсии во многом остаются загадочными. Известно, что тут большую роль играют нейроны гипоталамуса, вырабатывающие белки гипокретины, или орексины. Самые известные их функции – во-первых, регуляция аппетита и энергетического баланса и, во-вторых, регуляция сна.
Эксперименты с животными показали, что если гипокретинов в мозге мало, или же они по каким-то причинам плохо работают, то это приводит к симптомам, похожим на человеческую нарколепсию. Также известно, что у людей с нарколепсией 1 в мозге оказывается очень мало нервных клеток, синтезирующих гипокретины. По их уровню в спинномозговой жидкости можно наглядно увидеть, как уменьшается число гипокретин-синтезирующих нейронов в мозге.
По их уровню в спинномозговой жидкости можно наглядно увидеть, как уменьшается число гипокретин-синтезирующих нейронов в мозге.
Но отчего их становится мало? Генетические исследования говорят о том, что в развитии нарколепсии замешаны иммунные гены. В частности, это те гены, которые порой становятся причиной аутоиммунных процессов. Мы знаем, что иммунные клетки отличают своих от чужих по молекулярному портрету. Во всех клетках есть особые белки, которые, если в клетку проникла бактерия или же клетка вообще стала больной, вытаскивают наружу молекулы (точнее, их фрагменты), которые указывают на патологию, и показывают их иммунитету. Эти демонстрирующие болезнь белки называются HLA. Но бывает так, что сами HLA начинают работать как-то не так и вытаскивают на показ совершенно нормальные клеточные белки. Их «видят» Т-клетки, и, поскольку они считают за опасность все, что им показывают, начинают атаку против совершенно нормальных, здоровых тканей.
Так вот, со временем удалось обнаружить, что в геноме подавляющего числа больных нарколепсией есть одна из дефектных версий гена HLA, хотя и у людей без нарколепсии этот дефектный ген тоже встречается.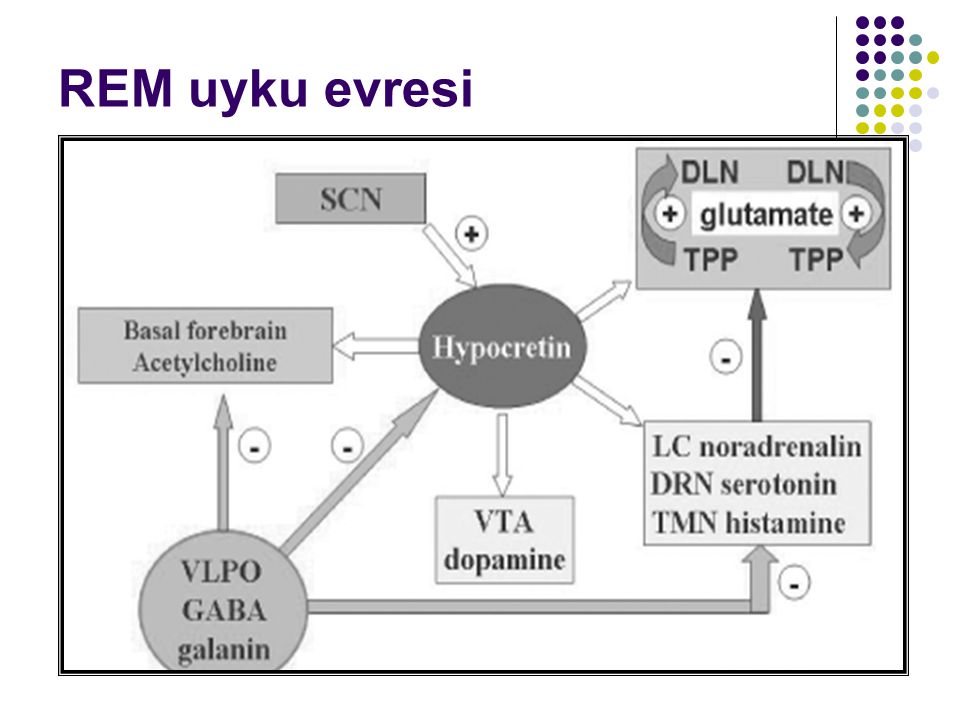 Кроме того, у больных нарколепсией в крови можно заметить антитела против белков нервных клеток, что указывает на аутоиммунную реакцию иммунитета против собственных нейронов.
Кроме того, у больных нарколепсией в крови можно заметить антитела против белков нервных клеток, что указывает на аутоиммунную реакцию иммунитета против собственных нейронов.
В статье в Nature исследователи из Университета Лугано и Швейцарской высшей технической школы Цюриха пишут, что у нарколептиков в крови также можно найти Т-клетки, которые настроены помнить молекулы гипокретинов, и если показать этим Т-клеткам гипокретин, то они ответят молекулярными сигналами, мобилизующими иммунитет на борьбу с опасностью.
Притом у людей, у которых есть дефектный ген HLA, но у которых нет нарколепсии, иммунитет относится к гипокретинам и фрагментам их молекул довольно спокойно. То есть нарколепсия возникает действительно из-за проблем с иммунитетом, а именно с Т-клетками, которые либо обращают, либо не обращают внимания на то, что им показывают HLA-белки. И если Т-клетки обращают внимание, то они начинают истреблять нейроны, синтезирующие гипокретины.
Правда, дальнейшие эксперименты несколько запутали картину. У HLA-белков, которые демонстрируют опасные молекулы Т-клеткам, есть разные разновидности. Оказалось, что реакция Т-клеток на гипокретины зависит не столько от той разновидности HLA, у которой есть дефект, сколько от другой разновидности HLA.
Вполне возможно, что поначалу Т-клетки «видят» гипокретины с помощью одних HLA, а последующее развитие иммунного ответа идет уже с помощью других HLA. Кроме того, когда мы говорим «Т-клетки», то нужно понимать, что их тоже существует масса видов. И новые данные позволяют предполагать, что собственно гибель гипокретиновых нейронов зависит не от тех Т-лимфоцитов, которые непосредственно «видят» гипокретиновые молекулы, а от других, которые гипокретины не «видят», но зато «видят» другие белки, характерные для нервных клеток.
Вырисовывается довольно сложная картина, в которой неправильный сигнал к атаке передается от одних лимфоцитов к другим; впрочем, подобные сложности в иммунитете – обычное дело. Разбираться в них так или иначе придется, если мы хотим найти способ победить нарколепсию, от которой, по статистике, страдает один человек из каждых двух тысяч.
Разбираться в них так или иначе придется, если мы хотим найти способ победить нарколепсию, от которой, по статистике, страдает один человек из каждых двух тысяч.
Как ненормированный сон влияет на сердце и сосуды — Российская газета
Доказано: причина 31% всех смертей в мире — сердечно-сосудистые заболевания. Известно, что развиваются они при неправильном питании, курении, недостатке физической активности и неправильном режиме сна. Известно и то, как потребляемая пища, никотин, сидячий образ жизни отражаются на сердце и сосудах. А вот влияние ненормированного режима сна до сих пор оставалось загадкой. Ее-то и решили разгадать исследователи из Гарварда.
Ученые захотели понять, как недостаточный сон приводит к развитию атеросклероза. При этом недуге в артериях человека образуются жировые бляшки, препятствующие свободному кровотоку. Что приводит к уменьшению эластичности сосудов, их воспалению. Потом возникают более серьезные проблемы: приступы и инсульт.
Все начинается с неправильной работы гипоталамуса — области мозга, отвечающей за регуляцию сна и вырабатывающей белок гипокретин
Специалистам удалось выявить неожиданную химическую реакцию, связывающую плохой сон с сердечными заболеваниями. Ученые провели эксперимент на мышах, которых перевели на диету с большим содержанием жиров. Мышей разделили на две группы, в одной из них разрешался сон, а в другой — нет. Исследователи заметили: у сонных мышей жировые бляшки в сосудах образуются гораздо быстрее и с большей интенсивностью. Химические процессы, которые приводят к ускоренному засорению сосудов, выявили чуть позже.
Ученые провели эксперимент на мышах, которых перевели на диету с большим содержанием жиров. Мышей разделили на две группы, в одной из них разрешался сон, а в другой — нет. Исследователи заметили: у сонных мышей жировые бляшки в сосудах образуются гораздо быстрее и с большей интенсивностью. Химические процессы, которые приводят к ускоренному засорению сосудов, выявили чуть позже.
По мнению медиков, все начинается с неправильной работы гипоталамуса — области мозга, отвечающей за регуляцию сна и вырабатывающей белок гипокретин. Недостаточный сон приводит к недостатку этого белка. А это увеличивает количество гормона под названием колониестимулирующий фактор, ускоряющего производство лейкоцитов. Лейкоциты же приводят к образованию бляшек в сосудах и, следовательно, к заболеваниям.
Вот такая цепная зависимость. Даже сами исследователи были удивлены столь большой ролью гипокретинов в возникновении смертельных сердечных заболеваний. Ради интереса они дали мышам добавки с гипокретинами, и их состояние здоровья заметно улучшилось. Конечно, это может не сработать в случае с людьми, но ученые намерены провести еще несколько исследований и дать точный ответ. Подождем? Но одно уже очевидно: надо спать крепко, надо высыпаться. Бессонница, нарушение ритма сна всегда мучительно. И потому… спокойной ночи.
Конечно, это может не сработать в случае с людьми, но ученые намерены провести еще несколько исследований и дать точный ответ. Подождем? Но одно уже очевидно: надо спать крепко, надо высыпаться. Бессонница, нарушение ритма сна всегда мучительно. И потому… спокойной ночи.
Комментарий к нейробиологии системы гипокретин / орексин — Neuropsychopharmacology
Предметы
Аннотация
Гипокретины / орексины быстро становятся функционально важными нейротрансмиттерами. В настоящее время известны два родственных нейропептида (Hcrt-1 / OXA, Hcrt-2 / OXB), кодируемые одним и тем же геном-предшественником, и двумя рецепторами, связанными с G-белком (Hcrtr1 / OXR1, Hcrtr2 / OXR2). Гипокретинсодержащие клетки локализованы дискретно в периферическом гипоталамусе, но имеют широко распространенные проекции с обычно возбуждающими постсинаптическими эффектами. Сообщалось о плотных возбуждающих проекциях для всех групп моноаминергических клеток. Главной новой функцией этой системы, вероятно, будет регуляция сна. Изменения в нейротрансмиссии гипокретина вызывают нарколепсию сна у мышей, собак и людей. Влияние на аппетит, нейроэндокринную и энергетическую регуляцию метаболизма также предполагают другие исследования. Гипокретины имеют уникальную возможность связать сон, аппетит и нейроэндокринный контроль, три вида поведения, имеющих важнейшее значение в психиатрии. Обсуждается потенциальная роль этой системы в регулировании цикла сна, модуляции бодрствования в определенные циркадные времена и в опосредовании вредных последствий лишения сна.
Изменения в нейротрансмиссии гипокретина вызывают нарколепсию сна у мышей, собак и людей. Влияние на аппетит, нейроэндокринную и энергетическую регуляцию метаболизма также предполагают другие исследования. Гипокретины имеют уникальную возможность связать сон, аппетит и нейроэндокринный контроль, три вида поведения, имеющих важнейшее значение в психиатрии. Обсуждается потенциальная роль этой системы в регулировании цикла сна, модуляции бодрствования в определенные циркадные времена и в опосредовании вредных последствий лишения сна.
Главный
Редко в истории медицины научные открытия так быстро переходили от сообщения о системе нейротрансмиттеров к патофизиологии заболеваний (Mignot 2001). В 1998 году две группы независимо друг от друга идентифицировали одну и ту же нейропептидную систему и назвали молекулы «гипокретины» и «орексины» соответственно (de Lecea et al. 1998; Sakurai et al. 1998). Одним из наиболее ярких результатов этих первоначальных исследований была дискретная локализация гипокретинсодержащих клеток в очень дискретной области латерального гипоталамуса. Это привело к тому, что одна группа назвала эту пептидную систему «гипокретин», термин, полученный из гипоталамуса и кретина (слабая и оспариваемая гомология с секретином была отмечена этими авторами). Установленная роль периферического региона в регуляции аппетита вместе с наблюдением, что внутрицеребровентрикулярные инъекции пептидов вызывали потребление пищи у крыс, заставили другую группу использовать термин «орексин» (orexis = аппетит) для этой системы.
Это привело к тому, что одна группа назвала эту пептидную систему «гипокретин», термин, полученный из гипоталамуса и кретина (слабая и оспариваемая гомология с секретином была отмечена этими авторами). Установленная роль периферического региона в регуляции аппетита вместе с наблюдением, что внутрицеребровентрикулярные инъекции пептидов вызывали потребление пищи у крыс, заставили другую группу использовать термин «орексин» (orexis = аппетит) для этой системы.
Открытие в 1999 году, что нарколепсия у собак была вызвана мутациями в гене Hypocretin рецептор 2 (Hcrtr2), смещает акцент исследования с контроля аппетита на регуляцию сна (Lin et al. 1999). За этим открытием последовало наблюдение, что мыши, нокаутированные по гипокретину, имеют нарушения сна и поведения, напоминающие нарколепсию (Chemelli et al. 1999). Другие исследования показали плотные прогнозы для всех групп моноаминергических клеток и стимулирующие бодрствование эффекты гипокретинов при центральном введении (Hagan et al. 1999). Совсем недавно клинические исследования показали, что большинство пациентов с нарколепсией имеют неопределяемые гипокретины в CSF (Nishino et al. 2000) и поразительное снижение иммунореактивности гипокретина и уровней транскрипта в периферическом гипоталамусе (Peyron et al. 2000; Thannickal et al. 2000). В настоящее время известно, что наиболее частой причиной нарколепсии у человека является дефицит гипокретина, скорее всего, в результате аутоиммунной атаки на клетки, содержащие гипокретин. В этом комментарии я кратко расскажу о современных знаниях, касающихся этой системы, расскажу о ее возможной функции в регуляции сна и расскажу о потенциальной важности этой системы для нейропсихиатрии.
1999). Совсем недавно клинические исследования показали, что большинство пациентов с нарколепсией имеют неопределяемые гипокретины в CSF (Nishino et al. 2000) и поразительное снижение иммунореактивности гипокретина и уровней транскрипта в периферическом гипоталамусе (Peyron et al. 2000; Thannickal et al. 2000). В настоящее время известно, что наиболее частой причиной нарколепсии у человека является дефицит гипокретина, скорее всего, в результате аутоиммунной атаки на клетки, содержащие гипокретин. В этом комментарии я кратко расскажу о современных знаниях, касающихся этой системы, расскажу о ее возможной функции в регуляции сна и расскажу о потенциальной важности этой системы для нейропсихиатрии.
ГИПОКРЕТИН / ОРЕКСИНЫ: НЕЙРОНАТОМИЯ И РЕЦЕПТОРНЫЕ СИСТЕМЫ
Описание этой системы было объектом многочисленных недавних обзоров (Kilduff and Peyron 2000; Sutcliffe и de Lecea 2000; Hungs and Mignot 2001; Overeem et al. 2001; Willie et al. 2001) и будет только кратко изложено. Описаны два биологически активных пептида, кодируемых одним геном-предшественником с двумя экзонами, локусом препрогипокретина (Hcrt).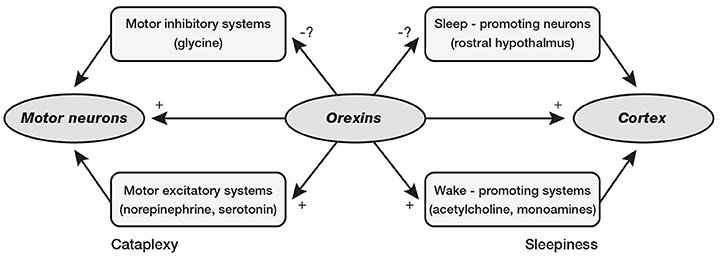 Ген-предшественник содержит последовательность сигнального пептида, за которым следует первый активный пептид, гипокретин-1 (или орексин-А), второй активный пептид, гипокретин-2 (или орексин-В) и С-концевой участок неизвестной биологической активности., Эндопептидное расщепление происходит в типичных последовательностях двухосновных остатков, расположенных между пептидами гипокретина и на С-конце последовательности гипокретина-2. Области гипокретина-1 и гипокретина-2, но не С-концевой участок предшественника, сохраняются у разных видов, что указывает на биологическую важность. И гипокретин-1, и гипокретин-2 являются С-концевыми амидированными, что важно для биологической активности и связывания рецепторов. Известно также, что гипокретин-1 трансамидируется в N-концевой области с образованием циклического пироглутамильного остатка и имеет две дисульфидные связи. Эти признаки могут объяснить более высокую активность гипокретина-1 в большинстве фармакологических экспериментов, которые, как обычно полагают, обусловлены лучшей стабильностью in vivo .
Ген-предшественник содержит последовательность сигнального пептида, за которым следует первый активный пептид, гипокретин-1 (или орексин-А), второй активный пептид, гипокретин-2 (или орексин-В) и С-концевой участок неизвестной биологической активности., Эндопептидное расщепление происходит в типичных последовательностях двухосновных остатков, расположенных между пептидами гипокретина и на С-конце последовательности гипокретина-2. Области гипокретина-1 и гипокретина-2, но не С-концевой участок предшественника, сохраняются у разных видов, что указывает на биологическую важность. И гипокретин-1, и гипокретин-2 являются С-концевыми амидированными, что важно для биологической активности и связывания рецепторов. Известно также, что гипокретин-1 трансамидируется в N-концевой области с образованием циклического пироглутамильного остатка и имеет две дисульфидные связи. Эти признаки могут объяснить более высокую активность гипокретина-1 в большинстве фармакологических экспериментов, которые, как обычно полагают, обусловлены лучшей стабильностью in vivo .
Нейроанатомические исследования показывают, что, хотя все гипокретинсодержащие клетки дискретно расположены в гипоталамусе, проекции широко распространены и включают не только гипоталамус, но также кору, базальный передний мозг, различные лимбические структуры, таламус, большую часть ствола головного мозга и спинного мозга. Удивительно плотные проекции с прямым синаптическим контактом наблюдались в locus coeruleus и во всех группах моноаминергических клеток. Два рецептора, Hcrtr1 (или OX1R) и Hcrtr2 (OX2R), известны на сегодняшний день для этой системы. Оба являются рецепторами, связанными с 7-трансмембранным G-белком, кодируемыми семью экзонами. Два рецептора имеют высокую гомологию друг с другом и являются более отдаленными родственниками нейропептидного Y-рецептора Y2. Неожиданно Hcrtr1 обладает в 10–100 раз большей аффинностью к гипокретину-1 по сравнению с гипокретином-2, в то время как Hcrtr2 связывает оба нейропептида с одинаковой аффинностью. Одной из наиболее интересных особенностей этой двухрецепторной системы является дифференциальное нейроанатомическое распределение Hcrtr1 и Hcrtr2, которое лучше всего изложено в Marcus et al. (2001). Наиболее поразительно, что норадренергический локус coeruleus плотно упакован Hcrtr1, но не содержит Hcrtr2, в то время как гистаминергическое туберомамиллярное ядро содержит Hcrtr2, но не рецепторы Hcrtr1. Серотонинергический шлейф магнуса и дофаминергический вентральный сегментарный участок и черная субстанция содержат оба подтипа рецепторов.
Последующие молекулярные пути, опосредующие функцию рецептора гипокретина, все еще не определены. Во всех прямых электрофизиологических экспериментах, о которых сообщалось до настоящего времени, гипокретины являются высоко возбуждающими пептидами. Это особенно хорошо известно в locus coeruleus, структуре с Hcrtr1 (Hagan et al. 1999; Sutcliffe and de Lecea 2000). О подобных возбуждающих эффектах сообщалось на ядре шва, черной субстанции и туберомамиллярном ядре (Hungs and Mignot 2001; Haas, личное сообщение). In vitro и Hcrtr1, и Hcrtr2 могут связываться с Gq и мобилизовать внутриклеточный кальций. Таким образом, большинство исследователей теперь считают, что Hcrtr1 является возбуждающим во всех случаях, в то время как дело до сих пор обсуждается для Hcrtr2. Действительно, недавние эксперименты показывают, что Hcrtr2 может в некоторых случаях связываться с Gq или Go / Gi. Используя изолированные POMC-нейроны и флюоресцентную визуализацию fura-2, Yada et al. Показали снижение внутриклеточного кальция после применения гипокретина-1 и гипокретина-2, эффект, блокируемый токсином коклюша (Yada, личное сообщение). Другие авторы также предположили существование ингибирующих ауторецепторов Hcrtr2 на гипокретиновых нейронах с использованием аналогичных методов. Обнаружение того, что нейроны туберомамиллярного ядра сильно возбуждаются гипокретином (Haas, личное сообщение), указывает на возможные возбуждающие эффекты Hcrtr2, по крайней мере, на передачу гистаминергического белка.
Дифференциальная экспрессия Hcrtr1 по сравнению с Hcrtr2 может объяснить первичную роль Hcrtr2 в опосредовании фенотипа нарколепсии у собак с нарколепсией. Мыши, нокаутированные по рецептору гипокретина, были созданы и изучены. В соответствии с данными, полученными на собаках, у животных с Hcrtr2 — / — было показано, что эпизоды поведенческой остановки напоминают катаплексию и / или наступление быстрого сна. Интересно, однако, что Hcrtr2 — / — были менее поражены, чем животные, нокаутированные по лиганду гипокретина (Tokita et al. 2001). Кроме того, было обнаружено, что животные с мутацией Hcrtr1 — / — имеют легкие нарушения сна, но не имеют поведенческих эпизодов остановки (Kisanuki et al. 2000). Это указывает на то, что Hcrtr1 является сильным модифицирующим локусом нарколепсии и может иметь некоторые регуляторные эффекты сна у мышей.
КЛИНИЧЕСКИЕ АСПЕКТЫ НАРКОЛЕПСИИ НАРУШЕНИЯ СОНА ЧЕЛОВЕКА
Нарколепсия связана с тяжелой дневной сонливостью и полной дезорганизацией цикла сна / бодрствования (Overeem et al. 2001). Основным нарушением нарколепсии является неспособность поддерживать бодрствование или сон в течение длительных периодов времени. Дремлющий сон обычно временно снимает сонливость, и пациентам часто трудно поддерживать сон ночью. Другие симптомы включают катаплексию (мышечная атония, вызванная эмоциями, обычно смехом и гневом; см. //Www.med.stanford.edu/school/Psychiatry/narcolepsy/), паралич сна (неспособность двигаться при наступлении сна или при пробуждении) и гипнагогия галлюцинации (похожие на сон галлюцинации в начале сна или во время приступов сна). Эти последние симптомы, как полагают, являются ненормальными событиями диссоциированного быстрого сна. Из этих симптомов только катаплексия очень специфична для нарколепсии. Степень тяжести этого симптома варьирует от очень легкой (сгибание коленей при смехе, несколько раз в месяц) до инвалидности (несколько раз в день, с полной атонией). Следует отметить, что нарколепсия человека также часто ассоциируется с периодическими движениями конечностей (ночной миоклонус) во время сна (Overeem et al. 2001), расстройством поведения REM и умеренным ожирением (Schuld et al. 2000).
ДИАГНОСТИКА НАРКОЛЕПСИИ
Нарколепсия у человека не редкость. Когда рассматриваются только случаи с катаплексией, в Соединенных Штатах страдают 0, 05% населения (Mignot 1998), распространенность которого сходна с рассеянным склерозом. Диагностика, как правило, проводится с использованием теста 4–5 дремот, называемого тестом латентного сна (MSLT). В этом тесте у пациентов с нарколепсией обычно наблюдается короткая средняя латентность сна (min 8 мин) и более двух переходов в режим быстрого сна. Этот тест проводится после ночи в лаборатории, где изучается ночной сон, чтобы исключить обструктивное апноэ во сне или другие более частые нарушения сна. Распространенность более легких случаев, включая необъяснимую сонливость, задокументированную MSLT, без катаплексии (с или без других вспомогательных симптомов, таких как паралич сна и гипнагогические галлюцинации) неизвестна. MSLT особенно полезен для объективного документирования дневной сонливости и обоснования будущего лечения амфетаминоподобными стимуляторами в течение всей жизни.
ПСИХОСОЦИАЛЬНОЕ ВОЗДЕЙСТВИЕ НАРКОЛЕПСИИ
Психосоциальное воздействие нарколепсии является серьезным, особенно когда расстройство лечится на поздних стадиях заболевания. Контролируемые исследования показали, что влияние заболевания столь же серьезно, как и эпилепсия, как референтное состояние. Нарколепсия обычно начинается в подростковом возрасте (15–25 лет), в период, критический для нормального развития, межличностных отношений и правильного обучения. Социальная изоляция и профессиональные трудности распространены, но у пациентов нормальный интеллект. Пациенты с нарколепсией чаще имеют избыточный вес, аномалия, которая, вероятно, отражает снижение энергетического обмена и активности. Они также часто клинически подавлены, симптом часто маскируется фармакологическим лечением их симптомов. Группы поддержки и обсуждения с другими пациентами часто бывают полезны.
ГЕНЕТИЧЕСКИЕ АСПЕКТЫ НАРКОЛЕПСИИ ЧЕЛОВЕКА
Нарколепсия человека является мультигенным расстройством, подверженным влиянию окружающей среды (Mignot 1998). Приблизительно 25–35% сообщенных монозиготных близнецов согласны на расстройство. В большинстве случаев семейный анамнез отсутствует, но у родственников первой степени возрастает риск развития нарколепсии и катаплексии в 20–40 раз. Наиболее поразительно, что нарколепсия тесно связана с HLA-DR2 и DQB1 * 0602, что свидетельствует о возможной аутоиммунной этиологии. Недавно были также описаны сложные ассоциации HLA при нарколепсии (Mignot et al. 2001).
ЛЕЧЕНИЕ НАРКОЛЕПСИИ ЧЕЛОВЕКА
Современные методы лечения являются чисто симптоматическими и частично эффективными (Nishino and Mignot 1997; Overeem et al. 2001). Поведенческие изменения, такие как запланированный сон и корректировка работы, полезны, но редко бывают достаточными. Фармакологическое лечение необходимо в более чем 95% случаев. Сонливость, самый инвалидизирующий симптом нарколепсии, лечится амфетаминоподобными стимуляторами или более новым составом модафинил. Эти соединения действуют путем ингибирования обратного захвата дофамина (например, модафинила) и / или стимулирования высвобождения дофамина (например, декстроамфетамина) (Nishino et al. 1998; Wisor et al. 2001). Амфетаминоподобные стимуляторы, как правило, более эффективны, чем модафинил, но менее специфичны в фармакологическом отношении и вызывают больше побочных эффектов. Амфетаминоподобные соединения труднее назначать (тройные, назначенные препараты), и в настоящее время они чаще используются в качестве терапевтических средств второго ряда, если только стоимость не является проблемой. Стимуляторная терапия, к сожалению, не очень эффективна при катаплексии и других симптомах ненормального быстрого сна.
Катаплексия, второй наиболее инвалидизирующий симптом нарколепсии, обычно лечится с помощью трициклических препаратов (например, протриптилина, кломипрамина) или более высоких доз ингибиторов обратного захвата серотонина (например, флуоксетина). Было показано, что ингибирование адренергического обратного захвата является наиболее эффективным в снижении катаплексии на животных моделях (Mignot et al. 1993a), но на сегодняшний день лишь немногие антидепрессанты нацелены на сайт адренергического транспортера. Клинический опыт использования блокаторов обратного захвата этой системы, таких как ребоксетин, дает очень положительные антикатаплектические эффекты, но опыт применения этих новых препаратов более ограничен.
Доступна скупая информация о лечении паралича сна, нарушения ночного сна и гипнагогических галлюцинаций. Паралич сна и гипнагогические галлюцинации, два симптома диссоциированного быстрого сна, частично отвечают на антидепрессивную терапию. Нарушенный ночной сон можно лечить с помощью снотворного бензодиазепина, но это лечение не уменьшает дневную сонливость.
Новое соединение, Gammahydroxybutyrate (GHB), в настоящее время проходит клинические испытания для лечения нарколепсии (Nishino and Mignot 1997; Bernasconi et al. 1999). Это снотворное, бывшее анестезирующее средство, является уникальным, поскольку оно консолидирует ночной сон путем увеличения глубокого медленного сна и в меньшей степени быстрого сна. Это также уменьшает дневную катаплексию и сонливость, чаще всего через 1-3 месяца после хронического введения. Текущий опыт свидетельствует о благоприятном профиле побочного эффекта / эффективности. К сожалению, однако, соединение имеет очень короткий период полураспада и должно вводиться дважды в течение ночи. Запас безопасности для соединения также невелик, и одобрение GHB осложняется его популярностью как наркотика злоупотребления. Действительно, благодаря своему стимулирующему действию на медленный сон, препарат выпускает гормон роста, свойство, которое сделало препарат популярным у спортсменов. Другие лица, злоупотребляющие наркотиками, использовали это соединение в качестве наркотика для изнасилования или в сочетании с другими наркотиками в качестве эйфорического агента на рейв-вечеринках.
Следует отметить, что способ действия GHB все еще не определен и может включать специфические рецепторы GHB и / или стимуляцию рецепторов GABA-B (Bernasconi et al. 1999). В электрофизиологических исследованиях введение ГОМК резко снижает частоту запуска дофаминергических клеток и высвобождение этого нейротрансмиттера у бодрствующих животных. Интересно, что синтез дофамина не связан, и в результате увеличивается содержание дофамина в мозге. Предполагается, что увеличение запаса дофамина может объяснить улучшение дневной сонливости на следующий день.
ФАРМАКОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ ПРИ НАРОДНОЙ НАРКОЛЕПСИИ
О нарколепсии у собак впервые сообщили в 1973 году. Как и у людей, большинство случаев нарколепсии у собак носят эпизодический характер, но в 1975 году были зарегистрированы семейные случаи, в результате чего доктор В.Д. Демент основал стабильную колонию в Стэнфордском университете (Baker and Dement 1985). Семейные случаи связаны с мутациями Hcrtr2, в то время как спорадические случаи имеют дефицит гипокретина, но не имеют мутаций гена гипокретина (Lin et al. 1999; Ripley et al. 2001a). Фенотип нарколепсии этих животных поражает. Положительное возбуждение, такое как подача пищи или игра с животными, приводит к атонии мышц (см. //Www.med.stanford.edu/school/Psychiatry/narcolepsy/). Катаплексия, как правило, более тяжелая, а симптомы у животных с дефицитом лиганда более различны. Сонливость, основной симптом нарколепсии человека, труднее документировать у нарколептических животных, учитывая полифазность сна у собак. Двадцать четыре записи сна показали, что у нарколептических животных, будь то лиганд или дефицит рецепторов, нарушались схемы сна. Процедуры, подобные MSLT, также были адаптированы к видам собак и показали снижение латентности сна и латентности REM у нарколептических собак (Nishino and Mignot 1997).
В течение более трех десятилетий у этих животных изучалось действие более 200 фармакологических препаратов (Baker and Dement 1985; Nishino and Mignot 1997). Большинство исследований было сосредоточено на катаплексии. У людей этот симптом непредсказуем и трудно поддается количественной оценке. Напротив, катаплексия у собак может быть надежно оценена у собак с помощью теста на катаплексию, вызванного пищей. В целом, фармакологический контроль катаплексии оказался сходным с контролем быстрого сна и согласуется с моделью аминергико-холинергического реципрокного взаимодействия, впервые предложенной Хобсоном и Маккарли (McCarley and Massaquoi 1992). В этой модели бодрствование связано с высокой холинергической и аминергической активностью, приводящей к активации ЭЭГ. Во время быстрого сна холинергическая и моноаминергическая активность снижается в связи с синхронизацией ЭЭГ. Во время быстрого сна холинергические системы активируются, в то время как активность аминергических нейронов практически отсутствует. Тем не менее, следует отметить, что этот тип активности наиболее поразителен по серотонинергическому, адренергическому и гистаминергическому тонусам; Дофаминергическая активность нейронов не изменяется очень значительно в течение цикла сна.
В соответствии с этой моделью лекарства, которые либо активируют холинергический тонус, либо снижают моноаминергическую активность, усиливают катаплексию, тогда как антихолинергические и моноаминергические усилители уменьшают симптомы (Baker and Dement 1985; Mignot et al. 1993b; Nishino and Mignot 1997). Однако, как упоминалось выше, ингибирование адренергического поглощения является более эффективным, чем ингибирование обратного захвата серотонина или дофамина в снижении катаплексии (Mignot et al. 1993a). Поскольку ингибиторы обратного захвата серотонина также уменьшают REM-сон, это может свидетельствовать о преимущественном адренергическом контроле REM-атонии адренергической системой. Удивительно, но мы также обнаружили, что допаминергические препараты D2 / D3 оказывают существенное влияние на катаплексию, эффект, который контрастирует с отсутствием влияния блокаторов дофаминергического обратного захвата на этот симптом (Nishino and Mignot 1997). Местные перфузионные исследования показали, что этот эффект опосредуется дофаминергическими ауторецепторами, причем стимуляция и блокада обостряют и уменьшают симптомы соответственно (Nishino and Mignot 1997).
Было проведено меньше фармакологических исследований для оценки влияния препарата на сонливость в дневное время. Ряд исследований показал, что амфетаминоподобные стимуляторы и модафинил вызывают бодрствование, пресинаптически усиливая дофаминергическую передачу, либо путем ингибирования обратного захвата дофамина, и / или путем увеличения высвобождения дофамина (Nishino et al. 1998; Wisor et al. 2001).
ГИПОКРЕТИНОВАЯ НЕДОСТАТОЧНОСТЬ В НАРКОЛЕПСИИ ЧЕЛОВЕКА
Открытие того факта, что нарколепсия у собак была вызвана мутациями в гене рецептора-2 гипокретина, привело нас к изучению роли этой системы в нарколепсии человека. Эксперименты по скринингу мутаций препрогипокретина, Hcrtr1 и Hcrtr2 выявили только одну мутацию у необычно тяжелого пациента с началом нарколепсии и катаплексии в возрасте шести месяцев (Peyron et al. 2000). Полиморфизмы также были идентифицированы, и было показано, что они не связаны с заболеванием. Затем мы исследовали возможность функционального поражения системы гипокретина путем измерения уровня гипокретина в спинномозговой жидкости пациентов с этим расстройством. Поразительно, что уровни гипокретина-1 были легко измеримы во всех контрольных образцах CSF, в то время как более 90% пациентов имели неопределяемые уровни (гипокретин-2 не мог быть измерен ни в одном образце) (Nishino et al. 2000). Дальнейшие иммуноцитохимические и in situ исследования гибридизации в настоящее время показали значительное снижение, если не отсутствие мРНК гипокретина и иммунореактивности пептидов в образцах послеродовой нарколепсии (Peyron et al. 2000; Thannickal et al. 2000). Вместе с ранее установленной ассоциацией HLA в нарколепсии эти недавние находки позволяют предположить, что нарколепсия человека может быть аутоиммунным расстройством, связанным с перипубертатным разрушением гипокретинсодержащих клеток. Эта линия исследований в настоящее время находится под пристальным вниманием.
ПИТАНИЕ, ЭНЕРГЕТИЧЕСКИЙ МЕТАБОЛИЗМ И НЕЙРОГОРМОНАЛЬНЫЙ КОНТРОЛЬ ГИПОКРЕТИНОВ
Роль гипокретина в регуляции аппетита была впервые предложена на основе перифорической локализации гипокретин-содержащих клеток и наблюдения, что интрацеребровентрикулярные инъекции гипокретина-1 и 2 стимулировали потребление пищи у крыс (de Lecea et al. 1998; Sakurai et al. 1998). Согласно полученным данным, животные с дефицитом гипокретина также сообщают о снижении потребления пищи (Willie et al. 2001). Дальнейшие эксперименты в целом подтвердили эти результаты, но было показано, что эффекты, стимулирующие аппетит, были довольно слабыми и зависели от циркадного времени введения (Hungs and Mignot 2001).
Более поздние исследования в настоящее время указывают на более сложную взаимосвязь между регуляцией гипокретинсодержащих клеток, нейрогормональным высвобождением и энергетическим обменом (Kilduff и Peyron 2000; Sutcliffe и de Lecea 2000; Hungs и Mignot 2001; Overeem et al. 2001; Willie et al. 2001). Во-первых, не только стимулирование потребления пищи, но и влияние гипокретинов на потребление энергии может быть более важным для регуляции гомеостаза организма. Фактически, мыши, нокаутированные по гипокретину, имеют нормальную массу тела (Willie et al. 2001), а мутанты атаксина-3 с отсутствующими клетками, содержащими гипокретин, имеют увеличенную массу тела (Hara et al. 2001), эффект, несовместимый со сниженным орексиногенным сигналом. Считается, что ожирение отражает снижение метаболической активности и расхода энергии у животных с дефицитом гипокретина, что количественно более важно, чем гипофагия. Интересно, что интрацеребровентрикулярная инъекция гипокретина оказывает мощное стимулирующее воздействие на симпатический отток (Samson et al., 1999; 1Shirasaka et al. 1999) и высвобождение кортизола, но снижает выброс пролактина и гормона роста (Hagan et al. 1999). Было также показано, что центральное введение гипокретина-1 увеличивает скорость метаболизма (Lubkin and Stricker-Krongrad 1998). Эти данные не всегда согласуются с данными человека, указывающими на снижение выброса пролактина и гормона роста во время сна, но относительно неизменными уровнями кортизола при нарколепсии с дефицитом гипокретина (Higushi et al. 1979).
Во-вторых, активность гипокретина модулируется медиаторами энергетического обмена. Используя диссоциированные гипокретинсодержащие клетки, экспрессирующие EGFP, предварительные результаты показывают, что лептин и глюкоза ингибируют активность гипокретина, в то время как грелин, желудочный пептид, стимулирует спонтанную активность (Dr. Sakurai, личное сообщение). Эти результаты контрастируют с отсутствием эффектов моноамина или ацетилхолина, что указывает на важную метаболическую модуляцию активности гипокретина (Dr. Sakurai, личное сообщение). Наряду с обнаружением аномалий гипокретина в модели ожирения на животных и в других экспериментах (см. Hungs and Mignot 2001; Willie et al. 2001), данные указывают на то, что гипокретиновые системы могут активироваться голоданием и подавляться сытостью.
ПРОСМОТРЕТЬ СОДЕЙСТВИЕ ГИПОКРЕТИНУ-1
Фармакологические исследования показывают сильные эффекты, способствующие бодрствованию и REM-сну, после центрального введения гипокретина-1 либо локально в определенных структурах мозга (locus coeruleus, преоптическая зона), либо после внутрицеребровентрикулярной инъекции. В высоких дозах даже наблюдаются усиленная локомоция, груминг и стереотипии, эффект блокируется дофаминергическими антагонистами (Nakamura et al. 2000). Важно отметить, что интрацеребровентрикулярное введение гипокретина-1 во время сна неактивно у собак с мутацией Hcrtr2 (Fujiki et al. 2001a, b), что свидетельствует о преимущественном влиянии Hcrtr2 на развитие бодрствования.
ВЛИЯНИЕ ГИПОКРЕТИНОВОЙ ДЕЯТЕЛЬНОСТИ НА МОНОАМИНЕРГЕТИЧЕСКИЙ ТОН В ЦИКЛЕ СНА
Хотя роль гипокретинов в нарколепсии хорошо известна, на сегодняшний день очень мало данных свидетельствуют об участии гипокретинов в регуляции нормальной стадии сна / бодрствования. Наблюдение того, что гипокретиновые нейроны плотно проецируются на все группы моноаминергических клеток, привело к гипотезе, что эти клетки могут управлять моноаминергической активностью в течение всего цикла сна (Kilduff and Peyron 2000; Hungs and Mignot 2001). В соответствии с этой гипотезой, исследования c-fos показали увеличение активности во время бодрствования и снижение активности гипокретина во время NREM-сна (Estabrooke et al. 2001). Влияние на холинергическую передачу и гипокретинергическую активность во время быстрого сна более обсуждается и может включать более сложные и непрямые эффекты (Kilduff and Peyron 2000; Hungs and Mignot 2001). Следует отметить, что дофаминергическая активность также получает плотные проекции гипокретина, но не меняет активность так же резко, как другие группы моноаминергических клеток в разных состояниях сна. Очевидно, что модель, включающая глобальную моноаминергическую гипоактивность, должна быть упрощена. Электрофизиологические исследования полностью охарактеризованных нейронов гипокретина будут необходимы, чтобы ответить на эти важные вопросы.
СОДЕЙСТВИЕ ГИПОКРЕТИНОВОЙ ДЕЯТЕЛЬНОСТИ ЦИРКАДСКИМ ЧАСОМ
Недавний отчет о прямых проекциях из супрахиазматического ядра (SCN) на клетки гипокретина (Abrahamson et al. 2001) также предполагает, что активность гипокретина может модулироваться биологическими часами. Недавно было показано, что гипокретин в CSF или измеренный с использованием диализа in vivo увеличивается во второй половине активного периода у крыс в условиях увлечения (Fujiki et al. 2001; Yoshida et al., В печати). Дополнительные исследования в постоянной темноте и у пораженных SCN животных теперь необходимы, чтобы установить, действительно ли флуктуация вызвана SCN. Интересно, что недавняя модель регуляции сна, оппонентная модель регуляции сна, предложила существование сигнала, стимулирующего бодрствование, генерируемого из SCN во второй части активной фазы (Edgar et al. 1993). У людей этот сигнал противостоит растущему долгу сна, который накапливается в течение дня, тем самым помогая поддерживать постоянный период бодрствования. Таким образом, проекция SCN на клетки гипокретина может обеспечить биологический субстрат для концепции SCN-зависимой настороженности, системы, которая также считается ненормальной при нарколепсии с дефицитом гипокретина (Dantz et al. 1994).
$config[ads_text16] not foundГИПОКРЕТИНОВАЯ НЕДОСТАТОЧНОСТЬ И ВТОРИЧНЫЕ НЕЙРОХИМИЧЕСКИЕ НАРУШЕНИЯ ПРИ НАРКОЛЕПСИИ
Концепция, согласно которой нейротрансмиссия гипокретина является возбуждающей для моноаминергических систем и, возможно, холинергических систем, аналогична нейрохимическим данным, представленным при нарколепсии. При расстройстве сна симптомы лучше всего объясняются базовой моноаминергической гипоактивностью, гиперреактивностью холинергических систем и гиперчувствительностью холинергических рецепторов (Baker and Dement 1985; Nishino and Mignot 1997). Наиболее поразительно, что нарколепсия у собак связана со снижением уровня гистамина в мозге (Nishino et al. 2001), системы с почти исключительной локализацией Hcrtr2. Другие исследования показали увеличение содержания дофамина и ДОФАК в миндалине (Miller et al. 1990), что может свидетельствовать о вторичной дисрегуляции дофаминергического тонуса. Нарушение допамина может либо способствовать в первую очередь дневной сонливости при нарколепсии, либо представлять собой компенсаторный механизм. Аномальные дофаминергические системы также могут объяснять периодические движения ног при нарколепсии, симптом, который в настоящее время лечится с помощью агонистов допамина D2 / D3.
ГИПОКРЕТИНОВАЯ ГИПОКРЕТИНАЦИЯ В СООТВЕТСТВИИ СОНА
Эти модели все еще носят умозрительный характер. Гипокретиновые проекции для немоноаминергических, нехолинергических групп клеток также могут играть важную роль. Важнее всего то, что роль гипокретинов в регуляции гомеостатических аспектов сна также предстоит изучить. Эксперименты с C-fos показывают, что гипокретиновые нейроны могут активироваться во время вынужденного бодрствования (Estabrooke et al. 2001). Кратковременное лишение сна не изменяет уровни мРНК препрогипокретина, но транскрипция может не отражать внеклеточное высвобождение. Фактически, недавнее исследование, проведенное нашей группой, предполагает, что лишение сна увеличивает высвобождение гипокретина-1, как измерено с использованием диализа in vivo (Yoshida et al., В печати). Интересно, что лишение сна создало антидепрессантный эффект (Gillin 1983), свойство, которое может отражать активированную серотонинергическую и адренергическую передачу благодаря повышенному тонусу гипокретина. Аналогичным образом, длительное лишение сна связано с гиперфагией, гипертермией и парадоксальным увеличением метаболических расходов (Rechtschaffen and Bergmann 1995), симптомы, которые могут отражать повышенную активность гипокретина. В этой модели сигнал гипокретина противодействует сонливости во время лишения сна и косвенно увеличивает метаболизм, эффект, который может даже стать опасным для жизни во время длительного лишения сна
ДРУГИЕ ПЕРСПЕКТИВЫ В ГИПОКРЕТИНОВОМ ИССЛЕДОВАНИИ
Функция этой новой системы нейротрансмиттеров быстро появляется, поскольку больше информации становится доступным еженедельно. Новые экспериментальные протоколы сейчас крайне необходимы. Большинство текущих экспериментов изучали содержание гипокретина и / или транскрипцию мРНК в ответ на часто экстремальные метаболические манипуляции. Эти меры вряд ли будут очень важны с физиологической точки зрения, и в настоящее время остро необходимы другие методы, такие как диализ in vivo и электрофизиологические исследования на животных с естественным поведением. Точно так же фармакологические исследования с использованием местных инъекций и / или внутрицеребровентрикулярных экспериментов имеют ограничения. Наблюдаемые эффекты могут быть опосредованы сильным возбуждающим действием этого пептида на большинство нейронов и могут не отражать физиологическую регуляцию. Например, внутрицеребровентрикулярные инъекции гипокретина-1, вероятно, активируют дофаминергическую систему, эффект, который может объяснить стереотипы (Nakamura et al. 2000), и снижают выброс пролактина и гормона роста (Hagan et al. 1999). Однако неясно, важна ли дофаминергическая активация в естественных схемах, регулирующих сон, и / или если нарколепсия с дефицитом гипокретина связана со снижением дофаминергического тонуса. In fact, narcolepsy is rather associated with disturbed nocturnal sleep, periodic leg movements (Overeem et al. 2001) and decreased prolactin and growth hormone release (Higushi et al. 1979), possibly suggesting a compensatory hyperactivation of dopaminergic systems. Finally, hypocretin agonists and antagonists are also badly needed to assess the potential therapeutic value of this pathway for sleep and other disorders. Only one compound with moderate affinity and bioavailability, SB-334867, a Hcrtr1 antagonist, is available (Rodgers et al. 2001).
The phenotype of the system knockout, narcolepsy, indicate important and non redundant effects of this peptide system in the area of wake regulation, sleep consolidation and the cohesion of REM sleep. Based on current knowledge, hcrtr2 modulation could have significant effects on sleep and wakefulness, possibly via hcrtr2 effects on histaminergic transmission. Cholinergic and dopaminergic effects may also be relevant to sleep abnormalities, cataplexy and periodic leg movements while the role of other monoamines may be important for mood dysregulation. Projections to non monoaminergic, non cholinergic may also be involved. Experiments aiming at locally rescuing hypocretin deficits in animal models are needed to further our understanding of the narcolepsy circuitry.
Metabolic and neuroendocrine abnormalities are also apparent in narcolepsy but it is still difficult to fully dissociate those that are primary versus secondary to sleep abnormalities. Sleep, neuroendocrine release and metabolism are functionally interrelated. Sleep deprivation is associated with dramatic metabolic and neuroendocrine changes. Most likely, the hypocretin system integrates these multiple functions within the hypothalamus. Most convincingly, hypocretin neurons are sensitive to satiety and hunger signals, potentially explaining why alertness is modulated by food intake. As one of the proposed functions of sleep has been suggested to be energy conservation, these relationships are very logical from the point of view of natural evolution. Clearly however, other regulatory inputs relevant to sleep regulation remain to be discovered as sleep is not only regulated by metabolic changes and food intake.
The role of this system in neuropsychiatry also remains to be investigated. Hypocretins are uniquely positioned to link sleep, appetite and neuroendocrine control, three behaviors of major importance in psychiatry. A small study did not find significant changes in CSF hypocretin levels in schizophrenic patients (Ripley et al. 2001b). Based on its strong interactions with the monoaminergic system, this system may be more important for mood regulation. This interaction could explain the high prevalence of depression in human narcolepsy and the antidepressant effect of sleep deprivation. The finding that a genetically complex disorder like human narcolepsy is caused by the destruction of a few thousand cells secreting a neuropeptide that was unknown a few years ago is also encouraging for the future of neuropsychiatry in general. Many other unknown transmitters and peptides are currently been discovered. Phenotyping complex behaviors in knockout models such as sleep, memory or indirect measures of mood and anxiety is becoming more and more routine. As in narcolepsy, the effect of a discrete lesion of these systems may only become apparent before when these new systems are fully mapped and studied across the animal kingdom.
Подтверждения
This work was supported by NIH NS23724, NS33797, and HL59601 [EM]. Thank you to the entire staff of the Center for Narcolepsy for scientific contributions.
Нарколепсия
Содержание статьи
Виды заболевания
Различают две формы данного заболевания:
- полисимптомную;
- моносимптомную.
Причины
Проблемы психологического и психиатрического характера не относят к причинам нарколепсии. Данное заболевание может проявить себя в результате:
- тяжелых переутомлений;
- пережитой травмы черепа;
- как результат сильных эмоций;
- после перенесения заболеваний инфекционного происхождения.
Иногда причину развития нарколепсии связывают с нарушением в работе желез внутренней секреции и с наследственной предрасположенностью. Внезапными приступами сонливости могут страдать беременные женщины. Нарколепсия способна развиваться при значительном уменьшении в головном мозге, а точнее в его регуляторных областях, количества клеток. Некоторые исследования показывают, что нарколепсия может возникать в связи с геном, который ответственный за гипокретин – синтез химического вещества в мозгу. При данной болезни количество гипокретина значительно снижается. Сочетание множества факторов в личной жизни человека с его генными нарушениями приводит к развитию заболевания.
Точную причину нарколепсии до этого времени не выяснено, но медики обладают предположениями, что эта болезнь может развиваться в результате поражения некой части мозга, которая контролирует процесс сна и бодрствования.
Симптомы
Первые признаки болезни обычно появляются у ранее здорового человека, будучи подростком или же в молодости и могут сохраниться на всю оставшуюся жизнь. При нарколепсии человеческий организм одолевают внезапные приступы непреодолимой сонливости, возникающей в любое время. Сопротивляться сну он может лишь короткий промежуток времени. Количество подобных приступов за сутки день может быть разным, при этом каждый из них может продолжаться меньше часа.
Нарколепсия проявляется:
- мгновенным развитием паралича без перенесения потери сознания (это состояние называется катаплексия), который сопровождается внезапной эмоциональной реакцией, например, возмущением, страхом, радостью, смехом или удивлением.
- обмяканием организма;
- периодическими эпизодами паралича, связанными с засыпанием или пробуждением: при засыпании или сразу же после пробуждения от сна человек теряет способность двигаться произвольно. Во время ярких галлюцинаций человек видит или слышит то, что не на самом деле не существует. Они часто возникают в начале сна или в процессе пробуждения. Галлюцинации бывают похожими на нормальные сновидения, но немного ярче их.
Только десятая часть людей, которые страдают нарколепсией, имеет все эти симптомы, у большой части отмечаются лишь некоторые из них.
Диагностика
Диагностированием и лечением нарколепсии занимается сомнолог. Постановка диагноза начинается с того, что он выясняет анамнез заболевания и проводит физикальное обследование.
После того, как будут исключены другие заболевания, проводят такие диагностические тесты:
- полисомнографию – данный тест проводят в сомнологических лабораториях, где пациент больной проводит всю ночь. В процессе сна контролируют его частоту сердечных сокращений, мышечную и мозговую активность, движения. Это делают при помощи специальных электродов, которые передают информацию на устройство записи.
- тест на множественную латенцию ко сну – проводят так же, как полисомнографию, но теперь больной должен заснуть в дневное время суток. На основании результатов рисунка сна ставится правильный диагноз;
- энцефалографию – регистрируется биоэлектрическая активность в головном мозге.
Лечение
К сожалению, нарколепсию нельзя излечить. Однако при поддерживающем лечении качество жизни пациента может значительно улучшиться. Под медикаментозной терапией подразумевается назначение средств стимуляции, которые уменьшают сонливость днем, а также назначение лекарств, способных ослаблять симптомы паралича или катаплексии. Применяться эти средства должны только под строгим наблюдением лечащего врача.
Особое внимание следует гигиене сна. Необходимо обеспечение достаточного ночного сна, а также денного сна до 3 раз на день, продолжительностью по полчаса или час. Необходимо выбирать профессию, которая позволит не соблюдать жесткий график бодрствования и сна, а также не будет сопрягаться с применением механизмов и средств, которые требуют повышенного уровня внимания.
Профилактика
Профилактика нарколепсии основана на:
- изменении образа жизни;
- отказе от вредных привычек и тяжелой пищи;
- следовании жесткому режиму короткого дневного сна и долгого ночного;
- выполнении физических упражнений и правильном режиме питания.
Орексин — Orexin — xcv.wiki
Нейропептид, регулирующий возбуждение, бодрствование и аппетит.
Orexin ( ), также известный как hypocretin , является нейропептида , который регулирует возбуждение , бессонницу , и аппетит . Наиболее распространенная форма нарколепсии , тип 1, при которой у пациента наблюдается кратковременная потеря мышечного тонуса ( катаплексия ), вызвана нехваткой орексина в головном мозге из-за разрушения клеток, которые его производят.
В головном мозге человека всего 10 000–20 000 нейронов, продуцирующих орексин , расположенных преимущественно в перифорниальной области и латеральном гипоталамусе . Они широко проецируются на центральную нервную систему, регулируя бодрствование, кормление и другие формы поведения. Существует два типа пептидов орексина и два типа рецепторов орексина .
Орексин был открыт в 1998 году почти одновременно двумя независимыми группами исследователей, работающими над мозгом крысы . Одна группа назвала его орексином от слова orexis, что по-гречески означает «аппетит»; другая группа назвала его hypocretin , потому что он производится в гипо- таламусе и несет слабое сходство с секретином , другой пептид . Официально гипокретин ( HCRT ) используется для обозначения генов и транскриптов , в то время как орексин используется для обозначения кодируемых пептидов . Существует высокое сродство между системой орексина в мозге крысы и мозгом человека.
Открытие
В 1998 году сообщения об открытии орексина / гипокретина были опубликованы почти одновременно. Луис де Леса, Томас Килдафф и его коллеги сообщили об открытии гипокретиновой системы одновременно с Такеши Сакураи из лаборатории Масаши Янагисавы в Юго-Западном медицинском центре Техасского университета в Далласе, сообщив об открытии орексинов, отражающих орексигенные ( стимулирует аппетит) активность этих пептидов. В своей статье 1998 года, описывающей эти нейропептиды, они также сообщили об открытии двух рецепторов орексина, получивших название OX 1 R и OX 2 R.
Обе группы также использовали разные подходы к своему открытию. Одна команда была заинтересована в поиске новых генов, которые экспрессировались в гипоталамусе. В 1996 году ученые из Исследовательского института Скриппса сообщили об открытии нескольких генов в мозге крысы, в том числе одного, которого они назвали «клоном 35». Их работа показала, что экспрессия клона 35 ограничена латеральным гипоталамусом. Они извлекли селективную ДНК, обнаруженную в боковом гипоталамусе. Они клонировали эту ДНК и изучили ее с помощью электронной микроскопии. Нейротрансмиттеры, обнаруженные в этой области, были странно похожи на гормон кишечника секретин, член семейства инкретинов , поэтому они назвали гипокретином, чтобы обозначить гипоталамический член семейства инкретинов. Сначала считалось, что эти клетки находятся и работают только в боковой области гипоталамуса, но методы иммуноцитохимии показали, что эта область действительно имеет различные проекции на другие части мозга. Большинство этих проекций достигали лимбической системы и связанных с ней структур (включая миндалину, перегородку и базальную область переднего мозга).
С другой стороны, Сакураи и его коллеги изучали систему орексина как сиротские рецепторы . С этой целью они использовали трансгенные клеточные линии, которые экспрессировали отдельные орфанные рецепторы, а затем подвергали их воздействию различных потенциальных лигандов. Они обнаружили, что пептиды орексина активировали клетки, экспрессирующие рецепторы орексина, и обнаружили экспрессию пептида орексина именно в гипоталамусе. Кроме того, когда крысам вводили любой пептид орексина, он стимулировал кормление, что дало название «орексин».
Номенклатура системы орексин / гипокретин теперь учитывает историю ее открытия. «Гипокретин» относится к гену или генетическим продуктам, а «орексин» относится к белку, что отражает различные подходы, которые привели к его открытию. Использование обоих терминов также является практической необходимостью, поскольку «HCRT» является стандартным символом гена в таких базах данных, как GenBank, а «OX» используется для обозначения фармакологии пептидной системы Международным союзом фундаментальной и клинической фармакологии .
Изоформы
Существует два типа орексина: орексин-A и -B (гипокретин-1 и -2). Они представляют собой возбуждающие нейропептиды с приблизительно 50% идентичностью последовательностей, полученные расщеплением одного белка-предшественника. Орексин-A состоит из 33 аминокислотных остатков и имеет две внутрицепочечные дисульфидные связи ; орексин-B представляет собой линейный пептид из 28 аминокислотных остатков. Хотя эти пептиды производятся очень небольшой популяцией клеток в боковом и заднем гипоталамусе , они посылают проекции по всему мозгу. Пептиды орексина связываются с двумя рецепторами орексина, связанными с G-белком , OX 1 и OX 2 , при этом орексин-A связывается как с OX 1, так и с OX 2 примерно с одинаковым сродством, в то время как орексин-B связывается в основном с OX 2 и в 5 раз меньше. мощный на OX 1 .
Орексины — это строго консервативные пептиды, обнаруженные у всех основных классов позвоночных.
Функция
Первоначально предполагалось, что система орексина в первую очередь участвует в стимуляции приема пищи, на основании открытия, что центральное введение орексина-A и -B увеличивает потребление пищи. Кроме того, он стимулирует бодрствование, регулирует расход энергии и модулирует висцеральную функцию.
Активация бурого жира
Многие исследования подтверждают, что нейроны орексина регулируют активность коричневой жировой ткани (BAT) через симпатическую нервную систему, увеличивая расход энергии. Хотя сообщалось, что у мышей с нокаутом орексина обнаруживается недоразвитие коричневой жировой ткани (BAT), последующее сообщение показало нормальное развитие BAT.
Бодрствование
Орексин, кажется, способствует бодрствованию. Недавние исследования показывают, что основная роль системы орексина заключается в интеграции влияний метаболизма, циркадных ритмов и недосыпания, чтобы определить, должно ли животное спать или бодрствовать и быть активным. Орексиновые нейроны сильно возбуждают различные ядра мозга, играющие важную роль в бодрствовании, включая системы дофамина , норадреналина , гистамина и ацетилхолина , и, по-видимому, играют важную роль в стабилизации бодрствования и сна.
Открытие того, что мутация рецептора орексина вызывает у собак нарколепсию расстройства сна у доберман-пинчеров, впоследствии показало важную роль этой системы в регуляции сна . Сообщалось, что у мышей с генетическим нокаутом, лишенных гена орексина, наблюдалась нарколепсия. Часто и быстро переходя от сна к бодрствованию, эти мыши проявляют многие симптомы нарколепсии. Исследователи используют эту животную модель нарколепсии для изучения болезни. Нарколепсия приводит к чрезмерной дневной сонливости , неспособности закрепить бодрствование днем (и ночному сну) и катаплексии , то есть к потере мышечного тонуса в ответ на сильные, обычно положительные эмоции. У собак, у которых отсутствует функциональный рецептор орексина, наблюдается нарколепсия, в то время как животные и люди, у которых отсутствует сам нейропептид орексина, также страдают нарколепсией.
Центральное введение орексина-A сильно способствует бодрствованию, повышает температуру тела и движения, а также вызывает сильное увеличение расхода энергии. Недостаток сна также увеличивает передачу орексина-А. Таким образом, система орексина может играть более важную роль в регулировании расхода энергии, чем прием пищи. Фактически, пациенты с нарколепсией с дефицитом орексина имеют повышенное ожирение, а не снижение ИМТ , как можно было бы ожидать, если бы орексин был в первую очередь пептидом, стимулирующим аппетит. Еще одним признаком того, что дефицит орексина вызывает нарколепсию, является то, что лишение обезьян сна на 30–36 часов с последующим введением им нейрохимических веществ облегчает когнитивные нарушения, обычно наблюдаемые при таком недосыпании.
У людей нарколепсия связана со специфическим вариантом комплекса человеческого лейкоцитарного антигена (HLA). Кроме того, полногеномный анализ показывает, что, помимо варианта HLA, нарколептики также обнаруживают специфическую генетическую мутацию в локусе альфа — рецептора Т-клеток . В сочетании эти генетические аномалии заставляют иммунную систему атаковать и убивать критические нейроны орексина. Следовательно, отсутствие нейронов, продуцирующих орексин, у нарколептиков может быть результатом аутоиммунного заболевания.
Прием пищи
Орексин увеличивает тягу к еде и коррелирует с функцией веществ, которые способствуют его выработке. Также показано, что орексин увеличивает размер еды, подавляя тормозную постингестивную обратную связь. Однако некоторые исследования показывают, что стимулирующее действие орексина на кормление может быть связано с общим возбуждением, но не обязательно с увеличением общего количества потребляемой пищи.
Результаты обзора показывают, что гипергликемия , возникающая у мышей из-за привычной диеты с высоким содержанием жиров, приводит к снижению передачи сигналов рецептором орексина-2, и что рецепторы орексина могут стать терапевтической мишенью в будущем. Лептин — это гормон, вырабатываемый жировыми клетками, который действует как долгосрочное внутреннее средство измерения энергетического состояния. Грелин — это кратковременный фактор, выделяемый желудком непосредственно перед ожидаемым приемом пищи, и он сильно способствует приему пищи. Недавно было показано, что продуцирующие орексин клетки ингибируются лептином (через путь рецептора лептина), но активируются грелином и гипогликемией ( глюкоза подавляет выработку орексина). Орексин с 2007 года считается очень важным связующим звеном между метаболизмом и регуляцией сна. Такая связь давно подозревалась на основании наблюдения, что длительное лишение сна у грызунов резко увеличивает потребление пищи и энергетический метаболизм, то есть катаболизм , с долгосрочными летальными последствиями. Таким образом, недостаток сна приводит к нехватке энергии. Чтобы восполнить этот недостаток энергии, многие люди употребляют продукты с высоким содержанием углеводов и жиров, что в конечном итоге может привести к ухудшению здоровья и увеличению веса. Другие пищевые питательные вещества, аминокислоты, также могут активировать нейроны орексина, и они могут подавлять глюкозный ответ нейронов орексина при физиологической концентрации, вызывая нарушение энергетического баланса, который поддерживает орексин, из его нормального цикла.
Зависимость
Предварительные исследования показали, что блокаторы орексина могут помочь в лечении кокаиновой, опиоидной и алкогольной зависимости. Например, лабораторные крысы, которым давали лекарства, направленные на систему орексина, потеряли интерес к алкоголю, несмотря на то, что им предоставили бесплатный доступ в экспериментах.
Исследования участия орексина в никотиновой зависимости дали неоднозначные результаты. Например, блокирование рецептора орексин-1 с селективным антагонистом Orexin SB-334867 снижен никотином самоуправления у крыс и что курильщики , которые нанесены ущерб в островок , область мозга , который регулирует тяга и содержит Orexin-1 рецепторы, пропал желание курить. Однако другие исследования на крысах с использованием двойного антагониста рецепторов орексина TCS 1102 не обнаружили подобных эффектов.
Липидный обмен
Недавно было продемонстрировано, что орексин-A (OXA) оказывает прямое влияние на один из аспектов липидного обмена. OXA стимулирует захват глюкозы в адипоцитах 3T3-L1, и это повышенное потребление энергии сохраняется в виде липидов ( триацилглицерин ). Таким образом, OXA увеличивает липогенез . Он также подавляет липолиз и стимулирует секрецию адипонектина . Считается, что эти эффекты в основном передаются через путь PI3K, потому что этот ингибитор пути (LY294002) полностью блокирует эффекты OXA в адипоцитах. Связь между ОКСА и метаболизмом липидов является новой и в настоящее время находится в стадии дополнительных исследований.
Настроение
Высокий уровень орексина-А ассоциируется у людей с счастьем, а низкий — с печалью. Открытие предполагает, что повышение уровня орексина-А может улучшить настроение у людей, что, таким образом, станет возможным в будущем средством лечения таких расстройств, как депрессия.
Орексиновые нейроны
Нейротрансмиттеры
Orexinergic нейроны , как было показано , чтобы быть чувствительным к входам из группы III метаботропных глутаматных рецепторов , каннабиноидных рецепторов 1 и СВ1-Ox1 гетеродимеров рецепторов , аденозин 1 рецепторы , мускариновые М 3 рецепторов , серотонина 5-HT 1A рецепторы , нейропептида Y рецепторы, холецистокинин A рецепторы и катехоламины , а также к грелину , лептину и глюкозе . Орексинергические нейроны сами регулируют высвобождение ацетилхолина , серотонина и норадреналина .
Орексинергические нейроны можно разделить на две группы в зависимости от связности и функциональности. Орексинергические нейроны в латеральной гипоталамической группе тесно связаны с функциями, связанными с вознаграждением, такими как условное предпочтение места . Эти нейроны преимущественно иннервируют вентральную тегментальную область и вентромедиальную префронтальную кору . В отличие от латеральных нейронов гипоталамуса перифорнико-дорсальная группа орексинергических нейронов участвует в функциях, связанных с возбуждением и вегетативной реакцией. Эти нейроны проецируются межгипоталамически, а также в ствол мозга, где высвобождение орексина модулирует различные вегетативные процессы.
Клиническое использование
Система орексин / гипокретин является мишенью для лечения бессонницы суворексант , который блокирует оба рецептора орексина. Суворексант прошел три испытания фазы III и был одобрен в 2014 году Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) после того, как годом ранее ему было отказано в одобрении. Он продается как Белсомра .
В 2016 году Центр медицинских наук Техасского университета зарегистрировал клиническое испытание использования суворексанта для людей с кокаиновой зависимостью . Они планируют измерить реактивность, тревогу и стресс.
Другое потенциальное использование
Орексин для интраназального введения способен улучшить познавательные способности у приматов, особенно в условиях недосыпания, что может предоставить возможность лечения чрезмерной дневной сонливости.
В исследовании сообщается, что трансплантация нейронов орексина в ретикулярную формацию моста у крыс возможна, что указывает на разработку альтернативных терапевтических стратегий в дополнение к фармакологическим вмешательствам для лечения нарколепсии.
Рекомендации
Внешние ссылки
| Викискладе есть медиафайлы по теме Orexin . |
Hypocretin — обзор | Темы ScienceDirect
Энергия и метаболизм
В целом механизмы, регулирующие расход и хранение энергии, сохраняются среди млекопитающих и рыб. Как и для многих других эндокринных систем, рыбки данио стали важной моделью для изучения генетики, развития и регуляции энергетического гомеостаза.
Многие важные гормоны, регулирующие аппетит, можно сгруппировать в категории орексигенных или центральных гормонов, стимулирующих аппетит, анорексических или центральных гормонов, подавляющих аппетит, и гормонов периферического аппетита.В первую категорию входят нейропептид Y (Npy), родственный агути белок (Agrp), орексин и меланин-концентрирующий гормон (Mch). Npy является мощным стимулятором аппетита у млекопитающих, а также было показано, что он регулирует потребление пищи костистыми насекомыми (Narnaware, Peyon, Lin, & Peter, 2000; Silverstein, Breininger, Baskin, & Plisetskaya, 1998). Npy экспрессируется в головном мозге рыбок данио на протяжении всего развития и во взрослом возрасте (Soderberg et al., 2000). Рецепторы Npy, также называемые Y-рецепторами , представляют собой семейство рецепторов, связанных с G-белком.Рыбки данио экспрессируют ортологи рецепторов Y1, Y2 и Y4 млекопитающих, а также уникальные изоформы Y7, Y8a и Y8b (Fredriksson, Sjodin, Larson, Conlon, & Larhammar, 2006; Mathieu, Trombino, Argenton, Larhammar, & Vallarino, 2005 ; Salaneck, Larsson, Larson, & Larhammar, 2008). Эффекты передачи сигналов через многие из этих типов рецепторов все еще остаются предметом изучения. Родственный Npy пептид YY (с паралогами Pyya и Pyyb у рыбок данио) экспрессируется в желудочно-кишечном тракте и мозге рыбок данио, а также стимулирует аппетит (Soderberg et al., 2000; Сундстрем, Ларссон, Бреннер, Венкатеш и Лархаммар, 2008 г.).
Нейропептид, родственный агути (Agrp), является антагонистом анорексигенных рецепторов меланокортина. Сверхэкспрессия Agrp у рыбок данио была использована в качестве генетической модели ожирения (Song & Cone, 2007). Орексин A и B, также известный как гипокретин, экспрессируется в гипоталамусе рыбок данио (Kaslin, Nystedt, Ostergard, Peitsaro, & Panula, 2004; Song, Golling, Thacker, & Cone, 2003). Помимо регуляции энергетического гомеостаза, сверхэкспрессия орексинов приводит к бессоннице-подобному поведению у рыбок данио, что предполагает важную роль в установлении циркадных циклов (Prober, Rihel, Onah, Sung, & Schier, 2006; Yokogawa et al., 2007).
Меланин-концентрирующий гормон (Mch, кодируемый геном pmch ) был впервые обнаружен у рыб и назван в честь его роли в регулировании пигмента кожи (Enami, 1955; Imai, 1958; Pickford & Atz, 1957). Рыбки данио содержат два гена Mch: pmch (ранее известный как pmch3 ) и pmchl (ранее известный как pmch2 ) (Berman, Skariah, Maro, Mignot, & Mourrain, 2009). У рыбок данио, людей и грызунов разное количество рецепторов Mch, что может быть связано с различными эффектами на аппетит, о которых сообщалось у разных видов (Logan et al., 2003).
Центральное подавление аппетита регулируется лептином, мелатонином и некоторыми продуктами расщепления Pomc, такими как меланоцит-стимулирующий гормон (Piccinetti et al., 2010). Семейство рецепторов меланокортина, особенно Mc4r, важно для регуляции аппетита у людей, мышей и рыбок данио (Huszar et al., 1997; Song & Cone, 2007; Vaisse, Clement, Guy-Grand & Froguel, 1998; Yeo et al. , 1998; Zhang, Forlano, & Cone, 2012). Лептин из адипоцитов, желудочно-кишечного тракта, мышц и мозга стимулирует Mc4r и меланоцит-стимулирующий гормон для уменьшения потребления пищи.У рыбок данио есть две последовательности лептина, хотя Lepa и Lepb имеют низкую гомологию белковых последовательностей и, как полагают, выполняют разные функциональные роли, причем Lepa является основным регулятором аппетита (Gorissen, Bernier, Nabuurs, Flik, & Huising, 2009). Хроническое воздействие мелатонина на взрослых рыбок данио приводит к снижению аппетита, дозозависимому увеличению транскриптов lepa и mc4r и снижению орексигенных пептидов Ghrelin и Npy (Piccinetti et al., 2010).
Несфатин-1 — еще один анорексигенный фактор, один из трех белков несфатина, продуцируемых расщеплением белков нуклеобиндин2 (Nucb2), кодируемых генами nucb2a и nucb2b у рыбок данио (Hatef, Shajan, & Unniappan, 2015).Функция несфатина-2 и -3 неизвестна (Schalla & Stengel, 2018a). nucb2 Гены экспрессируются во многих тканях у многих видов, с самыми высокими уровнями в печени, мозге и желудочно-кишечном тракте рыбок данио (Gonzalez, Kerbel, Chun, & Unniappan, 2010; Hatef et al., 2015; Lin, Zhou, и др., 2014). У золотых рыбок инъекция несфатина-1 приводила к снижению потребления пищи, что согласуется с анорексигенной ролью, о которой сообщалось у грызунов, но о подобных исследованиях на рыбках данио не сообщалось (Gonzalez et al., 2010). У рыбок данио экспрессия мРНК nucb2 a и nucb2b в головном мозге снижается через 3 ч после кормления, а также через 7 дней голодания (Hatef et al., 2015). Рыбки данио, получавшие пробиотик ( Lactobacillus rhamnosus ) в сочетании с диетой с высоким содержанием жиров, снизили иммунореактивность Nucb2 / несфатин-1 в желудочно-кишечном тракте и уменьшили потребление пищи, что указывает на связь между несфатином-1 и микробиомной регуляцией аппетита ( Falcinelli et al., 2017). Хотя полный механизм действия у рыбок данио не выяснен, исследования несфатина-1 на крысах и цыплятах показывают, что белок может действовать через пути меланокортина и факторов высвобождения кортикотропина, препятствуя потреблению пищи (Schalla & Stengel, 2018a).
Фениксины (Pnx), недавно открытое семейство пептидных гормонов, регулируют энергию и метаболизм у нескольких видов (Schalla & Stengel, 2018b; Stein, Haddock, Samson, Kolar, & Yosten, 2018; Wang et al., 2018). Фениксин коэкспрессируется с несфатином-1 в гипоталамусе крыс и пятнистом помете ( Scatophagus argus ), эвригалинной субтропической рыбе из Индо-Тихоокеанского региона (Wang et al., 2018). Помимо паттернов экспрессии генов, повышенная экспрессия Pnx после периода голодания и последующее снижение экспрессии после повторного кормления предполагают анорексигенную роль, но необходимы дополнительные исследования, чтобы подтвердить это у рыбок данио и изучить предполагаемую связь между передачей сигналов Pnx и Gh ( Wang et al., 2018). Как фениксины влияют на аппетит и пищевое поведение у рыбок данио, еще предстоит полностью изучить.
За последние два десятилетия рыбки данио стали популярным животным для изучения ожирения и других метаболических заболеваний. Несмотря на значительные отличия в образе жизни и размерах от людей, рыбки данио разделяют многие эндокринные пути, контролирующие питание и метаболизм. Рыбки данио, манипулируя экспрессией и функцией генов, изменяя диету и / или микробиоту, оказались важным инструментом в понимании молекулярной и клеточной физиологии энергетического гомеостаза (Faillaci et al., 2018).
Молекулярные коды и образование нейронов гипокретина и меланинконцентрирующего гормона in vitro
Значение
Гипокретин (HCRT) и меланин-концентрирующий гормон — нейропептиды головного мозга, участвующие в различных функциях, включая сон и метаболизм. Потеря HCRT вызывает нарколепсию расстройства сна. Чтобы понять, как эти нейропептиды продуцируются и вносят свой вклад в различные функции при здоровье и болезнях, мы очистили их клетки из мозга эмбрионов мыши и установили их молекулярный механизм.Мы обнаружили, что частичное удаление PEG3 (фактора транскрипции) у мышей значительно снижает количество нейронов HCRT и меланин-концентрирующего гормона, а его подавление у рыбок данио полностью отменяет их экспрессию. Мы использовали наши молекулярные данные для получения этих нейронов in vitro из фибробластов мыши, метод, который может быть применен к клеткам пациентов с нарколепсией для создания модели на основе клеток in vitro.
Abstract
Нейропептиды гипокретина / орексина (HCRT) и меланинконцентрирующего гормона (MCH) вырабатываются исключительно латеральным гипоталамусом и играют важную роль во сне, метаболизме, вознаграждении и мотивации.Потеря HCRT (лигандов или рецепторов) вызывает нарколепсию с нарушением сна с катаплексией у людей и животных. Как эти нейропептиды продуцируются и участвуют в различных функциях, остается неизвестным. Здесь мы разработали методы для сортировки и очистки нейронов HCRT и MCH из гипоталамуса поздних эмбрионов мышей. Секвенирование РНК выявило ключевые факторы детерминации судьбы для нейронов HCRT ( Peg3 , Ahr1 , Six6 , Nr2f2 и Prrx1 ) и MCH ( Lmx1 , Gbx2 и Gbx2 ).Потеря Peg3 у мышей значительно снижает количество клеток HCRT и MCH, в то время как нокдаун ортолога Peg3 у рыбок данио полностью отменяет их экспрессию, что приводит к увеличению количества сна в 2 раза. Мы также обнаружили, что потеря нейронов HCRT у мышей Hcrt-ataxin-3 приводит к специфическому 50% снижению другого орексигенного нейропептида, QRFP, который может объяснять метаболический синдром при нарколепсии. Результаты транскриптома были использованы для разработки протоколов продукции нейронов HCRT и MCH из индуцированных плюрипотентных стволовых клеток, и было обнаружено, что аскорбиновая кислота необходима для HCRT и BMP7 для дифференцировки клеток MCH.Наши результаты предоставляют платформу для понимания развития и проявления HCRT и MCH и их многочисленных функций в отношении здоровья и болезней.
Боковой и задний гипоталамус играют центральную роль в регуляции приема пищи (1), состояний бдительности (2, 3), вознаграждения и мотивации (4). Среди основных типов клеток этой области — клетки, продуцирующие гипокретин / орексин (HCRT) и меланин-концентрирующий гормон (MCH). Эти нейропептиды не колокализуются, но их клетки пространственно перемешаны (5).
Нейроны HCRT и MCH посылают проекции по всей центральной нервной системе (ЦНС) (6, 7) и управляют своими эффектами через соответствующие рецепторы; Рецепторы 1 и 2 HCRT и рецепторы 1 и 2 MCH (8, 9). Нейроны HCRT проецируются на все стимулирующие бодрствование ядра мозга, расположенные в стволе мозга, базальных отделах переднего мозга, гипоталамусе и таламусе (7). Как физиологические интеграторы они действуют как промежуточные звенья между различными регуляторными путями, такими как вегетативная, эндокринная, система питания, вознаграждения и стресса (10, 11).Нейроны MCH также участвуют во многих функциях, включая сон, особенно сон с быстрым движением глаз (12), регулирование энергетического баланса (13), частоту ударов эпендимных ресничек и объем желудочков (14), и связаны с контролем стресса и обучением. и память (15, 16).
Существует множество доказательств того, что нарушения сна связаны с изменением передачи сигналов HCRT. Нарколепсия у собак связана с рецессивными мутациями потери функции в рецепторе 2 HCRT (17). Пациенты с нарколепсией с катаплексией (также называемой нарколепсией типа 1 или NT1) имеют пониженные или неопределяемые уровни в спинномозговой жидкости пептида HCRT-1, а иммуноокрашивание посмертного гипоталамуса показывает отсутствие или резко сниженное количество клеток HCRT, в то время как клетки MCH не повреждены (18).Дефицит гипокретина сопровождается внезапной потерей мышечного тонуса (катаплексией) и дневной сонливостью — двумя основными признаками нарколепсии с катаплексией. Кроме того, делеция гена Hcrt у мышей приводит к фенотипу, сходному с нарколепсией человека (19). Как пациенты с нарколепсией теряют экспрессию гена Hcrt или клеток HCRT, остается загадкой, но одна из гипотез — это аутоиммунное разрушение клеток HCRT (20). Специфический пептид, экспрессируемый клетками HCRT и нацеленный на иммунную атаку, неизвестен, хотя недавно сообщалось о наличии аутореактивных Т-клеток в отношении HCRT (21) при нарколепсии с катаплексией и без нее.Доказана важная роль MCH в патофизиологии ожирения, особенно ожирения, вызванного диетой (9, 13, 22). Каким образом эти многочисленные функции выполняются небольшим количеством типов нейрональных клеток гипоталамуса, необходимо тщательное изучение их внутренних свойств.
Карты транскрипции для клеток MCH отсутствовали до недавнего времени (23), и попытки получить профили для нейронов HCRT основывались на общей РНК или мРНК клеток HCRT посредством преципитации транскриптов и сравнения мозга с HCRT и без него (24–27), за исключением недавнего исследования одноклеточного транскриптома (23).Для мРНК, полученных из нейронов HCRT, некоторая часть транскриптов теряется из-за технических проблем и из-за того, что транскрипты не осаждаются из очищенных клеток. В сравнительном исследовании между HCRT-дефицитными и нормальными тканями мозга дифференциально экспрессируемые гены (DEG) могут быть замаскированы транскриптами других типов клеток. Наконец, для сравнения образцов использовалась технология микрочипов, которая менее чувствительна, чем секвенирование РНК (RNA-seq), метод, который позволяет обнаруживать транскрипты с дифференцированным сплайсингом и транскрипты с низким содержанием.У рыбок данио RNA-seq была использована на очищенных клетках HCRT и привела к идентификации гена Kcnh5a , который играет роль модулятора сна (28). В дополнение к этим подходам новые технологии, такие как одноклеточное секвенирование определенных (MCH и HCRT) (29) или целых типов клеток LH (23), существенно улучшили наше понимание молекулярных свойств этих типов клеток в мозге взрослых мышей.
Мы предположили, что за уникальные свойства клеток HCRT и MCH отвечает определенный механизм транскрипции.Чтобы идентифицировать молекулы, которые организуют раннюю спецификацию этих типов клеток, и охарактеризовать молекулы, уникальные для них, мы очистили эти клетки от мозга мыши. Мы идентифицировали набор факторов транскрипции (TF), играющих важную роль в определении судьбы как HCRT, так и MCH клеток. Один из них, PEG3, как было установлено, играет важную роль в регуляции состояний бдительности. Результат этого высокопроизводительного исследования и открытие этих специфических ТФ привели нас к разработке протокола для получения этих нейрональных популяций из фибробластов мыши, который потенциально может быть применен к человеческим клеткам для создания модели in vitro или для клеточно-заместительной терапии. при нарколепсии с катаплексией.Благодаря этому процессу мы также определили молекулы, которые могут иметь важное значение для понимания патофизиологии нарколепсии.
Результат
Анализ транскриптома различных областей мозга у мышей, подвергнутых абляции с
геном Hcrt или клетками Hcrt, выявил Qrfp как предполагаемый маркер нарколепсии с катаплексией.Для идентификации клеточных регуляторов HCRT-клеток мы использовали 2 модели нарколепсии с катаплексией на мышах: нокаут гена Hcrt ( Hcrt ko / ko ), мыши (19) и Hcrt — . ataxin-3 , у которых клетки HCRT уничтожены экспрессией гена атаксина-3 (30).Мы предположили, что сравнение транскриптома мозга этих мышей и их контрольной группы может выявить изменения транскрипции как из-за отсутствия гена Hcrt , так и нейронов HCRT в целом (как при нарколепсии). Мы вскрыли гипоталамус, ствол мозга и неокортекс взрослых мышей, принадлежащих к 4 группам генотипов: Hcrt ko / ko и Hcrt + / + однопометников и Hcrt-Ataxin-3 Tg + ) и однопометников WT.РНК очищали и подвергали высокопроизводительной RNA-seq.
Как и ожидалось, транскрипт Hcrt оказался сильно истощенным в гипоталамусе трансгенных мышей Hcrt ko / ko и Hcrt-атаксин-3 (рис. 1 A ). Тем не менее, было идентифицировано очень мало ДЭГ, за исключением Hcrt (скорректировано P <0,05) ( SI Приложение , Таблица S1). Анализ показал, что в коре головного мозга Hcrt ko / ko мышей транскрипты генов Kcnh5 и Krt12 подавлялись более чем в 2 раза. Kcnh5 кодирует потенциал-зависимый калиевый канал, который, как предполагается, играет роль в регуляции сна у рыбок данио (28). У мышей Hcrt-Ataxin-3 сравнение всех 3 областей мозга с соответствующими контролями выявило ген Cenpc1 со значительной активацией у трансгенных животных (фиг. 1 B ). Cenpc1 кодирует белок, который модулирует метилирование ДНК и код гистонов в центромерных областях (31).
Рис. 1.Идентификация Cenpc1 и Qrfp в качестве предполагаемых маркеров гена нарколепсии.( A — C ) Дифференциальный анализ секвенирования РНК между мышами Hcrt ko / ko (OXKO) или Hcrt-Ataxin-3 Tg (OXAt) и их соответствующими контрольными однопометниками (Ctrl) , проводилась в 3-х отделах головного мозга (ствол мозга, кора и гипоталамус). Изображены дифференциальные выражения Hcrt , Cenpc1 и Qrfp в каждом регионе. Обратите внимание, что уровни мРНК Qrfp примерно на 50% снижены в гипоталамусе трансгенных мышей Hcrt-ataxin-3 по сравнению с однопометными мышами дикого типа.Счетчики чтения были нормализованы с помощью пакета DESeq2. ( D — F ) Экспрессия Hcrt , Pmch и Qrfp в гипоталамусе трансгенных однопометников Hcrt-Ataxin-3 и WT в 4 временных точках развития (1, 3, 6, и через 9 недель после рождения). Показаны значения (среднее ± SEM, произвольные единицы), полученные на основе анализа qRT-PCR ( t тест, n = 3 мыши; * P = 0,023; ** P <0,01; *** P <0.001).
Одним из очень немногих генов, на которые повлияла потеря клеток HCRT в делеции Hcrt-Ataxin-3 , но не Hcrt , был Qrfp , который привлек наше внимание из-за своей нейропептидергической идентичности и анорексигенной функции. Hcrt-Ataxin-3 Tg + мышей продемонстрировали 50% снижение уровней транскрипта Qrfp в их гипоталамусе относительно контроля, тогда как уровни Hcrt ko / ko не отличались от мышей. Однопометники WT (рис.1 С ). Для подтверждения снижения Hcrt-атаксин-3 Tg + мышей гипоталамус Qrfp гипоталамус вскрывали в возрасте 1, 3, 6 и 9 недель и анализировали с помощью qRT-PCR. Наблюдалось массивное снижение экспрессии гена Hcrt в течение всех возрастов, в то время как не было изменений в экспрессии гена Pmch (рис. 1 D и E ). Снижение экспрессии гена Qrfp более чем на 50% наблюдалось во всех возрастных группах (1 нед .: WT = 0.9 ± 0,07 против tg = 0,31 ± 0,05, P <0,01; 3 недели: WT = 2,9 ± 0,2 против tg = 0,9 ± 0,06, P <0,01; 6 недель: WT = 1,8 ± 0,1 против tg = 0,6 ± 0,04, P <0,01; 9 недель: WT = 1,8 ± 0,1 по сравнению с tg = 0,7 ± 0,06, P <0,05; т тест) (рис.1 F ). На рыбках данио и мышах было показано, что QRFP и HCRT, скорее всего, включают разные подгруппы гипоталамических клеток без совместной локализации (25, 32). Тем не менее, одноклеточный РНК-анализ гипоталамуса показал совместную локализацию Qrfp и Hcrt , а иерархическая кластеризация подтипов гипоталамических нейронов, определенных по уникальным молекулярным отпечаткам пальцев, показала Hcrt и Qrfp среди ближайших подтипов нейронов. Разница в том, что нейроны QRFP также высоко экспрессируют нейротрофический фактор головного мозга (33).Наше открытие, что Qrfp теряется вместе с нейронами HCRT у Hcrt -аблированных мышей, предполагает, что Qrfp может играть роль не только в контроле сна и метаболизма, но потенциально при нарколепсии.
Сортировка интактных латеральных клеток гипоталамуса.
Несмотря на открытие Qrfp , вышеупомянутый эксперимент страдает несколькими недостатками, как описано во введении. Чтобы определить конкретные транскрипционные репертуары нейронов HCRT и MCH, мы решили очистить каждый тип клеток и сравнить их транскриптомы с остальной частью гипоталамуса и друг с другом.Уровень выживаемости клеток был слишком низким во время и после сортировки мозга взрослого человека, в то время как он был возможен на поздних эмбриональных стадиях (эмбриональные дни [E] 18 — E19). Мы разработали протокол, в котором гипоталамус трансгенных мышей E18 — E19 Hcrt-Cre (34) или эмбрионов C57BL / 6J препарировали, получали диссоциированные одиночные гипоталамические клетки и трансдуцировали вирусными векторами с репортерными белками (рис. и SI Приложение , Текст дополнительной информации ).Сложным вопросом была очистка клеток HCRT из-за малого количества клеток и низкого уровня экспрессии гена Hcrt на этой стадии развития. Следовательно, обычные репортерные маркеры, такие как eGFP у мышей Orexin-eGFP (35), не подходят. Чтобы улучшить сортировку, мы создали систему, позволяющую амплификацию репортерного гена. Мы воспользовались вектором аденоассоциированного вируса (AAV), в котором ген mCherry вставлен ниже промотора Eef1a1 в противоположной ориентации между двумя сайтами loxP (рис.2 В ). Нейробазальную среду, содержащую клетки и вирусный вектор, разливали в 96-луночные планшеты с низкой адгезией. Этот метод заставляет клетки быстро агрегироваться, что значительно улучшает выживаемость (рис. 2 A ). Агрегаты выдерживали в среде нейросферы в течение 7 дней, чтобы обеспечить накопление mCherry и сортировку клеток (рис. 2 C ). Мы смогли отсортировать 234,87 ± 126,29 mCherry + клеток из каждого мозга E18 — E19 и собрали около более 5000 клеток для каждой биологической реплики (3 реплики mCherry + и 3 mCherry —) ( SI Приложение ). , Рисунок.S1 A ). Общее количество высококачественной РНК, варьирующееся от 1 до 2,5 нг, было извлечено из образцов ( SI Приложение , рис. S1 C ), и РНК-seq была выполнена для идентификации DEG.
Рис. 2.Методы выделения нейронов HCRT и MCH. ( A ) Схема метода, используемого для выделения клеток гипоталамуса. трансгенных мышей Hcrt-Cre и мышей C57BL / 6J использовали для очистки клеток HCRT и MCH соответственно. В этом методе диссоциированные клетки гипоталамуса распределяют в 96-луночные планшеты с низким уровнем адгезии внутри нейросферной среды, содержащей вирусные векторы.Добавление bFGF со 2-го дня помогает повысить выживаемость. ( B ) Конструкция AAV, используемая для очистки клеток HCRT из мозга эмбриональных мышей Hcrt-Cre . В этом вирусном векторе для экспрессии mCherry требуется рекомбиназа Cre. ( C ) Культивируемые гипоталамические клетки E18, выделенные из трансгенных мышей Hcrt-Cre , после трансдукции AAV, несущего ген mCherry , накапливают достаточную экспрессию mCherry в течение 7 дней. ( D ) Двойная репортерная лентивирусная конструкция для очистки клеток МСН.( E ) Эмбриональные культуры гипоталамуса (Hypo), коры (Cx) и коры и гиппокампа (Cx + Hipp) трансдуцировали двойным репортерным лентивирусным вектором. Через 7 дней MCH и EGFP обнаруживаются только в гипоталамусе, которому принадлежат клетки MCH. (Масштаб: 50 мкм.)
Чтобы очистить клетки MCH, которые показывают достаточный уровень экспрессии от E18 до E19, мы выделили их на основе уровня экспрессии EGFP. С этой целью мы вставили последовательность eGFP между 2 длинными концевыми повторами лентивирусного остова pRRLSIN под промотором гена Pmch мыши и последовательностью mCherry под промотором PGK человека (рис.2 D ). Чтобы проверить, действует ли лентивектор специфически, мы трансдуцировали культуры клеток гипоталамуса, коры и коры + гиппокампа. Через неделю культуры окрашивали на экспрессию EGFP и MCH. Только в культурах гипоталамуса была обнаружена экспрессия и совместная локализация обоих пептидов, что указывает на специфичность нашей конструкции (фиг. 2 E ). Клетки MCH были отсортированы на основе этой лентивирусной системы, и примерно такое же количество клеток было отсортировано, и высококачественная РНК была извлечена для RNA-seq.
Идентификация обогащенных генов с помощью FACS-сортировки клеток HCRT и MCH.
Как и ожидалось, результаты RNA-seq показали большое обогащение счетчиков считываний для РНК mCherry в клетках HCRT (mCherry + = 67,1 ± 21,9 по сравнению с mCherry — = 11,2 ± 1,9, единиц на миллион считываний [имп ], среднее ± SEM) и для EGFP в клетках MCH (EGFP + = 82,5 ± 2,4 по сравнению с EGFP — = 15,6 ± 0,25, имп / мин, среднее ± SEM) (рис. 3 A и B ) . Этот анализ выявил 652 DEG, из них 350 генов, активируемых в клетках HCRT более чем в 2 раза.Помимо Hcrt , известными маркерами клеток HCRT являются Pdyn (увеличение в 3 раза), Dlk1, (увеличение в 4,5 раза) и Adra2a (увеличение в 3 раза) (24). Мы также идентифицировали 2665 DEG в клетках MCH по сравнению с другими типами клеток гипоталамуса; 468 из них были повышены более чем в 2 раза (Рис. 3 C и D и SI Приложение , Таблица S2). Более высокое количество DEG для нейронов MCH может быть связано с тем фактом, что эти нейроны кажутся более зрелыми на E18 – E19, чем нейроны HCRT.Проверка in silico (атлас Аллена) экспрессии некоторых из этих DEG подтвердила паттерны гипоталамической и латеральной гипоталамической экспрессии в мозге взрослой мыши ( SI, приложение , рис. S2). Мы также подтвердили совместную локализацию некоторых из этих генов с HCRT и MCH с помощью иммуногистохимии (рис. 3 E ).
Рис. 3.Проверка методов и обогащение генов, экспрессируемых в клетках HCRT и MCH. ( A ) Сортировка клеток HCRT: клетки, отсортированные по флуоресценции mCherry, показали обогащение по транскрипту Hcrt ( слева, ).Из-за очень низкой экспрессии гена Hcrt мы провели ПЦР, чтобы подтвердить обогащение клеток HCRT, и клетки mCherry + также были положительными по экспрессии Hcrt ( Right ). Результаты представляют собой результаты РНК-секвенирования, а уровень экспрессии транскрипта отображается как считывание импульсов в минуту. ( B ) Сортировка клеток MCH: клетки, обогащенные EGFP, показали обогащение транскриптами EGFP и Pmch . ( C и D ) Построение графика количества журналов на миллион считываний (LogCPM) иммунопреципитации в сравнении с входными данными LogCPM.Значимые гены DEG выделены красным, а незначимые — синим ( P > 0,05). Наружные линии — 2-кратное увеличение / уменьшение экспрессии. Отмечены некоторые репрезентативные гены. ( E ) Совместная локализация генов-кандидатов (красный) с нейропептидами HCRT и MCH (зеленый). (Масштабные линейки: слева , 50 мкм; справа , 20 мкм.)
Уникальные наборы генов различают типы клеток HCRT и MCH.
Мы определили 2 набора генов, которые могут лежать в основе уникальных характеристик этих 2 типов клеток: ( i ) набор генов с активностью связывания TF и ДНК и ( ii ) специфические гены, которые являются частью некоторых важных путей. и по-разному регулируются между двумя типами клеток.
Восемнадцать генов со связыванием ДНК и активностью TF были активированы более чем в 2 раза в клетках HCRT и 18 в клетках MCH. Только Ldb2 и Ahr были разделены между двумя типами ячеек, а остальные TF были привязаны к типу ячеек (Рис. 4 A и SI Приложение , Таблица S3). Lhx9 , предложенный в качестве регулятора развития клеток HCRT (24, 25, 36), существенно не изменился между типами клеток. Из других членов семейства генов Lhx только Lhx3 и Lhx6 были менее экспрессированы в клетках MCH ( SI Приложение , Таблица S2).
Рис. 4.Наборы генов, по-разному экспрессируемые в HCRT по сравнению с клетками MCH. ( A ) TF, обогащенные HCRT ( Left ) и клетками MCH ( Right ). Положительными являются чистые клетки HCRT и MCH, а отрицательными — другие клетки гипоталамуса. Выражение транскрипции отображается как LogCPM. * P <0,05; ** P <0,01; n = 3, среднее ± SEM. ( B ) Набор генов с противоположным направлением экспрессии между типами клеток HCRT (зеленый) и MCH (красный).График показывает кратное изменение экспрессии генов при сравнении транскриптома клеток HCRT и MCH с остальной частью гипоталамуса. ( C ) Иммуноокрашивание для совместной локализации клеток HCRT и MCH гипоталамуса с нейрональным маркером NeuN. Как показано, MCH, как и многие другие окружающие клетки, экспрессируют NeuN, а клетки HCRT — нет. (Масштаб: 20 мкм.)
Анализ пути дифференциально регулируемых генов выделил сигнальные пути, болезни и метаболические пути. В этот анализ мы включили все значительно дифференцированно регулируемые гены и определили общие, но дифференциальные пути между двумя типами клеток.Список генов с противоположным направлением экспрессии представлен на рис. 4 B . Эти гены имеют экзосомальные, гормональные и сигнальные функции, но в основном неизвестны функции и имеют латеральную гипоталамическую экспрессию. Анализ пути показал, что некоторые из этих генов участвуют в инфекционных заболеваниях, аутоиммунном заболевании щитовидной железы, надзоре за мРНК, боковом амиотрофическом склерозе и сигнальном пути PI3K-Akt ( SI Приложение , Таблица S4). Противоположное направление экспрессии этих генов в 2 типах клеток также может объяснять их противоположный вклад в поведение, такое как сон (HCRT способствует бодрствованию и MCH сну).
Анализируя паттерн экспрессии нейронов HCRT и MCH с помощью иммуногистохимии и с использованием зрелого нейронального маркера NeuN (антитело против NeuN против очищенных ядерных белков из мозга мыши), мы сделали счастливое открытие. Нейроны HCRT не экспрессируют маркер NeuN, в то время как нейроны MCH и другие нейроны гипоталамуса экспрессируют (рис. 4 C ). Чтобы проверить специфичность этого открытия, мы также протестировали другое антитело NeuN (против первых 100 аминокислот человеческого NeuN) и обнаружили точно такое же отсутствие окрашивания нейронов HCRT.Это удивительно, поскольку NeuN экспрессируется всеми зрелыми нейронами ЦНС, за исключением клеток Пуркинье и Гольджи мозжечка (37). NeuN кодируется Rbfox3 (38), регулятором сплайсинга, что позволяет предположить, что взрослые нейроны HCRT могут иметь набор дифференциально сплайсированных мРНК.
Несколько ионных каналов и рецепторов были также идентифицированы для каждого типа клеток ( SI Приложение , рис. S3). Наконец, мы обнаружили сильную активацию гена Trhr в клетках HCRT, и известно, что тиреотропин-рилизинг-гормон (TRH) стимулирует эти нейроны (39) ( SI Приложение , Таблица S2).
Морфолино нокдаун потенциальных ТФ.
Чтобы определить возможную роль ТФ-кандидатов в модуляции экспрессии генов Hcrt и Pmch , мы подавили их экспрессию морфолиноолигонуклеотидами (Мо) ( SI Приложение , Дополнительный Информационный Текст и Таблица S7) в эмбрионы рыбок данио на стадии 1 клетки. Среди ТФ-кандидатов PEG3 не обнаруживается в геноме рыбок данио. Поэтому мы использовали его ортолог в Danio rerio (si: ch311-266d19.4; XM_009297216.2; белок цинкового пальца 271, Zfp271 ). Среди 10 лучших ТФ, обогащенных клетками HCRT, Mo- Zfp271 в дозе 2,5 нг поразительно подавлял экспрессию гена Hcrt (рис. 5 A и B ), но не приводил к какому-либо дефекту развития (рис. 5A и SI Приложение , рис. S4 A ). Mo- Six6 (33%) и Mo- Prrx1 (10%) в дозе 1,25 нг также снижали экспрессию Hcrt . При 2,5 нг Mo- Six6 (45%) и Mo- Prrx1 (38%) имели наиболее выраженный эффект после Mo- Zfp271 (100%), Mo- Ahr (57%) и Mo- Nr2f2 (40%), что указывает на то, что клетки HCRT могут возникать из экспрессирующего шесть семейств домена эмбрионального гипоталамуса (40).Фенотип, полученный в результате нокдауна нескольких ТФ, обогащенных клетками MCH, представлял собой частичную потерю сигнала MCH для Mo- Gbx2 , Mo- Lmx1a и Mo- Msx2a (50%, 60% и 22% соответственно) ( SI Приложение , рис. S4 B ). Peg3 не был обогащен нейронами MCH, но чтобы проверить, оказывает ли он какое-либо влияние на экспрессию Pmch , мы также вводили Mo- Zfp271 и неожиданно обнаружили, что он также полностью отменяет экспрессию MCH ( SI, приложение , рис.S4 B ).
Рис. 5. Нокдаункритических ТФ, идентифицированных для экспрессии генов Hcrt и Pmch и поведения во сне у рыб. ( A , Left ) Смертность и частота дефектов развития личинок рыбок данио через 48 часов после оплодотворения, которым вводили 2,5 нг кандидата Мо ( SI Приложение , Таблица S7). Данные представлены как процентная доля рыб, проявляющих фенотип (10 < n <20). ( Справа ) Визуализация сигнала HCRT в полушариях мозга эмбрионов рыбок данио с помощью иммуноокрашивания и конфокальной микроскопии.Представлен процент полушарий головного мозга, положительных или отрицательных для сигнала HCRT для каждого кандидата Mo. ( B ) Репрезентативное изображение потери сигнала HCRT в мозге рыбок данио, инъецированных Mo- Zfp271 , по сравнению с контрольной группой. (10-кратное конфокальное увеличение.) ( C ) Часовое распределение локомоторной активности морфантов Zfp271 и их соответствующих контролей в течение 48 часов (ночь [10 часов] и день [14 часов]). Темные периоды обозначены серым цветом, а светлые — белым.Как показано на гистограмме ( справа, ), рыбки данио, инъецированные Mo- Zfp271 , демонстрируют снижение двигательной активности примерно на 50% в течение светового периода. ** P <0,01; *** P <0,001. ( D ) Почасовое распределение сна в течение 48 ч. Рыбки данио, инъецированные Mo- Zfp271 , демонстрируют значительное увеличение времени сна по сравнению с контролем. ( E ) Количество приступов сна и продолжительность схваток у рыб, получавших инъекцию Mo- Zfp271 , по сравнению с контрольной группой.Как в светлый, так и в темный периоды морфантов Zfp271 демонстрируют уменьшенное количество схваток. * P <0,05; *** P <0,001; n = 48, среднее ± SEM, t тест. ( F ) Подсчет нейронов HCRT и MCH у Peg3 гемизиготных мышей KO (Гц; Peg3 +/- ) и их однопометников WT. Был покрыт весь гипоталамус от передних до задних отделов, и все срезы были подсчитаны. * P = 0,04 для HCRT и * P = 0.02 для МЧ; общее количество клеток ± SEM, критерий Манна – Уитни U ; n = от 5 до 6. ( G ) Количественная ПЦР экспрессии мозга Hcrt , Pmch и Peg3 в разные моменты времени. Существует параллельное увеличение экспрессии Hcrt и Pmch вместе с Peg3 в течение 3 недель после рождения. * P = 0,019 для Peg3 и P = 0,03 для Pmch ; ** P <0.01; n = 3, среднее ± SEM; т испытание. ( H ) Потенциальная генная сеть для идентифицированных TF в клетках HCRT. Их взаимодействия извлекаются из баз данных. Более эффективные TF при исследовании рыбок данио (зеленые) имеют больший размер. Выявленные, но не протестированные ТФ выделены коричневым цветом, а потенциальные цели — красным.
Измененная двигательная активность и архитектура сна в
Zfp271 ( Peg3 Ortholog) сбитой рыбке данио.Обогащение Peg3 в клетках HCRT и его влияние на экспрессию нейропептидов HCRT и MCH предполагают возможное участие в регуляции сна.Эффект нокдауна Zfp271 на поведение рыбок данио оценивали с помощью анализа двигательной активности, как описано ранее (41, 42). Личинки Mo- Zfp271 проявляли значительно меньшую двигательную активность в основном в дневное время (день 1: WT = 42,6 ± 5,8 по сравнению с Mo- Zfp271 = 21,1 ± 2,7; P <0,01, t тест) (рис. С ). Это снижение активности сопровождается двукратным увеличением времени сна в течение дня (день 1: WT = 24,2 ± 2.6 по сравнению с Mo- Zfp271 = 45,2 ± 1,5; день 2: WT = 28 ± 2,2 по сравнению с Mo- Zfp271 = 41,6 ± 1,4; P <0,0001, t тест) (рис.5 D ). Анализ количества и продолжительности сна показал, что увеличение количества сна в основном связано с увеличением продолжительности сна как в светлое время суток (день 1: WT = 0,3 ± 0,02 против Mo- Zfp271 = 3,4 ± 1,3; P = 0,025, t test) и темный период (ночь 1: WT = 9,5 ± 1,3 против Mo- Zfp271 = 20.9 ± 2,5, P <0,0001; ночь 2: WT = 5,2 ± 0,6 по сравнению с Mo- Zfp271 = 9,3 ± 2, P = 0,05, t тест) (рис. 5 E ).
Peg3 Потеря функции у мышей снижает количество клеток HCRT и MCH.Peg3 экспрессируется от отцовского аллеля, и самки мышей, унаследовавшие целевую делецию этого аллеля, демонстрируют поразительное нарушение материнского поведения и снижение количества нейронов окситоцина (43). В той же модельной системе мы нашли 16.31% уменьшение количества клеток HCRT (WT [ n = 5]: 1716,4 ± 95,7 против KO [ n = 6]: 1436,5 ± 66,39, среднее ± SEM, P = 0,04, Манн-Уитни U ) и снижение количества клеток MCH на 15,44% (WT [ n = 5]: 3307,4 ± 123,6 по сравнению с KO [ n = 6]: 2796,5 ± 154,2, среднее ± SEM, P = 0,02, критерий Манна – Уитни U ) (рис. 5 F ). Эти значительные сокращения подтвердили роль Peg3 в регуляции этих критически важных типов клеток.
Мы также исследовали уровни экспрессии гена Peg3 у мышей в разные постнатальные моменты времени. Результаты показали, что на 21-й постнатальный день, когда Hcrt и Pmch достигают пика экспрессии, Peg3 также достигает своего максимального уровня, что указывает на сильную временную взаимосвязь экспрессии между 3 генами (рис. 5 G ). .
Данные транскриптома как дорожная карта для создания клеток MCH и HCRT из индуцированных мышами плюрипотентных стволовых клеток.
Чтобы лучше понять развитие нейронов HCRT и MCH, мы стремились установить эти типы нейрональных клеток из плюрипотентных стволовых клеток. Сначала мы сосредоточились на генерации клеток HCRT, чтобы легко контролировать их в культуре; мы установили индуцированные плюрипотентные стволовые клетки (ИПСК) из фибробластов кожи мышей Hcrt-eGFP . Это выполняли путем введения 4 TF (OCT3 / 4, SOX2, c-MYC и KLF4) в фибробласты, и через 2 недели колонии, подобные эмбриональным стволовым клеткам, собирали и увеличивали.Колонии экспрессировали известные маркеры плюрипотентности ( SI, приложение , рис. S5, A и C ) и подавляли свои трансгены, что обычно должно происходить после активации внутренних генов стволовости ( SI, приложение , рис. S5 B ). ). Установленные iPSCs также обладают сильным потенциалом дифференцироваться в направлении нейронной линии ( SI, приложение , Fig. S5 D ).
Чтобы дифференцировать наши ИПСК по отношению к предшественникам нейронов гипоталамуса, мы воспользовались протоколом, установленным Wataya et al.(44). В этом методе применяется строго определенная химическая среда с минимальным уровнем индуктивных сигналов, называемая «химически определенной средой, не содержащей факторов роста», вместе с быстрой агрегацией, при которой засеянные клетки быстро осаждаются в лунках 96-луночных планшетов с низкой адгезией. Предварительный скрининг с использованием этого протокола с различными условиями (более 100 условий) не смог вызвать экспрессию генов Hcrt и Pmch ( SI Приложение , рис. S5 E ).Затем мы проверили, может ли какая-либо конкретная сигнальная молекула индуцировать экспрессию некоторых ТФ, обогащенных HCRT ( Peg3 , Prrx1 и Six6 ) и клеток MCH ( Msx2 , Lmx1a и Rfx2 ). из нашего эксперимента с РНК-секвенцией. С этой целью, основываясь на днях, когда гипоталамические (ген Rax ) и нейроэпителиальные ( Sox1 ген) маркеры начинают активироваться во время нейрональной дифференцировки (рис.6 A ), мы изменили протокол и с первого дня 4 индивидуально применяли разные сигнальные молекулы и факторы роста ( SI Приложение , рис.S5 F ). Скрининг нескольких молекул выявил BMP7 как высокоэффективную молекулу, вызывающую экспрессию представляющих интерес ТФ (фиг. 6 B ). Почти все 6 ТФ, которые были протестированы, сильно экспрессировались в клетках, обработанных BMP7 (фиг. 6 B ). Интересно, что BMP7 индуцировал экспрессию Pmch , но не Hcrt гена (фиг. 6 B – D ).
Рис. 6.Генерация нейронов HCRT и MCH из ИПСК. ( A ) qRT-PCR для определения плюрипотентности ( Oct3 / 4 , Nanog ), гипоталамических ( Rax ) и ранних нейроэпителиальных ( Sox1 ) маркеров.Наблюдается значительное снижение уровня экспрессии плюрипотентных маркеров в течение 4 дней, в то время как гены гипоталамуса демонстрируют заметное повышение. ( B , Upper ) Схематическое изображение, которое показывает, что индукция генов-кандидатов, обогащенных клетками HCRT и MCH, с помощью определенной молекулы или состояния (?), Может индуцировать экспрессию Hcrt и Pmch. генов. ( Lower ) ОТ-ПЦР для ТФ, обогащенных клетками HCRT и MCH, в культурах, подвергшихся воздействию различных сигнальных молекул и факторов роста.ИПСК с использованием протокола в SI Приложение , рис. S5 F подвергались воздействию различных молекул, потенциально играющих роль в развитии гипоталамуса. BMP7 показал сильный потенциал для индукции всех указанных TF, а также Pmch . ( C ) Характер экспрессии Pmch в образцах с и без BMP7 после разных дней культивирования. Дифференцирующиеся нейросферы обрабатывали 10 нг / мл BMP7 и без него, начиная с 4-го дня. Только в образцах, обработанных BMP7, наблюдалась высокая экспрессия Pmch , но не в контроле.( D ) qRT-PCR для экспрессии Pmch . Образцы обрабатывали как в C . ( E ) Влияние различных концентраций BMP7 на характер экспрессии Pmch . Результаты показывают, что эффект BMP7 на экспрессию Pmch зависит от дозы. ( F ) Нейросферы выдерживали в среде для дифференцировки от 12 до 14 дней перед диссоциацией и посевом на чашки, покрытые PDL, для получения зрелых нейронов. Через две недели после посева клетки окрашивали на экспрессию MCH и MAP2.( G ) qRT-PCR для репрезентативных генов среди 30 протестированных генов ниже Bmp7 . ( H ) Схематическая модель того, как TF взаимодействуют друг с другом, чтобы вызвать экспрессию Pmch . Подробнее см. Обсуждение . ( I ) qRT-PCR для экспрессии Hcrt в различных условиях дифференцировки. Тот же метод, что и для дифференцировки MCH, использовали для управления экспрессией Hcrt , за исключением того, что аскорбиновую кислоту использовали вместо BMP7 с 3-го дня.Аскорбиновая кислота индуцировала экспрессию Hcrt отдельно и в комбинации с другими тестируемыми молекулами ( SI, приложение , таблица S5). Из-за короткой последовательности РНК гена Hcrt использовали 2 различных набора праймеров. ( J ) Гипоталамические клетки, полученные из Hcrt-eGFP и обработанные аскорбиновой кислотой, окрашивали на экспрессию EGFP и MAP2. ( K ) Через две недели после посева нейросфер дифференцированные клетки HCRT и MCH стимулировали TRH для HCRT и HCRT-1 для клеток MCH в течение 3 часов, и среду собирали для измерения секретируемых молекул в среде.Гистограммы показывают результаты ELISA анализа секреции нейропептидов HCRT и MCH. * P = 0,04 для HCRT и P = 0,039 для MCH; ** P <0,01; n = 3, среднее ± SEM, t тест. Для D , E , G и K : * P <0,05; ** P <0,01. Масштабные линейки: F и J , Left , 50 мкм; J , Right , 10 мкм.)
Затем мы провели подробный анализ влияния BMP7 на экспрессию Pmch .Воздействие нейросфер с 4-го дня показало, что BMP7 проявляет свой эффект через 2 дня после добавления, и экспрессия Pmch увеличивается в течение нескольких дней (фиг. 6 C ). Эффект BMP7 был более выражен только с 4-го дня ( SI, приложение , рис. S6, A ) и был дозозависимым (рис. 6 E и SI, приложение , рис. S6 D ). Sonic hedgehog, который является одним из основных регуляторов формирования гипоталамического паттерна (45), не был способен индуцировать экспрессию Pmch ни в разных средах, ни в разных концентрациях ( SI Приложение , рис.S6 D ). Влияние других членов семейства BMP, BMP4, было не таким сильным, как BMP7 ( SI Приложение , рис. S6 B ). Добавление ретиноевой кислоты, которая играет важную роль в формировании паттерна хвостовой части ЦНС (46), подавляет экспрессию Pmch ( SI Приложение , Fig. S6 C ). Через 2 недели нейросферы диссоциировали и культивировали на чашках с покрытием в течение 2 дополнительных недель, чтобы обеспечить рост зрелых нейронов. Окрашивание на MCH и MAP2 показало, что клетки, экспрессирующие MCH, также экспрессируют MAP2, что указывает на то, что эти клетки являются зрелыми нейронами (рис.6 F ). Мы проверили, влияет ли BMP7 на какую-либо конкретную комбинацию ТФ, отличную от ТФ, специфичных для клеток MCH, что приводит к индукции экспрессии гена Pmch . Анализ qPCR примерно 30 генов-кандидатов показал, что, хотя гены из семейства Pax сильно подавляются в условиях BMP7, Rax , важный маркер гипоталамуса, экспрессируется высоко. Six1 также показал повышенную экспрессию. Foxg1 , главный маркер развития конечного мозга, как и ожидалось, был сильно подавлен (рис.6 G ). Основываясь на наших данных и литературе, мы предлагаем модель, чтобы объяснить, как различные комбинации TF могут взаимодействовать друг с другом и как их повышающая или понижающая регуляция индуцирует экспрессию Pmch (Fig. 6 H ).
Все вышеупомянутые подходы не смогли вызвать какую-либо экспрессию HCRT, даже несмотря на то, что лечение BMP7 индуцировало HCRT-обогащенные TF (SIX6, PEG3 и PRRX1). Был проведен еще один большой экран молекул ( SI Приложение , рис.S6 E и Таблица S5) и включали витамин C в качестве одного из методов лечения. Причиной включения витамина C было обогащение гена Gulo (l-гулонолактоноксидаза) в нашем эксперименте с последовательностью РНК клеток HCRT, а также в нашем эксперименте с последовательностью РНК Hcrt-атаксин-3 мышей ( SI Приложение , рис. S6 F ). l-Гулонолактоноксидаза — это фермент, продуцирующий предшественник аскорбиновой кислоты (47). Хотя некоторые из проверенных молекул индуцировали экспрессию HCRT, можно было воспроизвести только лечение витамином С ( SI Приложение , рис.S6 G ). Включение витамина С в комбинации с различными молекулами показало его способность индуцировать экспрессию гена Hcrt (рис. 6, I ). Витамин С проявляет почти такой же эффект, как и ManNac, который, как ранее было показано, также индуцирует экспрессию гена Hcrt (48).
После посева клеток в чашки, покрытые поли-d-лизином (PDL), в наших культурах были обнаружены нейроны, экспрессирующие EGFP, полученные из Hcrt-EGFP ИПСК (рис.6 Дж ). Чтобы проверить, функционируют ли наши in vitro клетки MCH и HCRT, мы измерили секрецию их соответствующих нейропептидов в среде для культивирования клеток. Клетки MCH и HCRT, помещенные на чашки для PDL в течение 2 недель, секретировали около 96,61 ± 9,87 и 6,14 ± 1 пг / мл своих нейропептидов, соответственно (фиг. 6 K ). После стимуляции молекулой-индуктором (TRH [125 нМ] для клеток HCRT и HCRT-1 [1 мкМ] для клеток MCH) уровни увеличились до 115,35 ± 8,84 и 8,63 ± 0,38 пг / мл. Стадия созревания также влияет на их функциональность, и более зрелые нейроны показали большую секрецию MCH (3-недельная культура: 174.03 ± 31,67 против 2-недельного культивирования: 96,61 ± 9,87 пг / мл) и HCRT (3-недельное культивирование: 8,68 ± 2,3 против 2-недельного культивирования: 6,14 ± 1 пг / мл, среднее ± SEM, n = 3) нейропептиды (рис. 6 K ).
Сеть ТФ в ячейках HCRT и MCH.
Частичный или полный эффект удаления TF зависит от генной сети. Основываясь на литературе и различных базах данных (BioGRID, TRRUST и STRING), мы предсказали потенциальную сеть для 18 идентифицированных TF и их мишеней (физическое и генетическое взаимодействие) в клетках HCRT, что может объяснить результаты нашего эксперимента по нокдауну на рыбках данио. .PEG3 имеет наибольший вес в сети, поскольку его удаление полностью устраняет экспрессию HCRT (рис. 5 H ). Ldb2 , который не показал эффекта на экспрессию гена Hcrt при нокдауне, имеет прямое взаимодействие с семейством белков LHX, что, как было показано, необходимо для подмножества нейронов HCRT (24) (рис. H ). Чтобы получить более широкое представление и понять, как эти типы клеток выполняют свои многочисленные функции, мы создали карту TF, чтобы понять, как разные TF, назначенные для разных функций, таких как сон или кормление, взаимодействуют друг с другом.С этой целью мы использовали только экспериментально доступные данные, в которых было показано, что эти TF проявляют физическое или генетическое взаимодействие. Пул ТФ был выбран на основе следующих 3 критериев: ( i ) ТФ с повышенной регуляцией в наших данных РНК-seq, ( ii ) ТФ, регулирующие гены, с повышением регуляции более чем в 2 раза и ( iii) ) TF с известными функциями при определенном поведении, такими как FOXA2 (49) при кормлении и LHX9 (24) и EBF2 (50) во сне. Для всех TF мы также извлекли, играют ли они важную роль в конкретном фенотипе и являются ли они частью определенного пути.Некоторые TF участвовали в известных функциях, таких как развитие, сон, пищевое поведение и ожирение как в HCRT, так и в MCH клетках ( SI, приложение , рис. S7). Между различными функциональными группами существуют не только общие TF, но они также взаимодействуют друг с другом. Обычно выходом этой генной сети является экспрессия или ингибирование Hcrt , Pdyn (динорфин) и глутамата для клеток HCRT и экспрессия или ингибирование Pmch и Gaba для клеток MCH, а также правильное функционирование эти типы ячеек ( SI Приложение , рис.S7). Если эти выходные данные изменяются при различных физиологических и патологических условиях, это также требует изменения в генной сети. Ни один TF не может быть исключен из какой-либо функции, но на представленном здесь рисунке ( SI Приложение , рис. S7), основанном на имеющихся данных, показаны некоторые спецификации. Например, участие FOXA2 в кормлении может потребовать различных соединений в пределах 2 типов ячеек ( SI Приложение , рис. S7). К этой карте был также добавлен еще один слой, чтобы указать пути, в которых участвуют TF ( SI Приложение , Таблица S6).
Обсуждение
Используя маркеры конечной стадии латеральных нейронов гипоталамуса, которые представляют собой нейропептиды HCRT и MCH, мы установили их транскрипционный аппарат. Насколько нам известно, это исследование является уникальным в плане очистки интактных клеток HCRT и MCH из мозга поздних эмбрионов мышей. Мы определили молекулы, которые могут быть движущими силами этих нейронов, и использовали эти маркеры в качестве руководства для разработки протоколов создания этих клеток из ИПСК мыши.
Нашей целью было разработать метод диссоциации и культивирования живых нейронов и получить определенный маркер для выделения определенных типов клеток.С помощью репортерных белков под определенными промоторами и методом быстрой агрегации их можно было специфически очистить. Тем не менее, в случае типов клеток со слабой экспрессией их специфических маркеров требуется амплификация репортерного гена, для чего разработанный нами метод имеет высокую эффективность.
Мы показали, что для развития интактной гипокретиновой системы требуются PEG3, AHR, NR2F2, SIX6, PRRX1 и NKX6-2 в качестве TF, а для системы MCH требуются MSX2, GBX2, LMX1A, RFX2, SIX1, RAX, как а также ПЭГ3.Соответствующая роль этих транскрипционных факторов в развитии HCRT и MCH нуждается в дальнейших исследованиях с помощью экспериментов с потерей функции на мышах. Недавно в ходе комплексного исследования с использованием секвенирования отдельных клеток (23) были идентифицированы молекулярные сигнатуры нейронов HCRT и MCH в мозге взрослых мышей, которые могут дополнять наши эмбриональные результаты при построении общей схемы транскрипции для этих типов клеток. . Хотя из-за различий в возрасте развития мы не ожидаем идентичных результатов между этими двумя исследованиями, мы обнаружили важные гены и TF, общие для двух клеток HCRT ( Slc17a6 , Pdyn , Scg2 , Rasgrp1 и Плагл1 ).Интересно, что PLAGL1, который, как недавно сообщалось, играет роль в транскрипции Hcrt (51), обогащен в обоих наборах данных, предполагая, что этот TF в значительной степени экспрессируется от эмбриональной стадии до взрослого возраста и может участвовать в контроле экспрессии Hcrt . . Мы установили механизм транскрипции для этих двух типов клеток и проиллюстрировали взаимодействие TF друг с другом. Выявленные сети проливают свет на то, как эти типы клеток могут использовать свои механизмы во время нормального развития и функционирования взрослых.Эти сети могут также объяснить, как эти ячейки объединяют различные входы и должным образом функционируют по запросу. Мы разделили ТФ на подгруппы по поведению в отношении развития, сна и кормления и показали, как они могут взаимодействовать друг с другом. Документирована важная роль LHX9 и EBF2 как в развитии, так и во сне (24, 50), и мы добавляем сюда PEG3, который показал критическую роль в развитии и сне. Точная настройка этих сетей в течение дня и ночи гарантирует правильное функционирование этих клеток, которое в противном случае может привести к нарушению сна, ожирению и нарушениям обмена веществ.
Исследования потери функции подтверждают важность наших открытий на уровне развития, указывая на то, что обнаруженные здесь TF необходимы для правильного развития этих типов клеток. Удаление ортолога Peg3 ( Zfp271 ) полностью устраняет экспрессию HCRT и MCH у рыбок данио, а удаление отцовского аллеля Peg3 значительно снижает количество нейронов HCRT и MCH у мышей. Обратите внимание, что Zfp271 является ортологом Peg3 и имеет сходство с несколькими другими белками цинкового пальца.Следовательно, Zfp271 у рыбок данио может не быть функционально идентичным Peg3 у мышей. Кроме того, фенотип сна, связанный с Zfp271-, наблюдаемый у рыбок данио, может отличаться у мышей. Мы показали, что нокдаун Zfp271 влияет на двигательную активность у рыбок данио; однако у мышей это может влиять на другие аспекты сна, такие как фрагментация сна и ЭЭГ сна, а не на его общее количество, как показано в Hcrt KO / KO мышей.Такие видовые различия требуют дальнейшего изучения. Peg3 — импринтированный ген, тесно связанный с Zim1 (52). Было установлено, что импринтированный ген Magel2 , который аналогичен отцовски экспрессируемому гену Peg3 , также регулирует экспрессию Hcrt (53). Peg3 имеет промоторы, специфичные для пола и ткани (54), и считается, что, как и многие другие импринтированные гены, имеет моноаллельный паттерн экспрессии, хотя недавно было показано, что в некоторых областях мозга, особенно в гипоталамусе, существует двуаллельный паттерн выражения (55).Наше открытие, что делеция отцовского аллеля значительно снижает, но не отменяет экспрессию HCRT и MCH, предполагает, что здесь задействованы некоторые механизмы компенсации, включая роль материнского аллеля. Более того, Peg3 может играть роль в раннем развитии нейронов HCRT и MCH, а не на взрослой стадии. Как системы HCRT и MCH зависят от импринтированных генов и зависит ли Peg3 также от механизма тактовых импульсов ядра, еще предстоит выяснить.Участие Peg3 в модуляции сна у рыбок данио, по-видимому, зависит от его влияния на экспрессию Hcrt и Mch , но остается ли HCRT и MCH единственными затронутыми типами клеток и остается ли поражение обоих полов на одном уровне. необходимо изучить, поскольку было показано, что нейроны окситоцина гипоталамуса и материнское поведение затрагиваются у самок мышей KO Peg3 (43). Peg3 в ассоциации с Traf2 участвует в пути передачи сигнала TNF – NF-κB, что приводит к выживанию или гибели клеток (56).Следовательно, можно предположить, что в некоторых патологических состояниях, таких как нарколепсия, когда нейроны HCRT, по-видимому, избирательно разрушаются, Peg3 может участвовать в гибели клеток HCRT.
Трудности доступа к интактным нейронам человеческого мозга побудили нас разработать протоколы для производства этих клеток из ИПСК. Мы создали ИПСК из фибробластов мыши и дифференцировали их по типам латеральных гипоталамических клеток. Мы идентифицировали BMP7 как главную сигнальную молекулу, которая регулирует основные TF обоих типов клеток и экспрессию Pmch .Последовательность РНК клеток MCH указывает на то, что GBX2 является TF в этих клетках с повышенным уровнем регуляции. Экспрессия Gbx2 сильно влияет на экспрессию Pax2 (57, 58), которая сама подавляется BMP7 (рис. 6 G ). Six1 , который также активируется обработкой BMP7 (рис. 6 G ), имеет сильное генетическое взаимодействие с Pax2 (59). С другой стороны, MSX2, который представляет собой TF с самой высокой (5,5-кратное изменение) сверхэкспрессией в клетках MCH, высоко экспрессируется при воздействии BMP7 (рис.6 В ). На основании этих результатов мы предлагаем модель генерации клеток МСН из стволовых клеток (рис. 6 H ). Эта модель предполагает, что BMP7 является основным игроком в определении судьбы клеток MCH.
Чтобы вызвать экспрессию гена HCRT, мы применили витамин С, роль которого в развитии ЦНС хорошо известна. В мозге плода крысы было показано, что содержание витамина C увеличивается с 374 мкг / г на 15-й день беременности до 710 мкг / г к 20-му дню и остается на этом уровне до рождения (60).Наши результаты дополняют и добавляют маркеры индукции к другим исследованиям, которые успешно генерировали гипоталамические клетки из стволовых и ИПСК человека и мыши (48, 61–63). Поскольку мы получили нейроны HCRT от мышей Hcrt-EGFP , экспрессирующих eGFP под контролем промотора Hcrt человека размером 3,4 т.п.н. (64), полученные клетки могут не быть идентичными аутентичным нейронам HCRT мыши. Однако мы полагаем, что аутентичный промотор также активируется, поскольку мы сообщили об экспрессии Hcrt на уровнях мРНК и белка.
Мы идентифицировали гены и молекулы, которые могли играть роль в патофизиологии нарколепсии с катаплексией. QRFP — это последний нейропептид гипоталамуса, идентифицированный и участвующий в питании, двигательной активности, возбуждении и метаболизме (65–67). Совсем недавно было обнаружено, что QRFP и его рецептор GPR103 регулируют сон у рыбок данио (42). Кроме того, рецептор QRFP GPR103 гетеродимеризуется с рецепторами HCRT и участвует в защите от болезни Альцгеймера (68). QRFP, по-видимому, не колокализуется с HCRT, предполагая, что его пониженная экспрессия у мышей Hcrt-Ataxin-3 является вторичной по отношению к отсутствию клеток HCRT.Поскольку экспрессия Qrfp является нормальной у мышей Hcrt KO / KO , мы предполагаем, что его экспрессия находится под контролем других факторов, продуцируемых нейронами HCRT. Вторичное снижение QRFP при нарколепсии, если оно подтверждено, может объяснить вспомогательные симптомы, такие как поведение при приеме пищи и ожирение (30, 69). Тот факт, что идентифицированные TFs здесь также сильно обогащены иммунной системой, предполагает, что необходимы дополнительные исследования их роли в патофизиологии нарколепсии с катаплексией.
Методы
Животные.
Две модели нарколепсии на мышах [ Hcrt ko / ko : B6.129S6- Hcrt tm1Ywa / J и Hcrt-ataxin-3; Атаксин-3)] были использованы для выполнения секвенирования РНК различных областей мозга. Hcrt-Cre [B6; D2-Tg (HCRT-Cre-IRES-eGFP)] мышей использовали для очистки клеток HCRT, а мышей WT C57BL / 6J использовали для очистки клеток MCH. Hcrt-EGFP (B6; D2-Tg (HCRT-eGFP)) мышей использовали для установления ИПСК.Мышей Peg3 KO (129Sv.MF1- Peg3 Tm1 ) использовали для окрашивания и подсчета HCRT и MCH. Все животные были скрещены с C57BL / 6J в течение по крайней мере 10 поколений и предоставлены международными сотрудниками, за исключением мышей C57BL / 6J, которые были приобретены в лаборатории Charles Rivers. Животные содержались в стандартных условиях содержания животных со свободным доступом к пище и воде. Все протоколы экспериментов были одобрены Ветеринарной этической комиссией штата Во, Швейцария.
Секвенирование РНК.
Анализ транскриптома мышей с моделями нарколепсии выполняли, как описано в Nikolaeva et al. (70) и выровнен с Mus musculus GRCm38.75. Пакет R DESEQ2 использовался для статистических тестов. Для отсортированных гипоталамических клеток была создана двухцепочечная кДНК для подготовки библиотеки RNA-seq с использованием реагентов SMART-Seq v4 Ultra Low Input RNA (каталожный номер 634888, Clontech) в соответствии с протоколом, прилагаемым к реагентам, начинающимся с 2 нг (клетки MCH ) или 0.8 нг (для клеток HCRT) общей РНК и с использованием 11 циклов амплификации ПЦР. Затем 150 пг полученной кДНК использовали для приготовления библиотеки с реагентами библиотеки ДНК Illumina Nextera XT (каталожный номер 15032354, Illumina) с использованием протокола подготовки библиотеки одноклеточной РНК-seq, разработанного для Fluidigm C1 (Fluidigm). Анализ данных кратко изложен в Приложении SI , Текст дополнительной информации .
Поведенческие анализы.
Сон и активность рыбок данио оценивались на основании ссылок.41 и 42. Вкратце, поведенческие тесты были выполнены на рыбках данио, которым инъецировали 2,5 нг Zfp271 -Mo или H 2 O в качестве контроля. От 110 до 158 ч после оплодотворения личинок рыбок данио помещали в 96-луночный планшет, по 1 на лунку, в 300 мкл среды для эмбриона E3. Двигательная активность анализировалась модулем видеотрекинга классической версии Zebrabox (Viewpoint Lifescience). Система применила непрерывное инфракрасное обнаружение при 14/10-часовом цикле свет / темнота. Режим количественной оценки Zebrabox был настроен в соответствии с параметрами, описанными в Chen et al.(42): интервалы времени интегрирования, 1 мин; порог обнаружения — 15; взрыв, 29; замораживание, 3. Любая 1-минутная эпоха с менее чем 0,1 с движения считалась 1 минутой сна (42). Наконец, период сна был определен как непрерывная последовательность минут сна. Данные обрабатывались с помощью MATLAB.
Благодарности
Мы благодарим Центр геномных технологий Университета Лозанны (Швейцария) за выполнение нашего секвенирования РНК; и д-ру Т. Сакураи за предоставление мышей Hcrt ko / ko , орексин-EGFP, орексин-Cre и Hcrt-атаксин-3.Эта работа была поддержана грантами Швейцарского национального научного фонда 31003A_146615 и 31003A_173126 (для M.T.) и частично грантами от NRJ Foundation и Blackswan Foundation (для M.T.).
Сноски
Вклад авторов: A.S., R.M.J., F.A., and M.T. спланированное исследование; A.S., S.L., C.M., Y.A. и B.A. проведенное исследование; A.S., S.L., A.V., S.P., Y.A., H.P.M. и M.T. проанализированные данные; и A.S., A.V., R.M.J. и M.T. написал газету.
Авторы заявляют об отсутствии конфликта интересов.
Эта статья представляет собой прямое представление PNAS.
Размещение данных: данные, представленные в этой статье, были депонированы в базе данных Gene Expression Omnibus (GEO), https://www.ncbi.nlm.nih.gov/geo (инвентарные номера GSE126330 и GSE126345).
Эта статья содержит вспомогательную информацию на сайте www.pnas.org/lookup/suppl/doi:10.1073/pnas.18116/-/DCSupplemental.
- Авторские права © 2019 Автор (ы).Опубликовано PNAS.
Гипокретин | гормон | Британника
Узнайте об этой теме в этих статьях:нарколепсия
- При нарколепсии
… гормона, известного как гипокретин (также известного как орексин), который способствует бодрствованию. Потеря гипокретина, в свою очередь, может быть связана с основным аутоиммунным заболеванием, при котором иммунные клетки нацелены на гормон для разрушения. У некоторых людей предполагается, что аутоиммунитет против гипокретина возникает в результате… \ n
Подробнее
гормон
Альтернативное название: орексин
Узнайте об этой теме в этих статьях:нарколепсия
- При нарколепсии
… гормона, известного как гипокретин (также известного как орексин), который способствует бодрствованию.Потеря гипокретина, в свою очередь, может быть связана с основным аутоиммунным заболеванием, при котором иммунные клетки нацелены на гормон для разрушения. У некоторых людей предполагается, что аутоиммунитет против гипокретина возникает в результате…
Подробнее
Орексин при нарколепсии и других нарушениях сна
Орексин, вырабатываемый в области мозга, называемой гипоталамусом, является одним из химических мессенджеров или нейромедиаторов, которые воздействуют на ствол мозга и стимулируют прием пищи, бодрствование и использование энергии.Ученые открыли орексин в 1998 году и изучают их роль во сне и возбуждении, а также в лечении нарушений сна.
Мартин Маккарти / E + / Getty Images
Орексин, также называемый гипокретином, является частью класса химических веществ, называемых возбуждающими нейропептидными гормонами. Есть два разных пептида с похожей химической структурой: один известен как орексин-A (или гипокретин-1), а другой — орексин-B (или гипокретин-2). Дефицит орексина может нарушить способность организма поддерживать бодрствование и сон, что может привести к нарколепсии.
Орексин и нарколепсия
У людей, чей сон хорошо регулируется, орексины высвобождаются, когда они бодрствуют, и помогают увеличить активность нейронов, которые способствуют бодрствованию и подавляют быстрый сон — глубокий сон, когда возникают сны.
Когда кто-то страдает нарколепсией, которая характеризуется чрезмерной дневной сонливостью и засыпанием без предупреждения, это происходит потому, что его нейроны, производящие орексин, отмирают. Без орексинов человек с нарколепсией не может контролировать быстрый сон.В некоторых случаях сны, которые обычно случаются во время быстрого сна, могут происходить, когда человек бодрствует, что приводит к сновидению галлюцинаций.
Но почему орексины вообще отмирают? Исследователи полагают, что нарколепсия частично вызвана аутоиммунной атакой нейронов орексина. Как правило, у людей с нарколепсией повышен уровень антител, которые борются со стрептококком — бактериями, вызывающими стрептококк в горле. Это говорит о том, что аутоиммунная атака вызвана стрептококком или другой зимней инфекцией, особенно потому, что нарколепсия обычно начинается в конце весны или начале лета.
Лечение орексином
Если недостаток орексинов вызывает расстройств сна, тогда имеет смысл, что орексины также могут помочь вам бодрствовать, верно? Недавно был разработан класс препаратов, называемых антагонистами рецепторов орексина, для лечения нарушений сна, таких как бессонница. Эти средства для сна нацелены на действие орексина, блокируя передачу сигналов орексина в головном мозге. Орексин играет важную роль в том, чтобы люди бодрствовали и бодрствовали, поэтому их блокировка способствует сну.
Агонисты рецепторов орексина отличаются от других снотворных, отпускаемых по рецепту и без рецепта, тем, что они нацелены на другую и более локализованную химическую систему мозга.Суворексант, выпускаемый под названием «Белсомра», является первым доступным препаратом этого класса.
Какова роль гипокретиновой системы в патофизиологии нарколепсии?
Vendrame M, Havaligi N, Matadeen-Ali C, Adams R, Kothare SV. Нарколепсия у детей: одноцентровый клинический опыт. Педиатр Нейрол . 2008 май. 38 (5): 314-20. [Медлайн].
Плацци Г., Серра Л., Ферри Р. Ночные аспекты нарколепсии с катаплексией. Sleep Med Ред. . 2008 г., 12 (2): 109-28. [Медлайн].
Palaia V, Poli F, Pizza F, Antelmi E, Franceschini C, Moghadam KK и др. Нарколепсия с катаплексией, связанной с ночным компульсивным поведением: исследование случай-контроль. Сон . 2011 г., 1. 34 (10): 1365-71. [Медлайн]. [Полный текст].
Plazzi G, Pizza F, Palaia V, Franceschini C, Poli F, Moghadam KK и др. Сложные двигательные расстройства в дебюте заболевания в детском возрасте нарколепсия с катаплексией. Мозг . 2011 декабрь 134: 3480-92. [Медлайн]. [Полный текст].
Роджерс А.Е., Олдрич М.С., Лин X. Сравнение трех разных режимов сна для снижения дневной сонливости при нарколепсии. Сон . 2001 15 июня. 24 (4): 385-91. [Медлайн].
Бенбадис SR. Эффективное лечение нарколепсии кодеином у пациента, получающего гемодиализ. Фармакотерапия . 1996 май-июнь. 16 (3): 463-5. [Медлайн].
Szakacs Z, Dauvilliers Y, Михайлов В., Повереннова И., Крылов С., Янкович С. и др.Безопасность и эффективность питолизанта при катаплексии у пациентов с нарколепсией: рандомизированное двойное слепое плацебо-контролируемое исследование. Ланцет Нейрол . 2017 16 марта (3): 200-207. [Медлайн].
Wakix (питолизант) [вкладыш в упаковке]. Плимутская встреча, Пенсильвания: Harmony Biosciences, LLC. Август 2019 г. Доступно в [Полный текст].
Американская психиатрическая ассоциация. Диагностическое и статистическое руководство по психическим расстройствам, пятое издание .Арлингтон, Вирджиния: Американская психиатрическая ассоциация; 2013. 372-78.
Американская академия медицины сна. Пересмотренная Международная классификация нарушений сна: Руководство по диагностике и кодированию . 3-е изд. Рочестер, Миннесота: Американская академия медицины сна; 2014.
Ruoff C, Rye D. Рекомендации ICSD-3 и DSM-5 по диагностике нарколепсии: клиническая значимость и практичность. Curr Med Res Opin . 2016 20 июля. 1-12.[Медлайн].
Американская академия медицины сна. Международная классификация нарушений сна, . 2-е изд. Дариен, Иллинойс: Американская академия медицины сна; 2005.
Науманн А., Даум И. Нарколепсия: патофизиология и нейропсихологические изменения. Behav Neurol . 2003. 14 (3,4): 89-98. [Медлайн].
Берджесс CR, Скаммелл TE. Нарколепсия: нервные механизмы сонливости и катаплексии. Дж. Neurosci . 2012 Сен 5. 32 (36): 12305-11. [Медлайн]. [Полный текст].
Лин Л., Фарако Дж., Ли Р. и др. Нарушение сна у собак нарколепсия вызывается мутацией гена рецептора 2 гипокретина (орексина). Ячейка . 1999 6 августа. 98 (3): 365-76. [Медлайн].
Chemelli RM, Willie JT, Sinton CM, Elmquist JK, Scammell T, Lee C и др. Нарколепсия у мышей с нокаутом орексина: молекулярная генетика регуляции сна. Ячейка .1999 20 августа. 98 (4): 437-51. [Медлайн].
Diniz Behn CG, Klerman EB, Mochizuki T, Lin SC, Scammell TE. Аномальная динамика сна / бодрствования у мышей с нокаутом орексина. Сон . 2010 марта 33 (3): 297-306. [Медлайн]. [Полный текст].
Миньот Э., Ламмерс Г.Дж., Рипли Б., Окун М., Невсималова С., Оверим С. и др. Роль измерения гипокретина спинномозговой жидкости в диагностике нарколепсии и других гиперсомний. Arch Neurol .2002 Октябрь 59 (10): 1553-62. [Медлайн].
Partinen M, Saarenpää-Heikkilä O, Ilveskoski I, Hublin C, Linna M, Olsén P и др. Повышение заболеваемости и клинической картины детской нарколепсии после кампании вакцинации против пандемии h2N1 2009 г. в Финляндии. PLoS One . 2012. 7 (3): e33723. [Медлайн]. [Полный текст].
Nohynek H, Jokinen J, Partinen M, Vaarala O, Kirjavainen T, Sundman J, et al. Вакцина Ah2N1 с адъювантом AS03 связана с резким увеличением заболеваемости детской нарколепсией в Финляндии. PLoS One . 2012. 7 (3): e33536. [Медлайн]. [Полный текст].
Abad VC, Guilleminault C. Обзор нарушений сна при поведении, связанном с быстрым движением глаз. Curr Neurol Neurosci Rep . 2004 марта, 4 (2): 157-63. [Медлайн].
Миньот Э., Ламмерс Г.Дж., Рипли Б., Окун М., Невсималова С., Оверим С. и др. Роль измерения гипокретина спинномозговой жидкости в диагностике нарколепсии и других гиперсомний. Arch Neurol .2002 Октябрь 59 (10): 1553-62. [Медлайн].
Thannickal TC, Moore RY, Nienhuis R, Ramanathan L, Gulyani S, Aldrich M, et al. Уменьшение количества гипокретиновых нейронов при нарколепсии человека. Нейрон . 2000 сентября, 27 (3): 469-74. [Медлайн].
Thannickal TC, Nienhuis R, Siegel JM. Локальная потеря клеток гипокретина (орексина) при нарколепсии без катаплексии. Сон . 2009 г. 1. 32 (8): 993-8. [Медлайн]. [Полный текст].
Blouin AM, Thannickal TC, Worley PF, Baraban JM, Reti IM, Siegel JM.Нарп-иммуноокрашивание гипокретиновых (орексиновых) нейронов человека: потеря при нарколепсии. Неврология . 2005 25 октября. 65 (8): 1189-92. [Медлайн].
Nishino S, Sakurai E, Nevsimalova S, Yoshida Y, Watanabe T., Yanai K. Снижение гистамина в спинномозговой жидкости при нарколепсии с низким содержанием гипокретина-1 в спинномозговой жидкости и без него по сравнению со здоровым контролем. Сон . 2009 г. 1. 32 (2): 175-80. [Медлайн]. [Полный текст].
Канбаяси Т., Кодама Т., Кондо Х., Сато С., Иноуэ Ю., Чиба С.Содержание гистамина в спинномозговой жидкости при нарколепсии, идиопатической гиперсомнии и синдроме обструктивного апноэ во сне. Сон . 2009 г. 1. 32 (2): 181-7. [Медлайн]. [Полный текст].
Оверим S, Черный JL 3-й, Ламмерс GJ. Нарколепсия: иммунологические аспекты. Sleep Med Ред. . 2008 г., 12 (2): 95-107. [Медлайн].
Cvetkovic-Lopes V, Bayer L, Dorsaz S, Maret S, Pradervand S, Dauvilliers Y, et al. Повышенные уровни антител, специфичных к гомологу 2 Триббла, у пациентов с нарколепсией. Дж. Клин Инвест . 2010 Март 120 (3): 713-9. [Медлайн]. [Полный текст].
Dauvilliers Y, Abril B, Mas E, Michel F, Tafti M. Нормализация гипокретина-1 при нарколепсии после внутривенного лечения иммуноглобулином. Неврология . 2009 20 октября. 73 (16): 1333-4. [Медлайн].
Knudsen S, Mikkelsen JD, Bang B, Gammeltoft S, Jennum PJ. Внутривенное лечение иммуноглобулином и скрининг гипокретиновых нейрон-специфических аутоантител при недавно начавшейся детской нарколепсии с катаплексией. Нейропедиатрия . 2010 Октябрь 41 (5): 217-22. [Медлайн].
Сегал А., Миньот Э. Генетика сна и нарушений сна. Ячейка . 2011, 22 июля. 146 (2): 194-207. [Медлайн]. [Полный текст].
Mignot E. Сон, нарушения сна и гипокретин (орексин). Сон Мед . 2004 июн. 5 Приложение 1: S2-8. [Медлайн].
Weiner Lachmi K, Lin L, Kornum BR, Rico T., Lo B, Aran A, et al. Аллель-специфическая экспрессия DQB1 * 06: 02 зависит от аллельной дозы, а не от нарколептического статуса. Хум Иммунол . 2012 апр. 73 (4): 405-10. [Медлайн]. [Полный текст].
Hor H, Kutalik Z, Dauvilliers Y, Valsesia A, Lammers GJ, Donjacour CE и др. Полногеномное ассоциативное исследование выявляет новые гаплотипы HLA класса II, сильно защищающие от нарколепсии. Нат Генет . 2010 сентябрь 42 (9): 786-9. [Медлайн].
Халлмайер Дж., Фарако Дж., Лин Л., Хессельсон С., Винкельманн Дж., Кавашима М. и др. Нарколепсия прочно связана с альфа-локусом Т-клеточного рецептора. Нат Генет . 2009 июн. 41 (6): 708-11. [Медлайн]. [Полный текст].
Корнум Б.Р., Кавашима М., Фарако Дж., Линь Л., Рико Т.Дж., Хессельсон С. и др. Общие варианты P2RY11 связаны с нарколепсией. Нат Генет . 2011 Январь 43 (1): 66-71. [Медлайн]. [Полный текст].
Шимада М., Миягава Т., Кавасима М., Танака С., Хонда Y, Хонда М и др. Подход, основанный на полногеномном ассоциативном исследовании, выявляет кандидатные локусы нарколепсии. Хум Генет . 2010 Октябрь 128 (4): 433-41. [Медлайн].
Longstreth WT Jr, Koepsell TD, Ton TG, Hendrickson AF, van Belle G. Эпидемиология нарколепсии. Сон . 2007 г., 1 января 30 (1): 13-26. [Медлайн].
Silber MH, Krahn LE, Olson EJ, Pankratz VS. Эпидемиология нарколепсии в округе Олмстед, штат Миннесота: популяционное исследование. Сон . 2002 15 марта. 25 (2): 197-202. [Медлайн].
Dauvilliers Y, Arnulf I, Mignot E.Нарколепсия с катаплексией. Ланцет . 2007, 10 февраля. 369 (9560): 499-511. [Медлайн].
Доэрти Л., Кроу С., Суини Б. Национальное обследование нарколепсии. Ir Med J . 2010 апр. 103 (4): 110, 112-3. [Медлайн].
Дуглас, штат Нью-Джерси. Психосоциальные аспекты нарколепсии. Неврология . 1998, 50 февраля (2 приложение 1): S27-30. [Медлайн].
Pakola SJ, Dinges DF, Pack AI. Обзор правил и руководств для коммерческих и некоммерческих водителей с апноэ во сне и нарколепсией. Сон . 1995 18 ноября (9): 787-96. [Медлайн].
Прасад М., Сетти Г., Поннусами А., Хуссейн Н., Десуркар А. Катаплектические фации: клинический маркер в диагностике детской нарколепсии — отчет о двух случаях. Педиатр Нейрол . 2014 май. 50 (5): 515-7. [Медлайн].
Guilleminault C, Pelayo R. Нарколепсия у детей препубертатного возраста. Энн Нейрол . 1998, январь, 43 (1): 135-42. [Медлайн].
Bassetti C, Aldrich MS, Quint DJ.Результаты МРТ при нарколепсии. Сон . 1997 20 августа (8): 630-1. [Медлайн].
Мелберг А., Хетта Дж., Даль Н. и др. Аутосомно-доминантная мозжечковая атаксия, глухота и нарколепсия. J Neurol Sci . 1995 декабрь 134 (1-2): 119-29. [Медлайн].
Dauvilliers Y, Baumann CR, Carlander B, Bischof M, Blatter T, Lecendreux M, et al. Уровни гипокретина-1 в спинномозговой жидкости при нарколепсии, синдроме Клейне-Левина и других гиперсомнии и неврологических состояниях. J Neurol Neurosurg Psychiatry . 2003 декабрь 74 (12): 1667-73. [Медлайн].
Vossler DG, Wyler AR, Wilkus RJ, et al. Катаплексия и недостаточность моноаминоксидазы при болезни Норри. Неврология . 1996 май. 46 (5): 1258-61. [Медлайн].
Маэда М., Тамаока А., Хаяси А. и др. [Случай HLA-DR2, DQw1-отрицательной посттравматической нарколепсии]. Риншо Синкэйгаку . 1995 июл. 35 (7): 811-3. [Медлайн].
Фрай JM.Методы лечения нарколепсии. Неврология . 1998, 50 февраля (2 приложение 1): S43-8. [Медлайн].
Модафинил США в многоцентровой исследовательской группе нарколепсии. Рандомизированное испытание модафинила как средства лечения чрезмерной дневной сонливости при нарколепсии. Неврология . 2000 14 марта. 54 (5): 1166-75. [Медлайн].
Golicki D, Bala MM, Niewada M, Wierzbicka A. Modafinil для нарколепсии: систематический обзор и метаанализ. Медицинский научный мониторинг .2010 16 августа (8): RA177-86. [Медлайн].
Веб-сайт Nuvigil. Доступно на http://www.nuvigil.com/. Дата обращения: 08.12.2009.
Thorpy MJ, Shapiro C, Mayer G, Corser BC, Emsellem H, Plazzi G, et al. Рандомизированное исследование солриамфетола при чрезмерной сонливости при нарколепсии. Энн Нейрол . 2019 Март 85 (3): 359-370. [Медлайн].
Веб-сайт Xyrem. Доступно на https://www.xyrem.com/.
Lockrane B, Bhatia P, Gore R.Успешное лечение нарколепсии и катаплексии: обзор. Банка Респир J . 2005 май-июнь. 12 (4): 225-7. [Медлайн].
Black J, Pardi D, Hornfeldt CS, Inhaber N. Ночное использование оксибата натрия связано с уменьшением нарушений ночного сна: двойное слепое плацебо-контролируемое исследование у пациентов с нарколепсией. J Clin Sleep Med . 2010 15 декабря. 6 (6): 596-602. [Медлайн]. [Полный текст].
Vignatelli L, D’Alessandro R, Candelise L.Антидепрессанты при нарколепсии. Кокрановская база данных Syst Rev . 2005 20 июля. CD003724. [Медлайн].
[Рекомендации] Моргенталер Т.И., Капур В.К., Браун Т., Свик Т.Дж., Алесси К., Аврора Р.Н. и др. Параметры практики лечения нарколепсии и других гиперсомний центрального происхождения. Сон . 2007 30 декабря (12): 1705-11. [Медлайн]. [Полный текст].
Спенсер Т.Дж., Мадрас Б.К., Бонаб А.А., Догерти Д.Д., Кларк А., Мирто Т. и др.Исследование позитронно-эмиссионной томографии, изучающее дофаминергическую активность армодафинила у взрослых с использованием [C] альтропана и [¹¹C] раклоприда. Биологическая психиатрия . 2010 15 ноября. 68 (10): 964-70. [Медлайн].
Орексинов: понимание их роли во сне
Заявление об отказе от ответственности: содержимое этой страницы не следует воспринимать как медицинский совет или использовать как рекомендацию для каких-либо конкретных лекарств. Всегда консультируйтесь с врачом перед приемом любого нового лекарства или изменением текущей дозировки.
Нервные клетки в организме, также называемые нейронами, общаются друг с другом через химические посредники, называемые нейротрансмиттерами. Нейротрансмиттеры контролируют практически все, что мы делаем, влияя на наши мысли и чувства и координируя наши действия. Один тип нейромедиатора называется нейропептидом.
Орексины — это нейропептиды, вырабатываемые в части мозга, называемой гипоталамусом. Из миллиардов клеток головного мозга только от 10 000 до 20 000 клеток вырабатывают орексин.Эти клетки производят два типа орексинов: орексин-A и орексин-B.
Эти нейропептиды были открыты двумя группами примерно в одно и то же время, поэтому в научном сообществе у них есть два взаимозаменяемых названия. Одна группа выбрала название орексин, происходящее от греческого «orexis», что означает аппетит. Другая группа назвала эти нейропептиды гипокретинами, потому что они были обнаружены в гипоталамусе. Поэтому орексин-A и орексин-B часто называют гипокретином-1 и гипокретином-2.
Орексины в организме
Нейроны, производящие орексин, получают сигналы от тела, эмоций и окружающей среды, а затем выделяют орексины, которые влияют на всю центральную нервную систему. Фактически, орексины, по-видимому, играют в организме такие разнообразные роли, что исследователи утверждают, что мы только начинаем понимать их важность.
Считается, что орексины в первую очередь возбуждающие, что означает, что они заставляют другие нейроны становиться активными и начинают посылать свои собственные сигналы.Среди множества обнаруженных функций орексинов они, по-видимому, играют важную роль в сне, энергетическом обмене и настроении.
Недавнее исследование предложило гипотезу, которая пытается объяснить все, казалось бы, разнообразные роли орексинов в организме. Эта гипотеза предполагает, что орексины регулируют поведение во время физиологической потребности, воздействия угроз и возможностей для вознаграждения.
Понимание многих эффектов орексинов в организме очень интересно и ценно.Исследования в этой области расширяют наше понимание человеческого тела. Он также предлагает новые многообещающие способы лечения множества состояний, включая бессонницу, нарколепсию, депрессию и даже ожирение.
Сон и возбуждение
Предполагается, что основная роль орексинов — контролировать сон и возбуждение, а нейроны, выделяющие орексины, наиболее активны в течение дня. Чтобы не дать нам уснуть, эти нейропептиды стимулируют другие нейроны высвобождать нейротрансмиттеры, которые повышают бдительность, такие как дофамин, серотонин и норадреналин.
Без достаточного количества орексинов организму трудно бодрствовать и бодрствовать. У людей с диагнозом нарколепсия 1 типа наблюдается снижение количества нейронов, вырабатывающих орексины, на 85-95%. Эта потеря нейронов, продуцирующих орексин, приводит к симптомам нарколепсии, включая чрезмерную дневную сонливость, паралич сна, галлюцинации и катаплексию.
Хотя увеличение веса не является признаком нарколепсии, люди с этим заболеванием с большей вероятностью будут иметь избыточный вес. Исследования показывают, что связь между нарколепсией и увеличением веса может быть связана с ролью орексина в регулировании физической активности.
Стресс, физическая активность и ожирение
Орексины играют важную роль в реакции организма на стресс. Принимая сигналы из окружающей среды, нейроны, производящие орексин, реагируют на давление, возбуждая другие нейроны, которые увеличивают частоту сердечных сокращений и артериальное давление, помогая организму перейти из состояния покоя в состояние, когда оно готово реагировать и двигаться.
При меньшем количестве химических сигналов для мотивации реакции недостаток орексинов связан с гиподинамией и ожирением.Исследования на животных показали, что мыши, которые теряют свои нейроны, продуцирующие орексин, менее физически активны, имеют пониженный энергетический обмен и более склонны к развитию ожирения и диабета, даже если они потребляют меньше калорий.
Настроение и память
Орексины также возбуждают нейроны, важные для регулирования настроения. Слишком высокая или слишком низкая активность орексина связана с депрессией и другими психическими заболеваниями, такими как тревога, паническое расстройство, зависимости и посттравматическое стрессовое расстройство.
Эти нейропептиды также влияют на настроение благодаря своей функции в части мозга, называемой гиппокампом. Орексины стимулируют создание новых нейронов в гиппокампе, что важно для обучения, памяти и пространственных способностей. Без достаточного количества орексинов у людей могут развиться проблемы с обучением и памятью.
Снотворные препараты, нацеленные на орексины
Поскольку орексины стимулируют бодрствование, блокирование действия этих нейропептидов является одним из способов лечения некоторых нарушений сна.Двойные антагонисты рецепторов орексина (DORA) — это новый тип рецептурных снотворных, которые воздействуют на систему орексинов организма. Эти лекарства действуют как антагонисты рецепторов орексина, что означает, что они блокируют действие орексинов в организме, уменьшают стремление бодрствовать и облегчают сон.
Два типа DORA в настоящее время одобрены Управлением по контролю за продуктами и лекарствами (FDA) для лечения бессонницы у взрослых: суворексант и лемборексант. Новые DORA все еще находятся в разработке.
DORA отличаются от других типов снотворных, поскольку влияют на разные системы организма. Безрецептурные снотворные, такие как дифенгидрамин и мелатонин, вызывают седативный эффект или помогают регулировать циркадный ритм организма. Снотворные средства, отпускаемые по рецепту, способствуют засыпанию другими способами, например, воздействуют на рецепторы ГАМК в головном мозге, и могут иметь нежелательные побочные эффекты, такие как проблемы с памятью, изменения поведения и даже галлюцинации.
Исследователи надеются, что, воздействуя на орексиновую систему организма, DORA может быть эффективным с меньшим количеством побочных эффектов.Фактически, оба DORA, одобренные FDA, улучшают качество сна у людей с бессонницей, и наиболее частым побочным эффектом, связанным с их использованием, является сонливость. Они также могут улучшить архитектуру сна и использовались для улучшения делирия у госпитализированных пациентов.
Хотя DORA предлагают новый многообещающий подход к лечению бессонницы, они подходят не всем. Прежде чем принимать какие-либо лекарства, обязательно проконсультируйтесь с врачом или специалистом по сну. Для многих людей, страдающих бессонницей и другими проблемами со сном, полезно сначала сосредоточиться на изменении поведения, например, на улучшении гигиены сна, прежде чем рассматривать возможность приема лекарств.
- Была ли эта статья полезной?
- Да Нет
Гипокретин и рецепторы — Протеопедия, жизнь в 3D
Гипокретины
Гипокретины, также называемые орексинами, представляют собой нейропептиды гипоталамуса, которые выполняют важные функции в регуляции цикла сна / бодрствования человека, гомеостатических систем, таких как терморегуляция, аппетит и обработка вознаграждения [1] . Орексины бывают двух видов: длиной 33 аминокислоты и длиной 28 аминокислот [2] .Оба пептида орексина состоят из двух амфипатических α-спиралей, которые имеют свойства, аналогичные свойствам N-концевых α-спиралей, обнаруженных на рецепторах орексина. Орексин-A можно описать как неселективный к подтипу нейропептид, который способен связываться либо с OX1R, либо с OX2R, двумя возможными рецепторами орексина, с примерно равным сродством. Однако Orexin-B связывается с OX2R со сродством, в 10 раз превышающим его сродство к OX1R [2] . имеет гидрофильный поворот, вызванный двумя дисульфидными связями, позволяя гидрофобным остаткам находиться на одной стороне, а гидрофильным остаткам — на другой стороне.
См. Также Орексин и рецептор орексина.
Рецепторы
Orexin-A и Orexin-B связываются с соответствующими рецепторами, связанными с G-белками, известными как и. Хотя и OX1R, и OX2R можно найти в головном мозге млекопитающих, они неравномерно распределены по всему мозгу. OX1R и OX2R, оба, имеют α-спираль во внеклеточных N-концевых областях. N-концевые α-спирали играют важную роль в активации нейропептидов, опосредованной Orexin-A. Хотя структуры N-концевых α-спиралей как OX1R, так и OX2R схожи, ориентация этих двух рецепторов различна.В то время как N-концевая α-спираль взаимодействует с внеклеточной петлей 2 (ECL2), N-концевая α-спираль OX2R оказывается параллельной спирали 8 на внутриклеточной стороне мембраны [2 ] . Остатки около положений 2,61 Å и в OX1R, и в OX2R играют решающую роль в определении селективности подтипа [2] . Рецепторы орексина вызывают нейровозбуждение посредством постсинаптической деполяризации, активируя неселективные катионные каналы, ингибируя K + каналы и активируя обмен Na + / Ca2 +.Кроме того, OX1R и OX2R стимулируют высвобождение нейротрансмиттеров посредством пресинаптических действий, а OX1R и OX2R модулируют синаптическую пластичность. Было показано, что оба рецептора орексина сильно связаны с повышением уровня ионов Ca2 + и фосфолипазой C. Низкие концентрации орексина вызывают стимуляцию OX1R, активируя приток Ca2 + [3] . Было указано, прямо или косвенно, что OX1R и OX2R могут соединяться с Gq, Gi / o и Gs, тремя из четырех семейств гетеротримерных G-белков. Исследования также показали, что OX2R может по-разному связываться с белками Gq, Gi / o и Gs в зависимости от того, в каком из различных возможных типов тканей OX2R может быть обнаружен, OX2R находится в пределах [3] .Поскольку OX1R и OX2R играют важную роль в регуляции сна, нарушения сна, такие как нарколепсия, могут быть вызваны мутациями этих регуляторов. Нарколепсия, в частности нарколепсия 1 типа, может быть вызвана мутацией гена OX2R (HCRTR2) [2] .
ФункцииПоложение о сне-бодрствовании
Низкое количество орексина и мутации гена OX2R (HCRTR2) были связаны с развитием нарколепсии, нарушения сна, характеризующегося чрезмерной дневной сонливостью, катаплексией, параличом сна и гипнагогическими галлюцинациями.Считается, что катаплексия, потеря мышечного тонуса, гипнагогические галлюцинации, галлюцинации, возникающие во время засыпания человека, и сонный паралич, иммобилизация тела человека при падении или пробуждении, вызываются неожиданным прерыванием быстрого сна. Нарколепсия вызывает отсутствие регуляции цикла сна / бодрствования, и, таким образом, нарколепсия часто вызывает прерывание как бодрствования человека, так и его быстрого сна. Орексин взаимодействует с несколькими группами нейронов, способствующими бодрствованию, такими как гистаминергические нейроны туберомаммилярного ядра и норадренергические нейроны голубого пятна.Голубое пятно — это структура в стволе мозга, вырабатывающая нейромедиатор норадреналин. Таким образом, можно сделать вывод, что при стимуляции нейронов Orexin возможность перехода в состояние бодрствования увеличивается. Однако, если нейроны орексина подавлены, вероятность перехода в состояние сна увеличивается. Нарколепсия также характеризуется фрагментированным сном, то есть сном, прерываемым множеством коротких периодов возбуждения. Фрагментарный сон вызван нестабильностью регуляции поведенческого состояния из-за отсутствия орексина, снижающего пороговые значения, необходимые для перехода между сном и бодрствованием.Поскольку нарколептики имеют тенденцию засыпать днем, но часто просыпаются ночью, вполне вероятно, что орексин действует как способ стабилизации перехода между состояниями сна и бодрствования, а также вызывает переход между состояниями. [1]
Терморегуляция
Во время сна тело вырабатывает меньше тепла из-за снижения мышечной активности, снижения основного метаболизма, периферической вазодилатации и нейронов, способствующих сну, в преоптической области. Люди с нарколепсией имеют более низкую внутреннюю температуру тела во время бодрствования и более высокую, чем обычно, температуру тела во время сна.Указывает, что нарколепсия не позволяет температуре тела и скорости основного обмена должным образом снижаться или повышаться в соответствующие периоды сна или бодрствования. Обычно температура дистального отдела кожи изменяется обратно пропорционально внутренней температуре тела. В течение дня внутренняя температура тела высокая, а температура дистальных отделов кожи относительно низкая. Ночью внутренняя температура тела снижается, а температура дистальных отделов кожи относительно высока. Начало сна может характеризоваться повышением температуры кожи в дистальных отделах по сравнению с температурой в проксимальных отделах кожи.У нарколептиков в бодрствующем состоянии наблюдается более высокая температура кожи в дистальных отделах и более низкая температура в проксимальных отделах. Это может быть связано с чувством сонливости, которое испытывают нарколептики, поскольку обычно такая комбинация температур проявляется во время периодов сна. Кроме того, нарколептики лучше способны поддерживать бодрствование, когда их внутренняя температура и температура дистальных отделов кожи изменяются, чтобы имитировать условия, обычно испытываемые во время бодрствования.Орексин также играет важную роль в активации коричневой жировой ткани для повышения температуры тела. Это указывает на то, что орексин играет роль в активации как бодрствования, так и выработки тепла в ответ на снижение температуры окружающей среды. Система Orexin оптимизирует метаболизм при выполнении таких действий, как поиск пищи или размножение, где требуется повышенная производительность, путем повышения температуры тела во время бодрствования. В заключение, нарколептики обладают неспособностью точно модулировать терморегуляторный контроль в зависимости от своего поведенческого состояния. [1]
Поиск еды и получение вознаграждения
Название «орексин» возникло в основном из-за его роли в пищевом поведении, поскольку слово орексин в переводе с греческого означает «аппетит». Гипокретиновые нейроны подавляются после кормления, уменьшая возбуждение, и активируются во время голодания, увеличивая возбуждение. Если орексин не может выполнять свою нормальную функцию, усиление бодрствования и поведения в поисках пищи, которое ожидается в качестве реакции на недостаток пищи, не произойдет.Генетическое устранение орексина приводит к снижению активности упреждения пищи и ожидаемой временной экспрессии многих часовых генов. Это указывает на то, что орексин опосредует сдвиги в циркадных ритмах в ответ на изменения во времени доступности пищи или статуса питания. Поскольку стремление к еде имеет решающее значение для выживания, оно несет в себе мощный стимул к вознаграждению. Орексин играет активную роль в получении вознаграждения как за поведение, связанное с поиском пищи, так и за наркотики. Несмотря на то, что нарколептиков часто лечат стимуляторами в течение многих лет, они редко злоупотребляют стимуляторами или проявляют поведение, связанное с поиском наркотиков.Поскольку частое употребление стимуляторов может привести к зависимости и может привести к злоупотреблению этим лекарством в ответ на растущую толерантность к действию стимулятора, отсутствие поведения, связанного с поиском наркотиков, и злоупотребление стимуляторами у нарколептиков в значительной степени указывает на то, что орексин играет решающую роль в развитии зависимости . В заключение, Орексин играет важную роль в мотивационном поведении и обработке вознаграждения.
