Cовременные подходы к лечению больных дисциркуляторной энцефалопатией
Одной из самых актуальных проблем современной неврологии являются цереброваскулярные заболевания (ЦВЗ),
особое значение среди которых в силу своей высокой и прогрессивно возрастающей распространенности приобретает дисциркуляторная энцефалопатия (ДЭ). По данным официальной статистики МЗ Украины, в нашей стране ДЭ страдает около 5,6% населения. Причем за последние 10 лет темпы роста ДЭ практически удвоились, что связано как с истинным ростом данной патологии, так и с гипердиагностикой заболевания. Важность проблемы ДЭ определяется и тем, что течение этой патологии у многих больных осложняется развитием острых нарушений мозгового кровообращения (транзиторных ишемических атак (ТИА), мозговых инсультов (МИ), а также сосудистой деменции. ДЭ значительно влияет на качество жизни пациентов и является частой причиной временной и стойкой нетрудоспособности, что обусловливает чрезвычайную актуальность этой патологии.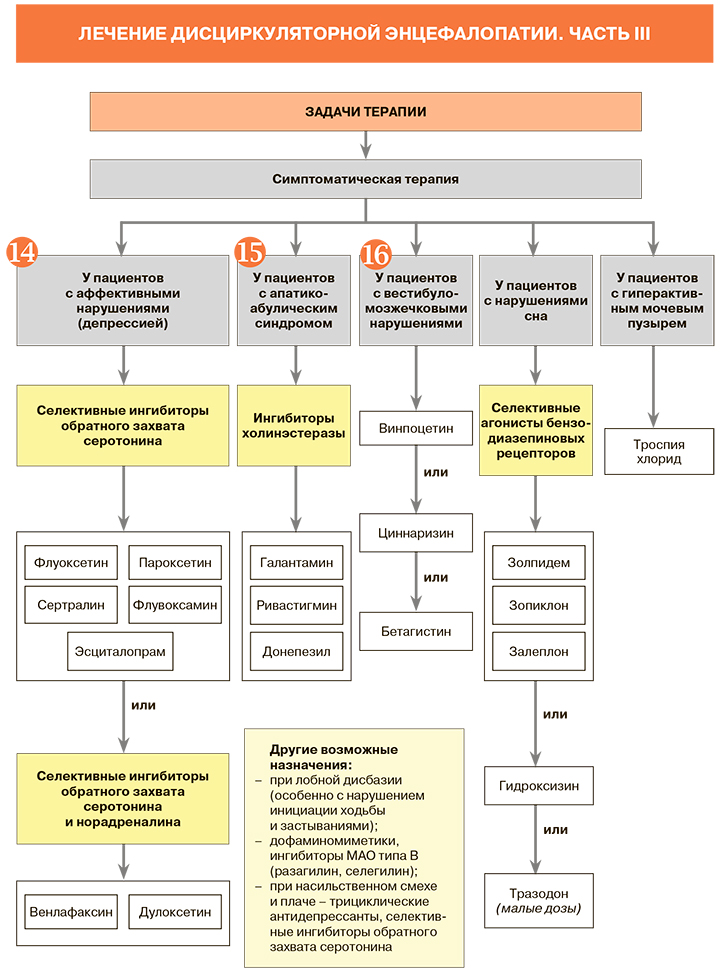
Лечение больных ДЭ представляет собой непростую задачу. К тому же в последние десятилетия ситуация значительно осложнилась. Так, на фармацевтическом рынке Украины представлено большое количество лекарственных препаратов, в показаниях для назначения которых значится ДЭ. Почти ежедневно врачей-неврологов посещают медицинские представители фармацевтических компаний, которые представляют информацию о препаратах (брендах или генериках) для терапии ДЭ. На страницах периодической медицинской литературы регулярно публикуются статьи об эффективности тех или других лекарственных средств в лечении больных ДЭ. Практически на каждой научно-практической конференции, пленумах и конгрессах звучат доклады, посвященные проблемам лечения ДЭ. В большом потоке информации, порой разноречивой, врач попросту теряется, что не может не отразиться на качестве лечения пациентов с ДЭ. Анализ листов назначения в историях болезни и амбулаторных картах показывает, что в ряде случаев одному и тому же больному назначают одновременно 2 и более препарата с однонаправленными механизмами действия или вообще бренд и генерик.
В связи с этим возникает несколько вопросов. Как эффективно, безопасно и в то же время рационально лечить больного ДЭ? Как повысить качество лечения пациентов с ДЭ и избежать развития у них осложнений в виде МИ и деменции?
Конечно же, на сегодня эффективным может быть только лечение, основанное на принципах доказательной медицины. К сожалению, далеко не все лекарственные средства или другие методы лечения, используемые в терапии ДЭ, прошли клинические испытания с соблюдением всех требований GCP (качественной клинической практики), эффективность и безопасность которых статистически достоверно доказана. Это связано с тем, что термин «дисциркуляторная энцефалопатия» отсутствует в Международной классификации болезней и не применяется в других странах мира.

Назначая больным ДЭ медикаментозное лечение, врач должен понимать цели этой терапии:
• снижение темпов прогрессирования ДЭ;
• устранение или уменьшение выраженности неврологических и психических проявлений заболевания;
• предупреждение развития ТИА, первого или повторного инсульта, инфаркта миокарда, заболеваний периферических артерий;
• предотвращение развития и прогрессирования деменции.
Для достижения всех вышеперечисленных целей сегодня в арсенале врача имеются все возможности.
Ведущую роль в терапии ДЭ занимает лечение основного заболевания (артериальной гипертензии (АГ), артериальной гипотензии, атеросклероза, васкулитов), обусловившего развитие ДЭ.
Наиболее частым этиологическим фактором развития ДЭ является АГ, наличие которой повышает риск развития МИ и сосудистой деменции на 30-40%.
 В то же время снижение систолического артериального давления (АД) на 12 мм рт. ст., а диастолического на 5 мм рт. ст. снижает риск развития МИ на 34%.
В то же время снижение систолического артериального давления (АД) на 12 мм рт. ст., а диастолического на 5 мм рт. ст. снижает риск развития МИ на 34%.Основные принципы антигипертензивной терапии при ЦВЗ сходны с общими подходами к лечению АГ. Они включают медикаментозное лечение и изменение образа жизни: снижение массы тела, увеличение физической активности, ограничение употребления алкоголя, прекращение курения, диету с низким содержанием жира и соли. Причем это относится к пациентам с любыми стадиями ДЭ независимо от наличия в анамнезе перенесенного МИ. Следует отметить, что направление лечения, связанное с изменением образа жизни, часто недооценивается как врачами, так и пациентами.
Принципы медикаментозного лечения больных ДЭ и АГ:
• лечение должно быть постоянным, непрерывным, курсовым;
• поддержание оптимального уровня АД в течение суток с помощью препаратов пролонгированного действия, одно- и двукратный прием которых обеспечивает равномерный терапевтический эффект в течение суток. Подобные средства не только эффективно контролируют АД, но и способствуют нормализации суточной его вариабельности, изменение которой наблюдается у большинства больных ДЭ, обусловленной АГ (по нашим данным, у 70%), и является самостоятельным фактором сердечно-сосудистого риска.
Подобные средства не только эффективно контролируют АД, но и способствуют нормализации суточной его вариабельности, изменение которой наблюдается у большинства больных ДЭ, обусловленной АГ (по нашим данным, у 70%), и является самостоятельным фактором сердечно-сосудистого риска.
Неконтролируемая АГ, гипертонические кризы, высокая вариабельность АД, высокая ночная гипертензия, чрезмерное снижение АД, включая ятрогенное, высокое пульсовое АД способствуют развитию и прогрессированию ДЭ и являются факторами высокого риска МИ и деменции.
Уже давно ведутся оживленные дискуссии по поводу того, какие из существующих антигипертензивных препаратов лучше предупреждают МИ. Современные рекомендации по лечению АГ с целью предотвращения первого инсульта не выделяют какой-либо основной группы антигипертензивных препаратов. Главное условие адекватной профилактики МИ – снижение АД как систолического, так и диастолического, по крайне мере до <140/90 мм рт. ст., а по возможности и до более низких значений. У больных сахарным диабетом (СД) рекомендуется более агрессивное снижение АД – <130/80 мм рт. ст. При этом следует помнить, что у пациентов с АГ и стенозом магистральных сосудов головы и шеи АД должно быть снижено не более чем на 15-20% от исходного уровня.
У больных сахарным диабетом (СД) рекомендуется более агрессивное снижение АД – <130/80 мм рт. ст. При этом следует помнить, что у пациентов с АГ и стенозом магистральных сосудов головы и шеи АД должно быть снижено не более чем на 15-20% от исходного уровня.
Однако эффективный контроль АД при монотерапии достигается не более чем у 30% больных, поэтому возникает потребность в назначении комбинированного лечения препаратами 2-3 различных классов, что более обоснованно. Комбинированная терапия позволяет контролировать несколько механизмов развития АГ, снижать дозы препаратов и риск побочных эффектов, которые могут ухудшать качество жизни пациента, а также уменьшать вероятность быстрого привыкания к лекарственным средствам.

Несколько иным должен быть подход к выбору медикаментозного лечения АГ у пациентов, перенесших ишемический инсульт или ТИА. Абсолютные целевые уровни АД в этом случае не установлены и у каждого пациента рассматриваются индивидуально. Однако успех терапии связан со снижением АД до 120/80 мм рт. ст. При этом у пациентов со стенозом сонной артерии >70% АД необходимо снижать не более чем на 10-15% от исходного уровня. Приоритетными препаратами выбора для лечения таких больных являются ингибиторы АПФ, диуретики и антагонисты рецепторов ангиотензина II (АРА), что было доказано в многоцентровых плацебо контролированных исследованиях, в частности PROGRESS и MOSES.
В международном многоцентровом исследовании PROGRESS больные, перенесшие инсульт или ТИА на фоне АГ или нормального АД, в течение 4 лет принимали ингибитор АПФ периндоприл + индапамид или плацебо. В основной группе частота повторного инсульта уменьшилась на 28%, в том числе ишемического – на 24%, геморрагического – на 50% по сравнению с группой плацебо.

Эффективность АРА во вторичной профилактике МИ была убедительно доказана в исследовании MOSES, в котором принимали участие больные, перенесшие МИ. Группа активной терапии получала эпросартан 600 мг/сут, а контрольная группа – антагонист кальция нитрендипин 10 мг/сут, который зарекомендовал себя как препарат, эффективно предотвращающий мозговые осложнения АГ. Первичными конечными точками исследования были общая смертность, общее число сердечно-сосудистых событий и мозговых осложнений; основной вторичной конечной точкой – оценка когнитивных нарушений. В результате в ходе исследования удалось добиться снижения общей смертности и всех сердечно-сосудистых и цереброваскулярных заболеваний на 20%, повторных инсультов и ассоциированных расстройств (ТИА) – на 25%, первичных сердечно-сосудистых осложнений и частоты развития деменции в обеих группах – на 30%.
Таким образом, адекватная антигипертензивная терапия сопровождается существенным снижением риска развития МИ и деменции.
 Вместе с тем, назначая антигипертензивные препараты больным ДЭ, не следует допускать развития чрезмерной гипотонии, включая ночные часы, особенно у лиц пожилого возраста, при гемодинамически значимых стенозах мозговых сосудов и тяжелой ДЭ. В последнее время все большее значение в развитии МИ и деменции у больных ДЭ придается артериальной гипотензии, в том числе обусловленной неадекватно активным использованием гипотензивных препаратов. Особенно это относится к лицам пожилого и старческого возраста с высоким риском развития ДЭ.
Вместе с тем, назначая антигипертензивные препараты больным ДЭ, не следует допускать развития чрезмерной гипотонии, включая ночные часы, особенно у лиц пожилого возраста, при гемодинамически значимых стенозах мозговых сосудов и тяжелой ДЭ. В последнее время все большее значение в развитии МИ и деменции у больных ДЭ придается артериальной гипотензии, в том числе обусловленной неадекватно активным использованием гипотензивных препаратов. Особенно это относится к лицам пожилого и старческого возраста с высоким риском развития ДЭ.В пожилом и старческом возрасте зависимость мозгового кровотока от состояния системной гемодинамики становится еще более значительной.
 Более чем у 70% пожилых больных сердечной недостаточностью выявляются признаки ДЭ различной степени выраженности, которые могут коррелировать со степенью левожелудочковой недостаточности за счет хронической церебральной гипоперфузии. В условиях патологии левого желудочка уменьшается сердечный выброс, снижается уровень объемного кровотока в магистральных артериях головы. Считается, что именно снижение сердечного выброса, а не системная артериальная гипотония, является основным фактором, определяющим снижение церебральной перфузии у большинства больных застойной сердечной недостаточностью. Разумеется, возникновение эпизодов системной гипотензии (например, на фоне аритмии или передозировки гипотензивных препаратов) усугубляет и без того уже сниженный мозговой кровоток.
Более чем у 70% пожилых больных сердечной недостаточностью выявляются признаки ДЭ различной степени выраженности, которые могут коррелировать со степенью левожелудочковой недостаточности за счет хронической церебральной гипоперфузии. В условиях патологии левого желудочка уменьшается сердечный выброс, снижается уровень объемного кровотока в магистральных артериях головы. Считается, что именно снижение сердечного выброса, а не системная артериальная гипотония, является основным фактором, определяющим снижение церебральной перфузии у большинства больных застойной сердечной недостаточностью. Разумеется, возникновение эпизодов системной гипотензии (например, на фоне аритмии или передозировки гипотензивных препаратов) усугубляет и без того уже сниженный мозговой кровоток.Прогностически неблагоприятным является и низкий уровень пульсового АД, при котором снижается уровень церебральной перфузии. Возникновение неврологических расстройств при нарушениях пульсового АД связано с повреждением паренхимы головного мозга в глубинных отделах полушарий с развитием в этих зонах ишемии.

У лиц пожилого и старческого возраста причиной развития ДЭ может быть и ортостатическая гипотензия, которая встречается у 20% лиц в возрасте 65 лет и старше и 30% – в возрасте 75 лет и старше. Это может быть обусловлено несколькими причинами: снижением чувствительности барорецепторов, дегидратацией различного происхождения, продолжительным периодом нахождения в горизонтальном положении, а также побочными эффектами проводимой по различным показаниям терапии. Таким образом, важнейшей составляющей лечения больных ДЭ является коррекция АД.
Важную роль в развитии и прогрессировании ДЭ, а также в профилактике МИ и деменции играет коррекция нарушений липидного обмена. Хотя связь повышенного уровня холестерина и МИ в целом не столь выражена, снижение содержания холестерина до нормальных значений определенно уменьшает вероятность МИ и является обязательным. Среди всех препаратов, снижающих содержание холестерина в крови, безусловное предпочтение следует отдавать статинам, поскольку только для этих препаратов отчетливо доказана способность уменьшать риск возникновения МИ.

Так, в недавно проведенном исследовании MRC/BHF, в котором около 5 лет наблюдались более 20 тыс. больных, было показано, что симвастатин вызывал достоверное 27% уменьшение риска основных сердечно-сосудистых событий, включая МИ, причем этот эффект не зависел от исходного содержания холестерина в крови.
Положительное действие статинов на вероятность возникновения МИ доказано в 4 метаанализах. Напротив, в 2 метаанализах, в которых изучали возможность предупреждения МИ с помощью модификации диеты или других гиполипидемических препаратов, положительного результата достичь не удалось.
Ранее считалось, что в отношении предупреждения МИ более эффективны так называемые природные статины (симвастатин и правастатин), однако это объяснялось лишь отсутствием доказательной базы в отношении синтетического статина аторвастатина. В ряде недавно проведенных исследований с использованием этого препарата отчетливо продемонстрировано, что он также способен существенно снижать риск МИ.
 Так, согласно результатам исследования ASCOT более чем у 19 тыс. больных АГ длительное (в течение 5 лет) назначение аторвастатина в дозе 10 мг способствовало уменьшению риска МИ на 29%. В исследовании IDEAL было доказано, что длительное назначение аторвастатина в дозе 80 мг/сут способствовало существенному снижению частоты МИ по сравнению с менее активной терапией симвастатином в дозе 40 мг.
Так, согласно результатам исследования ASCOT более чем у 19 тыс. больных АГ длительное (в течение 5 лет) назначение аторвастатина в дозе 10 мг способствовало уменьшению риска МИ на 29%. В исследовании IDEAL было доказано, что длительное назначение аторвастатина в дозе 80 мг/сут способствовало существенному снижению частоты МИ по сравнению с менее активной терапией симвастатином в дозе 40 мг.Совсем недавно были получены новые подтверждения эффективности активной терапии статинами в предупреждении повторного инсульта. Установлено, что пациентам, перенесшим ишемический инсульт или ТИА, независимо от уровня липидов показано назначение статинов.
Весомый фактор риска ДЭ – СД. Пациентам с СД рекомендуется постоянный контроль уровня глюкозы крови для предотвращения микро- и макрососудистых осложнений, а также более жесткий контроль АД и липидов крови. Для данной категории больных для снижения АД препаратами выбора являются ингибиторы АПФ и АРА.
Пациенты с ДЭ относятся к группе высокого риска развития сердечно-сосудистых и цереброваскулярных заболеваний.
 Кроме того, такие больные нуждаются в коррекции факторов образа жизни: следует отказаться от курения и злоупотребления алкоголем, избегать пассивного курения, необходимо поддерживать индекс массы тела между 18,5 и 24,9 кг/м2, показаны регулярные занятия физическими упражнениями до 30 мин в день.
Кроме того, такие больные нуждаются в коррекции факторов образа жизни: следует отказаться от курения и злоупотребления алкоголем, избегать пассивного курения, необходимо поддерживать индекс массы тела между 18,5 и 24,9 кг/м2, показаны регулярные занятия физическими упражнениями до 30 мин в день.Для уменьшения темпов прогрессирования ДЭ патогенетически обоснованы препараты, направленные на улучшение мозгового кровотока и метаболизма. Именно эти группы лекарственных препаратов способны влиять на выраженность неврологических и психических нарушений, составляющих ядро клинической картины ДЭ.
Для улучшения мозгового кровотока используют такие вазоактивные препараты:
• ингибиторы фосфодиэстеразы – эуфиллин, пентоксифиллин, винпоцетин и др., сосудорасширяющий эффект которых связан с увеличением содержания цАМФ в гладкомышечных клетках сосудистой стенки, что приводит к их расслаблению и увеличению просвета сосудов;
• блокаторы кальциевых каналов – циннаризин, флунаризин, нимодипин, оказывающие вазодилатирующий эффект благодаря уменьшению внутриклеточного содержания кальция в гладкомышечных клетках сосудистой стенки;
•α1-адреноблокатор ницерголин, устраняющий сосудосуживающее действие медиаторов симпатической нервной системы – адреналина и норадреналина;
• препараты с полимодальным механизмом действия.

Очень важно назначать вышеперечисленные препараты в терапевтически эффективных дозах курсами по 2-3 мес, 1-2 раза в год. Длительность лечения определяется стадией ДЭ.
Для улучшения метаболизма головного мозга, уменьшения выраженности неврологических симптомов и синдромов, а также когнитивных нарушений используют метаболические препараты:
• ГАМК-эргические препараты – пирацетам и его производные;
• пептидергические препараты и аминокислоты;
• метаболиты.
Препараты этой фармакологической группы оказывают симптоматический ноотропный эффект, оптимизируя метаболические процессы и увеличивая пластичность нейронов головного мозга. Эффективность вышеперечисленных препаратов зависит от применяемых доз, которые назначаются в зависимости от стадии ДЭ.
Для коррекции когнитивных нарушений целесообразно использовать антагонист глутаматных N-метил-D-аспартат-рецепторов – мемантин, действующий на оксидативный стресс и процессы эксайтотоксичности.
 Среди антагонистов кальциевых каналов предпочтение следует отдавать нимодипину, который действует преимущественно на церебральном уровне. Следует подчеркнуть, что препараты, улучшающие мозговой кровоток и нейрональный метаболизм, потенциально более эффективны при назначении на ранних стадиях ДЭ.
Среди антагонистов кальциевых каналов предпочтение следует отдавать нимодипину, который действует преимущественно на церебральном уровне. Следует подчеркнуть, что препараты, улучшающие мозговой кровоток и нейрональный метаболизм, потенциально более эффективны при назначении на ранних стадиях ДЭ.В последнее время получены данные об эффективности комбинированных препаратов в лечении больных ДЭ. Эти лекарства имеют несколько механизмов действия и влияют на выраженность многих неврологических симптомов, в том числе и когнитивных расстройств.
Специального лечения может потребовать возникновение у больных депрессии, тревожности, галлюцинаций, психомоторного возбуждения. Очень важным моментом в лечении больных ДЭ является своевременное лечение сопутствующих соматических заболеваний, которые оказывают существенное влияние на течение ДЭ.
У больных ДЭ III стадии, которые перенесли ТИА или ишемический инсульт, с целью профилактики развития повторных МИ показано назначение антитромбоцитарных препаратов, антикоагулянтов и хирургическое лечение.

Сегодня именно антитромбоцитарная терапия рассматривается в качестве основной составляющей вторичной профилактики атеротромботического, лакунарного или криптогенного ишемического инсульта. При этом для каждого антитромбоцитарного препарата установлены как преимущества, так и факторы, ограничивающие их применение. Так, часть пациентов резистентна к ацетилсалициловой кислоте (АСК). Ее в таком случае можно заменить клопидогрелем, который согласно результатам исследования CAPRIE особенно эффективен у пациентов группы высокого риска: перенесших инфаркт миокарда, страдающих СД, заболеваниями артерий нижних конечностей и др.
Более высокая эффективность применения комбинации низких доз АСК и дипиридамола, по сравнению с назначением этих препаратов в виде монотерапии, убедительно подтверждена в исследованиях ESPS и ESPS-2, а после завершения исследования PRoFESS можно будет сопоставить профилактическую эффективность клопидогреля и комбинации дипридамол + АСК.
Выбор антитромбоцитарного препарата должен основываться на анализе факторов риска, присущих конкретному пациенту, переносимости препарата, клинических характеристиках и финансовых возможностях больного.
 Комбинирование АСК с клопидогрелем увеличивает риск кровотечений и сегодня не может быть рекомендовано всем больным с инсультом или ТИА в повседневной практике. Не рекомендуется увеличивать дозу АСК при резистентности к данному препарату – для таких пациентов наиболее предпочтительным антитромбоцитарным препаратом является клопидогрель.
Комбинирование АСК с клопидогрелем увеличивает риск кровотечений и сегодня не может быть рекомендовано всем больным с инсультом или ТИА в повседневной практике. Не рекомендуется увеличивать дозу АСК при резистентности к данному препарату – для таких пациентов наиболее предпочтительным антитромбоцитарным препаратом является клопидогрель.Что же касается пациентов с кардиоэмболическим инсультом, то при наличии постоянной или пароксизмальной формы фибрилляции предсердий (наиболее значимого фактора риска) в качестве вторичной профилактики им показаны непрямые антикоагулянты в дозе, обеспечивающей поддержание международного нормализованного отношения в пределах 2,0-3,0.
Больным, которые по тем или иным причинам не могут получать терапию непрямыми антикоагулянтами, рекомендована АСК в дозе 325 мг/сут. Важным направлением вторичной профилактики нарушений мозгового кровообращения являются хирургические методы лечения – каротидная эндартерэктомия и ангиопластика. Наиболее эффективна каротидная эндартерэктомия в первые 2 недели после нарушения мозгового кровообращения.
 В некоторых случаях альтернативой каротидной эндартерэктомии может быть каротидная ангиопластика, например при хирургически недоступной локализации стеноза или рестенозе после каротидной эндартерэктомии.
В некоторых случаях альтернативой каротидной эндартерэктомии может быть каротидная ангиопластика, например при хирургически недоступной локализации стеноза или рестенозе после каротидной эндартерэктомии.Таким образом, лечение больных ДЭ должно быть всесторонним и комплексным. В большинстве случаев адекватная диагностика и правильное ведение пациентов с ДЭ позволяет повысить качество их жизни. Задача врачей заключается в максимальном и патогенетически обоснованном использовании всех возможностей фармакотерапии, направленных на предотвращение развития МИ и деменции у больных ДЭ.
СТАТТІ ЗА ТЕМОЮ
14.02.2022 Неврологія Проблема порушень сну під час пандемії COVID‑19За останні 70 років людство втратило близько 20% тривалості сну, що пов’язано з колосальним напруженням для мозку, особливо під час пандемії COVID‑19. У листопаді 2021 р. в онлайн-форматі відбулася IV науково-практична конференція з міжнародною участю «Психосоматична медицина: наука та практика», в межах якої однією з тем для обговорення був вплив панедемії COVID‑19 на порушення сну. Міркуваннями із цього приводу поділився Олег Созонтович Чабан, д. мед. н., професор, завідувач кафедри медичної психології, психосоматичної медицини та психотерапії Національного медичного університету імені О.О. Богомольця (м. Київ).
…
У листопаді 2021 р. в онлайн-форматі відбулася IV науково-практична конференція з міжнародною участю «Психосоматична медицина: наука та практика», в межах якої однією з тем для обговорення був вплив панедемії COVID‑19 на порушення сну. Міркуваннями із цього приводу поділився Олег Созонтович Чабан, д. мед. н., професор, завідувач кафедри медичної психології, психосоматичної медицини та психотерапії Національного медичного університету імені О.О. Богомольця (м. Київ).
…
Пацієнти, які перенесли інсульт, часто відчувають невропатичний біль (НБ) центрального ґенезу. Центральний післяінсультний НБ (ЦПНБ) з’являється в часовому діапазоні від 7 днів до 24 місяців після інсульту. Фармакологічна терапія ЦПНБ є важливою складовою відновлення хворих та підвищення якості їхнього життя. B. Rahajeng et al. провели дослідження, метою якого було оцінити динаміку зменшення проявів ЦПНБ на тлі терапії прегабаліном. Автори виявили, що прегабалін здатний суттєво поліпшувати стан таких пацієнтів через 12 тижнів лікування. Отримані результати, огляд яких ми пропонуємо до вашої уваги, опубліковані у виданні International Journal of Pharmaceutical Research (2021; 13 (1): 2805‑2814).
…
Центральний післяінсультний НБ (ЦПНБ) з’являється в часовому діапазоні від 7 днів до 24 місяців після інсульту. Фармакологічна терапія ЦПНБ є важливою складовою відновлення хворих та підвищення якості їхнього життя. B. Rahajeng et al. провели дослідження, метою якого було оцінити динаміку зменшення проявів ЦПНБ на тлі терапії прегабаліном. Автори виявили, що прегабалін здатний суттєво поліпшувати стан таких пацієнтів через 12 тижнів лікування. Отримані результати, огляд яких ми пропонуємо до вашої уваги, опубліковані у виданні International Journal of Pharmaceutical Research (2021; 13 (1): 2805‑2814).
…
У жовтні 2021 р. в онлайн-форматі відбулася Науково-практична конференція із міжнародною участю «Академія інсульту – 2021». Цей освітній форум для фахівців у сфері охорони здоров’я був присвячений питанням організації допомоги, профілактики, терапії та реабілітації пацієнтів з інсультом. Пропонуємо до вашої уваги огляд доповідей, що прозвучали в межах заходу й були присвячені проблемам, пов’язаним із діагностуванням та лікуванням фібриляції передсердь (ФП).
…
в онлайн-форматі відбулася Науково-практична конференція із міжнародною участю «Академія інсульту – 2021». Цей освітній форум для фахівців у сфері охорони здоров’я був присвячений питанням організації допомоги, профілактики, терапії та реабілітації пацієнтів з інсультом. Пропонуємо до вашої уваги огляд доповідей, що прозвучали в межах заходу й були присвячені проблемам, пов’язаним із діагностуванням та лікуванням фібриляції передсердь (ФП).
…
У жовтні 2021 р. в Харкові відбувся науковий симпозіум «Персоніфіковані підходи неврологічної, психіатричної, наркологічної допомоги». Під час заходу погляд невролога на хворобу Фабрі (ХФ) висвітлив у своїй доповіді керівник відділу судинної патології головного мозку та реабілітації ДУ «Інститут неврології, психіатрії та наркології НАМН України» (м. Харків), д. мед. н., професор Владислав Миколайович Міщенко.
…
в Харкові відбувся науковий симпозіум «Персоніфіковані підходи неврологічної, психіатричної, наркологічної допомоги». Під час заходу погляд невролога на хворобу Фабрі (ХФ) висвітлив у своїй доповіді керівник відділу судинної патології головного мозку та реабілітації ДУ «Інститут неврології, психіатрії та наркології НАМН України» (м. Харків), д. мед. н., професор Владислав Миколайович Міщенко.
…
Основа лечения дисциркуляторной энцефалопатии 2 степени смешанного генеза
Как лечить дисциркуляторную энцефалопатию головного мозга
Дисциркуляторная энцефалопатия – хроническое поражение нервной ткани мозга, причиной которого является нарушение кровообращения. Это прогрессирующая патология. Необратимые изменения в головном мозге приводят не только к нестабильности эмоционального состояния и изменению поведения (мышления), но в ряде случаев и к утрате трудоспособности и невозможности выполнения привычных бытовых задач. О том, как лечить дисциркуляторную энцефалопатию головного мозга, речь пойдет дальше.
О том, как лечить дисциркуляторную энцефалопатию головного мозга, речь пойдет дальше.
Виды заболевания:
- атеросклеротический;
- гипертензивный;
- венозный;
- смешанный.
Исходя из характера течения, дисциркуляторная энцефалопатия (ДЭП) может быть классической (вялотекущей), ремиттирующей с постепенным нарастанием симптомов и прогрессирующей. Основными причинами заболевания, по словам специалистов, являются гипертония и атеросклероз. Важно: препараты при дисциркуляторной гипертонической энцефалопатии помогут улучшить метаболизм и кровоснабжение мозга.
Кто в группе риска
Раньше считалось, что ДЭП более подвержены люди преклонного возраста. В настоящее время болезнь значительно «помолодела» и довольно часто ее диагностируют у больных, которым не исполнилось и 50 лет. В большинстве случаев это люди творческих профессий и умственного труда. К наиболее тяжелым последствиям дисциркуляторной энцефалопатии относятся старческое слабоумие и ишемический инсульт.
Факторами, провоцирующими заболевание, являются: неправильное питание с преобладанием жирной и копченой пищи, злоупотребление алкоголем, курение, избыточный вес, гормональные нарушения, высокое артериальное давление, травмы головы.
Причины дисциркуляторной энцефалопатии
Атеросклероз. Нарушение обмена веществ приводит к уменьшению просвета сосудов, вследствие чего мозг недополучает нужное количество кислорода и питательных веществ. Признаки дисциркуляторной атеросклеротической энцефалопатии:
- Высокое давление (гипертония) и низкое (гипотония): в первом случае сосуды чрезмерно наполняются кровью, а недостаточное наполнение – последствие гипотонии.
- Остеохондроз позвоночника. В результате сдавливания артерии мозг не получает необходимое ему количество питательных веществ.
- Травмы головы и позвоночника могут стать причинами гематом, которые пережимают кровеносные сосуды, нарушая питание нервных клеток.
- Курение провоцирует сужение кровеносных сосудов, особенно капилляров.

- Врожденные патологии.
- Заболевания сосудов.
- Гормональные нарушения.
Симптомы при дисциркуляторной энцефалопатии головного мозга 1 степени
Для стадии характерно постепенное нарастание симптоматики. Явными проявлениями заболевания являются жалобы на нестабильность настроения (от полной подавленности до внезапной радости), апатию и депрессию. Беспричинный плач, головная боль, нарушения сна, забывчивость и приступы агрессии к окружающим – симптомы 1 степени ДЭП головного мозга. В отдельных случаях больные могут испытывать незначительные боли в суставах, спине и области желудка.
На нашем сайте Добробут.ком вы найдете более подробную информацию по этому вопросу. Записаться на консультацию можно по указанным на страницах телефонам. На личном приеме врач ответит на все вопросы и расскажет о лечении дисциркуляторной энцефалопатии 2 степени смешанного генеза.
Дисциркуляторная энцефалопатия 2 степени – клинические проявления
Без надлежащего лечения ДЭП 1 степени переходит во вторую со всеми вытекающими из этого последствиями.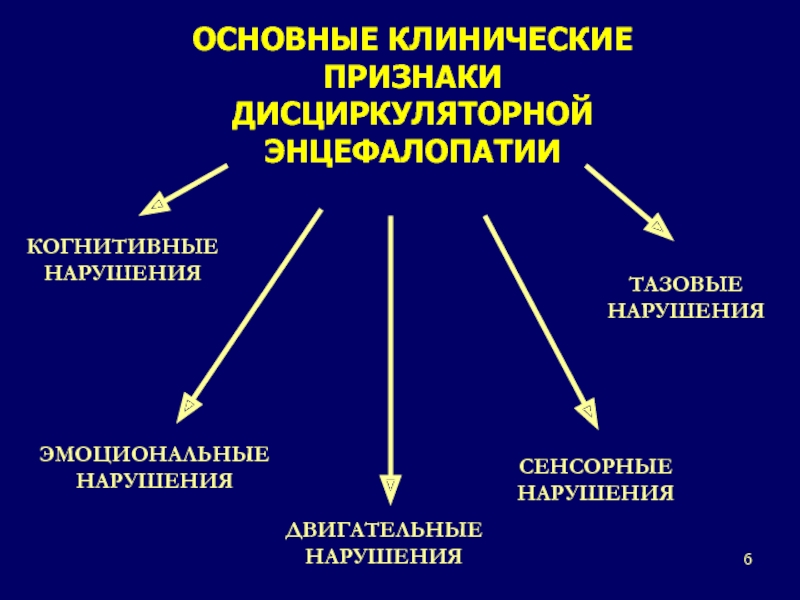 К симптомам при дисциркуляторной энцефалопатии головного мозга 1 степени присоединяются расстройства внимания и памяти, нарушается ориентация в пространстве. Появляется полная апатия к внешнему миру. В некоторых случаях возможна утрата трудоспособности.
К симптомам при дисциркуляторной энцефалопатии головного мозга 1 степени присоединяются расстройства внимания и памяти, нарушается ориентация в пространстве. Появляется полная апатия к внешнему миру. В некоторых случаях возможна утрата трудоспособности.
3 степень ДЭП – тяжелая степень заболевания, при которой пациент утрачивает способность к выполнению целенаправленных действий и нуждается в постоянном уходе. Характерные проявления – нарушение речи и функции тазовых органов, судорожные припадки, двигательные расстройства. Больной получает инвалидность при диагнозе дисциркуляторная энцефалопатия 3 степени.
Лечение ДЭП
Основной задачей лекарственной терапии является восстановление работы сосудов, улучшение притока крови к головному мозгу и нормализация работы нервной системы. С этой целью больному назначаются бета-адреноблокаторы, антагонисты кальция, сосудорасширяющие препараты, нейропротекторы, антикоагулянты. Это общая терапия. Симптоматическое лечение направлено на устранение отдельных клинических проявлений, а именно депрессии и лабильности поведения.
Хирургическое вмешательство рекомендовано при тяжелой прогрессирующей ДЭП (степень сужения сосудов – более 70%).
Сколько можно прожить с дисциркуляторной энцефалопатией сложного генеза
Однозначного ответа нет. Все зависит от степени заболевания, симптоматики, медикаментозной терапи и т.д. Прогноз благоприятный в случае раннего выявления ДЭП. Своевременное лечение и строгое выполнение рекомендаций врача поможет замедлить процесс развития патологии, а в некоторых случаях и приостановить его.
Если вас интересует вопрос о том, сколько можно прожить с дисциркуляторной энцефалопатией сложного генеза, запишитесь на личный прием к нашему специалисту.
Связанные услуги:
Компьютерная томография
Энцефалограмма головного мозга
Лечение энцефалопатии в СПб
Энцефалопатия (резидуальная энцефалопатия) это совокупность симптомов, которые являются результатом гибели клеток в головном мозге из-за длительного кровотечения, отравления, гипоксии или патологического состояния мозга, вызванного болезнью. Независимо от того, что вызывало энцефалопатию, это приводит, в частности, к потере двигательных функций и интеллектуального потенциала.
Независимо от того, что вызывало энцефалопатию, это приводит, в частности, к потере двигательных функций и интеллектуального потенциала.
ЛЕЧЕНИЕ ЭНЦЕФАЛОПАТИИ ДОСТУПНО В ФИЛИАЛАХ:
Лечение энцефалопатии в Приморском районе
Адрес: г. Санкт-Петербург, Приморский район, ул. Репищева, 13
Лечение энцефалопатии в Петроградском районе
Адрес: г. Санкт-Петербург, Петроградский район, ул. Ленина, 5
Лечение энцефалопатии во Всеволожске
Адрес: г. Всеволожск, Октябрьский пр-т, 96 А
Причины
энцефалопатииРазличают врождённую и приобретённую энцефалопатию.
Врожденная энцефалопатия возникает в результате:
- Родовых травм (перинатальная энцефалопатия)
- Инфекции плода (перенесённые во время беременности краснуха, токсоплазмоз, гепатит Б, ветряная оспа)
- Наследственных заболеваний (синдром Дауна, фенилкетонурия)
Приобретённая энцефалопатия головного мозга может возникать из-за:
- травм головного мозга (сотрясение мозга)
- сосудистых нарушений (дисциркуляторная энцефалопатия, ДЭ) – вегето-сосудистой дистонии, атеросклероза, заболевания крови.
 Признаки ДЭ нарастают постепенно (выделяют 3 степени энцефалопатии), состояние человека ухудшается и может привести к слабоумию.
Признаки ДЭ нарастают постепенно (выделяют 3 степени энцефалопатии), состояние человека ухудшается и может привести к слабоумию. - метаболических нарушений (при печёночной недостаточности, например, нарушается очищение крови от токсинов, которые поступают с кровью в мозг, и возникает печеночная энцефалопатия)
- воспалительных процессов в мозге и его оболочках (менингит).
- отравления алкоголем
Мозг в норме (справа), мозг при алкогольной энцефалопатии (слева)
Энцефалопатия — Симптомы
Энцефалопатия может иметь различные признаки. Самые начальные симптомы энцефалопатии включают в себя снижение умственных способностей и потерю памяти. Пациент испытывает трудности при смене действий и переключении внимания. Возникают раздражительность, перепады настроения, бессонница, усталость и вялость. Могут быть жалобы на шум в ушах, головные боли, нарушение зрения и слуха, вегетативные расстройства нервной системы и координации движений. На последних стадиях появляются такие неврологические симптомы, как паралич, паркинсонизм, парез. У некоторых больных развивается слабоумие и нарушение психики.
На последних стадиях появляются такие неврологические симптомы, как паралич, паркинсонизм, парез. У некоторых больных развивается слабоумие и нарушение психики.
Энцефалопатия – Диагностика
Диагноз энцефалопатия ставится в основном на анализе жалоб пациента. Обязательными являются обследование ЭЭГ, компьютерная томография, МРТ, биохимический и общий анализ крови и мочи, может быть назначено исследование спинномозговой жидкости.
Энцефалопатия — лечение
Лечение энцефалопатии направлено на снятие и облегчение симптомов, и лечение основного заболевания, вызвавшего энцефалопатию.
Занимаются лечением энцефалопатии врачи-неврологи
Лечение всегда проводится комплексно, используются лекарственные препараты, физиотерапевтические процедуры, а иногда в ход идут и самые современные технологии, такие как нейротерапия (тренинги биологической обратной связи, сеансы транскраниальной микрополяризации)
Из препаратов используют медикаменты,
- влияющими на метаболизм (обменные процессы) головного мозга:
- для уменьшения внутричерепного давления и устранения судорог — противосудорожные препараты и диуретики
- улучшающие мозговое кровообращение (пирридол, пирацетам)
- витамины А, Е, группы В
- для улучшения циркуляции крови в мозге применяют ангиопротекторы
В сложных и критичных случаях возможно хирургическое вмешательство.
В нашей клинике Вы можете пройти обследование у квалифицированных специалистов различных направлений.
Приём ведут врачи-невропатологи:
Выберите филиал“Династия” на Новочеркасском пр-те, Красногвардейский район“Династия” на Ленина, Петроградский район“Династия” на Репищева, Приморский район“Династия” во ВсеволожскеВыездная служба
Стоимость услуг врача-невролога
| Наименование услуг | Цена в рублях | |
| Санкт-Петербург | Всеволожск | |
| Первичный прием невролога 1 ступени | 1850 | 1700 |
| Повторный прием невролога 1 ступени | 1650 | 1500 |
| Первичный прием невролога 2 ступени | 2100 | — |
| Повторный прием невролога 2 ступени | 1900 | — |
Первичный прием невролога Коляда А. А. А. | 3200 | — |
| Повторный прием невролога Коляда А.А. | 2900 | — |
| Первичный прием невролога Ерошиной Е.С./Иришиной Ю.А./Цинзерлинг Н.В. | 4000 | 4000 |
| Повторный прием невролога Ерошиной Е.С./Иришиной Ю.А./Цинзерлинг Н.В. | 3500 | 3500 |
| Первичный прием нейрохирурга Холявина А.И. | 3300 | — |
| Повторный прием нейрохирурга Холявина А.И. | 2900 | — |
| Заключение невролога для справки | 700 | 700 |
| МАНИПУЛЯЦИИ | ||
| Блокада грушевидной мышцы | 2000 | 2000 |
| Блокада затылочного нерва | 1800 | 1800 |
| Блокада карпального канала | 2500 | 2500 |
| Блокада крестцово-подвздошных суставов | 2700 | 2700 |
| Блокада надлопаточного нерва | 1800 | 1800 |
| Ботулинотерапия | 5300 | 5300 |
| Ботулинотерапия бруксизма и хронической боли в лице | 18000 | — |
| Инфузионное купирование острового болевого синдрома в спине | 1750 | 1750 |
| Плазмолифтинг (1 процедура) | 3100 | 2800 |
| Транкраниальная поляризация при болезни Паркинсона (30 мин) | 1800 | — |
| Фармакопунктура | от 1500 | от 1500 |
| ЛЕЧЕНИЕ ГОЛОВНОЙ БОЛИ | ||
| Ботулинотерапия при хронической мигрени | 35000 25900 | 35000 25900 |
| Таргетное лечение мигрени (1 сеанс) | 17900 | 17900 |
ЗАПИСЬ НА ЛЕЧЕНИЕ ЭНЦЕФАЛОПАТИИ
Ваша заявка отправлена
Менеджер свяжется с вами для уточнения деталей
Мы ценим ваше обращение в наш медицинский центр «Династия»
ЛЕЧЕНИЕ ДИСЦИРКУЛЯТОРНОЙ ЭНЦЕФАЛОПАТИИ
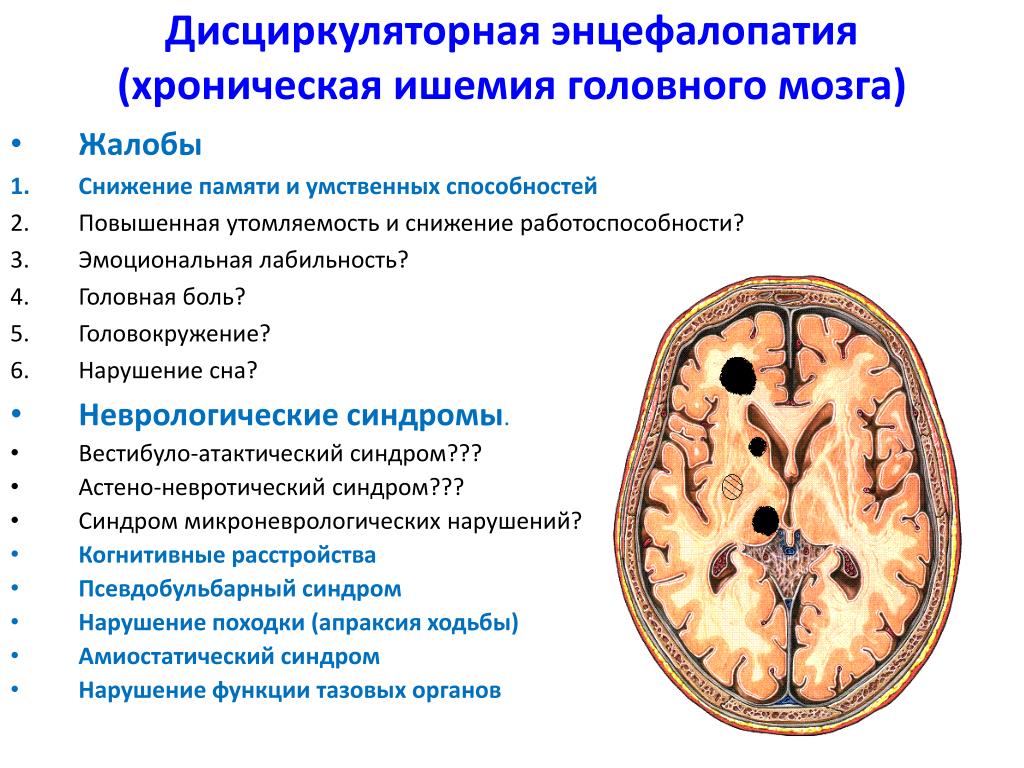
Дисциркуляторная энцефалопатия представляет собой прогрессирующее поражение головного мозга, связанное с хронической недостаточностью кровоснабжения мозга (ишемия мозга), либо с множественными инсультами (острое нарушение мозгового кровообращения).
Комплексный индивидуальный подход:
При диагнозе дисциркуляторная энцефалопатия лечение назначается индивидуально, в зависимости от причины, приведшей к развитию синдрома. Благодаря этому лечение данного заболевания позволяет не только уменьшить или устранить симптомы заболевания, но и воздействовать на его причину, которой может быть артериальная гипертензия, атеросклероз или иные сосудистые поражения.
Использование лекарственных препаратов с лечебными процедурами:
Широкие возможности использования медикаментозной терапии ( вазоактивные препараты, ноотропы, нейрометаболические средства), а также индивидуальный подбор препаратов способствует более высокой эффективности лечения дисциркуляторной энцефалопатии. Наряду с медикаментозной терапией мы также применяем такие лечебные процедуры как: лазерная терапия, массаж шейно-воротниковой зоны, а также психотерапевтическая помощь. Такое комплексное лечение позволяет повысить эффективность медикаментозной терапии и сделать лечение более безопасным, снизив побочные эффекты от применения лекарственных препаратов.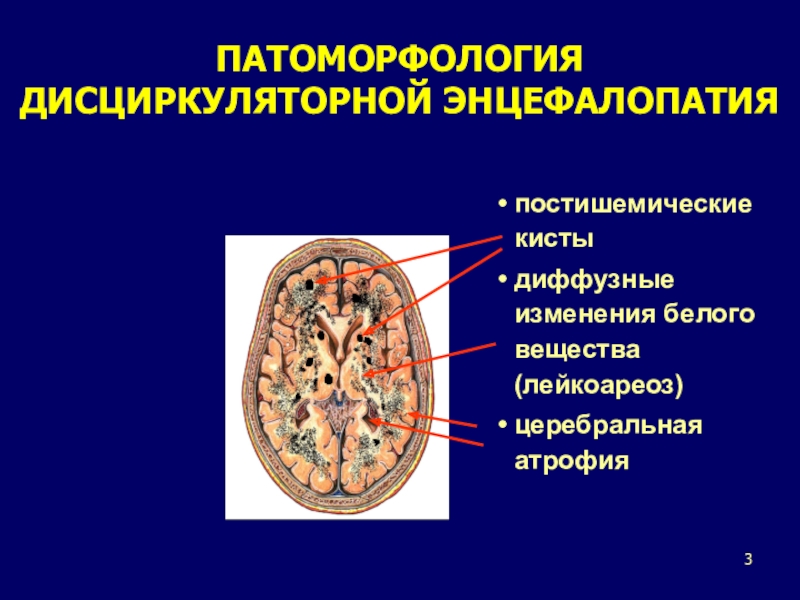
Возможность пребывания в стационаре вместе с близкими:
На протяжении всего времени лечения вы можете находиться вместе с близкими вам людьми в нашем стационаре. В нашем центре созданы все условия для пребывания родственников. Благодаря этому близкие смогут оказать вам психологическую помощь и поддержку.
Качественный персональный уход и питание:
Все пациенты, проходящие лечение в нашем стационаре, обеспечиваются качественным
питанием (в нашем центре имеется собственная кухня) и высококачественным персональным круглосуточным уходом. Высокая квалификация нашего медицинского персонала не только способствует успешности лечения, но и позволяет создать максимально комфортные условия пребывания в течение всего курса лечения.
Симптомы дисциркуляторной энцефалопатии:
· Психоэмоциональные симптомы: депрессия, быстрая смена настроения, плаксивость, раздражительность, агрессивность, апатия, снижение мотивации, ухудшение умственной работоспособности и умственной активности, снижение памяти и способности концентрации, ипохондрия.
· Физические симптомы: изменения походки (замедленная, шаркающая походка или «походка лыжника», связанная с затруднением отрыва стопы от пола), пошатывание при ходьбе, ухудшение координации движения, неустойчивость и головокружения при ходьбе, приводящие к частым падениям.
Главная опасность, которую представляет дисциркуляторная энцефалопатия, — это высокий риск возникновения инсульта мозга, который может привести к значительному снижению качества жизни, инвалидности и даже смерти человека.
Кыргызская государственная медицинская академия имени И. К. Ахунбаева
Кыргызская государственная медицинская академия имени И. К. Ахунбаева- Об Академии
- Образование
- Наука и лечебная работа
- Международное сотрудничество
- Жизнь студента
- Медиа
Знание, Oпыт и Инновации. Scientia, Experientia et Novitates.
Scientia, Experientia et Novitates.
Среда, 2 Февраля 2022 0
ДостиженияПонедельник, 14 Февраля 2022 0
ПартнёрствоПятница, 11 Февраля 2022 0
Университетская жизньПятница, 11 Февраля 2022 0
ДостиженияПятница, 11 Февраля 2022 0
ОбразованиеЧетверг, 10 Февраля 2022 0
ПартнёрствоПонедельник, 7 Февраля 2022 0
Университетская жизньПонедельник, 7 Февраля 2022 0
ОбразованиеЧетверг, 3 Февраля 2022 0
ДостиженияСреда, 2 Февраля 2022 0
Университетская жизньПонедельник, 31 Января 2022
Университетская жизньСуббота, 29 Января 2022
Пятница, 28 Января 2022
Понедельник, 17 Января 2022
Университетская жизньСуббота, 15 Января 2022
Четверг, 30 Декабря 2021
Университетская жизньЧетверг, 16 Декабря 2021
Университетская жизньСреда, 15 Декабря 2021
Понедельник, 13 Декабря 2021
Понедельник, 31 Января 2022
Пятница, 28 Января 2022
Понедельник, 20 Декабря 2021
Понедельник, 20 Декабря 2021
Четверг, 16 Декабря 2021
Вторник, 14 Декабря 2021
Среда, 24 Ноября 2021
Среда, 24 Ноября 2021
Среда, 24 Ноября 2021
Среда, 10 Ноября 2021
Понедельник, 1 Ноября 2021
Понедельник, 1 Ноября 2021
6.
 Болезни нервной системы / КонсультантПлюс
Болезни нервной системы / КонсультантПлюс6. Болезни нервной системы
Для значительного нарушения функций нервной системы характерны <1> снижение мышечной силы конечностей от 0 до 2 баллов <2>, выраженный бульбарный (псевдобульбарный) синдром, сопровождающийся нарушениями глотания и требующий наложения гастростомы или установки назогастрального зонда, расстройства функции тазовых органов, требующие использования средств ухода, выраженные мозжечковые и экстрапирамидные нарушения, выраженные когнитивные нарушения, выраженные нарушения речи.
Для умеренного нарушения функций нервной системы характерны <1> снижение мышечной силы конечностей в 3 балла <2>, умеренно выраженный бульбарный (псевдобульбарный) синдром, не требующий наложения гастростомы и установки назогастрального зонда, мозжечковые и экстрапирамидные нарушения, умеренные когнитивные нарушения, умеренно выраженные нарушения речи.
Для незначительного нарушения функций нервной системы характерны <1> снижение мышечной силы конечностей в 4 балла <2>, незначительно выраженный бульбарный (псевдобульбарный) синдром без нарушения глотания, незначительные мозжечковые и экстрапирамидные нарушения, легкие когнитивные нарушения, легкие нарушения речи.
———————————
<1> Если иное не оговорено в соответствующей статье расписания болезней.
<2> По 6-балльной шкале оценки мышечной силы (L. McPeak, 1996; М. Вейсс, 1986).
Критерии выраженных клинических проявлений синдрома повышения внутричерепного давления:
наличие головной боли, рвоты, глазодвигательных нарушений, когнитивных нарушений, нарушений походки, нарушений функции тазовых органов, застойных дисков зрительных нервов или вторичной атрофии дисков зрительных нервов;
ликворное давление при люмбальной пункции в положении лежа свыше 300 мм водного столба;
перивентрикулярный отек.
Критерии умеренно выраженных клинических проявлений синдрома повышения внутричерепного давления:
наличие головной боли, начальных явлений застоя на глазном дне;
ликворное давление при люмбальной пункции в положении лежа свыше 200 мм водного столба.
Статья расписания болезней | Наименование болезней, степень нарушения функции | Категория годности к военной службе | ||
I графа | II графа | III графа | ||
21 | Эпилепсия и эпилептические приступы: | |||
а) при эпилептических приступах с частотой 5 и более раз в год | Д | Д | Д | |
б) при однократном эпилептическом приступе в анамнезе в течение последних 5 лет или редких эпилептических приступах с частотой менее 5 раз в год | В | В | Б (В — ИНД) | |
Отделения
Отделение кардиоцеребральной патологии является структурным подразделением Республиканского научно-практического медицинского центра терапии и медицинской реабилитации. Основными задачами кардиоцеребрального отделения являются оказание высококвалифицированной диагностической и лечебной помощи больным с патологией нервной системы, оказание консультативной помощи врачам других отделений центра в вопросах дифференциальной диагностики и лечения больных с сопутствующей патологией нервной системы. Отделение рассчитано на 40 коек.
Основными задачами кардиоцеребрального отделения являются оказание высококвалифицированной диагностической и лечебной помощи больным с патологией нервной системы, оказание консультативной помощи врачам других отделений центра в вопросах дифференциальной диагностики и лечения больных с сопутствующей патологией нервной системы. Отделение рассчитано на 40 коек.
1. Сосудистые заболевания головного и спинного мозга
-Дисциркуляторная энцефалопатия на фоне атеросклероза и гипертонической болезни
-Преходящие нарушения мозгового кровообращения в бассейне средне-мозговой артерии, вертебро-базиллярном бассейне
-Нарушение мозгового кровообращения в раннем и позднем восстановительном периоде, реабилитационном периоде.
— Последствия ОНМК.
-Дисциркуляторная миелопатия
2. Заболевания периферической нервной системы
— Остеохондроз различных отделов позвоночника, грыжи дисков
— Невропатия лицевого нерва,
— диабетическая нейропатия
— мононевропатии верхних и нижних конечностей
— Невралгия тройничного нерва
— Синдром БАС
3.
Сирингомиелия
4. Эпилепсия( в т.ч. вторичная)
5. Болезнь Паркинсона, вторичный паркинсонизм
6. Последствие детского церебрального паралича
7. Последствия черепно-мозговой травмы
8. Последствия перенесенного полиомиелита
9. Синдром вегетативной дистонии
В РСНПМЦТ и Р для неврологических больных проводятся следующие инструментальные методы исследования:
1. РЭГ- для определения состояния тонуса сосудов (функциональный метод при сосудистых заболеваниях головного мозга, синдроме вегетативной дистонии)
2. ЭЭГ- для определения функциональной активности мозга(при дисциркуляторной энцефалопатии, судорожном синдроме, последствиях ЧМТ)
3. УЗ допплерография сосудов головного мозга- определения параметров кровотока, состояния стенок сосудов головного мозга при дисциркуляторной энцефалопатии , нарушении мозгового кровообращения
4. Исследование глазного дна (проводится врачом — офтальмологом)- состояние сосудов глазного дна, дифференциально-диагностические признаки повышения ВЧД при всех сосудистых заболеваниях головного мозга
5. ЭХОЭГ- выявления смещения М-эхо(косвенные признаки объемного образования головного мозга)
ЭХОЭГ- выявления смещения М-эхо(косвенные признаки объемного образования головного мозга)
Применяются следующие методы лечения :
А) При сосудистых заболеваниях нервной системы –
1. лекарственная терапия — ангиопротекторы, ноотропы, метаболические препараты, седативные, гипотензивные средства, антикоагулянты,антиагреганты, антидепрессанты, витаминотерапия, диуретики, антихолинэстеразные препараты, миорелаксанты
2. физиотерапевтические процедуры: франклинизация, дарсонвализация, магнитотерапия, электросон и др.
3. Лечебная физкультура, массаж, ИРТ
Б) При заболеваниях периферической нервной системы
1. лекарственная терапия- ноотропы, ангиопротекторы,метаболические препараты,НПВС, анальгетики, миорелаксанты , антихолинэстеразные препараты, витаминотерапия
2. физио- и бальнеопроцедуры: СМТ- терапия, УВЧ, УЗТ, электростимуляция, ИРТ, УФО,магнитотерапия, минеральные ванны, подводное вытяжение поясничного отдела позвоночника
3. ЛФК, массаж, тепловые процедуры(озокерит)
ЛФК, массаж, тепловые процедуры(озокерит)
В) При последствиях детского церебрального паралича, последствиях черепно-мозговой травмы, полиомиелита
— лекарственные препараты (ноотропы, ангиопротекторы, метаболические препараты, витаминотерапия, антихолинэстеразные препараты, НПВС, миорелаксанты),
— физио-, бальнеопроцедурами(франклинизация, электросон,ГАИ ,электростимуляция, минеральные ванны и др),тепловые процедуры(озокерит), ИРТ, ЛФК, массаж
Г) При сирингомиелии, болезни Паркинсона, вторичном паркинсонизме, судорожном синдроме
— лекарственные препараты- ангиопротекторы,ноотропы,метаболические препараты, диуретики,антиагреганты, седативные препараты
— физио-, бальнеопроцедуры –электрофорез лекарственных средств, магнитотерапия,минеральные ванны и др.
ПРАЙМ PubMed | Схемы комплексного патогенетического лечения сосудистых дисциркуляторных нарушений в отдаленном периоде после воздействия малых доз радиации «[Схемы комплексного патогенетического лечения сосудистых дисциркуляторных нарушений в отдаленном периоде после воздействия малых доз радиации]».
 Радиационная биология, Радиоэкология, том. 53, нет. 5, 2013, стр. 525-35.
Радиационная биология, Радиоэкология, том. 53, нет. 5, 2013, стр. 525-35.Холодова Н.Б., Жаворонкова Л.А., Рыжов Б.Н. Схемы комплексного патогенетического лечения сосудистых дисциркуляторных нарушений в отдаленном периоде после воздействия малых доз радиации. Радиац Биол Радиоэколь . 2013;53(5):525-35.
Холодова Н.Б., Жаворонкова Л.А., Рыжов Б.Н. (2013). Схемы комплексного патогенетического лечения сосудистых дисциркуляторных нарушений в отдаленном периоде после воздействия малых доз радиации. Радиационная биология, Радиоэкология , 53 (5), 525-35.
Холодова Н.Б., Жаворонкова Л.А., Рыжов Б.Н. Схемы комплексного патогенетического лечения сосудистых дисциркуляторных расстройств в отдаленном периоде после воздействия малых доз радиации. Радиац Биол Радиоэкол. 2013 сен-октябрь;53(5):525-35. PubMed PMID: 25434175.
TY — JOUR
Т1 — [Комплексные патогенетические схемы лечения сосудистых дисциркуляторных нарушений в отдаленном периоде после воздействия малых доз радиации]. АУ — Холодова,Н Б,
АУ — Жаворонкова Л А,
АУ — Рыжов Б Н,
PY – 2 декабря 2014 г.
PY — 1/9/2013/опубликовано
PY — 2014/12/18/medline
СП — 525
ЭП — 35
JF — Радиационная биология, радиоэкология
JO — Радиац Биол Радиоэколь
ВЛ — 53
ИС — 5
N2 — Комплексные исследования, включающие современные методы исследования структур и функций нервной системы: электроэнцефалографию (ЭЭГ), когерентный анализ, нейропсихологическое исследование и методы нейровизуализации проведены у 517 участников ликвидации последствий аварии (ЛКА) на Чернобыльской АЭС. в 1986-1987 гг.Выявлено, что основной патологией является дисциркуляторная метаболическая энцефалопатия, этиологический механизм которой основан на дисциркуляторно-гипоксических и метаболических нарушениях. Комплексность выявленных симптомов свидетельствовала о раннем старении организма в отдаленные сроки после воздействия малых доз радиации. Разработаны патогенетические схемы лечения дисциркуляторной энцефалопатии у ликвидаторов, включающие препараты, улучшающие кровоснабжение, антиагреганты, антиоксиданты и метаболиты головного мозга в различных сочетаниях.
АУ — Холодова,Н Б,
АУ — Жаворонкова Л А,
АУ — Рыжов Б Н,
PY – 2 декабря 2014 г.
PY — 1/9/2013/опубликовано
PY — 2014/12/18/medline
СП — 525
ЭП — 35
JF — Радиационная биология, радиоэкология
JO — Радиац Биол Радиоэколь
ВЛ — 53
ИС — 5
N2 — Комплексные исследования, включающие современные методы исследования структур и функций нервной системы: электроэнцефалографию (ЭЭГ), когерентный анализ, нейропсихологическое исследование и методы нейровизуализации проведены у 517 участников ликвидации последствий аварии (ЛКА) на Чернобыльской АЭС. в 1986-1987 гг.Выявлено, что основной патологией является дисциркуляторная метаболическая энцефалопатия, этиологический механизм которой основан на дисциркуляторно-гипоксических и метаболических нарушениях. Комплексность выявленных симптомов свидетельствовала о раннем старении организма в отдаленные сроки после воздействия малых доз радиации. Разработаны патогенетические схемы лечения дисциркуляторной энцефалопатии у ликвидаторов, включающие препараты, улучшающие кровоснабжение, антиагреганты, антиоксиданты и метаболиты головного мозга в различных сочетаниях. Учитывая, что раннее появление сосудистых дисциркуляторных нарушений, наблюдаемых у ликвидаторов, является признаком раннего старения организма, в схемы лечения были добавлены геропротекторы.
СН — 0869-8031
УР — https://www.unboundmedicine.com/medline/citation/25434175/[комплексное_патогенетическое_лечение_схемы_оф_сосудистых_дисциркуляторных_расстройств_в_отдаленном_периоде_после_воздействия_до_низкой_дозы_облучения]_
L2 — https://medlineplus.gov/occupationalhealth.html
ДБ — ПРАЙМ
ДП — Свободная медицина
Скорая помощь —
Учитывая, что раннее появление сосудистых дисциркуляторных нарушений, наблюдаемых у ликвидаторов, является признаком раннего старения организма, в схемы лечения были добавлены геропротекторы.
СН — 0869-8031
УР — https://www.unboundmedicine.com/medline/citation/25434175/[комплексное_патогенетическое_лечение_схемы_оф_сосудистых_дисциркуляторных_расстройств_в_отдаленном_периоде_после_воздействия_до_низкой_дозы_облучения]_
L2 — https://medlineplus.gov/occupationalhealth.html
ДБ — ПРАЙМ
ДП — Свободная медицина
Скорая помощь —
Применение, побочные эффекты, взаимодействие, дозировка/пиллинтрип
Мексилек-Лекфарм ® Ингибитор свободнорадикальных процессов, мембранопротектор с антигипоксическим, стресспротекторным, ноотропным, противосудорожным и анксиолитическим действием.
Препарат повышает устойчивость организма к воздействию различных повреждающих факторов (шок, гипоксия и ишемия, нарушения мозгового кровообращения, интоксикация алкоголем и нейролептиками).
Механизм действия препарата Мексилек-Лекфарм ® за счет антиоксидантного, антигипоксантного и мембранопротекторного действия, ингибирует перекисное окисление липидов, повышает активность супероксиддисмутазы, повышает липидно-белковое соотношение, снижает вязкость мембраны, повышает ее текучесть.
Мексилек-Лекфарм ® модулирует активность мембраносвязанных ферментов (кальций-независимая ФДЭ, аденилатциклаза, ацетилхолинэстераза), рецепторных комплексов (бензодиазепин, ГАМК, ацетилхолин), что повышает их способность связываться с лигандами, способствует сохранение структурно-функциональной организации биомембран, транспорта нейромедиаторов и улучшение синаптической передачи.
Мексилек-Лекфарм ® повышает содержание дофамина в головном мозге.Вызывает усиление компенсаторной активации аэробного гликолиза и снижение степени торможения окислительных процессов в цикле Кребса в условиях гипоксии с увеличением содержания АТФ и креатинфосфата, активацию энергосинтезирующих функций митохондрий. и стабилизации клеточных мембран.
и стабилизации клеточных мембран.
Препарат улучшает обмен веществ и кровоснабжение головного мозга, улучшает микроциркуляцию и реологические свойства крови, уменьшает агрегацию тромбоцитов.
Стабилизирует мембранные структуры клеток крови (эритроцитов и тромбоцитов) при гемолизе. Оказывает гиполипидемическое действие, снижает содержание общего холестерина и ЛПНП.
Антистрессовый эффект проявляется в нормализации постстрессорного поведения, соматовегетативных нарушений, восстановлении циклов сон-бодрствование, нарушении процессов обучения и памяти, уменьшении дистрофических и морфологических изменений в различных структурах головного мозга.
Мексилек-Лекфарм ® Обладает выраженным антитоксическим действием при абстинентном синдроме.Устраняет неврологические и нейротоксические проявления острой алкогольной интоксикации, восстанавливает нарушения поведения, вегетативных функций, а также способен снимать когнитивные расстройства, вызванные длительным употреблением этанола и его отменой.
Под влиянием препарата Мексилек-Лекфарм ® усиливается действие транквилизирующих, нейролептических, антидепрессивных, снотворных и противосудорожных препаратов, что позволяет уменьшить их дозы и уменьшить побочные эффекты.
Мексилек-Лекфарм ® улучшает функциональное состояние ишемизированного миокарда.В условиях коронарной недостаточности увеличивает коллатеральное кровоснабжение ишемизированного миокарда, способствует сохранению целостности кардиоцитов и поддержанию их функциональной активности. Эффективно восстанавливает сократительную способность миокарда при обратимой сердечной дисфункции.
Мексилек-Лекфарм ® улучшает функциональное состояние ишемизированного миокарда при инфаркте миокарда, улучшает сократительную функцию сердца, а также уменьшает проявления систолической и диастолической дисфункции левого желудочка.Действие препарата основано на его антиоксидантной активности, способности ингибировать свободнорадикальные процессы (выраженное усиление которых наблюдается при ишемии и некрозе миокарда, особенно при реперфузии) и снижать повреждающее действие свободных радикалов на кардиомиоциты. В условиях критического снижения коронарного кровотока Мексилек-Лекфарм ® способствует сохранению структурно-функциональной организации мембран кардиомиоцитов, стимулирует активность мембранных ферментов — ФДЭ, аденилатциклазы, ацетилхолинэстеразы.Препарат поддерживает активацию аэробного гликолиза, развивающегося при острой ишемии, и способствует восстановлению митохондриальных окислительно-восстановительных процессов в условиях гипоксии, повышает синтез АТФ и креатинфосфата. Эти механизмы обеспечивают целостность морфологических структур и физиологических функций ишемизированного миокарда.
В условиях критического снижения коронарного кровотока Мексилек-Лекфарм ® способствует сохранению структурно-функциональной организации мембран кардиомиоцитов, стимулирует активность мембранных ферментов — ФДЭ, аденилатциклазы, ацетилхолинэстеразы.Препарат поддерживает активацию аэробного гликолиза, развивающегося при острой ишемии, и способствует восстановлению митохондриальных окислительно-восстановительных процессов в условиях гипоксии, повышает синтез АТФ и креатинфосфата. Эти механизмы обеспечивают целостность морфологических структур и физиологических функций ишемизированного миокарда.
Мексилек-Лекфарм ® улучшает течение инфаркта миокарда, повышает эффективность терапии, ускоряет восстановление функциональной активности миокарда левого желудочка, снижает частоту аритмических осложнений и нарушений внутрисердечной проводимости.Препарат нормализует метаболические процессы в ишемизированном миокарде, уменьшает зону некроза, восстанавливает и/или улучшает электрическую активность и сократительную способность миокарда, а также увеличивает коронарный кровоток в ишемизированной зоне, повышает антиангинальную активность нитропрепаратов, улучшает реологические свойства крови, уменьшает последствия реперфузионного синдрома при острой коронарной недостаточности
Мексилек-Лекфарм ® оказывает нейропротекторное действие, повышает стабильность кровообращения головного мозга при гипоперфузии, препятствует снижению кровотока головного мозга в реперфузионном периоде после ишемии. Препарат способствует адаптации к повреждающему действию ишемии, тормозя истощение запасов углеводов, блокируя постишемическое падение утилизации глюкозы и кислорода мозгом и предотвращая прогрессирующее накопление лактата.
Препарат способствует адаптации к повреждающему действию ишемии, тормозя истощение запасов углеводов, блокируя постишемическое падение утилизации глюкозы и кислорода мозгом и предотвращая прогрессирующее накопление лактата.
Мексилек-Лекфарм ® Улучшает и стабилизирует мозговой метаболизм и кровоснабжение головного мозга, улучшает реологические свойства крови и микроциркуляцию. Препарат поддерживает функциональную активность головного мозга как при ишемии, так и в постишемическом периоде.Мексилек-Лекфарм ® оказывает избирательное, не сопровождающееся седативным эффектом и миорелаксацией, анксиолитическое действие, устраняет тревогу, страх, напряжение, тревогу.
Мексилек-Лекфарм ® обладает ноотропными свойствами, предотвращает и уменьшает нарушения обучения и памяти, возникающие при сосудистых заболеваниях головного мозга (ишемический инсульт, дисциркуляторная энцефалопатия), при легких и среднетяжелых когнитивных расстройствах, оказывает антигипоксическое действие, повышает концентрацию внимания и производительность.
Включение препарата Мексилек-Лекфарм ® в комплексную терапию больных с острыми нарушениями кровообращения головного мозга снижает выраженность клинических проявлений инсульта и улучшает течение реабилитационного периода.
Мексилек-Лекфарм ® Ингибитор свободнорадикальных процессов, мембранопротектор. Оказывает также антигипоксическое, стресспротекторное, ноотропное, противоэпилептическое и анксиолитическое действие. Он принадлежит к классу 3-оксипиридинов.
Механизм действия Мексилек-Лекфарм ® благодаря антиоксидантному и мембранозащитному действию. Препарат ингибирует перекисное окисление липидов, повышает активность супероксидазы, повышает липидно-белковое соотношение, улучшает структуру и функцию клеточной мембраны.
Мексилек-Лекфарм ® модулирует активность мембраносвязанных ферментов (кальций-независимой фосфодиэстеразы, аденилатциклазы, ацетилхолинэстеразы), рецепторных комплексов (бензодиазепин, ГАМК, ацетилхолин), что повышает их способность связываться с лигандами, способствует сохранение структурно-функциональной организации биомембран, транспорта нейромедиаторов и улучшение синаптической передачи. Мексилек-Лекфарм ® повышает содержание дофамина в головном мозге.Вызывает усиление компенсаторной активации аэробного гликолиза и снижение степени торможения окислительных процессов в цикле Кребса в условиях гипоксии с увеличением содержания АТФ и креатинфосфата, активацию энергосинтезирующих функций митохондрий. .
Мексилек-Лекфарм ® повышает содержание дофамина в головном мозге.Вызывает усиление компенсаторной активации аэробного гликолиза и снижение степени торможения окислительных процессов в цикле Кребса в условиях гипоксии с увеличением содержания АТФ и креатинфосфата, активацию энергосинтезирующих функций митохондрий. .
Повышает резистентность организма к воздействию различных повреждающих факторов при патологических состояниях (гипоксия и ишемия, нарушения мозгового кровообращения, интоксикация этанолом и нейролептиками).
В условиях критического снижения коронарного кровотока способствует сохранению структурно-функциональной организации мембран кардиомиоцитов, стимулирует активность мембранных ферментов — фосфодиэстеразы, аденилатциклазы, ацетилхолинэстеразы. Поддерживает активацию аэробного гликолиза, развивающегося при острой ишемии, и способствует восстановлению митохондриальных окислительно-восстановительных процессов в условиях гипоксии, увеличивает синтез АТФ и креатинфосфата. Обеспечивает целостность морфологических структур и физиологических функций ишемизированного миокарда.Улучшает клиническое течение инфаркта миокарда, повышает эффективность терапии, снижает частоту аритмий и нарушений внутрисердечной проводимости. Нормализует метаболические процессы в ишемизированном миокарде, повышает антиангинальную активность нитратов, улучшает реологические свойства крови, уменьшает последствия реперфузионного синдрома при острой коронарной недостаточности
Обеспечивает целостность морфологических структур и физиологических функций ишемизированного миокарда.Улучшает клиническое течение инфаркта миокарда, повышает эффективность терапии, снижает частоту аритмий и нарушений внутрисердечной проводимости. Нормализует метаболические процессы в ишемизированном миокарде, повышает антиангинальную активность нитратов, улучшает реологические свойства крови, уменьшает последствия реперфузионного синдрома при острой коронарной недостаточности
Уменьшает ферментативную токсемию и эндогенную интоксикацию при остром панкреатите.
Улучшает обмен веществ и кровоснабжение головного мозга, микроциркуляцию и реологические свойства крови, уменьшает агрегацию тромбоцитов.Стабилизирует мембраны клеток крови (эритроцитов и тромбоцитов), снижая вероятность гемолиза.
Оказывает гиполипидемическое действие, снижает содержание общего холестерина и ЛПНП.
Мексидол — антиоксидант — ингибитор свободнорадикальных процессов, обладающий антигипоксическим, стресс-протекторным, антиамнестическим, анксиолитическим действием. Препарат повышает устойчивость организма к воздействию экстремальных факторов и кислородозависимых патологических состояний (шок, гипоксия, нарушения мозгового кровообращения), предотвращает и уменьшает токсическое действие этилового спирта.
Препарат повышает устойчивость организма к воздействию экстремальных факторов и кислородозависимых патологических состояний (шок, гипоксия, нарушения мозгового кровообращения), предотвращает и уменьшает токсическое действие этилового спирта.
[Возможности антиоксидантной терапии астении и когнитивного дефицита у пожилых больных с хронической ишемией головного мозга] | Интернет-исследования в области здравоохранения и окружающей среды (HERO)
Цель: Оценить влияние антиоксиданта мексидола на оксидантно-антиоксидантный потенциал липопротеинов низкой плотности (ЛПНП), астеническую и тревожную симптоматику, когнитивную функцию нейродинамического типа у пожилых больных с хронической ишемией головного мозга (ХИМ). ОБЪЕКТЫ И МЕТОДЫ: Тридцать женщин (средний возраст 66 лет).7 лет) с дисциркуляторной энцефалопатией (ДЭ) 1-2 степени. Динамику астенической, тревожной и когнитивной симптоматики нейродинамического типа оценивали с помощью стандартных тестов (MFI-20, шкала оценки тревожности Гамильтона, таблицы Шульте, тест Векслера) на 1-й, 15-й и 60-й дни лечения мексидолом (в течение 60 дней). . ЛПНП выделяли из крови путем преципитации гепарином. Определяли исходный уровень продуктов перекисного окисления липидов и исследовали концентрацию жирорастворимых антиоксидантов (а-токоферола, ретинола, бета-каротина и ксантинов) в выделенных ЛПНП на 1-й и 5-й дни исследования.
. ЛПНП выделяли из крови путем преципитации гепарином. Определяли исходный уровень продуктов перекисного окисления липидов и исследовали концентрацию жирорастворимых антиоксидантов (а-токоферола, ретинола, бета-каротина и ксантинов) в выделенных ЛПНП на 1-й и 5-й дни исследования.
РЕЗУЛЬТАТЫ: 60-дневный цикл терапии мексидолом статистически значимо вызывал уменьшение астенической и тревожной симптоматики у пожилых пациентов с ЧМТ и вызывал положительные сдвиги в симптомах когнитивной нейродинамики. Оценка особенностей фармакодинамики антиоксиданта мексидола, применяемого у пациентов пожилого возраста в течение 15 дней, выявила статистически значимое положительное влияние на окислительный потенциал ЛПНП в виде снижения предрасположенности к их антиоксидантным процессам in vivo.Эффект препарата по повышению уровня а-токоферола и бета-каротина изменялся незначительно (без статистически значимых изменений), что отражает фармакодинамические особенности препарата у пациентов пожилого возраста.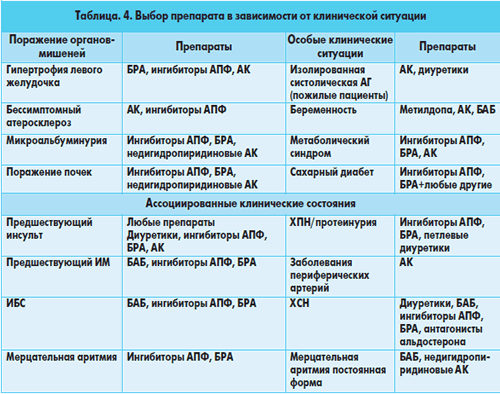
ЗАКЛЮЧЕНИЕ: 60-дневный цикл терапии антиоксидантом мексидолом оказывает положительное влияние на астеническую и невротическую симптоматику у пожилых больных ХИМ. Мексидол хорошо переносится и безопасен при длительном применении.
Энцефалопатия | HealthDirect
На этой странице
Что такое энцефалопатия?
Слово энцефалопатия описывает любое заболевание, которое поражает весь мозг и изменяет его структуру или то, как он работает, а также вызывает изменения в психической функции.
Каковы симптомы энцефалопатии?
Симптомы энцефалопатии варьируются от человека к человеку.
Наиболее частым симптомом энцефалопатии является изменение психического состояния с такими проблемами, как:
- потеря памяти
- снижение способности ясно мыслить или концентрироваться
- сонливость
- изменения личности, такие как раздражительность, агрессия, импульсивное поведение или суицидальные мысли
У некоторых людей также может быть:
Существует несколько различных моделей энцефалопатии. У некоторых людей бывает острая энцефалопатия, которая возникает довольно быстро и может пройти. Другие имеют хроническую энцефалопатию, которая имеет тенденцию к медленному развитию и не проходит.
У некоторых людей бывает острая энцефалопатия, которая возникает довольно быстро и может пройти. Другие имеют хроническую энцефалопатию, которая имеет тенденцию к медленному развитию и не проходит.
Некоторые люди с хроническими фоновыми заболеваниями, такими как заболевания печени, могут время от времени чувствовать себя хорошо, а затем у них может быть эпизод энцефалопатии, вызванный инфекцией, кровотечением в пищеварительном тракте, алкоголем, лекарствами или дисбалансом электролитов.
Некоторые энцефалопатии вызывают необратимое повреждение головного мозга, а другие нет.Некоторые могут быть фатальными.
Что вызывает энцефалопатию?
Энцефалопатия — это не отдельное заболевание; это может иметь широкий спектр основных причин.
Существует много типов энцефалопатии, в том числе:
- печеночная энцефалопатия — заболевание печени вызывает накопление токсических веществ, которые в норме выводятся печенью. Эти токсичные вещества затем нарушают нормальное функционирование мозга.
 Печеночная энцефалопатия может быть вызвана хроническим заболеванием печени, таким как цирроз, инфекция, передозировка отпускаемых по рецепту лекарств или кровотечение в пищеварительном тракте.
Печеночная энцефалопатия может быть вызвана хроническим заболеванием печени, таким как цирроз, инфекция, передозировка отпускаемых по рецепту лекарств или кровотечение в пищеварительном тракте. - хроническая травматическая энцефалопатия (ХТЭ) — это, вероятно, вызвано повторными ударами по голове и сотрясениями мозга. Это связано с контактными видами спорта, такими как бокс и футбол.
- гипоксически-ишемическая энцефалопатия — недостаток кислорода в головном мозге приводит к нарушению его функции. Это может быть вызвано сильным кровотечением, почти утоплением или удушьем.
- Энцефалопатия Вернике — тяжелый дефицит витамина В, называемого тиамином, вызывает энцефалопатию.Чаще всего это происходит у людей с тяжелым алкоголизмом.
Энцефалопатия также может быть вызвана:
Когда следует вызвать скорую помощь или обратиться в отделение неотложной помощи больницы?
Вам следует немедленно обратиться за помощью, позвонив по номеру три нуля (000) или обратившись в отделение неотложной помощи, если вы или кто-то, с кем вы находитесь, :
.
- сильное замешательство или дезориентация
- с неконтролируемыми припадками
- потеря сознания
- мысли о самоубийстве
Когда мне следует обратиться к врачу?
Если вы или кто-то из ваших знакомых заметите какие-либо новые проблемы, которые могут быть симптомами энцефалопатии, позвоните своему врачу.Это особенно важно, если у вас есть основная проблема, такая как заболевание печени, потому что энцефалопатия может стать неотложной ситуацией.
Как диагностируется энцефалопатия?
Если ваш врач считает, что у вас может быть энцефалопатия, он попытается выяснить основную причину.
Чтобы выяснить, есть ли у вас энцефалопатия и какой она может быть, ваш врач может использовать комбинацию:
Как лечится энцефалопатия?
Людей с острой энцефалопатией необходимо лечить в стационаре.Лечение может включать:
- устранение причин. Например, пищевые добавки могут использоваться для людей с энцефалопатией Вернике, а антибиотики могут использоваться для лечения энцефалопатий, вызванных или вызванных инфекциями.
- лечение симптомов. Например, противосудорожные препараты могут быть назначены для лечения судорог, и могут быть приняты меры для обеспечения безопасности людей.
В некоторых тяжелых случаях энцефалопатии, вызванной проблемами с печенью или почками, может потребоваться диализ или трансплантация органов.
Энцефалопатия часто обратима при лечении. Тем не менее, люди с сопутствующими хроническими заболеваниями, такими как заболевания печени, с большей вероятностью будут иметь повторные эпизоды энцефалопатии и нуждаются в постоянном лечении.
Сепсис-ассоциированная энцефалопатия
Сепсис-ассоциированная энцефалопатия (САЭ) является распространенным, но плохо изученным неврологическим осложнением сепсиса. Он характеризуется диффузной дисфункцией головного мозга, вторичной по отношению к инфекции в других частях тела без явной инфекции ЦНС.Патофизиология SAE является сложной и многофакторной, включая ряд взаимосвязанных механизмов, таких как повреждение сосудов, активация эндотелия, нарушение гематоэнцефалического барьера, изменение передачи сигналов в головном мозге, воспаление головного мозга и апоптоз. Клиническая картина SAE может варьироваться от легких симптомов, таких как недомогание и нарушение концентрации внимания, до глубокой комы. Оценка когнитивной дисфункции затруднена из-за отсутствия каких-либо специальных исследований или биомаркеров, а также из-за частого использования седативных средств у пациентов в критическом состоянии.Таким образом, SAE остается диагнозом исключения, который может быть поставлен только после исключения других причин измененного мышления у лихорадящего больного в критическом состоянии с помощью соответствующих исследований. Несмотря на высокую смертность, лечение СНЯ ограничивается лечением основной инфекции и симптоматическим лечением делирия и судорог. Важно знать об этом состоянии, поскольку SAE может проявляться на ранних стадиях сепсиса, даже до того, как будут соблюдены диагностические критерии сепсиса. В этом обзоре обсуждается диагностический подход к пациентам с SAE, а также его эпидемиология, патофизиология, клиническая картина и дифференциальный диагноз.
1. Введение
Сепсис является одной из наиболее частых причин обращения в отделение неотложной помощи, на которую приходится 6,4% госпитализаций [1, 2]. Сепсис и сопутствующие ему осложнения вызывают больше смертей, чем рак предстательной железы, рак молочной железы и ВИЧ/СПИД вместе взятые, что ложится тяжелым финансовым бременем на систему здравоохранения. Сепсис-ассоциированная энцефалопатия (САЭ) представляет собой многофакторный синдром, характеризующийся диффузной церебральной дисфункцией, вызванной системным ответом на инфекцию, без клинических или лабораторных признаков прямой инфекции головного мозга или других типов энцефалопатии (например, энцефалопатии).г., печеночная или почечная энцефалопатия). Термин SAE предпочтительнее широко используемого термина «септическая энцефалопатия», который для некоторых подразумевает стойкую прямую инфекцию центральной нервной системы. Вместо этого термин «септическая энцефалопатия» может использоваться для определения септического состояния, то есть системного воспалительного состояния, вызванного инфекционным процессом в головном мозге или ЦНС. Мозговая дисфункция вследствие сепсиса была забытой причиной делирия или измененного психического состояния у пациентов в критическом состоянии, прежде всего потому, что не существует точных, хорошо установленных клинических или биологических маркеров повреждения для оценки мозговой дисфункции, возникающей в результате сепсиса [3].Однако недавние исследования показали, что SAE является относительно частой причиной изменения психического статуса у пациентов в критическом состоянии, госпитализированных в отделение интенсивной терапии, и его распространенность колеблется от 8 до 70% в зависимости от используемых критериев включения и исключения [4–6]. Клинический спектр SAE может варьироваться от легкой невнимательности или дезориентации, возбуждения и повышенной сонливости до более тяжелых нарушений сознания, наблюдаемых при коме. Хотя прямой инфекции или инвазии ЦНС нет, лабораторные признаки дисфункции ЦНС часто встречаются при СНЯ.Могут быть признаки аномалий электроэнцефалографии (ЭЭГ) и соматосенсорных вызванных потенциалов (ССВП), повышения биомаркеров, таких как нейрон-специфическая енолаза, белок S-100 β , и некоторые аномалии при нейровизуализации. Ни одна из этих лабораторных аномалий не является специфичной, и SAE остается диагнозом исключения и может быть диагностирован только после того, как другие инфекционные, метаболические и токсические причины были исключены с помощью соответствующих исследований. Важно знать об этом состоянии, поскольку наличие энцефалопатии у пациентов с сепсисом связано с более высоким уровнем смертности и вероятными долгосрочными когнитивными эффектами [5, 7].Настоящий обзор посвящен клиническим особенностям, патофизиологии, дифференциальной диагностике и потенциальным стратегиям улучшения неврологических исходов СНЯ.
2. Сепсис: определения и терминология
Предпосылкой для постановки диагноза SAE является наличие сепсиса. Сепсис определяется как клинический синдром, осложняющий тяжелую инфекцию и характеризующийся кардинальными признаками воспаления (расширение сосудов, накопление лейкоцитов и повышение проницаемости микрососудов), возникающими в тканях, удаленных от инфекции.Сепсис является одной из наиболее частых причин госпитализации в отделения интенсивной терапии и составляет 37,4% госпитализаций [2]. Американский колледж врачей-пульмонологов и Общество реаниматологов (ACCP/SCCM) созвали консенсусную конференцию в 1991 г. для определения сепсиса и связанных с сепсисом синдромов, которые позже были изменены в 2003 г., как показано ниже [8, 9].
Определения терминов, используемых для описания сепсиса и связанных с ним Синдромов
Синдром системной воспалительной реакции. Системная воспалительная реакция на различные клинические инсульты проявляется двумя или более из следующих состояний [8]: температура < 36°C или > 38°C, частота сердечных сокращений > 90 уд/мин, частота дыхания > 20 вдохов/выдохов/ min или PaCO2 < 32 мм рт.ст., количество лейкоцитов <4000 клеток/ μ л, > 12000 клеток/ μ л, или > 10% незрелых (полосчатые формы).
Инфекция. Инфекция – это инвазия микроорганизмов в обычно стерильную ткань.
Бактериемия. Бактериемия – наличие жизнеспособных бактерий в крови.
Сепсис. Задокументировано или подозревается и некоторые из следующих. Общие параметры . Лихорадка (центральная температура > 38,3°C), гипотермия (центральная температура <36°C, частота сердечных сокращений > 90 уд/мин или >2 SD выше возрастной нормы, тахипноэ >30 уд/мин, изменение психического состояния, значительные отеки или положительный баланс жидкости (> 20 мл/кг в течение 24 часов) и гипергликемия (глюкоза плазмы> 110 мг/дл или 7.7 мМ/л) при отсутствии диабета. Параметры воспаления . Лейкоцитоз (количество лейкоцитов > 12000/ мк л), лейкопения (количество лейкоцитов <4000/ мк л), нормальное количество лейкоцитов с >10% незрелых форм, С-реактивный белок плазмы >2 SD выше нормальное значение, а прокальцитонин плазмы > 2 SD выше нормального значения. Параметры гемодинамики . Артериальная гипотензия (систолическое артериальное давление САД < 90 мм рт.ст., САД < 70 мм рт.ст. или снижение САД >40 мм рт.ст. у взрослых или менее двух стандартных отклонений ниже возрастной нормы). Параметры дисфункции органов . Артериальная гипоксемия (PaO2/FiO2 < 300), острая олигурия (диурез < 0,5 мл/кг/ч в течение как минимум двух часов, несмотря на адекватную инфузионную терапию), повышение креатинина > 0,5 мг/дл или 44,2 мкмоль/л, нарушения коагуляции (МНО). ≫ 1,5 или АЧТВ > 60 секунд), кишечная непроходимость (отсутствие кишечных шумов), тромбоцитопения (количество тромбоцитов < 100 000/мкл) и гипербилирубинемия (общий билирубин плазмы > 4 мг/дл). L), снижение капиллярного наполнения или пятнистость.
Тяжелый сепсис (синдром сепсиса) . Это сепсис, осложненный органной дисфункцией. Таким образом, пациент с сепсисом, у которого имеются отклонения в параметрах органной дисфункции или параметрах тканевой перфузии, классифицируется как больной тяжелым сепсисом.
Септический шок . Это сепсис-индуцированная гипотензия, сохраняющаяся, несмотря на адекватную инфузионную терапию, которая может быть определена как инфузия 30 мл/кг кристаллоидов или потребность в вазопрессорах для поддержания систолического артериального давления ≥ 90 мм рт.ст. или среднего артериального давления ≥ 70 мм рт.ст.
Синдром полиорганной дисфункции (СПОН) . Это прогрессирующая дисфункция >1 органа у тяжелобольного пациента, при которой гомеостаз не может поддерживаться без вмешательства.
Сепсис — это клинический синдром, возникающий в результате нерегулируемой воспалительной реакции на инфекцию. Он определяется как наличие вероятной или документально подтвержденной инфекции вместе с системными проявлениями инфекции. При септических синдромах одним из кардинальных проявлений системной гипоперфузии является изменение психического статуса.У пациентов с сепсисом и энцефалопатией ранее диагностировали септическую энцефалопатию. Однако использование этого термина не совсем корректно, так как предполагает активную инфекцию внутри ЦНС. Таким образом, термин «септическая энцефалопатия» лучше подходит для определения септического состояния, то есть системного воспалительного состояния, вызванного инфекционным процессом в головном мозге или ЦНС. Некоторые авторы также использовали термин «делирий» вместо «энцефалопатия», но эти два состояния не являются синонимами, поскольку СНЯ является одной из многих причин делирия, а делирий — не единственное клиническое проявление СНЯ.Делирий — это флуктуирующее расстройство сознания, связанное с изменением познания или нарушением восприятия; это может быть вызвано любым общим заболеванием [10]. Кроме того, симптомы СНЯ могут полностью миновать стадию делирия, поэтому использование двух терминов не является синонимом [11, 12].
3. Эпидемиология
Первое сообщение о делирии, связанном с инфекционным лихорадочным заболеванием, было дано доктором Джонсом в 1903 г., который предположил, что когнитивная дисфункция может быть вызвана фебрильным инфекционным заболеванием, которое может возникнуть во время или после лихорадки [13]. .Доктор Джонс был первым автором, выдвинувшим гипотезу о том, что тот же самый фактор, который вызывает лихорадку, может быть связан с дисфункцией мозга. С тех пор СНЯ все чаще признают причиной когнитивной дисфункции у пациентов в критическом состоянии. Несмотря на это, существует недостаток исследований, посвященных заболеваемости и распространенности СНЯ [4, 14]. Считается, что СНЯ является наиболее частой причиной энцефалопатии в медико-хирургических отделениях интенсивной терапии, и более половины пациентов с сепсисом имеют энцефалопатию [15, 16].Одна из самых больших проблем в установлении частоты и распространенности SAE заключается в том, что не существует специального теста или набора диагностических критериев для определения этого состояния. Поэтому распространенность СНЯ в различных исследованиях колеблется от 9 до 71% больных с тяжелым сепсисом в зависимости от того, как он определяется [5, 16–18]. В большинстве этих исследований определения сепсиса, а также критерии, используемые для определения энцефалопатии, различались. В то время как в некоторых более ранних исследованиях для определения сепсиса использовались положительный микробиологический посев или самостоятельные клинические признаки сепсиса, в большинстве недавних исследований для диагностики синдрома сепсиса использовались критерии ACCP/SCCM.Не менее важным ограничением в изучении распространенности SAE является сложность оценки когнитивных функций и чувствительности у пациентов в критическом состоянии с сепсисом. Различные авторы использовали разные методы для оценки энцефалопатии. В то время как некоторые авторы использовали клиническую оценку психического статуса путем тестирования внимания, памяти и ориентации для определения и степени энцефалопатии, другие использовали шкалу комы Глазго (ШКГ), замедление ЭЭГ или аномалии кортикальных сенсорных вызванных потенциалов для определения СНЯ. 4, 5, 16–20].Даже в тех случаях, когда для определения чувствительности и когнитивных функций использовались клинические критерии, распространенность СНЯ сильно различается. Янг и др. клинически оценивали внимание, память и ориентацию у 69 пациентов с лихорадкой и положительным микробным посевом. Они обнаружили, что у 70% были признаки дисфункции головного мозга [4]. В более крупном исследовании Sprung et al. обнаружили, что остро измененный психический статус имел место у 23% пациентов с сепсисом. Однако в этом исследовании не использовалось систематически объективное тестирование органов чувств, а определение сепсиса основывалось на положительных микробных культурах и 7 самостоятельных клинических признаках [5].В другом недавнем исследовании, проведенном в Китае, частота сепсис-ассоциированной энцефалопатии составила 17,7%, но это было ретроспективное исследование, и критерии, используемые для диагностики СНЯ, не были четко выяснены [14]. Очевидно, что при сочетании более чувствительных методов проверки когнитивных функций с соответствующими электрофизиологическими исследованиями до 70 % больных с бактериемией имеют неврологическую симптоматику от вялости и легкой невнимательности до комы, а почти у 80 % больных отмечаются отклонения на ЭЭГ [4, 17, 21]. ].Эти более легкие случаи можно легко пропустить, если использовать такие шкалы, как ШКГ, для определения психического статуса у пациентов с сепсисом.
Наличие SAE у критически больного пациента также имеет прогностическое значение. В основополагающем отчете Sprung et al. уровень смертности пациентов с сепсисом с измененным психическим статусом составил 49% по сравнению с 26% у пациентов с сепсисом без неврологических симптомов [5]. Эйдельман и др. сообщили, что тяжесть неврологических симптомов, вторичных по отношению к энцефалопатии, у пациентов в отделении интенсивной терапии, оцениваемая по шкале ШКГ, коррелирует с прогнозом, при этом уровень смертности достигает 63% у пациентов с баллами по шкале ШКГ от 3 до 8 [16]. .
Источник и этиология инфекции также являются важными факторами в развитии СНЯ с инфекциями желчевыводящих путей или кишечника, связанными с повышенным риском СНЯ с последующими легочными инфекциями. Наиболее часто вовлеченными микроорганизмами являются Staphylococcus aureus , Enterococcus faecium , Acinetobacter spp., Pseudomonas aeruginosa и Stenotrophomonas maltophilia [14]. Было замечено, что пациенты с множественными бактериями в культуре крови и с Candida albicans имеют более тяжелую дисфункцию головного мозга и более высокий уровень смертности [22].
Хотя СНЯ часто описывают как острый обратимый синдром, появляется все больше доказательств того, что СНЯ может представлять значительный риск долгосрочных когнитивных нарушений, включая изменения скорости умственной обработки, исполнительной функции, памяти, внимания и зрительно-пространственных способностей. Эти когнитивные изменения могут сохраняться в течение нескольких лет даже после выздоровления от сепсиса и СНЯ и могут неблагоприятно влиять на функциональные способности, качество жизни и способность вернуться к работе. Это может стать огромным бременем как для членов семьи, так и для лиц, осуществляющих уход.Недавние исследования пришли к выводу, что 70% выживших после сепсиса имели нейрокогнитивные нарушения при выписке из стационара и до 45% имели нейрокогнитивные нарушения через 1 год [23].
4. Патофизиология
Патофизиология СНЯ не установлена, но было предложено несколько вероятных механизмов [24]. SAE, по-видимому, включает прямое клеточное повреждение головного мозга, митохондриальную и эндотелиальную дисфункцию, нарушения нейротрансмиссии и нарушения гомеостаза кальция в ткани головного мозга [25].
4.1. Мозговая сигнализация во время сепсиса
Мозговая сигнализация является решающим событием для организма, чтобы выработать соответствующий ответ на вторжение микроорганизмов [26]. Обнаружение системного воспаления головным мозгом затрудняется гематоэнцефалическим барьером (ГЭБ). Два основных пути обеспечивают нейроиммунную связь: околожелудочковые органы (ОКО), расположенные в средней линии желудочковой системы, и блуждающий нерв. В CVO отсутствует BBB, что обеспечивает прямую связь между мозгом и кровотоком.Некоторые ЦВО расположены вблизи нейроэндокринных структур (например, organum subfornicale, organum subcommisurale, pineale corpus, neurohypophysis и organum vasculosum laminae terminalis), а другие расположены вблизи вегетативных центров ствола мозга (например, area postrema) [27]. Эти CVO экспрессируют компоненты врожденной и адаптивной иммунной системы, такие как toll-подобные рецепторы, CD14 и рецепторы цитокинов, включая бета-интерлейкин-1 (IL-1 β ), интерлейкин-6 (IL-6) и опухолевые рецепторы. фактор некроза-альфа (TNF- α ) [28–33].Блуждающий нерв обнаруживает висцеральное воспаление через свои аксональные рецепторы цитокинов, афферентные сигналы передаются в ядро одиночного пути в стволе головного мозга. Активация эфферентной активности блуждающего нерва подавляет синтез цитокинов в поврежденных тканях через холинергический противовоспалительный путь (воспалительный рефлекс). Как только висцеральное или системное воспаление обнаруживается первым или вторым путем, активирующий сигнал распространяется на поведенческие, нейроэндокринные и нейровегетативные центры.Это приводит к усилению транскрипции нескольких про- и противовоспалительных цитокинов и хемокинов в головном мозге. Эти цитокины, такие как TNF- α , IL-1 β , бета-трансформирующий фактор роста (TGF β ) и моноцитарный хемоаттрактантный белок 1 (MCP1), затем модулируют экспрессию α -амино-3-гидрокси. Рецепторы -5-метил-4-изоксазолпропионовой кислоты (AMPAR) и рецепторы N-метил-D-аспартата (NMDAR) на нейронах, которые могут иметь функциональные последствия для познания и поведения [34].Кроме того, эти цитокины, в частности IL-1 β , вызывают активацию микроглии, что может быть одним из самых ранних изменений, наблюдаемых при SAE [35]. Эти активированные глиальные клетки приобретают нейротоксические свойства, в частности, за счет высвобождения оксида азота, цитокинов, активных форм кислорода и глутамата, что вызывает гибель клеток в уязвимых областях мозга. В результате этот мозговой сигнальный механизм, который на самом деле призван служить защитным и противовоспалительным механизмом, становится виновником патогенеза SAE.
4.2. Микроскопическая травма головного мозга
При СНЯ человека описана прямая церебральная локализация микроорганизмов с образованием микроабсцессов [4]. Однако наблюдалось много случаев СНЯ без микроабсцессов головного мозга; не было никакой корреляции между SAE и каким-либо конкретным микроорганизмом, что делает маловероятным то, что прямое воздействие микроорганизмов на головной мозг может играть причинную роль в SAE. Кроме того, церебральные изменения, связанные с сепсисом, включают признаки церебральной ишемии и кровоизлияний, которые также могут быть причиной симптомов СНЯ [36].В проспективном патологоанатомическом исследовании пациентов с сепсисом сообщалось об церебральных поражениях, которые у одного пациента были совместимы с многоочаговой некротизирующей лейкоэнцефалопатией [37].
4.3. Нарушение эндотелиального и гематоэнцефалического барьера
Адекватная функция церебральной микроциркуляции и ГЭБ важна для поддержания нормальной функции головного мозга. В нормальных условиях ГЭБ защищает мозг от ряда повреждений и создает жестко регулируемую микросреду для нервных клеток.Целостность ГЭБ поддерживается за счет взаимодействия между ножками астроцитов, перицитами и эндотелиальными клетками [38]. Экспериментальные данные показывают, что на ранней стадии сепсиса оксид азота, производный эндотелиальной синтазы оксида азота, проявляет провоспалительные свойства и способствует активации и дисфункции цереброваскулярных эндотелиальных клеток [39]. Во-вторых, индуцированная липополисахаридами (ЛПС) и цитокинами экспрессия молекул адгезии на эндотелиальных клетках микрососудов головного мозга также способствует дисфункции ГЭБ.Это разрушение ГЭБ облегчает прохождение нейротоксических факторов, таких как цитокины, и объясняет отек головного мозга, наблюдаемый на МРТ у пациентов с СНЯ [40]. Разрушение ГЭБ чаще происходит вокруг пространств Вирхова-Робена, но может быть диффузным по всему белому веществу и задним долям. Более высокий уровень белка ЦСЖ у больных с сепсисом по сравнению с контрольными пациентами без сепсиса также связывают с распадом ГЭБ [41].
4.4. Церебральная микроциркуляция
Появляется все больше данных о том, что изменение церебральной микроциркуляции во время сепсиса может быть причиной клинических проявлений СНЯ.У больных с сепсисом нарушается церебральная ауторегуляция и притупляется реакция сосудов головного мозга на концентрацию углекислого газа или внеклеточный рН [42, 43]. Потеря церебральной ауторегуляции делает мозг более восприимчивым к изменениям среднего артериального давления, так что критические падения системного артериального давления напрямую передаются в сосудистое русло головного мозга, что приводит к гипоперфузии головного мозга. Однако этот механизм остается спорным, так как некоторые авторы не обнаружили изменений ауторегуляции церебральных сосудов у больных с сепсисом [44, 45].
4.5. Изменения в нейротрансмиссии
Некоторые нейротрансмиттеры, по-видимому, связаны с SAE, включая холинергический путь и экспрессию рецепторов гамма-аминомасляной кислоты, норадреналина, серотонина и дофамина [46–48]. Предполагается, что воспалительные и метаболические изменения связаны с сепсисом и приводят к изменениям церебральной нейротрансмиссии [49, 50]. Предполагается, что цитокины, такие как TNF- α , системно продуцируемые во время сепсиса, активируют церебральную микроглию, которая, в свою очередь, высвобождает медиаторы воспаления в ЦНС.Эти медиаторы воспаления вызывают аберрантную функцию нейронов и, таким образом, делирий и SAE [49].
Дефицит холинергической функции постулируется как вызывающий делирий и снижение когнитивных функций [51]. Глобальная гипохолинергия возникает в результате нескольких механизмов, включая нарушение синтеза ацетилхолина и холинергическую синаптическую дисфункцию (нарушение пресинаптической, синаптической или постсинаптической функции ацетилхолина). Если холинергическая функция нарушена, как при нейродегенеративном заболевании или из-за антихолинергических препаратов, может развиться более тяжелый и продолжительный делирий [49].Однако, несмотря на это, двойное слепое плацебо-контролируемое исследование показало, что делирий длится дольше и смертность выше у пациентов, получавших ингибитор холинэстеразы ривастигмин, по сравнению с контрольной группой, у которых делирия не было [52]. Хотя эти данные и ставят под сомнение роль холинергической системы в патогенезе делирия, тем не менее они не исключают полностью возможности того, что нарушения холинергической функции способствуют развитию СНЭ. Также возможно, что дисбаланс между дофаминергической и холинергической нейротрансмиссией является причиной бреда у пациентов в критическом состоянии.
Роль измененных уровней аминокислот в сыворотке крови при сепсисе и ее влияние на возможный дисбаланс нейротрансмиттеров в головном мозге сложна, противоречива и до сих пор неясна. Снижение уровня аминокислот с разветвленной цепью (лейцина, изолейцина и валина), группы больших нейтральных аминокислот, может быть связано с увеличением концентрации ароматических аминокислот (ААА) в головном мозге. У пациентов с энцефалопатическим сепсисом уровень ароматических аминокислот выше, а концентрация аминокислот с разветвленной цепью в плазме ниже, чем у пациентов без энцефалопатии [53].Избыток ароматических аминокислот, вероятно, вызван обширным мышечным протеолизом и сниженным печеночным клиренсом [54]. Потеря целостности ГЭБ означает повышенное соотношение ароматических аминокислот и аминокислот с разветвленной цепью в спинномозговой жидкости пациентов с СНЯ. ААА могут действовать как ложные нейротрансмиттеры или вызывать снижение церебральных концентраций норадреналина, дофамина и серотонина, в то время как уровни ГАМК в мозге, по-видимому, не изменяются [55, 56]. Изменение концентрации нейротрансмиттеров вызывает снижение утилизации глюкозы в отделах серотонинергической и норадренергической системы мозга [57].
Норадренергическая нейротрансмиссия также может быть особенно вовлечена в SAE, поскольку дексмедетомидин, селективный агонист α 2-адренорецепторов, экспрессируемых в голубом пятне, связан с меньшей дисфункцией головного мозга и лучшими результатами у пациентов с сепсисом по сравнению с мидазоламом или лоразепамом [58, 59].
4.6. Воспалительные медиаторы и система комплемента
Воспалительные цитокины и система комплемента являются последним общим звеном в патофизиологии дисфункции головного мозга при СНЯ.Цитокины, продуцируемые на периферии, ответственны за повреждение эндотелия и разрушение ГЭБ. Местно продуцируемые цитокины опосредуют дисфункцию нейронов и, в конечном счете, гибель клеток. TNF- α , по-видимому, является одним из наиболее значимых медиаторов воспаления при SAE. TNF- α индуцирует нейтрофильную инфильтрацию ткани головного мозга, апоптоз нейронов и отек головного мозга (вероятно, за счет индукции экспрессии аквапорина 4) [60]. ИЛ-6 также играет решающую роль в патогенезе СНЯ.ИЛ-6 индуцирует циклооксигеназу 2 в глиальных клетках, тем самым увеличивая синтез простагландинов и, в частности, простагландина Е2, который отвечает за активацию гипоталамо-гипофизарно-надпочечниковой оси, тем самым вызывая лихорадку и поведенческие изменения [61]. Каскад комплемента также играет роль в патогенезе СЭ. Чрезмерная активация комплемента может вызвать измененную экспрессию TLR4 и последующие изменения TNF- α , индуцибельной синтетазы оксида азота (iNOS) и аквапорина 4, вызывая отек, некроз клеток или апоптоз нейронов [38, 62].
4.7. Окислительный стресс, митохондриальная дисфункция и апоптоз
Сепсис связан с митохондриальной дисфункцией, которая может иметь значительные последствия для клеток и здоровья хозяина. Ранний сепсис связан со снижением образования митохондриального АТФ, что, вероятно, опосредовано цитокинами, активными формами кислорода (АФК) и оксидом азота (NO) [63]. Как упоминалось ранее, измененная передача сигналов в головном мозге и дисфункция ГЭБ приводят к устойчивому внутримозговому присутствию и продукции воспалительных молекул.Липополисахарид, продуцируемый грамотрицательными бактериями, вместе с различными цитокинами активирует iNOS в астроцитах и других клетках. Последующее увеличение производства NO и ROS оказывает несколько вредных эффектов на нейроны. NO и АФК ответственны за нитрозилирование белков, нарушение долговременной потенциации и ингибирование митохондриального дыхания, что вызывает патологические процессы в нервных клетках и усиление апоптоза [64–66]. Митохондриальная дисфункция, индуцированная NO, частично обусловлена снижением сродства цитохром-с-оксидазы к кислороду и ответственна как за индукцию апоптоза нервных клеток, так и за недостаточное снабжение нейронов энергией [11].
4.8. Гомеостаз кальция
SAE связан с повышением уровня внутриклеточного кальция. Изменение гомеостаза кальция ухудшает учебную память и когнитивную функцию [11].
Подводя итог, патогенез SAE является сложным и многофакторным (рис. 1). Дисфункция головного мозга при сепсисе также может быть связана с метаболическими нарушениями, вызванными печеночной и/или почечной недостаточностью или гипоперфузией вследствие септического шока.
5.Клинические признаки
Кардинальным признаком SAE является диффузное нарушение мозговой функции без каких-либо латеральных признаков. Двумя ключевыми предпосылками для постановки диагноза СНЯ являются наличие экстракраниальной инфекции и нарушение психического состояния. Таким образом, первичным клиническим признаком СНЯ является изменение психического состояния, особенно осознания/сознания и познания. SAE может вмешиваться в течение раннего сепсиса или может возникать позже в ходе болезни как часть полиорганной дисфункции, наблюдаемой в условиях рефрактерного септического шока [67].На основании психомоторной активности SAE можно дифференцировать на два типа проявления. Первый тип характеризуется возбуждением, спутанностью сознания, дезориентацией и раздражительностью, тогда как второй тип характеризуется повышенной сонливостью, ступором и комой. Эти два типа энцефалопатических проявлений почти поровну распределяются в группе больных с СНЯ. Состояния спутанности сознания, отсутствие внимания, неадекватное поведение, спутанность сознания, дезориентация и раздражительность обычно наблюдаются при ранней форме СНЯ наряду с кардинальными признаками ССВО и сепсиса.Когда когнитивные расстройства являются частью позднего СНЯ, чаще наблюдаются более тяжелые расстройства, такие как делирий и сильное возбуждение. Нарушение сознания в виде чрезмерной сонливости, ступора или комы чаще наблюдается при полиорганной дисфункции и рефрактерном септическом шоке [68]. Пациенты с SAE имеют уровень сознания, который непропорционален любому седативному лечению, которое они могут получать. Другим важным клиническим моментом, который затрудняет диагностику сепсис-ассоциированной энцефалопатии, является то, что у некоторых пациентов может развиться энцефалопатия на ранних стадиях инфекции, когда могут быть соблюдены критерии сепсиса, или спутанность сознания может развиться у пациентов с отдаленной инфекцией, такой как брюшной, отгороженный абсцесс, не вызвавший бактериемии или сепсиса.
У многих пациентов первые симптомы обычно появляются на ранней стадии сепсиса, часто до того, как будут диагностированы другие органные нарушения, и включают слабость, анорексию, недомогание и нарушение концентрации внимания, которые часто можно не заметить, если клиницист не осознает их значения. По мере прогрессирования сепсиса у пациентов с легкой энцефалопатией наблюдаются колебания спутанности сознания и неадекватное поведение. У них плохая концентрация внимания, и они могут делать ошибки при письме (включая орфографию, написание полных предложений и ориентацию письма на странице) [69].Среди других симптомов, обычно наблюдаемых при делирии, у них также могут проявляться нарушения циклов сна и бодрствования или признаки галлюцинаций, беспокойства или возбуждения. Однако, как указывалось ранее, СНЯ может полностью миновать стадию делирия [11]. По мере того, как сепсис становится все более тяжелым и рефрактерным, наступает состояние полиорганной недостаточности, которое может в дальнейшем усугублять энцефалопатию, часто приводящую к коме.
Двигательные симптомы редко наблюдаются у септических больных. Наиболее распространенным двигательным признаком является паратоническая ригидность или gegenhalten, сопротивление пассивному движению конечностей, зависящее от скорости: сопротивление, ощущаемое при движениях с нормальной скоростью, исчезает при медленном движении конечности.Астериксис, мультифокальный миоклонус, судороги и тремор относительно редки по сравнению с другими метаболическими энцефалопатиями, такими как печеночная и уремическая энцефалопатии или дисэлектролитемия. Почти 70% запущенных случаев SAE имеют связанную с критическим заболеванием невропатию или миопатию или их комбинацию, что может быть причиной неудачи в отлучении этих пациентов от искусственной вентиляции легких [16]. Нейропатия имеет аксональный тип и требует много месяцев для разрешения. Она начинается позже и восстанавливается намного медленнее, чем энцефалопатия.Клинически обнаруживают снижение подвижности и потерю глубоких сухожильных рефлексов. Существует относительное сохранение функции черепных нервов, так что больной будет гримасничать при болезненных раздражителях, но у него будет только слабое отдергивание конечности. Однако обычно вовлекаются диафрагмальные нервы, что приводит к проблемам с отлучением от ИВЛ. Как упоминалось выше, функции черепных нервов почти всегда сохраняются, даже в тяжелых случаях SAE, включая те, которые связаны с критической невропатией или миопатией, что отличает его от синдрома запертости и синдрома Гийена-Барре.Признаки латерализации, такие как паралич взора или гемипарез, встречаются крайне редко и требуют немедленного исключения более частых причин, таких как абсцесс головного мозга, инсульт или опухоли. Гипервентиляция при СНЯ часто возникает из-за респираторного алкалоза в ранней фазе бреда и из-за метаболического ацидоза в поздней стадии сепсиса [70].
Нейроэндокринная дисфункция (например, притупление реакции гипоталамо-гипофизарной оси и относительный дефицит вазопрессина) и вегетативная недостаточность (например, внезапное повышение или падение артериального давления и частоты сердечных сокращений, аритмия, нерегулярный паттерн дыхания и нейрогенный отек легких) являются некоторыми нераспознанными проявлениями дисфункция головного мозга при сепсисе [45, 71–73].
6. Подход к диагностике СНЯ: инструменты скрининга и лабораторные исследования
СНЯ является диагнозом исключения и требует исключения прямой инфекции центральной нервной системы, полиорганной недостаточности, травмы головы, жировой эмболии и побочных эффектов лекарств. . Первым шагом в оценке подозрения на SAE будет оценка психического статуса и выявление признаков энцефалопатии, которые могут быть малозаметными, особенно на ранних стадиях, и могут быть смешаны из-за обычного использования седативных средств в этой популяции.Следующим шагом является исследование и устранение возможности первичной патологии ЦНС, которая может быть ответственна за измененный уровень сознания. И последнее, но не менее важное: оценка должна быть направлена на выявление источника инфекции и ответственного инфекционного агента (рис. 2).
Существует несколько утвержденных шкал для выявления делирия и мониторинга сознания у пациентов с SAE. У неседативных пациентов психическое состояние напрямую оценивается с помощью метода оценки спутанности сознания (CAM) для пациентов вне отделения интенсивной терапии и метода оценки спутанности сознания для отделения интенсивной терапии (CAM-ICU) для пациентов, поступивших в отделение интенсивной терапии.САМ была одобрена для использования в диагностике делирия в этих условиях и демонстрирует превосходную чувствительность (94–100%) и положительную прогностическую ценность (91–94%) [74, 75]. Однако CAM-ICU имеет только 41–47% чувствительности при использовании обычными медсестрами в отделении интенсивной терапии, хотя специфичность была превосходной (98%) [76, 77]. САМ чаще всего пропускает пациентов с гипоактивным делирием.
Оценка среды интенсивной терапии (ATICE), которая позволяет оценить пробуждение, понимание и спокойствие, может указывать на делирий, когда оценка меньше 10 (максимальное значение равно 20).Оценка ATICE в значительной степени зависит от оценки открытия глаз на различные раздражители, тогда как CAM-ICU использует более широкий диапазон ответов для определения наличия делирия или комы [78]. Неструктурированные оценки делирия или Контрольный список для скрининга делирия в отделении интенсивной терапии также, по-видимому, обладают большей чувствительностью для выявления делирия в отделении интенсивной терапии, чем CAM-ICU [79, 80]. Таким образом, несмотря на ряд инструментов скрининга, наиболее подходящий инструмент скрининга делирия для ОИТ все еще остается спорным.Более того, все эти инструменты оценивают делирий, а не СНЯ; поэтому ни один инструмент не способен диагностировать весь спектр СНЯ, что требует мультифокального подхода.
У пациентов, находящихся под седацией, ежедневный перерыв в седации может облегчить оценку психического статуса [81]. Однако прекращение приема седативных средств не всегда приводит к успешному пробуждению больного, и во многих случаях пробуждение сопровождается возбуждением, вновь затрудняющим психическое обследование. Более того, в этих ситуациях сохранение комы или появление возбуждения не могут быть отнесены к СНЯ, поскольку это может быть связано с накоплением седативных средств или отменой седативных средств [12].Кроме того, не всегда возможно прервать седацию у пациентов в критическом состоянии из-за боязни самоэкстубации и плохой синхронизации пациента с аппаратом ИВЛ [82]. Статус седации и его влияние на мышление можно оценить с помощью утвержденной Ричмондской шкалы возбуждения-седации (RASS) [83]. У интубированных пациентов для оценки мозговой дисфункции можно использовать шкалу FOUR (Full Outline of Unresponsibility) и GCS. FOUR больше подходит для интубированных пациентов в отделении интенсивной терапии, чем GCS, хотя даже GCS может быть полезна для прогнозирования течения SAE и имеет значительную прогностическую ценность [84].У пациентов, находящихся под седацией и интубированных, потеря отдельных реакций ствола мозга, таких как окулоцефалический и кашлевой рефлексы, может быть предиктором смертности, изменения психического статуса и смертности. Шаршар и его коллеги заметили, что отсутствие окулоцефалической реакции с поправкой на оценку II по шкале Simplified Acute Physiology Score II независимо ассоциировалось с изменением психического статуса после отмены седативного средства. Кроме того, отсутствие кашлевого рефлекса было связано с более высокой 28-дневной смертностью [85].
При выявлении дисфункции головного мозга необходимо провести исчерпывающее неврологическое обследование с оценкой ригидности шеи, двигательных реакций, мышечной силы и тонуса, подошвенных и глубоких сухожильных рефлексов и черепных нервов, чтобы исключить другие причины энцефалопатии.Исследование положения и движения глаз, размера зрачка, моргания на яркий свет, реакции на свет, роговичного рефлекса, гримасничания на болезненную стимуляцию, окулоцефалической реакции и кашлевого рефлекса может иметь особое значение, особенно у пациентов, находящихся под седацией [12]. Исследование положения глаз и движений при окулоцефалическом маневре может оказать особую помощь в выявлении очаговых поражений ствола головного мозга, которые могут быть причиной измененного сознания у этих пациентов. Еще одним важным моментом в оценке пациентов с подозрением на СНЯ является правильная оценка лекарств, которые получает пациент.Следует отметить, что помимо очевидных виновников, таких как бензодиазепины, опиаты, противосудорожные и антихолинергические средства, могут быть назначены несколько других классов лекарств, включая антибиотики (особенно пенициллины, цефалоспорины, карбапенемы и хинолоны), антиаритмические средства, стероиды и нестероидные противовоспалительные препараты. связаны с дисфункцией головного мозга у пациентов в критическом состоянии [35]. Передозировка или отмена психоактивных препаратов в анамнезе могут указывать на альтернативную этиологию снижения уровня сознания или бреда, а недавняя история инфекции, требующая назначения антибиотиков, может помочь точно определить источник сепсиса и тем самым привести к диагностике СНЯ [86].
Тщательный физикальный осмотр для выявления источника инфекции (например, инфекции пролежней или других типов целлюлита или сыпи) должен быть дополнен соответствующими исследованиями, такими как УЗИ, эхокардиография и КТ для поиска скрытого источника инфекции. инфекционное заболевание. Нельзя недооценивать использование соответствующих культур (посев крови, посев из дыхательных путей или мокроты, посев мочи, анализ и посев спинномозговой жидкости [ЦСЖ]) и серологических исследований для выявления ответственного организма.Отсутствие бактериемии не исключает СНЯ, а идентификация патологического организма не всегда возможна. Распространенными причинами сложности идентификации болезнетворного организма являются предшествующее применение антибиотиков, которые могут препятствовать обнаружению специфических организмов, или наличие скрытого абсцесса [86].
Комплексная панель метаболических анализов, включая общий анализ крови, измерение расширенных электролитов (натрий, калий, хлорид, магний, фосфат и кальций) и уровней сывороточных ферментов (аланиновая и аспартатаминотрансферазы, щелочная фосфатаза и γ — глутамилтрансфераза) и функциональные тесты почек (креатинин сыворотки) должны быть выполнены для выявления признаков органной дисфункции или других аномалий, которые могут способствовать изменению чувствительности.Некоторые из метаболических параметров также могут иметь прогностическое значение, и было замечено, что уровни мочевины, креатинина, билирубина и щелочной фосфатазы в сыворотке прямо пропорциональны тяжести энцефалопатии [22]. Наконец, любые очаговые неврологические аномалии, такие как гемипарез или аномалии черепных нервов, могут указывать на очаговый неврологический процесс, такой как абсцесс или инсульт, и требуют срочной нейровизуализации.
Если при клиническом обследовании ничего не выявляется, диагноз SAE должен основываться на лабораторных исследованиях, которые могут включать ЭЭГ и сенсорные вызванные потенциалы (SEP).ЭЭГ чрезвычайно чувствительна для диагностики СНЯ и может показать отклонения даже при нормальном неврологическом обследовании. Однако специфичность низкая, и аналогичные результаты можно увидеть при других энцефалопатиях, включая печеночную и уремическую энцефалопатии. Янг и др. изучили 69 пациентов с сепсисом, 49 из которых имели некоторую степень энцефалопатии, которая была классифицирована как легкая или тяжелая. Они выделили 5 классов прогрессивно ухудшающегося паттерна ЭЭГ, связанного с ухудшением исхода: 1: нормальная ЭЭГ, 2: чрезмерная тета, 3: преобладающая дельта, 4: трехфазные волны и 5: подавление или всплеск подавления, в порядке возрастания тяжести [17]. .Смертность также была напрямую связана с тяжестью нарушений ЭЭГ: 0% при нормальной ЭЭГ, 19% при тета, 36% при дельта, 50% при трехфазных волнах и 67% при подавлении или подавлении всплесков. Несмотря на то, что паттерн подавления или всплеска подавления ЭЭГ подразумевает плохой прогноз, Янг и его коллеги также наблюдали полное выздоровление у нескольких пациентов с этим паттерном ЭЭГ, что означает, что, в отличие от аноксически-ишемической энцефалопатии, этот паттерн не всегда может указывать на тяжелый прогноз при СНЯ и выздоровление возможно при адекватном лечении [17].
Оддо и др. наблюдали периодические эпилептиформные разряды, а также судорожную активность на записи электроэнцефалограммы у 22% пациентов с SAE, но у двух третей пациентов электроэнцефалографические нарушения не коррелировали с клиническими наблюдениями. Они обнаружили, что припадки во время непрерывной ЭЭГ были чисто электрографическими (без видимой клинической корреляции) у большинства (67%) пациентов. Единственным предиктором наличия несудорожной судорожной активности и периодических разрядов было наличие сепсиса, а наличие судорог или ЭДС ассоциировалось со смертью или тяжелой инвалидностью при выписке из стационара [87].Было замечено, что ЭЭГ может выявить аномалии головного мозга у 50% пациентов, у которых нет клинических признаков энцефалопатии (с относительно сохранной когнитивной функцией) при физикальном обследовании, но есть лабораторные признаки бактериемии. Эти изменения на ЭЭГ могут разрешиться при успешном лечении сепсиса [17].
Кроме того, ЭЭГ может помочь в диагностике СНЯ, поскольку она может исключить бессудорожный эпилептический статус как причину изменения чувствительности у пациентов в критическом состоянии.Таким образом, ЭЭГ следует проводить систематически у всех пациентов с сепсисом при наличии аномальных движений или при подозрении на делирий, чтобы исключить бессудорожный эпилептический статус. Опять же, важно осознавать факт, подобный клинической оценке; седативные средства также могут мешать интерпретации аномалий сигнала на ЭЭГ.
Аномальные СЭП также могут быть полезным электрофизиологическим индикатором SAE. Преимущество использования SEP заключается в том, что на них не влияет непрерывная седация, но, с другой стороны, оценка SEP может быть слишком громоздкой для рутинного использования в отделении интенсивной терапии [18].Тем не менее, измерения SEP с короткой и длинной латентностью обеспечивают ценную оценку тяжести SE. Заунер и др. зафиксировали SEP у пациентов с сепсисом и обнаружили увеличение латентности пика SEP в подкорковых путях (34% всех случаев) и в корковых путях (84% всех случаев). Это нарушение подкорковых и корковых путей было связано с тяжестью заболевания, хотя результаты существенно не отличались между пациентами с тяжелым сепсисом и пациентами с септическим шоком [18].
Анализ спинномозговой жидкости при СНЯ показывает лишь небольшое повышение концентрации белка у некоторых, но не у всех пациентов, а также нормальные показатели числа клеток и концентрации глюкозы даже у пациентов с микроабсцессами головного мозга при аутопсии [22]. Несмотря на это, важность анализа ЦСЖ нельзя недооценивать, поскольку важно исключить первичную инфекцию ЦНС у пациентов с подозрением на СНЯ.
Наиболее важным применением нейровизуализации является исключение ишемического или геморрагического повреждения головного мозга или других очаговых поражений в случаях с очаговыми неврологическими симптомами.В противном случае нейровизуализация у пациентов с SAE дает переменные результаты. У некоторых пациентов результаты МРТ головного мозга нормальные, несмотря на СНЯ; другие могут показать множество аномалий. Наиболее распространенные острые аномалии, наблюдаемые на МРТ, включают множественные ишемические инсульты или поражения белого вещества, характеризующиеся гиперинтенсивностью на изображениях с инверсионным восстановлением с ослаблением жидкости (FLAIR) в полуовальном центре (в основном на уровне пространств Вирхова-Робена). У отдельных пациентов с СНЯ также могут наблюдаться различные степени вазогенного отека [69].Это может отражать нарушение гематоэнцефалического барьера или может быть связано с потерей церебральной ауторегуляции [88]. Задняя обратимая энцефалопатия (PRE) также может быть связана с сепсисом и инфекцией. В исследовании 106 пациентов с PRE у 23,6% была инфекция или сепсис/септический шок. Клинические симптомы включали измененное психическое состояние, судороги и нарушения зрения. PRE был поздним обнаружением, происходящим до 30 дней после заражения [89]. МР-ангиография в этом исследовании выявила вазоспазм и «усечение» сосудов, возможно, из-за снижения мозгового кровотока.Финелли и др. показали двусторонние аномалии базальных ганглиев, таламуса, мозжечка, ствола мозга и головного мозга в случае SAE [90]. Оценка характера и степени поражения головного мозга также может влиять на прогноз и лечение пациента, поскольку тяжесть этих поражений ЦНС связана с тяжестью сепсиса и обратно коррелирует с баллами по шкале ШКГ [31]. Оптимальные сроки проведения МРТ головного мозга при септическом шоке остаются неизвестными, но ее обязательно следует проводить у пациентов с очаговым неврологическим дефицитом и при изменении психического статуса.Кроме того, изменения при нейровизуализации могут быть обнаружены у лиц, перенесших СНЯ и септический шок в течение длительного времени. Нейровизуализационное исследование у пациентов в критическом состоянии с делирием (не конкретно SAE) показало, что более длительная продолжительность делирия была связана с меньшим объемом мозга через 3 месяца после выписки из больницы, что, в свою очередь, было связано с усилением когнитивных нарушений через 12 месяцев [91].
Значительные изменения также проявляются в мозговом кровообращении при СН, и транскраниальная допплерография (ТКД) использовалась для мониторинга церебральной вазомоторной реактивности при САЭ [92].Могут наблюдаться нарушения сосудистой ауторегуляции, особенно на ранних стадиях СЭ, хотя на ТКД-сонографию нельзя полностью полагаться как на диагностический инструмент, поскольку в некоторых случаях СЭ не было обнаружено различий в церебральной перфузии.
Сывороточные биомаркеры повреждения головного мозга использовались для диагностики и отслеживания течения СНЯ у пациентов с сепсисом. Двумя наиболее многообещающими маркерами, которые использовались при SAE, являются нейрон-специфическая энолаза и белок S-100 β . В частности, более высокие уровни белка S-100 β связаны с более тяжелыми септическими состояниями, а его уровни в сыворотке крови могут предсказывать раннюю смертность в отделении интенсивной терапии.Это определение можно рассматривать как инструмент прикроватного мониторинга неврологических расстройств при СНЯ [93, 94]. Однако опять же, как и при электрофизиологических и нейровизуализационных нарушениях, аномальные уровни этих биомаркеров просто отражают патологические процессы в головном мозге, а не природу патологии [93, 95]. Присутствие S-100 β в сыворотке пациентов отражает повреждение глиальных клеток и аномальную функцию ГЭБ, тогда как присутствие NSE, внутринейронального фермента, отражает повреждение нейронов [86]. Клиническое значение повышенных уровней NSE и S-100 β в сыворотке у пациентов с SAE сомнительно из-за их плохой чувствительности и специфичности.Безусловно, открытие и использование в будущем других маркеров остается задачей, заслуживающей дальнейших исследований.
Подводя итог, СНЯ остается диагнозом исключения. У пациентов с симптомами, указывающими на SAE, следует провести тщательное обследование на предмет других излечимых этиологий энцефалопатии, таких как системная органная дисфункция, инсульт, внутричерепное кровоизлияние, менингоэнцефалит или другие метаболические нарушения, чтобы не пропустить причину энцефалопатии [86]. .
7. Дифференциальный диагноз
Дифференциальный диагноз энцефалопатии у лихорадящих пациентов является широким и может быть особенно трудным у пациентов в критическом состоянии в условиях отделения интенсивной терапии (рис. 2). Энцефалопатия у пациентов в критическом состоянии может быть вызвана различными инфекционными и неинфекционными причинами, которые могут быть как замаскированы, так и усугублены септическим процессом. У пациентов в критическом состоянии с подозрением на СНЯ необходимо решить все проблемы, включая метаболические параметры, которые могут быть ответственны за изменение чувствительности.В первую очередь необходимо исключить первичную инфекцию ЦНС, тем самым подчеркнув роль визуализации головного мозга и люмбальной пункции у пациентов с подозрением на СНЯ. Инфекционный эндокардит является очень важным дифференциальным диагнозом и всегда должен быть возможен у пациентов с необъяснимыми неврологическими симптомами (очаговые неврологические симптомы или энцефалопатия) и инфекцией кровотока [96]. Следует отметить, что при наличии церебральных микрокровоизлияний на МРТ необходимо исключить эндокардит [97]. Трансторакальное эхо не всегда может быть чувствительным, и может потребоваться чреспищеводное эхо, если индекс подозрения высок.Всегда следует помнить об энцефалопатии Вернике, особенно у пожилых пациентов и пациентов с сопутствующими хроническими инвалидизирующими заболеваниями, особенно при наличии офтальмоплегии или атаксии. Упоминалось значение передозировки и отмены седативных средств. Многочисленные ятрогенные факторы и/или факторы окружающей среды также могут усугубить дисфункцию головного мозга, например, использование физических ограничений, чрезмерный шум или недостаточное освещение в отделении интенсивной терапии.
8. Стратегии лечения
Основой лечения СНЯ является раннее выявление делирия, которое может быть первым проявлением сепсиса, определение основной инфекции и микроорганизма, точное и быстрое лечение инфекции и обеспечение поддерживающей терапии .Внутривенная антибактериальная терапия остается основой фармакологического лечения и должна быть начата сразу после получения соответствующих культур, поскольку раннее начало антибактериальной терапии связано с более низкой смертностью [98]. Выбор антибиотиков снова является спорным и сложным вопросом, и следует учитывать анамнез пациента (например, недавний прием антибиотиков, сопутствующие заболевания, такие как иммуносупрессия, клинический контекст (например, приобретенный в больнице или в больнице)), данные окрашивания по Граму и местные модели резистентности. при выборе соответствующего режима [99–101].Хотя существует несколько руководств по начальному выбору эмпирических антибиотиков при тяжелом сепсисе или септическом шоке, соответствующий эмпирический режим должен включать в себя антибиотики широкого спектра действия, направленные как против грамположительных (ванкомицин), так и против грамотрицательных бактерий (пиперациллин-тазобактам или имипенем). циластатин или цефепим). Однако, если Pseudomonas также является возможным патогеном, к схеме следует добавить дополнительный антипсевдомонадный препарат, такой как фторхинолон, аминогликозид или монобактам.Максимальные рекомендуемые дозы противомикробных препаратов следует вводить внутривенно с поправкой на нарушение функции почек, когда это необходимо. Эмпирическая противогрибковая терапия эхинокандином (для каспофунгина: нагрузочная доза 70 мг, а затем 50 мг ежедневно) или липидной формой амфотерицина В следует добавить, если у пациента гипотензия, он получает антибактериальные препараты широкого спектра действия, нейтропения или имел длительный центральный венозный катетер [102]. Когда результаты посева становятся доступными, схему часто можно упростить, поскольку одного противомикробного препарата обычно достаточно для лечения известного патогена, поскольку несколько клинических испытаний и два метаанализа не смогли продемонстрировать более высокую общую эффективность комбинированной терапии по сравнению с монотерапией. с цефалоспорином третьего поколения или карбапенемом [103–105].Антимикробная терапия должна проводиться как минимум 7–10 дней, хотя более длительные курсы могут быть уместны у пациентов с медленным клиническим ответом, недренируемым очагом инфекции или иммунологической недостаточностью [106].
Лечение энцефалопатии, связанной с сепсисом, в первую очередь симптоматическое. Немедикаментозные подходы к предотвращению делирия имеют первостепенное значение при лечении тяжелого сепсиса и септического шока. Различные стратегии, которые были успешно использованы, включают усиление нормальных циркадных циклов сна; ранняя мобилизация; поощрение пероральных жидкостей для предотвращения обезвоживания; частые подсказки, чтобы подчеркнуть дату, место и причину госпитализации; и внимание к нарушениям зрения и слуха [107].При лечении делирия важно выявить и отменить любые препараты с антихолинергическими, гистаминергическими и другими психотропными свойствами. Также важно определить другие поддающиеся изменению факторы риска, такие как катетеры мочевого пузыря и физические ограничения, и снять их, когда это не требуется с медицинской точки зрения. Если это возможно с медицинской точки зрения, может быть предпочтительнее использовать надувные рукавицы, а не обычные удерживающие устройства, поскольку это может позволить пациентам проводить время вне постели и в вертикальном положении в кресле.Фармакологическое лечение делирия у пациентов с СНЯ требует разумного использования седативных и нейролептиков. Низкие дозы нейролептиков могут быть использованы пациентами для усиления циклов сна ночью, хотя их следует использовать с осторожностью в течение дня, если психомоторное возбуждение не является выраженным и пациент не представляет опасности для себя и персонала. В общем, следует избегать лоразепама, сильнодействующего бензодиазепина. Дексмедетомидин, альфа-2-агонист, по-видимому, лучше, чем лоразепам, у пациентов с сепсисом, поскольку у пациентов, получавших дексмедетомидин, было больше дней без энцефалопатии, более короткое время на ИВЛ и более низкая смертность по сравнению с теми, кто лечился лоразепамом [58].Таким образом, дексмедетомидин, вероятно, предпочтительнее бензодиазепинов, когда седативный эффект необходим для пациентов с SAE. Частота судорог при СНЯ низкая (менее 10%), и их появление должно побудить к исследованию других метаболических или структурных причин [108]. Это означает, что профилактическое применение противоэпилептических препаратов не оправдано.
В этом сценарии также необходимо признать, что текущие медицинские вмешательства, используемые для снижения смертности при сепсисе и остром респираторном дистресс-синдроме, могут быть связаны с неврологической заболеваемостью.Активированный протеин С (дротрекогин альфа) считался многообещающим средством для лечения сепсиса, септического шока и СНЯ [109]. Спапен и др. продемонстрировали, что использование APC у пациентов с SAE было связано со снижением уровня S-100 β в сыворотке, который использовался в качестве суррогатного маркера SAE [110]. Однако результаты первоначального исследования, показавшего положительный эффект АПК при тяжелом сепсисе, не удалось воспроизвести. На самом деле Проспективная всемирная оценка рекомбинантного человеческого активированного протеина С при тяжелом сепсисе и септическом шоке (PROWESS-SHOCK) показала, что APC не значительно снижал смертность через 28 или 90 дней по сравнению с плацебо у пациентов с септическим шоком и базой данных Cochrane. Обзор показал, что использование АПК было связано с повышенным риском кровотечения, включая кровотечение из ЦНС, без какого-либо значительного улучшения смертности [111, 112].Это привело к изъятию препарата Xigris с рынка.
Стероиды могут назначаться пациентам с сепсисом и острым респираторным дистресс-синдромом. Пациентам с вазопрессорозависимым септическим шоком можно назначить заместительную терапию низкими дозами стероидов, если у них подтверждена надпочечниковая недостаточность. Также было показано, что стероиды уменьшают синдром посттравматического стресса [113]. Воздействие стероидов было связано с повышенным риском приобретенной нервно-мышечной слабости, особенно миопатии критических состояний (CIM).Кроме того, введение стероидов само по себе может быть причиной психоза.
В отделении интенсивной терапии обычно применялся строгий контроль уровня глюкозы, поскольку было показано, что поддержание уровня сахара в крови между 81 мг/дл и 144 мг/дл снижает заболеваемость и смертность [114]. Однако жесткий контроль уровня глюкозы у пациентов с сепсисом и в критическом состоянии может быть связан с неврологическими последствиями гипогликемии, такими как судороги и энцефалопатия. Более того, недавние исследования, такие как исследование NICE-SUGAR, однозначно продемонстрировали, что у пациентов, получавших интенсивное лечение (целевой уровень глюкозы в крови от 81 до 108 мг/дл), наблюдалась более высокая частота тяжелой гипогликемии и значительно более высокая 90-дневная смертность по сравнению с обычным контролем уровня глюкозы. целевой уровень глюкозы в крови <180 мг/дл) [115].
Хотя окончательного лечения SAE не существует, ряд вмешательств был опробован или предложен на моделях SAE у людей и животных. Использование анти-C5a-антител уменьшает повреждение гематоэнцефалического барьера в модели CLP у крыс, а блокада C5a или C5aR, по-видимому, снижает смертность в экспериментальных исследованиях [116, 117]. Точно так же было обнаружено, что ингибитор высвобождения глутамата рилузол и антиоксидант аскорбат полезны на животных моделях SAE [118, 119]. Роль аминокислот с разветвленной цепью оценивала Фрейнд, который получил положительные результаты у пациентов с септической энцефалопатией, получавших раствор, обогащенный аминокислотами с разветвленной цепью.У септических больных, получавших раствор, содержащий 35% аминокислот с разветвленной цепью, наблюдалась нормализация аминокислотного состава плазмы и регресс энцефалопатических признаков [120]. Таким образом, по-прежнему существует потребность в потенциальных будущих методах лечения, направленных на сдерживание аномалий ЦНС, таких как микроциркуляторные изменения, измененная проницаемость ГЭБ и аномальная нейротрансмиссия.
9. Прогноз и долгосрочные когнитивные эффекты СНЯ
Наиболее известные и установленные неврологические проявления сепсиса имеют острое начало и считаются в значительной степени обратимыми при адекватном лечении.Однако все больше данных как в моделях на животных, так и в исследованиях на людях свидетельствуют о том, что серьезные долгосрочные когнитивные последствия связаны с SAE. Эти долгосрочные когнитивные изменения разнообразны, но в основном включают психомоторную активность, дефицит зрительной и функциональной памяти, беглость речи и визуальное построение [121]. Ивашина и др. изучали когнитивные нарушения у пожилых пациентов с тяжелым сепсисом (1194 пациента, средний возраст выживших 76,9 лет) и обнаружили, что распространенность умеренных и тяжелых когнитивных нарушений увеличивается в 10 раз.6 процентных пунктов среди пациентов, переживших тяжелый сепсис [7]. Вероятность развития умеренных/тяжелых когнитивных нарушений была в 3,3 раза выше после эпизода сепсиса. Более того, у многих пациентов, перенесших сепсис, наблюдаются признаки депрессии и тревожные расстройства, что еще больше ухудшает качество жизни [122]. Продолжительность делирия у пациентов на искусственной вентиляции легких является независимым предиктором когнитивных нарушений (по данным нейропсихологического тестирования) как через 3, так и через 12 месяцев после выписки из стационара [123].Semmler и его коллеги использовали комплексную батарею нейропсихологических тестов для выявления специфических когнитивных нарушений у более молодой когорты пациентов (средний возраст: 55,4 года), переживших сепсис. Они обнаружили диффузный когнитивный дефицит в областях рабочей памяти, внимания, переключения задач, вербального обучения, а также памяти и фонетической беглости речи. Дефицит большинства доменов составлял -1 · 5 SD, что согласуется с легкими когнитивными нарушениями [124]. Когортное магнитно-резонансное исследование VISIONS показало, что более длительная продолжительность делирия у пациентов с сепсисом была связана с меньшими объемами мозга до 3 месяцев после выписки, а меньшие объемы мозга, в свою очередь, были связаны с долгосрочными когнитивными нарушениями до 12 месяцев [91]. .Это долгосрочное влияние СНЯ на когнитивные функции может быть причиной ускорения снижения когнитивных функций у пациентов с ранее существовавшей деменцией и приобретенной деменцией у молодых людей без каких-либо ранее существовавших когнитивных заболеваний. Долгосрочные когнитивные нарушения ложатся тяжелым бременем на членов семьи и лиц, осуществляющих уход, поскольку инвалидность может сохраняться в течение нескольких лет после постановки диагноза SAE.
10. Заключение
В заключение следует отметить, что сепсис остается частой причиной заболеваемости и смертности.Зарегистрированная заболеваемость SAE широко варьируется в зависимости от изучаемой популяции и определения, используемого для диагностики энцефалопатии. Тем не менее широко распространено мнение, что SAE является наиболее распространенным типом энцефалопатии, наблюдаемым в медицинских отделениях интенсивной терапии. SAE включает широкий спектр неврологических проявлений, начиная от невнимательности, дезориентации и возбуждения до бреда, ступора и комы. Несмотря на недавние достижения в понимании патофизиологии СНЯ, он остается диагнозом исключения из-за отсутствия каких-либо окончательных тестов или биомаркеров.Врачи должны иметь высокий индекс подозрения для диагностики SAE, поскольку SAE может проявляться на любой стадии сепсиса, а использование седативных средств в этой популяции может спутать клинические данные. Электрофизиологически ЭЭГ и СЭП добавляют важную информацию и коррелируют с тяжестью СЭ, но ни в коем случае не являются специфическими, и результаты всегда следует интерпретировать в клиническом контексте. Нейровизуализация играет ключевую роль в оценке СНЯ, поскольку она не только позволяет исключить очаговые сосудистые и инфекционные расстройства, но также может выявить лежащую в основе лейкоэнцефалопатию, тяжесть которой имеет прогностическое значение.SAE не следует рассматривать как острое обратимое состояние, и у выживших SAE могут быть долгосрочные когнитивные, а также рентгенологические нарушения. Неврологический исход зависит от тяжести сепсиса: в легких случаях вероятно полное выздоровление, в то время как у выживших после тяжелого сепсиса могут наблюдаться долгосрочные дефициты.


 Признаки ДЭ нарастают постепенно (выделяют 3 степени энцефалопатии), состояние человека ухудшается и может привести к слабоумию.
Признаки ДЭ нарастают постепенно (выделяют 3 степени энцефалопатии), состояние человека ухудшается и может привести к слабоумию. Сирингомиелия
Сирингомиелия Печеночная энцефалопатия может быть вызвана хроническим заболеванием печени, таким как цирроз, инфекция, передозировка отпускаемых по рецепту лекарств или кровотечение в пищеварительном тракте.
Печеночная энцефалопатия может быть вызвана хроническим заболеванием печени, таким как цирроз, инфекция, передозировка отпускаемых по рецепту лекарств или кровотечение в пищеварительном тракте.