Томские ученые создают новые соединения лития для лечения психических заболеваний
Антиманиакальное действие солей лития было обнаружено еще в 1949 году. На основе этих соединений был разработан первый препарат из класса нормотимиков (стабилизаторов настроения), эффективных не только при мании, но и при депрессии. При назначении препаратов лития необходимо постоянно контролировать его содержание в крови пациента и учитывать возможность возникновения вредных побочных эффектов, однако положительные изменения при такой терапии превосходят недостатки. Поэтому, например, больные биполярным расстройством, как правило, принимают препараты лития всю жизнь.
«Чаще всего в психофармакологии используется карбонат лития, где карбонат-анион служит только для доставки основного вещества (ионов лития). Мы решили заменить этот нейтральный компонент на анионы органических кислот, участвующих в метаболических процессах клетки, чтобы это был не просто балласт, а полезный элемент», — объясняет научный сотрудник НИИ ПЗ Иннокентий Лосенков.
По просьбе ученых химики Томского политехнического университета синтезировали для экспериментов следующие соли лития: пируват (соль пировиноградной кислоты ), сукцинат (соль янтарной кислоты) и фумарат (соль фумаровой кислоты). Это биологически активные соединения, являющиеся важными компонентами, так называемого, цикла Кребса (цикл трикарбоновых кислот, цикл лимонной кислоты) – цикла биохимических реакций превращения органических кислот в клетке, являющегося важным элементом клеточной биоэнергетики.
В настоящее время показано, что как при депрессии, так и при биполярном расстройстве, патологий, в лечении которых используется литий, в частности его карбонатная соль, наблюдается активация процессов окислительного стресса. Одной из возможных причин этого могут являться нарушения в цикле Кребса. По нашей гипотезе, проблему окислительного стресса помогла бы решить нормализация концентрации одной из органических кислот-участников этого цикла.
«Сначала мы запускали в клетках мощный процесс окисления, а затем добавляли разные соли лития. Карбонат, сукцинат и фумарат не дали никакого эффекта, зато пируват уменьшал гибель клеток в два-три раза и снижал содержание клеток с активными формами кислорода, т.е., ингибировал окислительный стресс — рассказывает Иннокентий Лосенков. — Мы предполагаем, что при окислительном стрессе снижается концентрация пирувата, что еще больше усиливает окисление. Если клетке дать запас пирувата, то стресс будет стабилизирован, как следствие — выживет больше клеток».
На первом этапе ученые брали для исследований клетки крови (лейкоциты) здоровых людей, а также больных алкоголизмом, которому часто сопутствуют депрессия и другие заболевания. Дальше они будут смотреть клетки пациентов с депрессией и биполярным расстройством, и оценивать воздействие на них не только анионов, но и самого лития.
«Мы хотим посмотреть, как наши соли будут работать в культуре клеток нейронального происхождения, — уточняет Иннокентий Лосенков.
— Лейкоциты являются лишь моделью нейрона, имеющей свои недостатки. Однако позволяющей исследовать живые клетки пациента. Особенно ввиду того, что получить живые нервные клетки головного мозга для фундаментальных исследований практически невозможно».
В 2017 году исследование ученых НИИ ПЗ поддержано грантом Российского научного фонда.
СОЛИ ЛИТИЯ В ЭКСПЕРИМЕНТАЛЬНОЙ ОНКОЛОГИИ (ОБЗОР ЛИТЕРАТУРЫ) | Таскаева
1. Бгатова Н.П., Гаврилова Ю.С., Лыков А.П., Соловьева А.О., Макарова В.В., Бородин Ю.И., Коненков В.И. Апоптоз и аутофагия в клетках гепатокарциномы, индуцированные различными формами солей лития. Цитология. 2017; 59 (3): 178–184.2. Таскаева Ю.С., Бгатова Н.П. Ультраструктурные изменения в клетках гепатоцеллюлярной карциномы-29 при введении карбоната лития в эксперименте. Бюл. эксперим. биологии. 2019; 167 (1): 94–98. doi: 10.1007/s10517-019-04467-3.
Бюл. эксперим. биологии. 2019; 167 (1): 94–98. doi: 10.1007/s10517-019-04467-3.
3. Altamura A.C., Gomeni R., Sacchetti E., Smeraldi E. Plasma and intracellular kinetics of lithium after oral administration of various lithium salts. Eur. J. Clin. Pharmacol. 1977; 12 (1): 59–63.
4. Berridge M.J., Downes C.P., Hanley M.R. Lithium amplifies agonist-dependent phosphatidylinositol responses in brain and salivary glands. Biochem. J. 1982; 206 (3): 587–595. doi: 10.1042/bj2060587.
5. Beurel E., Blivet-Van Eggelpoël M.J., Kornprobst M., Moritz S., Delelo R., Paye F., Housset C., Desbois-Mouthon C. Glycogen synthase kinase-3 inhibitors augment TRAIL-induced apoptotic death in human hepatoma cells. Biochem. Pharmacol. 2009; 77 (1): 54–65. doi: 10.1016/j.bcp.2008. 09.026.
09.026.
6. Bijur G.N., Jope R.S. Glycogen synthase kinase-3 beta is highly activated in nuclei and mitochondria. Neuroreport. 2003; 14 (18): 2415–2419. doi 10.1097/00001756-200312190-00025.
7. Can A., Schulze T.G., Gould T.D. Molecular actions and clinical pharmacogenetics of lithium therapy. Pharmacol. Biochem. Behav. 2014; 123. 3–16. doi: 10.1016/j.pbb.2014.02.004.
8. Cockle J.V., Picton S., Levesley J., Ilett E., Carcaboso A.M., Short S., Steel LP., Melcher A., Lawler S.E., Brüning-Richardson A. Cell migration in paediatric glioma; characterisation and potential therapeutic targeting. Br. J. Cancer. 2015; 112 (4): 693–703. doi: 10.1038/bjc.2015.16.
9. Cohen Y., Chetrit A. , Cohen Y., Sirota P., Modan B. Сancer morbidity in psychiatric patients: influence of lithium carbonate treatment. Med. Oncol. 1998. 1. 32–36.
, Cohen Y., Sirota P., Modan B. Сancer morbidity in psychiatric patients: influence of lithium carbonate treatment. Med. Oncol. 1998. 1. 32–36.
10. Costabile V., Duraturo F., Delrio P., Rega D., Pace U., Liccardo R., Rossi G.B., Genesio R., Nitsch L., Izzo P., de Rosa M. Lithium chloride induces mesenchymal-to-epithelial reverting transition in primary colon cancer cell cultures. Int. J. Oncol. 2015;
11. (5): 1913–1923. doi: 10.3892/ijo.2015.2911.
12. De Araujo W.M., Robbs B.K., Bastos L.G., de Souza W.F., Vidal F.C., Viola J.P., Morgado-Diaz J.A. PTEN overexpression cooperates with lithium to reduce the malignancy and to increase cell death by apoptosis via PI3K/AKT suppression in colorectal cancer cells. J. Cell Biochem. 2016; 117 (2): 458–469. doi: 10. 1002/jcb.25294.
1002/jcb.25294.
14. Freland L., Beaulieu J.M. Inhibition of GSK3 by lithium, from single molecules to signaling networks. Front. Mol. Neurosci. 2012; 5: 14. doi: 10.3389/fnmol.2012.00014.
15. Fu Y., Jiao Y., Zheng S., Liang A., Hu F. Combination of lithium chloride and pEGFP-N1-BmK CT effectively decreases proliferation and migration of C6 glioma cells. Cytotechnology. 2016; 68 (2): 197–202. doi: 10.1007/s10616-014-9768-2.
16. Furuta T.
17. Gao S., Li S., Duan X., Gu Z., Ma Z., Yuan X., Feng X., Wang H. Inhibition of glycogen synthase kinase 3 beta (GSK3β) suppresses the progression of esophageal squamous cell carcinoma by modifying STAT3 activity. Mol. Carcinog. 2017; 56 (10): 2301–2316. doi: 10.1002/mc.22685.
18. Hallcher L.M., Sherman W.R. The effects of lithium ion and other agents on the activity of myoinositol-1-phosphatase from bovine brain. J. Biol. Chem. 1980; 255 (22): 10896–10901.
19. Han S., Meng L., Jiang Y., Cheng W., Tie X., Xia J., Wu A. Lithium enhances the antitumour effect of temozolomide against TP53 wild-type glioblastoma cells via NFAT1/FasL signalling. Br. J. Cancer. 2017; 116 (10): 1302–1311. doi: 10.1038/bjc.2017.89.
Han S., Meng L., Jiang Y., Cheng W., Tie X., Xia J., Wu A. Lithium enhances the antitumour effect of temozolomide against TP53 wild-type glioblastoma cells via NFAT1/FasL signalling. Br. J. Cancer. 2017; 116 (10): 1302–1311. doi: 10.1038/bjc.2017.89.
20. Huang R.Y., Hsieh K.P., Huang W.W., Yang Y.H. Use of lithium and cancer risk in patients with bipolar disorder: population-based cohort study. Br. J. Psychiatry. 2016; 209 (5): 393–399. doi: 10.1192/bjp.bp.116.181362.
21. Jakobsson E., Argüello-Miranda O., Chiu S.W., Fazal Z., Kruczek J., Nunez-Corrales S., Pandit S., Pritchet L. Towards a unified understanding of lithium action in basic biology and its significance for applied biology. J. Membr. Biol. 2017; 250 (6): 587–604. doi: 10.1007/s00232-017-9998-2.
22. Li H., Huang K., Liu X., Liu J., Lu X., Tao K., Wang G., Wang J. Lithium chloride suppresses colorectal cancer cell survival and proliferation through ROS/GSK-3β/NF-κB signaling pathway. Oxid. Med. Cell Longev. 2014; 2014: 241864. doi: 10.1155/2014/241864.
Li H., Huang K., Liu X., Liu J., Lu X., Tao K., Wang G., Wang J. Lithium chloride suppresses colorectal cancer cell survival and proliferation through ROS/GSK-3β/NF-κB signaling pathway. Oxid. Med. Cell Longev. 2014; 2014: 241864. doi: 10.1155/2014/241864.
23. Li L., Song H., Zhong L., Yang R., Yang X.Q., Jiang K.L., Liu B.Z. Lithium chloride promotes apoptosis in human leukemia NB4 cells by inhibiting glycogen synthase kinase-3 beta. Int. J. Med. Sci. 2015; 12 (10): 805–810. doi: 10.7150/ijms.12429.
24. Maeng Y.S., Lee R., Lee B., Choi S.I., Kim E.K. Lithium inhibits tumor lymphangiogenesis and metastasis through the inhibition of TGFBIp expression in cancer cells. Sci. Rep. 2016; 6: 20739. doi: 10.1038/srep20739.
25. Malhi G.S., Tanious M., Das P., Berk M. The science and practice of lithium therapy. Aust. N. Z. J. Psychiatry. 2012; 46 (3): 192–211. doi: 10.1177/0004867412437346.
The science and practice of lithium therapy. Aust. N. Z. J. Psychiatry. 2012; 46 (3): 192–211. doi: 10.1177/0004867412437346.
26. Mancinelli R., Carpino G., Petrungaro S., Mammola C.L., Tomaipitinca L., Filippini A., Facchiano A., Ziparo E., Giampietri C. Multifaceted roles of GSK-3 in cancer and autophagy-related diseases. Oxid. Med. Cell Longev. 2017; 2017: 4629495. doi: 10.1155/2017/4629495.
27. Martinsson L., Westman J., Hällgren J., Ösby U., Backlund L. Lithium treatment and cancer incidence in bipolar disorder. Bipolar Disord. 2016; 18 (1): 33–40. doi: 10.1111/bdi.12361.
28. McCubrey J.A., Steelman L.S., Bertrand F.E., Davis N.M., Sokolosky M., Abrams S.L., Montalto G., D’Assoro A.B., Libra M., Nicoletti F., Maestro R., Basecke J., Rakus D., Gizak A. , Demidenko Z.N., Cocco L., Martelli A.M., Cervello M. GSK-3 as potential target for therapeutic intervention in cancer. Oncotarget. 2014; 5 (10): 2881–2911. doi: 10.18632/oncotarget.2037.
, Demidenko Z.N., Cocco L., Martelli A.M., Cervello M. GSK-3 as potential target for therapeutic intervention in cancer. Oncotarget. 2014; 5 (10): 2881–2911. doi: 10.18632/oncotarget.2037.
29. Mota de Freitas D., Leverson B.D., Goossens J.L. Lithium in medicine: mechanisms of action. Met. Ions Life Sci. 2016; 16: 557–584. doi: 10.1007/978-3-319-21756-7_15.
30. O’Donovan T.R., Rajendran S., O’Reilly S., O’Sullivan G.C., McKenna S.L. Lithium modulates autophagy in esophageal and colorectal cancer cells and enhances the efficacy of therapeutic agents in vitro and in vivo. PLoS One. 2015; 10 (8): e0134676. doi: 10.1371/journal.pone.0134676.
31. Oruch R., Elderbi M.A., Khattab H.A., Pryme I.F., Lund A. Lithium: a review of pharmacology, clinical uses, and toxicity. Eur. J. Pharmacol. 2014; 740: 464–473. doi: 10.1016/j.ejphar.2014.06.042.
Eur. J. Pharmacol. 2014; 740: 464–473. doi: 10.1016/j.ejphar.2014.06.042.
32. Pasquali L., Busceti C.L., Fulceri F., Paparelli A., Fornai F. Intracellular pathways underlying the effects of lithium. Behav. Pharmacol. 2010; 21 (5-6): 473–492. doi: 10.1097/FBP.0b013e32833da5da.
33. Peixoto-da-Silva J., Calgarotto A.K., Rocha K.R., Palmeira-Dos-Santos C., Smaili S.S., Pereira G.J.S., Pericole F.V., da Silva S. Duarte A., Saad S.T.O., Bincoletto C. Lithium, a classic drug in psychiatry, improves nilotinib-mediated antileukemic effects. Biomed. Pharmacother. 2018; 99: 237–244. doi: 10.1016/j.biopha.2018.01.027.
34. Phiel C.J., Klein P.S. Molecular targets of lithium action. Annu. Rev. Pharmacol. Toxicol. 2001; 41: 789–813. doi: 10.1146/annurev.pharmtox.41. 1.789.
1.789.
35. Quiroz J.A., Gould T.D., Manji H.K. Molecular effects of lithium. Mol. Interv. 2004; 4 (5): 259–272. doi: 10.1124/mi.4.5.6.
36. Richman L.S., Dzierba A.L., Connolly K.A., Bryan P.M., Chandra S. Artificial lithium toxicity: a case report and review of the literature. J. Pharm. Pract. 2015; 28 (5): 479–481. doi: 10.1177/0897190015587698.
37. Roux M., Dosseto A. From direct to indirect lithium targets: a comprehensive review of omics data. Metallomics. 2017; 9 (10): 1326–1351. doi: 10.1039/c7mt00203c.
38. Sade Y., Toker L., Kara N.Z., Einat H., Rapoport S., Moechars D., Berry G.T., Bersudsky Y., Agam G. IP3 accumulation and/or inositol depletion: two downstream lithium’s effects that may mediate its behavioral and cellular changes. Transl. Psychiatry. 2016; 6 (12): e968. doi: 10.1038/tp.2016.217.
Transl. Psychiatry. 2016; 6 (12): e968. doi: 10.1038/tp.2016.217.
39. Sarkar S., Floto R.A., Berger Z., Imarisio S., Cordenier A., Pasco M., Cook L.J., Rubinsztein D.C. Lithium induces autophagy by inhibiting inositol monophosphatase. J. Cell Biol. 2005; 170 (7): 1101–1111. doi: 10.1083/jcb.200504035.
40. Schleicher S.B., Zaborski J.J., Riester R., Zenkner N., Handgretinger R., Kluba T., Traub F., Boehme K.A. Combined application of arsenic trioxide and lithium chloride augments viability reduction and apoptosis induction in human rhabdomyosarcoma cell lines. PLoS One. 2017; 12 (6): e0178857. doi: 10.1371/journal.pone.0178857.
41. Taskaeva Iu., Bgatova N. Ultrastructural and immunofluorescent analysis of lithium effects on autophagy in hepatocellular carcinoma cells. Asian Pac. J. Cancer Biol. 2018; 3 (3): 83–87. doi: 10.22034/APJCB.2018.3.3.83.
Asian Pac. J. Cancer Biol. 2018; 3 (3): 83–87. doi: 10.22034/APJCB.2018.3.3.83.
42. Toker L., Agam G. Lithium, inositol and mitochondria. ACS Chem. Neurosci. 2014; 5 (6): 411–412. doi: 10.1021/cn5001149.
43. Trnski D., Sabol M., Gojević A., Martinić M., Ozretić P., Musani V., Ramić S., Levanat S. GSK3β and Gli3 play a role in activation of Hedgehog-Gli pathway in human colon cancer – Targeting GSK3β downregulates the signaling pathway and reduces cell proliferation. Biochim. Biophys. Acta. 2015; 1852 (12): 2574–2584. doi: 10.1016/j.bbadis.2015.09.005.
44. Tsui M.M., Tai W.C., Wong W.Y., Hsiao W.L. Selective G2/M arrest in a p53 (Val135)-transformed cell line induced by lithium is mediated through an intricate network of MAPK and β-catenin signaling pathways. Life Sci. 2012; 91 (9-10): 312–321. doi: 10.1016/j.lfs.2012.07.027.
Life Sci. 2012; 91 (9-10): 312–321. doi: 10.1016/j.lfs.2012.07.027.
45. Vicencio J.M., Ortiz C., Criollo A., Jones A.W., Kepp O., Galluzzi L., Joza N., Vitale I., Morselli E., Tailler M., Castedo M., Maiuri M.C., Molgó J., Szabadkai G., Lavandero S., Kroemer G. The inositol 1,4,5-trisphosphate receptor regulates autophagy through its interaction with Beclin 1. Cell Death Differ. 2009; 16 (7): 1006–1017. doi: 10.1038/cdd.2009.34.
46. Vosahlikova M., Svoboda P. Lithium – therapeutic tool endowed with multiple beneficiary effects caused by multiple mechanisms. Acta Neurobiol. Exp. (Wars.): 2016; 76 (1): 1–19.
47. Wang X., Fang Z., Wang A., Luo C., Cheng X., Lu M. Lithium suppresses Hedgehog signaling via promoting ITCH E3 ligase activity and Gli1-SUFU interaction in PDA cells. Front. Pharmacol. 2017; 8: 820. doi: 10.3389/fphar.2017.00820.
Front. Pharmacol. 2017; 8: 820. doi: 10.3389/fphar.2017.00820.
48. Wang X., Luo C., Cheng X., Lu M. Lithium and an EPAC-specific inhibitor ESI-09 synergistically suppress pancreatic cancer cell proliferation and survival. Acta Biochim. Biophys. Sin. (Shanghai): 2017; 49 (7): 573–580. doi: 10.1093/abbs/gmx045.
49. Wang Y., Zhang Q., Wang B., Li P., Liu P. LiCl treatment induces programmed cell death of schwannoma cells through AKT- and MTOR-mediated necroptosis. Neurochem. Res. 2017; 42 (8): 2363–2371. doi: 10.1007/s11064-017-2256-2.
50. Zassadowski F., Pokorna K., Ferre N., Guidez F., Llopis L., Chourbagi O., Chopin M., Poupon J., Fenaux P., Ann Padua R., Pla M., Chomienne C., Cassinat B. Lithium chloride antileukemic activity in is GSK-3 and MEK/ERK dependent. Leukemia. 2015; 29 (12): 2277–2284. doi: 10.1038/leu.2015.159.
Leukemia. 2015; 29 (12): 2277–2284. doi: 10.1038/leu.2015.159.
51. Zinke J., Schneider F.T., Harter P.N., Thom S., Ziegler N., Toftgård R., Plate K.H., Liebner S. β-Catenin-Gli1 interaction regulates proliferation and tumor growth in medulloblastoma. Mol. Cancer. 2015; 14: 17. doi: 10.1186/s12943-015-0294-4.
Россия перейдет на собственный литий | Достижения науки НИТУ «МИСиС»
В России начата добыча лития и его соединений по разработанной дешевой технологии
В России начала работу первая в мире экспериментальная установка, сделавшая добычу соединений лития из бедной руды вдвое дешевле, чем до сих пор добывали из богатой. Установка разработана учеными НИТУ «МИСиС». Внедряемая технология может обеспечить все потребности страны в литии за счет собственных запасов и избавиться от некачественного китайского и дорогого африканского сырья.
Сфера применения лития и соединений на его основе довольно широка: в химических источниках тока и батареях на их основе, как теплоноситель в небольших ядерных реакторах (на кораблях и подлодках), как источник нейтронов в реакциях термоядерного синтеза, а также в керамике, оптике, смазках, полимерах, фармацевтике, кондиционерах, алюминиевых сплавах, используется для литья сверхлегких изделий.
Проблема в том, что в России нет руд, богатых литием, хотя сам этот металл не относится к редкоземельным, просто он слишком рассредоточен в породе. Более 70% пригодного для промышленной добычи лития находится в Чили, Боливии и Аргентине в виде солончаковых отложений, из которых состоят пустыни Атакама, Юни и Омбре Муэрто. Есть запасы в Неваде (США), Тибете, Бразилии, Конго, Китае, но существенно на рынок они не влияют. В России же самое большое содержания лития в слюде, сопровождающей месторождения редкоземельных металлов. И хотя теоретически механизмы самого эффективного способа извлечения лития из отечественных руд описал ещё ученик Курчатова профессор НИТУ «МИСиС» Владимир Кулифеев в шестидесятых годах прошлого века, ни технологии, ни материалы, из которых делали перерабатывающее оборудование, не позволяли реализовать этот процесс на экономически выгодном уровне. Поэтому сейчас приходится закупать готовые соединения лития, либо ввозить литийсодержащий концентрат из Конго и Китая. При этом качество приобретаемого сырья низкое, а транспортировка на длительные расстояния влечет за собой дополнительные расходы.
Поэтому сейчас приходится закупать готовые соединения лития, либо ввозить литийсодержащий концентрат из Конго и Китая. При этом качество приобретаемого сырья низкое, а транспортировка на длительные расстояния влечет за собой дополнительные расходы.
Доцент кафедры цветных металлов и золота НИТУ «МИСиС» к.т.н. Ольга Криволапова применила теоретические наработки профессора Кулифеева к литийсодержащим отходам флюоритных месторождений (таких как принадлежащие входящей в ОК РУСАЛ Ярославской горнорудной компании крупнейшие в мире Вознесенское и Приграничное) и отработанным литий-ионным источникам тока. Возглавляемая ею команда ученых из НИТУ «МИСиС» проработала технологию кислотной переработки литийсодержащих веществ, которая оказалась вдвое дешевле существующих аналогов. Установка расположена на экспериментальном полигоне Ярославской горнорудной компании. Планируется, что промышленный процесс производства лития батарейного качества (марки ЛЭ1) запустят на отвалах месторождений Уссурийского края, где за 20 лет предложенным способом можно добыть более 40 тысяч тонн карбоната лития, а также на Завитинском месторождении (Читинская область).
Немалую роль в том, что технология имеет шансы на успех, сыграло то, что установка работает на отечественном сырье: «Мы работаем над созданием нового производства, которое даст возможность полностью отказаться от импортного сырья, — подчеркнула руководитель проекта Ольга Криволапова. — Новая технология позволит осуществлять параллельно процессы извлечения и переработки лития и получать не только чистый литий, но и ценные продукты — соли лития, в зависимости от потребностей отечественной промышленности. Мы разрабатываем технические решения для переработки отечественного сырья, для этого мы спроектировали и создали уникальную пилотную опытно-промышленную установку. В настоящее время мы проводим лабораторные исследования влияния технологических факторов на получение металлического лития батарейного качества».
По оценкам специалистов компании РУСАЛ, уже на данном этапе можно говорить о возможности занять примерно 1% мирового рынка лития и обеспечить потребности отечественных предприятий в продукте более качественном, чем из Конго, и в полтора-два раза более дешевом, чем из Китая.
«Работа научной группы под руководством к.т.н., доцента Ольги Криволаповой демонстрирует, что не только фундаментальные, но и прикладные разработки могут найти свое применение спустя десятилетия, — говорит ректор НИТУ „МИСиС“ Алевтина Черникова. — Перспективная технология добычи соединений лития, созданная молодыми учеными университета, стала синтезом научно-исследовательской работы середины ХХ века, проведенной профессором НИТУ „МИСиС“ Владимиром Кулифеевым, разработок научного коллектива в области утилизации литий-ионных аккумуляторов, а также мировых достижений в области сопротивления материалов».
Работа над технологией проводится по заказу ряда крупнейших российских предприятий, таких как ГК РОСАТОМ, ОК РУСАЛ, Топливная компания «ТВЭЛ», ОАО «Аккумуляторная компания «Ригель», АО АРМЗ, Приаргунский горно-химический комбинат и другие.
Внедрение технологии на предприятиях планируется в 2020 — 2025 гг.
Германия собирается начать добычу лития на своей территории
Как известно, Германия рассчитывает стать первой крупнейшей экономикой, которая в энергетике откажется от атома и угля. Для этого, в частности, придётся предусмотреть системы накопления энергии, получаемой из возобновляемых источников, например, использовать литиево-ионные батареи. Одна беда, литий для батарей Германия в полном объёме закупает у иностранных компаний, а своя добыча отсутствует. Или это поправимо?
Для этого, в частности, придётся предусмотреть системы накопления энергии, получаемой из возобновляемых источников, например, использовать литиево-ионные батареи. Одна беда, литий для батарей Германия в полном объёме закупает у иностранных компаний, а своя добыча отсутствует. Или это поправимо?
Как сообщает пресс-релиз Технологического института Карлсруэ (KIT), двое учёных-геологов из Института прикладных наук о Земле (AGW) из KIT подали заявку на патент на экологически чистую добычу лития в Германии с минимальным воздействием на среду. Добывать литий в виде солей карбоната лития или гидроксида лития предложено из вод геотермальных источников в районе Верхнего Рейна. Для этого даже не придётся бурить новые скважины. Всё уже пробурено и работает в виде геотермальных станций в этом регионе.
Заводы по добыче лития из подземных резервуаров можно строить на базе действующих геотермальных установок. Прокачиваемая из недр вода содержит растворённый литий в объёме до 200 мг/л. Специальная установка в составе термальной станции будет улавливать ионы лития в процессе штатной перекачки термальной воды и концентрировать их до тех пор, пока литий не будет осаждён в виде соли.
Предложенное решение выгодно отличается от добычи лития в солёных озёрах Чили и Аргентины или на отвалах руды в Австралии, которые удерживают до 80 % мирового рынка лития. Немецкий способ не зависит от погоды (дожди/испарения) и не приводит к образованию отвалов отработанной породы. Всё чистенько и экологично. Каждый такой завод при термальной станции может за год добывать несколько сотен тонн гидроксида лития, а в целом добыча по всем термальным станциям района Верхнего Рейна (с учётом участия Франции), может приносить ежегодно несколько тысяч тонн лития, что почти полностью обеспечит Германию своим литием.
В настоящий момент учёные института разрабатывают опытную установку по извлечению лития из термальных источников. Затем на одной из станций будут добыты несколько первых килограммов лития, после чего будет приниматься решение о развёртывании полномасштабной добычи.
Если вы заметили ошибку — выделите ее мышью и нажмите CTRL+ENTER.
118 элементов. Глава третья: «каменный» гость
Элемент: литий (Lithium)
Химический символ: Li
Порядковый номер: 3
Год открытия: 1817
Стандартная атомная масса: 6. 938
938
Температура плавления: 453.65 К
Температура кипения: 1603 К
Плотность при стандартных условиях: 0.534 г/cм3
Скорость звука в литии: 6000 м/с
Число стабильных изотопов: 2
Кристаллическая решётка: объемно-центрированная кубическая
Как и в прошлых выпусках, начнем с начала. Если говорить о происхождении атомов лития, то наш герой – самый уникальный элемент. Потому что он образовывался сразу тремя (!) путями.
Во-первых, некоторое количество лития образовалось во время Большого взрыва. Примерно каждый миллиардный атом в молодой Вселенной был атомом 7Li, в 10 000 раз реже встречался 6Li. Во-вторых, атомы лития-7 появляются в молодых и больших звездах. Они – промежуточный продукт протон-протонного цикла, затем при высоких температурах через атом 8Be превращается в два атома гелия. Но если звезда живет недолго и гибнет – литий попадает в межзвездное пространство.
Есть и «в-третьих». Совершенно уникальный способ, которым образуется только три элемента – скалывание в космических лучах: частицы космических лучей «скалывают» кусочки от более тяжелых ядер.
Жозе Бонифасиу де Андрада и Силва
Человечество познакомилось с литием в 1800 году. Минерал петалит LiAlSi4O10 открыл бразильский ученый Жозе Бонифасиу де Андрада и Силва, который изучал геогнозию (как тогда называли геологию) в Португалии и которого занесло на шведский рудник Уто.
Впрочем, бразилец так и не догадался, что в новом минерале находится новый элемент – и пришлось ждать еще17 лет, пока петалит не попал в лабораторию знаменитого Йенса Якоба Берцелиуса, в руки молодого исследователя Иоганна Аугуста Арфведсона. Выполняя стандартную процедуру по установлению химического состава и определив петалит как алюмосиликат, Арфведсон определил, что алюминия, кремния и кислорода в нем 96 процентов по массе.
Петалит
Куда девались еще 4 процента? Оказалось, что в минерале присутствует некий металл, соли которого очень хорошо растворимы – еще лучше, чем соли калия и натрия. Арфведсон логично предположил, что неизвестный металл – «родственник» «потассиума» и «содиума», как иногда переводят названия калия и натрия горе-переводчики. Статью об открытии лития, впрочем, опубликовал сам Берцелиус – как руководитель лаборатории. Он же, поскольку никаких других ассоциаций «этот камень» (в смысле – петалит) не вызывал, предложил назвать литий литием (λίθος – «камень»). Впрочем, слава первооткрывателя нового элемента осталась за Арфведсоном: Берцелиусу хватило церия, селена и тория.
Арфведсон логично предположил, что неизвестный металл – «родственник» «потассиума» и «содиума», как иногда переводят названия калия и натрия горе-переводчики. Статью об открытии лития, впрочем, опубликовал сам Берцелиус – как руководитель лаборатории. Он же, поскольку никаких других ассоциаций «этот камень» (в смысле – петалит) не вызывал, предложил назвать литий литием (λίθος – «камень»). Впрочем, слава первооткрывателя нового элемента осталась за Арфведсоном: Берцелиусу хватило церия, селена и тория.
Иоганн Аугуст Арфведсон
С 1997 года Германское товарищество химиков (Gesellschaft Deutscher Chemiker) вручает иностранным исследователям лития премию Арфведсона-Шленка. Вторую часть названия премия получила в честь основателя литийорганической химии Вильгельма Шленка, который в 1917 году открыл первые литийорганические соединения. Кроме этого и сам Арфведсон дал имя иссиня-черному минералу арфведсониту. Правда, в его составе лития нет.
Что же дальше? Выделить чистый литий не получилось.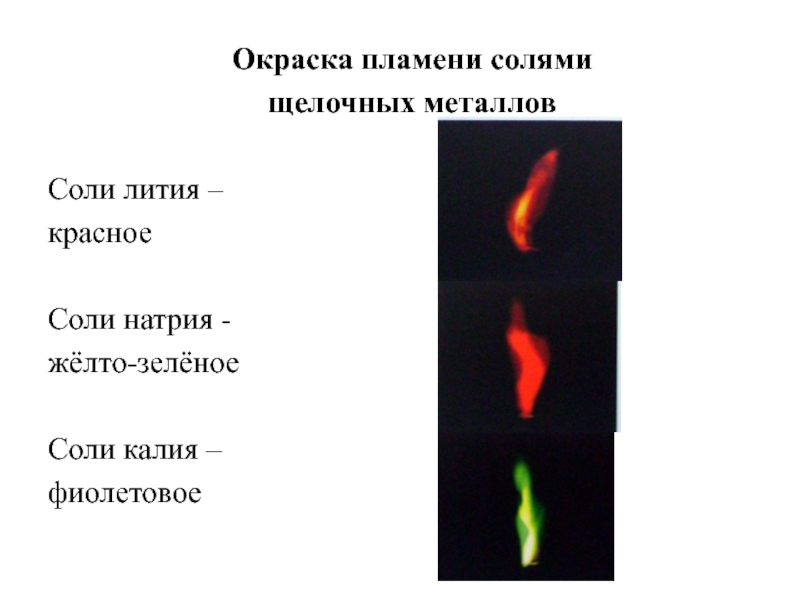 Через год после открытия элемента немецкий химик Кристиан Готлиб Гмелин открыл первую качественную реакцию на литий – он выяснил, что соли лития окрашивают пламя в очень характерный карминово-красный цвет.
Через год после открытия элемента немецкий химик Кристиан Готлиб Гмелин открыл первую качественную реакцию на литий – он выяснил, что соли лития окрашивают пламя в очень характерный карминово-красный цвет.
Окрашивание пламени литием
Чистый металл удалось получить британцу Уильяму Томасу Бранду, который в 1821 году добыл литий электролизом его оксида.
Уильям Томас Бранд
И, надо сказать, металл получился очень необычный. Очень мягкий – литий легко разрезать ножом: чуть тверже натрия, но помягче свинца. Очень легкий – почти в два раза легче воды. Правда в воде он не плавает, а активно с ней взаимодействует, выделяя водород. А вот в бензине – плавает. Очень быстро окисляется.
Поэтому такой металл не очень активно использовался в XIX – начале XX веков.
Металлический литий
Процитируем брошюрку «Применение редких элементов в промышленности». уральского химика Василия Сигизмундовича Сырокомского (автора многих брошюрок и методичек): «Главнейшее применение литий находит в данный момент в медицине, где углекислый и салицилово-кислый литий служат средством для растворения мочевой кислоты, выделяющейся в организме человека при подагре и некоторых других болезнях…». Это – ситуация на 1919 год, ровно через 60 лет первого использования солей лития для лечения подагры (в том числе и некоей «мозговой подагры»).
Это – ситуация на 1919 год, ровно через 60 лет первого использования солей лития для лечения подагры (в том числе и некоей «мозговой подагры»).
Ещё через 30 лет на краю Земли, а именно в Австралии попытка повторить «лечение подагры» привела к прорыву, который заметили не сразу.
Джон Кейд
Психиатр Джон Кейд, работавший в Мельбурне в Bundoora Repatriation Mental Hospital, проверял гипотезу о том, что маниакально-депрессивное психоз (ныне мы его называем БАР – биполярным аффективным расстройством) вызван отравлением каким-то продуктом метаболизма. И экспериментировал с животными. Чтобы вызвать у морских свинок расстройство, он впрыскивал несчастным животным мочу больных. Свинки, естественно, дохли. Кейд решил, что «побочка» от введения мочи в брюшную полость вызвана мочевой кислотой (а мы помним, что отложения кристаллов мочевой кислоты – это подагра). И тут Кейд вспомнил, как лечили подагру почти век назад. Для улучшения растворимости мочевой кислоты в крови, он добавил к моче урат лития. И внезапно, свинки стали спокойнее. Кейд что-то заподозрил. 3 сентября 1949 года в Medical Journal of Australia вышла статья Lithium salts in the treatment of psychotic excitement. Так были открыты нормотимические свойства солей лития. Увы, одно из величайших открытий в фармакологической психиатрии не сразу нашло путь в клиническую практику: в 1949 году FDA на 21 год запретило литиевые препараты из-за того, что погибло четыре пациента, получавших хлорид лития в качестве замены поваренной соли для гипертоников. А кроме того, карбонат лития – самая распространенная форма препаратов лития – не особенно интересовал фармгигантов: его же не запатентуешь, природное вещество…
И внезапно, свинки стали спокойнее. Кейд что-то заподозрил. 3 сентября 1949 года в Medical Journal of Australia вышла статья Lithium salts in the treatment of psychotic excitement. Так были открыты нормотимические свойства солей лития. Увы, одно из величайших открытий в фармакологической психиатрии не сразу нашло путь в клиническую практику: в 1949 году FDA на 21 год запретило литиевые препараты из-за того, что погибло четыре пациента, получавших хлорид лития в качестве замены поваренной соли для гипертоников. А кроме того, карбонат лития – самая распространенная форма препаратов лития – не особенно интересовал фармгигантов: его же не запатентуешь, природное вещество…
Карбонат лития
Препараты лития спасают жизни и поныне. Так, например, 48 рандомизированных клинических исследований показали (на 6674 участниках, на секундочку), что литий достоверно снижает уровень суицидов при любых психических расстройствах.
Но не медициной единой знаменит литий. Звездный час его настал во второй половине XX века. Конечно же, речь идет о литий-ионных аккумуляторах. У них есть преимущества перед никель-кадмиевыми и никель-металлогидридными аккумуляторами, которык не обладают эффектом памяти (падении емкости при нарушении режима зарядки). А еще нет-нет, да взрываются. Кстати, развитие электромобилей может, наверное, сказаться на запасах лития: пока что его добывают около 600 тысяч тонн при разведанных мировых ресурсах в 65 миллионов тонн. Но рост добычи идет очень бурный. А все Маск с его «Теслой»! Больше всего лития добывают в Австралии, Чили и Аргентине, а участок Чили-Боливия-Аргентина получил название «литиевый треугольник».
Звездный час его настал во второй половине XX века. Конечно же, речь идет о литий-ионных аккумуляторах. У них есть преимущества перед никель-кадмиевыми и никель-металлогидридными аккумуляторами, которык не обладают эффектом памяти (падении емкости при нарушении режима зарядки). А еще нет-нет, да взрываются. Кстати, развитие электромобилей может, наверное, сказаться на запасах лития: пока что его добывают около 600 тысяч тонн при разведанных мировых ресурсах в 65 миллионов тонн. Но рост добычи идет очень бурный. А все Маск с его «Теслой»! Больше всего лития добывают в Австралии, Чили и Аргентине, а участок Чили-Боливия-Аргентина получил название «литиевый треугольник».
Мировая добыча лития
Литий-6, как мы уже писали в главе про водород, служит источником трития в термоядерных процессах, поскольку сам тритий хранить особо негде. Именно поэтому дейтерид лития-6 – важнейший элемент водородной бомбы.
Алюмогидрид лития – прекрасная высокоэнергетичная добавка к топливу. А кое-где используется и металлический литий. Так, американская боевая торпеда Маrk 50 использует удивительный способ движения: гексафторид серы распыляется над блоком металлического лития, а выделившаяся в результате реакциии энергия превращает воду в пар, который вращает винт торпеды!
А кое-где используется и металлический литий. Так, американская боевая торпеда Маrk 50 использует удивительный способ движения: гексафторид серы распыляется над блоком металлического лития, а выделившаяся в результате реакциии энергия превращает воду в пар, который вращает винт торпеды!
Пуск торпеды Маrk 50
Литийорганические соединения, начало которым положил век назад Вильгельм Шленк, активно используют в органическом синтезе: они по своим свойствам напоминают реактив Гриньяра, только более активны.
Вильгельм Шленк
Важным соединением лития стал его фторид. Кристаллы его прозрачны не только в оптике, но и в ультрафиолете. Поэтому именно из него делают ультрафиолетовую оптику: лучше материала не найти.
Фторид лития
Как мы уже писали в самом начале, лития в звездах очень мало. Однако астрометрический телескоп Global Astrometric Interferometer for Astrophysics (GAIA) принес загадку – около 20 звезд-гигантов содержали в своем составе аномально большое количество лития. Так появилась «проблема богатых литием гигантов, «Li-rich giant problem»
Так появилась «проблема богатых литием гигантов, «Li-rich giant problem»
Однако в 2016 году в работе международной группы астрономов (arXiv:1603.03038) появилось объяснение. Оказалось, эту проблему можно очень изящно разрешить, предположив, что на поверхность звезд-гигантов падают слишком близкие экзопланеты. Они-то и насыщают на короткое время верхние слои звезды литием. Более того, предполагается, что в экзотических объектах Торна-Житков, красных сверхгигантах, «проглотивших» нейтронную звезду, тоже должен наблюдаться избыток лития. Осталось только наблюдать сам объект Торна-Житков.
Снимок Новой Центавра 2013. Фото Юрия Белецкого
Ну а напоследок расскажем, что совсем недавно, в 2015 году, удалось зафиксировать рождение лития во время гигантского взрыва звезды: спектральные линии лития заметили в Новой Центавра 2013 года. Здесь литий рождается во время термоядерных взрывов сжавшегося водорода, перетекшего на белый карлик со звезды-компаньона. Четвертый способ рождения лития – все-таки, это уникальный элемент!
Четвертый способ рождения лития – все-таки, это уникальный элемент!
Текст: Алексей Паевский
Электрофорез с литием
Соли лития применялись еще в древности для лечения подагры и растворения почечных камней. При проведении электрофореза с литием при заболеваниях суставов было обнаружено усиление выработки коллагена, который идет на постройку хрящевой ткани больного. Он стимулирует регенеративные процессы, тем самым останавливает болезнь.
Лечебное действие
-
усиливает выработку коллагена, который идет на постройку хрящевой ткани,
-
регенеративное действие,
-
стимулирует клеточный иммунитет,
- повышает функцию лимфоцитов,
-
обладает антигистаминным действием.
Показания:
Имплантация золотых нитей в биологически активные точки, столь широко рекламируемая в косметологии и орто-травматологии — это все тот же биоинертный материал. В данном случае вместо лития используется золото. Золото, как и литий усиливает выработку коллагена, который идет на постройку хрящевой ткани.
В данном случае вместо лития используется золото. Золото, как и литий усиливает выработку коллагена, который идет на постройку хрящевой ткани.
Преимущество методики электрофореза литием заключается в отсутствии травматизации кожи, возможности сочетания лекарственного воздействия с другими препаратами. И самое главное — наличие металла в организме в виде пластин, золотых нитей является противопоказанием для всех электропроцедур.
Остеофиты, связанные с костным перерождением связок, являются главной причиной, из-за которой больные обращаются за медицинской помощью. На сегодняшний день многие специалисты с помощью мануальной терапии, массажа, лечебной физкультуры, хирургическим путем пытаются «разбить» эти костные разрастания, или хотя бы уменьшить их прогрессирование. К сожалению, эти воздействия малоэффективны.
В лечебно-восстановительном центре «ОДА» применяется уникальная методика для лечения остеофитов, разработанная в НИИ им. Бурденко, г. Москва. Это сочетанное введение Карипазима (папаина) с хлористым литием. На курс требуется от 20 до 30 процедур электрофореза.
На курс требуется от 20 до 30 процедур электрофореза.
Лития соли — Справочник химика 21
Полимеризация циклических лактамов происходит под действием воды, спиртов, кислот, оснований, а также щелочных катализаторов. В случае применения воды протекает гидролитическая полимеризация. В присутствии щелочных катализаторов (металлический натрий, калий, литий, соли, окислы) протекает анионная полимеризация лактамов [c.80]Образование малорастворимого карбоната лития. Соли лития образуют с карбонатами натрия или калия белый кристаллический осадок карбоната лития Ь12СОз [c.242]
Образование малорастворимого фторида лития. Соли лития образуют с раствором фторида аммония малорастворимый фторид лития LiF (111 = 3,8-К)- ). [c.243]
Отделение калия от лития. Соли лития не мешают обнаружению калия в виде нитрокобальтиата, перхлората, хлороплатината и др Для отделения калия от лития рекомендуется осаждать последний в виде карбоната [2380] или лучше фосфата [1979, 1980, 1986, 2380] Для понижения растворимости осаждают фосфат лития в присутствии этанола [841] [c. 134]
134]
Алюмогидрид лития — соли металлов [c.352]
Предложенный состав электролита с практической точки зрения не был удачным, так как электролизу фактически подвергался бромистый литий — соль достаточно дорогая, но сама идея применения в качестве компонентов электролита соединений только одного лития, по-видимому, в отдельных случаях может быть использована. [c.173]
Хлористый водород связывают при нейтрализации сиропа гидроокисью лития, кальция или аммония. При отфильтровывании выпадающего осадка — хлоридов кальция или аммония — возникают затруднения из-за высокой вязкости прядильных растворов. Поэтому для нейтрализации предпочитают применять гидроокись лития, соли которого хорошо растворяются в органических растворителях. [c.336]
Размеры элементарных ячеек всех галогенидов калия можно использовать для вычисления разностей радиусов ионов галогенов, принимая радиус иона калия постоянным. Аналогичным образом межатомные расстояния ряда хлоридов щелочных металлов позволяют вычислить радиусы катионов щелочных металлов. Последовательные значения разностей радиусов галоген-ионов получаются у всех галогенидов щелочных металлов, за исключением солей лития. Соли лития являют- [c.669]
Последовательные значения разностей радиусов галоген-ионов получаются у всех галогенидов щелочных металлов, за исключением солей лития. Соли лития являют- [c.669]
Что касается электрохимических реакций, то для них требуется присутствие ионов в растворе. Если растворитель обладает достаточными ионизирующими свойствами, в нем растворяют какие-нибудь сильно ионизирующиеся соли (перхлорат лития, хлорид лития, соли аммония или его четырехзамещенных и т. п.) и проводят требуемую реакцию, например [c.625]
Раствор 3 содержит катионы IV и V групп Подкислите уксусной ки слотой, удалите кипяче нием Нз5 и центрифуги руйте. Осадок отбросьте Выпарьте раствор иуда лите соли NH , как ука зано на стр.ЗОЗ. Прибавьте НзО, НН С и (КНОаСОз и центрифугируйте. [c.311]
Литиевые руды. При флотации сподуменовых руд могут быть получены спо-думеновые LiAl [SlgOgl концентраты первого или второго сорта. Концентраты первого сорта должны содержать не менее 4 %, а концентраты второго сорта — не менее 3 % окиси лития. Эти концентраты используют для получения металлического лития, солей лития и для других целей. [c.362]
Концентраты первого сорта должны содержать не менее 4 %, а концентраты второго сорта — не менее 3 % окиси лития. Эти концентраты используют для получения металлического лития, солей лития и для других целей. [c.362]
Литий для лечения биполярного расстройства: побочные эффекты и многое другое
Литий (Eskalith, Lithobid) — одно из наиболее широко используемых и изучаемых препаратов для лечения биполярного расстройства. Литий помогает снизить тяжесть и частоту мании. Это также может помочь облегчить или предотвратить биполярную депрессию.
Исследования показывают, что литий может значительно снизить риск суицида. Литий также помогает предотвратить маниакальные и депрессивные эпизоды в будущем. В результате его можно назначать на длительный период времени (даже между эпизодами) в качестве поддерживающей терапии.
Литий действует на центральную нервную систему человека (головной и спинной мозг). Врачи не знают, как именно литий стабилизирует настроение человека, но считается, что он помогает укрепить связи нервных клеток в областях мозга, которые участвуют в регулировании настроения, мышления и поведения.
Обычно литий начинает работать через несколько недель. Ваш врач назначит периодические анализы крови во время лечения, потому что литий может повлиять на функцию почек или щитовидной железы. Литий работает лучше всего, если количество препарата в организме поддерживается на постоянном уровне.Важно, чтобы уровень лития в вашем организме не был слишком низким или слишком высоким. Ваш врач также, вероятно, посоветует вам выпивать от восьми до 12 стаканов воды или жидкости в день во время лечения и использовать обычное количество соли в еде. Как соль, так и жидкость могут повлиять на уровень лития в крови, поэтому важно потреблять постоянное количество каждый день.
Доза лития варьируется от человека к человеку и по мере изменения фазы его болезни. Хотя биполярное расстройство часто лечат более чем одним лекарством, некоторые люди могут контролировать свое состояние с помощью одного лития.
Побочные эффекты лития
Около 75% людей, принимающих литий при биполярном расстройстве, имеют некоторые побочные эффекты, хотя они могут быть незначительными. Они могут стать менее неприятными через несколько недель, когда ваш организм привыкнет к препарату. Иногда побочные эффекты лития можно уменьшить, изменив дозу. Однако никогда не меняйте дозу или график приема лекарств самостоятельно. Не меняйте марку лития, предварительно не посоветовавшись с врачом или фармацевтом. Если у вас возникли проблемы, поговорите со своим врачом о возможных вариантах.
Они могут стать менее неприятными через несколько недель, когда ваш организм привыкнет к препарату. Иногда побочные эффекты лития можно уменьшить, изменив дозу. Однако никогда не меняйте дозу или график приема лекарств самостоятельно. Не меняйте марку лития, предварительно не посоветовавшись с врачом или фармацевтом. Если у вас возникли проблемы, поговорите со своим врачом о возможных вариантах.
Продолжение
Общие побочные эффекты лития могут включать:
- Тремор рук (если тремор особенно беспокоит, иногда можно уменьшить дозировку или принять дополнительное лекарство.)
- Повышенная жажда
- Повышенное мочеиспускание
- Диарея
- Рвота
- Увеличение веса
- Нарушение памяти
- Низкая концентрация
- Сонливость
- Слабость мышц
- Выпадение волос
- Угри
- Снижение функции щитовидной железы (которое можно лечить гормоном щитовидной железы)
Сообщите своему врачу, если вы подозреваете, что у вас могут быть стойкие побочные эффекты от лития или если у вас развиваются диарея, рвота, лихорадка, неустойчивая ходьба, обмороки, спутанность сознания, невнятная речь или учащенное сердцебиение.
Продолжение
Расскажите врачу о своей истории болезни, включая рак, болезни сердца, почек, эпилепсию и аллергии. Убедитесь, что ваш врач знает обо всех других лекарствах, которые вы принимаете. Избегайте продуктов с низким содержанием натрия (соли), поскольку диета с низким содержанием натрия может привести к чрезмерно высокому уровню лития. Принимая литий, соблюдайте осторожность при вождении или использовании механизмов и ограничьте употребление алкогольных напитков. Людям, которые принимают литий, также следует проконсультироваться со своим врачом перед приемом нестероидных противовоспалительных препаратов (НПВП), таких как ибупрофен, поскольку эти лекарства могут повышать уровень лития.
Если вы пропустите дозу лития, примите ее, как только вспомните об этом — если следующая запланированная доза не наступит в течение двух часов (или шести часов для форм с медленным высвобождением). В таком случае пропустите пропущенную дозу и возобновите свой обычный график дозирования. Не удваивайте дозу, чтобы наверстать упущенное.
Не удваивайте дозу, чтобы наверстать упущенное.
Следует учитывать несколько серьезных рисков. Препарат был связан с определенными врожденными дефектами и следует использовать с осторожностью у беременных женщин, особенно в течение первых трех месяцев pregnancy.The безопасности грудного вскармливания при приеме литии является спорным и следует обсудить заранее с вашим врачом.Кроме того, у некоторых людей длительное лечение литием может нарушить функцию почек или привести к необратимому повреждению почек — вот почему так важен периодический мониторинг анализов крови для измерения функции почек.
Использование, побочные эффекты, взаимодействия, дозировка и предупреждения
Побочные эффекты и безопасность
При приеме внутрь : Литий ВЕРОЯТНО БЕЗОПАСНЫЙ для большинства людей при правильном приеме под наблюдением врача.Карбонат лития и цитрат лития были одобрены Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) в качестве лекарств, отпускаемых по рецепту. Но недостаточно информации, чтобы знать, безопасны ли литиевые добавки.
Но недостаточно информации, чтобы знать, безопасны ли литиевые добавки.Литий может вызывать тошноту, диарею, головокружение, изменение сердечного ритма, мышечную слабость, утомляемость и чувство ошеломления. Эти нежелательные побочные эффекты часто улучшаются при продолжении использования. Могут возникнуть мелкий тремор, частое мочеиспускание и жажда, которые могут сохраняться при продолжительном использовании. Также могут наблюдаться увеличение веса и отеки из-за избытка жидкости.Литий также может вызывать или усугублять кожные заболевания, такие как акне, псориаз и сыпь. Это также может вызвать проблемы с щитовидной железой. Количество лития в организме необходимо тщательно контролировать и контролировать с помощью анализов крови.
Особые меры предосторожности и предупреждения:
Беременность и кормление грудью : Литий ВОЗМОЖНО БЕЗОПАСНО при приеме во время беременности. Он может отравить развивающегося ребенка (плод) и увеличить риск врожденных дефектов, включая проблемы с сердцем. Тем не менее, использование лития может контролироваться врачом, если польза от приема лития для матери превышает риски для плода.
Тем не менее, использование лития может контролироваться врачом, если польза от приема лития для матери превышает риски для плода.Обработка литием ВЕРОЯТНО НЕ БЕЗОПАСНО для кормящих женщин. Литий может попадать в грудное молоко и вызывать нежелательные побочные эффекты у грудного ребенка. Его следует использовать только в очень редких случаях под тщательным наблюдением со стороны поставщика медицинских услуг.
Дети : Цитрат лития и карбонат лития ВОЗМОЖНО БЕЗОПАСНЫ при правильном применении под наблюдением медицинского работника у детей от 7 лет и старше.Недостаточно надежной информации, чтобы узнать, безопасны ли добавки лития для детей или каковы могут быть побочные эффекты.
Синдром Бругада : Синдром Бругада — это тип сердечного заболевания, при котором повышается риск внезапной остановки сердца. Литий не следует использовать людям с синдромом Бругада или тем, у кого в анамнезе были аномальные показания ЭКГ. Кроме того, прекратите принимать литий и обратитесь к врачу, если вы почувствуете слабость или изменится сердцебиение.
Обезвоживание : Повышенная температура, потоотделение и диарея могут увеличить риск обезвоживания и потери соли. Литий может усугубить обезвоживание. Если вы обезвожены или у вас низкий уровень соли, вам может потребоваться изменить дозу лития. Поговорите со своим врачом.
Пожилые люди : С возрастом литий может накапливаться в организме. Кроме того, пожилые люди, как правило, страдают другими заболеваниями и чаще принимают различные лекарства. Пожилой возраст, другие болезни и использование многих лекарств повышают вероятность того, что у кого-то будут побочные эффекты лития, а некоторые могут быть довольно серьезными.
Болезнь сердца : Литий может вызвать нарушение сердечного ритма. Это может быть проблемой, особенно для людей с сердечными заболеваниями.
Заболевание почек : Литий выводится из организма почками. Людям с заболеваниями почек может потребоваться уменьшить количество вводимого лития.
Низкий уровень натрия : Литий может снизить уровень соли в крови. Если у вас уже низкий уровень соли в крови, используйте литий с осторожностью.
Если у вас уже низкий уровень соли в крови, используйте литий с осторожностью.
Хирургия : Литий может изменять уровень серотонина, химического вещества, которое влияет на центральную нервную систему. Есть опасения, что литий может помешать хирургическим процедурам, которые часто связаны с анестезией и другими лекарствами, влияющими на центральную нервную систему. Использование лития следует прекратить с одобрения врача, по крайней мере, за две недели до запланированной операции.
Заболевание щитовидной железы : Литий может усугубить проблемы с щитовидной железой.Регулярно проверяйте функцию щитовидной железы.
захватывающая история успеха в психиатрии
Джон Кейд, изображенный в 1974 году, был первым человеком, протестировавшим литий для лечения биополярного расстройства Фото: News Ltd / Newspix
Литий: доктор, лекарство и прорыв Уолтер А. Браун Liveright (2019)
Около 70 лет назад австралийский психиатр Джон Кейд открыл лекарство от биполярного расстройства, которое помогло многим пациентам выздороветь. стабильность быстро.Литий в настоящее время является стандартным средством лечения этого состояния и одним из наиболее эффективных лекарств в психиатрии. Но его подъем был полон препятствий. Переплетенная история Кейда и его важного открытия рассказана в убедительной книге американского психиатра Уолтера Брауна Lithium .
стабильность быстро.Литий в настоящее время является стандартным средством лечения этого состояния и одним из наиболее эффективных лекарств в психиатрии. Но его подъем был полон препятствий. Переплетенная история Кейда и его важного открытия рассказана в убедительной книге американского психиатра Уолтера Брауна Lithium .
Биполярное расстройство, называвшееся маниакально-депрессивным расстройством до 1980 года, поражает примерно 1 человека из 100 во всем мире. Без лечения это может превратиться в непрерывный цикл эмоциональных взлетов и падений.Уровень самоубийств среди нелеченных людей в 10–20 раз выше, чем среди населения в целом. К счастью, карбонат лития, полученный из легкого серебристого металлического лития, может уменьшить эту цифру в десять раз.
Рассказ Брауна о насыщенной событиями жизни Кейда во многом охватывает те же темы, что и Finding Sanity (2016), довольно агиографическая биография Грега де Мура и Энн Уэстмор. Что Браун делает великолепно, так это показывает, что Кейд сделал свое открытие, не имея доступа к достижениям в области технологий или современным средствам — и почти вопреки им. Его открытие было счастливым результатом того, что его заставляли работать простейшими средствами.
Его открытие было счастливым результатом того, что его заставляли работать простейшими средствами.
Во время Второй мировой войны Кейд был интернирован более чем на три года в печально известном японском лагере для военнопленных в Чанги в Сингапуре. Его назначили заведующим психиатрическим отделением, где он начал замечать решающую связь между определенными недостатками пищи и болезнями у своих товарищей по заключению. Например, недостаток витаминов группы В вызывает бери-бери и пеллагру.
После войны он продолжил свои исследования.Работая в заброшенной кладовой психиатрической больницы Bundoora Repatriation Mental Hospital недалеко от Мельбурна, Австралия, он начал собирать образцы мочи у людей, страдающих депрессией, манией и шизофренией, с целью выяснить, может ли секреция в их моче быть связана с их симптомами. Не имея доступа к сложному химическому анализу и в значительной степени не руководствуясь теорией, Кейд вводил мочу в брюшную полость морских свинок, повышая дозу до тех пор, пока они не умерли. Моча людей с манией оказалась особенно смертельной для животных.
Моча людей с манией оказалась особенно смертельной для животных.
В дальнейших экспериментах в Бундуре Кейд обнаружил, что карбонат лития, который использовался для лечения таких состояний, как подагра, с девятнадцатого века, снижает токсичность мочи пациентов. Кейд также заметил, что большая доза лекарства успокаивает морских свинок. Он мог перевернуть их на спину, и обычно беспокойные грызуны спокойно смотрели на него. Он задавался вопросом, может ли литий оказывать такое же успокаивающее действие на его пациентов.Попробовав на себе установить безопасную дозу, Кейд начал лечить десять человек с манией. В сентябре 1949 года он сообщил о быстрых и значительных улучшениях во всех из них в Медицинском журнале Австралии (J. F. J. Cade Med. J. Aus. 2 , 349–351; 1949). Большинство этих пациентов были в Бундуре и уезжали из нее в течение многих лет; Теперь пятеро из них достаточно поправились, чтобы вернуться в свои дома и семьи.
Карбонат лития теперь включен в список основных лекарственных средств Всемирной организации здравоохранения. Предоставлено: Чарльз Д. Уинтерс / Библиотека научных фотографий
Предоставлено: Чарльз Д. Уинтерс / Библиотека научных фотографий
Кейда в то время осталась практически незамеченной. Вскоре, двигаясь по строкам таблицы Менделеева, как гребец на берегу, Кейд начал экспериментировать с солями рубидия, церия и стронция. Ни один из них не оказался терапевтическим В 1950 году он также отказался от экспериментов с литием. Терапевтическая доза лития опасно близка к токсической дозе, и в том же году один из его пациентов — «У. Б.», человек с 30-летней историей биполярного расстройства — фигурировал в записях коронера как умер от отравления литием.
Коричневый цвет также является частью истории Могенса Скоу. Датский психиатр был таким же героем, как Кейд, борется долго и трудно получить литий принятого в качестве средства для лечения биполярного расстройства. Он хорошо знал это состояние, потому что оно было у его брата. Начиная с 1950-х годов Ско объединился с коллегой-психиатром Полом Бааструпом, чтобы провести серию экспериментов с литием в более строгих условиях, кульминацией которых стало двойное слепое плацебо-контролируемое клиническое испытание. Опубликованный в 1970 году в журнале The Lancet , это без сомнения установило, что литий эффективен для большинства людей с биполярным расстройством, включая брата Шу (П.К. Бааструп и др. . Ланцет 296 , 326–330; 1970).
Опубликованный в 1970 году в журнале The Lancet , это без сомнения установило, что литий эффективен для большинства людей с биполярным расстройством, включая брата Шу (П.К. Бааструп и др. . Ланцет 296 , 326–330; 1970).
Сегодня литий помогает стабилизировать настроение миллионов людей, страдающих этим заболеванием, хотя дозу необходимо тщательно контролировать, и это может иметь неприятные побочные эффекты, такие как тошнота и дрожь. Его механизм до сих пор остается загадкой. Большинство исследований нацелено на тонкую химию, поддерживающую работу нейротрансмиттеров; но пока нет окончательных результатов.Причина расстройства также не установлена. Ясно, что существует генетический компонент: если один из пары монозиготных близнецов (которые имеют общий генетический материал) страдает заболеванием, существует около 60% вероятности, что это будет у другого. У дизиготных близнецов этот показатель составляет 10%.
Finish Lithium , у читателей остается ощущение парадокса. Препарат, положивший начало «психофармакологической революции» 1950-х годов с появлением антипсихотических средств и антидепрессантов, во многих отношениях имеет ошеломляющий успех.Тем не менее, он был разработан в ветхой кладовой, а образцы мочи в бутылках хранились в семейном холодильнике Кейдов. Более того, в ретроспективе открытие лития кажется частично связанным с ошибочной интерпретацией Кейда. «Транквилизированные» морские свинки, вероятно, демонстрировали первые симптомы отравления литием: летаргия по-прежнему является предупреждающим признаком передозировки. И переход от морских свинок к людям был «концептуальным скачком», как любезно выразился Браун, — вряд ли вывод из здравой теории.Маловероятно, что современный исследователь получит разрешение на такие эксперименты, как у Кейда.
Препарат, положивший начало «психофармакологической революции» 1950-х годов с появлением антипсихотических средств и антидепрессантов, во многих отношениях имеет ошеломляющий успех.Тем не менее, он был разработан в ветхой кладовой, а образцы мочи в бутылках хранились в семейном холодильнике Кейдов. Более того, в ретроспективе открытие лития кажется частично связанным с ошибочной интерпретацией Кейда. «Транквилизированные» морские свинки, вероятно, демонстрировали первые симптомы отравления литием: летаргия по-прежнему является предупреждающим признаком передозировки. И переход от морских свинок к людям был «концептуальным скачком», как любезно выразился Браун, — вряд ли вывод из здравой теории.Маловероятно, что современный исследователь получит разрешение на такие эксперименты, как у Кейда.
Открытия Кейда могли легко провалиться, если бы Шоу и другие, такие как американский медицинский исследователь Джон Тэлботт, не последовали его статье 1949 года. Таким образом, приветствовать Кейда как первопроходца справедливо, но без Скоу и остальных следов не было бы. Благодаря им всем этот вездесущий элемент, легко производимый и никогда не запатентованный фармацевтическими компаниями, остается дешевым и неоценимым средством лечения тревожного расстройства.
Благодаря им всем этот вездесущий элемент, легко производимый и никогда не запатентованный фармацевтическими компаниями, остается дешевым и неоценимым средством лечения тревожного расстройства.
| DermNet NZ
Автор: Стюарт Шиу, студент пятого курса медицинского факультета Оклендского университета, Новая Зеландия, май 2016 г.
Что такое литий?
Литий — химический элемент и самый легкий из щелочных металлов. Поскольку он очень реактивен и легко воспламеняется, он существует в природе в составе соединений. Соли лития используются терапевтически при лечении расстройств настроения, таких как биполярное расстройство и депрессия.
В Новой Зеландии карбонат лития (соль лития) полностью субсидируется и может быть прописан в виде капсул по 250 мг, таблеток по 250 или 400 мг или таблеток с модифицированным высвобождением по 400 мг.Торговые наименования включают Литикарб ФК и Приадель. Лучше всего принимать его во время еды, чтобы предотвратить тошноту.
Для чего используется литий?
Литий показан для:
- Профилактика и лечение мании, гипомании и депрессии при биполярном расстройстве
- Профилактика и лечение рецидивирующей униполярной депрессии
- Комбинированная терапия с другими антидепрессантами для лечения депрессии.
Литий используется более 60 лет и является основой как для профилактики, так и для лечения острого биполярного расстройства.Многие плацебо-контролируемые исследования показали его эффективность в снижении частоты и тяжести маниакальной и депрессивной фаз биполярного расстройства. Также было показано, что он снижает риск самоубийства и смерти по сравнению с плацебо.
Сколько времени нужно литию, чтобы работать?
При острой мании и гипомании терапевтический эффект проявляется в течение 6–10 дней. При использовании от депрессии эффект проявляется с задержкой на 6-8 недель. В профилактических целях может пройти 6–12 месяцев, прежде чем будет достигнут полный терапевтический эффект.
Каковы побочные эффекты лития?
Литий имеет узкий терапевтический индекс, что означает небольшую разницу между дозами, эффективными для лечения, и токсическими дозами. В связи с этим необходимы регулярные анализы крови для проверки уровня лития в сыворотке крови. Поскольку литий выводится из организма через почки, следует соблюдать осторожность у пациентов с почечной недостаточностью, поскольку они с большей вероятностью будут страдать от накопления лития и токсичности.
Побочные эффекты лития обычно зависят от дозы и возникают, когда уровни лития в сыворотке выше терапевтических уровней.
Желудочно-кишечные побочные эффекты лития
Тошнота, рвота, анорексия и диарея чаще встречаются на начальных этапах литиевой терапии, когда уровни лития в сыворотке еще не стабильны.
Неврологические побочные эффекты лития
В терапевтических дозах литий может вызывать стойкий мелкий тремор рук, мышечную слабость и, в редких случаях, экстрапирамидные проявления. Тремор можно лечить с помощью бета-адреноблокаторов. У пациентов с токсичностью лития может наблюдаться нарушение сознания, апатия, гиперрефлексия, гипертонус, судороги и, в редких случаях, смерть.Продолжительное токсическое воздействие может привести к повреждению мозга.
Тремор можно лечить с помощью бета-адреноблокаторов. У пациентов с токсичностью лития может наблюдаться нарушение сознания, апатия, гиперрефлексия, гипертонус, судороги и, в редких случаях, смерть.Продолжительное токсическое воздействие может привести к повреждению мозга.
Эндокринные побочные эффекты лития
Длительное лечение литием, особенно у женщин среднего и старшего возраста, может привести к гипотиреозу и эутиреоидному зобу, который хорошо поддается лечению дополнительным тироксином. Гиперкальциемия наблюдается у 10% пациентов. Также отмечались гипермагниемия и гиперпаратиреоз.
Побочные эффекты лития на почки
Примерно у одной трети пациентов может развиться несахарный нефрогенный диабет, который проявляется полиурией и полидипсией и обратим при прекращении приема лития.Длительное лечение литием может вызвать необратимое нарушение функции почек.
Сердечные побочные эффекты лития
Литий может вызывать изменения ЭКГ и аритмии из-за удлинения интервала QT. Недавно перенесенный инфаркт миокарда является противопоказанием к применению лития.
Недавно перенесенный инфаркт миокарда является противопоказанием к применению лития.
Кожные побочные эффекты лития
Кожа — это орган, на который литий наиболее часто оказывает отрицательное воздействие.
- Мужчины чаще пострадают. Литий
- чаще вызывает неблагоприятные кожные эффекты по сравнению с другими психотропными препаратами, применяемыми при расстройствах настроения.
- По сравнению с другими системами органов, кожные побочные эффекты возникают, даже если содержание лития в сыворотке все еще находится в нормальном терапевтическом диапазоне.
Может вызвать первое проявление кожного заболевания или обострить уже существующее заболевание, например псориаз или угри.
- Не все пациенты с существующим кожным заболеванием будут обостряться при приеме лития.
- Обострение ранее существовавшего кожного заболевания может стать невосприимчивым к обычному лечению. Состояние кожи обратимо, если прекратить прием лития, за исключением некоторых случаев псориаза.
 Некоторые состояния, такие как фолликулит, проходят даже при продолжении лечения литием.
Некоторые состояния, такие как фолликулит, проходят даже при продолжении лечения литием.
Кожные побочные эффекты лития
ПсориазПсориаз — хроническое воспалительное заболевание кожи, характеризующееся хорошо выраженными красными и чешуйчатыми бляшками.
УгриУгри — распространенное воспалительное заболевание кожи, характеризующееся комедонами (закупоркой волосяных фолликулов).
- Это наиболее частое побочное действие лития.
- Обычно появляется через несколько недель после начала приема препарата.
- Индуцированные литием акне проявляются в виде стойких мономорфных пустул на эритематозной основе
- Обычно возникает на конечностях и туловище, а не на лице.
Нежные красные пустулы характеризуют фолликулит, вызванный воспалением волосяных фолликулов.
- Индуцированный литием фолликулит имеет тенденцию проявляться на разгибательных поверхностях предплечий и ног через несколько месяцев после начала приема лития.

- Напоминает волосяной кератоз.
- Фолликулит проходит самостоятельно, даже если прием лития продолжается.
От выпадения волос страдают 12–19% пациентов, получающих долгосрочную литиевую терапию.
- Чаще встречается у женщин.
- Аутоиммунное облысение может проявляться очаговой алопецией (круглые залысины) или, в некоторых случаях, тотальной алопецией (потерей всех волос на коже черепа).
- Выпадение волос может возобновиться после прекращения приема лития.
- Диффузное истончение волос может быть вызвано литием индуцированным гипотиреозом, поэтому следует измерять функцию щитовидной железы.
Другие кожные заболевания, связанные с литием, включают:
Какие исследования проводятся при использовании лития?
Пациенты, принимающие литий, должны проходить регулярные анализы на:
- Уровни лития в крови
- Почечная и сердечная функции
- Функциональные пробы щитовидной железы.

Могут потребоваться дополнительные тесты, в зависимости от наблюдаемого побочного эффекта, например, биопсия кожи или соскобы кожи на микологию.
Как управляются кожные побочные эффекты у пациентов, принимающих литий?
Для многих пациентов расстройство настроения может быть более тяжелым, чем состояние кожи, а польза лития может перевешивать его побочные эффекты.
- Большинство неблагоприятных воздействий на кожу от легкой до средней степени тяжести, и прием лития можно безопасно продолжать. Состояние кожи лечится как обычно, с помощью местных и системных процедур.
- Если состояние кожи тяжелое и не поддается лечению, можно рассмотреть возможность уменьшения дозы лития или прекращения лечения.
Лекарственные взаимодействия с литием
Было показано, что многие лекарства взаимодействуют с литием и либо увеличивают, либо уменьшают концентрацию лития в организме.
- Возможно, потребуется изменить дозу лития.

- Возможно, потребуется отменить прием другого лекарства.
Примеры включают:
- Диуретики, ингибиторы АПФ и нестероидные противовоспалительные средства, которые снижают выведение лития почками и могут привести к накоплению лития.
- Селективные ингибиторы обратного захвата серотонина (СИОЗС), блокаторы кальциевых каналов, трициклические антидепрессанты и нейролептики следует использовать с осторожностью.
- Антибиотики тетрациклинового ряда часто используются для лечения акне и розацеа, которые могут вызывать отравление литием. Литий
- противопоказан при приеме других лекарств, вызывающих удлинение интервала QT, таких как домперидон, гидроксизин, мизоластин, пиперахин и сибутрамин.
Литий для местного применения
Соли лития для местного применения полезны при лечении себорейного дерматита.Считается, что он снижает выделение жирных кислот в коже. Поскольку жирные кислоты важны для роста грибов, это снижает количество грибков на поверхности кожи.
Высокая местная концентрация лития для местного применения также оказывает противовоспалительный эффект за счет снижения выработки простагландинов и других эйкозаноидов. Это позволяет использовать его для лечения других воспалительных заболеваний кожи.
Литий для местного применения обычно хорошо переносится и не вызывает значительного повышения уровня лития в сыворотке крови.Это может вызвать временное легкое раздражение кожи.
Литий: лекарство для контроля расстройств настроения, таких как мания и биполярное расстройство.
Важно принимать литий в соответствии с рекомендациями врача.
Существует 2 различных типа лития — карбонат лития и цитрат лития. Важно не переходить на другой тип, если это не рекомендовано вашим врачом. Это потому, что разные типы по-разному усваиваются организмом.
Карбонат лития выпускается в виде обычных таблеток и таблеток с медленным высвобождением, в которых лекарство высвобождается медленно с течением времени.
Цитрат лития представляет собой жидкость. Обычно это назначают только людям, у которых есть проблемы с глотанием таблеток.
Дозы варьируются от человека к человеку. Ваша начальная доза будет зависеть от вашего возраста, от того, от чего вы лечитесь, и от типа лития, рекомендованного вашим врачом.
Если у вас проблемы с почками, ваш врач будет более внимательно следить за уровнем лития в вашей крови и при необходимости изменить дозу.
Обычно вы принимаете литий один раз в день на ночь.Это связано с тем, что при регулярном анализе крови его необходимо сдавать через 12 часов после приема лекарства. Вы можете выбирать, когда принимать литий — просто старайтесь соблюдать одно и то же время каждый день.
Как принимать
Таблетки проглатывать целиком, запивая водой или соком. Не разжевывайте их. Вы можете принимать литий с пищей или без нее.
Если вы принимаете жидкость, используйте пластиковый шприц или ложку, прилагаемую к лекарству, чтобы отмерить правильную дозу. Если у вас его нет, спросите своего фармацевта.Не используйте кухонную чайную ложку, так как вы не получите нужное количество.
Если у вас его нет, спросите своего фармацевта.Не используйте кухонную чайную ложку, так как вы не получите нужное количество.
Информация о лечении литием
Когда вы начнете принимать литий, вы получите пакет лечения литием (обычно фиолетовую папку или книгу) с записной книжкой. Вам необходимо показывать свою карточку каждый раз, когда вы идете к врачу, в больницу или забираете рецепт.
Когда вы пойдете к врачу для сдачи анализов крови, вы или ваш врач напишете в журнале учета:
- ваша доза лития
- ваш уровень лития в крови
- любые другие результаты анализа крови
- ваш вес
В лечебной упаковке также есть карточка с предупреждением о литии.Вам нужно будет постоянно носить эту карту с собой. Он сообщает медицинским работникам, что вы принимаете литий. Им может быть полезно узнать об этом в экстренных случаях.
Сообщите своему врачу или фармацевту, если вы потеряли свою лечебную упаковку или не получили ее.
Будет ли моя доза увеличиваться или уменьшаться?
Когда вы начнете лечение, вам необходимо каждую неделю сдавать анализ крови, чтобы убедиться, что уровень лития в вашей крови не слишком высокий или слишком низкий. Ваш врач может изменить вашу дозу в зависимости от результатов анализа крови.
Как только врач будет доволен, вам каждые 3–6 месяцев будут сдавать анализ крови, чтобы проверять, остается ли уровень стабильным.
Как только вы найдете подходящую дозу, она обычно останется прежней — если только ваше состояние не изменится или ваш врач не пропишет другое лекарство, которое может влиять на литий.
Что делать, если я заболею во время приема лития?
Инфекции и болезни, такие как простуда и грипп, могут вызвать обезвоживание, а это может повлиять на уровень лития в крови.
Поговорите со своим врачом или фармацевтом, если вы:
- имеете заболевание, вызывающее тяжелую диарею, рвоту, высокую температуру или потоотделение
- , у вас инфекция мочевыводящих путей (ИМП)
- вы мало едите и не пьете
Что, если я забуду его взять?
Если вы обычно принимаете:
- таблетки или таблетки с медленным высвобождением — если прошло меньше, чем 6 часов с того момента, как вы должны были принять литий, примите его, как только вспомните.
 Если больше, чем 6 часов, просто пропустите пропущенную дозу и примите следующую в обычное время
Если больше, чем 6 часов, просто пропустите пропущенную дозу и примите следующую в обычное время - жидкость — если вы забыли принять дозу, просто пропустите пропущенную дозу и примите следующую в обычное время
Никогда не принимайте 2 дозы одновременно. Никогда не принимайте дополнительную дозу, чтобы наверстать упущенное.
Если вы часто забываете дозы, может быть полезно установить будильник, чтобы напомнить вам. Вы также можете попросить своего фармацевта посоветовать, как еще не забыть принимать лекарство.
Что делать, если я возьму слишком много?
Если вам нужно пойти в отделение неотложной помощи, возьмите с собой литиевый пакет или листок-вкладыш внутри него, а также все оставшееся лекарство.
Границы | Влияние концентрации литиевой соли на структурные и транспортные свойства ионных жидких электролитов
Введение
С ростом популярности персональных портативных электронных устройств быстро развиваются транспортные средства на новых источниках энергии и возобновляемые источники энергии. Электрохимическая система хранения энергии с высокой плотностью энергии, высокой циклической стабильностью и высокой плотностью мощности сталкивается с огромными проблемами и постепенно стала основным направлением исследований в мире.Литий-ионные аккумуляторы доминируют на рынке аккумуляторов с момента их успешной коммерциализации в начале 1990-х годов благодаря их высокому напряжению, высокой удельной энергии и длительному сроку службы (Scrosati and Garche, 2010; G динаф и Ким, 2011). Однако требования к характеристикам и составу батарей становятся все более строгими по мере того, как требования приложений продолжают улучшаться. Озабоченность по поводу безопасности литий-ионных аккумуляторов стала очевидной и возросла, поскольку трудно удовлетворить требования к легкому, высокопроизводительному и долговечному электронному оборудованию, электромобилям и другим технологиям.Таким образом, разработка нового поколения экологически чистых аккумуляторных систем с высокими характеристиками и защитой окружающей среды стала общей проблемой для международного сообщества.
Электрохимическая система хранения энергии с высокой плотностью энергии, высокой циклической стабильностью и высокой плотностью мощности сталкивается с огромными проблемами и постепенно стала основным направлением исследований в мире.Литий-ионные аккумуляторы доминируют на рынке аккумуляторов с момента их успешной коммерциализации в начале 1990-х годов благодаря их высокому напряжению, высокой удельной энергии и длительному сроку службы (Scrosati and Garche, 2010; G динаф и Ким, 2011). Однако требования к характеристикам и составу батарей становятся все более строгими по мере того, как требования приложений продолжают улучшаться. Озабоченность по поводу безопасности литий-ионных аккумуляторов стала очевидной и возросла, поскольку трудно удовлетворить требования к легкому, высокопроизводительному и долговечному электронному оборудованию, электромобилям и другим технологиям.Таким образом, разработка нового поколения экологически чистых аккумуляторных систем с высокими характеристиками и защитой окружающей среды стала общей проблемой для международного сообщества.
Электролит, как ключевой компонент литиевой батареи, не только играет роль в проведении ионов лития и внутренней цепи, но также является одним из наиболее важных факторов, определяющих емкость батареи и стабильность цикла. Отличный аккумуляторный электролит обычно имеет следующие характеристики: (1) хорошая химическая и электрохимическая стабильность, т.е.е., не вступающие в реакцию с электродом в диапазоне рабочих напряжений; (2) высокая емкость переноса ионов лития; (3) хорошая совместимость с положительным электродом и отрицательным электродом из металлического лития; (4) отличные характеристики электронной изоляции; (5) низкая стоимость, низкая токсичность и защита окружающей среды и т. Д. Однако в настоящее время наиболее широко используемый в промышленности электролит на основе органических растворителей не может обеспечить все вышеперечисленные комплексные характеристики. Таким образом, оптимизация и разработка состава и формулы электролита стала одним из лучших способов способствовать быстрому развитию литий-ионных батарей (Xu, 2014; Kim et al. , 2015; Wu et al., 2019).
, 2015; Wu et al., 2019).
Ионные жидкости (ИЖ) определяются как расплавленные соли с температурой плавления ниже 100 ° C, которые считаются третьим типом растворителей после воды и органических растворителей. Между тем ИЖ обладают уникальными свойствами, такими как высокая термическая стабильность, незначительное давление пара, нелетучесть, высокая ионная проводимость и т. Д. (Galinski et al., 2006; Lewandowski and Swiderska-Mocek, 2009; Zhang et al., 2018). Поэтому они широко используются во многих устройствах хранения энергии, таких как электрохимические двухслойные конденсаторы, солнечные элементы и т. Д., особенно в качестве электролитов в литиевых батареях в последние годы (Рисунок S1). Однако на эти свойства сильно влияют кулоновские взаимодействия, ван-дер-ваальсовы взаимодействия и направленность взаимодействий между катионами и анионами. Таким образом, мы должны внимательно рассмотреть эти характеристики и структуры, а также выбрать подходящие ИЖ для практических приложений. Из-за гибкости конструкции ИЖ (теоретически существует 10 18 типов ИЖ) невозможно проверить все ИЖ экспериментально и выбрать лучшую систему для литий-ионных аккумуляторов.До сих пор при применении литиевых батарей в качестве электролитов использовалось лишь несколько ИЖ (рис. 1). Между тем, этот рисунок также указывает на то, что структура электролитов ИЖ изменяется с концентрацией соли лития; то есть литиевая соль обернута IL, когда концентрация литиевой соли низкая; напротив, ИЖ обертываются литиевой солью, когда концентрация литиевой соли высока. Поэтому в этом исследовании мы сначала резюмируем последние достижения в области электролитов IL и стремимся пролить свет на будущую дорожную карту в этой области исследований.
Из-за гибкости конструкции ИЖ (теоретически существует 10 18 типов ИЖ) невозможно проверить все ИЖ экспериментально и выбрать лучшую систему для литий-ионных аккумуляторов.До сих пор при применении литиевых батарей в качестве электролитов использовалось лишь несколько ИЖ (рис. 1). Между тем, этот рисунок также указывает на то, что структура электролитов ИЖ изменяется с концентрацией соли лития; то есть литиевая соль обернута IL, когда концентрация литиевой соли низкая; напротив, ИЖ обертываются литиевой солью, когда концентрация литиевой соли высока. Поэтому в этом исследовании мы сначала резюмируем последние достижения в области электролитов IL и стремимся пролить свет на будущую дорожную карту в этой области исследований.
Рисунок 1 . Общая структура ионных жидкостей и литиевой соли, используемых в литиево-ионных батареях (ионные жидкости обертывают литиевую соль, когда концентрация литиевой соли низкая; напротив, ионные жидкости оборачиваются литиевой солью).
С момента коммерциализации литиевых батарей в основе электролитов лежит органический карбонат. Хотя эти типы электролитов допускают большое количество циклов заряда и разряда, существуют некоторые серьезные проблемы с безопасностью из-за воспламеняемости, летучести и т. Д.В последние десятилетия было приложено много усилий, чтобы решить эту проблему, чтобы найти потенциальные альтернативы доступному растворителю. Из-за огромных преимуществ ИЖ распространенной стратегией является тестирование доступных ИЖ, чтобы заменить проблемные органические карбонаты, что широко применяется. Сакаэбе и Мацумото (2003) обнаружили, что ячейка Li / LiCoO 2 , содержащая N -метил- N -пропилпиперидин бис (трифторметансульфонил) имид в качестве электролита, показала хорошие рабочие характеристики с постоянной емкостью LiCoO 2 и эффективностью Coulomb. при полных циклах более 97% при норме тока C / 10.После этого Гарсия и др. (2004) исследовали этилметилимидазолий бис- (трифторметансульфонил) -имид ([C 2 mim] [TFSI]), допированный LiTFSI в качестве электролита в литиевой батарее. Результаты сравнивали с традиционными жидкими органическими растворителями этиленкарбонат / карбонатные электролиты (EC / DMC). Они обнаружили, что электролиты IL могут обеспечить лучшую производительность при езде на велосипеде; между тем проводимость была аналогична проводимости электролита с органическим растворителем, достигая 7 мСм / см. Постепенно все больше исследователей обнаружили, что электролиты IL не только могут эффективно улучшать проводимость, но также демонстрируют свои преимущества в стабильности и цикличности электрода и батареи, соответственно.Например, Ishikawa et al. (2006) впервые сообщили о чистом IL-1-этил-3-метилимидазолий бис (фторсульфонил) имид ([C 2 мим] [FSI]) и N-метил-N-пропилпирролидиния бис (фторсульфонил) имид ([Pry13] [FSI ]) в качестве электролита может обеспечить стабильную и обратимую емкость для графитированного отрицательного электрода без каких-либо добавок или растворителей при температуре окружающей среды. Экспериментальные результаты также показали, что обратимая емкость графитового отрицательного электрода имеет стабильное значение ~ 360 мАч / г в течение 30 циклов при скорости заряда / разряда 0.
Результаты сравнивали с традиционными жидкими органическими растворителями этиленкарбонат / карбонатные электролиты (EC / DMC). Они обнаружили, что электролиты IL могут обеспечить лучшую производительность при езде на велосипеде; между тем проводимость была аналогична проводимости электролита с органическим растворителем, достигая 7 мСм / см. Постепенно все больше исследователей обнаружили, что электролиты IL не только могут эффективно улучшать проводимость, но также демонстрируют свои преимущества в стабильности и цикличности электрода и батареи, соответственно.Например, Ishikawa et al. (2006) впервые сообщили о чистом IL-1-этил-3-метилимидазолий бис (фторсульфонил) имид ([C 2 мим] [FSI]) и N-метил-N-пропилпирролидиния бис (фторсульфонил) имид ([Pry13] [FSI ]) в качестве электролита может обеспечить стабильную и обратимую емкость для графитированного отрицательного электрода без каких-либо добавок или растворителей при температуре окружающей среды. Экспериментальные результаты также показали, что обратимая емкость графитового отрицательного электрода имеет стабильное значение ~ 360 мАч / г в течение 30 циклов при скорости заряда / разряда 0. 2 C. Впоследствии Sugimoto et al. (2010) сравнили электролиты IL [C 2 mim] [FSI] и DMC в композитном аноде кремний-никель-углерод для перезаряжаемых литий-ионных батарей. Результаты экспериментов показали, что гальваностатическое циклирование композитного анода на основе Si в электролите на основе FSI — с ограничением заряда 800 мАч / г было стабильным и обеспечивало разрядную емкость 790 мАч / г на 50-м цикле. В то же время все больше и больше исследователей осознавали, что электролиты IL могут использоваться для различных электродов в литиевых батареях с высокими характеристиками (Chagnes et al., 2005; Ким и др., 2008; Zhang et al., 2008; Ma et al., 2019).
2 C. Впоследствии Sugimoto et al. (2010) сравнили электролиты IL [C 2 mim] [FSI] и DMC в композитном аноде кремний-никель-углерод для перезаряжаемых литий-ионных батарей. Результаты экспериментов показали, что гальваностатическое циклирование композитного анода на основе Si в электролите на основе FSI — с ограничением заряда 800 мАч / г было стабильным и обеспечивало разрядную емкость 790 мАч / г на 50-м цикле. В то же время все больше и больше исследователей осознавали, что электролиты IL могут использоваться для различных электродов в литиевых батареях с высокими характеристиками (Chagnes et al., 2005; Ким и др., 2008; Zhang et al., 2008; Ma et al., 2019).
Однако только из экспериментальных исследований ИЖ количество электролитов очень ограничено, потому что ИЖ слишком сложны по сравнению с обычными растворителями. Поэтому он получил широкое распространение для исследования микроструктуры и свойств электролита методами моделирования. Бородин и др. исследовали катионную среду Li + , перенос и механические свойства для N-метил-N-пропилпирролидиния бис (трифторметансульфонил) имида ([mppy] [TFSI]) и N, N -диметилпирролидиния бис (трифторметансульфонил) имда. [mmpy] [TFSI]) IL с 0.25 моль / л соли LiTFSI при 303–500 K методом молекулярной динамики. Результат показал, что в среднем с катионом Li + координировано <4 атомов кислорода; Между тем, коэффициенты самодиффузии ионов следуют порядку Li +
[mmpy] [TFSI]) IL с 0.25 моль / л соли LiTFSI при 303–500 K методом молекулярной динамики. Результат показал, что в среднем с катионом Li + координировано <4 атомов кислорода; Между тем, коэффициенты самодиффузии ионов следуют порядку Li +  Между тем, в последние годы это мощный метод проверки и разработки новых электролитов.
Между тем, в последние годы это мощный метод проверки и разработки новых электролитов.
В последнее время все больше внимания исследователей привлекает высокая концентрация концентрированного электролита (≥2 M соли Li). Исследования показали, что высококонцентрированные электролиты могут ингибировать образование дендритов лития во время процесса осаждения / удаления лития, тем самым эффективно улучшая стабильность слоя SEI и термическую стабильность электролита (Yamada et al., 2014; Qian et al., 2015; Ямада и Ямада, 2015). Что еще более важно, электролиты с высокой концентрацией имеют необычную сольватационную структуру по сравнению с обычными электролитами с низкой концентрацией. Shirai et al. (2008) исследовали с помощью экспериментов комбинационного рассеяния света и ЯМР и показали, что в высококонцентрированных электролитах, состоящих из LiTFSI и ИЖ ( N, N -диэтил- N -метил- N — (2-метоксиэтил) аммоний бис (трифторметансульфонил) амид, Li + координируется с четырьмя атомами кислорода в двух анионах [TFSI] — с образованием структуры [Li (TFSI) 2 ] — . В то же время Umebayashi et al. сообщили о влиянии температуры на структуру электролита LiTFS- [C 2 mim] [TFSI] с высокой концентрацией, что указывает на то, что цис-форма [TFSI] — более стабильна при высокой концентрации соли лития (Umebayashi et al. др., 2008). После этого Ямада и др. сообщили, что производительность 3,6 моль / л электролита, состоящего из двойного (фторсульфонил) амида лития (LiFSA) и DME, была намного выше, чем у коммерческих электролитов при сверхбыстрой зарядке.Это открытие является важным прорывом в области быстро заряжаемых ионно-литиевых батарей, а также расширяет наши знания о том, что электролит с высокой концентрацией работает плохо (Yamada et al., 2013). Недавно мы также провели исследование высококонцентрированных электролитов ИЖ. Путем сравнения 2 моль / л литиевой соли (LiTFSI) с чистыми органическими растворителями (DMC и DEC) и растворителями IL ([C n mim] [BF 4 ] и [C n mim] [ TFSI] ( n = 2, 4)) мы обнаружили, что электролиты ИЖ имели более высокую проводимость, чем органические растворители, при высокой концентрации соли Li; Между тем, растворение LiTFSI в растворителях ИЖ было процессом, управляемым анионами (Тонг и др.
В то же время Umebayashi et al. сообщили о влиянии температуры на структуру электролита LiTFS- [C 2 mim] [TFSI] с высокой концентрацией, что указывает на то, что цис-форма [TFSI] — более стабильна при высокой концентрации соли лития (Umebayashi et al. др., 2008). После этого Ямада и др. сообщили, что производительность 3,6 моль / л электролита, состоящего из двойного (фторсульфонил) амида лития (LiFSA) и DME, была намного выше, чем у коммерческих электролитов при сверхбыстрой зарядке.Это открытие является важным прорывом в области быстро заряжаемых ионно-литиевых батарей, а также расширяет наши знания о том, что электролит с высокой концентрацией работает плохо (Yamada et al., 2013). Недавно мы также провели исследование высококонцентрированных электролитов ИЖ. Путем сравнения 2 моль / л литиевой соли (LiTFSI) с чистыми органическими растворителями (DMC и DEC) и растворителями IL ([C n mim] [BF 4 ] и [C n mim] [ TFSI] ( n = 2, 4)) мы обнаружили, что электролиты ИЖ имели более высокую проводимость, чем органические растворители, при высокой концентрации соли Li; Между тем, растворение LiTFSI в растворителях ИЖ было процессом, управляемым анионами (Тонг и др. , 2019). Подводя итог, можно сказать, что электролиты с высокой концентрацией ИЖ перспективны для разработки батарей высокого напряжения и высокой плотности энергии.
, 2019). Подводя итог, можно сказать, что электролиты с высокой концентрацией ИЖ перспективны для разработки батарей высокого напряжения и высокой плотности энергии.
Таким образом, благодаря огромным возможностям IL-электролитов, то, как эффективно экранировать IL, исследовать состав электролита и разрабатывать новые высокоэффективные IL-электролиты, стало ключевой частью для улучшения характеристик литий-ионных батарей. В этой работе ряд электролитов ИЖ, включая ИЖ на основе 1-алкил-3-метилимидазола ([C n mim] [TFSI] и [C n mim] [FSI] ( n = 2,4)) с примесью бис (трифторметилсульфонил) имида лития (LiTFSI) (0.3, 0,5, 1,5 и 2,0 моль / л). Влияние концентрации лития на характеристики электролитов ИЖ, такие как плотность, вязкость, коэффициент самодиффузии, число переноса иона лития и структуры, было выявлено с помощью комбинирования вычислительных и экспериментальных методов.
Материалы и методы
Экспериментальный
В этой работе все электролиты ИЖ, включая бис (трифторметансульфонил) имид лития (LiTFSI) и четыре различных чистых ИЖ, т. е.е., 1-этил-3-метилимидазолий бис [(трифторметил) сульфонил] имид ([C 2 мим] [TFSI]), 1-этил-3-метилимидазолий бис (фторсульфонил) имид ([C 2 мим ] [FSI]), 1-бутил-3-метилимидазолий бис (трифторметилсульфонил) имид (C 4 мим] [TFSI]) и 1-бутил-3-метилимидазолий бис (фторсульфонил) имид (C 4 mim] [FSI]) были приобретены в Институте химической физики Ланьчжоу Китайской академии наук. Все образцы были получены путем смешивания ИЖ с различной молярной концентрацией (0.3, 0,5, 1,5 и 2,0 моль / л) LiTFSI и перемешивание в течение ночи в перчаточном боксе, заполненном аргоном.
е.е., 1-этил-3-метилимидазолий бис [(трифторметил) сульфонил] имид ([C 2 мим] [TFSI]), 1-этил-3-метилимидазолий бис (фторсульфонил) имид ([C 2 мим ] [FSI]), 1-бутил-3-метилимидазолий бис (трифторметилсульфонил) имид (C 4 мим] [TFSI]) и 1-бутил-3-метилимидазолий бис (фторсульфонил) имид (C 4 mim] [FSI]) были приобретены в Институте химической физики Ланьчжоу Китайской академии наук. Все образцы были получены путем смешивания ИЖ с различной молярной концентрацией (0.3, 0,5, 1,5 и 2,0 моль / л) LiTFSI и перемешивание в течение ночи в перчаточном боксе, заполненном аргоном.
Измерения плотности и вязкости проводили с использованием измерителя вязкости / плотности (DMA5,000M-Lovis2,000ME) при 25 ° C. Кроме того, диффузионные свойства электролитов измеряли следующим образом: ~ 20 мг образцов диспергировали в 1 мл D 2 O, и это измеряли с помощью 5-миллиметровой трубки ЯМР (ядерного магнитного резонанса). DOSY (диффузионно-упорядоченная спектроскопия) ЯМР-измерения проводили на спектрометре Bruker (500 WB AVANCE III). Инструмент был оснащен 5-миллиметровым датчиком PABBO (работающим на частоте 500,137 МГц для 1 H, 19 F, 7 Li) и катушкой с градиентом z с номинальным максимальным градиентом 50 Гс · см −1. . Последовательность импульсов представляла собой ledbpgp2s (биполярный градиентный импульс с задержкой продольного вихревого тока). Эксперименты проводились с 8 сканированиями ( 1 H и 19 F: Δ = 100 мс; 7 Li: Δ = 100 мс). Спектры DOSY, полученные на спектрометре, обрабатывались с помощью Bruker Topspin 3.2. Все результаты будут подробно обсуждены позже.
Инструмент был оснащен 5-миллиметровым датчиком PABBO (работающим на частоте 500,137 МГц для 1 H, 19 F, 7 Li) и катушкой с градиентом z с номинальным максимальным градиентом 50 Гс · см −1. . Последовательность импульсов представляла собой ledbpgp2s (биполярный градиентный импульс с задержкой продольного вихревого тока). Эксперименты проводились с 8 сканированиями ( 1 H и 19 F: Δ = 100 мс; 7 Li: Δ = 100 мс). Спектры DOSY, полученные на спектрометре, обрабатывались с помощью Bruker Topspin 3.2. Все результаты будут подробно обсуждены позже.
Детали моделирования
В этой работе все моделирование атомной МД было выполнено для четырех ИЖ ([C n mim] [TFSI], [C n mim] [FSI] ( n = 2, 4)) электролиты при четырех различных концентрациях литиевой соли LiTFSI (0,3, 0,5, 1,5 и 2 моль / л) при 298 К. Атом Li описывался силовым полем Янтаря (Wang et al. , 2004). Между тем, все ИЖ описывались оптимизированным силовым полем Янтаря, разработанным Liu et al.(2004), поскольку они показали, что на основе этого силового поля может быть достигнуто надежное описание плотности, коэффициентов диффузии и проводимости для ИЖ. Кроме того, была использована процедура ограничения электростатического потенциала (RESP) для обработки частичного заряда всех IL (Bayly et al., 1993). Кроме того, из-за эффекта поляризации электростатическое взаимодействие между ионами будет завышено. Таким образом, чтобы решить эту проблему, уменьшите частичный заряд атома в 0,8 раза. Таким образом, в данной работе удалось получить более точные термодинамические и структурные свойства электролитов ИЖ (Maginn, 2009; Salanne, 2015).Об эффективности этого метода также сообщают Schmollngruber et al. (2015).
, 2004). Между тем, все ИЖ описывались оптимизированным силовым полем Янтаря, разработанным Liu et al.(2004), поскольку они показали, что на основе этого силового поля может быть достигнуто надежное описание плотности, коэффициентов диффузии и проводимости для ИЖ. Кроме того, была использована процедура ограничения электростатического потенциала (RESP) для обработки частичного заряда всех IL (Bayly et al., 1993). Кроме того, из-за эффекта поляризации электростатическое взаимодействие между ионами будет завышено. Таким образом, чтобы решить эту проблему, уменьшите частичный заряд атома в 0,8 раза. Таким образом, в данной работе удалось получить более точные термодинамические и структурные свойства электролитов ИЖ (Maginn, 2009; Salanne, 2015).Об эффективности этого метода также сообщают Schmollngruber et al. (2015).
Для поддержания различных концентраций соли в этой работе 100 пар LiTFSI были помещены в периодические граничные блоки моделирования с различным количеством ИЖ соответственно (Таблица 1). Все моделирование проводилось с периодическими граничными условиями в кубическом ящике, а начальные конфигурации были созданы с помощью пакета Packmol (Martínez et al., 2009). Все модели MD использовались с помощью программного обеспечения Gromacs (Van Der Spoel et al., 2005). Алгоритм Верле использовался для интегрирования уравнений движения Ньютона. Между тем, ван-дер-Ваальсовое и электростатическое взаимодействие обрабатывали с помощью потенциала Леннарда-Джонса и алгоритма Эвальда с сеткой частиц (PME), соответственно. Для каждой системы канонический ансамбль (NVT) и изотермический изобарический ансамбль (NPT) были ослаблены в течение первых 10 нс и следующих 60 нс соответственно. Кроме того, ансамбль NPT и микроканонический ансамбль (NVE) были выполнены в течение 50 и 10 нс для достижения конфигурационного равновесия.В процессе моделирования траектория записывалась каждые 0,1 пс с шагом по времени 1,0 фс для дальнейшего анализа.
Все моделирование проводилось с периодическими граничными условиями в кубическом ящике, а начальные конфигурации были созданы с помощью пакета Packmol (Martínez et al., 2009). Все модели MD использовались с помощью программного обеспечения Gromacs (Van Der Spoel et al., 2005). Алгоритм Верле использовался для интегрирования уравнений движения Ньютона. Между тем, ван-дер-Ваальсовое и электростатическое взаимодействие обрабатывали с помощью потенциала Леннарда-Джонса и алгоритма Эвальда с сеткой частиц (PME), соответственно. Для каждой системы канонический ансамбль (NVT) и изотермический изобарический ансамбль (NPT) были ослаблены в течение первых 10 нс и следующих 60 нс соответственно. Кроме того, ансамбль NPT и микроканонический ансамбль (NVE) были выполнены в течение 50 и 10 нс для достижения конфигурационного равновесия.В процессе моделирования траектория записывалась каждые 0,1 пс с шагом по времени 1,0 фс для дальнейшего анализа.
Таблица 1 . Составы систем моделирования в данной работе.
Результаты и обсуждения
Физико-химические свойства
Высокая плотность и умеренная вязкость для электролитов обеспечивает более мощную энергию и эффективно предотвращает испарение растворителя. Следовательно, по мере увеличения емкости аккумуляторов энергии будет меньше загрязнения окружающей среды.В этой работе были исследованы плотность (ρ) и динамическая вязкость (η) из экспериментов и моделирования при атмосферном давлении в зависимости от концентрации LiTFSI для всех четырех электролитов IL (Рисунок 2). Ясно, что смоделированная плотность была немного выше экспериментальной, но все ошибки были <3%. Вязкость различалась на порядок из-за ограничения неполяризуемого силового поля, но тенденция осталась прежней. Принимая во внимание простоту силового поля, использованного в этом исследовании, результаты моделирования были относительно удовлетворительными.О подобных результатах также сообщили Рей-Кастро и Вега (2006).
Рисунок 2 . Плотность (A) и вязкость (B) в зависимости от концентрации LiTFSI для всех ионных жидких электролитов (пунктирная линия и открытые точки — результат эксперимента, а сплошная линия и темные точки — модели МД).
Плотность (A) и вязкость (B) в зависимости от концентрации LiTFSI для всех ионных жидких электролитов (пунктирная линия и открытые точки — результат эксперимента, а сплошная линия и темные точки — модели МД).
На Рисунке 2 тенденции изменения плотности с концентрацией LiTFSI были линейными; Между тем вязкость всех электролитов ИЖ в этой работе была почти экспоненциальной.Ранее мы сообщали, что из-за их сильного взаимодействия между Li + и TFSI — добавление литиевой соли LiTFSI в электролит привело к увеличению плотности (Tong et al., 2019). Между тем, для обычного катиона ([C 2 mim] + или [C 4 mim] + ) электролиты IL типа [TFSI] — имели более высокую плотность и вязкость, чем [FSI] — электролиты ИЖ типа . Эти результаты согласуются с исследованиями Gouveia et al., который доказал, что, когда ИЖ имеют общий катион, плотности связаны с числом более плотных атомов в анионах (плотность ИЖ тем выше, когда в анионах присутствуют более высокие доли атомов кислорода и / или фтора) (Gouveia et al. др., 2017). Однако для обычного аниона ([TFSI] — или [FSI] — ) плотность электролитов IL снижалась по мере увеличения длины боковой цепи, а вязкость имела обратную тенденцию. Кроме того, в зависимости от вязкости и концентрации соли лития вязкость электролитов IL типа [FSI] — изменяется медленно по сравнению с вязкостью электролитов типа [TFSI] —.
др., 2017). Однако для обычного аниона ([TFSI] — или [FSI] — ) плотность электролитов IL снижалась по мере увеличения длины боковой цепи, а вязкость имела обратную тенденцию. Кроме того, в зависимости от вязкости и концентрации соли лития вязкость электролитов IL типа [FSI] — изменяется медленно по сравнению с вязкостью электролитов типа [TFSI] —.
Транспортные свойства
Перенос ионов при моделировании МД обычно измеряется коэффициентом самодиффузии (D), который является функцией среднего квадратичного смещения (MSD), показанного в уравнении (1). Более высокое значение D в данный момент времени означает более быструю динамику диффузии.
D = 16limt → ∞ddt 〈∑i = 1N [ri⃗ (t) -ri⃗ (0)] 2〉 (1), где ri⃗ (t) указывает вектор положения центра масс i -го иона в момент времени t .
В данной работе рассчитывались МСД Li + , катиона и аниона ИЖ в электролитах от 2 до 6 нс.Затем наклон графиков MSD -t был линейно аппроксимирован, коэффициенты самодиффузии могли быть получены, как пример электролитов LiTFSI- [C 2 mim] [FSI] при четырех различных концентрациях при 298 К. (Рисунок 3). Когда концентрация соли лития увеличилась с 0,3 до 2 моль / л, D всех ионов показывал две поворотные точки: движение ионов быстро увеличивалось с 0,3 до 0,5 моль / л, а затем медленно падало, пока концентрация не превысила 1,5 моль / л. , затем снова увеличился после 1.5 моль / л. Кроме того, тенденция коэффициента самодиффузии была такой: катион D > анион D > DLi +, что согласуется с выводом Liu и Maginn (2013), в котором они указали, что маленький Li + имеет самый медленный коэффициент диффузии. из-за того, что Li + сильно взаимодействует с анионом ИЖ (подробности взаимодействия Li + и TFSI — обсуждаются в разделе «Структурный анализ»). Подробные сведения о результатах коэффициентов самодиффузии для всех электролитов ИЖ показаны в таблице S1.Что еще более важно, с точки зрения эксперимента, мы также получили ту же тенденцию с помощью измерения ЯМР, и результаты перечислены в таблице S2. Результаты экспериментов и моделирования различаются на несколько порядков из-за высокой степени поляризации электролита в данном исследовании.
(Рисунок 3). Когда концентрация соли лития увеличилась с 0,3 до 2 моль / л, D всех ионов показывал две поворотные точки: движение ионов быстро увеличивалось с 0,3 до 0,5 моль / л, а затем медленно падало, пока концентрация не превысила 1,5 моль / л. , затем снова увеличился после 1.5 моль / л. Кроме того, тенденция коэффициента самодиффузии была такой: катион D > анион D > DLi +, что согласуется с выводом Liu и Maginn (2013), в котором они указали, что маленький Li + имеет самый медленный коэффициент диффузии. из-за того, что Li + сильно взаимодействует с анионом ИЖ (подробности взаимодействия Li + и TFSI — обсуждаются в разделе «Структурный анализ»). Подробные сведения о результатах коэффициентов самодиффузии для всех электролитов ИЖ показаны в таблице S1.Что еще более важно, с точки зрения эксперимента, мы также получили ту же тенденцию с помощью измерения ЯМР, и результаты перечислены в таблице S2. Результаты экспериментов и моделирования различаются на несколько порядков из-за высокой степени поляризации электролита в данном исследовании. В настоящее время очень сложно использовать традиционное силовое поле для точного расчета этой системы. Следовательно, в будущей работе поляризуемое силовое поле может быть оптимизировано с учетом транспортных свойств.
В настоящее время очень сложно использовать традиционное силовое поле для точного расчета этой системы. Следовательно, в будущей работе поляризуемое силовое поле может быть оптимизировано с учетом транспортных свойств.
Рисунок 3 .Среднеквадратичное смещение (MSD) Li + , [C 2 mim] + и [FSI] — в зависимости от концентрации LiTFSI для LiTFSI- [C 2 mim] [FSI] на 298 К.
В заданный период времени число переноса ионов лития T Li , т. Е. Вклад в проводимость за счет переноса Li + , может быть аппроксимирован из D с помощью уравнения (Lesch et al., 2016 ; Chen et al., 2018):
. TLi = NLiDLi∑NiDi (2), где N i — количество ионов вида i , а D i — соответствующий коэффициент самодиффузии.Полученные числа переноса иона лития показаны в таблице 2.
Таблица 2 . Число переноса иона лития ( T Li ) для всех электролитов IL при четырех концентрациях LiTFSI.
Число переноса иона лития ( T Li ) для всех электролитов IL при четырех концентрациях LiTFSI.
Число переноса лития — одно из важнейших свойств литиевой батареи. Очевидно, что таблица 2 показывает, что переносимое число лития увеличивается с увеличением концентрации литиевой соли. Кроме того, число переноса ионов лития было примерно на 24% выше в электролите [C 2 mim] [TFSI], чем в электролите [C 2 mim] [FSI].Между тем, в электролитах [C 4 mim] [TFSI] на 14% выше, чем в [C 4 mim] [FSI] для всех концентраций соли лития. Следовательно, динамика иона лития в системах типа [TFSI] — относительно быстрее при той же длине боковой цепи системы электролитов IL. Это явление в основном связано с различным взаимодействием между Li + и [TFSI] — ИЖ.
Структурный анализ
Функция радиального распределения (RDF) (Méndez-Morales et al., 2013) — мощный метод исследования взаимосвязи между структурой и физико-химическими свойствами на микромасштабе. Поэтому в данной работе исследовалась ФРР центра масс ионов:
Поэтому в данной работе исследовалась ФРР центра масс ионов:
, где N — количество частиц, ρ — числовая плотность, а r ij — пространственное расстояние между частицами i и j .
Координационный номер ( N ) (Lourenço et al., 2018) является функцией RDF, как показано в уравнении (4). Число частиц j , окружающих частицу i в ее первой сольватной оболочке, описывается координационным числом N ( i — j ) ,
N (i-j) = 4πρj∫0r′gij (r) r2dr, (4), где r ′ — первый минимум на графике g, (r), r — расстояние, а ρ j — плотность частицы j .
Время пребывания (τ) отражает степень сольватации ИЖ, которая определяется интегрированием автокорреляционной функции (АКФ). Время пребывания катиона и аниона ИЖ в первой координационной оболочке Li + можно рассчитать по уравнению (5):
τi = ∫0∞ACF (t) ACF (t) = 〈Bij (t) Bij (0)〉 〈Bij (0) Bij (0)〉, (5), где B ij = 1, если ионы i и j находятся внутри первой координационной оболочки друг друга; в противном случае B ij = 0.
Как упоминалось в наших предыдущих исследованиях, в электролитах ИЖ наблюдался анионный движущий эффект, т.е. ионы лития в основном взаимодействовали с анионами ИЖ в растворе электролита (Tong et al., 2019). Поэтому в этом разделе, как показано на рисунке 4, мы изучали влияние концентрации четырех литиевых солей на структуру и взаимодействие ионов Li с анионами в ИЖ по функции радиального распределения, координационному числу, времени пребывания, тенденции ассоциации ионов и сольватации. эффект.
Рисунок 4 .Функция радиального распределения иона Li и аниона (A) [C 2 mim] [TFSI], (B) [C 2 mim] [FSI], (C) [C 4 мим] [TFSI] и (D) [C 4 мим] [FSI] при четырех концентрациях литиевой соли LiTFSI при 298 К.
Координационная структура
Как показано на рисунке 4, исследовали RDF между ионами лития и анионами ИЖ в четырех типах электролитов ИЖ при всех концентрациях LiTFSI. Очевидно, что при увеличении концентрации лития взаимодействие между ионом лития и анионом ослабевает.Что еще более важно, для той же боковой цепи структура электролитов IL типа [TFSI] — резко изменилась с концентрацией соли лития по сравнению с таковой электролитов IL типа [FSI] — (рисунки 4A, B). , что отражает более медленное изменение вязкости систем типа [FSI] —, как упомянуто выше. Кроме того, взаимодействия для более длинной боковой цепи катиона ([C 4 mim] + ) были намного сильнее для электролитов IL типа [FSI] — (Рисунки 4B, D), что указывает на то, почему [C 4 мим] [FSI] имеет более высокую вязкость, чем [C 2 мим] [FSI].Однако для электролитов типа [TFSI] — взаимодействие между Li + и анионом [C 4 mim] [TFSI] было усилено по сравнению с взаимодействием [C 2 mim] [TFSI] когда концентрация LiTFSI была <1,5 моль / л. Однако при высокой концентрации (1,5–2 моль / л) они были практически одинаковыми.
Очевидно, что при увеличении концентрации лития взаимодействие между ионом лития и анионом ослабевает.Что еще более важно, для той же боковой цепи структура электролитов IL типа [TFSI] — резко изменилась с концентрацией соли лития по сравнению с таковой электролитов IL типа [FSI] — (рисунки 4A, B). , что отражает более медленное изменение вязкости систем типа [FSI] —, как упомянуто выше. Кроме того, взаимодействия для более длинной боковой цепи катиона ([C 4 mim] + ) были намного сильнее для электролитов IL типа [FSI] — (Рисунки 4B, D), что указывает на то, почему [C 4 мим] [FSI] имеет более высокую вязкость, чем [C 2 мим] [FSI].Однако для электролитов типа [TFSI] — взаимодействие между Li + и анионом [C 4 mim] [TFSI] было усилено по сравнению с взаимодействием [C 2 mim] [TFSI] когда концентрация LiTFSI была <1,5 моль / л. Однако при высокой концентрации (1,5–2 моль / л) они были практически одинаковыми. Это свидетельствует о влиянии катионов ИЖ на основе имидазола на взаимодействие анионов с ионами лития при низкой концентрации соли лития. Однако влияние катионов постепенно уменьшалось по мере увеличения концентрации LiTFSI.Кроме того, результаты нашего моделирования показали, что анион Li + имел структуру с двумя пиками между 2,8 и 5,0 Å независимо от типа ИЖ. Между тем первый пик был намного выше второго. Это указывает на то, что существует сильная координация между Li + и анионом в системе электролита, и на структуру стабильности первого пика меньше влияет тип ИЖ. Что еще более важно, как показано на рисунке 4A, две возможные координации аниона и иона лития были подтверждены структурой с двумя пиками, в которой первый пик представлял бидентатную координацию Li + и аниона (TFSI — или FSI — ), а второй — монодентатная координация.К таким же выводам пришли Lesch et al. (2016). Кроме того, после первичного пика при 2,8 Å, мы также наблюдали два вторичных пика RDF при 3,5 и 4,2 Å.
Это свидетельствует о влиянии катионов ИЖ на основе имидазола на взаимодействие анионов с ионами лития при низкой концентрации соли лития. Однако влияние катионов постепенно уменьшалось по мере увеличения концентрации LiTFSI.Кроме того, результаты нашего моделирования показали, что анион Li + имел структуру с двумя пиками между 2,8 и 5,0 Å независимо от типа ИЖ. Между тем первый пик был намного выше второго. Это указывает на то, что существует сильная координация между Li + и анионом в системе электролита, и на структуру стабильности первого пика меньше влияет тип ИЖ. Что еще более важно, как показано на рисунке 4A, две возможные координации аниона и иона лития были подтверждены структурой с двумя пиками, в которой первый пик представлял бидентатную координацию Li + и аниона (TFSI — или FSI — ), а второй — монодентатная координация.К таким же выводам пришли Lesch et al. (2016). Кроме того, после первичного пика при 2,8 Å, мы также наблюдали два вторичных пика RDF при 3,5 и 4,2 Å. Согласно нашим предыдущим исследованиям, основной причиной появления двух вторичных пиков была цис-трансформная структура аниона, где цис-FSI в основном появлялся в положении пика 3,5 Å, в то время как транс-FSI в основном появлялся при 4,2 Å (рис. 4B). .
Согласно нашим предыдущим исследованиям, основной причиной появления двух вторичных пиков была цис-трансформная структура аниона, где цис-FSI в основном появлялся в положении пика 3,5 Å, в то время как транс-FSI в основном появлялся при 4,2 Å (рис. 4B). .
Для дальнейшего изучения влияния концентрации литиевой соли на ионную ассоциацию для электролитов ИЖ в данном исследовании была проанализирована координация иона лития и аниона ИЖ.Один пример того, где координационное число каждой системы Li + -O (FSI) и Li + -N (FSI) для системы LiTFSI- [C 2 mim] [FSI], приведено на рисунке 5. В нашем примере В предыдущей работе мы доказали, что ионы лития в основном координируются с атомами кислорода анионов в ИЖ. Таким образом, сумма координационных чисел Li + -O (FSI) была вычислена, когда концентрация LiTFSI составляла 0,3 моль / л, N (Li-O) составляла 5,8; однако оно было уменьшено до N (Li-O) = 3,42 в системе 2,0 моль / л LiTFSI- [C 2 мим] [FSI]. Наша гипотеза о причине заключалась в том, что ионный кластер, то есть [Li [FSI] 3 ] 2-, был сформирован в электролитах, что было подтверждено на снимках МД в этой работе и показано на рисунке 6. Как упоминалось выше ион лития был расположен в центре трех анионов, когда концентрация LiTFSI была низкой, из-за бидентатной координации для Li- [FSI] — . Когда концентрация LiTFSI увеличивалась, ион лития и атом кислорода постепенно склонялся к монодентатной координации.Однако структура ионного кластера всегда состояла из трех анионов и одного иона лития, что согласуется с колебательным спектроскопическим анализом Lassègues et al. (2009). Координационное число ионов лития и атомов кислорода для других электролитов ИЖ также было рассчитано и приведено в таблице S3. Между тем, ионный кластер [Li [TFSI] 3 ] — был обнаружен в других системах LiTFSI-IL, и такой же вывод был также продемонстрирован Monteiro et al. (2008).
Наша гипотеза о причине заключалась в том, что ионный кластер, то есть [Li [FSI] 3 ] 2-, был сформирован в электролитах, что было подтверждено на снимках МД в этой работе и показано на рисунке 6. Как упоминалось выше ион лития был расположен в центре трех анионов, когда концентрация LiTFSI была низкой, из-за бидентатной координации для Li- [FSI] — . Когда концентрация LiTFSI увеличивалась, ион лития и атом кислорода постепенно склонялся к монодентатной координации.Однако структура ионного кластера всегда состояла из трех анионов и одного иона лития, что согласуется с колебательным спектроскопическим анализом Lassègues et al. (2009). Координационное число ионов лития и атомов кислорода для других электролитов ИЖ также было рассчитано и приведено в таблице S3. Между тем, ионный кластер [Li [TFSI] 3 ] — был обнаружен в других системах LiTFSI-IL, и такой же вывод был также продемонстрирован Monteiro et al. (2008).
Рисунок 5 . Координационный номер между участком ( N ) Li + -O (FSI — ) и Li + -N (FSI — ) для LiTFSI- [C 2 mim] [FSI] электролитная система (A) в 0,3 моль / л LiTFSI (B) в четырех различных концентрациях литиевой соли.
Координационный номер между участком ( N ) Li + -O (FSI — ) и Li + -N (FSI — ) для LiTFSI- [C 2 mim] [FSI] электролитная система (A) в 0,3 моль / л LiTFSI (B) в четырех различных концентрациях литиевой соли.
Рис. 6. (A) Снимки четырех различных концентраций лития в системе LiTFSI- [C 2 mim] [FSI] от MD (синий представляет ионные жидкости, розовый представляет соли лития). (B) Конфигурации [Li [FSI] 3 ] 2- были случайным образом захвачены при 0,3 и 2 моль / л для системы электролита LiTFSI- [C 2 mim] [FSI] соответственно.
Время пребывания
Время пребывания катиона и аниона ИЖ в первой координационной оболочке Li + является одним из наиболее важных свойств десорбционной сольватационной оболочки в литий-ионной батарее. Его можно рассчитать по уравнению (5) и показать в таблице 3. Очевидно, что увеличение концентрации LiTFSI привело к увеличению времени пребывания всех электролитов ИЖ. Как упоминалось выше, увеличение концентрации соли лития привело к более замкнутой и компактной координационной структуре. Следовательно, должна существовать закрытая координационная оболочка из-за большего времени пребывания. Кроме того, времена пребывания в электролитных системах на основе [C 2 mim] + были ниже, чем в системах на основе [C 4 mim] + .В основном это связано с различными взаимодействиями [C 2 mim] + и [C 4 mim] + с Li. Что еще более важно, сильная корреляция / связь между временем пребывания и подвижностью Li + была доказана Li et al. (2015). Следовательно, это основная причина увеличения числа переноса ионов лития с увеличением концентрации LiTFSI.
Очевидно, что увеличение концентрации LiTFSI привело к увеличению времени пребывания всех электролитов ИЖ. Как упоминалось выше, увеличение концентрации соли лития привело к более замкнутой и компактной координационной структуре. Следовательно, должна существовать закрытая координационная оболочка из-за большего времени пребывания. Кроме того, времена пребывания в электролитных системах на основе [C 2 mim] + были ниже, чем в системах на основе [C 4 mim] + .В основном это связано с различными взаимодействиями [C 2 mim] + и [C 4 mim] + с Li. Что еще более важно, сильная корреляция / связь между временем пребывания и подвижностью Li + была доказана Li et al. (2015). Следовательно, это основная причина увеличения числа переноса ионов лития с увеличением концентрации LiTFSI.
Таблица 3 . Время пребывания (нс) катиона и аниона для всех ИЖ в первой координационной оболочке Li + .
Выводы
ИЖ используются в качестве электролитов в устройствах накопления энергии благодаря своим уникальным характеристикам, тем самым повышая безопасность и емкость литий-ионных аккумуляторов. В этой работе мы рассмотрели развитие и направления исследований электролитов IL и прояснили большие возможности электролитов IL. Комбинируя атомистическое моделирование МД и эксперименты с фундаментальными физическими свойствами, мы исследовали влияние концентрации лития на характеристики электролита в четырех растворителях ИЖ ([C n mim] [TFSI] и [C n mim] [ FSI], n = 2, 4).
Сначала были рассчитаны и измерены физико-химические свойства всех электролитов-растворителей ИЖ. Результаты моделирования показали, что плотность и вязкость увеличиваются с увеличением концентрации LiTFSI для всех электролитов LiTFSI-IL. Как показано в результатах моделирования, по мере увеличения концентрации LiTFSI были обнаружены более высокие значения плотности и вязкости электролитов LiTFSI-IL. Точка поворота коэффициента самодиффузии указывает на то, что миграция ионов в электролитах ИЖ нелинейна с концентрацией.Следовательно, изучение экстремальных значений концентрации электролита в окружающей среде имеет решающее значение для улучшения миграции ионов лития и улучшения характеристик батареи. Позднее мы исследовали влияние концентрации соли лития на ионные ассоциации ионов Li + и ИЖ, оценивая функцию радиального распределения и координационное число ионов. Для всех электролитов IL наблюдалась сильная координация между Li + и анионом IL, бидентатная и монодентатная координация в положениях между 2.8 и 5,0 Å соответственно. Между тем, цис- и транс-изомерия [FSI] — наблюдалась вблизи Li + в положениях 3,5 и 4,2 Å. Кроме того, ионный кластер [Li [анион] 3 ] 2- в электролитах ИЖ был обнаружен путем анализа координации иона лития и аниона ИЖ. Кроме того, вычисляя время пребывания катиона и аниона ИЖ в первой координационной оболочке иона лития, мы видим, что увеличение концентрации LiTFSI приводит к более замкнутой и компактной координационной структуре и что существует сильная корреляция / связь между временем пребывания продемонстрирована подвижность Li + .
Точка поворота коэффициента самодиффузии указывает на то, что миграция ионов в электролитах ИЖ нелинейна с концентрацией.Следовательно, изучение экстремальных значений концентрации электролита в окружающей среде имеет решающее значение для улучшения миграции ионов лития и улучшения характеристик батареи. Позднее мы исследовали влияние концентрации соли лития на ионные ассоциации ионов Li + и ИЖ, оценивая функцию радиального распределения и координационное число ионов. Для всех электролитов IL наблюдалась сильная координация между Li + и анионом IL, бидентатная и монодентатная координация в положениях между 2.8 и 5,0 Å соответственно. Между тем, цис- и транс-изомерия [FSI] — наблюдалась вблизи Li + в положениях 3,5 и 4,2 Å. Кроме того, ионный кластер [Li [анион] 3 ] 2- в электролитах ИЖ был обнаружен путем анализа координации иона лития и аниона ИЖ. Кроме того, вычисляя время пребывания катиона и аниона ИЖ в первой координационной оболочке иона лития, мы видим, что увеличение концентрации LiTFSI приводит к более замкнутой и компактной координационной структуре и что существует сильная корреляция / связь между временем пребывания продемонстрирована подвижность Li + .
Заявление о доступности данных
Все наборы данных, созданные для этого исследования, включены в статью / дополнительные материалы.
Авторские взносы
JT участвовал в разработке исследования, выполнил моделирование электролитов и написал рукопись. SW внесла свой вклад в экспериментальные исследования. Все авторы участвовали в редактировании рукописи, прочитали и одобрили представленную версию.
Финансирование
Эта работа была поддержана Департаментом химической и биохимической инженерии Датского технического университета; Пекинский фонд естественных наук (2192052), Общая программа Национального фонда естественных наук Китая (21878295, 21978291) и Основная программа Национального фонда естественных наук Китая (218).
Конфликт интересов
Авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Дополнительные материалы
Дополнительные материалы к этой статье можно найти в Интернете по адресу: https://www.frontiersin.org/articles/10.3389/fchem.2019.00945/full#supplementary-material
Список литературы
Bayly, C. I., Cieplak, P., Cornell, W.Д. и Коллман П. А. (1993). Метод с хорошим поведением, основанный на электростатическом потенциале, с использованием ограничений заряда для получения атомных зарядов: модель RESP. J. Phys. Chem. 97, 10269–10280. DOI: 10.1021 / j100142a004
CrossRef Полный текст | Google Scholar
Бородин, О., Смит, Г. Д., Хендерсон, В. (2006). Катионное окружение Li +, транспорт и механические свойства N-метил-N-алкилпирролидиния + TFSI-ионных жидкостей, легированных LiTFSI. J. Phys. Chem. B 110, 16879–16886.DOI: 10.1021 / jp061930t
CrossRef Полный текст | Google Scholar
Chagnes, A., Diaw, M., Carré, B., Willmann, P., and Lemordant, D. (2005). Смеси имидазолия и органических растворителей в качестве электролитов для литиевых батарей. J. Источники энергии 145, 82–88. DOI: 10.1016 / j.jpowsour.2004.12.035
J. Источники энергии 145, 82–88. DOI: 10.1016 / j.jpowsour.2004.12.035
CrossRef Полный текст | Google Scholar
Чен Ф., Хоулетт П. и Форсайт М. (2018). Na-ионная сольватация и высокое число переноса в суперконцентрированных ионных жидких электролитах: теоретический подход. J. Phys. Chem. С 122, 105–114. DOI: 10.1021 / acs.jpcc.7b09322
CrossRef Полный текст | Google Scholar
Галински М., Левандовски А. и Степняк И. (2006). Ионные жидкости как электролиты. Электрохим. Acta 51, 5567–5580. DOI: 10.1016 / j.electacta.2006.03.016
CrossRef Полный текст | Google Scholar
Гарсия, Б., Лавалле, С., Перрон, Г., Мишо, К., и Арман, М. (2004). Расплавленные соли при комнатной температуре в качестве электролита литиевой батареи. Электрохим. Acta 49, 4583–4588. DOI: 10.1016 / j.electacta.2004.04.041
CrossRef Полный текст | Google Scholar
Гуденаф, Дж. Б., и Ким, Ю. (2011). Проблемы аккумуляторных батарей. J. Источники энергии 196, 6688–6694. DOI: 10.1016 / j.jpowsour.2010.11.074
J. Источники энергии 196, 6688–6694. DOI: 10.1016 / j.jpowsour.2010.11.074
CrossRef Полный текст | Google Scholar
Гувейя А.С.Л., Бернардес С.Э.С., Томе Л.С., Лозинская Е.И., Выгодский Ю.С., Шаплов А.С. и др. (2017). Ионные жидкости с анионами на основе фторсульфонильных производных: от асимметричных замещений к модели согласованного силового поля. Phys. Chem. Chem. Phys. 19, 29617–29624. DOI: 10.1039 / C7CP06081E
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Исикава, М., Сугимото, Т., Кикута, М., Исико, Э. и Коно, М. (2006). Чистые ионные жидкие электролиты, совместимые с графитированным углеродным отрицательным электродом в перезаряжаемых литий-ионных батареях. J. Источники энергии 162, 658–662. DOI: 10.1016 / j.jpowsour.2006.02.077
CrossRef Полный текст | Google Scholar
Ким, Дж.Г., Сон, Б., Мукерджи, С., Шупперт, Н., Бейтс, А., Квон, О. и др. (2015). Обзор твердотельных батарей на литиевой и нелитиевой основе. J. Источники энергии 282, 299–322. DOI: 10.1016 / j.jpowsour.2015.02.054
J. Источники энергии 282, 299–322. DOI: 10.1016 / j.jpowsour.2015.02.054
CrossRef Полный текст | Google Scholar
Ким, Дж. К., Черувалли, Г., Ли, X., Ан, Дж. Х., Ким, К. В., и Ан, Х. Дж. (2008). Приготовление и электрохимическая характеристика электропряденых, микропористых мембранных композитных полимерных электролитов для литиевых батарей. J. Источники энергии 178, 815–820. DOI: 10.1016 / j.jpowsour.2007.08.063
CrossRef Полный текст | Google Scholar
Lassègues, J. C., Grondin, J., Aupetit, C., and Johansson, P. (2009). Спектроскопическая идентификация частиц, переносящих ион лития, в ионных жидкостях, легированных LiTFSI. J. Phys. Chem. А 113, 305–314. DOI: 10.1021 / jp806124w
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Леш В., Ли З., Бедров Д., Бородин, О., Хойер, А. (2016). Влияние катионов на координацию и перенос ионов лития в ионных жидких электролитах: исследование методом МД.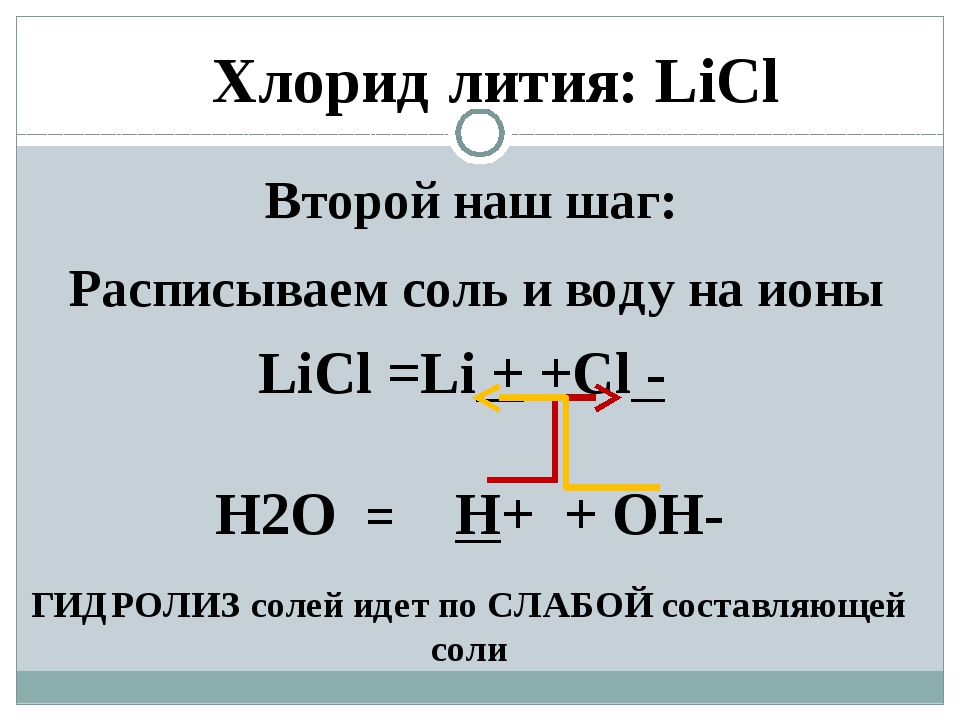 Phys. Chem. Chem. Phys. 18, 382–392. DOI: 10.1039 / C5CP05111H
Phys. Chem. Chem. Phys. 18, 382–392. DOI: 10.1039 / C5CP05111H
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Левандовски А., Свидерска-Мочек А. (2009). Ионные жидкости как электролиты для литий-ионных аккумуляторов — обзор электрохимических исследований. J. Источники энергии 194, 601–609.DOI: 10.1016 / j.jpowsour.2009.06.089
CrossRef Полный текст | Google Scholar
Ли З., Бородин О., Смит Г. Д., Бедров Д. (2015). Влияние органических растворителей на сольватацию и перенос ионов Li + в ионных жидких электролитах: исследование с помощью моделирования молекулярной динамики. J. Phys. Chem. B 119, 3085–3096. DOI: 10.1021 / jp510644k
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лю Х., Магинн Э. (2013). Влияние ионной структуры на проводимость в ионных жидких электролитах, легированных литием: исследование молекулярной динамики. J. Chem. Phys. 139: 114508. DOI: 10. 1063 / 1.4821155
1063 / 1.4821155
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лю З., Хуанг С. и Ван В. (2004). Уточненное силовое поле для молекулярного моделирования ионных жидкостей на основе имидазолия. J. Phys. Chem. B 108, 12978–12989. DOI: 10.1021 / jp048369o
CrossRef Полный текст | Google Scholar
Лоренсу, Т. К., Чжан, Ю., Коста, Л. Т., и Магинн, Э. Дж. (2018). Исследование молекулярной динамики литийсодержащих апротонных гетероциклических ионных жидких электролитов. J. Chem. Phys. 148: 193834. DOI: 10.1063 / 1.5016276
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ма, З., Форсайт, М., Макфарлейн, Д. Р., и Кар, М. (2019). Ионная жидкость / тетраглимный гибридный Mg [TFSI] 2 электролит для перезаряжаемых Mg батарей. Green Energy Environ. 4, 146–153. DOI: 10.1016 / j.gee.2018.10.003
CrossRef Полный текст | Google Scholar
Мартинес, Л., Андраде, Р., Биргин, Э. Г., и Мартинес, Х. М. (2009). PACKMOL: пакет для создания начальных конфигураций. Softw. Обновление новостей. 30, 2157–2164. DOI: 10.1002 / jcc.21224
М. (2009). PACKMOL: пакет для создания начальных конфигураций. Softw. Обновление новостей. 30, 2157–2164. DOI: 10.1002 / jcc.21224
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мендес-Моралес, Т., Каррете, Дж., Бусон-Капело, С., Перес-Родригес, М., Кабеса, О., Гальего, Л. Дж. И др. (2013). МД-моделирование образования стабильных кластеров в смесях щелочных солей и ионных жидкостей на основе имидазолия. J. Phys. Chem. B 117, 3207–3220.DOI: 10.1021 / jp312669r
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Монтейро, М. Дж., Базито, Ф. Ф. К., Сикейра, Л. Дж. А., Рибейро, М. К. С. и Торрези, Р. М. (2008). Коэффициенты переноса, рамановская спектроскопия и компьютерное моделирование растворов солей лития в ионной жидкости. J. Phys. Chem. В 40, 2102–2109. DOI: 10.1021 / jp077026y
CrossRef Полный текст | Google Scholar
Цянь, Дж., Хендерсон, В. А., Сюй, В., Бхаттачарья, П., Энгельгард М. , Бородин О. и др. (2015). Высокая скорость и стабильная работа анода из металлического лития. Нат. Commun. 6: 6362. DOI: 10.1038 / ncomms7362
, Бородин О. и др. (2015). Высокая скорость и стабильная работа анода из металлического лития. Нат. Commun. 6: 6362. DOI: 10.1038 / ncomms7362
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рей-Кастро, К., Вега, Л. Ф. (2006). Транспортные свойства ионной жидкости хлорида 1-этил-3-метилимидазолия по данным равновесного молекулярно-динамического моделирования. влияние температуры. J. Phys. Chem. B 110, 14426–14435. DOI: 10.1021 / jp062885s
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сакаэбе, Х., и Мацумото, Х. (2003). N-метил-N-пропилпиперидини бис (трифторметансульфонил) имид (PP13-TFSI) — новая электролитная основа для литиевых аккумуляторов. Electrochem. Commun. 5, 594–598. DOI: 10.1016 / S1388-2481 (03) 00137-1
CrossRef Полный текст | Google Scholar
Саланн, М. (2015). Моделирование ионных жидкостей при комнатной температуре: от поляризуемых до крупнозернистых силовых полей. Phys. Chem. Chem. Phys. 17, 14270–14279. DOI: 10.1039 / C4CP05550K
Phys. Chem. Chem. Phys. 17, 14270–14279. DOI: 10.1039 / C4CP05550K
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шмольнгрубер, М., Леш В., Шредер К., Хойер А. и Штайнхаузер О. (2015). Сравнение наведенных точечных диполей и осцилляторов Друде. Phys. Chem. Chem. Phys. 17, 14297–14306. DOI: 10.1039 / C4CP04512B
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Скросати, Б., и Гарче, Дж. (2010). Литиевые батареи: состояние, перспективы и будущее. J. Источники энергии 195, 2419–2243. DOI: 10.1016 / j.jpowsour.2009.11.048
CrossRef Полный текст | Google Scholar
Шираи, А., Фудзи, К., Секи, С., Умэбаяси, Ю., Исигуро, С. И., Икеда, Ю. (2008). Сольватация иона лития в бис (трифторметансульфонил) амиде N, N-диэтил-N-метил-N- (2-метоксиэтил) аммония с использованием рамановской и многоядерной ЯМР-спектроскопии. Анал. Sci. 24, 1291–1296. DOI: 10.2116 / analsci.24.1291
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сугимото, Т. , Ацуми, Ю., Коно, М., Кикута, М., Исико, Э., Ямагата, М., и др. (2010). Применение ионного жидкого электролита на основе бис (фторсульфонил) имида для кремний-никель-углеродного композитного анода для литий-ионных аккумуляторов. J. Источники энергии 195, 6153–6156. DOI: 10.1016 / j.jpowsour.2010.01.011
, Ацуми, Ю., Коно, М., Кикута, М., Исико, Э., Ямагата, М., и др. (2010). Применение ионного жидкого электролита на основе бис (фторсульфонил) имида для кремний-никель-углеродного композитного анода для литий-ионных аккумуляторов. J. Источники энергии 195, 6153–6156. DOI: 10.1016 / j.jpowsour.2010.01.011
CrossRef Полный текст | Google Scholar
Тонг, Дж., Сяо, X., Лян, X., фон Сольмс, Н., Хо, Ф., Хе, Х. и др. (2019). Понимание сольватации и динамического поведения соли лития в электролитах на основе органических и ионных жидкостей. Phys. Chem. Chem. Phys. 35, 19216–19225. DOI: 10.1039 / C9CP01848D
CrossRef Полный текст | Google Scholar
Умэбаяси, Ю., Ямагути, Т., Фукуда, С., Мицуги, Т., Такеучи, М., Фуджи, К. и др. (2008). Рамановское спектроскопическое исследование сольватации ионов щелочного металла в ионной жидкости 1-бутил-3-метилимидазолий бис (трифторметансульфонил) амид. Анал. Sci. 24, 1297–1304. DOI: 10.2116 / analsci. 24.1297
24.1297
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ван дер Споэль, Д., Линдал, Э., Гесс, Б., Гроенхоф, Г., Марк, А. Э. и Берендсен, Х. Дж. С. (2005). GROMACS: быстро, гибко и бесплатно. J. Comput. Chem. 26, 1701–1718. DOI: 10.1002 / jcc.20291
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ван Дж., Вольф Р. М., Колдуэлл Дж. У., Коллман П. А. и Кейс Д. А. (2004). Разработка и тестирование общего силового поля Янтаря. J. Comput. Chem. 25, 1157–1174. DOI: 10.1002 / jcc.20035
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Wu, X., Pan, K., Jia, M., Ren, Y., He, H., Zhang, L., et al.(2019). Электролит для защиты лития: от жидкого до твердого. Green Energy Environ. 4, 360–374. DOI: 10.1016 / j.gee.2019.05.003
CrossRef Полный текст | Google Scholar
Ямада, Ю., Фурукава, К., Содеяма, К., Кикучи, К., Яэгаши, М., Татэяма, Ю., и др. (2014). Необычная стабильность суперконцентрированных электролитов на основе ацетонитрила для быстро заряжаемых литий-ионных аккумуляторов. J. Am. Chem. Soc. 136, 5039–5046. DOI: 10.1021 / ja412807w
J. Am. Chem. Soc. 136, 5039–5046. DOI: 10.1021 / ja412807w
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ямада, Ю., Яэгаши, М., Абэ, Т., и Ямада, А. (2013). Сверхконцентрированный эфирный электролит для быстрой зарядки литий-ионных аккумуляторов. Chem. Commun. 49, 11194–11196. DOI: 10.1039 / c3cc46665e
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ямада, Ю., Ямада, А. (2015). Обзор-суперконцентрированные электролиты для литиевых аккумуляторов. J. Electrochem. Soc. 162, 2406–2423. DOI: 10.1149 / 2.0041514jes
CrossRef Полный текст | Google Scholar
Чжан, Х., Чжу, М., Чжао, В., Ли, С., и Фэн, Г. (2018). Молекулярно-динамическое исследование ионных жидкостей при комнатной температуре с водой на поверхности слюды. Green Energy Environ. 3, 120–128. DOI: 10.1016 / j.gee.2017.11.002
CrossRef Полный текст | Google Scholar
Чжан, З. X., Чжоу, Х. Ю., Ян, Л. , Тачибана, К., Камидзима, К., и Сюй, Дж. (2008). Асимметричные дикатионные ионные жидкости на основе имидазолия и алифатического аммония в качестве потенциальных электролитных добавок, применяемых для литиевых вторичных батарей. Электрохим. Acta 53, 4833–4838. DOI: 10.1016 / j.electacta.2008.02.008
, Тачибана, К., Камидзима, К., и Сюй, Дж. (2008). Асимметричные дикатионные ионные жидкости на основе имидазолия и алифатического аммония в качестве потенциальных электролитных добавок, применяемых для литиевых вторичных батарей. Электрохим. Acta 53, 4833–4838. DOI: 10.1016 / j.electacta.2008.02.008
CrossRef Полный текст | Google Scholar
Уровни, признаки и симптомы, причины и лечение
Что такое токсичность лития?
Литиевая токсичность — это еще один термин, обозначающий передозировку литием. Это происходит, когда вы принимаете слишком много лития, лекарства, стабилизирующего настроение, которое используется для лечения биполярного расстройства и большого депрессивного расстройства. Литий помогает уменьшить эпизоды мании и снижает риск самоубийства у людей с этими состояниями.
Правильная дозировка лития варьируется от человека к человеку, но большинству людей назначают от 900 миллиграммов (мг) до 1200 мг в день в разделенных дозах. Некоторые люди принимают более 1200 мг в день, особенно во время острых приступов. Другие могут быть более чувствительны к более низким дозам.
Другие могут быть более чувствительны к более низким дозам.
Безопасный уровень лития в крови составляет 0,6 и 1,2 миллиэквивалента на литр (мэкв / л). Отравление литием может произойти, когда этот уровень достигает 1,5 мг-экв / л или выше. Тяжелая токсичность лития встречается на уровне 2.0 мэкв / л и выше, что в редких случаях может быть опасным для жизни. Уровни 3,0 мг-экв / л и выше считаются неотложной медицинской помощью.
Людям, принимающим литий, необходимо внимательно следить за тем, сколько и когда они его принимают. Легко случайно передозировать литий, приняв дополнительную таблетку, смешав ее с другими лекарствами или не выпив достаточного количества воды. Например, в 2014 году в США было зарегистрировано 6850 случаев отравления литием.
Симптомы отравления литием и их тяжесть зависят от того, сколько лития содержится в вашей крови.
Токсичность от легкой до умеренной
Симптомы от легкой до умеренной токсичности лития включают:
Тяжелая токсичность
Сывороточные уровни лития выше 2,0 мЭкв / л могут вызывать тяжелую токсичность и дополнительные симптомы, в том числе:
Побочные эффекты при более низких дозах
Имейте в виду, что литий также может вызывать побочные эффекты при приеме в более низких дозах. Сообщите своему врачу, если вы принимаете литий и заметите какие-либо из следующих побочных эффектов:
Сообщите своему врачу, если вы принимаете литий и заметите какие-либо из следующих побочных эффектов:
Эти побочные эффекты могут возникнуть при приеме низких доз лития и не означают, что у вас токсичность лития.Однако они могут быть признаком того, что вам нужно изменить дозировку или нужно более частое наблюдение.
Отравление литием обычно вызвано приемом лития, превышающего предписанную дозу, сразу или медленно в течение длительного периода времени.
Существует три основных типа токсичности лития, каждый из которых имеет разные причины:
ВСТАВЬТЕ ФОРМАТ ДЛИННОГО СПИСКА:
- Острая токсичность. Это происходит, когда вы принимаете слишком много лития сразу, случайно или намеренно.
- Хроническая токсичность. Это случается, когда вы принимаете слишком много лития ежедневно в течение длительного периода времени. Обезвоживание, прием других лекарств и другие состояния, включая проблемы с почками, могут повлиять на то, как ваше тело обрабатывает литий.
 Со временем эти факторы могут вызвать медленное накопление лития в организме.
Со временем эти факторы могут вызвать медленное накопление лития в организме. - Острая хроническая токсичность. Это может произойти, если вы принимаете литий каждый день в течение длительного периода времени, а затем внезапно однажды случайно или намеренно примете дополнительную таблетку.
Если вы считаете, что кто-то подвергается непосредственному риску членовредительства, передозировки или причинения вреда другому человеку:
- Позвоните 911 или по номеру местной службы экстренной помощи.
- Оставайтесь с человеком, пока не прибудет помощь.
- Уберите все пистолеты, ножи, лекарства и другие предметы, которые могут причинить вред.
- Слушайте, но не осуждайте, не спорите, не угрожайте и не кричите.
Если вы или кто-то из ваших знакомых подумываете о самоубийстве, обратитесь за помощью по горячей линии по предотвращению самоубийств или кризисным ситуациям.Воспользуйтесь услугами Национальной линии по предотвращению самоубийств по телефону 800-273-8255.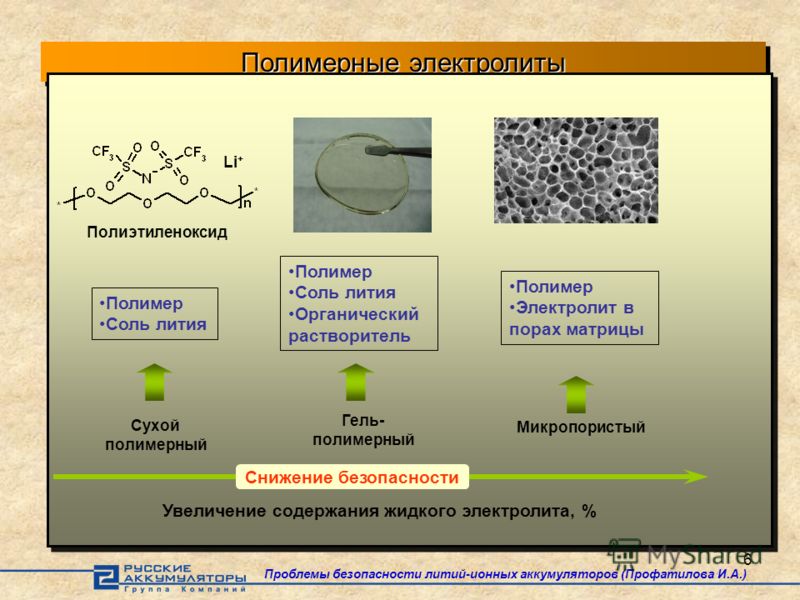
Чувствительность и взаимодействие с литием
Некоторые люди более чувствительны к литию и могут испытывать симптомы отравления литием на более низких уровнях, чем другие. Это особенно актуально для пожилых людей или людей с обезвоживанием. Это также более вероятно у людей с проблемами сердечно-сосудистой системы и почек.
Некоторые продукты и напитки также могут влиять на концентрацию лития в организме. Лучше не изменять следующие параметры без наблюдения врача:
ВСТАВИТЬ ФОРМАТ ДЛИННОГО СПИСКА:
- Потребление соли. Меньшее количество соли может повысить уровень лития, а увеличение потребления соли может привести к его снижению.
- Потребление кофеина. Кофеин, содержащийся в кофе, чае и безалкогольных напитках, может влиять на уровень лития. Меньшее количество кофеина может привести к повышению уровня лития, а большее — к его снижению.
- Избегайте алкоголя. Алкогольные напитки могут отрицательно влиять на многие лекарства.

Кроме того, прием лития с другими лекарствами также может увеличить риск отравления литием.Если вы принимаете литий, обязательно поговорите со своим врачом перед использованием:
Легкую токсичность лития часто трудно диагностировать, поскольку ее симптомы аналогичны симптомам многих других состояний. Ваш врач, скорее всего, начнет с того, что задаст вам несколько вопросов о том, сколько лития вы принимаете, а также о том, как часто вы его принимаете.
Обязательно сообщите врачу обо всех своих симптомах, недавних заболеваниях и о том, принимаете ли вы какие-либо другие лекарства, включая витамины, добавки и даже чай.
Они также могут использовать один или комбинацию следующих тестов:
- электрокардиограмма для проверки аномального сердцебиения
- химический анализ крови для проверки вашего метаболизма и уровня электролитов
- анализ крови или мочи для определения вашего уровни лития в сыворотке
- анализ крови для проверки функции почек
Если вы принимаете литий и испытываете какие-либо симптомы отравления литием, немедленно обратитесь за лечением или позвоните на горячую линию Центра контроля за отравлениями по телефону 1-800-222-1222 для получения инструкций о том, что делать.
Специфического противоядия от токсичности лития не существует.
Умеренная токсичность
Умеренная токсичность лития обычно проходит сама по себе, когда вы прекращаете прием лития и выпиваете дополнительные жидкости. Тем не менее, ваш врач может по-прежнему присматривать за вами, пока вы выздоравливаете.
Токсичность от умеренной до тяжелой
Токсичность литием от умеренной до тяжелой обычно требует дополнительного лечения, например:
- Промывание желудка. Эта процедура может быть вариантом, если вы принимали литий в течение последнего часа.
- Орошение всего кишечника. Вы проглатываете раствор или вводите раствор через зонд, чтобы вывести лишний литий из кишечника.
- IV жидкости. Они могут понадобиться вам для восстановления электролитного баланса.
- Гемодиализ. В этой процедуре используется искусственная почка, называемая гемодиализатором, для удаления отходов из крови.

- Лекарства. Если у вас начнутся судороги, ваш врач может назначить противосудорожные препараты.
- Контроль показателей жизнедеятельности. Ваш врач может оставить вас под наблюдением, пока он будет контролировать ваши жизненно важные функции, включая артериальное давление и частоту сердечных сокращений, на предмет любых необычных признаков.
Отравление литием может иметь длительные последствия, поэтому важно немедленно обратиться за медицинской помощью, если вы подозреваете, что оно у вас есть. Избегайте домашних средств, таких как активированный уголь, который не связывается с литием.
При раннем выявлении токсичность лития часто лечится дополнительной гидратацией и снижением дозировки.Однако умеренная или тяжелая токсичность лития требует неотложной медицинской помощи и может потребовать дополнительного лечения, например промывания желудка.
Если вы принимаете литий, убедитесь, что вы знаете признаки передозировки, и держите номер токсикологического контроля (1-800-222-1222) под рукой в телефоне.


 — Лейкоциты являются лишь моделью нейрона, имеющей свои недостатки. Однако позволяющей исследовать живые клетки пациента. Особенно ввиду того, что получить живые нервные клетки головного мозга для фундаментальных исследований практически невозможно».
— Лейкоциты являются лишь моделью нейрона, имеющей свои недостатки. Однако позволяющей исследовать живые клетки пациента. Особенно ввиду того, что получить живые нервные клетки головного мозга для фундаментальных исследований практически невозможно».
 Некоторые состояния, такие как фолликулит, проходят даже при продолжении лечения литием.
Некоторые состояния, такие как фолликулит, проходят даже при продолжении лечения литием.


 Если больше, чем 6 часов, просто пропустите пропущенную дозу и примите следующую в обычное время
Если больше, чем 6 часов, просто пропустите пропущенную дозу и примите следующую в обычное время Со временем эти факторы могут вызвать медленное накопление лития в организме.
Со временем эти факторы могут вызвать медленное накопление лития в организме.
