Аномалии мочевого пузыря — Педиатрия
Нейрогенный мочевой пузырь — это дисфункция мочевого пузыря, вызванная неврологическими расстройствами, включая спинномозговые аномалии или аномалии ЦНС, травмой или осложнениями операций на тазовых органах (например, при крестцово-копчиковой тератоме или атрезии заднего прохода). Мочевой пузырь может быть вялым, спастическим или комбинированным. Вялый мочевой пузырь имеет большой объём, низкое давление и минимальные сокращения. Спастический мочевой пузырь характеризуется нормальным или низким объемом, высоким давлением, и непроизвольными сокращениями. Если присутствует хронически повышенное давление мочевого пузыря (> 40 см водн. ст. h3О), это часто приводит к прогрессирующему повреждению почек, даже при отсутствии инфекции или рефлюкса.
Лежащие в основе неврологические нарушения, как правило, очевидны. Обычно измеряется остаточный объем мочи после мочеиспускания, УЗИ почек проводится для выявления гидронефроза, а уровень сывороточного креатинина измеряется для оценки функции почек.
Цели ведения пациента включают в себя снижение риска инфицирования, поддержание необходимого давления мочевого пузыря и резервуарного объема, эффективное опорожнение мочевого пузыря и достижение социального удержания мочи. Лечение нейрогенного мочевого пузыря включает в себя препараты (например, антихолинергические средства, профилактическое назначение антибиотиков), интермиттирующую (прерывистую) катетеризацию и/или хирургическое вмешательство (например, расширительная пластика мочевого пузыря, илеоцистостомия, инъекции ботулотоксина, нейростимуляция). Дети с нейрогенным мочевым пузырём часто также имеют нейрогенный кишечник с запорами и недержанием стула, которые также требуют правильного ведения.
УЗИ мочевого пузыря
В связи с возрастанием частоты развития заболеваний мочевого пузыря, ультразвуковая диагностика становится все более популярной для выявления патологических процессов данного органа. Помимо цистита, заболевания, которое наиболее известно людям, при ультразвуковой диагностике можно обнаружить различные врождённые и приобретённые аномалии. Эта манипуляция абсолютно не причиняетболи.
Помимо цистита, заболевания, которое наиболее известно людям, при ультразвуковой диагностике можно обнаружить различные врождённые и приобретённые аномалии. Эта манипуляция абсолютно не причиняетболи.
Чтобы результаты были максимально достоверными, нужно провести определённую подготовку. Обратите внимание, что эта диагностическая процедура не имеет побочных эффектов и прямых противопоказаний. К тому же, её можно проводить в любом возрасте.
Кому необходимо УЗИ мочевого пузыря
- Изменение цвета мочи. Он стал более темным или же совсем прозрачным
- При попытке опорожнения мочевого пузыря возникают сильные боли, неприятные ощущения или жжение
- Затруднения при мочеиспускании. Моча идет очень скудными порциями или вовсе каплями
- Слишком частые позывы в туалет. Или же наблюдается обратная ситуация: человек не ощущает позывов
- Боль внизу животу не выясненной причины
- Примеси крови или хлопья гноя в моче
Также существуют случаи, когда ультразвуковое исследование мочевого пузыря проводят в профилактических целях. Это бывает при наличии хронических заболеваний мочевыводящей и мочеполовой системы. Также врач может дать направление на УЗИ при вынашивании ребенка, при диспансеризации или в пожилом возрасте.
Это бывает при наличии хронических заболеваний мочевыводящей и мочеполовой системы. Также врач может дать направление на УЗИ при вынашивании ребенка, при диспансеризации или в пожилом возрасте.
Благодаря ультразвуковой диагностике мочевого пузыря можно выявить множество аномалий и патологических процессов:
- Неправильное расположение
- Повышенный тонус
- Наличие камней или песка
- Закупорка или сужение мочевыводящего протока
- Доброкачественные и злокачественные опухоли
- Атония
- Воспаление стенок мочевого пузыря
Существуют ли противопоказания
Как было оговорено выше, как таковых противопоказаний к процедуре нет. Но все же, при значительных повреждениях кожного покрова живота, например, глубоких ссадинах или сильных ожогах, это исследование не проводят.
Обратите внимание, это касается только ультразвукового исследования через брюшную стенку. У трансвагинального и ректального способа имеются свои противопоказания, о них мы поговорим ниже.
У трансвагинального и ректального способа имеются свои противопоказания, о них мы поговорим ниже.
Как правильно подготовиться
Прийти на УЗИ нужно строго на голодный желудок, поэтому последний прием пищи должен быть как минимум за 12 часов. Утром вы можете сходить в туалет, но непосредственно перед процедурой нужно наполнить мочевой пузырь и выпить как минимум литр воды. Если речь идет о ректальном способе, непосредственно перед диагностикой нужно провести очистительную клизму.
Подготовка детей к обследованию
По сути разницы между взрослой и детской подготовкой нет. Единственным нюансом выступает количество потребляемой жидкости. Ребёнку перед процедурой достаточно выпить один стакан. Детям старше 6 лет — минимум два стакана. Кроме воды ребёнку можно дать сок, чай или компот.
Кроме воды ребёнку можно дать сок, чай или компот.
Как проходит процедура
Ультразвуковое исследование мочевого пузыря может проводиться различными способами: через брюшную стенку, через влагалище или прямую кишку. Выбор конкретного вида диагностики зависит от индивидуальных особенностей. Если требуется осмотреть просто мочевой пузырь, выбирается самый простой вариант — через кожный покров. Если помимо мочевого пузыря необходимо осмотреть женские придаточные органы — проводят исследование трансвагинально. Мужчинам, при одновременном обследовании предстательной железы, проводят ультразвуковое исследование через прямую кишку.
Абдоминальное обследование
Данная процедура подразумевает проведение манипуляции через брюшную стенку. Согласно статистике, чаще всего мочевой пузырь проверяют именно таким образом. Этот метод совершенно безболезненный. Пациенту внизу живота обильно смазывают специальным гелем для хорошего контакта датчика. Исследование занимает не более 15 минут.
Ректальное исследование
Этот вид диагностики может проводиться только мужчинам. Его назначают в том случае, если требуется провести ультразвуковое исследование мочевого пузыря одновременно с предстательной железой. Используется специальная насадка, она обильно смазывается гелем, после чего датчик вставляют в прямую кишку. Исследования проводится в течение 15-20 минут.
Трансвагинальный метод
Эта процедура подразумевает исследование через влагалище. На датчик надевают специальную насадку, сверху кондом и обильно смазывают гелем. Женщина должна лечь на спину и согнуть ноги в коленях. Специалист осматривает не только мочевой пузырь, но также матку и оба яичника. Трансвагинальный метод имеет некоторые особенности, поэтому следует соблюдать несколько правил:
- Запрещено проводить процедуру во время менструации
- Проведите гигиенические манипуляции перед УЗИ
- Не осуществляйте диагностику при молочнице
Как выглядят различные патологии на УЗИ
Согласно официальным статистическим данным, самым частым недугом мочевого пузыря является цистит. При цистите на ультразвуковом исследовании наблюдается такая картина: в пространстве мочевого пузыря наблюдаются очень мелкие включения. Эти частички – микрохлопья гноя, то есть большие скопления лейкоцитов. Если речь идет о начальной степени заболевания – края и контуры остаются в прежнем состоянии без особых изменений. Если же провести ультразвуковое исследование на запущенных стадиях, в таком случае изменения ощутимы. Толщина стенок мочевого пузыря становится больше, контуры — размытыми, края нечеткими.
При цистите на ультразвуковом исследовании наблюдается такая картина: в пространстве мочевого пузыря наблюдаются очень мелкие включения. Эти частички – микрохлопья гноя, то есть большие скопления лейкоцитов. Если речь идет о начальной степени заболевания – края и контуры остаются в прежнем состоянии без особых изменений. Если же провести ультразвуковое исследование на запущенных стадиях, в таком случае изменения ощутимы. Толщина стенок мочевого пузыря становится больше, контуры — размытыми, края нечеткими.
- Если в органе наблюдаются инородные тела – скорее всего, речь идет о камнях или песке
- Если орган увеличен – это свидетельствует о травмах мочевого пузыря или же о проблемах предстательной железы
- Слишком маленький мочевой пузырь может наблюдаться до достижения совершеннолетия или же сигнализировать о врожденной аномалии
Расшифровка результатов
Обратите внимание, что исследованием данного органа мочевыделительной системы занимается врач-узист. Этот специалист не может поставить определенный диагноз, а лишь печатает результаты на листке. Расшифровкой и постановкой диагноза занимается непосредственно врач-уролог или нефролог, в зависимости от конкретной причины направления на ультразвуковое исследование.
Этот специалист не может поставить определенный диагноз, а лишь печатает результаты на листке. Расшифровкой и постановкой диагноза занимается непосредственно врач-уролог или нефролог, в зависимости от конкретной причины направления на ультразвуковое исследование.
Если вам поставили какой-либо серьезный диагноз – его обязательно нужно уточнить повторной диагностикой. При подтверждении того или иного диагноза вам будет назначено соответствующее лечение. При различных воспалениях отличные результаты показывает медикаментозное лечение. При более серьезных проблемах может потребоваться оперативное вмешательство. Подробнее вам расскажет лечащий врач.
Норма по УЗИ
Мочевой пузырь имеет нормальную эхоструктуру. Форма данного органа округлая, немного продолговатая, симметричная. Контуры четкие и ровные, не должно быть размытости и затемнений. Посторонние включения отсутствуют. Толщина стенок примерно 0,3 миллиметра. Допускаются небольшое варьирование +-0,2 мм. Скорость тока не больше 14 см в секунду.
Для адекватной оценки шейки органа может потребоваться проведение обследования внутри органа. Сначала ультразвуковое исследование проводят на полный мочевой пузырь, затем на пустой. При отсутствии патологических процессов мочи должно остаться не более 50 миллилитров. Если осталось больше жидкости, это сигнализирует о воспалительном процессе.
Таким образом, можно сделать вывод, что благодаря ультразвуковому исследованию можно выявить ряд заболеваний даже на начальных стадиях. При появлении первых же тревожных симптомов немедленно обращайтесь к доктору и не затягивайте с диагностикой. Помните о том, что патологии легче вылечить на начальных стадиях, нежели на запущенных.
Визуальная диагностика патологий мочевого пузыря
Ветер Д.С. – ветеринарный врач ИВЦ МВА, специалист визуальной диагностики, соискатель кафедры ветеринарой хирургии МГАВМиБ им. К.И. Скрябина.
Бобровский М.А. – ветеринаный врач ИВЦ МВА, аспирант кафедры ветеринарной хирургии МГАВМиБ им. К.И. Скрябина.
К.И. Скрябина.
Различные патологические процессы в мочевом пузыре встречаются довольно часто. Очень важно правильно диагностировать патологию для назначения адекватного лечения. В данной статье описываются как наиболее часто встречающиеся патологии мочевыделительной системы, так и редкие диагностические находки. А так же рассматриваются методы визуальной диагностики, которые может применить врач для более точной визуализации мочевого пузыря в конкретных случаях.
Рис. 1 — УЗ изображение мочевого пузыря в норме
Рис. 2 — УЗ изображение мочевого пузыря с деформацией стенки от компрессии прямой кишки
Рис.3 – На изображении четко видны слои мочевого пузыря и уролит на дорсальной стенке с эхоакустической тенью
С точки зрения УЗ-диагностики мочевой пузырь – это полый орган, ан эхогенный по структуре с гипоэхогенной стенкой расположенный в каудовентральной области брюшной полости. (рис.1) В норме все слои хорошо дифференцируются: слизистый и серозный слои гипоэхогенны (рис.3 – 1,3), мышечный слой практически анэхогенен (рис.3-2).
(рис.1) В норме все слои хорошо дифференцируются: слизистый и серозный слои гипоэхогенны (рис.3 – 1,3), мышечный слой практически анэхогенен (рис.3-2).
При умеренном наполнении мочой, один из самых легко обнаруживаемых органов. Во время исследования животное укладывается в дорсальной или латеральной позиции. Сканирование проводится трансабдоминально. Если животное агрессивное или лишний стресс опасен и угрожает жизни животного, допускается визуализация мочевого пузыря в положении стоя. Плоскости сканирования мочевого пузыря – сегментарная и сагиттальная.
Для полной визуализации органа, необходимо выполнение двух условий – умеренное наполнение мочевого пузыря и опорожненная прямая кишка. (рис. 1) Второе условие необходимо, дабы исключить деформацию мочевого пузыря кишкой, заполненной каловыми массами, что ошибочно можно принять за конкремент или опухоль (рис.2 -прямая кишка смещает дорсальную стенку мочевого пузыря). При опорожненном мочевом пузыре возможна катетеризация и введения стерильного изотонического 0,9% раствора натрия хлорида в мочевой пузырь или внутривенная инъекция фуросемида из расчета 2 мг на кг веса животного.
При опорожненном мочевом пузыре возможна катетеризация и введения стерильного изотонического 0,9% раствора натрия хлорида в мочевой пузырь или внутривенная инъекция фуросемида из расчета 2 мг на кг веса животного.
Уроцистолитиаз у животных встречается довольно часто, этиология разнообразна, включает климатические, алиментарные, генетические факторы, гормональный дисбаланс, инфекции мочевыделительной системы, анатомические особеннности. Так некоторые породы собак являются носителями генетической мутации, которая формирует предрасположенность к развитию уролитиаза. Данная аномалия установлена у собак породы далматин, у кошек так же существует предрасположенность, но она мало изучена.
При УЗ-диагностике уролиты в мочевом пузыре выглядят, как гипо- или гиперэхогенные структуры в зависимости от плотности. Отличительной особенностью конкремента является наличие четкой эхоакустической тени, благодаря которой можно определить плотность уролита. Так, если эхоакустическая тень начинается под конкрементом (pис. 3), его плотность низкая, если тень начинается с середины конкремента и как бы “приподнимает” его над дорсальной стенкой мочевого пузыря, (рис.4) плотность средняя. Если же при сканировании мы видим только верхнюю гиперэхогенную часть конкремента, от которой начинается эхоакустическая тень, и сложно определить его форму, то это свидетельствует о высокой плотности уролита. (pис. 5).
3), его плотность низкая, если тень начинается с середины конкремента и как бы “приподнимает” его над дорсальной стенкой мочевого пузыря, (рис.4) плотность средняя. Если же при сканировании мы видим только верхнюю гиперэхогенную часть конкремента, от которой начинается эхоакустическая тень, и сложно определить его форму, то это свидетельствует о высокой плотности уролита. (pис. 5).
Рис. 4 – конкремент средней плотности в просвете мочевого пузыря.
Рис. 5 — (стенка мочевого пузыря плохо визуализируется, четко видна эхоакустическая тень).
Бывают случаи, когда дифференциация конкремента затруднительна. Так произошло с чихуахуа, которая поступила к нам на прием в критическом состоянии с признаками острой задержки мочи. При УЗ-сканировании мочевого пузыря, полость мочевого пузыря плохо визуализировалась, присутствовала четкая эхоакустическая тень (рис.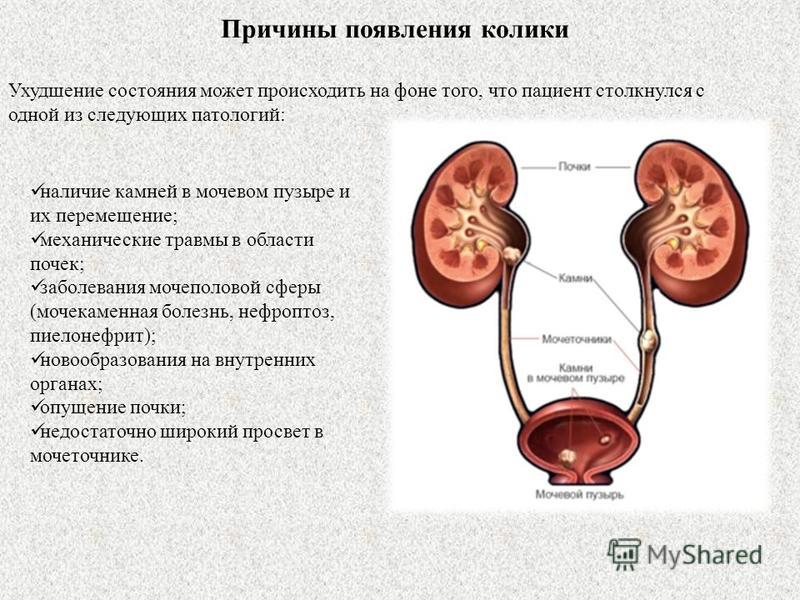 5), чтобы исключить компрессию прямой кишки каловыми массами, было принято решение провести рентгенографию в левой латеральной проекции. (рис.6) На рентгенограмме четко виден конкремент, занимающий весь просвет мочевого пузыря. Была проведена цистотомия (рис.7), уролит отправлен на анализ.
5), чтобы исключить компрессию прямой кишки каловыми массами, было принято решение провести рентгенографию в левой латеральной проекции. (рис.6) На рентгенограмме четко виден конкремент, занимающий весь просвет мочевого пузыря. Была проведена цистотомия (рис.7), уролит отправлен на анализ.
Рис. 6 – рентгенограмма левая латеральная проекция, в просвете мочевого пузыря конкремент.
Рис.7 – извлеченный конкремент после цистотомии.
Мелкие уролиты опасны выходом из мочевого пузыря по мочеиспускательному каналу, что может вызвать обструкцию уретры, особенно у самцов, у которых уретра имеет специфические анатомические особенности. При обструкции уретры на УЗ сканировании не всегда можно визуализировать конкремент (рис.8 – переполненный мочевой пузырь, уретра в продольном сканировании, проксимальная часть расширена, в просвете визуализируется анэхогенная моча и слои уретры. Конкременты, сгустки, новообразования в просвете уретры не визуализируются).
Конкременты, сгустки, новообразования в просвете уретры не визуализируются).
Рис.8 – мочевой пузырь и расширенная уретра вследствие обструкции конкрементами.
Рис.9 – конкременты в уретре, рентгенограмма в левой латеральной проекции.
После рентгенографии в левой латеральной проекции (рис. 9), в просвете дистальной части уретры визуализируются конкременты (указаны стрелками).
Разрыв мочевого пузыря встречается довольно часто в практике ветеринарного специалиста. Это происходит вследствие травмы (падение с высоты, автотравма). При УЗ сканировании выявляется утолщение стенки мочевого пузыря и наличие свободной жидкости в брюшной полости, в большей степени в районе мочевого пузыря. (рис. 10) Для подтверждения разрыва необходимо провести позитивно-контрастную ретроградную цистоуреографию. (рис. 11 вентро-дорсальная ретроградная цистография). На рис. 11 частично прокрашена полость мочевого пузыря, остальное контрастное вещество распространилось из мочевого пузыря и находится с правой стороны в брюшной полости.
(рис. 11 вентро-дорсальная ретроградная цистография). На рис. 11 частично прокрашена полость мочевого пузыря, остальное контрастное вещество распространилось из мочевого пузыря и находится с правой стороны в брюшной полости.
Рис. 10 – УЗ картина разрыва мочевого пузыря, свободная жидкость в брюшной полости.
Рис. 11 – разрыв мочевого пузыря вследствие автотравмы, ретроградная цистография.
Переходно-клеточная карцинома мочевого пузыря у собаки.
Новообразование мочевого пузыря обычно представляет собой неоднородную структуру, выдающуюся в просвет органа. Наиболее распространенный вид опухолей мочевого пузыря – переходно-клеточная карцинома, которая образуется из переходного эпителия, выстилающего пузырь изнутри. Новообразования мочевого пузыря встречаются довольно редко, но по статистике более 70% из них переходно-клеточный рак.
Новообразования мочевого пузыря встречаются довольно редко, но по статистике более 70% из них переходно-клеточный рак.
Существует породная предрасположенность данного заболевания, чаще всего оно встречается у скотч-терьеров, вест-хайленд-уайт терьеров, биглей и колли.
При УЗ сканировании образования могут быть гипо-, гипер- и изоэхогенные по сравнению со стенкой мочевого пузыря и часто выглядят неоднородно.(pис. 12, 13) Располагаются опухоли в районе шейки мочевого пузыря и на его дорсальной стенке.
По УЗИ нельзя определить вид и природу опухолевого процесса, для этого необходима биопсия, но если поверхность новообразования гладкая, это может указывать на мезенхимальное происхождение. Иногда бывает затруднительно дифференцировать плотный кровяной сгусток от пристеночного новообразования мочевого пузыря, для этого необходимо прибегнуть к цветному доплеровскому картированию (ЦДК). (pис. 14)
Организованные сгустки крови и фибрина, лишены сосудистой сети и, следовательно, не могут иметь цветовых локусов при ЦДК (Рис. 15), в отличие от опухолей, которые , как правило, хорошо кровоснабжаются (pис.14).
15), в отличие от опухолей, которые , как правило, хорошо кровоснабжаются (pис.14).
При УЗ сканировании мочевого пузыря могут встретиться неоднородные объемные новообразования, которые на первый взгляд имеют УЗ-признаки злокачественности, но ультрасонография является субъективной, дополнительной диагностикой для врача. Так на рис. 16 мы видим объемное неоднородное образование мочевого пузыря у собаки породы метис 6 лет.
Рис. 12 — УЗ мочевого пузыря собаки породы скотч-терьер 8 лет, переходно-клеточная карцинома.
Рис. 13 – УЗ мочевого пузыря собаки породы шарпей, 10 лет, переходноклеточный рак.
Рис. 14 –УЗ картина новообразования мочевого пузыря, которое хорошо кровоснабжается, режим ЦДК.
Рис. 15 -УЗ картина, кровяной сгусток в мочевом пузыре.
Была проведена диагностическая лапаротомия, в ходе которой выполнена биопсия. Гистологический материал биоптата соответствовал лейомимоме — доброкачественному новообразованию. Животному была проведена парциальная цистэктомия, после операции у собаки наблюдалась положительная динамика, рецидивирования не произошло. Несмотря на массивность опухоли ( вес новообразования достигал около 5 кг) и неоднородную бугристую картину новообразования на УЗИ, прогноз у пациента оказался благоприятным.
Рис.16 – УЗ картина новообразование мочевого пузыря.
Рис. 17 – диагностическая лапаротомия, огромная опухоль мочевого пузыря у собаки.
Список литературы:
-
Kruger JM, Osborne CA, Lulich JP.
 Inherited and congenital disease of the lower urinary tract. In: Osborne CA, Canine and Feline Nephrology and Urology/ 689 c.
Inherited and congenital disease of the lower urinary tract. In: Osborne CA, Canine and Feline Nephrology and Urology/ 689 c. - Houston DM, Moore AE, Stone diseases in animals/ Urinary tract stone diseases 370-372 c.
- Dominique Penninck, Marc-Andre d’Anjou Атлас по ультразвуковой диагностике. Исследования у собак и кошек.
Вернуться к списку
УЗИ почек + мочевой пузырь
УЗИ почек + мочевой пузырь
Ультразвуковое исследование почек и мочевого пузыря является наиболее информативным, безболезненным, безопасным и легко доступным методом исследования органов мочевыделительной системы.
Почки — это парный орган мочевыделительной системы человека необходимый для фильтрации и выведения продуктов распада из организма.
Функция почек:
- выделительная
- внутрисекреторная (эндокринная)
- осморегулирующая
- регуляция электролитного баланса
- управления метаболизмом
Показания к проведению исследования почек и мочевого пузыря:
- наличие патологии в анализах мочи
- болевой синдром
- дизурические расстройства
- заболевания эндокринной системы
- артериальная гипертензия
- травмы
- аномалии развития органов мочевыделительной системы
- острые и хронические воспалительные процессы
при УЗИ почек оценивается:
- расположение почек
- форма
- размер
- контуры
- структура
- изменения около почечного пространства
Выявляемая патология при УЗИ почек:
- аномалии развития
- аномалий положения
- аномалий сращение
- аномалии величины
- структурные изменения
- наличие образований: доброкачественных (кисты, ангиомиолипомы, аденомы), злокачественных
- наличие камней
- воспалительные заболевания (пиелонефрит, карбункул, абсцесс)
- туберкулезный процесс
- наличие расширение и закупорки верхних мочевых путей
- диффузные заболевания паренхимы почек
- наличие посттравматических гематом
при УЗИ мочевого пузыря оценивается: объем, форма, структура стенок мочевого пузыря, содержимое мочевого пузыря.
УЗИ мочевого пузыря выявляет следующие патологии:
- аномалии развития
- камни
- новообразования (доброкачественные, злокачественные)
- наличие воспалительного процесса в мочевом пузыре
- посттравматические изменения, разрывы мочевого пузыря
Подготовка к исследованию почек и мочевого пузыря.
Исследование проводится при полном мочевом пузыре. Поэтому за час-полтора до исследования рекомендуется выпить 1 литр негазированной жидкости (вода, чай и др.)
Исследование назначается врачами урологами, терапевтами, кардиологами и эндокринологами.
Патология мочевого пузыря и уретры кошек и собак
Объем мочевого пузыря
В гуманной медицине широко применяется измерение объема мочи посредством ультразвука, особое внимание уделяется накопленному объему мочи и остаточному объему после мочеиспускания. При вычислении объема мочи у людей применяется следующая формула : объем = длина Х ширина Х высота Х 0. 523. У собак последний коэффициент был заменен на 0.625, что более точно определяет исчисляемый объем мочи.
523. У собак последний коэффициент был заменен на 0.625, что более точно определяет исчисляемый объем мочи.
В практике мелких домашних животных ультразвуковое исчисление объема мочи посредством УЗИ может быть использовано для оценки таких состояний как: сократимость мочевого пузыря, нейрогенный мочевой пузырь, обструкция оттока мочи. У собак и кошек определение объема мочи также может оказать пользу для оценки степени дисфункции мочевого пузыря на фоне проводимого медикаментозного или хирургического лечения. Также, ультразвуковое измерение остаточного объема мочи используется для оценки дизурии собак и успеха хирургического лечения грыжи пояснично-крестцовых межпозвоночных дисков.
Положение шейки мочевого пузыря
Ультразвуковая идентификация расположения шейки мочевого пузыря может дать ветеринару некоторые данные, которые несколько противоречивы по смыслу и содержанию (полезность данных измерений остается не раскрытой). Смещение мочевого пузыря в тазовый канал устанавливается при нахождении там >10% органа, и данное отклонение может потребовать кольпосуспензии (на усмотрение врача).
В практике мелких домашних животных посредством ультразвука определяется изменение в положении шейки мочевого пузыря у здоровых собак и у собак на фоне сфинктерного механизма недержания мочи, который чаще развивается при отдыхе или расслаблении животного. При анализе данных было обнаружено, что у собак с недержанием мочи отмечалась большая степень каудального движения мочевого пузыря под анестезией. Была предположена теория, что недержание может быть связано с дефицитом механизма пузырно-уретральной поддержки. Также, при данной форме недержания, мочевой пузырь также может иметь аномальную форму и не сужаться нормально в месте соединения с уретрой.
Итак, УЗИ мочевого пузыря при недержании может исключить видимые причины (пр. эктопия мочеточника, см. выше), и помогает в диагностике сфинктерного недержания посредством оценки динамических изменений в положении шейки мочевого пузыря. Следует отметить, что при каудальном смещении шейки мочевого пузыря, очень трудно исключить другие причинные недержания по причине плохой визуализации зонты тригона мочевого пузыря (трудности при диагностики эктопии мочеточника).
Также, было проведено сравнение стрессового недержания мочи у женщин и сфинктерного недержания у сук, ученые нашли между ними много общего. Было отмечено, что как у женщин, так и у сук при данных заболеваниях определяется укорочение, по сравнению с нормой, участка функциональной уретры а также малое максимальное давление в уретре.
Аномалии урахуса и приобретенные дивертикулы
Лучшим методом оценки положения и протяженности дивертикулов (врожденных и приобретенных) и фистул является контрастное радиографическое исследование. Ультразвук в данных случаях выполняет вспомогательную роль, но некоторые патологии урахуса, дивертикулы и фистулы могут быть заподозрены во время УЗИ мочевого пузыря (которое часто проводится перед радиографией) и служит поводом для дальнейшей диагностики.
Урахус играет важную роль в период нахождения животного плода в матке, он соединяет мочевой пузырь с аллантоисным мешком. Урахус после рождения животного подвергается регрессу и превращению в фиброзные массы. При нарушении обратного развития урахуса, вероятно развитие следующих патологий: персистирующий (открытый) урахус; дивертикул урахуса; киста урахуса.
При нарушении обратного развития урахуса, вероятно развитие следующих патологий: персистирующий (открытый) урахус; дивертикул урахуса; киста урахуса.
Персистирующий (открытый) урахус – сохранение соединения мочевого пузыря со внешней средой в области пупка. Клинически выражается в подтекании мочи в области пупка (может наблюдаться только смоченный волос), при лежачем положении вероятно образование точечных подтеков. Основным методом диагностики служит контрастная цистография, УЗИ служит вспомогательным методом. При ультразвуковом исследовании на фоне открытого урахуса, он определяется между краниовентральным отделом стенки мочевого пузыря и пупком, и подозревается в случаев изменения контура верхушки мочевого пузыря (необычно приподнятый, остроконечный вид). Сама стенка мочевого пузыря при персистирующем урахусе часто утолщена. Основной метод лечения персистирующего урахуса – хирургическая коррекция (прямые показания), она ведет к полному излечению.
Дивертикул(-ы) урахуса — слабое выпячивание тканей мочевого пузыря на верхушке, при неполном закрытии урахуса плода. Вероятно развитие вторичного дивертикула урахуса вторично к обструкции уретры или идиопатическому циститу кошек. Дивертикул урахуса предрасполагает животное к развитию бактериальной колонизации мочевого пузыря, может способствовать развитию признаков идиопатического цистита. Основным методом диагностики, также как при персистирующем урахусе, служат контрастные радиографические методы визуализации; УЗИ лишь помогает заподозрить дивертикул. Ультразвуковое исследование при дивертикулах урахуса обычно выявляет структуры, наполненные жидкостью, простирающиеся из просвета мочевого пузыря. Дивертикулы могут значительно варьировать в размерах, стенка при длительном течении может утолщаться в случаях хронического цистита. Удаление дивертикулов (дивертикулэктомия) показано только при наличии клинических признаков, т.к. дивертикул урахуса может предрасполагать мочевой пузырь к развитию рецидивирующей инфекции, у асимптоматичных животных лечение не проводится.
Вероятно развитие вторичного дивертикула урахуса вторично к обструкции уретры или идиопатическому циститу кошек. Дивертикул урахуса предрасполагает животное к развитию бактериальной колонизации мочевого пузыря, может способствовать развитию признаков идиопатического цистита. Основным методом диагностики, также как при персистирующем урахусе, служат контрастные радиографические методы визуализации; УЗИ лишь помогает заподозрить дивертикул. Ультразвуковое исследование при дивертикулах урахуса обычно выявляет структуры, наполненные жидкостью, простирающиеся из просвета мочевого пузыря. Дивертикулы могут значительно варьировать в размерах, стенка при длительном течении может утолщаться в случаях хронического цистита. Удаление дивертикулов (дивертикулэктомия) показано только при наличии клинических признаков, т.к. дивертикул урахуса может предрасполагать мочевой пузырь к развитию рецидивирующей инфекции, у асимптоматичных животных лечение не проводится.
Следует помнить, что аномалии урахуса локализованы в краниовентральной стенке мочевого пузыря, между самим пузырем и пупком, тогда как приобретенные дивертикулы могут развиваться в любой локализации. Дивертикулы стенки мочевого пузыря могут формироваться по причине травмы или цистита.
Дивертикулы стенки мочевого пузыря могут формироваться по причине травмы или цистита.
Киста урахуса формируется при условии продолжающейся секреции изолированной части эпителия урахуса, в том время как оставшийся урахус подвергается фиброзу и обратному развитию. Типично при УЗИ кисты урахуса выглядят как тонкостенные, анэхогенные структуры краниально к мочевому пузырю. Вероятно инфицирование кисты и формирование абсцесса (с соответствующим видом при ультразвуковом исследовании). Основным методом диагностики также остается контрастная цистография, а лечением выбора – хирургическое иссечение кисты урахуса.
Описана также такая патология, как сохраненная связка урахуса, она тянет мочевой пузырь краниально к пупку и предотвращает адекватное его опорожнение у кошек, ведя к удлинению мочевого пузыря и формированию остроконечной вершины. Хирургическое рассечение данной связки ведет к выздоровлению животного.
При УЗИ мочевого пузыря может быть определено грыжеобразование (герниация) интактной слизистой через надрыв мышечного слоя стенки мочевого пузыря после травматического воздействия. Но диагноз также должен быть подтвержден при проведении контрастной цистографии. Также, при УЗИ мочевого пузыря могут быть заподозрены деформация просвета и прилипание мочевого пузыря, подтверждение диагноза данных патологий требует контрастного радиографического обследования.
Но диагноз также должен быть подтвержден при проведении контрастной цистографии. Также, при УЗИ мочевого пузыря могут быть заподозрены деформация просвета и прилипание мочевого пузыря, подтверждение диагноза данных патологий требует контрастного радиографического обследования.
Дупликация мочевого пузыря
Дупликация мочевого пузыря – это достаточно редкая патология, описанная для собак. УЗИ позволяет заподозрить данную патологию, окончательная диагностика проводится посредством обзорной и контрастной радиографии. Дупликация мочевого пузыря может предрасполагать животное к инфекции мочевыводящих путей и недержанию мочи, основной метод лечения – хирургическая коррекция.
Разрыв мочевого пузыря
При подозрении на разрывы мочевыводящих путей (пр. при травме), экспертными средствами оценки их целостности служат различные методы контрастной визуализации (экскреторная урография, контрастная цистография и уретрография). Ультразвук в данных случаях может выполнять лишь вспомогательную, и далеко не главную, роль. Также, при УЗИ мочевого пузыря, разрыв стенки может быть ошибочно заподозрен по причине прерывания сигнала искривленной стенки (краевой или рефракционный артефакт). В дополнение, малые дефекты стенки могут не визуализироваться посредством ультразвука и вероятен пропуск поражений других частей мочевыводящих путей.
Также, при УЗИ мочевого пузыря, разрыв стенки может быть ошибочно заподозрен по причине прерывания сигнала искривленной стенки (краевой или рефракционный артефакт). В дополнение, малые дефекты стенки могут не визуализироваться посредством ультразвука и вероятен пропуск поражений других частей мочевыводящих путей.
Цистит
При ультразвуковом исследовании мочевого пузыря на фоне цистита, чаще всего отмечается ассиметричное утолщение его стенок, наибольшую выраженность данный феномен проявляет в краниовентральном отделе, но, при тяжелом течении, может отмечаться генерализованное утолщение. Нормальная толщина стенки растянутого мочевого пузыря составляет порядка 1-2 мм. При состоянии спавшегося мочевого пузыря требуется субъективная оценка толщины стенки, исходя из степени растяжения. Во многих случаях цистита, стенка мочевого пузыря нормальна, это может быть истиной, даже при наличии осадка или камней. Ультразвуковое утолщение стенок мочевого пузыря (гипоэхогенное, гиперэхогенное или слоистое) часто сочетается с обнаружением других находок, таких как: камни, дебрис или кровяные сгустки. И опять же, ультразвуковые данные при цистите чаще вспомогательные, и для установления окончательного диагноза требуется сочетанное применение других методов обследования.
И опять же, ультразвуковые данные при цистите чаще вспомогательные, и для установления окончательного диагноза требуется сочетанное применение других методов обследования.
Полипоидный цистит – редкая форма цистита, описанная для собак. Ультразвуковое исследование мочевого пузыря, при данной форме цистита, выявляет гиперэхогенные массы (полипоидные или на ножке), выступающие в просвет мочевого пузыря, а также диффузное утолщение стенок (последнее не всегда). Полипоидные массы характеризуются определенной локализацией, чаще они располагаются на краниовентральной стенке мочевого пузыря, в редких случаях они могут располагаться краниодорсально.
Основной дифференциальный диагноз при полипоидном цистите – новообразование мочевого пузыря (чаще переходно-клеточная карцинома собак), при любых сомнениях следует проводить катетерную биопсию (suction biopsies), с последующим цитологическим исследованием образцов. Следует помнить, что новообразования мочевого пузыря встречаются гораздо чаще полипов стенки.
Эмфизематозный цистит – это отдельная форма цистита, характеризуется образованием газа такими бактериями как: Escherichia coli, Aerobacter aerogenes, Proteus mirabilis, и Clostridium sp. Данный вид цистита чаще наблюдается у животных на фоне сахарного диабета, при ферментации глюкозы мочи бактериями. Ультразвуковой вид при эмфизематозном цистите характеризуется обнаружением многоочаговой, гиперэхогенной поверхности мочевого пузыря неправильной формы с реверберационным артефактом и формированием грязной тени.
Свободный газ просвета мочевого пузыря (часто наблюдается при катетеризации) дифференцируется сменой положения пациента и/или датчика (свободный газ смещается с изменением положения пациента). В качестве вспомогательного метода диагностики эмфизематозного цистита выступает радиография брюшной полости, она выявляет свечение стенки мочевого пузыря.
Псевдомембранозный цистит в основном описан в гуманной медицине, но также может встречаться у кошек. Данный вид цистита связан с тяжелым диффузным изъязвлением, некрозом и кровоизлияниями в стенку мочевого пузыря, также как с внутрипросветным некрозом, и образованием в просвете свободных фибринозных и геромррагических перегородок, а также дебриса. Скопление в просвете тканей и дебриса предрасполагает к обструкции тока мочи по уретре. Ультразвуковая картина при псевдомембазнозном цистите выявляет утолщение стенок мочевого пузыря, наличие эхогенного дебриса и перегородок развбивающих мочевой пузырь на малые отделы.
Данный вид цистита связан с тяжелым диффузным изъязвлением, некрозом и кровоизлияниями в стенку мочевого пузыря, также как с внутрипросветным некрозом, и образованием в просвете свободных фибринозных и геромррагических перегородок, а также дебриса. Скопление в просвете тканей и дебриса предрасполагает к обструкции тока мочи по уретре. Ультразвуковая картина при псевдомембазнозном цистите выявляет утолщение стенок мочевого пузыря, наличие эхогенного дебриса и перегородок развбивающих мочевой пузырь на малые отделы.
Цистит на фоне инверсии стенок мочевого пузыря – это достаточно редкое состояние, может быть бессимптомным, а может вызывать признаки воспаления мочевого пузыря. Ультразвуковая картина выявляет утолщение на верхушке мочевого пузыря в виде масс, либо складки мочевого пузыря, выступающей в мочевой пузырь. Инверсия ведет к формированию изрезанных серозных границ мочевого пузыря. Утолщение инверсированной стенки сохраняет слоистость, ведя к формированию характерного смешенного (гипер- и гипоэхогенного) вида. Данное состояние также может встречаться после установки мочевого катетера на длительное время.
Данное состояние также может встречаться после установки мочевого катетера на длительное время.
Сгустки крови в просвете и геморрагии стенок мочевого пузыря
Сгустки крови в просвете мочевого пузыря и гематомы стенки могут формироваться по следующим причинам: травма, нарушения гемостаза, инфекция, неоплазия. Кровяные сгустки – ожидаемые находки при соответствующей истории болезни и клинических признаках. Сгустки при УЗИ обычно гиперэхогенны, без тени, неправильной формы, смещаются согласно законом гравитации. При наличии больших сгустков или их прилипании к стенке мочевого пузыря, вешний вид их может быть более эхогенным с меньшей подвижностью, что ведет к постановке ошибочного диагноза муральных масс. Для дифференцировки между новообразованиями стенки мочевого и кровяными сгустками (или гематомами) может быть использован Доплер, при образованиях он выявляет некоторую сосудистость поражений. Манипуляции приложением перемежающегося давления датчика на мочевой пузырь временно подвешивают малые сгустки в моче (поднимают), данный феномен не наблюдается при наличии муральных масс или больших уролитов.
При ультразвуковом исследовании интрамуральной гематомы выявляются массы различной эхогенности (чаще гипоэхогенные) внутри утолщенной стенки, они могут быт линейной или круглой формы. Исследование при помощи Доплера помогает отграничить гематому от образования по недостатку кровотока в очаге кровоизлияния. Также, повторное исследование помогает дифференцировать неоплазию и воспалительные заболевания стенки мочевого вторичные к нарушениям гемостаза, при соответствующем успешном лечении – гематома разрешается со скоростью порядка 1 мм/день. При травме могут отмечаться сопутствующие поражения мочевого пузыря в виде свободной жидкости вокруг наружной стенки, в постановке диагноза может помочь подходящая история болезни или сопутствующие признаки недавней травмы.
Интрамуральная гематома постепенно рассасывается, если не ведет к формированию некроза стенки мочевого пузыря и подтеканию мочи в брюшную полость.
Камни мочевого пузыря
Характерный ультразвуковой вид рентгенопрозрачных и рентгеноконтрастных камней мочевого пузыря – гиперэхогенные очаги, с артефактом затенения в зависимой части просвета мочевого пузыря (нижней, обращенной к земле). Камни мочевого пузыря тяжелее мочи и имеют тенденцию мигрировать в зависимую часть просвета, в редких случаях – вероятно их прилипание к стенке на фоне тяжелого воспаления. Уролиты обычно имеют сферическую форму, поверхность их гиперэхогенная и криволинейная, количество и размеры их разнообразны.
Камни мочевого пузыря тяжелее мочи и имеют тенденцию мигрировать в зависимую часть просвета, в редких случаях – вероятно их прилипание к стенке на фоне тяжелого воспаления. Уролиты обычно имеют сферическую форму, поверхность их гиперэхогенная и криволинейная, количество и размеры их разнообразны.
Ультразвуковая идентификация уролитов в мочевом пузыре на современном оборудовании имеет сходную аккуратность, как и контрастное радиографическое исследование. Однако, по сравнению с другими методами визуализации, ультразвук имеет тенденцию увеличивать истинные размеры уролитов на несколько миллиметров.
Степень затенения камней мочевого пузыря значительно варьирует и зависит от таких факторов как: состав и плотность уролитов; расположение их в фокальной зоне датчика; частота используемого ультразвука. Наличие затенения плохо кореллирует с составом камней, наибольшую выраженность затенение приобретает при использовании большей частоты ультразвука, с расположением уролитов в фокальной зоне датчика. При наличии камней малых размеров (не превышающих ширину пучка ультразвука по оси x или Z), артефакт затенения обычно не проявляется. Ультразвуковую идентификацию сомнительных камней мочевого пузыря облегчает применение цветного Доплера; наличие уролитов при этом определяется по наличию мерцающего артефакта (twinkling artifact).
При наличии камней малых размеров (не превышающих ширину пучка ультразвука по оси x или Z), артефакт затенения обычно не проявляется. Ультразвуковую идентификацию сомнительных камней мочевого пузыря облегчает применение цветного Доплера; наличие уролитов при этом определяется по наличию мерцающего артефакта (twinkling artifact).
Трудности при идентификации камней могут возникать при наличии осадка; он чаще локализуется в зависимой части просвета мочевого пузыря и может давать затенение. Однако, осадок легко суспендируется при воздействии на мочевой пузырь, а если камни отсутствуют – нет возможности наблюдать диксретные эхогенные фокусы уролитов. Скопление малых камней или минерализованного осадка в зависимой части пузыря способны создавать линейную поверхность с тенью различной степени выраженности. Наличие зависимого осадка без тени указывает на присутствие неминеральных субстанций (пр. клеточный дебрис) или малое количество солей при кристаллурии. Менее эхогенная пиурия может представляться при УЗИ как эхогенное скопление в зависимой части мочевого пузыря.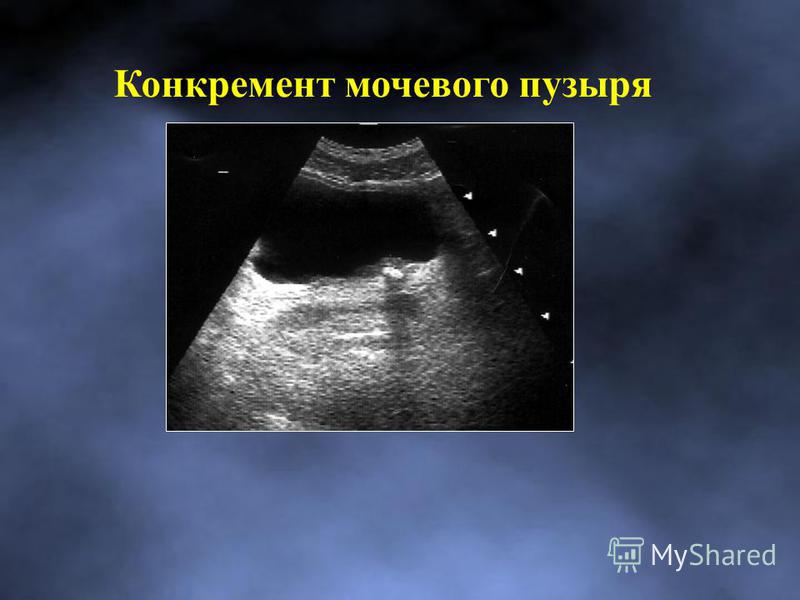 В отличии от осадка и камней, пузырьки газа поднимаются вверх в мочевом пузыре, но тоже создают тень, и должны быть дифференцированы от ревеберберационного артефакта ближних полей. Как осадок, так и пузырьки газа изменяют свою локализацию с изменением положения тела пациента.
В отличии от осадка и камней, пузырьки газа поднимаются вверх в мочевом пузыре, но тоже создают тень, и должны быть дифференцированы от ревеберберационного артефакта ближних полей. Как осадок, так и пузырьки газа изменяют свою локализацию с изменением положения тела пациента.
Фиброз или кальцификация стенки мочевого пузыря способны формировать муральную гиперэхогенность и затенение. В большинстве случаев смена позиции или визуализация датчика в нескольких плоскостях (вместе или по отдельности), помогают разграничить фиброз или кальцификацию от камней, кровяных сгустков, осадка или пузырьков газа.
Для новичка в ультразвуковой диагностики ободочная кишка имеет гиперэхогенную поверхность, создает артефакт затенения и может мимицировать большие камни мочевого пузыря. Для дифференцировки сего феномена — перемещение датчика в продольную плоскостью определяет ободочную кишку как линейную поверхность, идущую по всей длине изображения, тогда как камни должны оставаться сферическими. В дополнение, смена положения животного (стоя или на боку) должна вести к изменению положения камней в просвете мочевого пузыря, тогда как ободочная кишка остается в одной позиции.
В дополнение, смена положения животного (стоя или на боку) должна вести к изменению положения камней в просвете мочевого пузыря, тогда как ободочная кишка остается в одной позиции.
Инородные тела мочевого пузыря
Примерами инородных тел мочевого пузыря могут служить такие патологии как: оставленный катетер, остья злаков, шовный материал. Катетер представляется в виде параллельных эхогенных линий при расположении пучка ультразвука перпендикулярно стенке, параллельные линии представляют стенки катетера. Остья злаков имеют различный вид, но могут представляться как гиперэхогенные структуры без затенения. При реакции на шовный материал стенок – место операции представляется утолщенным, вероятно определить шовный паттерн.
Новообразования мочевого пузыря
Переходно-клеточная карцинома (transitional cell carcinoma (TCC)) мочевого пузыря – наиболее частый вид опухоли в данной локализации. Чаще поражает собак, у кошек практически не встречается. Существует вероятность обнаружения других видов опухолей мочевого пузыря; они могут быть по происхождению эпителиальными (плоско-клеточная карцинома, аденокарцинома) и мезенхимальными (гроздевидная рабдомиосаркома, опухоли периферического футляра нерва, лейомиома, лейомиосаркома, фиброма, фибросаркома, остеосаркома, лимфома, гемангиома, гемангиосаркома, миксома и хемодектома, мастоцитома). Посредством ультразвука невозможно разграничить тип опухоли, как и отличить от доброкачественного образования, однако, новообразования эпителиального происхождения имеют внутрипросветное выпячивание неправильной формы, тогда как мезенхимальные опухоли дают гладкую поверхность (как слизистую так и серозную). Ввиду того, что переходно-клеточная карцинома мочевого пузыря – это единственный вид опухоли часто встречаемый в ветеринарной практике мелких домашних животных, дальше речь пойдет о ней. При различных сомнениях, животное с образованием лучше отправить в референсную ветеринарную клинику.
Посредством ультразвука невозможно разграничить тип опухоли, как и отличить от доброкачественного образования, однако, новообразования эпителиального происхождения имеют внутрипросветное выпячивание неправильной формы, тогда как мезенхимальные опухоли дают гладкую поверхность (как слизистую так и серозную). Ввиду того, что переходно-клеточная карцинома мочевого пузыря – это единственный вид опухоли часто встречаемый в ветеринарной практике мелких домашних животных, дальше речь пойдет о ней. При различных сомнениях, животное с образованием лучше отправить в референсную ветеринарную клинику.
Характерная локализация переходно-клеточной карциномы мочевого пузыря – зона тригона и дорсальная стенка мочевого пузыря, в редких случаях может отмечаться любая другая локализация или диффузное вовлечение стенки. Ультразвуковой вид данной опухоли обычно представляется как ее утолщение и изменение формы с формированием масс, выступающих в просвет мочевого пузыря с широким прикреплением. Эхогенность поражений чаще смешанная, и общий вид может быть слабо или выражено эхогенным. При минерализации опухоли (существует вероятность развития), требуется дифференциация интрамуральных поражений от внутрипростветных уролитов. При диффузном вовлечении стенки мочевого пузыря и отсутствии локальных масс, внешний вид утолщения должен быть отдифференциирован от утолщения при тяжелом и хроническом течении цистита.
При минерализации опухоли (существует вероятность развития), требуется дифференциация интрамуральных поражений от внутрипростветных уролитов. При диффузном вовлечении стенки мочевого пузыря и отсутствии локальных масс, внешний вид утолщения должен быть отдифференциирован от утолщения при тяжелом и хроническом течении цистита.
При локализации переходно-клеточной карциномы мочевого пузыря в области сосочков мочеточника, вероятно развитие обструкции и расширения мочеточника (одно- и двустороннего). При данном виде новообразования, часто происходит инвазия опухоли в проксимальный отдел уретры. Однако, возможен переход опухоли из простаты и мочеточника в мочевой пузырь. У собак с переходно-клеточной карциномой часто отмечают одновременное течение уролитиаза, уретрита, цистита и/или кровяных сгустков.
Как было сказано выше, разграничение вида опухоли возможно только посредством цитологии и/или патоморфологии. Но проведение чрезкожной биопсии, при переходно-клеточной карциноме собак противоречиво (скорее противопоказано), т. к. способствует распространению клеток по каналу иглы (чаще развитие вторичной опухоли на вентральной стенке брюшной полости). Поэтому, для диагностики данного вида опухоли предпочтительным методом установки окончательного диагноза является катетерная биопсия (вероятно проведение под контролем ультразвука).
к. способствует распространению клеток по каналу иглы (чаще развитие вторичной опухоли на вентральной стенке брюшной полости). Поэтому, для диагностики данного вида опухоли предпочтительным методом установки окончательного диагноза является катетерная биопсия (вероятно проведение под контролем ультразвука).
Для стадирования опухоли ультразвуковое исследование применяется для оценки подпоясничных (подвздошных) лимфатических узлов, а также исключается обструкция мочеточника посредством визуализации как самого мочеточника, так и степени наполнения почечной лоханки. Оператор должен помнить, что опухоли мочеточника или простаты могут простираться в мочевой пузырь, изображая опухоль мочевого. Для завершения полного стадирования опухоли, кроме мирокскопического исследования образцов требуется проведение радиографического исследования грудной и брюшной полостей (метастазирование в легкие, оценка подвздошных лимфоузлов, таза и поясничного отдела спинного мозга). Полное стадирование переходно-клеточной карциномы мочевого пузыря может повлиять на прогнозы заболевания.
Патология уретры
Ценность ультразвуковой оценки уретры у собак и кошек затруднительна и достаточно ограничена анатомически. Наибольшую пользу приносит оценка проксимальной части уретры у сук и простатической части уретры у самцов. Применение современного внутрипросветного высокочастотного оборудования, позволяет провести оценку уретры на всей протяженности (определение опухоли уретры, оценка метастазов, локализация камней), но данный вид исследования пока вне зоны досягаемости и остается уделом референсных ветеринарных клиник. При значительных размерах камней уретры, ультразвук может определить тень, саму структуру и смещение стенки уретры во вне, но многие камни уретры достаточно малы и не дают тени. Соединение уретры с влагалищем и прямой кишкой лучше оценивается посредством контрастных видов исследования, ультразвук в этом случае не играет значительно роли. УЗИ может оказать помощь в диагностике опухолей простаты, вторгающихся в уретру и простирающихся до шейки мочевого пузыря.
MEDISON.RU — Экстрофия мочевого пузыря
SonoAce-R7
Универсальный ультразвуковой сканер высокого класса, ультракомпактный дизайн и инновационные возможности.
Введение
Экстрофия мочевого пузыря (ЭМП) — редкий тяжелый врожденный порок развития нижних мочевых путей, характеризующийся отсутствием передней брюшной стенки и передней стенки мочевого пузыря, а также расхождением лонного сочленения (диастаз). Через дефект передней брюшной стенки пролабирует слизистая оболочка. В нижней части обнаженной слизистой оболочки расположены устья мочеточников, из которых постоянно выделяется моча. Пуповина впадает низко в верхний край дефекта передней брюшной стенки.
Экстрофийные пороки нижних мочевых путей делят на классическую экстрофию мочевого пузыря и экстрофию клоаки. У мальчиков экстрофия мочевого пузыря сочетается с расщеплением мочеиспускательного канала (эписпадия). Экстрофия мочевого пузыря у девочек сопровождается расщеплением клитора, расщеплением или отсутствием мочеиспускательного канала, а также спайками больших и малых половых губ [1, 2].
В литературе экстрофия мочевого пузыря чаще всего описывается в комплексе с эписпадией, хотя имеются сообщения об изолированном поражении стенки мочевого пузыря, когда его шейка и мочеиспускательный канал сформированы. Такая патология называется неполной экстрофией, или переднепузырным свищом. При неполной экстрофии патология половых органов отсутствует [3, 4]. Наиболее тяжелой и редкой формой порока является экстрофия клоаки, при которой расщепление распространяется не только на урогенитальную область, но и на терминальный отдел кишечника [5, 6].
Впервые экстрофию мочевого пузыря, как врожденный порок развития, описал Schenk von Grafenberg в 1597 г. В 1780 г. Chaussier впервые использовал термин «экстрофия». Упоминания об экстрофии мочевого пузыря обнаружены на ассирийских табличках, сделанных 2000 лет до н. э. [7]. Частота экстрофии мочевого пузыря составляет 0,25-0,5 на 10 тыс. новорожденных. Соотношение классической экстрофии мочевого пузыря у мальчиков и девочек 3:1 [1, 8]. При экстрофии мочевого пузыря встречаются сопутствующие врожденные аномалии — паховые грыжи (у 56 % мальчиков, у 15 % девочек), крипторхизм (20 %), колоректальные аномалии (1,8 %) и др. [1, 2]. Экстрофия мочевого пузыря может входить в состав комплекса OEIS (omphalocele, extrophy, imperforate anus, spinal defects), OMIM 258040.
В 1780 г. Chaussier впервые использовал термин «экстрофия». Упоминания об экстрофии мочевого пузыря обнаружены на ассирийских табличках, сделанных 2000 лет до н. э. [7]. Частота экстрофии мочевого пузыря составляет 0,25-0,5 на 10 тыс. новорожденных. Соотношение классической экстрофии мочевого пузыря у мальчиков и девочек 3:1 [1, 8]. При экстрофии мочевого пузыря встречаются сопутствующие врожденные аномалии — паховые грыжи (у 56 % мальчиков, у 15 % девочек), крипторхизм (20 %), колоректальные аномалии (1,8 %) и др. [1, 2]. Экстрофия мочевого пузыря может входить в состав комплекса OEIS (omphalocele, extrophy, imperforate anus, spinal defects), OMIM 258040.
Пренатальная диагностика экстрофии мочевого пузыря возможна уже при первом скрининговом обследовании в 11-14 нед беременности, когда в норме полость мочевого пузыря начинает наполняться мочой. Визуализация мочевого пузыря обязательно входит в стандартные протоколы исследования пренатального скрининга.
Эмбриопатогенез
Экстрофия мочевого пузыря формируется на 4-5-й неделе эмбриогенеза, когда на 28-32-й день происходит каудальная миграция мембраны клоаки. В то же время формируется передняя брюшная стенка, однако если мезенхима не переходит из одного клеточного слоя нижней брюшной стенки в другой, то это приводит к нестабильности клоакальной мембраны. Преждевременный разрыв мембраны клоаки приводит к комплексу «подпупочных» аномалий. Разрыв клоакальной мембраны после полного разделения «урогенитальной» части от пищеварительного тракта приводит к формированию классической экстрофии мочевого пузыря.
В то же время формируется передняя брюшная стенка, однако если мезенхима не переходит из одного клеточного слоя нижней брюшной стенки в другой, то это приводит к нестабильности клоакальной мембраны. Преждевременный разрыв мембраны клоаки приводит к комплексу «подпупочных» аномалий. Разрыв клоакальной мембраны после полного разделения «урогенитальной» части от пищеварительного тракта приводит к формированию классической экстрофии мочевого пузыря.
Если повреждение мембраны происходит до того, как спускается уроректальная перегородка, тогда это приводит к вывороту нижнего уретрального тракта и части пищеварительного тракта с формированием клоакальной экстрофии. Генетические факторы, связанные с экстрофией мочевого пузыря, на сегодняшний день не выявлены, однако существует гипотеза, что потеря экспрессии р63 из-за полиморфизмов очередности у промотера является фактором риска развития экстрофии мочевого пузыря [1, 9].
Ниже представлен случай диагностики экстрофии мочевого пузыря в III триместре беременности.
Материал и методы
Пациентка С.,18 лет, настоящая беременность первая, от первого брака, супруги соматически здоровы, профессиональных вредностей не имеют, наследственность не отягощена. На учете в женской консультации пациентка состояла с 9 нед беременности. Беременность протекала без осложнений. При скрининговом УЗ-исследовании в I и II триместрах по месту жительства ВПР и УЗ-маркеров хромосомных перестроек у плода не обнаружено.
При УЗ-обследовании в 34 нед беременности в женской консультации по месту жительства было обнаружено образование средней эхогенности размером 28x23x25 мм в области нижних отделов передней брюшной стенки. Женщина была направлена в медикогенетическое отделение МОНИИАГ с диагнозом: «ВПР плода, экстрофия мочевого пузыря?».
УЗ-исследование проводилось на сканере WS80A (компании Samsung Medison) с использованием объемного датчика CV1-8A.
Результаты
При УЗ-исследовании обнаружен один живой плод женского пола в головном предлежании. Гестационный срок составил 34,4 нед. Фетометрические показатели плода соответствовали данному сроку. Патологических изменений плаценты и околоплодных вод не выявлено. При исследовании мочевой пузырь в типичном месте не визуализировался.
В нижних отделах передней брюшной стенки в надлобковой области визуализировалось эхогенное образование размером 30x28x25 мм (рис. 1, 2). Определялось низкое впадение пуповины. Почки плода визуализировались в типичном месте, без структурных изменений. Патологических изменений других органов не было выявлено.
Рис. 1. Эхогенное образование в нижнем отделе передней брюшной стенки (экстрофированный мочевой пузырь).
Рис. 2. Экстрофия мочевого пузыря в сочетании с отсутствием видимой патологии наружных половых органов (режим трехмерной реконструкции).
2. Экстрофия мочевого пузыря в сочетании с отсутствием видимой патологии наружных половых органов (режим трехмерной реконструкции).
Поставлен диагноз: «Беременность 34,4 нед. ВПР плода — экстрофия мочевого пузыря».
Обсуждение
Пренатальными УЗ-признаками экстрофии мочевого пузыря являются: отсутствие визуализации мочевого пузыря при нормальном количестве околоплодных вод, структурно неизмененные почки, визуализация эхогенного образования в надлобковой области, аномалии строения половых органов. Использование ЦДК является дополнительным инструментом для диагностики экстрофии мочевого пузыря. В норме пупочные артерии проходят вдоль стенки мочевого пузыря при поперечном сканировании нижней части живота. Для экстрофии мочевого пузыря характерно низкое впадение пуповины, при котором артерии охватывают образование в надлобковой области. При отсутствии визуализации мочевого пузыря в типичном месте необходимо провести повторное сканирование через 30-40 мин для адекватной оценки его расположения и степени наполнения.
При отсутствии визуализации мочевого пузыря в типичном месте необходимо провести повторное сканирование через 30-40 мин для адекватной оценки его расположения и степени наполнения.
Изолированная экстрофия мочевого пузыря, как правило, не сочетается с хромосомными перестройками у плода и не требует пренатального кариотипирования.
В данном клиническом наблюдении экстрофия мочевого пузыря была диагностирована у плода женского пола, что встречается значительно реже, чем у плодов мужского пола. Кроме того, отсутствие выраженной деформации наружных половых органов позволяет предположить неполную форму экстрофии. Оценка анатомии мочевого пузыря включена в протокол обязательного скринингового обследования во всех триместрах беременности. Отсутствие визуализации мочевого пузыря в типичном месте должно насторожить врачей УЗ-диагностики. Однако часто экстрофия мочевого пузыря диагностируют лишь в III триместре беременности.
После рождения детям с экстрофией мочевого пузыря требуется многоэтапная сложная хирургическая коррекция.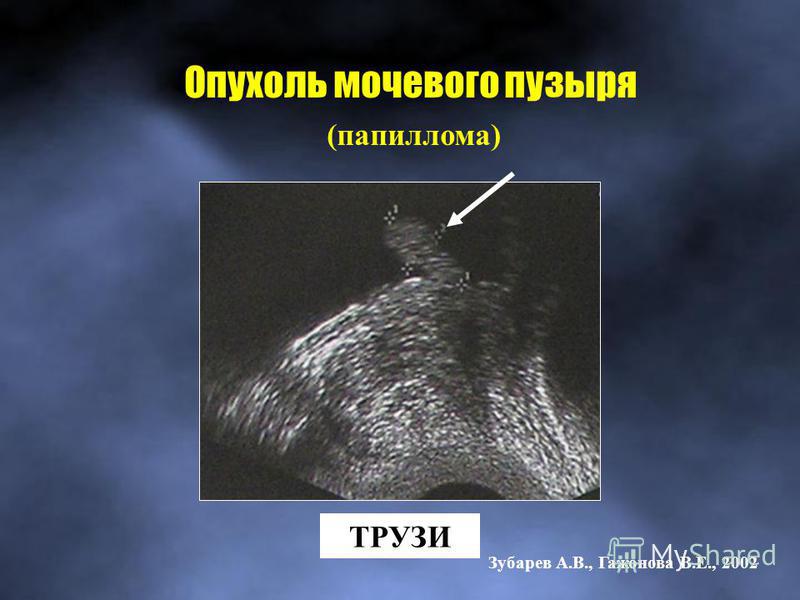 Процент неудовлетворительных отдаленных результатов, к сожалению, остается на сегодняшний день очень высоким, как правило, вследствие присоединения таких осложнений, как нарушение функции тазовых органов: недержание мочи, рубцовая деформация половых органов, половая дисфункция, выраженная деформация передней брюшной стенки, уретерогидронефроз III-IV степени, непрерывно рецидивирующий пиелонефрит со снижением функции почек, хроническая почечная недостаточность и др. [4, 7]. Огромной и сложной проблемой остается медико-социальная реабилитация больных с экстрофией мочевого пузыря.
Процент неудовлетворительных отдаленных результатов, к сожалению, остается на сегодняшний день очень высоким, как правило, вследствие присоединения таких осложнений, как нарушение функции тазовых органов: недержание мочи, рубцовая деформация половых органов, половая дисфункция, выраженная деформация передней брюшной стенки, уретерогидронефроз III-IV степени, непрерывно рецидивирующий пиелонефрит со снижением функции почек, хроническая почечная недостаточность и др. [4, 7]. Огромной и сложной проблемой остается медико-социальная реабилитация больных с экстрофией мочевого пузыря.
Заключение
Сложности ранней диагностики связаны с невыраженными УЗ-проявлениями достаточно тяжелой патологии. Четкое соблюдение алгоритма скрининговых УЗ-исследований анатомии плода в 11-14 и 20-22 нед беременности позволяет диагностировать экстрофию мочевого пузыря. При выявлении экстрофии мочевого пузыря у плода необходимо проведение медико-генетического консультирования с оформлением пренатального консилиума. Требуется тщательное разъяснение родителям сути выявленной патологии, а также информация о частых послеоперационных отдаленных последствиях и осложнениях как физического, так и психогенного генеза.
Требуется тщательное разъяснение родителям сути выявленной патологии, а также информация о частых послеоперационных отдаленных последствиях и осложнениях как физического, так и психогенного генеза.
Литература
- Лопаткин Н.А., Пугачев А.Г. Пороки развития мочевого пузыря и уретры. В кн. Детская урология. Руководство. М.: Медицина, 1986. С. 207-242.
- Gearhart J.P. Criteria for the prenatal diagnosis of classic bladder exstrophy / J.P. Gearhart, J. Ben-Chaim, R.D. Jeffs // Obstet. Gynecol. 1995. Jun. 1. V. 85. № 6. P. 961-964.
- Михельсон А.И. Оперативное лечение недержания мочи на почве врожденных аномалий мочевой системы. Минск, Госсиздат БССР. 1957.
- Осипов И.Б. Реконструктивно-пластические операции при экстрофии мочевого пузыря у детей: автореф. дисс. докт. мед. наук. СПб, 1996.
- Ахунзянов А.
 А. Диагностика и лечение врожденной клоаки у детей // Хирургия. 1976. № 9. С. 98-101.
А. Диагностика и лечение врожденной клоаки у детей // Хирургия. 1976. № 9. С. 98-101. - Захаров Н.Л. Дефекты передней брюшной стенки у новорожденных // Хирургия. 1986. № 6.
- Hollowell J.G., Ransley P.G. Surgical management of Incontinence in bladder exstrophy // Brit. J. Urol. 1991. V. 68. № 5. P. 543-548.
- Kockum C.C., Hansson E.E., Stenberg A.et. al. Bladder exstrophy in Sweden-a long-term follow-up study // Eur. J. Pediatr. Surg. 1996. V. 6. P. 208-211.
- Баиров Г.А., Ахметджанов И.А., Осипов И.Б. Реконструктивно-пластические операции при экстрофии мочевого пузыря у детей // Вестник хирургии. 1986. Т. 136. № 6. С. 105-108.
SonoAce-R7
Универсальный ультразвуковой сканер высокого класса, ультракомпактный дизайн и инновационные возможности.
причины, симптомы, диагностика и лечение в НКЦ ОАО «РЖД», с филиалом ЦКБ № 1.
Нейрогенным мочевым пузырем называют нарушение функции мочеиспускания, обусловленное поражением нервной системы. Нейрогенную дисфункцию мочевого пузыря нельзя рассматривать как самостоятельное заболевание. Это собирательный синдром, объединяющий состояния, возникающие в связи с врожденными или приобретенными поражениями на различных уровнях нервных путей и центров, иннервирующих мочевой пузырь и обеспечивающих функцию произвольного мочеиспускания.
Причины возникновения нейрогенного мочевого пузыря:
· Воспалительно-дегенеративные заболевания и опухоли головного и спинного мозга (энцефалит; диабетическая, алкогольная и поствакцинальные нейропатии, холестеатома, туберкулома, рассеянный склероз и т. д. ).
).
· Травматические повреждения головного и спинного мозга (инсульты, разрывы, сдавления, разрушения, хирургические вмешательства на органах малого таза).
· Врожденные дефекты терминального отдела позвоночника, спинного мозга, нервной системы мочевого пузыря.
Клиника
Нарушения при нейрогенном мочевом пузыре бывают либо в виде патологической задержки мочи, либо в виде ее недержания. Истинное недержание мочи сопровождается отсутствием ощущения наполнения мочевого пузыря. Больной не может удерживать мочу, она не накапливается в мочевом пузыре и беспрерывно выделяется по каплям по мере поступления в него.
При парадоксальном недержании мочи (вялом мочевом пузыре) нарушается рефлекторное опорожнение пузыря. Детрузор не сокращается, внутренний сфинктер закрыт. Мочевой пузырь наполняется, а рефлекс не срабатывает. При переполнении мочевого пузыря моча, вследствие механического растяжения внутреннего сфинктера, небольшими порциями вытекает наружу. При этом большое количество мочи остается в мочевом пузыре (остаточная моча).
При переполнении мочевого пузыря моча, вследствие механического растяжения внутреннего сфинктера, небольшими порциями вытекает наружу. При этом большое количество мочи остается в мочевом пузыре (остаточная моча).
При отсутствии корковой регуляции мочеиспускания (при повреждении спинного мозга выше центров сегментарной иннервации мочевого пузыря) мочевой пузырь опорожняется рефлекторно – формируется автоматизм мочевого пузыря: по мере его растяжения накопленной мочой возникают соответствующие раздражения рецепторов растяжения (давления) и происходит рефлекторное опорожнение. Моча выделяется непроизвольно. Ощущение наполнения мочевого пузыря и позывы к мочеиспусканию чаще всего отсутствуют. В этом случае наблюдается периодическое недержание мочи при постоянной остаточной моче в пузыре (спастичный мочевой пузырь) .
Другим нарушением чувствительности мочевого пузыря может быть отсутствие чувства его наполненности и позывов к мочеиспусканию. При этом нарушении человек не чувствует своего мочевого пузыря и о необходимости мочеиспускания приходится постоянно помнить. Это нарушение, особенно в сочетании со спазмом сфинктера, может приводить к патологическому расширению мочевого пузыря, забросу мочи в мочеточники и почки с развитием в них воспаления.
Это нарушение, особенно в сочетании со спазмом сфинктера, может приводить к патологическому расширению мочевого пузыря, забросу мочи в мочеточники и почки с развитием в них воспаления.
Наряду с невозможностью контролировать мочеиспускание, могут возникать такие патологические ощущения в мочевом пузыре как чувство его чрезмерной наполненности с так называемыми ложными позывами к мочеиспусканию. Ложные позывы могут возникать очень часто, лишая человека возможности нормально работать и общаться.
Ввиду того, что денервация мочевого пузыря приводит к резко выраженным трофическим нарушениям, течение болезни часто осложняется интерстициальным циститом, вызывающим склерозирование и сморщивание мочевого пузыря. Это тяжелое осложнение усугубляет опасность для почек и в ряде случаев требует специальных хирургических вмешательств для увеличения емкости мочевого пузыря.
Диагностика
Большое значение в диагностике нейрогенного мочевого пузыря помимо осмотра придается лабораторным и инструментальным исследованиям. Лабораторная диагностика включает в себя общий анализ мочи, пробу по Зимницкому, общий анализ крови, биохимическое исследование крови. Из рентгенологических исследований проводятся обзорная рентгенография, уретроцистография (обычная и микционная), экскреторная урография, восходящая пиелография. Значимыми методами инструментальной диагностики являются УЗИ почек и мочевого пузыря, радиоизотопная ренография, цистоскопия, уродинамическое исследование и видеоуродинамическое исследование (урофлоуметрия, цистометрия, сфинктерометрия).
Лабораторная диагностика включает в себя общий анализ мочи, пробу по Зимницкому, общий анализ крови, биохимическое исследование крови. Из рентгенологических исследований проводятся обзорная рентгенография, уретроцистография (обычная и микционная), экскреторная урография, восходящая пиелография. Значимыми методами инструментальной диагностики являются УЗИ почек и мочевого пузыря, радиоизотопная ренография, цистоскопия, уродинамическое исследование и видеоуродинамическое исследование (урофлоуметрия, цистометрия, сфинктерометрия).
Лечение
Лечение нейрогенного мочевого пузыря напрямую зависит от причины повреждения нервов и требует, в первую очередь, проведение лечения первичного заболевания. Выделяют три основных направления лечения: медикаментозное, электростимуляция и хирургическое.
Основным видом лечения является использование фармакологических средств. При задержке мочи необходимы также адекватное дренирование мочевого пузыря с использованием постоянного катетера; профилактика инфекции мочевых путей или лечение урологической инфекции в случае ее развития антисептиками и/или антибиотиками. У больных с недержанием мочи проводятся мероприятия для возобновления рефлекторного опорожнения мочевого пузыря. С этой целью применяют регулярное пережатие постоянного катетера на каждые 2-3 ч и другие методы.
У больных с недержанием мочи проводятся мероприятия для возобновления рефлекторного опорожнения мочевого пузыря. С этой целью применяют регулярное пережатие постоянного катетера на каждые 2-3 ч и другие методы.
Пройти диагностику и лечение заболевания Вы можете в отделении неврологии Центра патологии спинного мозга нашей клиники .
Для получения подробной информации и записи на прием обращайтесь к нам по телефону контакт-центра: (495) 925-02-02 (круглосуточно).
Патология мочевого пузыря — обзор
УДЕРЖАНИЕ МОЧИ
После трансплантации почки задержка мочи может быть связана с обструкцией оттока мочевого пузыря или нейрогенным неконтрактильным пузырем. У пациентов с анурией эти проблемы могут быть выявлены только после удаления катетера Фолея после трансплантации. Пациенты с неконтрактильным мочевым пузырем обычно имеют в анамнезе проблемы с мочеиспусканием или неврологические расстройства, такие как болезнь Паркинсона, рассеянный склероз или диабет с периферической невропатией. При подозрении на патологию мочевого пузыря диагноз может поставить уродинамик. Немедленная терапия — это чистая периодическая самокатетеризация, которая безопасна и эффективна для реципиентов трансплантата. 9
При подозрении на патологию мочевого пузыря диагноз может поставить уродинамик. Немедленная терапия — это чистая периодическая самокатетеризация, которая безопасна и эффективна для реципиентов трансплантата. 9
Обструкция оттока мочевого пузыря после трансплантации почти исключительно наблюдается у мужчин и может быть вызвана стриктурой уретры, доброкачественной гипертрофией простаты или контрактурой шейки мочевого пузыря, или, реже, инородным телом, стойкими задними клапанами уретры или эктопическим уретероцеле. . Мужчинам с анурией и доброкачественной гипертрофией простаты не следует предлагать хирургическое вмешательство перед трансплантацией, потому что трансуретральная операция на предстательной железе в «сухой уретре» имеет высокую вероятность образования стриктур.После трансплантации у мужчин со значительной обструкцией оттока мочевого пузыря из-за доброкачественной гипертрофии предстательной железы терапию следует начинать с альфа-блокатора (например, теразозина, тамсулозина, альфузозина) и ингибитора 5-альфа-редуктазы (например, финастерида, дутастерида).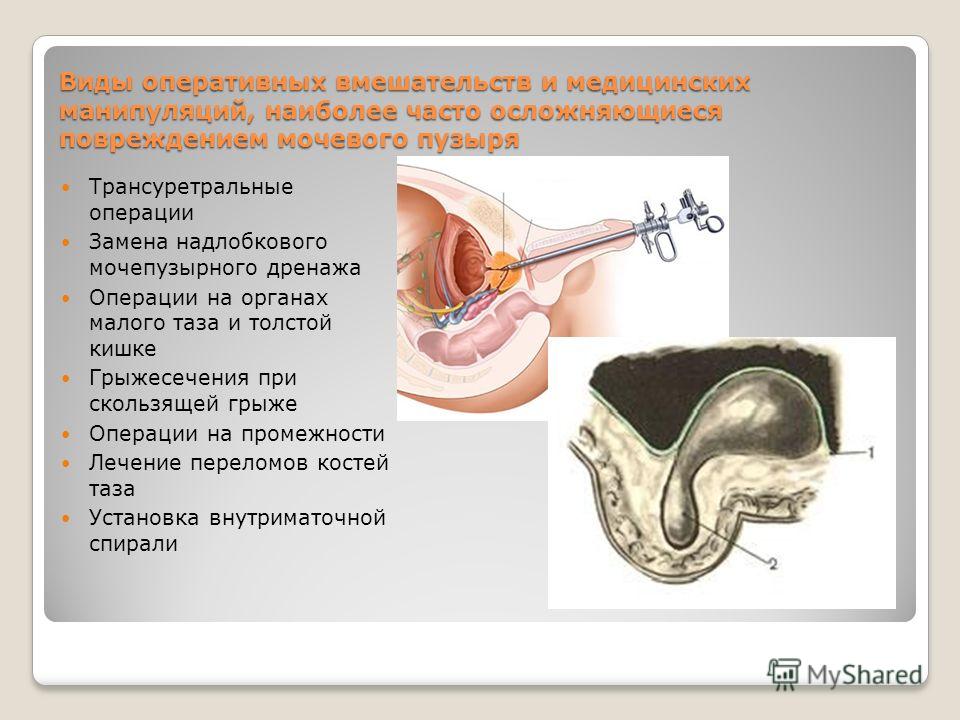 Мужчинам, находящимся в удержании, несмотря на прием лекарств, следует начать периодическую самокатетеризацию и отложить окончательную операцию на предстательной железе как минимум на 3 месяца. Хотя трансуретральная резекция простаты может быть сделана сразу после трансплантации, сообщалось о 22 значительной заболеваемости 33 и смертности 37 .Хотя нет публикаций о минимально инвазивных методах лечения доброкачественной гипертрофии предстательной железы у реципиентов трансплантата, мы в отдельных случаях успешно использовали трансуретральную игольную абляцию и фотоселективную вапоризацию простаты (ПВП) (ПВП «зеленый свет»).
Мужчинам, находящимся в удержании, несмотря на прием лекарств, следует начать периодическую самокатетеризацию и отложить окончательную операцию на предстательной железе как минимум на 3 месяца. Хотя трансуретральная резекция простаты может быть сделана сразу после трансплантации, сообщалось о 22 значительной заболеваемости 33 и смертности 37 .Хотя нет публикаций о минимально инвазивных методах лечения доброкачественной гипертрофии предстательной железы у реципиентов трансплантата, мы в отдельных случаях успешно использовали трансуретральную игольную абляцию и фотоселективную вапоризацию простаты (ПВП) (ПВП «зеленый свет»).
Американский журнал хирургической патологии
Что вы по профессии? Academic MedicineAcute Уход NursingAddiction MedicineAdministrationAdvanced Практика NursingAllergy и ImmunologyAllied здоровьеАльтернативная и комплементарной MedicineAnesthesiologyAnesthesiology NursingAudiology & Ear и HearingBasic ScienceCardiologyCardiothoracic SurgeryCardiovascular NursingCardiovascular SurgeryChild NeurologyChild PsychiatryChiropracticsClinical SciencesColorectal SurgeryCommunity HealthCritical CareCritical Уход NursingDentistryDermatologyEmergency MedicineEmergency NursingEndocrinologyEndoncrinologyForensic MedicineGastroenterologyGeneral SurgeryGeneticsGeriatricsGynecologic OncologyHand SurgeryHead & Neck SurgeryHematology / OncologyHospice & Паллиативная CareHospital MedicineInfectious DiseaseInfusion Сестринское делоВнутреннее / Лечебное делоВнутреннее / Лечебное отделениеБиблиотечные науки Уход за матерью и детьмиМедицинская онкологияМедицинские исследованияНеонатальный / Перинатальный Неонатальный / Перинатальный уход ecialtiesNursing-educationNutrition & DieteticsObstetrics & GynecologyObstetrics & Gynecology NursingOccupational & Environmental MedicineOncology NursingOncology SurgeryOphthalmology / OptometryOral и челюстно SurgeryOrthopedic NursingOrthopedics / Позвоночник / Спорт Медицина SurgeryOtolaryngologyPain MedicinePathologyPediatric SurgeryPediatricsPharmacologyPharmacyPhysical Медицина и RehabilitationPhysical Терапия и женщин Здоровье Физическое TherapyPlastic SurgeryPodiatary-generalPodiatry-generalPrimary Уход / Семейная медицина / Общие PracticePsychiatric Сестринское делоПсихиатрияПсихологияОбщественное здравоохранениеПульмонологияРадиационная онкология / ТерапияРадиологияРевматологияНавыки и процедурыСонотерапияСпорт и упражнения / Тренировки / ФитнесСпортивная медицинаХирургический уходПереходный уходТрансплантационная хирургияТерапия травмТравматическая хирургияУрологияЖенское здоровьеУход за ранамиДругое
Что ваша специальность? Addiction MedicineAllergy & Clinical ImmunologyAnesthesiologyAudiology & Speech-Language PathologyCardiologyCardiothoracic SurgeryCritical Уход MedicineDentistry, Oral Surgery & MedicineDermatologyDermatologic SurgeryEmergency MedicineEndocrinology & MetabolismFamily или General PracticeGastroenterology & HepatologyGenetic MedicineGeriatrics & GerontologyHematologyHospitalistImmunologyInfectious DiseasesInternal MedicineLegal / Forensic MedicineNephrologyNeurologyNeurosurgeryNursingNutrition & DieteticsObstetrics & GynecologyOncologyOphthalmologyOrthopedicsOtorhinolaryngologyPain ManagementPathologyPediatricsPlastic / Восстановительная SugeryPharmacology & PharmacyPhysiologyPsychiatryPsychologyPublic, Окружающая среда и гигиена трудаРадиология, ядерная медицина и медицинская визуализацияФизическая медицина и реабилитация Респираторная / легочная медицинаРевматологияСпортивная медицина / наукаХирургия (общая) Травматологическая хирургияТоксикологияТрансплантационная хирургияУрологияСосудистая хирургияВироло у меня нет медицинской специальности
Каковы ваши условия работы? Больница на 250 коекБольница на более 250 коекУправление престарелыми или хосписы Психиатрическое или реабилитационное учреждениеЧастная практикаГрупповая практикаКорпорация (фармацевтика, биотехнология, инженерия и т. Д.) Докторантура Университета или Медицинского факультета Магистратура или 4-летнего Академического Университета Колледж Сообщества Правительство Другое
Д.) Докторантура Университета или Медицинского факультета Магистратура или 4-летнего Академического Университета Колледж Сообщества Правительство Другое
Практическое руководство по патологии рака мочевого пузыря
Mokdad, A.H. et al. . Тенденции и модели различий в смертности от рака между округами США, 1980–2014 гг. JAMA 317 , 388–406 (2017).
Артикул PubMed PubMed Central Google ученый
Weijers, Y., Arentsen, H.C., Arends, T. J. H. & Witjes, J. A. Управление немышечноинвазивной карциномой мочевого пузыря низкого и среднего риска.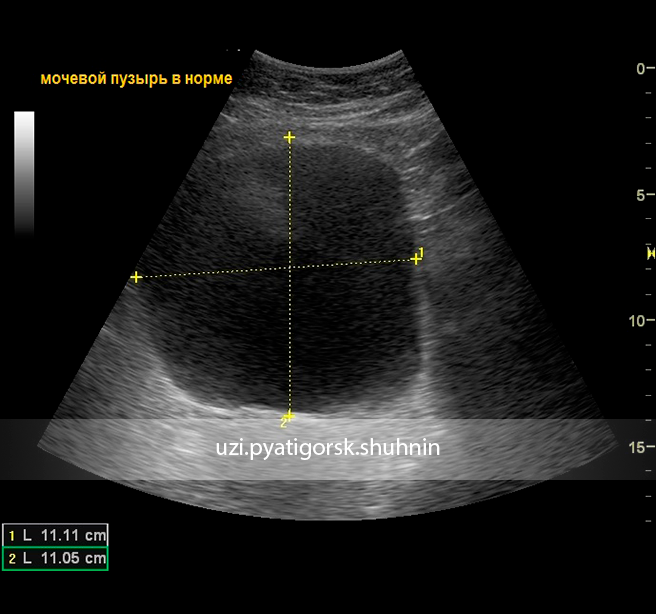 Hematol. Онкол. Clin. North Am. 29 , 219–225, vii (2015).
Hematol. Онкол. Clin. North Am. 29 , 219–225, vii (2015).
Артикул PubMed Google ученый
Чаппиди, М.Р. и др. . Причины, сроки, больничные расходы и периоперационные исходы индексной и неиндексной повторных госпитализаций после радикальной цистэктомии: значение для регионализации помощи. J. Urol. 197 , 296–301 (2017).
Артикул PubMed Google ученый
Велти, К. Дж. и др. . Оценка риска рака мочевого пузыря (COBRA): оценка смертности после радикальной цистэктомии. Рак 123 , 4574–4582 (2017).
CAS Статья PubMed Google ученый
Альфред Витес, Дж. и др. . Обновленные рекомендации ЕАУ 2016 г. по мышечно-инвазивному и метастатическому раку мочевого пузыря. Eur. Урол. 71 , 462–475 (2017).
CAS Статья PubMed Google ученый
Бабюк, М. и др. . Рекомендации EAU по неинвазивной уротелиальной карциноме мочевого пузыря: обновление 2016 г. Eur. Урол. 71 , 447–461 (2017).
Артикул PubMed Google ученый
Hansel, D. E. et al. . Современное обновление стандартов патологии при раке мочевого пузыря: трансуретральная резекция и образцы радикальной цистэктомии. Eur. Урол. 63 , 321–332 (2013).
Артикул PubMed Google ученый
Амин, М. Б. и др. . Обновление для практикующего патолога: Международная консультация по урологическим заболеваниям — Европейская ассоциация урологов по вопросам рака мочевого пузыря. Мод. Патол. 28 , 612–630 (2015).
Артикул PubMed Google ученый
Чандра, А., Griffiths, D. & McWilliam, L.J. Передовой опыт: макроскопическое исследование и отбор образцов хирургических образцов из мочевого пузыря. J. Clin. Патол. 63 , 475–479 (2010).
Артикул PubMed Google ученый
Международное сотрудничество в области отчетности по раку. Добро пожаловать в Международное сотрудничество по сообщению о раке (ICCR). ICCR http://www. iccr-cancer.org/ (2018).
iccr-cancer.org/ (2018).
Хамфри, П.А., Мох, Х., Кубилла, Улбрайт, А. Л., Т. М. и Рейтер, В. Е. Классификация ВОЗ опухолей мочевыделительной системы и мужских половых органов 2016 г. — часть B: опухоли простаты и мочевого пузыря. Eur. Урол. 70 , 106–119 (2016).
Артикул PubMed Google ученый
Классификация опухолей Всемирной организации здравоохранения. Патология и генетика опухолей мочевыделительной системы и мужских половых органов (IARC Press, Lyon, 2004).
Эпштейн, Дж. И., Амин, М. Б., Рейтер, В. Р. и Мостофи, Ф. К. Консенсусная классификация уротелиальных (переходных клеток) новообразований мочевого пузыря Всемирной организацией здравоохранения / Международным обществом урологической патологии. Комитет конференции по консенсусу по мочевому пузырю. г. J. Surg. Патол. 22 , 1435–1448 (1998).
Комитет конференции по консенсусу по мочевому пузырю. г. J. Surg. Патол. 22 , 1435–1448 (1998).
CAS Статья PubMed Google ученый
Мостофи, Ф.К., Собин, Л. Х. и Торлони, Х. Гистологическое типирование опухолей мочевого пузыря (Всемирная организация здравоохранения, Женева, 1973).
Google ученый
Сильвестр Р. Дж. и др. . Прогнозирование рецидива и прогрессирования у отдельных пациентов с раком мочевого пузыря стадии Ta T1 с использованием таблиц риска EORTC: комбинированный анализ 2596 пациентов из семи исследований EORTC. Eur. Урол. 49 , 466–477 (2006).
Артикул PubMed Google ученый
Ким, Дж. К. и др. . Папиллярное уротелиальное новообразование низкого злокачественного потенциала (PUNLMP) после первоначальной ТУР-БТ: сравнительный анализ с неинвазивной папиллярной уротелиальной карциномой низкой степени злокачественности (LGPUC). J. Cancer 8 , 2885–2891 (2017).
Артикул PubMed PubMed Central Google ученый
Ху, З., Mudaliar, K., Quek, M. L., Paner, G. P. и Barkan, G. A. Измерение размера инвазивного компонента в уротелиальной карциноме pT1 в образцах трансуретральной резекции может предсказать время рецидива. Ann. Диаг. Патол. 18 , 49–52 (2014).
Артикул PubMed Google ученый
МакКенни, Дж. К., Гомес, Дж. А., Десаи, С., Ли, М. В. и Амин, М. Б. Морфологические проявления уротелиальной карциномы in situ: подробная оценка ее гистологических структур с акцентом на карциному in situ с микроинвазией. г. J. Surg. Патол. 25 , 356–362 (2001).
К., Гомес, Дж. А., Десаи, С., Ли, М. В. и Амин, М. Б. Морфологические проявления уротелиальной карциномы in situ: подробная оценка ее гистологических структур с акцентом на карциному in situ с микроинвазией. г. J. Surg. Патол. 25 , 356–362 (2001).
CAS Статья PubMed Google ученый
Сеть исследований атласа генома рака. Комплексная молекулярная характеристика уротелиальной карциномы мочевого пузыря. Природа 507 , 315–322 (2014).
Розенталь Д. Л., Войчик Э. М. и Куртыц Д. Ф. И. Парижская система отчетности по цитологии мочи (Springer, 2016).
Google ученый
Reis, L. O. et al. . Значение второстепенного компонента высокой степени злокачественности в неинвазивной папиллярной уротелиальной карциноме мочевого пузыря низкой степени злокачественности. Гум. Патол. 47 , 20–25 (2016).
O. et al. . Значение второстепенного компонента высокой степени злокачественности в неинвазивной папиллярной уротелиальной карциноме мочевого пузыря низкой степени злокачественности. Гум. Патол. 47 , 20–25 (2016).
Артикул PubMed Google ученый
Cheng, L. et al. . Неоднородность рака и его биологические последствия для классификации уротелиальной карциномы. Рак 88 , 1663–1670 (2000).
CAS Статья PubMed Google ученый
Гофрит, О. Н. и др. . Смешанные опухоли мочевого пузыря высокой и низкой степени злокачественности — клинически высокая или низкая? J. Urol. 191 , 1693–1696 (2014).
Артикул PubMed Google ученый
Доунс, М. Р. и др. .Анализ папиллярных уротелиальных карцином мочевого пузыря с неоднородностью степени: подтверждающие доказательства ранней роли делеций CDKN2A в пути FGFR3. Гистопатология 70 , 281–289 (2017).
Артикул PubMed Google ученый
Киркали, З. и др. . Рак мочевого пузыря: эпидемиология, стадия и классификация, диагностика. Урология 66 , 4–34 (2005).
Артикул PubMed Google ученый
van Rhijn, B. W. G. et al. . Рецидив и прогрессирование заболевания при неинвазивном раке мочевого пузыря: от эпидемиологии к стратегии лечения. Eur. Урол. 56 , 430–442 (2009).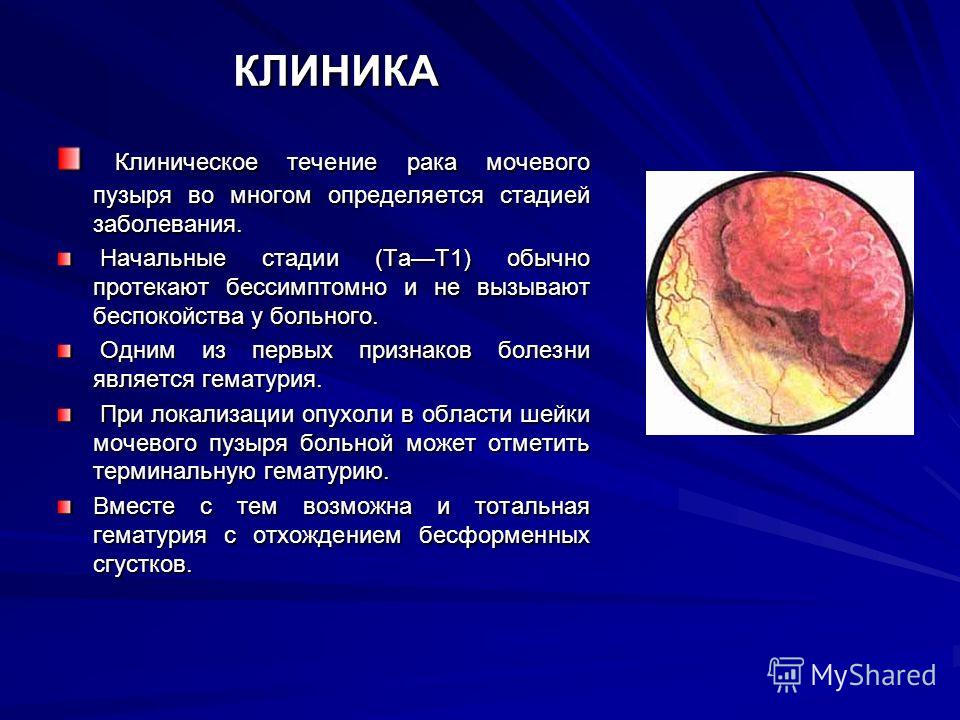
Артикул PubMed Google ученый
Уильямс, С. Б. и Камат, А. М. Оптимальное лечение неинвазивного мышечного микропапиллярного варианта уротелиальной карциномы: возможность упущенного шанса на излечение? BJU Int. 118 , 349–350 (2016).
Артикул PubMed Google ученый
Compérat, E. et al. . Исследование воспроизводимости между наблюдателями инвазивности рака мочевого пузыря с использованием виртуальной микроскопии и тепловых карт. Гистопатология 63 , 756–766 (2013).
Артикул PubMed Google ученый
Herr, H. W., Donat, S. M. и Dalbagni, G. Может ли повторная трансуретральная резекция рака мочевого пузыря T1 отбирать пациентов для немедленной цистэктомии? J. Urol. 177 , 75–79 (2007).
W., Donat, S. M. и Dalbagni, G. Может ли повторная трансуретральная резекция рака мочевого пузыря T1 отбирать пациентов для немедленной цистэктомии? J. Urol. 177 , 75–79 (2007).
Артикул PubMed Google ученый
van Rhijn, B. W. G. et al. . Просмотр патологической стадии показан при первичном раке мочевого пузыря pT1. BJU Int. 106 , 206–211 (2010).
Артикул PubMed Google ученый
Орсола, А. и др. . Исходная уротелиально-клеточная карцинома высокой степени злокачественности T1: возможность и прогностическое значение микростадий инвазии собственной пластинки (T1a / b / c) у пациентов, получавших и не получавших BCG. Eur. Урол. 48 , 231–238 (2005).
Урол. 48 , 231–238 (2005).
CAS Статья PubMed Google ученый
Kassouf, W. et al. . Рекомендации по улучшению качества лечения рака мочевого пузыря в Канаде: согласованный документ, рассмотренный и одобренный Канадской организацией по борьбе с раком мочевого пузыря (BCC), Канадской урологической онкологической группой (CUOG) и Канадской урологической ассоциацией (CUA), декабрь 2015 г. Кан. Урол. Доц. J. 10 , E46 – E80 (2016).
Артикул PubMed PubMed Central Google ученый
Бол, М. Г. и др. . Воспроизводимость и прогностическая вариабельность степени инвазии и инвазии собственной пластинки на стадиях Та, Т1 уротелиальной карциномы мочевого пузыря. J. Urol. 169 , 1291–1294 (2003).
J. Urol. 169 , 1291–1294 (2003).
Артикул PubMed Google ученый
Лопес-Бельтран, А.И Ченг, Л. Рак мочевого пузыря стадии pT1: диагностические критерии, подводные камни и прогностическое значение. Патология 35 , 484–491 (2003).
Артикул PubMed Google ученый
Cox, R. & Epstein, J. I. Большой вложенный вариант уротелиальной карциномы: 23 случая, имитирующие гнезда фон Брунна, и инверсный характер роста неинвазивной папиллярной уротелиальной карциномы. г. J. Surg. Патол. 35 , 1337–1342 (2011).
Артикул PubMed Google ученый
Бримо, Ф. и др. . Инвертированная уротелиальная карцинома: серия из 12 случаев с широким морфологическим спектром, совпадающим с большим вложенным вариантом. Гум. Патол. 46 , 1506–1513 (2015).
Артикул PubMed Google ученый
Ченг, Л., Монтирони, Р., Дэвидсон, Д.Д. и Лопес-Белтран, А. Постановка и отчетность по уротелиальной карциноме мочевого пузыря. Мод. Патол. 22 (Приложение 2), S70 – S95 (2009).
Артикул PubMed Google ученый
Дрю П. А., Фурман Дж., Сивантос Ф. и Мерфи В. М. Вложенный вариант переходно-клеточной карциномы: агрессивное новообразование с безвредной гистологией. Мод. Патол. 9 , 989–994 (1996).
CAS PubMed Google ученый
Rouprêt, M. et al. . Прогностический интерес к различению инвазии мышечной слизистой оболочки (T1a по сравнению с T1b) при немышечной инвазивной карциноме мочевого пузыря: французское национальное многоцентровое исследование с центральным обзором патологии. J. Urol. 189 , 2069–2076 (2013).
Артикул PubMed Google ученый
Юнес, М., Sussman, J. & True, L.D. Полезность уровня мышечной слизистой оболочки при постановке инвазивной переходно-клеточной карциномы мочевого пузыря. Рак 66 , 543–548 (1990).
CAS Статья PubMed Google ученый
Орсола А. и др. . Пересмотр метода лечения рака мочевого пузыря высокой степени злокачественности T1 в зависимости от глубины инвазии собственной пластинки: проспективное исследование с участием 200 пациентов. руб. J. Cancer 112 , 468–474 (2015).
CAS Статья PubMed Google ученый
Де Марко, В. и др. . Прогностическая роль субстанции в переходно-клеточной карциноме мочевого пузыря T1G3. Мол. Clin. Онкол. 2 , 575–580 (2014).
Артикул PubMed PubMed Central Google ученый
Ченг, Л., Уивер, А. Л., Нойман, Р. М., Шерер, Б. Г. и Боствик, Д. Г. Подстадия карциномы мочевого пузыря Т1 на основе глубины инвазии, измеренной микрометром: новое предложение. Рак 86 , 1035–1043 (1999).
Рак 86 , 1035–1043 (1999).
CAS Статья PubMed Google ученый
ван дер Аа, М. Н. М. и др. . Новая система для подстановки папиллярного рака мочевого пузыря pT1: прогностическая оценка. Гум.Патол. 36 , 981–986 (2005).
CAS Статья PubMed Google ученый
van Rhijn, B. W. G. et al. . Новая высокопрогностическая система для определения подстадии рака мочевого пузыря T1. Eur. Урол. 61 , 378–384 (2012).
Артикул PubMed Google ученый
Бримо, Ф. и др. .Факторы прогноза при уротелиальной карциноме мочевого пузыря T1: значение регистрации миллиметровой глубины инвазии, диаметра инвазивной карциномы и инвазии мышечной слизистой оболочки. Гум. Патол. 44 , 95–102 (2013).
и др. .Факторы прогноза при уротелиальной карциноме мочевого пузыря T1: значение регистрации миллиметровой глубины инвазии, диаметра инвазивной карциномы и инвазии мышечной слизистой оболочки. Гум. Патол. 44 , 95–102 (2013).
Артикул PubMed Google ученый
Chang, W.-C., Chang, Y.-H. И Пан, К.-К. Прогностическое значение в подгруппе уротелиальной карциномы мочевого пузыря Т1 при трансуретральной резекции. г. J. Surg. Патол. 36 , 454–461 (2012).
Артикул PubMed Google ученый
Бриерли, Дж. Д., Господарович, М. К. и Виттекинд, К. Классификация злокачественных опухолей TNM (John Wiley & Sons, 2016).
Google ученый
Анантанараянан В. и др. . Влияние гистологических критериев и смешивающих факторов в постановке сомнительных случаев микроскопической перивезикальной тканевой инвазии (pT3a): исследование с участием нескольких наблюдателей среди патологоанатомов. г. J. Surg. Патол. 38 , 167–175 (2014).
Артикул PubMed Google ученый
Варинот, Дж. и др. . Полный анализ простатической уретры во время радикальной цистопростатэктомии по поводу рака мочевого пузыря: влияние на последнюю стадию заболевания. Virchows Arch. Int. J. Pathol. 455 , 449–453 (2009).
Артикул Google ученый
Лопес-Бельтран, А., Bassi, P., Pavone-Macaluso, M. & Montironi, R. Обработка и сообщение о патологии образцов с карциномой мочевого пузыря, мочеточника и почечной лоханки. Eur. Урол. 45 , 257–266 (2004).
& Montironi, R. Обработка и сообщение о патологии образцов с карциномой мочевого пузыря, мочеточника и почечной лоханки. Eur. Урол. 45 , 257–266 (2004).
Артикул PubMed Google ученый
Prakash и др. . Дивертикул мочевого пузыря и его связь со злокачественными новообразованиями: анатомическое исследование на трупах. Rom. J. Morphol. Эмбриол. 51 , 543–545 (2010).
CAS PubMed Google ученый
Уокер, Н. Ф., Ган, К., Олсбург, Дж. И Хан, М. С. Диагностика и лечение интрадивертикулярных опухолей мочевого пузыря. Nat. Преподобный Урол. 11 , 383–390 (2014).
Артикул PubMed Google ученый
Голиянин, Д., Йосепович, О., Бек, С.Д., Согани П. и Далбаньи Г. Карцинома в дивертикуле мочевого пузыря: представление и результаты лечения. J. Urol. 170 , 1761–1764 (2003).
Артикул PubMed Google ученый
Гопалан А. и др. . Карцинома урахала: клинико-патологический анализ 24 случаев с корреляцией результатов. г. J. Surg. Патол. 33 , 659–668 (2009).
Артикул PubMed PubMed Central Google ученый
Шелдон, К.А., Клейман, Р. В., Гонсалес, Р., Уильямс, Р. Д. и Фрейли, Е. Е. Злокачественные урахальные поражения. J. Urol. 131 , 1–8 (1984).
CAS Статья PubMed Google ученый
Брюинз, Х. М. и др. . Влияние степени лимфаденэктомии на онкологические исходы у пациентов, перенесших радикальную цистэктомию по поводу рака мочевого пузыря: систематический обзор. Eur. Урол. 66 , 1065–1077 (2014).
Артикул PubMed Google ученый
Ли Д. и др. . Плотность лимфатических узлов в сравнении с системой определения узловой стадии TNM Американского объединенного комитета по раку при узко-положительном раке мочевого пузыря у пациентов, перенесших расширенную или сверхрасширенную тазовую лимфаденэктомию. Урол. Онкол. 35 , 151.e1–151.e7 (2017).
Артикул Google ученый
Zehnder, P. и др.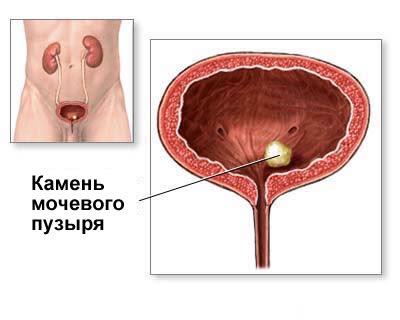 . Радикальная цистэктомия с суперрасширенной лимфаденэктомией: влияние отдельного или единичного представления лимфатических узлов на анализ и результаты. BJU Int. 117 , 253–259 (2016).
. Радикальная цистэктомия с суперрасширенной лимфаденэктомией: влияние отдельного или единичного представления лимфатических узлов на анализ и результаты. BJU Int. 117 , 253–259 (2016).
Артикул PubMed Google ученый
Штейн, Дж. П., Цай, Дж., Грошен, С. и Скиннер, Д. Г. Факторы риска для пациентов с метастазами в тазовые лимфатические узлы после радикальной цистэктомии с блочной тазовой лимфаденэктомией: понятие плотности лимфатических узлов. J. Urol. 170 , 35–41 (2003).
Артикул PubMed Google ученый
Амин, М. Б. и др. . Восьмое издание AJCC «Руководство по стадированию рака»: продолжение работы по наведению моста от популяционного подхода к более «персонализированному» подходу к определению стадии рака. CA. Рак J. Clin. 67 , 93–99 (2017).
CA. Рак J. Clin. 67 , 93–99 (2017).
Артикул Google ученый
Перри-Кин, Дж., Фергюсон, П., Самаратунга, Х., Нейси, Дж. Н. и Делахант, Б. Возможно, эффективно, но рентабельно ли? Ответ. Гистопатология 65 , 729–730 (2014).
Артикул PubMed Google ученый
Перри-Кин, Дж., Фергюсон, П., Самаратунга, Х., Нейси, Дж. Н. и Делахант, Б. Полное введение тканей тазовой лимфаденэктомии, удаленных во время радикальной простатэктомии по поводу рака простаты, увеличивает выход лимфатических узлов и обнаруживает микрометастазы. Гистопатология 64 , 399–404 (2014).
Артикул PubMed Google ученый
Masson-Lecomte, A. et al. . Внешняя проверка экстранодального расширения и плотности лимфатических узлов как предикторов выживаемости при лимфоузловом раке мочевого пузыря после радикальной цистэктомии. Ann. Surg. Онкол. 20 , 1389–1394 (2013).
Артикул PubMed Google ученый
Энгвад, Б., Poulsen, M. H., Staun, P. W., Walter, S. & Marcussen, N. Гистологическое поэтапное срезы тазовых лимфатических узлов увеличивает количество выявленных метастазов в лимфатические узлы. Virchows Arch. 464 , 45–52 (2014).
CAS Статья PubMed Google ученый
Ван, Х. Дж., Соланки, С., Трабулси, С., Кассуф, В. и Бримо, Ф. Гистологические изменения радикальной цистэктомии, связанные с неоадъювантной химиотерапией: точность оценки и прогнозирование ответа. Гум. Патол. 53 , 35–40 (2016).
Гистологические изменения радикальной цистэктомии, связанные с неоадъювантной химиотерапией: точность оценки и прогнозирование ответа. Гум. Патол. 53 , 35–40 (2016).
CAS Статья PubMed Google ученый
Ноулз, М. А. и Херст, К. Д. Молекулярная биология рака мочевого пузыря: новые взгляды на патогенез и клиническое разнообразие. Nat. Rev. Cancer 15 , 25–41 (2015).
CAS Статья PubMed Google ученый
Маевский, Т. и др. . Понимание развития рака мочевого пузыря человека с помощью стратегии геномного картирования всего органа. Lab. Вкладывать деньги. 88 , 694–721 (2008).
CAS Статья PubMed PubMed Central Google ученый
Нгуен, Д. П. и Тальманн, Г. Н. Современное обновление неоадъювантной терапии рака мочевого пузыря. Nat. Преподобный Урол. 14 , 348–358 (2017).
CAS Статья PubMed Google ученый
Sjödahl, G. и др. . Молекулярная таксономия уротелиальной карциномы. Clin. Cancer Res. 18 , 3377–3386 (2012).
Артикул CAS PubMed Google ученый
Патчан, О. и др. . Молекулярная патологическая основа для стратификации риска уротелиальной карциномы стадии T1. Eur. Урол. 68 , 824–836 (2015).
CAS Статья PubMed Google ученый
Чой, В. и др. . Идентификация различных базальных и просветных подтипов мышечно-инвазивного рака мочевого пузыря с различной чувствительностью к химиотерапии первой линии. Cancer Cell 25 , 152–165 (2014).
CAS Статья PubMed PubMed Central Google ученый
Damrauer, J. S. et al. . Внутренние подтипы рака мочевого пузыря высокой степени злокачественности отражают признаки биологии рака груди. Proc. Natl Acad. Sci. США 111 , 3110–3115 (2014).
CAS Статья PubMed Google ученый
Лернер С. П. и др. . Молекулярная таксономия рака мочевого пузыря: резюме консенсусной встречи. Рак мочевого пузыря 2 , 37–47 (2016).
Артикул PubMed PubMed Central Google ученый
Ребуйсу, С. и др. . EGFR как потенциальная терапевтическая мишень для подгруппы мышечно-инвазивного рака мочевого пузыря, имеющего базальный фенотип. Sci. Пер. Med. 6 , 244ra91 (2014).
Артикул CAS PubMed Google ученый
Sjödahl, G., Eriksson, P., Liedberg, F. & Höglund, M. Молекулярная классификация уротелиальной карциномы: глобальная классификация мРНК по сравнению с классификацией опухолевых клеток по фенотипу. J. Pathol. 242 , 113–125 (2017).
Артикул CAS PubMed PubMed Central Google ученый
МакКонки, Д. Дж. и др. . Сигнатура прогностической экспрессии гена в молекулярной классификации уротелиального рака, ранее не полученного химиотерапией, позволяет прогнозировать клинические исходы неоадъювантной химиотерапии: исследование фазы 2 плотных доз метотрексата, винбластина, доксорубицина и цисплатина с бевацизумабом при уротелиальном раке. Eur. Урол. 69 , 855–862 (2016).
CAS Статья PubMed Google ученый
Плимак, Э. Р. и др. . Дефекты в генах репарации ДНК предсказывают ответ на неоадъювантную химиотерапию на основе цисплатина при мышечно-инвазивном раке мочевого пузыря. Eur. Урол. 68 , 959–967 (2015).
CAS Статья PubMed PubMed Central Google ученый
Зайлер, Р. и др. . Влияние молекулярных подтипов мышечно-инвазивного рака мочевого пузыря на прогнозирование ответа и выживаемость после неоадъювантной химиотерапии. Eur. Урол. 72 , 544–554 (2017).
CAS Статья PubMed Google ученый
Powles, T. et al. . Лечение MPDL3280A (анти-PD-L1) приводит к клинической активности при метастатическом раке мочевого пузыря. Природа 515 , 558–562 (2014).
CAS Статья PubMed Google ученый
Кардос, Дж. и др. . Клаудиновые опухоли мочевого пузыря инфильтрируются иммунной системой и активно подавляются иммунной системой. JCI Insight 1 , e85902 (2016).
Артикул PubMed PubMed Central Google ученый
Международное сотрудничество в области отчетности по раку. Руководство по гистопатологической отчетности карциномы мочевыводящих путей Трансуретральная резекция и образец биопсии. ICCR http://www.iccr-cancer.org/datasets/datasets-under-consultation/datasets-for-comment/iccr-urinary-tract-tur-and-biopsy-bookmarked1st-ed (2018).
Международное сотрудничество в области отчетности по раку. Карцинома мочевого пузыря. Руководство по гистопатологии. Образцы цистэктомии, цистопростатэктомии и дивертикулэктомии. ICCR http://www.iccr-cancer.org/datasets/datasets-under-consultation/datasets-for-comment/iccr-urinary-tract-bladder-bookmarked1st-edition-v (2018).
Merlin, T., Weston, A. & Tooher, R. Расширение иерархии доказательств для включения других тем, кроме лечения: пересмотр австралийских «уровней доказательности». BMC Med. Res. Методол. 9 , 34 (2009).
Артикул PubMed PubMed Central Google ученый
Обзор плоскоклеточного рака мочевого пузыря, эпидемиология плоскоклеточного рака мочевого пузыря, патогенез и этиология
Bessette PL, Abell MR, Herwig KR.Клинико-патологическое исследование плоскоклеточного рака мочевого пузыря. Дж Урол . 1974 июл.112 (1): 66-7. [Медлайн].
Faysal MH. Плоскоклеточный рак мочевого пузыря. Дж Урол . 1981 ноябрь 126 (5): 598-9. [Медлайн].
Лагвински Н., Томас А., Стивенсон А. Дж., Кэмпбелл С., Хошар А. П., Эль-Габри Е. и др. Плоскоклеточный рак мочевого пузыря: клинико-патологический анализ 45 случаев. Ам Дж. Сург Патол . 2007 декабрь31 (12): 1777-87. [Медлайн].
Rous SN. Плоскоклеточный рак мочевого пузыря. Дж Урол . 1978 ноябрь 120 (5): 561-2. [Медлайн].
Сарма КП. Плоскоклеточный рак мочевого пузыря. Int Surg . 1970 Май. 53 (5): 313-9. [Медлайн].
Martin JW, Carballido EM, Ahmed A, et al. Плоскоклеточная карцинома мочевого пузыря: систематический обзор клинических характеристик и терапевтических подходов. Араб Дж Урол . 2016 Сентябрь 14 (3): 183-91. [Медлайн]. [Полный текст].
Майя М.К., Хансен А., Алвес С., Салах С. Биомаркеры плоскоклеточной карциномы мочевого пузыря, не связанной с шистосомозом: обзор. Crit Rev Oncol Hematol . 2019 Март 135: 76-84. [Медлайн].
Гауда I, Мохтар Н, Билал Д., Эль-Болкайны Т., Эль-Болкайны Н.М. Бильгарциоз и рак мочевого пузыря: анализ временных тенденций 9843 пациентов. J Egypt Natl Canc Inst .2007 июня 19 (2): 158-62. [Медлайн].
Heyns CF, van der Merwe A. Рак мочевого пузыря в Африке. Кан Дж Урол . 2008 15 февраля (1): 3899-908. [Медлайн].
Феликс А.С., Солиман А.С., Халед Х., Заглул М.С., Банерджи М., Эль-Баради М. и др. Изменения в структуре рака мочевого пузыря в Египте за последние 26 лет. Контроль причин рака . 2008 май. 19 (4): 421-9. [Медлайн].
Ахмад I, Барнетсон Р.Дж., Кришна Н.С.Кератинизирующая плоскоклеточная метаплазия мочевого пузыря: обзор. Урол Инт . 2008. 81 (3): 247-51. [Медлайн].
Хан М.С., Торнхилл Дж. А., Гаффни Э, Лофтус Б., Батлер МР. Кератинизирующая плоскоклеточная метаплазия мочевого пузыря: естественное течение и рационализация лечения на основе обзора 54-летнего опыта. Евро Урол . 2002 Ноябрь 42 (5): 469-74. [Медлайн].
Ньюман Д.М., Браун-младший, Джей А.К., Понтиус Э. Плоскоклеточный рак мочевого пузыря. Дж Урол . 1968 Октябрь 100 (4): 470-3. [Медлайн].
Faysal MH, Freiha FS. Первичное новообразование в дивертикулах мочевого пузыря. Отчет о 12 случаях. Бр Дж Урол . 1981, апрель, 53 (2): 141-3. [Медлайн].
STUART WT. Карцинома мочевого пузыря, связанная с экстрофией. Отчет о случае и обзор литературы. Va Med Mon (1918) . 1962, январь 89: 39-42. [Медлайн].
Ribeiro JC, Silva C, Sousa L, García P, Santos A.[Плоскоклеточный рак при экстрофии мочевого пузыря]. Actas Urol Esp . 2005 29 января (1): 110-2. [Медлайн].
Gupta S, Gupta IM. Ectopia vesicae, осложненная плоскоклеточным раком. Бр Дж Урол . 1976 Август 48 (4): 244. [Медлайн].
Rieder JM, Parsons JK, Gearhart JP, Schoenberg M. Первичная плоскоклеточная карцинома в нереконструированном экстрофическом мочевом пузыре. Урология . 2006 январь 67 (1): 199. [Медлайн].
Sheldon CA, Clayman RV, Gonzalez R, Williams RD, Fraley EE.Злокачественные урахальные поражения. Дж Урол . 1984, январь, 131 (1): 1-8. [Медлайн].
Lin RY, Rappoport AE, Deppisch LM, Natividad NS, Katz W. Плоскоклеточная карцинома урахуса. Дж Урол . 1977 Декабрь 118 (6): 1066-7. [Медлайн].
SHAW RE. Плоскоклеточный рак кисты мочеиспускательного канала. Бр Дж Урол . 1958 30 марта (1): 87-9. [Медлайн].
Чоу YC, Лин WC, Tzen CY, Chow YK, Lo KY.Плоскоклеточный рак мочевого пузыря. Дж Урол . 2000 Март 163 (3): 903-4. [Медлайн].
Fujiyama C, Nakashima N, Tokuda Y, Uozumi J. Плоскоклеточная карцинома урахуса. Инт Дж Урол . 2007 октября, 14 (10): 966-8. [Медлайн].
Brennan P, Bogillot O, Cordier S, Greiser E, Schill W., Vineis P, et al. Курение сигарет и рак мочевого пузыря у мужчин: объединенный анализ 11 исследований случай-контроль. Инт Дж. Рак .2000 15 апреля. 86 (2): 289-94. [Медлайн].
Фортуни Дж., Кожевинас М., Чанг-Клод Дж., Гонсалес Калифорния, Час М, Йокель К. Х. и др. Табак, профессия и непереходно-клеточная карцинома мочевого пузыря: международное исследование методом случай-контроль. Инт Дж. Рак . 1999, 5 января. 80 (1): 44-6. [Медлайн].
Kantor AF, Hartge P, Hoover RN, Fraumeni JF Jr. Эпидемиологические характеристики плоскоклеточного рака и аденокарциномы мочевого пузыря. Cancer Res . 1 июля 1988 г. 48 (13): 3853-5. [Медлайн].
Штейн Дж. П., Скиннер Э. К., Бойд С. Д., Скиннер Д. Г.. Плоскоклеточный рак мочевого пузыря, связанный с терапией циклофосфамидом гранулематоза Вегенера: сообщение о 2 случаях. Дж Урол . 1993 г., 149 (3): 588-9. [Медлайн].
Юрдакуль Т, Авундук МЦ, Пискин ММ. Чистый плоскоклеточный рак после внутрипузырного лечения БЦЖ. Отчет о болезни. Урол Инт .2005. 74 (3): 283-5. [Медлайн].
Эль-Болкаини М.Н., Мохтар Н.М., Гонейм М.А., Хусейн М.Х. Влияние шистосомоза на патологию карциномы мочевого пузыря. Рак . 1981 15 декабря. 48 (12): 2643-8. [Медлайн].
Botelho M, Ferreira AC, Oliveira MJ, Domingues A, Machado JC, da Costa JM. Общий антиген Schistosoma haematobium вызывает усиление пролиферации, миграции и инвазии, а также снижает апоптоз нормальных эпителиальных клеток. Инт Дж Паразитол . 2009 Август 39 (10): 1083-91. [Медлайн].
Chuttiangtum A, Udomthavornsuk B, Chumworathayi B. Скрининговый тест на гематурию для выявления инфильтрации слизистой оболочки мочевого пузыря при раке шейки матки. Азиатский Pac J Cancer Prev . 2012. 13 (10): 4931-3. [Медлайн].
Саккас JL. Клиника и лечение плоскоклеточного рака мочевого пузыря. Int Surg . 1966, январь, 45 (1): 71-6. [Медлайн].
Johnson DE, Schoenwald MB, Ayala AG, Miller LS.Плоскоклеточный рак мочевого пузыря. Дж Урол . 1976 Май. 115 (5): 542-4. [Медлайн].
Holck S, Jørgensen L. Веррукозная карцинома мочевого пузыря. Урология . 1983 22 октября (4): 435-7. [Медлайн].
Блэкмор CC, Ratcliffe NR, Harris RD. Веррукозный рак мочевого пузыря. Визуализация брюшной полости . 1995 сентябрь-октябрь. 20 (5): 480-2. [Медлайн].
Boileau M, Hui KK, Cowan DF. Инвазивная бородавчатая карцинома мочевого пузыря, леченная облучением. Урология . 1986, 27 января (1): 56-9. [Медлайн].
Вальтер М., О’Брайен Д. П. 3-й, Берч HW. Condylomata acuminata и бородавчатая карцинома мочевого пузыря: отчет о болезни и обзор литературы. Дж Урол . 1986 Февраль 135 (2): 362-5. [Медлайн].
Чапман-Фредрикс Дж. Р., Чиоффи-Лавина М., Аккола М. А., Рехрауэр В. М., Гарсия-Буитраго М. Т., Гомес-Фернандес С. и др. ДНК вируса папилломы человека высокого риска обнаружена при первичной плоскоклеточной карциноме мочевого пузыря. Arch Pathol Lab Med . 2013 Август 137 (8): 1088-93. [Медлайн].
Невес TR, Соарес MJ, Монтейро PG, Лима MS, Монтейро HG. Базалоидная плоскоклеточная карцинома мочевого пузыря с мелкоклеточной карциномой. Дж. Клин Онкол . 2011 20 мая. 29 (15): e440-2. [Медлайн]. [Полный текст].
Джинори А., Бароне А., Сантопьетро Р., Барбанти Г., Чеккони Ф, Триподи С.А. Базалоидная плоскоклеточная карцинома мочевого пузыря, связанная с вирусом папилломы человека, ассоциированная с инфекцией вируса папилломы человека половых путей. Инт Дж Урол . 2015 22 февраля (2): 222-5. [Медлайн]. [Полный текст].
Vakar-López F, Abrams J. Базалоидная плоскоклеточная карцинома мочевого пузыря. Arch Pathol Lab Med . 2000 Mar.124 (3): 455-9. [Медлайн].
Bostwick GD, Cheng L. В: Bostwick GD, Cheng L, eds. Новообразования мочевого пузыря . 2-е изд. Филадельфия, Пенсильвания: Эльзевьер / Мосби; 2008. Урологическая хирургическая патология: Консультация специалиста: 309.
Wu RL, Osman I, Wu XR, Lu ML, Zhang ZF, Liang FX и др. Ген уроплакина II экспрессируется при переходно-клеточной карциноме, но не экспрессируется при плоскоклеточной карциноме мочевого пузыря: альтернативные пути дифференцировки эпителия мочевого пузыря и образования опухоли. Cancer Res . 1998 15 марта. 58 (6): 1291-7. [Медлайн].
Джи-Дж. Р., Монтойя Р. Г., Халед Н. М., Сабичи А. Л., Гроссман Н. Б.. Экспрессия цитокератина 20, AN43, PGDH и COX-2 при переходной и плоскоклеточной карциноме мочевого пузыря. Урол Онкол . 2003 июл-авг. 21 (4): 266-70. [Медлайн].
Али М.С., Халед Х.М. Хромосомные аберрации при ранней стадии бильгарциального рака мочевого пузыря. Cancer Genet Cytogenet . 2002 г., 1. 132 (1): 41-5. [Медлайн].
Эль-Рифаи В., Камель Д., Ларраменди М.Л., Шоман С., Гад Ю., Байтун С. и др. Изменения количества копий ДНК при раке мочевого пузыря, ассоциированном и не ассоциированном с шистосомой. Ам Дж. Патол . 2000 Март.156 (3): 871-8. [Медлайн]. [Полный текст].
Fadl-Elmula I, Kytola S, Leithy ME, Abdel-Hameed M, Mandahl N, Elagib A, et al. Хромосомные аберрации при доброкачественных и злокачественных поражениях мочевого пузыря, связанных с бильгарзией, проанализированы с помощью сравнительной геномной гибридизации. BMC Рак . 2002 22 марта, 2: 5. [Медлайн]. [Полный текст].
Gonzalez-Zulueta M, Shibata A, Ohneseit PF, Spruck CH 3rd, Busch C, Shamaa M, et al. Высокая частота аллельной потери хромосомы 9p и изменений гена-супрессора опухоли CDKN2 при плоскоклеточном раке мочевого пузыря. Национальный институт рака . 1995 20 сентября. 87 (18): 1383-93. [Медлайн].
Muscheck M, Abol-Enein H, Chew K, Moore D. 2nd, Bhargava V, Ghoneim MA, et al. Сравнение генетических изменений переходного и плоскоклеточного рака мочевого пузыря, связанных с шистосомами, с использованием сравнительной геномной гибридизации. Канцерогенез . 2000 Сентябрь 21 (9): 1721-6. [Медлайн].
Pycha A, Mian C, Posch B, Haitel A, Mokhtar AA, El-Baz M и др. Численные хромосомные аберрации при мышечно-инвазивном плоскоклеточном и переходноклеточном раке мочевого пузыря: альтернатива классическим прогностическим показателям ?. Урология . 1999 Май. 53 (5): 1005-10. [Медлайн].
Шоу М.Э., старейшина П.А., Аббас А., Ноулз Массачусетс. Частичный аллелотип рака мочевого пузыря, ассоциированного с шистосомозом. Инт Дж. Рак . 1999 г. 1. 80 (5): 656-61. [Медлайн].
Habuchi T., Takahashi R, Yamada H, Ogawa O, Kakehi Y, Ogura K, et al. Влияние курения сигарет и шистосомоза на мутацию гена p53 при уротелиальном раке. Cancer Res . 1993 15 августа.53 (16): 3795-9. [Медлайн].
Рамчуррен Н., Купер К., Саммерхейес И. Молекулярные явления, лежащие в основе рака мочевого пузыря, связанного с шистосомозом. Инт Дж. Рак . 1995 28 июля, 62 (3): 237-44. [Медлайн].
Warren W, Biggs PJ, el-Baz M, Ghoneim MA, Stratton MR, Venitt S. Мутации в гене p53 при шистосомном раке мочевого пузыря: исследование 92 опухолей у египетских пациентов и сравнение мутационных спектров шистосомных и не -шистосомальные уротелиальные опухоли. Канцерогенез . 1995 Май. 16 (5): 1181-9. [Медлайн].
Абдуламир А.С., Хафид Р.Р., Кадхим Х.С., Абубакар Ф. Онкологические маркеры рака мочевого пузыря: шистосомные опухоли мочевого пузыря по сравнению с нешистосомальными опухолями мочевого пузыря. J Exp Clin Cancer Res . 2009 25 февраля, 28:27. [Медлайн]. [Полный текст].
Хуанг В., Уильямсон С.Р., Рао К., Лопес-Бельтран А., Монтирони Р., Эбл Дж. Н. и др. Новые маркеры сквамозной дифференцировки в мочевом пузыре. Хум Патол . 2013 Октябрь 44 (10): 1989-97. [Медлайн].
Przybojewska B, Jagiello A, Jalmuzna P. Активация генов H-RAS, K-RAS и N-RAS при раке мочевого пузыря человека. Cancer Genet Cytogenet . 2000 августа 121 (1): 73-7. [Медлайн].
Раббани Ф., Кордон-Кардо С. Мутация регуляторов клеточного цикла и их влияние на поверхностный рак мочевого пузыря. Урол Клин Норт Ам . 2000, 27 февраля (1): 83-102, ix. [Медлайн].
Guo CC, Gomez E, Tamboli P, Bondaruk JE, Kamat A, Bassett R, et al.Плоскоклеточный рак мочевого пузыря: клинико-патологическое и иммуногистохимическое исследование 16 случаев. Хум Патол . 2009 Октябрь 40 (10): 1448-52. [Медлайн].
Бадави А.Ф., Купер Д.П., Мостафа М.Х., Абул-Азм Т., Барнард Р., Марджисон Г.П. и др. Активность O6-алкилгуанин-ДНК-алкилтрансферазы при раке мочевого пузыря человека, связанном с шистосомозом. Eur J Cancer . 1994. 30A (9): 1314-9. [Медлайн].
Badawi AF, Mostafa MH, Aboul-Azm T, Haboubi NY, O’Connor PJ, Cooper DP.Повреждение промутагенным метилированием ДНК мочевого пузыря у пациентов с раком мочевого пузыря, ассоциированным с шистосомозом, и у здоровых людей. Канцерогенез . 1992 Май. 13 (5): 877-81. [Медлайн].
Fadl-Elmula I, Gorunova L, Lundgren R, Mandahl N, Forsby N, Mitelman F, et al. Хромосомные аномалии в двух карциномах мочевого пузыря с вторичной дифференцировкой плоскоклеточных клеток. Cancer Genet Cytogenet . 1998 15 апреля. 102 (2): 125-30. [Медлайн].
Lundgren R, Elfving P, Heim S, Kristoffersson U, Mandahl N, Mitelman F.Плоскоклеточный рак мочевого пузыря с кариотипическими аномалиями, напоминающий переходно-клеточный рак. Дж Урол . 1989, август 142 (2, часть 1): 374-6. [Медлайн].
Ванни Р., Скарпа Р.М., Ниедду М., Усай Э. Цитогенетическое исследование 30 карцином мочевого пузыря. Cancer Genet Cytogenet . 1988 30 января (1): 35-42. [Медлайн].
Пример Д.С., Ван М., Чжан С. и др. Мелкоклеточная карцинома мочевого пузыря и предстательной железы: статус мутации промотора TERT позволяет дифференцировать участки злокачественной опухоли и свидетельствует об общей клональности между мелкоклеточной карциномой мочевого пузыря и уротелиальной карциномой. Eur Urol Focus . 2018 декабрь 4 (6): 880-8. [Медлайн].
Грин Л.Ф., Пейдж Д.Л., Флеминг Д. и др. Американский объединенный комитет по раку (AJCC) Руководство по стадированию рака . 6-е изд. Нью-Йорк, штат Нью-Йорк: Спрингер-Верлаг; 2002.
Эль-Себайе М., Заглул М.С., Ховард Г., Мохтар А. Плоскоклеточная карцинома бильгарциального и небильгарциального мочевого пузыря: обзор этиологических особенностей, естественного течения и ведения. Инт Дж. Клин Онкол .2005 10 февраля (1): 20-5. [Медлайн].
Ричи Дж. П., Вайсман Дж., Скиннер Д. Г., Дретлер СП. Плоский рак мочевого пузыря: лечение радикальной цистэктомией. Дж Урол . 1976 июн. 115 (6): 670-2. [Медлайн].
Винклер Х.З., Натив О, Хосака Ю., Фэрроу Г.М., Либер М.М. Плоидность ядерной дезоксирибонуклеиновой кислоты при плоскоклеточном раке мочевого пузыря. Дж Урол . 1989, февраль, 141 (2): 297-302. [Медлайн].
Shaaban AA, Javadpour N, Tribukait B, Ghoneim MA.Прогностическое значение анализа проточной ДНК и изоантигенов клеточной поверхности при карциноме бильгарциального пузыря. Урология . 1992 марта 39 (3): 207-10. [Медлайн].
Elsobky E, El-Baz M, Gomha M, Abol-Enein H, Shaaban AA. Прогностическое значение ангиогенеза при плоскоклеточной карциноме мочевого пузыря, ассоциированной с шистосомой. Урология . 2002 Июль 60 (1): 69-73. [Медлайн].
Абдель-Рахман О. Плоскоклеточная карцинома мочевого пузыря: анализ базы данных SEER. Клиника рака гениторин . 2017 июн.15 (3): e463-8. [Медлайн].
Ghoneim MA, Ashamallah AK, Awaad HK, Whitmore WF Jr. Рандомизированное испытание цистэктомии с предоперационной лучевой терапией или без нее для карциномы бильгарциального пузыря. Дж Урол . 1985 августа. 134 (2): 266-8. [Медлайн].
Юсеф Р.Ф., Капур П., Мосбах А., Абол-Энеин Х., Гонейм М., Лотан Ю. Роль фактора роста фибробластов в плоскоклеточном раке мочевого пузыря: прогностический биомаркер и потенциальная терапевтическая цель. Урол Онкол . 2015 марта 33 (3): 111.e1-7. [Медлайн].
Izard JP, Siemens DR, Mackillop WJ, et al. Результаты плоской гистологии при раке мочевого пузыря: популяционное исследование. Урол Онкол . 2015 окт.33 (10): 425.e7-13. [Медлайн].
Martin JW, Vernez SL, Lotan Y, et al. Патологические характеристики и прогностические показатели различных гистопатологических типов рака мочевого пузыря после радикальной цистэктомии в большой одноцентровой египетской когорте. Мир Дж. Урол . 2018 Ноябрь 36 (11): 1835-43. [Медлайн].
Мочевой пузырь — Libre Pathology
Мочевой пузырь хранит мочу между мочеиспусканиями, то есть походами в туалет, чтобы сходить в туалет. Он получает мочу из мочеточников и выводит ее через уретру.
Часто болеет раком. Хорошо известным имитатором рака является малакоплакия . [1]
Микроскоп
- Muscularis mucosae — тонкая, прерывистая.
- Жир — много in lamina propria.
Примечание:
- На TURBT — никогда не звоните в pT3.
- AKA разделка .
Самый распространенный тип рака мочевого пузыря — это уротелиальная карцинома . Это описано в статье urothelium .
Факторы риска рака мочевого пузыря SEX LIC :
- S chistomsoma haematobium — особенно.плоскоклеточная карцинома. [2]
- EX трофей мочевого пузыря.
- L Итиаз.
- I Постоянный катетер или хроническое I воспаление. [2]
- C Иклофосфамид.
DDx:
Плоскоклеточный рак мочевого пузыря
Основная статья: Плоскоклеточный рак мочевого пузыря- Редкий вид рака мочевого пузыря.
- Уротелиальный рак с плоскоклеточной дифференцировкой встречается гораздо чаще.
Карцинома Урахала
Основная статья: карцинома УрахалаРабдомиосаркома мочевого пузыря
Основная статья: рабдомиосаркомаОбщий
- Считается крайне редко у взрослых. [3]
Микроскоп
- См. рабдомиосаркома .
DDx:
- Рабдомиосаркоматозная саркоматоидная карцинома — у взрослых встречается чаще, чем RMS.
- Требуется идентификация компонента карциномы.
- Рабдомиоматозная опухоль. [3]
- Используется, если при обширном отборе проб не обнаружен карциноматный компонент.
- Мелкоклеточный рак мочевого пузыря.
- Должен быть положительным на кератин и хромогранин А.
IHC
Характеристики: [3]
- Desmin + ve.
- Миогенин + ве.
- Кератины-ве.
Метастазы в мочевой пузырь
Основная статья: Метастазы в мочевой пузырьИнфаркт мочевого пузыря
Общий
Микроскоп
Характеристики: [4]
- Некроз без разжижения.
- Контуры видимых ячеек.
- Ядра отсутствуют.
Примечание:
- Разжижение предполагает инфекционную этиологию. [4]
Амилоидоз мочевого пузыря
Основная статья: амилоидоз мочевого пузыряТубулярная аденома мочевого пузыря
Основная статья: Тубулярная аденома мочевыводящих путейКератинизирующая плоскоклеточная метаплазия мочевого пузыря
Основная статья: Кератинизирующая плоскоклеточная метаплазия мочевого пузыряЛейомиома мочевого пузыря
Основная статья: Лейомиома мочевого пузыряЦистит
- См. уротелий .
- ↑ Wong-You-Cheong JJ, Woodward PJ, Manning MA, Davis CJ (2006). «Из архивов AFIP: Воспалительные и неопухолевые образования мочевого пузыря: лучевая и патологическая корреляция». Радиография 26 (6): 1847–68. DOI: 10.1148 / rg.266065126. PMID 17102055.
- ↑ 2,0 2,1 Мишо Д.С. «Хроническое воспаление и рак мочевого пузыря». Урол Онкол 25 (3): 260-8. DOI: 10.1016 / j.urolonc.2006.10.002. PMID 17483025.
- ↑ 3,0 3,1 3,2 3,3 Bing, Z .; Чжан, П.Дж. (2011). «Опухоли мочевого пузыря у взрослых с рабдомиосаркоматозной дифференцировкой: клинические, патологические и иммуногистохимические исследования». Диагностика Pathol 6 : 66. DOI: 10.1186 / 1746-1596-6-66. PMID 21762516.
- ↑ 4,0 4,1 4,2 Нино-Мурсия, М .; Фридланд, GW. (1988). «Инфаркт мочевого пузыря». Урол Радиол 9 (4): 234-6.PMID 3394185.
- ↑ Кривенко, ОН .; Эпштейн, JI. (Июнь 2013 г.). «Псевдокарциноматозная уротелиальная гиперплазия мочевого пузыря: клинические данные и наблюдение за 70 пациентами». Дж Урол 189 (6): 2083-6. DOI: 10.1016 / j.juro.2012.12.005. PMID 23228381.
Рак мочевого пузыря — AmeriPath: Anatomic Pathology Services
Рак мочевого пузыря — это заболевание, которое формируется в тканях мочевого пузыря и развивается, когда аномальные клетки бесконтрольно размножаются.Внутренняя часть мочевого пузыря выстлана слоем клеток, называемых уротелиальными или переходными клетками — именно здесь начинается наиболее распространенная форма рака мочевого пузыря. Он начинается в подкладочном слое мочевого пузыря и перерастает в стенку мочевого пузыря. Как только рак распространяется от уротелиальных клеток к внутренним слоям стенки мочевого пузыря, его называют инвазивным раком мочевого пузыря . Клетки того же типа выстилают почки, мочеточники и уретру. Рак может развиться в слизистой оболочке любого из этих органов мочевыделительной системы.По оценкам Американского онкологического общества, в этом году в Соединенных Штатах будет диагностировано 67 160 новых случаев рака мочевого пузыря. Это заболевание чаще встречается у мужчин и среди кавказцев, чем у афроамериканцев. У мужчин в три раза чаще диагностируют рак мочевого пузыря. Когда рак мочевого пузыря обнаруживается и лечится на ранних стадиях, шансы на выживание очень высоки.
В: Что такое мочевой пузырь?
A: Расположенный в нижней части живота, этот орган служит резервуаром для мочи — продукта жизнедеятельности, образующегося при фильтрации крови почками.Мочевой пузырь можно описать как эластичный мешок; у него есть небольшая мышечная стенка, которая позволяет ему расширяться или сокращаться при хранении или опорожнении мочи. Моча проходит из почек в мочевой пузырь по трубкам, называемым мочеточниками, и выходит из мочевого пузыря по другой трубке, называемой уретрой.
Q: Я подвержен риску?
A: Рак мочевого пузыря чаще всего встречается у мужчин старше 55 лет. Уровень заболеваемости у мужчин в три раза выше, чем у женщин, а уровень заболеваемости среди кавказцев в два раза выше, чем у афроамериканцев.Причина рака мочевого пузыря до конца не изучена; однако известно, что к его факторам риска относятся следующие:
- Воздействие канцерогенов на рабочем месте, таких как краски и растворители
- Курение:
- У курильщиков рак мочевого пузыря развивается в два-три раза чаще, чем у некурящих.
- По оценкам, курение является причиной примерно 47% случаев рака мочевого пузыря у мужчин и 37% у женщин.
- Людям, которые считают, что у них может быть риск развития рака мочевого пузыря, следует поговорить со своим врачом.
В: Каковы симптомы?
A: Общие симптомы рака мочевого пузыря включают следующее:
- Кровь в моче
- Боль при мочеиспускании
- Частое мочеиспускание
- Чувство позывов к мочеиспусканию, но безрезультатно
- Боль в пояснице
Поскольку эти симптомы могут вызывать другие проблемы со здоровьем, важно проконсультироваться с врачом, чтобы получить точный диагноз.
В: Как диагностируется рак мочевого пузыря?
A: Когда у пациента появляются симптомы рака мочевого пузыря, существует несколько типов тестов, которые можно использовать для подтверждения или исключения диагноза рака. Некоторые инструменты, которые врачи используют для обнаружения и диагностики рака мочевого пузыря, включают:
- Физикальное обследование — Врач осматривает живот и таз на предмет опухолей; обследование может включать прямую кишку или влагалище.
- Анализы мочи –Лабораторное исследование мочи на цвет, содержимое (i.е. сахар, белок, красные кровяные тельца, белые кровяные тельца), кровь (гематурия), раковые клетки (аномальная клеточность) и другие признаки болезней
- Тесты с визуализацией — Эти тесты позволяют врачу визуализировать органы на мониторе или на пленке и могут включать МРТ, рентген, компьютерную томографию и / или ультразвук; краситель может быть введен или проглочен, чтобы сделать органы / ткани более заметными во время этих процедур.
- Цистоскопия — Тонкая светящаяся трубка (цистоскоп) вводится через уретру в мочевой пузырь для выявления аномалий; врач может вырезать образец ткани (биопсия) для последующего патологического исследования — часто это единственный метод окончательной диагностики рака мочевого пузыря.
Q: Есть ли у меня выбор лечения?
A: У человека с раком мочевого пузыря есть несколько вариантов лечения, которые следует учитывать при столкновении с этим заболеванием. Выбор варианта лечения зависит от ряда факторов, таких как стадия заболевания, тип раковых клеток мочевого пузыря, возраст пациента и общее состояние здоровья, а также любые личные проблемы пациента, которые могут возникнуть в отношении процесса лечения. Варианты лечения могут включать следующее:
- Операция — в зависимости от стадии и степени опухоли:
- Трансуретральная резекция
- Радикальная цистэктомия
- Сегментарная цистэктомия
- Лучевая терапия:
- Внешнее излучение
- Внутреннее излучение
- Химиотерапия
- Биологическая терапия
Ваш врач — лучший специалист для обсуждения вариантов лечения и ожидаемых результатов.Очень важно, чтобы вы посоветовались со своим врачом, чтобы он или она могли разработать наиболее эффективный план лечения, специально адаптированный к вашим потребностям.
Плазмацитоидная уротелиальная карцинома мочевого пузыря | Американский журнал клинической патологии
Абстрактные
Цели: Плазмацитоидная уротелиальная карцинома (PUC) мочевого пузыря является редким гистологическим вариантом. Мы ретроспективно проанализировали большую серию PUC мочевого пузыря из одного учреждения.
Методы: Пациенты состояли из 44 мужчин и пяти женщин, средний возраст которых составлял 62 года (диапазон 45-86 лет).
Результаты: PUC был чистым в 23 случаях и смешанным с другими гистологическими типами в 26 случаях. Все PUC диффузно проникли в стенку мочевого пузыря. Большинству PUC не хватало иммунореактивности в отношении белка гена ретинобластомы (RB) (12/32) и E-кадгерина (8/30). Из 44 пациентов с последующим наблюдением 25 умерли от PUC в среднем через 23 месяца, тогда как 19 пациентов были живы в среднем через 22 месяца.
Выводы: Наши результаты подтверждают, что PUC мочевого пузыря является очень агрессивным заболеванием. Отсутствие экспрессии E-cadherin в PUC может лежать в основе отчетливого гистологического появления дискогезии, а аномальная функция гена RB может быть вовлечена в развитие PUC.
Уротелиальная карцинома (ЯК) — наиболее распространенное злокачественное новообразование мочевого пузыря, на которое приходится примерно 90% всех новообразований мочевого пузыря. 1 Большинство ЯК представляют собой неинвазивные папиллярные поражения на момент обращения.Однако от 20% до 30% ЯК проникают в стенку мочевого пузыря, а некоторые даже метастазируют в лимфатические узлы или другие органы. Инвазивный ЯК демонстрирует заметную тенденцию к дивергентной дифференцировке, что приводит к множеству гистологических вариантов. 1 , 2 Эти варианты ЯК не только имеют отчетливые микроскопические особенности, но также демонстрируют агрессивное поведение, связанное с плохим клиническим исходом. Распознавание вариантов ЯК важно для обеспечения оптимального ухода, поскольку пациенты с этими агрессивными вариантами могут извлечь выгоду из новых терапевтических подходов, которые отличаются от тех, которые используются при обычном ЯК. 3 Однако распознавание вариантов ЯК, особенно в местах метастазирования, может быть затруднено, поскольку гистологические особенности вариантов не ограничиваются ЯК, но могут быть связаны с другими неопластическими заболеваниями. Таким образом, иммуногистохимия часто используется для помощи в дифференциальной диагностике вариантов ЯК. 4 , 5
Плазмацитоидный ЯК (PUC) — редкий вариант ЯК, составляющий от 1% до 3% инвазивных ЯК. 6-8 В отличие от обычного ЯК, PUC характеризуется дискогезивными клетками с эксцентрично расположенными ядрами и обильной цитоплазмой, напоминающей плазматические клетки.С тех пор, как два десятилетия назад впервые было зарегистрировано PUC в мочевом пузыре, 9 , 10 , было проведено ограниченное количество исследований, касающихся этого редкого варианта заболевания, и большинство исследований было основано на отчетах об отдельных случаях и небольших группах пациентов. 6‐10 Недавно было сообщено о нескольких больших сериях PUC, но случаи часто собирались из нескольких институтов, где пациенты могли проходить различное лечение. 11‐13 Здесь мы описываем самую большую серию случаев PUC из одного учреждения, предоставляя подробные клинико-патологические и иммуногистохимические характеристики этого редкого заболевания.
Материалы и методы
Пациенты
После того, как институциональный наблюдательный совет онкологического центра им. М. Д. Андерсона Техасского университета одобрил исследование, мы провели поиск в нашей базе данных патологий с 1992 по 2014 год и обнаружили 49 случаев PUC мочевого пузыря. Всем 49 пациентам была выполнена трансуретральная биопсия или резекция опухоли, а 39 пациентам — радикальная цистэктомия или цистопростатэктомия. Архивные слайды пациентов, окрашенные H & E, были извлечены из наших файлов и просмотрены на предмет патологического анализа, включая гистологические особенности PUC, количество PUC, степень опухоли, связь с UC и другими вариантами, лимфоваскулярную инвазию, метастазы в лимфатические узлы и другие органы, а также рак. сцена.Клинические данные, включая демографические данные пациентов, лечение и исходы, были получены из их медицинских записей. Опухоли были классифицированы в соответствии с критериями 1 Всемирной организации здравоохранения / Международного общества урологической патологии и классифицированы в соответствии с критериями TNM Американского объединенного комитета по раку 2010 года. 14 В случаях, когда цистэктомия не проводилась, стадия опухоли определялась на основании клинических и рентгенологических данных.
Иммуногистохимия
Иммуногистохимическое окрашивание проводилось в отдельных случаях с использованием стандартных срезов, а также срезов тканевого микрочипа (ТМА).ТМА состояла из 1-миллиметровых тканевых ядер PUC (два ядра на пациента) и была сконструирована с использованием ручного тканевого устройства (Beecher Instruments, Silver Spring, MD). Для иммуноокрашивания использовали следующие моноклональные антитела: GATA-3 (клон HG3-31, разведение 1: 100; Santa Cruz Biotechnology, Санта-Крус, Калифорния), уроплакин II (клон BC-21, разведение 1:00; Biocare, Concord, CA), цитокератин (CK) 7 (клон OV-TL 12/30, разведение 1: 100; Dako, Carpinteria, CA), CK20 (клон Ks20.8, разведение 1: 4000; Dako), CD138 (клон M115, 1 : Разведение 600; Dako), CD56 (клон 123C3, разведение 1: 100; Life Technologies, Карлсбад, Калифорния), p63 (клон 4A4, разведение 1: 1000; Santa Cruz Biotechnology), E-кадгерин (клон HECD-1, 1 : Разведение 7000; Invitrogen, Carlsbad, CA), ретинобластома (RB; клон LM95.1, разведение 1:30; Millipore, Сан-Диего, Калифорния), белок 1 программируемой гибели клеток (PD-1; клон MRQ-22, разведение 1: 100; Cell Marque, Rocklin, Калифорния) и лиганд запрограммированной смерти 1 (PD-L1; клон SP142, Разведение 1: 100; Spring Bioscience, Плезантон, Калифорния). Вкратце, срезы толщиной 4 мкм депарафинизировали в ксилоле и гидратировали в градуированном спирте. Иммуноокрашивание проводили с использованием автоокрашивания BOND-MAX (Leica Biosystems, Buffalo Grove, IL). Срезы инкубировали с первичным антителом, а затем с реагентом для визуализации (вторичный козий антимышиный иммуноглобулин и пероксидаза хрена, связанная с основной цепью полимера декстрана).Затем предметные стекла промывали дистиллированной водой, инкубировали с раствором 3,3′-диаминобензидиновый субстрат-хромоген и подвергали контрастному окрашиванию гематоксилином Майера. Иммуногистохимические препараты были оценены двумя патологами (M.D.F. и C.C.G.), не знавшими личности пациента, и были представлены как положительные, так и отрицательные.
Статистический анализ
Общая выживаемость пациентов с PUC на разных стадиях сравнивалась с использованием метода Каплана-Мейера с программой Prism 6 (GraphPad Software, La Jolla, CA).Для расчета двусторонних значений P использовался точный критерий Фишера. P Значения менее 0,05 считались статистически значимыми.
Результаты
Демографические и патологические результаты
Пациенты состояли из 44 мужчин и пяти женщин со средним возрастом 62 года (диапазон 45-86 лет) на момент постановки диагноза PUC. Макрогематурия была наиболее частым симптомом, встречающимся у 61% пациентов, по которым была доступна клиническая информация.Другие общие симптомы включали дизурию, частое мочеиспускание и боль в животе.
Всем 49 пациентам была выполнена трансуретральная биопсия или резекция опухоли, а 39 пациентам — радикальная цистэктомия или цистопростатэктомия. Опухоли продемонстрировали диффузно инфильтративный характер роста. Image 1A . Опухолевые клетки были дискогезивными с эксцентрично расположенными ядрами и умеренной или обильной эозинофильной цитоплазмой, очень напоминающей плазматические клетки. Image 1B . Компонент PUC составлял в среднем 68% (диапазон от 5% до 100%) опухоли.PUC были чистыми в 23 случаях и смешанными с другими типами UC в 26 случаях Image 1C , включая обычный UC (n = 19), саркоматоидный (n = 5), микропапиллярный (n = 3), вложенный (n = 2), и варианты мелкоклеточной карциномы (n = 1). В четырнадцати случаях были опухолевые клетки с морфологией перстня-печатки Image 1D , а в 21 случае была выявлена лимфоваскулярная инвазия. Опухоли проникли в собственную пластинку (pT1; n = 4), мышечную ткань (pT2; n = 16), перивезикальную жировую ткань (pT3; n = 17) и соседние органы (pT4; n = 12).Тридцать два пациента перенесли лимфодиссекцию, а у 15 (47%) были метастазы в лимфатические узлы.
Иммуногистохимический анализ
Иммуногистохимическое окрашивание проводилось в отдельных случаях (Таблица 1), в которых диагноз был неопределенным на основании стандартного обследования H&E. В целом, PUC выражали CK7 (89%; 17/19), CK20 (76%; 13/17), GATA-3 (64%; 14/22), p63 (40%; 4/10), CD56 (33% ; 1/3) и CD138 (100%; 2/2). Кроме того, 11 (69%) из 16 PUC продемонстрировали цитоплазматическое и мембранное окрашивание на уроплакин II Image 2A, специфический уротелиальный маркер.В то время как 22 (73%) из 30 PUC были отрицательными по экспрессии E-кадгерина, изображение 2B, оставшиеся восемь (27%) из 30 демонстрировали фокальную экспрессию E-кадгерина, изображение 2C, которое характеризовалось периферическим мембранным окрашиванием на E-кадгерин. Кроме того, у 20 (63%) из 32 PUC отсутствовало ядерное окрашивание для RB1 Image 2D, и все были отрицательными для PD-1 и PD-L1.
Таблица 1Иммуногистохимические характеристики плазмоцитоидной уротелиальной карциномы
| Антитело . | Источник . | Разведение . | Количество протестированных случаев . | Число (%) положительных случаев . | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CK7 | Dako | 1: 100 | 19 | 17 (89) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CK20 | Dako | 1: 4,000 | 71873 | 71873 | 71873 | GATA-3 | Санта-Крус | 1: 100 | 22 | 14 (64) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| p63 | Санта-Крус | 1: 1,000 | 10 | 4 (40) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
69
|

 Inherited and congenital disease of the lower urinary tract. In: Osborne CA, Canine and Feline Nephrology and Urology/ 689 c.
Inherited and congenital disease of the lower urinary tract. In: Osborne CA, Canine and Feline Nephrology and Urology/ 689 c. А. Диагностика и лечение врожденной клоаки у детей // Хирургия. 1976. № 9. С. 98-101.
А. Диагностика и лечение врожденной клоаки у детей // Хирургия. 1976. № 9. С. 98-101.