Наследственный фактор
Наследственный факторНаследственный фактор
Ген — функциональная единица наследственного материала. Ген (от греч. genos — род, происхождение) — участок молекулы геномной нуклеиновой кислоты, характеризуемый специфической для него последовательностью нуклеотидов, представляющий единицу функции, отличной от функций других генов, и способный изменяться путем мутирования.
От гипотетических дискретных наследственных факторов до локализованных в хромосомах и молекулах ДНК генов. Долгое время ген рассматривали как минимальную часть наследственного материала (генома), обеспечивающую развитие определенного признака у организмов данного вида. Однако каким образом функционирует ген, оставалось неясным. Термин ген предложен В. Иогансеном в 1909 году, однако проникновение в его сущность связано с именем Г. Менделя, который еще в 1860-х гг. ввел термин «наследственный фактор» и на основе точных экспериментов сделал гениальные обобщения относительно свойств и поведения наследственных факторов при передаче информации от родителей потомкам, которые в последующем легли в основу теории гена.
1) наличие альтернативных наследственных факторов для развития каждого конкретного признака организма (в современном представлении доминантный и рецессивный аллели гена).
2) Парность наследственных факторов, определяющих развитие признака (у диплоидного организма). Существенный вывод: наследуются не признаки, а от родителей к потомкам передаются вместе с гаметами гены. Из этих двух положений был развит принцип аллелизма.
3) Относительное постоянство гена.
Мендель не имел никаких сведений о местонахождении наследственных факторов в клетке, и тем более об их химической природе и механизме влияния на признак, т. е. наследственный фактор в начале 20 века выступал как условная единица наследственности.
Роль наследственных факторов в патогенезе заболеваний, связанных с дегенерацией межпозвонковых дисков
Роль генетических факторов в дегенерации межпозвонковых дисков была установлена относительно недавно. Большую часть XX века в качестве основных причин возникновения этой патологии рассматривали возраст, пол, профессиональные вредности, курение, вибрационные нагрузки [9]. Вклад других факторов, таких как рост, вес и генетическая предрасположенность, учитывался в меньшей степени. Однако за последние десятилетия наметился прогресс в понимании генетических причин, связанных с риском возникновения дегенерации дисков, что в значительной степени изменило традиционные взгляды на проблему. Несмотря на то, что некоторые средовые и конституциональные факторы вовлечены в эти заболевания, их вклад относительно небольшой в сравнении с генетическими причинами, которые во многом отвечают за дегенерацию и образование грыж межпозвонковых дисков [3, 6, 39]. Согласно данным исследования семей и близнецовых пар, вклад генетических факторов для этих заболеваний варьирует в пределах 34-61% [17, 35]. Генетико-математические методы показали, что модель наследования является полигенной и в ней принимают участие множественные факторы и многие гены, которые могут передаваться из поколения в поколение.
Большую часть XX века в качестве основных причин возникновения этой патологии рассматривали возраст, пол, профессиональные вредности, курение, вибрационные нагрузки [9]. Вклад других факторов, таких как рост, вес и генетическая предрасположенность, учитывался в меньшей степени. Однако за последние десятилетия наметился прогресс в понимании генетических причин, связанных с риском возникновения дегенерации дисков, что в значительной степени изменило традиционные взгляды на проблему. Несмотря на то, что некоторые средовые и конституциональные факторы вовлечены в эти заболевания, их вклад относительно небольшой в сравнении с генетическими причинами, которые во многом отвечают за дегенерацию и образование грыж межпозвонковых дисков [3, 6, 39]. Согласно данным исследования семей и близнецовых пар, вклад генетических факторов для этих заболеваний варьирует в пределах 34-61% [17, 35]. Генетико-математические методы показали, что модель наследования является полигенной и в ней принимают участие множественные факторы и многие гены, которые могут передаваться из поколения в поколение.
В настоящее время многие исследователи приходят к однозначному выводу, что грыжи пояснично-крестцового отдела позвоночника относятся к заболеваниям со сложной этиологией. Это означает, что при изучении причин возникновения этих патологий нужно рассматривать взаимосвязи между средовыми факторами и наследственностью.
В статье рассмотрены работы, посвященные исследованию генетической эпидемиологии грыж межпозвонковых дисков. Прежде всего, это работы, связанные с изучением накопления в семьях случаев болезни. Именно множественные случаи заболевания в одной родословной могут указывать на возможное генетическое влияние.
В 1991 г. G. Varlotta и соавт. [44] обнаружили, что 32% взрослых больных с грыжами дисков имеют отягощенную наследственность по этой патологии. H. Matsui и соавт. [25] сообщили, что в семьях больных в возрасте моложе 18 лет часто встречаются грыжи дисков поясничного отдела.
В 1991 г. был запущен международный проект исследования близнецов с заболеваниями позвоночника, который назвали Twin Spine Study. В его рамках M. Battie и соавт. [5] изучили данные МРТ у 115 пар монозиготных близнецов мужского пола для оценки вклада генетических и средовых факторов в эти показатели. В качестве фенотипических клинических маркеров были использованы такие параметры, как пролабирование дисков, сужение высоты и обезвоживание дисков по показателям интенсивности сигнала. Было обследовано 230 больных разного возраста. Многофакторный анализ грудного и поясничного отделов позвоночника показал, что фактор, связанный с физическими нагрузками, объяснял только 7% вариативности этих показателей, возраст — 16%, а семейная отягощенность — 77%. В поясничном и пояснично-крестцовом позвоночных отделах фактор, связанный с физическими нагрузками, объяснял только 2% вариативности. Показатель дисперсии в нижнем поясничном отделе возрастал до 9% с учетом возраста и до 43% с учетом семейной отягощенности. В этом исследовании была впервые предложена оценка как средовых, так и генетических факторов.
В его рамках M. Battie и соавт. [5] изучили данные МРТ у 115 пар монозиготных близнецов мужского пола для оценки вклада генетических и средовых факторов в эти показатели. В качестве фенотипических клинических маркеров были использованы такие параметры, как пролабирование дисков, сужение высоты и обезвоживание дисков по показателям интенсивности сигнала. Было обследовано 230 больных разного возраста. Многофакторный анализ грудного и поясничного отделов позвоночника показал, что фактор, связанный с физическими нагрузками, объяснял только 7% вариативности этих показателей, возраст — 16%, а семейная отягощенность — 77%. В поясничном и пояснично-крестцовом позвоночных отделах фактор, связанный с физическими нагрузками, объяснял только 2% вариативности. Показатель дисперсии в нижнем поясничном отделе возрастал до 9% с учетом возраста и до 43% с учетом семейной отягощенности. В этом исследовании была впервые предложена оценка как средовых, так и генетических факторов.
H. Matsui и соавт. [26] проанализировали ответы на специальный опросник у 3042 фабричных рабочих в Японии. Авторы этого исследования обнаружили, что средний возраст на момент первого приступа боли в пояснице у рабочих, родители которых также страдали от этой патологии, был значительно ниже, чем у рабочих без семейного отягощения. После того, как было установлено существование накопления случаев дегенерации дисков в семьях, появилась необходимость разграничения между биологическими (гены) и социальными (культуральное наследование) источниками семейного сходства. P. Sambrook и соавт. [32] осуществили классическое близнецовое исследование для проверки гипотезы о том, что в дегенерацию дисков существенный вклад вносит наследственный компонент. МРТ-исследование позвоночника было проведено у 86 пар моно- и 154 дизиготных близнецов, 80% из которых были женщины. Было обнаружено значительное влияние генетических факторов на дегенерацию дисков. Оценки наследуемости для различных показателей, выявляемых МРТ, были очень высокими и составляли более 70% (доверительный интервал при 95% вероятности (ДИ 95%).
[26] проанализировали ответы на специальный опросник у 3042 фабричных рабочих в Японии. Авторы этого исследования обнаружили, что средний возраст на момент первого приступа боли в пояснице у рабочих, родители которых также страдали от этой патологии, был значительно ниже, чем у рабочих без семейного отягощения. После того, как было установлено существование накопления случаев дегенерации дисков в семьях, появилась необходимость разграничения между биологическими (гены) и социальными (культуральное наследование) источниками семейного сходства. P. Sambrook и соавт. [32] осуществили классическое близнецовое исследование для проверки гипотезы о том, что в дегенерацию дисков существенный вклад вносит наследственный компонент. МРТ-исследование позвоночника было проведено у 86 пар моно- и 154 дизиготных близнецов, 80% из которых были женщины. Было обнаружено значительное влияние генетических факторов на дегенерацию дисков. Оценки наследуемости для различных показателей, выявляемых МРТ, были очень высокими и составляли более 70% (доверительный интервал при 95% вероятности (ДИ 95%).

Результаты генетических эпидемиологических исследований, в том числе и полученные в ходе Twin Spine Study [7], позволили сделать следующие выводы.
1. Влияние наследственности на дегенерацию поясничных дисков весьма значительно.
2. Существенные различия между близнецами в профессиональных занятиях и физических нагрузках, не связанных с профессией, не оказывают значимого эффекта на возникновение заболевания.
4. Не найдено доказательств влияния вибрационных нагрузок, вызванных вождением транспортного средства.
5. Антропометрические факторы, такие как масса тела и мускульная сила, оказывают умеренное влияние, которое более выражено по сравнению с профессиональными вредностями.
6. В то же время обычные физические нагрузки могут быть полезны.
Кроме того, были идентифицированы генетические варианты, ассоциированные с дегенерацией дисков.
Таким образом, общие представления о том, что дегенерация дисков является результатом старения и физического износа за счет механических повреждений, в этом исследовании не подтвердились. Основное внимание при изучении этиологии заболевания должно быть сконцентрировано на генетических факторах.
В настоящее время исследования заболеваний проводят с использованием методов молекулярной генетики. Связь с заболеванием устанавливается с помощью анализа ассоциаций с признаком полиморфного вариантов генов-кандидатов и/или анализа сцепления с заболеванием определенного хромосомного участка, включающего искомый ген. Анализ сцепления проводят в семьях, где встречаются множественные случаи заболевания.
За последние годы выявлены четыре основные группы генов, имеющих отношение к заболеванию поясничных дисков [50]. Первая группа включает в себя гены, ассоциированные с конструкцией структурных компонентов межпозвонковых дисков, таких как ген агрекана и коллагена типа IX. Вторая группа состоит из генов, которые продуцируют ферменты, разрушающие содержимое диска, например ген металлопротеиназы. В третью группу входят гены, связанные с костной структурой, — связанные с остеопорозом, ген рецепторов витамина D и эстрогена. И наконец, четвертая группа представлена генами с невыясненной или неспецифической функцией. К ним можно отнести, например, гены интерлейкинов.
Первая группа включает в себя гены, ассоциированные с конструкцией структурных компонентов межпозвонковых дисков, таких как ген агрекана и коллагена типа IX. Вторая группа состоит из генов, которые продуцируют ферменты, разрушающие содержимое диска, например ген металлопротеиназы. В третью группу входят гены, связанные с костной структурой, — связанные с остеопорозом, ген рецепторов витамина D и эстрогена. И наконец, четвертая группа представлена генами с невыясненной или неспецифической функцией. К ним можно отнести, например, гены интерлейкинов.
Коллаген типа IX представляет собой структурный компонент ядра дисков и служит связывающим звеном между коллагенсодержащими белками и другими протеинами ткани, а также играет существенную роль в составе межпозвонковых дисков. Коллаген типа IX — это гетеротримерный белок и кодируют его три гена: COL9A1, COL9A2, и COL9A3. Эти гены являются перспективными кандидатами для молекулярно-генетических исследований. S. Annunen и соавт. [4] показали, что аллель G гена COL9A2 (полиморфизм rs7533552, вызывающий замещение глютамина на аргинин в аминокислотной последовательности белка) играет существенную роль в патогенезе дегенерации дисков. В этом исследовании на материале финской популяции аллель G был обнаружен у 6 (4%) из 157 больных и не обнаружен ни у одного здорового индивида из контрольной группы (174 человека). Позднее ассоциация между аллелем G и заболеванием была найдена при изучении более 300 близнецовых пар [27]. J. Jim и соавт. [15] сообщили о более высокой частоте этого аллеля в Китае по сравнению с Финляндией. Он был обнаружен в 20% случаев в выборке, состоящей из 804 человек. У больных с аллелем Trp2 наблюдалась более тяжелая дегенерация, более того, связь между аллелем и заболеванием была опосредована возрастом [42]. В японской популяции ассоциации этого аллеля с заболеванием выявлено не было [33]. Полученные результаты свидетельствуют, что аллельные вариации COL9A2, связанные с дегенерацией поясничных дисков, зависят от расовых и этнических особенностей.
[4] показали, что аллель G гена COL9A2 (полиморфизм rs7533552, вызывающий замещение глютамина на аргинин в аминокислотной последовательности белка) играет существенную роль в патогенезе дегенерации дисков. В этом исследовании на материале финской популяции аллель G был обнаружен у 6 (4%) из 157 больных и не обнаружен ни у одного здорового индивида из контрольной группы (174 человека). Позднее ассоциация между аллелем G и заболеванием была найдена при изучении более 300 близнецовых пар [27]. J. Jim и соавт. [15] сообщили о более высокой частоте этого аллеля в Китае по сравнению с Финляндией. Он был обнаружен в 20% случаев в выборке, состоящей из 804 человек. У больных с аллелем Trp2 наблюдалась более тяжелая дегенерация, более того, связь между аллелем и заболеванием была опосредована возрастом [42]. В японской популяции ассоциации этого аллеля с заболеванием выявлено не было [33]. Полученные результаты свидетельствуют, что аллельные вариации COL9A2, связанные с дегенерацией поясничных дисков, зависят от расовых и этнических особенностей.
Что касается гена COL9A3, то его связь с заболеванием была также обнаружена в финской популяции [29].
У носителей аллеля Trp3 риск поражения дисков был в 3 раза выше по сравнению с больными, у которых этот аллель отсутствовал. Исследование 164 больных и 321 человека контрольной группы (186 здоровых, 83 с остеоартритом, 31 с ревматоидным артритом и 21 с хондродисплазией) установило, что частота аллеля риска составляла 12,2% в опытной выборке и только 4,7% в контрольной. Различия были статистически значимы. Эти результаты были получены только для финской популяции, попытка повторить их на выборке больных другой этнической принадлежности, в частности греческой, успехом не увенчалась [16]. В другом исследовании [38] было показано, что эффект аллеля Trp3 на болезнь зависит от присутствия аллеля T (3954) гена интерлейкина IL-1β. Также аллель Trp3 был связан с некоторыми показателями, выявляемыми с помощью радиографических методов при болезни Шейермана [18]. Исследование генотип-средовых взаимодействий показало, что дегенерация межпозвонковых дисков чаще возникала, если носители мутации испытывали постоянные нагрузки на диски [36]. Изучив 135 человек — носителей аллеля Trp3, авторы показали, что заболеванием страдали в основном (71% от всех обследуемых) люди с избыточной массой тела. Еще один кандидат — это ген коллагена типа I (COLIA1). Коллаген I является важным компонентом фиброзного кольца дисков. Некоторые исследователи [31, 43] сообщают, что риск поражения дисков выше у людей с генотипом TT по сравнению с теми, кто является носителями генотипов GG или GT. Аллель T может оказывать влияние на регуляцию гена, в результате чего повышается уровень его экспрессии и нарушается количество образовавшегося белка [24]. Гены коллагена типов IV и X также связаны с заболеванием [28, 48], однако данных об их роли пока недостаточно.
Изучив 135 человек — носителей аллеля Trp3, авторы показали, что заболеванием страдали в основном (71% от всех обследуемых) люди с избыточной массой тела. Еще один кандидат — это ген коллагена типа I (COLIA1). Коллаген I является важным компонентом фиброзного кольца дисков. Некоторые исследователи [31, 43] сообщают, что риск поражения дисков выше у людей с генотипом TT по сравнению с теми, кто является носителями генотипов GG или GT. Аллель T может оказывать влияние на регуляцию гена, в результате чего повышается уровень его экспрессии и нарушается количество образовавшегося белка [24]. Гены коллагена типов IV и X также связаны с заболеванием [28, 48], однако данных об их роли пока недостаточно.
Ген Sox9 кодирует факторы транскрипции, которые могут различным образом влиять на процессы дифференциации и развития. Он проявляет активность в процессах хондрогенеза и может активировать ген, кодирующий коллаген типа II [8, 21]. Также этот ген регулирует гены, кодирующие белок аггрекан [34] и коллаген типа XI [10]. R. Paul и соавт. [30] изучали возможность использования гена Sox9 для терапии дегенерации дисков. Они использовали в качестве вектора аденовирусы, которые вводили в клетки хондробластов и диска. При этом возрастала продукция Sox9 и коллагена типа II.
R. Paul и соавт. [30] изучали возможность использования гена Sox9 для терапии дегенерации дисков. Они использовали в качестве вектора аденовирусы, которые вводили в клетки хондробластов и диска. При этом возрастала продукция Sox9 и коллагена типа II.
Ген рецептора витамина D играет важную роль в минерализации и трансформации костной ткани. Обнаружено, что полиморфизм гена связан с дегенерацией дисков и образованием грыж [19, 46]. Генотипы tt и Tt чаще встречались в группах больных, особенно тех, у которых болезнь началась в раннем возрасте. T. Videman и соавт. [45] сообщили, что у мужчин показатели интенсивности сигнала при использовании МРТ были хуже у носителей генотипов tt (Taq I полиморфизм), ff и Ff (Fok l полиморфизм). K. Cheung и соавт. [11] также подтвердили, что аллель t связан с риском дегенерации дисков, особенно у людей моложе 40 лет. Каким образом изменения в структуре гена рецептора витамина D влияют на клинические проявления болезни, пока не выяснено Возможно, ген является лишь маркером, поскольку расположен на одной хромосоме (12q12) с генами коллагена типа II и фактором роста инсулина типа 1.
Матриксные металлопротеиназы (ММР). Эти ферменты относятся к семейству внеклеточных цинкзависимых эндопептидаз, способных разрушать все типы белков внеклеточного матрикса. Важную роль в дегенерации межпозвонковых дисков играют матриксные металлопротеиназы типа 3 (MMP-3) и 9 (MMP-9) [12]. Они проявляют активность в ответ на такие локальные воздействия, как механическая нагрузка [13] и воспалительный процесс [14]. В гене MMP-3 описан полиморфизм 5A/6A в промоторном участке, который вовлечен в регуляцию его экспрессии, при этом аллель 5A имеет в 2 раза большую активность по сравнению с аллелем 6A [49]. M. Takahashi и соавт. [41] обнаружили, что в японской популяции у лиц пожилого возраста генотипы 5A5A и 5A6A были ассоциированы с большим числом дегенеративных межпозвонковых дисков, а у молодых пациентов такой ассоциации выявлено не было. Результаты этого исследования указывают, что аллель 5A гена MMP-3 может быть фактором риска, ускоряющим процесс дегенерации, особенно у людей пожилого возраста. В гене MMP-9 изучен полиморфизм С-1562Т, расположенный в промоторном участке, который влияет на транскрипционную активность гена. Этот полиморфизм оказался ассоциирован с дегенерацией позвонковых дисков при изучении 408 больных молодого возраста и 451 здорового человека [40]. Частота аллеля Т была выше в группе больных по сравнению с контролем. Также этот аллель был связан с большей степенью разрушения дисков.
В гене MMP-9 изучен полиморфизм С-1562Т, расположенный в промоторном участке, который влияет на транскрипционную активность гена. Этот полиморфизм оказался ассоциирован с дегенерацией позвонковых дисков при изучении 408 больных молодого возраста и 451 здорового человека [40]. Частота аллеля Т была выше в группе больных по сравнению с контролем. Также этот аллель был связан с большей степенью разрушения дисков.
Гены интерлейкинов
Интерлейкин-1 — провоспалительный цитокин, который способствует продукции ферментов, разрушающих протеогликан, а также опосредует возникновение боли.
S. Solovieva и соавт. [37] продемонстрировали, что показатели дегенерации дисков на томограммах связаны с полиморфизмом гена у рабочих мужского пола финского происхождения. У носителей генотипа TT риск деформации дисков был в 3 раза выше, чем у людей с другими вариантами этого гена. Были также выявлены варианты, при которых в 2,5 раза возрастал риск появления боли.
Интерлейкин-6 обладает широким спектром биологических функций, является одним из главных медиаторов острой фазы воспаления и может действовать в качестве про-, и противовоспалительного фактора. В промоторе гена IL-6, локализованного на хромосоме 7 (7p21), обнаружен функциональный полиморфизм G-174C (rs1800795). Минорный генотип СС связывают с усиленной продукцией IL-6. В исследовании финских ученых, которые провели генотипирование 588 детей и подростков, была обнаружена ассоциация между полиморфизмом rs1800795 и дегенерацией позвонковых дисков [20]. Аллелем риска был низкоактивный аллель G.
Интерлейкин-10 служит важнейшим регулятором иммунного ответа, подавляющим активность макрофагов и Th2-клеток и, вследствие этого, цитотоксический ответ организма. Он также обеспечивает реализацию некоторых биологических эффектов Th3-клеток, что способствует развитию гуморальной составляющей иммунного ответа. Ген локализован на хромосоме 1 (участок 1q31-q32). Он является высокополиморфным. На продукцию цитокина влияют промоторные полиморфизмы G-1082A (rs1800896) и C-592A (rs1800872), которые находятся в неравновесии по сцеплению. Полиморфизм G-1082A локализован на участке узнавания транскрипционного фактора Ets и может влиять на экспрессию гена. Показано, что аллель А коррелирует со снижением продукции IL-10 при стимуляции Т-клеток in vitro и снижением плазменной концентрации цитокина. Полиморфизм C-592A обусловлен заменой цитозина на аденин. Он влияет на экспрессию гена и продукцию соответствующего белка. В случае аллеля C уровень продукции IL-10 повышен, что приводит к ухудшению ответа организма на внедрение инфекционных агентов и усилению выработки антител. Еще один полиморфизм в области промотора обозначают как G-1082A (rs1800896). Замена G-1082A в промоторной области гена ИЛ-10 приводит к снижению плазменного уровня интерлейкина-10, в связи с этим полиморфизм рассматривают как фактор риска. Генетический анализ перечисленных выше полиморфизмов в дисках, полученных после операции от 134 пациентов, показал, что частота аллеля А и генотипа АА полиморфизмов C-592A и G-1082A была выше у больных, чем в контрольной группе [22].
На продукцию цитокина влияют промоторные полиморфизмы G-1082A (rs1800896) и C-592A (rs1800872), которые находятся в неравновесии по сцеплению. Полиморфизм G-1082A локализован на участке узнавания транскрипционного фактора Ets и может влиять на экспрессию гена. Показано, что аллель А коррелирует со снижением продукции IL-10 при стимуляции Т-клеток in vitro и снижением плазменной концентрации цитокина. Полиморфизм C-592A обусловлен заменой цитозина на аденин. Он влияет на экспрессию гена и продукцию соответствующего белка. В случае аллеля C уровень продукции IL-10 повышен, что приводит к ухудшению ответа организма на внедрение инфекционных агентов и усилению выработки антител. Еще один полиморфизм в области промотора обозначают как G-1082A (rs1800896). Замена G-1082A в промоторной области гена ИЛ-10 приводит к снижению плазменного уровня интерлейкина-10, в связи с этим полиморфизм рассматривают как фактор риска. Генетический анализ перечисленных выше полиморфизмов в дисках, полученных после операции от 134 пациентов, показал, что частота аллеля А и генотипа АА полиморфизмов C-592A и G-1082A была выше у больных, чем в контрольной группе [22].
Таким образом, с генетической точки зрения, дегенерация поясничных дисков — сложный процесс, в котором задействовано много генов, а также средовые факторы, причем имеют место как взаимодействия между генами, так и генотип-средовые взаимодействия. Однако, несмотря на большое количество уже полученных данных, необходимы дальнейшие исследования в этой области. Нужно отметить, что описанные в настоящем обзоре полиморфизмы не являются специфичными для заболеваний, связанных с дегенерацией позвонковых дисков. Как указано в некоторых обзорных работах [23], это гены, обладающие плейотропным, т.е. множественным действием. Как правило, они обладают небольшим эффектом, который является результатом совместного действия многих генетических вариантов. Есть основания считать, что существуют и генетические вариации (мутации), которые обладают большим эффектом и большей специфичностью в отношении заболевания. Однако выявить эти мутации с большей вероятностью возможно в этнически гомогенных группах, в которых могут быть найдены большие родословные, включающие кровнородственные браки, с множественными случаями заболеваний, связанных с дегенерацией позвонковых дисков.
Как управлять ДНК – Наука – Коммерсантъ
Наследственная информация любого организма, как известно, хранится в молекуле ДНК. У человека последовательность из четырех букв (оснований ДНК) общей длиной около 3 млрд — геном — несет полную информацию об организме. На основе этой информации он развивается и умеет приспосабливаться к изменяющимся условиям окружающей среды.
Казалось бы, если мы получим доступ к информации, хранящейся в геноме, то сможем узнать все о нашей биологической природе. Неудивительно, что генетики сфокусировали значительные усилия на задаче прочтения ДНК. Благодаря революции в технологиях работы с ДНК конца XX века и созданию новых технологий чтения ДНК в начале XXI века исследователи наконец получили доступ к наследственной информации: в настоящее время любой человек за относительно небольшую сумму может прочитать свою ДНК. Что же он узнает о себе? К сожалению, очень немногое. Проблема в том, что из всего массива генетического текста мы точно понимаем смысл только той части, которая кодирует белки (кодирующей части генов). А она составляет в геноме только несколько процентов.
А она составляет в геноме только несколько процентов.
Исследования последних 10–15 лет указывают на то, что значительная доля генома с пока неизвестной функцией, скорее всего, нужна для регуляции работы той самой небольшой доли генов. Таким образом, на десятки тысяч генов человека приходятся сотни тысяч (или, по другим оценкам, миллионы) «управленцев», которые указывают, где и когда нужно работать каждому отдельному гену. Это очень важное явление, которое называется дифференциальной экспрессией (активностью) генов. Дело в том, что все клетки организма содержат одинаковый — совершенно полный — набор генетической информации. Однако клетки очень сильно отличаются, и причина этого в том, что в разных клетках работают разные наборы генов с разной интенсивностью, что в результате и определяет, как устроена клетка и какие функции она выполняет.
Для того чтобы читать информацию, регулирующую работу генов, в клетке имеется большой молекулярный аппарат транскрипции. Транскрипция — первый этап реализации наследственной информации: она переписывается с ДНК на небольшие копии — мРНК. Именно этот этап является ключевым с точки зрения регуляции активности (экспрессии) генов. Специфичные факторы транскрипции способны узнавать регуляторные элементы генома, связываться с ними и затем передавать посредством взаимодействия с другими белками сигнал на нужный ген.
Именно этот этап является ключевым с точки зрения регуляции активности (экспрессии) генов. Специфичные факторы транскрипции способны узнавать регуляторные элементы генома, связываться с ними и затем передавать посредством взаимодействия с другими белками сигнал на нужный ген.
Аппарат транскрипции — это одна из наиболее сложных молекулярных систем клетки: у человека имеется несколько тысяч таких факторов. Их слаженная работа обеспечивает работу всего генома. Факторы стоят на разных уровнях иерархии и выполняют очень разные молекулярные функции. Имеются факторы, которые специфически узнают определенную последовательность букв в ДНК. Другие факторы упаковывают или размечают молекулу ДНК и могут, например, переводить ее в нерабочее, «архивное», состояние. Существуют промежуточные факторы-посредники и т. д. Факторы транскрипции не работают поодиночке, а согласуют работу друг с другом: обычно для запуска одного гена требуется совместное присутствие нескольких десятков (до сотни) факторов.
Итак, над генами стоит большой, сложно устроенный руководящий орган. С одной стороны, он умеет читать ДНК клетки, с другой — аппарат транскрипции реагирует на сигналы, поступающие в клетку извне. В ответ на поступающие сигналы (например, гормональные) клетка должна реагировать изменением экспрессии определенных генов, а реализуется эта реакция клетки через аппарат транскрипции. Интересно, например, что самый большой аппарат транскрипции — у клеток на ранних стадиях развития организма, когда они еще только выбирают, в какой тип клеток они разовьются. А у клеток, уже достигших зрелости, таких как нейрон или клетка мышцы, обычно происходит «сокращение штатов»: остаются только те, которые обслуживают специфические для этих клеток гены.
Таким образом, значительная часть наследственной информации распознается факторами транскрипции. В последнее время активно изучаются схожие с ними архитектурные факторы, распознающие определенные последовательности в ДНК и формирующие ее пространственную структуру. Вероятно, существуют и другие классы белков, умеющих прочитывать регуляторную информацию генома, которая пока непонятна нам. Важная фундаментальная научная задача — понять, как работает весь этот аппарат.
Вероятно, существуют и другие классы белков, умеющих прочитывать регуляторную информацию генома, которая пока непонятна нам. Важная фундаментальная научная задача — понять, как работает весь этот аппарат.
Это важно также и с практической точки зрения. Прежде всего, нужно вспомнить, что множество болезней вызвано именно тем, что нарушается контроль за работой генов. Это может быть связано с тем, что факторы транскрипции не справляются с работой: они могут быть поломаны, их может быть недостаточно или, наоборот, слишком много. Яркий пример — раковая опухоль: в некоторых клетках происходит бесконтрольная активация генов, нужных для роста и размножения клеток, в результате начинается «бунт» этих клеток против своего организма. Виновные в таком сценарии чаще всего оказываются именно факторы транскрипции, причем имена многих участников уже известны ученым. Другой пример — из современной области стволовых клеток. Если мы будем знать, какие именно факторы транскрипции работают в той или иной ткани, то сможем вырастить в пробирке ткань заданного типа.
В настоящее время изучение регуляции активности одного-единственного гена и факторов, которые его контролируют,— это большая научная задача. Наверное, нет еще такого гена, про регуляцию которого мы бы знали все. У исследователей, занимающихся механизмами регуляции экспрессии генов, еще много нерешенных задач. В Институте биологии гена РАН в Москве также ведутся исследования в этой области. Мы изучаем факторы транскрипции, которые выполняют разнообразные функции. Например, был найден фактор, который способен объединять две активности: он готовит матрицу ДНК к транскрипции, высвобождая ее из «архивированного» состояния, и одновременно собирает другие белки, которые запускают саму транскрипцию. Так осуществляется эффективный запуск работы генов, которые находятся под контролем этого фактора. Мы показали, что такой сценарий реализуется при действии внешних сигналов (например, некоторых гормонов): изученный фактор привлекается на нужные гены-мишени и запускает их работу.
Эти результаты были получены на мушке дрозофиле. Оказалось, что у других организмов, в том числе у позвоночных, есть схожие с ним белки. У мыши такой фактор присутствует в стволовых клетках мозга и важен для того, чтобы они не потеряли этот статус. Таким образом, изучение даже одного фактора транскрипции проводилось в целой серии работ и открыло новые механизмы регуляции активности клеток на уровне молекул и целых клеток. Работы активно продолжаются и, несомненно, мы узнаем еще много нового о том, как функционирует геном.
Оказалось, что у других организмов, в том числе у позвоночных, есть схожие с ним белки. У мыши такой фактор присутствует в стволовых клетках мозга и важен для того, чтобы они не потеряли этот статус. Таким образом, изучение даже одного фактора транскрипции проводилось в целой серии работ и открыло новые механизмы регуляции активности клеток на уровне молекул и целых клеток. Работы активно продолжаются и, несомненно, мы узнаем еще много нового о том, как функционирует геном.
Работа отдельного гена контролируется несколькими десятками регуляторных элементов, которые могут быть расположены далеко от самого гена по последовательности генетического текста. С каждым элементом и с самим геном связывается целый набор различных факторов транскрипции, которые взаимодействуют друг с другом и с геном и таким образом регулируют его работу.
Юлий Шидловский, Институт биологии гена РАН
Варикозная болезнь
Варикозное расширение вен
Варикоз или варикозное расширение вен — это увеличенные, извитые, выступающие над поверхностью кожи вены, часто с узлами, порой, в запущенных случаях, больших размеров. В основе варикозного расширения вен лежат генетические особенности организма, а именно, слабость венозной стенки. Функция вен нижних конечностей – нести кровь для обогащения кислородом в сердце и легкие, для очищения — в печень, почки и селезенку, снизу вверх, преодолевая силу гравитации. Препятствуют обратному потоку крови венозные клапаны. На начальном этапе варикозного расширения вен клапаны «ломаются», и начинается постепенное расширение и удлинение вены, имеющее необратимый характер. В XXI веке к пятидесяти годам каждая третья женщина и каждый десятый мужчина имеют варикозное расширение вен. К семидесяти годам численность страдающих варикозом женщин и мужчин удваивается.
В основе варикозного расширения вен лежат генетические особенности организма, а именно, слабость венозной стенки. Функция вен нижних конечностей – нести кровь для обогащения кислородом в сердце и легкие, для очищения — в печень, почки и селезенку, снизу вверх, преодолевая силу гравитации. Препятствуют обратному потоку крови венозные клапаны. На начальном этапе варикозного расширения вен клапаны «ломаются», и начинается постепенное расширение и удлинение вены, имеющее необратимый характер. В XXI веке к пятидесяти годам каждая третья женщина и каждый десятый мужчина имеют варикозное расширение вен. К семидесяти годам численность страдающих варикозом женщин и мужчин удваивается.
Факторы риска варикозной болезни
Причину, по которой происходит развитие варикозного расширения вен, еще только предстоит выяснить. Тем не менее научному сообществу хорошо известны факторы, непосредственно запускающие патологический процесс.
Возраст. С течением времени варикозное расширение вен прогрессирует, особенно после выхода из детородного периода (наступление климакса).
Генетическая предрасположенность или наследственный фактор. Варикоз одного из родителей повышает «шансы» младшего поколения в 2 – 3 раза.
Женщины более подвержены варикозу по причине беременности (с каждой последующей состояние вен значимо ухудшается), а также из-за приема гормональных препаратов.
Ожирение нарушает и затрудняет циркуляцию крови, способствует возникновению или усугублению варикозного расширения вен.
Тяжелый физический труд. Повышение венозного давления в глубоких венах при физических нагрузках отрицательно влияет на функциональное состояние вен и венозных клапанов нижних конечностей.
Длительная работа в положении стоя или сидя — доказанные факторы, дестабилизирующие венозный отток нижних конечностей, повышающие риски в 2 – 3 раза;
Симптомы варикозного расширения вен
Здесь обязательно необходимы слова моего учителя, профессора Сергея Германовича Суханова: «Без варикозных вен не бывает варикозной болезни».
Извитые, выпирающие над поверхностью кожи вены (более 4мм в диаметре). Кожа над ними обычно горячее.
Тяжесть в ногах, усталость, ноющие и тянущие боли, нарастающие к вечеру (проходят после поднятия ног или отдыха в положении лежа)
Отеки ног, усиливающиеся во второй половине дня (затруднения при надевании сапог женщинами) и обычно полностью проходящие за время ночного отдыха.
Кожный зуд, чувство жжения вокруг варикозных вен и ощущение пульсации свидетельствуют о прогрессировании варикозной болезни.
Синдром беспокойных ног и судороги (преимущественно в ночное время) также говорят об ухудшении состояния вен.
Что будет, если продолжать жить с варикозной болезнью
Внезапно, на фоне полного благополучия могут образоваться тромбы в варикозных венах (варикозные вены становятся плотными, кожа над ними приобретает багровую окраску, сильные боли в области тромбофлебита затрудняют ходьбу и сохраняются в положении лежа, повышается температура тела до 37 – 37,5С) или может возникнуть сильное венозное кровотечение из варикозного узла.
Постепенно кожа становится очень чувствительной и часто воспаляется. Очень сильно дестабилизирует ситуацию неконтролируемое применение мазей и гелей, вплоть до возникновения венозной или микробной экземы или выраженной аллергической реакции (крапивница). Кожа на голени темнеет и становится плотной, образуются обширные, длительно не заживающие трофические язвы. Данные изменения являются стойкими. Не допустить таких осложнений позволяет своевременное обращение к врачу-флебологу.
Варикозная болезнь приговор или варикозная болезнь излечима
Сегодня мы можем вам предложить самые современные способы лечения варикозного расширения вен. Ультразвуковая диагностика, протоколирование точной схемы «пораженных» варикозом вен, составление индивидуального плана лечения, далее выполнение оптимальной процедуры позволят получить в Вашем конкретном случае отличный результат с гарантией. Своевременное обращение к специалистам и лечение позволит не допустить осложнений, избежать тромбов и образования язв. Получите полную информацию о современных методах лечения и ЭВЛК, «золотом стандарте» лечения варикоза, на нашем сайте.
Получите полную информацию о современных методах лечения и ЭВЛК, «золотом стандарте» лечения варикоза, на нашем сайте.
| АриоСэвен™ | Лиофилизат д/пригот. р-ра д/в/в введения 1.2 мг (60КЕД): фл. в комплекте с растворителем рег. №: ЛП-006562 от 11.11.20 | |||
| Викасол | Р-р д/в/м введения 10 мг/1 мл: амп. | |||
| Викасол | Р-р д/в/м введения 10 мг/1 мл: амп. 10 шт. рег. №: ЛС-002477 от 05.04.12 | |||
| Викасол | Р-р д/в/м введения 10 мг/1 мл: амп. | |||
| Викасол | Р-р д/в/м введения 10 мг/мл: 1 мл амп. 10 шт., 2 мл амп. 10 шт. рег. №: ЛП-002067 от 14.05.13 | |||
| Викасол | Р-р д/в/м введения 10 мг/мл: 1 мл или 2 мл амп. | |||
| Викасол | Р-р д/в/м введения 10 мг/мл: 1 мл или 2 мл амп. 5 или 10 шт. рег. №: ЛП-002130 от 05.07.13 | |||
| Викасол | Р-р д/в/м введения 10 мг/мл: 1 мл или 2 мл амп. | |||
| Викасол | Р-р д/в/м введения 20 мг/2 мл: амп. 10 шт. рег. №: ЛС-002477 от 05.04.12 | |||
| Викасол | Таб. | |||
| Викасол | Таб. 15 мг: 10, 20, 30, 50 или 60 шт. рег. №: ЛП-005583 от 13.06.19 | |||
| Викасол | Таб. | |||
| Викасол | Таб. 15 мг: 30 шт. рег. №: ЛСР-004919/08 от 25.06.08 | |||
| Викасол-Виал | Р-р д/в/м введения 10 мг/1 мл: амп. | |||
| Викасол-Дарница | Р-р д/в/м введения 10 мг/1 мл: амп. 10 шт. рег. №: П N010099 от 08.07.11 | |||
| Коагил-VII | Лиофилизат д/пригот. Лиофилизат д/пригот. р-ра д/в/в введения 2.4 мг: фл. 1 шт. в компл. с растворителем (амп. 1 шт.), шприцем, иглой д/разведения, катетером д/периферич. вен, фильтром инъекц. и салфетками рег. №: ЛСР-010225/09 от 15.12.09Лиофилизат д/пригот. р-ра д/в/в введения 4.8 мг: фл. 1 шт. в компл. с растворителем (амп. 2 шт.), шприцем, иглой д/разведения, катетером д/периферич. вен, фильтром инъекц. и салфетками рег. №: ЛСР-010225/09 от 15.12.09 | |||
| Коаплекс | Лиофилизат д/пригот. | |||
| Коаплекс | Лиофилизат д/пригот. р-ра д/в/в введения: фл. 500 ME в компл. с р-лем и устройством д/добавления р-ля рег. №: ЛП-003500 от 14.03.16 | |||
| НовоСэвен® | Лиофилизат д/пригот. | |||
| НовоСэвен® | Лиофилизат д/пригот. р-ра д/в/в введения 2 мг (100 КЕД): фл. 1 шт. в компл. с растворителем рег. №: П N012454/01 от 07.12.10 | |||
| НовоСэвен® | Лиофилизат д/пригот. | |||
| Октаплекс® | Лиофилизат д/пригот. р-ра д/в/в введения: фл. в компл. с р-лем и набором для растворения и введения рег. №: ЛП-004107 от 30.01.17 Дата перерегистрации: 06.02.19 | Произведено: OCTAPHARMA (Франция) Первичная упаковка: OCTAPHARMA (Франция) Выпускающий контроль качества: OCTAPHARMA (Франция) | ||
| Протромплекс 600 | Лиофилизат д/пригот. | |||
| Уман-Комплекс Д.и. | Лиофилизат д/пригот. р-ра д/инф. 200 МЕ: фл. 1 шт. в компл. с растворителем и стерильным апирогенным оборудованием рег. №: П N015135/01-2003 от 23.01.09 | |||
Уман-Комплекс Д. и. и. | Лиофилизат д/пригот. р-ра д/инф. 500 МЕ: фл. 1 шт. в компл. с растворителем и стерильным апирогенным оборудованием рег. №: П N015135/01-2003 от 23.01.09 | |||
| Фактор VII | Лиофилизат д/пригот. | |||
Наследственная предрасположенность к раку — Docrates
Наследственность рака
Обычно рак не является наследственным заболеванием. Однако 5-10% случаев заболеваемости онкологией относят к зависимым от наследственной предрасположенности. Подозревать наследственность онкологии можно, если:
- у нескольких членов рода выявлен рак
- онкология выявлена в молодом возрасте
- у пациента нескольких онкологических диагнозов
Практически у всех видов рака имеются редкие наследственные формы. Чаще всего наследственные формы бывают при раке груди, яичников и толстой кишки.
Как проводится тест?
Свяжитесь с нами, и наш специалист оценит необходимость проведения Вам генетического тестирования. Сам тест проводится по крови. Результаты теста готовятся в течение 5 недель. Анализы исследует финская генетическая лаборатория Blueprint Genetics (Аккредитации FINAS и CAP, CЕ-тесты). Blueprint Genetics использует в исследованиях новейшие технологии, а результаты тестов описывают опытные специалисты генетики.
Самым популярным тестом по исследованию наследственности рака является генетическая панель, которая анализирует группу генов, по мутации которых определяется наследственность рака. К таким панелям относятся: Hereditary Cancer High Risk Panel, Hereditary Breast and Gynecological Cancer Panel, Hereditary Melanoma and Skin Cancer Panel, Hereditary Gastrointestinal Cancer Panel. Стоимость одной генетической панели 1030 евро.
О чем расскажет генетический тест?
Генотест – быстрый способ определить риски наследственного рака, но тест не определяет само наличие рака. Выяснив наследственный фактор риска заболевания онкологией, Вы становитесь более осведомленным и можете снизить риски заболевания с помощью образа жизни и других профилактических мер.
Выяснив наследственный фактор риска заболевания онкологией, Вы становитесь более осведомленным и можете снизить риски заболевания с помощью образа жизни и других профилактических мер.
Положительный результат теста говорит о повышенном риске заболевания онкологией. Результат даст больше информации о вероятности заболеваемости и о наличии/отсутствии необходимости протестировать других членов семьи. Вы сможете пересмотреть свой образ жизни, активнее следить за своим здоровьем или принять меры по профилактике рака. Специалисты Дократес помогут Вам и составят индивидуальный план наблюдения.
Негативный результат теста говорит о том, что изменений, говорящих о раке, в Вашем геноме не найдено. Помимо наследственного фактора, повышающими риск онкологии факторами являются: общее состояние здоровья, образ жизни и окружающая среда. Негативный ответ, однако, не исключает вероятность заболеваемости онкологией. Если в Вашем роду часто встречается рак, у Вас может быть повышенный риск заболеть (какой-то конкретный рак), даже при негативном результате теста, поскольку пока еще изучены не все генетические изменения относительно онкологии.
Если в Вашем роду часто встречается рак, у Вас может быть повышенный риск заболеть (какой-то конкретный рак), даже при негативном результате теста, поскольку пока еще изучены не все генетические изменения относительно онкологии.
Неопределенный результат теста говорит о том, что генетическое изменение есть, но для утверждения наличия наследственности рака не хватает данных. У людей может быть много изменений в генетике, которые не наносят вреда здоровью. Наши знания о генах на сегодняшний день неполные, поэтому, в каких-то случаях у нас нет достаточной информации, подтверждающей связь изменений гена с наследственностью рака.
Инвитро. Генетические предрасположенности, узнать цены на анализы и сдать в Москве
Исследование гена фибриногена, полиморфизм FGB c.-467G>AАнализ направлен на исследование полиморфизмов в гене β-полипептида фибриногена FGB, которые могут обуславливать увеличение риска развития тромбофилических состояний. На бланке результата выдается информация о полиморфизмах, полученная при молекулярно-генетическом исследовании, с комментариями.
На бланке результата выдается информация о полиморфизмах, полученная при молекулярно-генетическом исследовании, с комментариями.
Выявление изменений в основных генах ферментов фолатного цикла для оценки наличия склонности к гипергомоцистеинемии (рекомендовано оценивать в комплексе с иммунохимическим тестом на определение уровня гомоцистеина).
Гиперагрегация тромбоцитов, полиморфизм гена ITGA2 с.759 С>TИсследование полиморфизмов в генах интегрина альфа-2 и тромбоцитарного гликопротеина 1b проводят для выявления генетической предрасположенности к раннему развитию инфаркта миокарда, ишемического инсульта, тромбоэмболии, а также для оценки риска развития тромбозов. На бланке результата выдается информация о полиморфизмах, полученная при молекулярно-генетическом исследовании, с комментариями.
Тромбоцитарный рецептор фибриногенаОпределение полиморфизмов в гене тромбоцитарного рецептора фибриногена (β3-интегрина) выполняют для выявления наследственной предрасположенности к тромбофилическим состояниям. На бланке результата выдается информация о полиморфизмах, полученная при молекулярно-генетическом исследовании, с комментариями.
На бланке результата выдается информация о полиморфизмах, полученная при молекулярно-генетическом исследовании, с комментариями.
Анализ полиморфизмов в генах ACE, AGT, NOS3 дает возможность обнаружить наследственные факторы риска развития артериальной гипертензии. На бланке результата выдается информация о полиморфизмах, полученная при молекулярно-генетическом исследовании, с комментариями.
Артериальная гипертензия, связанная с нарушениями в ренин-ангиотензиновой системеТест позволяет определить наличие генетических факторов риска развития артериальной гипертензии в результате сужения просвета сосудов и нарушения водно-солевого баланса, возникающих при наличии полиморфизмов в генах ACE, AGT. На бланке результата выдается информация о полиморфизмах, полученная при молекулярно-генетическом исследовании, с комментариями.
Болезнь КронаТест используют при диагностике болезни Крона, для определения прогноза тяжести течения заболевания и риска развития осложнений. Также исследование применяют для дифференциальной диагностики болезни Крона с язвенным колитом и в качестве прогностического теста у родственников пациентов с болезнью Крона.
Также исследование применяют для дифференциальной диагностики болезни Крона с язвенным колитом и в качестве прогностического теста у родственников пациентов с болезнью Крона.
Исследование используется для дифференциальной диагностики генетических причин патологии печени — дефицита альфа-1-антитрипсина, болезни Вильсона-Коновалова, классического гемохроматоза и злокачественной формы неалкогольной жировой болезни печени
Анализ перестроек 1 хромосомы (FISH, колич.)Исследование показано для диагностики, определения прогноза течения заболевания, подбора адекватной терапии и мониторинга минимальной остаточной болезни пациентов с множественной миеломой.
Синдром множественной эндокринной неоплазии 2B типаСиндром множественной эндокринной неоплазии 2В типа относится к группе семейных опухолевых синдромов, ассоциированных со специфическими мутациями протоонкогена RET, которые выявляют в процессе исследования.
Генетическая диагностика синдрома Жильбера – неконъюгированной доброкачественной гипербилирубинемии – основана на исследовании возможных мутаций в промоторной области гена UGT1A1.
Остеопороз: полная панельИсследование проводят при наличии нарушений минерального обмена, а также при отягощенном семейном анамнезе по заболеваниям костной системы.
Остеопороз: сокращённая панельИсследование проводят при наличии нарушений минерального обмена, а также при отягощенном семейном анамнезе по заболеваниям костной системы.
Остеопороз: рецептор витамина DИсследование генетических факторов риска развития остеопороза проводят при отягощенном семейном анамнезе по заболеваниям костного аппарата, а также при наличии нарушений минерального обмена. На бланке результата выдается информация о полиморфизмах, полученная при молекулярно-генетическом исследовании, с комментариями.
Выявление индивидуальных особенностей в основных генах ферментов фолатного цикла для оценки наличия склонности к гипергомоцистеинемии (рекомендовано оценивать в комплексе с иммунохимическим тестом на определение уровня гомоцистеина).
Наследственный гемохроматоз, I тип. HFEВыявление 2 наиболее часто встречаемых мутаций в гене HFE для оценки риска развития гемохроматоза 1-го типа. Рекомендовано при выявлении повышения концентрации ферритина и % насыщения трансферрина железом в сыворотке крови.
Описание результатов генетического теста 2 категории сложности (№№ 118ГП/БЗ, 121ГП/БЗ, 123ГП/БЗ, 131ГП/БЗ, 141ГП/БЗ, 149ГП/БЗ, 150ГП/БЗ, 115ГП/БЗ, 152ГП/БЗ, 124ГП/БЗ, 154ГП/БЗ)Исследование включает описание врачом-генетиком результатов генетических анализов, которые относятся ко второй категории сложности.
Описание результатов генетического теста 3 категории сложности (№№ 122ГП/БЗ, 129ГП/БЗ, 120ГП/БЗ, 137ГП/БЗ, 138ГП/БЗ, 153ГП/БЗ, 151ГП/БЗ, 110ГП/БЗ, 114ГП/БЗ, 140ГП/БЗ, 7661БЗ, 7258БЗ, 134ГП/БЗ, 135ГП/БЗ, 136ГП/БЗ)Исследование включает описание врачом-генетиком результатов генетических анализов, которые относятся к третьей категории сложности.
Анализ полиморфизмов в гене ACE необходим для прогнозирования нефропротективного эффекта ингибиторов ангиотензин-превращающего фермента (АПФ) – физиологического регулятора артериального давления и водно-солевого обмена при недиабетических заболеваниях. Посредством исследования можно определить генетические маркеры эффективности атенолола при артериальной гипертензии с гипертрофией левого желудочка или флувастатина при ишемической болезни сердца.
Лозартан/ирбесартанВ процессе исследования проводится анализ полиморфизмов в гене CYP2C9, который выступает генетическим маркером риска нарушений метаболизма блокаторов рецепторов ангиотензина II.
МетотрексатВыявление изменений в основных генах ферментов фолатного цикла для оценки вероятности развития побочных реакций при приеме метотрексата.
Нестероидные противовоспалительные препаратыАнализ полиморфизмов в гене CYP2C9 выполняют с целью выявления наследственных факторов развития побочных реакций по типу желудочных кровотечений при приеме нестероидных противовоспалительных препаратов (НПВП).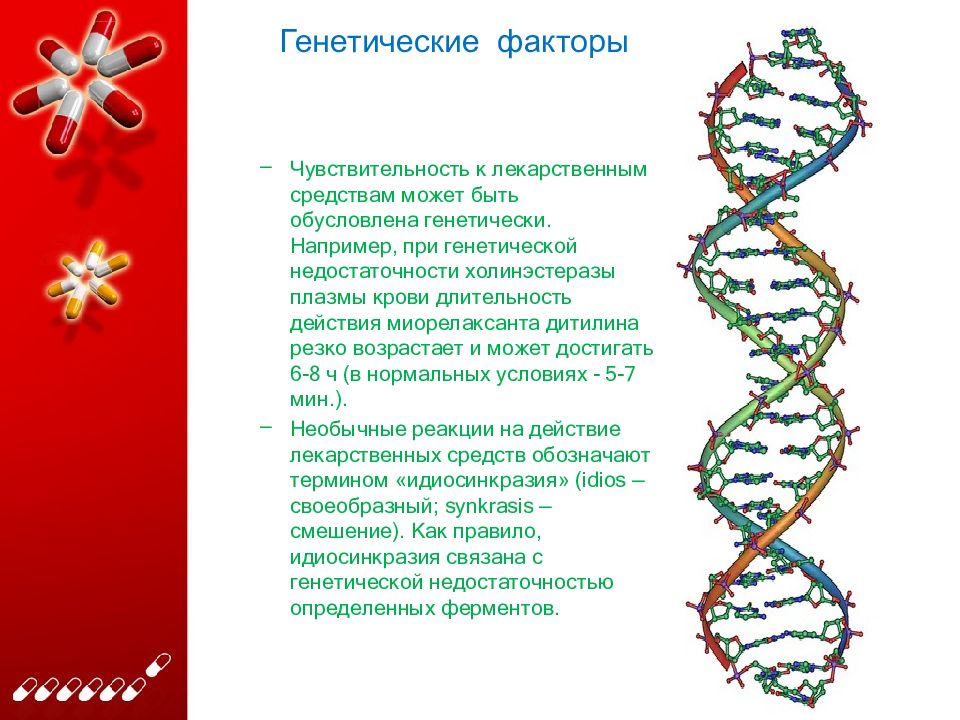
Цитохром CYP2D6 участвует в метаболизме лекарственных препаратов (β-адреноблокаторов, антиаритмиков, аналептиков, антидепрессантов и наркотических анальгетиков), применяемых при лечении ряда сердечно-сосудистых заболеваний и психических расстройств. Исследование полиморфизмов в гене CYP2D6 позволяет выявить людей со сниженной активностью CYP2D6, поскольку таким пациентам необходимо индивидуально подбирать более низкие дозы препаратов.
Цитохром СYP2D6: ген СYP2D6Тест целесообразно проводить перед плановым назначением антигипертензивных, антиаритмических, психотропных препаратов, а также при длительном их приеме.
Цитохром CYP2C9Анализ наличия полиморфизмов в гене цитохрома Р450 проводят для выявления наследственных факторов нарушения детоксикации. CYP2C9 участвует в метаболизме лекарственных средств. При снижении активности цитохрома CYP2C9 метаболизм препаратов замедляется, в результате чего происходит увеличение их концентрации в крови, что может быть причиной развития нежелательных реакций.
Наследственная болезнь дефицита фактора VIII — Состояния — GTR
Гемофилия А характеризуется недостаточностью свертывающей активности фактора VIII, что приводит к длительному просачиванию крови после травм, удаления зубов или операций, а также к отсроченным или рецидивирующим кровотечениям до полного заживления раны. Возраст постановки диагноза и частота эпизодов кровотечения связаны с уровнем свертывающей активности фактора VIII. У людей с тяжелой формой гемофилии А обычно диагностируют в течение первых двух лет жизни после кровотечения из незначительных травм рта и больших «гусиных яиц» из незначительных ударов по голове.Без профилактического лечения они могут иметь в среднем до двух-пяти эпизодов спонтанных кровотечений в месяц, включая спонтанные кровотечения в суставы или глубокие мышечные гематомы, а также длительное кровотечение или чрезмерную боль и отек из-за незначительных травм, операций и удаления зубов. У лиц с умеренной гемофилией А редко бывают спонтанные кровотечения; однако у них действительно наблюдается длительное или замедленное выделение мочи после относительно небольшой травмы, и обычно их диагностируют в возрасте до пяти-шести лет; частота эпизодов кровотечения варьирует, обычно от одного раза в месяц до одного раза в год. У лиц с легкой формой гемофилии А не бывает спонтанных эпизодов кровотечения; однако без пред- и послеоперационного лечения возникает аномальное кровотечение при хирургическом вмешательстве или удалении зубов; частота эпизодов кровотечения варьирует в широких пределах, обычно от одного раза в год до одного раза в десять лет. Лица с легкой формой гемофилии А часто не диагностируются до более позднего возраста. Приблизительно 30% гетерозиготных женщин имеют свертывающую активность ниже 40% и подвержены риску кровотечения (даже если пораженный член семьи страдает легким заболеванием).После серьезной травмы или инвазивных процедур обычно возникает продолжительное или чрезмерное кровотечение, независимо от тяжести.
У лиц с легкой формой гемофилии А не бывает спонтанных эпизодов кровотечения; однако без пред- и послеоперационного лечения возникает аномальное кровотечение при хирургическом вмешательстве или удалении зубов; частота эпизодов кровотечения варьирует в широких пределах, обычно от одного раза в год до одного раза в десять лет. Лица с легкой формой гемофилии А часто не диагностируются до более позднего возраста. Приблизительно 30% гетерозиготных женщин имеют свертывающую активность ниже 40% и подвержены риску кровотечения (даже если пораженный член семьи страдает легким заболеванием).После серьезной травмы или инвазивных процедур обычно возникает продолжительное или чрезмерное кровотечение, независимо от тяжести.- Полный текст GenereView (по разделу):
- Сводка
- Диагностика
- Клинические характеристики
- Генетически связанные (аллелические) расстройства
- Дифференциальный диагноз
- Управление
- Генетическое консультирование
- Ресурсы
- Молекулярная генетика
- Список литературы
- Примечания к главам
- Авторы:
- Barbara A Konkle
- Haley Huston
- Shelley Nakaya Fletcher
- просмотреть полную информацию об авторе
- просмотреть полную информацию об авторе
- Определения и факты
Донаучные концепции наследственности
Наследственность долгое время была одним из самых загадочных и загадочных явлений природы.
 Это произошло потому, что половые клетки, образующие мост, по которому наследственность должна проходить между поколениями, обычно невидимы невооруженным глазом. Только после изобретения микроскопа в начале 17 века и последующего открытия половых клеток можно было понять основы наследственности. До этого древнегреческий философ и ученый Аристотель (4 век до н.э.) предполагал, что относительный вклад родителей женского и мужского пола был очень неравным; Считалось, что самка обеспечивает то, что он называл «материей», а самец — «движением».« институтов Ману », составленных в Индии между 100 и 300 годами нашей эры, рассматривают роль женщины как роль поля, а роль мужчины — как роль семени; новые тела формируются «в результате совместной работы семени и поля». В действительности оба родителя одинаково передают наследственный образец, и в среднем дети похожи на своих матерей не меньше, чем на своих отцов. Тем не менее женские и мужские половые клетки могут сильно различаться по размеру и строению; масса яйцеклетки иногда в миллионы раз превышает массу сперматозоида.
Это произошло потому, что половые клетки, образующие мост, по которому наследственность должна проходить между поколениями, обычно невидимы невооруженным глазом. Только после изобретения микроскопа в начале 17 века и последующего открытия половых клеток можно было понять основы наследственности. До этого древнегреческий философ и ученый Аристотель (4 век до н.э.) предполагал, что относительный вклад родителей женского и мужского пола был очень неравным; Считалось, что самка обеспечивает то, что он называл «материей», а самец — «движением».« институтов Ману », составленных в Индии между 100 и 300 годами нашей эры, рассматривают роль женщины как роль поля, а роль мужчины — как роль семени; новые тела формируются «в результате совместной работы семени и поля». В действительности оба родителя одинаково передают наследственный образец, и в среднем дети похожи на своих матерей не меньше, чем на своих отцов. Тем не менее женские и мужские половые клетки могут сильно различаться по размеру и строению; масса яйцеклетки иногда в миллионы раз превышает массу сперматозоида.
Древние вавилоняне знали, что пыльцу финиковой пальмы мужского пола нужно наносить на пестики женского дерева, чтобы получить плоды. Немецкий ботаник Рудольф Якоб Камерариус показал в 1694 году, что то же самое верно и для кукурузы (кукурузы). Шведский ботаник и исследователь Каролус Линней в 1760 году и немецкий ботаник Йозеф Готлиб Кёльройтер в серии работ, опубликованных с 1761 по 1798 год, описали скрещивания сортов и видов растений. Они обнаружили, что эти гибриды в целом занимали промежуточное положение между родителями, хотя по некоторым характеристикам они могли быть ближе к одному родителю, а по другим — к другому.Кёльрейтер сравнил потомство реципрокных скрещиваний, то есть скрещивания разновидности A , функционирующей как самка, с разновидностью B как самца и, наоборот, разновидности B как самки с A как самца. Гибридное потомство от этих взаимных скрещиваний обычно было одинаковым, что указывает на то, что, вопреки убеждению Аристотеля, наследственность потомства в равной степени происходила от родителей женского и мужского пола.
 В 1800-х годах было проведено еще много экспериментов с гибридами растений.Эти исследования также показали, что гибриды обычно занимают промежуточное положение между родителями. Между прочим, они записали большинство фактов, которые позже привели Грегора Менделя (, см. ниже) к формулировке его знаменитых правил и к основанию теории гена. По-видимому, никто из предшественников Менделя не видел значения накапливаемых данных. Общее промежуточное положение гибридов, казалось, лучше всего согласовывалось с верой в то, что наследственность передается от родителей к потомству «по крови», и это убеждение было принято большинством биологов XIX века, в том числе английским натуралистом Чарльзом Дарвином.
В 1800-х годах было проведено еще много экспериментов с гибридами растений.Эти исследования также показали, что гибриды обычно занимают промежуточное положение между родителями. Между прочим, они записали большинство фактов, которые позже привели Грегора Менделя (, см. ниже) к формулировке его знаменитых правил и к основанию теории гена. По-видимому, никто из предшественников Менделя не видел значения накапливаемых данных. Общее промежуточное положение гибридов, казалось, лучше всего согласовывалось с верой в то, что наследственность передается от родителей к потомству «по крови», и это убеждение было принято большинством биологов XIX века, в том числе английским натуралистом Чарльзом Дарвином.Теория наследственности крови, если это понятие можно удостоить таким названием, на самом деле является частью фольклора, предшествовавшего научной биологии. Это подразумевается в таких популярных фразах, как «полукровка», «новая кровь» и «голубая кровь». Это не означает, что наследственность действительно передается через красную жидкость в кровеносных сосудах; существенным моментом является вера в то, что родитель передает каждому ребенку все его характеристики и что наследственный дар ребенка представляет собой сплав, смесь дарований его родителей, бабушек и дедушек и более отдаленных предков.
 Эта идея нравится тем, кто гордится тем, что имеет благородную или выдающуюся «кровную» линию. Однако возникает загвоздка, когда замечают, что у ребенка есть некоторые характеристики, которых нет ни у одного из родителей, но они присутствуют у некоторых других родственников или присутствовали у более отдаленных предков. Еще чаще видно, что братья и сестры хотя и обнаруживают фамильное сходство в одних чертах, но в других явно различаются. Как одни и те же родители могли передать разную «кровь» каждому из своих детей?
Эта идея нравится тем, кто гордится тем, что имеет благородную или выдающуюся «кровную» линию. Однако возникает загвоздка, когда замечают, что у ребенка есть некоторые характеристики, которых нет ни у одного из родителей, но они присутствуют у некоторых других родственников или присутствовали у более отдаленных предков. Еще чаще видно, что братья и сестры хотя и обнаруживают фамильное сходство в одних чертах, но в других явно различаются. Как одни и те же родители могли передать разную «кровь» каждому из своих детей?Мендель опроверг теорию крови.Он показал, (1) что наследственность передается через факторы (теперь называемые генами), которые не смешиваются, а разделяются, (2) что родители передают каждому ребенку только половину имеющихся у них генов, а детям они передают разные наборы генов. разные дети, и (3) что, хотя братья и сестры получают свою наследственность от одних и тех же родителей, они не получают одну и ту же наследственность (исключение составляют однояйцевые близнецы).
 Таким образом, Мендель показал, что, даже если бы возвышение какого-либо предка было целиком отражением его генов, весьма вероятно, что некоторые из его потомков, особенно более отдаленные, вообще не унаследовали бы эти «хорошие» гены.У организмов, размножающихся половым путем, включая человека, каждый индивидуум обладает уникальной наследственной одаренностью.
Таким образом, Мендель показал, что, даже если бы возвышение какого-либо предка было целиком отражением его генов, весьма вероятно, что некоторые из его потомков, особенно более отдаленные, вообще не унаследовали бы эти «хорошие» гены.У организмов, размножающихся половым путем, включая человека, каждый индивидуум обладает уникальной наследственной одаренностью.Ламаркизм — школа мысли, названная в честь пионера XIX века, французского биолога и эволюциониста Жана-Батиста де Моне, шевалье де Ламарка, — предполагала, что черты, приобретенные в течение жизни человека, наследуются его потомством, или, говоря современным языком, , что изменения, внесенные средой в фенотип, отражаются в аналогичных изменениях в генотипе.Если бы это было так, то результаты физических упражнений сделали бы физические упражнения гораздо более легкими или даже ненужными для потомства человека. Не только Ламарк, но и другие биологи XIX века, в том числе Дарвин, признавали наследование приобретенных признаков.
 Его поставил под сомнение немецкий биолог Август Вейсман, чьи знаменитые эксперименты конца 1890-х годов по ампутации хвостов у поколений мышей показали, что такая модификация не приводит ни к исчезновению, ни даже к укорочению хвостов у потомков.Вейсман пришел к выводу, что наследственный дар организма, который он назвал зародышевой плазмой, совершенно обособлен и защищен от влияний, исходящих от остального тела, называемого соматоплазмой или сомой. Понятия зародышевая плазма–соматоплазма связаны с понятиями генотип–фенотип, но они не тождественны, и их не следует смешивать с ними.
Его поставил под сомнение немецкий биолог Август Вейсман, чьи знаменитые эксперименты конца 1890-х годов по ампутации хвостов у поколений мышей показали, что такая модификация не приводит ни к исчезновению, ни даже к укорочению хвостов у потомков.Вейсман пришел к выводу, что наследственный дар организма, который он назвал зародышевой плазмой, совершенно обособлен и защищен от влияний, исходящих от остального тела, называемого соматоплазмой или сомой. Понятия зародышевая плазма–соматоплазма связаны с понятиями генотип–фенотип, но они не тождественны, и их не следует смешивать с ними.Ненаследуемость приобретенных признаков не означает, что гены не могут быть изменены влиянием среды; Рентгеновские лучи и другие мутагены, безусловно, изменяют их, а генотип популяции может быть изменен отбором.Это просто означает, что то, что приобретено родителями в их телосложении и интеллекте, не наследуется их детьми. С этими неправильными представлениями связаны убеждения в «препотентности» — т.
 е. в то, что некоторые особи передают свою наследственность своим потомкам более эффективно, чем другие, — и в «пренатальные влияния» или «материнские впечатления», т. е. в то, что события, переживаемые беременной самкой, отражаются в конституции будущего ребенка. Насколько древними являются эти верования, показано в Книге Бытия, в которой Иаков производит пятнистое или полосатое потомство овец и коз, показывая стадам полосатые прутья, пока животные размножаются.Другая такая вера — «телегония», восходящая к Аристотелю; в нем утверждалось, что на наследственность человека влияет не только его отец, но и самцы, с которыми женщина могла спариваться и которые вызвали предыдущие беременности. Даже Дарвин еще в 1868 г. серьезно обсуждал предполагаемый случай телегонии: случай, когда кобыла спарилась с зеброй, а затем с арабским жеребцом, от которого кобыла произвела на свет жеребенка со слабыми полосами на ногах. Простое объяснение этого результата состоит в том, что такие полосы естественным образом встречаются у некоторых пород лошадей.
е. в то, что некоторые особи передают свою наследственность своим потомкам более эффективно, чем другие, — и в «пренатальные влияния» или «материнские впечатления», т. е. в то, что события, переживаемые беременной самкой, отражаются в конституции будущего ребенка. Насколько древними являются эти верования, показано в Книге Бытия, в которой Иаков производит пятнистое или полосатое потомство овец и коз, показывая стадам полосатые прутья, пока животные размножаются.Другая такая вера — «телегония», восходящая к Аристотелю; в нем утверждалось, что на наследственность человека влияет не только его отец, но и самцы, с которыми женщина могла спариваться и которые вызвали предыдущие беременности. Даже Дарвин еще в 1868 г. серьезно обсуждал предполагаемый случай телегонии: случай, когда кобыла спарилась с зеброй, а затем с арабским жеребцом, от которого кобыла произвела на свет жеребенка со слабыми полосами на ногах. Простое объяснение этого результата состоит в том, что такие полосы естественным образом встречаются у некоторых пород лошадей.
Все эти верования, от наследования приобретенных черт до телегонии, теперь должны быть отнесены к разряду суеверий. Они не выдерживают экспериментального исследования и несовместимы с тем, что известно о механизмах наследственности и о замечательных и предсказуемых свойствах генетического материала. Тем не менее, некоторые люди все еще цепляются за эти убеждения. Некоторые животноводы серьезно относятся к телегонии и не считают чистокровными особей, чьи родители, по общему признанию, «чистокровны», но чьи матери скрещивались с самцами других пород.Советский биолог и агроном Трофим Денисович Лысенко смог почти за четверть века, примерно между 1938 и 1963 годами, сделать свою особую разновидность ламаркизма официальным кредо в Советском Союзе и запретить большую часть преподавания и исследований в области ортодоксальной генетики. . Он и его сторонники опубликовали сотни статей и книг, якобы подтверждающих их утверждения, фактически отрицающие достижения биологии как минимум за предшествующее столетие.
 Официально лысенковцы были дискредитированы в 1964 году.
Официально лысенковцы были дискредитированы в 1964 году.Является ли болезнь Альцгеймера наследственной/генетической?
Семейный анамнез не обязателен для развития болезни Альцгеймера. Тем не менее, исследования показывают, что те, у кого есть родитель или брат или сестра с болезнью Альцгеймера, более склонны к развитию болезни, чем те, у кого нет близкого родственника с болезнью Альцгеймера. Те, у кого есть более одного родственника первой степени с болезнью Альцгеймера, подвергаются еще большему риску. Когда такие заболевания, как болезнь Альцгеймера и другие виды деменции, имеют тенденцию передаваться по наследству, определенную роль могут играть либо генетика (наследственные факторы), либо факторы окружающей среды, либо и то, и другое.
- Генетика и болезнь Альцгеймера
- Более пристальный взгляд на гены, связанные с болезнью Альцгеймера
Генетика и болезнь Альцгеймера
Существует две категории генов, влияющих на развитие у человека болезни: (1) гены риска и (2) детерминированные гены.
 Исследователи выявили наследственные гены болезни Альцгеймера в обеих категориях.
Исследователи выявили наследственные гены болезни Альцгеймера в обеих категориях.- Гены риска повышают вероятность развития болезни, но не гарантируют, что она произойдет.Исследователи обнаружили несколько генов, повышающих риск болезни Альцгеймера. APOE-e4 является первым идентифицированным геном риска и остается геном с самым сильным влиянием на риск. По оценкам исследователей, от 40 до 65% людей с диагнозом болезни Альцгеймера имеют ген APOE-e4.
APOE-e4 является одной из трех распространенных форм гена APOE; другие — APOE-e2 и APOE-e3. Мы все наследуем копию той или иной формы APOE от каждого родителя. Те, кто наследует одну копию APOE-e4 от своей матери или отца, имеют повышенный риск развития болезни Альцгеймера.У тех, кто унаследовал две копии от матери и отца, риск еще выше, но не наверняка. В дополнение к повышению риска, APOE-e4 может вызывать появление симптомов в более молодом возрасте, чем обычно.
Приблизительно 20-30% людей в Соединенных Штатах имеют одну или две копии APOE-e4; примерно 2% населения США имеют две копии APOE-e4.

Генетическое тестирование
Генетические тесты доступны как для APOE-e4, так и для редких генов, непосредственно вызывающих болезнь Альцгеймера.Однако медицинские работники в настоящее время не рекомендуют рутинное генетическое тестирование на болезнь Альцгеймера. Тестирование на APOE-e4 иногда входит в состав научных исследований.
Скачать- Детерминированные гены напрямую вызывают заболевание, гарантируя, что у любого, кто унаследует его, разовьется заболевание. Ученые обнаружили редкие гены, вызывающие болезнь Альцгеймера, всего в нескольких сотнях больших семей по всему миру. Эти гены, на которые, по оценкам, приходится 1% или менее случаев болезни Альцгеймера, вызывают семейные формы с ранним началом, при которых симптомы обычно развиваются в период от 40 до 50 лет.Подавляющее большинство людей с болезнью Альцгеймера имеют позднее начало заболевания, возникающее в возрасте 65 лет или позже.
Хотя наследственные гены, вызывающие «семейную болезнь Альцгеймера», встречаются редко, их открытие дало важные сведения, помогающие нам понять болезнь Альцгеймера.
 Все эти гены влияют на процессинг или продукцию бета-амилоида, белкового фрагмента, который является основным компонентом бляшек. Бета-амилоид является главным подозреваемым в упадке и гибели клеток головного мозга. Адуканумаб (Aduhelm™), препарат, получивший ускоренное одобрение FDA, является первой терапией, демонстрирующей, что удаление амилоида из мозга с достаточной вероятностью снижает когнитивные и функциональные нарушения у людей, живущих с ранними стадиями болезни Альцгеймера.Несколько других методов лечения, нацеленных на амилоид, также находятся в разработке.
Все эти гены влияют на процессинг или продукцию бета-амилоида, белкового фрагмента, который является основным компонентом бляшек. Бета-амилоид является главным подозреваемым в упадке и гибели клеток головного мозга. Адуканумаб (Aduhelm™), препарат, получивший ускоренное одобрение FDA, является первой терапией, демонстрирующей, что удаление амилоида из мозга с достаточной вероятностью снижает когнитивные и функциональные нарушения у людей, живущих с ранними стадиями болезни Альцгеймера.Несколько других методов лечения, нацеленных на амилоид, также находятся в разработке.В настоящее время проводятся два международных исследования, чтобы получить более полное представление о болезни Альцгеймера путем изучения лиц с детерминированными генами болезни Альцгеймера: (1) Сеть доминантно наследуемой болезни Альцгеймера (DIAN), финансируемая Национальным институтом старения (NIA), включает 10 флагманских исследований. центров в США, Великобритании и Австралии. (2) Инициатива по предотвращению болезни Альцгеймера (API) ориентирована на большую семью в Антиокии, Колумбия, Южная Америка.
 В 5000 членов это самая большая семья в мире, в которой был идентифицирован ген, вызывающий болезнь Альцгеймера. Среди соавторов API — DIAN.
В 5000 членов это самая большая семья в мире, в которой был идентифицирован ген, вызывающий болезнь Альцгеймера. Среди соавторов API — DIAN.
Генетические тесты доступны как для APOE-e4, так и для редких генов, непосредственно вызывающих болезнь Альцгеймера. Кроме того, тестирование на APOE-e4 иногда включается в исследования. Ассоциация Альцгеймера не рекомендует генетическое тестирование на болезнь Альцгеймера для населения в целом. Если вы обеспокоены болезнью Альцгеймера или изменениями памяти у себя или у близкого человека, Ассоциация рекомендует вам откровенно поговорить со своим лечащим врачом.
О домашних генетических тестах
Ассоциация Альцгеймера рекомендует вам поговорить с консультантом по генетическим вопросам, прежде чем принять решение о сдаче теста на дому, и, если вы решите пройти генетическое тестирование на болезнь Альцгеймера, еще раз после получения результатов. На веб-сайте Национального общества консультантов-генетиков есть каталог с возможностью поиска, где можно найти консультанта.
 При неконтролируемом домашнем тесте существует реальная вероятность неправильного понимания результатов, что может привести к принятию ошибочных решений о вашем здоровье.Если вы уже испытываете симптомы снижения когнитивных функций, обратитесь к врачу для полного обследования.
При неконтролируемом домашнем тесте существует реальная вероятность неправильного понимания результатов, что может привести к принятию ошибочных решений о вашем здоровье.Если вы уже испытываете симптомы снижения когнитивных функций, обратитесь к врачу для полного обследования. 23 пары хромосом; Идентифицировано 4 гена болезни Альцгеймера:
АППС-1ПС-2АПОЕ4
Белок-предшественник амилоида (APP) ,
Открытый в 1987 году, это первый ген с мутациями, вызывающими наследственную форму болезни Альцгеймера.Пресенилин-1 (ПС-1) ,
идентифицированный в 1992 году, это второй ген с мутациями, вызывающими наследственную болезнь Альцгеймера.Вариации этого гена являются наиболее распространенной причиной наследственной болезни Альцгеймера.Пресенилин-2 (ПС-2) ,
открытый в 1993 году, является третьим геном, мутации которого вызывают наследственную болезнь Альцгеймера.
Аполипопротеин E-e4 (APOE4) ,
обнаруженный в 1993 году, является первой вариацией гена, повышающей риск болезни Альцгеймера, и остается геном риска с наибольшим известным влиянием. Однако наличие этой мутации не означает, что у человека разовьется заболевание.Более пристальный взгляд на гены, связанные с болезнью Альцгеймера
23 пары хромосом человека содержат все 30 000 генов, которые кодируют биологическую схему человеческого существа. На этой интерактивной иллюстрации показаны хромосомы, содержащие каждый из трех генов, вызывающих семейную болезнь Альцгеймера, и ген, оказывающий наибольшее влияние на риск развития болезни Альцгеймера.
Генетика и наследственные факторы рака поджелудочной железы – Сеть действий по борьбе с раком поджелудочной железы
На этой странице:
Является ли рак поджелудочной железы наследственным?
Все виды рака являются генетическими.
 ДНК (дезоксирибонуклеиновая кислота) есть в каждой клетке нашего тела. Каждая цепь ДНК содержит множество генов. Все виды рака начинаются, когда мутации или изменения ДНК заставляют клетки делиться и бесконтрольно расти.
ДНК (дезоксирибонуклеиновая кислота) есть в каждой клетке нашего тела. Каждая цепь ДНК содержит множество генов. Все виды рака начинаются, когда мутации или изменения ДНК заставляют клетки делиться и бесконтрольно расти.Но это отличается от наследственного рака. Наследственный или семейный рак означает, что риск заболевания передается в семье.
Является ли рак поджелудочной железы наследственным?
Около 10% случаев рака поджелудочной железы являются наследственными. Это означает, что на каждые 10 человек с раком поджелудочной железы, вероятно, приходится один человек с наследственной мутацией, повышающей риск развития заболевания.Мутации, которые происходят в течение жизни человека, а не унаследованные мутации, вызывают большинство видов рака поджелудочной железы. Эти мутации не могут передаваться от родителей к детям.
Но в некоторых случаях мутировавшая ДНК переходит из поколения в поколение. Их называют мутациями зародышевой линии. Эти мутации могут привести к наследственному раку поджелудочной железы.
 Это единственный путь наследования рака поджелудочной железы.
Это единственный путь наследования рака поджелудочной железы.Знания – сила в борьбе с раком поджелудочной железы.
- Знай свою семью.
- Знай свой риск.
- Знай свой план.
Как узнать, является ли рак поджелудочной железы в вашей семье наследственным?
Если вы являетесь ближайшим родственником человека, у которого диагностирован рак поджелудочной железы, у вас может быть повышенный риск развития рака поджелудочной железы. Члену вашей семьи с раком поджелудочной железы настоятельно рекомендуется пройти генетическое тестирование на наличие наследственных мутаций.
- Отрицательные результаты часто означают, что вам не нужно проходить генетическое тестирование.
- Если результаты положительные, неизвестные или если у вас есть несколько близких родственников с раком, Сеть действий по борьбе с раком поджелудочной железы рекомендует вам проконсультироваться с консультантом-генетиком, чтобы определить, следует ли вам пройти генетическое тестирование на наследственный риск рака и следует ли вам обсудить варианты мониторинг.

Риск возрастает, если больше членов семьи страдают раком поджелудочной железы или другими специфическими видами рака или состояниями, включая:
- Семейный рак молочной железы, яичников или толстой кишки
- Семейная меланома
- Наследственный панкреатит: повторяющееся воспаление поджелудочной железы, как правило, начиная с 20 лет
- Наследственные генетические синдромы, связанные с раком поджелудочной железы
Используйте нашу таблицу семейного анамнеза, чтобы лучше понять свой риск наследственного рака поджелудочной железы.
Наличие повышенного риска или наличие семейного анамнеза рака поджелудочной железы не означает, что вы обязательно заболеете этим заболеванием.
Обратитесь в Службу поддержки пациентов PanCAN компании PanCAN, чтобы получить дополнительную информацию о рисках, разобраться в различных тестах или получить помощь в поиске генетического консультанта.
Какие гены связаны с наследственным раком поджелудочной железы?
Исследователи изучают несколько наследственных синдромов и генов, связанных с раком поджелудочной железы, в том числе:
- Мутация BRCA
- Муковисцидоз
- Семейный аденоматозный полипоз (САП)
- Семейная атипичная множественная меланома (FAMMM)
- Наследственный неполипозный колоректальный рак (HNPCC) или синдром Линча
- Наследственный панкреатит
- Мутация PALB2
- Синдром Пейтца-Егерса
Узнайте больше о генетических мутациях.
Служба поддержки пациентов PanCAN
также может предоставить вам дополнительную информацию о наследственных синдромах, связанных с раком поджелудочной железы.
Если у вас есть одно из этих заболеваний, означает ли это, что вы заболеете раком поджелудочной железы?
Наличие генетического заболевания, связанного с раком поджелудочной железы, не означает, что человек обязательно заболеет раком поджелудочной железы. Но это означает, что у них может быть больше шансов заболеть, чем у других.
Если вы считаете, что у вас может быть риск развития рака поджелудочной железы, поговорите со своим врачом или консультантом по генетическим вопросам.Консультант-генетик может дать вам информацию о генетическом тестировании и помочь определить, какие тесты вам подходят.
Единственный способ убедиться, что у вас есть мутация, связанная с раком поджелудочной железы, — это встретиться с консультантом-генетиком и пройти обследование.
Кто такой консультант-генетик?
Консультанты-генетики обучены медицинским и эмоциональным аспектам наследственных заболеваний.
 Консультант-онколог-генетик специализируется на консультировании и обучении людей, больных раком, и членов их семей, у которых может быть повышенный риск развития рака.
Консультант-онколог-генетик специализируется на консультировании и обучении людей, больных раком, и членов их семей, у которых может быть повышенный риск развития рака.Узнайте больше о генетическом консультировании.
Консультант-генетик также может помочь вам и вашей семье решить, следует ли вам проходить генетическое тестирование.
Что такое генетическое тестирование?
Генетическое тестирование ищет унаследованные мутации. Изменения в ДНК человека одинаковы по всему телу. Итак, этот анализ обычно делается на образце крови или слюны.
Все люди, у которых диагностирован рак поджелудочной железы, независимо от семейного анамнеза, должны пройти генетическое тестирование, чтобы помочь в принятии решений о лечении.Если генетическое тестирование выявит мутацию зародышевой линии, то их близкие могут также подумать о том, чтобы пройти тестирование.
Носители генетического изменения подвержены большему риску, чем большинство людей. Но это не значит, что у них обязательно разовьется заболевание.

Генетические тесты могут быть дорогими. Страховка может покрыть тестирование, но не всегда. Консультанты-генетики могут помочь, сообщив вашей страховой компании о важности генетического консультирования и покрытия расходов на анализы.
Поговорите со своим врачом или консультантом по генетическим вопросам, чтобы выбрать тесты и следующие шаги, которые подходят именно вам.
Что вы можете сделать, если в вашей семье есть наследственный рак поджелудочной железы?
Если консультант-генетик считает, что вы подвержены более высокому риску развития заболевания:
- Эксперты рекомендуют зарегистрироваться в программе наблюдения, если вы соответствуете требованиям.
- Некоторые врачи рекомендуют ежегодное томографическое сканирование. Эти сканирования часто начинаются в возрасте 50 лет, но могут начаться раньше, если рак поджелудочной железы случился в семье этого человека в более раннем возрасте.
- Вы можете принять участие в генетическом или семейном реестре.

Для получения информации о программах эпиднадзора в вашем районе и списка генетических реестров обращайтесь в службу поддержки пациентов PanCAN.
Что такое программа наблюдения?
В рамках программы наблюдения, раннего выявления или скрининга врачи активно проверяют людей, подверженных риску заболевания раком поджелудочной железы.
Цель состоит в том, чтобы найти ранний рак поджелудочной железы и предраковые поражения. Пациенты, у которых болезнь обнаружена на ранних стадиях, имеют лучшие результаты. Это потому, что у них больше шансов на операцию.
Программы наблюдения обычно используют визуализирующие тесты для наблюдения за пациентами. Они также могут собирать кровь или жидкости поджелудочной железы для анализа.
Преимущества участия в программе наблюдения включают в себя:
- Знающие врачи следят за вами
- Возможная помощь от новых диагностических тестов
- Помощь в продвижении усилий по раннему обнаружению
Прежде чем зарегистрироваться в программе наблюдения, вы должны понимать риски и преимущества скрининга.
 Медицинские работники, ведущие программу, могут помочь вам в этом.
Медицинские работники, ведущие программу, могут помочь вам в этом.Что такое генетический реестр?
Генетические или семейные реестры собирают информацию о семьях с множественными диагнозами рака поджелудочной железы. Сюда часто входит информация о семье:
- Окружающая среда
- Образ жизни
- Рак поджелудочной железы в анамнезе
- Заболеваемость другими видами рака в семье
Цель состоит в том, чтобы найти общие аспекты в семьях с множественными случаями рака поджелудочной железы, что приведет к лучшему пониманию болезни.Реестры жизненно важны для исследования причин наследственного рака поджелудочной железы.
Семейные регистры не предлагают тесты или скрининг для раннего выявления рака поджелудочной железы.
Если у вас диагностирован рак поджелудочной железы или вы ухаживали за кем-то, у кого диагностирован рак поджелудочной железы, и вы хотели бы внести свой вклад в исследования, присоединитесь к нашему Реестру пациентов.

Как информация об унаследованной генетической мутации может помочь пациентам?
Помимо увеличения риска рака поджелудочной железы, некоторые мутации зародышевой линии влияют на варианты лечения для тех, кто заболевает.Использование биологии пациента для определения наилучших вариантов лечения человека называется точной медициной. Пациенты, которые получают лечение, основанное на их биологии, могут жить дольше.
Как можно скорее после постановки диагноза Сеть действий по борьбе с раком поджелудочной железы настоятельно рекомендует всем пациентам с раком поджелудочной железы пройти генетическое тестирование на наличие наследственных мутаций и тестирование биомаркеров опухолевой ткани. Эти тесты помогут медицинскому персоналу определить наилучшие варианты лечения для пациента и информировать членов семьи о риске.
Пациенты должны обсудить оба теста со своим лечащим врачом. Тесты можно получить в их лечащем учреждении или в службе прецизионной медицины PanCAN «Знай свою опухоль».

Генетика рака поджелудочной железы Видео
Мы здесь, чтобы помочь
Свяжитесь со службой поддержки пациентов PanCAN для получения бесплатной подробной информации о факторах риска рака поджелудочной железы, генетических тестах, генетическом консультировании, программах скрининга и наблюдения.
Связанные темы
Новости о генетике и семейной истории
Информация проверена Научно-медицинским консультативным советом PanCAN, в состав которого входят специалисты в данной области из таких учреждений, как Пенсильванский университет, Мемориальный онкологический центр Слоуна-Кеттеринга, Медицинский центр Вирджинии Мейсон и других.
Информация, предоставленная организацией Pancreatic Cancer Action Network, Inc. («PanCAN»), не заменяет медицинскую консультацию, диагностику, лечение или другие медицинские услуги. PanCAN может предоставлять вам информацию о врачах, продуктах, услугах, клинических испытаниях или методах лечения рака поджелудочной железы, но PanCAN не рекомендует и не поддерживает какие-либо конкретные медицинские ресурсы.
 Кроме того, обратите внимание, что любая личная информация, которую вы предоставляете персоналу PanCAN во время общения по телефону и/или электронной почте, может храниться и использоваться, чтобы помочь компании PanCAN выполнить свою миссию по оказанию помощи пациентам с раком поджелудочной железы, а также поиску лекарств и методов лечения.Сохраненная информация о компонентах может использоваться для информирования программ и действий PanCAN. Информация также может быть предоставлена третьим сторонам в совокупном или ограниченном формате для руководства будущими исследованиями и образовательными усилиями в области рака поджелудочной железы. PanCAN не будет предоставлять личную информацию, непосредственно идентифицирующую личность (например, ваше имя или контактную информацию), таким третьим лицам без вашего предварительного письменного согласия, если это не требуется или не разрешено законом. Для получения дополнительной информации о том, как мы можем использовать вашу информацию, вы можете найти нашу политику конфиденциальности на нашем веб-сайте по адресу https://www.
Кроме того, обратите внимание, что любая личная информация, которую вы предоставляете персоналу PanCAN во время общения по телефону и/или электронной почте, может храниться и использоваться, чтобы помочь компании PanCAN выполнить свою миссию по оказанию помощи пациентам с раком поджелудочной железы, а также поиску лекарств и методов лечения.Сохраненная информация о компонентах может использоваться для информирования программ и действий PanCAN. Информация также может быть предоставлена третьим сторонам в совокупном или ограниченном формате для руководства будущими исследованиями и образовательными усилиями в области рака поджелудочной железы. PanCAN не будет предоставлять личную информацию, непосредственно идентифицирующую личность (например, ваше имя или контактную информацию), таким третьим лицам без вашего предварительного письменного согласия, если это не требуется или не разрешено законом. Для получения дополнительной информации о том, как мы можем использовать вашу информацию, вы можете найти нашу политику конфиденциальности на нашем веб-сайте по адресу https://www. pancan.org/privacy/.
pancan.org/privacy/..content-left-column iframe {margin: 0px 0 !important;}
Фактор V Лейден — Симптомы и причины
Обзор
Фактор V Лейден (FAK-tur 5 LIDE-n) представляет собой мутацию одного из факторов свертывания крови. Эта мутация может увеличить вероятность образования аномальных тромбов, чаще всего в ногах или легких.
У большинства людей с фактором V Leiden никогда не образуются аномальные тромбы.Но у людей, которые это делают, эти аномальные сгустки могут привести к долгосрочным проблемам со здоровьем или стать опасными для жизни.
И мужчины, и женщины могут иметь фактор V Лейден. Женщины-носители лейденской мутации фактора V могут иметь повышенную склонность к образованию тромбов во время беременности или при приеме гормона эстрогена.
Если у вас есть фактор V Лейдена и у вас образовались тромбы, антикоагулянты могут снизить риск образования дополнительных тромбов и помочь вам избежать потенциально серьезных осложнений.

Товары и услуги
Показать больше продуктов Mayo ClinicСимптомы
Мутация фактора V Лейдена сама по себе не вызывает никаких симптомов. Поскольку фактор V Лейден представляет собой риск образования тромбов в ногах или легких, первым признаком того, что у вас есть заболевание, может быть образование аномального тромба.
Некоторые сгустки не причиняют вреда и исчезают сами по себе. Другие могут быть опасными для жизни.Симптомы тромба зависят от того, какая часть вашего тела поражена.
Сгусток в глубокой вене
Это известно как тромбоз глубоких вен (ТГВ), который чаще всего возникает в ногах. ТГВ может не вызывать никаких симптомов. Если признаки и симптомы все же возникают, они могут включать:
- Боль
- Отек
- Покраснение
- Тепло
Сгусток, который перемещается в легкие
Известная как легочная эмболия, это происходит, когда часть ТГВ вырывается на свободу и проходит через правую часть сердца в легкие, где блокирует кровоток.
 Это может быть опасной для жизни ситуацией. Признаки и симптомы могут включать:
Это может быть опасной для жизни ситуацией. Признаки и симптомы могут включать:- Внезапная одышка
- Боль в груди при дыхании
- Кашель с выделением крови или мокроты с прожилками крови
- Учащенное сердцебиение
Когда обратиться к врачу
Немедленно обратитесь за медицинской помощью, если у вас есть признаки или симптомы тромбоза глубоких вен или легочной эмболии.
Причины
Если у вас есть фактор V Лейдена, вы унаследовали одну или, реже, две копии дефектного гена.Наследование одной копии немного увеличивает риск образования тромбов. Наследование двух копий — по одной от каждого родителя — значительно увеличивает риск образования тромбов.
Факторы риска
Фактор V Лейден в семейном анамнезе увеличивает риск наследования заболевания. Заболевание чаще всего встречается у белых людей европейского происхождения.

Люди, унаследовавшие фактор V Лейден только от одного родителя, имеют 5-процентный шанс развития аномального тромба к 65 годам.Факторы, которые увеличивают этот риск, включают:
- Два дефектных гена. Наследование генетической мутации от обоих родителей, а не только от одного, может значительно увеличить риск образования аномальных тромбов.
- Неподвижность. Продолжительные периоды неподвижности, например сидение во время длительного полета на самолете, могут увеличить риск образования тромбов в ногах.
- Эстрогены. Оральные контрацептивы, заместительная гормональная терапия и беременность могут повысить вероятность образования тромбов.
- Операции или травмы. Операции или травмы, такие как переломы костей, могут увеличить риск образования аномальных тромбов.
- Не-0 группа крови. Аномальные тромбы чаще встречаются у людей с группами крови A, B или AB по сравнению с людьми с группой крови O.

Осложнения
Фактор V Лейден может вызвать образование тромбов в ногах (тромбоз глубоких вен) и легких (тромбоэмболия легочной артерии). Эти сгустки крови могут быть опасными для жизни.
01 августа 2020 г.
НАСЛЕДСТВЕННЫЕ ФАКТОРЫ РОСТА ЧЕЛОВЕКА на JSTOR
АбстрактныйКривые роста были рассчитаны с помощью IBM 1620 для 31 пары разнояйцевых и 29 пар однояйцевых близнецов на основе измерений, полученных в течение первых четырех лет их жизни. Использовалась следующая формула: Y = a + bx + cx², где Y — рост, а x — возраст в днях.Было обнаружено, что эта парабола хорошо согласуется с изучаемым возрастным диапазоном (от рождения до 4 лет). Для оценки статистической значимости наследственного компонента в параметрах кривой были построены отношения F между братскими и идентичными внутрипарными дисперсиями.
Информация о журнале F не имел значения для исходного статуса; F для b, скорость роста, была значимой при уровне вероятности 5%; и F для c, замедление или изменение скорости роста, было значительным на уровне 1%.Отношения F также представлены для измерений при каждом посещении. Обычно они выше, потому что отражают совместное действие всех трех параметров. Мы заключаем, что для роста в настоящей небольшой выборке наследственное влияние, по-видимому, имеет первостепенное значение только для замедления скорости роста (которое вступает в силу несколько позже), имеет умеренное значение для скорости роста, но не является статистически значимым для начальный статус.
F не имел значения для исходного статуса; F для b, скорость роста, была значимой при уровне вероятности 5%; и F для c, замедление или изменение скорости роста, было значительным на уровне 1%.Отношения F также представлены для измерений при каждом посещении. Обычно они выше, потому что отражают совместное действие всех трех параметров. Мы заключаем, что для роста в настоящей небольшой выборке наследственное влияние, по-видимому, имеет первостепенное значение только для замедления скорости роста (которое вступает в силу несколько позже), имеет умеренное значение для скорости роста, но не является статистически значимым для начальный статус.Всемирный форум для обсуждения самых современных идей, методов и приемов в этой области. Биология человека фокусируется на генетике в ее самом широком смысле.В эту рубрику включены: генетика человеческой популяции, эволюционная и генетическая демография, количественная генетика, эволюционная биология, исследования древней ДНК, биологическое разнообразие, интерпретируемое с точки зрения адаптации (биометрия, физическая антропология), и междисциплинарные исследования, связывающие биологическое и культурное разнообразие (выведенные из языковая изменчивость, этнологическое разнообразие, археологические свидетельства и т.
Информация об издателе д.)
д.)Издательство Уэйнского государственного университета является выдающимся городским издательством, стремящимся поддерживать основную исследовательскую, учебную и сервисную миссию своего головного учреждения, создавая высококачественные научные и общие работы, представляющие глобальный интерес.Через свою издательскую программу пресса распространяет исследования, продвигает образование и служит местному сообществу, одновременно укрепляя международную репутацию прессы и университета.
Генетические заболевания глаз и причины слепоты
Какие виды болезней глаз передаются по наследству?
Генетические факторы играют роль во многих видах заболеваний глаз, в том числе в тех заболеваниях, которые являются основной причиной слепоты среди младенцев, детей и взрослых.
Более 60 процентов случаев слепоты среди младенцев вызваны наследственными заболеваниями глаз, такими как врожденная (присутствующая при рождении) катаракта, врожденная глаукома, дегенерация сетчатки, атрофия зрительного нерва и пороки развития глаз.
 До 40% пациентов с определенными типами косоглазия (косоглазие) имеют семейный анамнез заболевания, и в настоящее время предпринимаются усилия по выявлению ответственных генов.
До 40% пациентов с определенными типами косоглазия (косоглазие) имеют семейный анамнез заболевания, и в настоящее время предпринимаются усилия по выявлению ответственных генов.У взрослых глаукома и возрастная дегенерация желтого пятна являются двумя ведущими причинами слепоты, и в большинстве случаев обе они передаются по наследству.Исследователи картировали несколько генов глаукомы и начинают идентифицировать гены, участвующие в дегенерации желтого пятна. Они также добились очень значительного прогресса в идентификации генов, вызывающих пигментный ретинит, дегенеративное заболевание сетчатки, вызывающее куриную слепоту и постепенную потерю зрения.
Могут ли общие проблемы со зрением передаваться по наследству?
Генетика также играет роль в проблемах со зрением, которые возникают у здоровых глаз. Генетические офтальмологи теперь имеют доказательства того, что наиболее распространенные проблемы со зрением у детей и взрослых обусловлены генетически.Список включает косоглазие (косоглазие), амблиопию (ленивый глаз) и аномалии рефракции, такие как близорукость (близорукость), дальнозоркость (дальнозоркость) и астигматизм.

Могут ли аномалии глаз быть вызваны другими заболеваниями?
Глазные аномалии присутствуют в одной трети наследственных системных заболеваний. Наличие определенного глазного признака, связанного с системным заболеванием, часто является решающим фактором в подтверждении диагноза этого заболевания. Например, вывих хрусталика в глазу может подтвердить диагноз синдрома Марфана, заболевания соединительной ткани, связанного с проблемами с сердцем; характерное вишнево-красное пятно в глазу обычно указывает на болезнь Тея-Сакса.
Можно ли скорректировать наследственные заболевания глаз при ранней диагностике?
Врачи Центра генетических заболеваний глаз Института глаза Коула тесно сотрудничают со специалистами Программы медицинской генетики и других служб Клиники Кливленда, чтобы обеспечить раннюю диагностику и эффективное лечение осложнений наследственных заболеваний глаз. Они также проводят обследование и лечение пациентов, направленных в Центр местными врачами.

Ваш офтальмолог, педиатр, генетик или семейный врач могут направить вас или вашего ребенка в Центр для специализированного обследования, тестирования и диагностики при подозрении на генетическое заболевание глаз.Институт глаза Коула и Центр генетических заболеваний глаз входят в состав Кливлендской клиники мирового уровня, в которую входят более 750 врачей, практикующих более чем по 100 специальностям. Для пациентов с системными генетическими заболеваниями специалисты Cole Eye Institute тесно сотрудничают со специалистами в других областях, чтобы интегрировать офтальмологическое лечение в общий план ухода за пациентом.
Что я могу ожидать во время оценки?
Когда вы или ваш ребенок направляетесь в Центр, специалист по генетическим заболеваниям глаз будет работать с вами, чтобы диагностировать проблему и спланировать последующее наблюдение и возможное лечение.
Первым шагом является полный обзор любых медицинских записей или результатов анализов, проведенных в клинике Кливленда или в другом учреждении.
 Затем вас спросят о вашей личной и семейной истории болезни, уделив особое внимание признакам и симптомам генетических нарушений. После того, как это будет завершено, вас попросят помочь составить ваше генеалогическое древо и определить других членов семьи, у которых могут быть подобные проблемы. Пациенты проходят всестороннюю оценку зрения и движения глаз, обследование с помощью щелевой лампы для микроскопического исследования глаза и проверку глазного давления.Используя глазные капли для расширения зрачков, офтальмолог может исследовать хрусталик, зрительный нерв и сетчатку на наличие аномалий.
Затем вас спросят о вашей личной и семейной истории болезни, уделив особое внимание признакам и симптомам генетических нарушений. После того, как это будет завершено, вас попросят помочь составить ваше генеалогическое древо и определить других членов семьи, у которых могут быть подобные проблемы. Пациенты проходят всестороннюю оценку зрения и движения глаз, обследование с помощью щелевой лампы для микроскопического исследования глаза и проверку глазного давления.Используя глазные капли для расширения зрачков, офтальмолог может исследовать хрусталик, зрительный нерв и сетчатку на наличие аномалий.Используя информацию, полученную при осмотре глаз, общем анамнезе и осмотре, офтальмолог и лечащий врач совместно определяют диагноз и план лечения.
Офтальмологи Центра обладают опытом диагностики и консультирования по лечению генетических заболеваний глаз. Когда требуется дополнительная экспертиза по конкретным глазным проблемам, они обращаются к другим специалистам Cleveland Clinic Cole Eye Institute за вторым мнением или консультацией.


 10 шт.
10 шт. 10 шт.
10 шт. 5 или 10 шт.
5 или 10 шт. 5 или 10 шт.
5 или 10 шт. 15 мг: 10, 20 или 30 шт.
15 мг: 10, 20 или 30 шт. 15 мг: 20 шт.
15 мг: 20 шт. 10 шт.
10 шт. р-ра д/в/в введения 1.2 мг: фл. 1 шт. в компл. с растворителем (амп. 1 шт.), шприцем, иглой д/разведения, катетером д/периферич. вен, фильтром инъекц. и салфетками
р-ра д/в/в введения 1.2 мг: фл. 1 шт. в компл. с растворителем (амп. 1 шт.), шприцем, иглой д/разведения, катетером д/периферич. вен, фильтром инъекц. и салфетками р-ра д/в/в введения: фл. 250 ME в компл. с р-лем и устройством д/добавления р-ля
р-ра д/в/в введения: фл. 250 ME в компл. с р-лем и устройством д/добавления р-ля р-ра д/в/в введения 1 мг (50 КЕД): фл. 1 шт. в компл. с растворителем
р-ра д/в/в введения 1 мг (50 КЕД): фл. 1 шт. в компл. с растворителем р-ра д/в/в введения 5 мг (250 КЕД): фл. 1 шт. в компл. с растворителем
р-ра д/в/в введения 5 мг (250 КЕД): фл. 1 шт. в компл. с растворителем р-ра д/в/в введения: фл. в компл. с растворителем и комплектом д/введения
р-ра д/в/в введения: фл. в компл. с растворителем и комплектом д/введения р-ра д/в/в введения 600 МЕ: фл. 1 шт. в компл. с растворителем, шприцем, иглой одноразов., иглой д/переноса, иглой фильтрующ., иглой аэрацион. и системой д/трансфузии
р-ра д/в/в введения 600 МЕ: фл. 1 шт. в компл. с растворителем, шприцем, иглой одноразов., иглой д/переноса, иглой фильтрующ., иглой аэрацион. и системой д/трансфузии Это произошло потому, что половые клетки, образующие мост, по которому наследственность должна проходить между поколениями, обычно невидимы невооруженным глазом. Только после изобретения микроскопа в начале 17 века и последующего открытия половых клеток можно было понять основы наследственности. До этого древнегреческий философ и ученый Аристотель (4 век до н.э.) предполагал, что относительный вклад родителей женского и мужского пола был очень неравным; Считалось, что самка обеспечивает то, что он называл «материей», а самец — «движением».« институтов Ману », составленных в Индии между 100 и 300 годами нашей эры, рассматривают роль женщины как роль поля, а роль мужчины — как роль семени; новые тела формируются «в результате совместной работы семени и поля». В действительности оба родителя одинаково передают наследственный образец, и в среднем дети похожи на своих матерей не меньше, чем на своих отцов. Тем не менее женские и мужские половые клетки могут сильно различаться по размеру и строению; масса яйцеклетки иногда в миллионы раз превышает массу сперматозоида.
Это произошло потому, что половые клетки, образующие мост, по которому наследственность должна проходить между поколениями, обычно невидимы невооруженным глазом. Только после изобретения микроскопа в начале 17 века и последующего открытия половых клеток можно было понять основы наследственности. До этого древнегреческий философ и ученый Аристотель (4 век до н.э.) предполагал, что относительный вклад родителей женского и мужского пола был очень неравным; Считалось, что самка обеспечивает то, что он называл «материей», а самец — «движением».« институтов Ману », составленных в Индии между 100 и 300 годами нашей эры, рассматривают роль женщины как роль поля, а роль мужчины — как роль семени; новые тела формируются «в результате совместной работы семени и поля». В действительности оба родителя одинаково передают наследственный образец, и в среднем дети похожи на своих матерей не меньше, чем на своих отцов. Тем не менее женские и мужские половые клетки могут сильно различаться по размеру и строению; масса яйцеклетки иногда в миллионы раз превышает массу сперматозоида./dna-structure-562597795-5ae77532c06471003681d684.jpg)
 В 1800-х годах было проведено еще много экспериментов с гибридами растений.Эти исследования также показали, что гибриды обычно занимают промежуточное положение между родителями. Между прочим, они записали большинство фактов, которые позже привели Грегора Менделя (, см. ниже) к формулировке его знаменитых правил и к основанию теории гена. По-видимому, никто из предшественников Менделя не видел значения накапливаемых данных. Общее промежуточное положение гибридов, казалось, лучше всего согласовывалось с верой в то, что наследственность передается от родителей к потомству «по крови», и это убеждение было принято большинством биологов XIX века, в том числе английским натуралистом Чарльзом Дарвином.
В 1800-х годах было проведено еще много экспериментов с гибридами растений.Эти исследования также показали, что гибриды обычно занимают промежуточное положение между родителями. Между прочим, они записали большинство фактов, которые позже привели Грегора Менделя (, см. ниже) к формулировке его знаменитых правил и к основанию теории гена. По-видимому, никто из предшественников Менделя не видел значения накапливаемых данных. Общее промежуточное положение гибридов, казалось, лучше всего согласовывалось с верой в то, что наследственность передается от родителей к потомству «по крови», и это убеждение было принято большинством биологов XIX века, в том числе английским натуралистом Чарльзом Дарвином. Эта идея нравится тем, кто гордится тем, что имеет благородную или выдающуюся «кровную» линию. Однако возникает загвоздка, когда замечают, что у ребенка есть некоторые характеристики, которых нет ни у одного из родителей, но они присутствуют у некоторых других родственников или присутствовали у более отдаленных предков. Еще чаще видно, что братья и сестры хотя и обнаруживают фамильное сходство в одних чертах, но в других явно различаются. Как одни и те же родители могли передать разную «кровь» каждому из своих детей?
Эта идея нравится тем, кто гордится тем, что имеет благородную или выдающуюся «кровную» линию. Однако возникает загвоздка, когда замечают, что у ребенка есть некоторые характеристики, которых нет ни у одного из родителей, но они присутствуют у некоторых других родственников или присутствовали у более отдаленных предков. Еще чаще видно, что братья и сестры хотя и обнаруживают фамильное сходство в одних чертах, но в других явно различаются. Как одни и те же родители могли передать разную «кровь» каждому из своих детей? Таким образом, Мендель показал, что, даже если бы возвышение какого-либо предка было целиком отражением его генов, весьма вероятно, что некоторые из его потомков, особенно более отдаленные, вообще не унаследовали бы эти «хорошие» гены.У организмов, размножающихся половым путем, включая человека, каждый индивидуум обладает уникальной наследственной одаренностью.
Таким образом, Мендель показал, что, даже если бы возвышение какого-либо предка было целиком отражением его генов, весьма вероятно, что некоторые из его потомков, особенно более отдаленные, вообще не унаследовали бы эти «хорошие» гены.У организмов, размножающихся половым путем, включая человека, каждый индивидуум обладает уникальной наследственной одаренностью. Его поставил под сомнение немецкий биолог Август Вейсман, чьи знаменитые эксперименты конца 1890-х годов по ампутации хвостов у поколений мышей показали, что такая модификация не приводит ни к исчезновению, ни даже к укорочению хвостов у потомков.Вейсман пришел к выводу, что наследственный дар организма, который он назвал зародышевой плазмой, совершенно обособлен и защищен от влияний, исходящих от остального тела, называемого соматоплазмой или сомой. Понятия зародышевая плазма–соматоплазма связаны с понятиями генотип–фенотип, но они не тождественны, и их не следует смешивать с ними.
Его поставил под сомнение немецкий биолог Август Вейсман, чьи знаменитые эксперименты конца 1890-х годов по ампутации хвостов у поколений мышей показали, что такая модификация не приводит ни к исчезновению, ни даже к укорочению хвостов у потомков.Вейсман пришел к выводу, что наследственный дар организма, который он назвал зародышевой плазмой, совершенно обособлен и защищен от влияний, исходящих от остального тела, называемого соматоплазмой или сомой. Понятия зародышевая плазма–соматоплазма связаны с понятиями генотип–фенотип, но они не тождественны, и их не следует смешивать с ними. е. в то, что некоторые особи передают свою наследственность своим потомкам более эффективно, чем другие, — и в «пренатальные влияния» или «материнские впечатления», т. е. в то, что события, переживаемые беременной самкой, отражаются в конституции будущего ребенка. Насколько древними являются эти верования, показано в Книге Бытия, в которой Иаков производит пятнистое или полосатое потомство овец и коз, показывая стадам полосатые прутья, пока животные размножаются.Другая такая вера — «телегония», восходящая к Аристотелю; в нем утверждалось, что на наследственность человека влияет не только его отец, но и самцы, с которыми женщина могла спариваться и которые вызвали предыдущие беременности. Даже Дарвин еще в 1868 г. серьезно обсуждал предполагаемый случай телегонии: случай, когда кобыла спарилась с зеброй, а затем с арабским жеребцом, от которого кобыла произвела на свет жеребенка со слабыми полосами на ногах. Простое объяснение этого результата состоит в том, что такие полосы естественным образом встречаются у некоторых пород лошадей.
е. в то, что некоторые особи передают свою наследственность своим потомкам более эффективно, чем другие, — и в «пренатальные влияния» или «материнские впечатления», т. е. в то, что события, переживаемые беременной самкой, отражаются в конституции будущего ребенка. Насколько древними являются эти верования, показано в Книге Бытия, в которой Иаков производит пятнистое или полосатое потомство овец и коз, показывая стадам полосатые прутья, пока животные размножаются.Другая такая вера — «телегония», восходящая к Аристотелю; в нем утверждалось, что на наследственность человека влияет не только его отец, но и самцы, с которыми женщина могла спариваться и которые вызвали предыдущие беременности. Даже Дарвин еще в 1868 г. серьезно обсуждал предполагаемый случай телегонии: случай, когда кобыла спарилась с зеброй, а затем с арабским жеребцом, от которого кобыла произвела на свет жеребенка со слабыми полосами на ногах. Простое объяснение этого результата состоит в том, что такие полосы естественным образом встречаются у некоторых пород лошадей.
 Официально лысенковцы были дискредитированы в 1964 году.
Официально лысенковцы были дискредитированы в 1964 году. Исследователи выявили наследственные гены болезни Альцгеймера в обеих категориях.
Исследователи выявили наследственные гены болезни Альцгеймера в обеих категориях.
 Все эти гены влияют на процессинг или продукцию бета-амилоида, белкового фрагмента, который является основным компонентом бляшек. Бета-амилоид является главным подозреваемым в упадке и гибели клеток головного мозга. Адуканумаб (Aduhelm™), препарат, получивший ускоренное одобрение FDA, является первой терапией, демонстрирующей, что удаление амилоида из мозга с достаточной вероятностью снижает когнитивные и функциональные нарушения у людей, живущих с ранними стадиями болезни Альцгеймера.Несколько других методов лечения, нацеленных на амилоид, также находятся в разработке.
Все эти гены влияют на процессинг или продукцию бета-амилоида, белкового фрагмента, который является основным компонентом бляшек. Бета-амилоид является главным подозреваемым в упадке и гибели клеток головного мозга. Адуканумаб (Aduhelm™), препарат, получивший ускоренное одобрение FDA, является первой терапией, демонстрирующей, что удаление амилоида из мозга с достаточной вероятностью снижает когнитивные и функциональные нарушения у людей, живущих с ранними стадиями болезни Альцгеймера.Несколько других методов лечения, нацеленных на амилоид, также находятся в разработке. В 5000 членов это самая большая семья в мире, в которой был идентифицирован ген, вызывающий болезнь Альцгеймера. Среди соавторов API — DIAN.
В 5000 членов это самая большая семья в мире, в которой был идентифицирован ген, вызывающий болезнь Альцгеймера. Среди соавторов API — DIAN. При неконтролируемом домашнем тесте существует реальная вероятность неправильного понимания результатов, что может привести к принятию ошибочных решений о вашем здоровье.Если вы уже испытываете симптомы снижения когнитивных функций, обратитесь к врачу для полного обследования.
При неконтролируемом домашнем тесте существует реальная вероятность неправильного понимания результатов, что может привести к принятию ошибочных решений о вашем здоровье.Если вы уже испытываете симптомы снижения когнитивных функций, обратитесь к врачу для полного обследования. 
 ДНК (дезоксирибонуклеиновая кислота) есть в каждой клетке нашего тела. Каждая цепь ДНК содержит множество генов. Все виды рака начинаются, когда мутации или изменения ДНК заставляют клетки делиться и бесконтрольно расти.
ДНК (дезоксирибонуклеиновая кислота) есть в каждой клетке нашего тела. Каждая цепь ДНК содержит множество генов. Все виды рака начинаются, когда мутации или изменения ДНК заставляют клетки делиться и бесконтрольно расти. Это единственный путь наследования рака поджелудочной железы.
Это единственный путь наследования рака поджелудочной железы.

 Консультант-онколог-генетик специализируется на консультировании и обучении людей, больных раком, и членов их семей, у которых может быть повышенный риск развития рака.
Консультант-онколог-генетик специализируется на консультировании и обучении людей, больных раком, и членов их семей, у которых может быть повышенный риск развития рака.

 Медицинские работники, ведущие программу, могут помочь вам в этом.
Медицинские работники, ведущие программу, могут помочь вам в этом.

 Кроме того, обратите внимание, что любая личная информация, которую вы предоставляете персоналу PanCAN во время общения по телефону и/или электронной почте, может храниться и использоваться, чтобы помочь компании PanCAN выполнить свою миссию по оказанию помощи пациентам с раком поджелудочной железы, а также поиску лекарств и методов лечения.Сохраненная информация о компонентах может использоваться для информирования программ и действий PanCAN. Информация также может быть предоставлена третьим сторонам в совокупном или ограниченном формате для руководства будущими исследованиями и образовательными усилиями в области рака поджелудочной железы. PanCAN не будет предоставлять личную информацию, непосредственно идентифицирующую личность (например, ваше имя или контактную информацию), таким третьим лицам без вашего предварительного письменного согласия, если это не требуется или не разрешено законом. Для получения дополнительной информации о том, как мы можем использовать вашу информацию, вы можете найти нашу политику конфиденциальности на нашем веб-сайте по адресу https://www.
Кроме того, обратите внимание, что любая личная информация, которую вы предоставляете персоналу PanCAN во время общения по телефону и/или электронной почте, может храниться и использоваться, чтобы помочь компании PanCAN выполнить свою миссию по оказанию помощи пациентам с раком поджелудочной железы, а также поиску лекарств и методов лечения.Сохраненная информация о компонентах может использоваться для информирования программ и действий PanCAN. Информация также может быть предоставлена третьим сторонам в совокупном или ограниченном формате для руководства будущими исследованиями и образовательными усилиями в области рака поджелудочной железы. PanCAN не будет предоставлять личную информацию, непосредственно идентифицирующую личность (например, ваше имя или контактную информацию), таким третьим лицам без вашего предварительного письменного согласия, если это не требуется или не разрешено законом. Для получения дополнительной информации о том, как мы можем использовать вашу информацию, вы можете найти нашу политику конфиденциальности на нашем веб-сайте по адресу https://www. pancan.org/privacy/.
pancan.org/privacy/.
 Это может быть опасной для жизни ситуацией. Признаки и симптомы могут включать:
Это может быть опасной для жизни ситуацией. Признаки и симптомы могут включать:

 F не имел значения для исходного статуса; F для b, скорость роста, была значимой при уровне вероятности 5%; и F для c, замедление или изменение скорости роста, было значительным на уровне 1%.Отношения F также представлены для измерений при каждом посещении. Обычно они выше, потому что отражают совместное действие всех трех параметров. Мы заключаем, что для роста в настоящей небольшой выборке наследственное влияние, по-видимому, имеет первостепенное значение только для замедления скорости роста (которое вступает в силу несколько позже), имеет умеренное значение для скорости роста, но не является статистически значимым для начальный статус.
F не имел значения для исходного статуса; F для b, скорость роста, была значимой при уровне вероятности 5%; и F для c, замедление или изменение скорости роста, было значительным на уровне 1%.Отношения F также представлены для измерений при каждом посещении. Обычно они выше, потому что отражают совместное действие всех трех параметров. Мы заключаем, что для роста в настоящей небольшой выборке наследственное влияние, по-видимому, имеет первостепенное значение только для замедления скорости роста (которое вступает в силу несколько позже), имеет умеренное значение для скорости роста, но не является статистически значимым для начальный статус. д.)
д.) До 40% пациентов с определенными типами косоглазия (косоглазие) имеют семейный анамнез заболевания, и в настоящее время предпринимаются усилия по выявлению ответственных генов.
До 40% пациентов с определенными типами косоглазия (косоглазие) имеют семейный анамнез заболевания, и в настоящее время предпринимаются усилия по выявлению ответственных генов.

 Затем вас спросят о вашей личной и семейной истории болезни, уделив особое внимание признакам и симптомам генетических нарушений. После того, как это будет завершено, вас попросят помочь составить ваше генеалогическое древо и определить других членов семьи, у которых могут быть подобные проблемы. Пациенты проходят всестороннюю оценку зрения и движения глаз, обследование с помощью щелевой лампы для микроскопического исследования глаза и проверку глазного давления.Используя глазные капли для расширения зрачков, офтальмолог может исследовать хрусталик, зрительный нерв и сетчатку на наличие аномалий.
Затем вас спросят о вашей личной и семейной истории болезни, уделив особое внимание признакам и симптомам генетических нарушений. После того, как это будет завершено, вас попросят помочь составить ваше генеалогическое древо и определить других членов семьи, у которых могут быть подобные проблемы. Пациенты проходят всестороннюю оценку зрения и движения глаз, обследование с помощью щелевой лампы для микроскопического исследования глаза и проверку глазного давления.Используя глазные капли для расширения зрачков, офтальмолог может исследовать хрусталик, зрительный нерв и сетчатку на наличие аномалий.