Болезнь Паркинсона излечима или метод «вечной иглы»
О болезни Паркинсона в последние десятилетия говорят много. Количество людей с этим недугом с каждым годом увеличивается, а возраст пациентов становится моложе. Можно с уверенностью сказать, что нейродегенеративные заболевания, к которым относится болезнь Паркинсона, стали одной из наиболее острых проблем современного здравоохранения.
Болезнь Паркинсона считается неизлечимой, и все же есть люди, которые смогли полностью победить болезнь, например, 76-летний Енрике Фрейре из Аргентины. У которого через 6 месяцев установилась выработка дофамина и со временем ушли на нет все симптомы. Через 3 года его лечащий невропатолог смог снять диагноз Паркинсона.
Нейродегенеративные болезни характеризуются прогрессирующей дегенерацией и гибелью нервных клеток, вследствие чего происходит нарушение речи, мыслительных способностей, ухудшение памяти и двигательных функций человека.
Все эти симптомы в полной мере характерны для болезни Паркинсона, которая в буквальном смысле превращает человека в малоподвижного старика. Не даром Джеймс Паркинсон назвал открытую им в 1817 году болезнь — «дрожательный паралич».
Точная причина возникновения паркинсонизма неизвестна, но причина, по которой возникают симптомы, характерные для этого заболевания, ясна — это нарушение выработки дофамина.
Современная медицина и болезнь Паркинсона
Вот уже более полувека одним из основных лекарств, используемых для лечения «дрожательного паралича» остается леводопа. Это простое химическое соединение, предшественник дофамина. Поступая в организм человека, леводопа преобразуется нервными клетками в дофамин, снимая тем самым симптомы заболевания.
Однако не все так просто. Леводопа не лечит паркинсонизм, она даже не замедляет развитие патологии, а лишь приводит к временному облегчению состояния. При этом постоянный прием леводопы приводит к тому, что мозг пациента прекращает вырабатывать собственный дофамин.
Метод «вечной иглы»
И все же безопасный метод лечения болезни Паркинсона существует! Единственная в мире терапия, которая заставляет организм вырабатывать собственный дофамин — это аурикулотерапия или метод «вечной иглы».
Метод был открыт в 2001 году немецким невропатологом Ульрихом Вертом и с тех пор более 6000 пациентов смогли убедиться в его результативности. Среди них есть пациенты, у которых диагноз «болезнь Паркинсона» был полностью снят, а выздоровление подтверждено другими врачами и сканированием головного мозга.
Метод «вечной иглы» основывается на иглоукалывании или акупунктуре, которая успешно применяется в восточной медицине не одну тысячу лет. Современному европейскому человеку трудно понять, как именно работает акупунктура. Краткое объяснение сводится к тому, что воздействуя на определенные точки на теле человека, врач может регулировать течение жизненной энергии Ци и восстанавливать здоровье человека.
Доктор мед наук У. Верт пошел дальше и усилил эффект традиционной акупунктуры, сделав воздействие игл на точки постоянным с помощью вживления имплантатов.
Крошечные имплантаты, длиной не более двух миллиметров, размещаются под кожей ушной раковины. Там они воздействуют на активные точки, которые связаны с головным мозгом через множество нервных окончаний, воздействие на точки способствует возобновлению выработки дофамина. Благодаря этому уменьшается проявление симптомов многих заболеваний, а главное, улучшается качество жизни пациентов.
Центр Нейро-Регенеративной медицины
На берегу Средиземноморского побережья находится клиника, в которой вот уже 18 лет помогают людям, страдающим паркинсонизмом, болезнью Альцгеймера, рассеянным склерозом, боковым амиотрофическим склерозом, синдромом беспокойных ног, астмой, мигренью и другими недугами.
Здесь обследуют и лечат не болезнь, а человека. Зачастую пациенты, которые обращаются в клинику, имеют целый букет заболеваний. Кроме того, некоторые болезни и состояния возникают в результате осложнения других недугов, поэтому лечение необходимо проводить комплексно.
На индивидуальном приеме врач выясняет полную картину состояния здоровья пациента и разрабатывает план имплантации. Как правило, ему назначают от 80 до 120 имплантов, которые призваны не только уменьшить симптомы основного заболевания, но и улучшить работу всех систем организма, а также поддержать эмоциональное состояние человека, поскольку стресс усугубляет протекание многих болезней.
Процедура имплантации длится 2 часа и проходит под местной анестезией. Дальше все зависит от организма и стадии заболевания человека Некоторые чувствуют улучшение сразу же после процедуры, другим пациентам требуется несколько месяцев, чтобы симптомы болезни ушли.
Статистика показывает, что после лечения у 80% пациентов качество жизни улучшается на 40-60%. Клинические исследования по нормативам Европейского Союза полностью подтверждают результаты, полученные в клинике.
Клинические исследования по нормативам Европейского Союза полностью подтверждают результаты, полученные в клинике.
Стоимость терапии в клинике составляет 3,5 — 6,5 тысячи евро. Сумма зависит от количества имплантов, которые вводят пациенту. Импланты устанавливают один раз и навсегда, после этого пациенту достаточно лишь раз в несколько лет появляться для контроля.
Отзыв пациента с болезнью Паркинсона
Мария Гвадалупе из Мексики, у которой болезнь Паркинсона диагностировали в 2006 году рассказывает: «Мой муж увидел в Интернете отзывы пациентов, которые благодаря иглам вновь смогли говорить и даже бегать. Впрочем, волшебством казалось даже то, что люди смогли избавиться от тремора. Несмотря на сомнения, я попробовала лечиться по новой методике и вскоре удостоверилась, что отзывы были правдивыми.
Благодаря иголкам я вернула прежнюю активность, утраченную из-за болезни. Я больше не нуждаюсь в уходе, помощи или наблюдении. Я могу нормально жить без посторонней помощи.
Каждый пациент — индивидуальный случай и, соответственно, может по-разному реагировать на лечение. И хотя побочных эффектов у терапии нет, но все же очень важно подобрать индивидуальный подход и план лечения к каждому из обратившихся за помощью.
Проконсультировать Ваш случай или заболевание Ваших родственников можно здесь: http://terapiawerth.com
Хотите первыми получать важную и полезную информацию о ДЕНЬГАХ и БИЗНЕСЕ? Подписывайтесь на наши аккаунты в мессенджерах и соцсетях: Telegram, Twitter, YouTube, Facebook, Instagram.
Эту дрожь нельзя остановить.
 Повесть о болезни Паркинсона
Повесть о болезни ПаркинсонаФеноменальный успех книги Катрин Лаборд «Дрожать», рассказывающей о том, как она живет с болезнью Паркинсона, имеет несколько объяснений. Во-первых, практически все жители Франции знают автора книги в лицо. В течение 28 лет Катрин Лаборд, которой сегодня 67, работала телеведущей прогноза погоды на первом канале французского телевидения. Вторая, не менее важная причина успеха книги, – тот факт, что во Франции число людей, страдающих болезнью Паркинсона, составляет 160 тысяч человек, и по мере роста продолжительности жизни в стране число пациентов неумолимо растет – порядка десяти тысяч новых заболеваний в год. (Кстати, достоверной статистики о числе больных в Российской Федерации найти не удалось.)
Рецензии на книгу «Дрожать» можно разделить на две категории. Это, во-первых, письма и мейлы пациентов, страдающих паркинсонизмом, но чаще всего – отклики родных и близких, ибо названная болезнь обязывает окружение больного к неустанным усилиям, связанным с уходом за больным.
В тот вечер мой милый друг приготовил на ужин роскошное блюдо из даров моря, и я с интересом наблюдала за тем, как тщательно он их чистит, поливает оливковым маслом и даже, как мне показалось, нежно поглаживает. «Готово! – воскликнул он. – Добро пожаловать к столу».
В момент, когда каждый из нас усаживался на свой стул, он вдруг сказал мне: «Знаешь, по-моему, тебе стоит показаться врачу. У тебя почему-то дрожит правая рука». – «Разве? – ответила я. – Ах, впрочем, ты прав, но причина, скорее всего, в том, что, зажигая горелку плиты, я отдернула руку, чтобы не обжечься. Вот она и дрожит».
Но он не успокаивается: «Ты, возможно, права, а возможно – не очень. Покажись врачу. Чего тебе стоит…»
Вняв увещеваниям любимого человека, Катрин Лаборд на следующий день позвонила врачу и договорилась о приеме.
Тот день оказался судьбоносным, и Катрин до конца дней не забудет каждый жест, каждое слово врача:
Вначале он попросил меня просто походить по его кабинету, сначала вдоль, потом поперек. Затем постоять на одной ноге. Следующей просьбой была «проба пера». Врач попросил меня написать несколько фраз на листе бумаги, затем нарисовать круглые часы. Все эти упражнения показались мне скорее смешными. Впрочем, не все. Я уже несколько месяцев назад заметила, что писать от руки становится всё труднее, но решила, что дело в чрезмерной усталости на работе. Ведь у меня, к счастью, имеется компьютер, к чему, спрашивается, вся эта писанина от руки!
Затем постоять на одной ноге. Следующей просьбой была «проба пера». Врач попросил меня написать несколько фраз на листе бумаги, затем нарисовать круглые часы. Все эти упражнения показались мне скорее смешными. Впрочем, не все. Я уже несколько месяцев назад заметила, что писать от руки становится всё труднее, но решила, что дело в чрезмерной усталости на работе. Ведь у меня, к счастью, имеется компьютер, к чему, спрашивается, вся эта писанина от руки!
И вот врач подводит первые итоги обследования.
– Во время ходьбы, – замечает доктор, – ваша правая рука не участвует в движении, а исписанный вами лист бумаги больше всего напоминает поверхность, засиженную мухами. Речь, возможно, идет о болезни Паркинсона.
– Болезнь Паркинсона?.. У меня?! – кричу я.
– Да, скорее всего, речь идет о болезни Паркинсона, – спокойно отвечает врач.
– Слушайте, доктор, я знала владельца цветочного магазина, который в один прекрасный день начал есть собственные цветы, особенно красные. Это – то же самое, что Паркинсон?
Это – то же самое, что Паркинсон?
– Ах, какая глупость. Конечно, нет. Тот страдал болезнью Альцгеймера.
– Скажите, доктор, а можно в одно и то же время болеть Паркинсоном и Альцгеймером?
Катрин Лаборд– Да, бывает и такое, – отвечает врач.
– В таком случае я хочу смотреть правде в глаза и знать ВСЁ об этой болезни!
На лице врача промелькнуло некое подобие улыбки.
– Поймите, ВСЁ знать о болезни Паркинсона сегодня просто невозможно. Мы сами только-только начинаем понимать, как устроен и как действует человеческий мозг… Одно я могу вам твердо обещать. Я буду держать вас в курсе хода вашей болезни.
Многоопытный врач, к которому обратилась Катрин Лаборд, сдержал своё слово, но и она осталась при своём намерении смотреть правде в глаза, ни в коем случае не сдаваться, пока сохраняет ясность рассудка.
Книга «Дрожать», написанная Катрин Лаборд для тех, кто болен или для тех, кому суждено когда-нибудь заболеть болезнью Паркинсона, равно как и для близкого окружения пациентов, это и есть, по словам автора, её оружие против болезни. Обращаясь к товарищам по несчастью, Катрин Лаборд пишет: «Помните, вы – не одни! Нас тысячи и тысячи. Меня постигла та же участь, что и вас, и я буду бороться до конца!»
Обращаясь к товарищам по несчастью, Катрин Лаборд пишет: «Помните, вы – не одни! Нас тысячи и тысячи. Меня постигла та же участь, что и вас, и я буду бороться до конца!»
Книга «Дрожать» читается как своеобразный дневник, разделенный на небольшие главы, сочетающие воспоминания о матери, о детстве, о годах работы на телевидении, но речь прежде всего идет о дневнике болезни.
Катрин Лаборд внимательно следит за тем, как болезнь Паркинсона поражает отдельные органы. Пальцы и щиколотки, бедра, спина, глаза и ноги, но также выражение лица, голос, память. В главе «Секс» Катрин Лаборд пишет, что моменты, когда она прижимается к телу любимого человека, являются единственными, когда она почти не замечает дрожи, того самого «паралитического тремора», всегда сопровождающего болезнь Паркинсона…
Зная, что эта болезнь, равно как и болезнь Альцгеймера, относящаяся к числу так называемых «нейродегенеративных заболеваний», не смертельна, но в то же время необратима, Катрин Лаборд замечает: «Я от этой болезни не умру, но и не вылечусь» и продолжает: «Книга не поможет мне выздороветь, и я пишу ее с одной целью: создать дистанцию между болезнью и мной».
Как именно создается та самая дистанция между пациентом и его болезнью, о которой пишет Катрин Лаборд?
Вот только два примера из книги, две поездки, о которых автор мечтала давно. Первая – это Венеция. Приехав в город дожей со своим другом, Катрин Лаборд с юмором замечает: «Венеция, как известно, с каждым годом всё больше погружается в воду, и когда-нибудь, быть может, совсем утонет. Я тоже понемногу тону. Но утону я всё-таки раньше Венеции».
Цель второй поездки – замок на юго-западе Франции, в котором родился великий французский философ Мишель де Монтень. Поднимаясь на башню, в которой Монтень проводил дни и ночи за чтением древних фолиантов, Катрин Лаборд вспоминает, что философ тоже страдал от камней в почках, мучительной болезни, и именно Монтеню принадлежат слова, которые она цитирует в книге: «Не зная, где именно нас подстерегает смерть, мы должны ожидать её появления в любом месте. Размышления о ней равнозначны размышлениям о свободе, и тот, кто приучил себя к мысли о смерти, разучился раз и навсегда быть рабом».
Великий Монтень, замечает Катрин Лаборд, черпал мудрость у древних эпикурейцев, и вот её умозаключение: «Чтение Монтеня помогает сохранять душевное здоровье перед лицом болезни Паркинсона…»
Катрин Лаборд – далеко не первый автор, прибегающий к литературе для создания той самой «дистанции» между собой и болезнью.
Философ Сьюзен Сонтаг начала писать книгу «Болезнь как метафора», узнав о своем раковом заболевании. Сонтаг написала замечательное эссе, в котором она объясняет свое отношение к собственной болезни следующим образом:
Мне бы хотелось описать не то, как происходит изгнание в страну больных и какова там жизнь, но «карательные» и сентиментальные мифы, коими щедро наделено это печальное царство, – то есть описать не реальную географию, а стереотипы национального характера. Тема этого эссе не физическая болезнь как таковая, а использование болезни в качестве фигуры речи или метафоры. Я стремилась показать, что болезнь не метафора и что самый честный подход к болезни, а также наиболее «здоровый» способ болеть – это попытаться полностью отказаться от метафорического мышления. И все же вряд ли возможно поселиться в царстве больных, не отягощая себя грозно пылающими метафорами, что образуют его ландшафт. Именно прояснению этих метафор – и освобождению от них – я посвящаю эту работу.
И все же вряд ли возможно поселиться в царстве больных, не отягощая себя грозно пылающими метафорами, что образуют его ландшафт. Именно прояснению этих метафор – и освобождению от них – я посвящаю эту работу.
Внимательное прочтение эссе Сьюзен Сонтаг позволяет без труда вскрыть противоречие: с одной стороны, стремление «отказаться от метафорического мышления», а с другой – «попытка прояснения этих самых грозно пылающих метафор», вынесенных в название книги «Болезнь как метафора».
В книге Катрин Лаборд «Дрожать» нет никаких метафор, и не здесь ли время прибегнуть к тем самым «стереотипам национального характера», о которых пишет Сонтаг, ибо позицию автора книги «Дрожать» трудно понять, не вспомнив о Декарте, о духе картезианства, отвергающего «сумеречное сознание», завуалированность и приблизительность описания, то есть называющего вещи своими именами.
Катрин Лаборд, 28 лет проработавшая телеведущей прогноза погоды, является по складу души и ума художником, талантливой писательницей, и никто об этом, скорее всего, не узнал бы, не будь обрушившейся на неё тяжкой болезни.
Книга написана с юмором, а некоторые эпизоды вполне способны вызвать смех, позволяющий на минуту забыть о тяжких буднях пациента, страдающего болезнью Паркинсона.
Вот пример. Один из многих.
Мой издатель без конца повторяет. Позаботься о том, чтобы книга получилась не слишком грустной. Не пиши всё время о смерти.
– Ладно, – говорю я. – Так и быть. Я постараюсь.
Ведь в чем главная забота издателя? Главная забота издателя состоит в том, чтобы продать как можно больше экземпляров.
И даже мой милый друг вторит издателю: «Не пиши так много о смерти, ибо если будешь упрямствовать, то все читатели просто разбегутся».
Мишель Монтень. Портрет работы неизвестного художникаДа ладно, не знаю, разбегутся читатели или нет, но я остаюсь в конечном итоге при своем: CARPE DIEM, то есть «лови момент», «живи настоящим», хотя я и не до конца уверена в том, что вкладываю в это выражение его истинный смысл.
Вот ведь и Монтень тоже всё время писал о смерти, а разве Монтеня скучно читать?!
А мне на это отвечают: «Всё верно, но ты ведь не Монтень!»
Услышав это возражение, Катрин Лаборд отвечает словом, заимствованным из области фехтования, – Touché, то есть «укол (удар), нанесённый шпагой в соответствии с правилами».
Автор твердо знает, что в поединке с болезнью Паркинсона у неё нет шансов одержать победу, но она твердо решила бороться до самого конца.
Не уверен, что Катрин Лаборд знает стихи Пастернака, написанные будто специально для неё, как будто описывающие именно её случай, а заодно и тех, кто прочтет её книгу.
Другие по живому следу
Пройдут твой путь за пядью пядь,
Но пораженья от победы
Ты сам не должен отличать.
И должен ни единой долькой
Не отступаться от лица,
Но быть живым, живым и только,
Живым и только до конца.
Именно это в полной мере удается автору книги «Дрожать» Катрин Лаборд, остающейся живой – живой и только до конца.
Средства при болезни Паркинсона
Сложность лечения болезни Паркинсона в том, что ученые не удалось установить точную причину появления заболевания и получить препарат, который смог бы избавить о болезни навсегда. Средства для лечения болезни Паркинсона позволяют замедлить развитие заболевания, нормализовать работу нервной системы. И чем раньше будет обнаружено заболевание, тем проще добиться ремиссии, контроля состояния и не допустить осложнения.
И чем раньше будет обнаружено заболевание, тем проще добиться ремиссии, контроля состояния и не допустить осложнения.
Препараты при болезни Паркинсона
Болезнь Паркинсона является дегенеративным неврологическим заболеванием, при котором разрушаются нейроны, и снижается синтез дофамина — одного с основных медиаторов в нервной системе. Процессы, протекающие при заболевании необратимы.
Первыми симптомами заболевания является утрата настроения, затрудненность дефекации. Однако на начальной стадии симптомы не слишком выраженные, чтобы больной обратил на них внимание. Потом наблюдается замедленность действий, движения становятся скованными. Развитие заболевания усиливает скованность, начинается гипертонус мышц, они становятся ригидными. Наблюдается тремор конечность, интенсивность которого возрастает и как следствие со временем человек теряет возможность нормально двигаться, держать равновесие. Замедляется мышление и развивается депрессия и апатия.
Болезнь полностью вылечить невозможно, но улучшить состояние с применением некоторых групп препаратов можно:
- леводопа;
- агониста допамина;
- антагонисты глутамата;
- ингибиторы comt;
- ингибиторы мао-в.
При начальной стадии возникновения заболевания используются фармацевтические препараты, которые положительно влияют на синтез допамина, увеличивая его концентрацию. Снижения допамина и является основным проявлением болезни, потому если держать его уровень можно предотвратить быстрое развитие заболевания. Подобные лекарственные средства предотвращают распад нейромедиаторов и существенно улучшают состояние.
Одним с представителей представленной фармакологической группы препаратов является Мирапекс с действующим веществом прамипексолом. Препарат может использоваться в качестве проведения монотерапии на ранних стадиях заболевания или в проведении комплексного лечения с леводопой. Лекарство улучшает координацию действий, снижает тремор нижних конечностей, что позволяет пациентам нормально двигаться.
Лекарство улучшает координацию действий, снижает тремор нижних конечностей, что позволяет пациентам нормально двигаться.
К допаминергическим средствам для лечения болезни Паркинсона принадлежит Неомидантан с действующим веществом амантадином. Препарат успешно блокирует глутаматные рецепторы, притом чувствительность дофаминовых рецепторов увеличивается и количество медиатора значительно увеличивается. Таким образом, интенсивность проявления заболевания снижается, улучшается умственная деятельность и возможность контролировать движения. Вещество доступно и под другим названием Амантин.
Средства дополнительной опоры для нормализации состояния содержат в своем составе убихинон. К таким фармацевтическим препаратам относится Коэнзим Q10. Убихинон является частью важных процессов в организме: синтеза АТФ, доставки кислорода в клетки, выработке энергии, замедлению процессов старения. На выработку вещества влияет недостаток витаминов и возраст. Каждые 20 лет способность продуцировать убихинон падает, в таком случае без синтетических его аналогов не обойтись, потому они являются частью комплексной терапии состояния.
При прогрессировании заболевания используются препараты на основе леводопы. Они являются единственным возможным вариантом лечения для пациентов после 70 лет.
Леводопа является предшественником дофамина и ее распад в периферических тканях позволяет увеличить концентрацию элемента в организме и тем самым снизить интенсивность проявления ригидности, а также брадикинезии. Однако препарат характеризуется большим спектром побочных реакций: непроизвольные движения, психические расстройства.
К препаратам с леводопой принадлежит Левоком, который принимается вместе с витаминами группы В по половине таблетки 1-2 раза в день.
Комбинированное средство с леводопой обладает лучшими характеристиками и эффективностью. К таким средствам относится Карбидопа и Леводопа-Тева, Наком, Мадопар. Одновременное использование леводопы и ингибитора ее распада позволяет увеличить терапевтический эффект, а также снизить риск побочных реакций. Дозировка составляет половину таблетки несколько раз в день в зависимости от интенсивности симптомов заболевания.
Дозировка составляет половину таблетки несколько раз в день в зависимости от интенсивности симптомов заболевания.
Для проведения монотерапии или комплексного лечения болезни Паркинсона используется препарат Бромкриптин, который является ингибитором пролактина. Для устранения симптомов заболевания допустимо использование миорелаксанта Мидокалм.
Лекарства при болезни Паркинсона цена в аптеке:
Вылечить болезнь Паркинсона у макак
Болезнь Паркинсона занимает твёрдое второе место среди нейродегенеративных заболеваний. Во время неё в чёрной субстанции мозга гибнут дофаминергические нейроны. Пока что единственный более-менее эффективный метод – даже не лечения, а ослабления симптомов – это глубокая стимуляция мозга (DBS). Правда, как этот метод работает, неврологи до конца не понимают. Однако в последнее время всё больше групп работает над методами трансплантации в мозг собственных нейронов человека – вместо погибших. Их получают перепрограммированием клеток кожи в индуцированные стволовые плюрипотентные клетки, а затем последние превращают в нейроны. Однако всегда есть вероятность образования из таких клеток опухолей. Именно поэтому клинические испытания на людях пока не начинались.
Однако в последнее время всё больше групп работает над методами трансплантации в мозг собственных нейронов человека – вместо погибших. Их получают перепрограммированием клеток кожи в индуцированные стволовые плюрипотентные клетки, а затем последние превращают в нейроны. Однако всегда есть вероятность образования из таких клеток опухолей. Именно поэтому клинические испытания на людях пока не начинались.
Яванский макак (Macaca fascicularis)
Muhammad Mahdi Karim / Wikimedia Commons
В новом выпуске Nature авторы впервые представили результаты долгосрочных испытаний такого метода на приматах. Авторы из
японского Университета Киото и шведского Университета Лунда получили 11
линий клеток-предшественников дофаминергических нейронов,
перепрограммировав клетки от восьми здоровых людей и троих пациентов
с болезнью Паркинсона, а затем имплантировали их в мозг 11
яванских макак (Macaca fascicularis) с моделью
заболевания. В этой модели в мозг макак вводили нейротоксин МТФП
(1-метил-4-фенил-1,2,3,6-тетрагидропиридин), который разрушает
дофаминергические нейроны чёрной субстанции и вызывает симптомы болезни
Паркинсона.
Авторы из
японского Университета Киото и шведского Университета Лунда получили 11
линий клеток-предшественников дофаминергических нейронов,
перепрограммировав клетки от восьми здоровых людей и троих пациентов
с болезнью Паркинсона, а затем имплантировали их в мозг 11
яванских макак (Macaca fascicularis) с моделью
заболевания. В этой модели в мозг макак вводили нейротоксин МТФП
(1-метил-4-фенил-1,2,3,6-тетрагидропиридин), который разрушает
дофаминергические нейроны чёрной субстанции и вызывает симптомы болезни
Паркинсона.Формула МТФП
Как выяснилось, клетки-предшественники прекрасно прижились и образовали новые нейроны, которые начали функционировать, создав новую дендритную сеть.Авторы статьи отмечают два важных
результата своих экспериментов. Во-первых, трансплантация человеческих
дофаминергических нейронов улучшила симптомы болезни на
40-55% и улучшение продолжалось 21 месяц, а во-вторых – минимум на
протяжении 24 месяцев ни на ПЭТ (позитронно-эмиссионная томография), ни на МРТ не обнаруживались какие-либо
новообразования.
Долгосрочные изменения в мозге макак
T. Kikuchi et al. / Nature, 2017
Подобное доклиническое испытание нового метода может стать последним шагом перед испытанием трансплатации собственных «выращенных» дофаминергических нейронов людям, страдающим болезнью Паркинсона.Алексей Паевский
Оригинал текста на сайте Нейроновости
Болезнь Паркинсона: Лечение (Самые Эффективные Методы)
Прежде чем вы начнёте читать статью, я отвечу на самый популярный вопрос — как вылечить болезнь Паркинсона навсегда, и существует ли такое лечение, которое помогает забыть о болезни.
На сегодняшний день наука далеко продвинулась в изучении болезни Паркинсона, существует целый арсенал средств, которые помогают при заболевании. Однако, до сих пор не известно о хотя бы одном случае, когда пациент полностью излечился от болезни Паркинсона.
Однако, до сих пор не известно о хотя бы одном случае, когда пациент полностью излечился от болезни Паркинсона.
Заболевание официально признано неизлечимым, и все применяемые методы в лечении нацелены на то, чтобы сдержать прогрессирование и облегчить симптомы паркинсоновой болезни.
Болезнь Паркинсона поражает разных людей. В основном, это люди старшего возраста, от шестидесяти лет и старше. В последнее время «Паркинсон» сильно помолодел и проявляется моторными признаками в возрасте до сорока лет. Болезнь не выбирает и поражает представителей разных профессий и социальных групп.
Среди тех, кого поразила болезнь Паркинсона, немало известных имён.
▪️Американский комедийный актёр Робин Маклорин Уильямс умер от тяжёлой депрессии, хотя страдал заболеванием на ранней стадии.
▪️У отечественного актёра Михаил Ульянова болезнь Паркинсона была диагностирована в слабой, но быстропрогрессирующей стадии. После постановки диагноза Ульянов прожил около десяти лет.
▪️Советский поэт Андрей Вознесенский умер от осложнения болезни после пятнадцати лет после того, как ему поставили диагноз.
▪️В последние годы жизни болезнью Паркинсона страдал основоположник национал-социализма Адольф Гитлер.
▪️Самым известным пациентом с болезнью Паркинсона можно назвать американского боксёра Мохаммеда Али. Спортсмен, многократный чемпион вынужденно завершил карьеру, но прожил с болезнью более трёх десятков лет.
Мохаммед Али: последние минуты жизни
Краткое содержание:
Лечится ли болезнь Паркинсона?
Болезнь Паркинсона — это прогрессирующее заболевание. Современная медицина даёт возможность замедлить прогрессирование заболевания, действуя по нескольким направлениям:
1. Лечебная физическая активность, гимнастика, эфирные масла для облегчения болезни Паркинсона.
2. Магнитная стимуляция.
3. Медикаментозная терапия.
4. Хирургические методы.
После постановки диагноза и наблюдения, как протекает паркинсоновая болезнь, лечение и решение о выборе методов в каждом конкретном случае принимает врач на основании наблюдения за больным.
Как лечить болезнь Паркинсона?
Разберём детали про Паркинсона болезнь, методы лечения, препараты и прогноз продолжительности жизни.
✔️ Транскраниальная магнитная стимуляция
Транскраниальная магнитная стимуляция применяется сравнительно недавно. Впервые этот метод лечения болезни Паркинсона применили во Франции. Позднее канадские врачи подтвердили эффективность использования переменного магнитного поля при болезни Паркинсона: у пациентов улучшались устойчивость, походка, мелкая моторика. В США магнитная стимуляция входит в протокол лечения паркинсонизма для облегчения сопутствующих болезни психологических расстройств — психозов и депрессий.
✔️ Медикаментозная терапия
Медикаментозную терапию в соответствии со стандартами подбирает врач, после постановки диагноза.
▪️При лечении болезни Паркинсона используются холинолитики, которые регулируют воздействие передачи импульсов от нервных клеток. Применение холиноблокаторов — ответственный этап лечения, он требует максимально точной дозировки и способен вызвать зависимость.
▪️Циклодол — синтетический холинолитик и самое старое средство для лечения паркинсонизма. Основное действие препарата — уменьшить проявления болезни — тремор, слюнотечение, потоотделение. В меньшей степени Циклодол оказывает влияние на замедленную речь и зажатость движений.
В лечебных целях данной патологии Циклодол в СССР начали применять в середине прошлого века для уменьшения прогрессирования болезни Паркинсона. Схема, как лечить тяжёлый недуг с помощью токсичного препарата, показала эффективность нового лекарства. Обратной стороной использования Циклодола стало его распространение в лагерях и тюрьмах. Препарат использовали как психостимулирующее средство вместе с «чифиром» и алкоголем. Врачи-наркологи и психиатры предупреждают о крайне высоком уровне опасности, включая «снижение умственного уровня», при бесконтрольном и вневрачебном применении Циклодола. Зависимость от препарата в современной России признана токсикоманией. Циклодол не входит в официальный список наркотических средств.
▪️При заболевании Паркинсона в мозге снижена выработка дофамина, поэтому при лечении применяют препараты, которые повышают содержание дофамина в головном мозге. В качестве лечения синдрома паркинсонизма назначают препараты группы агонистов дофаминовых рецепторов. Их действие вызывает биологический отклик, имитируя действие дофамина.
▪️Леводопа — противопаркинсонический лекарственный препарат, который при попадании в печень превращается в дофамин. Леводопа эффективно действует при треморе, ригидности, затруднении глотания, слюнотечении. Препарат Леводопа в основном, назначают пациентам с 60-70 лет, так как его эффективность при длительном лечении снижается. До этого возраста пациентам стараются назначать другие медицинские препараты.
▪️При лечении болезни Паркинсона медикаментами применяют ингибиторы, замедляющие гибель нервных клеток и прогрессирование болезни, противоэпилептические препараты, миорелаксанты и препараты от деменции.
В комбинированной терапии с Леводопа при лечении болезни Паркинсона применяют:
- Церебролизин, обладающий нейротрофируюшим действием, снижающий депрессивный синдром и улучшающий когнитивные функции.

- Мирапекс — для уменьшения тремора и нормализации ходьбы.
- Атропин — уменьшает напряжение в мышцах.
- Глицин — уменьшает токсичность лекарств, улучшает общее состояние.
- И другие лекарства.
На фоне выраженного дефицита больному назначают витамины железа. При болезни Паркинсона необходимо контролировать уровень витамина D: при его низком уровне заболевание прогрессирует быстрее. Для нервных тканей назначают витамин B.
Можно ли вылечить болезнь Паркинсона при помощи медикаментов? Медикаментозная терапия не избавляет от болезни. Правильно назначенная терапия лекарствами при болезни Паркинсона призвана обеспечить выраженное клиническое улучшение состояние пациента, способна продлить и улучшить качество жизни.
Выбор стандарта, если назначено лечение Паркинсона медикаментозное, определяет исключительно врач.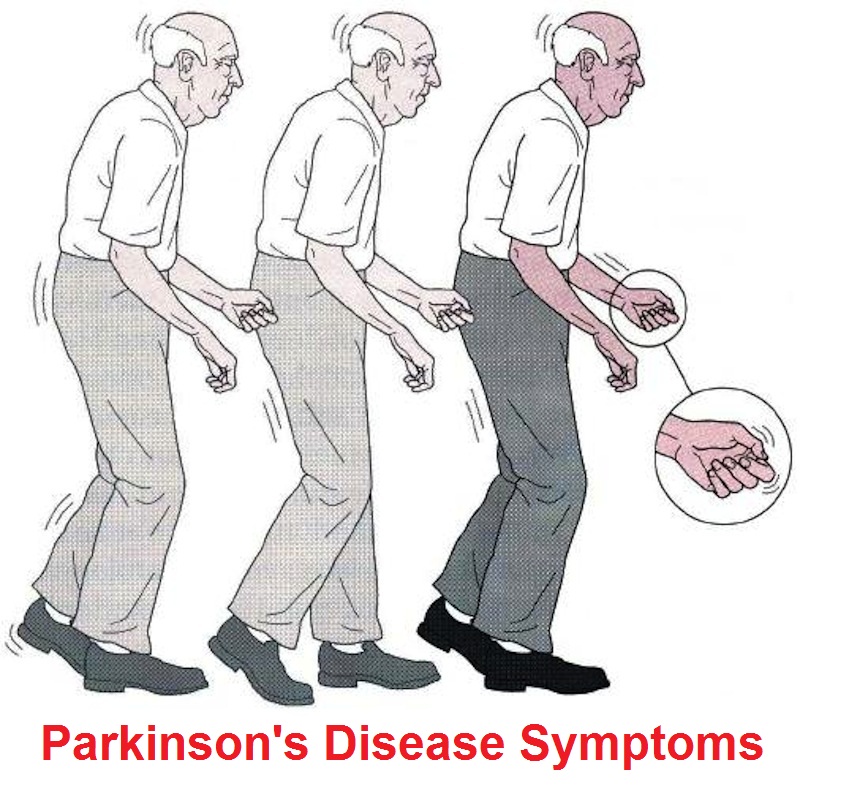 На подбор препаратов при болезни влияет:
На подбор препаратов при болезни влияет:
- Возраст пациента.
- Стадия заболевания.
- Сопутствующие болезни.
- Изучение истории предыдущих лечений на предмет выяснения побочных эффектов.
Известен ещё один способ, как бороться с болезнью Паркинсона. В ряде штатов США практикуется опыт лечения болезни Паркинсона марихуаной. Такой метод применяется крайне избирательно, и при строгом контроле врача-невропатолога.
✔️ Оперативные методы
Хирургические (оперативные) методы лечения болезни Паркинсона проводят пациентам в относительно молодом возрасте.
Таламотомия является серьёзной операцией — речь идёт о разрушении больного участка мозга. Таламотомия назначается, когда болезнь Паркинсона проявляется выраженный тремором, и лечение по консервативному типу не приносит результатов. Однако, при талатомии высок риск развития осложнений — угнетение воли, расстройство речи, двигательных процессов.
Паллидотомия как оперативный метод лечения Паркинсона, назначается, когда среди симптомов болезни преобладают двигательные расстройства, и консервативный метод лечения не даёт эффективности. При паллидотомии электрический зонд вводится в одно из ядер передней части структур головного мозга, нагревается в течение 1 минуты до 80 градусов по Цельсию. Как результат — участок клеток мозга разрушается.
При паллидотомии электрический зонд вводится в одно из ядер передней части структур головного мозга, нагревается в течение 1 минуты до 80 градусов по Цельсию. Как результат — участок клеток мозга разрушается.
На фото: хирурги провели правостороннюю стереотаксическую МРТ-управляемую паллидотомию. Операция была проведена в Джайнском госпитале имени Бхагвана Махавира в индийском городе Бангалор, столице Южного штата Карнатака.
Паллидотомия признана относительно безопасным методом. Потенциальным риском можно считать возможность повреждения других участков мозга. Среди осложнений, которые возникают на фоне паллидотомии, выделяют повреждение функции лицевого нерва, депрессию, проблемы с памятью, со зрением, с голосом, послеоперационный психоз. Серьёзным осложнением может стать инсульт, который вызывает кровотечение в головном мозге.
Нейростимуляция. Когда при корректной медикаментозной терапии болезни Паркинсона не удаётся добиться значимого уменьшения её проявлений, пациенту рекомендуют нейростимуляцию. Нейростимуляция — малоинвазивная нейрохирургическая операция.
Нейростимуляция — малоинвазивная нейрохирургическая операция.
Глубокая стимуляция мозга при лечении болезни Паркинсона является эффективным способом стимулирования определённой области головного мозга. При нейростимуляции пациенту в головной мозг вводят (вживляют) тонкие электроды и тестируют их лечебный эффект. Место, куда вводят электроды (размером меньше кукурузного зерна), точно выверяют по томографическим данным. Затем пациенту под ключицу устанавливают имплантант-нейростимулятор, который связывают с электродами.
Нейростимуляция обычно хорошо переносится больными. Такой способ является обратимым, он позволяет контролировать изменение активности мозга. Каждый пациент после операции проходит соответствующее обучение и самостоятельно, при помощи электродов, корректирует проявления болезни Паркинсона в зависимости от своего состояния.
Нейростимуляция назначается при прогрессировании заболевания, при угрозе дееспособности пациента и при отсутствии видимого улучшения состояния больного при других способах лечения.
Минусами нейростимуляции являются — необходимость повторной операции при сдвиге или поломке электродов и каждые 3-7 лет обязательная замена генератора. Объективным недостатком нейростимуляции остаётся её высокая стоимость.
Врач-невролог из калифорнийского университета Джилл Острем говорит, что учёные до сих пор точно не знают, как «такое грубое вмешательство, такой взрыв мозга, так хорошо помогает». Глубокую стимуляцию мозга (DBS) ежегодно проходит около 10000 человек в мире. Около 140000 человек в мире, страдающие болезнью Паркинсона, живут с электродами, через которые управляют своим состоянием.
Лечение болезни Паркинсона с помощью дифференцированных в головной мозг стволовых клеток изучено недостаточно. Пока нельзя сказать о том, излечима ли болезнь Паркинсона при помощи стволовых клеток. Однако, результаты первых испытаний, заявленные в 2009 году, говорят о положительном эффекте у 80 процентов пациентов. В США в единичных случаях используют новый метод лечения болезни Паркинсона — это перепрограммирование и пересадка больному его собственных клеток кожи.
Первым пациентом с болезнью Паркинсона, которому была проведена терапия собственными стволовыми клетками в 2017 году, стал бывший врач Дж.Лопез, который является спонсором данных исследований. По официальной информации состояние больного после проведённого лечения улучшилось, повысилось качество жизни.
Джордж Лопес
Французские учёные в научно-популярном формате поделились информацией о старте тестирования нового метода лечения болезни Паркинсона с помощью инфракрасного света. Цель экспериментов — найти «безболезненное» решение нейродегенеративной болезни Паркинсона. Лечение пациентов, страдающих средней степенью болезни Паркинсона, с помощью инфракрасного света должно продлиться четыре года.
До этого лечение болезни Паркинсона протестировали на макаках. В результате тестирования у половины подопытных животных наблюдали уменьшение проявлений нейродегенеративных симптомов, представители второй половины тестируемых макак после лечения передвигались так, словно до этого вообще не было никаких симптомов болезни.
Ещё одним нетрадиционным методом дополнительной программы по реабилитации страдающих от болезни Паркинсона, стала музыкальная терапия.
Американская ассоциация по болезни Паркинсона упоминает, что ритм и музыка помогают облегчить некоторые проявления заболевания. Кроме движений, у пациентов с болезнью Паркинсона бывают проблемы с артикуляцией, их речь становится невнятной.
Это связано с трудностями движения рта и языка. Пациентам рекомендуют петь и растягивать одиночные слоги, способствуя поддержке дыхания. Параллельно пациенты отстукивают ритм, это помогает координации и чёткости речи.
Как облегчить состояние при болезни Паркинсона?
Методы лечения и уменьшения прогрессирования заболевания развивались параллельно с изучением болезни Паркинсона.
Разные виды традиционной медицинской терапии доказали свою эффективность в контроле пациентов, страдающих болезнью Паркинсона, лечение в домашних условиях дополняет основную схему терапии.
Медицинские отчёты прошлого описывают положительное действие лекарственной формы многолетнего растения белладонны (красавки обыкновенной) при заболевании.
Беладонна
Французский невролог Ж. Шарко отмечал положительное действие белладонны при уменьшении тремора и саливации — слюноотделения, контролируемого вегетативной нервной системой.
Дополнительной терапией является лечение Паркинсона народными средствами, самые эффективные масла и травы в каждом случае будут свои. Природные компоненты способны уменьшить напряжение в мышцах, улучшить сон, аппетит и снизить выраженность тремора.
🌿 Лучшие эфирные масла при болезни Паркинсона
🌿 Смеси эфирных масел, помогающие при болезни Паркинсона
Альтернативная медицина рассказывает, как лечить Паркинсон в домашних условиях с помощью пчёл. Суть метода состоит в непосредственном «ужаливании» пчёлами и в использовании мазей и кремов на основе пчелиного яда и других продуктов пчелопроизводства (настойки с прополисом на спирту, маточное молочко и др).
Лечение пчёлами применяют для уменьшения мышечных спазмов: пчела жалит напряжённую мышцу через активные точки, что усиливает приток крови и биологически активных веществ к поражённому участку.
Осторожно
Известны нетрадиционные методы лечения заболевания с помощью ядовитого гриба-мухомора. Но все методы и способы пока неполного выздоровления и не отвечают на вопрос, как вылечить болезнь Паркинсона навсегда.
Прогноз болезни Паркинсона: продолжительность жизни
Какие перспективы у больных, которым поставили диагноз болезнь Паркинсона, сколько с ней живут — рассмотрим этот важный вопрос.
Медицинские справочники называют прогноз неблагоприятным. Заболевание Паркинсона меняет привычный жизненный уклад, но не является «смертельным приговором». Многое зависит от того, в каком возрасте поставлен диагноз.
Если у человека диагностирована болезнь Паркинсона, прогноз продолжительности жизни и её качество зависит во многом от самого больного. На продолжительность жизни при заболевании Паркинсона и механизм её развития могут влиять возраст больного, его наследственность и наличие тяжёлых сопутствующих заболеваний.
Чем раньше поставлен диагноз и назначена корректирующая терапия данной патологии, тем дольше проживёт больной с Паркинсоном.
► Если диагноз поставлен в возрасте больного до 60 лет, то, возможно, что пациент будет жить ещё пятнадцать лет. Если диагноз поставлен у более пожилого человека, то и прогнозируемая продолжительность жизни будет меньшей: около пяти лет живут пациенты, в этом возрасте ресурсы организма исчерпываются, параллельно проявляются тяжёлые сопутствующие болезни.
► Бывают случаи, когда с болезнью Паркинсона человек сталкивается в очень молодом возрасте. В молодом возрасте прогрессирование болезни проходит значительно медленнее, поддерживающая терапия воспринимается молодыми людьми хорошо, и прогноз для них оптимистичный — ещё три-четыре десятилетия больные смогут сохранять активность и оставаться способными к самообслуживанию.
Главное в вопросе, как лечить болезнь Паркинсона у пожилых людей, остаётся понимание близких, что заболевание будет быстро прогрессировать, физиологические и психические симптомы усилятся и больные, скорее всего, будут нуждаться в постоянной помощи со стороны.
При болезни Паркинсона врач-невролог работает в тесном контакте со специалистами, корректирующими психологическое состояние больного. Психологи советуют подойти к ситуации, когда поставлен диагноз болезнь Паркинсона, рационально, максимально сохранив качество жизни и смягчив последствия заболевания.
✔️ Следует отказаться от вредных привычек и пересмотреть образ жизни. Помните, что алкоголь и никотин негативно влияют на сосуды и ускоряют гибель клеток.
✔️ Начните больше двигаться и заниматься гимнастикой, в идеале — на свежем воздухе.
✔️ Обязательно найдите хорошего врача, принимайте медикаменты, которые вам назначат.
✔️ Не допускайте осложнения хронических заболеваний, укрепляйте иммунитет. Придерживайтесь прописанной доктором диеты, иногда при болезни Паркинсона следует ограничить потребление белковой пищи.
Японские учёные выяснили, что развитие симптомов болезни (тремор, неустойчивость, мышечная ригидность) способны замедлить занятия настольным теннисом.
Пинг-понг улучшает координацию, обостряет рефлексы и стимулирует работу мозга. По мнению японских учёных, занятия настольным теннисом — недорогой метод терапии, который может уменьшить некоторые симптомы и улучшить прогноз болезни Паркинсона.
Поиск лекарства от болезни Паркинсона ведётся учёными всего мира. Каждый год создаются новые препараты и внедряются современные методы лечения и корректировки для облегчения состояния и улучшения качества жизни больных. Как видите, современные методы лечения болезни Паркинсона отличаются разнообразием. Возможно, нам удастся стать свидетелями появления эффективного и безопасного лекарства от тяжёлого недуга.
Не занимайтесь самолечением, статья носит информационный характер. Подобрать правильное лечение может только врач.
Врач-психоневролог РНПЦ неврологии и нейрохирургии г. Минск.
Практикующий психоневролог, специализируюсь на диагностике и лечении стрессовых состояний, неврозов и психосоматических расстройств. Увлекаюсь йогой и люблю читать.
Похожие статьи:
Рецензия на фильм «Любовь и другие лекарства»
В середине 90-х молодой и чертовски обаятельный Джейми Рэнделл (Джейк Джилленхол) решает заняться распространением лекарств, и незамедлительно пускает в дело компании Pfizer свое умение обвораживать женщин, прокладывая свой путь к успеху через постель девушек из регистратуры. Но однажды Джейми знакомится со своенравной художницей Мэгги, болеющей Паркинсоном (Энн Хэтэуэй). Благодаря которой он пересматривает свое отношение к жизни, обретает чувство ответственности и становится врачом. Да, и, кстати, все это комедия.
Фильм по мотивам автобиографии Джейми Рейди «Как я продавал Виагру» мог бы, по большому счету, стать чем угодно: байопиком, разоблачающим фарминдустрию, интеллигентной драмой о любви карьериста к девушке с синдромом Паркинсона и даже убойной молодежной комедией. И решив в конечном итоге делать ромком (получившийся, в целом, довольно симпатичным), режиссер Эдвард Цвик так и не сумел до конца забыть о прочих опциях. Однако все шпильки в адрес американской системы здравоохранения, где фармацевтические компании напоминают секты, а клятва Гиппократа трактуется чересчур вольно, совершенно разбиваются о крупные планы женской груди, представляющей, как ни крути, куда более интересный объект для исследования.
Однако все шпильки в адрес американской системы здравоохранения, где фармацевтические компании напоминают секты, а клятва Гиппократа трактуется чересчур вольно, совершенно разбиваются о крупные планы женской груди, представляющей, как ни крути, куда более интересный объект для исследования.
В книге Рейди нет любовной линии.
Готовясь к съемкам Энн Хэтэуэй ходила в группы поддержки для людей, страдающих болезнью Паркинсона, и консультировалась у невропатологов.
Хэтэуэй и Джилленхол играли супругов в фильме «Горбатая гора», за которую последний получил номинацию на «Оскар».
Хэтэуэй номинировали на «Оскар» за роль в фильме «Рэйчел выходит замуж».
И сколько ни старается Эдвард Цвик подружить ромком с проблемами фармацевтики, союз этот выходит довольно странным: дежурный хеппи-энд все ж таки совсем не сочетается с неизлечимой болезнью Паркинсона, а прикроватный юмор – с гуманистической заботой о нуждах больных и страждущих. Благо, совсем уж расползтись на части ленте не позволяет отличная сыгранность дуэта Хэтэуэй-Джилленхол, где первая покоряет вкрадчивым взглядом оленьих глаз, а второй парирует соблазнительной улыбкой. Да и в целом, приличных сцен в фильме так мало, а шуток про Виагру так много, что приходится признать: «любовь» здесь все-таки на первом месте, а «другие лекарства» – так, для бодрости.
Да и в целом, приличных сцен в фильме так мало, а шуток про Виагру так много, что приходится признать: «любовь» здесь все-таки на первом месте, а «другие лекарства» – так, для бодрости.
Сегодня международный день борьбы с болезнью Паркинсона
Искусство и жизнь Сальвадора Дали по праву позволили занять ему место в сонме Великих мастеров живописи, навсегда сделав бессмертным его имя. Воскресные мессы Иоанна Павла II собирали на площади перед Собором Святого Петра и экранов телевизоров по всему миру миллионы страждущих, неся мир и покой в сердца верующих. А кто из нас не смеялся вместе с признанным мастером комедии Робином Уильямсом, воплотившим на экране множество запоминающихся и оригинальных образов. Ну, и конечно, великий Михаил Ульянов, создавший самое убедительное киновоплощение одного из величайших национальных героев России.
Всех этих людей объединяет не только признание их трудов благодарными потомками, но общий недуг – болезнь Паркинсона.
Заболевание, известное сейчас каждому. Кто-то слышал о нем, кто-то сталкивался с людьми, страдающими этой коварной болезнью, а кто-то болен ею сам.
11 апреля по всему миру отмечается день борьбы с болезнью Паркинсона. К сожалению, сегодня медицина не может излечить заболевание, которое крадет у людей бесценное время общения с близкими и родными. Однако существующие методы консервативного и оперативного лечения, позволяют значительно улучшить качество жизни больных
и замедлить прогрессирование болезни.
За прошлый год в России около 12,5 тыс. человек, страдающих Паркинсоном, обратились за стационарной медицинской помощью. По прогнозам экспертов из разных стран ситуация с распространенностью заболевания может ухудшиться по всему миру.
Когда-то научное сообщество не придало большого значения труду английского исследователя Джеймса Паркинсона, написавшего «Эссе о дрожательном параличе» — труд, не оцененный при жизни автора. И только открыватель болезни невролог Жан Шарко присвоил ей имя Паркинсона, воздавая должное выдающемуся британцу.
И только открыватель болезни невролог Жан Шарко присвоил ей имя Паркинсона, воздавая должное выдающемуся британцу.
Распознавание болезни на ранней стадии позволяет во время начать терапию и купировать развитие тяжелых форм заболевания.
Следите внимательно за здоровьем ваших родных и близких, сохраняя драгоценное время вашего общения.
Когда будет лекарство от болезни Паркинсона?
Что мы знаем на данный момент
- Мы обнаружили ключи к разгадке причин и генетической причастности к болезни Паркинсона.
- Мы выясняем цепочку событий, которая приводит к повреждению и потере клеток мозга.
- Мы работаем над продвижением новых методов лечения и терапии.
- Мы изучаем новые лекарства, которые помогут справиться с некоторыми из наиболее тревожных симптомов, таких как галлюцинации и падения.
- И мы знаем, что, хотя у людей с болезнью Паркинсона общие симптомы, каждый человек воспринимает это состояние и реакцию на лечение по-разному.

Теперь наука готова к разработке новых методов лечения и лечения, в которых так отчаянно нуждаются люди с болезнью Паркинсона.
Исследования требуют времени. Но мы запустили виртуальную биотехнологию Паркинсона, чтобы ускорить наиболее многообещающие потенциальные методы лечения. Чем больше мы сможем инвестировать, тем быстрее добьемся цели.
Как будет выглядеть лекарство от болезни Паркинсона?
Поскольку болезнь Паркинсона сильно различается от человека к человеку, не может быть единого «лекарства».
Вместо этого нам может понадобиться ряд различных методов лечения, чтобы удовлетворить потребности человека и его конкретную форму состояния.
Этот набор может включать лечение, терапию и стратегии, которые могут:
- замедлить или остановить прогрессирование состояния
- заменить или восстановить потерянные или поврежденные клетки мозга
- контролировать и управлять определенными симптомами
- диагностировать болезнь Паркинсона как можно раньше сцена.

И это может включать в себя лечение, такое как лекарства и хирургические вмешательства, а также изменение образа жизни, например диету и упражнения.
Какие новые методы лечения разрабатываются?
Благодаря уже достигнутому нами прогрессу в клинических испытаниях проходят испытания новые препараты, которые могут замедлить, остановить или даже обратить вспять болезнь Паркинсона.
К ним относятся:
- терапии стволовыми клетками, которые нацелены на использование здоровых живых клеток для замены или восстановления повреждений в мозгу людей с помощью методов лечения генов Паркинсона
- , которые используют возможности генетики для перепрограммирования клеток и изменения их
- факторов роста (например, GDNF), которые представляют собой естественные молекулы, которые поддерживают рост, развитие и выживание клеток мозга.
И мы разрабатываем методы лечения, направленные на улучшение жизни с этим заболеванием, включая новые лекарства, которые могут уменьшить дискинезию.
Как мы ускоряем поиск лекарства
Мы считаем, что новые и лучшие методы лечения станут возможны через годы, а не десятилетия, и у нас есть четкая стратегия, чтобы это произошло. Это включает:
Мы знаем, что чем больше мы можем инвестировать, тем быстрее мы сможем выполнить поставку. Поэтому мы прилагаем все усилия, чтобы собрать средства, необходимые для более быстрого продвижения вперед.
Передовые и будущие методы лечения болезни Паркинсона
Хотя лекарства от болезни Паркинсона не существует, недавние исследования привели к усовершенствованию методов лечения.
Ученые и врачи работают вместе, чтобы найти метод лечения или профилактики. Исследования также направлены на то, чтобы понять, у кого больше вероятность развития болезни. Кроме того, ученые изучают генетические факторы и факторы окружающей среды, повышающие вероятность постановки диагноза.
Вот новейшие методы лечения этого прогрессирующего неврологического расстройства.
В 2002 году FDA одобрило глубокую стимуляцию мозга (DBS) в качестве лечения болезни Паркинсона. Но достижения в области DBS были ограничены, потому что только одна компания была одобрена для производства устройства, используемого для лечения.
В июне 2015 года FDA одобрило систему нейростимуляции Brio. Это имплантируемое устройство помогло уменьшить симптомы, генерируя небольшие электрические импульсы по всему телу.
Исследователи еще не нашли надежного способа вылечить болезнь Паркинсона, замедлить ее прогрессирование или обратить вспять вызываемое ею повреждение мозга. Генная терапия обладает потенциалом для всех трех. Несколько исследований показали, что генная терапия может быть безопасным и эффективным средством лечения болезни Паркинсона.
Помимо генной терапии, исследователи также разрабатывают нейропротекторные методы лечения.Этот вид терапии может помочь остановить прогрессирование заболевания и предотвратить ухудшение симптомов.
У врачей мало инструментов для оценки прогрессирования болезни Паркинсона. Постановка, хотя и полезна, позволяет отслеживать только прогрессирование двигательных симптомов, связанных с болезнью Паркинсона. Существуют и другие шкалы оценок, но они недостаточно широко используются, чтобы их можно было рекомендовать в качестве общего руководства.
Постановка, хотя и полезна, позволяет отслеживать только прогрессирование двигательных симптомов, связанных с болезнью Паркинсона. Существуют и другие шкалы оценок, но они недостаточно широко используются, чтобы их можно было рекомендовать в качестве общего руководства.
Однако многообещающая область исследований может сделать оценку болезни Паркинсона более простой и точной.Исследователи надеются обнаружить биомаркер (клетку или ген), который приведет к более эффективному лечению.
Восстановление клеток головного мозга, потерянных в результате болезни Паркинсона, является многообещающей областью лечения в будущем. Эта процедура заменяет больные и умирающие клетки мозга новыми, которые могут расти и размножаться. Но исследования по трансплантации нейронов дали неоднозначные результаты. Некоторым пациентам стало лучше после лечения, в то время как другие не заметили никаких улучшений и даже развили больше осложнений.
Пока не будет найдено лекарство от болезни Паркинсона, лекарства, методы лечения и изменения в образе жизни могут помочь людям с этим заболеванием жить лучше.
Frontiers | Новые подходы к лечению болезни Паркинсона
Введение
Болезнь Паркинсона (БП) — второе по распространенности нейродегенеративное заболевание, обычно проявляющееся характерным двигательным расстройством, состоящим из брадикинезии, ригидности, тремора покоя и постуральной нестабильности (Kalia and Lang, 2015).Возникают дополнительные немоторные проявления, включая депрессию, беспокойство, нарушения сна, запоры и снижение когнитивных функций с деменцией, которые могут значительно ухудшить качество жизни пациента (Khoo et al., 2013).
Патологически PD характеризуется наличием аномальных внутринейрональных агрегатов α-синуклеина, называемых тельцами Леви и нейритами Леви (Spillantini et al., 1997). Хотя механистическая роль телец Леви до конца не изучена, α-синуклеин явно играет центральную роль в патогенезе БП, о чем свидетельствует тот факт, что редкие мутации, дупликации или трипликации SNCA вызывают аутосомно-доминантный семейный БП (Klein and Westenberger , 2012).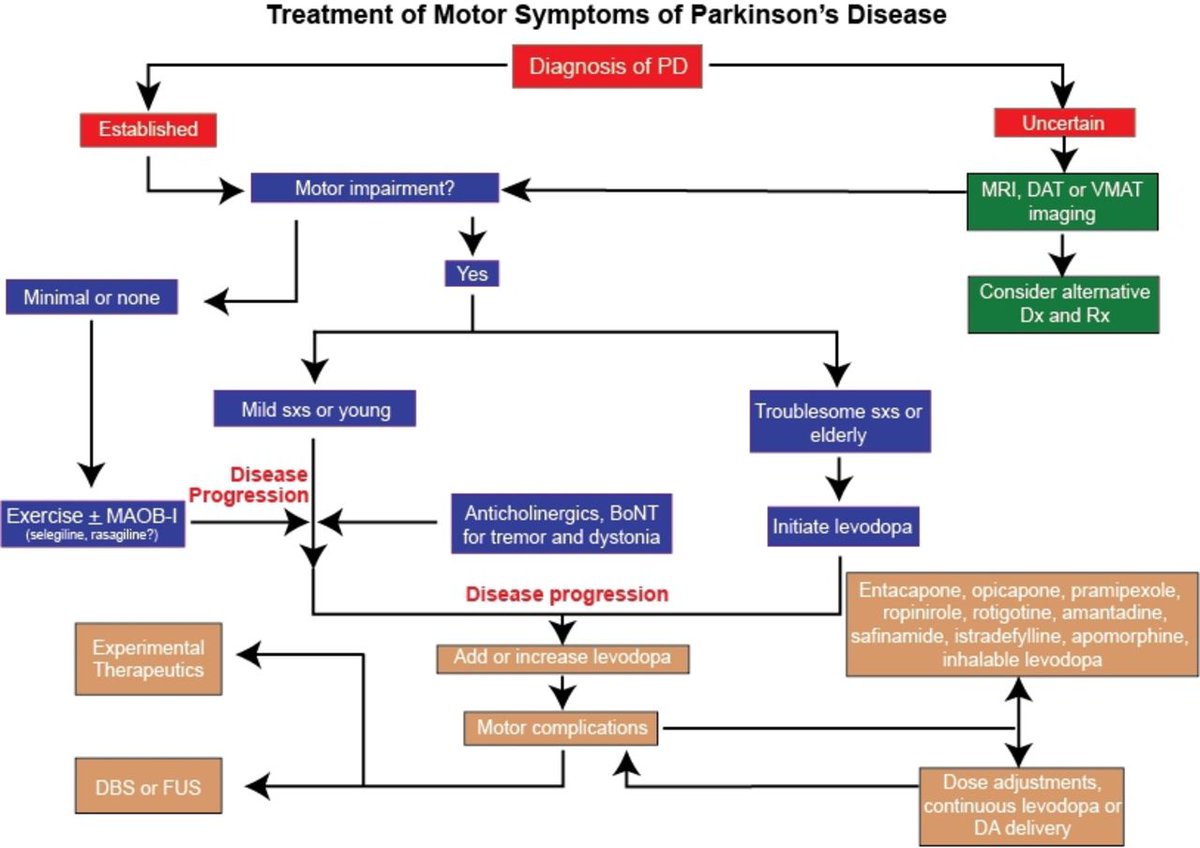 Двигательное расстройство при БП возникает частично из-за избирательной потери дофаминергических нейронов компактной части черной субстанции, что приводит к истощению дофамина в полосатом теле, в то время как немоторные проявления преимущественно возникают из-за более распространенной нейродегенерации, затрагивающей кору головного мозга и количество отделов ствола мозга (Селихова и др., 2009; Kalia, Lang, 2015). Дофаминергическая потеря также имеет более широкое влияние, в том числе на сон и когнитивные способности (Williams-Gray et al., 2009).
Двигательное расстройство при БП возникает частично из-за избирательной потери дофаминергических нейронов компактной части черной субстанции, что приводит к истощению дофамина в полосатом теле, в то время как немоторные проявления преимущественно возникают из-за более распространенной нейродегенерации, затрагивающей кору головного мозга и количество отделов ствола мозга (Селихова и др., 2009; Kalia, Lang, 2015). Дофаминергическая потеря также имеет более широкое влияние, в том числе на сон и когнитивные способности (Williams-Gray et al., 2009).
С момента появления леводопы в 1960-х годах в лечении БП было относительно мало разработок.Не существует лечения, модифицирующего заболевание, и хроническое использование леводопы приводит к значительным побочным эффектам, которые сами по себе составляют важную часть продвинутой БП (Jenner, 2003; Kalia and Lang, 2015). Однако ряд интересных подходов к лечению либо уже находится в стадии разработки, либо скоро начнется в клинических испытаниях, и картина лечения БП, вероятно, кардинально изменится в ближайшие десятилетия.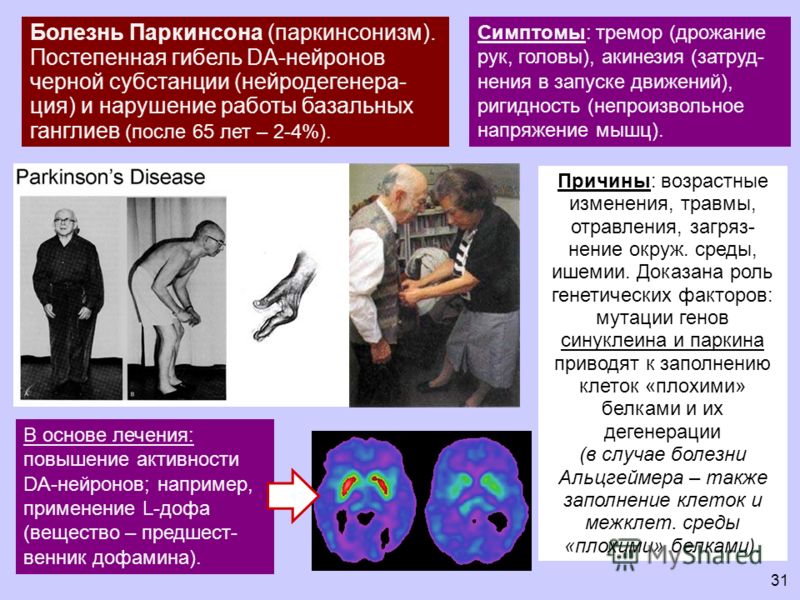 В этом обзоре мы обсуждаем новые подходы к лечению и форму, которую может принять будущее лечение БП в ближайшие несколько лет.
В этом обзоре мы обсуждаем новые подходы к лечению и форму, которую может принять будущее лечение БП в ближайшие несколько лет.
Современные методы лечения болезни Паркинсона
В настоящее время не существует лечения БП, модифицирующего болезнь, и лечение в основном состоит из дофаминергических препаратов. Чаще всего используются препараты леводопы, предшественника дофамина, который вводят в сочетании с ингибитором допа-декарбоксилазы, который ограничивает некоторые побочные эффекты, такие как тошнота. Также используются агонисты дофамина, такие как ропинирол или ротиготин. Ингибиторы моноаминоксидазы B, такие как разагилин и селегилин, и ингибиторы катехол-O-метилтрансферазы (COMT), такие как энтакапон, могут использоваться для снижения метаболизма эндогенного дофамина.Эти методы лечения могут восстановить дофаминергическую активность в полосатом теле, предвещая улучшение моторных характеристик БП. Однако они не лечат многие из немоторных функций, которые вызывают особую инвалидность у многих пациентов. Действительно, в некоторых случаях лечение может обострить некоторые немоторные симптомы, такие как постуральная гипотензия и нейропсихиатрические проблемы (Young et al., 1997; Kujawa et al., 2000).
Действительно, в некоторых случаях лечение может обострить некоторые немоторные симптомы, такие как постуральная гипотензия и нейропсихиатрические проблемы (Young et al., 1997; Kujawa et al., 2000).
Хотя эти методы лечения могут вызвать резкое улучшение моторных характеристик БП, особенно на ранних стадиях, длительное использование леводопы, в частности, приводит к значительным побочным эффектам, которые составляют важную часть клинической картины прогрессирующей БП.Считается, что нефизиологическая непрерывная доставка дофамина в полосатое тело лежит в основе проблемных дискинезий (ненормальные непроизвольные судорожные движения) (Jenner, 2003; Huot et al., 2013), а значительные колебания двигательной функции могут происходить из-за беспорядочного поглощения лекарство и переменный транзит леводопы в мозг — так называемый феномен включения-выключения (Nutt et al., 1984). Эти лекарства также приводят к нецелевым эффектам в результате их доставки в области мозга, отличные от полосатого тела, что, как полагают, является основой возможных нейропсихиатрических побочных эффектов, включая галлюцинации и нарушение контроля над импульсами (Ernst, 1969).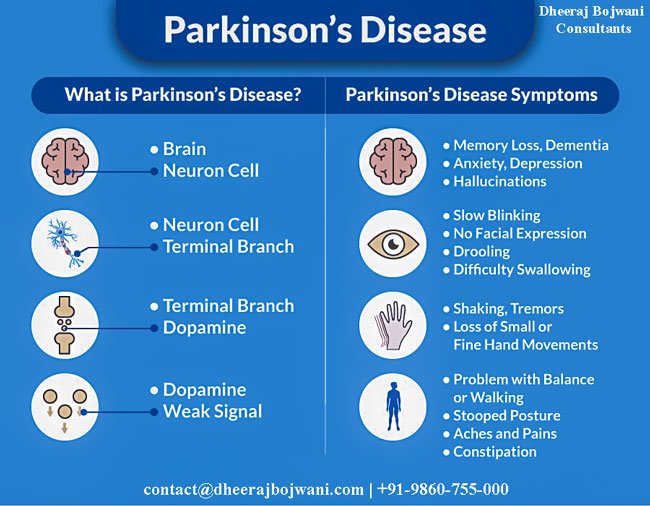 ; Voon et al., 2009).
; Voon et al., 2009).
Другие варианты лечения включают глубокую стимуляцию мозга (DBS), которая может быть очень эффективной при контроле двигательного расстройства при БП, но, как и дофаминергические препараты, она не помогает при большинстве немоторных проявлений (Kalia et al., 2013) . Хотя DBS является безопасным подходом к лечению, существуют другие потенциально проблемные побочные эффекты, включая речевую дисфункцию и психические расстройства, а также общие риски, связанные с нейрохирургической процедурой, и это лечение подходит только в меньшинстве случаев БП (Benabid, 2003). ).
Один из подходов к более физиологической доставке дофамина — это использование кишечного геля леводопа, который приводит к более предсказуемому высвобождению дофамина, чем это возможно с пероральными препаратами. Это может быть полезно для снижения моторных побочных эффектов дофаминергической терапии, но в настоящее время очень дорого для широкого использования и сопряжено с осложнениями, учитывая хирургическое вмешательство, необходимое для его установки (Olanow et al. , 2014). Кроме того, как и в случае насосов DBS и апоморфина, пациенты прикрепляются к устройству, которое необходимо носить все время, что нежелательно для многих людей.
, 2014). Кроме того, как и в случае насосов DBS и апоморфина, пациенты прикрепляются к устройству, которое необходимо носить все время, что нежелательно для многих людей.
Таким образом, даже несмотря на то, что существуют эффективные варианты лечения двигательных функций БП, они сопряжены со значительными проблемами, и ни один из них не может замедлить прогрессирование заболевания или улучшить немоторные функции, приводящие к инвалидности. На самом деле некоторые из этих немоторных свойств даже частично обусловлены этими препаратами. Следовательно, существует потребность в идентификации новых методов целенаправленного и физиологического восстановления дофамина в полосатом теле, а также в идентификации методов лечения, которые способны предотвратить продолжающуюся нейродегенерацию и прогрессирование заболевания.Несколько экспериментальных подходов в настоящее время исследуются в доклинических исследованиях и клинических испытаниях, и вполне вероятно, что в ближайшие десятилетия в лечении БП произойдут кардинальные изменения. Здесь мы обсуждаем некоторые из наиболее многообещающих перспективных подходов к лечению.
Здесь мы обсуждаем некоторые из наиболее многообещающих перспективных подходов к лечению.
Восстановление дофаминергического дефицита
Лечение многих моторных симптомов БП может быть достигнуто за счет восстановления дофаминергического тонуса полосатого тела. Это может быть достигнуто путем адресной доставки клеток, продуцирующих дофамин, или использования вирусов для доставки генов, кодирующих ферменты, необходимые для биосинтеза дофамина, в полосатое тело.Нацеливание этих регенеративных методов лечения на полосатое тело, место наибольшей потери дофамина при БП, позволит минимизировать побочные эффекты, наблюдаемые при пероральном замещении дофамина.
Подходы на основе ячеек
В настоящее время исследованы различные источники клеток для трансплантации при БП с разной степенью успеха (Таблица 1; Barker et al., 2015). Использование тканевых трансплантатов вентрального среднего мозга (ВМ) плода человека подтвердило концепцию того, что такие клеточные подходы могут быть эффективными при лечении многих критических признаков БП, но этические и логистические барьеры (в основном непредсказуемые и непредсказуемые). недостаточное снабжение фетальной тканью) означает, что этот подход никогда не будет жизнеспособным основным методом лечения этого состояния (Barker et al., 2015). Что требуется, так это возобновляемый источник клеток, продуцирующих дофамин, или их предшественников, которые обладают способностью интегрироваться в мозг хозяина, распространять аксоны на адекватные расстояния для иннервации всего полосатого тела и выживать в организме хозяина в течение многих лет. Этим критериям, скорее всего, будут соответствовать нейроны, полученные из стволовых клеток, которые теперь предлагают наиболее вероятный подход к предоставлению клинически полезной и масштабируемой клеточной терапии БП (Barker et al., 2018).
недостаточное снабжение фетальной тканью) означает, что этот подход никогда не будет жизнеспособным основным методом лечения этого состояния (Barker et al., 2015). Что требуется, так это возобновляемый источник клеток, продуцирующих дофамин, или их предшественников, которые обладают способностью интегрироваться в мозг хозяина, распространять аксоны на адекватные расстояния для иннервации всего полосатого тела и выживать в организме хозяина в течение многих лет. Этим критериям, скорее всего, будут соответствовать нейроны, полученные из стволовых клеток, которые теперь предлагают наиболее вероятный подход к предоставлению клинически полезной и масштабируемой клеточной терапии БП (Barker et al., 2018).
ТАБЛИЦА 1. Экспериментальные регенеративные подходы к лечению болезни Паркинсона.
Испытания продуцируемых эмбриональными стволовыми клетками (ESC) и индуцированных плюрипотентных стволовых клеток (iPSC) предшественников дофаминергических нейронов должны начаться в течение следующих одного или двух лет (Barker et al. , 2017). Подробная информация о дизайне этих испытаний, включая метод доставки клеток, критерии отбора пациентов, иммуносупрессию и конечные точки исследования, подробно обсуждаются в другом месте (Barker et al., 2017). Линии ESC выделены из ранней бластоцисты и были получены из избыточных человеческих эмбрионов, полученных в результате процедур оплодотворения in vitro (Thomson et al., 1998). Теперь стало возможным перепрограммировать их на предшественники дофаминергических нейронов среднего мозга с высокой эффективностью, которые были безопасно привиты грызунам, с восстановлением двигательного дефицита (Kriks et al., 2011; Grealish et al., 2014). Как и в случае предыдущих трансплантатов среднего мозга плода человека, эти клетки будут аллогенными, поэтому, вероятно, потребуется период иммуносупрессии, который связан с рисками для хозяина, включая инфекцию и злокачественность (Gutierrez-Dalmau and Campistol, 2007).Конечно, существуют этические соображения при использовании эмбриональной ткани, но в большинстве культур это, вероятно, считается приемлемым по сравнению с использованием эмбриональной ткани (Barker and de Beaufort, 2013).
, 2017). Подробная информация о дизайне этих испытаний, включая метод доставки клеток, критерии отбора пациентов, иммуносупрессию и конечные точки исследования, подробно обсуждаются в другом месте (Barker et al., 2017). Линии ESC выделены из ранней бластоцисты и были получены из избыточных человеческих эмбрионов, полученных в результате процедур оплодотворения in vitro (Thomson et al., 1998). Теперь стало возможным перепрограммировать их на предшественники дофаминергических нейронов среднего мозга с высокой эффективностью, которые были безопасно привиты грызунам, с восстановлением двигательного дефицита (Kriks et al., 2011; Grealish et al., 2014). Как и в случае предыдущих трансплантатов среднего мозга плода человека, эти клетки будут аллогенными, поэтому, вероятно, потребуется период иммуносупрессии, который связан с рисками для хозяина, включая инфекцию и злокачественность (Gutierrez-Dalmau and Campistol, 2007).Конечно, существуют этические соображения при использовании эмбриональной ткани, но в большинстве культур это, вероятно, считается приемлемым по сравнению с использованием эмбриональной ткани (Barker and de Beaufort, 2013).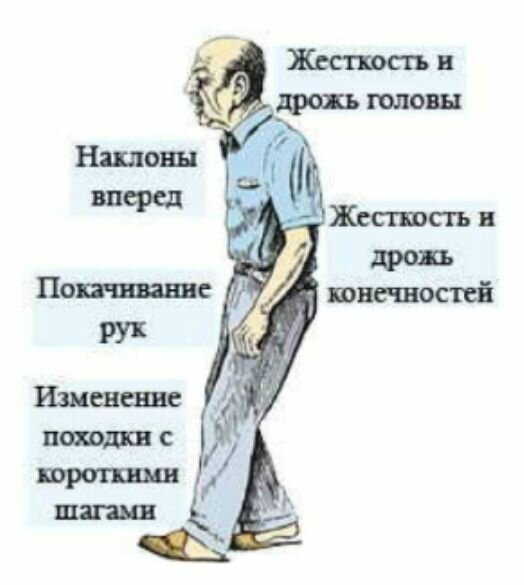
Напротив, ИПСК получают путем перепрограммирования соматических клеток, таких как фибробласты, в плюрипотентные клетки, которые впоследствии могут быть преобразованы в предшественников дофаминергических нейронов (Takahashi et al., 2007; Kikuchi et al., 2017). Было показано, что они интегрируются в полосатое тело хозяина у нечеловеческих приматов, приводя к улучшению моторики без образования опухоли через 2 года (Kikuchi et al., 2017). Эта концепция привлекательна, так как потенциально может предоставить трансплантаты аутологичных тканей, что может обойтись без иммунодепрессантов. Однако одним из недостатков использования аутологичных клеток является то, что привитый продукт будет содержать любые генетические факторы восприимчивости к PD, которые способствовали развитию PD у хозяина. Приобретение патологии БП было замечено в аллогенных трансплантатах ВМ плода, и, возможно, это происходит быстрее в клетках с врожденной генетической предрасположенностью к этому типу патологии, а это означает, что преимущества трансплантатов, полученных из ИПСК, могут быть потеряны раньше по сравнению к трансплантатам, полученным из ESC (Li et al. , 2016). Хотя репрограммирование ESC может быть в высокой степени воспроизводимым, обеспечивая согласованный клеточный продукт для использования в большой популяции пациентов, существует высокая степень вариабельности между людьми в репрограммировании взрослых фибробластов в ИПСК и последующей дифференцировке в нервные клетки. Это создает нормативные проблемы, поскольку каждая производная линия ИПСК будет по существу отдельным продуктом и потенциально может подлежать утверждению регулирующими органами и обширным доклиническим испытаниям, что влечет за собой значительные затраты.Влияние этого может быть уменьшено за счет использования гаплобанков и принятия некоторой степени несоответствия человеческого лейкоцитарного антигена (HLA), но это, вероятно, потребует использования иммунодепрессантов, что означает, что основное преимущество трансплантатов, полученных из ИПСК, утрачивается (Taylor и др., 2012).
, 2016). Хотя репрограммирование ESC может быть в высокой степени воспроизводимым, обеспечивая согласованный клеточный продукт для использования в большой популяции пациентов, существует высокая степень вариабельности между людьми в репрограммировании взрослых фибробластов в ИПСК и последующей дифференцировке в нервные клетки. Это создает нормативные проблемы, поскольку каждая производная линия ИПСК будет по существу отдельным продуктом и потенциально может подлежать утверждению регулирующими органами и обширным доклиническим испытаниям, что влечет за собой значительные затраты.Влияние этого может быть уменьшено за счет использования гаплобанков и принятия некоторой степени несоответствия человеческого лейкоцитарного антигена (HLA), но это, вероятно, потребует использования иммунодепрессантов, что означает, что основное преимущество трансплантатов, полученных из ИПСК, утрачивается (Taylor и др., 2012).
Хотя разработки в области клеточной терапии заняли десятилетия, есть большие надежды, связанные с предстоящими испытаниями трансплантатов нервных предшественников, полученных из ESC и iPSC. Все больше внимания уделяется практическим аспектам применения этих методов лечения, подчеркивая прогресс, достигнутый в направлении полезной клеточной терапии.
Все больше внимания уделяется практическим аспектам применения этих методов лечения, подчеркивая прогресс, достигнутый в направлении полезной клеточной терапии.
Альтернативным источником стволовых клеток, который рассматривался как потенциальное средство лечения БП, являются мезенхимальные стволовые клетки (МСК) костного мозга. Это мультипотентные клетки, которые можно дифференцировать в положительные по тирозингидроксилазе клетки, которые обладают улучшенным двигательным поведением у грызунов, пораженных 6-гидроксидофамином (Offen et al., 2007). Однако дифференциация дофаминергических нейронов была сложной задачей, о чем было опубликовано лишь несколько сообщений (Trzaska et al., 2007), и полезность МСК, вероятно, будет зависеть от периода оптимизации, как это было видно с ИПСК и ЭСК.Также было высказано предположение, что сами МСК могут обладать нейропротекторными свойствами за счет противовоспалительной и паракринной активности и что они могут быть полезны в качестве регенеративной терапии даже без дифференциации на дофаминергические нейроны (Kim YJ et al. , 2009; Delcroix et al., 2011). Трансплантаты МСК были доставлены пациентам с БП в рамках небольшого открытого исследования, продемонстрировавшего краткосрочную безопасность (Venkataramana et al., 2010). В этом исследовании не было возможности прокомментировать, было ли какое-либо клиническое преимущество при коротком времени наблюдения, а роль МСК в будущем остается неясной.
, 2009; Delcroix et al., 2011). Трансплантаты МСК были доставлены пациентам с БП в рамках небольшого открытого исследования, продемонстрировавшего краткосрочную безопасность (Venkataramana et al., 2010). В этом исследовании не было возможности прокомментировать, было ли какое-либо клиническое преимущество при коротком времени наблюдения, а роль МСК в будущем остается неясной.
Основная проблема, связанная с использованием методов лечения БП на основе стволовых клеток, связана с теоретическим потенциалом образования опухоли. Это может происходить из-за чрезмерного роста трансплантата или наличия мутаций в онкогенах или генах-супрессорах опухолей в трансплантированных клетках. Хотя опухоли наблюдались в некоторых ранних доклинических испытаниях трансплантатов, полученных из ESC, они не наблюдались при улучшенных протоколах дифференцировки (Sonntag et al., 2007; Kikuchi et al., 2017). Однако следует признать ограниченное время последующего наблюдения, которое возможно на животных моделях, и может оказаться, что при наличии в течение многих лет, как это было бы в случае с пациентами с БП, эти трансплантаты действительно несут риск онкогенеза. Кроме того, интерпретация генетических аномалий в продукте трансплантата является сложной задачей, и из-за этого в предстоящих клинических испытаниях были приняты различные стратегии генетического тестирования (Barker et al., 2017). Тщательное исследование безопасности и тщательное наблюдение будут иметь жизненно важное значение для обеспечения того, чтобы риск образования опухоли был незначительным, если эти методы лечения будут успешными.
Кроме того, интерпретация генетических аномалий в продукте трансплантата является сложной задачей, и из-за этого в предстоящих клинических испытаниях были приняты различные стратегии генетического тестирования (Barker et al., 2017). Тщательное исследование безопасности и тщательное наблюдение будут иметь жизненно важное значение для обеспечения того, чтобы риск образования опухоли был незначительным, если эти методы лечения будут успешными.
Подходы к доставке вирусных генов
Альтернативный подход к регенеративному лечению БП включает использование вирусных векторов для достижения экспрессии специфических генов в полосатом теле.В их число входят векторы, доставляющие гены, кодирующие ферменты, ответственные за производство дофамин-ароматической аминодекарбоксилазы (AADC), тирозингидроксилазы и циклогидролазы-1.
Было показано, что векторы аденоассоциированного вируса (AAV), несущие AADC, вызывают стойкую экспрессию трансгена с последующим долгосрочным превращением леводопы в дофамин у нечеловеческих приматов (Bankiewicz et al. , 2006). Впоследствии в исследованиях фазы I изучали безопасность векторов AAV, доставляющих AADC в скорлупу пациентов с БП (Christine et al., 2009; Мурамацу и др., 2010). В обоих испытаниях сообщалось об улучшении клинических параметров и параметров ПЭТ-изображений через 6 месяцев, процедуры хорошо переносились. Были проведены еще два клинических испытания фазы I, проведенных у пациентов с БП с использованием векторов AAV, но в них использовались различные терапевтические подходы. Один использовал трофический фактор для дофаминергических нейронов (нейртурин), а другой попытался изменить идентичность субталамических выходных нейронов с глутаматергических на экспрессирующие глутаминовую кислоту декарбоксилазу.Эти испытания показали первоначальные перспективы и подтвердили безопасность подходов к генной терапии (Kaplitt et al., 2007; Marks et al., 2008). Однако рандомизированные исследования фазы II не были столь многообещающими, поскольку показали отсутствие или лишь незначительную пользу по сравнению с плацебо (Marks et al.
, 2006). Впоследствии в исследованиях фазы I изучали безопасность векторов AAV, доставляющих AADC в скорлупу пациентов с БП (Christine et al., 2009; Мурамацу и др., 2010). В обоих испытаниях сообщалось об улучшении клинических параметров и параметров ПЭТ-изображений через 6 месяцев, процедуры хорошо переносились. Были проведены еще два клинических испытания фазы I, проведенных у пациентов с БП с использованием векторов AAV, но в них использовались различные терапевтические подходы. Один использовал трофический фактор для дофаминергических нейронов (нейртурин), а другой попытался изменить идентичность субталамических выходных нейронов с глутаматергических на экспрессирующие глутаминовую кислоту декарбоксилазу.Эти испытания показали первоначальные перспективы и подтвердили безопасность подходов к генной терапии (Kaplitt et al., 2007; Marks et al., 2008). Однако рандомизированные исследования фазы II не были столь многообещающими, поскольку показали отсутствие или лишь незначительную пользу по сравнению с плацебо (Marks et al.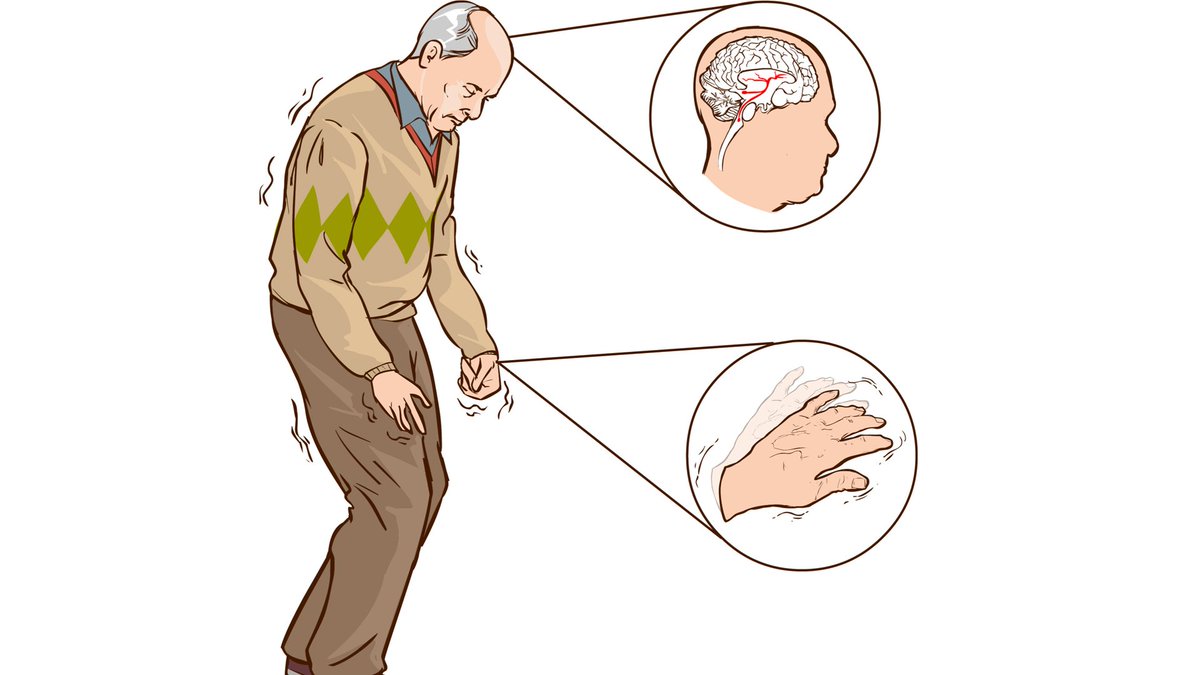 , 2010; LeWitt et al., 2011). Векторы AAV являются неинтегрирующими векторами, поэтому не несут риска инсерционного мутагенеза, который может происходить с интегрирующими вирусными векторами (Mukherjee and Thrasher, 2013). Однако основным недостатком векторов AAV является то, что потенциальный размер генетического груза относительно ограничен, а это означает, что ген только одного из ферментов в пути синтеза дофамина может быть доставлен в вышеупомянутых испытаниях.
, 2010; LeWitt et al., 2011). Векторы AAV являются неинтегрирующими векторами, поэтому не несут риска инсерционного мутагенеза, который может происходить с интегрирующими вирусными векторами (Mukherjee and Thrasher, 2013). Однако основным недостатком векторов AAV является то, что потенциальный размер генетического груза относительно ограничен, а это означает, что ген только одного из ферментов в пути синтеза дофамина может быть доставлен в вышеупомянутых испытаниях.
Напротив, лентивирусные векторы интегрируют вирусные векторы, способные переносить гораздо больший генетический груз, чем AAV, — атрибут, который использовался в испытаниях доставки вирусных генов (Palfi et al., 2014). ProSavin (Oxford Biomedica, Великобритания) — лентивирусный продукт, содержащий гены AADC, а также гены тирозингидроксилазы и циклогидролазы-1. Исследование фазы I / II показало, что этот продукт хорошо переносится, хотя у значительного числа пациентов действительно наблюдалось увеличение дискинезий на фоне приема лекарств (Palfi et al. , 2014). Следующие испытания новой версии ProSavin, OXB-102, вот-вот начнутся в Великобритании и Франции.
, 2014). Следующие испытания новой версии ProSavin, OXB-102, вот-вот начнутся в Великобритании и Франции.
α-Синуклеин как терапевтическая мишень
Накопление и агрегация альфа-синуклеина является патологическим признаком БП, и, хотя его роль до конца не изучена, он, по-видимому, имеет решающее значение в патогенезе БП (и других альфа-синуклеинопатий, таких как деменция с тельцами Леви и множественная системная атрофия) ( Spillantini et al., 1997). Отсюда следует, что снижение уровней патологических форм α-синуклеина может изменить течение БП.Ряд экспериментальных подходов был исследован или в настоящее время исследуется на предмет их способности потенциально оказывать модифицирующий заболевание эффект при БП (см. Рисунок 1) посредством нацеливания на α-синуклеин. Здесь мы даем обзор некоторых из наиболее многообещающих подходов.
РИСУНОК 1. Терапевтические мишени при патологии, опосредованной α-синуклеином. ДНК, дезоксирибонуклеиновая кислота; мРНК, мессенджер рибонуклеиновая кислота; РНК, рибонуклеиновая кислота.
Снижение продукции α-синуклеина
Один из механизмов, с помощью которого можно смягчить патологический эффект α-синуклеина, — это снижение его синтеза.Это может быть достигнуто с помощью технологий РНК-интерференции, в которых экзогенное введение молекул синтетической рибонуклеиновой кислоты (РНК) используется для запуска селективного посттранскрипционного молчания гена α-синуклеина посредством деградации информационной РНК (мРНК). Лентивирусная доставка РНК с короткой шпилькой (shRNA), нацеленной на α-синуклеин, как было показано, подавляет эктопическую экспрессию α-синуклеина на модели грызунов и в клетках SH-SY5Y, что подтверждает эту концепцию (Sapru et al., 2006). Кроме того, прямая инфузия малой интерферирующей РНК (миРНК), направленной против α-синуклеина, в гиппокамп мыши приводит к снижению экспрессии α-синуклеина (Lewis et al., 2008). Вслед за этим работа, проведенная на нечеловеческих приматах, которым вводили инфузию siRNA, направленную против α-синуклеина, продемонстрировала снижение мРНК α-синуклеина и 40-50% снижение уровней белка α-синуклеина ( McCormack et al. , 2010). Еще неизвестно, приведет ли это снижение уровней α-синуклеина к клинической пользе, но демонстрация того, что эти методы обладают способностью снижать уровни α-синуклеина, безусловно, многообещающая.
, 2010). Еще неизвестно, приведет ли это снижение уровней α-синуклеина к клинической пользе, но демонстрация того, что эти методы обладают способностью снижать уровни α-синуклеина, безусловно, многообещающая.
Конечно, одна проблема с подавлением продукции α-синуклеина заключается в том, что могут быть негативные последствия из-за молчания нормального α-синуклеина и, как следствие, потери его нормальной физиологической функции.Эта функция до конца не изучена, но, по-видимому, она играет роль в стыковке вакуолей с клеточной мембраной, поэтому потенциально может быть важна в высвобождении нейромедиаторов (Burré et al., 2014). Обнадеживает то, что несмотря на снижение уровней α-синуклеина в обсуждаемых моделях грызунов, подавление α-синуклеина не привело к какой-либо токсичности (Lewis et al., 2008). Однако в других исследованиях сообщалось о значительной нейротоксичности в связи с подавлением α-синуклеина, в том числе в компактной части черной субстанции (Robertson et al., 2004; Горбатюк и др. , 2010; Канаан и Манфредссон, 2012). В одном из этих исследований нейродегенерация могла быть спасена путем добавления уровней α-синуклеина, предполагая, что действительно потеря α-синуклеина спровоцировала патологию (Горбатюк и др., 2010). Эти отчеты подчеркивают необходимость в адекватных данных о безопасности, если эти методы будут развиваться от доклинических к клиническим исследованиям.
, 2010; Канаан и Манфредссон, 2012). В одном из этих исследований нейродегенерация могла быть спасена путем добавления уровней α-синуклеина, предполагая, что действительно потеря α-синуклеина спровоцировала патологию (Горбатюк и др., 2010). Эти отчеты подчеркивают необходимость в адекватных данных о безопасности, если эти методы будут развиваться от доклинических к клиническим исследованиям.
Хотя эти подходы, основанные на РНК, снижают трансляцию гена α-синуклеина, альтернативной целью может быть снижение транскрипции гена α-синуклеина.В последнее время агонисты β2-адренергических рецепторов (агонисты β2), включая кленбутерол, были связаны со снижением экспрессии гена α-синуклеина (Mittal et al., 2017). Кленбутерол, лекарство, используемое для лечения астмы, снижает экспрессию α-синуклеина на 35% в линии клеток нейробластомы и в нейронах коры головного мозга крыс. Кроме того, он обладает способностью преодолевать гематоэнцефалический барьер — необходимое требование для любого из предложенных подходов к лечению (Mittal et al. , 2017). Эти доклинические испытания были подтверждены результатами двух больших норвежских эпидемиологических когорт, в которых наблюдались четыре миллиона человек.В них агонисты β2 были связаны со снижением риска развития БП. И наоборот, антагонисты β2 (такие как пропранолол) были связаны с повышенным риском БП (Mittal et al., 2017). Хотя эта связь требует дальнейшего изучения, перспектива того, что агонисты β2 могут оказывать модифицирующий болезнь эффект при БП, является захватывающей, особенно с учетом того факта, что уже имеется обширный опыт использования этих препаратов при других состояниях, а это означает, что их введение в клинику можно было относительно быстро.
, 2017). Эти доклинические испытания были подтверждены результатами двух больших норвежских эпидемиологических когорт, в которых наблюдались четыре миллиона человек.В них агонисты β2 были связаны со снижением риска развития БП. И наоборот, антагонисты β2 (такие как пропранолол) были связаны с повышенным риском БП (Mittal et al., 2017). Хотя эта связь требует дальнейшего изучения, перспектива того, что агонисты β2 могут оказывать модифицирующий болезнь эффект при БП, является захватывающей, особенно с учетом того факта, что уже имеется обширный опыт использования этих препаратов при других состояниях, а это означает, что их введение в клинику можно было относительно быстро.
Увеличение клиренса α-синуклеина
Альтернативный подход к нацеливанию на α-синуклеин заключается в увеличении его клиренса. Это потенциально может быть достигнуто за счет увеличения внутриклеточной деградации α-синуклеина посредством путей аутофагии и системы убиквитин-протеасома, например, или путем использования иммунотерапии для удаления внеклеточного α-синуклеина, особенно с учетом гипотезы о том, что α -синуклеиновая патология может распространяться между клетками подобно прионам.
Иммунотерапия
Активная и пассивная иммунотерапия была исследована как средство нацеливания и разложения внеклеточного α-синуклеина, и было показано, что они уменьшают агрегацию α-синуклеина и предотвращают поведенческие дефициты у трансгенных мышей (George and Brundin, 2015). Некоторые из этих методов лечения прошли клинические испытания с многообещающими данными о безопасности и ранними результатами (Brundin et al., 2017).
Недавно завершилась фаза I клинических испытаний активной иммунотерапевтической вакцины (AFFITOPE PD03A, AFFiRiS, Австрия).Это синтетически произведенная вакцина, содержащая пептид, имитирующий α-синуклеин. В этом исследовании пациенты с ранней стадией БП получали повторные подкожные инъекции AFFITOPE PD03A. Тридцать шесть пациентов были рандомизированы для получения высоких или низких доз AFFITOPE PD03A или плацебо. Сообщалось о дозозависимом иммунном ответе против пептида, а также о перекрестной реактивности против α-синуклеина с увеличением титров антител с течением времени 1 . Обнадеживает, что обе дозы хорошо переносятся, и не сообщалось о серьезных побочных эффектах, связанных с лекарствами.Сообщается, что другой активный иммунотерапевтический препарат компании, PD01A, безопасен на ранних стадиях болезни Паркинсона в течение более 4 лет.
Обнадеживает, что обе дозы хорошо переносятся, и не сообщалось о серьезных побочных эффектах, связанных с лекарствами.Сообщается, что другой активный иммунотерапевтический препарат компании, PD01A, безопасен на ранних стадиях болезни Паркинсона в течение более 4 лет.
Подход пассивной иммунотерапии с использованием гуманизированных моноклональных антител против α-синуклеина (PRX001) также был протестирован. Prothena провела клиническое испытание фазы Ia, демонстрирующее снижение уровней α-синуклеина на 96,5% у здоровых добровольцев, и последующее испытание фазы 1b у пациентов с БП, в котором также наблюдалось снижение уровня α-синуклеина (Schenk et al., 2017).PRX001 хорошо переносился, и в настоящее время проводится исследование фазы II у пациентов с ранней стадией БП.
Дополнительные виды иммунотерапии, направленные на α-синуклеин, не за горами, и фармацевтические компании AstraZeneca и Takeda объявляют о разработке антитела к α-синуклеину MEDI1341 для лечения болезни Паркинсона. В пресс-релизе, касающемся MEDI1341, утверждалось, что этот препарат имеет высокое сродство к мишени и сниженную эффекторную функцию, потенциально предлагая более безопасное и эффективное лечение по сравнению с другими видами иммунотерапии α-синуклеином.
В пресс-релизе, касающемся MEDI1341, утверждалось, что этот препарат имеет высокое сродство к мишени и сниженную эффекторную функцию, потенциально предлагая более безопасное и эффективное лечение по сравнению с другими видами иммунотерапии α-синуклеином.
Улучшение аутофагии
Предлагаемый механизм иммунотерапии, который обсуждался, — это клиренс внеклеточного α-синуклеина, но также может быть возможным удалить внутриклеточный α-синуклеин другими способами. Система лизосома-аутофагия играет важную роль в клиренсе α-синуклеина посредством как опосредованной шапероном аутофагии, так и макроаутофагии (Decressac et al., 2013). Следовательно, усиление активности в этой системе может снизить уровни α-синуклеина и его склонность к накоплению и агрегации.Ряд лекарств был исследован как потенциальные средства активации аутофагии, включая новые агенты, а также перепрофилирование лекарств с другими установленными показаниями.
Рапамицин, например, исторически использовался в качестве иммунодепрессанта и является хорошо известным индуктором макроаутофагии (Moors et al. , 2017), и было показано, что он снижает накопление α-синуклеина в модели in vitro GBA1 PD, связанный с мутацией (Cullen et al., 2011). Хотя профиль неблагоприятных побочных эффектов рапамицина означает, что он вряд ли будет полезен в качестве хронического лечения БП, такие результаты позволяют предположить, что усиление аутофагии действительно может снизить общий уровень α-синуклеина (Cullen et al., 2011; Moors et al. , 2017). Было предложено несколько соединений, повышающих активность аутофагии, включая, например, дисахарид трегалозу (Sarkar et al., 2007; Rodríguez-Navarro et al., 2010) и трициклический антидепрессант нортриптилин (Gassen et al., 2014), которые находятся на рассмотрении для ввода в клинические испытания.
, 2017), и было показано, что он снижает накопление α-синуклеина в модели in vitro GBA1 PD, связанный с мутацией (Cullen et al., 2011). Хотя профиль неблагоприятных побочных эффектов рапамицина означает, что он вряд ли будет полезен в качестве хронического лечения БП, такие результаты позволяют предположить, что усиление аутофагии действительно может снизить общий уровень α-синуклеина (Cullen et al., 2011; Moors et al. , 2017). Было предложено несколько соединений, повышающих активность аутофагии, включая, например, дисахарид трегалозу (Sarkar et al., 2007; Rodríguez-Navarro et al., 2010) и трициклический антидепрессант нортриптилин (Gassen et al., 2014), которые находятся на рассмотрении для ввода в клинические испытания.
Трегалоза представляет особый интерес, поскольку на моделях других нейродегенеративных заболеваний было показано, что она снижает количество белковых агрегатов (Tanaka et al., 2004; Davies et al., 2006). Трегалоза — это встречающийся в природе дисахарид, который, по-видимому, играет важную роль в реакции дрожжей на стресс (Singer and Lindquist, 1998). Хотя было высказано предположение, что его способность уменьшать агрегацию белков происходит из-за активности шаперона или за счет связывания и стабилизации аномальных белков (Tanaka et al., 2004; Davies et al., 2006), также было показано, что он действует через mTOR-независимый путь, увеличивая аутофагию (Sarkar et al., 2007; Rodríguez-Navarro et al., 2010). Эти исследования явно вызвали интерес к этому соединению, хотя недавнее исследование первичных кортикальных нейронов мышей показало, что трегалоза не предотвращает токсичность от воздействия на предварительно сформированные фибриллы α-синуклеина (Redmann et al., 2017).
Хотя было высказано предположение, что его способность уменьшать агрегацию белков происходит из-за активности шаперона или за счет связывания и стабилизации аномальных белков (Tanaka et al., 2004; Davies et al., 2006), также было показано, что он действует через mTOR-независимый путь, увеличивая аутофагию (Sarkar et al., 2007; Rodríguez-Navarro et al., 2010). Эти исследования явно вызвали интерес к этому соединению, хотя недавнее исследование первичных кортикальных нейронов мышей показало, что трегалоза не предотвращает токсичность от воздействия на предварительно сформированные фибриллы α-синуклеина (Redmann et al., 2017).
По мере углубления понимания генетической основы БП становится все более очевидным, что различные патогенетические механизмы могут быть более выраженными у определенных групп пациентов.Отсюда следует, что по мере расширения наших знаний о патологических подтипах БП могут появиться различные целевые терапевтические подходы. GBA1 Мутации являются наиболее частым генетическим фактором риска БП (Sidransky et al. , 2009). Ген GBA1 кодирует фермент β-глюкоцереброзидазу (GCase), и гомозиготные мутации в этом гене приводят к лизосомному расстройству накопления, болезни Гоше (Migdalska-Richards and Schapira, 2016). Хотя механизм, с помощью которого мутации GBA1 увеличивают риск БП, до конца не изучен, существует установленная литература, предполагающая, что в этом случае нарушается дисфункция системы лизосома-аутофагия (Schöndorf et al., 2014; Bae et al., 2015; Fernandes et al., 2016). Поэтому в этой группе пациентов нацеливание на аутофагию может быть особенно актуальным. В настоящее время проходят два клинических испытания, в которых пациенты с БП с мутациями GBA1 получают лечение, направленное на коррекцию аномалий в лизосомной среде. В первом исследовании фазы II (MOVES-PD, Genzyme / Sanofi) пациенты получали соединение под названием GZ / SAR402671. Это подавляет продукцию гликосфинголипидов, которые обычно катаболизируются GCase, и накапливаются в клетках у пациентов с PD с мутациями GBA1 .
, 2009). Ген GBA1 кодирует фермент β-глюкоцереброзидазу (GCase), и гомозиготные мутации в этом гене приводят к лизосомному расстройству накопления, болезни Гоше (Migdalska-Richards and Schapira, 2016). Хотя механизм, с помощью которого мутации GBA1 увеличивают риск БП, до конца не изучен, существует установленная литература, предполагающая, что в этом случае нарушается дисфункция системы лизосома-аутофагия (Schöndorf et al., 2014; Bae et al., 2015; Fernandes et al., 2016). Поэтому в этой группе пациентов нацеливание на аутофагию может быть особенно актуальным. В настоящее время проходят два клинических испытания, в которых пациенты с БП с мутациями GBA1 получают лечение, направленное на коррекцию аномалий в лизосомной среде. В первом исследовании фазы II (MOVES-PD, Genzyme / Sanofi) пациенты получали соединение под названием GZ / SAR402671. Это подавляет продукцию гликосфинголипидов, которые обычно катаболизируются GCase, и накапливаются в клетках у пациентов с PD с мутациями GBA1 . В другом случае муколитик, одобренный Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA), амброксол исследуется в качестве потенциального средства лечения БП, связанного с мутацией GBA1 (идентификаторы ClinicalTrials.gov: NCT02941822 и NCT02914366). Амброксол обладает свойствами шаперона, поэтому потенциально облегчает переход неправильно свернутой GCase к лизосомам (Maegawa et al., 2009). В исследованиях in vitro он улучшает лизосомную функцию фибробластов дермы с помощью мутаций GBA1 (Bendikov-Bar et al., 2013; McNeill et al., 2014) и увеличивает активность GCase у нечеловеческих приматов in vivo (Migdalska-Richards et al., 2017).
В другом случае муколитик, одобренный Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA), амброксол исследуется в качестве потенциального средства лечения БП, связанного с мутацией GBA1 (идентификаторы ClinicalTrials.gov: NCT02941822 и NCT02914366). Амброксол обладает свойствами шаперона, поэтому потенциально облегчает переход неправильно свернутой GCase к лизосомам (Maegawa et al., 2009). В исследованиях in vitro он улучшает лизосомную функцию фибробластов дермы с помощью мутаций GBA1 (Bendikov-Bar et al., 2013; McNeill et al., 2014) и увеличивает активность GCase у нечеловеческих приматов in vivo (Migdalska-Richards et al., 2017).
Перепрофилирование других лекарственных средств
Два других препарата недавно были перепрофилированы и испытаны на пациентах с БП — агонист глюкагоноподобного пептида-1 (GLP-1), экзенатид, и ингибитор тирозинкиназы, нилотиниб. Эксенатид является общепризнанным средством лечения сахарного диабета второго типа (Lovshin and Drucker, 2009), в то время как нилотиниб используется для лечения хронического миелолейкоза, поэтому данные о безопасности и переносимости этих агентов у пациентов уже существуют, что помогло ускорить их лечение.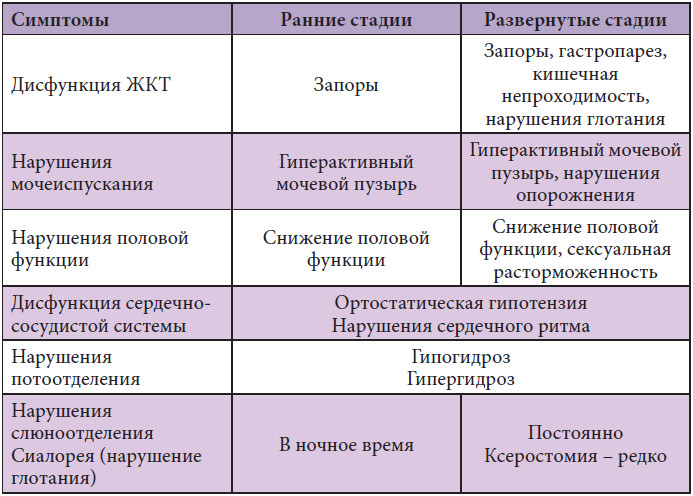 прогресс в клинических испытаниях, которые показали многообещающие результаты.
прогресс в клинических испытаниях, которые показали многообещающие результаты.
Эксенатид оказывает нейропротекторное и нейровосстановительное действие в основанных на токсинах моделях нигростриатальной дегенерации на грызунах с улучшением моторной функции, поведения, обучения и памяти (Bertilsson et al., 2008; Kim S. et al., 2009 ). В недавнем двойном слепом плацебо-контролируемом исследовании изучались эффекты подкожного введения экзенатида у пациентов с умеренной БП (Athauda et al., 2017). Лечение было связано с положительным и длительным эффектом на двигательные показатели, не принимавшие лекарства, через 60 недель.В контексте БП этот период наблюдения относительно короткий, и остается неясным, снижает ли этот препарат прогрессирование нейродегенерации при БП, но эти первые результаты кажутся многообещающими (Athauda et al., 2017).
Было показано, что нилотиниб усиливает клиренс амилоида и, следовательно, был заявлен как потенциальное средство снижения уровней α-синуклеина (Lonskaya et al. , 2014). Он действует как ингибитор c-abl, онкогена, участвующего в регуляции роста, дифференцировки, пролиферации и выживания клеток.Повышенные уровни c-abl были связаны с PD, что, как считается, приводит к увеличению фосфорилирования и агрегации α-синуклеина (Brahmachari et al., 2016; Lindholm et al., 2016). Кроме того, повышение активности c-abl приводит к снижению функции паркина, который является ключевым белком в митохондриальном биогенезе и мутации которого приводят к семейной БП (Lonskaya et al., 2014). Было показано, что нилотиниб снижает уровни экзогенно экспрессируемого α-синуклеина у мышей и снижает индуцированную α-синуклеином дегенерацию нерва (Hebron et al., 2013). Недавнее открытое исследование, в котором пациенты с БП с деменцией или деменцией с тельцами Леви получали нилотиниб, продемонстрировало безопасность и переносимость препарата в этих группах в дозах 150 и 300 мг (ниже тех, которые используются по установленным показаниям) ( Pagan et al., 2016). Однако в этом исследовании не участвовала группа плацебо, и между двумя небольшими группами наблюдались значительные исходные различия, поэтому было невозможно прокомментировать какие-либо клинические преимущества, которые может предложить препарат. Хотя доклинические исследования открывают интересные перспективы для нилотиниба, до сих пор нет убедительных доказательств его эффективности у пациентов с БП (Wyse et al., 2016), хотя еще одно испытание (NILO-PD) с этим агентом в настоящее время продолжается в США (идентификатор ClinicalTrials.gov: NCT03205488).
, 2014). Он действует как ингибитор c-abl, онкогена, участвующего в регуляции роста, дифференцировки, пролиферации и выживания клеток.Повышенные уровни c-abl были связаны с PD, что, как считается, приводит к увеличению фосфорилирования и агрегации α-синуклеина (Brahmachari et al., 2016; Lindholm et al., 2016). Кроме того, повышение активности c-abl приводит к снижению функции паркина, который является ключевым белком в митохондриальном биогенезе и мутации которого приводят к семейной БП (Lonskaya et al., 2014). Было показано, что нилотиниб снижает уровни экзогенно экспрессируемого α-синуклеина у мышей и снижает индуцированную α-синуклеином дегенерацию нерва (Hebron et al., 2013). Недавнее открытое исследование, в котором пациенты с БП с деменцией или деменцией с тельцами Леви получали нилотиниб, продемонстрировало безопасность и переносимость препарата в этих группах в дозах 150 и 300 мг (ниже тех, которые используются по установленным показаниям) ( Pagan et al., 2016). Однако в этом исследовании не участвовала группа плацебо, и между двумя небольшими группами наблюдались значительные исходные различия, поэтому было невозможно прокомментировать какие-либо клинические преимущества, которые может предложить препарат. Хотя доклинические исследования открывают интересные перспективы для нилотиниба, до сих пор нет убедительных доказательств его эффективности у пациентов с БП (Wyse et al., 2016), хотя еще одно испытание (NILO-PD) с этим агентом в настоящее время продолжается в США (идентификатор ClinicalTrials.gov: NCT03205488).
Заключение
Текущие варианты лечения БП ограничиваются симптоматическими мерами, преимущественно в форме дофаминергических препаратов и DBS. Хотя они могут принести значительную симптоматическую пользу, они также приводят к тревожным побочным эффектам, которые могут ухудшить качество жизни пациентов. Кроме того, ничто из этого не меняет течение болезни.Следовательно, существует необходимость в разработке методов лечения, которые могут целенаправленно и физиологически восстанавливать дофаминергический тонус в полосатом теле, а также в идентификации лекарственных средств, которые могут предотвратить или замедлить текущую нейродегенерацию. Ряд интересных подходов к лечению начинает проходить клинические испытания. К ним относятся регенеративные методы лечения в виде трансплантатов, полученных из стволовых клеток, и терапии вирусных генов, предназначенные для замены функции утраченных нейронов, а также новые и перепрофилированные препараты, нацеленные на патогенные механизмы БП, с потенциально изменяющими болезнь свойствами. .Расширение знаний о патофизиологии и генетике БП позволило разработать конкретные подходы к лечению, и вполне вероятно, что стандартное лечение БП в ближайшие десятилетия существенно изменится, поскольку эти новые варианты лечения появляются и используются в комбинации. .
Авторские взносы
TS и KT в равной степени внесли свой вклад в написание рукописи. РБ просмотрел и отредактировал рукопись.
Финансирование
Авторы выражают благодарность за финансовую поддержку следующим организациям: Институт стволовых клеток Wellcome Trust (Кембридж), Совет медицинских исследований, Центр биомедицинских исследований Национального института исследований в области здравоохранения и Cure Parkinson’s Trust.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Сноски
- http://www.affiris.com/news/affiris-announces-top-line-results-of-first-in-human-clinical-study-using-affitope/
- http://www.affiris.com/news/affiris-announces-encouraging-long-term-data-from-a-series-of-first-in-human-studies-using-affitope-pd01a-targeting- олигомерный альфа-синуклеин у пациентов с ранней паркинсонической болезнью /
- http: // ir.prothena.com/news-releases/news-release-details/prothena-announces-initiation-phase-2-pasadena-study?ReleaseID=1032188
- https://www.astrazeneca.com/media-centre/press-releases/2017/astrazeneca-and-takeda-establish-collaboration-to-develop-and-commercialise-medi1341-for-parkinsons-disease-25082017. html
- http://news.genzyme.com/press-release/sanofi-initiates-phase-2-clinical-trial-evaluate-therapy-genetic-form-parkinsons-disea
Список литературы
Аллен, Г.С., Бернс, Р.С., Тюлипан, Н.Б., и Паркер, Р.А. (1989). Трансплантация мозгового вещества надпочечников в хвостатое ядро при болезни Паркинсона. Первые клинические результаты у 18 пациентов. Arch. Neurol. 46, 487–491. DOI: 10.1001 / archneur.1989.00520410021016
CrossRef Полный текст | Google Scholar
Арджона В., Мингес-Кастелланос А., Монторо Р. Дж., Ортега А., Эскамилла Ф., Толедо-Арал Дж. Дж. И др. (2003). Аутотрансплантация агрегатов клеток каротидного тела человека для лечения болезни Паркинсона. Нейрохирургия 53, 321-328; обсуждение 328–330.
Google Scholar
Athauda, D., Maclagan, K., Skene, S. S., Bajwa-Joseph, M., Letchford, D., Chowdhury, K., et al. (2017). Эксенатид один раз в неделю по сравнению с плацебо при болезни Паркинсона: рандомизированное двойное слепое плацебо-контролируемое исследование. Ланцет 390, 1664–1675. DOI: 10.1016 / S0140-6736 (17) 31585-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Backlund, E.O., Granberg, P.O., Hamberger, B., Knutsson, E., Mårtensson, A., Sedvall, G., et al. (1985). Трансплантация мозгового вещества надпочечников в полосатое тело при паркинсонизме. Первые клинические испытания. J. Neurosurg. 62, 169–173. DOI: 10.3171 / jns.1985.62.2.0169
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Bae, E.J., Yang, N.Y., Lee, C., Lee, H.J., Kim, S., Sardi, S.P., et al. (2015). Потеря активности глюкоцереброзидазы 1 вызывает дисфункцию лизосом и агрегацию α-синуклеина. Exp. Мол. Med. 47: e153. DOI: 10.1038 / emm.2014.128
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Bankiewicz, K. S., Forsayeth, J., Eberling, J. L., Sanchez-Pernaute, R., Pivirotto, P., Bringas, J., et al. (2006). Долгосрочное клиническое улучшение у приматов, пораженных МРТР, после генной терапии AAV-hAADC. Мол. Ther. 14, 564–570. DOI: 10.1016 / j.ymthe.2006.05.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Баркер, Р.А., и де Бофор I. (2013). Научные и этические вопросы, связанные с исследованиями стволовых клеток и вмешательствами при нейродегенеративных заболеваниях головного мозга. Прог. Neurobiol. 110, 63–73. DOI: 10.1016 / j.pneurobio.2013.04.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Баркер, Р. А., Друин-Уэлле, Дж., И Пармар, М. (2015). Клеточные методы лечения болезни Паркинсона — прошлые открытия и будущий потенциал. Nat. Rev. Neurol. 11, 492–503.DOI: 10.1038 / nrneurol.2015.123
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Баркер, Р. А., Пармар, М., Студер, Л., и Такахаши, Дж. (2017). Испытания на людях дофаминовых нейронов, полученных из стволовых клеток, при болезни Паркинсона: рассвет новой эры. Стволовые клетки клетки 21, 569–573. DOI: 10.1016 / j.stem.2017.09.014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бенабид А. Л. (2003). Глубокая стимуляция мозга при болезни Паркинсона. Curr. Opin. Neurobiol. 13, 696–706. DOI: 10.1016 / j.conb.2003.11.001
CrossRef Полный текст | Google Scholar
Бендиков-Бар И., Маор Г., Филокамо М. и Горовиц М. (2013). Амброксол как фармакологический шаперон для мутантной глюкоцереброзидазы. Blood Cells Mol. Дис. 50, 141–145. DOI: 10.1016 / j.bcmd.2012.10.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бертилссон, Г., Патроне, К., Закриссон, О., Андерссон, А., Dannaeus, K., Heidrich, J., et al. (2008). Пептидный гормон эксендин-4 стимулирует нейрогенез субвентрикулярной зоны в мозге взрослых грызунов и вызывает выздоровление на животной модели болезни Паркинсона. J. Neurosci. Res. 86, 326–338. DOI: 10.1002 / jnr.21483
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Brahmachari, S., Ge, P., Lee, S.H., Kim, D., Karuppagounder, S. S., Kumar, M., et al. (2016). Активация тирозинкиназы c-Abl способствует индуцированной α-синуклеином нейродегенерации. J. Clin. Вкладывать деньги. 126, 2970–2988. DOI: 10.1172 / JCI85456
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Brundin, P., Pogarell, O., Hagell, P., Piccini, P., Widner, H., Schrag, A., et al. (2000). Двусторонние трансплантаты хвостатого ядра и скорлупы эмбриональной мезэнцефальной ткани, обработанные лазароидами при болезни Паркинсона. Мозг 123 (Pt 7), 1380–1390. DOI: 10.1093 / мозг / 123.7.1380
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бурре, Дж., Шарма М. и Зюдхоф Т. К. (2014). α-Синуклеин собирается в мультимеры более высокого порядка при связывании с мембраной, что способствует образованию комплекса SNARE. Proc. Natl. Акад. Sci. США 111, E4274 – E4283. DOI: 10.1073 / pnas.1416598111
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кристин К. В., Старр П. А., Ларсон П. С., Эберлинг Дж. Л., Джагуст В. Дж., Хокинс Р. А. и др. (2009). Безопасность и переносимость генной терапии путамина AADC при болезни Паркинсона. Неврология 73, 1662–1669. DOI: 10.1212 / WNL.0b013e3181c29356
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Каллен, В., Сарди, С. П., Нг, Дж., Сюй, Ю. Х., Сан, Ю., Томлинсон, Дж. Дж. И др. (2011). Мутанты кислой β-глюкозидазы, связанные с болезнью Гоше, болезнью Паркинсона и деменцией с тельцами Леви, изменяют процессинг α-синуклеина. Ann. Neurol. 69, 940–953. DOI: 10.1002 / ana.22400
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дэвис, Дж.Э., Саркар С., Рубинштейн Д. К. (2006). Трегалоза снижает образование агрегатов и задерживает патологию в модели окулофарингеальной мышечной дистрофии у трансгенных мышей. Хум. Мол. Genet. 15, 23–31. DOI: 10.1093 / hmg / ddi422
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Decressac, M., Mattsson, B., Weikop, P., Lundblad, M., Jakobsson, J., and Björklund, A. (2013). TFEB-опосредованная аутофагия спасает дофаминовые нейроны среднего мозга от токсичности α-синуклеина. Proc. Natl. Акад. Sci. США 110, E1817 – E1826. DOI: 10.1073 / pnas.1305623110
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Delcroix, G.J., Garbayo, E., Sindji, L., Thomas, O., Vanpouille-Box, C., Schiller, P.C, et al. (2011). Терапевтический потенциал мультипотентных мезенхимальных стромальных клеток человека в сочетании с фармакологически активными микроносителями, трансплантированными гемипаркинсоническим крысам. Биоматериалы 32, 1560–1573. DOI: 10.1016 / j.биоматериалы.2010.10.041
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Друкер-Колин, Р., Мадрасо, И., Остроски-Солис, Ф., Шкурович, М., Франко, Р., и Торрес, К. (1988). Трансплантация мозгового вещества надпочечников в хвостатом ядре пациентов с болезнью Паркинсона. Прог. Brain Res. 78, 567–574. DOI: 10.1016 / S0079-6123 (08) 60332-5
CrossRef Полный текст | Google Scholar
Эрнст А. М. (1969). Роль биогенных аминов в экстрапирамидной системе. Acta Physiol. Pharmacol. Neerl. 15, 141–154.
PubMed Аннотация | Google Scholar
Фернандес, Х. Дж., Хартфилд, Э. М., Кристиан, Х. К., Эмманулиду, Э., Чжэн, Ю., Бут, Х. и др. (2016). ER стресс и аутофагические пертурбации приводят к увеличению внеклеточного альфа-синуклеина в дофаминовых нейронах GBA-N370S Паркинсона, происходящих от ИПСК. Stem Cell Rep. 6, 342–356. DOI: 10.1016 / j.stemcr.2016.01.013
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фрид, К.R., Greene, P.E., Breeze, R.E., Tsai, W.Y., DuMouchel, W., Kao, R., et al. (2001). Трансплантация эмбриональных дофаминовых нейронов при тяжелой болезни Паркинсона. N. Engl. J. Med. 344, 710–719. DOI: 10.1056 / NEJM200103083441002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Freeman, T. B., Olanow, C. W., Hauser, R. A., Nauert, G. M., Smith, D. A., Borlongan, C. V., et al. (1995). Двусторонняя трансплантация черного плода в посткомиссуральную скорлупу при болезни Паркинсона. Ann. Neurol. 38, 379–388. DOI: 10.1002 / ana.410380307
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Gassen, N.C., Hartmann, J., Zschocke, J., Stepan, J., Hafner, K., Zellner, A., et al. (2014). Связь FKBP51 с праймингом путей аутофагии и опосредованием ответа на лечение антидепрессантами: данные на клетках, мышах и людях. PLoS Med. 11: e1001755. DOI: 10.1371 / journal.pmed.1001755
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гетц, К.Г., Таннер, К. М., Пенн, Р. Д., Стеббинс, Г. Т., Гилли, Д. В., Шеннон, К. М. и др. (1990). Пересадка мозгового вещества надпочечников в полосатое тело пациентов с запущенной болезнью Паркинсона: моторные и психомоторные данные за 1 год. Неврология 40, 273–276. DOI: 10.1212 / WNL.40.2.273
CrossRef Полный текст | Google Scholar
Горбатюк, О.С., Ли, С., Нэш, К., Горбатюк, М., Левин, А.С., Салливан, Л.Ф. и др. (2010). In vivo РНКи-опосредованное молчание альфа-синуклеина индуцирует нигростриатальную дегенерацию. Мол. Ther. 18, 1450–1457. DOI: 10.1038 / mt.2010.115
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Grealish, S., Diguet, E., Kirkeby, A., Mattsson, B., Heuer, A., Bramoulle, Y., et al. (2014). Дофаминовые нейроны, происходящие из ЭСК человека, демонстрируют доклиническую эффективность и активность, аналогичную фетальным нейронам при трансплантации на крысиной модели болезни Паркинсона. Стволовые клетки клетки 15, 653–665. DOI: 10.1016 / j.stem.2014.09.017
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гросс, Р.E., Watts, R.L., Hauser, R.A., Bakay, R.A., Reichmann, H., von Kummer, R., et al. (2011). Интрастриатальная трансплантация связанных с микроносителями пигментных эпителиальных клеток сетчатки человека в сравнении с фиктивным хирургическим вмешательством у пациентов с поздней стадией болезни Паркинсона: двойное слепое рандомизированное контролируемое исследование. Ланцет Нейрол. 10, 509–519. DOI: 10.1016 / S1474-4422 (11) 70097-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гутьеррес-Дальмау, А., Кампистол, Дж. М.(2007). Иммуносупрессивная терапия и злокачественные новообразования у реципиентов трансплантата органов: систематический обзор. Наркотики 67, 1167–1198. DOI: 10.2165 / 00003495-200767080-00006
CrossRef Полный текст | Google Scholar
Хеврон, М. Л., Лонская, И., и Мусса, К. Э. (2013). Нилотиниб устраняет потерю дофаминовых нейронов и улучшает моторное поведение за счет аутофагической деградации α-синуклеина в моделях болезни Паркинсона. Хум. Мол. Genet. 22, 3315–3328. DOI: 10.1093 / hmg / ddt192
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хуот, П., Джонстон, Т. Х., Коприч, Дж. Б., Фокс, С. Х. и Бротчи, Дж. М. (2013). Фармакология дискинезии, вызванной L-DOPA, при болезни Паркинсона. Pharmacol. Ред. 65, 171–222. DOI: 10.1124 / pr.111.005678
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дженнер, П. (2003). Агонисты дофамина, селективность рецепторов и индукция дискинезии при болезни Паркинсона. Curr. Opin. Neurol. 16 (Дополнение 1), S3 – S7. DOI: 10.1097 / 00019052-200312001-00002
CrossRef Полный текст | Google Scholar
Цзяо, С.S., Zhang, W.C., Cao, J.K., Zhang, Z.M., Wang, H., Ding, M.C. и др. (1988). Изучение трансплантации мозгового вещества надпочечников в полосатое тело при паркинсонизме. Прог. Brain Res. 78, 575–580. DOI: 10.1016 / S0079-6123 (08) 60333-7
CrossRef Полный текст | Google Scholar
Калия, Л. В., и Ланг, А. Э. (2015). Болезнь Паркинсона. Ланцет 386, 896–912. DOI: 10.1016 / S0140-6736 (14) 61393-3
CrossRef Полный текст
Калия, С.К., Санкар, Т., и Лозано, А. М. (2013). Глубокая стимуляция мозга при болезни Паркинсона и других двигательных нарушениях. Curr. Opin. Neurol. 26, 374–380. DOI: 10.1097 / WCO.0b013e3283632d08
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Каплитт, М.Г., Фейгин, А., Танг, К., Фитцсимонс, Х.Л., Мэттис, П., Лоулор, П.А., и др. (2007). Безопасность и переносимость генной терапии с геном GAD, переносимым аденоассоциированным вирусом (AAV), при болезни Паркинсона: открытое испытание, фаза I. Ланцет 369, 2097–2105. DOI: 10.1016 / S0140-6736 (07) 60982-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Келли, П. Дж., Альског, Дж. Э., ван Хеерден, Дж. А., Кармайкл, С. В., Стоддард, С. Л. и Белл, Г. Н. (1989). Трансплантация костного мозга надпочечников аутотрансплантатом в полосатое тело пациентов с болезнью Паркинсона. Mayo Clin. Proc. 64, 282–290. DOI: 10.1016 / S0025-6196 (12) 65248-3
CrossRef Полный текст | Google Scholar
Ху, Т.К., Ярнал, А. Дж., Дункан, Г. В., Колман, С., О’Брайен, Дж. Т., Брукс, Д. Дж. И др. (2013). Спектр немоторных симптомов на ранних стадиях болезни Паркинсона. Неврология 80, 276–281. DOI: 10.1212 / WNL.0b013e31827deb74
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кикучи Т., Моризане А., Дои Д., Маготани Х., Оноэ Х., Хаяси Т. и др. (2017). Дофаминергические нейроны, полученные из iPS-клеток человека, функционируют на модели болезни Паркинсона приматов. Природа 548, 592–596.DOI: 10.1038 / природа23664
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ким, С., Мун, М., и Парк, С. (2009). Эксендин-4 защищает дофаминергические нейроны путем ингибирования активации микроглии и экспрессии матриксной металлопротеиназы-3 на животной модели болезни Паркинсона. J. Endocrinol. 202, 431–439. DOI: 10.1677 / JOE-09-0132
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ким, Ю. Дж., Пак, Х. Дж., Ли, Г., Банг, О.Y., Ahn, Y.H., Joe, E., et al. (2009). Нейропротекторное действие мезенхимальных стволовых клеток человека на дофаминергические нейроны за счет противовоспалительного действия. Glia 57, 13–23. DOI: 10.1002 / glia.20731
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кордовер, Дж. Х., Фриман, Т. Б., Сноу, Б. Дж., Вингерхутс, Ф. Дж., Муфсон, Э. Дж., Санберг, П. Р. и др. (1995). Невропатологические доказательства выживания трансплантата и реиннервации полосатого тела после трансплантации мезэнцефальной ткани плода пациенту с болезнью Паркинсона. N. Engl. J. Med. 332, 1118–1124. DOI: 10.1056 / NEJM199504273321702
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Крикс, С., Шим, Дж. У., Пиао, Дж., Ганат, Ю. М., Уэйкман, Д. Р., Се, З. и др. (2011). Дофаминовые нейроны, полученные из человеческих ES-клеток, эффективно приживаются в моделях болезни Паркинсона на животных. Природа 480, 547–551. DOI: 10.1038 / природа10648
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Куджава, К., Леурганс, С., Раман, Р., Бласуччи, Л., и Гетц, К. Г. (2000). Острая ортостатическая гипотензия при запуске агонистов дофамина при болезни Паркинсона. Arch. Neurol. 57, 1461–1463. DOI: 10.1001 / archneur.57.10.1461
CrossRef Полный текст | Google Scholar
Lewis, J., Melrose, H., Bumcrot, D., Hope, A., Zehr, C., Lincoln, S., et al. (2008). In vivo подавление альфа-синуклеина с помощью голой миРНК. Мол. Neurodegener. 3:19. DOI: 10.1186 / 1750-1326-3-19
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Левитт, П.A., Rezai, A.R., Leehey, M.A., Ojemann, S.G., Flaherty, A.W., Eskandar, E.N. и др. (2011). Генная терапия AAV2-GAD для запущенной болезни Паркинсона: двойное слепое рандомизированное исследование, контролируемое фиктивным хирургическим вмешательством. Ланцет Нейрол. 10, 309–319. DOI: 10.1016 / S1474-4422 (11) 70039-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Li, W., Englund, E., Widner, H., Mattsson, B., van Westen, D., Lätt, J., et al. (2016). Обширная дофаминергическая иннервация трансплантата сохраняется через 24 года после трансплантации в дегенерирующем паркинсоническом мозге. Proc. Natl. Акад. Sci. США 113, 6544–6549. DOI: 10.1073 / pnas.1605245113
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Линдхольм Д., Фам Д. Д., Касконе А., Эрикссон О., Веннерберг К. и Саарма М. (2016). Ингибиторы c-Abl позволяют получить представление о патофизиологии и нейропротекции при болезни Паркинсона. Фронт. Aging Neurosci. 8: 254. DOI: 10.3389 / fnagi.2016.00254
CrossRef Полный текст | Google Scholar
Линдвалл, О., Backlund, E.O., Farde, L., Sedvall, G., Freedman, R., Hoffer, B., et al. (1987). Трансплантация при болезни Паркинсона: два случая трансплантации костного мозга надпочечников на скорлупу. Ann. Neurol. 22, 457–468. DOI: 10.1002 / ana.410220403
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Линдвалл, О., Брундин, П., Виднер, Х., Ренкрона, С., Густави, Б., Фраковяк, Р. и др. (1990). Трансплантаты дофаминовых нейронов плода выживают и улучшают двигательную функцию при болезни Паркинсона. Наука 247, 574–577. DOI: 10.1126 / science.2105529
CrossRef Полный текст | Google Scholar
Линдвалл, О., Ренкрона, С., Брундин, П., Густави, Б., Астедт, Б., Виднер, Х., и др. (1989). Дофаминовые нейроны плода человека, трансплантированные в полосатое тело у двух пациентов с тяжелой болезнью Паркинсона. Подробное описание методологии и 6-месячного наблюдения. Arch. Neurol. 46, 615–631. DOI: 10.1001 / archneur.1989.00520420033021
CrossRef Полный текст | Google Scholar
Линдвалл, О., Sawle, G., Widner, H., Rothwell, J.C., Björklund, A., Brooks, D., et al. (1994). Доказательства долгосрочного выживания и функции дофаминергических трансплантатов при прогрессирующей болезни Паркинсона. Ann. Neurol. 35, 172–180. DOI: 10.1002 / ana.410350208
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лонская, И., Хеврон, М. Л., Десфорж, Н. М., Шахтер, Дж. Б., и Мусса, К. Э. (2014). Аутофагические изменения, вызванные нилотинибом, повышают уровень эндогенного паркина и убиквитинирование, что приводит к клиренсу амилоида. J. Mol. Med. 92, 373–386. DOI: 10.1007 / s00109-013-1112-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мадрасо, И., Друкер-Колин, Р., Диас, В., Мартинес-Мата, Дж., Торрес, К. и Бесеррил, Дж. Дж. (1987). Открытый микрохирургический аутотрансплантат мозгового вещества надпочечника к правому хвостатому ядру у двух пациентов с трудноизлечимой болезнью Паркинсона. N. Engl. J. Med. 316, 831–834. DOI: 10.1056 / NEJM198704023161402
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Маэгава, Г.Х., Тропак, М. Б., Баттнер, Дж. Д., Ригат, Б. А., Фуллер, М., Пандит, Д. и др. (2009). Идентификация и характеристика амброксола как агента, повышающего активность ферментов при болезни Гоше. J. Biol. Chem. 284, 23502–23516. DOI: 10.1074 / jbc.M109.012393
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Marks, W. J., Bartus, R. T., Siffert, J., Davis, C. S., Lozano, A., Boulis, N., et al. (2010). Доставка гена AAV2-нейрурина при болезни Паркинсона: двойное слепое рандомизированное контролируемое исследование. Ланцет Нейрол. 9, 1164–1172. DOI: 10.1016 / S1474-4422 (10) 70254-4
CrossRef Полный текст | Google Scholar
Marks, W. J., Ostrem, J. L., Verhagen, L., Starr, P. A., Larson, P. S., Bakay, R.A., et al. (2008). Безопасность и переносимость интрапутаминальной доставки CERE-120 (аденоассоциированный вирус серотипа 2-нейрурин) пациентам с идиопатической болезнью Паркинсона: открытое исследование фазы I. Ланцет Нейрол. 7, 400–408. DOI: 10.1016 / S1474-4422 (08) 70065-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
МакКормак, А.Л., Мак, С. К., Хендерсон, Дж. М., Бамкрот, Д., Фаррер, М. Дж., И Ди Монте, Д. А. (2010). Подавление альфа-синуклеина направленной малой интерферирующей РНК в черной субстанции приматов. PLoS One 5: e12122. DOI: 10.1371 / journal.pone.0012122
PubMed Аннотация | CrossRef Полный текст | Google Scholar
McNeill, A., Magalhaes, J., Shen, C., Chau, K. Y., Hughes, D., Mehta, A., et al. (2014). Амброксол улучшает биохимию лизосом в клетках болезни Паркинсона, связанных с мутацией глюкоцереброзидазы. Мозг 137, 1481–1495. DOI: 10,1093 / мозг / аву020
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Mendez, I., Dagher, A., Hong, M., Hebb, A., Gaudet, P., Law, A., et al. (2000). Повышение выживаемости сохраненных дофаминергических клеток и стимулирование выживаемости трансплантата за счет воздействия нейротрофического фактора, происходящего от линии глиальных клеток, на нигральную ткань плода человека у пациентов с болезнью Паркинсона. Отчет о двух случаях и технических соображениях. J. Neurosurg. 92, 863–869. DOI: 10.3171 / jns.2000.92.5.0863
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мигдальска-Ричардс, А., Ко, В. К. Д., Ли, К., Безард, Э., и Шапира, А. Х. В. (2017). Пероральный амброксол увеличивает активность глюкоцереброзидазы мозга у приматов, кроме человека. Synapse 71: e21967. DOI: 10.1002 / syn.21967
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мигдальска-Ричардс, А., Шапира, А. Х. (2016). Связь между мутациями глюкоцереброзидазы и болезнью Паркинсона. J. Neurochem.
Google Scholar
Мингес-Кастелланос, А., Эскамилья-Севилья, Ф., Хоттон, Г. Р., Толедо-Арал, Дж. Дж., Ортега-Морено, А., Мендес-Феррер, С. и др. (2007). Аутотрансплантация каротидного тела при болезни Паркинсона: исследование клинической и позитронно-эмиссионной томографии. J. Neurol. Нейрохирургия. Психиатрия 78, 825–831. DOI: 10.1136 / jnnp.2006.106021
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Миттал, С., Бьёрневик, К., Im, D. S., Flierl, A., Dong, X., Locascio, J. J., et al. (2017). β2-адренорецептор является регулятором гена α-синуклеина, определяющего риск болезни Паркинсона. Наука 357, 891–898. DOI: 10.1126 / science.aaf3934
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Moors, T. E., Hoozemans, J. J., Ingrassia, A., Beccari, T., Parnetti, L., Chartier-Harlin, M. C., et al. (2017). Терапевтический потенциал агентов, усиливающих аутофагию, при болезни Паркинсона. Мол.Neurodegener. 12:11. DOI: 10.1186 / s13024-017-0154-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мурамацу, С., Фудзимото, К., Като, С., Мизуками, Х., Асари, С., Икегучи, К. и др. (2010). Фаза I исследования генной терапии декарбоксилазы ароматической L-аминокислоты при болезни Паркинсона. Мол. Ther. 18, 1731–1735. DOI: 10.1038 / mt.2010.135
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Натт, Дж. Г., Вудворд, В.Р., Хаммерстад, Дж. П., Картер, Дж. Х. и Андерсон, Дж. Л. (1984). Феномен включения-выключения при болезни Паркинсона. Отношение к абсорбции и транспорту леводопы. N. Engl. J. Med. 310, 483–488. DOI: 10.1056 / NEJM198402233100802
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Оффен, Д., Бархум, Ю., Леви, Ю.С., Бурштейн, А., Панет, Х., Черлоу, Т. и др. (2007). Интрастриатальная трансплантация стволовых клеток, полученных из костного мозга мышей, улучшает моторное поведение на мышиной модели болезни Паркинсона. J. Neural Transm. Дополнение 72, 133–143. DOI: 10.1007 / 978-3-211-73574-9_16
CrossRef Полный текст | Google Scholar
Olanow, C.W., Goetz, C.G., Kordower, J.H., Stoessl, A.J., Sossi, V., Brin, M.F., et al. (2003). Двойное слепое контролируемое испытание двусторонней трансплантации черного плода при болезни Паркинсона. Ann. Neurol. 54, 403–414. DOI: 10.1002 / ana.10720
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Оланов, С.W., Kieburtz, K., Odin, P., Espay, A.J., Standaert, D.G., Fernandez, H.H., et al. (2014). Непрерывная интраджунальная инфузия кишечного геля леводопа-карбидопа для пациентов с поздней стадией болезни Паркинсона: рандомизированное контролируемое двойное слепое исследование с двойной фиксацией. Ланцет Нейрол. 13, 141–149. DOI: 10.1016 / S1474-4422 (13) 70293-X
CrossRef Полный текст | Google Scholar
Pagan, F., Hebron, M., Valadez, E.H., Torres-Yaghi, Y., Huang, X., Mills, R.R., et al.(2016). Эффекты нилотиниба при болезни Паркинсона и слабоумие с непристойными тельцами. J. Parkinsons Dis. 6, 503–517. DOI: 10.3233 / JPD-160867
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Палфи, С., Гурручага, Дж. М., Ральф, Г. С., Лепет, Х., Лависс, С., Баттери, П. С. и др. (2014). Долгосрочная безопасность и переносимость ProSavin, генной терапии на основе лентивирусного вектора для лечения болезни Паркинсона: увеличение дозы, открытое, фаза 1/2 испытания. Ланцет 383, 1138–1146.DOI: 10.1016 / S0140-6736 (13) 61939-X
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Редманн, М., Вани, В. Ю., Вольпичелли-Дейли, Л., Дарли-Усмар, В., и Чжан, Дж. (2017). Трегалоза не улучшает выживаемость нейронов при воздействии предварительно сформированных фибрилл альфа-синуклеином. Редокс Биол. 11, 429–437. DOI: 10.1016 / j.redox.2016.12.032
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Редмонд Д. Э., Роббинс Р. Дж., Нафтолин Ф., Марек, К. Л., Фоллмер, Т. Л., Лерант, К. и др. (1993). Клеточное замещение дефицита дофамина при болезни Паркинсона с использованием мезэнцефальной ткани плода человека: предварительные результаты у четырех пациентов. Res. Publ. Доц. Res. Nerv. Ment. Дис. 71, 325–359.
Google Scholar
Робертсон, Д. К., Шмидт, О., Нинкина, Н., Джонс, П. А., Шарки, Дж., И Бухман, В. Л. (2004). Потеря развития и устойчивость к токсичности дофаминергических нейронов MPTP в компактной части черной субстанции гамма-синуклеина, альфа-синуклеина и мышей с двойным нуль-мутантом по альфа / гамма-синуклеину. J. Neurochem. 89, 1126–1136. DOI: 10.1111 / j.1471-4159.2004.02378.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Родригес-Наварро, Дж. А., Родригес, Л., Касарехос, М. Дж., Солано, Р. М., Гомес, А., Перучо, Дж. И др. (2010). Трегалоза улучшает дофаминергическую и тау-патологию у мышей с удаленным паркин / тау-антителом за счет активации аутофагии. Neurobiol. Дис. 39, 423–438. DOI: 10.1016 / j.nbd.2010.05.014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сапру, М.К., Йейтс, Дж. У., Хоган, С., Цзян, Л., Холтер, Дж., И Бон, М. К. (2006). Молчание человеческого альфа-синуклеина in vitro и в головном мозге крысы с помощью лентивирусной РНКи. Exp. Neurol. 198, 382–390. DOI: 10.1016 / j.expneurol.2005.12.024
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Саркар С., Дэвис Дж. Э., Хуанг З., Туннаклифф А. и Рубинштейн Д. К. (2007). Трегалоза, новый mTOR-независимый усилитель аутофагии, ускоряет выведение мутантного хантингтина и альфа-синуклеина. J. Biol. Chem. 282, 5641–5652. DOI: 10.1074 / jbc.M609532200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шенк Д. Б., Коллер М., Несс Д. К., Гриффит С. Г., Грундман М., Заго В. и др. (2017). Первая оценка на людях PRX002, моноклонального антитела против α-синуклеина, на здоровых добровольцах. Mov. Disord. 32, 211–218. DOI: 10.1002 / mds.26878
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шёндорф, Д.К., Аурели, М., Макаллистер, Ф. Э., Хиндли, К. Дж., Майер, Ф., Шмид, Б. и др. (2014). Нейроны, полученные из ИПСК пациентов с GBA1-ассоциированной болезнью Паркинсона, демонстрируют аутофагические дефекты и нарушение гомеостаза кальция. Nat. Commun. 5: 4028. DOI: 10.1038 / ncomms5028
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шумахер, Дж. М., Эллиас, С. А., Палмер, Э. П., Котт, Х. С., Динсмор, Дж., Демпси, П. К. и др. (2000). Трансплантация эмбриональной мезэнцефальной ткани свиньи пациентам с БП. Неврология 54, 1042–1050. DOI: 10.1212 / WNL.54.5.1042
CrossRef Полный текст | Google Scholar
Селихова, М., Уильямс, Д. Р., Кемпстер, П. А., Холтон, Дж. Л., Ревес, Т., и Лис, А. Дж. (2009). Клинико-патологическое исследование подтипов болезни Паркинсона. Мозг 132, 2947–2957. DOI: 10.1093 / мозг / awp234
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сидранский, Э., Наллс, М.А., Ослы, Дж. О., Аарон-Перец, Дж., Аннези Г., Барбоза Э. Р. и др. (2009). Многоцентровый анализ мутаций глюкоцереброзидазы при болезни Паркинсона. N. Engl. J. Med. 361, 1651–1661. DOI: 10.1056 / NEJMoa0
1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Зоннтаг, К. К., Прушак, Дж., Йошизаки, Т., ван Аренсберген, Дж., Санчес-Пернауте, Р., и Исаксон, О. (2007). Повышенный выход нейроэпителиальных предшественников и дофаминергических нейронов среднего мозга из человеческих эмбриональных стволовых клеток с использованием антагониста костных морфогенных белков ноггина. Стволовые клетки 25, 411–418. DOI: 10.1634 / стволовые клетки.2006-0380
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Спиллантини, М. Г., Шмидт, М. Л., Ли, В. М., Трояновски, Дж. К., Джейкс, Р., и Гёдерт, М. (1997). Альфа-синуклеин в тельцах Леви. Природа 388, 839–840. DOI: 10.1038 / 42166
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Стовер, Н. П., Бакай, Р. А., Субраманиан, Т., Райзер, К. Д., Корнфелд, М.L., Schweikert, A. W. и др. (2005). Интрастриатальная имплантация пигментных эпителиальных клеток сетчатки человека, прикрепленных к микроносителям, при запущенной болезни Паркинсона. Arch. Neurol. 62, 1833–1837. DOI: 10.1001 / archneur.62.12.1833
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Такахаши К., Танабе К., Охнуки М., Нарита М., Ичисака Т., Томода К. и др. (2007). Индукция плюрипотентных стволовых клеток из фибробластов взрослого человека определенными факторами. Cell 131, 861–872. DOI: 10.1016 / j.cell.2007.11.019
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Танака М., Мачида Ю., Ниу С., Икеда Т., Яна Н. Р., Дои Х. и др. (2004). Трегалоза облегчает патологию, опосредованную полиглутамином, на мышиной модели болезни Хантингтона. Nat. Med. 10, 148–154. DOI: 10,1038 / нм985
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тейлор, К. Дж., Пикок, С., Чаудри, А.Н., Брэдли, Дж. А., и Болтон, Э. М. (2012). Создание банка iPSC для трансплантации HLA-совместимой ткани на основе известных типов HLA донора и реципиента. Стволовые клетки клетки 11, 147–152. DOI: 10.1016 / j.stem.2012.07.014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Томсон, Дж. А., Ицковиц-Элдор, Дж., Шапиро, С. С., Вакниц, М. А., Свиергил, Дж. Дж., Маршалл, В. С. и др. (1998). Линии эмбриональных стволовых клеток, полученные из бластоцист человека. Наука 282, 1145–1147.DOI: 10.1126 / science.282.5391.1145
CrossRef Полный текст | Google Scholar
Трзаска, К. А., Кужикандатхил, Э. В., и Рамешвар, П. (2007). Спецификация дофаминергического фенотипа мезенхимальных стволовых клеток взрослого человека. Стволовые клетки 25, 2797–2808. DOI: 10.1634 / стволовые клетки.2007-0212
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Венкатарамана, Н. К., Кумар, С. К., Балараджу, С., Радхакришнан, Р. К., Бансал, А., Диксит, А. и др.(2010). Открытое исследование односторонней трансплантации аутологичных мезенхимальных стволовых клеток костного мозга при болезни Паркинсона. Пер. Res. 155, 62–70. DOI: 10.1016 / j.trsl.2009.07.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Вун В., Фернагут П. О., Викенс Дж., Баунес К., Родригес М., Павон Н. и др. (2009). Хроническая дофаминергическая стимуляция при болезни Паркинсона: от дискинезий до нарушений контроля над импульсами. Ланцет Нейрол. 8, 1140–1149. DOI: 10.1016 / S1474-4422 (09) 70287-X
CrossRef Полный текст | Google Scholar
Веннинг, Г. К., Один, П., Морриш, П., Ренкрона, С., Виднер, Х., Брундин, П. и др. (1997). Краткосрочная и долгосрочная выживаемость и функция односторонних интрастриатальных дофаминергических трансплантатов при болезни Паркинсона. Ann. Neurol. 42, 95–107. DOI: 10.1002 / ana.410420115
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Уильямс-Грей, К., Эванс, Дж. Р., Горис, А., Фолтиние, Т., Бан, М., Роббинс, Т. У. и др. (2009). Отличительные когнитивные синдромы болезни Паркинсона: 5-летнее наблюдение когорты CamPaIGN. Мозг 132, 2958–2969. DOI: 10.1093 / мозг / awp245
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Янг, Б. К., Камичиоли, Р., и Ганзини, Л. (1997). Нейропсихиатрические побочные эффекты противопаркинсонических препаратов. Характеристики, оценка и лечение. Наркотики старения 10, 367–383.DOI: 10.2165 / 00002512-199710050-00005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Есть ли естественное лекарство от болезни Паркинсона?
Болезнь Паркинсона — это нейродегенеративное состояние, которое приводит к ухудшению мимики, ригидности, ригидности мышц, тремору, а также нарушению равновесия и ходьбы. Существует множество обычных лекарств и хирургических вмешательств, которые могут улучшить симптомы болезни Паркинсона. Однако многие люди с этим заболеванием задаются вопросом: «Есть ли естественное лекарство от болезни Паркинсона?» Эта статья прольет свет на ответ на этот вопрос.
Как можно заболеть болезнью Паркинсона?
Болезнь Паркинсона — это нейродегенеративное заболевание, которое вызывает снижение работы определенных частей мозга, ответственных за выработку нейромедиатора, дофамина. Дофамин отвечает за многие функции организма, включая контроль движений и эмоциональную мимику. Когда уровень дофамина слишком низкий, начинают проявляться симптомы Паркинсона. Точная причина болезни Паркинсона пока неясна.Было проведено множество исследований и теорий, которые предполагают, что болезнь Паркинсона является результатом сочетания генетических факторов и факторов окружающей среды. По сути, эта теория предполагает, что если человек с генетической предрасположенностью к болезни Паркинсона подвергается сильному воздействию токсинов окружающей среды, у него может развиться болезнь Паркинсона.
Есть ли природное лекарство от болезни Паркинсона?
Краткий ответ на вопрос «Есть ли естественное лекарство от болезни Паркинсона»: нет.В настоящее время не существует естественного или обычного лекарства от болезни Паркинсона. Несмотря на то, что лекарства неизлечимо, все же существуют методы лечения, которые могут улучшить симптомы болезни Паркинсона. Основная медицина предлагает лекарства и хирургические методы для улучшения уровня дофамина в головном мозге. Натуральная медицина предлагает питание, травы, витамины, минералы, аминокислоты и другие природные методы лечения. Эти различные подходы могут улучшить уровень дофамина в головном мозге, а также улучшить общее состояние мозга. Хотя естественного лекарства от болезни Паркинсона не существует, многое можно сделать для улучшения здоровья и качества жизни людей, страдающих болезнью Паркинсона.
Какие натуральные методы лечения доступны при болезни Паркинсона?
Как и в случае любого другого лечения, важно обсудить с врачом, какие естественные методы лечения могут вам подойти. Хотя существует множество естественных методов лечения, которые могут улучшить симптомы, важно убедиться, что они безопасны для вашего конкретного состояния здоровья.
Образ жизни
Здоровый образ жизни может улучшить общее состояние здоровья человека, страдающего болезнью Паркинсона.
- Хорошее питание
- Хорошо сбалансированная диета с хорошими жирами и белками, овощами и небольшим количеством крахмала является хорошей основой для здорового питания. Исключение продуктов с высоким содержанием воспалительных процессов и употребление продуктов с высоким содержанием противовоспалительных средств может улучшить здоровье организма.
- Качественный сон
- Сон — это когда тело исцеляется. Хороший сон и достаточное количество сна помогают организму отдыхать и восстанавливаться.
- Обычные упражнения
- Регулярные упражнения улучшают работу мышц и повышают уровень дофамина.
Детоксикационные процедуры
Многие считают, что болезнь Паркинсона развивается после того, как организм подвергся воздействию токсинов окружающей среды. Удаление этих токсинов может снизить токсиновую нагрузку на организм и улучшить здоровье.
- Хелатирующая терапия
- Хелатотерапия — это лечение, которое помогает удалить тяжелые металлы из организма.
- Средства для лечения пота
- Терапия с потом, например, FIR-сауна, может нагревать ткани тела и вызывать потоотделение.Токсины можно вывести через пот.
- Очищает печень и толстую кишку
- Печень очищает кровь, а толстая кишка выводит шлаки и токсины с калом. Очищение печени и толстой кишки может помочь вывести токсины из организма.
Травы
- Mucuna Pruriens
- Mucuna Pruriens — это натуральное растение, содержащее L-допа, предшественник дофамина. L-допа проникает через гематоэнцефалический барьер и превращается в дофамин в головном мозге.Повышение уровня дофамина может улучшить симптомы Паркинсона.
- Куркумин
- Куркумин — это основной полифенол, содержащийся в куркуме. Куркумин обладает противовоспалительными и антиоксидантными свойствами, которые могут улучшить общее состояние мозга.
Питательные вещества
- витаминов группы В
- Витамины группы В необходимы для функционирования некоторых ферментов в организме. Фермент, который превращает L-допа в дофамин, требует B6.Некоторые лекарства от болезни Паркинсона могут истощить организм от витаминов группы В. Дефицит витамина B может ухудшить симптомы Паркинсона.
- CoQ10
- CoQ10 — это натуральное вещество, вырабатываемое организмом. Это необходимо клеткам для выработки энергии. Были проведены исследования по CoQ10 и болезни Паркинсона. Результаты показывают, что не было заметной разницы в моторных симптомах Паркинсона в группе, принимавшей CoQ10 по сравнению с плацебо.
Физиотерапия
Физическая терапия может быть очень полезной для пациентов с болезнью Паркинсона.Физическая терапия может помочь сохранить мышечную силу, хорошую осанку, хорошее равновесие и хорошую способность ходить.
Иглоукалывание
Иглоукалывание — это метод лечения традиционной китайской медицины. Иглоукалывание может помочь улучшить симптомы Паркинсона, а также неспецифические симптомы Паркинсона, такие как бессонница или психические / эмоциональные симптомы.
Работают ли натуральные средства?
Природные методы лечения болезни Паркинсона не были изучены так тщательно, как традиционные методы лечения болезни Паркинсона.Тем не менее, было проведено множество исследований естественных методов лечения и болезни Паркинсона. Были проведены исследования, изучающие эффективность определенных изменений образа жизни, трав, витаминов, аминокислот и других естественных методов лечения. Некоторые исследования показывают некоторые положительные результаты.
Хотя не существует естественного лекарства от болезни Паркинсона, натуральная медицина может дать надежду на улучшение качества жизни. Если вы хотите получить дополнительную информацию о том, как натуральная медицина может помочь, свяжитесь с The Parkinson’s Plan по телефону 603-677-1484.
Автор
Доктор Дарлин Драгг, Северная Дакота
Заявление об ограничении ответственности: информация в этой статье предназначена только для образовательных целей и не заменяет консультацию, диагностику или лечение у лицензированного врача. Вам следует проконсультироваться с врачом, прежде чем использовать натуральные лекарства или внести изменения в свой план лечения.Руководство по симптомам, стадиям и лечению болезни Паркинсона
Симптомы и признаки болезни Паркинсона
Трудно напрямую диагностировать болезнь Паркинсона.Не существует специальных тестов, которые врачи могут провести для подтверждения диагноза, поэтому важно, чтобы исследования продолжали определять постоянно развивающееся определение болезни Паркинсона. Помимо выявления многих из этих симптомов, врачи также исследуют семейный анамнез и проведут общее обследование мозга, чтобы официально поставить диагноз.
Частота появления этих симптомов варьируется в зависимости от человека, и нет определенного количества времени, которое вы гарантированно проживете после постановки диагноза.Он может быстро развиться или вы можете прожить 30 лет, прежде чем начнется самая тяжелая болезнь. Хотя сам Паркинсон определил шесть основных качеств болезни, когда он впервые подробно описал ее, симптомы болезни Паркинсона со временем развились. Они включают, но не ограничиваются полностью, следующее:
- Медлительность движений : Это определяется как неспособность двигаться так же быстро, как обычно, при этом мышцы движутся медленнее в координации друг с другом.В мире медицины он известен как «брадикинезия» и является одним из определяющих симптомов болезни Паркинсона. Исследователи объясняют, что болезнь заставляет мозг вырабатывать меньше клеток головного мозга определенного типа (базальных ганглиев), которые помогают части головного мозга приказывать нам двигать мышцами. Замедленность движений может проявляться во многих формах (которые мы скоро обсудим), а брадикинезия может вынудить больных тратить больше времени на выполнение рутинных действий и в конечном итоге потерять координацию.
- Ухудшение выражения лица : По мере прогрессирования болезни Паркинсона вы можете обнаружить, что лицо пациента со временем становится менее выразительным.Кто-то, кто раньше часто улыбался или хмурился, может быть не в состоянии показать выражение так сильно, как раньше. Это состояние, известное как «гипомимия», имеет некоторую связь с брадикинезией. Пациенты могут быть не в состоянии выражать эмоции и мимику так хорошо, как раньше, просто потому, что их тело не позволяет им быстро улыбаться, изгибать брови, хмуриться или задействовать какие-либо лицевые мышцы в конкретный момент. Кажется, будто человек с болезнью носит постоянную маску, скрывающую его реакционные эмоции — вы не сможете сказать, как он себя чувствует, если он это не произнесет.
- Тремор : Официально известный как дискинезия, тремор определяется Национальным институтом здоровья как «непроизвольное ритмичное сокращение мышц, приводящее к дрожащим движениям в одной или нескольких частях тела». Эти сокращения могут быть постоянными или происходить случайным образом, и они не у всех людей с болезнью Паркинсона. Этот тремор чаще всего возникает в кистях, руках, ногах и в области головы / шеи. Хотя врачи не могут в явной форме объяснить, почему у пациентов с болезнью Паркинсона возникает тремор (исследования показали, что этому может способствовать недостаток определенных химических веществ в мозге), было обнаружено, что тремор является побочным эффектом людей, принимающих леводопу — лекарство, используемое для лечения болезни Паркинсона.
- Неустойчивое равновесие : На более поздних стадиях болезни Паркинсона ваше равновесие может начать теряться, что может повлиять на базовые действия, такие как ходьба, надевание одежды и купание. Подобно уменьшенному выражению лица, неустойчивый баланс частично связан с брадикинезией, поскольку неспособность вашего тела двигать мускулами так быстро при реакции на определенные движения может вызвать падения и общую нестабильность. Неустойчивое равновесие — и попытки чрезмерной компенсации, наклоняясь или наклоняясь определенным образом, чтобы предотвратить постоянные падения, — могут привести к неправильной осанке.Многие из этих симптомов взаимосвязаны, так как один может вызвать цепную реакцию, вызывая другие.
- Монотонный голосовой тон / тихая речь : Ваше лицо может стать менее выразительным, так же как и ваш голос, потому что мышцы, окружающие ваши губы и шею, предоставляют меньше возможностей для выражения громким и изменчивым голосом. (В медицине это известно как «дизартрия».) Из-за этого врачам становится сложнее лечить пациентов, а лицам, осуществляющим уход, понимать потребности пациента.Как и брадикинезия, нарушения речи возникают из-за заболевания, поражающего ту часть мозга, которая отвечает за гладкую моторику, например, речь. То, как говорит человек с болезнью Паркинсона, не ограничивается медленным монотонным тоном. Возможно, что у пациента может быть быстрая речь, что также затрудняет понимание. В целом, пациенты с болезнью Паркинсона с трудом поддерживают разговоры из-за всех этих эффектов.
- Снижение способности сгибаться (ригидность) : По мере прогрессирования болезни вам может стать труднее сгибать руки, ноги и спину, что делает ваши движения в целом менее плавными.Это может затруднить одевание, встать и встать с постели, переворачиваться в постели, ходить в плавном темпе и выполнять другие повседневные дела. В целом, болезнь Паркинсона вызывает спазмы и боли в мышцах на постоянной основе. Хотя этот симптом до конца не изучен, исследователи полагают, что он связан с резким снижением дофамина — химического вещества, которое помогает клеткам мозга и нервам оставаться связанными — у пациентов с болезнью Паркинсона. У людей с этим заболеванием на 60-80 процентов меньше дофамина, чем у среднего человека.
- Шаркающая походка : На походку человека — плавность его ходьбы — может влиять болезнь Паркинсона. Хотя это часто бывает временным, пациенты сообщают, что им кажется, что их ноги приклеиваются к полу, когда они пытаются переместить их. И когда их ноги действительно двигаются, это больше похоже на шарканье, чем на то, чтобы поднимать одну ногу и ставить ее перед другой. Как и многие другие симптомы, это вызвано повреждением части мозга, которая способствует плавности двигательных движений.Если человек с болезнью Паркинсона не шаркает ногами, его шаги могут быть короче при более быстрой ходьбе. Все это может происходить при чрезмерной компенсации плохого равновесия, которое может сделать ходьбу чрезвычайно трудной и болезненной.
Приводит ли болезнь Паркинсона к деменции?
Во время последней стадии болезни Паркинсона симптомы могут прогрессировать от серьезного угнетения двигательной функции до потери памяти. Обычно любая форма потери памяти называется деменцией.
Существует несколько форм деменции, например:
- Болезнь Альцгеймера (наиболее частая)
- Болезнь Хантингтона
- Сосудистая деменция
- Деменция с тельцами Леви
- Деменция, вызванная травмой головы
- Деменция, вызванная злоупотреблением алкоголем и наркотиками
Болезнь Паркинсона указана как форма деменции просто потому, что потеря памяти происходит на более поздних стадиях.Подсчитано, что потеря памяти не вызывает беспокойства, по крайней мере, через 10 лет после первоначального диагноза. Хотя потеря памяти не является основным признаком болезни, более чем у половины пациентов с болезнью Паркинсона развивается какая-либо форма деменции. Подобно болезни Альцгеймера, деменция, связанная с болезнью Паркинсона, прогрессивно ухудшается.
Ассоциация Альцгеймера утверждает, что если деменция действительно возникает из-за болезни Паркинсона, симптомы аналогичны деменции с тельцами Леви. Это связано с тем, что у пациентов начинают развиваться эти белковые отложения (тельца Леви) в тех частях мозга, которые влияют на движение и познание, что затем может влиять на память.
Симптомы деменции включают:
- Галлюцинации
- Изменения в рассуждениях
- Изменение уровня бдительности, которое меняется изо дня в день
- Заблуждения
- Сложность интерпретации визуальной информации
- Депрессия
Деменция не может быть явным симптомом болезни Паркинсона. Возможно, люди с этим заболеванием имеют более высокий риск развития деменции, чем люди без него. Также может быть, что потеря памяти происходит отдельно от болезни.Большинству пациентов с болезнью Паркинсона, страдающих деменцией, больше 70 лет, и именно тогда показатели потери памяти также начинают расти. Тем не менее, это значительный шаг вперед в прогрессировании болезни Паркинсона, и врачи должны учитывать это в процессе лечения.
Стадии болезни Паркинсона
Поскольку болезнь Паркинсона развивается с течением времени, существуют различные стадии, которые помогают определить, как развивались симптомы и чего ожидать дальше.
Обычно врачи следуют пяти этапам, описанным ниже:
1 этапНачальная стадия болезни Паркинсона иногда вообще не проявляется.Если симптомы заметны, это обычно тремор, поражающий одну сторону тела. Симптомы обычно не влияют на ваш распорядок дня, но к ним следует отнестись серьезно и довести до сведения врача, если они еще этого не сделали.
2 этапНа этой стадии болезнь начинает поражать все ваше тело. Тремор и скованность приводят к тому, что выполнение рутинных действий занимает немного больше времени, и это начинает влиять на ваше общее движение. Ваша осанка и выражение лица могут начать меняться, что может повлиять на вашу способность ходить в обычном темпе или общаться, как вы привыкли.
3 этапНа этой стадии ухудшаются все симптомы, которые начали постепенно ухудшаться на стадии 2, но вы также начинаете испытывать потерю равновесия и координации, а также скорость ваших рефлексов. По мере того, как эти симптомы начинают проявляться, люди с заболеванием начинают чаще падать, что может стать причиной их собственных травм и ослабления. Такие действия, как вставание с постели, прием пищи и одевание, становятся все труднее.
4 этапНа данном этапе практически невозможно жить самостоятельно. Ваша способность выполнять повседневные действия (одеваться, принимать душ, принимать пищу) сильно ограничивается, и вам не следует выполнять их без посторонней помощи, потому что это опасно, особенно готовить пищу и пытаться искупаться. Ходьба также ограничена, ваше движение ограничено только ходящим (если возможно).
5 этапЭто последняя и самая тяжелая стадия, и тут уже нельзя жить без посторонней помощи.По сути, все двигательные функции утрачиваются, и вы прикованы к кровати или инвалидному креслу для передвижения. На пятой стадии начинается слабоумие, галлюцинации и спутанность сознания.
В дополнение к медленному началу болезни, существует не одна единичная форма болезни Паркинсона, а несколько, которые проявляются с разной скоростью и вызывают разные симптомы. В то время как различные формы болезни имеют подробные рейтинговые симптомы о том, насколько серьезно болезнь прогрессирует, вышеупомянутая рейтинговая система представляет устойчивое развитие симптомов при всех формах болезни Паркинсона.
Болезнь Паркинсона не всегда является явной причиной смерти людей, страдающих этим заболеванием, это скорее опасности и запреты (неподвижность, ведущая к сердечным заболеваниям, нестабильность, ведущая к смертельным падениям) болезни, которая может стать фатальной.
Различные типы болезни Паркинсона
Когда болезнь Паркинсона начинает проявляться в полной мере, болезнь может поражать разные части мозга и вызывать различные симптомы. От этого зависит диагноз, какой у вас тип болезни Паркинсона (симптомы, где она начинается и т. Д.). Иногда врачи также не знают точной причины, но они знают, что у вас проявляются симптомы, сходные с симптомами болезни Паркинсона. Давайте углубимся в различные формы нечестивой болезни:
- Сосудистый паркинсонизм : Сосудистый паркинсонизм вызывается ограничением притока крови к мозгу, особенно к тем частям мозга, которые влияют на движение и речь. Когда у кого-то случается обширный инсульт или даже несколько более мелких инсультов, немедленное ограничение поступления крови в определенные части мозга может вызвать симптомы, подобные болезни Паркинсона.В отличие от нормальной болезни Паркинсона, симптомы сосудистого паркинсонизма — чаще всего проблемы с ходьбой и потеря памяти — обычно проявляются очень быстро из-за немедленного ограничения крови.
- Идиопатическая болезнь Паркинсона : наиболее распространенная форма болезни Паркинсона, диагностируется, когда корень болезни неизвестен. В то время как потерю моторики и устойчивости можно подробно объяснить в других случаях, врачи часто не знают, почему заболевание развилось.
- Паркинсонизм, индуцированный лекарствами : Болезнь Паркинсона может развиться после длительного приема определенных лекарств. Из-за этого она развивается от 5 до 10 процентов людей с болезнью Паркинсона. Антипсихотические и нейролептические препараты, которые используются для лечения таких состояний, как шизофрения и психоз, могут вызывать болезнь Паркинсона, поскольку они влияют на естественный уровень дофамина в головном мозге. Хотя они блокируют дофамин в ближайшем будущем, это долгосрочное истощение может начать размножаться в виде симптомов Паркинсона.Если болезнь все же развивается из-за этих типов лекарств, она часто обратима в течение недель и месяцев после прекращения приема лекарств.
- Кортикобазальная дегенерация : более редкая форма заболевания, возникает, когда белок, называемый тау, накапливается в определенных частях мозга. Кортикобазальная дегенерация развивается медленнее и часто поражает одну сторону тела, прежде чем в течение пары лет медленно отразится на всем теле. Его можно диагностировать в возрасте 40 лет, но чаще всего заболевание развивается в возрасте от 50 до 70 лет.
Есть и другие поколения болезни, но они самые редкие формы. Тем не менее они несут такие же симптомы, как и все другие формы болезни.
Лечение болезни Паркинсона и его будущее
Болезнь Паркинсона неизлечима. Однако ежегодно миллионы долларов тратятся на исследования, чтобы помочь лучше понять болезнь, начиная с ее определения и заканчивая методами лечения. Конечная конечная цель — разработать лекарство от болезни Паркинсона, но тем временем врачи и исследователи разработали планы лечения, основанные на том, что, как они предполагают, в первую очередь вызывает болезнь, — чаще всего на недостатке определенных химических веществ и клеток мозга, таких как дофамин.
Планы варьируются в зависимости от пациента, и некоторые из этих вариантов лечения включают:
- Леводопа : это основное лекарство, используемое для лечения симптомов болезни Паркинсона. Было обнаружено, что у людей с диагнозом этого заболевания уровень дофамина значительно ниже, и леводопа решает эту проблему и стимулирует нервную систему. Леводопа увеличивает уровень дофамина в вашем теле и направлен на решение проблем, связанных с нервной системой, таких как тремор, мышечный контроль и координация.Как правило, леводопа принимается вместе с препаратом под названием карбидопа, который действует как защитник леводопы, поэтому он действительно достигает мозга и позволяет ему быть эффективным. К сожалению, леводопа имеет некоторые недостатки, в том числе рвоту, тошноту, бессонницу и диарею, а также другие побочные эффекты. При длительном применении леводопа может усилить тремор и другие мышечные спазмы. Комбинация этих препаратов принимается несколько раз в день.
- Агонисты дофамина : В отличие от приема леводопы, которая превращается в дофамин, некоторым пациентам назначают агонисты дофамина, которые имитируют эффекты дофамина.Эти агонисты активируют дофаминовые рецепторы в вашем мозгу и создают впечатление, что ваши дофаминовые рецепторы работают нормально. В некоторых случаях агонисты дофамина принимают вместе с леводопой, чтобы помочь найти здоровый баланс между двумя лекарствами и ограничить побочные эффекты от обоих методов лечения. Побочные эффекты агонистов дофамина аналогичны побочным эффектам леводопы, но есть и другие серьезные побочные эффекты, включая галлюцинации и спорадическое поведение, выходящее за рамки вашей личности.
- Хирургия / стимуляция мозга : Доступны хирургические варианты для пациентов с болезнью Паркинсона.Первичная форма хирургического вмешательства, которую получают пациенты с болезнью Паркинсона, — это глубокая стимуляция мозга (DBS), направленная на воздействие на определенные части мозга, такие как кора. Во время операции в мозг посылаются электрические волны, чтобы стимулировать те части органа, которые страдают от болезни Паркинсона. Конечная цель — облегчить некоторые симптомы, вызываемые болезнью. Еще одна операция, которую могут сделать пациенты с болезнью Паркинсона, — это имплант, который постоянно выделяет агонисты дофамина или леводопу, чтобы гарантировать своевременный прием препарата.
- Медицинская марихуана : Медицинская марихуана не была официально рекомендована Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов для лечения болезни Паркинсона, так как не было научно доказано, что каннабиноиды явно помогают бороться с этой болезнью. Однако на протяжении десятилетий его использовали для лечения заболеваний, подобных тем, которые проявляются при болезни Паркинсона, таких как тремор и замедленность движений. Чтобы узнать больше, прочитайте наше полное руководство по медицинской марихуане для пожилых людей.
- Другие лекарства : Существуют и другие лекарства, включая Элдеприл, Зелапар, Дуопа (комбинация леводопы и карбидопы), Азилект и многие другие, которые снижают уровень дофамина в головном мозге и различные симптомы, которые могут возникнуть из-за болезни.
Также нет реального способа окончательно предотвратить болезнь. Как и в случае профилактики любых заболеваний или недомоганий, рекомендуется вести здоровый образ жизни до и после постановки диагноза. Сохранение физической активности посредством таких видов деятельности, как бег, йога и поднятие тяжестей, а также здоровое питание — это оба способа предоставить вашему телу наилучшие возможности для здорового образа жизни.
Клинические испытания также рассматриваются как «вариант лечения», потому что они могут дать вам такие же шансы на облегчение симптомов, как и другие уже существующие методы лечения.Клинические испытания проводятся круглый год в различных учреждениях и фондах, и ваши демографические данные могут соответствовать исследованию на начальной доклинической стадии или на продвинутой стадии.
Поговорите со своим врачом о любых доступных клинических испытаниях, на которые вы можете претендовать, и о том, как стать их участником. Также оставайтесь на связи со своим врачом относительно любых проблем, которые могут возникнуть у вас с болезнью Паркинсона, или о том, как ее лечить.
Как жить хорошо с болезнью Паркинсона: Часть 1
Вы можете жить успешной жизнью с таким хроническим заболеванием, как болезнь Паркинсона (БП)! Под успешным я подразумеваю более управляемый образ жизни, при котором симптомы находятся под вашим контролем, а побочные эффекты лекарств более предсказуемы и стабильны.Как это возможно?
Хорошо жить с болезнью Паркинсона
Я лично боролся с последствиями болезни Паркинсона почти 22 года. Симптомы включают тремор в конечностях, непроизвольные движения, называемые дискинезией, ригидность мышц, боль в суставах и мышечные спазмы (дистония). Это лишь некоторые из моторных симптомов болезни Паркинсона. Есть и другие симптомы, связанные с этим заболеванием, которые не видны и часто остаются незамеченными. Некоторые из них — проблемы с памятью, ясностью мысли, организованностью, речью и глотанием.Многие люди не думают, что они родственники, и поэтому часто остаются без лечения. Кроме того, существуют психологические проблемы, такие как депрессия, беспокойство, обсессивно-компульсивные расстройства и многое другое. Теперь вы можете спросить себя, прочитав, чего я могу ожидать от диагноза БП: «Как я могу жить хорошо?»
Управление одной частью
Велнес — это одна часть менеджмента и одна часть отношения. Физические симптомы можно контролировать с помощью лекарств. Теперь я должен вам сказать, что я не большой поклонник лекарств, отпускаемых по рецепту.Принимаю ли я его за свой ПД? Да! Помогает? Опять же, да, но я дополняю режим приема лекарств активностью и физическими упражнениями. Движение — важный элемент, позволяющий опередить болезнь. Если вы просто сидите на диване и смотрите телевизор в ожидании какого-нибудь чудодейственного лекарства, вы не оказываете своему телу услуги. Врачи постоянно советуют нам заниматься спортом. Есть много причин для этого. Когда мы тренируемся, наши тела вырабатывают эндорфины, которые стимулируют мозг и стимулируют выработку различных химических веществ в мозгу, а также учащают сердечный ритм, что увеличивает кровоток и увеличивает количество кислорода.Это научный факт, и было доказано, что он не только улучшает наше общее состояние здоровья, но и замедляет прогрессирование болезни Паркинсона. Существуют различные типы упражнений, дружественных к БП, и вам следует проконсультироваться с врачом, какие из них подходят вам лучше всего.
Одна часть позиции
Отношение решает все. Я упомянул, что сидел на диване и ждал лекарства. Я хотел бы в кое-чем признаться. Я был тем парнем! Я не только жалел себя, я чувствовал, что впадаю в глубокую депрессию. К счастью, моя сестра вытащила меня из этого состояния жалости к себе и познакомила с группой других людей, живущих с PD, которые собирались раз в неделю.Я думаю, вы могли бы назвать это группой поддержки, но это было намного больше. Я помню, как они говорили об этой болезни и смеялись над каждым своим опытом жизни с БП. Мое отношение к PD полностью изменилось. Я обнаружил, что сочетание физических упражнений и социальной активности изменило мое отношение к болезни Паркинсона в будущем. Никогда бы я больше не посмотрел на эту болезнь так же. Я благодарен за первые уроки, научившиеся победно жить с болезнью Паркинсона, и за привнесенный юмор, но больше всего я бесконечно благодарен за заботу и любовь к вмешательству моей сестры и за почти 22 года хорошей жизни с болезнью Паркинсона.
Щелкните здесь, чтобы перейти ко второй части книги «Хорошо жить с болезнью Паркинсона».
В этой статье представлены мнения, мысли и опыт автора; ни один из этих материалов не был оплачен рекламодателями. Команда ParkinsonsDisease.net не рекомендует и не поддерживает какие-либо продукты или методы лечения, обсуждаемые здесь. Узнайте больше о том, как мы поддерживаем редакционную честность здесь.
Доктора лечат болезнь Паркинсона с помощью новой трансплантации клеток мозга.
Первая из двух частей.
За месяц до запланированной операции четверо исследователей были готовы сопровождать клетки мозга в их 190-мильном путешествии. Они никогда не ожидали, что их ждут «Удивительная гонка» — встречи — «Скорая помощь».
Было далеко за полночь поздней летней ночью 2017 года, и у них было меньше восьми часов, чтобы доставить камеры на машине скорой помощи, частном самолете и другой машине скорой помощи из онкологического института Дана-Фарбер в Бостоне в медицинский центр Weill Cornell на Манхэттене. Если бы это заняло больше времени, клетки почти наверняка были бы DOA, как и план исследователей провести беспрецедентную в анналах медицины экспериментальную операцию по трансплантации: заменить дисфункциональные клетки мозга пациента с болезнью Паркинсона потомством необычного тип стволовой клетки.Созданные в лаборатории из кусочка собственной кожи пациента, эти клетки, как предполагалось, поселятся в мозге, как будто они принадлежат ему, и навсегда восстановят способность пациента нормально ходить и двигаться.
объявление
В случае успеха операция может навсегда изменить болезнь Паркинсона, превратив ее из неумолимого, жестокого, а иногда и фатального спада в — по крайней мере для некоторых пациентов — состояние, которое можно успешно вылечить.
Бин Сонг, биолог стволовых клеток из больницы Маклин под Бостоном, поднялся на лифте на 11-й этаж здания Даны-Фарбер по производству клеток.Там, после шести часов сбора и тестирования практически новорожденных клеток мозга, продуцирующих дофамин, техники поместили их в стерильные флаконы, осторожно поместили флаконы в холодильник размером с пикник, в котором температура должна была храниться на 4 градуса Цельсия, и передали его Сонгу. Она помчалась к поджидающей машине скорой помощи.
объявление
Водитель вылез из машины и направился в Хэнском Филд, расположенный в 20 милях, чтобы встретиться с нейрохирургом Массачусетской больницы общего профиля и биологом по стволовым клеткам Маклина Кван-Су Кимом, начальником Сонга, для полета на юг.Но по дороге они заблудились, из-за чего они отстали от графика еще до того, как сели в частный медицинский самолет. Кулер стоял на носилках.
Beechjet 400 приземлился в аэропорту Тетерборо, через реку Гудзон от Манхэттена. Исследователи погрузились в другую машину скорой помощи, водитель которой отказался включить сирену: это было нарушением закона штата, если только жизнь или здоровье пациента не подвергались опасности. Ким не могла убедить его в этом. Они проползли через пробки к мосту Джорджа Вашингтона и вниз по улице ФДР.
Они подъехали к подъездной дорожке Корнелла на два часа позже. Ким схватила холодильник и передала его ожидающему сотруднику Корнелла, который отнес его в камеру. Там техник загрузил в шприцы клетки мозга. Затем Ким увидела клетки: они образовали скопления, которые не выглядели терапевтическими. Если бы это был день самой операции, она была бы разрушительной.
Вот почему, подумала Ким, мы проводим тренировочные пробежки.
Месяц спустя, когда клетки, направлявшиеся из Бостона в Нью-Йорк, действительно должны были быть пересажены, казалось, что почти десятилетний проект Кима был проклят: он узнал, что Hanscom будет закрыт 1 сентября.5, день операции. Им пришлось уехать из более загруженного аэропорта Логан.
Но скорая помощь была подъехала в 5 утра и прибыла в Вейл Корнелл в 6:30. Техники осторожно засосали клетки в специальные шприцы, которые Сонг быстро доставила в хирургический кабинет, где ждали нейрохирург и пациент.
В конце 2018 года в новостях сообщалось, что в октябре того же года хирурги в Японии выполнили экспериментальную процедуру, которая была в списке желаний неврологов более десяти лет: трансплантация в мозг пациента с болезнью Паркинсона замещающих клеток, созданных из собственной кожи пациента. ячеек с использованием протокола, удостоенного Нобелевской премии.Согласно отчетам, это был первый случай.
Не было.
Слухи ходили внутри небольшого сообщества биологов стволовых клеток, которые надеялись вылечить болезнь Паркинсона, что это сделал кто-то, помимо японской группы. Но кто? И когда? Несмотря на безудержные слухи, никто не знал, что в сентябре 2017 года в Нью-Йорке хирурги провели первую такую операцию.
Это было, как сказал Джеймс Бек, главный научный сотрудник Фонда Паркинсона (который не участвовал в работе и не знал о ней), «где мы знали, что эта область должна развиваться.Он представляет собой потенциальное будущее болезни Паркинсона ».
Подробная информация об этой новаторской терапии будет впервые раскрыта в среду в медицинском журнале. Но вот уже почти два года STAT ведет хронику того, как это произошло. Это история, основанная на интервью с учеными, врачами и самим пациентом.
«Я готов профинансировать работу»
Не считая предложений увеличить пенис, это был самый очевидный спам, который он когда-либо видел, думал Кван Су Ким, просматривая свой почтовый ящик 2 мая 2013 года.Имя, о котором он никогда не слышал, было в электронном письме, в котором было много восхвалений, в котором он назвал исследование Кима в McLean, посвященное терапии болезни Паркинсона стволовыми клетками, «самым многообещающим», с которым он когда-либо сталкивался.
«Я готов профинансировать работу, — написал таинственный Джордж Лопес, — все, что нужно, чтобы продвинуться вдвое быстрее. … Я надеюсь, что эта работа принесет пользу. Если бы не я, человечество было бы лучше ».
Джордж Лопес, чей чек на 2 миллиона долларов профинансировал ранние эксперименты. Снимок экрана через YouTubeЛопес, как вскоре узнает Ким, сам был диагностирован болезнью Паркинсона почти десятью годами ранее.Однажды вечером, когда его жена была прикована к постели в их доме в южной Калифорнии с раком груди, унесшим ее жизнь, Лопес сказал ей, что у него тремор, отрывистая дрожь, когда его руки не двигались.
«Итак?» — спросила его жена, Диана Костира Лопес. «Я думаю, что у меня болезнь Паркинсона, — сказал Лопес. «У вас нет болезни Паркинсона», — пренебрежительно сказала она.
«Я почувствовал себя глупо из-за того, как она это сказала», — вспоминал Лопес в долгой дискуссии со STAT в 2018 году.«Это также заставило меня почувствовать себя лучше».
Однако вскоре невролог Кэролайн Нефф подтвердила его страшную догадку: у него болезнь Паркинсона.
По оценкам, 1 миллион человек в США это делают, и ежегодно диагностируется около 60 000 новых случаев. Хотя конечной причиной является малоизученная комбинация генетики и окружающей среды, непосредственным триггером является потеря нейронов среднего мозга, продуцирующих дофамин, которые располагаются в черной субстанции мозга и проецируются в дорсальное полосатое тело. Эта нейронная магистраль контролирует движение.Когда дофаминовые клетки умирают, пациенты страдают от тремора, скованности и затруднения при ходьбе. В худшем случае они вынуждены пользоваться инвалидной коляской и терять способность купаться, кормиться и иным образом заботиться о себе.
Его прогноз безрадостный. По словам Ким, нет лекарства и «нет лечения, которые могут замедлить или остановить процесс болезни».
Как хорошо знал Лопес. Когда-то он был терапевтом, но прекратил практику после того, как его пациент умер, когда случайно отключили капельницу — хотя он все еще говорит: «Позвони мне Док», когда вы впервые встречаетесь с ним.В 1984 году он основал ICU Medical в Сан-Клементе недалеко от своего дома. Компания производит медицинское оборудование, в том числе катетеры и системы для внутривенных вливаний, например те, которые используются для химиотерапии. Лопес изобрел «ClickLock», который удерживает компоненты IV на месте. Это предотвращает повторение того, что случилось с пациентом, которого он потерял. Он также изобрел «Диану» — устройство для безопасного смешивания сильнодействующих наркотиков. Он назвал его в честь своей жены, которая умерла в канун Рождества 2006 года в возрасте 67 лет.
Лопес всегда был активным спортсменом, ездил на велосипеде и плавал, а также выигрывал турниры по подводной охоте.С новым диагнозом «я впал в крайнюю депрессию», — сказал он. «Из всех людей, которые поражены болезнью Паркинсона, которая запирает вас в вашем теле, как заключенного, я чувствовал, что мне не следовало бы страдать от нее, если во вселенной есть какая-то справедливость. Но, конечно, нет ».
«Я не должен был огорчаться этим, если во вселенной есть какая-то справедливость. Но, конечно, нет ».
Джордж Лопес: у него диагностирована болезнь Паркинсона
Лопес начал принимать стандартные лекарства от болезни Паркинсона, такие как карбидопа, леводопа и ротиготин, которые заменяют дофамин, вырабатываемый самовольной волей мозга.Но со временем лекарства перестают действовать. Ухудшается тремор и ухудшается способность ходить. К 2013 году Лопес знал, что приближается к этой точке.
«Больше не быть пассивным пациентом», — решил он. Сначала как врач, а затем как бизнесмен, Лопес сказал: «Я всегда принимал вызовы лицом к лицу и с командой». Его невролог сказал ему, что лучший шанс на излечение — это стволовые клетки. У нее случайно оказался флаер на «Саммит стволовых клеток», который состоится в апреле в Бостоне. Судя по списку выступающих и их загадочным титулам, «это не похоже на что-то для слабонервных», — сказал Лопес.Тем не менее, он выложил регистрационный взнос в размере 3000 долларов и улетел на восток.
Среди множества почти непонятных технических презентаций выделялась одна: Kim’s. Ученый Маклин описал создание из клеток кожи пациентов дофаминовых нейронов среднего мозга, которые погибают при болезни Паркинсона. «Я думал, что там что-то было», — сказал Лопес. Он пытался найти Ким во время перерыва, но ученый исчез.
Ким помчался обратно в Маклин, где он является директором лаборатории молекулярной нейробиологии.Он не заканчивал решающий эксперимент; он обрабатывал заявки на финансирование. После нескольких лет получения пяти грантов Национального института здравоохранения на общую сумму 1,1 миллиона долларов в 2011 и 2012 годах на разработку индивидуальных клеток мозга для лечения болезни Паркинсона, проблемы с бюджетом NIH сократили его до одного, на 335 тысяч долларов.
Он был подавлен по поводу увольнения сотрудников лаборатории, особенно когда он чувствовал себя ближе, чем когда-либо, к достижению своей цели.
«Произошла катастрофа»
Первые трансплантации дофаминовых нейронов в мозг пациентов с болезнью Паркинсона произошли в конце 1980-х годов.Хирурги использовали нейроны мозга абортированных плодов, по 16 плодов на пациента. Однако многие врачи сочли это неэтичным, и, хотя десятки пациентов с болезнью Паркинсона получили трансплантаты плода, никогда не было ясно, насколько они полезны и требуется ли длительная иммуносупрессия для предотвращения отторжения чужеродных клеток. В любом случае казалось, что большинство пересаженных клеток погибло.
Как и многие другие биологи стволовых клеток, Ким считал, что источником стволовых клеток должны быть не плоды и не эмбриональные стволовые клетки, а собственные клетки пациента.В 2009 году он опубликовал получившую высокую оценку работу, в которой описал, как безопасно превратить взрослые фибробласты — соединительные клетки кожи — в индуцированные плюрипотентные стволовые клетки. Такие «iPS-клетки» почти подобны эмбрионам по своей способности трансформироваться в любые специализированные клетки организма — мышцы, сердце, печень, мозг и многое другое.
РецептКим был сделанной на заказ версией рецепта, который, по сути, помещает взрослые клетки в «Назад в будущее» Делориана. И как только они отправились в прошлое, говоря с точки зрения развития, все, что потребовалось, — это небольшая поддержка (в виде питательных веществ и других биохимических веществ), чтобы заставить эти iPS-клетки превратиться в любые специализированные клетки организма, такие как нейроны мозга, которые производят нейромедиатор дофамин.
Первоначальная методология iPS-клеток, которая принесла изобретателю Шинья Яманака Нобелевскую премию 2012 года, использовала стандартный лабораторный вирус для переноса квартета «репрограммирующих генов» в фибробласты. Ким чувствовал, что он значительно продвинулся в работе Яманаки. Некоторые ученые опасались, что гены могут оказаться в неправильных местах хромосом клетки и непреднамеренно деактивировать гены-супрессоры опухоли или активировать гены, вызывающие рак. «Это могло бы стать катастрофой, если бы клетки использовались в терапевтических целях», — сказал Ким.Он решил, что вирусы должны исчезнуть.
После многих лет проб и ошибок он сообщил в статье 2009 года, что он произвел четыре фактора Яманака в бактериях E. coli, очистил их и присоединил к небольшой молекуле. Эта молекула, пептид, проникала в клетки, как некая деревянная лошадь, несущая Одиссея, Аякса и их команду через стены Трои.
Другие эксперты по стволовым клеткам считали, что препарат Кима — это решение в поисках проблемы. Его заявление о том, что его рецепт безопаснее, чем использование вируса, «какое-то время меня раздражало», — сказала биолог по стволовым клеткам Жанна Лоринг из Исследовательского института Скриппса.Спустя годы, в исследовании 2016 года, она и ее коллеги пришли к выводу, что метод Яманака «не вызывает мутаций, как утверждала Ким», — сказала она.
Несмотря на сомнения, Ким продолжала. Но когда он попытался увеличить производство iPS-клеток, он смог заставить E. coli вырабатывать только два из четырех факторов Яманака. «Это был полный тупик, — сказал Ким. «После статьи [2009 г.] я получил сотни писем, в которых говорилось:« О, вы решили проблему! »О производстве iPS-клеток без вирусов. «Но я не мог сделать это достаточно эффективным.Это была катастрофа.»
Для того, чтобы этот процесс работал в промышленных масштабах, потребовалась бы лаборатория промышленного размера и батальон технических специалистов. У Ким не было ни того, ни другого.
Вот когда он получил электронное письмо Лопеса.
После того, как Ким рефлекторно отклонил это как шутку, передумал. Этот парень потратил тысячи долларов на встречу по стволовым клеткам. Может, это не розыгрыш.
На следующий день Ким ответила, поблагодарив Лопеса за проявленный интерес. Они решили встретиться в МакЛине, где Лопес снова спросила Ким, что нужно сделать, чтобы провести исследование на пациентах раньше.«1 миллион долларов или 2 миллиона долларов, — сказала Ким.
По сей день Лопес не знает, вытащила ли Ким цифры из воздуха. (Ким говорит, что сделал быструю оценку.) Но он вытащил свою чековую книжку и выписал Маклину чек на 2 миллиона долларов. Ким думала, что он подпрыгнет. Это не так.
Благодаря финансированию Лопеса Ким нанял дополнительных лаборантов и ускорил свои эксперименты. Один за другим он и его команда преодолели препятствия, которые не позволяли его рецепту iPS-ячейки расширяться. (Ким получил несколько патентов на свои работы.Важно отметить, что стволовые клетки легко превратились в дофаминовые нейроны среднего мозга, которые Ким — а теперь и Лопес — надеялись вылечить болезнь Паркинсона.
Ким знала, что потребуются десятки миллионов дофаминовых нейронов, чтобы помолиться о помощи пациенту с болезнью Паркинсона. Рецепт превращения недифференцированных iPS-клеток в дофаминовые нейроны был несовершенным, что создавало проблему: оставшиеся iPS-клетки могут засеивать опухоли.
«Даже после двух или трех недель дифференцировки могут оставаться недифференцированные клетки», — сказал Ким.Если он превратит 99,9% iPS-клеток в дофаминовые нейроны, останется 10 000 iPS-клеток. Если набрать 99,99%, останется 1000. Насколько эффективно было достаточно эффективно? «Мы поняли, что нам нужно удалить их все», — сказала Ким.
Это означало поиск убийцы. Ким и его коллеги из Южной Кореи изучили базу данных соединений в поисках любых, которые нацелены на ген, называемый сурвивином, которого много в iPS-клетках. У них появился хит: кверцетин. Тестируя китайское травяное соединение на своих iPS-клетках, Ким обнаружил, что «если вы обрабатываете клетки один раз в течение 12 часов, пока они дифференцируются, кверцетин полностью удаляет недифференцированные клетки.”
Пора было задуматься о том, чтобы поместить клетки в чей-то мозг.
Стволовые клетки (слева), полученные из клеток кожи взрослых, выращивают в лабораторных чашках, превращаясь в дофаминовые нейроны (справа), подобные тем, которые используются для трансплантации. Больница Маклина«Кто ты ?!»
Лопес говорит, что финансировал исследование Кима, не планируя, что он станет первым пациентом, хотя его первоначальное электронное письмо Ким показывает, что он, тем не менее, надеялся стать первым. «Я сомневался, что он сможет действовать достаточно быстро, чтобы принести мне пользу», — сказал он.Это должно было измениться.
Успехи Ким заставили Лопес решить, что пора позвонить. Кто, как он спросил своего невролога в конце 2014 года, является лучшим нейрохирургом из известных вам? — Доктор Джеффри Швейцер, — ответила Нефф.
Лопес достиг Швейцера в его клинике в Сан-Диего, когда он был с пациентом. Швейцер услышал незнакомый голос: «Хотели бы вы, чтобы вас называли нейрохирургом, вылечившим болезнь Паркинсона?» — спросил мужчина.
«Кто ты ?!» Швейцер ответил. Лопес представился, и Швейцер пообещал перезвонить через пару дней.
ТелефонЛопес зазвонил 20 минут спустя.
Услышав подробное описание того, что собирал Лопес (Швейцер уже знал работу Ким), нейрохирург сказал: «Я здесь».
Ким продолжал создавать стволовые клетки, проверять их на мутации и превращать в дофаминовые нейроны. Он ввел их в мозг более 100 крыс, чьи собственные вырабатывающие дофамин клетки были уничтожены нейротоксином. К 2016 году, по словам Ким, эти эксперименты «показали, что трансплантированные клетки функционируют», что позволяет лечить симптомы болезни Паркинсона у крыс.
Успехи Кима вселили в Лопес надежду. Однако он угасал. Последний раз он занимался подводной охотой (когда-то он установил мировой рекорд по самому большому синему марлину) в 2009 году. Он отложил свой горный велосипед. В 2014 году он ушел с поста председателя и генерального директора ICU Medical. К 2016 году его боль была почти постоянной. Он изо всех сил пытался подняться со стула.
«Хотели бы вы, чтобы вас называли нейрохирургом, вылечившим болезнь Паркинсона?»
Джордж Лопес по телефону нейрохирурга Джеффри Швейцера
Тем временем собралась бригада медиков.Швейцер был на борту, чтобы сделать операцию вместе с нейрохирургом Бобом Картером из Калифорнийского университета в Сан-Диего. Когда Картер в 2017 году переехал в Массачусетс, он нанял невролога Тодда Херрингтона. Швейцер вскоре переехал через всю страну, чтобы присоединиться к ним в бостонской больнице.
Они обсуждали операцию в стране со слабыми медицинскими правилами. Они обсуждали, что сказать Управлению по контролю за продуктами и лекарствами. Они поговорили с юристами. Они наняли (на деньги Лопеса) бывшего заместителя директора FDA по регулированию, чтобы тот проконсультировал их; он сказал, что то, что они предлагали, займет пять лет и 5 миллионов долларов только на то, чтобы собрать документы и собрать достаточно данных, среди прочего, о качестве и характеристиках клеток, которые они предложили пересадить.
И затем команда совершила прорыв, который казался таким же чудесным, как и все, что они делали в лаборатории. В январе 2017 года FDA подписало представленный им протокол «милосердного использования» на 2500 страницах, положив зеленый свет на эксперимент с одним пациентом.
К тому времени у них был доброволец. Швейцер и другие врачи, которые обследовали Лопеса, пришли к выводу, что он был хорошим кандидатом для операции, и Лопес был допущен к получению вырабатывающих дофамин клеток мозга, которые Ким создал из своих клеток фибробластов.Имея медицинское образование, Лопес понимал потенциальные риски терапии, Ким объяснил: «Он хотел быть первым пациентом».
Вроде бы все поставили. Но было еще одно препятствие.
Швейцер, который подозревал, что неуклюжие инструменты были одной из причин неудач при трансплантации эмбриональных клеток при болезни Паркинсона, разработал новое устройство, чтобы избежать этой проблемы.
«Невозможно телепортировать клетки в мозг», — сказал Швейцер. Вам понадобится игла, которая доставит клетки в определенное место, не сдавливая их.Тем не менее, в некоторых предыдущих методах клеточной терапии «более 90% клеток умирали вскоре после трансплантации», сказал Швейцер, вероятно, потому, что иглы вонзили клетки в мозг как один большой шар. Это не давало клеткам доступа к кислороду или питательным веществам.
ПоэтомуSchweitzer разработал шприц с моторным приводом, чтобы «не дать клеткам вылететь из нижней части иглы» одной каплей, объяснил он, и вместо этого откладывать их «по мере вытягивания иглы». Он работал с производителем над созданием готового шприца, который выдавал бы 2 микролитра клеток в минуту в тракт, образовавшийся при входе иглы.Когда они попробовали его на мозге крысы и свиньи, шприц оставил после себя красивую линию клеток с доступом к питательным веществам и кислороду.
Была только одна проблема. Устройство, которое вводило иглу в череп пациента, не подходило к устройствам визуализации в MGH. Больница могла бы купить новое оборудование, но на то, чтобы обучить этому кого-нибудь, потребовались бы месяцы. Или же команда могла бы попросить FDA разрешить использование стандартной иглы вместо иглы Швейцера, но это также заняло бы месяцы бумажной работы.У Кима было лучшее решение: он позвонил своему бывшему коллеге из Weill Cornell, у которого было необходимое оборудование, и он был готов позволить хирургам сделать трансплантацию клеток мозга Лопесу там.
Это означало, что для доставки ячеек Лопеса с производственной площадки в Дана-Фарбер потребовался бы воздушный подъем. Вот почему Ким и его коллеги совершили пробную поездку от Дана-Фарбер до Корнелла и 5 сентября 2017 года сделали это по-настоящему.
Биолог Кван Су Ким из больницы Маклин, который разработал новый способ получения эмбрионоподобных стволовых клеток из клеток кожи взрослых. Больница МаклинаВ то утро группа хирургов установила МРТ и КТ-изображения мозга Лопеса на рабочей станции, чтобы управлять «нейронавигацией». Когда Лопес находился в состоянии наркозного сна, его голова была обездвижена в стереотаксической рамке Leksell, вошел нейрохирург Корнелла Майкл Каплитт: Швейцер стоял через его плечо, а остальная часть команды Лопеса наблюдала из-за угла, он просверлил череп Лопеса примерно дюйм позади линии роста волос и на полдюйма левее центра мозга.Это было место, которое могло бы сэкономить важные участки коры.
Схватив первый из трех шприцев, предварительно загруженных в общей сложности 4 миллионами дофаминовых клеток, Каплитт медленно протолкнул его в скорлупу, область, вовлеченную в движение. Затем, вытащив его, он осторожно отпустил поршень, чтобы шприц оставил после себя крошечный след клеток — именно такую красивую линию, на которую рассчитывал Швейцер.
Прогулка до Таймс-сквер
Лопес едва успокоился на своей больничной койке после четырехчасовой операции, как почувствовал, как его мускулы укрепляются, а дрожь уходит.Он угрожал схватиться на руках хирургу, который пришел проверить его. И он сказал своему личному помощнику, что хотел бы убраться из больницы и прогуляться. «Я сказал, что это то, что значит быть нормальным», — вспоминает Лопес.
Лопес, его сын и помощник прошли 2 мили до Таймс-сквер под почти безоблачным небом с приятными 70 градусами и лишь легким ветром, трепещущим навесы вдоль Бродвея. У Лопеса были свои новые нейроны, производящие дофамин, всего несколько часов, но уже казалось, что Лурдес проскользнул через червоточину в пространственно-временном континууме и приземлился на Манхэттене.
Это было описание такого рода, которое заставляло его врачей извиваться. Год спустя, когда Лопес и его врачи рассказали эту сагу, Картер вернул суть дискуссии в реальность. Он не оспаривал, что Лопес чувствовал себя и двигался намного лучше сразу после клеточных имплантатов. Но это не означало, что они работали.
Во-первых, простое копание в полосатом теле мозга может высвободить дофамин. Это могло бы облегчить симптомы Паркинсона в краткосрочной перспективе. С другой стороны, воткнув иглы в мозг, можно убить клетки, а клетки в агонии (даже пересаженные нейроны) часто высвобождают весь свой дофамин за одну большую отрыжку; снова симптомы временно исчезают.Наконец, при болезни Паркинсона очень сильны эффекты ожидания: ожидаемое улучшение может высвобождать дофамин.
«Мы и раньше видели такого рода немедленное« я чувствую себя лучше », — сказал Картер, который сейчас возглавляет нейрохирургию в Массачусетсе. Клеткам-предшественникам дофаминовых нейронов, таким как те, которые получил Лопес, требуется гораздо больше времени, порядка месяцев, чтобы сформировать синапсы с существующими нейронами и тем самым начать восстанавливать утраченные двигательные функции.
Повышенный уровень дофамина у Лопеса и ощущение, что его мозг и тело — это их «я» до болезни Паркинсона, длились два дня.Потом он «вернулся к исходному уровню»: не хуже, но не лучше. Тем не менее, по его словам, «мы остановили ухудшение состояния. Они дали мне еще один шанс на жизнь ». Без клеточных имплантатов, сказал Лопес, «я думаю, что сейчас был бы мертв».
По настоянию FDA процедура в Корнелле вводила клетки только в левую часть мозга Лопеса: агентство заявило, что если дела пойдут плохо, было бы вдвое хуже, если бы Лопес имел клеточные имплантаты с обеих сторон его мозга. «Я не согласился, — сказал Лопес. «Я должен был сделать обе стороны» сразу.По его словам, потребовав двух операций, FDA «удвоило риск и стоимость».
Но первая процедура, похоже, не причинила вреда: ни инфекции, ни опухолей, ни кровотечений, ни ухудшения симптомов. 6 марта 2018 года еще одна партия дофаминовых клеток, изготовленных из клеток кожи Лопеса, совершила 20-минутное путешествие из Дана-Фарбер не в Манхэттен, а в Массачусетс, который теперь был оборудован для проведения операции. Швейцер пересадил их на правую сторону скорлупы Лопеса.
На этот раз у Лопеса не было лурдезианского опыта.Никто не совсем уверен, почему, но возможно, что более свежие клетки (не многочасовая поездка на Манхэттен) не дают мозгу быстрого выброса дофамина. Но они могут образовывать устойчивые синапсы. В итоге.
Принимая во внимание все, что могло пойти не так, Картер говорит, что Лопес отважился провести экспериментальные операции для этого пилотного исследования. «Не думаю, что я храбрый», — сказал Лопес STAT, добавив с улыбкой: «Хотя это правда, мы не знали, взорвется ли моя голова».
Лопес сказал, что никогда не намеревался стать звездой этой истории.Его чек на 2 миллиона долларов, выписанный Маклину, должен был ускорить исследования Кима, а не поставить его в очередь на экспериментальное лечение. Финансовая поддержка «не была обусловлена его терпением», — сказал Картер.
Медицинские и научные группы, такие как Международное общество исследования стволовых клеток, предостерегают от схем «плати за игру», при которых состоятельные люди покупают свое участие в клинических испытаниях. Но жестких запретов мало, и в случае с Лопес советы по этике в Mass.Дженерал и Корнелл одобрили операции.
«Спасти одну жизнь»
После операции 2018 года Лопес регулярно проходил сканирование мозга в поисках любых признаков опухолей, а также подсказок о том, что делают пересаженные клетки. Специальная версия ПЭТ-визуализации предполагает, что в тех областях, где Каплитт, а затем Швейцер выделили 4 миллиона клеток, они производят дофамин (согласно сканированию, проводимому каждые несколько месяцев, последний раз в марте) и, по-видимому, «прижились» или установили долгосрочные связи с другими нейронами, в том числе, что особенно важно, в двигательных областях.
Данные за 18 месяцев «были минимумом, который, как мы думали, нам нужен, чтобы получить представление о долгосрочной траектории Дока», — сказал Херрингтон, невролог общего профиля в Массачусетсе. С чем-то меньшим было бы трудно исключить, что какое-либо улучшение было связано с эффектом плацебо.
Биомаркер болезни Паркинсона отсутствует. Единственный способ оценить влияние терапии — это тесты на ригидность и тремор, а также более тонкие подсказки, такие как сила голоса и способность говорить.
«Док продемонстрировал ряд функциональных улучшений, с которыми трудно поспорить», — сказал Херрингтон в сентябре 2018 года.Лопес перестал носить туфли на шнурках — его пальцы не могли их связать, — но к моменту того разговора они смогли это сделать. Он занимается фридайвингом, что требует силы и контроля осанки. В конце прошлого года 69-летний Лопес прислал своей медицинской бригаде видео, на котором он плывет по бассейну, от чего он отказался, опасаясь утонуть.
На этой неделе исследователи опубликуют результаты своего пилотного исследования в научном издании. Они отказались поделиться этим видео или другими изображениями Лопес до публикации статьи, но подчеркнули, что, в лучшем случае, трансплантаты демонстрируют умеренную эффективность.Лопес по-прежнему принимает почти столько же лекарств от Паркинсона, сколько и раньше.
«Мы не вылечили его от болезни Паркинсона», — сказал Картер. «Мне нравится думать, что мы стабилизировали его».
Об улучшении симптомов и улучшении качества жизни сообщают сами пациенты. Это может отражать не только эффект плацебо, но и уникальную роль Лопес. «Он потратил на это много денег, — сказал Бек из Фонда Паркинсона. «Он хотел, чтобы это сработало», что отчасти может быть самореализом.
В конечном счете, только тщательное клиническое исследование может показать, помогла ли терапия стволовыми клетками.Исследователи встретились с официальными лицами FDA по поводу его запуска.
Даже если через много лет терапия оправдает себя, Бек предлагает проверку реальности: «Проведение трансплантации iPS-клеток каждому пациенту с болезнью Паркинсона, — сказал он, — будет стоить целое состояние».
«Во многом это сводится к расширению масштабов и тому, как сделать трансплантацию клеток полезной для самых разных пациентов», — согласился Брайан Фиск, вице-президент по исследованиям Фонда Майкла Дж.


 Пинг-понг улучшает координацию, обостряет рефлексы и стимулирует работу мозга. По мнению японских учёных, занятия настольным теннисом — недорогой метод терапии, который может уменьшить некоторые симптомы и улучшить прогноз болезни Паркинсона.
Пинг-понг улучшает координацию, обостряет рефлексы и стимулирует работу мозга. По мнению японских учёных, занятия настольным теннисом — недорогой метод терапии, который может уменьшить некоторые симптомы и улучшить прогноз болезни Паркинсона.
