что это такое, для чего нужны
Онлайн-диагностика
КОЖИ ЗА 1 МИНУТУ
Пройдите онлайн-диагностику кожи
и узнайте программу ухода SkinCeuticals,
подходящую именно Вам.
Задать вопрос
эксперту
Задайте интересующий Вас
вопрос и получите ответ
от экспертов SkinCeuticals.
Что такое антиоксиданты?
Антиоксидантами называют вещества, нейтрализующие атаки свободных радикалов — неустойчивых молекул, которые
проникают в организм извне, в первую очередь из загрязненного воздуха.
Слишком активными свободные радикалы делает неспаренный электрон. Они «цепляются» им за другие молекулы, присоединяя недостающий и запуская тем самым в клетках окислительные реакции.
Конечно, организм имеет свою систему антиоксидантной защиты. Но со временем она ослабевает, клетки повреждаются, в них накапливаются нарушения. Тогда на помощь приходят антиоксиданты в составе продуктов питания, витаминов, БАД и косметики.
Для чего антиоксиданты нужны человеку?
Роль антиоксидантов в нашей жизни невозможно переоценить. Они помогают ограничить агрессию свободных радикалов и возместить нанесенный ими ущерб. По некоторым данным, их эффективность составляет 99%.
Вот чем занимаются антиоксиданты.
- •Противостоят свободным радикалом, прерывая губительный процесс окисления.

- •Укрепляют собственную антиоксидантную систему организма.
- •Предотвращают разложение продуктов микробами и бактериями, благодаря чему могут использоваться в качестве консервантов.
- •Смягчают вредное воздействие ультрафиолета.
- •Способствуют восстановлению обмена веществ.
Какие разновидности антиоксидантов существуют?
Антиоксиданты могут иметь природное происхождение и поступать в организм из продуктов питания (в первую очередь овощей и фруктов), а также из растительных экстрактов.
Их могут получать и путем химического синтеза. Это, например:
- •большинство витаминов;
Химическое происхождение не является недостатком. Напротив, это позволяет создать наиболее активную форму вещества,
добиться максимальной концентрации.
Самыми активными борцами со свободными радикалами считаются:
- •витамины А, С и Е, некоторые исследователи причисляют к ним и витамины группы В;
- •ненасыщенные жирные кислоты Омега-3 и -6;
- •супероксидисмутаза;
- •ресвератрол;
- •коэнзим Q10;
- •экстракты зеленого чая, сосновой коры, гинкго билоба;
- •молочная сыворотка.
Богатая антиоксидантами диета — то, что надо для продления молодости и красоты. Разберемся, в каких продуктах они содержатся.
Антиоксиданты в питании
Антиоксиданты |
Продукты питания |
Витамин С |
цитрусовые, плоды шиповника, красный сладкий перец (паприка), шпинат, свежие чайные листья |
Витамин А |
сливочное масло, рыбий жир, молоко, яичный желток, печень рыб и животных, икра |
Провитамин А (бета-каротин) |
шпинат, морковь, свекла, тыква, абрикосы, персики, красный перец, томаты |
Витамин Е (токоферол) |
семена злаков, растительные масла (соевое, кукурузное, хлопковое), яичный желток, овощи, бобовые, масло зародышей пшеницы |
Витамин В2 (рибофлавин) |
молоко, мясо, яичный желток, бобовые, дрожжи |
Витамин В5 (пантотеновая кислота) |
печень, арахис, шампиньоны, чечевица, куриные яйца, горох, лук, капуста, овсяные хлопья |
Витамин В6 |
лосось, сардины, семена подсолнечника, сладкий стручковый перец, хлеб с отрубями, проростки пшеницы |
Омега-3 |
рыба (лосось, тунец, сардины, палтус, горбуша), рыбий жир, морепродукты |
Омега-6 |
растительные масла, орехи, кунжут, семена тыквы |
Коэнзим Q10 |
говядина, сельдь, курица, семена кунжута, арахис, брокколи |
Ресвератрол |
кожура черных сортов винограда, красное вино |
Антиоксиданты содержатся практически во всех средствах против старения кожи.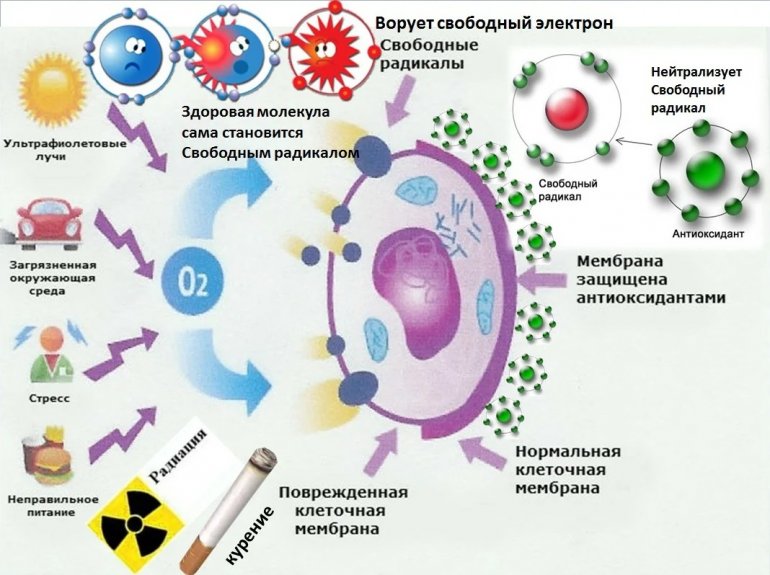 Но одного их присутствия недостаточно.
По мнению консультанта марки SkinCeuticals Елены Лыковой, их действие можно принимать в расчет при таких условиях.
Но одного их присутствия недостаточно.
По мнению консультанта марки SkinCeuticals Елены Лыковой, их действие можно принимать в расчет при таких условиях.
- 1) Они входят в активную и стабильную рабочую формулу.
- 2) Присутствуют в средстве в нужной концентрации.
- 3) Проникают достаточно глубоко в кожу.
- 4) Работают в ней необходимое время.
Высокоэффективная антиоксидантная сыворотка для сухой и нормальной кожи CЕ Ferulic
Комплекс чистой L-аскорбиновой кислоты, альфа-токоферола и феруловой кислоты обезвреживает свободные радикалы. Итог — повышение упругости кожи за счет стимуляции синтеза коллагена, сокращение морщин, осветление пигментных пятен. Кроме того, кожа быстрее восстанавливается после лазерных процедур. 4–5 капель средства наносите утром на очищенную кожу.
Сыворотка в геле Phloretin CF Gel
Это средство отличается максимальной глубиной проникновения, подходит женщинам и мужчинам.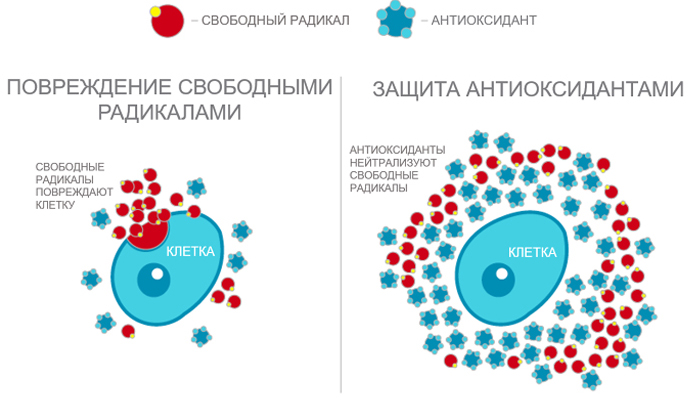 С признаками старения
— морщинами, пигментными пятнами – борются L-аскорбиновая (10%) и феруловая кислоты, флоретин. Вниманию
мужчин: попробуйте нанести на кожу после бритья. Требуется 2–3 капли.
С признаками старения
— морщинами, пигментными пятнами – борются L-аскорбиновая (10%) и феруловая кислоты, флоретин. Вниманию
мужчин: попробуйте нанести на кожу после бритья. Требуется 2–3 капли.
Ночной антиоксидантный уход Resveratrol BE
Помогает собственной антиоксидантной системе организма работать как в молодости. Со свободными радикалами успешно сражаются антиоксиданты ресвератрол, байкалин и альфа-токоферол, укрепляя внутреннюю защиту. Средство подходит мужской коже.
Высокоэффективная антиоксидантная сыворотка для всех типов кожи Serum 10
Формула из чистой L-аскорбиновой и феруловой кислот нейтрализует свободные радикалы, защищает от ультрафиолета. В
результате увеличивается выработка коллагена, разглаживаются мелкие и глубокие морщины, бледнеют пигментные пятна.
Помогает восстановить кожу после косметологических процедур.
Антиоксидантная сыворотка для жирной и нормальной кожи Phloretin CF
Борется с негативным воздействием солнечного излучения и плохой экологии, корректирует признаки старения: морщины, тусклость кожи, пигментацию. На эффект работают два сильных антиоксиданта — L-аскорбиновая и феруловая кислоты. Продлевает эффект косметических процедур. Подходит мужской коже.
Антиоксидантный гель для кожи вокруг глаз Aox+ Eye GelУменьшает проявления старения нежной кожи вокруг глаз: припухлости, темные круги, «гусиные лапки». Придает коже природное сияние, свежий вид. Глубине проникновения способствует необычная текстура — сыворотка в геле. Содержит L-аскорбиновую и феруловую кислоты, флоретин.
Источник: skin.ru
Антиоксиданты: что это такое и зачем их едят
Кислород потребляют особые органеллы клеток — митохондрии. Они вырабатывают из него молекулы аденозинтрифосфата, служащего источником энергии для организма. Там же, в митохондриях, образуются — как побочный продукт — активные формы кислорода (АФК). У них есть неспаренный электрон, поэтому они очень агрессивно ищут, с кем бы вступить в реакцию. Избыток АФК способен буквально убить клетку (ученые называют это окислительным стрессом). АФК способствуют старению, развитию атеросклероза и связанных с ним сердечно-сосудистых заболеваний, ревматоидного артрита, катаракты, некоторых видов онкологии. Чтобы не впасть в окислительный стресс, организм в процессе эволюции изобрел антиоксидантную защиту, нейтрализующую АФК. Кроме того, кислородные радикалы задействованы в борьбе с чужеродными инфекциями, атакующими организм, работают как посредники в межклеточной и внутриклеточной коммуникации, помогают избавляться от различных продуктов метаболизма и ксенобиотиков.
Они вырабатывают из него молекулы аденозинтрифосфата, служащего источником энергии для организма. Там же, в митохондриях, образуются — как побочный продукт — активные формы кислорода (АФК). У них есть неспаренный электрон, поэтому они очень агрессивно ищут, с кем бы вступить в реакцию. Избыток АФК способен буквально убить клетку (ученые называют это окислительным стрессом). АФК способствуют старению, развитию атеросклероза и связанных с ним сердечно-сосудистых заболеваний, ревматоидного артрита, катаракты, некоторых видов онкологии. Чтобы не впасть в окислительный стресс, организм в процессе эволюции изобрел антиоксидантную защиту, нейтрализующую АФК. Кроме того, кислородные радикалы задействованы в борьбе с чужеродными инфекциями, атакующими организм, работают как посредники в межклеточной и внутриклеточной коммуникации, помогают избавляться от различных продуктов метаболизма и ксенобиотиков.
«Антиоксидантная защита образована низкомолекулярными соединениями, реагирующими с АФК как в водной фазе клеток, так и в мембранах. Главным низкомолекулярным антиоксидантом считается глутатион. Кроме того, это витамины группы Е (токоферолы), убихинон, витамины группы А (ретинолы) и провитамины группы А (α-, β-, γ-каротины), витамины группы D (кальциферолы), К (филохиноны и менахинон), липоевая кислота, некоторые стероидные гормоны, мелатонин, соединения, содержащие тиольные и селеногруппы. Избыток АФК устраняется также рядом эффективных ферментов: супероксиддисмутазой, каталазой, глутатионредуктазой», — говорит Корыстов.
Главным низкомолекулярным антиоксидантом считается глутатион. Кроме того, это витамины группы Е (токоферолы), убихинон, витамины группы А (ретинолы) и провитамины группы А (α-, β-, γ-каротины), витамины группы D (кальциферолы), К (филохиноны и менахинон), липоевая кислота, некоторые стероидные гормоны, мелатонин, соединения, содержащие тиольные и селеногруппы. Избыток АФК устраняется также рядом эффективных ферментов: супероксиддисмутазой, каталазой, глутатионредуктазой», — говорит Корыстов.
Как снять окислительный стресс
В принципе, здоровой клетке в нормальных условиях окислительный стресс не грозит. Риск возрастает, если человек болен, например, диабетом. Или подвергся облучению, даже ультрафиолетовому, просто загорая на солнце. Или надышался воздухом, загрязненным озоном, автомобильными выхлопами, промышленными выбросами. Собственная антиоксидантная защита организма может не справиться, и потребуется помощь извне.
Антиоксиданты для защиты организма от действия свободных радикалов
Окислительные процессы в организме
Окислительным стрессом (оксидативным стрессом) называется процесс повреждения клетки в результате окисления.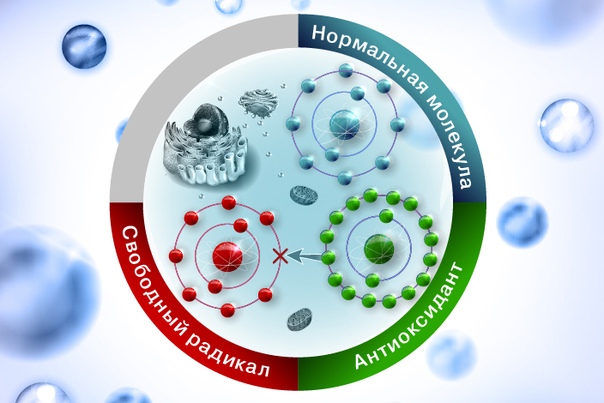
В процессе жизнедеятельности любого организма в клетках и межклеточном пространстве происходит один из самых универсальных процессов – образование свободных радикалов. Они составляют особый класс химических веществ, различных по своему атомарному составу, но характеризующихся наличием в молекуле непарного электрона. Свободные радикалы – это вещества, являющиеся непременными спутниками кислорода и обладающие высокой химической активностью.
Их действие специалисты рассматривают как звено в метаболизме клетки, необходимое при иммунных реакциях, окислительном фосфорилировании (получении энергии в виде АТФ при клеточном дыхании), биосинтезе простагландинов и нуклеиновых кислот. У человека же оксидативный стресс является основной причиной либо важной составляющей многих серьезных заболеваний, таких как атеросклероз, гипертензия, диабет. Но самое серьезное влияние оксидативного стресса на организм – его непосредственное участие в процессе старения организма.
Однако в некоторых случаях оксидативный стресс совершенно необходим человеку как защитный механизм, так как иммунная система организма «использует» оксидативный стресс для борьбы с патогенами (факторами внешней среды, способными вызвать повреждение каких-либо систем организма или развитие заболеваний).
Как образуются свободные радикалы
Свободные радикалы представляют собой активные неустойчивые частицы, образующиеся в ходе процессов естественного метаболизма клеток. Их образованию способствуют многие процессы, сопровождающие жизнедеятельность организма: стрессы, экзогенные и эндогенные интоксикации, влияние техногенных загрязнений окружающей среды и излучения. Легкость образования свободных радикалов связана с уникальными свойствами молекул кислорода. В химических соединениях атомы кислорода двухвалентны (иллюстрацией этого является молекула воды). Однако в молекуле кислорода оба атома соединены только одинарной связью, а остающийся на каждом атоме кислорода один электрон свободен. И когда их валентности направлены в разные стороны, образуется очень опасный для биологических субстанций нестабильный токсичный кислород.
Опасность оксидативного стресса
По данным некоторых авторов, деятельность свободных радикалов способствует появлению и развитию более 100 различных заболеваний. Патологическое действие свободных радикалов связано, прежде всего, с их влиянием на клеточные мембраны.
Патологическое действие свободных радикалов связано, прежде всего, с их влиянием на клеточные мембраны.
Это приводит к тому, что начинается разрушительная цепная реакция, которая губительно действует на живые клетки. В результате организм начинает преждевременно СТАРЕТЬ, начинаются патологические изменения, которые могут стать причиной рака, сердечно-сосудистых заболеваний, диабета, ослабления зрения, памяти. Ученые предполагают, что начальной стадией многих заболеваний – от простого кашля до онкозаболевания – является именно большое количество свободных радикалов в организме.
Мишени свободных радикалов – клетки, их составляющие или даже целые органы. Так, чаще всего воздействию свободных радикалов подвергается ДНК-кислота, обеспечивающая хранение и передачу генетической программы. Подсчитано, что ДНК подвергается их нападению до 10 000 раз в день. С повреждением структур ДНК свободными радикалами связывают в настоящее время такие болезни, как рак, артрозы, инфаркт, ослабление иммунной системы.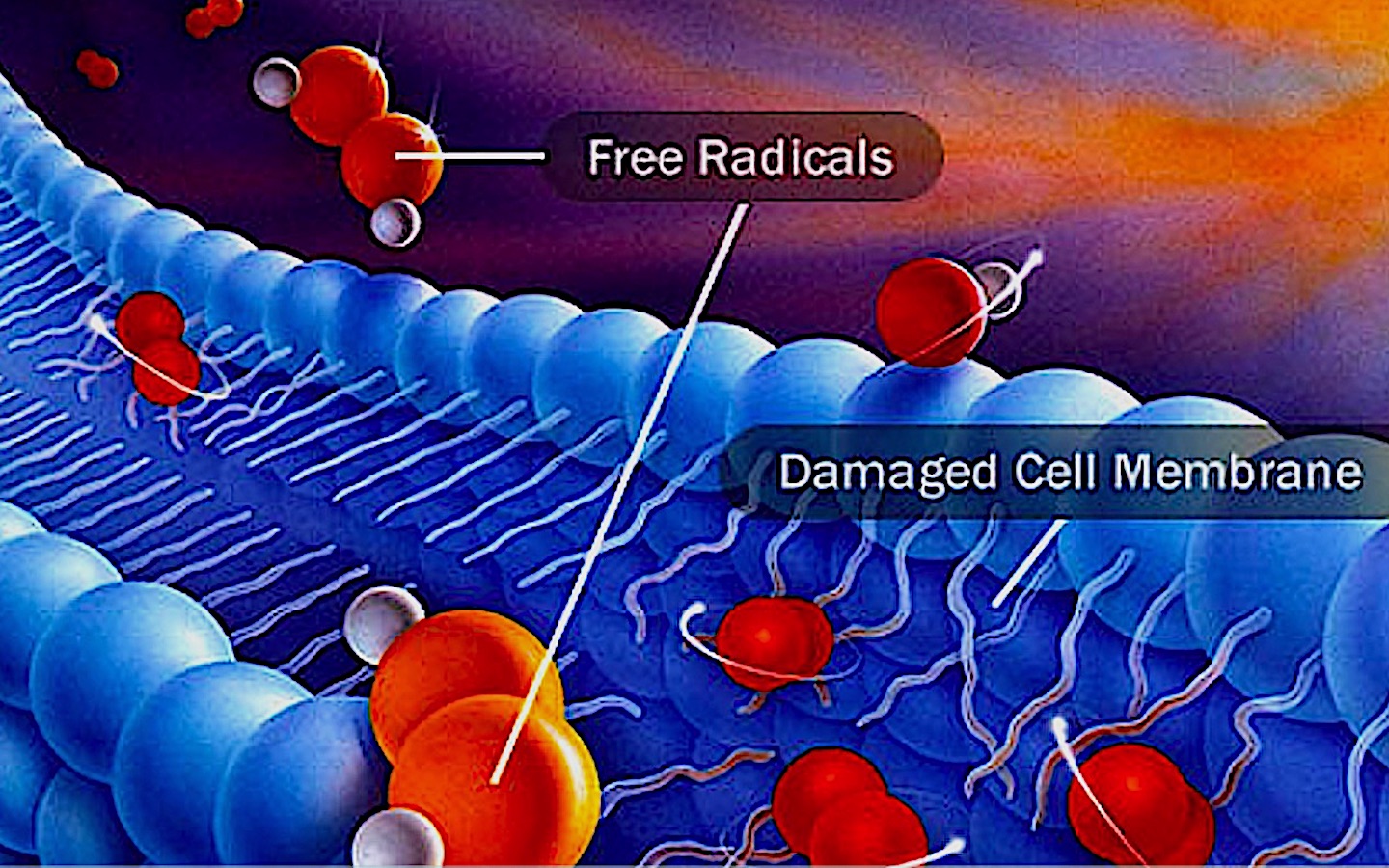
Изменения молекул мембран клеток, вызванные атакой свободных радикалов, оказывают разрушительное воздействие на сердечно-сосудистую систему: компоненты крови становятся «липкими», стенки сосудов пропитываются липидами и холестерином, в результате возникают тромбоз, атеросклероз и другие заболевания.
Особо чувствителен к гиперпродукции свободных радикалов и окислительному стрессу головной мозг, так как в нем содержится множество ненасыщенных жирных кислот, таких как, например, лецитин. При их окислении в мозгу повышается уровень липофусцина. Это один из пигментов изнашивания, избыток которого ускоряет процесс старения.
В отличие от других органов легкие непосредственно подвергаются действию кислорода – инициатора окисления, а также оксидантов, содержащихся в загрязненном воздухе (озона, диоксидов азота, серы и т.д.). Ткань легких содержит в избытке ненасыщенные жирные кислоты, которые оказываются жертвами свободных радикалов. На легкие также прямо воздействуют оксиданты, образующиеся при курении. Также экспериментально доказано, что свободные радикалы могут являться факторами, провоцирующими развитие сахарного диабета и вызывающими его осложнения. Обычно здоровый организм сам справляется со свободными радикалами, однако неблагоприятные внешние факторы приводят к ситуации, когда ему необходима поддержка.
Также экспериментально доказано, что свободные радикалы могут являться факторами, провоцирующими развитие сахарного диабета и вызывающими его осложнения. Обычно здоровый организм сам справляется со свободными радикалами, однако неблагоприятные внешние факторы приводят к ситуации, когда ему необходима поддержка.
Как защитить организм
Наряду со свободнорадикальным окислением в процессе функционирования биологических объектов из групп радикалов вырабатываются вещества, обладающие антиоксидантным действием, которые называют стабильными радикалами. Они не способны нанести урон клеточным мембранам.
Такие химические соединения называются антиоксидантами, так как механизм их действия основан на торможении свободнорадикальных процессов в тканях организма. В отличие от нестабильных свободных радикалов, оказывающих повреждающее действие на клетки, антиоксиданты тормозят развитие деструктивных процессов.
В настоящее время биологические и химически синтезированные аниоксиданты подразделяются на жирорастворимые (самый известный – токоферол) и водорастворимые (наиболее распространенный – глутатион).
Полезная пища для защиты организма от свободных радикалов
В борьбе со свободными радикалами принимают участие не только антиоксидантные вещества, вырабатываемые организмом, но и антиоксиданты, поступающие с пищей. К антиоксидантам относятся также минеральные вещества (соединения селена, магния, меди), некоторые аминокислоты и растительные полифенолы (флавоноиды). А самыми сильными антиоксидантными свойствами обладают флавоноиды и антоцианы – вещества, содержащиеся в растениях, и определяющие их окраску. Поэтому в продуктах растительного происхождения антиоксидантов больше всего, особенно в кисло-сладких и кислых фруктах и овощах красного, оранжевого, синего и черного цвета. В желтых, ярко-зеленых и темно-зеленых растениях антиоксидантов тоже много, и есть даже список наиболее богатых ими растительных продуктов, хотя мнения ученых по этому поводу могут быть различными.
В один из таких списков попали фасоль – пестрая, черная и красная. Особенно ценятся мелкая фасоль, дикая и садовая, смородина, черная и красная, малина, клюква, клубника, слива и чернослив, черешня, сухофрукты и орехи, некоторые сорта яблок, артишок.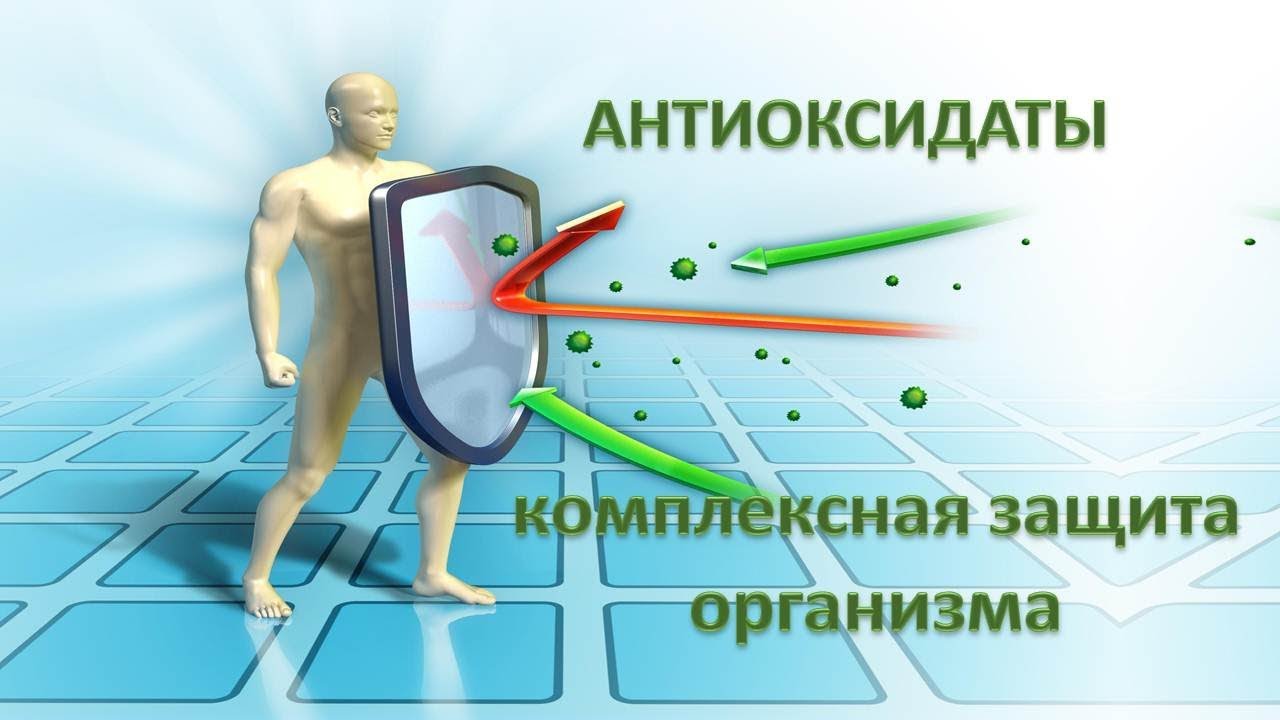 Из орехов лучшими антиоксидантами считаются миндаль, грецкие орехи, фундук, фисташки и пекан.
Из орехов лучшими антиоксидантами считаются миндаль, грецкие орехи, фундук, фисташки и пекан.
Интересный факт: обычно считается, что при тепловой обработке продукты теряют свои полезные свойства, тем не менее, в вареном артишоке антиоксидантов становится на порядок больше, чем в сыром. Содержание антиоксидантов в продуктах может сильно отличаться, и ученые пока не могут сказать, чем это обусловлено, да и исследования проводились далеко не во всех областях. Например, мелкую фасоль считают самой полезной, но многие виды фасоли остаются пока неизученными. Лесные ягоды тоже исследованы не все, но одно можно сказать наверняка: чем ярче и насыщеннее цвет продукта, тем богаче он антиоксидантами. Ярко-желтая кукуруза содержит лютеин, оранжевые овощи и фрукты – каротин, ярко-красные помидоры – ликопин, темно-синие и черные ягоды богаты антоцианами.
Антиоксиданты в соках
В свежевыжатых соках ягод и фруктов антиоксидантов очень много: в гранатовом, виноградном, соке цитрусовых; антиоксиданты содержатся также в белом слое под их кожурой. Почти столько же антиоксидантов в яблочном соке и соке черноплодной рябины, вишни, и многих ягод и плодов, выращиваемых по всей России.
Почти столько же антиоксидантов в яблочном соке и соке черноплодной рябины, вишни, и многих ягод и плодов, выращиваемых по всей России.
К продуктам, богатым антиоксидантами, относится и чай: зеленый, красный, черный и другие его виды. Содержание антиоксидантов, однако, зависит от технологии приготовления чая и от того, как он выращивался.
Антиоксиданты — защита от старения и болезней
В последнее время ученые разных специальностей приходят к выводу, что в основе многих патологических процессов в организме, приводящих к различным заболеваниям и в конечном итоге к старению, лежит одно и то же явление. Это повреждение клеточных оболочек и других структур внутри клетки свободными радикалами кислорода. На протяжении всей жизни в организме человека протекает множество химических реакций, и для каждой из них требуется энергия. Для получения её организм использует разные вещества, но для её высвобождения, всегда нужен незаменимый компонент – кислород. Окисляя органические соединения, поступающие с пищей, именно он дает нам энергию и жизненные силы.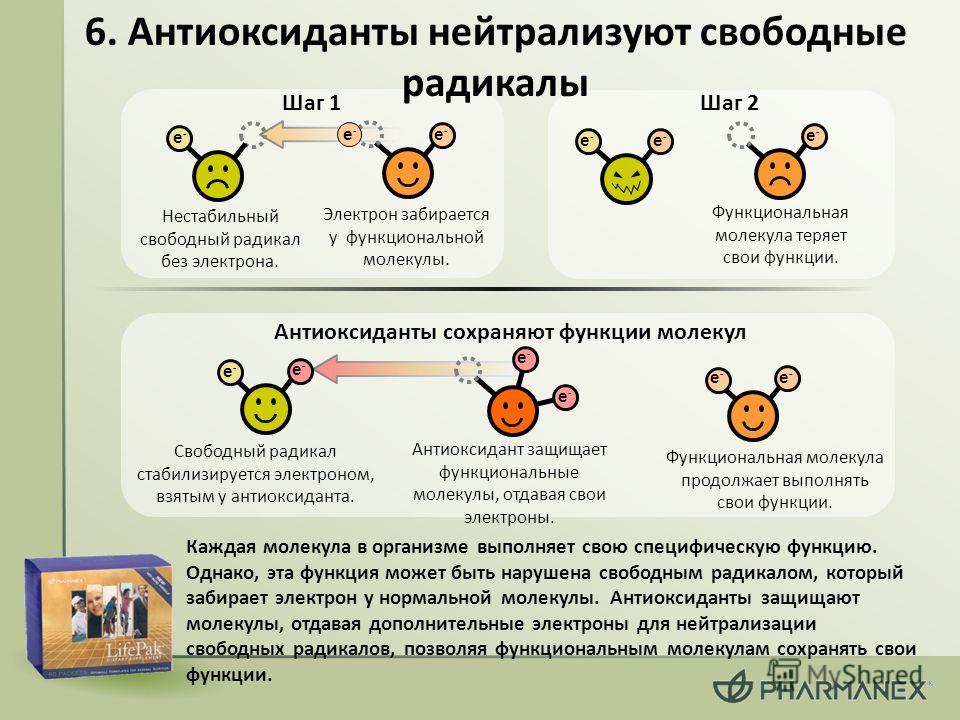 Однако насколько кислород крайне необходим для нас, настолько же и опасен: даруя жизнь, он ее и отбирает. В процессе жизнедеятельности нашего организма он способен окислять молекулы до невероятно активной формы — состояния так называемых «свободных радикалов», которые в небольшом количестве необходимы организму для участия во многих его физиологических процессах. Однако, часто под воздействием различных неблагоприятных факторов, число свободных радикалов начинает возрастать сверх необходимой меры и тогда они превращаются в настоящих беспощадных агрессоров, которые разрушают всё, что попадает им «под руку»: молекулы, клетки, кромсают ДНК и вызывают настоящие клеточные мутации. Свободные радикалы провоцируют в организме основное большинство процессов, похожих на настоящее ржавление или гниение — это разложение, которое с годами, буквально в полном смысле слова, «разъедает» нас изнутри.
Однако насколько кислород крайне необходим для нас, настолько же и опасен: даруя жизнь, он ее и отбирает. В процессе жизнедеятельности нашего организма он способен окислять молекулы до невероятно активной формы — состояния так называемых «свободных радикалов», которые в небольшом количестве необходимы организму для участия во многих его физиологических процессах. Однако, часто под воздействием различных неблагоприятных факторов, число свободных радикалов начинает возрастать сверх необходимой меры и тогда они превращаются в настоящих беспощадных агрессоров, которые разрушают всё, что попадает им «под руку»: молекулы, клетки, кромсают ДНК и вызывают настоящие клеточные мутации. Свободные радикалы провоцируют в организме основное большинство процессов, похожих на настоящее ржавление или гниение — это разложение, которое с годами, буквально в полном смысле слова, «разъедает» нас изнутри.
ВОЗДЕЙСТВИЕ СВОБОДНЫХ РАДИКАЛОВ НА ОРГАНИЗМ.
Свободные радикалы атакуют наш организм 24 часа в сутки, но их атаки могут происходить чаще или реже.
 Это зависит от многих факторов. Курение, алкоголь, стрессы, неправильное питание и долгое пребывание на солнце увеличивают количество свободных радикалов, а правильный образ жизни, полноценный отдых и рациональное питание, наоборот, снижают их активность. Свободные радикалы очень сильно повреждают белок, результатом атаки которого является старение всего организма, поскольку стареют все клетки, в которых белок атакован свободными радикалами.
Это зависит от многих факторов. Курение, алкоголь, стрессы, неправильное питание и долгое пребывание на солнце увеличивают количество свободных радикалов, а правильный образ жизни, полноценный отдых и рациональное питание, наоборот, снижают их активность. Свободные радикалы очень сильно повреждают белок, результатом атаки которого является старение всего организма, поскольку стареют все клетки, в которых белок атакован свободными радикалами.Свободные радикалы повреждают ДНК – генетический код клетки, что в свою очередь приводит к изменениям в структуре его кода, его свойств и даже мутации. Смутированные клетки больше не могут выполнять свои прежние функции. Считается, что свободные радикалы наиболее сильно влияют на процесс старения и являются основной причиной рака и большинства болезней кровообращения. Наука доказала, что именно они и повинны в развитии таких болезней, как: рак, атеросклероз, инфаркт, инсульт, ишемия, атеросклероз, заболевания нервной и иммунной систем и заболевания кожи.
Свободные радикалы — это бич нашего времени и отнимают у нас не один десяток лет жизни!
ИСТОЧНИКИ СВОБОДНЫХ РАДИКАЛОВ
По мнению ученых, считается нормальным, если примерно 5% веществ, образовавшихся в ходе химических реакций, — это свободные радикалы. В малом количестве они необходимы нашему организму, потому что только при их участии иммунная система может бороться с вирусами и болезнетворными микроорганизмами. Но избыток их губителен и, к сожалению, неизбежен.
Основными «фабриками» по производству свободных радикалов в нашем организме служат маленькие продолговатые тельца внутри живой клетки — митохондрии, самые главные её энергетические станции.
Возникнув в них, радикалы повреждают оболочки митохондрий, а также другие внутренние структуры клетки, и это усиливает их утечку. Со временем активных форм кислорода становится там все больше и больше, в результате чего они полностью разрушают клетку и распространяются по всему организму. Как «молекулярные террористы» они хаотично «рыщут» по всем живым клеткам и, внедряясь туда, повергают вокруг себя всё в хаос.
Как «молекулярные террористы» они хаотично «рыщут» по всем живым клеткам и, внедряясь туда, повергают вокруг себя всё в хаос.
Свободные радикалы могут образовываться во многих продуктах нашего питания, например, таких, как: кондитерские изделия длительных сроков хранения, мясные продукты и продукты растительного происхождения. Особенно это касается жиров, содержащих ненасыщенные жирные кислоты, которые очень легко окисляются. Больше всего таких кислот в кукурузном и подсолнечном маслах, а меньше всего в оливковом и льняном маслах. В жареных продуктах как: чипсы, хрустящий картофель (жареный в большом количестве масла низкого качества), тесто для пиццы, жирные соусы и в продуктах с длительным сроком хранения жиры также быстро окисляются, и такая еда тоже содержит очень много свободных радикалов.
Источники внутри организма:
— в процессах образования энергии в митохондриях, например из углеродов;
— в процессе распада вредных жиров в организме при сжигании многонасыщенных жирных кислот;
— в воспалительных процессах, при нарушениях метаболизма – диабет
— в продуктах обмена веществ в толстом кишечнике.
Источники из окружающей среды:
— загрязненный воздух, дым промышленности, сигаретный дым, ионизированный воздух;
— высокообработанная, просроченная, испорченная еда и лекарства.
Кроме всего этого свободные радикалы могут также образовываться в нормальных процессах метаболизма, под влиянием солнечных лучей (фотолиз), радиоактивного облучения (радиолиз) и даже ультразвуков.
Необходимо запомнить:
1. чем дольше данный продукт был подвержен промышленной обработке, тем больше в нём свободных радикалов;
2. чем больше добавлено в его состав «улучшателей», наполнителей, искусственных красителей, консервантов, тем большая насыщенность таких продуктов свободными радикалами;
3. чем дольше срок хранения продукта, тем больше (как правило) свободных радикалов;
4. чем дольше жарите, печете, сохраняете, варите, тем больше окисляете продукты.
БОРЬБА СО СВОБОДНЫМИ РАДИКАЛАМИПрирода заложила в живом организме собственные средства защиты от избытка свободных радикалов и природная система достаточно хорошо работает. Однако через нее все же постоянно «проскальзывают» отдельные радикалы, которые не успели вступить во взаимодействие с антиокислительными ферментами. Если лавину окисления не остановить, то может погибнуть весь организм. Отсюда и вытекает вывод: бороться со свободными радикалами нужно несколькими путями: с помощью препаратов — «ловушек», нейтрализующих уже имеющиеся свободные радикалы, а также внешних антиоксидантных средств, препятствующих образованию свободных радикалов.
Однако через нее все же постоянно «проскальзывают» отдельные радикалы, которые не успели вступить во взаимодействие с антиокислительными ферментами. Если лавину окисления не остановить, то может погибнуть весь организм. Отсюда и вытекает вывод: бороться со свободными радикалами нужно несколькими путями: с помощью препаратов — «ловушек», нейтрализующих уже имеющиеся свободные радикалы, а также внешних антиоксидантных средств, препятствующих образованию свободных радикалов.
Итак, АНТИОКСИДАНТЫ — это биологически активные вещества (БАВ), блокирующие реакции свободно-радикального окисления и восстанавливающие окисленные соединения. Антиоксиданты бывают ферментной природы (ферменты (или энзимы), продуцируемые в т.ч. бактериями) и неферментные.
К неферментативным антиоксидантам можно отнести следующие вещества:
витамины А, Е, К, С, В6, РР, коэнзим Q10; биофлавоноиды (кверцетин, рутин, антоцианы, ресвератрол, гесперидин, катехины и др.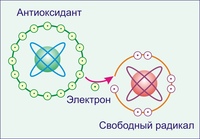 ), аминокислоты цистин и метионин, глютатион,; микроэлемент селен.
), аминокислоты цистин и метионин, глютатион,; микроэлемент селен.
Биофлавоноиды- представляют собой нетоксические соединения растительного происхождения с выраженными антиоксидантными свойствами. Биофлавоноиды получили свое название от латинского слова flavus — желтый, так как первые флавоноиды, которые были выделены из растений, имели желтый цвет.
Максимальное количество природных натуральных антиоксидантов наблюдается обычно в кожуре и коре растений и деревьев, а также в косточках, где хранится генетическая информация. Считается, что наиболее эффективные соединения — биофлавоноиды, которые лучше всего препятствуют разрушению и старению организма, находятся в тех составах, которые придают растениям их выраженную пигментацию или окраску. Именно по этой причине наиболее полезными оказываются те продукты, которые имеют наиболее тёмную окраску (черника, тёмный виноград, свёкла, фиолетовые капуста и баклажаны и т.п. ). То есть, даже без химического анализа мы можем «поедать» самые полезные продукты (фрукты, овощи, ягоды и т.п.), отдавая предпочтение тем, что сильнее всего окрашены в тёмные тона.
). То есть, даже без химического анализа мы можем «поедать» самые полезные продукты (фрукты, овощи, ягоды и т.п.), отдавая предпочтение тем, что сильнее всего окрашены в тёмные тона.
Биофлавоноиды способны снижать даже уровень холестерина в организме, а также тенденцию красных кровяных телец слипаться и образовывать тромбы, как впрочем и многое другое. Например доказано, что биофлавоноиды эффективно помогают снижать гипертонию и устранять разного рода аллергии.
Недавно в Бостонском Университете в США проводились исследования о качественном наличии антиоксидантов в различных продуктах питания. По итогам их исследований были выложены две сводные таблицы содержания антиоксидантов в продуктах
Таблица 1 — Содержание антиоксидантов в продуктах
Продукты питания | Антиоксидантная способность / грамм | Продукты питания | Антиоксидантная способность / грамм |
Пять лучших ягод и фруктов: | Пять лучших орехов: | ||
Клюква | 94. | Пеканы | 179.40 |
Черника (дикорос) | 92.60 | Грецкий орех | 135.41 |
Чёрная слива | 73.39 | Фундук, лесной орех | 135.41 |
Слива (тип не указан) | 62.39 | Фисташки | 79.83 |
Черника (культивируемая) | 62.20 | Миндаль | 44.54 |
Пять лучших овощей: | Пять лучших специй: | ||
Маленькая красная фасоль | 149.21 | Гвоздика | 3144. |
Обычная красная фасоль | 144.13 | Молотая корица | 2675.36 |
Фасоль (разный цвет) | 123.59 | Душицы лист | 2001.29 |
Артишоки | 94.09 | Куркума | 1592.77 |
Чёрные бобы | 80.40 | Сушёная петрушка | 743.49 |
Таблица 2 — Антиоксиданты в 10 лучших продуктах антиоксидантных единиц на 100 грамм
Фрукты: | Овощи: | ||
Чернослив | 5,770 | Капуста | 1,770 |
Изюм | 2,830 | Шпинат | 1,260 |
Черника | 2,400 | Брюссельская капуста | 0,980 |
Ежевика | 2,036 | Ростки люцерны | 0,930 |
Земляника | 1,540 | Брокколи (цветки) | 0,890 |
Малина | 1,220 | Свёкла | 0,840 |
Слива | 0,949 | Красный перец | 0,710 |
Апельсины | 0,750 | Лук | 0,450 |
Виноград красный | 0,739 | Зерно | 0,400 |
Вишня | 0,670 | Баклажан | 0,390 |
Вывод: антиоксиданты обезвреживают свободные радикалы, которые, в свою очередь, являются одной из главных причин старения и множества дегенеративных болезней.
Свободные радикалы и антиоксидантная защита
Универсальным механизмом повреждения биологических мембран, встречающимся при самых различных заболеваниях и повреждающих воздействиях на организм, является каскад реакций свободно-радикального (перекисного) окисления липидов (ПОЛ).
К числу постоянных факторов, играющих определенную роль в жизнедеятельности клетки является образование перекисей. Процессам свободно-радикального окисления липидов отводят роль фундаментального молекулярного механизма повреждения биологических мембран. Биомембраны определяют морфологическую целостность, восприятие, ионную проницаемость клетки и ее внутриклеточных органелл, транспорт метаболитов, поэтому патогенез многих заболеваний и изменение структуры и функции цитомембран обусловлены процессами свободно-радикального окисления.
Основным источником липоперекисей в клетке является ферментный путь, связанный с НАДФН-зависимым микросомальным окислением. Кроме того, существует неферментный аскорбатзависимый путь. Оба процесса протекают с участием активных радикалов кислорода.
Оба процесса протекают с участием активных радикалов кислорода.
В общем представлении свободными радикалами называют молекулы с неспаренными электронами, находящимися на внешней оболочке атома или молекулы, обладающие очень высокой реакционной способностью и, как следствие, выраженным повреждающим действием на клеточные структуры.
Доказано участие свободных радикалов в патогенезе очень многих заболеваний и преждевременного старения:
— шок различного генеза;
— атеросклероз;
— нарушения мозгового, коронарного и периферического кровообращения;
— сахарный диабет и диабетическая ангиопатия;
— ревматоидные, воспалительные и дегенеративные заболевания опорно-двигательной системы;
— поражения глаз;
— легочные заболевания;
— онкологическая патология;
— термические поражения;
— различные интоксикации;
— реперфузионные поражения.
Кроме того, к повышенному образованию свободных радикалов в организме приводят прием препаратов с прооксидантными свойствами, проведение ряда лечебных процедур (гипербарическая оксигенация, ультрафиолетовое облучение, лазерная коррекция зрения, лучевая терапия), а также различные экологически неблагоприятные факторы окружающей среды.
Причины активации ПОЛ могут быть самыми разными. В частности, при радиационном поражении это внутриклеточное образование гидроксильных радикалов в результате прямого радиолиза воды. Одновременно с этим под действием радиации происходит деструкция белков-антиоксидантов. Гипоксия, сопровождающая многие патологические состояния, характеризуется преимущественно одноэлектронным митохондриальным восстановлением кислорода, снижением pHи изменением в связи с этим активности антиоксидантных ферментов, поступлением в кровь из жировых депо свободных жирных кислот.
При злокачественных новообразованиях осуществляется иммунный ответ, направленный на отторжение клеток опухоли, окисление токсинов. Эти реакции сопровождаются целенаправленной инициацией организмом ПОЛ.
Вообще, следует отметить, что любая воспалительная реакция сопровождается усиленной генерацией активных форм кислорода фагоцитирующими клетками. Микробицидная функция фагоцитов, осуществляющих защиту организма от бактериальных инфекций, во многом зависит от способности клеток продуцировать супероксидный радикал и перекись водорода.
Следует особо подчеркнуть, что свободные радикалы являются постоянными продуктами кислородного метаболизма в живых клетках, принимающих участие практически при всех физиологических функциях. В нормальных условиях поддерживается равновесие между антиоксидантными и прооксидантными системами организма, а при чрезмерном накоплении активных форм кислорода, пероксидов и их метаболитов и возникает состояние, которое называют оксидативным стрессом.
В условиях согласованного функционирования систем антиоксидантной защиты свободные радикалы являются продуктами физиологического клеточного механизма и не представляют опасности, так как сразу же нейтрализуются антиоксидантной системой клетки.
Важное влияние ПОЛ проявляется в обновлении состава и поддержании функциональных свойств биомембран, участии в энергетических процессах, клеточном делении, синтезе биологически активных веществ. Через стадию перекисных производных ненасыщенных жирных кислот осуществляется биосинтез простагландинов и лейкотриенов, а тромбоксаны, оказывающие мощное влияние на адгезивно-агрегационные свойства форменных элементов крови и микроциркуляцию, сами являются гидроперекисями.
Образование гидроперекисей холестерина — одно из звеньев в синтезе некоторых стероидных гормонов, в частности, прогестерона.
Избыточная активация процессов цепного свободнорадикального окисления липидов может привести к накоплению в тканях таких продуктов, как липоперекиси, радикалы жирных кислот, кетоны, альдегиды, кетокислоты, что, в свою очередь, может привести к повреждению и увеличению проницаемости клеточных мембран, окислительной модификации структурных белков, ферментов, биологически активных веществ.
Антиоксидантная защита. Антиоксиданты — это молекулы, которые способны блокировать реакции свободнорадикального окисления, восстанавливая разрушенные соединения. Когда антиоксидант отдает свой электрон окислителю и прерывает его разрушительное действие, он сам окисляется и становится неактивным. Для того, чтобы вернуть его рабочее состояние, его надо снова восстановить. Например, витамин С восстанавливает витамин Е, а глютатион восстанавливает витамин С.
Самые лучшие антиоксидантные кооперативы содержатся в растениях. Это растительные полифенолы или биофлавоноиды, которые сообща очень эффективно борются со свободными радикалами. Наиболее мощными антиоксидантными системами обладают растения, которые могут расти в суровых условиях: облепиха, сосна, кедр, пихта и другие.
Важную роль в организме играют антиокислительные ферменты. Это супероксиддисмутаза (СОД), каталаза и глютатионпероксидаза. СОД и каталаза образуют антиоксидантную пару, которая борется со свободными радикалами кислорода, не давая им возможности запустить процессы цепного окисления.
Глютатионпероксидаза обезвреживает липидные перекиси, обрывая тем самым цепное перекисное окисление липидов. Для работы глютатионпероксидазы необходим селен, поэтому пищевые добавки с селеном усиливают антиоксидантную защиту организма.
Антиоксидантными свойствами в организме обладают многие соединения. Это токоферолы, каротиноиды, аскорбиновая кислота, антиокислительные ферменты, женские половые гормоны, коэнзим Q, тиоловые соединения, содержащие серу, некоторые аминокислоты, белковые комплексы, витамин К и многие другие.
Врач ЦДЛ б/х отдела
городской больницы
Василевская К.И.
Жить здорово! Антиоксиданты против старения
Эликсир бессмертия ученые умы искали с древних времен. Пока он все еще не найден, но открытые современной наукой антиоксиданты, возможно, помогут замедлить процессы старения в организме.
Что же такое антиоксиданты и как они работают? Антиоксиданты — это вещества, которые замедляют процессы старения в организме. Они восстанавливают молекулы, поврежденные ускоряющими старение свободными радикалами, обезвреживая их (снижают уровень так называемого окислительного стресса).
Антиоксиданты являются мощными соединениями, которые непосредственно поддерживают клеточное здоровье организма и являются потенциальным средством улучшения общего состояния здоровья и, по-видимому, увеличения продолжительности жизни. Они обозначены как мощные молекулы, которые поддерживают здоровое старение.
В последнее время все больше говорится о том, что старение больше связано с уровнем стресса и функцией наших клеток, чем с количеством свечей на торте в день рождения. И лучший способ защитить клетки включает потребление мощных антиоксидантов, многие из которых доступны в растительных продуктах. Антиоксиданты помогают предотвратить некоторые онкологические заболевания и болезни сердца. Они благотворно влияют на память, уменьшают риск развития дегенеративных заболеваний, таких как болезнь Паркинсона и болезнь Альцгеймера. Эти соединения уменьшают болезненность и защищают суставы, снижают усталость мышц, предотвращают слепоту, вызванную дегенерацией желтого пятна и катарактой и даже разглаживают морщины.
Все мы постоянно подвергаемся бомбардировке негативными элементами — от загрязнения химикатами до воздействия ультрафиолетовых лучей, которые способны наносить ущерб клеткам тела. И наше собственное тело постоянно производит гормоны стресса и токсические элементы в ходе химических реакций. Эти токсины ослабляют молекулы в клетках, заставляя их терять электрон — единицу в клетке, которая несет электрические заряды и позволяет клеткам работать вместе. Лишенные электронов молекулы, называемые свободными радикалами, или окислителями, пытаются компенсировать свою неадекватность, крадя электроны с других молекул. Это повреждает и окисляет эти клетки, превращая их в свободнорадикальные электроны. Как только создается свободный радикал, урон в организме распространяется быстро.
Свободные радикалы в ваших кровеносных сосудах вызываются глубокозамороженной пищей, сигаретным дымом или загрязненным воздухом, особенно выхлопными газами от работающих авто, солнечным излучением. Свободные радикалы нарушают работы сердца и сосудов, повреждают сетчатку, приводя к катаракте и слепоте, а также воздействуют на клетки кожи, повышая риск возникновения рака кожи и ускоряя образование морщин.
Наши собственные антиоксиданты, производимые внутри организма, не способны сражаться со всеми свободными радикалами на всех невидимых фронтах внутри организма. К счастью, антиоксиданты можно найти в привычных продуктах питания, таких как фрукты и овощи, шоколад, некоторые растения, экстракт граната, натуральное виноградное вино. Антиоксиданты проводят миссию по спасению тела изнутри.
Витамин С является основным водорастворимым антиоксидантом и действует, как первая защита от свободных радикалов. Витамин С блокирует неконтролируемое деление клеток, которое приводит к опухолям. Витамин Е защищает от окислительного повреждения, воздействуя непосредственно на различные радикалы кислорода. Его антиоксидантная функция сильно поддерживается витамином С. Селен запускает гены, необходимые для разрушения канцерогенов.
Каротиноиды — это жирорастворимые антиоксиданты, среди которых наиболее известен β-каротин, содержащийся в обычной моркови. Известно более 750 каротиноидов, но в составе продуктов питания можно встретить всего около 20 из них, а в крови человека определяют и того меньше — 14. Менее известны такие каротиноиды, как ликопин (содержится в томатах), лютеин и зеаксантин (содержатся в капусте, шпинате, сладком перце, хурме). Изотиоцианаты, обнаруженные в брокколи, помогают предотвратить развитие рака. Все они относятся к витаминоподобным веществам. Исследования показали, что увеличение потребления пищевых антиоксидантов, включая витамин Е, витамин С и β-каротин, связано с уменьшением риска развития атеросклеротических заболеваний. Ликопин, мощный антиоксидант, представляет собой каротиноид, содержащийся в красных фруктах и овощах.
Доказано также, что физические упражнения могут привести к увеличению антиоксидантной защиты организма.
Так называемый «Французский парадокс», показал, что у французского населения наблюдается низкая частота ишемической болезни сердца и высокая продолжительность жизни, несмотря на то, что многие французы курят и не придерживаются строгого режима. И хотя исследование вызвало большие споры, по результатам исследования было высказано предположение, что положительные эффекты могут быть связаны с высоким содержанием антиоксидантов от потребления высококачественного натурального красного вина, — древней традиции во Франции.
Ресвератрол, фитоалексин, обнаруженные в нескольких растениях (и, в частности, красном винограде), способны регулировать накопление холестерина, защищать сердце и сосуды.
В последнее время все больше доказательств указывают на то, что окислительный стресс, вызываемый свободными радикалами, является потенциальной причиной болезни Альцгеймера. Как показывают исследования, витамин Е можно рассматривать как эффективное лечение болезни Альцгеймера. Но комбинации витаминов с антиоксидантными свойствами (в частности, витамин С и витамин Е) показали наибольшую пользу и являются наиболее эффективными. Люди, придерживающиеся сбалансированной диеты с упором на богатые антиоксидантами фрукты, овощи и цельные зерна, а также пользователи витаминных добавок, имеют более низкие показатели болезни Альцгеймера.
Некоторые антиоксиданты ассоциируются с более низкой распространенностью конкретных типов рака. Например, в исследованиях было доказано, что витамин Е уменьшает заболеваемость раком молочной железы, легких и толстой кишки, но наиболее значимые результаты были получены при раке предстательной железы. Однако, возможно, что добавление антиоксидантов может оказывать благотворное влияние на заболеваемость раком только у здоровых лиц, которые не подвержены риску заболевания раком. Предполагается, что антиоксидантные добавки способны предотвращать рак желудочно-кишечного тракта.
И хотя наука продолжает искать ответы, и многое еще предстоит прояснить, очевидно, что антиоксиданты способны противостоять свободным радикалам и нейтрализовать их, помогая сохранять здоровье и повышая качество нашей жизни.
Валеолог отделения профилактики УЗ «40-я ГКП» М.Верещагина
Система перекисное окисление липидов — антиоксидантная защита и роль ее нарушений в патогенезе сахарного диабета и ангиопатий | Ляйфер
1. Берштейн С. А., Гуревич М. И., Соловьев А. И. Дефицит кислорода и сосудистый тонус.— Киев, 1984.
2. Биленко М. В., Чуракова Т. Д. // Бюл. экспер. биол.— 1982,— Т. 94, № 7,— С. 22—25.
3. Биленко М. В. Ишемические и реперфузионные повреждения органов.— М., 1989.
4. Вахрушева Л. Л., Князев Ю. А, Сергеева Н. А. и др. // Пробл. эндокринол.— 1989.— Т. 35, № 1.— С. 22—25.
5. Верболович В. П, Подгорный Ю. К.. Подгорная Л. М. // Науч. докл. высш. школы. Биол. науки.— 1989.— № 1.— С. 27—33.
6. Воскресенский О. Н. // Кардиология,— 1981.— Т. 21, № 6,— С. 118—123.
7. Галенок В. А., Диккер В. Е. // Тер. арх.— 1990.— Т. 62, № 12,— С. 87—90.
8. Генык С. Н, Шевчук В. С., Пидуфалый В. Р., Карась Г. М. // Врач. дело.— 1989.— № 2.— С. 1—5.
9. Диккер В. Е., Галенок В. А. // Тер. арх.— 1986.— Т. 58, № 6,— С. 105—110.
10. Долина О. А, Галеев Ф. С., Фархутдинов Р. Р. // Анест. и реаниматол.— 1987.— № 5.— С. 71—75.
11. Ефимов А. С., Плешанов Е. В., Гогина И. Ф. // Пробл. эндокринол.— 1988.— Т. 34, № 2.— С. 13—15.
12. Ефимов А. С. Диабетические ангиопатии.— М., 1989.
13. Зелинский Б. А., Власенко М. В. // Пробл. эндокринол.— 1990,— Т. 36, № 1,— С. 37—40.
14. Иванов В. В, Луста И. В., Сатрихина Т. Н., Удинцев Н. А. // Пробл. эндокринол.— № 2.— С. 77—80.
15. Исрафилова Н. М., Юсубова А. А. // Метаболические факторы риска при эндокринопатиях у детей / Под ред. Ю. А. Князева.— М., 1988.— С. 25—27.
16. Каган В. Е., Савов В. М., Диденко В. В. и др. // Бюл. экспер. биол.— 1983.— Т. 95, № 4.— С. 46—48.
17. Калмыкова В. И., Захарова Е. В.. Рахимова Д. 3. // Сахарный диабет: (Новое в патогенезе, диагностике, лечении) / Под ред. В. В. Трусова,—Горький, 1987.— С. 56—60.
18. Касимова Г. М., Мирталипов Д. Т., Абидов А. А. и др. // Вопр. мед. химии.— 1989,— Т. 35, № 3.— С. 42—47.
19. Красиков С. И., Боев В. М, Синюков А. П, Твердохлеб В. П. // Процессы биоэнергетики и структурнофункциональные свойства биологических мембран в норме и в условиях патологии.— Саратов, 1988.— С. 125—131.
20. Литвиненко Л. А. // Пробл. эндокринол.— 1991.— Т. 37, № 3,— С. 6—8.
21. Мажуль Л. М. // Вопр. мед. химии,— 1987.— Вып. 2.— С. 41—44.
22. Мажуль Л. М., Якубовский С. М, Самбурский С. С, Егуткин Г. Г. // Пробл. эндокринол.— 1989,— № 4.— С. 61—64.
23. Максимова О. В., Солун М. Н. // Мед. реф. журн. XX.— 1988,— № 2,— С. 11 — 12.
24. Мамедгасанов Р. М. Ранние стадии диабетических ангиопатий нижних конечностей: (Некоторые вопросы патогенеза, клиники и лечения): Автореф. дне…. д—ра мед. наук,— М., 1989.
25. Мамедгасанов Р. М., Рахмани С. А. // Пробл. эндокринол.— 1989,—Т. 35, № 1,— С. 19—21.
26. Мамедгасанов Р. М., Мазовецкий А. Г., Перелыгина А. А. и др. // Пробл. эндокринол.— 1991,— Т. 37, № 3,— С. 31—34.
27. Мехтиева 3. С. Диабетическая нефроангиопатия, диагностические критерии и лечение в современном аспекте: Автореф. дис. … канд. мед. наук.— Баку, 19$9.
28. Нелаева А. А., Кашуба Э. А., Кардаков. Ю. И. // Пробл. эндокринол.— 1990.— Т. 36, № 5.— С. 24—28.
29. Окороков А. Н. // Всесоюзный съезд эндокринологов, 3—й: Тезисы докладов.— Ташкент, 1989.— С. 292—293.
30. Сальникова Л. А., Мусатова Н. В. // Пробл. эндокринол.— 1990,— Т. 36, № 2,— С. 32—34.
31. Сальникова Л. А., Мусатова И. В., Лопатина И. И. // Вопр. мед. химии.— 1990.— Т. 36, № 1.— С. 39—41.
32. Стаарсельцева Л. К., Косилова Е. С., Смурова Т. Ф. и др. // Пробл. эндокринол.— 1986.— Т. 32, № 1.— С. 19—22.
33. Хачатрян Э. С. // Журн. эксперим. и клин, мед,— 1984.— Т. 24, № 4,—С. 371—378.
34. Холодова Е. А., Мохорт Т. В. // Пробл. эндокринол.— 1986,— Т. 32, № 4,— С. 55—59.
35. Чернух А. М., Александров П. Н, Алексеев О. В. Микроциркуляция.— М., 1984.
36. Шатилина Л. В., Быкова Н. О., Борисенко Л. В. и др. // Кардиология.— 1989.— Т. 29, № 2.—С. 45—49.
37. Юсубова А. М., Садых-Заде X. С., Алекперова Г. А. и др. // Педиатрия.— 1989.— № 5.— С. 111 —112.
38. Attali J. R., Valensi P. // Diabete et Metab.— 1990.— Vol. 16, N 1,— P. 1—6.
39. Brand F. N, Abbott R. D, Kannel W. B. // Diabetes.— 1989,— Vol. 38, N 4,— P. 504—509.
40. Caimi G. // Horm. Metab. Res.— 1983.— Vol. 15, N 10. P. 467—470.
41. Clavel J. P, Emerit J., Thuillier A. // Path.—Biol.— 1985,— Vol. 33, N 1,—P. 61—69.
42. Ditzel J., Standl Е. // Acta med. scand.— 1975.— Vol. 578.— P. 49—58. .
43. Dobretsov G. Е., Borschevskaya T. A, Petrov V. A. et al. // FEBS Lett.— 1977,— Vol. 84, N 1,— P. 125—128.
44. Dorman J. S., Laporte R. Е., Kuller L. H. et al. // Diabetes.— 1984, — Vol. 33, N 3,— P. 271—276.
45. Ernst Е. // Munch. Med. Wschr.— 1982.— Bd 124, N 19.— S. 473. /
46. Flatt P. R., Shibier O., Joannides C. et al. // Exp. clin. Endocr.— 1989,— Vol. 93, N 2—3,— P. 193—202.
47. Frenzel H, Refschneidel G. // Therapiewichoche.— 1983.— Bd. 33, N 6,— S. 2228—2230; 2235—2237.
48. Goeble K. M., Lanser K. G. // Biomed. biochim. Acta.— 1983,— Vol. 42, N 11 — 12,— P. 102—106.
49. Hagglof B, Marklund S. L., Holmgren G. /J Acta ender. (Kbh) — 1983,— Vol. 102,— P. 235—239.
50. Harman D. // Proc. nat. Acad. Sci. USA.— 1981.— Vol. 78,— P. 7124—7128.
51. Hiramatsu K., Arimori S. // Diabetes.— 1988.— Vol. 37, N 6,— P. 832—837.
52. Hubel C. A., Griggs K. C, McLaughlin M. K. /J Amer. J. Physiol.— 1989,— Vol. 256, N 6, Pt 2,—P. h2539— h2545.
53. Jain S. K, McVie R., Duett J. et al. // Diabetes.— 1989.— Vol. 38, N 12,— P. 1539—1543.
54. Janke H. U. Thrombozytenfunktion bei diabetischer Angiopathologie.— Stuttgart; New York, 1983.
55. Jenkinson S. J., Lawrence R. A, Tucker W. J. // Amer. Rev resp. Dis.— 1984. — Vol. 130, N 2.— P. 302—304.
56. Johnston R. B., Rabst M. J., Sasada M. Biological and Clinical Aspects of Superoxide and Superoxide Dismutase.— New York, 1980,—P. 211—221.
57. Jones R. L., Peterson C. M. // Amer. J. Med.— 1981.— Vol. 70, N 2,— P. 339—352.
58. Keisari Y., Pick Е. /J Biochemical Characterization of Lymphokines / Eds A. L. de—Weck et al.— New York, 1980,— P. 113—121.
59. Laila Ph., Thomas G, Jayanthi Bai N. et al. // Curr. Sci.— 1977 — Vol. 46, N 1 9,— P . 664——6.
60. Lipkin Е. W., Teller D. C., De Haen C. // Biochemistry.— 1983.— Vol. 22,— P. 792—799.
61. Loeper J., Goy J, Emerit J. // Bull. Acad. nat. Med. (Paris).— 1984,— Vol. 168, N 1—2,— P. 91—97.
62. Lubin B, Chire D. // Pediat. Res.— 1982,— Vol. 16, N П.— P. 928—932.
63. Marklund S. L. // Biochem. J.— 1984.— Vol. 202.— P. 269—272.
64. Martins-Silva J., Levy-Craz F., Freitas J. P. et al. // Acta diabetol. lat.— 1984,— Vol. 21, N 2,—P. 133—138.
65. Matkovics B, Vagra Sz. J., Szabo L., Witas H. // Horm. Metab. Res.— 1982,— Vol. 14.—P. 77—79.
66. Michelson A. M.. Puget K., Durosay A. et al. Biochemical and Medical Aspects of Active Oxygen.— Baltimore, 1977.
67. McMillan D. Е., Utteback N. G., Puma J. L. // Diabetes.— 1978 — . 7, N 9. —895—901.
68. McMillan D. Е. // Diabetologia.— 1983,— Vol. 24, N 5,— P. 308—310.
69. Muchmore D. B, Littes S. A, De Haen C. // Ibid.— 1982,— Vol. 21,— P. 3886—3892.
70. Nath N., Chari S. N., Rathi A. B. // Diabetes.— 1984.— Vol. 33, N 6,— P. 586—589.
71. Oberley L. W. // Free Radical Med.— 1988.— Vol. 5, N 2,— P. 113—124.
72. Pieper G. M. // Cardiovasc. Res.— 1988.— Vol. 22, N 12.— P. 916—926.
73. Pfeffer S. R.. Swislocki N. Y. // Meeh. Ageing Develop.— 1982,— Vol. 18, N 4,— P. 355—367.
74. Pottathil R., Chandrabose K. A., Cuatrecasas P., Lang D. J. // Proc. nat. Acad. Sci. USA.— 1981,— Vol. 78,— P. 3343—3347.
75. Schuch J., Fairclough G. F., Hashemeyer R. H. // Ibid.— 1978,— Vol. 75, N 7,— P. 3173—3177.
76. Therond B. // Biologiste.— 1988,—Vol. 22,—P. 97/39— 102/44.
77. Tiliman W., Werten A., Lakomik M. // Klin. Wschr.— 1984,—Bd 62, N 23,—S. 1136—1139.
78. Uzel N.. Sivas A.. Uysal M. et al. // Horm. metab. Res.— 1987,— Vol. 19.— P. 89—90.
79. Willis R. J., // Fed. Proc.— 1980,—Vol. 39, N 13,— P. 3134—3137.
80. Yaguchi Y., Tomino Y., Watanabe S. et al. // Nephron.— 1990,— Vol. 54, N 4,— P. 68.
Антиоксидантные ферментные системы
Существует несколько ферментных систем, которые катализируют реакции по нейтрализации свободных радикалов и активных форм кислорода. Эти ферменты включают:
- супероксиддисмутаза
- пероксид глутатиона
- глутатионредуктаза
- каталасов
Они формируют эндогенные защитные механизмы организма, помогая защитить клетки от повреждения, вызванного свободными радикалами. Антиоксидантные ферменты — глутатионпероксидаза, каталаза и супероксиддисмутаза (СОД) — метаболизируют токсичные промежуточные продукты окисления.
Этим ферментам также требуются кофакторы, такие как селен, железо, медь, цинк и марганец для оптимальной каталитической активности. Было высказано предположение, что недостаточное потребление этих микроэлементов с пищей может снизить эффективность этих механизмов антиоксидантной защиты. Потребление и усвоение этих важных микроэлементов может уменьшаться с возрастом.
Ферменты и система глутатиона
Глутатион, важный водорастворимый антиоксидант, синтезируется из аминокислот глицина, глутамата и цистеина.Глутатион может напрямую нейтрализовать АФК, такие как перекиси липидов, а также играет важную роль в метаболизме ксенобиотиков.
Ксенобиотики — это токсины, воздействию которых подвергается организм. Воздействие ксенобиотических веществ на печень означает, что организм готовится за счет увеличения количества ферментов детоксикации, то есть оксидазы смешанной функции цитохрома Р-450.
Когда человек подвергается воздействию высоких уровней ксенобиотиков, для конъюгации используется больше глутатиона. Конъюгация с глутатионом делает токсин нейтральным и делает его менее доступным для использования в качестве антиоксиданта.Исследования показывают, что глутатион и витамин C взаимодействуют друг с другом, нейтрализуя свободные радикалы. Эти двое также оказывают щадящее влияние друг на друга.
Система глутатиона включает глутатион, глутатионредуктазу, глутатионпероксидазы и S-трансферазы глутатиона. Из них глутатионпероксидаза представляет собой фермент, содержащий четыре кофактора селена, который катализирует распад перекиси водорода и органических гидропероксидов. Глутатион «S» — трансферазы проявляют высокую активность в отношении перекисей липидов.Эти ферменты особенно высоки в печени.
Липоевая кислота
Это еще один важный эндогенный антиоксидант. Он классифицируется как «тиол» или «биотиол». Это серосодержащие молекулы, которые катализируют окислительное декарбоксилирование альфа-кетокислот, таких как пируват и альфакетоглутарат, в цикле Кребса.
Липоевая кислота и ее восстановленная форма, дигидролипоевая кислота (DHLA), нейтрализуют свободные радикалы как в липидном, так и в водном доменах, и поэтому были названы «универсальным антиоксидантом».”
Супероксиддисмутаза
Супероксиддисмутазы (СОД) — это класс ферментов, которые катализируют распад супероксид-аниона на кислород и перекись водорода. Эти ферменты присутствуют почти во всех аэробных клетках и во внеклеточных жидкостях.
SOD содержат кофакторы ионов металлов, которые, в зависимости от изофермента, могут быть медью, цинком, марганцем или железом. Например, у человека СОД медь / цинк присутствует в цитозоле, тогда как СОД марганца присутствует в митохондриях.Митохондриальная СОД является наиболее биологически важной из этих трех.
У растений изоферменты СОД присутствуют в цитозоле и митохондриях. В хлоропластах также содержится железная СОД.
Каталасы
Каталазы — это ферменты, катализирующие превращение перекиси водорода в воду и кислород с использованием кофактора железа или марганца. Это обнаружено в пероксисомах большинства эукариотических клеток. Его единственный субстрат — перекись водорода. Он следует за механизмом пинг-понга.
Здесь его кофактор окисляется одной молекулой перекиси водорода и затем регенерируется путем передачи связанного кислорода второй молекуле субстрата.
Пероксиредоксины
Есть пероксидазы, которые катализируют восстановление пероксида водорода, органических гидропероксидов, а также пероксинитрита. Они могут быть трех основных типов: типичные пероксиредоксины 2-цистеина; атипичные пероксиредоксины 2-цистеина; и пероксиредоксины 1-цистеина. Пероксиредоксины, по-видимому, играют важную роль в метаболизме антиоксидантов.
Дополнительная литература
Рекомендации по охране здоровья и безопасности пожарных, принятые на апрельской конференции 1999 г., 9951-2841-MTDC
Окислительный стресс и антиоксиданты: Рекомендации по охране здоровья и безопасности пожарных на апрельской конференции 1999 г., 9951-2841-MTDC Wildland Здоровье и безопасность пожарныхРекомендации апрельской конференции 1999 г.
Уэйн Аскью, доктор философии.
Профессор и директор
Подразделение продуктов питания и питания
Университет штата Юта
Введение
В камерах вашего тело, которое могло загореться в любой момент.Ученые, которые изучают старение, хронические заболевания и профилактическая медицина называют «тлеющим» огонь »производство свободных радикалов и« пламя »окислительное стресс. Пока огонь тлеет, он находится под контролем эндогенных антиоксидантная защита. Однако, если его раздуть до «пламени» при определенных обстоятельствах, таких как упражнения, вдыхание загрязняющих веществ, чрезмерное воздействие солнечного света или плохое потребление антиоксидантных питательных веществ с пищей, окислительный стресс может выйти из-под контроля, нанося кумулятивный ущерб к важным тканям в организме.Ущерб не всегда заметен, но со временем может привести к серьезным потерям.
Рассмотрим следующий сценарий: Джек Джонс, пожарный из диких земель, находится на борту самолета во время незапланированного полета. Он покинул свой дом — сейчас В 200 милях позади — в спешке. Некогда есть или даже сказать жене и дети до свидания. Пять тысяч акров нетронутого дикого леса горит, и его команда собирается, чтобы помочь взять под контроль огонь.Через 10 минут он будет на земле, мчась к пылающему аду. По-прежнему некогда есть. Возможно, позже будет время для этого. Теперь важнее Задачи стоят перед собравшейся на площадке бригадой Лесной службы. Дым заполняет воздух. Солнце палит, заставляя ручейки пота стекать по его телу. лицо, смыв солнцезащитный крем, который он поспешно нанес, прежде чем покинуть самолет. Когда он приближается к огню, дым кружится и окутывает его, вызывая ему кашлять и жжение в глазах.Может ветер развеет дым скоро в обратном направлении. Команда переходит в бой, сокращая перерыв линии в подлеске. Тяжелые цепные пилы воют, выделяя пыль и выхлопные газы пары. Пуласки орудуют, издавая отрывистые неровные удары, когда экипаж готов к физически сложной задаче. Жара невыносимая. Солнце безжалостно палит, его жгучие ультрафиолетовые лучи отражают со скал на несчастных рабочих.Когда день переходит в ночь пора менять смены. Рабочие этой команды потратили колоссальное количество энергии, примерно 6000 ккал на этот в день, это почти вдвое превышает нормальные затраты энергии. Боль в мышцах напряжение и воспаление охватывает спину, колени, плечи и запястья. Джек голоден, но слишком устал, чтобы съесть большую часть предложенной еды. Он берет гамбургер и кусок пирога и запивает их небольшим количеством лимонад.Он засыпает прежде, чем его голова коснется подушки. Этот сценарий будет повторяться в течение нескольких дней, пока его команда не выздоровеет и вернитесь снова, если пламя все еще бушует. Джек испытывает повторяющиеся периоды окислительного стресса.
Теперь перенесемся на 25 лет вперед. Джек сейчас приближается к 60-летнему возрасту. Сейчас все не так тяжело физически, он работает за столом, но он чувствует себя все более болезненным и жестким в суставах.Офтальмолог Джека обеспокоен тем, что он назвал «Пятно» его глаза, его зрение пятнистое, а детали трудно разобрать, даже в новых очках. Он смотрит в зеркало и чудеса с количеством возрастных пятен, которые, кажется, поселились на его лице и тыльной стороне рук. Он думает: «Может, мне стоит проверь некоторые из них, когда я в следующий раз буду проходить медосмотр ». Он помнит, как волновалась его мать, когда на его Лицо отца было диагностировано как злокачественное.Он откидывается на спинку стула и вздыхает, массируя больные артритом колени. «Думаю, я просто стареет », — думает он. Я всегда знал, что это должно произойти, но я не думал, что это будет так скоро!
Джек прав в одном: он переживает ускоренное старение и страдает от того, что мы называем (из-за отсутствия лучшего слова) хроническое заболевание. Хронические болезни — это те недуги, которые мы часто ассоциируем с процессами старения, такими как артрит, дегенерация желтого пятна и даже некоторые формы рака.Можно ли отсрочить появление этих симптомов или даже помешали? Ученые, изучающие хронические заболевания, считают, что многие из них можно предотвратить. Ключ, кажется, связан с диетой (Garewal 1997, Papas 1999). Эпидемиологи, изучающие взаимосвязь между диетой и болезнью убедительно доказали важность определенных питательных веществ содержащиеся во фруктах и овощах (McLarty 1997, Mayne and Ziegler 1999).Эти важные питательные вещества называются антиоксидантами. Меньше чем три из пяти американцев потребляют их в достаточном количестве ежедневно (Krebs-Smith и другие. 1995). Эти питательные антиоксиданты из фруктов и овощей помогают нам контролировать окислительные процессы в нашем организме, которые могут повредить важные клеточные компоненты. Высокие показатели расхода энергии, воспаления, чрезмерное воздействие солнечного света и неправильное питание способствуют оксидативный стресс (Askew, 1995).Сильный окислительный стресс может повредить или убивают клетки (Гаттеридж и Холливелл, 1994). Ученые считают, что чрезмерный окислительный стресс в наших тканях может быть причиной многих хронические болезни.
Окислительный стресс — это термин, используемый для описания повреждающего окисление биологических тканей свободными радикалами (Гаттеридж и Холливелл, 1994). Свободные радикалы — это нестабильные, короткоживущие молекулы, которые особенно реактивные химические соединения, потому что у них есть неспаренный электрон в их внешняя орбита.Эти молекулы стремятся стабилизировать свою структуру. (объединить электроны на их внешней орбите) путем «похищения электрона» от ничего не подозревающего соседа (рис. 1). Когда это случается, свободный радикал снова стабилен, но молекула потерявший электрон может выйти из строя или даже стать свободным радикальный сам по себе.
Рисунок 1 — Что такое окислительный стресс?
Свободные радикалы — это нестабильные химические молекулы, которые постоянно формируются и разрушаются в вашем теле.Они самые часто молекулы на основе кислорода, углерода или азота. Молекулы кислорода с неспаренными электронами на их внешних орбитах особенно опасны разновидность. Их называют «активными формами кислорода». Реактивный формы кислорода — это нестабильные молекулы, содержащие кислород с неспаренными электроны на своей внешней орбите (рис. 2). Примеры активных форм кислорода — молекула супероксида, гидроксильная анион и синглетный молекулярный кислород (Gutteridge, Halliwell 1994).Обычно молекулы кислорода в организме необходимы для жизни и не повреждают. Однако небольшой процент этих молекул кислорода могут стать потенциально опасными для активных форм кислорода или свободных радикалов (Гаттеридж и Холливелл, 1994). Поскольку люди должны существовать в атмосфере кислорода и потребляют большие количества, чтобы выжить, они разработали очень эффективные системы антиоксидантной защиты для нейтрализации этих реактивных формы кислорода.Образование определенного количества свободных радикалов является нормальным часть обмена веществ. Наши системы антиоксидантной защиты обычно предотвращают свободные радикалы от причинения чрезмерного ущерба.
Рисунок 2 — Что такое свободные радикалы?
Считается, что определенные ситуации или условия приводят к образованию свободных радикалов и повышенному уровню окислительного стресс (таблица 1, Askew 1995).Высокие показатели энергии расходы и их отношение к окислительному стрессу могут быть лучше понимается путем рассмотрения аналогии «давление воды и негерметичный шланг ». Так же, как большее давление воды, приложенное к шлангу с точечная утечка делает утечку более выраженной, так же как и «метаболическая давление »(высокие темпы расхода энергии) вызывают больше электронов «вытекать» из нормально связанного электронного транспорта цепи в цитоплазму клетки, где эти электроны могут уменьшить молекулярный кислород к свободному радикалу, супероксид.
Факторы риска окислительного стресса:
|
Таблица 1 — Факторы риска окислительного стресс.
Другая теория предполагает, что ткань «голодает». для кислорода »может пострадать от свободных радикалов при повторной оксигенации. с кровью, в которой восстановлено нормальное содержание кислорода. Эта теория называется «раздувание тлеющих углей», и его можно сравнить с тлеющему углю, воспламеняющемуся при подаче воздуха. Такая ситуация может возникнуть после изнурительных тренировок на высоте. где напряжение кислорода не соответствует расходу энергии требуется.
Высокоэнергетические лучи в ультрафиолетовом спектре солнечного света действительно может «проникать» в дерму кожи. и передают достаточно энергии молекулам кислорода в дерме, чтобы сформировать особый тип «активных форм кислорода», синглетный молекулярный кислород. Эта молекула «возбудилась» ультрафиолетом. энергии, и один из его электронов поглотил достаточно энергии, чтобы вызвать он сам по себе поднялся на более высокую орбиталь, тем самым формируя потенциально повреждение непарной электронной конфигурации.Синглетный молекулярный кислород может «Сдирать» электроны с клеточных мембран, вызывая внутренние клеточное повреждение. Рак кожи, вызванный чрезмерным воздействием солнечного света, может получить его таким образом.
Другой фактор окислительного стресса связан с биохимические процессы, связанные с воспалением. Фагоцитотические клетки стремление к месту повреждения или травмы ткани может высвободить значительные количество свободных радикалов в процессе борьбы с инфекциями и воспалениями.
Вдыхание токсичных соединений в воздухе, которым мы дышим может также вызвать образование свободных радикалов (Таблица 2). Дым особенно раздражает легкие и может повредить из-за повышенного образования свободных радикалов (Gutteridge and Halliwell 1994). Большинство доказательств разрушительного воздействия острого и хронического дыма вдыхание происходит из исследований курения табака, но вдыхание дыма можно ожидать, что лесной пожар вызовет острую реакцию, аналогичную курению сигарет (но менее хроническому, чем).Мало данных существует, чтобы подтвердить или опровергнуть вдыхание дыма как предмет повышенного риска для пожарных. Шарки (1997a) рекомендовал пожарным вести осмотрительный подход. Избегайте воздействия дыма и соблюдайте диету, включающую антиоксидантные продукты, чтобы поддерживать здоровая иммунная система.
Дым
|
Таблица 2 — Дым и свободные радикалы.
Хорошая новость в том, что человеческое тело удивительно хорошо оборудованы, чтобы минимизировать окислительный стресс, вызванный повреждением свободными радикалами (Таблица 3) при условии, что мы сделаем все от нас зависящее. Мы должны предоставить наш организм с «биологическими антипиренами» или антиоксидантами питательные вещества, необходимые для нейтрализации свободных радикалов. Антиоксидантные питательные вещества могут быть минералы, витамины или фитохимические вещества растений. Минералы цинк, селен, магний и марганец действуют как важные кофакторы питательных веществ или «помощники» для ферментов, таких как супероксиддисмутаза и глутатионредуктаза.Эти минералы и ферменты работают согласованно. способ нейтрализовать свободные радикалы, такие как супероксид. Не отмечено флажком, эти плохие персонажи могут лишить электроны ничего не подозревающих сотовых соседние компоненты, приводящие к негерметичности клеточных мембран, нефункциональные ферментные белки и даже ошибки кодирования в молекулах ДНК.
Системы антиоксидантной защиты: Корпус «пожарных»
|
Таблица 3 — Антиоксидантная защита системы.
Антиоксидантные ферменты быстродействующие и очень эффективные при условии, что уровень проникновения свободных радикалов не является чрезмерным. Когда присутствует тяжелый окислительный стресс, и антиоксидантные ферменты подавлены за счет вторжения свободных радикалов, витаминов-антиоксидантов и антиоксидантов фитохимические вещества становятся последней линией защиты между нашими клетками и повреждение свободными радикалами. Большие сложные молекулы витаминов-антиоксидантов и фитохимические вещества могут напрямую взаимодействовать со свободными радикалами и «нейтрализовать» поглощая всю силу своей атаки, как сумоист охватит меньшего врага.Антиоксиданты нейтрализуют свободные радикалы. отдавая электрон для стабилизации свободных радикалов. В отличие от меньшего молекулы, которые могут быть атакованы свободными радикалами, эти большие органические, молекулы антиоксидантов «усваивают» потерю электрона. через резонанс между углеродными связями. Они сами не становятся свободные радикалы, ищущие электроны. Некоторые витамины-антиоксиданты, такие как витамин E (альфа-токоферол) и витамин C (аскорбат) действуют как «команда меток» партнеры для перехвата и нейтрализации свободных радикалов.Витамин Е липидный растворим и может позиционировать себя в мембране клеток и липопротеинов где он может «перехватывать» свободные радикалы, атакующие липидсодержащие клеточные мембраны. Как только витамин Е перехватил свободный радикал, он может передать «удар» водорастворимому витамину С. Таким образом, витамин C восстанавливает неподвижный витамин E в мембране и может, в свою очередь, регенерироваться другими антиоксидантными фитохимическими веществами в клетке или переходят из клетки в кровь и в конечном итоге выводятся моча.
Фитохимические вещества — это молекулы растительного происхождения (например, каротиноиды, флавеноиды, фитостерины, хлорофиллы, терпеноиды, индолы и аллильные соединения), потребляемые с пищей, которые не соответствуют действительности витамины, но могут быть очень мощными питательными антиоксидантами (Papas 1999). Растения выработали очень сложные механизмы защиты. из-за большого количества кислорода, образующегося при фотосинтезе. Преобразование даже небольших количеств этого кислорода к свободным радикалам потенциально может быть смертельным для растений (Halliwell and Gutteridge, 1993).Мы получаем защитный эффект этих мощных антиоксидантных фитохимикатов при мы потребляем фрукты и овощи. Пять порций фруктов и овощей в день поставляют нам достаточно этих антиоксидантов для предотвращения или борьбы с многие хронические заболевания, такие как рак и дегенерация желтого пятна (блок и другие. 1992).
Однако активные люди, работающие в удаленных местах на открытом воздухе обычно не имеют доступа к достаточному количеству свежих фруктов и овощей (Аскью 1995).Национальный институт рака и другие заинтересованные организации с профилактикой болезней рекомендуют съесть пять порций фруктов и овощи в день. Фактически, многие люди даже не употребляют пять порций. фруктов и овощей в день, когда они едят дома, близко в местный супермаркет (Krebs-Smith et al. 1995). Эта информация не умаляет значения диеты, но усиливает аргументы в пользу дополнение рациона антиоксидантными питательными веществами для людей, которые могут подвергаться повышенному окислительному стрессу.
-Продолжить-
Тепло и обезвоживание вызывают окислительное повреждение и антиоксидантную защиту после теплового стресса в инкубаторе и моделируемой волны тепла у пойманных в дикой природе четырехполосых полевых мышей Rhabdomys dilectus
Abstract
Волны жары известны своими катастрофическими последствиями массовой гибели людей из-за обезвоживания и повреждения клеток, но мало что известно о нелетальных последствиях выживания в условиях сильного теплового воздействия.Сильное тепловое воздействие может вызвать окислительный стресс, который может иметь негативные последствия для познания, воспроизводства и продолжительности жизни животных. Мы исследовали текущий окислительный стресс, испытываемый мезическими мышами, четырехполосной полевой мышью, Rhabdomys dilectus , с помощью моделирования тепловой волны с ad lib водой и более жестким температурным воздействием с минимальным количеством воды. Дикие четырехполосые полевые мыши были пойманы в период с 2017 по 2019 год. Мы предсказали, что дикие четырехполосые полевые мыши в моделировании аномальной жары будут демонстрировать меньшую восприимчивость к окислительному стрессу по сравнению с более сильным тепловым стрессом, который, вероятно, произойдет в будущем.Окислительный стресс определяли в печени, почках и головном мозге с использованием малонового диальдегида (MDA) и карбонила белка (PC) в качестве маркеров окислительного повреждения, а также супероксиддисмутазы (SOD) и общей антиоксидантной способности (TAC) в качестве маркеров антиоксидантной защиты. Тепловой стресс инкубатора вызывали повышением температуры тела животных до 39–40,8 ° C в течение 6 часов. Волна тепла (один жаркий день, за которым следует трехдневная волна тепла) была смоделирована с использованием температурного цикла, который дикие четырехполосые полевые мыши будут испытывать в своей местной среде обитания (определяемой по данным метеостанции с использованием температуры и влажности) с максимальной температурой окружающей среды 39 ° С.Печень и почки не продемонстрировали никаких изменений в моделируемой тепловой волне, но печень имела значительно более высокую активность СОД, а почки имели значительно более высокое перекисное окисление липидов в эксперименте с инкубатором. Обезвоживание значительно способствовало увеличению этих маркеров, о чем свидетельствует уменьшение массы тела после эксперимента. Мозг показал значительно более высокое перекисное окисление липидов после моделирования тепловой волны без каких-либо значительных изменений после эксперимента в инкубаторе.Значительное увеличение перекисного окисления липидов не коррелировало с массой тела после эксперимента. Величина и продолжительность теплового стресса в сочетании с обезвоживанием сыграли решающую роль в окислительном стрессе, испытываемом каждой тканью, и результаты демонстрируют важность измерения нескольких тканей для определения физиологического состояния животного. Текущие тепловые волны у этого вида могут вызвать окислительный стресс в мозгу, а в будущем тепловые волны, возможно, приведут к нагрузке на почки и печень в зависимости от состояния гидратации животных.
Образец цитирования: Jacobs PJ, Oosthuizen MK, Mitchell C, Blount JD, Bennett NC (2020) Тепло и обезвоживание, вызванное окислительным повреждением и антиоксидантной защитой после теплового стресса в инкубаторе и имитируемой волны тепла в дикой природе, пойманных четырех полосатых мышей Дилектус . PLoS ONE 15 (11): e0242279. https://doi.org/10.1371/journal.pone.0242279
Редактор: Марсело Гермес-Лима, Universidade de Brasilia, БРАЗИЛИЯ
Поступила: 14 мая 2020 г .; Одобрена: 29 октября 2020 г .; Опубликовано: 13 ноября 2020 г.
Авторские права: © 2020 Jacobs et al.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Все соответствующие данные находятся в рукописи и вспомогательных информационных файлах.
Финансирование: Это исследование было поддержано кафедрой DST-NRF SARChI по поведенческой экологии и физиологии млекопитающих при NCB, а также стипендиями для докторантов Университета Претории и стипендиями для аспирантов по международному сотрудничеству в Университете Претории. PJJ.Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили, что никаких конкурирующих интересов не существует.
Введение
Экстремальные климатические явления (волны тепла) представляют собой реальную угрозу биоразнообразию животных из-за различных летальных и сублетальных эффектов [1–4]. Смертельный тепловой стресс от волн тепла, вероятно, связан с обезвоживанием и тепловым повреждением клеток [5], при этом всего один день экстремальных температур приводит к массовому вымиранию находящейся под угрозой исчезновения птицы какаду Карнаби ( Calyptorhynchus latirostris ) [6] .За последние 20 лет произошло несколько других случаев массовой гибели людей, в результате которых погибли люди, летучие мыши и птицы [4, 7–9]. Сублетальные эффекты от многократного воздействия экстремальной жары могут включать потерю физического состояния, нарушение репродуктивной функции и снижение когнитивных функций, что может привести к общему сокращению популяции [3]. Согласно прогнозам, эти волны тепла станут более частыми и интенсивными в антропоцене [8, 10–12], что подчеркивает озабоченность по поводу исчезновения видов [13].
Обычно считается, что мелкие животные избегают последствий изменения климата за счет использования микросайтов в среде обитания, чтобы избежать экстремальных температур [14–17].В дополнение к использованию микросайтов, более мелкие животные имеют большее отношение площади поверхности к объему, что обеспечивает быструю потерю тепла при условии, что температура воздуха ниже температуры кожи [18]. Большее отношение площади поверхности к объему также может быть вредным, так как быстрая потеря тепла сопровождается быстрым нагревом, а без присутствия микросайтов может резко подорвать выживаемость мелких животных [14].
Животные могут поведенчески смягчать последствия теплового стресса, выпивая больше воды [19–21], снижая термогенную активность, уменьшая потребление пищи [22, 23] и снижая уровень активности [24, 25].Грызуны не потеют (кроме подушечек ног) [26, 27] и не дышат, чтобы увеличить потерю воды за счет испарения [28]. Вместо этого грызуны в основном используют распространение слюны для потери тепла за счет испарения, в то время как виды грызунов, которые не используют распространение слюны, страдают от чрезмерной реакции на тепловой стресс [20].
Одной из закономерностей, наблюдаемых как следствие антропогенного изменения климата, является географическое перемещение видов, чтобы избежать повышенных температур [10]. Предполагается, что один южноафриканский вид, мезическая четырехполосная полевая мышь, Rhabdomys dilectus (de Winton, 1987), находится в группе риска и может претерпеть географический сдвиг, чтобы избежать изменения климата [29, 30].Исследуемый вид предпочитает биомы пастбищ и саванн с напочвенным покровом и водой [19], при этом напочвенный покров обеспечивает тепловой буфер, позволяющий избежать экстремальных температур [29]. Родственные пустынные обитатели четырех полосатых полевых мышей Rhabdomys pumilio (Sparrman 1784) имеют термонейтральную зону (TNZ) 32 ° C [31], TNZ мезических видов еще предстоит определить.
Аэробные организмы постоянно производят активные формы кислорода (АФК) в результате метаболизма и используют антиоксиданты для снижения избыточных АФК для поддержания окислительно-восстановительного баланса [32, 33].Несмотря на негативный оттенок АФК, АФК важны для клеточной передачи сигналов [34], воспалительного ответа [35], изменения поглощения и метаболизма глюкозы [36], иммунного ответа [37], что позволяет препарату бороться с гипоксическим стрессом [38] ] и осмопротекторной передачи сигналов [39].
Тепловой стресс и обезвоживание независимо друг от друга могут нарушить этот баланс [40–42]. Тепловой стресс может нарушить этот баланс из-за чрезмерного метаболического производства АФК и снижения антиоксидантной активности, что приводит к состоянию окислительного стресса [43, 44].Обезвоживание нарушает этот баланс, вызванный гиперосмоляльностью, вызванной сокращением клеток и нарушением функциональности мембран [45–47]. Этот чрезмерный окислительный дисбаланс в пользу ROS может в конечном итоге привести к окислительному повреждению ДНК [48, 49], липидов [50] и белков [51, 52]. Окислительный стресс может снизить когнитивные и двигательные функции [53], фертильность [54, 55] и продолжительность жизни [56, 57]. Следовательно, биомаркеры окислительного стресса могут дать очень важную информацию о физиологическом состоянии организма [58, 59], позволяя установить, уязвимо ли животное к изменениям в окружающей его среде.Однако нам не известны какие-либо предыдущие исследования, в которых измеряли уровни окислительного стресса в различных тканях в результате воздействия различных тепловых режимов у четырехполосых полевых мышей.
Мы измерили реакцию на тепловой стресс с точки зрения окислительного повреждения и антиоксидантной защиты четырехполосых полевых мышей после эксперимента по тепловому стрессу и дегидратации в инкубаторе и моделированной тепловой волны. Тепловой стресс инкубатора — это воздействие лихорадки всего тела, которое является показателем верхнего предела животного и сбоя системы терморегуляции.Смоделированная волна тепла представляет текущие экстремальные явления тепла, когда животные были пойманы (собраны и смоделированы данные метеостанции). Окислительное повреждение и антиоксидантная защита были измерены в трех органах, а именно в печени, почках и головном мозге. На эти три ткани приходится более 60% скорости метаболизма в организме, по крайней мере, у людей [60, 61]. Мозг был выбран из-за его восприимчивости к тепловому стрессу и, в частности, из-за его участия в полиорганной дисфункции во время теплового стресса [62, 63].Почка была выбрана на основании ее важности для удержания воды и обилия длинноцепочечных полиненасыщенных жирных кислот в составе почечных липидов [64], такие молекулы особенно чувствительны к перекисному окислению липидов [65]. Наконец, была выбрана печень, поскольку она является важным источником глутатиона [66], наиболее важного антиоксиданта, определяющего общую антиоксидантную способность (TAC) в тканях [67]. В дополнение к значимости печени для TAC, тепловой стресс также связан с повышенным окислительным повреждением и антиоксидантной защитой в этой ткани [68, 69], частично из-за колебаний лабильного железа [70].
Мы предсказали, что четырехполосная полевая мышь будет демонстрировать повышенную восприимчивость к окислительному стрессу, вызванному тепловым стрессом, в эксперименте в инкубаторе по сравнению с моделируемой волной тепла по сравнению с их соответствующими контролями. В этом контексте мы определяем окислительный стресс как значительные изменения в окислительном повреждении и антиоксидантной защите по сравнению с контролем.
Окислительное повреждение и антиоксидантная защита происходят одновременно, поэтому усиление антиоксидантной защиты (фермент супероксиддисмутаза (SOD) или TAC) будет демонстрировать повышенный окислительный стресс, тогда как окислительное повреждение (липид и / или белки) будет представлять собой нарушение антиоксидантной защиты.
Методы
Комитет по этике животных Университета Претории (AEC) с номером разрешения EC008-17.
Содержание животных
Десять взрослых самцов четырехполосых полевых мышей были пойманы в дикой природе и использованы в эксперименте по тепловому стрессу в инкубаторе, а тринадцать взрослых самцов животных были пойманы в дикой природе для моделирования тепловой волны. Самцов использовали для предотвращения половых различий при окислительном стрессе [71–73]. Полевые мыши были отловлены в заповеднике Ритвлей (3800 га, Центурион, ЮАР, -25 ° 53 ‘29.39 «ю.ш., 28 ° 17 ‘22,80» в.д.) с использованием металлических ловушек Шермана (26 см x 9 см x 9 см) с приманкой из смеси овса и арахисового масла. Ритвлей — местный заповедник, и мы получили письменное разрешение от менеджера на выполнение здесь работ. Мыши, использованные в эксперименте с тепловым стрессом в инкубаторе, были пойманы с марта по июнь 2017 года; в то время как те, которые использовались в эксперименте с моделированной волной тепла, были отловлены в период с января 2019 года по март 2019 года. После отлова мышей содержали в полевых клетках, а затем перевозили на факультет зоологии и энтомологии Университета Претории.Средняя масса тела полосатой мыши, использованной в эксперименте с тепловым стрессом в инкубаторе, до эксперимента составляла 62,7 ± 16,4 стандартного отклонения (SD) г, тогда как средняя масса тела перед экспериментом для эксперимента с моделированием тепловой волны составляла 43,1 ± 5,6 (SD ) грамм. Мышей еженедельно взвешивали для оценки состояния тела. Мышей взвешивали с точностью ± 0,1 г до и после эксперимента. Животных помещали в комнату в Университете Претории и акклиматизировали к фотопериоду 12L: 12D, относительной влажности 40% и температуре около 23 ° C.Эта температура также напоминает среднюю температуру летнего дня. Перед использованием в обоих экспериментах мышей содержали в неволе не менее 60 дней. Этот начальный период акклиматизации был проведен, чтобы свести к минимуму влияние стресса путем помещения диких животных в неволи. Всех мышей содержали индивидуально в стандартных контейнерах для лабораторных мышей размером 40 x 25 x 12 см, выстланных деревянной стружкой и камнем, рулонах туалетной бумаги, небольшом пластиковом контейнере для гнезда и папиросной бумаге для гнездового материала.Животным давали воду и корм ad libitum . Еда подавалась через день в виде семян подсолнечника, кукурузы, банана, моркови, яблочной стружки или ломтиков сладкого картофеля. Клетки чистили еженедельно.
Эксперимент 1: Схема и протокол эксперимента по тепловому стрессу в инкубаторе
Обработка тепловым стрессом использовалась для исследования маркеров окисления после 6-часовой гипертермии всего тела, острого теплового стресса (температура тела 39–40,8 ° C (T b )) и стресса обезвоживания в инкубаторе.Этот протокол теплового стресса в инкубаторе соответствовал протоколу Остберга, Каплана [74], 6-часовой период T b около 39–40,8 ° CT b использовался для индукции гипертермии всего тела, которая могла привести к окислительной реакции. реакция на тепловой стресс.
Контрольная группа, поддерживаемая при температуре окружающей среды (T a ) 25 ° C (в ядре животных T b в среднем ± 36,6 ° C), служила для определения маркеров окисления без влияния теплового стресса. Людей случайным образом распределили на группу теплового стресса и контрольную группу.Наконец, во время этого эксперимента не были обеспечены пища и вода, чтобы предотвратить повышение метаболизма и влажности соответственно, что повлияет на потерю тепла.
Для определения ядра животного T b термочувствительные PIT-метки (BioTherm, Identipet), которые можно считывать с помощью считывающего устройства PIT-меток, вводили внутрибрюшинно с использованием стерильных шприцев по крайней мере за неделю до эксперимента. Из-за продолжительности эксперимента всем людям вводили 1 мл физиологического раствора в день 1 эксперимента непосредственно перед термической манипуляцией, чтобы помочь животным создать буфер против обезвоживания в течение 6-часового периода времени.
Инкубатор предварительно нагревали до 41 ° C T a (тепловой стресс) или 25 ° C T a (контроль) перед помещением животного в инкубатор. Затем животных переносили в экспериментальную камеру размером 25 х 13 х 16 см и помещали в инкубатор. Свет внутри инкубатора был выключен, чтобы свести к минимуму дополнительное тепло от источников света внутри инкубатора. Ядро животных T b отслеживали с помощью антенны для считывания PIT; Температуру инкубатора (T a ) регулировали так, чтобы поддерживать T b на уровне около 39-40.8 ° C, требуемый диапазон (таблица S1). Читатели были настроены на запись каждые 10 секунд. Через 6 часов животных сняли с эксперимента.
Эксперимент 2: Схема эксперимента с моделированием тепловой волны и протокол
Контроль, переход и моделирование тепловых волн.
Четырех полосатых полевых мышей поместили в большие пластиковые индивидуальные контейнеры (60 x 40 x 30 см), выстланные стружкой, небольшой пластиковый контейнер для гнезда и рулон туалетной бумаги и папиросную бумагу, предоставленные в качестве материала для гнезд.Освещение было настроено на график длинного дня 14L: 10D, который включал 4 часа «сумерек» с увеличивающейся и уменьшающейся интенсивностью света, имитирующей рассвет и сумерки соответственно. Фотопериод длинного дня сопровождался типичным температурным циклом, который был определен на основе климатических данных, полученных от службы погоды Южной Африки (рис. 1).
Рис. 1. Фотопериод и температурный профиль, используемые для моделирования контроля, перехода и температурных волн.
Белые области представляют дневное время, а затемненные области — ночное время.Черные линии представляют изменения в экспериментальных условиях, при этом контрольные температуры продолжались 5 дней, переходные температуры продолжались 1 день, а моделируемая волна тепла длилась 3 дня. Красная линия представляет температурный цикл, которому подвергались животные в течение 9-дневного эксперимента.
https://doi.org/10.1371/journal.pone.0242279.g001
Контрольная группа мышей была создана для определения влияния суточного температурного цикла от среднего летнего дня (рассчитано на основе данных службы погоды Южной Африки). ) для моделирования минимального теплового стресса или его отсутствия, по крайней мере, по сравнению с волной тепла.Контрольных мышей содержали в течение девяти дней по циклу, который колебался между минимумом 19 ° C и максимумом 29 ° C (рис. 1). Напротив, при моделировании аномальной жары всех животных сначала поддерживали при контрольной температуре в течение пяти дней, затем переводили на температуру, которая колебалась между минимумом 22 ° C и максимумом 34 ° C в течение одного дня, после чего следовала температура волны тепла. которая колебалась от минимум 24 ° C до максимума 39 ° C в течение полных трех дней. Во время изменений температуры (контроль перехода и переход к аномальной жаре) температуры устанавливались так, чтобы соответствовать новым условиям обработки, начиная с 9:00 утра.Во время экспериментов влияние экспериментатора сводилось к минимуму с 30-минутным интервалом (с 8:00 до 8:30) для кормления и проверки общего благополучия животных. Мышам давали фиксированное количество воды и корма (семена подсолнечника каждый день, свежие фрукты / овощи каждый второй день).
Расчет смоделированных температур аномальной жары
Данные метеостанции, предоставленные Южноафриканской метеорологической службой, были скорректированы с использованием индекса температуры-влажности (THI).Этот индекс был рассчитан на основе температур воздуха по влажному и сухому термометрам для конкретного дня по следующей формуле: THI = 0,72 (W + D) + 40,6, где W — влажный термометр, а D — температура по сухому термометру в градусах Цельсия. Следующий веб-сайт использовался для преобразования значений климатических данных в значения теплового индекса (http://www.wpc.ncep.noaa.gov/html/heatindex.shtml). THI использовался для корректировки постоянной влажности внутри комнат контроля температуры, чтобы животные воспринимали воспринимаемую температуру воздуха как фактические температурные условия, а не повышенную температуру с более высокой влажностью.
Эвтаназия и иссечение тканей
Всех мышей умерщвляли передозировкой изофлурана сразу в конце каждого соответствующего эксперимента. Все образцы были собраны в одно и то же время, чтобы предотвратить влияние суточного ритма, при этом ткани собирались в том же порядке в течение 10 минут при вскрытии с приблизительно 1-минутным интервалом между тканями. Это было сделано для предотвращения и / или минимизации денатурации белков и метаболитов от вскрытия до мгновенного замораживания. Печень, почки и мозг собирали и быстро замораживали в жидком азоте, а затем хранили при -80 ° C до анализа (менее 6 месяцев для всех тканей).
Анализы окислительного повреждения и антиоксидантной защиты
Гомогенизация тканей.
Ткани (печень, мозг и почки) гомогенизировали на льду из расчета 10% веса на объем в 20 мМ буфере HEPES (N-2-гидроксиэтилпиперазин-N9-2-этансульфоновая кислота) на базовом гомогенизаторе Ultra Turrax T18 (IKA, Staufen, Германия) для теплового стресса инкубатора и на гомогенизаторе Ultra Turrax T25 Basic (IKA Labortechnik, Германия) для эксперимента с моделированием тепловой волны. Затем гомогенаты хранили в морозильной камере -80 ° C до момента проведения анализа (менее 6 месяцев для всех тканей).
Малоновый диальдегид: тепловой стресс инкубатора и имитация тепловой волны.
Концентрации МДА во всех гомогенатах тканей (т.е. печени, почках и головном мозге) были измерены с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) с использованием стандартных методик [75]. Подготовленные образцы вводили 20 мкл в систему ВЭЖХ Agilent (InfinityLab Solutions, Калифорния, США), снабженную защитной колонкой ODS 5 мкм и колонкой Hewlett-Packard Hypersil 5 мкм ODS 100 x 64,6 мм, поддерживаемой при 37 ° C. Подвижной фазой был метанол-буфер (40:60, об. / Об .; 50 мМ безводный раствор одноосновного фосфата калия при pH 6.8), протекая изократически в течение 3,5 мин при скорости потока 1 мл в мин. Данные собирали с использованием флуоресцентного детектора (RF2000; Dionex), установленного на 515 нм (возбуждение) и 553 нм (испускание). Для калибровки стандартная кривая была построена с использованием исходного раствора ТЕР (5 мкМ в 40% этаноле), серийно разбавленного 40% этанолом. Результаты выражены в мкМоль МДА на 1 г гомогената.
Карбонил белка: тепловой стресс инкубатора.
Концентрации ПК были измерены в гомогенатах тканей (т.е.е. печень, почки и мозг). Окисление или окислительное расщепление белков приводит к образованию карбонильных групп по стандартной методике [76], которые ковалентно реагируют с 2,4-динитрофенилгидразином (DNPH) с образованием 2,4-динитрофенил (DNP) гидразона. ДНФ обнаруживают спектрофотометрически при длине волны 370 нм [77]. Протокол нашего исследования отличался использованием 1 мл 20% TCA вместо 125 мкл 50% TCA. Поглощения считывали с помощью планшет-ридера Spectramax M2 (Molecular Devices Corp., Саннивейл, Калифорния, США).Образцы были проанализированы в двух экземплярах с повторяемостью r = 0,99 между контролем и образцами. Содержание белка определяли с помощью анализа Брэдфорда с использованием стандартной кривой бычьего сывороточного альбумина (BSA). 180 мкл раствора гуанидин-HCL добавляли к 20 мкл контрольного образца (раствор HCL) в соотношении 1:10. Поглощение считывали при 280 нМ с использованием планшет-ридера Spectramax M2 (Molecular Devices Corp., Саннивейл, Калифорния, США). Образцы для анализа Брэдфорда были проанализированы в двух экземплярах с повторяемостью r = 0.99. Результаты выражены в мкМоль на грамм белка.
Карбонил белка: Имитация тепловой волны.
PC был измерен в гомогенатах тканей (т.е. печени, почек и головного мозга). Концентрации ПК измеряли с помощью имеющегося в продаже набора (Sigma-Aldrich, номер по каталогу MAK094, Миссури, США), считывая оптическую плотность образцов с помощью высокопроизводительного микропланшетного спектрофотометра Eon (BioTek Instruments Inc., США). Содержание белка в каждом образце анализировали с помощью анализа BCA (Sigma-Aldrich, cat.нет. BCA1 и B9643, Миссури, США) с использованием стандарта BSA (Sigma-Aldrich, каталожный номер P0914, Миссури, США). Образцы ПК были проанализированы в двух экземплярах с повторяемостью r = 0,70. Образцы BCA были проанализированы в двух экземплярах с повторяемостью r = 0,83. Результаты выражены в мкМоль на грамм белка.
Супероксиддисмутаза: тепловой стресс инкубатора и имитация тепловой волны.
Активность СОД была измерена во всех гомогенатах тканей (то есть в печени, почках и головном мозге). СОД — ферментный антиоксидант, катализирующий дисмутацию супероксид-анионов до кислорода и перекиси водорода [78].Анализы проводились по стандартной методике [79]. Содержание SOD измеряли с помощью имеющегося в продаже набора (Superoxide Dismutase Assay Kit, Cayman Chemical Co., Ann Arbor, MI, USA), который измеряет процент супероксидных радикалов, которые подвергаются дисмутации в данном образце. Поглощение измеряли при 450 нм с использованием планшет-ридера Spectramax M2 (Molecular Devices Corp., Саннивейл, Калифорния, США). Образцы были проанализированы в двух экземплярах с повторяемостью r = 0,82. Результаты выражены в единицах активности СОД на грамм гомогената.
Общая антиоксидантная способность: тепловой стресс инкубатора.
TAC в гомогенатах печени, почек и мозга определяли количественно с использованием коммерчески доступного набора (Antioxidant Assay Kit, Cayman Chemical Co., Ann Arbor, MI, USA), который измеряет окисление ABTS (2,29-азино-ди- [3-этибензтиазолинсульфонат]) метмиоглобином, который ингибируется неферментативными антиоксидантами, содержащимися в образце. Окисленный ABTS измеряется спектрофотометрически при длине волны 750 нм. Способность антиоксидантов в образце ингибировать окисление ABTS сравнивается со способностью известных концентраций Trolox, и результаты выражаются в мМ эквивалентов Trolox на грамм гомогената.Образцы были проанализированы в двух экземплярах с повторяемостью r = 0,90.
Общая антиоксидантная способность: Имитация тепловой волны.
ТАС в гомогенатах печени, почек и мозга определяли количественно с использованием коммерчески доступного набора (Sigma-Aldrich, кат. № MAK187 и D2650, Миссури, США), следуя стандартным методикам [80]. Концентрация крупномолекулярных и низкомолекулярных антиоксидантов и общая антиоксидантная способность могут быть измерены путем преобразования ионов Cu 2+ в Cu + , причем восстановленный ион Cu + хелатируется с помощью колориметрического зонда, считываемого при поглощении 570 нм. .TAC сравнивают со стандартом антиоксидантной активности в эквивалентах Trolox (в 4-20 нмоль / лунку). Поглощение измеряли с помощью высокопроизводительного микропланшетного спектрофотометра Eon (BioTek Instruments Inc., США). Образцы были проанализированы в двух экземплярах с повторяемостью r = 0,95. Результаты выражены в мМ эквивалентов Trolox на грамм гомогената.
Статистический анализ
Утерян один контрольный образец почки на сумму R . dilectus в процессе анализа эксперимента с моделированной волной тепла.Данные были проверены на нормальность и выбросы, выбросы были сохранены для сохранения размера выборки. Нормальность проверялась с помощью теста Шапиро-Уилка и Колмогорова-Смирнова. Однородность дисперсии проверяли с помощью теста Левена и теста Брауна-Форсайта. Данные были преобразованы в логарифмическую форму там, где нормальность не наблюдалась, и мы использовали соответствующий статистический тест для неравных дисперсий, когда не наблюдалась однородность дисперсий. Уровни MDA, PC, SOD и TAC состояли из данных с одной независимой переменной (лечение), разделенной на две группы (контроль против теплового стресса).Каждую ткань анализировали отдельно. Исходя из этого, были проведены t-тесты независимых выборок, чтобы определить разницу в тепловом стрессе инкубатора и моделированной обработки тепловыми волнами от их соответствующих контролей. ANOVA с повторными измерениями использовался, чтобы определить, значительно ли изменилась масса тела (до и после) для каждого лечения (контроль и стресс) для каждого эксперимента отдельно (инкубатор и моделируемая тепловая волна). Сообщается интерактивный термин масса тела x лечение. Для значимых лечебных эффектов была проведена частичная корреляция, чтобы определить, коррелировала ли дегидратация (определяемая по изменениям массы тела до и после эксперимента) с окислительным маркером.Значимость рассчитывалась при P <0,05. Все анализы были выполнены с использованием SPSS (версия 26) (IBM Corp. Armonk, NY). Результаты представлены как средние значения ± s.e.
Результаты
Эксперимент 1: Нагревание инкубатора и стресс от обезвоживания
Перекисное окисление липидов после эксперимента с тепловым стрессом в инкубаторе существенно не отличалось от контроля в печени (t-критерий, t 8 = 0,85, p = 0,42 или мозг (t-критерий, t 8 = 2,01, p = 0,10), но был значительно выше в почках (t-критерий, t 8 = 2.70, р = 0,027) (рис. 2А) по сравнению с контролем. После эксперимента с тепловым стрессом в инкубаторе ткани существенно не различались по окислению белка по сравнению с контролем (печень: t-тест, t 8 = 0,53, p = 0,61; почки: t-тест, t 8 = 1,03, p = 0,33; мозг: t-тест, t 8 = 1,13, p = 0,29) (рис. 2B). SOD после эксперимента с тепловым стрессом в инкубаторе существенно не отличался от контроля для почек (t-критерий, t 8 = 1,69, p = 0,13) или мозга (t-критерий, t 8 = 0.17, p = 0,87), но был значительно выше в печени (t-критерий, t 7,34 = 2,42, p = 0,045) по сравнению с контролем (рис. 2C). ОДУ после эксперимента с тепловым стрессом в инкубаторе существенно не различались ни в одной ткани (печень: t-критерий, t 8 = 0,94, p = 0,93; почки: t-критерий, t 8 = 0,72, p = 0,49; мозг : t-тест, t 8 = 0,58, p = 0,58) (рис. 2D). Группа теплового стресса инкубатора имела значительно большее изменение массы тела на 4,22 ± 1,79% по сравнению с контрольной группой, у которой было 0.Изменение массы тела после эксперимента на 45 ± 0,66% (F 1 = 23,47, p = 0,001) (таблица S2). Активность SOD печени (N = -0,753, df = 7, p = 0,019) и MDA почек (r = -0,763, df = 7, p = 0,017) имели значительную отрицательную корреляцию с массой тела после эксперимента при контроле за телом. масса перед экспериментом (таблица S2).
Рис. 2. Среднее значение A) малоновый диальдегид B) карбонил белка C) супероксиддисмутаза D) общая антиоксидантная способность мозга, почек и печени у Rhabdomys dilectus (N = 5) в зависимости от воздействия теплового стресса в инкубаторе.
Планки погрешностей представляют ± s.e. Достоверность при p <0,05.
https://doi.org/10.1371/journal.pone.0242279.g002
Эксперимент 2: Моделирование тепловой волны
После смоделированной волны тепла перекисное окисление липидов существенно не отличалось от контроля для печени (t-критерий, t 11 = 0,78, p = 0,45) или почек (t-критерий, t 10 = 0,35, p = 0,74), но был значительно выше для мозга (t-критерий, t 11 = 3.10, p = 0,010) (рис. 3А). Окисление белков после моделируемой волны тепла существенно не отличалось от контроля для любой из трех тканей (печень: t-критерий, t 11 = 1,63, p = 0,13; почки: t-критерий, t 10 = 1,67 , p = 0,13; мозг: t-тест, t 11 = 1,74, p = 0,11) (рис. 3B). После смоделированной волны тепла SOD существенно не отличался от контроля для всех тканей (печень: t-критерий, t 11 = 0,38, p = 0,71; почки: t-критерий, t 10 = 0.35, p = 0,73; мозг: t-тест, t 11 = 0,14, p = 0,89) (рис. 3C). Ткани существенно не отличались от контроля в TAC после моделируемой волны тепла (печень: t-критерий, t 11 = 2,18, p = 0,052; почки: t-критерий, t 10 = 0,038, p = 0,97; мозг: t-тест, t 11 = 0,27, p = 0,79) (рис. 3D). Обе экспериментальные группы имели чистую положительную массу тела без существенной разницы (F1 = 2,23, p = 0,15) после эксперимента, с контрольной группой с 7,96 ± 7.Изменение массы тела на 36%, а в группе теплового стресса изменение массы тела после эксперимента составило 1,12 ± 7,28% (таблица S2). Для MDA головного мозга значимой частичной корреляции не наблюдалось (p = -0,491, df = 10, p = 0,11) (таблица S2).
Рис. 3. Среднее значение A) малоновый диальдегид B) карбонил белка C) супероксиддисмутаза D) общая антиоксидантная способность мозга, почек и печени Rhabdomys dilectus как функция моделируемой волны тепла.
Контрольные ткани N = 7 (почки N = 6) и моделированная волна тепла N = 6.Планки погрешностей представляют ± s.e. Достоверность при p <0,05.
https://doi.org/10.1371/journal.pone.0242279.g003
Обсуждение
Маркеры окислительного стресса значительно изменились в ответ на два различных режима теплового стресса по сравнению с их контролем, что позволяет предположить, что тепловой и дегидратационный стресс могут изменить окислительный баланс в определенных тканях у четырех полосатых полевых мышей. Обезвоживание определяли по изменению массы тела, при этом ожидается, что масса тела, превышающая 2%, приведет к обезвоживанию [81, 82].Среднее значение для людей намного превышало это значение, и поэтому вполне вероятно, что люди были обезвожены. В контрольной группе инкубатора мыши в целом продемонстрировали чистый прирост массы тела, что свидетельствует о том, что они были гидратированы после эксперимента. Измерения массы тела проводились перед инъекцией физиологического раствора, что объясняло чистый прирост массы тела в контрольной группе, в то время как экспериментальная группа потеряла вес после инъекции и более, что привело к чистой потере массы тела. После теплового стресса в инкубаторе печень продемонстрировала антиоксидантную защиту за счет более высокой активности СОД, предотвращающей значительное окислительное повреждение.В отличие от этого почки были подвержены перекисному окислению липидов со значительно более высоким уровнем МДА. Интересно, что печень и почки не показали каких-либо значительных изменений в окислительном повреждении или антиоксидантной защите после смоделированной волны тепла, а в мозге наблюдались значительно более высокие уровни перекисного окисления липидов.
Величина и продолжительность теплового стресса сильно влияет на реакцию тканей [83, 84]. Эксперимент в инкубаторе характеризовался высокой величиной и продолжительностью теплового стресса, который приводил к быстрому притоку тепла и высоким тепловым нагрузкам в тканях [83].Напротив, в моделируемой волне тепла, несмотря на гораздо большую продолжительность теплового стресса (3 дня), общая величина теплового стресса, испытываемого животным каждый день, в целом была меньше (± 3 часа в день). Тепловой стресс инкубатора привел к чистой потере воды у людей, вызывая обезвоживание, тогда как достаточное количество воды (еды и питья) во время моделируемой волны тепла позволило людям гидратироваться, что, возможно, привело к снижению реакции на окислительный стресс из-за отсутствия чистой потери воды. Таким образом, восприимчивость к окислительному повреждению, вызванному тепловым стрессом, может сильно зависеть от продолжительности и величины теплового стресса в зависимости от ткани, а также подчеркивает важность наличия воды для предотвращения серьезного обезвоживания.Тепловой стресс и обезвоживание вместе, вероятно, приводят к комбинированному эффекту и усугубляются в зависимости от продолжительности и величины теплового стресса. Это исследование продемонстрировало, что предотвращение сильного обезвоживания может минимизировать последствия окислительного стресса. Ранее было обнаружено, что стресс обезвоживания не приводит к полному восстановлению после регидратации [41], и будущие исследования могут позволить изучить окислительный баланс в тканях в аналогичных условиях с периодом восстановления.
Несколько исследований, посвященных тепловому окислительному стрессу печени, продемонстрировали повышенное перекисное окисление липидов и снижение активности СОД [68, 85–88]. Тепловая нагрузка (количество поглощенного тепла) во время теплового стресса особенно важна для печени, так как печень показала 21-кратное увеличение белков теплового шока (HSP) (защитные белки в ответ на тепловой стресс) по сравнению с 12-кратным увеличением белков теплового шока. ВТН при меньшей тепловой нагрузке [83]. В дополнение к большему количеству HSP, продуцируемых во время высоких тепловых нагрузок в печени, более высокий тепловой стресс и / или состояние дегидратации привели к быстрой активации активности СОД [87, 89–91].Печень подвергается воздействию гиперосмотических жидкостей в непатогенных условиях и может стать гиперосмотической при патологических условиях, что может привести к окислительному стрессу [45, 92, 93]. Настоящее исследование продемонстрировало значительную повышающую регуляцию активности СОД при тепловом и дегидратационном стрессе, с аналогичным открытием у Xenopus laevis (Daudin 1802), где активность СОД увеличивалась [94]. Из-за того, что активность СОД значительно увеличилась, а не уменьшилась, обезвоживание могло сыграть большую роль в окислительном стрессе, испытываемом в печени.Напротив, поскольку во время смоделированной волны тепла не наблюдалось значительного повышения активности антиоксидантных ферментов, мы полагаем, что теплового стресса, наряду с отсутствием сильного обезвоживания, было недостаточно, чтобы вызвать какой-либо значительный окислительный стресс в этой ткани.
Эффект окислительного повреждения и антиоксидантной защиты в почках в ответ на болезнь (например, сахарный диабет) [95, 96], гиперосмолярные состояния [45, 97, 98] и выработку HSP в ответ на тепловой стресс хорошо документированы [83 , 99–101].Однако литературы о влиянии теплового стресса на окислительный баланс почек очень мало; острый тепловой стресс от упражнений не вызвал значительного окислительного повреждения у крыс Sprague-Dawley [102], но мыши, подвергшиеся тепловому стрессу, имели более высокое перекисное окисление липидов и снижение активности СОД [103]. У цыплят-бройлеров острый тепловой стресс вызвал незначительное снижение активности СОД наряду с более низким уровнем перекисного окисления липидов по сравнению с контролем [88]. Золотая рыбка, Carassius auratus (Linneaus, 1758) в ответ на тепловой стресс демонстрировала повышенное перекисное окисление липидов, минимальные изменения активности СОД, но повышенное содержание ферментов глутатиона, которые демонстрировали более высокую экспрессию других антиоксидантных ферментов в ответ на тепловой стресс.Почки чувствительны к окислительному повреждению [104, 105], которое вызвано гиперосмоляльностью, что более вероятно под действием повышенных температур, приводящих к обезвоживанию [98]. В этом исследовании почки, вероятно, подверглись тепловому стрессу и дегидратации (наблюдались по дефициту% массы тела), что могло привести к гиперосмоляльности [98, 106]. Гиперсомоляльность в почках активирует путь полиол-фруктокиназы и, возможно, хронические эффекты вазопрессина, вызывающие повреждение канальцев и клубочков, которые вызывают окислительное повреждение [98].В этом исследовании подчеркивается важность гидративного состояния почек, поскольку ограниченная доступность воды, наряду с обезвоживанием после эксперимента в инкубаторе, была связана со значительно повышенным окислительным стрессом. Это также может объяснить, почему животные, возможно, стали активными во время моделируемой волны тепла, чтобы пить воду, чтобы предотвратить обезвоживание [19], и, в свою очередь, предотвратить окислительный стресс почек. В целом, окислительный стресс почек может в значительной степени зависеть от способности животных концентрировать мочу, что приводит к различной толерантности к гиперосмоляльности, а у пустынных животных более выражен оксидативный стресс почек [107–109].
Мозг известен своей восприимчивостью к тепловому удару, который приводит к полиорганной дисфункции [63, 110, 111]. В мозге лабораторных мышей, подвергшихся острому тепловому стрессу от физических упражнений, наблюдалось снижение уровня МДА и ПК [102], однако во время острого теплового стресса при экстремальных температурах активность СОД мозга снижалась, что сопровождалось увеличением перекисного окисления липидов [62, 111, 112]. Напротив, моделируемая волна тепла продемонстрировала повышенное перекисное окисление липидов, но не изменила активность антиоксидантных ферментов [62, 111, 112].Несмотря на величину и продолжительность теплового стресса в эксперименте с инкубатором, в мозге не наблюдалось значительного увеличения окислительного повреждения. Продолжительность теплового стресса после смоделированной волны тепла была намного больше и, возможно, нарушила проницаемость гематоэнцефалического барьера (ГЭБ) и привела к каскадному эффекту повышенного окислительного повреждения [113, 114]. Из-за того, что обезвоживание имело минимальный эффект после смоделированной волны тепла, вполне вероятно, что одного теплового стресса было достаточно, чтобы вызвать окислительный стресс в мозгу в течение длительных периодов времени, при этом более жесткие температурные воздействия могут быть более опасными [115].
В свете изменения климата, в настоящее время для мезо-сумеречного грызуна, четырехполосной полевой мыши, трехдневной волны тепла со свободно доступной водой достаточно, чтобы вызвать окислительное повреждение в мозге, при измерении в отсутствие поведенческой и физиологической терморегуляции ( например, микросайты). В дополнение к текущим условиям (при условии отсутствия поведенческой и физиологической терморегуляции) температура и обезвоживание всего тела в диапазоне температур и обезвоживания, вероятно, могут привести к окислительному стрессу почек и печени.При обезвоживании почка страдает окислительным повреждением, что подчеркивает важность воды для животных во время теплового стресса для компенсации обезвоживания и потенциальной регидратации [19]. Однако неясно, в какой степени механизмы восстановления после окислительного повреждения могут уменьшить потенциальные сублетальные последствия окислительного стресса, вызванного нагреванием [41, 116–120]. Различия, наблюдаемые между тканями, демонстрируют важность оценки окислительного повреждения и антиоксидантной защиты в разных тканях для получения обзора физиологического состояния организма [61].
Благодарности
Мы хотим поблагодарить профессора Криса Велдона и профессора Дункана Кромарти за предоставление оборудования. Амбадж Шарма за помощь во время лабораторных работ. Мы благодарим заповедники Эземвело и Ритвлей за сотрудничество в проведении исследований в их заповедниках.
Список литературы
- 1. Робинсон П.Дж. Об определении волны тепла. Журнал прикладной метеорологии. 2001. 40 (4): 762–75.
- 2. Souch C, Гриммонд К.Прикладная климатология: «волны тепла». Успехи в физической географии. 2004. 28 (4): 599–606.
- 3. Конради С.Р., Вудборн С.М., Каннингем С.Дж., Маккечни А.Э. Хронические сублетальные эффекты высоких температур вызовут резкое сокращение численности птиц южноафриканской засушливой зоны в 21 веке. Труды Национальной академии наук. 2019: 201821312. pmid: 31235571
- 4. Маккечни А.Е., Вольф Б.О. Изменение климата увеличивает вероятность катастрофической гибели птиц во время волн экстремальной жары.Письма биологии. 2010. 6 (2): 253–6. pmid: 19793742
- 5. Lovegrove BG, Canale C, Levesque D, Fluch G, eháková-Petr M, Ruf T. Являются ли тропические мелкие млекопитающие физиологически уязвимыми к эффектам Аррениуса и изменению климата? Физиологическая и биохимическая зоология. 2013. 87 (1): 30–45. pmid: 24457919
- 6. Сондерс Д.А., Моусон П., Доусон Р. Влияние двух экстремальных погодных явлений и других причин смерти на черного какаду Карнаби: обещание будущего для угрожаемого вида? Биология сохранения Тихого океана.2011; 17 (2): 141–8.
- 7. Истерлинг Д.Р., Мил Г.А., Пармезан С, Чангнон С.А., Карл Т.Р., Мирнс Л.О. Экстремальные климатические явления: наблюдения, моделирование и воздействия. наука. 2000. 289 (5487): 2068–74. pmid: 11000103
- 8. Миль Г.А., Тебальди С. Более интенсивные, более частые и продолжительные волны тепла в 21 веке. Наука. 2004. 305 (5686): 994–7. pmid: 15310900
- 9. Поумадер М., Мэй С., Ле Мер С., Блонг Р. Жара 2003 года во Франции: опасное изменение климата здесь и сейчас.Анализ рисков: международный журнал. 2005. 25 (6): 1483–94.
- 10. МГЭИК. Изменение климата 2014: воздействия, адаптация и уязвимость. Часть А: глобальные и отраслевые аспекты. В C.B. Field, V.R. Баррос, Д.Дж. Доккен, К.Дж. Мах, доктор медицины Мастрандреа, Т. Билир, М. Чаттерджи и др., Ред. Вклад Рабочей группы II в пятый оценочный доклад Межправительственной группы экспертов по изменению климата: Cambridge University Press, Кембридж; 2014.
- 11. Vasseur DA, DeLong JP, Gilbert B., Greig HS, Harley CD, McCann KS, et al.Повышенные колебания температуры представляют больший риск для видов, чем потепление климата. Труды Королевского общества B: биологические науки. 2014; 281 (1779): 20132612. pmid: 24478296
- 12. Любер Г., МакГихин М. Изменение климата и экстремальная жара. Американский журнал профилактической медицины. 2008. 35 (5): 429–35. pmid: 18929969
- 13. Thomas CD, Cameron A, Green RE, Bakkenes M, Beaumont LJ, Collingham YC, et al. Риск исчезновения из-за изменения климата. Природа.2004. 427 (6970): 145–8. pmid: 14712274
- 14. Scheffers BR, Edwards DP, Diesmos A, Williams SE, Evans TA. Микрореда обитания сокращают подверженность животных экстремальным климатическим явлениям. Биология глобальных изменений. 2014. 20 (2): 495–503. pmid: 24132984
- 15. Божинович Ф., Лагос Дж. А., Васкес Р. А., Кенаги Г. Использование времени и энергии при ограничениях по терморегуляции у дневных грызунов. J Therm Biol. 2000. 25 (3): 251–6.
- 16. Митчелл Д., Снеллинг Е.П., Хетем Р.С., Мэлони СК, Штраус В.М., Фуллер А.Пересмотр концепций тепловой физиологии: прогнозирование реакции млекопитающих на изменение климата. J Anim Ecol. 2018. pmid: 29479693
- 17. Маклин I, редактор. Адаптация охраны природы к изменению климата: важность микроклимата. ECCB2018: 5-й Европейский конгресс по природоохранной биологии 12-15 июня 2018 г., Ювяскюля, Финляндия; 2018: Центр открытой науки Университета Ювяскюля.
- 18. Гарднер Дж. Л., Питерс А., Кирни М. Р., Джозеф Л., Хайнсон Р. Уменьшение размеров тела: третий универсальный ответ на потепление? Тенденции в экологии и эволюции.2011; 26 (6): 285–91. pmid: 21470708
- 19. Джейкобс П.Дж., Беннетт Северная Каролина, Остхейзен М.К. Двигательная активность в полевых условиях была отражена у сумеречных четырехполосых полевых мышей, Rhabdomys dilectus и ночных мышей Namaqua, Micaelamys namaquensis во время моделируемой волны тепла. Журнал термобиологии. 2020; 87: 102479. pmid: 32001021
- 20. Хейнсворт Ф. Распространение слюны, активность и регулирование температуры тела у крыс. Американский журнал физиологии — наследие.1967. 212 (6): 1288–92.
- 21. Hainsworth F, Stricker EM, Epstein A. Водный метаболизм крыс в жару: обезвоживание и питье. Американский журнал физиологии — наследие. 1968. 214 (5): 983–9. pmid: 5647202
- 22. Сасси П.Л., Новилло А. Приспособление к температурным изменениям: внутривидовая изменчивость у мелких млекопитающих из Анд. Биология млекопитающих-Zeitschrift für Säugetierkunde. 2015; 80 (2): 81–6.
- 23. Хаммонд KA, Szewczak J, Król E.Влияние высоты и температуры на фенотипическую пластичность органов по высотному градиенту. Журнал экспериментальной биологии. 2001. 204 (11): 1991–2000. pmid: 11441040
- 24. Зуб К., Шафранска П., Конаржевски М., Редман П., Спикман Дж. Компромисс между активностью и терморегуляцией у мелких хищников, с наименьшей лаской Mustela nivalis. Труды Лондонского королевского общества B: биологические науки. 2009: рспб. 2008. 1936 г.
- 25. Мюррей И.В., Смит Ф.А.Оценка влияния термальной среды на характер активности пустынной лесной крысы (Neotoma lepida) с использованием температурной хронологии. Может J Zool. 2012; 90 (9): 1171–80.
- 26. Холерс ПК, Купер С.Е., Мэлони СК, Божинович Ф., Круз-Нето А.П. Экологическая и экологическая физиология млекопитающих: Oxford University Press; 2016.
- 27. Фолк Г.Е., Семкен А. Эволюция потовых желез. Международный журнал биометеорологии. 1991. 35 (3): 180–6. pmid: 1778649
- 28.Маккечни А.Е., Вольф Б.О. Физиология теплостойкости у малых эндотерм. Физиология. 2019; 34 (5): 302–13. pmid: 31389778
- 29. Раймер Т., Пиллэй Н., Шрадин С. Вымирание или выживание? Поведенческая гибкость в ответ на изменение окружающей среды у африканской полосатой мыши Rhabdomys . Устойчивое развитие. 2013. 5 (1): 163–86.
- 30. Du Toit N, Pillay N., Ganem G. & Relton C. Rhabdomys dilectus Красный список МСОП видов, находящихся под угрозой исчезновения, 2019 г .; (e.Т112168645А140971990.). http://dx.doi.org/10.2305/IUCN.UK.2019-1.RLTS.T112168645A140971990.en
- 31. Хаим А, Фурье Флорида. Производство тепла ночными (Praomys natalensis) и дневными (Rhabdomys pumilio) южноафриканскими мюридами. Южноафриканский зоологический журнал. 1980. 15 (2): 91–4.
- 32. Бирбен Э., Сахинер У.М., Сакесен С., Эрзурум С., Калайчи О. Окислительный стресс и антиоксидантная защита. Журнал Всемирной организации аллергии. 2012; 5 (1): 9. pmid: 23268465
- 33.Холливелл Б. Биохимия окислительного стресса. Портленд Пресс Лимитед; 2007.
- 34. Дроге В. Свободные радикалы в физиологическом контроле функции клеток. Физиологические обзоры. 2002. 82 (1): 47–95. pmid: 11773609
- 35. Джордано Ф.Дж. Кислород, окислительный стресс, гипоксия и сердечная недостаточность. Журнал клинических исследований. 2005. 115 (3): 500–8. pmid: 15765131
- 36. Блэр А.С., Хайдух Э., Литерленд Г.Дж., Хундал Х.С. Регуляция транспорта глюкозы и синтеза гликогена в мышечных клетках L6 во время окислительного стресса свидетельствует о перекрестном взаимодействии между инсулином и сигнальными путями митоген-активируемой протеинкиназы sapk2 / p38.Журнал биологической химии. 1999. 274 (51): 36293–9. pmid: 10593919
- 37. Сис Х. Окислительный стресс: концепция в окислительно-восстановительной биологии и медицине. Редокс-биология. 2015; 4: 180–3. pmid: 25588755
- 38. Oliveira MF, Geihs MA, França TF, Moreira DC, Hermes-Lima M. Является ли «подготовка к окислительному стрессу» случаем физиологического кондиционирования гормезиса? Границы физиологии. 2018; 9: 945. pmid: 30116197
- 39. Бург М.Б., Феррарис Ю.Д., Дмитриева Н.И.Клеточный ответ на гиперосмотические стрессы. Физиологические обзоры. 2007. 87 (4): 1441–74. pmid: 17928589
- 40. Хиллман А.Р., Винс Р.В., Тейлор Л., Макнотон Л., Митчелл Н., Сиглер Дж. Обезвоживание, вызванное физическими упражнениями, с тепловым стрессом окружающей среды и без него, приводит к усилению окислительного стресса. Appl Physiol Nutr Metab. 2011; 36 (5): 698–706. pmid: 21980993
- 41. Джорджеску В.П., де Соуза Т.П. Джуниор, Беренс С., Баррос М.П., Буэно Калифорния, Аттер А.С. и др. Влияние обезвоживания, вызванного физической нагрузкой, на маркеры окислительного повреждения и антиоксидантную способность кровообращения.Appl Physiol Nutr Metab. 2017; 42 (7): 694–9. pmid: 28182858
- 42. Laitano O, Kalsi KK, Pook M, Oliveira AR, González-Alonso J. Отдельные и комбинированные эффекты теплового стресса и физических упражнений на маркеры кровообращения окислительного стресса у обезвоженных людей. Eur J Appl Physiol. 2010. 110 (5): 953–60. pmid: 20658249
- 43. Slimen IB, Najar T, Ghram A, Dabbebi H, Ben Mrad M, Abdrabbah M. Реактивные формы кислорода, тепловой стресс и повреждение митохондрий, вызванное окислением.Обзор. Международный журнал гипертермии. 2014. 30 (7): 513–23. pmid: 25354680
- 44. Habashy WS, Milfort MC, Rekaya R, Aggrey SE. На активность клеточных антиоксидантных ферментов и биомаркеры окислительного стресса влияет тепловой стресс. Международный журнал биометеорологии. 2019; 63 (12): 1569–84. pmid: 31352522
- 45. Schliess F, Häussinger D. Состояние клеточной гидратации: критический фактор, определяющий гибель и выживание клеток. Biol Chem. 2002. 383 (3–4): 577–83.pmid: 12033446
- 46. França M, Panek A, Eleutherio E. Окислительный стресс и его эффекты во время обезвоживания. Сравнительная биохимия и физиология. Часть A: Молекулярная и интегративная физиология. 2007. 146 (4): 621–31.
- 47. Navari-Izzo F, Quartacci M, Sgherri C. Образование супероксида в связи с обезвоживанием и регидратацией. Портленд Пресс Лтд .; 1996. https://doi.org/10.1042/bst0240447 pmid: 8736781
- 48. Рихтер С., Парк Дж. В., Эймс Б. Н..Нормальное окислительное повреждение митохондриальной и ядерной ДНК обширно. Труды Национальной академии наук. 1988. 85 (17): 6465–7.
- 49. Леду С.П., Дриггерс В.Дж., Холленсуорт Б.С., Уилсон Г.Л. Ремонт алкилирования и окислительного повреждения митохондриальной ДНК. Мутационные исследования. 1999. 434 (3): 149–59. pmid: 10486589
- 50. Руббо Х., Ради Р., Трухильо М., Теллери Р., Кальянараман Б., Барнс С. и др. Оксид азота регуляция супероксидного и пероксинитрит-зависимого перекисного окисления липидов.Образование новых азотсодержащих окисленных производных липидов. Журнал биологической химии. 1994. 269 (42): 26066–75. pmid: 7929318
- 51. Стэндман Э., Левин Р. Окисление белков. Летопись Нью-Йоркской академии наук. 2000; 899: 191–208. pmid: 10863540
- 52. Кальмар Б., Гринсмит Л. Индукция белков теплового шока для защиты от окислительного стресса. Расширенные обзоры доставки лекарств. 2009. 61 (4): 310–8. pmid: 19248813
- 53. Форстер М.Дж., Дубей А., Доусон К.М., Штаттс, Вашингтон, Лал Х., Сохал, Р.С.Возрастные потери когнитивных функций и двигательных навыков у мышей связаны с окислительным повреждением белков в головном мозге. Труды Национальной академии наук. 1996. 93 (10): 4765–9.
- 54. Пол С., Тенг С., Сондерс П.Т. Единичный легкий преходящий тепловой стресс мошонки вызывает гипоксию и окислительный стресс в семенниках мышей, что вызывает гибель половых клеток. Биология размножения. 2009. 80 (5): 913–9. pmid: 19144962
- 55. Tvrdá E, Kňažická Z, Bárdos L, Massányi P, Lukáč N.Влияние окислительного стресса на мужскую фертильность — обзор. Acta veterinaria hungarica. 2011. 59 (4): 465–84.
- 56. Бизе П., Крискуоло Ф., Меткалф Н.Б., Насир Л., Монаган П. Динамика теломер, а не возраст предсказывают продолжительность жизни в дикой природе. Труды Королевского общества B: биологические науки. 2009. 276 (1662): 1679–83.
- 57. фон Зглиницки Т. Окислительный стресс укорачивает теломеры. Направления биохимических наук. 2002. 27 (7): 339–44. pmid: 12114022
- 58.Родригес-Эстиваль Дж., Гарсиа-де-Блас Э., Смитс Дж. Э. Биомаркеры окислительного стресса указывают на сублетальное воздействие на здоровье охраняемого вида мелких млекопитающих, оленьих мышей (Peromyscus maniculatus) на мелиорированных нефтеносных песках. Экологические показатели. 2016; 62: 66–75.
- 59. Stahlschmidt Z, French S, Ahn A, Webb A, Butler MW. Моделируемая волна тепла оказывает разнообразное воздействие на иммунную функцию и окислительную физиологию кукурузной змеи ( Pantherophis guttatus ). Physiol Biochem Zool.2017; 90 (4): 434–44.
- 60. Ван З., О’Коннор Т.П., Хешка С., Хеймсфилд С.Б. Реконструкция закона Клейбера на уровне орган-ткань. Журнал питания. 2001. 131 (11): 2967–70. pmid: 11694627
- 61. Шмидт CM, Блаунт Дж. Д., Беннетт NC. Репродукция связана с тканезависимым снижением окислительного стресса у эусоциальных самок землекопов Damaraland (Fukomys damarensis). PloS один. 2014; 9 (7): e103286.
- 62. Hsu S-F, Niu K-C, Lin C-L, Lin M-T.Охлаждение мозга вызывает ослабление церебрального оксидативного стресса, системного воспаления, активации коагуляции и ишемии / повреждения тканей во время теплового удара. Шок. 2006. 26 (2): 210–20.
- 63. Чен С.Х., Линь М-Т, Чанг С.П. Ишемическое и окислительное повреждение гипоталамуса может быть причиной теплового удара. Современная нейрофармакология. 2013. 11 (2): 129–40.
- 64. Балат А., Резик Х, Беллингхиери Дж., Анарат А. Дьявольский треугольник в заболеваниях почек: окислительный стресс, медиаторы и воспаление.Международный журнал нефрологии. 2012; 2012.
- 65. Ayala A, Muñoz MF, Argüelles S. Перекисное окисление липидов: производство, метаболизм и сигнальные механизмы малонового диальдегида и 4-гидрокси-2-ноненала. Окислительная медицина и клеточное долголетие. 2014; 2014: 1–31.
- 66. Бхарти В.К., Шривастава Р., Кумар Х., Баг С., Маджумдар А., Сингх Г. и др. Влияние мелатонина и эпифизарных белков на фторид-индуцированные неблагоприятные изменения антиоксидантного статуса сердца, печени и почек крыс.Успехи фармакологических наук. 2014; 2014.
- 67. Balcerczyk A, Bartosz G. Тиолы являются основными детерминантами общей антиоксидантной способности клеточных гомогенатов. Исследования свободных радикалов. 2003. 37 (5): 537–41. pmid: 12797475
- 68. Чжан Х.Дж., Доктроу С.Р., Сюй Л., Оберли Л.В., Бичер Б., Моррисон Дж. И др. Редокс-модуляция печени с помощью хронического лечения миметиками антиоксидантных ферментов предотвращает возрастное окислительное повреждение, связанное со стрессом окружающей среды.Журнал FASEB. 2004. 18 (13): 1547–9.
- 69. Zhang Z, Ferraris JD, Brooks HL, Brisc I, Burg MB. Экспрессия генов, связанных с осмотическим стрессом, в тканях нормальных и гипоосмотических крыс. Американский журнал физиологии-физиологии почек. 2003; 4 (285): F688 – F93.
- 70. Bloomer SA, Kregel KC, Brown KE. Тепловой стресс стимулирует экспрессию мРНК гепсидина и экспрессию белка C / EBPα в печени старых грызунов. Архивы геронтологии и гериатрии. 2014. 58 (1): 145–52. pmid: 23993269
- 71.Tiidus PM. Влияние эстрогена и пола на повреждение мышц, воспаление и окислительный стресс. Канадский журнал прикладной физиологии. 2000. 25 (4): 274–87. pmid: 10953066
- 72. Миллер А.А., Де Сильва Т.М., Джекман К.А., Соби К.Г. Влияние пола и половых гормонов на оксидативный стресс сосудов. Клиническая и экспериментальная фармакология и физиология. 2007. 34 (10): 1037–43. pmid: 17714091
- 73. Katalinic V, Modun D, Music I, Boban M. Гендерные различия в антиоксидантной способности тканей крысы, определяемые с помощью тестов 2, 2′-азинобис (3-этилбензотиазолин-6-сульфонат; ABTS) и восстановления антиоксидантной способности железа (FRAP).Сравнительная биохимия и физиология, часть C: токсикология и фармакология. 2005. 140 (1): 47–52. pmid: 15792622
- 74. Остберг Дж., Каплан К., Репаски Е. Индукция стрессовых белков в панели тканей мышей с помощью гипертермии всего тела до лихорадки. Международный журнал гипертермии. 2002. 18 (6): 552–62. pmid: 12537754
- 75. Холливелл Б., Кирико С. Перекисное окисление липидов: его механизм, измерение и значение. Американский журнал лечебного питания.1993; 57 (5): 715С – 25С.
- 76. Далле-Донн И., Росси Р., Джустарини Д., Милзани А., Коломбо Р. Карбонильные группы белка как биомаркеры окислительного стресса. Clinica Chimica Acta. 2003. 329 (1–2): 23–38. pmid: 12589963
- 77. Левин Р.Л., Гарланд Д., Оливер С.Н., Амичи А., Климент I, Ленц А.Г. и др. Определение содержания карбонила в окислительно модифицированных белках. Методы Энзимол. 186: Эльзевир; 1990. стр. 464–78. pmid: 1978225
- 78. Наито Ю., Масаичи Си-иЛ, Като Ю., Нагаи Р., Ёнэй Ю.Маркеры окислительного стресса. Антивозрастная медицина. 2010. 7 (5): 36–44.
- 79. Шпиц DR, Оберли LW. Анализ активности супероксиддисмутазы в гомогенатах тканей млекопитающих. Аналитическая биохимия. 1989. 179 (1): 8–18. pmid: 2547324
- 80. Эрэл О. Новый автоматизированный метод измерения общего антиоксидантного ответа на сильные реакции свободных радикалов. Клиническая биохимия. 2004. 37 (2): 112–9. pmid: 14725941
- 81. Кенефик Р.В., Шевронт С.Н.Физиологические корректировки гипогидратации: влияние на терморегуляцию. Автономная неврология. 2016; 196: 47–51. pmid: 26944095
- 82. Cheuvront SN, Haymes EM. Терморегуляция и марафонский бег. Sports Med. 2001. 31 (10): 743–62. pmid: 11547895
- 83. Flanagan S, Ryan A, Gisolfi C, Moseley P. Тканевый ответ HSP70 у животных, подвергающихся тепловому стрессу. Американский журнал физиологии — регуляторной, интегративной и сравнительной физиологии. 1995; 268 (1): R28 – R32.pmid: 7840333
- 84. Mizzen LA, Welch WJ. Характеристика термотолерантной ячейки. I. Влияние на активность синтеза белка и регуляцию экспрессии белка теплового шока 70. Журнал клеточной биологии. 1988. 106 (4): 1105–16. pmid: 3360849
- 85. Шахин Э., Гюмюшлю С. Иммобилизационный стресс в тканях крысы: изменения в окислении белков, перекисном окислении липидов и системе антиоксидантной защиты. Сравнительная биохимия и физиология, часть C: токсикология и фармакология.2007. 144 (4): 342–7. pmid: 17157074
- 86. Дас А. Гепатотоксичность, вызванная тепловым стрессом, и ее предотвращение ресвератролом у крыс. Механизмы и методы токсикологии. 2011; 21 (5): 393–9. pmid: 21426263
- 87. Лин Х, Декуипер Э, Буйс Дж. Острый тепловой стресс вызывает окислительный стресс у цыплят-бройлеров. Сравнительная биохимия и физиология. Часть A: Молекулярная и интегративная физиология. 2006. 144 (1): 11–7. pmid: 16517194
- 88. Линь Х, Ду Р, Чжан З.Перекисный статус тканей бройлеров, подвергшихся тепловому стрессу. Азиатско-Австралазийский журнал наук о животных. 2000. 13 (10): 1373–6.
- 89. Алтан О., Пабучуоглу А., Алтан А., Коньялиоглу С., Байрактар Х. Влияние теплового стресса на окислительный стресс, перекисное окисление липидов и некоторые параметры стресса у бройлеров. Британская наука о птицеводстве. 2003. 44 (4): 545–50. pmid: 14584844
- 90. Озтюрк О., Гюмюшлю С. Возрастные изменения активности антиоксидантных ферментов, статуса глутатиона и перекисного окисления липидов в эритроцитах крыс после теплового стресса.Науки о жизни. 2004. 75 (13): 1551–65. pmid: 15261761
- 91. Скибба Дж, Гвартни Э. Гипертермия печени и окислительный стресс: роль производства железа и альдегида. Международный журнал гипертермии. 1997. 13 (2): 215–26. pmid: 9147147
- 92. Брокер С., Томпсон Д.К., Василиу В. Роль гиперосмотического стресса в воспалении и болезнях. Биомолекулярные концепции. 2012. 3 (4): 345–64. pmid: 22977648
- 93. Арамбуру Дж., Лопес-Родригес К. Бркс проливают свет на путь от гиперосмолярности к NFAT5.Научная сигнализация. 2009; 2 (65): pe20 – pe. pmid: 19351952
- 94. Малик А.И., Стори КБ. Транскрипционная регуляция антиоксидантных ферментов с помощью FoxO1 в условиях дегидратационного стресса. Ген. 2011. 485 (2): 114–9. pmid: 21708231
- 95. Озбек Э. Индукция окислительного стресса в почках. Международный журнал нефрологии. 2012; 2012. pmid: 22577546
- 96. Асмат У., Абад К., Исмаил К. Сахарный диабет и оксидативный стресс — краткий обзор. Саудовский фармацевтический журнал.2016; 24 (5): 547–53. pmid: 27752226
- 97. Росас-Родригес Х.А., Валенсуэла-Сото EM. Ферменты, участвующие в синтезе осмолита: как окислительный стресс влияет на осморегуляцию в почечных клетках? Науки о жизни. 2010. 87 (17–18): 515–20. pmid: 20727361
- 98. Джонсон Р.Дж., Санчес-Лозада Л.Г., Ньюман Л.С., Ланаспа М.А., Диас Х.Ф., Лемери Дж. И др. Изменение климата и почки. Анналы питания и обмена веществ. 2019; 74 (3): 38–44.
- 99. Ю. БП. Клеточная защита от повреждений реактивными формами кислорода.Физиологические обзоры. 1994. 74 (1): 139–62. pmid: 8295932
- 100. Сридхар А., Пардхасаради Б., Хар А., Шринивас, Великобритания. Перекрестная связь между передачей клеточных сигналов и окислительно-восстановительным состоянием клеток во время индуцированного нагреванием апоптоза в гистиоцитоме крысы. Свободная радикальная биология и медицина. 2002. 32 (3): 221–7. pmid: 11827747
- 101. Ловис К., Мах Ф., Донати Ю. Р., Бонвентре СП, Полла Б.С. Белки теплового шока и почки. Почечная недостаточность. 1994. 16 (2): 179–92. pmid: 8041958
- 102.Лю Дж., Йео Х.С., Овервик-Доуки Э., Хаген Т., Донигер С.Дж., Чу Д.В. и др. Хронические и интенсивные тренировки крыс: биомаркеры окислительного стресса и эндогенные антиоксиданты. Журнал прикладной физиологии. 2000. 89 (1): 21–8. pmid: 10
1
- 103. Пэн X-y, Ji L-p. Эффекты метаболизма свободных радикалов в почках мышей после теплового стресса [J]. Иньшаньский академический журнал (издание по естествознанию). 2009; 3.
- 104. Холливелл Б., Гаттеридж Дж. Свободные радикалы в биологии и медицине : 2-е изд.Великобритания: Clarendon: Oxford Science Publications; 1989.
- 105. Hulbert AJ, Turner N, Hinde J, Else P, Guderley H. Как можно сравнить митохондрии из разных тканей и разных видов? Журнал сравнительной физиологии B. 2006; 176 (2): 93–105. pmid: 16408229
- 106. Кюльц Д. Гиперосмоляльность вызывает окислительное повреждение почечных клеток. Труды Национальной академии наук. 2004. 101 (25): 9177–8. pmid: 15199186
- 107. Сегар МЫ.Хроническая гиперосмоляльность: состояние, являющееся результатом отсутствия жажды, нарушения осморегуляции и ограниченной способности концентрировать мочу. Американский журнал болезней детей. 1966. 112 (4): 318–27.
- 108. Шмидт-Нильсен К., Шмидт-Нильсен Б., Шнайдерман Х. Выделение солей у пустынных млекопитающих. Американский журнал физиологии — наследие. 1948. 154 (1): 163–6. pmid: 18893073
- 109. Дональд Дж., Паннабекер Т.Л. Осморегуляция у адаптированных к пустыне млекопитающих. Гомеостаз натрия и воды: Springer; 2015 г.п. 191–211.
- 110. Хаббард Р., Бауэрс В., Мэтью В., Кертис Ф., Крисс Р., Шелдон Дж. И др. Модель смертности от острого теплового удара на крысах. Журнал прикладной физиологии. 1977; 42 (6): 809–16. pmid: 881380
- 111. Ян Ци, Линь М-Т. Окислительный стресс у крыс с церебральной ишемией, вызванной тепловым ударом. Гладить. 2002. 33 (3): 790–4.
- 112. Чанг C-K, Чанг C-P, Лю S-Y, Lin M-T. Окислительный стресс и ишемические повреждения при тепловом ударе. Прогресс в исследованиях мозга.2007. 162: 525–46. pmid: 17645935
- 113. Шарма Х., Дункан Дж., Йохансон С. Гипертермия всего тела у крысы нарушает гематоэнцефалический барьер и вызывает отек мозга. Отек мозга XIII: Springer; 2006. с. 426–31.
- 114. Локхед Дж. Дж., Маккаффри Дж., Куигли К. Э., Финч Дж., Демарко К. М., Наметц Н. и др. Окислительный стресс увеличивает проницаемость гематоэнцефалического барьера и вызывает изменения окклюдина во время гипоксии-реоксигенации. Журнал мозгового кровотока и метаболизма.2010. 30 (9): 1625–36.
- 115. Шарма Х. Смерти, связанные с жарой, во многом связаны с повреждением головного мозга. Индийский журнал медицинских исследований. 2005; 121 (5): 621. pmid: 15937362
- 116. Шактер Э. Количественная оценка и значение окисления белков в биологических образцах. Обзоры метаболизма лекарств. 2000. 32 (3–4): 307–26. pmid: 11139131
- 117. Ван З., Ри Д. Б., Лу Дж., Бор CT, Чжоу Ф., Валлабханени Х. и др. Характеристика окислительного повреждения и восстановления гуанина в теломерах млекопитающих.PLoS генетика. 2010; 6 (5). pmid: 20485567
- 118. Насси Д.Х., Пембертон Дж. М., Пилкингтон Дж. Г., Блаунт Дж. Д.. История жизни коррелирует с окислительным повреждением у свободноживущих млекопитающих. Функциональная экология. 2009. 23 (4): 809–17.
- 119. Бекман КБ, Эймс Б.Н. Созревает свободнорадикальная теория старения. Физиологические обзоры. 1998. 78 (2): 547–81. pmid: 9562038
- 120. Ли Х, Бенипал Б., Чжоу С., Додиа С., Чаттерджи С., Тао Дж-Кью и др. Критическая роль пероксиредоксина 6 в восстановлении перекисных клеточных мембран после окислительного стресса.Свободная радикальная биология и медицина. 2015; 87: 356–65. pmid: 26117327
Антиоксиданты играют ключевую роль в иммунитете и защите организма: 8 продуктов, богатых антиоксидантами, для укрепления вашей иммунной системы
Яблоки, черника, апельсины, какао, зеленый чай, лук, капуста, помидоры богаты антиоксидантами. & Nbsp
Ключевые особенности
- Клетки в организме вырабатывают мощные антиоксиданты, такие как альфа-липоевая кислота и глутатион.
- Нашим клеткам необходим адекватный уровень антиоксидантной защиты, чтобы предотвратить повреждение иммунных клеток.
- Диетические антиоксиданты связаны с изменением восприимчивости или устойчивости организма к инфекционным патогенам.
В своем сегодняшнем обращении к нации премьер-министр Нарендра Моди посоветовал людям укрепить свою иммунную систему, чтобы защитить себя от COVID-19.Он также попросил граждан следовать инструкциям Министерства АЮШ.
Функции иммунной системы человека зависят от адекватного потребления питательных микроэлементов, которые действуют как антиоксиданты. Термин «антиоксидант» отражает химическое свойство, а не конкретное питательное свойство. Клетки нашего тела производят мощные антиоксиданты, такие как альфа-липоевая кислота и глутатион. Природные антиоксиданты — это молекулы, которые защищают структурную целостность клеток и тканей и обладают способностью нейтрализовать свободные радикалы, отдавая часть собственных электронов.
Свободным радикалам не хватает полного набора электронов, из-за чего они крадут электроны у других молекул и при этом повреждают эти молекулы. Вредная активность свободных радикалов может привести к повреждению мембран, ферментов и ДНК. Свободные радикалы образуются при нормальном клеточном метаболизме и при метаболизме некоторых лекарств и ксенобиотиков. Когда иммунная система борется с злоумышленниками, кислород, который она использует, запускает свободные радикалы, которые уничтожают вирусы, бактерии и поврежденные клетки тела.Некоторая нормальная выработка свободных радикалов также происходит во время упражнений. Дым от сигарет, воздействие ультрафиолета и других загрязнителей окружающей среды также увеличивают нагрузку на наш организм свободными радикалами. Наши клетки нуждаются в адекватном уровне антиоксидантной защиты, чтобы избежать вредного воздействия чрезмерного производства активных форм кислорода (АФК) и предотвратить повреждение иммунных клеток.
Диетические антиоксиданты связаны с изменением восприимчивости или устойчивости организма к инфекционным патогенам.Антиоксидантные питательные вещества, которые обычно входят в наш рацион, такие как витамин E, витамин C, β-каротин, селен, медь, железо и цинк, улучшают различные иммунные функции, проявляя важную защитную роль при инфекциях, вызванных бактериями, вирусами или паразитами. Добавки антиоксидантов могут значительно улучшить определенные иммунные реакции.
Антиоксидантные свойства включают замедление старения, защиту от сердечных заболеваний, улучшение зрения и сдерживание рака. Антиоксиданты сохраняют адекватную функцию иммунных клеток против гомеостатических нарушений, вызванных окислительным стрессом, например, связанным со старением.
Ниже приведены некоторые натуральные продукты, богатые антиоксидантами, которые можно употреблять для повышения иммунитета:
Апельсины : Фитохимическое вещество под названием гесперетин, содержащееся в апельсинах и других цитрусовых, восстанавливает витамин С до его активной антиоксидантной формы.
Капуста : В капусте есть лютеин, каротиноид, который помогает вам оставаться в тонусе. Его часто называют съедобным воином против рака и депрессии.
Черника : Антоцианы в чернике оказывают благотворное влияние на сердечно-сосудистые заболевания, нейродегенеративные заболевания, диабет и рак.
Какао : флаванолы в какао оказывают защитное действие на наше сердце, мозг, кожу и иммунную систему.
Лук : Лук содержит кверцетин, мощный антиоксидант, который помогает организму бороться с воспалениями. Употребление лука может быть полезно при лечении некоторых видов рака.
Помидоры : они содержат ликопин, который представляет собой ярко-красный каротиноидный углеводород.
Яблоки : Кверцетин в яблоках может уменьшить воспаление.Яблоки содержат множество фитохимических веществ, таких как катехины, флоридзин и хлорогеновая кислота, которые являются сильными антиоксидантами.
Зеленый чай : Зеленый чай содержит множество противовоспалительных флавоноидов. Катехины в зеленом чае (эпигаллокатехин-3-галлат) являются мощным противовоспалительным соединением с терапевтическим потенциалом. Зеленый чай снижает риск рака груди, рака простаты и колоректального рака.
Натуральные мощные антиоксиданты
Фарм США .2007; 1: HS38-HS42.
Антиоксиданты помогают защитить клетки человеческого тела от образования радикалов. В их состав входят витамины, минералы, ферменты и натуральные продукты. Радикалы, также известные как свободные радикалы , представляют собой молекулы с одним неспаренным электроном или двумя или более неспаренными электронами, которые не взаимодействуют друг с другом. Свободные радикалы, полученные из кислорода, агрессивны и токсичны и обычно образуются в процессе клеточного метаболизма. 1 Это обычные промежуточные посредники в химических реакциях с компонентами клетки, вызывающие необратимые повреждения.Считается, что они являются источником старения и причиной ряда дегенеративных заболеваний. В организме человека белые кровяные тельца взаимодействуют со свободными радикалами, защищая клетки организма от повреждений. 1
Воздействие экологических опасностей, таких как курение, загрязнение окружающей среды, солнечное излучение или другие токсины, увеличивает окислительный стресс сверх уровня, на котором иммунная система может обеспечить защиту. С увеличением количества свободных радикалов в организме человека ресурсы иммунной системы будут активно участвовать в борьбе со свободными радикалами.Способность антиоксидантов бороться со свободными радикалами укрепляет иммунную систему, чтобы выявлять токсины и бороться с ними.
Есть три известных свободных радикала: супероксид, гидроксил и пероксид. Антиоксиданты присоединяются к свободным радикалам и образуют комплекс, который предотвращает разрушение клеток и легко удаляется человеческим организмом как отходы. В результате, помимо других преимуществ, происходит меньшее повреждение клеток и более здоровая иммунная система. 1 В этой статье рассматриваются основные источники и роль нескольких антиоксидантов в защите клеток человеческого тела, способствующих здоровью и благополучию.
Ликопин
Красная пигментация таких продуктов, как помидоры, розовый грейпфрут, гуава и арбуз, вызывается каротиноидом ликопином. Исследования показали, что ликопин является мощным антиоксидантом, который помогает бороться с рядом заболеваний, включая болезни сердца и рак. Повышенные концентрации ликопина обеспечивают больший защитный эффект; поэтому наиболее концентрированные пищевые продукты, такие как томатная паста и кетчуп, лучше защищают от этих болезней. 1,2 К сожалению, человеческий организм не может производить ликопин и поэтому должен получать эту молекулу из природных источников, содержащих пищевые каротиноиды. Каротиноиды — это семейство природных пигментов. Известно более 600 природных каротиноидов, все из которых биосинтезируются только в растениях.
Ликопин имеет уникальную длинноцепочечную молекулярную структуру, содержащую 13 двойных связей — больше, чем у любого другого каротиноида. 2 Эта конфигурация отвечает за особую способность ликопина нейтрализовать свободные радикалы.Ликопин естественным образом присутствует в свежих фруктах и овощах в транс-конфигурации, которая плохо усваивается. Тепловая обработка пищевых продуктов — например, томатов, переработанных в томатную пасту, сок или кетчуп — вызывает изомеризацию ликопина из транс- в цис-конфигурацию. Цис-конфигурация имеет гораздо лучшую биодоступность.
Каротиноиды — жирорастворимые соединения; в организме человека они находятся в жировой ткани и переносятся липопротеинами. Они действуют как диетические предшественники витамина А и помогают иммунной системе.Ликопин также обладает высокой липофильностью и обычно находится в клеточных мембранах. Это мощный антиоксидант, который подавляет свободные радикалы синглетного кислорода в два раза эффективнее, чем бета-каротин. Синглетный кислород — это не стабильная молекула, а нестабильная, богатая энергией форма, которая является агрессивным радикалом.
Коэнзим Q 10
Коэнзим Q 10 (CoQ10) или убихинон, по сути, является витамином или витаминоподобным веществом. 3 Он содержится в небольших количествах в самых разных продуктах питания и синтезируется во всех тканях.Биосинтез CoQ10 из аминокислоты тирозина — это многоступенчатый процесс, требующий не менее восьми витаминов и нескольких микроэлементов. CoQ10 является коферментом по крайней мере для трех митохондриальных ферментов, а также ферментов в других частях клетки. Митохондриальные ферменты пути окислительного фосфорилирования необходимы для производства высокоэнергетического фосфата или аденозинтрифосфата, от которого зависят все клеточные функции. Функции переноса электронов и протонов хинонового кольца имеют фундаментальное значение для всех форм жизни.
CoQ10 был предметом научных исследований в течение многих лет и стал одной из самых популярных пищевых добавок. Он играет решающую роль в выработке энергии в клетках. Он действует как мощный антиоксидант, что означает, что он помогает нейтрализовать молекулы, повреждающие клетки, или свободные радикалы. CoQ10, производимый всеми клетками организма, также содержится в небольших количествах в продуктах питания, особенно в мясе и рыбе.
Коэнзим Q10 снижается в организме по мере того, как люди стареют или развиваются определенные заболевания (например, некоторые сердечные заболевания, болезнь Паркинсона и астма).Но это не означает, что более низкие уровни CoQ10 вызывают заболевания, или что дополнительный CoQ10 будет бороться с болезнями или обращать вспять эффекты старения. Некоторые препараты, в том числе определенные статины, снижающие уровень холестерина, бета-блокаторы и антидепрессанты, могут снижать уровень CoQ10 в организме, но не было никаких доказательств того, что это вызывает какие-либо побочные эффекты.
Исследователи из Калифорнийского университета в Сан-Диего обнаружили, что очень большие дозы CoQ10 (вместе с витамином E) замедляют прогрессирование болезни Паркинсона.Это уменьшило снижение неврологической функции и улучшило повседневную жизнь. Поскольку исследование было небольшим, исследователи определили, что необходимы более масштабные испытания, прежде чем они смогут рекомендовать CoQ10.
В большинстве исследований использовались дозы от 50 до 200 мг / день. Но новое исследование болезни Паркинсона проверило 300, 600 и 1200 мг, причем самая большая доза имела наибольший эффект. Поскольку CoQ10 жирорастворим, вероятно, лучше всего принимать его во время еды, содержащей хотя бы немного жира. 3
Альфа-липоевая кислота
Альфа-липоевая кислота вполне может пополнить ряды витаминов C и E как часть первой линии защиты от свободных радикалов.Он был открыт в 1951 году и служит коферментом в цикле Кребса и в производстве клеточной энергии. В конце 1980-х исследователи поняли, что альфа-липоевая кислота не рассматривалась как мощный антиоксидант. 4
Альфа-липоевая кислота отличается от других антиоксидантов несколькими качествами. Он нейтрализует свободные радикалы как в жировой, так и в водной областях клеток, в отличие от витамина C (который растворим в воде) и витамина E (растворим в жирах). Он также является высокоэффективным терапевтическим средством при ряде состояний, в которых окислительное повреждение играет важную роль. 5
Организм обычно превращает некоторое количество альфа-липоевой кислоты в дигидролипоевую кислоту, которая оказывается еще более мощным антиоксидантом. Обе формы липоевой кислоты гасят пероксинитритные радикалы, особенно опасный тип, состоящий как из кислорода, так и из азота. Радикалы пероксинитрита играют роль в развитии атеросклероза, заболеваний легких, хронических воспалений и неврологических расстройств. 6
В Германии альфа-липоевая кислота является одобренным препаратом для лечения периферической невропатии, распространенного осложнения диабета.Он ускоряет удаление глюкозы из кровотока, по крайней мере частично, за счет усиления функции инсулина, и снижает резистентность к инсулину.
В Европе терапевтическая доза липоевой кислоты составляет 600 мг / день. В Соединенных Штатах он продается как пищевая добавка, обычно в виде таблеток по 50 мг. Самый богатый пищевой источник альфа-липоевой кислоты — красное мясо.
Эллаговая кислота
Эллаговая кислота — это полифенол растительного происхождения и суперантиоксидант, ингибирующий гидроксильные радикалы.В основном он содержится в гранатах. Гранаты тысячелетиями выращивали в Азии и на Ближнем Востоке по духовным причинам, а также по причинам здоровья. Западная медицина только недавно осознала важность этого суперантиоксиданта, который набирает популярность в профилактике и лечении рака и болезней сердца. 7
Недавний интерес к антиоксидантным свойствам гранатов возник в основном в 2000 году. Aviram et al. продемонстрировали эффективность гранатов в лечении атеросклероза за счет снижения уровня холестерина липопротеинов низкой плотности и повышения уровня холестерина липопротеинов высокой плотности у людей до 20%. 8 Их исследования показали, что потребление гранатового сока значительно уменьшило размер артериальных бляшек как у людей, так и у мышей.
Авирам и др. показали, что гранатовый сок содержит самую высокую антиоксидантную способность по сравнению с другими соками, красным вином, зеленым чаем, помидорами, витамином Е и другими источниками антиоксидантов. Их исследования показали, что гранатовый сок содержит по крайней мере три основных антиоксиданта, а его антиоксидантная сила в три раза выше, чем у красного вина или зеленого чая. 8
Считается, что эллаговая кислота сама по себе не присутствует в растениях. Вместо этого полимеры галловой кислоты и гексагидроксидифеноила (HHDP) связаны с центрами глюкозы с образованием класса соединений, известных как эллагитаннины. Когда две группы галловой кислоты соединяются бок о бок в молекуле танина, образуется группа HHDP. Эллаговая кислота является результатом, когда группа HHDP отщепляется от молекулы танина и самопроизвольно перестраивается. Именно эллагитаннины содержатся в гранатах. 9
Недавние научные исследования показывают, что гранат может быть полезен при профилактике и лечении различных типов рака, таких как рак простаты. Сок увеличил время удвоения специфического антигена простаты у онкологических больных с повышенным уровнем ПСА после операции или лучевой терапии. Исследование показало положительное влияние сока на рак простаты, пролиферацию клеток in vitro и апоптоз, а также на окислительный стресс. 7
Гранаты не только являются самым богатым источником эллаговой кислоты, но также содержат антоцианидины и проантоцианидины (флавоноиды) — вещества, которые, как было показано в экспериментах на животных и в пробирках, снижают ангиогенез опухолей.
Зеленый чай
Зеленый чай веками употребляли в Индии, Китае, Японии и Иране, а в традиционной китайской и индийской медицине он использовался как стимулятор (от снотворного), мочегонное средство (для улучшения выведения мочи), вяжущее ( для остановки кровотечения и заживления ран), а также для улучшения здоровья сердца. Другие традиционные применения зеленого чая включают лечение метеоризма, регулирование температуры тела и уровня глюкозы в крови, улучшение пищеварения и улучшение умственных процессов.
Существует три основных сорта чая — зеленый, черный и улун ( Camellia sinensis ). Зеленый чай и чай улун чаще употребляются в азиатских странах, в то время как черный чай наиболее популярен в США. Разница между чаями заключается в их обработке. Зеленый чай готовят из неферментированных листьев, улун — из частично ферментированных листьев, а черный чай — из полностью ферментированных листьев. Чем больше ферментируются листья, тем ниже содержание полифенолов и выше содержание кофеина.Полифенолы — это химические вещества, которые действуют как мощные антиоксиданты. По сравнению с черным чаем в зеленом чае больше полифенолов; однако черный чай содержит примерно в два-три раза больше кофеина, чем зеленый чай. 10
Полифенолы, содержащиеся в чае, классифицируются как катехины. Зеленый чай содержит шесть основных катехиновых соединений: катехин, галлокатехин, эпикатехин, эпигаллокатехин, эпикатехин галлат и эпигаллокатехин галлат (также известный как EGCG). EGCG считается наиболее активным компонентом зеленого чая и наиболее изученным из всех полифенолов зеленого чая.Зеленый чай содержит от 30% до 40% полифенолов, а черный чай содержит только от 3% до 10% полифенолов. Зеленый чай также содержит алкалоиды, включая кофеин, теобромин и теофиллин. Эти алкалоиды оказывают стимулирующее действие на зеленый чай. 10
В заключение, флавоноиды чая являются мощными антиоксидантами, которые всасываются из кишечника после употребления. Постоянное употребление чая приводит к значительному увеличению антиоксидантной способности крови. Положительные эффекты увеличения антиоксидантной способности организма могут заключаться в уменьшении окислительного повреждения важных биомолекул.Научная поддержка является самой сильной для защиты ДНК от окислительного повреждения после употребления черного или зеленого чая. 10
Витамин C
Витамин С достигает каждой клетки тела, а концентрация витамина С как в сыворотке крови, так и в тканях довольно высока. Фактически, этот нутриент играет важную роль в производстве и защите нашей соединительной ткани, сложной матрицы, которая скрепляет тело. Он служит основным ингредиентом коллагена, похожего на клей вещества, которое связывает клетки вместе с образованием тканей.
Витамин С помогает некоторым из наших важнейших систем организма. Прежде всего, это помогает иммунной системе бороться с чужеродными захватчиками и опухолевыми клетками. Кроме того, витамин С поддерживает сердечно-сосудистую систему, способствуя метаболизму жиров и защищая ткани от повреждения свободными радикалами. Он также помогает нервной системе, превращая определенные аминокислоты в нейромедиаторы.
Кожа, зубы и кости также извлекают выгоду из свойств витамина С образовывать коллаген и сопротивляться захватчикам; этот витамин способствует поддержанию здоровья костей, профилактике заболеваний пародонта и заживлению ран.Он борется с воспалением и болью, подавляя секрецию простагландинов, которые способствуют возникновению таких симптомов. 11 Поскольку является водорастворимым антиоксидантом, витамин С находится в уникальном положении, позволяя «улавливать» водные перекисные радикалы до того, как эти деструктивные вещества получат шанс повредить липиды. Он работает в сотрудничестве с витамином Е, жирорастворимым антиоксидантом, и ферментом глутатионпероксидазой, чтобы остановить цепные реакции свободных радикалов. Витамин С — отличный источник электронов; следовательно, он может отдавать электроны свободным радикалам, таким как гидроксильные и супероксидные радикалы, и гасить их реакционную способность.
Витамин C в больших концентрациях содержится в таких фруктах, как апельсины, грейпфруты, мандарины, лимоны и лаймы. Витамин С и биофлавоноиды — водорастворимые вещества, которые помогают защитить капилляры человека — содержатся в белых покровах этих и других растений. Многие овощи также содержат витамин С, включая помидоры, брокколи, зеленый и красный сладкий перец, сырой салат и другую листовую зелень.
Исследования показывают, что антиоксидантные механизмы витамина С могут помочь предотвратить рак несколькими способами.Например, витамин С борется с перекисным окислением липидов, которое связано с дегенерацией и старением. 12 Витамин С может также уменьшить образование нитросаминов из нитратов — химических веществ, которые обычно используются в обработанных пищевых продуктах.
Рекомендуемая суточная доза витамина С составляет 120 мг. Предполагается, что допустимая верхняя доза составляет менее 1 г / день. 12
Витамин E
Витамин Е — жирорастворимый витамин, который существует в восьми различных формах.Каждая форма имеет свою собственную биологическую активность, которая является мерой эффективности или функционального использования в организме. Альфа-токоферол — самая активная форма витамина Е у человека. Это также мощный биологический антиоксидант. Добавки витамина Е обычно продаются как альфа-токоферилацетат, форма, которая защищает его способность действовать как антиоксидант. Синтетическая форма обозначена как «D, L», а натуральная форма обозначена как «D.» Синтетическая форма вдвое менее активна, чем натуральная.
В настоящее время проводятся исследования, чтобы определить, может ли витамин Е, благодаря его способности ограничивать производство свободных радикалов, помочь предотвратить или замедлить развитие некоторых хронических заболеваний, таких как сердечные заболевания.Также было показано, что витамин Е играет роль в иммунной функции, восстановлении ДНК и других метаболических процессах. 13
Селен
Селен — это микроэлемент, который поддерживает здоровую активность иммунной системы, действует как часть мощного антиоксиданта глутатиона и необходим для хорошего здоровья щитовидной железы.
Селен используется нашим организмом для производства глутатионпероксидазы, компонента естественной системы антиоксидантной защиты организма, которая вырабатывается в печени.Он работает с витамином Е, чтобы защитить клеточные мембраны от повреждений, вызванных вредными свободными радикалами, и помогает выводить токсины из вредных соединений в печени. Кроме того, некоторое количество глутатиона попадает в кровоток, где он помогает поддерживать целостность эритроцитов, защищая лейкоциты иммунной системы как часть защиты организма. 14
В исследовании, опубликованном в American Journal of Clinical Nutrition , исследователи изучали влияние добавок селена и бета-каротина на пациентов, у которых был выявлен дефицит селена и витамина А. 15 Исследователи оценили ферментативную антиоксидантную систему крови, включая концентрацию глутатиона и селена. Восемнадцать пациентов не получали никаких добавок, 14 пациентов получали селен перорально, а 13 пациентов получали бета-каротин перорально в течение одного года. Между тремя и шестью месяцами активность глутатиона значительно увеличилась у пациентов, получавших селен, по сравнению с пациентами, получавшими плацебо. Было обнаружено лишь небольшое увеличение после лечения бета-каротином.Исследователи заявили, что, поскольку глутатион играет важную роль в системе естественной ферментативной защиты при детоксикации перекиси водорода в воде, добавки селена могут представлять большой интерес для защиты клеток от окислительного стресса.
Из-за риска накопления токсичных уровней селена в организме пациентам следует избегать приема высоких доз — 900 мкг или более за один раз или 600 мкг в день в течение длительного периода времени. Пациенты также должны знать количество селена, которое они получают из морепродуктов, цельного зерна, овса и орехов. 14
Роль фармацевта
Рацион, богатый антиоксидантами, снижает риск некоторых видов рака, сердечных заболеваний, астмы, диабета и болезни Паркинсона. Большинство этих антиоксидантов доступны по цене и доступны каждому, кто в них нуждается. Исследования показывают многообещающие результаты защитного действия антиоксидантов для укрепления иммунной системы в борьбе с токсинами в организме человека.
Фармацевты имеют исключительную возможность объяснять правильные дозировки своим пациентам и разъяснять роль различных синтетических и природных антиоксидантов, имеющихся на рынке.Они также могут объяснить преимущества, которые получают пациенты от улавливания свободных радикалов в своем организме, чтобы уменьшить повреждение клеток и тканей.
ССЫЛКИ
1. Ди Мацио П., Кайзер С., Сис Х. Ликопин как наиболее эффективный биологический гаситель синглетного кислорода каротиноидов. Arch Biochem Biophys. 1989; 274: 532-538.
2. Салджогиан М. Ликопин: мощный природный антиоксидант. Фарм США . 2002; 27 (10): 29-35.
3. Письмо о благополучии Калифорнийского университета в Беркли.com. Коэнзим Q10. Май 2003.
4. Смит А.Р., Шенви С.В., Видлански М. и др. Липоевая кислота как потенциальная терапия хронических заболеваний, связанных с окислительным стрессом. Curr Med Chem . 2004; 11 (9): 1135-1146.
5. Пакер Л., Витт Э. Х., Тритчлер Х. Дж. Альфа-липоевая кислота как биологический антиоксидант. Free Radic Biol Med. , 1995; 19: 227-250.
6. Whiteman M, Tritschler H, Halliwell B. Защита от пероксинитрит-зависимого нитрования тирозина и инактивации альфа-1-антипротеиназы окисленной и восстановленной липоевой кислотой. FEBS Lett . 1996; 379: 74-76.
7. Pantuck AJ, Leppert JT, Zomorodian N, et al. Фаза II исследования гранатового сока для мужчин с повышением уровня специфического антигена простаты после операции или лучевой терапии по поводу рака простаты. Clin Cancer Res. , 2006; 12: 4018-4026.
8. Авирам М., Розенблат М., Гайфини Д. и др. Гранатовый сок улучшает здоровье сонной артерии и снижает кровяное давление у пациентов со стенозом сонной артерии. HerbalGram . 2005; 65: 28-30.
9. Гил М.И., Томас-Берберан Ф.А., Хесс-Пирс Б. и др. Антиоксидантная активность гранатового сока и ее связь с фенольным составом и обработкой. J Agric Food Chem. 2000; 48 (10): 4581-4589.
10. Ритвельд А., Вайзман С. Антиоксидантные эффекты чая: данные клинических испытаний на людях. J Nutr. 2003; 133: 3285S-3292S.
11. Найду К.А. Витамин С в здоровье и болезнях человека до сих пор остается загадкой? Обзор. Nutr J .2003; 2: 7.
12. Левин М., Рамси С.К., Дарувала Р. и др. Критерии и рекомендации по приему витамина С. JAMA . 1999; 281: 1415-1423.
13. Khanna S, Roy S, Ryu H, et al. Молекулярная основа действия витамина Е: токотриенол модулирует 12-липоксигеназу, ключевой медиатор нейродегенерации, вызванной глутаматом. Дж. Биол. Хим. . 2003; 278: 43508-43515.
14. Томсон CD. Оценка требований к селену и адекватности селенового статуса: обзор. Eur J Clin Nutr. 2004; 58: 391-402.
15. Hercberg S. История бета-каротина и рака: от наблюдения к интервенционным исследованиям. Какие уроки можно извлечь для будущих исследований полифенолов? Am J Clin Nutr . 2005; 81 (1 доп.): 218С-222С.
Чтобы прокомментировать эту статью, свяжитесь с [email protected].
Разъяснениеантиоксидантов: почему эти соединения так важны
ЧТО АНТИОКСИДАНТЫ МОГУТ — И НЕ МОГУТ — СДЕЛАТЬ
Ученые начали теоретизировать, что свободные радикалы повреждение было вовлечено на ранних стадиях атеросклероза и могло играют роль в развитии многих других хронических заболеваний в 1990-е гг.Исследования того времени показали, что люди, которые ели мало богатые антиоксидантами фрукты и овощи имели больший риск развития эти медицинские условия. Так началось несколько клинических испытаний, в которых антиоксидантные добавки, такие как бета-каротин и витамин Е, были проверены на их защита от болезней сердца, рака и других состояний.
В результате «антиоксиданты» стали модным словом в 90-х, и их средства массовой информации прославляли преимущества пищевой промышленности, которая начала маркировка продуктов как «богатых антиоксидантами» и добавкой промышленность, поскольку они начали рекламировать преимущества для здоровья антиоксидантов добавки.Их даже рекламировали как антивозрастные ингредиенты в косметические продукты.
Ложная шумиха относительно старения и риска для простаты
Однако результаты исследования были неоднозначными, и ожидаемые выгоды явно не присутствовали. Пока какие-то испытания сообщили о положительном воздействии, особенно на снижение когнитивных функций, надежды на то, что витамин Е защитит от сердечных заболеваний и рака, не оправдались, как ожидалось. Фактически, по крайней мере одно исследование показало, что прием антиоксидантных добавок увеличивает риск рака легких у курильщиков, а совсем недавно было обнаружено, что витамин Е увеличивает риск рака простаты.Как бы нам ни хотелось думать, что соединение в пище может предотвратить старение, антиоксиданты вряд ли являются ответом.
Несмотря на отсутствие окончательных исследований, антиоксиданты все еще рекламируется как пищевые добавки и добавки, которые могут предотвратить изобилие заболеваний, включая сердечные заболевания, рак, катаракту и потерю памяти, и они по-прежнему рекламируются как активные ингредиенты в продуктах против старения.
Важно для глаз
Возможно, наиболее многообещающей областью исследований антиоксидантов является область здоровья глаз.Изучение обнаружили, что комбинация антиоксидантов бета-каротина, витамина С и E, а минеральный цинк снижает риск развития продвинутых стадии возрастной дегенерации желтого пятна (AMD) у тех, у кого была средняя или продвинутая AMD на одном глазу.
ЕСТЬ ЛИ ПРИЕМ АНТИОКСИДАНТНЫХ ДОБАВОК ВРЕДА?
Принимаются ли они по отдельности или в комбинации смеси, антиоксиданты могут иметь неблагоприятные последствия для здоровья, так как Упомянутые ранее исследования рака простаты и рака легких предполагают.Добавки также связаны с повышенным риском рака кожи. у женщин. Другое исследование показало, что те, кто принимал витамины А, Е и Добавки с бета-каротином могут привести к преждевременной смерти. Чрезмерное потребление витамина Е также связано с сердцем. сбой и усиление кровотечения.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов не регулирует пищевые добавки, и они могут продаваться с небольшими исследованиями или без них как к их безопасности, чистоте и эффективности. Биологически активная добавка методы производства не всегда стандартизированы, Итак, насколько хорошо они работают и их побочные эффекты могут различаться в зависимости от марки или даже внутри бренда.Форма биологически активной добавки, приобретенная в аптека или магазин здоровой пищи, скорее всего, не та форма, которая используется в исследование. Долгосрочные эффекты дополнительных антиоксидантов не известен.
Что делают свободные радикалы и можно ли их остановить
Свободные радикалы — это нестабильные молекулы или атомы, которые могут повредить клетки вашего тела. Они образуются, когда атомы или молекулы приобретают или теряют электроны, что приводит к образованию неспаренного электрона. Свободные радикалы сталкиваются с вашими клетками в попытке «украсть» электрон, и клетки, которые теряют электроны, могут начать работать со сбоями.
Свободные радикалы часто возникают в результате нормальных обменных процессов. Например, когда ваше тело использует кислород, он создает свободные радикалы в качестве побочного продукта, и ущерб, причиненный этими свободными радикалами, называется «окислительным стрессом».
Но ваш метаболизм — не единственный виновник. Вы также можете подвергнуться воздействию свободных радикалов из различных источников окружающей среды, таких как радиация, лекарства, пестициды, сигаретный дым и другие загрязнители.
Чем занимаются свободные радикалы?
Если вы молоды и здоровы, ваше тело довольно хорошо справляется со свободными радикалами, и вы, вероятно, даже ничего не заметите.Но если вы неправильно питаетесь, курите или подвергаетесь воздействию множества источников свободных радикалов из окружающей среды, ваш риск повреждения клеток и органов возрастает. Старение сказывается и на вашей системе защиты от свободных радикалов.
Свободные радикалы со временем повреждают клетки, поэтому в конечном итоге какой бы орган эти клетки ни принадлежали, он не будет функционировать должным образом. Например, соединительная ткань, называемая коллагеном, ослабевает под воздействием свободных радикалов, и в результате на вашей коже появляется больше морщин.Взаимодействие с другими людьми
Стенки артерий могут быть повреждены, и накапливаются холестериновые бляшки, которые могут уменьшить приток крови к сердцу, мозгу и другим органам или вызвать образование тромбов.
Чрезмерное воздействие свободных радикалов связано с повышенным риском хронических заболеваний, таких как болезни сердца и рак. Принятие мер по предотвращению воздействия свободных радикалов и повышение вашей антиоксидантной защиты может помочь снизить риск.
Как питание влияет на свободные радикалы?
Употребление в пищу здоровой пищи, особенно ярких фруктов и овощей, может помочь в борьбе с повреждением, вызываемым свободными радикалами.Такие питательные вещества, как витамин С, бета-каротин, селен и витамин Е, могут помочь предотвратить повреждение клеток свободными радикалами и снизить окислительный стресс, поэтому их называют антиоксидантами.
Эти питательные вещества содержатся в различных продуктах, но больше всего их в растительных источниках. Это может быть одной из причин, почему диета, богатая фруктами и овощами, так важна для вашего здоровья.
Действительно, исследования показывают, что диета с высоким содержанием антиоксидантов связана с улучшением здоровья.Конечно, есть и другие причины, по которым люди, потребляющие много антиоксидантов, могут чувствовать себя лучше. Люди, которые едят здоровую пищу, также, как правило, более физически активны и с большей вероятностью будут поддерживать надлежащее потребление калорий.
Могут ли диетические добавки бороться с свободными радикалами?
Многие пищевые добавки называют антиоксидантами, потому что они состоят из питательных веществ или экстрактов растений, которые продемонстрировали антиоксидантную активность в лаборатории. Хотя употребление в пищу продуктов, богатых антиоксидантами, кажется полезным, прием антиоксидантных добавок не дает таких же преимуществ, за исключением редких случаев.
Одним из таких случаев является комбинация лютеина, зеаксантина и других питательных веществ, которые могут замедлить прогрессирование дегенерации желтого пятна, которая является основной причиной слепоты у пожилых людей.


 56
56 46
46